
6. strateška konferenca: Življenje z rakom
Na letošnji konferenci bo v središču razprave uvedba novih presejalnih programov za raka pljuč, prostate in želodca ter različni vidiki integrirane zdravstvene oskrbe za učinovitejšo obravnavo raka.

Na letošnji konferenci bo v središču razprave uvedba novih presejalnih programov za raka pljuč, prostate in želodca ter različni vidiki integrirane zdravstvene oskrbe za učinovitejšo obravnavo raka.

Pomemben korak, a nekatera tveganja ostajajo

EFPIA in Vaccines Europe v Biotech Actu ter reviziji MDR/IVDR vidita pozitiven signal za evropske inovacije

EFPIA in Vaccines Europe podpirata načrt EU »Safe Hearts« za izboljšanje zdravja srca in ožilja ter pozivata k njegovi hitri izvedbi

Še veliko je treba storiti za ohranitev konkurenčnosti evropske farmacevtske industrije

20. 10. 2025
-
Na Onkološkem inštitutu Ljubljana so 23. septembra uspešno opravili prvo robotsko asistirano operacijo in bolniku z rakom prostate srednjega tveganja odstranili prostato. Z uvajanjem robotske kirurgije Onkološki inštitut Ljubljana bolnikom omogoča najsodobnejše metode zdravljenja in hitrejše okrevanje po operaciji, so sporočili z inštituta.
16. 10. 2025
-
V Univerzitetnem kliničnem centru (UKC) Ljubljana so prvič uspešno izvedli implementacijo dolgotrajne dvoprekatne podpore srca tipa Berlin Heart pri otroku s telesno težo pod deset kilogramov. Ta poseg omogoča, da imajo tudi najmlajši bolniki s hudim srčnim popuščanjem prvič možnost dolgoročne mehanske podpore, so sporočili iz UKC Ljubljana.
11. 10. 2025
-
Nobelovo nagrado za medicino letos prejmejo ameriška znanstvenika Mary Brunkow in Fred Ramsdell ter japonski znanstvenik Shimon Sakaguchi za odkritja v zvezi s periferno imunsko toleranco, mehanizmi, s katerimi se imunski sistem odzove na okužbe, je danes sporočil švedski inštitut Karolinska v Stockholmu.
06. 10. 2025
-
Nobelovo nagrado za medicino letos prejmejo ameriška znanstvenika Mary Brunkow in Fred Ramsdell ter japonski znanstvenik Shimon Sakaguchi za odkritja v zvezi s periferno imunsko toleranco, mehanizmi, s katerimi se imunski sistem odzove na okužbe, je danes sporočil švedski inštitut Karolinska v Stockholmu.
01. 10. 2025
-
Začenja se rožnati oktober, mesec ozaveščanja o raku dojk, najpogostejšem raku pri ženskah v Sloveniji. Tudi letos je v ospredju pomen pravočasnega odkrivanja bolezni, saj je le tako dobro obvladljiva. So pa letos kampanjo povezali z ozaveščanjem tudi o rakih rodil in pozivom k skrbi z zdravje.
Smo predstavnik inovativne farmacevtske industrije v Sloveniji in delujemo kot nevladno, neprofitno, nepolitično in neodvisno gospodarsko interesno združenje. Povezujemo 22 farmacevtskih podjetij, ki imajo skupno poslanstvo: #BrezPredaha razvijati inovativna zdravila, ki so ključna za obvladovanje bolezni in izboljšanje kakovosti življenja bolnikov.
text
id,module_id,title,summary,description,author,created,publish_date,lang,id,definition_id,parent_id,site_id,template_id,module_id,class_name,name,path,type,image_url,published,order,created,updated
237,12313,”6. strateška konferenca Vrednost inovacij “,”Trajnostni in ciljno usmerjeni zdravstveni sistem “,”
Ljubljana, 12. oktober 2017 – Inovacije v zdravstvu rešujejo življenja, kljub temu pa v sistemu še vedno ni relevantnega vrednotenja zdravstvenih tehnologij in potrebnih registrov, ki bi omogočili učinkovito obravnavo bolnikov in dostop do inovacij v zdravstvu. Manjkajo tudi spodbude zaposlenim v zdravstvu, predvsem pa vizija trajne vzdržnosti sistema, da se bo ta lahko prilagajal izzivom prihodnosti.
Le trajno vzdržen zdravstveni sistem in z dokazi podprto odločanje omogočata hiter dostop do inovativnih zdravil, cepiv, terapij in tehnologij, ki spreminjajo obravnavo mnogih bolezni ter podaljšujejo in rešujejo življenja bolnikov. Ker hkrati znižujejo tudi stroške specialistične in bolnišnične obravnave ter dvigujejo produktivnost, so vlaganja v raziskave in razvoj ne le stroškovno upravičena, temveč nujna. Toda soočamo se s starajočo se družbo in vse pogostejšimi kroničnimi boleznimi, propulzivnimi inovacijami, pomembnimi razvojnimi premiki v medicini in omejenimi finančnimi viri. Vse to že danes resno ogroža vzdržnost slovenskega zdravstvenega sistema, pri čemer so cene zdravil na recept prispevale k upočasnitvi rasti tekočih izdatkov za zdravstvo, saj so danes za skoraj tretjino nižje kot v letih pred svetovno gospodarsko krizo, stroški življenjskih potrebščin pa so se v tem obdobju povišali. Poleg tega izdatki za zdravila na recept predstavljajo le 14 odstotkov javnih zdravstvenih izdatkov.

Na strateški konferenci je ministrica za zdravje Milojka Kolar Celarc med drugim poudarila, da bosta novela Zakona o zdravstvenem varstvu in zdravstvenem zavarovanju ter Zakon o dolgotrajni oskrbi zagotovila trajne in stabilne vire za dolgoročno financiranje zdravstvenega varstva ter kakovostno, dostopno in inovacijam odprto zdravstvo. Izpostavila je tudi pomen inovacij v zdravstvu, kot so uvedba e – recepta, e – napotnice ter projekta Intravizor, s katerim spremljajo porabo in cene zdravil v slovenskih bolnišnicah ter pomen farmakoloških inovacij ter uvajanje novih zdravil, ki podaljšujejo življenja, zmanjšujejo potrebo po drugih zdravstvenih storitvah, izboljšujejo kakovost življenja in zmožnost za delo ter dodala: ˝Posebno dobre rezultate zdravljenja imamo z biološkimi zdravili, ki so dobila dovoljenja za promet v zadnjih 15 letih in so izrazito izboljšala zdravstvene izide bolnikov z multiplo sklerozo in upočasnila napredovanje te bolezni. Tudi nove metode zdravljenja revmatoidnega artritisa upočasnjujejo napredovanje bolezni in celo izboljšujejo zdravstveno stanje. Nove terapije so v zadnjih 20 letih za kar 20 odstotkov zmanjšale umrljivost zaradi raka, velik pa je napredek tudi pri zdravljenju bolnikov z virusom HIV, saj je zdravljenje prispevalo k znižanju smrtnosti za kar 80 odstotkov, … Poleg ekonomskega, pri nabavah upoštevamo tudi etični vidik in kljub majhnosti našega trga, nam uspeva zagotavljati zelo širok nabor novih inovativnih zdravil, pacienti pa jih pri nas lahko dobijo primerljivo hitro z drugimi evropskimi državami, čeprav dajemo v Sloveniji za zdravstveno blagajno bistveno manj denarja na prebivalca kot nekatere druge države.˝
Državni svetnik mag. Peter Požun, predsednik Komisije za socialno varstvo, delo, zdravstvo in invalide Državnega sveta RS pa je uvodoma pojasnil še:˝Vsi se zavedamo, da je obdobje gospodarske krize v zdravstvenem sistemu pustilo težke posledice. Kot smo večkrat opozorili tudi v razpravah v Državnem svetu, je v kriznem obdobju izrazito primanjkovalo sredstev že za ustaljene zdravstvene prakse, kaj šele za vlaganje v inovacije in razvoj. Pred oblikovalci javnih zdravstvenih politik zato niso enostavni izzivi, saj se od njih pričakuje, da bodo oblikovali politike, ki bodo usmerjene v paciente in jim zagotavljale visoko stopnjo varnosti zdravstvene obravnave, hkrati pa bodo učinkovite in vzdržne z ekonomskega vidika. Na žalost se ob omembi vzdržnosti sistema še vedno največkrat v prvi vrsti pomisli na stroške – bodisi progresivno naraščajoče stroške zdravstvene oskrbe, bodisi na, zlasti v začetnih fazah, stroškovno precej obremenilne investicije v napredek. Pri tem se je treba zavedati, da med njimi obstaja pomembna razlika – s premišljenim vlaganjem v slednje se namreč lahko posredno ali neposredno vpliva tudi na zniževanje prvih.˝
Pred 6. strateško konferenco Vrednost inovacij: Trajnostni in ciljno usmerjeni zdravstveni sistem, ki je potekala v Državnem svetu Republike Slovenije, so predstavniki izvajalcev zdravstvenih politik, akademskih raziskovalnih institucij, farmacevtske industrije in bolnikov izmenjali poglede in stališča o vrednosti inovacij v zdravstvu in prihodnosti slovenskega zdravstvenega sistema, ki se bo moral prilagajati novim okoliščinam in izzivom. Kakšen naj bo torej zdravstveni sistem, ki bo omogočal za napredek slovenske družbe ključna vlaganja v raziskave in razvoj, ki bo bolnikom v prihodnosti lahko zagotavljal hiter in nemoten dostop do inovacij in bil ob tem trajno vzdržen?
Napredek v zdravljenju se navadno povezuje z medicino, visoki stroški pa z zdravili, opozarja dr. Vasilisa Sazonov, podpredsednica uprave Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, ki je skupaj s Kemijskim inštitutom pripravil 6. strateško konferenco: ˝Zdravila so draga, imamo najdražja zdravila v Evropi, izdatki za zdravila strmo naraščajo,…to so pogosto slišane domneve, ki tvorijo ene največjih mitov v slovenskem zdravstvu, saj nimajo prav nič opraviti s stvarnostjo. Nedavna primerjalna analiza uradnih cen v Evropi je pokazala, da so ravni slovenskih uradnih cen med najnižjimi v EU. Poleg tega so izdatki za zdravila v Sloveniji danes podobni izdatkom v času svetovne gospodarske krize v letu 2009. Rezultati analiz so jasno pokazali, da so cene zdravil na recept, kljub staranju prebivalstva in posledično povečani rabi zdravil, v Sloveniji pripomogle k upočasnitvi rasti tekočih izdatkov za zdravstvo, saj so se med letoma 2010 in 2016 znižale za kar 31 odstotkov. Medtem pa so v istem obdobju cene življenjskih potrebščin narasle za 5,9 odstotka. Javnost bo prav gotovo razveselilo tudi dejstvo, da slovenski bolnik za 200 evrov na leto prejme približno enak nabor zdravil kot belgijski, ki zanj odšteje skoraj 450 evrov. Vse to so podatki, ki pričajo, da imamo v Sloveniji v primerjavi z evropskimi državami, ki imajo podoben dostop do zdravil, najnižje izdatke za zdravila na prebivalca. In pričajo tudi o tem, da na področju cen zdravil ni več prostora za administrativne ukrepe.˝

Ob aktualnih več milijonskih izgubah javnih zdravstvenih zavodov in interventnih ukrepih za finančno konsolidacijo javnega zdravstva, skrajševanje čakalnih dob in paketu novel zdravstvenih zakonov v parlamentarnem postopku, je razmislek o potrebnih pogojih za trajno vzdržen zdravstveni sistem še kako na mestu. Mag. Marjan Sušelj, generalni direktor Zavoda za zdravstveno zavarovanje Slovenije poudarja: ˝Za financiranje obstoječih pravic iz obveznega zdravstvenega zavarovanja in vedno novih inovacij v zdravstvu je potrebno vsako leto načrtovati tudi določen odstotek dodatnega denarja za vlaganje v razvoj, vendar pa morajo takšna vlaganja istočasno spremljati tudi konkretni ukrepi za bolj učinkovito in uspešno delovanje zdravstvenega sistema (učinkovita organizacija javne zdravstvene službe, integralna oskrba bolnikov, ugodno razmerje med stroški in koristmi novih zdravi,…). Vlaganje se bo namreč obrestovalo le, če ga bomo znali tako upravljati, da bomo z njim tudi dosegli zastavljene vsebinske cilje, kot so bolj zdravo in kakovostno življenje ter učinkovito upravljanje kroničnih bolezni.˝
Izzive in nove vloge, s katerimi se bodo v prihodnosti soočali javni zdravstveni sistemi ter nekatere predloge za finančno konsolidacijo obstoječega stanja je predstavila izr. prof. dr. Petra Došenović Bonča z Ekonomske fakultete Univerze v Ljubljani, ki ocenjuje: ˝Obstoječi ukrepi, kot na primer sanacija bolnišnic, niso zadosten odgovor na izzive prihodnosti, ko bo uresničevanje osnovnih načel zdravstvenega sistema – solidarnost, kakovost, dostopnost in učinkovitost – ob velikih družbenih spremembah in novih pristopih v medicini zahtevalo spremembe v financiranju, pri izvajalcih in podpornem okolju za disperzijo inovacij, saj obstaja nevarnost, da bi bila sodobna medicina zaradi pomanjkanja finančnih virov v obstoječem sistemu dostopna le delu populacije. Zato so med drugim nujno potrebni jasno odločanje o sestavi košarice, ki je solidarnostno financirana, reforma zdravstvenega zavarovanja in večja vloga vseživljenjskega financiranja, realne cene zdravstvenih storitev in ažurirani plačilni modeli izvajalcev, spodbude za zaposlene v zdravstvu, vrednotenje zdravstvenih tehnologij, z dokazi podprto odločanje, transparentnost in večja učinkovitost zdravstvenega sistema. Slednja je nujna, da z razpoložljivimi viri, ki bodo sicer vedno zaostajali za potrebami, vseeno zagotovimo zdravstvo po zgledu razvitih držav.˝
Slovenske znanstvene skupine so zaradi mednarodno priznanih znanstvenih dosežkov in prestižnih nagrad mednarodno uveljavljene in spoštovane, saj se na področju inovativnih raziskav uvrščajo v sam svetovni vrh. Raziskovalka Dr. Iva Hafner Bratkovič s Kemijskega inštituta je pojasnila vlogo akademskih institucij pri razvoju novih zdravil, diagnostičnih metod in inovativnih metod zdravljenja ter poudarila: ˝Vlaganja v bazične raziskave so ključnega pomena za poznavanje mehanizmov neozdravljivih bolezni, ki omogočajo razvoj novih zdravil in naprednih oblik zdravljenja. Prav z užitkom bi opazovala, kako bi se slovenska znanost razvijala, če ne bi bila podhranjena praktično v vseh pogledih ter močno obremenjena z birokracijo.˝
Kakšna je resnična vrednost inovacij v zdravstvu nedvomno najbolje vedo bolniki in njihovi svojci na področjih, kjer ključnega preboja v zdravljenju še ni. In pa tisti, ki so jim inovacije v zdravstvu spremenile življenje. Med njimi je tudi Aladar Belec, bolnik z juvenilnim revmatoidnim artritisom iz Društva revmatikov Slovenije, ki ob današnjem svetovnem dnevu revmatikov sporoča: ˝Inovativna zdravila zame pomenijo življenje – z njihovo pomočjo namreč lahko migam, skrbim sam zase in kot tak sem lahko oče, partner, prijatelj in trudim se biti čim bolj koristen državljan. Zaradi revme res ne umreš, ampak, če ni pravočasne zdravstvene oskrbe, če ni ustrezne terapije in če ni ustrezne strokovne pomoči, potem življenje revmatika z vsemi bolečinami in tegobami ni dostojno in polnovredno življenje.˝
Sodelujoči so se strinjali, da inovacije v zdravstvu rešujejo življenja, kljub temu pa v sistemu še vedno ni relevantnega vrednotenja zdravstvenih tehnologij in potrebnih registrov, ki bi omogočili učinkovito obravnavo bolnikov in dostop do inovacij v zdravstvu. Manjkajo tudi spodbude zaposlenim v zdravstvu, predvsem pa vizija trajne vzdržnosti sistema, da se bo ta lahko prilagajal izzivom prihodnosti.
“,”Rok Knafelj”,1507747320,1507747320,sl,12313,306,12310,43,0,NULL,,”6. strateška konferenca Vrednost inovacij”,6-strateska-konferenca-vrednost-inovacij,Post,”/sites/43/files/images/news/6. strateska konferenca/6._strateska_konferenca_MAIN.jpg”,1,0,1521488291,1538997803
238,12315,”5. strateška konferenca Vrednost inovacij”,”Še vedno nezadostna vloga podatkov pri odločanju o inovacijah v zdravstvu, argumentov za to pa več kot dovolj”,”
Ljubljana, 11. oktober 2016 – Oblikovanje politik v zdravstvu in odločitve o vključevanju in financiranju inovacij bi za vzdržnost in kakovost zdravstvenega sistema morale biti podprte z dokazi na vseh področjih, zbiranje podatkov povezano med institucijami, izsledki pa dostopni širše, tudi uporabnikom zdravstvenih storitev.
Demografski kazalci in vedno večje odstopanje med potrebami in razpoložljivimi finančnimi viri so eden ključnih izzivov zdravstvene politike. Da finančni viri ne zadoščajo za vse zdravstvene tehnologije, ki so na voljo in še manj za vse, ki prihajajo, je že nekaj časa realnost našega zdravstvenega sistema. Zato je toliko bolj pomembno, da so odločitve dobro pretehtane in sprejete na podlagi različnih podatkov o njihovi učinkovitosti in ekonomičnosti njihove uvedbe v najširšem smislu. Na 5. strateški konferenci Vrednost inovacij, ki je potekala danes v dvorani Državnega sveta Republike Slovenije, so se oblikovalci zdravstvenih politik, predstavniki institucij, ki podatke zbirajo, hranijo in obdelujejo ter bolniki oziroma civilna družba strinjali, da je na določenih področjih podatkov v obliki študij in registrov dovolj, na drugih pa še veliko prostora za boljše spremljanje zdravstvenih izidov in s tem povezano smotrno nadaljnje odločanje.
Svoje poglede na zbiranje in pomen podatkov pri odločanju o uvajanju in financiranju inovacij v zdravstvu sta uvodoma podala predsednik Državnega sveta Mitja Bervar in predsednik Odbora za zdravstvo Tomaž Gantar. Predsednik Državnega sveta je v svojem uvodnem nagovoru izpostavil pomen informiranosti kot temelja oblikovanja vsebinskih podlag za nadaljnje odločanje, pri čemer so pomembne kakovostne in pravočasne informacije, saj sicer postane zdravstvena politika neučinkovita in celo izvor konfliktov. O vlogi Državnega sveta pri tem je povedal, da se je ta v praksi izkazal kot institucija, ki tesno sodeluje s civilno družbo. Predsednik Odbora za zdravstvo Tomaž Gantar meni, da smo končno prišli do točke, ko se bo treba odločiti, kako naprej in poiskati rešitve za trenutno stanje v zdravstvenem sistemu, da bomo lahko ponosni na rezultate, tako kot smo danes, tudi čez deset ali petnajst let. Seveda pa to pomeni tudi obsežnejše investiranje, tudi zaradi povečevanja števila bolnikov z nenalezljivimi boleznimi.
Državna sekretarka na Ministrstvu za zdravje Sandra Tušar je poudarila, da dokazi, podatki in prave metode v proces odločanja in oblikovanje politik v zdravstvu vnašajo racionalnost, doslednost in sistematičnost. Podobno kot Tomaž Gantar je opozorila tudi, da se bodo odločitve, ki se sprejemajo danes, zrcalile v zdravstvenih parametrih prihodnosti. Zato je prav, da se v procesih odločanja vedno vprašamo, katere dokaze uporabiti, kdaj jih smiselno vključiti v proces. Opozorila je tudi na dejstvo, da se zbirajo številni podatki z različnih področij zdravstva, da pa žal povezanost med njimi ni optimalna. Ministrstvo je po besedah Tušarjeve odprto za predloge, ki bodo izboljšali proces povezovanja različnih podatkovnih in informacijskih baz. Pri uvajanju elementov HTA – v angleščini Health Technology Assesment – vrednotenje zdravstvenih tehnologij v procese odločanja, pa vidi Ministrstvo za zdravje skupaj z Nacionalnim inštitutom za javno zdravje v krovni, usklajevalni vlogi med različnimi deležniki.
Mircha Poldrugovac z Nacionalnega inštituta za javno zdravje je opozoril na pomembnost in način vključevanja različnih deležnikov v razpravo. Proces z dokazi podprtega odločanja se namreč pogosto spremeni v konfrontacijo, v debato namesto potrebnega dialoga. Poudaril je priložnost, ki jo ponuja EVIPNet (Evidence-informed Policy Network) za krepitev mehanizmov za prenos znanja in spodbujanje z dokazi podprtega odločanja ter potencial za zapolnitev vrzeli med raziskovalci in odločevalci. Vse z namenom, da so izhodišča za odločanje kakovostna in uporabna.
V procesu (so)odločanja je vse bolj zaželena in sprejeta tudi vloga bolnikov, a je glas civilne družbe v praksi pogosto preslišan in kar se tiče možnosti zagotavljanja različnih podatkov tudi podcenjen. Matija Cevc, predsednik izvršnega odbora Mreže nevladnih organizacij s področja javnega zdravstva 25 x 25, vidi vlogo nevladnih organizacij ravno v dajanju pobud odločevalcem, vzpostavljanju dialoga in izmenjavi dobrih praks. Za optimalno zagovorništvo bolnikov pa je nujna tudi dostopnost do podatkov oziroma do izsledkov. Kot je opozoril Cevc, platforma podatkov obstaja, a je treba biti strokovnjak, da si z njimi dejansko lahko kaj pomagamo, saj so podatki razdrobljeni, za resnično dostopnost podatkov pa je potrebno tudi določeno znanje, zato si bolniki z njimi ne morejo pomagati.
Na okrogli mizi, kjer sta poleg naštetih gostov sodelovala tudi Stanislav Primožič z Javne agencije za zdravila in medicinske pripomočke in Marjan Sušelj, v.d. direktorja Zavoda za zdravstveno zavarovanje, so se sodelujoči strinjali, da je veliko podatkov že na voljo, na veliko področjih bi jih še bilo smiselno spremljati, glavni izziv pa predstavlja njihova povezljivost. Vsi so izrazili upanje, da se bo z uvajanjem elementov HTA v odločanje izmenjava informacij optimizirala. Evropska unija vsem državam članicam nalaga tudi ustanovitev organa za vrednotenje zdravstvenih tehnologij in njegovo vključenost v evropsko mrežo, a kot je opozoril Stanislav Primožič, za zdaj ostaja odprto vprašanje, kdo bo prevzel in vodil vpeljavo HTA na nacionalnem nivoju. Sogovorniki so se strinjali, da bo izbira inovacij v zdravstvu vedno večja, a potrebe zavarovancev rastejo veliko hitreje kot možnosti uvajanja novih zdravstvenih tehnologij, obenem je na voljo relativno malo denarja za njihovo vključevanje v sistem javnega financiranja. Trenutno je po besedah Tomaža Gantarja zaradi drugih perečih vprašanj razprava o uvajanju inovacij ne glede na dokaze in argumente med odločevalci nekoliko v ozadju.
Profesor Nils Wilking s švedskega Karolinskega inštituta je predstavil najnovejše poročilo in pregled oskrbe bolnikov z rakom v Evropi in Sloveniji ter primerjavo s prejšnjim poročilom. Zanimivo je, da je kljub povečani incidenci raka v Evropi za 30 odstotkov med letoma 1995 in 2012 zahvaljujoč uvajanju novih terapij smrtnost narasla le za okrog 11 odstotkov, ob tem pa se je podaljšal tudi čas preživetja. Stroški oskrbe in zdravljenja raka so v povprečju ostali na enaki ravni, to je 6,7 odstotkov od sredstev, namenjenih za zdravstvo. Njegovo poročilo med drugim govori tudi o različni dostopnosti do zdravil in terapij v različnih državah ter močno v prid smiselno zastavljenemu in transparentnemu zbiranju in obdelovanju podatkov o obolevnosti in zdravstvenih izidih. Področje onkologije postaja zaradi novih zdravstvenih tehnologij vse bolj kompleksno, zato je zaradi vzdržnosti zdravstvenega sistema potrebno najti trajne rešitve za njihovo financiranje, v katere je trebe vključiti vse deležnike.
Podatki, ki se zbirajo prek različnih javnih institucij, programov, študij in raziskav ter tudi skozi strukture civilne družbe, so odličen in potreben vir informacij za napovedovanje trendov in pregled nad dokazi o učinkovitosti posameznih inovativnih terapij ter s tem kar najbolj učinkovito in utemeljeno uvajanje inovacij v sistem zdravstvene oskrbe glede na omejene vire. A je ob tem nujno storiti korak v smeri med seboj bolj povezljivih in povezanih ter s tem transparentnih in kakovostnih podatkov, za to pa so potrebne jasno opredeljene vloge in pristojnosti, pa tudi skupna volja in uporaba sodobnih tehnologij.
Z osredotočanjem na dokaze se lahko zagotovi uvajanje ustreznih organizacijskih, tehnoloških in drugih inovacij. Obenem dostop do ustreznih podatkov in informacij tudi v prihodnje ohranja dostopnost do kakovostnega in učinkovitega zdravljenja in nenazadnje zmanjša »razsipnost« v sistemu, ki je pogosto posledica stihijskega presojanja in (ne)uvajanja novosti. Inovativna zdravila in druge inovacije v zdravstvu pomembno povečujejo kakovost življenja bolnikov z nekdaj neozdravljivimi in neobvladljivimi boleznimi, podaljšujejo življenjsko dobo in kakovost življenja ter na srednji in dolgi rok zmanjšujejo neposredne in posredne stroške družbe. A le, če so zdravstvenim delavcem in bolnikom dejansko dostopni.
“,Administrator,1478809260,1478809260,sl,12315,306,12314,43,0,NULL,,”5. strateška konferenca Vrednost inovacij”,5-strateska-konferenca-vrednost-inovacij,Post,”/sites/43/files/images/news/5. strateska/IRM_4_b.jpg”,1,0,1521490665,1524590975
239,12317,”8. infozajtrk za medije”,”Vpliv sodelovanja zdravstvenih delavcev s farmacevtsko industrijo na stroko, posameznika in družbo “,”
O vplivu sodelovanja zdravstvenih delavcev s farmacevtsko industrijo na stroko, posameznika in družbo je tekla beseda na zdaj že 8. Forumovem info zajtrku za predstavnike medijev v torek, 7. junija 2016. Sogovorniki so spregovorili o tem, zakaj zdravstveni delavci potrebujejo farmacevtska podjetja, zakaj farmacevtska industrija potrebuje zdravstvene delavce ter kako to sodelovanje vpliva na življenje posameznikov in spreminja družbo.
Udeležence je uvodoma pozdravila mag. Katarina Verhnjak, predsednica uprave Foruma, ki je poudarila, da je razvoj novih zdravilnih učinkovin vedno plod združevanja ekspertnih znanj in praktičnih izkušenj, zato je sodelovanje med vsemi udeleženci v tem trikotniku – bolniki, zdravniki in farmacevti – izjemno pomembno. “A to sodelovanje je pogosto predmet ugibanj in različnih, tudi napačnih interpretacij, zato smo osvetlitev teh odnosov z različnih zornih kotov izbrali za temo tokratnega info zajtrka,” je pojasnila Katarina Verhnjak.
Srečanje se je nato nadaljevalo s pričevanjema dveh bolnikov. Prvi je spregovoril Marko Korenjak, bolnik z Willebrandovo boleznijo (vrsta hemofilije) in predsednik društva Slovenija HEP. Njegovo življenje bi se brez razvoja novih zdravil, za katerega je sodelovanje med zdravstvenimi delavci in farmacevtsko industrijo ključno, končalo v zgodnji adolescenci. Otroštvo je preživel ob stalni skrbi, da se ne bi poškodoval, ob velikih količinah arašidov in jetrc, za katere so takrat verjeli, da pomagajo pri izboljšanju zdravstvenih stanj, vezanih na hemofilijo. Danes mu zdravila omogočajo, da je aktiven član družbe, da lahko potuje in se rekreativno ukvarja s športom.
Prav šport je izjemno pomemben tudi za Aladarja Belca, bolnika z juvenilnim revmatoidnim artritisom. Tudi on je bil prisiljen otroštvo preživeti v postelji in bolnišnicah, danes pa mu zdravila omogočajo, da na fitnesu dviguje 85-kilogramske uteži. “Zelo pomembna posledica sodelovanja med bolniki, zdravniki in farmacijo je tudi primeren nivo informiranosti. Uspešno se razbija stereotip, da so revmatska obolenja bolezni starejših, in danes se bolezen pri otrocih obravnava takoj. To je zelo pomembno, saj zgodnje prepoznavanje bolezni in učinkovito zdravljenje preprečujeta posledice, ki so lahko tudi trajne,” je poudaril Aladar Belec.

Prav izobraževanje zdravnikov, pri katerem zaradi pomanjkanja sredstev v državni blagajni ključno vlogo igra pomoč farmacevtske industrije, je bilo osredja tema pogovora s prof. dr. Matijo Tomšičem, predstojnikom Kliničnega oddelka za revmatologijo na UKC Ljubljana. »Prav jutri nas več z oddelka potuje na kongres v London, vsi imamo tam aktivno udeležbo. Brez donacije farmacevtske industrije tja enostavno ne bi mogli,« je opisal dr. Tomšič in poudaril, da se zdravniki s predstavniki farmacevtskih podjetij za potovanja na kongrese nikoli ne dogovarjajo osebno. Čeprav so v javnosti kongresi v tujini tisti, ki zbujajo največ pozornosti, pa je prof. dr. Tomšič poudaril pomen izobraževanj in predavanj s strani specialistov za družinske zdravnike po Sloveniji. »Tudi tega ne bi mogli izvajati brez pomoči farmacevtske industrije, ne bi mogli izdati priročnikov za družinske zdravnike in drugih informativnih gradiv,« je našteval prof. dr. Tomšič.
Z video izjavo se je v srečanje vključil tudi prof. dr. Mitja Košnik, ki je spregovoril tudi o pomenu kliničnih raziskav, nato pa se je srečanje prevesilo v drugo polovico, v kateri je bilo govora predvsem o tem, zakaj farmacevtska podjetja potrebujejo zdravnike in o širših družbenih učinkih posledic sodelovanja med njimi.
Generalna sekretarka Foruma, mag. Barbara Stegel, je poudarila, da so zdravniki tisti, ki imajo neposreden stik z bolniki, zato je sodelovanje z njimi tako na raziskovalnem področju, kot pri spremljanju učinkovitosti zdravil, ki so že v uporabi, bistvenega pomena. Tudi ona je izpostavila pomen izobraževanja: »Vsi se lahko v življenju znajdemo v vlogi bolnika in tedaj si zagotovo želimo ob sebi imeti zdravnika, ki pozna celoten nabor najnovejših in najbolj učinkovitih zdravil in postopkov zdravljenja,« je dejala. Kot eno od pozitivnih posledic razvoja in uporabe inovativnih zdravil v sodelovanju zdravnikov in farmacije je izpostavila tudi obsežne neposredne prihranke v zdravstvu in posredne prihranke pri socialnih transferjih. »Vsak dan manj, ki ga bolniki preživijo v bolnišnici ali doma na bolniški, predstavlja znaten prihranek.«
Mag. Katarina Verhnjak pa je spregovorila o pravilih igre, ki urejajo sodelovanje med zdravstvenimi delavci in farmacevtsko industrijo. »Ta so zelo stroga in nas zavezujejo na več ravneh. Regulirani smo z zakonodajo, s kodeksi na ravni EFPIA-e in z internimi pravili samih podjetij. Pri tem upoštevamo pravilo, da se držimo najstrožjega predpisa, če neko področje urejajo različni predpisi na vseh omenjenih ravneh. Poleg letalske smo tako najbolj regulirana industrija na svetu,« je opisala.
Njene besede je dopolnila tudi prof. dr. Bojana Beovič, predstavnica Zdravniške zbornice Slovenije, ki je prav tako poudarila pomen podpore farmacevtske industrije na področju izobraževanja zdravnikov in izpostavila, kako pomembno je, da v te odnose sodelovanja obe strani vstopata in jih izvajata kar najbolj transparentno.
Sodelovali so:
Osrednje teme:
“,”Rok Knafelj”,1465501140,1465501140,sl,12317,306,12316,43,0,NULL,,”8. infozajtrk za medije”,8-infozajtrk-za-medije,Post,”/sites/43/files/images/news/8. infozajtrk/Gostje_med_razpravo_b.jpg”,1,0,1521491788,1538638797
240,12319,”Srečanje Delovne skupine EFPIA za srednjo in vzhodno Evropo v Ljubljani”,” “,”
Forum je 3. marca 2016 z Evropsko zvezo farmacevtskih industrij in združenj (EFPIA) v Ljubljani soorganiziral delavnico o implementaciji evropske direktive o preprečevanju vstopa ponarejenih zdravil v zakonito dobavno verigo, 4. marca pa je gostil srečanje Delovne skupine EFPIA za srednjo in vzhodno Evropo.
Nosilec implementacije direktive na evropski ravni je Evropska organizacija za verifikacijo zdravil – EMVO, ki na evropskem nivoju združuje deležnike: EFPIA, Evropsko združenje proizvajalcev generičnih zdravil (EGA), Evropsko združenje veletrgovcev z zdravili (GIRP), Evropsko združenje paralelnih uvoznikov/izvoznikov zdravil (EARCP) ter Evropsko lekarniško združenje (PGEU). V slovenskem prostoru dogovarjanja med deležniki usklajuje Forum, ki je pripravil tudi predstavitev projekta implementacije direktive za predstavnike družb članic Foruma ter koordiniral delavnico na to temo za predstavnike lokalnih združenj inovativne farmacevtske industrije v centralni in vzhodni Evropi, EGA ter Združenja proizvajalcev zdravil Slovenije.
Na srečanju Delovne skupine EFPIA za srednjo in vzhodno Evropo je Forum gostil predstavnike EFPIA na čelu s predsednikom Richardom Bergströmom, EGA ter predstavnike generične farmacevtske industrije iz Romunije, Poljske in Slovenije. K delu razprave je povabil tudi direktorja ZZZS, Sama Fakina, predstavnico Ministrstva za zdravje RS, odgovorno za področje zdravil, Andrejo Jerina in dr. Petro Došenovič Bonča z Ekonomske fakultete Univerze v Ljubljani, ki so gostom predstavili značilnosti slovenskega zdravstvenega sistema ter osvetlili izglede za njegov nadaljnji razvoj.
“,Administrator,1457383320,1457383320,sl,12319,306,12318,43,0,NULL,,”Srečanje Delovne skupine EFPIA za srednjo in vzhodno Evropo v Ljubljani”,srecanje-delovne-skupine-efpia-za-srednjo-in-vzhodno-evropo-v-ljubljani,Post,”/sites/43/files/images/news/Srecanje delovne skupine/Srecanje_delovne_skupine.jpg”,1,1,1521491897,1522771371
241,12320,#BrezPredaha,”Bolezen nikoli ne spi, zato tudi inovacije v zdravstvu ne morejo mirovati. Prebojna odkritja na področju farmacije, ki rešujejo življenja, so rezultat strasti in predanosti tistih, ki so svoja življenja posvetili odkrivanju in razvoju novih zdravil.
Oglejte si, zakaj v farmacevtski industriji delujemo #BrezPredaha in kako se borimo za boljši svet za vse.”,”
Inovativne farmacevtske družbe apelirajo na oblikovalce politik, naj podprejo robusten sistem spodbud za raziskave in razvoj na področju zdravil sirot in dajo upanje bolnikom, ki živijo z redkimi boleznimi.

Da bi prinesli upanje tridesetim milijonom Evropejcevi (vsakemu sedemnajstemu), ki živijo z redko boleznijo, moramo vsi partnerji v zdravstvu delati skupaj in zagotoviti, da bolniki lahko dostopajo do vseh trenutno razpoložljivih možnosti zdravljenja. Poleg tega moramo dodatno spodbuditi raziskave in razvoj novih možnosti zdravljenja za bolnike na področjih, kjer zdravila trenutno ne obstajajo. Noben od omenjenih dveh ciljev pa ne bo dosežen z ogrožanjem preverjene in učinkovite Uredbe. Njuno doseganje zahteva drugačne pristope in rešitve.
Spodbujanje raziskav in razvoja zdravil sirot je dober primer načina, na katerega lahko industrijska strategija EU usmerja raziskovanje in inovacije v izpolnjevanje neizpolnjenih potreb bolnikov in hkrati tudi krepitev Evropskega gospodarstva. Morebitna vprašanja glede uspešnosti delovanja Uredbe o zdravilih sirotah pa je mogoče najbolje nasloviti v okviru Evropskega foruma za boljši dostop do zdravstvenih inovacij, ki bi združeval različne deležnike na tem področju.
V kontekstu aktualne presojeii učinkov Uredbe o zdravilih sirotah EFPIA poziva evropske institucije, da zagotovijo stabilno in predvidljivo ogrodje predpisov in spodbud, s katerim bi še dodatno podprle nadaljnje raziskave in razvoj potrebnih novih zdravil za redke bolezni.
Redke bolezni so pogosto genetskega izvora. Pojavijo se večinoma v otroštvu in povzročajo hudo breme. Bolezni, kot so na primer amiotrofična lateralna skleroza (ALS), kronična limfocitna levkemija, duchennova mišična distrofija ali wilsonova bolezen, so zapletene, znanstveno zahtevne in raznolike bolezni, ki so sicer izjemno redke, toda skupno prizadenejo 30 milijonov Evropejceviii.
Evropska Unija je leta 2000 sprejela Uredbo o zdravilih sirotahiv, da bi poskrbela za potrebe Evropejcev, ki živijo z redko boleznijo. Pred uvedbo Uredbe so bile raziskave na tem področju omejene in »zelo redke in niso privedle do bistvenega napredka v raziskavah«v. Glede na majhne populacije bolnikov s posamezno boleznijo, zapletenost in tveganje odkrivanja in razvoja zdravila, ki ima nato le majhno komercialno vrednost, so se pojavljale skrbi, da bi v odsotnosti posebnih spodbud za razvoj in inovacije razvili premalo ali nič novih specifičnih zdravil za te hude bolezni.
Uredba o zdravilih sirotah je spodbudila razvoj novih zdravil za bolnike z do sedaj neozdravljivimi boleznimi. Število odobrenih produktov za redke bolezni je od sprejema Uredbe naraslo iz 8vi na današnjih 164vii.
Evropa je s sprejemom Uredbe o zdravilih sirotah in z njo povezanimi ciljno usmerjenimi spodbudami veliko pridobila. Uredba spodbuja raziskave in razvoj, na primer z zmanjšanjem dajatev in s pomočjo pri izvedbi protokolov obetavnih metod zdravljenja in z 10-letno tržno ekskluzivnostjo nagrajuje tiste, ki prestanejo dolg in zapleten postopek razvoja nove metode zdravljenja, razvijejo novo zdravilo in prinesejo upanje bolnikom. Prednosti Uredbe o zdravilih sirotah so prinesle:
Spodbude so spremenile življenja bolnikov in njihovih družin, izboljšale izide zdravljenja in prispevale k rasti gospodarstva.
So ključnega pomena za širjenje znanj v medicini ter spodbujanje in ohranjanje raziskovalnega, inovativnega in investicijskega okolja v Evropi.
Trdno verjamemo, da noben bolnik ne sme ostati pozabljen. Uredba o zdravilih sirotah je bistvenega pomena za spodbujanje nadaljnjih investicij in inovacij v Evropi v smeri razvoja novih zdravil za preostale redke bolezni.
Kljub bistvenemu napredku 95%xi redkih bolezni še vedno ostaja brez možnosti zdravljenja. Nekateri izmed razlogov za takšno stanje so veliko število različic redkih bolezni po svetu (od 5000 do 8000), majhne in razpršene populacije bolnikov s posamezno boleznijo, pomanjkanje preverjenih bioloških označevalcev in končnih točk, slaba diagnostika in omejeno klinično znanje ter zapletenost in tveganja pri odkrivanju in razvoju zdravilxii.
Poleg naše skupne odgovornosti za iskanje novih možnosti zdravljenja za bolnike, ki živijo z redkimi boleznimi, lahko Uredba o zdravilih sirotah opravi svojo vlogo tudi v prihodnji gospodarski strategiji EU in pomaga promovirati trajnostne inovacije. V skladu s študijo gospodarskih in družbenih vplivov v biofarmacevtskih družbahxiii, »…postopna odprava obstoječih spodbud v Evropi bi imela bistven negativen učinek na njihovo delovanje v Evropi, saj je več kot polovica [anketirancev] povedala, da bi takšen scenarij povzročil zmanjšanje njihovega razvojno raziskovalnega in komercialnega prizadevanja za več kot 25%. (…) Šibkejši režimi intelektualne lastnine zmanjšujejo pripravljenost družb za investicije v raziskave in razvoj [v Evropi].«
V skladu s potrebami po dostopu do novih zdravil sirot so raziskovalna farmacevtska podjetja zavezana sodelovanju z deležniki in iskanju novih modelov financiranja takšnih zdravil in s tem ohranjanju dostopa za bolnike ter izboljševanju trajnosti zdravstvenih sistemov. Ponovno odpiranje Uredbe, ki je namenjena podpori raziskav novih možnosti zdravljenja, ne bo izboljšala dostopa bolnikov – ne sedaj, ne v prihodnosti. Dostop lahko izboljša le iskanje novih skupnih pristopov v sodelovanju z vsemi vključenimi deležniki.
Nova zdravila in zgodnje odkrivanje pri otrocih in odraslih prinaša novo upanje. Uspeh in vrednost Uredbe pri spodbujanju razvoja novih zdravil je lahko v celoti dosežen le, če bolniki dobijo dostop do takšnih zdravil.
Pri dostopu do novih zdravil sirot pa obstajajo pomembne razlike med državami članicami, mestoma celo znotraj posamezne države članice. Kazalnik PATIENT W.A.I.T. za leto 2018xiv ne kaže le, da so zdravila sirote manj dostopna. V več kot 80 odstotkih 26 analiziranih evropskih držav je tudi njihova pot do bolnikov po odobritvi dolgotrajnejša.
Zagotavljanje dostopa do novih zdravil sedanjosti in prihodnosti je skupni cilj in odgovornost, ki zahteva sodelovanje regulatorjev, partnerjev v zdravstvu, bolnikov, vlad in panoge. Deležniki morajo skupaj poiskati nove vire financiranja inovativnih zdravil, ki bodo zagotovili dostop za bolnike in trajnostno vzdržnost nacionalnih zdravstvenih sistemov. Dosežen je bil opazen napredek:
EFPIA verjame, da je prišel čas za novo vrsto pogovorov v Evropskih ustanovah o sprejemu predloga zdravstvene koalicije EU in vzpostavitvi foruma za boljši dostop do zdravstvenih inovacijxv, ki bi združil vse deležnike na zadevnem področju v iskanju rešitev za dostop do novih zdravil in tehnologij danes, zdravstvene inovacije za jutri in oblikovanje vzdržnih zdravstvenih sistemov v globalno konkurenčni Evropi. Le s takšnim dialogom je mogoče identificirati in oblikovati smiseln odziv na izzive, s katerimi se spopadajo zdravstveni sistemi.
i http://www.orpha.net/national/data/NO-NO/www/uploads/Orphanet_publication_pointprev_2019.pdf
ii https://www.who.int/medicines/areas/priority medicines/BP6 19Rare.pdf
iii https://ec.europa.eu/info/research-and-innovation/research-area/health/rare-diseases_en
iv https://ec.europa.eu/health/sites/health/files/files/eudralex/vol-1/reg_2000_141_cons-2009-07/reg_2000_141_cons-2009-07_en.pdf
v https://ec.europa.eu/health/sites/health/files/files/orphanmp/doc/orphan_inv_report_20160126.pdf
vi Mark L Flear, Anne-Maree Farrell, Tamara K Hervey and Therese Murphy (eds) (2013) European law and New Health Technologies. Oxford Studies in European Law.
vii https://www.ema.europa.eu/en/documents/other/orphan-medicines-figures-2000-2018 en.pdf
viii https://www.pugatch-consilium.com/reports/Benchmarking success.pdf
ix https://www.ema.europa.eu/en/documents/other/orphan-medicines-figures-2000-2018_en.pdf
x http://www.europlanproject.eu/NationalPlans?idMap=1
xi Global Genes, Rare diseases: Facts and Statistics, https:// globalgenes.org/rare-diseases-facts-statistics/
xii https://www.pugatch-consilium.com/reports/Benchmarking_success.pdf and https://www.who.int/medicines/areas/priority medicines/BP6_19Rare.pdf
xiii https://www.efpia.eu/media/412939/efpia-economic-societal-footprint-industry-final-report-250619.pdf
xiv https://www.efpia.eu/media/412747/efpia-patient-wait-indicator-study-2018-results-030419.pdf
xv https://www.euhealthcoalition.eu/recommendations/
“,,1513197900,1513197900,sl,12320,306,12296,43,0,NULL,,#BrezPredaha,brezpredaha,Post,/sites/43/files/images/Fokus/Microskop.jpg,1,0,1521558538,1583260440
242,12328,”4. strateška konferenca Vrednost inovacij”,” “,”
4. strateška konferenca Vrednost inovacij s temo Z dokazi podprto zdravljenje – za vzdržnost zdravstvenega sistema, je odprla razpravo o tem, kako spodbuditi krogotok med vsemi deležniki v zdravstvu – od raziskovalcev preko zdravnikov in politike ter drugih strok – za to, da bi močneje spodbudili zbiranje in analizo podatkov v zdravstvu ter takšno obliko snovanja zdravstvenih politik, ki bi na teh podatkih temeljile.
V slovenskem zdravstvu je problematika sprejemanja kakovostnih odločitev v zadnjem obdobju ena najpogosteje obravnavanih, izpostavljenih, kritiziranih in vrednotenih. Kar ne preseneča – dobre ali slabe, ustrezne ali napačne odločitve vedno privedejo do zelo oprijemljivih rezultatov, ki jih je mogoče izmeriti in jih nato tudi javno ocenjevati.
Strokovne in tudi javne razprave o z dokazi podprtem odločanju v zdravstvu so se razširile v 90-ih letih prejšnjega tisočletja kot logično nadaljevanje velikega zanimanja in empiričnega dela na področju z dokazi podprte medicine. Na že tradicionalni, 4. strateški konferenci Vrednost inovacij, so zato strokovnjaki z različnih področij predstavili svoj pogled na problematiko ter predstavili primere dobrih praks.
V uvodnem predavanju je dr. Petra Došenovič Bonča z Ekonomske fakultete Univerze v Ljubljani pojasnila, da v zdravstvu že dolgo ne gre več zgolj za odločanje zdravstvenih delavcev na podlagi izsledkov, ampak postaja vse pomembnejše tudi z dokazi podprto odločanje menedžerjev in snovalcev zdravstvenih politik. Med raziskovalci, znanstveniki in inštituti na eni ter snovalci politik ter zdravstvenimi menedžerji na drugi strani bi morala teči nenehna interakcija; raziskovalci in analitiki namreč neodvisno od odločevalcev po svoji presoji iščejo novosti in izzive. Vez med obema poloma, ki bi zmogla opredeliti relevantna vprašanja ter vzpostaviti dialog med odločevalci in raziskovalci ter slednje spodbuditi k raziskovanju družbeno pomembnih tem, ne obstaja. Prav tako je malo prenašalcev znanja, ki bi rezultate raziskav preobrazili v jasno sporočilo, s katerim bi lažje upravljali odločevalci, ki se do zdaj odločajo predvsem na podlagi zgodb, mitov in mnenjskih voditeljev, ne pa na podlagi empiričnih dokazov. Šele ko so dokazi zbrani, ovrednoteni, filtrirani ter prilagojeni in približani naslovnim odločevalcem, je mogoče sprejeti prave odločitve in ukrepe v zdravstvu.
Dorijan Marušič, nekdanji zdravstveni minister in član strokovnega sveta o učinkovitih oblikah vlaganja v zdravje pri Generalnem direktoratu za zdravje in varstvo potrošnikov v Bruslju, si je v predavanju zastavil zanimivo izhodišče, v kolikšni meri in zakaj je sistematično spremljanje izidov zdravljenja pomemben gradnik za nadaljnje odločanje v zdravstvu in s tem tudi na financiranje le-tega. Z dokazi podprto zdravljenje je, kot rečeno, že dve desetletji razmeroma vroča tema, hkrati pa je kot javno gibanje ali zdravstvena doktrina še zelo mlada. Vrednotenje njenih dobrobiti je nedorečeno, veliko je skeptičnih mnenj, ima celo izrazite nasprotnike, kar ne čudi, saj je zasnovana kot nasprotje vplivom socialne moči, tradicije in subjektivnosti na medicinske odločitve. Zato je izjemno zanimiv njegov predlog, da je neizogibno, da se v določitev košarice zdravstvenih pravic vključi tudi vrednotenje inovativnih tehnologij in vseh obstoječih programov. Spremljanje izidov zdravljenja je skratka pomemben gradnik nadaljnjega odločanja v zdravstvu, zlasti glede spremljanja izvajanja obstoječih in uvajanja novih tehnologij, zdravil, postopkov zdravljenja, organizacije in uvajanja kar najboljših poti pacienta skozi zdravstveni sistem. Zdravstvena politika namreč potrebuje strokovne usmeritve pri odločanju o uvrščanju zdravil in drugih tehnologij v javno financiranje. Tudi na ravni Evropske unije vse bolj poudarjajo usmeritve v kakovost in varnost v zdravstvu na temelju spremljanja podatkov, njihovega povezovanja, analiziranja in na tej podlagi ukrepanja, zlasti v preventivi; vizija 21. stoletja, kot jo definira ravno EU, je ravno »preprečiti, kar je preprečljivo«. Temeljna usmeritev pri tem bi morala biti vzpostavitev sistema spremljanja izidov zdravljenja najprej skozi proučitev primerljivih sistemov in kasneje s prilagoditvijo teh rešitev nacionalnim okvirom.
Dve pozitivni praksi, predstavljeni na konferenci, sta prispevala dr. Matija Tomšič, predstojnik Kliničnega oddelka za revmatologijo na UKC Ljubljana, ter dr. Tamara Poljičanin, predstavnica hrvaškega inštituta za javno zdravje.
Dr. Tomšič je predstavil interaktivni register BioRx.si, s katerim že od leta 2008 na nacionalnem nivoju beležijo uporabo bioloških zdravil, predpisanih v revmatoloških ambulantah. S pomočjo programa so povečali merjenja stopnje obolelosti ter obseg dela v ambulanti (hospitalizacije so se zmanjšale za polovico), zmanjšali pa so tako stopnje obolelosti kot tudi trajanja bolezni. S sistematičnim delom so izboljšali obravnavo vseh bolnikov z različnimi oblikami revmatskih obolenj, zmanjšali so stroške ter izboljšali poznavanje bioloških zdravil in njihovih neželenih učinkov.
Dr. Poljičanin je s primerom soočanja sosednje Hrvaške s problemom diabetesa, za katerim zboli eden od enajstih bolnikov in za katerega porabijo kar 11 % proračuna za zdravstvo, pokazala in dokazala, da zbiranje različnih podatkov o kroničnih bolezni skozi leta, njihovo analiziranje in na podlagi podatkovnih analiz sprejete odločitve lahko močno prispevajo k razumevanju bremena neke kronične bolezni v državi, pomagajo pri nižanju stroškov soočanja s to boleznijo (na Hrvaškem so se kar za 13 % zmanjšali stroški zdravljenja diabetesa po tem, ko so program razširili na nacionalno raven) ter omogočajo pripravo strategij in akcij, ki so potrebne za obvladovanje neke kronične bolezni, kot je diabetes. Poudarila je še, da je pomembno že v izhodišču dognati, kdo bo izvajal monitoring in odgovarjal za njegove rezultate, da program sploh lahko uspe.
V končni razpravi, podprti z glasovanjem, je še vedno vsaj polovica udeležencev konference kot ključni problem pri uveljavljanju z dokazi podprtega zdravljenja ocenila nezaupanje in posledično preslabo sodelovanje med institucijami (55 %), oziroma da problem tiči v tem, da se odločevalci v raje opirajo na mite ter stališča mnenjskih voditeljev kot na razpoložljive dokaze (25 %). Hkrati med udeleženci diskusije ni bilo mogoče najti skupnega stališča o tem, kdo je za vzpostavljanje z dokazi podprtega zdravljenja odgovoren – politika ali stroka. Kot je pripomnil dr. Marijan Ivanuša, vodja urada Svetovne zdravstvene organizacije v Sloveniji, ter vodja projekta EVIDNet, je politika neučinkovita in draga, če ne temelji na dokazih. Poudaril je tudi, da po njegovem ne gre za nezaupanje med institucijami, temveč za slabo poznavanje različnih akterjev med seboj: »Raziskovalci ne vedo, kaj želijo politični odločevalci, in obratno.« Projekt EVIDNet, evropski program za sistematičnejšo uporabo raziskovalnih dognanj pri oblikovanju politik, v Sloveniji pilotno analizira trenutni položaj ter išče primerno platformo za prenos znanja.
Tomaž Gantar, bivši minister za zdravje in predsednik parlamentarnega odbora za zdravstvo, je kot problem izpostavil tudi neučinkovitost državnih odborov, v katerih sedijo poslanci, ki morda niso strokovnjaki ter se v problematiko težje poglobijo. Hkrati je poudaril, da je zdravstvo težavno področje, saj se dotika prav vseh, zato je zakone načeloma težje sprejemati kot v drugih resorjih, kar je še ena izmed ovir za ustrezno implementacijo z dokazi podprtega zdravljenja.
Zaključna misel konference se je zlila v ugotovitev, da predvsem manjkajo spodbude, s katerimi bi pospešili krogotok zbiranja in analiziranja podatkov v zdravstvu. Ena od možnosti vsekakor je, da bi nekatere obstoječe dobre prakse lahko spremenili v institucionalizirane oblike tovrstnih spodbud.
“,”Jaka Verbic Miklic”,1447699380,1447699380,sl,12328,306,12327,43,0,NULL,,”4. strateška konferenca Vrednost inovacij”,4-strateska-konferenca-vrednost-inovacij,Post,”/sites/43/files/images/news/4. strateska/2015-10-15-Vrednost-inovacij-0066_b.jpeg”,1,1,1521571635,1522502249
243,12330,”1. posvet o bioloških in podobnih bioloških zdravilih”,”Biološka zdravila so bolnikom v zadnjih tridesetih letih odprla nove možnosti zdravljenja”,”
Biološka zdravila so bolnikom v zadnjih tridesetih letih odprla nove možnosti zdravljenja in prinesla revolucijo pri obvladovanju nekaterih bolezni; spremenila in izboljšala so življenje že več kot 350 milijonom bolnikov po vsem svetu, danes pa je več kot polovica vseh novih zdravil, ki pridejo na trg, bioloških. Prihajajo pa tudi že podobna biološka zdravila. O tem, kakšne so bistvene značilnosti enih in drugih ter kaj prinašajo bolnikom in kaj zdravstveni blagajni, so strokovnjaki razpravljali na posvetu, ki sta ga organizirala Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb in revija Medicina danes.
Biološka zdravila delujejo tarčno in so za zdravljenje nekaterih bolezni zato lahko veliko bolj učinkovita od sinteznih kemičnih zdravil. Biološka zdravila se pomembno razlikujejo od kemičnih zdravil, saj gre za kompleksne in občutljive beljakovine, pridobljene z zahtevnimi postopki s pomočjo celic živih organizmov, ki proizvedejo na primer hormon ali protitelo, ki ga našemu telesu primanjkuje. Ker je pridobljeno s pomočjo živih celic in je celotni postopek in način pridobivanja končne zdravilne beljakovine nemogoče popolnoma kopirati, pri bioloških zdravilih tudi ne moremo govoriti o generičnih zdravilih in medsebojni zamenljivosti, temveč o podobnosti oziroma podobnih bioloških zdravilih.

Sodobna biološka zdravila so v glavnem pridobljena s pomočjo rekombinantne tehnologije DNK. Pri tem biotehnološkem postopku najprej izoliramo gen, ki je v našem telesu zadolžen za proizvodnjo želene snovi, npr. inzulina ali rastnega hormona. Ta gen nato vstavimo v gostiteljsko celico, ki je s tem dobila navodila, kakšne snovi naj proizvede. Celice nato v velikih posodah hranimo, da se delijo in množijo, na koncu pa s čiščenjem in izolacijo pridobimo čisto beljakovino, ki je končni proizvod – biološko zdravilo. Celotni postopek je računalniško voden in poteka v strogo določenih in nadzorovanih pogojih. Poleg tega so celice zelo občutljive na spremembe v okolju, na primer temperature in kislosti.
Popolno posnemanje zdravilne učinkovine je mogoče pri sinteznih kemičnih zdravilih, zato pri njih lahko govorimo o generičnih zdravilih. Podobno biološko zdravilo je torej podobno in ne enako originalnemu oziroma referenčnemu biološkemu zdravilu. Zato za odobritev podobnega biološkega zdravila ne zadošča le dokazana bioekvivalenca kot pri generičnih zdravilih, ampak mora proizvajalec podobnega biološkega zdravila opraviti tudi klinične študije, s katerimi dokaže varnost in učinkovitost zdravila.
Postopek pridobivanja biološkega zdravila je veliko zahtevnejši od sintetiziranja kemičnih zdravil, slednji je precej krajši, saj traja nekaj dni, za eno serijo biološkega zdravila pa potrebujemo tedne ali mesece. Gre za velike in težke molekule, tako je na primer molekula aspirina sestavljena iz 21 atomov, jih ima inzulin približno štiridesetkrat več, eno monoklonsko protitelo pa tisočkrat več, preko 20 tisoč atomov, ki so med seboj povezani v vijačnice ter tvorijo kompleksno in občutljivo tridimenzionalno molekulo. Kot je v uvodnem predavanju poudaril prof. dr. Borut Štrukelj s Fakultete za farmacijo, je struktura takšne molekule odvisna od procesa (»Proces določi produkt«), minimalna sprememba v procesu pa vodi do sprememb v strukturi. Zato dodaja, da »avtomatske zamenljivosti ne priporočamo«, kot tudi ne morebitnega uvajanja terapevtskih skupin na tem področju, »vse dokler varnost in učinkovitost podobnih bioloških zdravil ne bosta stoodstotno dokazana«. Kot je pojasnil Jure Mikolič z Oddelka za zdravila Zavoda za zdravstveno zavarovanje Slovenije, o avtomatski zamenljivosti na zavodu »zaenkrat« tudi še ne razmišljajo.
Učinkovitost bioloških zdravil izhaja iz dejstva, da so našemu telesu navadno zelo domača in v veliko pomoč, ker so jih naredile žive celice, lahko pa jih telo prepozna tudi kot tujek, ki izzove naš imunski sistem. Tak odziv imenujemo imunogenost, kar je posebnost bioloških zdravil in tudi zato so zahteve pri spremljanju in poročanju neželenih učinkov drugačne in bolj stroge. Zelo pomembna je sledljivost, zato se med drugim pri poročanju zahtevajo podatki o zaščitenem imenu, proizvajalcu in seriji originalnega ali podobnega biološkega zdravila. Tu je jasno tudi stališče Javne agencije za zdravila in medicinske pripomočke; Sabina Zalar, njena predstavnica, pravi, da bi morala vsaka učinkovina imeti svoje ime glede na strukturo. Prof. dr. Sonja Praprotnik, specialistka revmatologinja, ki se pri svojem delu v praksi srečuje s predpisovanjem bioloških in podobnih bioloških zdravil, dodaja, da »pri neidentičnih zdravilih ne bi smeli uporabljati identičnih imen«. Dodala je tudi, da se v Sloveniji premalo testira imunsko neodzivnost bolnikov na določeno zdravilo. Za kakovostno obravnavo je po njenem mnenju treba uvesti tudi ustrezno imunsko testiranje. S tem, da je prihod podobnih bioloških zdravil dobrodošel, tudi za zdravstveno blagajno, a da je treba biti pri menjavanju zdravil, ko je bolnik enkrat že na določeni terapiji, izjemno previden, se strinja tudi dr. Simona Borštnar z Onkološkega inštituta. Oziroma kot je to razpravo v enem stavku povzela dr. Praprotnikova: »Upam, da izkušenj z avtomatsko zamenljivostjo bioloških zdravil ne bomo nikoli imeli.« Strokovnjaki so opozorili tudi na potencialno problematično ekstrapolacijo indikacij, to je razširjanje indikacij podobnega biološkega zdravila tudi na druge indikacije referenčnega zdravila, ne le na tiste, ki jih je podobno biološko zdravilo dokazalo v kliničnih študijah, saj vsaj v nekaterih primerih lahko zaradi neidentične strukture podobno biološko zdravilo učinkuje drugače kot referenčno.
Sodelujoči na posvetu so se strinjali, da so slovenskim bolnikom za zdaj dostopna vsa zdravila in terapije, ki jih potrebujejo. A Irma Veberič z Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb opozarja, da pri uvajanju novih zdravil žal zaostajamo za drugimi evropskimi državami. Po odobritvi zdravila s strani Evropske agencije za zdravila v Sloveniji na registracijo zdravila čakajo tudi do 20 mesecev. Podobna biološka zdravila že prihajajo na trg in vse več jih bo na voljo bolnikom. Trenutno od 450 milijonov, kolikor jih letno porabimo za zdravila, 70 milijonov namenimo za biološka zdravila, od tega 25 milijonov samo za onkološka zdravila. ZZZS seveda lahko pričakuje določen prihranek na račun prihoda podobnih bioloških zdravil, a Veberičeva opozarja, da tolikšnih prihrankov, kot smo jih vajeni pri generičnih zdravilih, pri podobnih bioloških zdravilih zaradi zahtevnosti proizvodnje vendarle ne gre pričakovati; realen je kvečjemu 20-odstotni prihranek, govorjenje o večjih vsotah (40 do 50 odstotkih prihrankov) pa je nerealno in neodgovorno.
Tudi predstavniki bolnikov in bolniških združenj, ki so sodelovali v razpravi, so opozorili pred morebitnim prehitrim uvajanjem podobnih bioloških zdravil zaradi domnevno nujnega varčevanja v zdravstveni blagajni; najprej mora biti popolnoma in v celoti dokazana njihova učinkovitost in varnost, šele potem jih bo mogoče bolj pospešeno uvajati. In ravno zaradi včasih pretiranega varčevanja v zdravstveni blagajni se zdi bolnikom na mestu opozorilo, da morajo biti še naprej deležni najsodobnejših terapij kot doslej. Kot je rekla Andreja Čufer, specialistka Lekarne UKC Ljubljana, je treba biti pri predpisovanju teh zdravil izjemno previden, saj pri referenčnem biološkem zdravilu in njemu podobnem biološkem zdravilu ne gre za popolnoma enake molekule. Te razlike pa omogočajo drugačen kliničen učinek zdravila: »Končna odločitev o predpisanem zdravilu za bolnika mora do nadaljnjega ostati v rokah zdravnikov.« In te odločitve nikoli ne smejo biti sprejete »v škodo izidov zdravljenja bolnikov«.
“,”Jaka Verbic Miklic”,1417029660,1417029660,sl,12330,306,12329,43,0,NULL,,”1. posvet o bioloških in podobnih bioloških zdravilih”,1-posvet-o-bioloskih-in-podobnih-bioloskih-zdravilih,Post,”/sites/43/files/images/news/1. posvet/Bioloka_zdravila-8862_b.jpg”,1,0,1521573728,1522491622
244,12332,”Miti in resnice”,”O zdravilih, cepivih in drugih terapevtskih rešitvah v javnosti kroži veliko napačnih podatkov in interpretacij. Ne izgubite se v megli mitov in se raje opremite z znanstveno dokazanimi dejstvi, podatki in statistikami.
Odločajte se na podlagi preverjenih in relevantnih informacij s področja zdravil, cepiv, farmacije in zdravstva. “,”
Med največje mite v slovenskem zdravstvu spadajo populistične ocene, da so zdravila v Sloveniji med najdražjimi v Evropi in da izdatki zanje strmo naraščajo. A številke in dejstva dokazujejo, da temu v resnici ni tako. Čeprav se poraba zdravil zaradi staranja prebivalstva povečuje, smo za zdravila na recept leta 2016 porabili 21 milijonov manj kot leta 2009. Cene zdravil so v obdobju od 2010 do 2016 padle za 30 odstotkov. Delež za zdravila je v celotnih izdatkih za zdravstvo med letoma 2012 in 2016 padal in je leta 2016 znašal le še 14,6 odstotka.
Pa si cene zdravil v Sloveniji oglejmo nekoliko podrobneje. Eden najpomembnejših dejavnikov, ki vplivajo na porabo zdravil, je starost prebivalstva. Demografski trendi jasno kažejo, da se je prebivalstvo v Sloveniji v zadnjem času staralo izredno hitro. Imamo namreč blizu 400.000 prebivalcev, starejših od 65 let, kar je skoraj 30 odstotkov več kot pred desetimi leti. Ker zdravstvene potrebe državljanov po 65. letu strmo narastejo, in sicer za približno dvakrat, to pomeni tudi večje stroške za zdravstvo. Skladno z demografskimi spremembami se poraba dnevnih odmerkov zdravil stalno povečuje, kar je povezano s podaljševanjem življenjske dobe bolnikov in izboljševanjem kakovosti življenja ljudi v Sloveniji.
Kljub povečanim potrebam in dobremu naboru novih razvrščenih zdravil so bili stroški za zdravila leta 2016 nižji kot leta 2009. Analiza podatkov iz letnih poročil oddelka za zdravila na Zavodu za zdravstveno zavarovanje Slovenije (ZZZS) je pokazala, da zdravila na recept niso prispevala k dvigovanju stroškov za zdravstvo. Nasprotno – za zdravila na recept smo leta 2016 porabili kar 21 milijonov evrov manj kot leta 2009, poleg tega so bili odhodki ZZZS za zdravila leta 2016 za 13,9 milijonov evrov nižji od z rebalansom dodeljenih sredstev.
.jpg)
V Sloveniji so najvišje dovoljene cene (NDC) zdravil pod strogim nadzorom. Po zakonu je NDC za posamezno zdravilo v Sloveniji najnižja cena tega zdravila med izbranimi državami, to je med Nemčijo, Francijo in Avstrijo. Čeprav se na prvi pogled zdi, da raven NDC zdravil v Sloveniji določajo le tri države, upoštevajo Avstrija, Nemčija in Francija, vsaka na svoj način, tudi druge države ali relevantne klinične doprinose – vrednosti – zdravila. Tako na raven NDC v Sloveniji dejansko posredno vplivajo tudi druge evropske države.
Konec leta 2017 je slovensko podjetje za raziskavo trga PhMR naredilo raziskavo o tem, kolikšne so NDC zdravil po Evropi. Rezultati so pokazali, da je raven NDC zdravil v Sloveniji precej pod povprečjem držav z višjim bruto domačim proizvodom (BDP), pod ravnijo cen v skandinavskih in drugih razvitih državah ter le dva odstotka nad cenami v evropskih državah z nižjim BDP. V Sloveniji zdravil torej ne preplačujemo, seveda pa NDC ni končna cena, po kateri farmacevtska industrija zdravila dejansko trži. NDC predstavlja le izhodiščno ceno za nadaljnja pogajanja med ZZZS in farmacevtsko industrijo, ki nato dogovorita še dodatne popuste.
Poglobljena analiza podjetja QuintilesIMS (NYSE), vodilnega svetovnega ponudnika storitev in podatkovnih baz, ki temeljijo na integriranih informacijsko-tehnoloških rešitvah na področju zdravstva, je pokazala, da so dodatni popusti na NDC zdravil v Sloveniji izdatni in še rastejo. Rezultati za leti 2013 in 2016 so pokazali, da povprečen dodatni popust na NDC za zdravila znaša več kot 20 odstotkov. In če smo na televiziji lahko slišali, da pri diagnostični opremi ni mogoče dobiti popolnoma enakega »Mercedesa« 20 odstotkov ceneje, kot stane v Franciji ali Nemčiji, je situacija na področju inovativnih zdravil na recept zaradi sodelovanja med ZZZS in inovativno farmacevtsko industrijo nasprotna.
Strokovnjaki z Ekonomske fakultete v Ljubljani so naredili dodatno razčlenitev stroškov zdravstvenih storitev, ki se financirajo iz sredstev ZZZS in ugotovili, da cene zdravil skozi leta padajo. Cene zdravil so v obdobju od leta 2010 do leta 2016 padle za 31 odstotkov, medtem ko so v istem obdobju cene življenjskih potrebščin narasle za 5,9 odstotka. Pri analizi so upoštevali ceno, količino in dve vrsti strukturnih premikov. Indeks cen za zdravila so izračunali po isti metodologiji, kot se izračuna indeks cen življenjskih potrebščin. Negativen učinek na izdatke za 31 odstotnih točk velja za cene zdravil, ki so bila predpisovana v celotnem analiziranem obdobju. Ta prihranek pri zdravilih je omogočil strukturne premike v predpisovanju v korist nekoliko dražjih zdravil, kar je posledica uvajanja novih, učinkovitejših zdravil in tudi posledica staranja prebivalstva. Tako privarčevana sredstva so omogočila tudi povečanje količine predpisanih zdravil, ki se merijo v definiranih dnevnih odmerkih (DDD).
Primerjavo Slovenije je možno delati z državami s podobnim številom razvrščenih zdravil in indikacij, kot jih ima Slovenija. Slovenija ima na prebivalca med državami s podobnim dostopom do zdravil – primerjava s Francijo, Belgijo, Norveško, Avstrijo, Finsko, Švedsko, Španijo – najnižje izdatke za zdravila. Slovenske davkoplačevalce gotovo lahko veseli, da podatki organizacije OECD in evropskega združenja EFPIA kažejo, da slovenski bolniki za 230 evrov na leto dobijo približno enak nabor zdravil kot belgijski za skoraj 450 evrov! Če bi v EU določili, da mora enak »Mercedes« v revnejših državah stati manj kot v bogatejših, in če bi upoštevali slovensko kupno moč po podatkih organizacije OECD, bi ugotovili, da je Slovenija med državami, ki si dober nabor zdravil – verjetno zaradi ugodnejših cen zdravil – bistveno lažje privoščijo kot večina drugih držav s podobnim naborom razvrščenih zdravil in indikacij.
Leta 2015 je bilo več kot 83 odstotkov izdanih zdravil cenejših od 10 evrov in skoraj 65 odstotkov zdravil cenejših od 5 evrov. To je pokazala analiza predpisovanja zdravil glede na njihovo ceno, ki jo je izvedla mag. Alenka Rutar Pariš, mag. farm. (Analiza je dostopna tu https://www.linkedin.com/pulse/so-zdravila-res-predraga-alenka-rutar-pari%C5%A1/). Do podobnih ugotovitev o porabi zdravil glede na njihovo ceno so prišli tudi raziskovalci z Ekonomske fakultete. In na tem mestu se moramo vprašati, ali si res želimo za zelo močne substance, od katerih pričakujemo vrhunsko kakovost in natančnost izdelave, plačevati manj kot za navadno bonboniero?
Vsi ti podatki, še posebej podatka o padcu cen v obdobju 2010–2016 in strošku na prebivalca, jasno nakazujejo, da so bile cene v Sloveniji pred letom 2010 na evropskem povprečju, danes pa ga ne ujamejo več. Zato je treba za ohranjanje dobre dostopnosti do zdravil v inovativna zdravila investirati več. Prihranke bi bilo treba iskati v drugih delih izdatkov za zdravstvo, mogoče tudi s preslikavo stroge regulacije področja zdravil na druga področja zdravstva.
Zdravila rešujejo človeška življenja, to vemo. Samo leta 2008 smo v Sloveniji lahko zabeležili kar 700 smrti manj zaradi rakavih obolenj. Globalno gledano se je zaradi novih terapij umrljivost zaradi raka od 90. let prejšnjega tisočletja zmanjšala za 20 odstotkov in dve od treh diagnosticiranih oseb preživita vsaj pet let. V zadnjih dveh desetletjih se je zaradi napredka pri zdravljenju bolnikov z virusom HIV ali aidsom smrtnost znižala za kar 80 odstotkov, razvoj učinkovitih zdravil pa je to bolezen spremenil iz akutne in smrtne v kronično.
Poleg daljšega življenja zdravila družbi in posamezniku prinašajo še mnoge druge vrednosti, kot so denimo zmanjšanje potreb po drugih zdravstvenih storitvah, zlasti v bolnišnicah in domovih za ostarele, izboljšanje kakovosti življenja in izboljšanje zmožnosti za delo. Poglejmo, na primer, bolnike s kroničnimi boleznimi, kot sta revmatoidni artritis ali multipla skleroza. V 90. letih prejšnjega tisočletja je zdravljenje revmatoidnega artritisa sicer omogočalo zmanjševanje vnetij sklepov, vendar je bilo usmerjeno v blaženje simptomov, bolezen pa je relativno hitro napredovala do funkcionalne nezmožnosti. Danes so lahko biološka imunomodulirajoča zdravila (DMARDs) ciljno usmerjena na vzroke vnetij, kar izboljša telesno zmogljivost bolnikov in preprečuje nepopravljive poškodbe sklepov. Tudi pri bolnikih z multiplo sklerozo so peroralna in biološka zdravila, ki so dobila dovoljenje v zadnjih petnajstih letih, izrazito izboljšala njihove zdravstvene izide, upočasnila napredek bolezni in omogočila manj ponovnih izbruhov bolezni. Koristni učinki inovacij so prisotni tudi pri vseh pogostih kroničnih boleznih, kot so na primer srčno-žilne bolezni in sladkorna bolezen.
Zdravila tako posredno prispevajo tudi k zniževanju drugih stroškov za družbo, saj študije, ki temeljijo na podatkih OECD in ameriških zdravstvenih zavarovalnic, jasno kažejo njihov vpliv na manjše število bolniških odsotnosti. Ena od študij¹ je, denimo, pokazala, da je v dvajsetih državah OECD povprečno znižanje izdatkov – na prebivalca – zaradi bolnikov z boleznimi srca in ožilja 3,7-krat večje od zvišanja stroškov zaradi uporabe novih zdravil.
¹ Lichtenberg, F.R., 2009: »Have newer cardiovascular drugs reduced hospitalization? Evidence from longitudinal country-level data on 20 OECD countries, 1995-2003,« Health Economics, John Wiley & Sons, Ltd., vol. 18(5), str. 519–534.
“,Administrator,1521578040,1521578040,sl,12332,306,12297,43,0,NULL,,”Miti in resnice”,miti-in-resnice,Post,/sites/43/files/images/Fokus/Magnify.jpg,1,0,1521577856,1524652734
245,12333,”Cene zdravil”,” Cene inovativnih zdravil na recept so v Sloveniji strogo nadzorovane.
Farmacevtska podjetja aktivno sodelujemo s pristojnimi organi pri oblikovanju cen zdravil in si prizadevamo za njihovo dostopnost. Preverite, kako potekajo postopki določanja cen zdravil v Sloveniji.”,”
Pojasnjujemo osnovne pojme in prikazujemo, kaj vpliva na ceno zdravil
Področje zdravil velja za eno najbolj nadzorovanih. Zdravila so strogemu nadzoru podvržena na celotni poti – od postopka raziskav in razvoja, pa vse do njihove prodaje in uporabe. Tako so tudi cene inovativnih zdravil na recept, ki se financirajo iz javnih sredstev, strogo regulirane ter predmet dela več različnih inštitucij in tema več različnih zakonov in predpisov.
Pri nas področje cen zdravil urejajo Zakon o zdravilih in pridruženi akti. V strokovnem smislu je v pristojnosti Javne agencije RS za zdravila in medicinske pripomočke (JAZMP). Financiranje zdravil iz javnih sredstev je opredeljeno z Zakonom o zdravstvenem varstvu in zdravstvenem zavarovanju in je v pristojnosti Zavoda za zdravstveno zavarovanje Slovenije (ZZZS). Dodaten nadzor cen inovativnih zdravil na recept zagotavljata še Pravilnik o določanju cen zdravil za uporabo v humani medicini in Pravilnik o razvrščanju zdravil na listo.
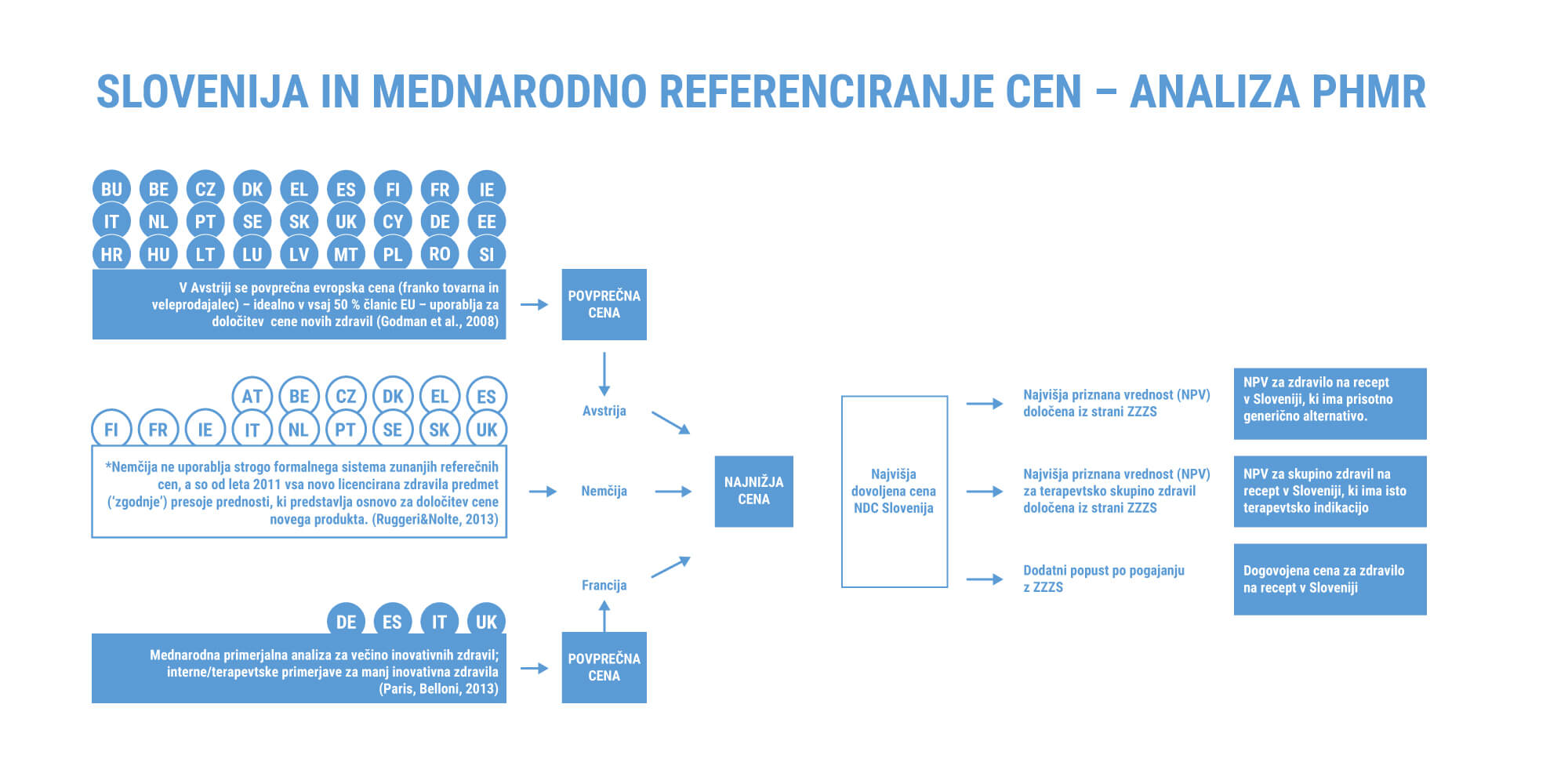
Tako kot večina drugih držav imamo v Sloveniji za določanje cen zdravil uveden primerjalni model, ki v našem primeru upošteva cene zdravil v Nemčiji, Avstriji in Franciji. Najvišja dovoljena cena (NDC) posameznega zdravila pri nas je po zakonu enaka najnižji ceni tega zdravila v teh treh državah. NDC zdravil so pod strogim nadzorom in JAZMP jih redno, dvakrat letno pregleduje. Avstrija, Nemčija in Francija pri določanju cen zdravil vsaka na svoj način upoštevajo tudi cene zdravil v drugih državah ter relevantne klinične doprinose – vrednosti – zdravila. Tako na raven NDC v Sloveniji dejansko posredno vplivajo tudi cene teh zdravil v drugih evropskih državah.
Strogo regulirane NDC zdravil pa niso končne cene. Dobavitelji zdravil, plačniki in kupci zdravil se namreč lahko dogovarjajo o cenah, ki so nižje od reguliranih. Tako ZZZS in farmacevtska industrija s pogajanji dogovorita popuste, ki jih omogoči farmacevtska industrija na področju Slovenije. Dogovorjena cena zdravila je torej običajno nižja od najnižje cene izmed držav Avstrija, Nemčija in Francija. Glede na poglobljeno analizo podjetja Quintiles IMS (NYSE) dodatni popusti na NDC zdravil v Sloveniji v povprečju znašajo že več kot 20 odstotkov.
Poleg najvišje dovoljene in dogovorjene cene zdravil je treba za razumevanje tega področja pojasniti tudi pojem najvišje priznane vrednosti (NPV). To je cenovni standard, ki ga ZZZS določi za posamezno zdravilo, ki se financira iz obveznega zdravstvenega zavarovanja v celoti, oziroma v ustreznem odstotnem deležu in glede na razvrstitev zdravila. Ravni NPV se praviloma prilagajajo vsaka dva meseca in jih s sklepom določi upravni odbor ZZZS ali po njegovem pooblastilu generalni direktor ZZZS. Najvišje priznane vrednosti ZZZS določa v skupini terapevtskih in v skupini medsebojno zamenljivih zdravil. Če je prodajna cena zdravila višja od NPV, je potrebno za zdravilo doplačati.
Terapevtske skupine zdravil določa ZZZS na lastno pobudo. V posamezno terapevtsko skupino so vključena inovativna zdravila z isto terapevtsko indikacijo z ali brez prisotne odobrene generične alternative. NPV za terapevtsko skupino zdravil je enaka najnižji ceni primerljivega odmerka zdravila z najugodnejšim razmerjem med stroški in učinki zdravljenja v terapevtski skupini. Vsi odmerki vsaj enega zdravila v posamezni terapevtski skupini zdravil so v celoti kriti iz sredstev zdravstvenega zavarovanja.
Skupine medsebojno zamenljivih zdravil sestavljajo inovativna zdravila po preteku patentne zaščite in prisotne odobrene generične alternative. Posamezno skupino medsebojno zamenljivih zdravil opredeljujejo določeni kriteriji (učinkovina, ATC oznaka, jakost in primerljiva oblika zdravila), skupino pa predstavljata najmanj dve zdravili z lastniškim imenom glede na delovno šifro. Zdravila iz te skupine imajo NPV določeno na ravni najcenejšega zdravila glede na primerljivi odmerek.
“,”Jaka Verbic Miklic”,1521579840,1521579840,sl,12333,306,12298,43,0,NULL,,”Cene zdravil”,cene-zdravil,Post,/sites/43/files/images/Fokus/Flascs.jpg,1,0,1521579892,1551697965
249,12396,”Kodeks transparentnosti”,”Kodeks transparentnosti (JOPS) opredeljuje javno objavo plačil in drugih prenosov sredstev zdravstvenim delavcem, neposredno ali posredno prek zdravstvenih organizacij.”,”
KODEKS O JAVNI OBJAVI PRENOSOV SREDSTEV ZDRAVSTVENIM DELAVCEM IN ZDRAVSTVENIM ORGANIZACIJAM S STRANI FARMACEVTSKIH DRUŽB
(Kodeks JOPS – Kodeks transparentnosti)
Sprejet na Skupščini Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ dne 21. novembra 2013 in spremenjen dne 4. julija 2014, 5. decembra 2014 in 27. maja 2016.
IZVAJANJE DOLOČIL KODEKSA
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ (v nadaljevanju: Forum) uvaja ustrezne postopke, s katerimi želi zagotoviti, da bi družbe članice Foruma delovale v skladu z zahtevami tako evropskega kodeksa, kot ga je sprejela Evropska zveza farmacevtske industrije in združenj (v nadaljevanju: EFPIA) kot ustreznega nacionalnega kodeksa (Kodeks o javni objavi prenosov sredstev zdravstvenim delavcem in zdravstvenim organizacijam s strani farmacevtskih družb (v nadaljevanju: Kodeks JOPS)) ter s temi postopki zagotovile preglednost plačil in prenosov sredstev zdravstvenim organizacijam in/ali zdravstvenim delavcem ter reševale morebitne pritožbe zaradi neprimernosti le teh.
UVOD
Zdravstveni delavci (ZD) in zdravstvene organizacije (ZO), s katerimi sodelujejo, farmacevtski industriji zagotavljajo dragoceno, neodvisno in strokovno znanje, ki temelji na njihovih izkušnjah na področju klinične prakse in vodenja. To znanje in izkušnje pomembno prispevajo k prizadevanjem industrije, da bi izboljšala kakovost oskrbe bolnikov, hkrati pa prinašajo korist za posameznike in širšo družbo. Zdravstveni delavci in zdravstvene organizacije bi morali prejeti pravično nadomestilo za legitimne storitve in strokovno znanje, ki jih nudijo industriji.
Zdravila na recept, ki jih razvije industrija, so kompleksni izdelki, namenjeni bolnikom, zato je usposabljanje zdravstvenih delavcev o zdravilih in boleznih, ki jih zdravijo, koristno za bolnike. Farmacevtska industrija lahko zagotovi legitimni forum za izobraževanje zdravstvenih delavcev in izmenjavo znanja med zdravstvenimi delavci in industrijo.
Forum poudarja, da ima sodelovanje med farmacevtsko industrijo in zdravstvenimi delavci izjemno pozitiven vpliv na kakovost oskrbe bolnikov in vrednost prihodnjih raziskav. Hkrati pa je svobodno odločanje zdravstvenega delavca o tem, katero zdravilo bo predpisal, eden od temeljev zdravstvenega sistema. Forum se zaveda, da lahko sodelovanje med industrijo in zdravstvenimi delavci ustvarja tudi morebitno nasprotje interesov. Zato so strokovna in industrijska združenja, vključno z EFPIA in njenimi včlanjenimi organizacijami, sprejeli kodekse in smernice, s katerimi zagotavljajo visok standard integritete tovrstnega sodelovanja, kakršnega pričakujejo bolniki, vlade in drugi deležniki.
Za zagotavljanje uspeha tudi v prihodnje morajo potrebe po samourejanju odgovarjati spreminjajočim se zahtevam družbe. Poleg integritete sodelovanja med podjetji in družbo se vedno bolj zahteva tudi popolna preglednost takšnih odnosov. Po sprejetju Pobude Evropske komisije o etiki in preglednosti v farmacevtskem sektorju je skupina deležnikov – med drugim tudi EFPIA – sprejela »Seznam vodilnih načel spodbujanja dobre vodstvene prakse v farmacevtskem sektorju«.
V skladu s temi vodilnimi načeli Forum meni, da se mora farmacevtska industrija ustrezno odzvati na vedno strožje zahteve družbe, če želi biti uspešna tudi v prihodnje. Zato se je Forum odločil, da je treba dopolniti obstoječe predpise, kot sta Kodeks obveščanja in seznanjanja o zdravilih na recept (Kodeks OSZRp) in Kodeks obnašanja v odnosih med farmacevtsko industrijo in združenji bolnikov (Kodeks ZB) z zahtevami po javni objavi vrste in obsega sodelovanja med industrijo in zdravstvenimi delavci ter organizacijami. Forum upa, da bo s tem ukrepom javnosti omogočil primeren nadzor in razumevanje teh odnosov in s tem prispeval h krepitvi zaupanja deležnikov v farmacevtsko industrijo.
Forum prav tako meni, da je zanimanje bolnikov in drugih deležnikov za preglednost tovrstnega sodelovanja povsem upravičeno. Forum se zaveda, da bi se lahko ob takšni objavi pojavili pomisleki glede varstva podatkov, zato si prizadeva sodelovati z zdravstvenimi delavci ter tako zagotoviti ustrezno rešitev v zvezi s tovrstnimi pomisleki. Kljub temu pa Forum meni, da je mogoče preglednost zagotoviti tudi brez ogrožanja legitimnih pravic do zasebnosti zdravstvenih delavcev in da zato zakonodaja industriji ne bi smela nalagati prevelikih omejitev glede javne objave podatkov.
Kodeks JOPS opredeljuje javno objavo plačil in drugih prenosov sredstev zdravstvenim delavcem, bodisi neposredno ali posredno prek zdravstvenih organizacij oz. tretjih oseb – kot so izvajalci, zastopniki, partnerji ali podružnice (vključno s fundacijami). Pri odločanju o načinu javne objave prenosa sredstev se podjetja spodbuja, naj objavijo podatke na ravni posameznih zdravstvenih delavcev (ne zdravstvenih organizacij), če je to mogoče storiti z zadostno točnostjo, doslednostjo in skladno z veljavno zakonodajo.
Ta kodeks uvaja obveznost javne objave plačil in drugih prenosov sredstev zdravstvenim delavcem in zdravstvenim organizacijam, z začetkom poročanja leta 2016 v zvezi s plačili in drugimi prenosi sredstev za koledarsko leto 2015. Določila tega kodeksa izvaja Forum na način, ki je skladen z veljavno zakonodajo na področju konkurence in varstva podatkov ter predpisov in drugih veljavnih pravnih zahtev.
PODROČJE UPORABE DOLOČIL KODEKSA
Ta kodeks ureja javne objave plačil in drugih prenosov sredstev v zvezi z določenimi oblikami sodelovanja z ZD in ZO. Namen tega kodeksa je njegova uporaba za urejanje preglednosti sodelovanja z ZD in ZO v enakem obsegu kot obstoječa kodeksa OSZRp in ZB. Ta kodeks velja za vse družbe članice Foruma.
DOLOČBE KODEKSA
1. Obveznost javne objave
1.1. Splošna obveznost. V skladu s pogoji tega kodeksa vsaka članica dokumentira in objavi plačila in druge prenose sredstev, ki jih izvede neposredno ali posredno prejemniku ali v njegovo korist, kot je podrobno opisano v točki 3.
1.2. Soglasje prejemnika. Pred javno objavo plačil in drugih prenosov sredstev za vsakega jasno določljivega zdravstvenega delavca je vsaka članica dolžna pridobiti njegovo soglasje za objavo omenjenih podatkov. Pri sklepanju pogodb, ki vključujejo prenos vrednosti na zdravstvenega delavca, se članice spodbuja, naj vključijo v pogodbo določbe, ki se nanašajo na soglasje posameznika za javno objavo prenosa vrednosti v skladu z določbami tega kodeksa. Enako velja za že obstoječe pogodbe, za katere se članice spodbuja, naj vanje vključijo takšno soglasje za javno objavo, čimprej je to mogoče.
1.3. Izključene objave. Ne objavljajo se plačila in prenosi sredstev, ki (i) se nanašajo izključno na zdravila, ki se prodajajo ali izdajajo brez recepta, (ii) ki niso navedeni v 3. členu tega kodeksa, torej informativno in izobraževalno gradivo in izdelki za medicinsko rabo (točka 2.9. Kodeksa OSZRp), prehrana in pijača na dogodkih (točka 2.11. Kodeksa OSZRp, predvsem točka 5) ter vzorci zdravil (točka 11. Kodeksa OSZRp), oziroma (iii) so del običajnega postopka nabave in prodaje zdravil na relaciji članice in zdravstvenega delavca (kot je na primer lekarnar) ali zdravstvene organizacije.
1.4. Priloge. Vse priloge k temu kodeksu so sestavni del tega kodeksa.
Z namenom zagotavljanja enotnega pojmovanja vsebine kodeksa so opredeljeni posamezni pojmi, ki se uporabljajo v kodeksu v Prilogi 1.
Za pregled nad prenosi sredstev je določena standardizirana predloga za objavo v Prilogi 2.
2. Oblika javne objave
2.1. Letni cikel objav. Podatki o plačilih in drugih prenosih sredstev se objavijo enkrat letno, pri čemer vsako obdobje poročanja pokriva celotno koledarsko leto (obdobje poročanja). Prvo obdobje poročanja je koledarsko leto 2015, pri čemer se podatki prvič objavijo v prvi polovici leta 2016.
2.2. Čas objav. Vsaka članica objavi podatke v 6 mesecih po koncu ustreznega obdobja poročanja, javno objavljene informacije pa morajo biti na voljo javnosti vsaj 3 leta od datuma prve objave v skladu s točko 2.4., razen če se v posameznem primeru (i) zahteva krajše obdobje v skladu z zakonodajo o varovanju osebnih podatkov ali drugimi predpisi ali (ii) izjemoma, če prejemnik umakne svoje soglasje za določeno javno objavo.
2.3. Predloga. V skladu s točko 2.4. (ii) se podatki objavijo na standardizirani predlogi iz Priloge 2.
2.4. Mesto objav. Podatki se objavijo na spletni strani ustrezne družbe članice v skladu s točko 2.5., pod pogojem da dostop na spletno stran ni omejen.
2.5. Veljavni nacionalni kodeks. Podatki se objavijo v skladu z nacionalnim kodeksom države, v kateri ima prejemnik naslov opravljanja glavne poklicne dejavnosti ali registriran sedež. Če članica Foruma ni rezidenčna družba ali nima podružnice ali povezane družbe v državi, kjer ima naslov opravljanja glavne poklicne dejavnosti ali registriran sedež prejemnik, članica Foruma tak prenos sredstev objavi na način, ki je skladen s kodeksom, ki jo zavezuje v njeni matični državi.
2.6. Jezik objav. Objave se opravijo v slovenskem jeziku. Članice se spodbuja, naj poleg obvezne objave v slovenskem jeziku podatke objavijo tudi v angleščini.
2.7. Dokumentacija in hramba evidenc. Vsaka članica dokumentira vsa plačila in druge prenose sredstev, ki jih je treba objaviti v skladu s točko 1.1. in hrani ustrezne evidence o objavah po tem kodeksu vsaj 10 let po koncu ustreznega obdobja poročanja.
3. Javne objave posameznih in skupinskih podatkov
3.1. Objave posameznih podatkov. Plačila in drugi prenosi sredstev se objavijo individualno, razen če ni izrecno določeno drugače v tem kodeksu. Vsaka članica objavi podatke za vsakega posameznega jasno določljivega prejemnika, zneske prenosov sredstev na takega prejemnika v vsakem obdobju poročanja, ki jih je mogoče razumno razvrstiti v eno od spodaj navedenih kategorij. Razumni stroški poti, namestitve in registracije morajo biti prikazani na pregleden način, kot navedeno v nadaljevanju. Takšna plačila in drugi prenosi sredstev so lahko združeni na podlagi posameznih kategorij, vendar pa so na zahtevo prejemnika in/ali upravnega organa članice dolžne predložiti poročilo s podatki po posameznih postavkah.
3.1.1. Za prenose sredstev na ZO se objavi znesek, povezan s katero koli spodaj navedeno kategorijo:
3.1.1.1.Donacije in prispevki za izobraževanje. Donacije in prispevki za izobraževanje ZO v podporo zdravstveni oskrbi, vključno z donacijami, prispevki za izobraževanje in v naravi, dane ustanovam, organizacijam ali združenjem, ki jih sestavljajo ZD in/ali nudijo zdravstvene storitve (v skladu s točko 6. Kodeksa OSZRp).
3.1.1.2.Prispevek za kritje stroškov, povezanih z dogodki. Prispevek za kritje stroškov, povezanih z dogodki, vključno s sponzorstvom udeležbe na dogodku ZD ali prek ZO, kot so na primer:
i. Pristojbine za registracijo;
ii. Sponzorske pogodbe z ZO ali tretjimi osebami, ki jih imenuje ZO za vodenje dogodka in
iii. Stroški potovanja in nastanitve (v skladu s točko 2.11. Kodeksa OSZRp).
3.1.1.3.Nadomestila za storitve in svetovanje. Prenosi sredstev na podlagi pogodb med članicami in ustanovami, organizacijami ali združenji ZD, po katerih takšne ustanove, organizacije ali združenja članicam zagotavljajo kakršne koli storitve (ali jim članice Foruma omogočajo katero koli drugo obliko financiranja, ki ni opredeljena v prejšnjih kategorijah), če se takšne storitve (ali druge oblike financiranja s strani članic) (x) zagotavljajo z namenom dajanja podpore zdravstveni oskrbi ali raziskavam in (y) ne spodbujajo k priporočanju, predpisovanju, nakupu, dobavljanju, prodaji določenih medicinskih izdelkov ali oskrbovanju z njimi (v skladu s točko 7. in 8. Kodeksa OSZRp). Ločeno je potrebno javno objaviti i.) neposredna nadomestila za storitve in svetovanje ter ii.) druge stroške, nastale na podlagi sklenjene pogodbe za storitve in svetovanje (npr. stroški povezani s potovanjem, drugi materialni stroški,…).
3.1.2. Za prenose sredstev na ZD se objavi znesek, povezan s katero koli spodaj navedeno kategorijo:
3.1.2.1.Prispevek za kritje stroškov, povezanih z dogodki. Prispevek za kritje stroškov, povezanih z dogodki, kot so:
i. Pristojbine za registracijo in
ii. Stroški potovanj in nastanitve (v skladu s točko 2.11. Kodeksa OSZRp).
3.1.2.2. Nadomestila za storitve in svetovanje. Prenosi sredstev na podlagi ali v zvezi s pogodbami med članicami Foruma in ZD, po katerih ZD članicam zagotavljajo kakršne koli storitve (ali članice zagotavljajo katero koli drugo obliko financiranja, ki ni opredeljena v prejšnjih kategorijah, vključno z dogovorjenimi in/ali s pogodbo določenimi stroški, povezanimi z nadomestilom za storitve) (v skladu s točko 7. in 8. Kodeksa OSZRp). Ločeno je potrebno javno objaviti i) neposredna nadomestila za storitve in svetovanje ter ii) druge stroške, nastale na podlagi sklenjene pogodbe za storitve in svetovanje (npr. stroški povezani s potovanjem, drugi materialni stroški,…).
3.2. Objave skupinskih podatkov. Pri prenosih sredstev, kjer nekaterih informacij, ki jih je sicer možno razporediti v eno od kategorij, opredeljenih v točki 3.1., zaradi pravnih razlogov ni mogoče javno objaviti posamično, članica javno objavi zneske takih prenosov sredstev skupinsko, za vsako obdobje poročanja. Takšna skupinska javna objava za vsako kategorijo posebej določajo (i) število prejemnikov, ki jih vključujejo, absolutno in kot odstotek vseh prejemnikov in (ii) skupni znesek prenosov sredstev takim prejemnikom.
3.3. Brez podvajanja. Pri prenosih sredstev, ki jih je treba javno objaviti v skladu s točko 3.1. ali 3.2., na posameznega ZD posredno prek ZO, je treba takšen prenos sredstev javno objaviti le enkrat. Ta javna objava mora biti v čim večji možni meri izvedena skladno s točko 3.1.2.
3.4. Plačila na področju raziskav in razvoja. Vsaka članica javno objavi plačila na področju raziskav in razvoja skupinsko, za vsako obdobje poročanja. Stroški v zvezi z dogodki, ki so očitno povezani z aktivnostmi iz te točke, se lahko vključijo v skupinsko poročanje v kategorijo “Plačila na področju raziskav in razvoja”.
3.5. Metodologija. Vsaka članica objavi poročilo, v katerem povzame metodologije, ki jih je uporabila pri pripravi objav in identifikaciji prenosov sredstev za vsako kategorijo, opisano v točki 3.1. V sporočilu so opisane uporabljene metodologije za prepoznavanje, prav tako pa lahko vključuje obravnavo večletnih pogodb, DDV in druge davčne vidike, vidike, povezane z valutami, in druga vprašanja glede časa in zneska prenosa sredstev za namene tega kodeksa.
4. Sankcije
Če Forum ugotovi kršitev Kodeksa JOPS na osnovi prijave, mora od družbe kršiteljice zahtevati, da nemudoma preneha s kršitvijo in podpiše izjavo, da je ne bo ponovila. Sankcije morajo biti sorazmerne z naravo kršitve, učinkovati svarilno in upoštevati ponavljajoče se kršitve enakega tipa ali vzorce različnih kršitev. Sankcije so določene v Delovnem postopku Odbora za nadzor določil etičnih kodeksov. Na splošno za najučinkovitejšo sankcijo velja kombinacija obvestitve vseh družb članic Foruma in denarne kazni za družbo kršiteljico, vendar pa lahko Forum izreče katerokoli drugo učinkovito sankcijo, da zagotovi izvajanje Kodeksa. Forum mora tudi preučiti vse veljavne pravne ali finančne zahteve, ki bi vplivale na naravo možnih sankcij.
Odgovornost
Obseg odgovornosti.
Odgovornost za javno objavo plačil in drugih prenosov sredstev s farmacevtskih družb na ZD in ZO velja za javno objavo kot celoto: za kategorije prenosov, prejemnike, za javnost objave in upoštevanje rokov.
Odgovorne osebe.
Odgovornost za zagotavljanje skladnosti s tem kodeksom nosijo vse družbe članice Foruma. Prav tako so za skladnost z določili tega kodeksa odgovorni pooblaščeni predstavniki članic Foruma.
Forum zagotovi, da je Kodeks JOPS skupaj z drugimi kodeksi in ustreznimi informacijami enostavno dosegljiv najmanj prek objave kodeksa na spletni strani Foruma.
6. Nadzor
Odbor za nadzor določil etičnih kodeksov (Odbor) kot organ Foruma presoja glede javne objave plačil in drugih prenosov sredstev ZD in ZO s strani farmacevtskih družb in daje smernice glede njih. Odbor pri tem odloča po postopku, ki je enak postopku za ugotavljanje kršitev Kodeksa OSZRp.
Pritožbe
Pritožbe zaradi kršitve teh pravil se pošljejo Odboru v roku 30 dni od nastanka kršitve.
Spremembe
Spremembe ali prilagoditve Kodeksa JOPS se lahko opravijo na podlagi mnenja večine družb članic Foruma.
Kodeks se lahko spremeni večkrat v letu:
ob spremembi Kodeksa EFPIA o javni objavi prenosov sredstev s farmacevtskih družb na ZD in ZO.
na predlog, ki ga družba(e) članica(e) Foruma poda(jo) upravi Foruma, ta pa ga predloži v sprejem skupščini.
Za sprejetje spremembe je treba pridobiti večino glasov, prisotnih na skupščini.
Uveljavitev
Ta kodeks je stopil v veljavo 21. novembra 2013, ko ga je potrdila Skupščina Foruma.
Priloga 1:
Opredelitev pojmov, ki se uporabljajo v Kodeksu JOPS
Donacije in dotacije
– Skupaj pomenijo donacije, dotacije in prispevke v naravi v okviru 6. člena Kodeksa OSZRp.
Dogodki
– Vsa promocijska, znanstvena ali strokovna srečanja, kongresi, konference, simpoziji in drugi sorodni dogodki (kar vključuje, a ni omejeno na srečanja svetovalnega odbora, obiskov raziskovalnih ali proizvodnih prostorov in sestanke za načrtovanje, usposabljanje ali srečanja za raziskovalce v povezavi s kliničnimi raziskavami in neintervencijskimi študijami) – v nadaljevanju posamično “dogodek”, ki so organizirani ali sponzorirani s strani ali v imenu družbe (2.11. člen Kodeksa OSZRp).
Zdravstvene organizacije (ZO)
– Vsi samostojni podjetniki (s.p.) in pravne osebe (i), ki so zdravstvena, medicinska ali znanstvena združenja ali organizacije (ne glede na pravno ali organizacijsko obliko), kot so bolnice, klinike, fundacije, univerze ali druge izobraževalne ustanove ali akademska združenja (razen organizacij bolnikov v okviru kodeksa ZB) ali (ii) preko katerih eden ali več ZD izvaja svoje storitve.
Zdravstveni delavci (ZD)
– Vse fizične osebe, ki so članice zdravstvene, zobozdravstvene, farmacevtske ali negovalne stroke ali vse druge osebe, ki lahko pri opravljanju svojih poklicnih dejavnosti predpišejo, kupijo, zagotovijo ali odmerijo zdravilo in katerih primarna praksa, naslov glavne poklicne dejavnosti ali sedež je v Republiki Sloveniji.
– V izogib dvomom opredelitev ZD vključuje: (i) vse uradnike ali zaposlene v vladni agenciji ali drugi organizaciji (ne glede na to, ali je v zasebnem ali javnem sektorju), ki lahko predpišejo, kupijo, zagotovijo ali odmerijo zdravila in (ii) vse zaposlene v Republiki Sloveniji, katerih glavna poklicna dejavnost je izvajanje zdravstvene dejavnosti, to pa ne vključuje (x) vseh drugih zaposlenih v Republiki Sloveniji in (y) prodajalcev na debelo ali distributerjev zdravil.
Kodeks OSZRp
– Kodeks Foruma o obveščanju in seznanjanju o zdravilih na recept in sodelovanju z zdravstvenimi delavci, ki ga je potrdila Skupščina Foruma 20. januarja 2012, kot je lahko vsakokrat spremenjen, dopolnjen ali posodobljen.
Zdravila
– Pojem »Zdravila«, kot se uporablja v tem kodeksu in Kodeksu OSZRp ima pomen, kot je določen v 1. členu Direktive 2001/83/ES in vključuje zdravila, imunološka zdravila, radiofarmacevtske izdelke, zdravila, pridobljena iz človeške krvi ali človeške plazme, za katere je bilo izdano dovoljenje za promet v smislu Direktive 2001/83/ES.
Članice Foruma
– Skupaj “članice” (kot so opredeljene v Kodeksu OSZRp) Foruma, njihove ustrezne obvladujoče družbe, če gre za druge družbe, odvisne družbe (ne glede na to ali je odvisna družba podjetje ali druga oblika družbe ali organizacije) ter vse družbe, povezane s članicami ali njihovimi odvisnimi družbami, če so se te povezane družbe zavezale, da bodo spoštovale ta kodeks.
Kodeks ZB
– Kodeks Foruma o obnašanju v odnosih med farmacevtsko industrijo in združenji bolnikov, ki ga je potrdila Skupščina Foruma 20. januarja 2012, kot je vsakič dopolnjen, spremenjen ali posodobljen.
Prejemnik
– Smiselno pomenijo vse ZD in ZO, ki opravljajo zdravstveno dejavnost v Republiki Sloveniji, oziroma so v takšnih ZO zaposleni.
Plačila na področju raziskav in razvoja
– Plačila na ZD ali ZO, povezana z načrtovanjem ali izvajanjem (i) nekliničnih študij (kot je opredeljeno v Načelih dobre laboratorijske prakse OECD), (ii) kliničnih raziskav (kot je opredeljeno v Direktivi 2001/20/ES) in (iii) neintervencijskih študij, ki so po naravi predvidljive in vključujejo zbirko podatkov o bolnikih, zbranih s strani ali na zahtevo posameznega zdravstvenega delavca ali skupine, posebej za študijo (člen 9 Kodeksa OSZRp).
Prenosi sredstev
– Posredni in neposredni prenosi sredstev v gotovini, v naravi ali kakor koli drugače, izvedeni v promocijske ali druge namene, v zvezi z razvojem in prodajo generičnih zdravil ali patentiranih zdravil na recept, izključno za uporabo v humani medicini. Neposredni prenosi sredstev so prenosi, ki jih neposredno izvedejo članice v korist prejemnika. Posredni prenosi sredstev so prenosi, ki jih izvedejo tretje osebe – kot so izvajalci, zastopniki, partnerji ali podružnice (vključno s fundacijami), v imenu članice v korist prejemnika, pri čemer članica pozna ali lahko identificira prejemnika.
“,”Jaka Verbic Miklic”,1521785520,1521785520,sl,12396,306,12395,43,0,NULL,,”Kodeks transparentnosti”,kodeks-transparentnosti,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1521785625,1567593506
251,12399,”Kodeks sodelovanja z zdravstvenimi delavci “,”Kodeks sodelovanja z zdravstvenimi delavci (kodeks OSZRp) ureja promocijo zdravil na recept, namenjeno zdravstvenim delavcem.”,”
KODEKS SODELOVANJA Z ZDRAVSTVENIMI DELAVCI
(Kodeks OSZRp)
Sprejet na Skupščini Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ dne 20. januarja 2012
in spremenjen dne 21. novembra 2013, 4. julija 2014, 27. maja 2016, 23. marca 2018 in 22. marca 2019
(PREČIŠČENO BESEDILO – MAREC 2018)
IZVAJANJE DOLOČIL KODEKSA
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ (v nadaljevanju: Forum) uvaja ustrezne postopke, s katerimi želi zagotoviti, da bi družbe članice Foruma delovale v skladu z zahtevami tako evropskega (kot ga je sprejela Evropska zveza farmacevtske industrije in združenj (v nadaljevanju: EFPIA)) kot ustreznega nacionalnega kodeksa (Kodeks obveščanja in seznanja o zdravilih na recept in sodelovanja z zdravstvenimi delavci (v nadaljevanju: Kodeks OSZRp)) ter na podlagi teh postopkov reševale morebitne pritožbe zaradi neizpolnjevanja zahtev.
V okviru Foruma deluje Odbor za nadzor določil etičnih kodeksov (v nadaljevanju: Odbor), katerega člani so neodvisni strokovnjaki s posameznih področij in ustreznim strokovnim znanjem ter predstavniki članov Foruma.
Odbor nadzoruje izvajanje tega kodeksa in drugih kodeksov Foruma ter po lastni presoji predlaga spremembe kodeksov ali postopkov, sprejetih za njihovo izvajanje.
Odbor je ustanovljen za presojo informacij o zdravilih, presojo primernosti sodelovanja članic z zdravstvenimi delavci in združenji bolnikov ter skladnosti javne objave prenosa sredstev zdravstvenim delavcem in zdravstvenim organizacijam s strani članic. Odbor deluje kot prostovoljni in samoregulatorni nadzorni organ za vse družbe članice Foruma.
UVOD
Glavna naloga farmacevtske industrije je razvoj novih in učinkovitih zdravil ter izboljševanje obstoječih zdravil, ki so v pomoč bolnikom, ter posredovanje zanesljivih informacij o teh zdravilih.
Farmacevtska industrija zato poleg drugih trženjskih dejavnosti za tovrstna zdravila organizira strokovna srečanja in s tem pripomore k nenehnemu dvigovanju ravni znanja in usposobljenosti v javnem zdravstvu. Strokovna raven takšnih prireditev mora biti visoka, ostali elementi pa v zmernih okvirih.
Trženje zdravil se izvaja v skladu z naslednjimi nacionalnimi in mednarodnimi pravili:
1. Vse družbe članice Foruma so dolžne delovati v skladu z veljavnim Zakonom o zdravilih in drugo veljavno zakonodajo. Vse farmacevtske družbe morajo zdravstvenim delavcem posredovati bistvene, verodostojne in primerne informacije o zdravilih, ki jih tržijo.
2. Določila Kodeksa OSZRp temeljijo na pravilih, ki jih je sprejela EFPIA, predstavniški organ evropske farmacevtske industrije, katerega pridruženi član je Forum. Kodeks EFPIA o predstavljanju zdravil na recept zdravstvenim delavcem in sodelovanju z njimi je bil sprejet zaradi uskladitve z Direktivo Sveta 2001/83/ES z novembra 2001 in njenih dopolnitev. Poleg tega morajo družbe članice Foruma spoštovati določbe veljavne slovenske zakonodaje na področju trženja, oglaševanja in obveščanja o zdravilih.
3. Forum spodbuja konkurenco med farmacevtskimi družbami. Namen Kodeksa OSZRp vsekakor ni omejevanje lojalne konkurence. Nasprotno, namen Kodeksa OSZRp je zagotavljanje poštenih in verodostojnih promocijskih dejavnosti, izogibanje nepoštenim praksam in morebitnemu konfliktu interesov z zdravstvenimi delavci ter delovanje v skladu z veljavnimi zakoni in predpisi. Cilj Kodeksa OSZRp je ustvariti okolje, v katerem splošna javnost lahko zaupa odločitvam o izbiri zdravila, saj so te sprejete na podlagi prednosti posameznega zdravila ter hkrati zdravstvenega stanja in potreb posameznega bolnika.
PODROČJE UPORABE DOLOČIL KODEKSA
Določila veljajo za vse oblike trženja. Sem sodijo vse informacije in dejavnosti pospeševanja prodaje, ki jih izvaja bodisi proizvajalec zdravil bodisi tretja oseba v njegovem imenu, te pa so takšne oblike, da vplivajo na predpisovanje, trženje, prodajo in porabo zdravil tega proizvajalca.
Kodeks OSZRp ureja promocijo zdravil na recept, namenjeno zdravstvenim delavcem. Termin »promocija«, kot ga uporablja Kodeks OSZRp, vključuje kakršnokoli dejavnost, ki jo izvede, organizira ali sponzorira farmacevtska družba oziroma se izvaja na podlagi njenega pooblastila in ki pospešuje predpisovanje, dobavo, prodajo, dajanje ali jemanje zdravil(a) te družbe. Kodeks OSZRp ureja promocijske dejavnosti in komunikacije, namenjene tako zdravnikom kot drugim članom zdravstvene, zobozdravstvene ali farmacevtske stroke, zdravstvene nege ali katerikoli drugi osebi, ki v okviru svoje poklicne dejavnosti predpisuje, izdaja ali kako drugače rokuje z zdravili (priprava/rekonstitucija, apliciranje) (v nadaljevanju: »zdravstveni delavci«).
Namen Kodeksa OSZRp ni omejevati ali urejati posredovanje nepromocijskih medicinskih, znanstvenih in dejanskih informacij; prav tako njegov namen ni omejevati ali urejati dejavnosti, ki so namenjene splošni javnosti in zadevajo izključno zdravila, ki se izdajajo brez recepta.
Kodeks OSZRp ne velja za:
– ovojnino, povzetek glavnih značilnosti zdravila in navodila za uporabo zdravila ter druge dokumente, ki jih je odobril pristojni organ ob izdaji dovoljenja za promet z zdravilom ali kasneje;
– korespondenco in katerokoli drugo informativno gradivo, katerega namen je odgovoriti na specifična vprašanja o določenem farmacevtskem izdelku;
– javne objave specifičnega in informativnega tipa, na primer glede nove ovojnine ali opozorila o morebitnih neželenih učinkih, ter kataloge izdelkov in cenike, pod pogojem, da ne vsebujejo nobenih informacij o zdravilu;
– informacije o zdravju ali boleznih človeka, pod pogojem, da ni nobenega napotila, tudi posrednega ne, na zdravila in da so informacije kakovostne, objektivne, nedvoumne, celovite, uravnotežene, uporabnikom razumljive in ne vsebujejo prvin neposrednega ali prikritega oglaševanja;
– dejavnosti, ki zadevajo izključno zdravila, ki se izdajajo brez recepta;
– nepromocijske splošne informacije o družbah (kot so informacije za vlagatelje ali zaposlene/potencialne zaposlene), vključno s finančnimi podatki, opisi raziskovalnih in razvojnih programov ter obravnavo sprememb predpisov, ki vplivajo na družbo in njene izdelke.
DOLOČBE KODEKSA
1. TRŽENJE
1.1. Zdravila ni dovoljeno oglaševati, dokler se ne pridobi dovoljenje za promet s tem zdravilom.
1.2. Vsi elementi promocije se morajo dosledno ujemati s podatki, navedenimi v povzetku glavnih značilnosti zdravila (SmPC), in se morajo omejiti na odobrene indikacije.
1.3. Vsako promocijsko gradivo mora skladno z veljavno državno zakonodajo in predpisi vsebovati naslednje informacije, podane na jasen in čitljiv način:
a) bistvene informacije, ki so skladne s povzetkom glavnih značilnosti izdelka (sestava zdravila, terapevtske indikacije, odmerjanje in način uporabe, povzetek neželenih učinkov, previdnostnih ukrepov in opozoril, kontraindikacij in interakcij, ime, znak in naslov imetnika dovoljenja za promet) in vsebujejo datum, ko so bile te bistvene informacije zbrane ali nazadnje spremenjene;
b) razvrstitev izdelka glede na način in režim izdaje zdravil.
2. PROMOCIJA
2.1. PROMOCIJA
a) Informacije o zdravilu morajo biti točne, uravnotežene, verodostojne, objektivne in zadostne, da si prejemnik lahko oblikuje mnenje o terapevtski vrednosti dotičnega zdravila. Informacije morajo temeljiti na najnovejši presoji celotnega ustreznega gradiva in morajo jasno odražati vsebino tega gradiva. Informacije ne smejo biti zavajajoče zaradi izkrivljanja, pretiravanja, nepravilnih trditev, izpuščanja in podobno. Informacije o zdravilu morajo biti praviloma označene z oznako »Samo za strokovno javnost«.
b) Beseda »varno« se nikoli ne sme uporabiti brez ustrezne obrazložitve.
c) Beseda »novo« se ne sme uporabiti za opis kateregakoli zdravila ali prodajne oblike, ki je splošno dostopna, ali katerekoli terapevtske indikacije, za katero promocija poteka več kot eno leto od razpoložljivosti na slovenskem tržišču.
d) Nikoli se ne sme trditi, da zdravilo nima stranskih učinkov in da ni tveganj za zastrupitev ali odvisnost.
e) Kadar se promocijsko gradivo sklicuje na objavljene raziskave, morajo biti podatki pravilno navedeni in sklicevanje jasno opredeljeno.
f) Promocijske dejavnosti morajo biti zasnovane tako, da se lahko zdravstvenim delavcem na njihovo upravičeno zahtevo takoj posreduje strokovna utemeljitev. Še zlasti za promocijske trditve o stranskih učinkih velja, da morajo temeljiti na razpoložljivih dokazih ali biti podprte s kliničnimi izkušnjami. Utemeljitev pa ni potrebna, ko gre za indikacije, ki so bile odobrene že v dovoljenju za promet z zdravilom.
g) Promocija mora spodbujati razumno uporabo zdravil, in sicer tako, da jih predstavi objektivno in brez pretiravanj v opisu njihovih lastnosti. Trditve ne smejo napeljevati k prepričanju, da ima zdravilo ali njegova učinkovina kakšno posebno lastnost, kakovost ali učinek, če to ni utemeljeno.
h) Kakršnakoli primerjava med različnimi zdravili mora temeljiti na ustreznih in primerljivih vidikih zdravil. Primerjalno oglaševanje ne sme zavajati ali omalovaževati.
i) Za slikovno gradivo, vključno z grafi, ilustracijami, fotografijami in tabelami, ki je bilo v promocijsko gradivo preneseno iz objavljenih raziskav, velja naslednje:
– vir(i) slikovnega gradiva mora(jo) biti jasno in natančno opredeljen(i);
– slikovno gradivo mora biti vestno reproducirano, razen v primerih, ko se zaradi uskladitve z veljavnim(i) kodeksom(-i) opravi prilagoditev ali sprememba, vendar pa je ob tem treba jasno navesti, da je bilo gradivo prilagojeno in/ali spremenjeno.
Slikovno gradivo, ki je vključeno v promocijo, predpisovalca in uporabnika nikakor ne sme zavajati glede narave zdravila (na primer ali je primerno za uporabo pri otrocih) ali glede trditev ali primerjav (na primer z uporabo nepopolnih ali statistično nepomembnih informacij ali neobičajnih kriterijev).
2.2. DOKUMENTACIJA
Vse informacije, vključene v promocijsko gradivo, morajo biti podprte z dokumentacijo, ki se lahko na zahtevo tudi predloži.
Vendar pa takšne dokumentacije ni treba predložiti za tiste informacije, ki so bile odobrene že z izdajo dovoljenja za promet z zdravilom.
Klinični podatki, za katere se sklicuje na neobjavljene vire družbe, morajo vsebovati navedek: »Podatki so dostopni na lokalnem sedežu družbe in so razpoložljivi na zahtevo«. Prejemniki promocijskega gradiva morajo imeti na voljo zadostne informacije, da lahko preverijo navedena gradiva, pri čemer morajo biti te informacije ali sestavni del promocijskega gradiva, referenca objavljenemu poročilu ali razpoložljive na zahtevo. Družba mora posredovati vire svojih navedb v 15 dneh od datuma zahteve.
2.3. NEODOBRENE INDIKACIJE
Promocija zdravila mora biti v skladu z dovoljenjem za promet z zdravilom in s podatki, navedenimi v povzetku glavnih značilnosti zdravila.
Promocija indikacij, ki jih dovoljenje za promet z zdravilom ne zajema, je prepovedana. Medicinski oddelek družbe članice Foruma lahko posreduje informacije o indikacijah zdravila, ki jih dovoljenje za promet z zdravilom ne zajema (»neodobrene indikacije«) na zahtevo zdravstvenega delavca, ne sme pa neodobrenih indikacij uporabljati za promocijo zdravila.
2.4. DARILA
Strokovni sodelavci ne smejo ponujati nobenih daril ali uporabljati pretveze, da bi si zagotovili obisk pri zdravstvenem delavcu. Za obisk ali pogovor z zdravstvenim delavcem ni dovoljeno ponujati plačila oziroma plačevati.
Izraz »nagrada / darilo« se razume v širšem pomenu besede in ni omejen le na neposredne finančne ali materialne spodbude zdravstvenim delavcem (na primer strokovnim sodelavcem ni dovoljeno, da v zameno za obisk pri zdravstvenem delavcu prispevajo v dobrodelne namene).
2.5. UPORABA CITATOV V PROMOCIJSKE NAMENE
Citati iz medicinske in znanstvene literature ali iz osebnih komunikacij morajo biti natančno uporabljeni (razen ko se zaradi uskladitve s Kodeksom OSZRp opravi prilagoditev ali sprememba, vendar pa je treba v tem primeru jasno navesti, da je bilo gradivo prilagojeno in/ali spremenjeno), viri pa natančno navedeni.
2.6. SPREJEMLJIVOST PROMOCIJE
Družbe morajo ves čas upoštevati visoke etične standarde. Promocija:
a) nikoli ne sme ogrožati ugleda farmacevtske industrije ali slabiti zaupanja vanjo;
b) mora biti takšna, da upošteva specifično naravo zdravil in strokovni profil prejemnika(-ov);
c) ne sme biti žaljiva.
2.7. RAZDELJEVANJE PROMOCIJSKEGA GRADIVA
a) Promocija je namenjena samo tistim zdravstvenim delavcem, za katere se lahko upravičeno predpostavlja, da informacije potrebujejo oziroma jih te zanimajo.
b) Sezname zdravstvenih delavcev je treba redno posodabljati. Če zdravstveni delavec zahteva, da se ga s seznama izbriše, se njegovi zahtevi ugodi.
c) V skladu z veljavno nacionalno zakonodajo in predpisi je uporaba faksov, e-pošte, avtomatskih pozivnih sistemov, kratkih tekstovnih sporočil (SMS) in drugih elektronskih podatkovnih komunikacij v promocijske namene dovoljena, če prejemnik to vnaprej dovoli ali zahteva.
2.8. PREGLEDNOST PROMOCIJE
a) Promocija in promocijsko gradivo ne smeta biti prikrita in ne smeta prikrivati dejanskega namena.
b) Klinično spremljanje, postmarketinški programi in postavtorizacijske raziskave ne smejo prikrito promovirati zdravila. Takšni programi in raziskave se morajo izvajati izključno z znanstvenim ali izobraževalnim namenom.
c) Kadar družba plača ali kako drugače zagotovi ali uredi objavo promocijskega gradiva v časopisih ali revijah, to promocijsko gradivo ne sme dajati videza neodvisnega uredniškega prispevka.
d) Gradivo z informacijami o zdravilih in njihovi uporabi, bodisi da je promocijskega tipa ali ne, ki ga sponzorira družba, mora vsebovati jasne navedbe, da ga je sponzorirala konkretna družba.
2.9. INFORMATIVNO IN IZOBRAŽEVALNO GRADIVO, IZDELKI ZA MEDICINSKO RABO
a) Razdeljevanje informativnih ali izobraževalnih gradiv je dovoljeno, če je: (i) “razumne vrednosti”, (ii) neposredno povezano z opravljanjem zdravstvene ali lekarniške dejavnosti, in (iii) neposredno koristno za oskrbo bolnikov. Razdeljevanje takšnih gradiv ne sme predstavljati spodbude za predpisovanje, nabavo, dobavo, prodajo ali odmerjanje zdravila.
b) Izdelki za medicinsko rabo, namenjeni neposredno izobraževanju zdravstvenih delavcev in oskrbi bolnikov, se lahko delijo pod pogojem, da so “razumne vrednosti” in ne nadomeščajo rutinskih poslovnih praks prejemnika.
c) Področje informativnih ali izobraževalnih materialov ter izdelkov za medicinsko uporabo ne sodi v kategorijo prepovedi dajanja daril, kot je določeno v 4. členu kodeksa.
Pomen izraza “razumna vrednost”, kot je uporabljen v tem členu, je opredeljen z zakonsko določeno izjemo, da se v davčno osnovo po Zakonu o dohodnini ne všteva posamezno darilo,če njegova vrednost ne presega 42 EUR (skupaj z DDV) oziroma če skupna vrednost vseh daril, prejetih v davčnem letu od iste pravne osebe, ne presega 84 EUR (skupaj z DDV).
2.10. PROMOCIJA SPLOŠNI JAVNOSTI SE NE IZVAJA
a) Za splošno javnost je prepovedana promocija naslednjih zdravil:
– zdravila, ki se izdajajo izključno na zdravniški recept;
– zdravila, ki vsebujejo učinkovine, ki jih mednarodna konvencija, na primer Konvencija Združenih narodov iz let 1961 in 1971, opredeljuje kot psihotropne ali narkotične;
– katerakoli druga zdravila, za katera zakonodaja ne dovoljuje oglaševanja za splošno javnost. Ta prepoved ne velja za obvestila o cepljenjih, ki jih izvaja farmacevtska industrija in jih odobrijo pristojni organi.
b) Če posamezni predstavnik splošne javnosti prosi za nasvet glede osebnih zdravstvenih zadev, mu svetujemo, naj obišče zdravnika.
2.11. DOGODKI IN GOSTOLJUBNOST
1) Vsa promocijska, znanstvena ali strokovna srečanja, kongresi, konference, simpoziji in drugi sorodni dogodki (v nadaljevanju: dogodek), ki jih organizira ali sponzorira družba, morajo biti organizirani na “primernem” kraju, ki ustreza glavnemu namenu dogodka, stroški pa se krijejo le, če je to primerno in v skladu z zakonsko omejenimi zneski ter določbami Kodeksa OSZRp.
“Primerna” lokacija ali kraj v smislu te točke pomeni katero koli lokacijo ali kraj, ki se običajno uporablja za organizacijo podobnih dogodkov, z izjemo “razvedrilnih” ali “razkošnih” lokacij.
“Razvedrilna” lokacija ali kraj v smislu te točke pomeni lokacijo, ki je znana zlasti po zagotavljanju posebnih vrst zabave (kar ni tipična kongresna dejavnost), kot sta na primer igralnica in igrišče za golf.
“Razkošna” lokacija v okviru te točke pomeni hotel s kategorizacijo 5* ali podoben objekt luksuzne kategorije, pri čemer se šteje, da je kategorizacija kongresnih kapacitet na posamezni lokaciji enaka kategorizaciji hotela ali objekta, v ali neposredno ob katerem se nahajajo.
2) Nobena družba ne sme organizirati ali sponzorirati dogodka, ki poteka zunaj njene države (mednarodni dogodek), razen če je:
a) večina povabljenih iz drugih držav in je glede na državo, iz katere prihaja večina udeležencev, logistično bolj smotrno organizirati dogodek v drugi državi;
b) glede na lokacijo pomembnega vira ali strokovnjaka, ki je predmet ali tema dogodka, logistično bolj smotrno organizirati prireditev v drugi državi (»mednarodni dogodek«).
3) Kritje stroškov, povezano s promocijskimi, strokovnimi ali znanstvenimi dogodki, mora biti omejeno na prevoz, prehrano, namestitev in kotizacijo ter ne sme presegati višine, kot jo določa Zakon o zdravilih oziroma drug zakon, na katerega se ta zakon sklicuje.
Stroški poti, namestitve, kotizacije in prehrane se ne štejejo med darila po Zakonu o javnih uslužbencih. Razumni stroški poti, namestitve in prehrane morajo biti prikazani na pregleden način.
4) Stroški se lahko krijejo le udeležencem dogodka, ne pa tudi spremljajočim osebam.
5) Podjetja zdravstvenim delavcem ne smejo nuditi obrokov (hrane in pijače), razen v kolikor posamezni obroki (hrana in pijača) vrednostno ne presegajo 60 EUR (skupaj z DDV), če dogodek poteka v Sloveniji. Če poteka v tujini, se upoštevajo mejne vrednosti gostoljubja države, v kateri dogodek poteka. Gostoljubnost mora biti na “razumni” ravni in strogo v okvirih glavnega namena dogodka. Na splošno velja, da izkazano gostoljubje ne sme preseči ravni, za katero se predvideva, da bi bili zanjo zdravstveni delavci pripravljeni plačati tudi sami.
“Razumna” gostoljubnost v smislu te točke pomeni gostoljubnost v okviru omejitev, ki bi jih zdravstvene ustanove običajno upoštevale pri organizaciji dogodkov za lastne potrebe, pri tem pa se je treba izogibati dogodkom, ki so namenjeni zlasti razvedrilu.
Zdravstvenim delavcem se ne sme zagotoviti ali plačati nobenega samostojnega razvedrila ter drugih interesnih ali družabnih dejavnosti. Na srečanjih je dovoljeno zmerno (preprosto) razvedrilo1, ki je drugotnega pomena v primerjavi z osvežilnimi napitki in/ali prehrano. Članice se morajo izogibati organizaciji dogodkov na “razvedrilnih” lokacijah ali v krajih, ki “slovijo” po zabaviščni ponudbi ali “razkošnosti”.
6) Stroški sponzoriranja ali organizacije zabavnih (npr. športnih ali v prostem času) dogodkov se ne smejo kriti. Družbe naj se izogibajo krajem dogodkov, ki so znani po bogati ponudbi zabavnih vsebin.
3. KAKOVOST INFORMACIJ
Promocijsko gradivo mora biti zadovoljive kakovosti in ne sme biti žaljivo.
4. PREPOVED DAJANJA DARIL
Zdravstvenim delavcem ni dovoljeno dajati, ponujati ali obljubljati daril, nagrad, finančnih ugodnosti ali prejemkov v naravi.
5. SPONZORIRANJE ZDRAVSTVENIH DELAVCEV
Podjetja morajo delovati skladno z merili, ki veljajo za izbiro in sponzoriranje zdravstvenih delavcev pri udeležbi na izobraževanju ali dogodku, kot je navedeno v veljavnem Zakonu o zdravilih in Kodeksu OSZRp ali v povezavi z njim(a). Financiranja ni dovoljeno ponujati zgolj kot nadomestilo za čas, ki so ga zdravstveni delavci porabili za udeležbo na dogodku. Če je pri mednarodnih dogodkih, za katere zdravstvenemu delavcu udeležbo sponzorira podjetje, temu zdravstvenemu delavcu kakršnokoli financiranje zagotovljeno skladno z določbami člena 5., veljajo za takšno financiranje pravila države, v kateri takšen zdravstveni delavec opravlja svojo dejavnost, in ne skladno s pravili države, v kateri takšen mednarodni dogodek poteka (v pojasnilo: namen člena 5. ni prepoved zagotavljanja gostoljubnosti za zdravstvene delavce v skladu s členom 2.11).
6. DONACIJE IN SREDSTVA, NAMENJENA ZDRAVSTVENI OSKRBI, RAZISKAVAM ALI IZOBRAŽEVANJU2
Dajanje donacij, sredstev in materialnih ali drugih ugodnosti ustanovam, organizacijam ali združenjem, kjer delajo zdravstveni delavci in/ali ki opravljajo raziskave ali zagotavljajo zdravstveno oskrbo (na katere se Kodeks EFPIA o predstavljanju zdravil na recept zdravstvenim delavcem in sodelovanju z njimi ali Kodeks EFPIA o obnašanju v odnosih med farmacevtsko industrijo in združenji bolnikov sicer ne nanašata), je dovoljeno samo, če: (i) je namenjeno zagotavljanju podpore za zdravstveno oskrbo, raziskave ali izobraževanje; (ii) jih donator/dajalec dokumentira in evidentira; (iii) ne spodbujajo k priporočanju, predpisovanju, nakupu, dobavljanju, prodaji določenega zdravila ali oskrbovanju z njim in (iv) če donator nima nikakršnega vpliva na izbor udeleženca srečanja, temveč je to izključno v pristojnosti institucije, prejemnice donacije. Dajanje donacij in sredstev posameznim zdravstvenim delavcem in/ali samostojnim podjetnikom v skladu s to točko ni dovoljeno.
Sponzoriranje zdravstvenih delavcev s strani podjetij pri udeležbi na mednarodnih dogodkih opredeljuje člen 5. Podjetja spodbujamo, da javnosti omogočijo dostop do informacij o donacijah, sredstvih ali materialnih in drugih ugodnostih, na katere se nanaša ta člen 6.
7. NADOMESTILA ZA STORITVE
Pogodbe med podjetji in ustanovami, organizacijami ali združenji zdravstvenih delavcev, po katerih takšne ustanove, organizacije ali združenja podjetjem zagotavljajo kakršnekoli storitve (ali katerokoli drugo obliko financiranja, ki ni zajeta v členu 8 ali kje drugje v Kodeksu), so dovoljene le, če se takšne storitve (ali drugo financiranje): (i) zagotavljajo z namenom dajanja podpore zdravstveni oskrbi ali raziskavam in (ii) ne spodbujajo k priporočanju, predpisovanju, nakupu, dobavljanju, prodaji določenih zdravil ali oskrbovanju z njimi.
8. NAJEM SVETOVALCEV
8.1. Dovoljen je najem zdravstvenih delavcev kot svetovalcev, posamično ali v skupinah, za storitve, kot so govori in vodenje sestankov, sodelovanje pri zdravstvenih/znanstvenih raziskavah, kliničnih raziskavah ali izobraževanju, sodelovanje na sestankih svetovalnega odbora in sodelovanje pri tržnih raziskavah, kjer takšno sodelovanje vključuje plačilo in/ali potovanje. Dogovori, ki se nanašajo na dejansko svetovanje ali druge storitve, morajo, v obsegu, ki ustreza posameznemu dogovoru, izpolnjevati naslednja merila:
a) pogodba ali sporazum v pisni obliki je sklenjen pred začetkom izvajanja storitev, v njem pa je navedena narava storitev, ki bodo opravljene, in ob upoštevanju spodnje točke (g), podlaga za plačevanje teh storitev;
b) upravičena potreba po storitvah mora biti jasno opredeljena že pred zahtevanjem storitev in pred sklenitvijo sporazumov z morebitnimi svetovalci;
c) merila za izbiro svetovalcev se morajo nanašati neposredno na določeno potrebo; osebe, odgovorne za izbiro svetovalcev, pa morajo imeti ustrezno strokovno znanje za presojo, ali posamezen zdravstveni strokovnjak izpolnjuje ta merila;
d) število najetih zdravstvenih delavcev ne sme biti večje od števila, ki je razumno potrebno za izpolnjevanje določene potrebe;
e) pogodbeno podjetje mora voditi evidenco, ki se nanaša na storitve, ki jih ponujajo svetovalci, in omogočati njihovo ustrezno uporabo;
f) najemanje zdravstvenih delavcev za opravljanje ustrezne storitve ne sme spodbujati priporočanja, predpisovanja, nakupa, dobave, prodaje določenega medicinskega izdelka ali oskrbe z njim in
g) plačilo za storitve je razumno in odraža pošteno tržno vrednost opravljenih storitev. V povezavi s tem fiktivnih dogovorov o svetovanju ni mogoče uporabljati za upravičevanje plačila zdravstvenim delavcem.
8.2. Podjetja močno spodbujamo, da v pisne pogodbe s svetovalci vključijo določbe, ki se nanašajo na dolžnosti svetovalca, da vedno, kadar za javnost piše ali govori o zadevi, ki je predmet sporazuma, ali o vprašanju, ki se nanaša na to podjetje, navede, da je svetovalec tega podjetja. Prav tako močno spodbujamo podjetja, ki za skrajšani delovni čas zaposlujejo zdravstvene delavce, ki še vedno opravljajo svojo prakso, da od takšnih oseb zahtevajo, da svoj status zaposlitve pri podjetju navedejo vedno, kadar za javnost pišejo ali govorijo o zadevah, ki so predmet zaposlitve, ali katerem koli drugem vprašanju, ki se nanaša na podjetje. Določbe, ki izhajajo iz člena 8.2., veljajo kljub temu, da Kodeks sicer ne pokriva nepromocijskih splošnih informacij o podjetjih.
8.3. Omejene tržne raziskave, kot so enkratne telefonske ankete ali vprašalniki po pošti/e-pošti/internetu, ne sodijo v obseg člena 8., če zdravstveni delavec ne zagotavlja redne storitve svetovanja (glede na splošno pogostost klicev ali klicev, ki se nanašajo na isto raziskavo) in plačilo ne presega 20 EUR (skupaj z DDV) na anketo ali vprašalnik.
8.4. Če se zdravstveni delavec udeleži dogodka (mednarodnega ali drugega) kot svetovalec, veljajo ustrezne določbe člena 2.11.
9. NEINTERVENCIJSKA KLINIČNA PRESKUŠANJA ZDRAVIL
9.1. Neintervencijsko klinično preskušanje zdravil, ki se tržijo, je preskušanje, pri katerem se zdravilo(a) predpiše(jo) na običajen način skladno s pogoji, navedenimi v dovoljenju za promet z zdravilom. O dodelitvi bolnika v določen način zdravljenja se ne odloči vnaprej po načrtu preskušanja, ampak po ustaljeni praksi, predpisovanje zdravila pa je jasno ločeno od odločitve, da se bolnik vključi v preskušanje. Za bolnike se ne uporabljajo nobeni dodatni diagnostični ali opazovalni postopki, za analizo zbranih podatkov pa se uporabljajo epidemiološke metode. Bolniki morajo biti seznanjeni, da se o njih zbirajo podatki, ki bodo uporabljeni za preskušanje. Dobiti morajo zagotovilo, da bo poskrbljeno za varstvo zaupnosti.
9.2. Neintervencijska klinična preskušanja, ki so po naravi prospektivna in vključujejo zbirko podatkov o bolnikih, namenjenih posebej za preskušanje in zbranih s strani ali na zahtevo posameznega zdravstvenega delavca ali skupine njih, morajo biti v skladu z naslednjimi merili:
a) preskušanja se izvaja s strokovnim namenom;
b) (i) obstaja pisni načrt preskušanja in (ii) obstajajo pisne pogodbe med zdravstvenimi delavci in/ali ustanovami, kjer bo potekalo preskušanje, in podjetjem, ki sponzorira preskušanje, v katerih je določena narava storitev, ki bodo zagotovljene, in ob upoštevanju spodnje točke (c) podlaga za plačevanje teh storitev;
c) vsa izplačana nadomestila so razumna in odražajo pošteno tržno vrednost opravljenih storitev;
d) pred izvedbo preskušanja je treba pridobiti soglasje pristojne komisije za medicinsko etiko;
e) upoštevati je treba lokalno zakonodajo, pravila in predpise o varovanju osebnih podatkov (vključno s pridobivanjem in uporabo osebnih podatkov);
f) preskušanje ne sme spodbujati priporočanja, predpisovanja, nakupa, dobave, prodaje določenega zdravila ali oskrbe z njim;
g) načrt preskušanja mora odobriti medicinski oddelek podjetja, prav tako pa mora medicinski oddelek nadzirati izvajanje preskušanja skladno s členom 10.2.c);
h) rezultati preskušanja morajo biti analizirani s strani ali na zahtevo naročnika, povzetek rezultatov pa mora biti v razumnem obdobju na voljo službi, odgovorni za izvajanje kliničnih preskušanj (kot je opisano v členu 10.2.b), ki vodi evidenco o takšnih poročilih v razumnem obdobju. Podjetje posreduje povzetek poročila vsem zdravstvenim delavcem, ki so sodelovali pri preskušanju, prav tako pa na njeno zahtevo zagotovi dostop do povzetka poročila pristojni komisiji za medicinsko etiko. Če so rezultati preskušanja pomembni za ocenjevanje razmerja med koristmi in tveganji, je treba povzetek poročila nemudoma posredovati ustreznemu pristojnemu organu;
i) strokovni sodelavci lahko sodelujejo le pri administrativnih opravilih, takšno sodelovanje pa mora biti pod nadzorom medicinskega oddelka podjetja, ki prav tako zagotovi, da so strokovni sodelavci ustrezno usposobljeni. Takšno sodelovanje ne sme biti povezano s promocijo nobenega zdravila.
9.3. Članice so dolžne upoštevati še dodatne strožje pogoje, kot so določeni v veljavni zakonodaji.
9.4. Podjetja se v ustreznem obsegu spodbuja, da skladno s členom 9.2. delujejo pri vseh drugih vrstah preskušanj, na katere se nanaša člen 9.1., vključno z epidemiološkimi študijami in registri ter drugimi študijami, ki so retrospektivne narave. V vsakem primeru za takšna preskušanja velja člen 8.1.
10. OSEBE, ZAPOSLENE V FARMACEVTSKIH PROMOCIJSKIH DEJAVNOSTIH
10.1. STROKOVNI SODELAVCI FARMACEVTSKE DRUŽBE
a) Vsaka družba mora zagotoviti, da so njeni strokovni sodelavci, vključno z osebami, ki delujejo v imenu družbe, ter katerikoli drugi predstavniki družbe, ki obiskujejo zdravstvene delavce, lekarne, bolnišnice ali druge zdravstvene ustanove zaradi promocije zdravil (v nadaljevanju: strokovni sodelavci), seznanjeni z zahtevami ustreznega kodeksa ali več kodeksov ter vsemi veljavnimi nacionalnimi zakoni in predpisi, da so ustrezno usposobljeni in imajo dovolj strokovnega znanja, da lahko posredujejo natančne in popolne informacije o izdelkih svoje družbe, ki jih promovirajo.
b) Strokovni sodelavec mora svoje naloge opravljati etično in odgovorno.
c) Strokovni sodelavec izvaja svoje dejavnosti v skladu s Kodeksom Foruma ter vsemi veljavnimi zakoni in predpisi, družbe pa so odgovorne za zagotavljanje skladnosti.
d) Ob vseh obiskih mora strokovni sodelavec v skladu z veljavno nacionalno zakonodajo in predpisi obiskanemu zdravstvenemu delavcu posredovati povzetke glavnih značilnosti zdravil(a), ki jih(ga) predstavlja, ali pa mu te informacije zagotoviti kako drugače.
e) Strokovni sodelavec mora družbi nemudoma posredovati kakršnekoli povratne informacije glede uporabe izdelkov, ki jih je predstavil, še zlasti informacije o stranskih učinkih.
f) Strokovni sodelavci morajo paziti, da so pogostost, termin in trajanje obiska pri zdravstvenih delavcih, v lekarnah, bolnišnicah ali drugih zdravstvenih ustanovah v primernih okvirih.
g) Strokovni sodelavci ne smejo uporabljati različnih spodbud ali pretvez, da bi si zagotovili obisk pri zdravstvenem delavcu. Med obiskom ali pri dogovarjanju za obisk morajo strokovni sodelavci že na začetku poskrbeti, da ne zavajajo glede lastne identitete oziroma identitete družbe, ki jo zastopajo.
10.2. DRUGI ZAPOSLENI
a) Vsi zaposleni, ki kakorkoli sodelujejo pri pripravi ali odobritvi promocijskega gradiva ali informacij, namenjenih zdravstvenim delavcem, morajo biti v celoti seznanjeni z določbami Pravilnika o oglaševanju zdravil.
b) Vse družbe morajo imeti oddelek ali odgovorno osebo, ki se ukvarja z informacijami o izdelkih družbe in z nadzorom neintervencijskih kliničnih preskušanj zdravil. Tak oddelek mora imeti zdravnika ali farmacevta, ki je odgovoren za odobritev promocijskega gradiva pred objavo. Ta oseba mora s podpisom potrditi, da je pregledala končno različico promocijskega gradiva, da je to po njenem mnenju skladno z zahtevami veljavnega(-ih) kodeksa(-ov) ter veljavne zakonodaje in predpisov s področja oglaševanja, da je promocijsko gradivo skladno s Povzetkom glavnih značilnosti zdravila ter da so medicinska dejstva predstavljena pošteno in verodostojno. Poleg tega mora družba zagotoviti tudi zdravnika ali farmacevta, ki je odgovoren za nadzor neintervencijskih kliničnih preskušanj zdravil (vključno z nadzorom vseh zadolžitev v zvezi s takšnimi preskušanji, še posebej glede obveznosti, ki jih izpolnjujejo strokovni sodelavci). Ta oseba mora s podpisom potrditi, da je pregledala protokol neintervencijskega kliničnega preskušanja in je po njenem mnenju v skladu z zahtevami veljavnega(-ih) kodeksa(-ov).
c) Vsaka družba mora določiti odgovorno osebo za nadzor glede izpolnjevanja standardov veljavnega(-ih) kodeksa(-ov).
11. VZORCI ZDRAVIL
11. 1. V skladu z Direktivo EU 2001/83/ES in veljavnim Pravilnikom o oglaševanju se osebam, pooblaščenim za predpisovanje zdravil, načeloma ne sme dajati brezplačnih vzorcev zdravil, razen izjemoma pod naslednjimi pogoji:
– zdravilo ima dovoljenje za promet v skladu z zakonom;
– za zdravilo niso določeni posebni pogoji shranjevanja, kot je hladna veriga;
– od pridobitve dovoljenja za promet z zdravilom ali od odobritve spremembe dovoljenja za promet, ki zahteva novo vlogo, ni preteklo več kot dve leti;
– vse vzorce se dostavi le na pisno prošnjo, ki jo predpisovalec podpiše in opremi z datumom;
– prejemnik mora o prejetih vzorcih voditi evidenco in jih ne sme prodajati;
– noben vzorec ne sme biti večji od najmanjšega pakiranja na trgu;
– vsem vzorcem mora biti priložen izvod povzetka glavnih značilnosti zdravila;
– vsak vzorec mora biti v ovojnini in opremljen z navodilom za uporabo, odobrenima v dovoljenju za promet z zdravilom in označen z navedbo, da gre za brezplačen vzorec, ki ni namenjen za prodajo;
– vzorec ne sme vsebovati narkotičnih ali psihotropnih snovi.
Članice so dolžne upoštevati še dodatne strožje pogoje, kot so določeni v veljavni zakonodaji.
Vzorcev zdravil se ne sme dajati z namenom, da se spodbuja priporočanje, predpisovanje, nakup, dobava, prodaja ali dajanje določenih zdravil, niti se jih ne sme dajati za namen samega zdravljenja bolnikov.
Vzorce zdravil se posreduje zdravstvenim delavcem, da lahko bolnike poučijo o načinu uporabe novega zdravila, če to ni namenjeno za peroralno uporabo.
11.2. Podjetja morajo imeti ustrezne sisteme za evidentiranje, nadzor in odgovornost za vzorce, ki jih distribuirajo, in za vsa zdravila, s katerimi ravnajo njihovi zastopniki. Ti sistemi morajo jasno določati, da lahko oseba, pooblaščena za predpisovanje zdravil, na leto prejme le en vzorec posameznega zdravila v najmanjšem pakiranju, za katero je pridobljeno dovoljenje za promet in za katerega je imetnik dovoljenja za promet organ, pristojen za zdravila pisno obvestil o dejanskem začetku prometa.
Vsak vzorec mora biti označen z napisom “brezplačen vzorec – ni za prodajo”, ali povedano v tem smislu in mora imeti priložen izvod povzetka glavnih značilnosti zdravila.
12. SANKCIJE
Če Forum v skladu z določili Kodeksa OSZRp ugotovi kršitev, mora od družbe kršiteljice zahtevati, da nemudoma preneha s kršitvijo in podpiše izjavo, da je ne bo ponovila. Sankcije morajo biti sorazmerne z naravo kršitve, učinkovati svarilno in upoštevati ponavljajoče se kršitve enakega tipa ali vzorce različnih kršitev. Na splošno za najučinkovitejšo sankcijo velja kombinacija obvestitve vseh družb članic Foruma in denarne kazni za družbo kršiteljico, vendar pa lahko Forum izreče katerokoli drugo učinkovito sankcijo, da zagotovi izvajanje Kodeksa OSZRp. Forum mora tudi preučiti vse veljavne pravne ali finančne zahteve, ki bi vplivale na naravo možnih sankcij.
13. ODGOVORNOST
13.1. OBSEG ODGOVORNOSTI
Odgovornost za farmacevtske informacije velja za informacije kot celoto: za obliko in vsebino.
13.2. ODGOVORNE OSEBE
Odgovornost za zagotavljanje skladnosti s Kodeksom OSZRp nosijo vse družbe članice Foruma. Prav tako so za spoštovanje tega kodeksa odgovorni pooblaščeni predstavniki članic Foruma.
14. NADZOR
Odbor kot organ Foruma presoja informacije o zdravilih kot tudi primernost sodelovanja članic z zdravstvenimi delavci in združenji bolnikov in daje smernice glede njih.
15. PRITOŽBE
Pritožbe zaradi kršitve teh pravil se pošljejo Odboru v roku 30 dni od nastanka kršitve.
16. SPREMEMBE
Spremembe ali prilagoditve Kodeksa OSZRp se lahko opravijo na podlagi mnenja večine družb članic Foruma. Kodeks OSZRp se lahko spremeni večkrat v letu:
a) ob spremembi Kodeksa EFPIA o predstavljanju zdravil na recept zdravstvenim delavcem in sodelovanju z njimi
b) na predlog, ki ga družba(e) članica(e) Foruma poda(jo) upravi Foruma, ta pa ga predloži v sprejem skupščini.
Za sprejetje spremembe je treba pridobiti večino glasov prisotnih na seji skupščine.
17. UVELJAVITEV
Ta kodeks je stopil v veljavo 20. januarja 2012, ko ga je potrdila Skupščina Foruma.
ČLANI MEDNARODNEGA FORUMA ZNANSTVENORAZISKOVALNIH FARMACEVTSKIH DRUŽB:
Abbvie
Amgen
Astellas
AstraZeneca
Bayer
Baxalta
Biogen Idec
Boehringer Ingelheim
Chiesi
Celgene
Eli Lilly
GlaxoSmithKline
Janssen
Lundbeck
Merck d.o.o.
Merck Sharp & Dohme
Novartis
Novo Nordisk
Pfizer
Roche
Sanofi-aventis
Servier
“,”Jaka Verbic Miklic”,1521786060,1521786060,sl,12399,306,12398,43,0,NULL,,”Kodeks sodelovanja z zdravstvenimi delavci “,kodeks-sodelovanja-z-zdravstvenimi-delavci,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1521786158,1567593476
252,12402,”Kodeks sodelovanja z združenji bolnikov”,”Farmacevtska industrija se zaveda, da ima številne skupne interese z organizacijami bolnikov, ki zastopajo in/ali podpirajo potrebe bolnikov in/ali njihovih skrbnikov. EFPIA je sprejela Kodeks sodelovanja združenji bolnikov (“Kodeks”) zato, da bi bili ti odnosi etični in pregledni.”,”
Pripravila EFPIA in Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb.
Kot ga je potrdila Generalna Skupščina EFPIA 14.6.2011.
Kot ga je potrdila Generalna Skupščina Foruma 20.1.2012 in 7.12.2018.
Evropska zveza farmacevtskih industrij in združenj (EFPIA) zastopa farmacevtsko industrijo v Evropi. Njeni člani so nacionalna industrijska združenja iz tridesetih evropskih držav in prek štirideset vodilnih farmacevtskih podjetij1. Glavna naloga zveze EFPIA je spodbujati tehnološki in gospodarski razvoj farmacevtske industrije v Evropi ter pripomoči k čim boljši oskrbi trga s farmacevtskimi izdelki, ki izboljšujejo zdravje ljudi.
Farmacevtska industrija se zaveda, da ima številne skupne interese z organizacijami bolnikov, ki zastopajo in/ali podpirajo potrebe bolnikov in/ali njihovih skrbnikov.
EFPIA je sprejela Kodeks obnašanja v odnosih med farmacevtsko industrijo in združenji bolnikov zato, da bi bili ti odnosi etični in pregledni.
Ta kodeks temelji na naslednjih načelih, ki jih je EFPIA skupaj s panevropskimi združenji bolnikov nazadnje posodobila septembra 2006:
1. Združenjem bolnikov mora biti zagotovljena neodvisnost pri odločanju o politikah delovanja in njihovih aktivnostih.
2. Vsi odnosi med združenji bolnikov in farmacevtsko industrijo morajo temeljiti na medsebojnem spoštovanju, pri čemer so odločitve obeh partnerjev enako pomembne.
3. Farmacevtska industrija ne sme zahtevati, združenja bolnikov pa ne smejo izvajati nobene promocije zdravila, ki se izdajajo na recept.
4. Cilji in obseg vseh odnosov morajo biti pregledni. Finančna in nefinančna pomoč, ki jo zagotovi farmacevtska industrija, mora biti vedno jasno objavljena.
5. Farmacevtska industrija pozdravlja obsežno financiranje združenj bolnikov iz različnih virov.
Ta kodeks EFPIA se nanaša na odnose med podjetji, ki so člani EFPIA, njihovimi podružnicami in pogodbeno zaposlenimi tretjimi strankami ter združenji bolnikov, ki delujejo v Evropi.
Združenja bolnikov so opredeljena kot neprofitne organizacije (vključno s krovnimi organizacijami, katerim pripadajo), ki jih sestavljajo predvsem bolniki in/ali njihovi skrbniki, ki zastopajo in/ali podpirajo potrebe bolnikov in/ali njihovih skrbnikov.
Kodeks EFPIA določa standarde, za katere EFPIA meni, da jih je treba upoštevati. Včlanjena združenja morajo v svojih nacionalnih kodeksih skladno s svojo nacionalno zakonodajo sprejeti predpise, ki niso manj strogi od predpisov kodeksa EFPIA.
Farmacevtska podjetja morajo delovati skladno z naslednjimi veljavnimi kodeksi (»veljavni kodeksi«) ter vsemi zakoni in predpisi, ki veljajo zanje:
1. če ima podjetje sedež v Evropi, skladno s kodeksom panoge v državi, v kateri ima podjetje sedež, če ima podjetje sedež zunaj Evrope, skladno s kodeksom EFPIA;
in
2. a) v primeru partnerstva in izvajanja dejavnosti v evropski državi skladno s panožnim kodeksom v državi, v kateri dejavnosti potekajo;
ali
b) v primeru čezmejnega sodelovanja in dejavnosti skladno s panožnim kodeksom v državi, kjer je glavni evropski sedež združenja bolnikov.
Zahteve veljajo za dejavnosti ali financiranje znotraj Evrope. »Evropa«, kot se uporablja v kodeksu EFPIA, vključuje tiste države, v katerih velja kodeks obnašanja združenj, ki so člani EFPIA.
Veljavni kodeksi morajo biti navedeni v pisnem sporazumu med podjetjem in združenjem bolnikov. Ob kakršnih koli neskladnostih med določbami zgoraj navedenih veljavnih kodeksov prevladajo strožje določbe.
V pojasnilo: pojem »podjetje«, kot se uporablja v kodeksu EFPIA, pomeni vsak pravni subjekt, ki zagotavlja sredstva ali sodeluje v dejavnostih z združenji bolnikov, na katere se nanaša veljavni kodeks in ki delujejo v Evropi, ne glede na to, ali je takšen subjekt matična družba (npr. sedež podjetja, glavna pisarna ali obvladujoča družba trgovskega podjetja), podružnica ali kakršna koli druga oblika podjetja ali organizacije.
Pojem »dejavnost«, kot se uporablja zgoraj, pomeni vsako vzajemno delovanje, na katerega se nanaša veljavni kodeks, vključno z zagotavljanjem sredstev.
1. člen
Nepromocija prodaje zdravil, ki se izdajajo samo na recept
Veljajo zakonodaja EU, nacionalna zakonodaja in kodeksi obnašanja, ki prepovedujejo oglaševanje zdravil, ki se izdajajo samo na recept.
2. člen
Pisni sporazumi
Kadar farmacevtska podjetja združenjem bolnikov zagotovijo finančno pomoč, znatno posredno pomoč in/ali znatno nefinančno pomoč, morajo imeti za to sklenjen pisni sporazum. V njem morata biti navedena znesek sredstev in namen (npr. nezavezujoča donacija, posebno srečanje ali publikacija). Prav tako mora sporazum vsebovati opis znatne posredne pomoči (npr. donacija časa agencije za odnose z javnostmi in naravo njene vključenosti) in znatne nefinančne pomoči. Vsako farmacevtsko podjetje mora za te sporazume vzpostaviti ustrezen postopek odobritve.
Predloga pisnega sporazuma je na voljo v prilogi I.
3. člen
Uporaba logotipov in zakonsko zaščitenega gradiva
Za javno uporabo logotipa in zakonsko zaščitenega gradiva združenja bolnikov mora farmacevtsko podjetje predhodno pridobiti dovoljenje tega združenja. Pri pridobivanju takšnega dovoljenja mora biti jasno naveden namen in način uporabe logotipa in/ali zakonsko zaščitenega gradiva.
4. člen
Uredniški nadzor
Farmacevtsko podjetje ne sme vplivati na besedilo gradiva združenja bolnikov, ki ga podjetje sponzorira, na način, ki bi pozitivno vplival na njegove lastne komercialne interese. To ne preprečuje podjetjem, da bi popravila netočnosti v dejanskih podatkih.
5. člen
Preglednost
a) Vsako podjetje mora zagotoviti javno dostopen seznam združenj bolnikov, katerim zagotavlja finančno pomoč in/ali znatno posredno/nefinančno pomoč. Seznam mora vsebovati tudi opis narave pomoči, ki je dovolj popoln, da povprečnemu bralcu omogoča, da razume pomen podpore. Opis mora vsebovati tudi denarno vrednost finančne pomoči in zaračunanih stroškov. Če gre za znatno nefinančno pomoč, ki ji ni mogoče pripisati smiselne denarne vrednosti, mora opis jasno navajati nedenarno korist, ki jo prejme združenje bolnikov. Te informacije se lahko zagotavljajo na državni ali evropski ravni in se posodabljajo vsaj enkrat na leto.
b) Podjetja morajo zagotoviti, da je njihovo sponzorstvo vedno jasno prikazano in razvidno.
c) Vsako podjetje mora zagotoviti javno dostopen seznam združenj bolnikov, ki jih je najelo za zagotavljanje pomembnih pogodbenih storitev. Seznam mora vsebovati tudi opis narave zagotovljenih storitev, ki je dovolj popoln, da povprečnemu bralcu omogoča, da razume naravo dogovora, ne da bi bile pri tem razkrite zaupne informacije. Podjetja morajo tudi objaviti skupen znesek, plačan posameznemu združenju bolnikov v koledarskem letu, najkasneje do 30. junija naslednjega leta
6. člen
Pogodbene storitve
Pogodbe med podjetji in združenji bolnikov, skladno s katerimi slednji zagotavljajo katerokoli vrsto storitev podjetjem, so dovoljene samo, če se te storitve zagotavljajo za namen podpore zdravstvenega varstva ali raziskav.
Združenja bolnikov se sme najeti kot strokovnjake in svetovalce za storitve, kot so sodelovanje na sejah svetovalnih odborov in govorniške storitve. Dogovori, ki se nanašajo na svetovanje ali druge storitve, morajo, v obsegu, ki ustreza posameznemu dogovoru, izpolnjevati naslednja merila:
a) pogodba ali sporazum v pisni obliki se sklene pred začetkom izvajanja storitev, v njem pa je opredeljena narava storitev, ki bodo opravljene, in, ob upoštevanju točke (g), podlaga za plačevanje teh storitev;
b) upravičena potreba po storitvah je bila jasno opredeljena in zabeležena že pred zahtevo po storitvah in pred sklenitvijo dogovorov;
c) merila za izbiro storitev se morajo nanašati neposredno na določeno potrebo; osebe, odgovorne za izbiro storitve, pa morajo imeti ustrezno strokovno znanje za presojo, ali posamezen strokovnjak in svetovalec izpolnjuje ta merila;
d) obseg storitve ne sme biti večji od obsega, ki je razumno potreben za izpolnjevanje določene potrebe;
e) pogodbeno podjetje mora voditi evidenco, ki se nanaša na storitve, in omogočati njihovo ustrezno uporabo;
f) najemanje združenj bolnikov ni namenjeno spodbujanju priporočanja določenega zdravila;
g) plačilo za storitve je razumno in ne presega poštene tržne vrednosti opravljenih storitev. V povezavi s tem simboličnih dogovorov o svetovanju ni mogoče uporabljati za upravičevanje plačila združenjem bolnikov;
h) Podjetja močno spodbujamo, da v pisne pogodbe z združenji bolnikov vključijo določbe, ki se nanašajo na dolžnosti združenja bolnikov, da slednje vedno, kadar za javnost piše ali javno govori o zadevi, ki je predmet dogovora, ali o vprašanju, ki se nanaša na zadevno podjetje, navede, da je opravilo plačane storitve za podjetje;
i) Vsako podjetje mora zagotoviti javno dostopen seznam združenj bolnikov, ki jih je najelo za zagotavljanje plačljivih storitev – glejte 5.c. člen.
7. člen
Ekskluzivnost financiranja
Nobeno podjetje ne sme zahtevati ekskluzivnosti pri financiranju združenja bolnikov ali katerega koli izmed njenih glavnih programov.
8. člen
Dogodki in gostoljubnost
Vsi dogodki, ki jih sponzorira ali organizira podjetje ali se organizirajo v njegovem imenu, morajo potekati na primernem kraju, ki ustreza glavnemu namenu dogodka, pri tem pa se je treba izogibati tistim prostorom, ki »slovijo« po zabaviščni ponudbi ali razkošnosti.
Vse oblike gostoljubnosti, ki jih farmacevtska industrija ponuja združenjem bolnikov in njihovim članom, morajo biti zmerne in ustrezati glavnemu namenu dogodka ne glede na to, ali dogodek organizira združenje bolnikov ali farmacevtska industrija.
Gostoljubnost, ki se zagotavlja v povezavi z dogodki, je omejena na potovanje, obroke hrane, namestitev in stroške registracije.
Gostoljubnost se lahko zagotovi samo osebam, ki so same po sebi upravičene do udeležbe. V izjemnih primerih, v primeru očitne zdravstvene potrebe (npr. invalidnosti), se lahko krijejo stroški prehrane na poti, nastanitve in registracije spremljevalne osebe, ki se šteje za negovalca.
Vse oblike gostoljubnosti, ki so ponujene združenjem bolnikov in njihovim zastopnikom, morajo biti v okviru „razumnega“, prav tako pa naj bodo strogo omejene na namen dogodka.
Gostoljubnost ne vključuje sponzoriranja ali prirejanja zabavnih dogodkov (npr. športnih ali prostočasnih dogodkov).
Nobeno podjetje ne sme prirediti ali sponzorirati dogodka, ki poteka zunaj države njegovega sedeža, razen ko:
a) večina povabljenih ne prihaja iz države njegovega sedeža in kadar je, glede na države, iz katerih prihaja večina povabljenih, z logističnega vidika bolj logično prirediti dogodek v drugi državi ali
b) je glede na lokacijo ustreznega vira ali strokovnjakov, ključnih za ta dogodek, z logističnega vidika dogodek bolj smiselno prirediti v drugi državi.
9. člen
Uveljavitev
Kodeksu EFPIA so v prilogi II priložena Pravila o izvajanju in postopkih, ki so zavezujoča za včlanjena združenja in podjetja ter določajo okvir za izvajanje tega kodeksa, obravnavanje pritožb in izrekanje ali izvajanje kazni za včlanjena združenja.
Članice Forume v 3 mesecih od sprejema tega kodeksa sprejmejo smernice o pomenu pojmov »ustrezen«, »znaten«, »glavni«, »razumen«, »ugleden« in »razkošen«, ki se uporabljajo v tem kodeksu.
.
.
Priloge:
– priloga I »Predloga modela za pisne sporazume med farmacevtsko industrijo in združenji bolnikov«
– priloga II »Pravila o izvajanju in postopkih«
PRILOGA I
Kadar farmacevtska podjetja združenjem bolnikov zagotovijo finančno podporo, znatno posredno podporo in/ali znatno nefinančno podporo, morajo za to imeti sklenjen pisni sporazum.
Spodaj je predloga, ki jo lahko uporabite v celoti ali jo po potrebi prilagodite in ki navaja ključne točke pisnega sporazuma. Namenjena je enostavnemu evidentiranju dogovorjenih stvari, pri čemer so upoštevane zahteve Kodeksa obnašanja EFPIA v odnosih med farmacevtsko industrijo in združenji bolnikov.
Vse stranke se popolnoma zavedajo, da mora biti sponzorstvo jasno prikazano in razvidno.
Veljavn(i) kodeks (kodeksi) obnašanja:
Podpisi sporazuma:
Datum sporazuma:
.
.
PRILOGA II
Pravila o izvajanju in postopkih, določena v tem dokumentu, vzpostavljajo okvir za izvajanje Kodeksa obnašanja v odnosih med farmacevtsko industrijo in organizacijami bolnikov (»Kodeks EFPIA«) Evropske zveze farmacevtskih industrij in združenj (»EFPIA«), obravnavo pritožb in izrekanje ali izvajanje kazni za včlanjena združenja..
1. poglavje: Naloge včlanjenega združenja
Vsako včlanjeno združenje mora:
a) vzpostaviti nacionalne postopke in strukture za sprejemanje in obravnavanje pritožb, določanje sankcij in objavo ustreznih podrobnosti o tem, v to vključiti vsaj nacionalni organ včlanjenega združenja, ki je imenovan za obravnavo pritožb in ga sestavljajo predsednik, ki ne prihaja iz industrije, in poleg vseh morebitnih članov iz industrije tudi predstavniki drugih partnerjev;
b) zagotoviti, da je njegov nacionalni kodeks skupaj z upravnimi postopki in drugimi ustreznimi informacijami enostavno dosegljiv najmanj prek objave nacionalnega kodeksa na njegovi spletni strani, in
c) Odboru za Kodeks obnašanja EFPIA (opredeljen spodaj) pripraviti in zagotoviti letno poročilo s povzetkom dela, ki je bilo med letom opravljeno v povezavi z izvajanjem, razvojem in uveljavljanjem njegovega nacionalnega kodeksa.
2. poglavje: Delo in ključne naloge Odbora za Kodeks obnašanja EFPIA
a) Odbor za Kodeks obnašanja EFPIA (»Odbor za Kodeks EFPIA«) včlanjenim združenjem zagotavlja pomoč pri izpolnjevanju njihovih dolžnosti v skladu s 1. poglavjem.
b) Odbor za Kodeks EFPIA bodo sestavljali vsi sekretarji nacionalnih združenj, predsedoval pa mu bo generalni direktor EFPIA, ki mu bo pomagala oseba iz zveze EFPIA.
c) V okviru svoje ključne vloge včlanjenim združenjem pomagati pri usklajevanju dejavnosti z nacionalnim kodeksom mora Odbor za Kodeks EFPIA spremljati sprejemanje skladnih nacionalnih kodeksov. Odbor za Kodeks EFPIA ne bo sodeloval pri presojanju nobene posamezne pritožbe, ki je v skladu s katerim koli nacionalnim kodeksom.
d) Odbor za Kodeks EFPIA bo vsaj enkrat na leto včlanjena združenja in zastopnike povabil na srečanje, kjer bodo sodelujoči imeli možnost izmenjati izkušnje, povezane s Kodeksom EFPIA. Vsi na sestanku sprejeti sklepi bodo zbrani v letnem poročilu o kodeksu (navedeno pod spodnjo točko (e) 2. poglavja) in, če bo potrebno, predstavljeni Svetu EFPIA.
e) Odbor za Kodeks EFPIA mora objaviti letno poročilo o kodeksu. Poročilo povzema delo in aktivnosti, povezane z izvajanjem, razvojem in uveljavljanjem različnih nacionalnih kodeksov v posameznem letu, in sicer na podlagi poročil po posameznih državah, ki so jih pripravila včlanjena združenja v skladu z zgornjo točko (c) 1. poglavja.
f) Odbor za Kodeks EFPIA mora Svetu EFPIA enkrat na leto (i) poročati o svojem delu in aktivnostih ter o delu in aktivnostih včlanjenih združenj, kot je to v strnjeni obliki navedeno v letnih poročilih včlanjenih združenj. Da bi izboljšali preglednost in odprtost farmacevtske industrije v odnosih med včlanjenimi organizacijami in podjetji, mora Odbor (ii) s Svetom EFPIA preučiti vsa dodatna priporočila za izboljšanje Kodeksa EFPIA.
3. poglavje: Sprejemanje pritožb
Pritožbe je mogoče predložiti včlanjenemu združenju ali zvezi EFPIA. Presoja pritožb je izključno v pristojnosti nacionalnih združenj.
Pritožbe, ki jih prejme EFPIA, morajo biti obravnavane na naslednji način:
(i) EFPIA bo vse pritožbe, ki jih prejme (ne da bi pri tem odločala o njihovi upravičenosti ali podajala pripombe nanje), posredovala pristojnim včlanjenim združenjem.
(ii) EFPIA bo pritožniku poslala obvestilo o prejemu, v katerem bo navedla pristojna včlanjena združenja, katerim je pritožbo posredovala v obdelavo in razsodbo.
(iii) Poleg tega bo EFPIA, če prejme številne zunanje pritožbe (tj. številne pritožbe, ki so jih o istem ali podobnem vprašanju proti številnim odvisnim družbam enega samega podjetja vložili subjekti izven industrije), te pritožbe posredovala nacionalnemu združenju obvladujočega podjetja ali nacionalnemu združenju podružnice EU, ki ga določi obvladujoče podjetje..
4. poglavje: Obravnava pritožb in izrekanje sankcij s strani včlanjenih združenj
a) Včlanjena združenja morajo zagotoviti, da se pritožbe, ki prihajajo iz industrije ali iz krogov zunaj nje, obravnavajo na enak način ne glede na to, kdo je vložil pritožbo.
b) Pritožbe bodo obravnavane na državni ravni po postopkih in s strukturami, ki so jih vzpostavila včlanjena združenja v skladu z zgornjo točko (a) 1. poglavja. Vsak nacionalni organ včlanjenega združenja sprejme odločitve in izreče vse sankcije na podlagi nacionalnega kodeksa, ki velja v njegovi državi. Sankcije so sorazmerne z naravo kršitve, imajo odvračalni učinek, pri izrekanju pa se upoštevajo tudi ponovna kazniva dejanja podobne narave ali vzorci različnih kaznivih dejanj.
c) Če pritožba ne more izkazati očitnih dejstev (»prima facie«) o tem, da gre za kršitev veljavnega predpisa, se takšna pritožba zavrne skladno z nacionalnim kodeksom. Včlanjena združenja lahko določijo, da je vsaka pritožba, katere cilj je v celoti ali predvsem komercialni interes, zavrnjena.
d) Vsako včlanjeno združenje vzpostavi učinkovite postopke za obravnavanje pritožb na prvotno odločitev svojega nacionalnega organa. Takšni postopki in pritožbe prav tako potekajo na nacionalni ravni.
e) Nacionalni odbori zagotovijo, da so vse končne odločbe, sprejete v posameznem primeru, objavljene v celoti ali da je, kadar so objavljene le izbrane podrobnosti, zagotovljenih dovolj podrobnosti o resnosti in/ali obstoju kršitve na naslednji način:
(i) v primeru resnih/ponovnih kršitev se objavijo podrobnosti primera skupaj z imenom podjetja (podjetij);
(ii) v primerih manjših kršitev ali kjer kršitve ni, ni treba, da objava vsebuje ime podjetja (podjetij).
f) Nacionalne odbore spodbujamo, da v angleškem jeziku povzemajo primere precedenčne vrednosti ali mednarodnega pomena (pri čemer upoštevajo, da imajo takšno vrednost tako primeri, v katerih je bila ugotovljena kršitev, kot tudi tisti, v katerih so ugotovili, da kršitve ni bilo).
.
.
.
(Navodila o pomenu izrazov)*
* Kot ga je sprejela Generalna Skupščina Foruma dne 7. marca 2012.
V skladu s členom 9(2) Kodeksa obnašanja v odnosih med farmacevtsko industrijo in združenji bolnikov (»Kodeks«), so članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb sprejele smernice o uporabi naslednjih izrazov v Kodeksu:
– »USTREZNA« lokacija ali kraj v skladu s členom 8 pomeni katero koli lokacijo ali kraj, ki se običajno uporablja za organizacijo podobnih dogodkov, z izjemo UGLEDNIH ali RAZKOŠNIH lokacij, kot so opredeljene spodaj.
– »ZNATNA« pomoč (člen 2, člen 5(a)) ali pogodbena storitev (člen 5(c)) pomeni katero koli pomoč ali storitev, ki ji je mogoče pripisati denarno vrednost, ki pa ne presega EUR 150.00 na transakcijo in EUR 600.00 na leto.
– »GLAVNI« program v smislu člena 7 pomeni program, ki mu združenje bolnikov nameni več kot 25 % svojih letnih sredstev.
– »RAZUMNA« gostoljubnost v skladu s členom 8 pomeni gostoljubnost v okviru omejitev, ki bi jih združenja bolnikov običajno upoštevala pri organizaciji dogodkov za lastne potrebe, pri tem pa se je treba izogibati dogodkom, ki so namenjeni zlasti zabavi. Dovoljeni so zabavni dogodki, katerih namen ni ponujanje gostoljubnosti (npr. zbiranje sredstev ali ozaveščanje o boleznih).
– »UGLEDNA« lokacija ali kraj v okviru pomena člena 8 pomeni kakršno koli lokacijo, ki je znana zlasti po zagotavljanju posebnih vrst zabave (kar ni tipična kongresna dejavnost), kot je na primer igralnica, igrišče za golf ali zdravilišče (z izjemo zdravilišč, ki izvajajo zdravstvene storitve kot del javnega zdravstvenega sistema, ki ga financira ZZZS).
– »RAZKOŠNA« lokacija v okviru pomena člena 8 pomeni hotel ali podoben objekt višje ali luksuzne kategorije, ki se uporablja zlasti za namene preživljanja prostega časa ali zabave in le redko za znanstvena, poslovna ali strokovna srečanja.
.
.
.
.
1 Spisek vseh članic EFPIA je dostopen na www.efpia.eu
“,Admin,1545114540,1545114540,sl,12402,306,12401,43,0,NULL,,”Kodeks sodelovanja z združenji bolnikov”,kodeks-sodelovanja-z-zdruzenji-bolnikov,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1521786621,1545138118
253,12404,”Javna objava prenosov vrednosti ZD in ZO 2015″,”Skladno z določili Kodeksa transparentnosti javno objavljamo prenose vrednosti zdravstvenim delavcem in zdravstvenim organizacijam s strani farmacevtskih družb”,”
Sodelovanje med farmacevtsko industrijo in zdravstveno skupnostjo je izjemno pomembno za zagotavljanje kakovostne zdravstvene oskrbe ter nujni pogoj za razvoj inovativnih zdravil in metod zdravljenja v dobro bolnikov. Raziskovanje, razvoj in uvajanje novih, inovativnih zdravil v klinično prakso namreč niso mogoči brez sodelovanja z zdravstvenimi delavci, zdravstvenimi organizacijami in drugimi deležniki. Industrija in širša zdravstvena skupnost si pri tem delita skupni cilj; pacientom omogočiti najboljšo oskrbo ter napredek pri njihovi zdravstveni obravnavi in dobrobiti celotne družbe.
Farmacevtska industrija velja za eno najbolj reguliranih panog, ki je že vrsto let aktivna na področju samoregulacije. Za najvišje etične standarde se zavzema tudi Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ (v nadaljevanju Forum), ki s Kodeksom transparentnosti vse članice zavezuje k javni objavi prenosov vrednosti zdravstvenim delavcem in organizacijam. Kodeks transparentnosti je bil sprejet, ker želimo, da je odnos med farmacevtsko industrijo ter zdravstvenimi delavci in organizacijami pregleden. To predstavlja pomemben korak k razumevanju tovrstnega sodelovanja.
Kodeks transparentnosti vse članice Evropske zveze farmacevtske industrije in združenj (EFPIA), ki jih predstavljajo mednarodne farmacevtske družbe in nacionalna združenja inovativne farmacevtske industrije iz 33 evropskih držav, zavezuje, da najkasneje do 30. junija javno objavijo vse prenose vrednosti zdravstvenim delavcem in organizacijam. Po določilih zveze EFPIA se podatki javno objavljajo periodično, vsako leto, najkasneje do konca meseca junija, in sicer za preteklo koledarsko leto. Prva tovrstna javna objava zajema prenose zdravstvenim delavcem in zdravstvenim organizacijam v koledarskem letu 2015.
Za implementacijo določil transparentnosti, ki jih je EFPIA sprejela junija 2013 in so za vse članice enaka, v Sloveniji skrbi Forum. Kot predstavnik inovativne farmacevtske industrije na naših tleh, ki združuje 20 farmacevtskih podjetij, je določila prilagodil slovenskim zakonodajnim ureditvam. Kodeks transparentnosti je Forum na skupščini potrdil konec novembra 2013, v veljavo pa je stopil s 1. januarjem 2014. Zavezujoč je za vse družbe, članice Foruma, ter farmacevtske družbe v lasti družb, članic zveze EFPIA.
Javna objava prenosov vrednosti vključuje podatke o vrednostih vseh sredstev, ki so jih prejeli posamezni zdravstveni delavci in zdravstvene organizacije, s katerimi sodelujejo posamezne članice Foruma ali Forum – bodisi neposredno ali prek tretjih oseb, kot so agencije za organizacijo dogodkov. Javna objava vsebuje tudi informacije o vrsti dejavnosti ali tipu podpore: za izobraževanje; za kritje stroškov povezanih z izobraževalnimi oziroma strokovnimi dogodki; za storitve in svetovanje; za raziskave in razvoj. Te prenose vsaka članica Foruma objavi v slovenskem jeziku na svoji lokalni, regijski ali mednarodni spletni strani.
Prva objava v tovrstni obliki, na evropski ravni, se zaključuje 30. junija 2016. Objava zajema podatke o prenosih vrednosti v preteklem koledarskem letu in na spletnih straneh posameznih članic ponuja vpogled v prenose v obdobju od 1. januarja do 31. decembra 2015. Nato bodo podatki objavljeni periodično, vsako leto do konca meseca junija.
Vsi prenosi zdravstvenim organizacijam, kamor se po Kodeksu transparentnosti uvrščajo javne zdravstvene institucije, zdravniška društva, združenja, zbornice in zasebna podjetja (d.o.o. in s.p.), so skladno z zakonodajo objavljeni individualno s polnim nazivom prejemnika.
Pri prenosih vrednosti posameznim zdravstvenim delavcem, fizičnim osebam, je objava v skladu z Zakonom o varstvu osebnih podatkov mogoča samo na podlagi predhodnega pisnega soglasja zdravstvenega delavca. V nasprotnem primeru se prenos objavi v skupinski obliki, v vsaki kategoriji posebej število prejemnikov ter skupni znesek takim prejemnikom.
Podatki o plačilih na področju raziskav in razvoja zaradi varstva konkurence ter inovacij, ki jih razvijajo posamezne družbe, skladno z zakonodajo ne morejo biti objavljeni drugače kot v skupinski obliki.
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ, je v koledarskem letu 2015 sodeloval z 21 različnimi posamezniki in organizacijami. Za izvedene storitve na področju svetovanja (kategorija Nadomestila za storitve in svetovanje) je na osnovi avtorskih pogodb izplačal nadomestila 13 zdravstvenim delavcem, sponzorsko podprl izvedbo strokovnih srečanj in simpozijev 3 zdravstvenim organizacijam, 5 organizacijam pa poravnal stroške izvedbe predavanja oziroma organizacije strokovnega dogodka.
Skupna vrednost prenosov Foruma posameznim zdravstvenim delavcem v letu 2015 je znašala 11.839,03 EUR, zdravstvenim organizacijam pa 23.200,00 EUR. Vsi prenosi so objavljeni poimensko oziroma s polnim nazivom prejemnika.
Javno objavljeni podatki zajemajo prenose vrednosti, ki so bili v finančnem sistemu Foruma dejansko izvršeni v koledarskem letu 2015 – to je od vključno 1. januarja 2015 do vključno 31. decembra 2015.
Prenosi posameznim zdravstvenim delavcem so navedeni kot bruto vrednosti tovrstnih pogodb.
Prenosi zdravstvenim organizacijam so navedeni kot neto zneski tovrstnih pogodb, ki ne vključujejo DDV.
Prenosi vrednosti, povezani s potnimi stroški, nastanitvami in stroški prijav, so objavljeni v podatkih za koledarsko leto, v katerem so dejavnosti potekale.
Podatki, objavljeni v tem poročilu, so izraz naših prizadevanj za ravnanje skladno z zahtevami Kodeksa transparentnosti in zveze EFPIA (Disclosure Code). Če se kljub našim prizadevanjem za zagotovitev natančnih objav zgodi, da poročilo vsebuje nepopolne ali netočne podatke, bomo to raziskali in morebitne napačne podatke ustrezno popravili.
Opombe k tabeli “Podatki o prenosu vrednosti zdravstvenim delavcem in zdravstvenim organizacijam s strani Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ, za leto 2015”
Področje opredeljuje Kodeks transparentnosti, člen 3.1.1.1
Področje opredeljuje Kodeks transparentnosti, člen 3.1.1.2 in 3.1.2.1
Področje opredeljuje Kodeks transparentnosti, člen 3.1.1.3 in člen 3.1.2.2
Področje opredeljuje Kodeks transparentnosti, člen 3.2
Področje opredeljuje Kodeks transparentnosti, člen 3.2
Področje opredeljuje Kodeks transparentnosti, člen 3.4
Oznaka “/” pomeni, da na tem področju ni bilo izvedenih prenosov vrednosti.
Vsi navedeni zneski predstavljajo skupne vrednosti za leto 2015.
Vse navedene transakcije so bile izvršene v koledarskem letu 2015, torej od vključno 1. januarja 2015 do vključno 31. decembra 2015.
Vrednosti prenosov sredstev zdravstvenim delavcem v letu 2015 so navedene v bruto zneskih.
Vrednosti prenosov sredstev zdravstvenim organizacijam so navedene v neto zneskih (brez DDV).
Zdravstvene organizacije (ZO) Kodeks transparentnosti opredeljuje kot:
vse samostojne podjetnike (s.p.) in pravne osebe (i), ki so zdravstvena, medicinska ali znanstvena združenja ali organizacije (ne glede na pravno ali organizacijsko obliko), kot so bolnice, klinike, fundacije, univerze ali druge izobraževalne ustanove ali akademska združenja (razen organizacij bolnikov v okviru kodeksa ZB) ali (ii) preko katerih eden ali več zdravstvenih delavcev izvaja svoje storitve.
Zdravstvene delavce (ZD) Kodeks transparentnosti opredeljuje kot:
vse fizične osebe, ki so članice zdravstvene, zobozdravstvene, farmacevtske ali negovalne stroke ali vse druge osebe, ki lahko pri opravljanju svojih poklicnih dejavnosti predpišejo, kupijo, zagotovijo ali odmerijo zdravilo in katerih primarna praksa, naslov glavne poklicne dejavnosti ali sedež je v Republiki Sloveniji.
V izogib dvomom opredelitev ZD vključuje: (i) vse uradnike ali zaposlene v vladni agenciji ali drugi organizaciji (ne glede na to, ali je v zasebnem ali javnem sektorju), ki lahko predpišejo, kupijo, zagotovijo ali odmerijo zdravila in (ii) vse zaposlene v Republiki Sloveniji, katerih glavna poklicna dejavnost je izvajanje zdravstvene dejavnosti, to pa ne vključuje (x) vseh drugih zaposlenih v Republiki Sloveniji in (y) prodajalcev na debelo ali distributerjev zdravil.
Kodeks transparentnosti je v celoti dostopen na tukaj.
“,”Jaka Verbic Miklic”,1521787740,1521787740,sl,12404,306,12403,43,0,NULL,,”Javna objava prenosov vrednosti zdravstvenim delavcem in zdravstvenim organizacijam s strani farmacevtskih družb”,javna-objava-prenosov-vrednosti-zdravstvenim-delavcem-in-zdravstvenim-organizacijam-s-strani-farmacevtskih-druzb,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1521787867,1524655072
254,12406,”Javna objava prenosov vrednosti ZD in ZO 2016″,”Skladno z določili Kodeksa transparentnosti javno objavljamo prenose vrednosti zdravstvenim delavcem in zdravstvenim organizacijam s strani farmacevtskih družb”,”
Skladno z določili Kodeksa transparentnosti članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ (v nadaljevanju Forum) tudi v letošnjem letu javno objavljajo prenose vrednosti zdravstvenim delavcem in zdravstvenim organizacijam. Kot določa Kodeks bodo vse inovativne farmacevtske družbe, članice Foruma, podatke objavile do vključno 30. junija 2017.
Objava zajema podatke o prenosih vrednosti v preteklem koledarskem letu in na spletnih straneh posameznih članic ponuja vpogled v prenose v obdobju od 1. januarja do 31. decembra 2016. Po določilih zveze EFPIA se podatki javno objavljajo periodično, vsako leto, najkasneje do konca meseca junija, in sicer za preteklo koledarsko leto.
Javna objava prenosov vrednosti vključuje podatke o vrednostih vseh sredstev, ki so jih prejeli posamezni zdravstveni delavci in zdravstvene organizacije, s katerimi sodelujejo posamezne članice Foruma ali Forum – bodisi neposredno ali prek tretjih oseb, kot so agencije za organizacijo dogodkov. Javna objava vsebuje tudi informacije o vrsti dejavnosti ali tipu podpore:
– za izobraževanje;
– za kritje stroškov povezanih z izobraževalnimi oziroma strokovnimi dogodki;
– za storitve in svetovanje;
– za raziskave in razvoj.
Te prenose vsaka članica Foruma objavi v slovenskem jeziku na svoji lokalni, regijski ali mednarodni spletni strani.
Vsi prenosi zdravstvenim organizacijam, kamor se po Kodeksu transparentnosti uvrščajo javne zdravstvene institucije, zdravniška društva, združenja, zbornice in zasebna podjetja (d.o.o. in s.p.), so skladno z zakonodajo objavljeni individualno s polnim nazivom prejemnika.
Pri prenosih vrednosti posameznim zdravstvenim delavcem, fizičnim osebam, je objava v skladu z Zakonom o varstvu osebnih podatkov mogoča samo na podlagi predhodnega pisnega soglasja zdravstvenega delavca. V nasprotnem primeru se prenos objavi v skupinski obliki, v vsaki kategoriji posebej število prejemnikov ter skupni znesek takim prejemnikom.
Podatki o plačilih na področju raziskav in razvoja zaradi varstva konkurence ter inovacij, ki jih razvijajo posamezne družbe, skladno z zakonodajo ne morejo biti objavljeni drugače kot v skupinski obliki.
Podatki, objavljeni v tem poročilu, so izraz naših prizadevanj za ravnanje skladno z zahtevami Kodeksa transparentnosti in zveze EFPIA (Disclosure Code). Če se kljub našim prizadevanjem za zagotovitev natančnih objav zgodi, da poročilo vsebuje nepopolne ali netočne podatke, bomo to raziskali in morebitne napačne podatke ustrezno popravili.
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ, je v koledarskem letu 2016 sodeloval s 14 različnimi posamezniki in organizacijami. Za izvedene storitve na področju svetovanja – kategorija Nadomestila za storitve in svetovanje – je na osnovi avtorskih pogodb izplačal nadomestila 6 zdravstvenim delavcem, sponzorsko podprl izvedbo strokovnih srečanj in simpozijev 3 zdravstvenim organizacijam, 5 organizacijam pa prispeval sredstva za izvedbo predavanja oziroma organizacije strokovnega dogodka.
Skupna vrednost prenosov Foruma posameznim zdravstvenim delavcem v letu 2016 je znašala 6.756,33 EUR, zdravstvenim organizacijam pa 49.529,50 EUR. Vsi prenosi so objavljeni poimensko oziroma s polnim nazivom prejemnika.
Javno objavljeni podatki zajemajo prenose vrednosti, ki so bili v finančnem sistemu Foruma dejansko izvršeni v koledarskem letu 2016 – to je od vključno 1. januarja 2016 do vključno 31. decembra 2016.
Prenosi posameznim zdravstvenim delavcem so navedeni kot bruto vrednosti tovrstnih pogodb.
Prenosi zdravstvenim organizacijam so navedeni kot neto zneski tovrstnih pogodb, ki ne vključujejo DDV.
Prenosi vrednosti, povezani s potnimi stroški, nastanitvami in stroški prijav, so objavljeni v podatkih za koledarsko leto, v katerem so dejavnosti potekale.
Opombe k tabeli “Podatki o prenosu vrednosti zdravstvenim delavcem in zdravstvenim organizacijam s strani Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ, za leto 2016” (.pdf)
1 Področje opredeljuje Kodeks transparentnosti, člen 3.1.1.1
2 Področje opredeljuje Kodeks transparentnosti, člen 3.1.1.2 in 3.1.2.1
3 Področje opredeljuje Kodeks transparentnosti, člen 3.1.1.3 in člen 3.1.2.2
4 Področje opredeljuje Kodeks transparentnosti, člen 3.2
5 Področje opredeljuje Kodeks transparentnosti, člen 3.2
6 Področje opredeljuje Kodeks transparentnosti, člen 3.4
Oznaka “/” pomeni, da na tem področju ni bilo izvedenih prenosov vrednosti.
Vsi navedeni zneski predstavljajo skupne vrednosti za leto 2016.
Vse navedene transakcije so bile izvršene v koledarskem letu 2016, torej od vključno 1. januarja 2016 do vključno 31. decembra 2016.
Vrednosti prenosov sredstev zdravstvenim delavcem v letu 2016 so navedene v bruto zneskih.
Vrednosti prenosov sredstev zdravstvenim organizacijam so navedene v neto zneskih (brez DDV).
Zdravstvene organizacije (ZO) Kodeks transparentnosti opredeljuje kot vse samostojne podjetnike (s.p.) in pravne osebe, ki so zdravstvena, medicinska ali znanstvena združenja ali organizacije (ne glede na pravno ali organizacijsko obliko), kot so bolnišnice, klinike, fundacije, univerze ali druge izobraževalne ustanove ali akademska združenja (razen organizacij bolnikov v okviru Kodeksa sodelovanja z združenji bolnikov) ali preko katerih eden ali več zdravstvenih delavcev izvaja svoje storitve.
Zdravstvene delavce (ZD) Kodeks transparentnosti opredeljuje kot vse fizične osebe, ki so članice zdravstvene, zobozdravstvene, farmacevtske ali negovalne stroke ali vse druge osebe, ki lahko pri opravljanju svojih poklicnih dejavnosti predpišejo, kupijo, zagotovijo ali odmerijo zdravilo in katerih primarna praksa, naslov glavne poklicne dejavnosti ali sedež je v Republiki Sloveniji.
V izogib dvomom opredelitev ZD vključuje vse uradnike ali zaposlene v vladni agenciji ali drugi organizaciji (ne glede na to, ali je v zasebnem ali javnem sektorju), ki lahko predpišejo, kupijo, zagotovijo ali odmerijo zdravila in vse zaposlene v Republiki Sloveniji, katerih glavna poklicna dejavnost je izvajanje zdravstvene dejavnosti, to pa ne vključuje vseh drugih zaposlenih v Republiki Sloveniji in prodajalcev na debelo ali distributerjev zdravil.
Kodeks transparentnosti je v celoti dostopen tukaj.
“,”Jaka Verbic Miklic”,1521788460,1521788460,sl,12406,306,12405,43,0,NULL,,”Javna objava prenosov sredstev ZD in ZO 2016″,javna-objava-prenosov-sredstev-zd-in-zo-2016,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1521788562,1529661077
255,12408,”Začasno: Javna objava prenosa sredstev ZD in ZO družbe MSD na spletni strani FORUM-a”,” “,”
Zaradi tehničnih težav je spletna stran www.msd.si družbe Merck Sharp & Dohme, inovativna zdravila d.o.o. (MSD) nedostopna, zato je javna objava prenosa sredstev zdravstvenim delavcem in zdravstvenim organizacijam za leto 2016 začasno objavljena na spletni strani FORUM-a.
Takoj ko bo mogoče, bo družba MSD skladno z določili Kodeksa transparentnosti objavila podatke o prenosu sredstev na svoji spletni strani www.msd.si. Istočasno bodo podatki umaknjeni s spletne strani FORUM-a.
Hvala za razumevanje!
Pojasnila o metodologiji (.pdf)
“,”Jaka Verbic Miklic”,1521788640,1521788640,sl,12408,306,12407,43,0,NULL,,”Začasno: Javna objava prenosa sredstev ZD in ZO družbe MSD na spletni strani FORUM-a”,zacasno-javna-objava-prenosa-sredstev-zd-in-zo-druzbe-msd-na-spletni-strani-forum-a,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,0,0,1521788700,1541417880
256,12410,”Sodelovanje z društvi bolnikov”,”Na področju izobraževanja in informiranja sodelujemo z društvi bolnikov”,”
Seznam društev, ki jih Forum vabi na svoje izobraževalne in informativne dogodke:
Društvo Trepetlika
Društvo za kronično vnetno črevesno bolezen
Društvo revmatikov Slovenije
Društvo psoriatikov Slovenije
Zveza društev bolnikov z osteoporozo Slovenije
Zveza društev diabetikov Slovenije
Društvo hemofilikov Slovenije
Združenje Europa Donna
Združenje Onko net
Društvo onkoloških bolnikov Slovenije
Slovensko društvo Transplant
Slovensko združenje bolnikov z limfomom in levkemijo
Društvo za pomoč osebam z depresijo in anksioznimi motnjami
Društvo atopijski dermatitis
Društvo bolnikov s Huntingtonovo boleznijo in svojcev
Društvo bolnikov s krvnimi boleznimi
Društvo bolnikov z limfomom
Društvo Liga proti epilepsiji Slovenije
Društvo operiranih na srcu Slovenije
Društvo pljučnih in alergijskih bolnikov Slovenije
Društvo srčnih bolnikov s spodbujevalnikom Slovenije Utrip
Društvo za fibromialgijo
Društvo za zdravje srca in ožilja Slovenije
Mreža NVO 25X25
Slovensko društvo za pomoč pri demenci, Spominčica
Združenje bolnikov s cerebrovaskularno boleznijo Slovenije
Združenje multiple skleroze Slovenije
Združenje za boj proti raku debelega črevesa in danke – Europacolon Slovenija
Zveza društev ledvičnih bolnikov Slovenije
Zveza koronarnih društev in klubov Slovenije Viktor Nameršnik
Društvo za zdrava sečila
Ozara Nacionalno združenje za kakovost življenja
Društvo bolnikov z boreliozo
Društvo bolnikov z Gaucherjevo boleznijo Slovenije
Društvo za samopomoč dializnih bolnikov Pretok
Slovensko društvo za celiakijo
Društvo za bolezni jeter
V koledarskem letu 2019 Forum ni namenil sredstev v obliki donacij nobenemu društvu bolnikov.
Seznam društev, ki jih Forum vabi na svoje izobraževalne in informativne dogodke:
Društvo Trepetlika
Društvo za kronično vnetno črevesno bolezen
Društvo revmatikov Slovenije
Društvo psoriatikov Slovenije
Zveza društev bolnikov z osteoporozo Slovenije
Zveza društev diabetikov Slovenije
Društvo hemofilikov Slovenije
Združenje Europa Donna
Združenje Onko net
Društvo onkoloških bolnikov Slovenije
Slovensko društvo Transplant
Slovensko združenje bolnikov z limfomom in levkemijo
Društvo za pomoč osebam z depresijo in anksioznimi motnjami
Društvo atopijski dermatitis
Društvo bolnikov s Huntingtonovo boleznijo in svojcev
Društvo bolnikov s krvnimi boleznimi
Društvo bolnikov z limfomom
Društvo Liga proti epilepsiji Slovenije
Društvo operiranih na srcu Slovenije
Društvo pljučnih in alergijskih bolnikov Slovenije
Društvo srčnih bolnikov s spodbujevalnikom Slovenije Utrip
Društvo za fibromialgijo
Društvo za zdravje srca in ožilja Slovenije
Mreža NVO 25X25
Slovensko društvo za pomoč pri demenci, Spominčica
Združenje bolnikov s cerebrovaskularno boleznijo Slovenije
Združenje multiple skleroze Slovenije
Združenje za boj proti raku debelega črevesa in danke – Europacolon Slovenija
Zveza društev ledvičnih bolnikov Slovenije
Zveza koronarnih društev in klubov Slovenije Viktor Nameršnik
Društvo za zdrava sečila
Ozara Nacionalno združenje za kakovost življenja
Društvo bolnikov z boreliozo
Društvo bolnikov z Gaucherjevo boleznijo Slovenije
Društvo za samopomoč dializnih bolnikov Pretok
Slovensko društvo za celiakijo
Društvo za bolezni jeter
Društvo za zdravje srca in ožilja je nevladna humanitarna organizacija, ki se ukvarja s preventivo bolezni srca in ožilja. Forum je društvu za namen organizacije izobraževanja, preventivnih pregledov in svetovanja doniral 3.000 evrov.
Seznam društev, ki jih Forum vabi na svoje izobraževalne in informativne dogodke:
Društvo Trepetlika
Društvo za kronično vnetno črevesno bolezen
Društvo revmatikov Slovenije
Društvo psoriatikov Slovenije
Zveza društev bolnikov z osteoporozo Slovenije
Zveza društev diabetikov Slovenije
Društvo hemofilikov Slovenije
Združenje Europa Donna
Društvo onkoloških bolnikov Slovenije
Slovensko društvo Transplant
Slovensko združenje bolnikov z limfomom in levkemijo
Društvo za pomoč osebam z depresijo in anksioznimi motnjami
Društvo atopijski dermatitis
Društvo bolnikov s Huntingtonovo boleznijo in svojcev
Društvo bolnikov s krvnimi boleznimi
Društvo bolnikov z limfomom
Društvo Liga proti epilepsiji Slovenije
Društvo operiranih na srcu Slovenije
Društvo pljučnih in alergijskih bolnikov Slovenije
Društvo srčnih bolnikov s spodbujevalnikom Slovenije Utrip
Društvo za fibromialgijo
Društvo za zdravje srca in ožilja Slovenije
Mreža NVO 25X25
Slovensko društvo za pomoč pri demenci, Spominčica
Združenje bolnikov s cerebrovaskularno boleznijo Slovenije
Združenje multiple skleroze Slovenije
Združenje za boj proti raku debelega črevesa in danke – Europacolon Slovenija
Zveza društev ledvičnih bolnikov Slovenije
Zveza koronarnih društev in klubov Slovenije Viktor Nameršnik
Društvo za zdrava sečila
Ozara Nacionalno združenje za kakovost življenja
Društvo bolnikov z boreliozo
Društvo bolnikov z Gaucherjevo boleznijo Slovenije
Društvo za samopomoč dializnih bolnikov Pretok
Slovensko društvo za celiakijo
Društvo za bolezni jeter
Društvo za zdravje srca in ožilja je nevladna humanitarna organizacija, ki se ukvarja s preventivo bolezni srca in ožilja. Forum je društvu za namen organizacije izobraževanja, preventivnih pregledov in svetovanja doniral 6.000 evrov.
Koronarni klub Ljubljana (KKL) je humanitarna neprofitna organizacija kroničnih koronarnih bolnikov. Forum je klubu za namen organizacije izobraževanja, preventivnih pregledov in svetovanja v okviru programa gibalnih dejavnosti za bolnike z motnjami srčnega ritma doniral 500 evrov.
Seznam društev, ki jih Forum vabi na svoje izobraževalne in informativne dogodke:
Društvo Trepetlika
Društvo za kronično vnetno črevesno bolezen
Društvo revmatikov Slovenije
Društvo psoriatikov Slovenije
Zveza društev bolnikov z osteoporozo Slovenije
Zveza društev diabetikov Slovenije
Društvo hemofilikov Slovenije
Združenje Europa Donna
Društvo onkoloških bolnikov Slovenije
Slovensko društvo Transplant
Slovensko združenje bolnikov z limfomom in levkemijo
Društvo za pomoč osebam z depresijo in anksioznimi motnjami
Društvo atopijski dermatitis
Društvo bolnikov s Huntingtonovo boleznijo in svojcev
Društvo bolnikov s krvnimi boleznimi
Društvo bolnikov z limfomom
Društvo Liga proti epilepsiji Slovenije
Društvo operiranih na srcu Slovenije
Društvo pljučnih in alergijskih bolnikov Slovenije
Društvo srčnih bolnikov s spodbujevalnikom Slovenije Utrip
Društvo za fibromialgijo
Društvo za zdravje srca in ožilja Slovenije
Mreža NVO 25X25
Slovensko društvo za pomoč pri demenci, Spominčica
Združenje bolnikov s cerebrovaskularno boleznijo Slovenije
Združenje multiple skleroze Slovenije
Združenje za boj proti raku debelega črevesa in danke – Europacolon Slovenija
Zveza društev ledvičnih bolnikov Slovenije
Zveza koronarnih društev in klubov Slovenije Viktor Nameršnik
Društvo za zdrava sečila
Ozara Nacionalno združenje za kakovost življenja
Društvo bolnikov z boreliozo
Društvo bolnikov z Gaucherjevo boleznijo Slovenije
Društvo za samopomoč dializnih bolnikov Pretok
Slovensko društvo za celiakijo
Društvo za bolezni jeter
Društvo za zdravje srca in ožilja je nevladna humanitarna organizacija, ki se ukvarja s preventivo bolezni srca in ožilja. Forum je društvu za namen organizacije izobraževanja, preventivnih pregledov in svetovanja doniral 3.000 evrov.
Slovensko združenje za boj proti raku dojk Europa Donna je samostojna, neodvisna, neprofitna organizacija civilne družbe. Forum je društvu za namen organizacije izobraževanja doniral 2.700 evrov.
Seznam društev, ki jih Forum vabi na svoje izobraževalne in informativne dogodke:
Društvo Trepetlika
Društvo za kronično vnetno črevesno bolezen
Društvo revmatikov Slovenije
Društvo psoriatikov Slovenije
Zveza društev bolnikov z osteoporozo Slovenije
Zveza društev diabetikov Slovenije
Društvo hemofilikov Slovenije
Združenje Europa Donna
Društvo onkoloških bolnikov Slovenije
Slovensko društvo Transplant
Slovensko združenje bolnikov z limfomom in levkemijo
Društvo za pomoč osebam z depresijo in anksioznimi motnjami
Društvo atopijski dermatitis
Društvo bolnikov s Huntingtonovo boleznijo in svojcev
Društvo bolnikov s krvnimi boleznimi
Društvo bolnikov z limfomom
Društvo Liga proti epilepsiji Slovenije
Društvo operiranih na srcu Slovenije
Društvo pljučnih in alergijskih bolnikov Slovenije
Društvo srčnih bolnikov s spodbujevalnikom Slovenije Utrip
Društvo za fibromialgijo
Društvo za zdravje srca in ožilja Slovenije
Mreža NVO 25X25
Slovensko društvo za pomoč pri demenci, Spominčica
Združenje bolnikov s cerebrovaskularno boleznijo Slovenije
Združenje multiple skleroze Slovenije
Združenje za boj proti raku debelega črevesa in danke – Europacolon Slovenija
Zveza društev ledvičnih bolnikov Slovenije
Zveza koronarnih društev in klubov Slovenije Viktor Nameršnik
Društvo za zdrava sečila
Ozara Nacionalno združenje za kakovost življenja
Društvo bolnikov z boreliozo
Društvo bolnikov z Gaucherjevo boleznijo Slovenije
Društvo za samopomoč dializnih bolnikov Pretok
Slovensko društvo za celiakijo
Društvo za bolezni jeter
Društvo za zdravje srca in ožilja je nevladna humanitarna organizacija, ki se ukvarja s preventivo bolezni srca in ožilja. Forum je društvu za namen organzacije izobraževanja, preventivnih pregledov in svetovanja doniral 7.500 evrov.
Seznam društev, ki jih Forum vabi na svoje izobraževalne in informativne dogodke:
Društvo Trepetlika
Društvo za kronično vnetno črevesno bolezen
Društvo revmatikov Slovenije
Društvo psoriatikov Slovenije
Zveza društev bolnikov z osteoporozo Slovenije
Zveza društev diabetikov Slovenije
Društvo hemofilikov Slovenije
Združenje Europa Donna
Društvo onkoloških bolnikov Slovenije
Slovensko društvo Transplant
Slovensko združenje bolnikov z limfomom in levkemijo
Društvo za pomoč osebam z depresijo in anksioznimi motnjami
Društvo atopijski dermatitis
Društvo bolnikov s Huntingtonovo boleznijo in svojcev
Društvo bolnikov s krvnimi boleznimi
Društvo bolnikov z limfomom
Društvo Liga proti epilepsiji Slovenije
Društvo operiranih na srcu Slovenije
Društvo pljučnih in alergijskih bolnikov Slovenije
Društvo srčnih bolnikov s spodbujevalnikom Slovenije Utrip
Društvo za fibromialgijo
Društvo za zdravje srca in ožilja Slovenije
Mreža NVO 25X25
Slovensko društvo za pomoč pri demenci, Spominčica
Združenje bolnikov s cerebrovaskularno boleznijo Slovenije
Združenje multiple skleroze Slovenije
Združenje za boj proti raku debelega črevesa in danke – Europacolon Slovenija
Zveza društev ledvičnih bolnikov Slovenije
Zveza koronarnih društev in klubov Slovenije Viktor Nameršnik
Društvo za zdrava sečila
Ozara Nacionalno združenje za kakovost življenja
Društvo bolnikov z boreliozo
Društvo bolnikov z Gaucherjevo boleznijo Slovenije
Društvo za samopomoč dializnih bolnikov Pretok
Slovensko društvo za celiakijo
Društvo za bolezni jeter
Društvo za zdravje srca in ožilja je nevladna humanitarna organizacija, ki se ukvarja s preventivo bolezni srca in ožilja. Forum je društvu za namen organzacije izobraževanja, preventivnih pregledov in svetovanja doniral 3.000 evrov.
Društvo za zdravje srca in ožilja je nevladna humanitarna organizacija, ki se ukvarja s preventivo bolezni srca in ožilja. Forum je društvu za namen organzacije izobraževanja, preventivnih pregledov in svetovanja po celi državi decembra 2013 doniral 4.400 evrov.
“,”Jaka Verbic Miklic”,1521788940,1521788940,sl,12410,306,12409,43,0,NULL,,”Javna objava prenosov sredstev društvom bolnikov”,javna-objava-prenosov-sredstev-drustvom-bolnikov,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1521789025,1591777015
258,12412,”Predpisi in zakoni”,”Zdravila so natančno regulirano področje”,”
Pravilnik o razvrščanju, predpisovanju in izdajanju zdravil za uporabo v humani medicini
UREDBA o izvajanju uredbe (EU) o kliničnem preskušanju zdravil za uporabo v humani medicini
Pravilnik o spremembah Pravilnika o oblikovnaju cen za uporabo v humani medicini 29/03/2021
Pravilnik o spremembah in dopolnitvah Pravilnika o oglaševanju zdravil
Pravilnik o določanju cen zdravil za uporabo v humani medicini, UL št. 19/2018, 23. 3. 2018
Pravilnik o farmakovigilanci zdravil za uporabo v humani medicini, UL št. 57/2014, 25. 7. 2014
Zakon o zdravilih (ZZdr-2) UL št. 17/2014, 7. 3. 2014
Pravilnik o razvrščanju zdravil na listo, UL št. 35, 26. 4. 2013
Pravilnik o oglaševanju zdravil, UL št. 105, 24.12.2010
Zakon o integriteti in preprečevanju korupcije, UL št. 45, 4.6.2010
Zakon o medicinskih pripomočkih, UL št. 98, 4.12.2009
Pravilnik o pogojih za opravljanje dejavnosti prometa z zdravili na debelo, UL št. 46, 19.6.2009
“,”Jaka Verbic Miklic”,1521891000,1521891000,sl,12412,306,12304,43,0,NULL,,Predpisi,predpisi,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,1,0,1521891082,1712245727
261,12432,”Pravilnik o dovoljenju za promet z zdravilom za uporabo v humani medicini “,”UL 57/2014, 25/07/2014″,”
Na podlagi tretjega odstavka 44. člena, drugega odstav-ka 56. člena, osmega odstavka 58. člena, sedmega odstavka 62. člena, sedmega odstavka 63. člena, tretjega odstavka 66. člena in drugega odstavka 70. člena Zakona o zdravilih (Uradni list RS, št. 17/14) ministrica za zdravje izdaja
P R A V I L N I K o dovoljenju za promet z zdravilom za uporabo v humani medicini
I. SPLOŠNE DOLOČBE
1. člen
(področje urejanja)
(1) Ta pravilnik v skladu z Direktivo 2001/83/ES Evropskega parlamenta in Sveta z dne 6. novembra 2001 o zakoniku Skupnosti o zdravilih za uporabo v humani medicini (UL L št. 311 z dne 28. 11. 2001, str. 67), zadnjič spremenjeno z Direktivo 2012/26/EU Evropskega parlamenta in Sveta z dne 25. oktobra 2012 o spremembi Direktive 2001/83/ES, kar zadeva farmakovigilanco (UL L št. 299 z dne 27. 10. 2012, str. 1), (v nadaljnjem besedilu: Direktiva 2001/83/ES), Uredbo (ES) št. 726/2004 Evropskega parlamenta in Sveta z dne 31. marca 2004 o postopkih Skupnosti za pridobitev dovoljenja za promet in nadzor zdravil za humano in veterinarsko uporabo ter o ustanovitvi Evropske agencije za zdravila (ULLšt. 136 z dne 30. 4. 2004, str. 1), zadnjič spremenjeno z Uredbo (EU) št. 1027/2012 Evropskega parlamenta in Sveta z dne 25. oktobra 2012 o spremembi Uredbe (ES) št. 726/2004, kar zadeva farmakovigilanco (UL L št. 316 z dne 14. 11. 2012, str. 38), (v nadaljnjem besedilu: Uredba 726/2004/ES) in Uredbo Komisije (ES) št. 1234/2008 z dne 24. novembra 2008 o pregledu sprememb pogojev dovoljenj za promet z zdravilom z zdravili za uporabo v humani medicini in zdravili za uporabo v veterinarski medicini (UL L št. 334 z dne 12. 12. 2008, str. 7), zadnjič spremenjeno z Uredbo Komisije (EU) št. 712/2012 z dne 3. avgusta 2012 o spremembi Uredbe (ES) št. 1234/2008 o pregledu sprememb pogojev dovoljenj za promet z zdravilom z zdravili za uporabo v humani medicini in zdravili za uporabo v veterinarski medicini (UL L št. 209 z dne 4. 8. 2012, str. 4), (v nadaljnjem besedilu: Uredba 1234/2008/ES), ureja:
– podrobnejše pogoje, obliko in vsebino vloge ter dokumentacije v postopkih za pridobitev dovoljenja za promet z zdravilom za uporabo v humani medicini (v nadaljnjem besedilu: dovoljenje za promet z zdravilom) po nacionalnem postopku, po postopku z medsebojnim priznavanjem in decentraliziranem postopku;
– podrobnejše pogoje za postopek z medsebojnim priznavanjem, za decentralizirani postopek in nacionalni postopek pridobitve dovoljenja za promet z zdravilom;
– podrobnejše pogoje in postopek za napotitvene postopke;
– podrobnejše pogoje dovoljenja za promet z zdravilom s posebnimi pogoji;
– podrobnejše pogoje, obliko in vsebino dokumentacije v postopkih za spremembo dovoljenja za promet z zdravilom po nacionalnem postopku, po postopku z medsebojnim priznava-njem in decentraliziranem postopku;
– podrobnejše pogoje, obliko in vsebino dokumentacije v postopkih za podaljšanje dovoljenja za promet z zdravilom po nacionalnem postopku, po postopku z medsebojnim priznava-njem in decentraliziranem postopku;
– podrobnejši postopek prenosa dovoljenja za promet z zdravilom, dokumentacijo in postopek preverjanja predpisanih pogojev ter drugih dokazil;
– podrobnejšo vsebino vloge in postopek v zvezi s prenehanjem dovoljenja za promet z zdravilom.
(2) Zdravila iz Priloge Uredbe 726/2004/ES in zdravila sirote, kot jih opredeljuje Uredba (ES) št. 141/2000 Evropskega parlamenta in Sveta z dne 16. decembra 1999 o zdravilih sirotah (UL L št. 18 z dne 22. 1. 2000, str. 1), zadnjič spremenjena z Uredbo (ES) št. 596/2009 Evropskega parlamenta in Sveta z dne 18. junija 2009 o prilagoditvi nekaterih aktov, za katere se uporablja postopek iz 251. člena Pogodbe, Sklepu Sveta 1999/468/ES glede regulativnega postopka s pregledom, Prilagoditev regulativnemu postopku s pregledom – Četrti del (ULL št. 188 z dne 18.7. 2009, str. 14; v nadaljnjem besedilu: Uredba 596/2009/ES), pridobijo dovoljenje za promet z zdravilom po centraliziranem postopku. Pri teh zdravilih tudi postopki podaljšanja, obravnave sprememb že izdanega dovoljenja za promet z zdravilom in preklica ali začasnega odvzema dovoljenja za promet z zdravilom potekajo na Evropski agenciji za zdravila (v nadaljnjem besedilu: EMA).
(3) Pri pripravi vloge in dokumentacije predlagatelj po-leg Zakona o zdravilih (Uradni list RS, št. 17/14; v nadaljnjem besedilu: zakon), tega pravilnika in drugih podzakonskih predpisov, izdanih na podlagi zakona, upošteva natančnejša navodila, ki jih Evropska komisija objavlja v pravilih, ki urejajo zdravila v Evropski uniji »The rules governing medicinal products in the European Union, Volume 2, Notice to applicants, Medicinal products for human use, European Commission, Directorate General III – Pharmaceuticals and Cosmetics« (spletna stran: http://ec.europa.eu/enter-prise/sectors/pharmaceuticals/documents/eudralex/index_ en.htm), podrobnejše smernice Skupine za usklajevanje (Coordination Group for Mutual Recognition and Decentralised Procedure – Human (spletna stran: http://www.hma. eu/cmdh.html), znanstvene smernice o kakovosti, varnosti in učinkovitosti zdravil, ki jih je sprejel Odbor za zdravila za uporabo v humani medicini (spletna stran: http://www.ema. europa.eu/index/indexh1.htm) in smernice o dobri farmakovigilančni praksi (spletna stran: http://www.ema.europa.eu/in-dex/indexh1.htm), v njihovem vsakokrat veljavnem besedilu. Navedena navodila in smernice JAZMP upošteva pri postop-kih pridobitve, spremembah in podaljšanjih dovoljenja za promet z zdravilom po nacionalnem postopku, po postopku z medsebojnim priznavanjem in decentraliziranem postopkih.
2. člen
(opredelitev izrazov)
Poleg opredelitev in izrazov, ki so opredeljeni v 5. in 6. členu zakona, se v tem pravilniku uporabljajo tudi naslednji izrazi:
1. CESP (Common European Submission Portal) je eno-ten evropski spletni sistem za predložitev elektronskih vlog organom držav članic, pristojnim za zdravila v Evropski uniji (v nadaljnjem besedilu: EU). Dostopen je preko spletne strani http://cesp.hma.eu.
2. Skupni tehnični dokument (CTD – Common Technical Document) je predpisana oblika dokumentacije v postopkih za pridobitev in vzdrževanje dovoljenja za promet z zdravilom, ki jo je sprejela Mednarodna konferenca o usklajevanju tehničnih zahtev za pridobitev dovoljenja za promet z zdravilom za uporabo v humani medicini (ICH – International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use).
3. Informacije o zdravilu so povzetek glavnih značilnosti zdravila, označevanje in navodilo za uporabo.
4. Isto zdravilo pomeni zdravilo z isto kakovostno in ko-ličinsko sestavo učinkovine in enako farmacevtsko obliko in je od istega predlagatelja v smislu opredelitve, podane v pravilih iz tretjega odstavka prejšnjega člena.
5. Odbor za oceno tveganja na področju farmakovigilance (PRAC – Pharmacovigilance Risk Assessment Commit-tee) je strokovni organ pri EMA, ki je pristojen za ocenjevanje in spremljanje varnosti zdravil za uporabo v humani medicini in je sestavljen iz predstavnikov držav članic EU, posamično imenovanih strokovnjakov, predstavnikov združenj zdravstvenih delavcev in organizacij pacientov.
6. Odbor za zdravila za uporabo v humani medicini (CHMP – Committee for Medicinal Products for Human Use) je strokovni organ pri EMA, ki je pristojen za oceno zdravil za uporabo v humani medicini in je sestavljen iz predstavnikov držav članic EU in posamično imenovanih strokovnjakov.
7. Seznam referenčnih datumov EU in pogostnosti oddaje rednih posodobljenih poročil o varnosti zdravil (v nadaljnjem besedilu: Seznam referenčnih datumov EU) je seznam, ki ga v skladu s sedmim odstavkom 107c. člena Direktive 2001/83/ES objavlja EMA na evropskem spletnem portalu o zdravilih, vzpostavljenem v skladu s 26. členom Uredbe 726/2004/ES.
8. Skupina za usklajevanje je skupina, ki deluje v imenu organov, pristojnih za zdravila v državah članicah EU. Preučuje vprašanja, povezana s pridobitvijo in vzdrževanjem dovoljenj za promet z zdravilom po postopku z medsebojnim priznavanjem in decentraliziranem postopku ter farmakovigilanco zdravil.
9. Tehnično ustrezen elektronski formatje format vloge eCTD (elektronska oblika skupnega tehničnega dokumenta) ali NeeS (dogovorjena elektronska oblika, ki ni v formatu e-CTD), ki je skladen s trenutno veljavnimi validacijskimi merili. Specifikacije in validacijska merila za tehnično ustrezne elektronske oblike so objavljene na spletni strani http://esubmission.ema. europa.eu/, v njihovem vsakokrat veljavnem besedilu.
3. člen
(način predložitve vlog)
(1) Predlagatelj vlogo predloži v obliki skupnega tehnične-ga dokumenta (v nadaljnjem besedilu: CTD):
– prek enotnega evropskega spletnega sistema CESP v tehnično ustreznem elektronskem formatu, če je podpisana z varnim elektronskim podpisom, overjenim s kvalificiranim digitalnim potrdilom,
– prek enotnega evropskega spletnega sistema CESP v tehnično ustreznem elektronskem formatu in z vzporedno vloženim spremnim dopisom v pisni obliki, če ni podpisana z varnim elektronskim podpisom, overjenim s kvalificiranim digitalnim potrdilom,
– zapisano na optičnem nosilcu, če je v tehnično ustreznem elektronskem formatu s spremnim dopisom v pisni obliki ali
– v pisni obliki, če ni v tehnično ustrezni elektronski obliki. (2) Za datum prejema vloge se šteje datum, ko JAZMP
prejme vlogo na enega od načinov iz prejšnjega odstavka.
(3) Če predlagatelj vlogo iz prejšnjega odstavka odda na več kot enega od načinov iz prvega odstavka tega člena, JAZMP obravnava izvod vloge, predložen:
– prek enotnega evropskega spletnega sistema CESP, če ta obstaja;
– zapisano na optičnem nosilcu, če ta obstaja,
ostale izvode vloge pa označi kot dvojnik in arhivira brez nadaljnje obravnave.
(4) Podrobnejša navodila glede predložitve vloge so ob-javljena na spletni strani Javne agencije Republike Slovenije za zdravila in medicinske pripomočke (v nadaljnjem besedilu: JAZMP) (http://www.jazmp.si), v njihovem vsakokrat veljavnem besedilu.
(5) JAZMP lahko od predlagatelja zahteva na vpogled izvirnike posameznih dokumentov, ki se zahtevajo v vlogi.
(6) Predlagatelj vlogo predloži v slovenskem ali angleškem jeziku, če s tem pravilnikom ni drugače določeno.
4. člen
(obveščanje javnosti)
JAZMP na svoji spletni strani obvešča javnost:
– o dovoljenju za promet z zdravilom, skupaj z zadnjim veljavnim navodilom za uporabo in povzetkom glavnih značilnosti zdravila,
– o pogojih, določenih z dovoljenji za promet, izdanimi na podlagi 36. do 38. člena tega pravilnika, skupaj z roki za izpolnitev teh pogojev za vsako zdravilo,
– z javnim poročilom o oceni zdravila, ki se dopolni vedno, ko so na voljo novi podatki, ki so pomembni za vrednotenje kakovosti, varnosti ali učinkovitosti zadevnega zdravila. Pred objavo se izbrišejo vsi podatki poslovno zaupne narave.
II. PRIDOBITEV DOVOLJENJA ZA PROMET Z ZDRAVILOM
A. Vsebina vloge
5. člen
(vsebina vloge)
(1) Vloga za pridobitev dovoljenja za promet z zdravilom vsebuje v splošnem delu naslednje podatke in dokumente, ki jih predlagatelj redno posodablja do zaključka postopka:
– ime, naziv in naslov predlagatelja, shemo z navedbo vseh proizvajalcev in mest proizvodnje zdravila in učinkovin;
– ime zdravila;
– podatke o kakovostni in količinski sestavi zdravila, z navedbo mednarodnega nelastniškega imena (INN), ki ga pri-poroča Svetovna zdravstvena organizacija, kadar tako ime ob-staja, ali navedbo drugega nelastniškega oziroma ustreznega kemijskega imena;
– oceno možnih tveganj za okolje, ki jih predstavlja zdravilo. Vpliv na okolje je treba oceniti in za vsak primer posebej sprejeti posebne ureditve za omejevanje tega vpliva;
– opis postopka proizvodnje;
–terapevtske indikacije, kontraindikacije in neželene učinke;
– odmerjanje, farmacevtsko obliko, postopek in pot uporabe zdravila ter pričakovani rok uporabnosti;
– navedbo razlogov za previdnostne in varnostne ukrepe pri shranjevanju zdravila, pri dajanju zdravila pacientom ter pri odlaganju odpadkov, skupaj z navedbo vseh možnih tveganj, ki jih zdravilo predstavlja za okolje;
– opis kontrolnih metod, ki jih uporablja proizvajalec;
– pisno potrdilo, da je proizvajalec zdravila z izvedbo presoj preveril skladnost proizvodnje učinkovine z načeli in smernicami dobre proizvodne prakse za vhodne snovi. Pisno potrdilo vsebuje datum presoje in izjavo, da je presoja potrdila skladnost proizvodnje v skladu z načeli in smernicami dobre proizvodnje prakse;
– rezultate farmacevtsko-kemijskih in bioloških preskusov, nekliničnih farmakološko-toksikoloških preskusov in kliničnih preskušanj;
– povzetek sistema farmakovigilance, ki vsebuje:
– dokazilo, da ima predlagatelj na voljo osebo, odgovorno za farmakovigilanco,
– navedbo države članice EU, kjer oseba, odgovorna za farmakovigilanco, prebiva in izvaja naloge farmakovigilance,
– kontaktne podatke osebe, odgovorne za farmakovigilanco,
– podpisano izjavo predlagatelja, da ima vire in sredstva, potrebna za izvajanje nalog in odgovornosti v skladu z zahtevami iz naslova IX Direktive 2001/83/ES in
– podatek o mestu, kjer se hrani glavni dosje o sistemu farmakovigilance za zdravilo;
– načrt za obvladovanje tveganj z opisom sistema obvladovanja tveganja, ki ga bo predlagatelj uvedel za zadevno zdravilo, skupaj s povzetkom načrta. Načrt za obvladovanje tveganj z opisom sistema obvladovanja tveganja je sorazmeren z ugotovljenimi in možnimi tveganji zdravila ter potrebo po podatkih o varnosti zdravila po pridobitvi dovoljenja za promet z zdravilom;
– izjavo, iz katere je razvidno, da so klinična preskušanja, opravljena zunaj EU, izvedena v skladu z zahtevami predpisov o kliničnih preskušanjih;
– povzetek glavnih značilnosti zdravila, osnutek zunanje in stične ovojnine zdravila ter navodilo za uporabo;
– dokazilo, da ima proizvajalec dovoljenje za proizvodnjo zdravil;
– kopije vseh dovoljenj za promet z zdravilom, pridobljenih v drugih državah članicah EU ali v tretjih državah skupaj s povzetki vseh varnostnih podatkov, tudi tistih iz rednih posodobljenih poročil o varnosti, če so na voljo, in poročil o domnevnih neželenih učinkih, skupaj s seznamom tistih držav članic EU, v katerih je bila vloga za pridobitev dovoljenja za promet z zdravilom predložena v skladu z Direktivo 2001/83/ES in je v postopku vrednotenja, skupaj s kopijami povzetkov glavnih značilnosti zdravila in navodil za uporabo, ki so jih odobrili pristojni organi držav članic EU; podrobne razloge za zavrnitev izdaje dovoljenja za promet z zdravilom v državah članicah EU ali v tretjih državah.
(2) K farmacevtsko-kemijskemu in biološkemu delu, ne-kliničnemu farmakološko-toksikološkemu in kliničnemu delu so priložena tudi strokovna mnenja v obliki povzetkov in pregledov, ki jih pripravijo strokovnjaki iz 14. člena tega pravilnika.
(3) Vloga za pridobitev dovoljenja za promet z zdravilom vsebujejo vse obstoječe upoštevne podatke, tako ugodne kot neugodne, ki so pomembni za oceno razmerja med koristjo in tveganjem pri uporabi zdravila. Predlagatelj je odgovoren za verodostojnost podatkov.
B. Vrste vlog
6. člen
(vrste vlog)
(1) Vloga za pridobitev dovoljenja za promet z zdravilom je lahko:
1. Vloga v skladu s 44. členom zakona, ki poleg splošne-ga dela v skladu z določbami prejšnjega člena vsebuje:
– lastne podatke predlagatelja oziroma proizvajalca o farmacevtsko-kemijskem in biološkem preskušanju zdravila,
– lastne podatke predlagatelja oziroma proizvajalca o ne-kliničnem farmakološko-toksikološkem preskušanju zdravila in
– lastne podatke predlagatelja oziroma proizvajalca o kliničnem preskušanju zdravila.
2. Vloga v skladu s 44. členom zakona, ki poleg splošne-ga dela v skladu z določbami prejšnjega člena vsebuje:
– lastne podatke predlagatelja oziroma proizvajalca o farmacevtsko-kemijskem in biološkem preskušanju zdravila,
–omejene lastne podatke o nekliničnem farmakološko-toksikološkem preskušanju zdravila, ki jih dopolnjujejo podatki iz literature, in
– omejene lastne podatke o kliničnem preskušanju zdravila, ki jih dopolnjujejo podatki iz literature.
3. Vloga v skladu s prvim odstavkom 45. člena zakona, ki poleg splošnega dela v skladu z določbami prejšnjega člena vsebuje:
– lastne podatke predlagatelja oziroma proizvajalca o farmacevtsko-kemijskem in biološkem preskušanju zdravila in
– namesto podatkov o nekliničnem farmakološko-toksikološkem ali kliničnem preskušanju zdravila ali obojem sklic na popolno dokumentacijo referenčnega zdravila, ki je pri-dobilo dovoljenje za promet z zdravilom v Republiki Sloveniji ali katerikoli drugi državi članici EU. Predložene morajo biti študije biološke uporabnosti v skladu s smernicami iz tretjega odstavka 1. člena tega pravilnika, če je glede na obliko zdravila to potrebno.
4. Vloga v skladu s šestim odstavkom 45. člena zakona, ki poleg splošnega dela v skladu z določbami prejšnjega člena vsebuje:
– lastne podatke predlagatelja oziroma proizvajalca o farmacevtsko-kemijskem in biološkem preskušanju zdravila,
– namesto dela podatkov o nekliničnem farmakološko-toksikološkem ali kliničnem preskušanju zdravila ali obo-jem sklic na popolno dokumentacijo referenčnega zdravila, ki je pridobilo dovoljenje za promet z zdravilom v Republiki Sloveniji ali katerikoli drugi državi članici EU. Predložene morajo biti študije biološke uporabnosti v skladu s smernicami iz tretjega odstavka 1. člena tega pravilnika, če je glede na obliko zdravila to potrebno,
– lastne rezultate ustreznih nekliničnih farmakološko-toksikoloških preskusov ali kliničnih preskušanj zdravila, ki dopolnjujejo podatke, na katere se predlagatelj sklicuje.
6. Vloga v skladu s 47. členom zakona, ki poleg splošne-ga dela v skladu z določbami prejšnjega člena vsebuje:
– lastne podatke predlagatelja oziroma proizvajalca o farmacevtsko-kemijskem in biološkem preskušanju zdravila,
– podatke iz literature o nekliničnem farmakološko-toksikološkem preskušanju zdravila in
– podatke iz literature o kliničnem preskušanju zdravila. Podatki iz literature morajo biti objavljeni v javno dostopnih publikacijah, ki po zgradbi in vsebini ustrezajo namenu tega dela dokumentacije. Če nekateri podatki, opisani v literaturi, niso zadostni, predlagatelj predloži utemeljitev, da so sestavine zdravila dobro znane, da je znana njihova učinkovitost in sprejemljiva varnost in da sta kljub temu, da določeni podatki niso predloženi, varnost in učinkovitost zdravila zagotovljeni. To mora biti razvidno tudi iz strokovnih mnenj v pregledih in povzetkih neklinične farmakološko-toksikološke ter klinične dokumentacije, ki jih pripravijo strokovnjaki iz 14. člena tega pravilnika.
7. Vloga v skladu z 49. členom zakona, ki poleg splošne-ga dela v skladu z določbami prejšnjega člena vsebuje:
– lastne podatke predlagatelja oziroma proizvajalca o farmacevtsko-kemijskem in biološkem preskušanju zdravila,
– rezultate novih nekliničnih farmakološko-toksikoloških preskusov v zvezi s predlagano kombinacijo učinkovin in
– rezultate novih kliničnih preskušanj v zvezi s predlagano kombinacijo učinkovin.
Rezultatov nekliničnih farmakološko-toksikoloških preskusov in kliničnih preskušanj ni treba predložiti za posamezno učinkovino.
8. Vloga v skladu s 50. členom zakona, ki poleg splošne-ga dela v skladu z določbami prejšnjega člena vsebuje soglasje imetnika dovoljenja za promet z zdravilom z referenčnim zdravi-lom za uporabo njegove dokumentacije o farmacevtsko-kemijskem in biološkem, nekliničnem farmakološko-toksikološkem in kliničnem preskušanju zdravila.
(2) Natančnejše zahteve za podatke o vlogah iz prejšnjega odstavka so določene v II. delu Priloge I Direktive 2001/83/ES.
C. Oblika vloge
7. člen
(oblika vloge)
Podatke in dokumente predlagatelj predloži v obliki CTD, ki obsega pet modulov:
– Modul 1, ki vsebuje podatke iz 8. člena tega pravilnika; – Modul 2, ki vsebuje povzetek o kakovosti ter preglede
in povzetke neklinične in klinične dokumentacije;
– Modul 3, ki vsebuje farmacevtsko-kemijske in biološke podatke;
– Modul 4, ki vsebuje neklinična farmakološko-toksikološka poročila;
– Modul 5, ki vsebuje poročila o kliničnih študijah.
8. člen
(sestava modula 1)
(1) Modul 1 vsebuje: 1.0 spremni dopis;
1.1 izčrpen pregled vsebine celotne dokumentacije (ka-zalo vseh modulov);
1.2 izpolnjen obrazec za pridobitev dovoljenja za promet z zdravilom;
1.3 informacije o zdravilu:
– predlog besedil povzetka glavnih značilnosti zdravila, označevanja in navodila za uporabo;
– barvne osnutke zunanje in stične ovojnine;
– podatke o posvetovanju s ciljnimi skupinami pacientov o berljivosti navodila za uporabo;
– informacije o zdravilu iz sedemnajste alinee prvega odstavka 5. člena tega pravilnika, odobrene v drugih državah članicah EU;
– podatke v Braillovi pisavi, skladno z določbami predpisa o označevanju zdravil in o navodilu za uporabo;
1.4 izjave s podpisi in podatki o usposobljenosti strokovnjaka za:
– farmacevtsko-kemijski in biološki del dokumentacije;
– neklinični farmakološko-toksikološki del dokumentacije; – klinični del dokumentacije;
1.5 posebne zahteve za posamezne vrste vlog v skladu s 6. členom tega pravilnika in navodili iz tretjega odstavka 1. člena tega pravilnika;
1.6 oceno tveganja za okolje:
– za zdravila, ki ne vsebujejo gensko spremenjenih organizmov, vendar predstavljajo tveganje za okolje;
– za zdravila, ki vsebujejo gensko spremenjene organizme;
1.7 podatke, ki se nanašajo na obdobje zaščite pri zdravilih sirotah;
1.8 podatke o farmakovigilanci:
– povzetek sistema farmakovigilance; – načrt za obvladovanje tveganj;
1.9 podatke o kliničnih preskušanjih, če so izvedena izven EU, kadar je to ustrezno;
1.10 podatke o uporabi zdravila v pediatriji.
(2) Sestava modula 1 je podrobneje opredeljena v 9. do 20. členu tega pravilnika.
9. člen
(sestava modula 1 – vsebina vloge in spremni dopis)
(1) Predlagatelj predloži seznam vsebine modulov 1 do 5, ki so predloženi v vlogi za pridobitev dovoljenja za promet z zdravilom.
(2) Spremni dopis vsebuje podatke o predlagatelju vloge za pridobitev dovoljenja za promet z zdravilom (ime in naslov), podatke o zadevnem zdravilu (ime zdravila, mednarodno ne-lastniško ime zdravila, farmacevtska oblika, jakost in številka postopka), podatke o načinu predložitve vloge (preko CESP ali vrsta in število nosilcev elektronskega zapisa ali število fasciklov), opredelitev vrste vloge, datum in podpis odgovorne osebe. Predlagatelj lahko uporabi predlogo Skupine za usklajevanje.
10. člen
(sestava modula 1 – obrazec za pridobitev dovoljenja za promet z zdravilom)
(1) Predlagatelj izpolni obrazec za pridobitev dovoljenja za promet z zdravilom v slovenskem ali angleškem jeziku in upošteva predlogo, objavljeno na spletni strani Evropske ko-misije v pravilih iz tretjega odstavka 1. člena tega pravilnika.
(2) Obrazcu iz prejšnjega odstavka so priloženi dokumenti, ki so v obrazcu zahtevani kot njegove priloge.
11. člen
(sestava modula 1 – povzetek glavnih značilnosti zdravila)
(1) Povzetek glavnih značilnosti zdravila vsebuje podatke v zaporedju kot ga določa 11. člen Direktive 2001/83/ES.
(2) Predlagatelj vključi besedilo, ki od zdravstvenih delavcev izrecno zahteva, naj poročajo o vsakem domnevnem neželenem učinku v skladu s predpisom, ki ureja področje farmakovigilance.
(3) Za zdravila s seznama zdravil, za katera se zahteva dodatno spremljanje varnosti, ki ga v skladu s 23. členom Uredbe 726/2004/ES objavlja EMA, predlagatelj na začetku povzetka glavnih značilnosti zdravila natisne simbol polnega navzdol obrnjenega trikotnika v črni barvi v skladu s 23. členom Uredbe 726/2004/ES. Simbolu sledita stavek »Za to zdravilo se izvaja dodatno spremljanje varnosti.« in standardna kratka obrazložitev.
(4) Vsebina povzetka glavnih značilnosti zdravila so pripravljena v skladu s smernico o povzetku glavnih značilnosti zdravila Evropske komisije (A Guideline on Summary of Pro-duct Characteristics), ki je del navodil iz tretjega odstavka 1. člena tega pravilnika.
(5) Za vsako farmacevtsko obliko in vsako jakost je treba praviloma predložiti ločen povzetek glavnih značilnosti zdravi-la. Besedilo je lahko skupno za različne farmacevtske oblike ali jakosti le, če imajo enake ali podobne farmakokinetične lastnosti in se uporabljajo za iste indikacije, imajo enako pot uporabe, iste kontraindikacije, opozorila, previdnostne ukrepe, neželene učinke. Pomožne snovi so v tem primeru navedene za vsako farmacevtsko obliko in, če je potrebno, za vsako jakost posebej.
(6) Predlagatelj pri vlogah po nacionalnem postopku predloži povzetek glavnih značilnosti zdravila v slovenskem jeziku. Pri vlogah po postopku z medsebojnim priznavanjem in decentraliziranem postopku predloži povzetek glavnih značilnosti zdravila v angleškem jeziku, kakor je bil odobren oziroma predložen v referenčni državi članici EU, pred prihodom zdravila na trg Republike Slovenije pa tudi strokovno, jezikovno in oblikovno ustrezen prevod odobrenega besedila v slovenskem jeziku. V prevodu je upoštevana strokovna terminologija, uveljavljena v Republiki Sloveniji. Kakršnakoli odstopanja med predlogoma povzetka glavnih značilnosti zdravila v slovenskem in angleškem jeziku predlagatelj označi in utemelji.
12. člen
(sestava modula 1 – označevanje)
Predlagatelj pri vlogah po nacionalnem postopku predloži predloge besedila zunanje in stične ovojnine v skladu s predpisom, ki ureja označevanje zdravil in navodilo za uporabo v slovenskem jeziku. Pri vlogah po postopku z medsebojnim priznavanjem in decentraliziranem postopku predlagatelj predloži predloge besedila zunanje in stične ovojnine v angleškem jeziku, kakor so bili odobreni oziroma predloženi v referenčni državi članici EU, pred prihodom zdravila na trg Republike Slovenije pa tudi strokovno, jezikovno in oblikovno ustrezen prevod odobrenega besedila v slovenskem jeziku z upošteva-njem strokovne terminologije, uveljavljene v Republiki Sloveniji. Pred prihodom zdravila na trg Republike Slovenije predlagatelj predloži barvne osnutke ovojnine, ki vključujejo ustrezne podatke v Braillovi pisavi, kadar je to potrebno.
13. člen
(sestava modula 1 – navodilo za uporabo)
(1) Predlagatelj predloži predlog besedila navodila za uporabo v skladu s predpisom, ki ureja označevanje zdravil in navodilo za uporabo. Pri vlogah po nacionalnem postopku predloži predlog besedila navodila za uporabo v slovenskem jeziku. Pri vlogah po postopku z medsebojnim priznavanjem in decentraliziranem postopku predloži predlog besedila navodila za uporabo v angleškem jeziku, kakor je bil odobren oziroma predložen v referenčni državi članici EU, pred prihodom zdravila na trg Republike Slovenije pa tudi strokovno, jezikovno in oblikovno ustrezen slovenski prevod odobrenega besedila v slovenskem jeziku z upoštevanjem strokovne terminologije, uveljavljene v Republiki Sloveniji.
(2) Za vsako farmacevtsko obliko in vsako jakost je treba predložiti ločeno navodilo za uporabo. Navodilo za uporabo je lahko skupno za različne farmacevtske oblike ali jakosti le, če imajo enake ali podobne farmakokinetične lastnosti in se uporabljajo za iste indikacije, imajo enako pot uporabe, iste kontraindikacije, opozorila, previdnostne ukrepe, neželene učinke. Pomožne snovi so v tem primeru navedene za vsako farmacevtsko obliko, in če je potrebno, za vsako jakost posebej.
(3) Berljivost, jasnost, razumljivost in enostavnost navodila za uporabo je treba preveriti v posvetovanju s ciljnimi skupinami pacientov v skladu s predpisom, ki ureja označevanje zdravil in navodilo za uporabo.
14. člen
(sestava modula 1 – strokovnjaki)
Strokovnjaki, ki pripravijo povzetke in preglede v modulu 2, so ustrezno strokovno in tehnično usposobljeni za objektiven opis in vrednotenje rezultatov preskušanj zadevnega zdravila oziroma za uporabo strokovne literature, kar je razvidno iz predloženih podatkov o njihovi izobrazbi, usposobljenosti in poklicnih izkušnjah.
15. člen
(sestava modula 1 – posebne zahteve za različne vrste vlog)
Predlagatelj predloži utemeljitev predloga za pridobitev dovoljenja za promet z zdravilom glede posebnih zahtev za različne vrste vlog v skladu z navodili iz tretjega odstavka 1. člena tega pravilnika.
16. člen
(sestava modula 1 – ocena tveganja za okolje)
Predlagatelj za zdravila, ki vsebujejo gensko spremenjene organizme, in za zdravila, ki ne vsebujejo gensko spremenjenih organizmov, vendar predstavljajo tveganje za okolje, ki nastanejo zaradi uporabe ali odstranjevanja zdravila, predloži oceno tveganja za okolje v skladu z 2. členom Direktive 2001/18/ES Evropskega parlamenta in Sveta z dne 12. marca 2001 o namernem sproščanju gensko spremenjenih organizmov v okolje in razveljavitvi Direktive Sveta 90/220/EGS (ULLšt. 106 z dne 17.4. 2001, str. 1), zadnjič spremenjene z Direktivo 2008/27/ES Evropskega parlamenta in Sveta z dne 11. marca 2008 o spremembi Direktive 2001/18/ES o namernem sproščanju gensko spremenjenih organizmov v okolje, glede Komisiji podeljenih izvedbenih pooblastil (UL L št. 81 z dne 20. 3. 2008, str. 45).
17. člen
(sestava modula 1 – podatki, ki se nanašajo na obdobje zaščite pri zdravilih sirotah)
Predlagatelj v vlogi za pridobitev dovoljenja za promet z zdravilom poda podatke v povezavi z obdobjem zaščite pri zdravilih sirotah v skladu z 8. členom Uredbe (ES) št. 141/2000 Evropskega parlamenta in Sveta z dne 16. decembra 1999 o zdravilih sirotah (UL L št. 18 z dne 22. 1. 2000, str. 1), zadnjič spremenjene z Uredbo 596/2009/ES, če so predlagane iste indikacije kot pri zdravilu, ki ima dovoljenje za promet z zdravilom in podeljen status zdravila sirote.
18. člen
(sestava modula 1 – podatki o farmakovigilanci)
Predlagatelj predloži povzetek sistema farmakovigilance, ki vsebuje podatke v skladu z dvanajsto alineo 5. člena tega pravilnika in načrt za obvladovanje tveganj.
19. člen
(sestava modula 1 – podatki o kliničnih preskušanjih v tretjih državah in podatki o uporabi zdravila v pediatriji)
(1) Predlagatelj predloži izjavo, iz katere je razvidno, da klinična preskušanja, izvedena v tretjih državah, izpolnjujejo etične zahteve Direktive 2001/20/ES Evropskega parlamenta in Sveta z dne 4. aprila 2001 o približevanju zakonov in drugih predpisov držav članic v zvezi z izvajanjem dobre klinične prakse pri kliničnem preskušanju zdravil za ljudi (UL L št. 121 z dne 1. 5. 2001, str. 34), zadnjič spremenjene z Uredbo 596/2009/ES, in podatke o teh preskušanjih.
(2) Predlagatelj predloži podatke o uporabi zdravila v pediatriji v skladu z Uredbo (ES) št. 1901/2006 Evropskega parlamenta in Sveta z dne 12. decembra 2006 o zdravilih za pediatrično uporabo in spremembah Uredbe (EGS) št. 1768/92, Direktive 2001/20/ES, Direktive 2001/83/ES in Uredbe (ES) št. 726/2004 (UL L št. 378 z dne 27. 12. 2006, str. 1), zadnjič spremenjeno z Uredbo (ES) št. 1902/2006 Evropskega par-lamenta in Sveta z dne 20. decembra 2006 o spremembah Uredbe 1901/2006 o zdravilih za pediatrično uporabo (UL L št. 378 z dne 27. 12. 2006, str. 20).
20. člen
(sestava modulov 2 do 5 in natančnejša navodila)
Natančnejša oblika in vsebina modulov 2 do 5 ter zahteve za posamezne vrste zdravil so določeni v Prilogi I Direktive 2001/83/ES in v navodilih iz tretjega odstavka 1. člena tega pravilnika.
Č. Vrste postopkov
21. člen (vrste postopkov)
(1) Ne glede na vrsto vloge iz 6. člena tega pravilnika, lahko pridobitev dovoljenja za promet z zdravilom, ki je predmet tega pravilnika, poteka po:
– nacionalnem postopku;
– postopku z medsebojnim priznavanjem ali – decentraliziranem postopku.
(2) V postopkih iz druge in tretje alinee prejšnjega odstavka je Republika Slovenija lahko referenčna država članica EU ali zadevna država članica EU.
22. člen (nacionalni postopek)
Nacionalni postopek za pridobitev dovoljenja za promet z zdravilom poteka v skladu s 55. členom zakona.
23. člen
(hkratna obravnava v več državah članicah EU)
Kadar JAZMP ugotovi, da vlogo za pridobitev dovoljenja za promet z zdravilom za isto zdravilo že obravnava druga država članica EU, ustavi postopek in predlaga predlagatelju, da ravna v skladu z določbami prvega odstavka 25. člena tega pravilnika.
24. člen
(dovoljenje za promet z zdravilom v drugi državi članici EU)
Kadar JAZMP ugotovi, da je druga država članica EU izdala dovoljenje za promet z zdravilom, ki je predmet vloge za pridobitev dovoljenja za promet z zdravilom v Republiki Sloveniji, zavrže vlogo, razen če je bila ta vložena v skladu z določbami prvega odstavka 25. člena tega pravilnika.
25. člen
(postopek z medsebojnim priznavanjem in decentralizirani postopek)
(1) Postopek z medsebojnim priznavanjem se uporabi, če zdravilo že ima dovoljenje za promet z zdravilom v eni državi članici EU, predlagatelj pa želi pridobiti dovoljenje za promet z zdravilom s tem zdravilom še v drugih državah članicah EU. (2) Decentralizirani postopek se uporabi, če predlagatelj želi hkrati pridobiti dovoljenje za promet z zdravilom v več državah članicah EU.
(3) V primerih iz prvega in drugega odstavka tega člena predlagatelj predloži vlogo z enako dokumentacijo v vseh teh državah članicah EU. Predlagatelj eno od držav članic EU zaprosi, da v postopku nastopi v vlogi referenčne države in da pripravi poročilo o oceni zdravila.
(4) JAZMP pri postopkih pridobitve dovoljenja za promet z zdravilom upošteva roke in potek postopkov v skladu s pravili in smernicami iz tretjega odstavka 1. člena tega pravilnika.
26. člen
(Republika Slovenija kot referenčna država članica EU v postopku z medsebojnim priznavanjem)
(1) Če je predlagatelj dovoljenja za promet z zdravilom za zadevno zdravilo že pridobil dovoljenje za promet z zdravilom po nacionalnem postopku v Republiki Sloveniji in želi začeti postopek z medsebojnim priznavanjem v drugih državah članicah EU, je Republika Slovenija referenčna država članica EU. O tem, da želi začeti postopek, v katerem nastopa Republika Slovenija v vlogi referenčne države, se predhodno uskladi z JAZMP.
(2) Imetnik dovoljenja za promet z zdravilom zaprosi JAZMP, da pripravi poročilo o oceni zdravila ali, če je to potrebno, dopolni obstoječe poročilo o oceni zdravila z zadnjimi podatki. Pred pripravo poročila imetnik dovoljenja za promet z zdravilom JAZMP predloži posodobljeno dokumentacijo, vključno z vsemi uveljavljenimi in priglašenimi oziroma odobrenimi spremembami.
(3) JAZMP pripravi ali dopolni poročilo o oceni zdravila z zadnjimi podatki v 90 dneh od prejetja popolne vloge s posodobljeno dokumentacijo. Poročilo o oceni zdravila skupaj z odobrenim povzetkom glavnih značilnosti zdravila, ovojnino in navodilom za uporabo pošlje zadevnim državam članicam EU in predlagatelju.
(4) Če zadevne države članice EU v 90 dneh od prejema dokumentacije iz prejšnjega odstavka odobrijo poročilo o oceni zdravila, povzetek glavnih značilnosti zdravila ter ovojnino in navodilo za uporabo, o tem obvestijo JAZMP. JAZMP zaključi postopek in o tem obvesti predlagatelja.
(5) Če zadevne države članice EU ne odobrijo poročila o oceni zdravila, povzetka glavnih značilnosti zdravila ter ovojni-ne in navodila za uporabo iz tretjega odstavka tega člena zaradi možnega resnega tveganja za javno zdravje, se uporabijo določbe 30. člena tega pravilnika.
27. člen
(Republika Slovenija kot referenčna država članica EU v decentraliziranem postopku)
(1) Predlagatelj se pred predložitvijo vloge po decentraliziranem postopku, v katerem želi, da Republika Slovenija nastopi kot referenčna država, predhodno uskladi z JAZMP.
(2) JAZMP pripravi osnutek poročila o oceni zdravila, vključno s povzetkom glavnih značilnosti zdravila, navodilom za uporabo in osnutkom ovojnine, v 120 dneh od prejema popolne vloge in jih pošlje zadevnim državam članicam EU in predlagatelju.
(3) Če zadevne države članice EU v 90 dneh od prejema dokumentov iz prejšnjega odstavka odobrijo poročilo o oceni zdravila, povzetek glavnih značilnosti zdravila ter ovojnino in navodilo za uporabo, o tem obvestijo JAZMP. JAZMP zaključi mednarodni del postopka in o tem obvesti predlagatelja.
(4) Če predlagatelj v petih dneh po zaključku medna-rodnega dela postopka predloži ustrezne prevode informacij o zdravilu v slovenskem jeziku z upoštevanjem strokovne terminologije, uveljavljene v Republiki Sloveniji, JAZMP izda dovoljenje za promet z zdravilom v 30 dneh.
(5) Če zadevne države članice EU ne odobrijo poročila o oceni zdravila, povzetka glavnih značilnosti zdravila ter ovojni-ne in navodila za uporabo iz tretjega odstavka tega člena, za-radi možnega resnega tveganja za javno zdravje, se uporabijo določbe 30. člena tega pravilnika.
28. člen
(Republika Slovenija kot zadevna država članica EU v postopku z medsebojnim priznavanjem)
(1) Če je v času predložitve vloge za pridobitev dovoljenja za promet z zdravilom v Republiki Sloveniji druga država člani-ca EU že izdala dovoljenje za promet z zdravilom, predlagatelj pa za zadevno zdravilo želi pridobiti dovoljenje za promet z zdravilom v Republiki Sloveniji, predlagatelj predloži vlogo JAZMP po postopku z medsebojnim priznavanjem, v katerem je Republika Slovenija zadevna država članica EU. Predlagatelj poda izjavo, da je predložena dokumentacija enaka dokumentaciji, ki jo je prejela referenčna država in ostale zadevne države članice EU.
(2) JAZMP se v 90 dneh po prejemu popolne vloge strinja s poročilom referenčne države članice EU o oceni zdravila skupaj s povzetkom glavnih značilnosti zdravila ter ovojnino in navodilom za uporabo, razen v primerih iz 30. člena tega pravilnika.
(3) Če predlagatelj v petih dneh po zaključku mednarodnega dela postopka predloži ustrezne prevode informacij o zdravilu v slovenskem jeziku z upoštevanjem strokovne terminologije, uveljavljene v Republiki Sloveniji, JAZMP v 30 dneh izda dovoljenje za promet z zdravilom.
(4) Ne glede na določbe prejšnjega odstavka JAZMP lahko zaključi postopek in izda dovoljenje za promet z zdravilom na podlagi informacij o zdravilu v angleškem jeziku, če imetnik dovoljenja za promet z zdravilom ne namerava takoj dati zdravila v promet in bo predložil informacije o zdravilu v slovenskem jeziku v skladu s 47. členom tega pravilnika.
29. člen
(Republika Slovenija kot zadevna država članica EU v decentraliziranem postopku)
(1) V postopku, kjer je Republika Slovenija kot zadevna država članica EU v decentraliziranem postopku, predlagatelj predloži JAZMP vlogo z enako dokumentacijo kot v referenčni in drugih zadevnih državah članicah EU.
(2) JAZMP v 90 dneh od prejema osnutka poročila o oceni zdravila referenčne države članice EU prizna poročilo o oceni zdravila, vključno s povzetkom glavnih značilnosti zdravila ter ovojnino in navodilom za uporabo, razen v izjemnih primerih iz 30. člena tega pravilnika, ter o tem obvesti referenčno državo članico EU.
(3) Če predlagatelj v petih dneh po zaključku mednarodnega dela postopka predloži ustrezne prevode informacij o zdravilu v slovenskem jeziku z upoštevanjem strokovne terminologije, uveljavljene v Republiki Sloveniji, JAZMP v 30 dneh izda dovoljenje za promet z zdravilom.
(4) Ne glede na določbe prejšnjega odstavka JAZMP lahko zaključi postopek in izda dovoljenje za promet z zdravilom na podlagi informacij o zdravilu v angleškem jeziku, če imetnik dovoljenja za promet z zdravilom ne namerava takoj dati zdravila v promet in bo predložil besedila informacij o zdravilu v slovenskem jeziku v skladu s 47. členom tega pravilnika.
30. člen
(napotitveni postopek Skupine za usklajevanje)
(1) Kadar JAZMP ne odobri poročila o oceni zdravila, povzetka glavnih značilnosti zdravila ter ovojnine in navodila za uporabo iz 28. oziroma 29. člena tega pravilnika zaradi možne-ga resnega tveganja za javno zdravje, poda podrobne razloge za svojo odločitev in o tem obvesti referenčno državo članico EU, druge zadevne države članice EU in predlagatelja. O ra-zlogih nestrinjanja takoj obvesti tudi Skupino za usklajevanje.
(2) JAZMP ugotovi možna resna tveganja za javno zdrav-je v skladu s Smernico za opredelitev možnega resnega tveganja za javno zdravje v skladu s členom 29 (1) in (2) Direktive 2001/83/ES (UL C št. 133 z dne 8. 6. 2006, str. 5).
(3) Če države članice EU v 60. dneh od obvestila o razlogih nestrinjanja dosežejo dogovor, referenčna država članica EU zaključi mednarodni del postopka z medsebojnim priznavanjem oziroma decentraliziranega postopka in o tem obvesti predlagatelja. Predlagatelj v petih dneh JAZMP predloži ustrezne prevode informacij o zdravilu v slovenskem jeziku z upoštevanjem strokovne terminologije, uveljavljene v Republiki Sloveniji. JAZMP postopek konča z izdajo dovoljenja za promet z zdravilom v 30 dneh po zaključku mednarodnega dela postopka.
(4) Ne glede na določbe prejšnjega odstavka JAZMP lahko zaključi postopek in izda dovoljenje za promet z zdravilom na podlagi informacij o zdravilu v angleškem jeziku, če imetnik dovoljenja za promet z zdravilom ne namerava takoj dati zdravila v promet in bo predložil besedila informacij o zdravilu v slovenskem jeziku v skladu s 47. členom tega pravilnika.
(5) Če države članice EU ne dosežejo dogovora v roku iz tretjega odstavka tega člena, referenčna država članica o zadevi takoj obvesti EMA o uvedbi napotitvenega postopka iz 34. člena tega pravilnika in ji predloži podrobno poročilo glede zadev, o katerih države članice EU niso mogle doseči dogovora, ter razloge za njihovo nesoglasje. Kopijo tega poročila prejme tudi predlagatelj.
(6) Ko predlagatelj prejme od referenčne države članice poročilo, da je bila zadeva predana EMA, pošlje na EMA kopijo dokumentacije o zdravilu.
(7) Če je JAZMP v okoliščinah iz tretjega oziroma četrtega odstavka tega člena odobrila poročilo o oceni zdravila, skupaj s povzetkom glavnih značilnosti zdravila ter ovojnino in navodilom za uporabo, referenčne države članice EU, lahko na zahtevo predlagatelja izda dovoljenje za promet z zdravilom, ne da bi počakala na rezultat postopka iz 32. člena Direktive 2001/83/ES. V tem primeru izdano dovoljenje za promet z zdravilom ne vpliva na rezultat tega postopka.
31. člen
(napotitveni postopek za usklajevanje različnih odločitev držav članic EU)
(1) Če so države članice EU že sprejele različne odločitve v zvezi z dovoljenjem za promet z zdravilom ali so ga začasno preklicale ali odvzele, lahko JAZMP v imenu Republike Slovenije, druga država članica EU, Evropska komisija ali pa imetnik dovoljenja za promet z zdravilom pri EMA sproži napotitveni postopek iz 34. člena tega pravilnika, ki omogoča uskladitev odločitev.
(2) JAZMP v imenu Republike Slovenije in druge države članice EU vsako leto pošljejo Skupini za usklajevanje seznam zdravil, za katere je treba pripraviti usklajen povzetek glavnih značilnosti zdravila, da bi se tako spodbujala usklajenost dovoljenj za promet z zdravilom zdravil v EU.
32. člen
(napotitveni postopek za zaščito interesov EU)
(1) JAZMP v imenu Republike Slovenije, druga država članica EU, Evropska komisija, predlagatelj ali imetnik dovoljenja za promet z zdravilom v posebnih primerih, kadar je to v interesu EU, zadevo predloži EMA za uporabo postopka iz 34. člena tega pravilnika pred sprejetjem odločitve glede predloga za pridobitev dovoljenja za promet z zdravilom, glede začasnega preklica ali odvzema dovoljenja za promet z zdravilom, ali kakršne koli spremembe dovoljenja za promet z zdravilom.
(2) JAZMP v imenu Republike Slovenije, druga država članica EU ali Evropska komisija opredelijo vprašanje, predlo-ženo EMA v obravnavo, in o tem obvestijo imetnika dovoljenja za promet z zdravilom.
(3) Države članice EU in imetnik dovoljenja za promet z zdravilom pošljejo EMA vse razpoložljive podatke v zvezi s predloženo zadevo iz prvega odstavka tega člena.
33. člen
(nujni postopek EU)
(1) JAZMP v imenu Republike Slovenije, druga država članica EU ali Evropska komisija na podlagi ocene podatkov o farmakovigilanci, začne nujni postopek EU, kadar:
– bo začasno odvzela ali odvzela dovoljenje za promet z zdravilom;
– bo prepovedala promet z zdravilom;
– bo zavrnila podaljšanje dovoljenja za promet z zdravi-lom ali
– bo od imetnika dovoljenja za promet z zdravilom prejela obvestilo, da je zaradi varnostnih razlogov prekinil s prometom zdravila ali zaprosil za prenehanje dovoljenja za promet z zdravilom ali to namerava storiti ali pa ni zaprosil za podaljšanje dovoljenja za promet z zdravilom.
(2) Če JAZMP oceni, da so pri zdravilu potrebne nove kontraindikacije, zmanjšanje priporočenega odmerka ali omejitev indikacij, lahko sproži postopek iz prejšnjega odstavka. Če JAZMP postopka iz prejšnjega odstavka ne sproži in gre za zdravila, ki so pridobila dovoljenje za promet z zdravilom po postopku z medsebojnim priznavanjem ali decentraliziranem postopku, zadevo posreduje Skupini za usklajevanje. Kadar so vključeni interesi EU, se uporabi postopek iz 31. člena Direktive 2001/83/ES.
(3) Ne glede na prvi odstavek tega člena lahko JAZMP v imenu Republike Slovenije, če je v kateri koli fazi postopka potrebno nujno ukrepanje za zavarovanje javnega zdravja, začasno odvzame dovoljenje za promet z zdravilom in prepove promet z zdravilom zadevnega zdravila na svojem ozemlju do sprejetja dokončne odločitve na ravni EU. O razlogih za tako ukrepanje obvesti Evropsko komisijo, EMA in druge države članice EU najpozneje naslednji delovni dan.
(4) JAZMP v imenu Republike Slovenije, druge države članice EU ali Evropska komisija jasno opredelijo vprašanje, predloženo Odboru za oceno tveganja na področju farmakovigilance v obravnavo, in o tem obvestijo imetnika dovoljenja za promet z zdravilom.
(5) Države članice EU in imetnik dovoljenja za promet z zdravilom Odboru za oceno tveganja na področju farmakovigilance pošljejo vse razpoložljive podatke v zvezi s postopki iz prvega odstavka tega člena.
34. člen
(potek in uveljavitev izidov napotitvenih postopkov)
(1) Obravnava napotitvenih postopkov poteka pri EMA v skladu z 32. do 34. členom Direktive 2001/83/ES.
(2) Obravnava nujnih postopkov EU poteka pri Odboru za oceno tveganja na področju farmakovigilance, Odboru za zdravila za uporabo v humani medicini ali Skupini za usklajevanje v skladu s 107i. do 107k. členom Direktive 2001/83/ES.
(3) Po zaključku postopka iz 30. do 33. člena tega pravilnika imetnik dovoljenja za promet z zdravilom za uveljavitev odločitve Evropske komisije oziroma Skupine za usklajevanje, predloži JAZMP vlogo za spremembo dovoljenja za promet z zdravilom vključno s posodobljenim povzetkom glavnih značilnosti zdravila in navodilom za uporabo, v skladu z Uredbo 1234/2008/ES, kadar je to potrebno.
(4) JAZMP uskladi zadevna dovoljenja za promet z zdravilom z določbami odločitve Evropske komisije oziroma Skupi-ne za usklajevanje po postopkih in v rokih, določenih v Uredbi 1234/2008/ES in o tem obvesti Evropsko komisijo,če je potrebno.
D. Dovoljenje za promet z zdravilom
35. člen
(dovoljenje za promet z zdravilom)
(1) Dovoljenje za promet z zdravilom izda JAZMP na podlagi popolne vloge, pozitivne ocene kakovosti, varnosti in učinkovitosti oziroma ugotovljenega ugodnega razmerja med koristjo in tveganjem.
(2) V dovoljenje za promet z zdravilom z imunološkimi zdravili in zdravili iz krvi ali plazme je vključeno tudi navodilo JAZMP o uradni kontroli kakovosti za sprostitev na trg EU.
(3) Kadar je izdano dovoljenje za promet z zdravilom s posebnimi pogoji, vsebuje pogoje iz 36. do 38. člena tega pravilnika, zahtevo za njihovo vključitev v sistem obvladovanja tveganj in roke za izpolnitev pogojev, če so določeni. JAZMP obvesti EMA o dovoljenjih za promet z zdravilom s posebnimi pogoji.
(4) Po zaključku postopka pridobitve JAZMP vključi v dovoljenje za promet z zdravilom podatek o predložitvi rednega posodobljenega poročila o varnosti zdravila s sklicem na zahteve, določene v seznamu referenčnih datumov EU, opredeljenem v sedmem odstavku 107c. člena Direktive 2001/83/ES in objavljenem na evropskem spletnem portalu o zdravilih.
36. člen
(izdaja dovoljenja za promet z zdravilom s posebnimi pogoji)
(1) Poleg določb iz prvega odstavka prejšnjega člena JAZMP lahko izda dovoljenje za promet z zdravilom z naslednjimi posebnimi pogoji:
– da bo predlagatelj v določenem roku izvedel nekatere ukrepe za zagotovitev varne uporabe zdravila in jih vključil v sistem obvladovanja tveganj,
– da bo predlagatelj v določenem roku po pridobitvi dovoljenja za promet z zdravilom izvedel študije o varnosti zdravila, – da bo predlagatelj izpolnjeval obveznosti evidentiranja
ali poročanja o domnevnih neželenih učinkih, ki so strožje od zahtev iz Naslova IX Direktive 2001/83/ES,
– da bo predlagatelj ustrezno nadgradil sistem farmakovigilance,
– da bo predlagatelj v določenem roku po pridobitvi dovoljenja izvedel študije učinkovitosti o vprašanjih, na katere se lahko odgovori šele po začetku trženja zdravila, v skladu z delegiranim aktom Evropske komisije, sprejetim na podlagi 22b. člena Direktive 2001/83/ES, ali
– da bo predlagatelj upošteval katere koli druge potrebne omejitve glede varne in učinkovite uporabe zdravila.
(2) Roke in pogoje za izpolnitev posebnih pogojev JAZMP vključi v dovoljenje za promet z zdravilom.
37. člen
(izdaja dovoljenja za promet z zdravilom s posebnimi pogoji v izjemnih okoliščinah)
(1) V izjemnih okoliščinah in po posvetu s predlagateljem se dovoljenje za promet z zdravilom lahko izda pod določenimi pogoji, predvsem v zvezi z varnostjo zdravila, uradnim obveščanjem JAZMP o vseh dogodkih v zvezi z uporabo zdravila in potrebnimi ukrepi.
(2) Dovoljenje za promet z zdravilom iz prejšnjega od-stavka se lahko izda le, če predlagatelj dokaže, da ne more predložiti obširnih podatkov o učinkovitosti in varnosti zdravila v običajnih pogojih uporabe zaradi objektivnih in naslednjih preverljivih razlogov:
– da so bolezni, za katere je zdravilo namenjeno, tako redke, da se ne more smiselno pričakovati obširnih dokazov,
– da se zdravilo predpisuje in izdaja le na zdravniški recept in se v določenih primerih lahko daje samo pod strogim zdravniškim nadzorom, po možnosti v bolnišnici,
– da obsežnih podatkov ni mogoče predložiti zaradi trenutnega stanja znanstvenih dognanj, ali
– da bi bilo zbiranje tovrstnih podatkov v nasprotju s splošno sprejetimi načeli medicinske etike.
(3) V dovoljenju za promet z zdravilom JAZMP določi časovno obdobje, v katerem predlagatelj zaključi določen pro-gram študij.
(4) Informacije o zdravilu vsebujejo opozorilo o tem, da so določeni podatki, ki so na voljo o zadevnem zdravilu, še vedno nezadostni.
(5) JAZMP vsako leto oceni izpolnjevanje pogojev in na podlagi te ocene podaljša, spremeni ali odvzame dovoljenje za promet z zdravilom, če je potrebno.
38. člen
(posebni pogoji po izdaji dovoljenja za promet z zdravilom)
(1) V času po izdaji dovoljenja za promet z zdravilom lahko JAZMP imetniku dovoljenja za promet z zdravilom naloži obveznost, da izpolni naslednje posebne pogoje:
– da bo izvedel dodatne študije o varnosti zdravila, če se ugotovijo zadržki glede njegovih tveganj pri uporabi. Če se iste varnostne zahteve uporabljajo za več kot eno zdravilo, JAZMP po posvetu z Odborom za oceno tveganja na področju farmakovigilance pozove imetnike dovoljenj za promet z zdravilom, naj opravijo skupno študijo o varnosti zdravila po pridobitvi dovoljenja za promet z zdravilom;
– da bo izvedel dodatne študije učinkovitosti zdravila, če razumevanje bolezni ali klinična metodologija nakazujeta, da bi se predhodne ocene učinkovitosti lahko bistveno spremenile, v skladu z delegiranim aktom Evropske komisije, sprejetim na podlagi 22b. člena Direktive 2001/83/ES.
(2) JAZMP naložitev te obveznosti ustrezno utemelji ter jih vključi v dovoljenje za promet z zdravilom skupaj s ciljem in časovnim okvirjem za predložitev in izvedbo študij.
III. SPREMEMBE DOVOLJENJA ZA PROMET Z ZDRAVILOM
39. člen
(vrste sprememb, kot jih določa Uredba 1234/2008/ES)
(1) Vrste sprememb za priglasitev oziroma odobritev dovoljenja za promet z zdravilom so določene v 2., 3., 4., 5. in 8. točki 2. člena Uredbe 1234/2008/ES.
(2) Spremembe se lahko združijo v skupine, kot to določa 7. člen Uredbe 1234/2008/ES, ali uporabi postopek za delitev dela med državami članicami EU, kot to določa 20. člen Uredbe 1234/2008/ES.
40. člen
(vsebina vloge)
Vloga za spremembo dovoljenja za promet z zdravilom vsebuje spremni dopis, obrazec in dokumentacijo za spremembo.
41. člen
(spremni dopis za spremembe dovoljenja za promet z zdravilom)
(1) Spremni dopis za spremembe dovoljenja za promet z zdravilom vsebuje podatke o imetniku dovoljenja za promet z zdravilom (ime in naslov), podatke o zadevnem zdravilu (ime zdravila, mednarodno nelastniško ime zdravila, farmacevtska oblika, jakost in številka postopka), podatke o načinu predložitve vloge (preko CESP ali vrsta in število nosilcev elektronskega zapisa ali število fasciklov), opredelitev spremembe dovoljenja za promet z zdravilom ter datum in podpis odgovorne osebe. Imetnik dovoljenja za promet lahko uporabi predlogo Skupine za usklajevanje.
(2) V primeru združenih sprememb ali uporabe postopka delitve dela med državami članicami EU iz drugega odstavka 39. člena tega pravilnika, spremni dopis vsebuje podatke iz prejšnjega odstavka za vključena zdravila oziroma spremembe.
42. člen
(obrazec za spremembe dovoljenja za promet z zdravilom)
(1) Imetnik dovoljenja za promet z zdravilom izpolni obrazec za spremembo dovoljenja za promet z zdravilom v slovenskem ali angleškem jeziku in upošteva predlogo, objavljeno na spletni strani Evropske komisije v pravilih iz tretjega odstavka
1. člena tega pravilnika. V primeru združenih sprememb ali uporabe postopka za delitev dela med državami članicami EU iz drugega odstavka 39. člena tega pravilnika, predloži skupen obrazec za vsa vključena zdravila oziroma spremembe.
(2) Obrazcu iz prejšnjega odstavka so priloženi dokumenti, ki so v obrazcu zahtevani kot njegove priloge.
43. člen (dokumentacija za spremembo)
(1) Dokumentacija za spremembo dovoljenja za promet z zdravilom je pripravljena v skladu z navodili in smernicami iz tretjega odstavka 1. člena tega pravilnika.
(2) Če se spreminjajo informacije o zdravilu, se predloži predlog spremenjenega povzetka glavnih značilnosti zdravila, označevanja in navodila za uporabo z označenimi spremembami ter njihov čistopis.
44. člen (obravnava sprememb)
(1) Postopki obravnave sprememb so določeni v 8. do 12. členu, 13a. do 13f. členu in 19. do 22. členu Uredbe 1234/2008/ES in se uporabljajo za zdravila, za katera je bilo v Republiki Sloveniji pridobljeno dovoljenje za promet z zdravilom po nacionalnem postopku, po postopku z medsebojnim priznavanjem ali po decentraliziranem postopku.
(2) Pri napotitvenih postopkih se smiselno uporabijo do-ločbe 30., 33. in 34. člena tega pravilnika.
45. člen
(sprememba dovoljenja za promet z zdravilom v zvezi z razvrstitvijo zdravila brez recepta glede mesta izdaje)
(1)Vloga za spremembo dovoljenja za promet z zdravilom v zvezi z razvrstitvijo zdravila brez recepta glede mesta izdaje vsebuje:
– spremni dopis;
– utemeljitev spremembe razvrstitve, ki dokazuje, da zdravilo izpolnjuje pogoje za predlagano mesto izdaje v skladu s predpisom o razvrščanju zdravil glede na predpisovanje in izdajanje zdravil za uporabo v humani medicini;
– predlog nove ovojnine in navodila za uporabo z označenimi spremembami in njun čistopis.
(2) Obravnava spremembe poteka po postopku in v rokih, ki so določeni za spremembo tipa IB v Uredbi 1234/2008/ES.
46. člen
(sprememba dovoljenja za promet z zdravilom zaradi uskladitve z referenčnim zdravilom v zvezi z iztekom patentne zaščite)
(1) Uskladitev povzetka glavnih značilnosti zdravila in navodila za uporabo generičnega zdravila s povzetkom glavnih značilnosti zdravila in navodilom za uporabo referenčnega zdravila zaradi izteka patentne zaščite je sprememba, katere obravnava poteka po postopku in v rokih, ki so določeni za spremembo tipa IB v Uredbi 1234/2008/ES.
(2)Vloga za spremembo dovoljenja za promet z zdravilom zaradi uskladitve z referenčnim zdravilom v zvezi z iztekom patentne zaščite vsebuje:
– spremni dopis;
– utemeljitev uskladitve;
– predlog spremenjenega povzetka glavnih značilnosti zdravila in navodila za uporabo z označenimi spremembami ter njun čistopis.
47. člen
(predložitev informacij o zdravilu v slovenskem jeziku)
(1) Če je bil postopek z medsebojnim priznavanjem in de-centraliziran postopek v skladu s četrtim odstavkom 28. člena ter 29. in 30. člena tega pravilnika zaključen z informacijami o zdravilu v angleškem jeziku, imetnik dovoljenja za promet z zdravilom vsaj tri mesece pred načrtovanim trženjem zdravila v Republiki Sloveniji predloži JAZMP informacije o zdravilu v slovenskem jeziku.
(2) Vloga vsebuje: – spremni dopis;
– seznam vseh odobrenih sprememb, ki se nanašajo na informacije o zdravilu, skupaj z datumi odobritve;
– zadnje odobrene informacije o zdravilu v angleškem jeziku ter njihov strokovno, jezikovno in oblikovno ustrezen prevod v slovenskem jeziku, z upoštevanjem strokovne terminologije, uveljavljene v Republiki Sloveniji;
– barvne osnutke zunanje in stične ovojnine.
(3) JAZMP o vlogi odloči v 30 dneh po prejemu ustreznih informacij o zdravilu v slovenskem jeziku.
48. člen
(sprememba dovoljenja za promet z zdravilom v zvezi z načinom predpisovanja in izdaje zdravila)
(1) Sprememba dovoljenja za promet z zdravilom v zvezi z načinom predpisovanja in izdaje zdravila je lahko:
– iz skupine zdravil brez recepta, ki se izdajajo v lekarnah, v skupino zdravil na recept, ki se izdajajo v lekarnah;
– iz skupine zdravil na recept, ki se izdajajo v lekarnah, v skupino zdravil brez recepta, ki se izdajajo v lekarnah.
(2) Sprememba dovoljenja za promet z zdravilom v zvezi z načinom predpisovanja in izdaje zdravila iz prejšnjega od-stavka se lahko obravnava na predlog imetnika dovoljenja za promet z zdravilom ali po uradni dolžnosti JAZMP.
(3)Vloga za spremembo dovoljenja za promet z zdravilom v zvezi z načinom predpisovanja in izdaje zdravila vsebuje:
– spremni dopis;
– dokumentacijo v skladu z navodili iz tretjega odstavka 1. člena tega pravilnika, ki dokazuje, da zdravilo izpolnjuje pogoje za predlagani način predpisovanja in izdaje zdravila v skladu s predpisom o razvrščanju zdravil glede na predpisovanje in izdajanje zdravil za uporabo v humani medicini;
– predlog nove ovojnine in navodila za uporabo z označenimi spremembami in njun čistopis.
(4) Obravnava spremembe poteka po postopku in v rokih, ki so določeni za spremembo tipa II v Uredbi 1234/2008/ES.
IV. PODALJŠANJE DOVOLJENJA ZA PROMET Z ZDRAVILOM
49. člen
(podaljšanje dovoljenja za promet z zdravilom)
(1) Veljavnost dovoljenja za promet z zdravilom se lahko podaljša po izteku petih let na podlagi vloge za podaljšanje dovoljenja za promet z zdravilom in ponovne ocene razmerja med koristjo in tveganjem zdravila. Dovoljenje za promet z zdravilom se podaljša za nedoločen čas, razen če JAZMP zahteva ponovno podaljšanje zaradi varovanja javnega zdravja.
(2) Imetnik dovoljenja za promet z zdravilom JAZMP predloži dokumentacijo glede kakovosti, varnosti in učinkovitosti, vključno z oceno podatkov iz poročil o domnevnih neželenih učinkih in rednih posodobljenih poročil o varnosti ter z vsemi spremembami pogojev, uvedenih od izdaje dovoljenja za promet z zdravilom.
(3) Ne glede na določbe prvega odstavka tega člena v postopkih z medsebojnim priznavanjem, v katerih je Republika Slovenija zadevna država članica in v katerih je referenčna država članica pred vključitvijo Republike Slovenije v zadev-ni postopek na podlagi ugotovljenega pozitivnega razmerja med koristjo in tveganjem pri uporabi zdravila že podaljšala dovoljenje za promet z zdravilom za nedoločen čas, JAZMP to lahko upošteva pri izdaji dovoljenja za promet z zdravilom in podaljšanje dovoljenja za promet s tem zdravilom v Republiki Sloveniji ni potrebno.
(4) Če se imetnik dovoljenja za promet z zdravilom odloči, da dovoljenja za promet z zdravilom ne bo podaljšal, o tem obvesti JAZMP, in navede razloge za takšno odločitev.
50. člen
(oblika in sestava dokumentacije)
Podatke in dokumentacijo za podaljšanje dovoljenja za promet z zdravilom imetnik dovoljenja za promet z zdravilom predloži v obliki CTD, ki obsega podatke iz modulov 1 in 2, kot je določeno v 51. do 58. členu tega pravilnika.
51. člen
(sestava modula 1)
(1) Imetnik dovoljenja za podaljšanje dovoljenja za promet z zdravilom posreduje v Modulu 1 naslednjo dokumentacijo:
1.0 spremni dopis;
1.1 pregled vsebine celotne dokumentacije (kazalo vseh modulov);
1.2 izpolnjen obrazec za podaljšanje dovoljenja za promet z zdravilom s pripadajočimi prilogami;
1.3 informacije o zdravilu:
– povzetek glavnih značilnosti zdravila, označevanje in navodilo za uporabo;
1.4 izjave s podpisi in podatki o usposobljenosti strokovnjakov za:
1.4.1 farmacevtsko-kemijski in biološki del dokumentacije,
1.4.2 neklinični farmakološko-toksikološki del dokumentacije, če je potrebno in
1.4.3 klinični del dokumentacije;
1.8.1 povzetek sistema farmakovigilance, če je to potrebno v skladu z določbo iz 203. člena zakona in 68. člena tega pravilnika;
1.8.2 načrt za obvladovanje tveganj, če je to potrebno.
(2) Sestava modula 1 je podrobneje opredeljena v 52. Do 57. členu tega pravilnika.
52. člen
(sestava modula 1 – vsebina vloge in spremni dopis)
(1) Imetnik dovoljenja za promet z zdravilom predloži vsebino modulov 1 in 2, ki so predloženi v vlogi za podaljšanje dovoljenja za promet z zdravilom.
(2) Spremni dopis vsebuje podatke o imetniku dovoljenja za promet z zdravilom (ime in naslov), podatke o zadevnem zdravilu (ime zdravila, mednarodno nelastniško ime zdravila, farmacevtska oblika, jakost in številka postopka), podatke o na-činu predložitve vloge (preko CESP ali vrsta in število nosilcev elektronskega zapisa ali število fasciklov) ter datum in podpis odgovorne osebe.
53. člen
(sestava modula 1 – obrazec za podaljšanje dovoljenja za promet z zdravilom)
(1) Imetnik dovoljenja za promet z zdravilom izpolni obrazec za podaljšanje dovoljenja za promet z zdravilom v slovenskem ali angleškem jeziku in upošteva predlogo, objavljeno na spletni strani Evropske komisije v pravilih iz tretjega odstavka 1. člena tega pravilnika.
(2) Obrazcu iz prejšnjega odstavka so priloženi dokumenti, ki so v obrazcu zahtevani kot njegove priloge.
54. člen
(sestava modula 1 – informacije o zdravilu)
(1) Imetnik dovoljenja za promet z zdravilom predloži:
– za zdravila, z dovoljenjem za promet z zdravilom po nacionalnem postopku, zadnji odobreni povzetek glavnih značilnosti zdravila, označevanje in navodilo za uporabo v slovenskem jeziku;
– za zdravila z dovoljenjem za promet z zdravilom po postopku z medsebojnim priznavanjem ali decentraliziranem postopku, zadnji odobreni povzetek glavnih značilnosti zdravila, označevanje in navodilo za uporabo v angleškem jeziku.
(2) Če imetnik dovoljenja za promet z zdravilom predla-ga spremembe že odobrenih informacij o zdravilu, jih mora označiti.
(3) Predlagatelj v petih dneh po zaključku mednarodne-ga dela postopka z medsebojnim priznavanjem oziroma pred prihodom zdravila na trg predloži prevode informacij o zdravilu v slovenskem jeziku, z upoštevanjem strokovne terminologije, uveljavljene v Republiki Sloveniji.
55. člen
(sestava modula 1 – podatki o strokovnjakih)
Imetnik dovoljenja za promet z zdravilom predloži izjave s podpisi in podatki o usposobljenosti strokovnjakov za:
– farmacevtsko-kemijski in biološki del dokumentacije,
– neklinični farmakološko-toksikološki del dokumentacije, če je potrebno, in
– klinični del dokumentacije.
56. člen (sestava modula 1 – povzetek sistema farmakovigilance)
Imetnik dovoljenja za promet z zdravilom predloži povzetek sistema farmakovigilance v skladu z dvanajsto alinejo 5. člena tega pravilnika.
57. člen
(sestava modula 1 – načrt za obvladovanje tveganj)
(1) Imetnik dovoljenja za promet z zdravilom predloži posodobljen ali nov načrt za obvladovanje tveganj.
(2) Kadar ni na voljo novih podatkov, ki bi utemeljevali spremembo odobrenega načrta za obvladovanje tveganj, ime-tnik dovoljenja za promet z zdravilom predloži izjavo, s katero potrjuje veljavnost dokumenta, odobrenega v predhodnem postopku pridobitve ali vzdrževanja dovoljenja za promet z zdravilom.
(3) Če za zadevno zdravilo načrta za obvladovanje tveganj ni in ta ni zahtevan, imetnik dovoljenja za promet to ute-melji z izjavo.
58. člen
(sestava modula 2)
(1) Imetnik dovoljenja za podaljšanje dovoljenja za promet z zdravilom v Modulu 2 pošlje naslednjo dokumentacijo:
1. V razdelku 2.3 dodatek k povzetku o kakovosti zdravila (poročilo strokovnjaka), ki mora praviloma vključevati:
– pisno izjavo, da je imetnik dovoljenja za promet z zdravilom spremljal znanstveni in tehnični napredek z uvedbo vseh potrebnih sprememb od pridobitve dovoljenja za promet z zdravilom ali od zadnjega podaljšanja;
– pisno izjavo, da so bile vse uvedene spremembe o kakovosti predložene JAZMP, ter da zdravilo ustreza smernicam o kakovosti Odbora za zdravila za uporabo v humani medicini, ki so na voljo na spletni strani EMA;
– kopijo zadnjih odobrenih specifikacij za učinkovino in končni izdelek, skupaj z datumom odobritve in številko postopka;
– kakovostno in količinsko sestavo zdravila, skupaj z datumom odobritve in številko postopka.
2. V razdelku 2.4 dodatek k pregledu neklinične dokumentacije (poročilo strokovnjaka), če je potrebno;
3. V razdelku 2.5 dodatek k pregledu klinične dokumentacije (poročilo strokovnjaka), ki mora opredeliti razmerje med koristjo in tveganjem na podlagi podatkov iz zadnjega rednega posodobljenega poročila o varnosti zdravila in podatkov o varnosti in učinkovitosti zdravila, zbranih od zadnje izdaje dovoljenja za promet z zdravilom ali od zadnjega podaljšanja dovoljenja za promet z zdravilom, pri čemer je treba upoštevati tudi nove podatke iz javno dostopnih publikacij. Dodatek vključuje:
– pregled izvedenih inšpekcijskih nadzorov farmakovigilančnega sistema s podatki o datumu, mestu nadzora, vrsti inšpekcijskega nadzora in zdravilih, ki jih zadeva, o pristojnem organu, ki ga je izvedel in analizo vpliva ugotovitev na razmerje med koristjo in tveganjem zdravila;
– podatke o veljavnosti dovoljenj za promet z zdravilom in trženju zadevnega zdravila v EU in tretjih državah;
– podatke o ukrepih zaradi varnosti zdravila od pridobitve ali od zadnjega podaljšanja dovoljenja za promet z zdravilom;
– pregled pomembnih sprememb povzetka glavnih značilnosti zdravila od pridobitve ali od zadnjega podaljšanja dovoljenja za promet z zdravilom;
– oceno o številu pacientov, ki so bili izpostavljeni zadevnemu zdravilu v kliničnih preskušanjih in med trženjem zdravila; – tabelarični povzetek resnih neželenih učinkov, o katerih
so poročali v kliničnih preskušanjih ali med trženjem zdravila, od pridobitve ali od zadnjega podaljšanja dovoljenja za promet z zdravilom;
– povzetke pomembnih ugotovitev o varnosti in učinkovitosti iz kliničnih preskušanj in neintervencijskih študij;
– pregled pomembne literature iz javno dostopnih publikacij od pridobitve ali od zadnjega podaljšanja dovoljenja za promet z zdravilom, ki ima možen vpliv na razmerje med koristjo in tveganjem zdravila;
– oceno tveganja zdravila s pomembnimi podatki o varnosti, vrednotenju in opredelitvi tveganj ter učinkovitosti ukrepov zmanjševanja tveganja od pridobitve ali od zadnjega podaljšanja dovoljenja za promet z zdravilom;
– oceno koristi zdravila s pomembnimi podatki o učinkovitosti od pridobitve ali od zadnjega podaljšanja dovoljenja za promet z zdravilom;
– opredelitev razmerja med koristjo in tveganjem zdravila za odobrene indikacije;
– povzetek najpomembnejših ugotovitev o varnosti in učinkovitosti po zaključku zbiranja podatkov in v času priprave dodatka h kliničnemu pregledu.
(2) Pisna izjava strokovnjaka kliničnih strok vključuje potrditev, da:
– ni na voljo novih kliničnih ali nekliničnih farmakološko-toksikoloških podatkov, ki bi spremenili oceno razmerja med koristjo in tveganjem. V primeru novih nekliničnih farmakološko-toksikoloških podatkov imetnik dovoljenja za promet z zdravilom predloži tudi strokovno poročilo o tem delu dokumentacije;
– se zdravilu po izteku petletnega obdobja lahko varno podaljša dovoljenje za promet z zdravilom za nedoločen čas, ali navedbo ter utemeljitev priporočenih ali začetih aktivnosti glede varnosti zdravila in potrebnega ponovnega podaljšanja;
– je imetnik dovoljenja za promet z zdravilom obveščal organ, pristojen za zdravila, o katerihkoli dodatnih podatkih, pomembnih za oceno razmerja med koristjo in tveganjem za zadevno zdravilo;
– so informacije o zdravilu v skladu s trenutnimi znanstvenimi dognanji upoštevajoč tudi ocene in priporočila, javno dostopna na evropskem spletnem informacijskem portalu.
59. člen
(natančnejša navodila)
(1) Pri pripravi dokumentacije iz 51. do 58. člena tega pravilnika imetnik dovoljenja za promet z zdravilom, poleg do-ločb zakona, tega pravilnika in drugih podzakonskih predpisov, izdanih na podlagi zakona, upošteva navodila in smernice iz tretjega odstavka 1. člena tega pravilnika.
(2) Za postopek obravnave podaljšanja dovoljenja za promet z zdravili, ki so v Republiki Sloveniji pridobila dovoljenje za promet z zdravilom po postopku z medsebojnim priznavanjem ali po decentraliziranem postopku, JAZMP upošteva navodila in smernice iz tretjega odstavka 1. člena tega pravilnika.
60. člen
(postopek podaljšanja dovoljenja za promet z zdravilom)
Za postopek podaljšanja dovoljenja za promet z zdravi-lom se smiselno uporabljajo določbe 21., 30. in 34. člena tega pravilnika.
61. člen
(ponovno podaljšanje dovoljenja za promet z zdravilom za določen čas)
Če JAZMP na podlagi upravičenih razlogov v zvezi s podatki iz sistema farmakovigilance, vključno z nezadostnim številom pacientov, izpostavljenih zadevnemu zdravilu, dovoljenja za promet z zdravilom ne podaljša za nedoločen čas, predlagatelj najmanj devet mesecev pred iztekom dovoljenja za promet z zdravilom vloži vlogo za ponovno podaljšanje v skladu z določbami 51. do 58. člena tega pravilnika.
V. PRENOS DOVOLJENJA ZA PROMET Z ZDRAVILOM
62. člen
(prenos dovoljenja za promet z zdravilom)
Imetnik dovoljenja za promet z zdravilom lahko prenese dovoljenje za promet z zdravilom na drug poslovni subjekt, ki izpolnjuje pogoje iz zakona, na podlagi vloge za prenos, ki jo JAZMP ne glede na vrsto postopka pridobitve dovoljenja za promet z zdravilom, obravnava po nacionalnem postopku.
63. člen
(vloga za prenos dovoljenja za promet z zdravilom)
(1) Vloga za prenos dovoljenja za promet z zdravilom, ki jo predloži dosedanji imetnik dovoljenja za promet z zdravilom, vsebuje spremni dopis in obrazec za prenos dovoljenja za promet z zdravilom. Dosedanji in bodoči imetnik dovoljenja za promet z zdravilom izpolnita obrazec za prenos dovoljenja za promet z zdravilom, ki je objavljen na spletni strani JAZMP (http://www.jazmp.si), v njegovem vsakokrat veljavnem besedilu.
(2) Obrazcu so priloženi dokumenti, ki so v obrazcu zahtevani kot njegove priloge.
(3) JAZMP o prenosu dovoljenja za promet odloči v 60 dneh po prejemu popolne vloge.
VI. PRENEHANJE VELJAVNOSTI DOVOLJENJA ZA PROMET Z ZDRAVILOM
64. člen
(vloga za ukinitev dovoljenja za promet z zdravilom)
(1) Dovoljenje za promet z zdravilom preneha veljati na podlagi vloge predlagatelja za ukinitev dovoljenja za promet z zdravilom.
(2) Vloga za ukinitev dovoljenja za promet z zdravilom vsebuje:
– spremni dopis, ki vsebuje podatke o vlogi, vključno z navedbo razlogov za ukinitev dovoljenja za promet z zdravilom;
– obrazec za ukinitev dovoljenja za promet z zdravilom,
ki je objavljen na spletni strani JAZMP (http://www.jazmp.si), v njegovem vsakokrat veljavnem besedilu. Obrazcu so priloženi dokumenti, ki so v obrazcu zahtevani kot njegove priloge.
(3)Imetnik dovoljenja za promet z zdravilom mora vlogo iz prejšnjega odstavka predložiti JAZMP najmanj dva in največ 18 mesecev pred predvidenim prenehanjem opravljanja prometa z zdravilom.
VII. PREHODNA IN KONČNA DOLOČBA
65. člen
(povzetek sistema farmakovigilance)
(1) Če je bila vloga za pridobitev dovoljenja za promet z zdravilom predložena pred 21. julijem 2012, ko povzetek sistema farmakovigilance še ni bil zahtevan, in dovoljenje za promet z zdravilom še ni bilo izdano, predlagatelj lahko pred izdajo dovoljenja za promet z zdravilom dopolni dokumentacijo s povzetkom sistema farmakovigilance.
(2) Imetnik dovoljenja za promet z zdravilom povzetek sistema farmakovigilance predloži v vlogi za podaljšanje dovoljenja za promet z zdravilom ali v vlogi za spremembo dovoljenja za promet z zdravilom, vendar najpozneje do 21. julija 2015.
66. člen (prenehanje veljavnosti)
Z dnem uveljavitve tega pravilnika preneha veljati Pravilnik o dovoljenju za promet z zdravilom za uporabo v humani medicini (Uradni list RS, št. 109/10).
67. člen (začetek veljavnosti)
Ta pravilnik začne veljati petnajsti dan po objavi v Ura-dnem listu Republike Slovenije.
Št. 0070-33/2014
Ljubljana, dne 16. junija 2014 EVA 2014-2711-0040
v funkciji ministrice za zdravje mag. Alenka Bratušek l.r. Predsednica vlade
“,”Jaka Verbic Miklic”,1521892560,1521892560,sl,12432,306,12414,43,0,NULL,,”Pravilnik o dovoljenju za promet z zdravilom za uporabo v humani medicini, UL št. 57/2014, 25. 7. 2014″,pravilnik-o-dovoljenju-za-promet-z-zdravilom-za-uporabo-v-humani-medicini-ul-st-57-2014-25-7-2014,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521892631,1523614597
262,12434,”Pravilnik o označevanju in navodilu za uporabo zdravil za uporabo v humani medicini “,”UL 57/2014, 25/07/2014″,”
Na podlagi sedmega odstavka 87. člena Zakona o zdravi-lih (Uradni list RS, št. 17/14) ministrica za zdravje izdaja
P R A V I L N I K
o označevanju in navodilu za uporabo zdravil za uporabo v humani medicini
I. SPLOŠNE DOLOČBE
1. člen (področje urejanja)
Ta pravilnik v skladu z Direktivo 2001/83/ES Evropskega parlamenta in Sveta z dne 6. novembra 2001 o zakoniku Sku-pnosti o zdravilih za uporabo v humani medicini (UL L št. 311 z dne 28. 11. 2001, str. 67), zadnjič spremenjeno z Direktivo 2012/26/EU Evropskega parlamenta in Sveta z dne 25. oktobra 2012 o spremembi Direktive 2001/83/ES, kar zadeva farmakovigilanco (UL L št. 299 z dne 27. 10. 2012, str. 1), (v nadaljnjem besedilu: Direktiva 2001/83/ES), natančneje določa:
– način označevanja zdravil;
– obliko in vsebino navodila za uporabo;
– posebne pogoje za označevanje in navodilo za uporabo za posamezna zdravila oziroma skupine zdravil.
2. člen
(izjeme glede uporabe pravilnika)
Ta pravilnik se ne uporablja za označevanje in navodila za uporabo zdravil iz prve alineje tretjega odstavka 20. člena Zakona o zdravilih (Uradni list RS, št. 17/14; v nadaljnjem besedilu: zakon), za katera je Javna agencija Republike Slovenije za zdravila in medicinske pripomočke (v nadaljnjem besedilu: JAZMP) začasno dovolila promet oziroma izdala dovoljenje za vnos ali uvoz iz drugega odstavka 116. člena zakona.
3. člen (definicije in izrazi)
Poleg definicij in izrazov, ki so opredeljeni v 5. in 6. členu zakona, se v tem pravilniku uporabljajo še naslednji izrazi, ki imajo naslednji pomen:
1. Koda QR je matrična oziroma dvodimenzionalna črtna koda, ki se lahko uporablja za posredovanje odobrenih doda-tnih podatkov o zdravilu iz 20. in 30. člena tega pravilnika.
2. Način uporabe je pot uporabe in postopek uporabe. 3. Odmerek je količina zdravila, ki jo pacient prejme naenkrat.
4. Postopek uporabe so osnovna navodila za pravilno uporabo zdravila (npr. »Tableto raztopite v ustih!«).
5. Pot uporabe je pot, po kateri se zdravilo daje (aplicira) na mesto, kjer se začne sproščati učinkovina. Za navajanje poti uporabe (aplikacije) se uporabljajo standardni izrazi, ki so objavljeni v Slovenskem nacionalnem dodatku k Evropski farmakopeji – Formularium Slovenicum, dosegljivem tudi na spletni strani: http://www. formularium.si, in v publikaciji Standardni izrazi (Standard terms), ki jo izdaja Evropska direkcija za kakovost zdravil (EDQM) in je dosegljiva tudi na spletni strani: http://www.edqm.eu/StandardTerms.
II. OZNAČEVANJE ZDRAVIL
4. člen
(podatki na zunanji ovojnini)
(1) Vsako zdravilo, ki se daje v promet, mora biti označeno na zunanji ali na stični ovojnini, če zunanje ovojnine ni, z naslednjimi podatki v slovenskem jeziku:
1. ime zdravila, ki mu sledita jakost in farmacevtska oblika, ter če je to ustrezno, navedba, ali je zdravilo za dojenčke, otroke ali odrasle. Če zdravilo vsebuje do tri učinkovine, mora imenu slediti tudi mednarodno nelastniško ime (INN) v slovenskem ali latinskem jeziku, ali če to ne obstaja, običajno splošno ime. Izjemoma lahko JAZMP pri večjezičnih ovojninah dovoli navedbo mednarodnega nelastniškega imena v angleškem jeziku;
2. kakovostna in količinska navedba učinkovin. Učinkovine je treba navesti s splošnim imenom na enoto odmerka oziroma glede na način uporabe, s količino in kemijsko obliko učinkovine na maso ali prostornino;
3. farmacevtska oblika in vsebina pakiranja, izražena v enotah mase, prostornine ali v številu enot farmacevtske oblike;
4. seznam pomožnih snovi. Pri farmacevtskih oblikah za parenteralno uporabo, za oko, nos, uho, za dermalno, vaginalno, rektalno uporabo ali za inhaliranje in pri zdravilih za uporabo na ustni sluznici je treba navesti vse pomožne snovi, pri ostalih farmacevtskih oblikah pa le tiste, ki imajo prepoznano delovanje ali učinek in so navedene v Prilogi, ki je sestavni del
tega pravilnika;
5. način uporabe zdravila. Navesti je treba postopek in če je treba pot uporabe. Vedno je treba navesti tudi opozorilo: »Pred uporabo preberite priloženo navodilo!«. Zagotoviti je treba prostor, kamor se vpiše predpisano odmerjanje zdravila za posameznega uporabnika;
6. opozorilo: »Zdravilo shranjujte nedosegljivo otrokom!«;
7. druga opozorila, če tako določi JAZMP;
8. datum izteka roka uporabnosti zdravila (mesec in leto) in rok uporabnosti zdravila, pripravljenega tik pred uporabo ali po prvem odpiranju, če je potrebno;
9. posebna navodila za shranjevanje, če so potrebna; 10. posebni varnostni ukrepi za odstranjevanje neuporabljenih zdravil ali iz njih nastalih odpadnih snovi, kadar so potrebni, kot tudi napotitev na ustrezen uveljavljen sistem zbiranja teh snovi;
11. številka serije;
12. ime in naslov imetnika dovoljenja za promet z zdravi-lom in, če je potrebno, ime predstavnika, ki ga imenuje imetnik dovoljenja za promet z zdravilom;
13. številka dovoljenja za promet z zdravilom, v skladu z navodili JAZMP;
14. pri zdravilih za samozdravljenje skrajšano navodilo za uporabo in odmerjanje zdravila;
15. zaščitni element v skladu z 88. členom zakona; 16. druge oznake, če tako določi JAZMP.
(2) Podatki iz prejšnjega odstavka so poleg v slovenskem jeziku lahko navedeni tudi v enem ali več jezikih držav članic Evropske unije ali drugih evropskih jezikih in pisavah. Pri tem je lahko le navedba imetnika dovoljenja za promet z zdravilom v različnih državah, za katere je pripravljena ovojnina, različna.
5. člen (izmišljeno ime zdravila)
(1) Izmišljeno ime zdravila:
– ne sme povzročiti zamenjave s splošnim imenom zdravila;
– ne sme imeti zavajajočih terapevtskih ali farmacevtskih pomenov;
– ne sme biti zavajajoče glede na sestavo zdravila;
– ne sme povzročati zmede in pomot pri predpisovanju, tiskanju ali izgovorjavi z imeni drugih zdravil;
– ne sme povzročati zamenjave z drugimi vrstami izdelkov;
– ne sme vsebovati prvin oglaševanja;
– naj bo praviloma sestavljeno le iz ene besede, brez okrajšav in uporabe številk ter kratic, razen če je drugače ustrezno utemeljeno.
(2) JAZMP na svoji spletni strani objavi podrobnejša navodila glede poimenovanja zdravil za uporabo v humani medicini.
6. člen
(dodatni podatki na zunanji ovojnini)
(1) Poleg podatkov iz 4. člena tega pravilnika mora biti zdravilo, ki se daje v promet in je pridobilo dovoljenje za promet po postopku z medsebojnim priznavanjem, decentraliziranem ali centraliziranem postopku, označeno na zunanji ali na stični ovojnini, če zunanje ovojnine ni, z naslednjimi podatki v slovenskem jeziku v tako imenovanem modrem okencu:
1. oznake previdnostnih ukrepov, ki jih določi JAZMP, če je potrebno;
2. način in režim predpisovanja in izdaje zdravila;
3. eno ali dvodimenzionalno optično čitljivo kodo za identifikacijo, skladno z ISO standardi, v kateri je zapisana 13-mestna globalna trgovinska številka (v nadaljnjem besedilu: številka GTIN). Koda mora biti združljiva s predpisi o nacionalnem identifikatorju zdravila in s sistemi kodiranja, ki se uporabljajo v sistemu javnega zdravstva Republike Slovenije;
4. pri zdravilih, ki so izdelana iz krvi ali plazme, je treba navesti geografski izvor krvi ali plazme (npr. Evropska unija, Združene države Amerike);
5. pri zdravilih, ki so izdelana izključno iz krvi ali plazme slovenskega izvora, je treba vključiti navedbo, da je zdravilo le iz krvi ali plazme slovenskega izvora;
6. pri zdravilih, ki vsebujejo učinkovine, pridobljene z gensko tehnologijo, je treba navesti te učinkovine, skupaj z oznako gensko spremenjenih mikroorganizmov ali celičnih linij.
(2) S podatki iz prejšnjega odstavka mora biti označeno tudi zdravilo, ki se daje v promet in je pridobilo dovoljenje za promet po nacionalnem postopku.
7. člen
(dodatni podatki za zdravila, ki so dovoljenje za promet pridobila po centraliziranem postopku)
(1) Če je zdravilo pridobilo dovoljenje za promet po centraliziranem postopku, imetnik dovoljenja za promet z zdravilom pred načrtovanim trženjem zdravila v Republiki Sloveniji predloži na JAZMP vlogo za potrditev podatkov iz prvega odstavka prejšnjega člena.
(2) Vloga vsebuje: – spremni dopis;
– obrazec, objavljen na spletni strani JAZMP. Obrazcu so priloženi dokumenti, ki so v obrazcu zahtevani kot njegove priloge.
(3) JAZMP o vlogi odloči v 30 dneh po prejemu popolne vloge.
8. člen
(označevanje posebnih skupin zdravil)
(1) Radiofarmacevtski izdelki morajo biti označeni v skladu s tem pravilnikom in v skladu s predpisom, ki ureja radiofarmacevtske izdelke.
(2) Zdravila rastlinskega izvora morajo biti označena v skladu s tem pravilnikom in v skladu s predpisom, ki ureja zdravila rastlinskega izvora.
(3) Homeopatska zdravila morajo biti označena v skladu s tem pravilnikom in v skladu s predpisom, ki ureja homeopatska zdravila
(4) Zdravila s kalijevim jodidom, namenjena oskrbi, razdeljevanju in uporabi tablet kalijevega jodida v okviru zaščitnega ukrepa jodne profilakse v primeru jedrske ali radiološke nesreče v Republiki Sloveniji ali v drugi državi, ki bi lahko ogrozila prebivalstvo na delu ali celotnem območju Republike Slovenije, mo-rajo biti označena v skladu s tem pravilnikom, pri čemer je lahko namesto roka uporabnosti odtisnjen datum proizvodnje zdravila.
9. člen
(označevanje zdravil za klinično preskušanje)
Zdravila, namenjena kliničnemu preskušanju, morajo biti označena v skladu s predpisom, ki ureja klinično preskušanje zdravil.
10. člen
(oznake previdnostnih ukrepov)
(1) JAZMP ob izdaji dovoljenja za promet zdravilom določi naslednje oznake previdnostnih ukrepov, kadar je potrebno:
– trigonik (relativna prepoved upravljanja vozil) – prazen trikotnik v barvi besedila ( );
– trigonik (absolutna prepoved upravljanja vozil) – poln trikotnik v rdeči barvi (▲);
– zdravilo, ki se izdaja na posebni zdravniški recept – paragraf v barvi besedila (§);
– omejena količina enkratne izdaje – klicaj v barvi besedila (!).
(2) Oznake iz prejšnjega odstavka morajo biti natisnjene v najmanj polovični velikosti imena zdravila.
11. člen
(podatki na stični ovojnini)
Kadar je zdravilo vloženo v zunanjo ovojnino, je treba praviloma na stični ovojnini v slovenskem jeziku navesti vse podatke iz 4. člena tega pravilnika, razen zaščitnega elementa.
12. člen
(podatki na manjši stični ovojnini)
(1) Na manjših stičnih ovojninah (npr. vsebnikih s prostornino do 10 ml, tubah z vsebnostjo do 10 g), na katerih ni mogoče navesti vseh podatkov iz 4. člena tega pravilnika, je treba navesti najmanj naslednje podatke:
– ime zdravila, kot je določeno v 1. točki 4. člena tega pravilnika in če je treba, pot uporabe;
– postopek uporabe zdravila;
– datum izteka roka uporabnosti zdravila; – številko serije;
– vsebino vsebnika, izraženo v enotah mase, prostornine ali v številu enot farmacevtske oblike;
(2) Praviloma je na manjših stičnih ovojninah treba na-vesti tudi imetnika dovoljenja za promet z zdravilom ali logotip
imetnika dovoljenja za promet z zdravilom oziroma z njim povezane družbe, odgovorne za zdravilo.
(3) Besedilo na manjših stičnih ovojninah je lahko navedeno v enem od jezikov držav članic Evropske unije, in sicer v latinici, če je mogoče iz njega nedvoumno razbrati podatke iz prvega in drugega odstavka tega člena.
(4) Na manjših stičnih ovojninah je lahko poleg besedila v enem ali več jezikih držav članic Evropske unije navedeno enako besedilo tudi v drugih evropskih jezikih in pisavah.
13. člen
(podatki na pretisnem omotu ali dvojnem traku)
(1) Na pretisnem omotu ali dvojnem traku zdravil, ki so dodatno vložena v zunanjo ovojnino, označeno v skladu s tem pravilnikom, je treba navesti najmanj naslednje podatke:
– ime zdravila, kot je določeno v 1. točki 4. člena tega pravilnika;
– imetnika dovoljenja za promet z zdravilom ali logotip imetnika dovoljenja za promet z zdravilom oziroma z njim po-vezane družbe, odgovorne za zdravilo;
– datum izteka roka uporabnosti zdravila; – številko serije.
(2) Besedilo na pretisnem omotu ali dvojnem traku je lahko navedeno v enem od jezikov držav članic Evropske unije, in sicer v latinici, če je mogoče iz njega nedvoumno razbrati podatke iz prejšnjega odstavka.
(3) Na pretisnem omotu ali dvojnem traku je lahko poleg besedila v enem ali več jezikih držav članic Evropske unije navedeno enako besedilo tudi v drugih evropskih jezikih in pisavah.
14. člen
(opremljanje zdravil z dovoljenjem za promet z nalepkami)
(1) Dovoljenje za opremljanje z nalepkami se izda za posamezno koledarsko leto, ne glede na datum vložitve vloge.
(2) JAZMP lahko na podlagi poročila o porabi zdravila v preteklem letu ali načrta porabe zdravila za koledarsko leto, ki ne presega 3.000 kosov ali 40.000 eurov letnega prometa, ali obojega, dovoli opremljanje zdravila v ovojnini v jeziku ene od držav članic Evropske unije, in sicer v latinici, z nalepko v slovenskem jeziku. Pri tem mora biti ime zdravila na ovojnini v jeziku ene od držav članic Evropske unije enako imenu zdravila z dovoljenjem za promet v Republiki Sloveniji. Če je ime zdravila sestavljeno iz mednarodnega nelastniškega imena (INN) ali drugega splošnega imena učinkovine, ki mu sledi blagovna znamka ali ime imetnika dovoljenja za promet z zdravilom, se vse jezikovne različice mednarodnega nelastniškega ime-na (INN) ali drugega splošnega imena učinkovine štejejo kot
enako ime.
(3) Ne glede na prejšnji odstavek lahko JAZMP izjemoma dovoli opremljanje zdravila v ovojnini v jeziku ene od držav članic Evropske unije, in sicer v latinici, z nalepko v slovenskem jeziku tudi, če poraba v preteklem letu ali načrt porabe zdravila za koledarsko leto presega 3.000 kosov ali 40.000 eurov letne-ga prometa, če na trgu ni drugega zdravila z enako učinkovino, farmacevtsko obliko in jakostjo, s katerim bi bilo mogoče pokriti terapevtske potrebe.
(4) Vlogo za opremljanje zdravila z dovoljenjem za promet z nalepkami se pri JAZMP vloži vsako leto s priloženim spremnim dopisom, z utemeljitvijo izpolnjevanja pogojev iz drugega ali tretjega odstavka tega člena, ki mora poleg navedbe imena zdravila, jakosti, farmacevtske oblike, pakiranja in proizvajalca zdravila vključevati tudi poročilo o porabi zdravila v preteklem letu in letni načrt prodaje zdravila.
(5) Nalepka mora biti označena z najmanj naslednjimi podatki v slovenskem jeziku:
– ime zdravila, kot je določeno v 1. točki 4. člena tega pravilnika;
– kakovostna in količinska navedba učinkovin;
– način uporabe, vključno z opozorilom: »Pred uporabo preberite priloženo navodilo!«;
– druga opozorila, če tako določi JAZMP;
– posebna navodila za shranjevanje, če so potrebna;
– rok uporabnosti zdravila, pripravljenega tik pred upora-bo ali po prvem odpiranju, če je potrebno;
– ime in naslov imetnika dovoljenja za promet z zdravilom; – način in režim predpisovanja in izdaje zdravila;
– opozorilo: »Zdravilo shranjujte nedosegljivo otrokom!«.
(6) Če iz originalne ovojnine niso razvidni pomožne snovi,
datum izteka roka uporabnosti zdravila, številka serije, oznake previdnostnih ukrepov, izpis imena v Braillovi pisavi in koda za identifikacijo zdravila, morajo biti tudi ti podatki navedeni na nalepki.
15. člen
(opremljanje esencialnih in nujno potrebnih zdravil, ki nimajo dovoljenja za promet, z nalepkami)
(1) Nalepko s podatki v slovenskem jeziku v skladu z do-ločbami prejšnjega člena morajo imeti tudi esencialna in nujno potrebna zdravila, ki nimajo dovoljenja za promet, in je zanje JAZMP začasno dovolila promet v skladu s tretjim odstavkom 20. člena zakona oziroma izdala dovoljenje za vnos ali uvoz iz drugega odstavka 116. člena zakona in se izdajajo v lekarnah. Za strokovno, jezikovno in oblikovno ustrezno besedilo na-lepke z upoštevanjem strokovne terminologije, uveljavljene v Republiki Sloveniji, je odgovoren poslovni subjekt, ki opravlja začasni promet oziroma vnos ali uvoz teh zdravil.
(2) Določbe prejšnjega odstavka se uporabijo tudi za zdravila iz druge alinee tretjega odstavka 20. člena zakona, ki se izdajajo v lekarnah, razen če JAZMP v izrednih primerih (infekcije, epidemije, pandemije, zastrupitve, sevanja in podobno) ne odloči drugače.
(3) Na nalepki iz prvega odstavka tega člena se pri esencialnih in nujno potrebnih zdravilih namesto imena in naslova imetnika dovoljenja za promet označi ime imetnika dovoljenja za začasen promet oziroma vnos ali uvoz tega zdravila.
16. člen (drugačno označevanje)
(1) Ne glede na določbe 14. člena tega pravilnika lahko JAZMP izjemoma odobri označevanje zdravil, ki jih dajejo (aplicirajo) zdravstveni delavci in imajo režim izdaje »H« ali »ZZ« v skladu s predpisom, ki ureja razvrščanje, predpisovanje in izdajanje zdravil za uporabo v humani medicini, v enem od jezikov držav članic Evropske unije, in sicer v latinici, če na trgu ni drugega ustreznega zdravila za določeno indikacijo.
(2) Vlogo za izjeme iz prejšnjega odstavka se pri JAZMP vloži vsako leto s priloženim spremnim dopisom, ki vsebuje navedbo imena zdravila, jakosti, farmacevtske oblike, pakiranja in proizvajalca zdravila ter utemeljitev izpolnjevanja pogojev iz prejšnjega odstavka.
(3) Ne glede na določbe 14. člena tega pravilnika so zdravila sirote lahko označena v enem od jezikov držav članic Evropske unije, če to odobri Evropska agencija za zdravila (v nadaljnjem besedilu: EMA), o čemer imetnik dovoljenja za promet z zdravilom ali poslovni subjekt, ki opravlja promet s tem zdravilom, pred začetkom prometa obvesti JAZMP.
17. člen (označevanje vzorcev zdravil)
(1) Vzorci zdravil, ki niso namenjeni prodaji, morajo biti dodatno označeni z navedbo »Ni za prodajo«.
(2) Vzorci zdravil, ki ne vsebujejo učinkovine in so name-njeni le za prikazovanje uporabe zdravila, morajo biti dodatno označeni z navedbo »Vzorec brez učinkovine«.
18. člen (zahteve za podatke)
Podatki na ovojnini morajo biti natisnjeni čitljivo, razumljivo in tako, da jih ni mogoče izbrisati.
19. člen (Braillova pisava)
(1) Ime zdravila mora biti na ovojnini izpisano tudi v Brail-lovi pisavi, razen pri zdravilih za klinično preskušanje ter pri zdravilih, ki jih dajejo (aplicirajo) zdravstveni delavci in imajo režim izdaje »H« ali »ZZ« v skladu s predpisom, ki ureja o razvrščanje, predpisovanje in izdajanje zdravil za uporabo v humani medicini.
(2) Na ovojnino je treba v Braillovi pisavi odtisniti najmanj ime zdravila v skladu s 23. točko 6. člena zakona. Če obstaja zdravilo v več različnih jakostih, mora imenu zdravila slediti tudi jakost.
(3) Podatkov v Braillovi pisavi ni treba odtisniti na stično ovojnino, če je ta vložena v zunanjo ovojnino, označeno v Braillovi pisavi. Če zunanje ovojnine ni, morajo biti podatki v Braillovi pisavi odtisnjeni na stično ovojnino ali pa mora biti na stično ovojnino pritrjena nalepka s podatki v Braillovi pisavi.
(4) Če je zdravilo v pakiranju manjše prostornine (do 10 ml) z omejenim prostorom za označevanje, se lahko uporabi tudi drugačen način označevanja v Braillovi pisavi (npr. stisnjen Braillov sistem, določene dogovorjene okrajšave ali pritrjeno nalepko s podatki v Braillovi pisavi).
(5) Če je ime zdravila rastlinskega izvora sestavljeno iz imena rastline, je podatek v Braillovi pisavi lahko omejen le na ime rastline in del rastline, kadar se uporablja več različnih delov rastline.
(6) Podatki v Braillovi pisavi morajo biti praviloma odtisnjeni v tipu pisave »Marburg medium« in v evropskem »medium« standardu oblikovanja znakov.
(7) Podatkov v Braillovi pisavi ni treba odtisniti na prazen del ovojnine, vendar je treba zagotoviti, da je besedilo pod odtisnjenimi točkami čitljivo.
(8) Pri večjezični ovojnini je treba podatke v Braillovi pisavi odtisniti v vseh zadevnih jezikih, razen če so podatki v različnih jezikih identični (npr. izmišljeno ime in jakost zdravila).
(9) Če je zdravilo opremljeno z nalepko v slovenskem jeziku, ki vključuje Braillovo pisavo, je treba zagotoviti, da so na nalepki v slovenskem jeziku navedeni enaki podatki v Braillovi pisavi kot na originalni ovojnini in da izvirni podatki v Braillovi
pisavi ne povzročajo zmede.
(10) Pri zdravilih, ki so pridobila dovoljenje za promet po nacionalnem postopku, po postopku z medsebojnim prizna-vanjem ali decentraliziranem postopku, imetnik dovoljenja za promet z zdravilom predloži pisno potrditev organizacije slepih in slabovidnih o pravilnosti slovenskih podatkov v Braillovi pisavi na obrazcu, ki ga na svoji spletni strani objavi JAZMP.
20. člen (dodatni podatki)
(1) Ovojnina lahko vsebuje dodatne podatke, simbole ali oznake za boljše razumevanje ter zdravstveno vzgojo, ki morajo biti v skladu s povzetkom glavnih značilnosti zdravila, ne sme pa vsebovati prvin oglaševanja.
(2) Ovojnina je lahko dodatno označena s kodo QR, ki se lahko uporablja le za posredovanje podatkov o zdravilu, ki so v skladu s prejšnjim odstavkom in jih je odobrila JAZMP oziroma EMA. Koda QR ne sme vplivati na berljivost podatkov, ki so zahtevani v tem poglavju pravilnika.
(3) JAZMP objavi podrobnejša navodila glede vključitve kode QR na ovojnino zdravil na svoji spletni strani.
III. NAVODILO ZA UPORABO
21. člen
(podatki v navodilu za uporabo)
(1) Navodilo za uporabo mora biti v slovenskem jeziku, sestavljeno v skladu s povzetkom glavnih značilnosti zdravila, in mora vsebovati podatke v naslednjem vrstnem redu:
1. podatke za istovetenje zdravila:
– ime zdravila, ki mu sledita jakost in farmacevtska oblika, ter, če je to ustrezno, navedbo ali je zdravilo za dojenčke, otroke ali odrasle.
Če zdravilo vsebuje do tri učinkovine, mora imenu praviloma slediti tudi mednarodno nelastniško ime (INN) v slovenskem ali latinskem jeziku, ali če to ne obstaja, običajno splošno ime;
– farmakoterapevtska skupina ali način delovanja zdravila v uporabniku razumljivem jeziku;
2. terapevtske indikacije;
3. podatke, ki jih je treba poznati pred uporabo zdravila: – kontraindikacije;
– ustrezne previdnostne ukrepe za uporabo zdravila;
– medsebojno delovanje z drugimi zdravili in druge oblike interakcij (npr. z alkoholom, tobakom, hrano), ki lahko vplivajo na delovanje zdravila;
– posebna opozorila. Pri
tem je treba:
– upoštevati posebna stanja določenih skupin uporabnikov (otroci, nosečnice, doječe matere, starostniki, osebe s specifičnimi patološkimi stanji);
– navesti vpliv na psihofizične sposobnosti;
– opisati tiste pomožne snovi, katerih poznavanje je pomembno za varno in učinkovito uporabo zdravila in navesti opozorila, ki izhajajo iz prisotnosti pomožnih snovi, zlasti tistih, ki jih določa Priloga tega pravilnika;
4. podatke, ki so potrebni za pravilno uporabo zdravila: – odmerjanje;
– postopek uporabe in, če je treba, pot uporabe;
– pogostnost uporabe (odmerjanja) in, če je treba, najprimernejši čas uporabe zdravila;
– trajanje zdravljenja, če ga je treba omejiti;
– ukrepe, ki jih je treba sprejeti v primeru prevelikega odmerjanja (npr. simptomi, nujni ukrepi);
– ukrepe, ki jih je treba sprejeti, kadar je bil eden ali več odmerkov izpuščen;
– navedbo tveganja ali simptomov, ki so posledica prenehanja jemanja zdravila, če je potrebno;
– posebno priporočilo, naj se uporabnik glede pojasnil o uporabi zdravila posvetuje z zdravnikom ali s farmacevtom; 5. neželene učinke. Treba je opisati neželene učinke, ki se lahko pojavijo pri predpisani uporabi zdravila in, če je potrebno, ukrepe, ki jih je treba sprejeti v tem primeru. Pacienta je treba izrecno pozvati, naj o kateremkoli neželenem učinku, ki ni naveden v navodilu za uporabo, obvesti svojega zdravnika ali farmacevta;
6. druge podatke:
– navedbo, da je datum izteka roka uporabnosti označen na ovojnini in opozorilo, da se zdravilo po datumu izteka roka uporabnosti ne sme uporabljati;
– rok uporabnosti zdravila, pripravljenega tik pred upora-bo ali po prvem odpiranju, če je potrebno;
– posebna navodila za shranjevanje, če so potrebna;
– opozorilo v zvezi z določenimi vidnimi znaki kvarjenja, če je potrebno;
– navedbo kakovostne sestave učinkovin in pomožnih snovi z njihovimi splošnimi imeni ter navedbo količinske sestave učinkovin, posebej za vsako jakost in farmacevtsko obliko zdravila;
– farmacevtsko obliko in vsebino pakiranja, izraženo v enotah mase, prostornine ali v številu enot zdravila;
– ime in naslov imetnika dovoljenja za promet z zdravilom in, če je primerno, ime predstavnika, ki ga imenuje imetnik dovoljenja za promet;
– ime in naslov proizvajalca;
– če je zdravilo pridobilo dovoljenje za promet z zdravilom po postopku z medsebojnim priznavanjem ali decentralizira-nem postopku pod različnimi imeni, seznam odobrenih imen v državah članicah Evropske unije;
– datum zadnje revizije navodila za uporabo.
(2) Zdravila, ki so na seznamu zdravil, za katera se zahteva dodatno spremljanje varnosti, ki ga v skladu s 23. členom Uredbe (ES) št. 726/2004 Evropskega parlamenta in Sveta z dne 31. marca 2004 o postopkih Skupnosti za pridobitev dovoljenja za promet in nadzor zdravil za humano in veterinarsko uporabo ter o ustanovitvi Evropske agencije za zdravila (UL L št. 136 z dne 30. 4. 2004, str. 1), zadnjič spremenjene z Uredbo (EU) št. 1027/2012 Evropskega parlamenta in Sveta z dne 25. oktobra 2012 o spremembi Uredbe (ES) št. 726/2004, kar zadeva farmakovigilanco (UL L št. 316 z dne 14. 11. 2012, str. 38), (v nadaljnjem besedilu: Uredba 726/2004/ES), objavlja EMA, morajo imeti na začetku navodila za uporabo natisnjen poln navzdol obrnjen trikotnik v črni barvi v skladu s 23. členom Uredbe 726/2004/ES. Simbolu sledi stavek »Za to zdravilo se izvaja dodatno spremljanje varnosti.« in standardna kratka obrazložitev.
(3) Vsa zdravila morajo imeti v navodilo za uporabo vključeno besedilo, ki spodbuja paciente, da zdravstvenim delavcem ali neposredno nacionalnemu centru za farmakovigilanco poročajo o vsakem domnevnem neželenem učinku zdravila, preko nacionalno dogovorjenih možnosti za poročanje, objavljenih na spletni strani http://www.ema.europa.eu/docs/en_GB/docu-ment_library/Template_or_form/2013/03/WC500139752.doc.
(4) Če so potrebni dodatni znanstveni podatki za zdravstvene delavce, lahko imetnik dovoljenja za promet z zdravilom:
– doda v zunanjo ovojnino povzetek glavnih značilnosti zdravila kot samostojen dokument ali
– v navodilo za uporabo doda poseben razdelek, v katerega vključi:
– celoten povzetek glavnih značilnosti zdravila ali
– pri parenteralnih in drugih zdravilih, ki jih dajejo zdravstveni delavci, podatke o rokovanju z zdravilom ali navodila o dajanju zdravila, namenjena zdravstvenim delavcem.
Pri tem mora zagotoviti, da je razdelek od ostalega navodila za uporabo ločen z luknjičasto zarezo in ga je mogoče z lahkoto odtrgati od zgornjega dela navodila za uporabo, ali pa je označeno mesto, kjer je treba razdelek odrezati (npr. s črto in narisanimi škarjami), besedilo razdelka pa se mora začeti z naslednjim stavkom: »Naslednje informacije so namenjene samo zdravstvenim delavcem:«.
22. člen
(dodatni podatki v navodilu za uporabo)
(1) Poleg podatkov iz prejšnjega člena, mora navodilo za uporabo zdravila, ki je pridobilo dovoljenje za promet po postopku z medsebojnim priznavanjem ali decentraliziranem postopku, vsebovati tudi podatek o načinu in režimu predpisovanja in izdaje zdravila.
(2) Podatek o načinu in režimu predpisovanja in izdaje zdravila mora biti naveden tudi v navodilu za uporabo zdravila, ki se daje v promet in je pridobilo dovoljenje za promet po nacionalnem postopku.
23. člen
(opremljanje esencialnih in nujno potrebnih zdravil,
ki nimajo dovoljenja za promet, z navodilom za uporabo v slovenskem jeziku)
(1) Navodilo za uporabo v slovenskem jeziku, ki je v skladu z 21. in 22. členom tega pravilnika, morajo imeti tudi esencialna in nujno potrebna zdravila, ki nimajo dovoljenja za promet, vendar je zanje JAZMP začasno dovolila promet v skladu s tretjim odstavkom 20. člena zakona oziroma izdala dovoljenje za vnos ali uvoz iz drugega odstavka 116. člena zakona, in se izdajajo v lekarnah. Za strokovno, jezikovno in oblikovno ustrezen slovenski prevod izvirnih navodil za upo-rabo, z upoštevanjem strokovne terminologije, uveljavljene v Republiki Sloveniji, je odgovoren pravni subjekt, ki opravlja začasen promet oziroma vnos ali uvoz teh zdravil.
(2) V navodilo za uporabo v slovenskem jeziku pri zdravilih iz prejšnjega odstavka se namesto imena in naslova imetnika dovoljenja za promet z zdravilom navede ime imetnika dovoljenja za začasen promet oziroma vnos ali uvoz tega zdravila. Kot datum zadnje revizije navodila se vpiše datum, ko je bilo potrjeno izvirno besedilo navodila za uporabo.
24. člen
(preverjanje jasnosti in razumljivosti)
(1) Navodilo za uporabo mora odražati izsledke posvetovanja s ciljnimi skupinami pacientov z namenom zagotoviti njegovo berljivost, jasnost, razumljivost in enostavnost za uporabo zdravila. To posvetovanje je lahko opravljeno v katerikoli državi članici Evropske unije, vendar se mora ustrezno odražati pri slovenskih prevodih.
(2) Berljivost, jasnost in razumljivost navodila za uporabo zdravil, ki že imajo dovoljenje za promet, so lahko preverjene tudi na druge načine (na primer: s primerljivostjo navodil za uporabo zdravil iz enake terapevtske skupine, pri katerih je bilo tako posvetovanje opravljeno). Ustreznost take primerjave potrdi JAZMP.
25. člen (posebne skupine zdravil)
(1) Radiofarmacevtski izdelki morajo imeti navodilo za uporabo v skladu s tem pravilnikom in v skladu s predpisom, ki ureja radiofarmacevtske izdelke.
(2) Zdravila rastlinskega izvora morajo imeti navodilo za uporabo v skladu s tem pravilnikom in v skladu s predpisom, ki ureja zdravila rastlinskega izvora.
(3) Homeopatska zdravila morajo imeti navodilo za upora-bo v skladu s tem pravilnikom in v skladu s predpisom, ki ureja homeopatska zdravila.
26. člen
(način opremljanja z navodilom za uporabo)
(1) Navodilo za uporabo mora biti vloženo v ovojnini oziroma mora biti nanjo pritrjeno tako, da skupaj z ovojnino predstavlja enovito celoto, razen če so vsi podatki iz 21. in 22. člena tega pravilnika natisnjeni na zunanji ovojnini, ali če zunanje ovojnine ni, na stični ovojnini.
(2) Navodilo za uporabo v slovenskem jeziku mora biti priloženo tudi v primerih opremljanja zdravila z nalepko iz 14. in 15. člena tega pravilnika v skladu z določbami prejšnjega odstavka.
27. člen
(izjeme pri navodilu za uporabo)
(1) Izjemoma lahko JAZMP na podlagi utemeljene zahteve predlagatelja dovoli za zdravila iz 16. člena tega pravilnika opremljanje z navodilom za uporabo v enem od jezikov držav članic Evropske unije, in sicer v latinici. Imetnik dovoljenja za promet z zdravilom mora uporabnika (zdravstveni zavod, zdravnika) oskrbeti z navodili v slovenskem jeziku oziroma ga pisno napotiti na uradno spletno stran z odobrenimi informacijami o zdravilu v slovenskem jeziku.
(2) Vlogo za izjeme iz prejšnjega odstavka je treba pri JAZMP vložiti vsako leto s priloženim spremnim dopisom z utemeljitvijo in navodilom za uporabo v predlaganem jeziku države članice Evropske unije.
(3) Pri zdravilih sirotah, ki so namenjena za izdajo v lekarni, mora biti navodilo za uporabo v slovenskem jeziku dostopno v elektronski obliki, zdravilu pa ob izdaji dodano v natisnjeni obliki.
28. člen (zahteve za podatke)
(1) Navodilo za uporabo mora biti uporabniku razumljivo, napisano v kratkih stavkih. Navodilo za uporabo z enako vsebino kot v slovenskem jeziku je lahko navedeno tudi v enem ali več jezikih držav članic Evropske unije ali drugih evropskih jezikih.
(2) Podatki na navodilu za uporabo morajo biti natisnjeni čitljivo in tako, da jih ni možno izbrisati.
(3) Za vsako farmacevtsko obliko in vsako jakost je treba praviloma napisati ločeno navodilo za uporabo. Navodilo za uporabo je lahko skupno za različne farmacevtske oblike ali različne jakosti le, če imajo enake ali podobne farmakokinetične lastnosti in se uporabljajo za iste indikacije, imajo enako pot uporabe (aplikacije), iste kontraindikacije, opozorila, previdnostne ukrepe in neželene učinke. Pomožne snovi morajo biti v tem primeru navedene za vsako farmacevtsko obliko, in, če je potrebno, za vsako jakost posebej.
(4) Pri zdravilih, ki se izdajajo brez recepta, je treba za vsako farmacevtsko obliko in jakost napisati ločeno navodilo za uporabo.
29. člen
(navodilo za uporabo za slepe in slabovidne)
(1) Imetnik dovoljenja za promet z zdravilom ali njegov predstavnik mora v sodelovanju z združenjem slepih in slabovidnih v Republiki Sloveniji ter lekarnami zagotoviti, da je zadnje odobreno navodilo za uporabo na voljo v oblikah, ki so primerne za slepe in slabovidne ter poskrbeti za prenos navodila v obliko, ki je, na podlagi mnenja JAZMP primerna za zadevnega slepega ali slabovidnega uporabnika ter njeno ustrezno dosegljivost na način, ki omogoča varovanje osebnih podatkov slepega ali slabovidnega.
(2) JAZMP objavi primerne oblike in načine zagotavljanja navodila za uporabo iz tega člena na svoji spletni strani.
30. člen (dodatni podatki)
(1) Navodilo za uporabo lahko vsebuje dodatne podatke, simbole ali oznake za boljše razumevanje ali zdravstveno vzgojo, ki morajo biti v skladu s povzetkom glavnih značilnosti zdravila, ne sme pa vsebovati prvin oglaševanja.
(2) Navodilo za uporabo lahko vsebuje tudi kodo QR, ki se lahko uporablja samo za posredovanje podatkov o zdravilu, ki so v skladu s prejšnjim odstavkom in jih je odobrila JAZMP oziroma EMA. Koda QR ne sme vplivati na berljivost podatkov v navodilu za uporabo, ki so zahtevani v tem poglavju tega pravilnika.
(3) JAZMP objavi podrobnejša navodila glede vključitve kode QR v navodilo za uporabo zdravil na svoji spletni strani.
31. člen (podrobnejša navodila)
(1) Podrobnejša navodila za pripravo vsebine podatkov na ovojnini in v navodilu za uporabo, skupaj s predlogami ovojnine in navodila za uporabo za zdravila, ki so ali bodo pridobila dovoljenje za promet po centraliziranem postopku, postopku z medsebojnim priznavanjem in decentraliziranim postopkom in se smiselno uporabljajo tudi pri zdravilih, ki so dovoljenje za promet pridobila po nacionalnem postopku, so dostopna na spletnem naslovu http://www.ema.eu-ropa.eu/ema/index.jsp?curl=pages/regulation/document_li-sting/document_listing_000134.jsp.
(2) Slog pisanja, velikost in oblika črk, uporabljene barve, stilistične rešitve ter oblika navodila za uporabo in ovojnine morajo zagotavljati ustrezno čitljivost, razumljivost in berljivost in so opredeljeni v veljavni smernici »Guideline on the Readability of the Label And Package Leaflet of medicinal products for human use« na spletnem naslovu http://ec.europa.eu/ health/documents/eudralex/ vol-2/in-dex_en.htm in na spletni strani JAZMP.
IV. SPREMEMBE OZNAČEVANJA ZDRAVIL IN NAVODIL ZA UPORABO
32. člen
(spremembe besedila označevanja zdravil in navodil za uporabo)
(1) Spremembe besedila označevanja zdravil in navodil za uporabo, ki niso v povezavi s povzetkom glavnih značilnosti zdravila, se priglasijo JAZMP.
(2) Glede sprememb označevanja zdravil, ki se nanašajo le na splošen videz in obliko, se uporablja 33. člen tega pravilnika.
(3) Vloga za priglasitev spremembe iz prvega odstavka tega člena vsebuje spremni dopis z obrazložitvijo spremembe, predlog spremenjenega označevanja oziroma navodila za uporabo z označenimi spremembami in njihov čistopis.
(4) Za spremembe, ki niso v povezavi s povzetkom glavnih značilnosti zdravila, se šteje, da jih imetnik dovoljenja za promet z zdravilom lahko uveljavi, če jim JAZMP v 90 dneh po prejemu popolne vloge ne nasprotuje.
(5) Če se spremembe označevanja zdravil nanašajo le na uvedbo podatkov v Braillovi pisavi, se šteje, da jih imetnik dovoljenja za promet z zdravilom lahko uveljavi, če jim JAZMP v 30 dneh po prejemu popolne vloge ne nasprotuje.
33. člen
(spremembe splošnega videza in oblike barvnih osnutkov ovojnine)
(1) Spremembe splošnega videza in oblike barvnih osnutkov ovojnine se priglasijo JAZMP.
(2) Vloga za priglasitev spremembe iz prejšnjega odstavka vsebuje spremni dopis z obrazložitvijo spremembe, zadnji odobreni barvni osnutek ovojnine in predlagan nov barvni osnutek ovojnine.
(3) Za spremembe, ki so v povezavi s splošnim videzom in obliko barvnih osnutkov ovojnine, se šteje, da jih imetnik dovoljenja za promet z zdravilom lahko uveljavi, če jim JAZMP v 30 dneh po prejemu popolne vloge ne nasprotuje.
34. člen
(sprememba posebnih oznak zdravila)
(1) Sprememba posebnih oznak zdravila se lahko obravnava na predlog imetnika dovoljenja za promet z zdravilom ali po uradni dolžnosti.
(2) Vloga za odobritev spremembe posebnih oznak na predlog imetnika dovoljenja za promet z zdravilom vsebuje:
– spremni dopis;
– strokovno utemeljitev spremembe posebnih oznak, ki dokazuje, da zdravilo izpolnjuje pogoje za spremembo posebnih oznak v skladu s tem pravilnikom;
– predlog posodobljene ovojnine z označenimi spremembami in čistopis.
(3) Določbe tega člena, razen tretje alinee prejšnjega člena se uporabljajo tudi za spremembo posebnih oznak za zdravila, ki so dovoljenje za promet pridobila po centraliziranem postopku.
(4) JAZMP o spremembi odloči v 60 dneh po prejemu popolne vloge.
V. PREHODNE IN KONČNA DOLOČBA
35. člen
(koda za identifikacijo)
(1) Določbe 3. točke prvega odstavka 6. člena tega pravilnika prenehajo veljati tri leta od dneva objave delegiranih aktov Evropske komisije, ki na podlagi Direktive 2011/62/ES določajo značilnosti in tehnične specifikacije za zaščitne elemente in sezname zdravil ali kategorij zdravil, ki morajo ali jim ni treba nositi zaščitnega elementa.
(2) Ne glede na določbe prejšnjega odstavka, za zdravila, ki jim ni treba nositi zaščitnega elementa, določbe 3. točke prvega odstavka 6. člena tega pravilnika veljajo tudi po uveljavitvi delegiranih aktov Evropske komisije.
(3) Do uveljavitve delegiranih aktov Evropske komisije iz prvega odstavka tega člena so zdravila označena z enodimenzionalno kodo za identifikacijo.
(4) JAZMP določa številke GTIN za kodo za identifikacijo zdravila še tri leta od dneva objave delegiranih aktov Evropske komisije iz prvega odstavka tega člena. Po tem datumu mora kodo za identifikacijo zdravila, za katero označevanje v skladu z določbami delegiranih aktov ni potrebno, zagotoviti imetnik dovoljenja za promet z zdravilom.
36. člen (prenehanje veljavnosti)
Z dnem uveljavitve tega pravilnika preneha veljati Pravilnik o označevanju in navodilu za uporabo zdravil za uporabo v humani medicini (Uradni list RS, št. 21/12 in 52/12).
37. člen (začetek veljavnosti)
Ta pravilnik začne veljati petnajsti dan po objavi v Ura-dnem listu Republike Slovenije.
Št. 0070-32/2014
Ljubljana, dne 16. junija 2014 EVA 2014-2711-0042
v funkciji ministrice za zdravje mag. Alenka Bratušek l.r. Predsednica vlade
“,”Jaka Verbic Miklic”,1521983940,1521983940,sl,12434,306,12415,43,0,NULL,,”Pravilnik o označevanju in navodilu za uporabo zdravil za uporabo v humani medicini, UL št. 57/2014, 25. 7. 2014″,pravilnik-o-oznacevanju-in-navodilu-za-uporabo-zdravil-za-uporabo-v-humani-medicini-ul-st-57-2014-25-7-2014,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521984012,1523614723
263,12435,”Pravilnik o farmakovigilanci zdravil za uporabo v humani medicini “,”UL 57/2014, 25/07/2014″,”
Na podlagi 39. točke 6. člena, 137. člena, četrtega od-stavka 138. člena in drugega odstavka 140. člena Zakona o zdravilih (Uradni list RS, št. 17/14) ministrica za zdravje izdaja
P R A V I L N I K
o farmakovigilanci zdravil za uporabo v humani medicini
I. SPLOŠNE DOLOČBE
1. člen (področje urejanja)
(1) Ta pravilnik v skladu z Direktivo 2001/83/ES Evrop-skega parlamenta in Sveta z dne 6. novembra 2001 o zakoni-ku Skupnosti o zdravilih za uporabo v humani medicini (UL L št. 311 z dne 28. 11. 2001, str. 67), zadnjič spremenjeno z Direktivo 2012/26/EU Evropskega parlamenta in Sveta z dne 25. oktobra 2012 o spremembi Direktive 2001/83/ES, kar zade-va farmakovigilanco (UL L št. 299 z dne 27. 10. 2012, str. 1); (v nadaljnjem besedilu: Direktiva 2001/83/ES) in Izvedbene ured-be Komisije (EU) št. 520/2012 z dne 19. junija 2012 o izvajanju dejavnosti na področju farmakovigilance, določenih v Uredbi (ES) št. 726/2004 Evropskega parlamenta in Sveta ter Direktivi 2001/83/ES Evropskega parlamenta (UL L št. 159 z dne 20. 6. 2012, str. 5; v nadaljnjem besedilu: Uredba 520/2012/EU) natančneje ureja sistem farmakovigilance na področju zdravil za uporabo v humani medicini (v nadaljnjem besedilu: zdravil), in sicer:
– način poročanja o neželenih učinkih zdravila;
– način zbiranja, ocenjevanja in vrednotenja neželenih učinkov zdravila in drugih podatkov o farmakovigilanci
zdravila; – način ukrepanja z namenom obvladovanja in zmanjševanja tveganja, povezanega z zdravilom;
– obveznosti imetnika dovoljenja za promet z zdravilom in imetnika začasnega dovoljenja za promet z zdravilom (v nadaljnjem besedilu: imetnik dovoljenja za promet z zdravilom), imetnika dovoljenja za promet z zdravili na debelo, proizvajal-ca, ki ima dovoljenje za uvoz zdravila, imetnika dovoljenja za promet s paralelno uvoženim zdravilom, imetnika potrdila o priglasitvi paralelne distribucije in imetnika dovoljenja za soču-tno uporabo zdravila;
– naloge nacionalnega centra za farmakovigilanco;
– naloge Javne agencije Republike Slovenije za zdravila in medicinske pripomočke (v nadaljnjem besedilu: JAZMP) na področju farmakovigilance;
– podrobnejše pogoje za pridobitev soglasja k osnutku protokola za neintervencijsko klinično preskušanje zdravila iz 138. člena Zakona o zdravilih (Uradni list RS, št. 17/14; v na-daljnjem besedilu: zakon) (v nadaljnjem besedilu: neinterven-cijska študija o varnosti zdravila).
(2) Farmakovigilanco nerutinsko pripravljenega zdravila za napredno zdravljenje ureja 82. člen zakona.
2. člen (natančnejša navodila)
Natančnejša navodila za imetnika dovoljenja za promet z zdravilom in JAZMP za upravljanje sistema farmakovigilance so določena v smernicah o dobri praksi na področju farmako-vigilance, objavljenih na spletni strani Evropske agencije za zdravila
h t t p : / / w w w . e m a . e u r o p a . e u / e m a / i n d e x . jsp?curl=pages/regulation/document_listing/document_li-sting_000345.jsp&mid=WC0b01ac058058f32c.
3. člen (pomen izrazov)
Poleg izrazov, ki so opredeljeni v 5. in 6. členu zakona, se v tem pravilniku uporabljajo še naslednji izrazi, ki imajo naslednji pomen:
1. Ocenjevanje poročila o neželenem učinku zdravila je preverjanje poročila glede izpolnjevanja zahtev iz prvega od-stavka 5. člena tega pravilnika, ugotavljanje resnosti, pričako-vanosti in vzročne povezanosti domnevnega neželenega učin-ka z zadevnim zdravilom. Vključuje tudi začetno ocenjevanje poročila, pridobitev podatkov potrebnih za oceno, če poročilo ne vsebuje dovolj podatkov, nadaljnje spremljanje podatkov o domnevnem neželenem učinku zdravila in vodenje podrobne dokumentacije.
2. Odbor za oceno tveganja na področju farmakovigilance (PRAC – Pharmacovigilance Risk Assessment Committee) je strokovni organ pri Evropski agenciji za zdravila (v nadaljnjem besedilu: EMA), ki je pristojen za ocenjevanje in spremljanje varnosti zdravil za uporabo v humani medicini in je sestavljen iz predstavnikov držav članic Evropske unije (v nadaljnjem bese-dilu: EU), posamično imenovanih strokovnjakov, predstavnikov združenj zdravstvenih delavcev in organizacij pacientov.
3. Odbor za zdravila za uporabo v humani medicini (CHMP – Committee for Medicinal Products for Human Use) je strokovni organ pri EMA, ki je pristojen za oceno zdravil za uporabo v humani medicini in je sestavljen iz predstavnikov držav članic EU in posamično imenovanih strokovnjakov.
4. Poročevalec je oseba, ki poroča o domnevnem neže-lenem učinku zdravila.
5. Redno posodobljeno poročilo o varnosti zdravila je ob-časno poročilo, ki ga v naprej določenih obdobjih ali na zahtevo JAZMP, predloži imetnik dovoljenja za promet z zdravilom, in vsebuje predpisane podatke o varnosti zdravila ter oceno raz-merja med koristjo in tveganjem.
6. Resen domnevni neželeni učinek zdravila je tudi neže-leni
učinek, ki ima za posledico drugo, po medicinski presoji, pomembno klinično stanje.
7. Seznam referenčnih datumov EU in pogostnosti oddaje rednih posodobljenih poročil o varnosti zdravil (EURD list – List of European Union Reference Dates and frequency of submis-sion of Periodic safety update reports) (v nadaljnjem besedilu: Seznam referenčnih datumov EU) je seznam, ki ga v skladu s sedmim odstavkom 107c. člena Direktive 2001/83/ES objavlja EMA na evropskem spletnem portalu o zdravilih vzpostavlje-nem v skladu s 26. členom Uredbe (ES) št. 726/2004 Evropskega parlamenta in Sveta z dne 31. marca 2004 o postopkih Skupnosti za pridobitev dovoljenja za promet in nadzor zdravil za humano in veterinarsko uporabo ter o ustanovitvi Evropske agencije za zdravila (UL L št. 136 z dne 30. 4. 2004, str. 1) zadnjič spremenjeno z Uredbo (EU) št. 1027/2012 Evropske-ga parlamenta in Sveta z dne 25. oktobra 2012 o spremembi Uredbe (ES) št. 726/2004, kar zadeva farmakovigilanco (UL L št. 316 z dne 14. 11. 2012, str. 38), (v nadaljnjem besedilu: Uredba 726/2004/ES).
8. Skupina za usklajevanje je skupina, ki deluje v imenu organov, pristojnih za zdravila v državah članicah EU. Preučuje vprašanja, povezana s pridobitvijo in vzdrževanjem dovoljenj za promet z zdravilom po postopku z medsebojnim priznavanjem in decentraliziranem postopku ter farmakovigilanco zdravil.
9. Varnostni signal je informacija, ki se pridobi iz enega ali več virov, vključno z opazovanjem in eksperimenti, in ki nakazuje novo morebitno vzročno povezanost ali nov vidik znane vzročne povezanosti med izpostavljenostjo zdravilu in dogodkom ali vrsto povezanih dogodkov, neželenih ali koristnih, za katerega se pre-sodi, da je dovolj verjeten, da upraviči preverjanje.
10. Znanstveno vrednotenje poročila o domnevnem neže-lenem učinku zdravila je obravnava poročila po oceni poročila, za ovrednotenje morebitnega vpliva na razmerje med koristjo in tveganjem ob upoštevanju ostalih farmakovigilančnih podatkov in kliničnih koristi zdravila.
II. NALOGE ZDRAVSTVENIH DELAVCEV
4. člen
(poročanje o domnevnih neželenih učinkih zdravil)
(1) Zdravstveni delavec poroča nacionalnemu centru za farmakovigilanco o domnevnih neželenih učinkih zdravil v skla-du s prvim in drugim odstavkom 129. člena zakona.
(2) Zdravstveni delavec poroča tudi:
– kadar je uporaba zdravila povzročila ali sumi, da je povzročila škodljivo medsebojno delovanje z drugim zdravilom;
– o kakršnemkoli sumu na povečanje pogostnosti pojavljanja domnevnega neželenega učinka zdravila;
– o sumu na neučinkovitost zdravila, katere posledica je ocenjena kot klinično pomembna.
(3) Zdravstveni delavec domnevne neželene učinke iz prvega in drugega odstavka tega člena poroča nacionalnemu centru za farmakovigilanco takoj, najpozneje pa v 15 dneh od ugotovitve.
(4) Če zdravstveni delavec o domnevnem neželenem učinku, ki se nanaša na uporabo cepiva, poroča inštituciji, ki v skladu s predpisi o zbirkah podatkov s področja zdravstvene-ga varstva vodi register neželenih učinkov po cepljenju, le ta posreduje poročila nacionalnemu centru za farmakovigilanco. Domnevne resne neželene učinke posreduje takoj ali najpozneje v sedmih dneh, domnevne neželene učinke cepiv, ki niso resni, pa takoj ali najpozneje v 15 dneh od prejema obvestila o domnevnem neželenem učinku.
(5) JAZMP posreduje poročila o domnevnih neželenih učinkih cepiv, ki jih je prejela neposredno, inštituciji, ki v skladu s predpisi o zbirkah podatkov s področja zdravstvenega varstva vodi register neželenih učinkov po cepljenju.
(6) Poročilo o domnevnem neželenem učinku zdravila se posreduje na način, kot je objavljeno na spletni strani JAZMP: http://www.jazmp.si.
5. člen
(oblika in vsebina poročila o neželenem učinku zdravila)
(1) Poročilo o domnevnem neželenem učinku zdravila vsebuje najmanj naslednje podatke:
– podatke o zadevnem zdravilu (ime, farmacevtska oblika, jakost, indikacija, za katero je bilo zdravilo predpisano, način aplikacije, trajanje zdravljenja);
– opis domnevnega neželenega učinka zdravila; –
podatke o poročevalcu;
– podatke o pacientu v kodirani obliki (začetnice imena in priimka in/ali starost in/ali datum rojstva, spol);
– številko serije zdravila, če se poročilo o domnevnem neželenem učinku nanaša na biološko zdravilo.
(2) Poročevalec zagotovi vse morebitne dodatne podatke, potrebne za oceno in vrednotenje domnevnega neželenega učinka zdravila, če ga k temu pozove JAZMP ali nacionalni center za farmakovigilanco.
6. člen (zaupnost podatkov)
(1) Osebni podatki iz prejšnjega člena se obravnavajo kot zaupni in se lahko uporabljajo le za izvajanje zakona, tega pravilnika in ukrepov, potrebnih za zagotavljanje varnosti in učinkovitosti zdravil.
(2) Poročilo o domnevnem neželenem učinku zdravila iz prvega in drugega odstavka 4. člena tega pravilnika se obrav-nava kot zaupen dokument, ki ni podlaga za oceno odgovor-nosti zdravstvenega delavca, ki je zdravilo predpisal ali izdal.
III. NALOGE IMETNIKA DOVOLJENJA ZA OPRAVLJANJE DEJAVNOSTI PROMETA Z ZDRAVILI NA DEBELO, PROIZVAJALCA, KI IMA DOVOLJENJE ZA UVOZ ZDRAVILA, IMETNIKA DOVOLJENJA S PARALELNO UVOŽENIM ZDRAVILOM, IMETNIKA POTRDILA O PRIGLASITVI PARALELNE DISTRIBUCIJE IN IMETNIKA DOVOLJENJA ZA SOČUTNO UPORABO ZDRAVILA
7. člen
(poročanje o domnevnih neželenih učinkih zdravil)
(1) Imetnik dovoljenja za opravljanje dejavnosti prometa z zdravili na debelo, proizvajalec, ki ima dovoljenje za uvoz zdravila, imetnik dovoljenja s paralelno uvoženim zdravilom, imetnik potrdila o priglasitvi paralelne distribucije in imetnik dovoljenja za sočutno uporabo zdravila, o domnevnih neželenih učinkih zdravil iz prvega in drugega odstavka 4. člena tega pra-vilnika poroča nacionalnemu centru za farmakovigilanco takoj, najpozneje pa v 15 dneh od prejema poročila o domnevnem neželenem učinku zdravila.
(2) Poročilo o domnevnem neželenem učinku zdravila se posreduje na način, kot je objavljeno na spletni strani JAZMP: http://www.jazmp.si.
(3) Poslovni subjekt iz prvega odstavka tega člena takoj ali najpozneje v 24 urah po prejemu obvestila, ki zahteva nujno ukrepanje zaradi neposrednega ogrožanja javnega zdravja, obvesti nacionalni center za farmakovigilanco in JAZMP.
8. člen
(objava informacij o vprašanjih farmakovigilance)
Poslovni subjekt iz prvega odstavka prejšnjega člena pri obveščanju javnosti o informacijah o vprašanjih farmakovigilan-ce smiselno uporablja 17. člen tega pravilnika.
9. člen
(ukrepi za zmanjševanje tveganj)
(1) Poslovni subjekt iz prvega odstavka 7. člena tega pra-vilnika izvede ukrepe, ki mu jih za zmanjševanje ali preprečeva – nje tveganj v zvezi s farmakovigilanco zdravila naloži JAZMP.
(2) Poslovni subjekt iz prvega odstavka 7. člena tega pravilnika pri obveščanju strokovne javnosti smiselno upošteva četrti, peti in šesti odstavek 16. člena tega pravilnika.
IV. NALOGE IMETNIKA DOVOLJENJA ZA PROMET Z ZDRAVILOM
10. člen
(oseba, odgovorna za sistem farmakovigilance)
(1) Oseba, odgovorna za sistem farmakovigilance:
– je odgovorna za vzpostavitev in vzdrževanje sistema farmakovigilance na način, ki zagotavlja zbiranje in primerjavo podatkov o vseh domnevnih neželenih učinkih zdravila;
– ima zagotovljen dostop do glavnega dosjeja o sistemu farmakovigilance in zadostno pristojnost za zagotavljanje, da je vsebina glavnega dosjeja o sistemu farmakovigilance točen in redno posodobljen odraz sistema farmakovigilance;
– ima zadostno pristojnost, da vpliva na izvajanje sistema kakovosti in dejavnosti farmakovigilance;
– ima pregled nad varnostnimi profili zdravil in varnostnimi vprašanji ter upošteva in spremlja pogoje dovoljenja za promet z zdravili in druge obveznosti, ki zadevajo varnost zdravil ter ukrepe za zmanjševanje tveganj;
– ima zadostno pristojnost glede vsebine načrtov za ob-vladovanje tveganj;
– sodeluje pri pregledu in odobritvi protokolov kliničnih preskušanj zdravil po pridobitvi dovoljenja za promet z zdra-vilom;
– zagotavlja ustrezno kakovost, pravilnost in popolnost podatkov o farmakovigilanci zdravila, ki so predloženi JAZMP, ter na vse zahteve JAZMP za predložitev dodatnih podatkov, potrebnih za vrednotenje koristi in tveganj, povezanih z zdravi-lom, odgovori v celoti in takoj, vključno s predložitvijo podatkov o obsegu prodaje;
– predloži JAZMP vse druge informacije, ki so pomembne za oceno koristi in tveganj, povezanih z zdravilom, vključno z ustreznimi podatki iz kliničnih preskušanj zdravila po pridobitvi dovoljenja za promet;
– zagotavlja 24-urno razpoložljivost.
(2) Imetnik dovoljenja za promet z zdravilom JAZMP spro-ti obvešča o spremembah glede odgovorne osebe za sistem farmakovigilance in o spremembi njenih kontaktnih podatkov v skladu s podzakonskim predpisom, ki ureja dovoljenje za promet z zdravilom za uporabo v humani medicini.
(3) Imetnik dovoljenja za promet z zdravilom, ki nima sedeža v Republiki Sloveniji in ima določeno kontaktno osebo za farmakovigilanco v Republiki Sloveniji, obvesti JAZMP o tej kontaktni osebi in sproti posreduje vse spremembe, ki se nanašajo nanjo.
(4) JAZMP lahko zahteva imenovanje kontaktne osebe za farmakovigilanco v Republiki Sloveniji, kadar v postopku in-špekcijskega nadzora ugotovi, da imetnik dovoljenja za promet z zdravilom iz prejšnjega odstavka naloge farmakovigilance na ozemlju Republike Slovenije ne izvaja v skladu z določbami zakona in tega pravilnika.
11. člen
(vodenje dokumentacije o domnevnih neželenih učinkih zdravil)
(1) Imetnik dovoljenja za promet z zdravilom vodi po-drobno dokumentacijo o vseh domnevnih neželenih učinkih zdravil v EU ali v tretjih državah, o katerih poročajo zdravstveni delavci, pacienti ali drugi poslovni subjekti, ali pa se pojavijo v okviru kliničnega preskušanja zdravila po pridobitvi dovoljenja za promet z zdravilom.
(2) Imetnik dovoljenja za promet z zdravilom zagotovi dostopnost podatkov iz prejšnjega odstavka na enem mestu v EU.
12. člen
(poročanje o domnevnih neželenih učinkih zdravil)
(1) Imetnik dovoljenja za promet z zdravilom:
– elektronsko posreduje poročila o domnevnih resnih ne-želenih učinkih zdravil, ki se pojavijo v EU in v tretjih državah, v podatkovno bazo EudraVigilance najpozneje v 15 dneh po prejemu obvestila o domnevnem neželenem učinku zdravila;
– elektronsko posreduje poročila o domnevnih neželenih učinkih zdravil, ki niso resni, ki se pojavijo v EU, v podatkovno bazo EudraVigilance najpozneje v 90 dneh po prejemu obvestila o domnevnem neželenem učinku zdravila;
– vzpostavi postopke za pridobitev natančnih in preverljivih podatkov za znanstveno vrednotenje poročil o domnevnih neželenih učinkih zdravil, zbira nadaljnje podatke o teh poro-čilih in posodobljene informacije posreduje v podatkovno bazo EudraVigilance;
– sodeluje z JAZMP in EMA pri odkrivanju dvojnikov poročil o domnevnih neželenih učinkih zdravil;
– spremlja medicinsko in znanstveno literaturo v Republiki Sloveniji, ki ni na seznamu publikacij, ki jih spremlja EMA, in po-roča o domnevnih neželenih učinkih zdravil v podatkovno bazo EudraVigilance najpozneje v 15 dneh po prejemu obvestila o domnevnem neželenem učinku zdravila;
– takoj ali najpozneje v 24 urah po prejemu obvestila o domnevnih resnih neželenih učinkih zdravila, ki zahtevajo nujno ukrepanje zaradi neposrednega ogrožanja javnega zdravja, obvesti JAZMP.
(2) Poleg nalog iz prejšnjega odstavka, imetnik dovoljenja za promet z zdravilom izpolnjuje dodatne zahteve glede poročanja o domnevnih neželenih učinkih zdravil, ki mu jih na podlagi utemeljenih razlogov, ki izhajajo iz sistema farmakovigilance, naloži JAZMP.
13. člen
(redno posodobljeno poročilo o varnosti zdravila)
(1) Imetnik dovoljenja za promet z zdravilom predloži redno posodobljeno poročilo o varnosti zdravila v skladu s po-gostnostjo in datumi predložitve, določenimi z dovoljenjem za promet z zdravilom. Pogostnost oddaje in datumi predložitve veljajo, dokler z dovoljenjem za promet z zdravilom ni določeno drugače.
(2) Imetnik dovoljenja za promet z zdravilom v skladu z osmo alinejo prvega odstavka 133. člena zakona, elektron-sko posreduje redno posodobljeno poročilo o varnosti zdravila EMA.
(3) Ne glede na prvi odstavek tega člena, imetnik do-voljenja za promet z zdravilom iz 45., 47., drugega odstavka 52. člena in drugega odstavka 53. člena zakona predloži redno posodobljeno poročilo o varnosti zdravila le v naslednjih primerih:
– kadar je obveznost predložitve določena kot pogoj v dovoljenju za promet z zdravilom;
– ko to zahteva JAZMP zaradi farmakovigilančnih ra-zlogov ali ker ni na voljo dovolj rednih posodobljenih poročil o varnosti za zadevno učinkovino, po tem, ko je bilo izdano dovoljenje za promet z zdravilom;
– če je učinkovina na Seznamu referenčnih datumov EU. (4) Imetnik dovoljenja za promet z zdravilom, za zdravilo,
ki je pridobilo dovoljenje za promet pred 21. julijem 2012, in za katero pogostnost oddaje in datumi predložitve rednega posodobljenega poročila o varnosti zdravila niso določeni z dovoljenjem za promet, predloži redno posodobljeno poročilo o varnosti zdravila:
– takoj, če to zahteva JAZMP;
– najmanj vsakih šest mesecev po izdaji dovoljenja za promet v obdobju pred dajanjem zdravila na trg;
– po začetku dajanja zdravila na trg:
– najmanj vsakih šest mesecev v prvih dveh letih;
– po preteku dveh let po začetku dajanja zdravila na trg enkrat letno v naslednjih dveh letih;
– po preteku štirih let po začetku dajanja zdravila na trg v triletnih intervalih.
(5) Pogostnost oddaje in datumi predložitve rednega po-sodobljenega poročila o varnosti zdravila iz prvega, tretjega in četrtega odstavka tega člena se lahko spremenijo, kadar sta za učinkovino ali kombinacijo učinkovin določena usklajena pogostnost za predložitev in referenčni datum EU, da se omo-goči enotna ocena v povezavi s postopkom delitve dela, in sta objavljena na spletni strani EMA. Imetnik dovoljenja za promet z zdravilom v tem primeru JAZMP predloži vlogo za spremem-bo dovoljenja za promet z zdravilom v skladu s podzakonskim predpisom, ki ureja dovoljenje za promet z zdravilom za upo-rabo v humani medicini.
(6) Imetnik dovoljenja za promet z zdravilom lahko iz farmakovigilančnih razlogov, ali da se prepreči podvajanje ocenjevanja, ali da se doseže mednarodna usklajenost, Odboru za zdravila za uporabo v humani medicini ali Skupini za usklajevanje predloži zahtevo za določitev referenčnega datuma EU ali za spremembo pogostnosti predložitve rednega posodobljenega poročila o varnosti zdravila. Vlogo predloži pisno in jo ustrezno utemelji.
(7) Imetnik dovoljenja za promet z zdravilom spremlja Seznam referenčnih datumov EU glede sprememb datumov ali pogostnosti predložitve rednega posodobljenega poročila o varnosti zdravila na evropskem spletnem portalu o zdravilih in če je potrebno, JAZMP predloži vlogo za spremembo dovoljenja za promet z zdravilom v skladu s podzakonskim predpisom, ki ureja dovoljenje za promet z zdravilom za uporabo v humani medicini.
(8) Vsaka sprememba datumov in pogostnosti predložitve rednih posodobljenih poročil o varnosti zdravila iz razlogov iz petega, šestega in sedmega odstavka tega člena začne veljati šest mesecev od dneva objave Seznama referenčnih datumov EU na evropskem spletnem portalu o zdravilih.
(9) Redno posodobljeno poročilo o varnosti zdravila vsebuje:
– povzetke podatkov, pomembnih za koristi in tveganja zdravila, vključno z rezultati kliničnih preskušanj po pridobitvi dovoljenja za promet z zdravilom ob upoštevanju morebitnega vpliva na dovoljenje za promet z zdravilom;
– znanstveno vrednotenje razmerja med koristjo in tvega-njem zdravila, ki temelji na vseh razpoložljivih podatkih, vključ-no s podatki iz kliničnih preskušanj pri neodobrenih indikacijah in populacijah;
– vse podatke, ki se nanašajo na obseg prodaje zdravila in vse podatke, ki jih ima imetnik dovoljenja za promet z zdravilom o številu receptov, vključno z oceno o tem, koliko prebivalstva je izpostavljenega zdravilu.
14. člen (zaznavanje varnostnih signalov)
(1) Imetnik dovoljenja za promet z zdravilom spremlja vse razpoložljive podatke o farmakovigilanci zdravila z namenom ugotavljanja ali je prišlo do novih tveganj, ali so se tveganja spremenila in ali pri posameznem zdravilu vplivajo na razmerje med koristjo in tveganjem.
(2) Imetnik dovoljenja za promet z zdravilom podatke iz prejšnjega odstavka spremlja s pogostnostjo, ki je sorazmerna z opredeljenim tveganjem, možnimi tveganji in potrebi po dodatnih informacijah v skladu s smernicami iz 2. člena tega pravilnika.
(3) Imetnik dovoljenja za promet z zdravilom obvesti JAZMP o ugotovljenih novih ali spremenjenih tveganjih in o vplivu na spremembo razmerja med koristjo in tveganjem zdravila.
15. člen
(sistem obvladovanja tveganj)
(1) Imetnik dovoljenja za promet z zdravilom upravlja in posodablja sistem obvladovanja tveganj za vsako zdravilo, razen za zdravila iz drugega odstavka 203. člena zakona.
(2) Imetnik dovoljenja za promet z zdravilom spremlja izid ukrepov za zmanjševanje tveganj iz načrta za obvladovanje tveganj in ukrepov, določenih z dovoljenjem za promet z zdravilom na podlagi 58. člena zakona.
(3) Imetnik dovoljenja za promet z zdravilom iz drugega odstavka 203. člena zakona, na podlagi utemeljene zahteve JAZMP, predloži načrt za obvladovanje tveganj, ki ga bo uvedel za zadevno zdravilo.
(4) Imetnik dovoljenja za promet z zdravilom lahko v 30 dneh od prejema pisnega obvestila o naloženi obveznosti JAZMP zaprosi, da predloži pisna pojasnila kot odgovor na naloženo obveznost iz prejšnjega odstavka.
(5) Imetnik dovoljenja za promet z zdravilom predloži odgovor na naloženo obveznost iz prejšnjega odstavka v roku, ki ga določi JAZMP.
(6) JAZMP na podlagi predloženih pisnih pojasnil umakne ali potrdi obveznost predložitve načrta za obvladovanje tveganj za zadevno zdravilo.
16. člen
(dodatni ukrepi za zmanjševanje tveganj)
(1) Imetnik dovoljenja za promet z zdravilom izvaja dodatne ukrepe za zmanjševanje tveganj iz sistema obvladovanja tveganj v skladu s smernicami iz 2. člena tega pravilnika.
(2) Imetnik dovoljenja za promet z zdravilom pred začet-kom izvajanja dodatnih ukrepov za zmanjševanje tveganj iz prejšnjega odstavka pridobi soglasje JAZMP, ne glede na vrsto postopka pridobitve dovoljenja za promet z zdravilom.
(3) Imetnik dovoljenja za promet z zdravilom predloži JAZMP izobraževalno gradivo za zdravstvene delavce ali paciente, ki je v skladu s smernicami iz 2. člena tega pravilnika del dodatnih ukrepov za zmanjševanje tveganj, ter navede ciljne skupine za posredovanje izobraževalnega gradiva, na-čin posredovanja in časovni okvir posredovanja. Če JAZMP v 30 dneh ne zahteva dopolnitev ali sprememb, se šteje, da je izobraževalno gradivo primerno.
(4) Imetnik dovoljenja za promet z zdravilom strokovno javnost obvešča o vprašanjih farmakovigilance z neposrednim obvestilom za zdravstvene delavce v skladu s smernicami iz 2. člena tega pravilnika oziroma jo mora obveščati, če tako zahteva JAZMP.
(5) Imetnik dovoljenja za promet z zdravilom neposredno obvestilo za zdravstvene delavce iz prejšnjega odstavka posreduje v soglasju z JAZMP glede vsebine, ciljnih skupin, načina obveščanja in časovnega okvira obveščanja.
(6) Ovojnica z obvestilom, poslanim v skladu s četrtim in petim odstavkom tega člena, mora biti jasno označena z naslednjim opozorilom v rdeči barvi: »Pomembno obvestilo o varnosti zdravila«.
(7) Izobraževalno gradivo iz tretjega odstavka tega člena in neposredno obvestilo za zdravstvene delavce iz četrtega odstavka tega člena ne vsebuje prvin oglaševanja.
(8) Imetnik dovoljenja za promet z zdravilom izvede druge ukrepe, ki mu jih za zmanjševanje ali preprečevanje tveganj naloži JAZMP.
(9) Na zahtevo JAZMP, imetnik dovoljenja za promet z zdravilom predloži oceno učinkovitosti dodatnih ukrepov za zmanjševanje tveganj.
(10) Če se izobraževalno gradivo iz tretjega odstavka tega člena ali neposredno obvestilo za zdravstvene delavce iz četrtega odstavka tega člena nanaša na zdravilo, ki je na seznamu zdravil, za katera se zahteva dodatno spremljanje varnosti, ki ga v skladu s 23. členom Uredbe 726/2004/ES objavlja EMA, gradivo vključuje poln navzdol obrnjen trikotnik v črni barvi. Simbolu sledi stavek »Za to zdravilo se izvaja dodatno spremljanje varnosti.« in standardna kratka obrazložitev v skladu s smernicami iz 2. člena tega pravilnika.
17. člen
(objava informacij o vprašanjih farmakovigilance)
Imetnik dovoljenja za promet z zdravilom zagotovi, da so vse objavljene informacije o vprašanjih farmakovigilance zdra-vila javnosti predstavljene objektivno in da niso zavajajoče ter da ne vsebujejo prvin oglaševanja.
18. člen
(glavni dosje o sistemu farmakovigilance)
(1) Imetnik dovoljenja za promet z zdravilom vodi glavni dosje o sistemu farmakovigilance v vsebini in obliki v skladu z Uredbo 520/2012/EU in s smernicami iz 2. člena tega pravilnika.
(2) Imetnik dovoljenja za promet z zdravilom zagotavlja, da je vsebina glavnega dosjeja o sistemu farmakovigilance točen in redno posodobljen odraz sistema farmakovigilance in odraža vse razpoložljive podatke o varnosti zdravil, za katera ima dovoljenje za promet v EU.
(3) Glavni dosje o sistemu farmakovigilance je shranjen v državi članici EU, kjer imetnik dovoljenja za promet z zdravilom izvaja glavne naloge farmakovigilance ali v državi članici EU, kjer deluje oseba, odgovorna za sistem farmakovigilance.
(4) Imetnik dovoljenja za promet z zdravilom zagotovi, da je glavni dosje o sistemu farmakovigilance stalno in takoj dostopen za nadzor na mestu, kjer je shranjen.
(5) Imetnik dovoljenja za promet z zdravilom redno presoja svoj sistem farmakovigilance in v glavni dosje o sistemu farmakovigilance vpiše opombo o glavnih ugotovitvah svoje presoje ter pripravi in izvede ustrezen načrt ukrepov za odpravo ugotovljenih pomanjkljivosti.
(6) Opomba iz prejšnjega odstavka se lahko umakne iz glavnega dosjeja o sistemu farmakovigilance po tem, ko so bili v celoti izvedeni ukrepi za odpravo ugotovljenih pomanjkljivosti.
V. NALOGE NACIONALNEGA CENTRA ZA
FARMAKOVIGILANCO
19. člen (naloge)
Nacionalni center za farmakovigilanco:
– zbira in ocenjuje poročila o domnevnih neželenih učinkih zdravil, vključno s podatki o nepravilni uporabi, zlorabi, neučinkovitosti zdravil, ponarejenih zdravilih in ostalih pomembnih podatkih za varno uporabo zdravil v skladu s smernicami iz 2. člena tega pravilnika;
– posreduje ocene poročil o domnevnih neželenih učinkih zdravil JAZMP najpozneje v sedmih dneh po prejemu poročila o domnevnem neželenem učinku zdravila;
– posreduje JAZMP druge pomembne podatke, ki zadeva-jo varnost zdravil;
– obvešča JAZMP v primeru potrebe po takojšnjem ukrepanju, najpozneje pa v 24 urah po prejemu obvestila, ki zahteva nujno ukrepanje.
VI. NALOGE JAZMP
20. člen
(obravnava poročil o domnevnih neželenih učinkih zdravil)
V okviru opravljanja nalog iz 134. člena zakona JAZMP v zvezi z obravnavo poročil o domnevnih neželenih učinkih izvaja naslednje naloge:
– upravlja sistem farmakovigilance za zbiranje podatkov o tveganjih za zdravje pacientov ali javno zdravje zaradi zdravil. Ti podatki se zlasti nanašajo na domnevne neželene učinke zdravila, in izhajajo iz uporabe zdravila v okviru pogojev in/ali uporabe zunaj okvira pogojev dovoljenja za promet z zdravilom, vključno na domnevne neželene učinkih zdravil, ki so posledica napake povezane z uporabo zdravila, nepravilne uporabe, zlorabe, prevelikega odmerjanja, neodobrene uporabe in poklicne izpostavljenosti zdravilu;
– znanstveno vrednoti poročila o domnevnih neželenih učinkih zdravil ter sprejme ukrepe za pridobitev natančnih in preverljivih podatkov za znanstveno vrednotenje poročil. V nadaljnje spremljanje poročil o domnevnih neželenih učinkih zdravil lahko vključi zdravstvene delavce in paciente, kot je primerno, ter imetnika dovoljenja za promet z zdravilom za poročila, ki jih ta posreduje JAZMP;
– elektronsko posreduje poročila o domnevnih resnih neželenih učinkih zdravil najpozneje v 15 dneh po prejemu obvestila o domnevnem resnem neželenem učinku zdravila v podatkovno bazo EudraVigilance v skladu s smernicami iz 2. člena tega pravilnika;
– elektronsko posreduje poročila o domnevnih neželenih učinkih zdravil, ki niso resni, v podatkovno bazo EudraVigilance v 90 dneh po prejemu obvestila o domnevnem neželenem učinku zdravila, v skladu s smernicami iz 2. člena tega pravilnika;
– sodeluje z imetniki dovoljenj za promet z zdravili in z EMA pri odkrivanju dvojnikov poročil o domnevnih neželenih učinkih zdravil;
– spodbuja zdravstvene delavce in paciente k poročanju o domnevnih neželenih učinkih zdravil in lahko v te aktivnosti po potrebi vključi nacionalni center za farmakovigilanco, organizacije zdravstvenih delavcev, pacientov in potrošnikov.
21. člen
(ukrepi v nujnih farmakovigilančnih primerih)
(1) JAZMP izvaja ukrepe v nujnih farmakovigilančnih primerih (v nadaljnjem besedilu: nujni postopek EU), kadar na podlagi ocene podatkov iz sistema farmakovigilance oceni, da je potrebno nujno ukrepanje.
(2) JAZMP postopek iz prejšnjega odstavka sproži tako, da obvesti Evropsko komisijo, EMA in organe, pristojne za zdravila drugih držav članic EU, kadar:
– bo odvzela ali začasno odvzela dovoljenje za promet z zdravilom;
– bo prepovedala uporabo zdravila;
– bo zavrnila podaljšanje dovoljenja za promet z zdravilom;
– jo imetnik dovoljenja za promet z zdravilom obvesti, da je zaradi varnostnih razlogov prekinil promet z zdravilom, zaprosil za ukinitev dovoljenja za promet z zdravilom ali to namerava storiti ali ni zaprosil za podaljšanje dovoljenja za promet z zdravilom.
(3) JAZMP o nameravanih ukrepih iz prejšnjega odstavka pisno obvesti EMA in navede razloge ter da na voljo zadevne strokovne podatke, ki vključujejo njihovo oceno.
(4) JAZMP lahko do sprejetja končne odločitve v postopku iz prvega odstavka tega člena, kadar je to potrebno zaradi varovanja javnega zdravja, ukrepa v skladu s petim odstavkom 64. člena zakona.
(5) Če JAZMP na podlagi ocene podatkov iz sistema farmakovigilance oceni, da so potrebne nove kontraindikacije, zmanjšanje priporočenega odmerka ali omejitev indikacij zdravila, o tem obvesti Evropsko komisijo, EMA in organe, pristojne za zdravila drugih držav članic EU in navede razloge zanje, ter začne nujni postopek EU, ko meni, da so potrebni nujni ukrepi. Če JAZMP postopka iz prvega odstavka tega člena ne začne, in gre za zdravilo, ki je pridobilo dovoljenje za promet z zdravilom po postopku z medsebojnim priznavanjem ali decentraliziranem postopku, zadevo posreduje Skupini za usklajevanje.
(6) Ne glede na prvi, drugi in peti odstavek tega člena, za zdravilo, ki ima dovoljenje za promet le v Republiki Sloveniji, obravnava farmakovigilančni primer, za katerega oceni, da je potrebno nujno ukrepanje, JAZMP in o začetku postopka ob-
vesti imetnika dovoljenja za promet z zdravilom.
(7) Imetnik dovoljenja za promet z zdravilom lahko za oceno farmakovigilančnega primera iz prejšnjega odstavka pisno poda svoje pripombe.
(8) JAZMP najpozneje v 60 dneh od začetka postopka iz
šestega odstavka tega člena:
– ugotovi, da nadaljnja ocena podatkov in ukrepi niso potrebni;
– naloži imetniku dovoljenja za promet z zdravilom, da opravi nadaljnjo oceno podatkov in spremlja izide ocene;
– naloži imetniku dovoljenja za promet z zdravilom, da izvede neintervencijsko klinično študijo o varnosti zdravila in oceni izide študije;
– naloži imetniku dovoljenja za promet z zdravilom, da izvede ukrepe za zmanjševanje tveganj, vključno s pogoji in omejitvami dovoljenja, kot jih določi JAZMP;
– začasno odvzame dovoljenje za promet z zdravilom; – odvzame dovoljenje za promet z zdravilom, ali
– spremeni dovoljenje za promet z zdravilom.
22. člen (obveščanje)
(1) JAZMP na svoji spletni strani obvešča javnost najmanj o: – načinih poročanja o domnevnih neželenih učinkih zdra-
vil za zdravstvene delavce in paciente;
– vprašanjih farmakovigilance;
– seznamu zdravil, za katera se zahteva dodatno spremljanje varnosti, ki ga v skladu s 23. členom Uredbe 726/2004/ES objavlja EMA;
– povzetkih načrtov za obvladovanje tveganj za zdravila, odobrena v skladu z zakonom;
– seznamu nacionalne medicinske in znanstvene literature, ki jo imetnik dovoljenja za promet z zdravilom spremlja za namen poročanja o domnevnih neželenih učinkih zdravil.
(2) Pri objavi obvestil o vprašanjih farmakovigilance upo-števa določbe zakona, zakona, ki ureja gospodarske družbe in zakona, ki ureja varovanje osebnih podatkov.
VII. NEINTERVENCIJSKA ŠTUDIJA O VARNOSTI ZDRAVILA PO PRIDOBITVI DOVOLJENJA ZA PROMET Z ZDRAVILOM
23. člen
(podrobnejši pogoji za pridobitev soglasja k osnutku protokola neintervencijske študije o varnosti zdravila)
(1) Imetnik dovoljenja za promet z zdravilom predloži JAZMP osnutek protokola neintervencijske študije o varnosti zdravila, ki bo potekala le v Republiki Sloveniji, in za katero mora pridobiti soglasje iz 138. člena zakona.
(2) Vsebina in oblika protokola iz prejšnjega odstavka morata biti v skladu s Prilogo III Uredbe 520/2012/EU in s smernicami iz 2. člena tega pravilnika.
(3) JAZMP v 60 dneh od predložitve osnutka protokola iz prvega odstavka tega člena izda sklep o soglasju k osnutku protokola, če so izpolnjeni naslednji pogoji:
– vsebina in oblika protokola izpolnjujeta zahteve iz prejšnjega odstavka;
– načrt neintervencijske študije o varnosti zdravila ustreza opredelitvi neintervencijskega kliničnega preskušanja v skladu z zakonom in s smernicami iz 2. člena tega pravilnika;
– načrt študije iz prejšnje alinee zagotavlja doseganje namena in ciljev preskušanja;
– predloženo je dokazilo, da je oseba, odgovorna za sistem farmakovigilance, vključena v pregled in odobritev protokola;
– izvajanje neintervencijske študije o varnosti zdravila ne pospešuje predpisovanja in porabe zdravila.
(4) Kadar se neintervencijska študija o varnosti zdravila izvaja tudi v drugi državi članici EU in za katero mora pridobiti soglasje iz 138. člena zakona, imetnik dovoljenja za promet z zdravilom predloži Odboru za oceno tveganja na področju farmakovigilance osnutek protokola v skladu s postopkom iz 107n. do 107p. člena Direktive 2001/83/ES.
24. člen
(vsebinske spremembe protokola neintervencijske študije o varnosti zdravila)
(1) Po začetku neintervencijska študija o varnosti zdravila iz prvega odstavka 23. člena tega pravilnika, imetnik dovoljenja za promet z zdravilom JAZMP predloži vsako vsebinsko spremembo protokola, preden se le ta začne izvajati.
(2) Vsebinska sprememba protokola pomeni pomembno spremembo protokola, kot je opredeljena v smernicah iz 2. člena tega pravilnika.
(3) JAZMP v 30 dneh od predložitve vsebinske spremembe protokola odloči o ustreznosti predložene spremembe.
(4) Po začetku študije iz četrtega odstavka 23. člena tega pravilnika imetnik dovoljenja za promet z zdravilom vsako vsebinsko spremembo protokola predloži Odboru za oceno tveganja na področju farmakovigilance v skladu s 107o. členom Direktive 2001/83/ES.
25. člen
(posredovanje podatkov v elektronski register študij po pridobitvi dovoljenja za promet z zdravilom EU)
Sponzor pred začetkom zbiranja podatkov posreduje podatke o vseh neintervencijskih študijah o varnosti zdravil po pridobitvi dovoljenja za promet z zdravilom v elektronski register študij po pridobitvi dovoljenja za promet z zdravilom EU, EU PAS Register, v skladu s smernicami iz 2. člena tega pravilnika, ki je dostopen prek evropskega spletnega portala o zdravilih http://www.encepp.eu/encepp_studies/indexRegister.sht ml.
VIII. KONČNI DOLOČBI
26. člen (prenehanje veljavnosti)
Z dnem uveljavitve tega pravilnika preneha veljati Pra-vilnik o farmakovigilanci zdravil za uporabo v humani medicini (Uradni list RS, št. 53/06 in 16/11).
27. člen (začetek veljavnosti)
Ta pravilnik začne veljati petnajsti dan po objavi v Ura-dnem listu Republike Slovenije.
Št. 0070-31/2014 Ljubljana, dne 16. junija 2014 EVA 2014-2711-0041
v funkciji ministrice za zdravje mag. Alenka Bratušek l.r. Predsednica vlade
“,”Jaka Verbic Miklic”,1521991320,1521991320,sl,12435,306,12416,43,0,NULL,,”Pravilnik o farmakovigilanci zdravil za uporabo v humani medicini, UL št. 57/2014, 25. 7. 2014″,pravilnik-o-farmakovigilanci-zdravil-za-uporabo-v-humani-medicini-ul-st-57-2014-25-7-2014,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521991422,1524643039
264,12436,”Zakon o zdravilih (ZZdr-2) “,”UL 17/2014, 07/03/2014″,”
Z A K O N
O ZDRAVILIH (ZZdr-2)
I. SPLOŠNE DOLOČBE
1. člen
(področje urejanja in pristojnosti)
(1) Ta zakon ureja področje zdravil za uporabo v humani in veterinarski medicini, določa pogoje in ukrepe za zagotavljanje njihove ustrezne kakovosti, varnosti in učinkovitosti, pogoje in postopke za njihovo preskušanje, proizvodnjo, promet in porabo zdravil, cene zdravil, uradno kontrolo, pripravo nerutinsko pripravljenih zdravil za napredno zdravljenje in nadzor nad izvajanjem tega zakona z namenom varovanja javnega zdravja za zdravila, ki so industrijsko proizvedena ali proizvedena na način, ki vključuje industrijski postopek, vključno s predmešanicami za pripravo zdravilnih krmnih mešanic, z učinkovinami, ki se uporabljajo kot vhodne snovi in za določene snovi, ki se lahko uporabljajo kot zdravila za uporabo v veterinarski medicini in imajo anabolne, protiinfekcijske, protiparazitne, protivnetne, hormonske ali psihotropne lastnosti, ter naloge in pristojnosti Javne agencije Republike Slovenije za zdravila in medicinske pripomočke (v nadaljnjem besedilu: JAZMP).
(2) Ta zakon se uporablja tudi za homeopatska zdravila, če z njim ni drugače določeno.
2. člen
(prenos in izvajanje predpisov Evropske unije)
(1) S tem zakonom se v pravni red Republike Slovenije vsebinsko prenašajo naslednje direktive:
– Direktiva Sveta z dne 21. decembra 1988 v zvezi s preglednostjo ukrepov, ki urejajo določanje cen zdravil za človeško uporabo in njihovo vključitev v področje nacionalnih sistemov zdravstvenega zavarovanja (UL L št. 40 z dne 11. 2. 1989, str. 8; v nadaljnjem besedilu: Direktiva 89/105/EGS);
– Direktiva Komisije z dne 23. julija 1991 o določitvi načel in smernic dobre proizvodne prakse za zdravila za uporabo v veterinarski medicini (UL L št. 228 z dne 17. 8. 1991, str. 70; v nadaljnjem besedilu: Direktiva 91/412/EGS);
– Direktiva 2001/20/ES Evropskega parlamenta in Sveta z dne 4. aprila 2001 o približevanju zakonov in drugih predpisov držav članic v zvezi z izvajanjem dobre klinične prakse pri kliničnem preskušanju zdravil za ljudi (UL L št. 121 z dne 1. 5. 2001, str. 34), zadnjič spremenjena z Uredbo (ES) št. 596/2009 Evropskega parlamenta in Sveta z dne 18. junija 2009 o prilagoditvi nekaterih aktov, za katere se uporablja postopek iz člena 251 Pogodbe, Sklepu Sveta 1999/468/ES glede regulativnega postopka s pregledom-Prilagoditev regulativnemu postopku s pregledom-Četrti del (UL L št. 188 z dne 18. 7. 2009, str. 14; v nadaljnjem besedilu: Uredba 596/2009/ES), (v nadaljnjem besedilu: Direktiva 2001/20/ES);
– Direktiva 2001/82/ES Evropskega parlamenta in Sveta z dne 6. novembra 2001 o zakoniku Skupnosti o zdravilih za uporabo v veterinarski medicini (UL L št. 311 z dne 28. 11. 2001, str. 1), zadnjič spremenjena z Uredbo 596/2009/ES, (v nadaljnjem besedilu: Direktiva 2001/82/ES), razen v delu, ki se nanaša na uporabo zdravil in z uporabo povezano sledljivost zdravil in je urejen v zakonu, ki ureja veterinarska merila skladnosti;
– Direktiva 2001/83/ES Evropskega parlamenta in Sveta z dne 6. novembra 2001 o zakoniku Skupnosti o zdravilih za uporabo v humani medicini (UL L št. 311 z dne 28. 11. 2001, str. 67), zadnjič spremenjena z Direktivo 2012/26/EU Evropskega parlamenta in Sveta z dne 25. oktobra 2012 o spremembi Direktive 2001/83/ES, kar zadeva farmakovigilanco (UL L št. 299 z dne 27. 10. 2012, str. 1), (v nadaljnjem besedilu: Direktiva 2001/83/ES);
– Direktiva Komisije 2003/94/ES z dne 8. oktobra 2003 o določitvi načel in smernic dobre proizvodne prakse v zvezi z zdravili za uporabo v humani medicini in zdravili za uporabo v humani medicini v preskušanju (UL L št. 262 z dne 14. 10. 2003, str. 22; v nadaljnjem besedilu: Direktiva 2003/94/ES);
– Direktiva Komisije 2005/28/ES z dne 8. aprila 2005 o načelih in podrobnih smernicah za dobro klinično prakso v zvezi z zdravili v preskušanju za humano uporabo ter o zahtevah za pridobitev dovoljenja za proizvodnjo ali uvoz takšnih izdelkov (UL L št. 91 z dne 9. 4. 2005, str. 13; v nadaljnjem besedilu: Direktiva 2005/28/ES).
(2) S tem zakonom se ureja izvajanje naslednjih uredb:
– Uredbe (ES) št. 726/2004 Evropskega parlamenta in Sveta z dne 31. marca 2004 o postopkih Skupnosti za pridobitev dovoljenja za promet in nadzor zdravil za humano in veterinarsko uporabo ter o ustanovitvi Evropske agencije za zdravila (UL L št. 136 z dne 30. 4. 2004, str. 1), zadnjič spremenjeno z Uredbo (EU) št. 1027/2012 Evropskega parlamenta in Sveta z dne 25. oktobra 2012 o spremembi Uredbe (ES) št. 726/2004, kar zadeva farmakovigilanco (UL L št. 316 z dne 14. 11. 2012, str. 38), (v nadaljnjem besedilu: Uredba 726/2004/ES);
– Uredbe (ES) št. 1394/2007 Evropskega parlamenta in Sveta z dne 13. novembra 2007 o zdravilih za napredno zdravljenje ter o spremembi Direktive 2001/83/ES in Uredbe (ES) št. 726/2004 (UL L št. 324 z dne 10. 12. 2007, str. 121), zadnjič spremenjene z Uredbo (EU) št.1235/2010 Evropskega parlamenta in Sveta z dne 15. decembra 2010 o spremembah Uredbe (ES) št. 726/2004 o postopkih Skupnosti za pridobitev dovoljenja za promet in nadzor zdravil za humano in veterinarsko uporabo ter o ustanovitvi Evropske agencije za zdravila in Uredbe (ES) št. 1394/2007 o zdravilih za napredno zdravljenje, glede farmakovigilance zdravil za uporabo v humani medicini (UL L št. 348 z dne 31. 12. 2010, str. 1), (v nadaljnjem besedilu: Uredba 1394/2007/ES);
– Uredbe Komisije (ES) št. 1234/2008 z dne 24. novembra 2008 o pregledu sprememb pogojev dovoljenj za promet z zdravili za uporabo v humani medicini in zdravili za uporabo v veterinarski medicini (UL L št. 334 z dne 12. 12. 2008, str. 7), zadnjič spremenjene z Uredbo Komisije (EU) št. 712/2012 z dne 3. avgusta 2012 o spremembi Uredbe (ES) št. 1234/2008 o pregledu sprememb pogojev dovoljenj za promet z zdravili za uporabo v humani medicini in zdravili za uporabo v veterinarski medicini (UL L št. 209 z dne 4. 8. 2012, str. 4), (v nadaljnjem besedilu: Uredba 1234/2008/ES);
– Uredbe (ES) št. 470/2009 Evropskega parlamenta in Sveta z dne 6. maja 2009 o določitvi postopkov Skupnosti za določitev mejnih vrednosti ostankov farmakološko aktivnih snovi v živilih živalskega izvora in razveljavitvi Uredbe Sveta (EGS) št. 2377/90 in spremembi Direktive 2001/82/ES Evropskega parlamenta in Sveta ter Uredbe (ES) št. 726/2004 Evropskega parlamenta in Sveta (UL L št. 152 z dne 16. 6. 2009, str. 11; v nadaljnjem besedilu: Uredba 470/2009/ES).
3. člen
(pristojnost)
(1) Pristojni minister oziroma ministrica za področje zdravil, ki jih ureja ta zakon, je minister, pristojen za zdravje (v nadaljnjem besedilu: minister), če ta zakon ne določa drugače.
(2) Podzakonske predpise za področje zdravil za uporabo v veterinarski medicini izda minister v soglasju z ministrom oziroma ministrico, pristojno za veterinarstvo (v nadaljnjem besedilu: minister, pristojen za veterinarstvo).
(3) Organ, pristojen za zdravila, ki jih obravnava ta zakon, je JAZMP.
(4) JAZMP odloča v upravnih zadevah po zakonu, ki ureja splošni upravni postopek, če ta zakon ne določa drugače.
(5) Če ta zakon ne določa drugače, JAZMP v upravnih zadevah zahteva dopolnitev nepopolne vloge v petih delovnih dneh od njenega prejema in določi predlagatelju ali predlagateljici (v nadaljnjem besedilu: predlagatelj) rok, v katerem jo mora dopolniti.
(6) V zadevah, v katerih JAZMP odloča po tem zakonu, lahko JAZMP predlagatelju s sklepom naloži, da predloži dodatno dokumentacijo ali podatke v roku, ki ga posebej določi. Z dokončnostjo tega sklepa se prekine rok za sprejem odločitve iz tega zakona, ponovno pa začne teči s pretekom roka za predložitev dokumentacije ali podatkov oziroma s predložitvijo teh, če je to prej.
4. člen
(Strateški svet za zdravila, komisije in zunanji strokovnjaki JAZMP)
(1) Strateški svet za zdravila je posvetovalni organ ministra, ki obravnava strateška vprašanja na področju zdravil. Člane Strateškega sveta za zdravila imenuje minister ter določi njegove naloge in način dela.
(2) JAZMP lahko v reševanje zadev iz svoje pristojnosti vključi zunanje strokovnjake in strokovnjakinje (v nadaljevanju besedila: zunanji strokovnjaki), če pri izvajanju nalog oceni, da so za rešitev zadev potrebna strokovna znanja, ki jih JAZMP nima. Za zunanje strokovnjake se določijo osebe ali organizacije, ki imajo strokovno znanje, ki je potrebno za razjasnitev stanja stvari. Če se za zunanjega strokovnjaka imenuje organizacija, nastopa v postopku v njenem imenu ena ali več pooblaščenih oseb.
(3) Posamezni zunanji strokovnjaki so lahko vključeni v strokovne odbore, strokovna delovna telesa in druge strokovne skupine Evropske agencije za zdravila in Evropske komisije, ter v aktivnosti ostalih organov in institucij ter drugih mednarodnih povezav pri obravnavi strokovnih vsebin s področij, ki jih določa ta zakon.
(4) Seznam zunanjih strokovnjakov iz drugega in tretjega odstavka tega člena določi minister izmed strokovnjakov s področja farmacije, medicine, veterine in drugih področij, seznam strokovnjakov za področje zdravil za uporabo v veterinarski medicini določi minister, v soglasju z ministrom, pristojnim za veterinarstvo. Izjemoma in s soglasjem ministra lahko JAZMP za potrebe nemotenega izvajanja delovnega procesa uporabi zunanjega strokovnjaka, ki ni vključen v aktualni seznam zunanjih strokovnjakov.
(5) Minister imenuje komisije, odbore in skupine, v katere vključi predstavnike JAZMP in zunanje strokovnjake iz prejšnjega odstavka za potrebe reševanja zadev iz pristojnosti JAZMP. Komisije, odbori in skupine pripravljajo mnenja in predloge na področju:
– postopkov za pridobitev dovoljenja za promet z zdravilom,
– postopkov za pridobitev dovoljenja za klinično preskušanje zdravil,
– priprave predloga seznama esencialnih zdravil in nujno potrebnih zdravil,
– določanja izrednih višjih dovoljenih cen zdravil za uporabo v humani medicini,
– farmakopeje.
(6) Merila za ugotavljanje strokovne usposobljenosti in nasprotja interesov kandidatov za delo zunanjega strokovnjaka, način dela posameznih zunanjih strokovnjakov in način dela odborov in komisij iz prejšnjega odstavka, določi JAZMP po predhodnem soglasju ministra.
(7) Zunanji strokovnjaki pri svojem delu ravnajo nepristransko in spoštujejo zaupnost podatkov. Ne smejo imeti nasprotja interesov na način, da bi omogočali neupravičene koristi ali dajali prednost posameznim strankam v postopkih.
(8) JAZMP imenuje strokovno komisijo za ugotavljanje izpolnjevanja pogojev proizvodnje in prometa z zdravili in učinkovinami ter priprave nerutinsko pripravljenih zdravil za napredno zdravljenje.
(9) Minister, pristojen za veterinarstvo imenuje komisije za področje doktrinarnih rešitev za zdravila za uporabo v veterinarski medicini.
5. člen
(definicija zdravila)
(1) Zdravilo je vsaka snov ali kombinacija snovi, ki so predstavljene z lastnostmi za zdravljenje ali preprečevanje bolezni pri ljudeh ali živalih.
(2) Za zdravilo se šteje tudi vsaka snov ali kombinacija snovi, ki se lahko uporablja pri ljudeh ali živalih ali se daje ljudem ali živalim z namenom, da bi se ponovno vzpostavile, izboljšale ali spremenile fiziološke funkcije prek farmakološkega, imunološkega ali presnovnega delovanja ali da bi se določila diagnoza bolezni.
(3) Snov iz prvega in drugega odstavka tega člena je lahko:
– človeškega izvora,
– živalskega izvora,
– rastlinskega izvora,
– mikrobnega izvora,
– kemičnega izvora,
– kemični izdelki, pridobljeni s kemično spremembo ali sintezo ali
– pridobljena z biotehnološkimi postopki.
6. člen
(pomen izrazov)
Izrazi, uporabljeni v tem zakonu, imajo naslednji pomen:
1. Analiza kakovosti zdravila je kvalitativna analiza vseh sestavin, kvantitativna analiza najmanj vseh učinkovin in vsi drugi preskusi, potrebni za ugotavljanje kakovosti zdravila v skladu z zahtevami dovoljenja za promet ali s preskusnimi metodami, ki so v skladu z določbami 28. člena tega zakona ali so razvite in validirane za namen ugotavljanja kakovosti zdravila.
2. Biološko zdravilo je zdravilo, ki kot učinkovino vsebuje biološko snov ali snov, pridobljeno s postopkom, ki vključuje biološke sisteme. Biološka snov je tista, ki je pridobljena iz ali z uporabo biološkega vira in ki za določitev kakovosti potrebuje kombinacijo fizikalno-kemijskega in biološkega preskušanja, skupaj s postopkom proizvodnje in nadzorom nad njim. To so na primer zdravila, proizvedena z biološkim ali biotehnološkim postopkom, vključno s celičnimi kulturami in podobno.
3. Centralizirani postopek je postopek pridobitve dovoljenja za promet z zdravilom v Evropski uniji, kakor ga določa Uredba 726/2004/ES.
4. Dajanje zdravila v promet pomeni odplačno ali neodplačno preskrbovati trg z zdravili oziroma dajati na voljo zdravilo v Republiki Sloveniji.
5. Decentralizirani postopek je postopek za pridobitev dovoljenja za promet z zdravilom, ki se začne hkrati v referenčni in v zadevnih državah članicah Evropske unije. Obvezen je za zdravila, ki se ne obravnavajo po centraliziranem postopku in še niso pridobila dovoljenja za promet z zdravilom v Evropski uniji in ki bodo na trgu v več kakor eni državi članici Evropske unije, kakor to določata Direktiva 2001/83/ES in Direktiva 2001/82/ES.
6. Dobra distribucijska praksa je sistem kakovosti, ki se nanaša na organizacijo, izvajanje in nadzor shranjevanja izdelkov po določenem redu pred nadaljnjo uporabo ali dajanjem v promet in prevoz izdelkov od proizvajalca oziroma proizvajalke (v nadaljnjem besedilu: proizvajalec) do končnega uporabnika oziroma uporabnice (v nadaljnjem besedilu: uporabnik) v skladu z načeli in smernicami, ki jih za zdravila in za učinkovine sprejme in objavi Evropska komisija.
7. Dobra farmakovigilančna praksa so smernice o izvajanju farmakovigilančnih aktivnosti v skladu s 108.a členom Direktive 2001/83/ES.
8. Dobra klinična praksa v kliničnem preskušanju v humani medicini je mednarodni etični in znanstveni sistem kakovosti načrtovanja, izvajanja, zapisovanja, nadzorovanja in poročanja o kliničnem preskušanju na ljudeh, ki zagotavlja verodostojnost podatkov, pridobljenih v preskušanju, ter zaščito pravic in varnosti preiskovancev v skladu s Helsinško deklaracijo Svetovne zdravstvene organizacije o biomedicinskem preskušanju na ljudeh (1964), objavljena na spletni strani http://www.wma.net tem zakonom in na njegovi podlagi sprejetimi predpisi ter predpisi Evropske unije.
9. Dobra klinična praksa v kliničnem preskušanju v veterinarski medicini je mednarodni etični in znanstveni sistem kakovosti načrtovanja, izvajanja, zapisovanja, nadzorovanja in poročanja o kliničnem preskušanju na ciljnih živalih, ki zagotavlja verodostojnost podatkov, pridobljenih v preskušanju, in varnost živali v skladu s tem zakonom in na njegovi podlagi sprejetimi predpisi ter predpisi o zaščiti živali.
10. Dobra kontrolna laboratorijska praksa je sistem kakovosti za izvajanje analiznega preskušanja zdravil, ki je lahko tudi del dobre proizvodne prakse, s katero se izvaja kontrola kakovosti izdelka.
11. Dobra laboratorijska praksa je sistem kakovosti, ki se nanaša na organizacijske procese in pogoje, v katerih se neklinične zdravstvene in okoljevarstvene študije načrtujejo, izvajajo, nadzorujejo, zapisujejo, arhivirajo in se o njih poroča v skladu z načeli in smernicami, ki jih sprejme in objavi Evropska komisija.
12. Dobra proizvodna praksa je sistem kakovosti, ki zagotavlja dosledno proizvodnjo in kontrolo zdravil in učinkovin v skladu s standardi kakovosti, ustreznimi za njihovo predvideno uporabo v skladu z načeli in smernicami, ki jih sprejme in objavi Evropska komisija.
13. Domnevni neželeni učinek zdravila je sum na neželeni učinek, pri katerem je vzročna povezava med zdravilom in neželenim dogodkom vsaj razumno mogoča.
14. Evropska farmakopeja je farmakopeja, ki jo določa Konvencija o izdelavi Evropske farmakopeje Sveta Evrope (1964), objavljena na spletni strani http://www.edqm.eu in jo izdaja Evropski direktorat za kakovost zdravil (EDQM).
15. Farmacevtska oblika je oblika zdravila, v katero se s tehnološkimi postopki vgradi učinkovino ali učinkovine in s tem omogoči njihovo uporabnost, ob upoštevanju fizioloških pogojev in fizikalno kemijskih lastnosti učinkovine ter pomožnih snovi.
16. Farmakopeja je zbirka monografij in drugih določb za razvoj, pripravo oziroma proizvodnjo zdravil, potrjevanje istovetnosti, ugotavljanje čistote in preskušanje drugih parametrov kakovosti in drugih lastnosti zdravil ter drugih snovi, iz katerih so zdravila pripravljena oziroma proizvedena ter druge podatke o zdravilih.
17. Farmakovigilanca je sistem odkrivanja, ocenjevanja, razumevanja in preprečevanja neželenih učinkov zdravil in drugih spoznanj o varnosti zdravil in ukrepanja z namenom upravljanja in zmanjševanja tveganja, povezanega z zdravili.
18. Galensko zdravilo za uporabo v humani medicini je zdravilo, ki se pripravi kot zdravilo na zalogo v lekarni ali v galenskem laboratoriju lekarne, iz sestavin, ki so učinkovine oziroma pomožne snovi, v skladu z veljavnimi farmakopejami ter v skladu z recepturami v veljavnih farmakopejah ali v skladu z recepturami (za potrebe bolnišnične dejavnosti), ki jih na skupni predlog razširjenega strokovnega kolegija, pristojnega za zadevno področje zdravljenja ter razširjenega strokovnega kolegija za lekarniško dejavnost, potrdi JAZMP, ter je namenjeno za izdajo končnim uporabnikom storitev zadevne lekarne v skladu s predpisi, ki urejajo lekarniško dejavnost.
19. Galensko zdravilo za uporabo v veterinarski medicini je zdravilo, ki ga pripravijo na zalogo v lekarni oziroma v galenskem laboratoriju lekarne iz sestavin, ki so učinkovine oziroma pomožne snovi, v skladu z veljavnimi farmakopejami ter v skladu z recepturami v veljavnih farmakopejah.
Priprava galenskega zdravila je lahko tudi v skladu z recepturami, ki jih na skupni predlog strokovnega organa, ki zastopa veterinarsko dejavnost, ter razširjenega strokovnega kolegija za lekarniško dejavnost potrdita JAZMP in organ, pristojen za veterinarstvo ter je namenjeno za izdajo končnim uporabnikom storitev zadevne lekarne v skladu s predpisi, ki urejajo lekarniško dejavnost.
20. Generično zdravilo je zdravilo, ki ima enako kakovostno in količinsko sestavo učinkovin(e) in farmacevtsko obliko kakor referenčno zdravilo, in čigar bioekvivalenca z referenčnim zdravilom je dokazana z ustreznimi študijami biološke uporabnosti. Različne soli, estri, etri, izomeri, zmesi izomerov, kompleksi ali derivati učinkovine se obravnavajo kot enaka učinkovina, razen če se pomembno razlikujejo glede varnosti ali učinkovitosti ali obojega.
21. Glavni dosje o sistemu farmakovigilance je podroben opis sistema farmakovigilance, ki ga uporabljajo imetniki dovoljenj za promet z zdravili za eno ali več zdravil, ki so pridobila dovoljenje za promet.
22. Homeopatsko zdravilo je zdravilo, pripravljeno iz snovi, ki se imenujejo homeopatske surovine, v skladu s homeopatskim postopkom izdelave po določbah Evropske farmakopeje ali po veljavnih farmakopejah držav članic Evropske unije, če Evropska farmakopeja teh določb ne vsebuje. Homeopatsko zdravilo lahko vsebuje tudi več bistvenih sestavin.
23. Ime zdravila je lahko izmišljeno ime, ki ne sme povzročiti zamenjave s splošnim imenom, ali pa splošno ali znanstveno ime, skupaj z blagovno znamko ali imenom imetnika oziroma imetnice (v nadaljnjem besedilu: imetnik) dovoljenja za promet z zdravilom.
24. Imunološka zdravila so cepiva, toksini in serumi, ki se uporabljajo za:
– sprožitev aktivne imunosti,
– sprožitev pasivne imunosti ali
– diagnosticiranje stanja imunosti ter
– alergeni, ki so namenjeni odkrivanju ali sprožitvi specifične pridobljene spremembe imunskega odgovora na povzročitelja alergije.
25. Intermediat je vmesni produkt večstopenjske sinteze učinkovine, ki je navadno podvržen nadaljnjim molekulskim spremembam ali prečiščevanju in se lahko izolira ali pa ne, preden postane učinkovina. Ta definicija se nanaša na snovi, proizvedene po stopnji sinteze, ki jo proizvajalec učinkovine opredeli kot začetek sinteze učinkovine.
26. Izdaja zdravila v prometu na drobno je prodaja in vročitev zdravila v prometu na drobno, vročitev delno ali v celoti v breme javnih sredstev ali vročitev zdravila, ki je donirano ali zagotovljeno iz proračunskih sredstev končnemu uporabniku, ki jo spremlja ustrezna in strokovno neodvisna podpora s svetovanjem.
27. Izjemna uporaba je uporaba zdravila v veterinarski medicini, ki ni v skladu s povzetkom glavnih značilnosti zdravila, vendar je dovoljena pod pogoji, ki jih določa ta zakon in zakon, ki ureja veterinarska merila skladnosti.
28. Iznos zdravila je promet zdravila na debelo iz Republike Slovenije v druge države članice Evropske unije. Iznos zdravila je tudi prenos zdravila iz ozemlja Republike Slovenije na ozemlje drugih držav članic Evropske unije, kadar zdravilo za svojo osebno uporabo oziroma za osebno uporabo njegovih ožjih družinskih članov oziroma na podlagi pooblastila za osebno uporabo največ enega posameznika, ki ni njegov družinski član, ali za svojo posamezno žival prenaša posameznik.
29. Izvoz zdravila je promet zdravila na debelo iz Republike Slovenije v tretje države. Izvoz zdravila je tudi prenos zdravila iz ozemlja Republike Slovenije na ozemlje tretjih držav, kadar zdravilo za svojo osebno uporabo oziroma za osebno uporabo njegovih ožjih družinskih članov oziroma na podlagi pooblastila za osebno uporabo največ enega posameznika, ki ni njegov družinski član, ali za svojo posamezno žival prenaša posameznik.
30. Izvajalci zdravstvene dejavnosti so javni zdravstveni zavodi ter druge pravne in fizične osebe, ki izvajajo zdravstveno dejavnost v skladu s predpisi, ki urejajo zdravstveno dejavnost, razen lekarniške dejavnosti.
31. Izvajalci veterinarske dejavnosti so veterinarske organizacije in druge organizacije, ki v skladu s predpisi, ki urejajo veterinarsko dejavnost, opravljajo veterinarsko dejavnost.
32. Jakost zdravila je vsebnost učinkovin, izražena količinsko na enoto odmerka, na enoto prostornine ali mase, skladno s farmacevtsko obliko.
33. Karenca je obdobje, ki mora preteči od zadnjega dajanja zdravila za uporabo v veterinarski medicini živali pod normalnimi pogoji uporabe v skladu s tem zakonom in na njegovi podlagi izdanimi predpisi, do začetka pridobivanja oziroma proizvodnje živil iz teh živali, da se zagotovi, da ta živila ne vsebujejo ostankov nad najvišjimi mejnimi vrednostmi, določenimi z Uredbo 470/2009/ES in Uredbo Komisije (EU) št. 37/2010 z dne 22. decembra 2009 o farmakološko aktivnih snoveh in njihovi razvrstitvi glede mejnih vrednosti ostankov v živilih živalskega izvora (UL L št. 15 z dne 20. 1. 2010, str. 1), zadnjič spremenjeno z Izvedbeno uredbo Komisije (EU) št. 489/2013 z dne 27. maja 2013 o spremembi Priloge k Uredbi (EU) št. 37/2010 o farmakološko aktivnih snoveh in njihovi razvrstitvi glede mejnih vrednosti ostankov v živilih živalskega izvora v zvezi s snovjo: dvoverižna ribonukleinska kislina, homologna virusni ribonukleinski kislini, ki nosi zapis za del plaščne beljakovine in del medgenske regije izraelskega virusa akutne paralize (UL L št. 141 z dne 28. 5. 2013, str. 4), (v nadaljnjem besedilu: Uredba 37/2010/EU).
34. Končni uporabnik zdravila za uporabo v humani medicini je posameznik, ki mu je bilo zdravilo predpisano oziroma izdano (v nadaljnjem besedilu: pacient) oziroma izvajalec zdravstvene dejavnosti, ki zdravilo uporablja pri izvajanju zdravstvenih storitev.
35. Končni uporabnik zdravila za uporabo v veterinarski medicini je lastnik oziroma skrbnik živali, ki ji je bilo zdravilo predpisano oziroma izdano oziroma poslovni subjekt, ki uporablja zdravilo pri izvajanju veterinarske dejavnosti.
36. Magistralno zdravilo za uporabo v humani medicini je zdravilo, ki ga, kadar za doseganje terapevtskega učinka na trgu ni industrijsko proizvedenega ali galensko izdelanega zdravila z enako sestavo učinkovin in pomožnih snovi v ustrezni jakosti ali farmacevtski obliki, izdelajo v lekarni po zdravniškem receptu za posameznega pacienta oziroma skupino pacientov in ga izdajo neposredno po izdelavi.
37. Magistralno zdravilo za uporabo v veterinarski medicini je zdravilo, ki ga izdelajo v lekarni na podlagi veterinarskega recepta za določeno žival ali manjšo skupino živali in ga izdajo neposredno po izdelavi.
38. Motnja v preskrbi z zdravilom je stanje na trgu, kjer poslovni subjekti, odgovorni za preskrbo trga Republike Slovenije, ne uspejo zagotoviti potrebnih količin zdravila v ustreznem času.
39. Nacionalni center za farmakovigilanco je pravna oseba, ki izvaja s tem zakonom določene naloge s področja farmakovigilance zdravil za uporabo v humani medicini in izpolnjuje pogoje glede kadrov, prostorov in opreme, ki jih za to dejavnost določi minister.
40. Nacionalni identifikator zdravila, s katerim se zdravilo daje v promet v Republiki Sloveniji, je oznaka, ki jo zdravilu dodeli JAZMP in ki enolično določa zdravilo na ravni učinkovine, farmacevtske oblike, jakosti, pakiranja in imetnika dovoljenja.
41. Nacionalni postopek za pridobitev dovoljenja za promet z zdravilom v Republiki Sloveniji je postopek za pridobitev dovoljenja za promet s tistimi zdravili, za katera ni obvezen centralizirani postopek in ki bodo pridobila dovoljenje za promet le v Republiki Sloveniji.
42. Načrt za obvladovanje tveganj na področju farmakovigilance je natančen opis sistema obvladovanja tveganj.
43. Najvišja mejna vrednost ostankov je najvišja mejna vrednost ostankov zdravil po njihovi uporabi v veterinarski medicini, kot to določa Uredba 470/2009/ES.
44. Napaka pri uporabi zdravila je kakršnokoli nenamerno napačno predpisovanje ali izdaja zdravila ali napačna uporaba zdravila s strani zdravstvenega delavca, pacienta ali končnega uporabnika.
45. Navodilo za uporabo zdravila je informacija za končnega uporabnika, ki je v pisni obliki priložena zdravilu, praviloma kot listič.
46. Neintervencijsko klinično preskušanje zdravila je klinično preskušanje zdravila, pri katerem izbira pacientov, načina zdravljenja, izbor zdravila, predpisovanje zdravila, določitev preiskav in spremljanje pacienta ne odstopa od ustaljenega načina zdravljenja, ki je v skladu z odobrenim ali predpisanim odmerjanjem, načinom uporabe ali indikacijskim področjem.
47. Neodobrena uporaba zdravila je kakršnakoli namerna uporaba zdravila z medicinskim namenom, ki ni v skladu z dovoljenjem za promet z zdravilom.
48. Nepravilna uporaba zdravila je kakršnakoli namerna neustrezna uporaba zdravila, ki ni v skladu z dovoljenjem za promet z zdravilom.
49. Nepričakovan neželen učinek zdravila je neželen učinek, čigar narava, resnost ali posledica ni v skladu s povzetkom glavnih značilnosti zdravila.
50. Nerutinsko pripravljeno zdravilo za napredno zdravljenje, je katerokoli zdravilo za napredno zdravljenje, ki je pripravljeno nerutinsko v Republiki Sloveniji v skladu s standardi kakovosti, določenimi v tem zakonu in uporabljeno v Republiki Sloveniji pri izvajalcu zdravstvene dejavnosti oziroma veterinarske dejavnosti, ki:
– opravlja zdravstveno dejavnost, ob izključni poklicni odgovornosti zdravnika v skladu s posamičnim naročilom za posamično nerutinsko pripravljeno zdravilo za napredno zdravljenje za posameznega pacienta oziroma
– opravlja veterinarsko dejavnost, ob izključni poklicni odgovornosti veterinarja v skladu s posamičnim naročilom za posamično žival ali skupino živali iz iste posesti.
51. Neželeni učinek zdravila za uporabo v humani medicini je odziv pacienta na zdravilo, ki je škodljiv in nenameren.
52. Neželeni učinek zdravila za uporabo v veterinarski medicini je škodljiva in nepričakovana reakcija, do katere lahko pride pri odmerkih, ki se pri živalih običajno uporabljajo za preprečevanje, diagnosticiranje ali zdravljenje bolezni ali za ponovno vzpostavitev, izboljšanje ali spremembo fiziološke funkcije.
53. Neželeni učinek zdravila v kliničnem preskušanju zdravila je vsak škodljiv ali nepredviden odziv na zdravilo v preskušanju, povezan z danim odmerkom.
54. Obveznost opravljanja storitev v javnem interesu je obveznost veletrgovcev, da zagotavljajo stalen in ustrezen nabor zdravil, s katerim zadoščajo zahtevam v Republiki Sloveniji na njenem celotnem ozemlju in v ustrezno kratkem času, ki ga na podlagi dokazljive zdravstvene potrebe oziroma zdravstvene dokumentacije določi izvajalec zdravstvene dejavnosti, in dostavljajo zahtevane dobave v Republiki Sloveniji.
55. Odpoklic določene serije zdravila je vsaka aktivnost, povezana z namenom umika serije zdravila iz prometa in iz uporabe zaradi neustrezne kakovosti serije zdravila ali zaradi ukrepa v sistemu farmakovigilance.
56. Označevanje zdravila so podatki na stični ali zunanji ovojnini.
57. Paralelna distribucija zdravila je vnos zdravila, ki je pridobilo dovoljenje za promet z zdravilom po centraliziranem postopku, iz ene v drugo državo članico Evropske unije ali Evropskega gospodarskega prostora (v nadaljnjem besedilu: EGP), ko ga, v skladu s predpisi, opravlja veletrgovec, ki je poslovno nepovezan pri prometu s tem zdravilom z imetnikom dovoljenja za promet z zdravilom.
58. Podobno biološko zdravilo je zdravilo, ki je podobno biološkemu referenčnemu zdravilu z dovoljenjem za promet. Učinkovina v podobnem biološkem zdravilu je podobna učinkovini v referenčnem biološkem zdravilu. Podobnost referenčnemu zdravilu mora biti dokazana z vidika kakovosti, biološke aktivnosti, varnosti in učinkovitosti na podlagi primerjalnih raziskav. Odmerjanje in pot dajanja morata biti enaka kot pri referenčnem biološkem zdravilu. Vsako odstopanje glede oblikovanja zdravila ali njegovih pomožnih snovi mora biti ustrezno utemeljeno in podprto z dodatnimi raziskavami.
59. Paralelni uvoz zdravila je vnos zdravila, ki ima dovoljenje za promet v državi izvoznici in je zadosti podobno zdravilu, ki je v Republiki Sloveniji pridobilo dovoljenje za promet po nacionalnem postopku ali po postopku z medsebojnim priznavanjem oziroma decentraliziranem postopku in se z dovoljenjem za promet s paralelno uvoženim zdravilom, ki ga izda JAZMP, vnaša v Republiko Slovenijo, pri čemer paralelni uvoz zdravila opravlja veletrgovec, poslovno nepovezan pri prometu s tem zdravilom z imetnikom dovoljenja za promet z zdravilom.
60. Poklicna izpostavljenost zdravilu je izpostavljenost zdravilu na delovnem mestu.
61. Polizdelek je izdelek, ki je prešel vse faze proizvodnje, razen pakiranja v zunanjo ovojnino.
62. Ponarejeno zdravilo je vsako zdravilo, pri katerem je lažno predstavljena:
– identiteta, vključno z ovojnino in označevanjem ali ime ali sestava katerekoli od sestavin, vključno s pomožnimi snovmi in njihovo jakostjo,
– izvor, vključno s proizvajalcem, državo proizvodnje, državo porekla ali imetnikom dovoljenja za promet z zdravilom ali
– zgodovina, vključno z zapisi in dokumentacijo o uporabljenih distribucijskih poteh.
Ta opredelitev ne velja za nenamerne napake v kakovosti in ne posega v kršitve pravic intelektualne lastnine.
63. Pomožna snov je vsaka sestavina zdravila, ki ni učinkovina ali ovojnina.
64. Posameznik ali posameznica (v nadaljnjem besedilu: posameznik) je določena ali določljiva fizična oseba, ki se jo lahko neposredno ali posredno identificira.
65. Posamezno mesto proizvodnje je omejen prostor, ki v razmerju do okolice predstavlja zaključeno celoto, in znotraj katerega imetnik dovoljenja za proizvodnjo zdravil opravlja aktivnosti proizvodnje zdravil.
66. Posamezne aktivnosti proizvodnje so aktivnosti proizvodnje zdravil, ki so opredeljene kot izdelava polizdelkov, izdelava končnih oblik v ožjem pomenu, primarno pakiranje, zunanje pakiranje, sprostitev serij končnega zdravila, kontrola kakovosti in uvoz zdravil. Delijo se glede na namembnost zdravila, na aktivnosti proizvodnje zdravil za uporabo v humani in veterinarski medicini in glede na stopnjo razvoja na aktivnosti proizvodnje zdravil in aktivnosti proizvodnje zdravil v kliničnem preskušanju. Aktivnosti proizvodnje končnih oblik v ožjem pomenu se delijo glede na farmacevtske oblike. Aktivnosti kontrole kakovosti se delijo glede na vrsto izvajanih testov, proizvodnje zdravil za uporabo v humani in veterinarski medicini in glede na stopnjo razvoja na aktivnosti proizvodnje zdravil ter aktivnosti proizvodnje zdravil v kliničnem preskušanju. Aktivnosti proizvodnje končnih oblik v ožjem pomenu se delijo glede na farmacevtske oblike. Aktivnosti kontrole kakovosti se delijo glede na vrsto izvajanih testov.
67. Poslovni subjekti so domače in tuje pravne osebe, samostojni podjetniki posamezniki, posamezniki, ki samostojno opravljajo dejavnost in druge fizične osebe, ki opravljajo registrirane dejavnosti, ali s predpisom ali z aktom o ustanovitvi določene dejavnosti.
68. Posredništvo zdravil ali učinkovin ali obojega so dejavnosti, povezane s prodajo ali nabavo zdravil ali učinkovin ali obojega, razen prometa na debelo, ki ne vključujejo stika z učinkovino ali z zdravilom in predstavljajo neodvisno posredovanje v imenu drugega poslovnega subjekta.
69. Postopek z medsebojnim priznavanjem je postopek za pridobitev dovoljenja za promet z zdravilom, ki se po odobritvi v referenčni državi članici, začne v zadevnih državah članicah Evropske unije in je obvezen za zdravila, ki se ne obravnavajo po centraliziranem ali decentraliziranem postopku izdaje dovoljenja za promet z zdravilom in ki bodo na trgu v več kakor eni državi članici Evropske unije, kakor to določata Direktiva 2001/83/ES in Direktiva 2001/82/ES.
70. Predmešanica za pripravo zdravilne krmne mešanice oziroma premiks za izdelavo medicirane krme je zdravilo za uporabo v veterinarski medicini, pripravljeno vnaprej za nadaljnjo izdelavo medicirane krme.
71. Prednost preskrbe z industrijsko izdelanimi zdravili iz slovenske plazme (to je iz sveže zamrznjene plazme za predelavo, zbrane v Republiki Sloveniji) je načelo, na podlagi katerega se izvaja preskrba z zdravili iz Evropske unije iz tuje plazme na podlagi dovoljenja za promet, če se z zdravili iz slovenske plazme ne pokrije vseh potreb po teh zdravilih v Republiki Sloveniji, razen kadar je vnos ali uvoz določenega zdravila iz tuje plazme strokovno utemeljen ali za to obstaja strateški razlog, do katerega se opredelita Strateški svet za zdravila ter Strokovni svet za preskrbo s krvjo in z zdravili iz plazme.
72. Preveliko odmerjanje je uporaba take količine zdravila v enem odmerku ali kumulativno, ki glede na dovoljenje za promet z zdravilom in ob upoštevanju klinične presoje presega največji dovoljen odmerek.
73. Prihod zdravila v promet pomeni prvo opravljeno aktivnost v prometu z zdravilom, ki omogoča preskrbo trga s tem zdravilom in njegovo dostopnost končnemu uporabniku.
74. Promet z učinkovinami in pomožnimi snovmi na debelo pomeni aktivnosti nakupa, shranjevanja, prodaje, vnosa, uvoza, iznosa ali izvoza učinkovin.
75. Promet z zdravili na debelo so aktivnosti nakupa, vnosa, shranjevanja, iznosa, izvoza, prodaje zdravil, razen izdaje zdravil v prometu na drobno končnim uporabnikom.
76. Promet z zdravili na drobno so aktivnosti nakupa, shranjevanja in izdaje zdravila ali uporaba zdravila ob zdravstveni ali veterinarski storitvi.
77. Radiofarmacevtski izdelki so radiofarmaki, radionuklidni predhodniki, radionuklidni generatorji in kompleti za pripravo radiofarmakov, in sicer:
– radiofarmak je zdravilo, ki, takrat, ko je pripravljeno za uporabo, vsebuje enega ali več radionuklidov (radioaktivnih izotopov), namenjenih za uporabo v humani in veterinarski medicini,
– radionuklidni generator je sistem z vgrajenim trdno vezanim starševskim radionuklidom, iz katerega nastane potomčev radionuklid, ki ga lahko ločimo s spiranjem ali drugo metodo, in se uporablja kot radiofarmak ali radionuklidni predhodnik,
– radionuklidni predhodnik je radionuklid, ki se v procesu priprave radiofarmaka uporablja za označevanje druge snovi, pri čemer označevanje poteka pred dajanjem pacientu,
– komplet za pripravo radiofarmaka je vsak izdelek, ki ga rekonstituiramo ali kombiniramo z radionuklidi (radionuklidnimi predhodniki) v končni radiofarmak, navadno pred dajanjem pacientu.
78. Razmerje med koristjo in tveganjem je ocena pozitivnih učinkov zdravljenja z zdravilom v primerjavi s tveganji, na način kot določa ta zakon.
79. Referenčna država članica je država, ki v postopku z medsebojnim priznavanjem ali decentraliziranem postopku izdela poročilo o oceni zdravila, na podlagi katerega se zadevne države članice Evropske unije odločajo o sprejemljivosti razmerja med koristjo in tveganjem oziroma o oceni kakovosti, varnosti in učinkovitosti zdravila v skladu z Direktivo 2001/83/ES in Direktivo 2001/82/ES.
80. Referenčno zdravilo je zdravilo, ki je pridobilo dovoljenje za promet v skladu s 44. členom tega zakona in se na njegovo dokumentacijo sklicujejo drugi predlagatelji ob upoštevanju 59. člena tega zakona.
81. Resen neželen učinek zdravila za uporabo v humani medicini je neželen učinek, ki povzroči smrt, neposredno življenjsko ogroženost, zahteva bolnišnično obravnavo ali podaljšanje obstoječe bolnišnične obravnave, dolgotrajno ali izrazito nezmožnost ali nesposobnost, prirojeno anomalijo ali okvaro ob rojstvu pacienta.
82. Resen neželen učinek zdravila za uporabo v veterinarski medicini je neželen učinek zdravila, ki povzroči pogin, neposredno življenjsko ogroženost, izrazito nezmožnost ali nesposobnost, prirojeno anomalijo, okvaro ob rojstvu, ali povzroči trajne ali dolgotrajnejše bolezenske znake pri obravnavanih živalih.
83. Serija zdravila je določena količina zdravila s pričakovano homogenostjo, ki je proizvedena v okviru enega procesa oziroma zaporedja procesov in je identificirana z jasno opredeljeno kombinacijo znakov, ki so številke ali črke. Vključuje vse enote farmacevtske oblike, ki so proizvedene iz iste začetne količine snovi in so bile vključene v isto zaporedje proizvodnih procesov ali isti proces sterilizacije. V primeru neprekinjenega procesa proizvodnje vsebuje vse enote, proizvedene v določenem časovnem obdobju.
84. Sistem farmakovigilance je sistem spremljanja in poročanja, ki ga upravljajo imetniki dovoljenj za promet z zdravili in države članice Evropske unije za izpolnjevanje nalog in odgovornosti na podlagi tega zakona in katerega namen je spremljati zdravila, ki so pridobila dovoljenje za promet, in odkrivanje sprememb razmerja med koristjo in tveganjem pri uporabi zdravil.
85. Sistem hitrega obveščanja je komunikacijski sistem organov, pristojnih za zdravila držav članic Evropske unije in Evropske unije, vzpostavljen z namenom takojšnjega medsebojnega in po potrebi širšega obveščanja o nastalem novem tveganju za javno zdravje, povezanim z varnostjo ali kakovostjo zdravila, ter z namenom zmanjševanja tega tveganja.
86. Sistem obvladovanja tveganj je sklop dejavnosti v sistemu farmakovigilance in ukrepov za ugotovitev, opredelitev, preprečevanje ali zmanjševanje tveganj v zvezi z zdravilom, vključno z oceno učinkovitosti navedenih dejavnosti in ukrepov.
87. Sočutna uporaba je dajanje zdravila z novo učinkovino, ki predstavlja pomembno terapevtsko, znanstveno in tehnično inovacijo in je v postopku pridobitve dovoljenja za promet z zdravilom oziroma v postopku kliničnega preskušanja zdravila, na voljo skupini pacientov s kronično ali resno izčrpavajočo boleznijo, ki je ni mogoče zadovoljivo zdraviti z zdravili, ki imajo dovoljenje za promet, kot to določa 83. člen Uredbe 726/2004/ES.
88. Specializirana prodajalna za zdravila je prodajni objekt, kjer poslovni subjekt na podlagi dovoljenja JAZMP, opravlja dejavnost prometa na drobno s tistimi zdravili, ki se na podlagi tega zakona izdajajo brez recepta v lekarnah in specializiranih prodajalnah.
89. Splošno ime zdravila je mednarodno nelastniško ime, ki ga priporoča Svetovna zdravstvena organizacija, ali če tega imena ni, običajno splošno ime.
90. Sponzor oziroma sponzorka (v nadaljnjem besedilu: sponzor) je poslovni subjekt oziroma posameznik, ki prevzame odgovornost za začetek, vodenje oziroma financiranje kliničnega preskušanja zdravila.
91. Stična ovojnina je vsebnik ali druga oblika ovojnine, ki je v neposrednem stiku z zdravilom.
92. Študija o varnosti zdravila po pridobitvi dovoljenja za promet z zdravilom za uporabo v humani medicini je vsaka študija o tem zdravilu, katere cilj je ugotovitev, opredelitev ali količinska določitev tveganja, ki potrjujejo varnostne lastnosti zdravila, ali merjenje učinkovitosti ukrepov za obvladovanje tveganj.
93. Študija o varnosti zdravila po pridobitvi dovoljenja za promet z zdravilom za uporabo v veterinarski medicini je farmakoepidemiološka študija ali klinično preskušanje zdravila, ki se izvede v skladu s pogoji dovoljenja za promet z zdravilom, da bi se odkrila in raziskala morebitna tveganja glede varnosti zdravila.
94. Tradicionalno zdravilo rastlinskega izvora je tisto zdravilo rastlinskega izvora, katerega lastnosti je mogoče prepoznati na podlagi njegove tradicionalne uporabe in izpolnjuje pogoje, ki jih določata ta zakon in Direktiva 2001/83/ES.
95. Tretje države so države, ki niso članice Evropske unije oziroma EGP.
96. Tveganje, povezano z uporabo zdravila, je:
– vsako tveganje za nastanek neželenih učinkov na okolje ali
– vsako tveganje za zdravje pacienta oziroma živali ali javno zdravje, ki je povezano s kakovostjo, varnostjo ali učinkovitostjo zdravila.
97. Učinkovina oziroma zdravilna učinkovina je vsaka snov ali mešanica snovi, namenjena uporabi v proizvodnji zdravil, ki v postopku proizvodnje postane aktivna sestavina zdravila, katerega namen je farmakološko, imunološko ali presnovno delovanje, da bi se ponovno vzpostavile, izboljšale ali spremenile fiziološke funkcije ali da bi se določila diagnoza.
98. Uradna kontrola kakovosti zdravila je ugotavljanje kakovosti zdravila, v skladu z dovoljenjem za promet oziroma z določbami tega zakona, ki vključuje analizno preskušanje zdravila ali preverjanje istovetnosti označevanja in navodila za uporabo ali oboje.
99. Uradni kontrolni laboratorij je laboratorij, ki opravlja uradno kontrolo kakovosti zdravil ter je vključen v mrežo uradnih kontrolnih laboratorijev (GEON).
100. Uvoz zdravila je promet zdravila iz tretjih držav na ozemlje Republike Slovenije, ki ga lahko opravljajo le imetniki dovoljenja za proizvodnjo zdravil, če to dovoljenje vključuje aktivnost uvoza. Uvoz zdravila je tudi prenos zdravila iz tretjih držav na ozemlje Republike Slovenije, kadar zdravilo za svojo osebno uporabo oziroma za osebno uporabo njegovih ožjih družinskih članov oziroma na podlagi pooblastila za osebno uporabo največ enega posameznika, ki ni njegov družinski član, ali za svojo posamezno žival prinaša posameznik.
101. Veletrgovec z zdravili je poslovni subjekt, ki na podlagi dovoljenja JAZMP opravlja dejavnost prometa z zdravili na debelo, z namenom ali brez namena pridobivanja dobička.
102. Vmesni izdelek je delno obdelan material, ki se mora obdelati z nadaljnjimi postopki preden postane polizdelek.
103. Vnos zdravila je promet zdravila na debelo iz druge države članice Evropske unije v Republiko Slovenijo. Vnos zdravila je tudi prenos zdravila iz ozemlja drugih držav članic Evropske unije na ozemlje Republike Slovenije, kadar zdravilo za svojo osebno uporabo oziroma za osebno uporabo njegovih ožjih družinskih članov oziroma na podlagi pooblastila za osebno uporabo največ enega posameznika, ki ni njegov družinski član, ali za svojo posamezno žival prinaša posameznik.
104. Zaščitni element je podatek na zunanji ovojnini zdravila za uporabo v humani medicini, ki trgovcem na debelo in pristojnim osebam za preskrbo z zdravili na drobno v lekarnah in specializiranih prodajalnah omogoča, da preverijo avtentičnost zdravila in identificirajo posamezno pakiranje.
105. Zadevna država članica je država, ki v postopku z medsebojnim priznavanjem ali v decentraliziranem postopku odloča o sprejemljivosti razmerja med koristjo in tveganjem oziroma o oceni kakovosti, varnosti in učinkovitosti zdravila na podlagi poročila o oceni, ki ga je izdelala referenčna država članica Evropske unije.
106. Zdravila iz krvi ali plazme so industrijsko proizvedena zdravila, kot na primer zdravila, ki vsebujejo zlasti albumine, faktorje strjevanja krvi in imunoglobuline človeškega izvora, ki jih iz krvnih sestavin, pridobljenih v skladu s predpisi, ki urejajo preskrbo s krvjo in krvnimi pripravki in s predpisi, ki urejajo zdravila, proizvajajo za to dejavnost specializirani poslovni subjekti.
107. Zdravilna krmna mešanica oziroma medicirana krma je vsaka mešanica zdravila za uporabo v veterinarski medicini in krme, ki je pripravljena za prodajo in namenjena krmljenju živali brez nadaljnje predelave, zaradi zdravilnih, preventivnih ali drugih lastnosti zdravil.
108. Zdravilo rastlinskega izvora je zdravilo, ki kot učinkovine vsebuje izključno eno ali več rastlinskih snovi, enega ali več pripravkov rastlinskega izvora, ali eno ali več rastlinskih snovi v kombinaciji z enim ali več pripravki rastlinskega izvora.
109. Zdravilo sirota je zdravilo, ki je namenjeno za zdravljenje zelo resnih in zelo redkih bolezni, za katere ni druge dovoljene metode zdravljenja, preprečevanja in diagnosticiranja, vendar brez spodbud promet z njimi ni dovolj donosen za upravičenje potrebne naložbe za njegov razvoj in promet, in je določeno kot zdravilo sirota v skladu s pogoji iz Uredbe (ES) št. 141/2000 Evropskega parlamenta in Sveta z dne 16. decembra 1999 o zdravilih sirotah (UL L št. 18 z dne 22. 1. 2000), zadnjič spremenjene z Uredbo 596/2009/ES.
110. Zdravilo za napredno zdravljenje je zdravilo, kakor je opredeljeno v 2. členu Uredbe 1394/2007/ES.
111. Zdravniški oziroma veterinarski recept je listina, ki jo v skladu s predpisi izda strokovnjak, usposobljen in pooblaščen za predpisovanje zdravil.
112. Zloraba zdravila je trajna ali občasna namerna prekomerna uporaba zdravila, ki jo spremljajo škodljivi fizični ali psihološki učinki.
113. Zunanja ovojnina zdravila je ovojnina, v katero je vloženo zdravilo v stični ovojnini.
II. ZDRAVILA NA TRGU
7. člen
(razmerje med zdravili in drugimi izdelki)
(1) Če izdelek po definiciji in ob upoštevanju vseh njegovih značilnosti lahko hkrati sodi v opredelitev zdravila in v opredelitev izdelka, ki je predmet drugih predpisov, se v primeru dvoma uporabijo določbe tega zakona.
(2) O opredelitvi iz prejšnjega odstavka odloča JAZMP v upravnem postopku s posebnim ugotovitvenim postopkom na podlagi vloge proizvajalca ali poslovnega subjekta, ki opravlja oziroma namerava opravljati promet z izdelkom iz prejšnjega odstavka, ali po uradni dolžnosti. Pri tem upošteva:
– kakovostno in količinsko sestavo izdelka,
– namen in način uporabe,
– ali ima izdelek oziroma njegove sestavine farmakološko, imunološko ali metabolično delovanje,
– ali se izdelku pripisujejo neposredni ali posredni učinki za zdravljenje, preprečevanje ali diagnosticiranje bolezni,
– predstavitev izdelka in vtis, ki ga izdelek naredi na končnega uporabnika oziroma kupca,
– možne neželene učinke in povezana tveganja za posameznika in za javno zdravje,
– poznavanje izdelka pri končnih uporabnikih oziroma kupcih,
– najnovejša znanstvena spoznanja in
– smernice Evropske unije, ki jih objavi JAZMP na svoji spletni strani in nacionalne smernice, ki jih pripravi in objavi JAZMP na svoji spletni strani.
(3) Vloga iz prejšnjega odstavka vsebuje podatke o kakovostni in količinski sestavi izdelka, o varnosti izdelka, predstavitvi izdelka končnim uporabnikom oziroma kupcem na ovojnini, priloženih lističih ali brošurah, spletnih straneh, ustno ali na kakršenkoli drug način in o statusu izdelka v državah članicah Evropske unije.
(4) Stroške postopka na podlagi vloge iz drugega odstavka tega člena plača proizvajalec ali poslovni subjekt, ki opravlja oziroma namerava opravljati promet z izdelkom iz prvega odstavka tega člena.
8. člen
(razmerje med industrijsko proizvedenimi zdravili in galenskimi zdravili)
(1) Zdravila, pri katerih se iz vhodnih snovi izdela v lekarni ali v galenskem laboratoriju lekarne največ 50.000 pakiranj na letni ravni, se obravnavajo kot galenska zdravila, ki jih določajo predpisi, ki urejajo lekarniško dejavnost.
(2) Kot galenska zdravila se ne smejo izdelovati:
– zdravila z enako sestavo učinkovin v enaki ali primerljivi obliki učinkovine, enako ali primerljivo sestavo pomožnih snovi, enako ali primerljivo farmacevtsko obliko in enako ali primerljivo jakostjo, kot jih imajo zdravila z dovoljenjem za promet v Republiki Sloveniji in so prisotna na trgu,
– homeopatska zdravila ali
– zdravila, ki se ne uporabljajo v državah članicah Evropske unije ter v tretjih državah, kjer imajo primerljive zahteve glede kakovosti, varnosti in učinkovitosti zdravil kot Evropska unija.
(3) Galensko zdravilo se lahko izdaja do izteka roka uporabnosti, vendar najdalj šest mesecev po datumu objave prihoda na trg enakega ali primerljivega industrijsko proizvedenega zdravila, kot ga objavi JAZMP na svoji spletni strani v skladu s tretjim odstavkom 24. člena tega zakona.
(4) Industrijsko proizvedenih zdravil, intermediatov, vmesnih izdelkov ali polizdelkov ni dovoljeno uporabiti za izdelavo galenskih zdravil, razen v izjemnih primerih v interesu varovanja javnega zdravja ob nevarnosti za zdravje ljudi in živali, če to na predlog razširjenega strokovnega kolegija za lekarniško dejavnost po predhodnem mnenju Strateškega sveta za zdravila odobri minister.
(5) Ne glede na določbo prvega odstavka tega člena lekarna lahko izdeluje galensko zdravilo v večji količini na podlagi predhodne odobritve JAZMP, če na trgu ni prisotno industrijsko proizvedeno zdravilo, ki je uvrščeno v seznam esencialnih zdravil oziroma v seznam nujno potrebnih zdravil v Republiki Sloveniji.
(6) JAZMP lahko lekarni odobri izdelavo galenskega zdravila iz prejšnjega odstavka v posebnem ugotovitvenem postopku na podlagi vloge lekarne, v kateri lekarna dokaže utemeljenost povečanih količin.
9. člen
(prepoved neustrezne predstavitve izdelkov)
(1) Prepovedano je oglaševati in dajati v promet izdelke, kakorkoli predstavljene z lastnostmi za zdravljenje ali preprečevanje bolezni pri ljudeh ali živalih, če po tem zakonu ne veljajo za zdravila.
(2) Izvajalci zdravstvene, veterinarske in lekarniške dejavnosti izdelkov, ki po tem zakonu ne veljajo za zdravila, ne smejo predstavljati pacientom ali kupcem z lastnostmi za zdravljenje in preprečevanje bolezni.
10. člen
(enakovrednost zahtev za proizvodnjo in uvoz zdravil)
Določbe tega zakona o proizvodnji in uvozu zdravil se uporabljajo tudi za zdravila, ki so namenjena dajanju v promet zunaj ozemlja Republike Slovenije ter za vmesne izdelke, polizdelke, intermediate, učinkovine in pomožne snovi.
11. člen
(izjeme glede uporabe tega zakona)
Določbe tega zakona se ne uporabljajo za:
1. magistralna zdravila, ki jih urejajo predpisi o lekarniški dejavnosti,
2. galenska zdravila, ki jih urejajo predpisi o lekarniški dejavnosti, razen v delu, ki določa količinsko razmejitev med industrijsko proizvedenimi zdravili in galensko izdelanimi zdravili v lekarnah oziroma v njihovih galenskih laboratorijih,
3. zdravila, namenjena za raziskave in razvojna preskušanja, vendar brez vpliva na izvajanje določb o kliničnem preskušanju zdravil,
4. intermediate, vmesne izdelke in polizdelke, namenjene za nadaljnjo predelavo s strani imetnikov dovoljenja za proizvodnjo zdravil v zdravila, za katera bo izdano dovoljenje za promet, razen za področje proizvodnje in uvoza zdravil v skladu z določbami prejšnjega člena,
5. radioaktivne izotope v obliki zaprtih virov, ki jih urejajo predpisi o varstvu pred ionizirajočimi sevanji in jedrski varnosti,
6. kri, plazmo ali krvne celice, ki jih urejajo predpisi o preskrbi s krvjo, razen za plazmo pripravljeno po metodi, ki vključuje industrijski postopek in se uporablja za proizvodnjo zdravil,
7. človeška tkiva in celice, namenjene za zdravljenje ljudi, ki jih urejajo predpisi o kakovosti in varnosti človeških tkiv in celic, namenjenih za zdravljenje,
8. medicirano krmo oziroma zdravilne krmne mešanice, ki jih urejajo predpisi o krmi,
9. krmne dodatke, ki jih urejajo predpisi o krmi,
10. zdravila za uporabo v veterinarski medicini, ki so predvidena izključno za akvarijske ribice, okrasne ptice v kletkah, terarijske živali, majhne glodavce in bele dihurje, glede določb 5. do 8. člena Direktive 2001/82/ES, pod pogojem, da ta zdravila ne vsebujejo snovi, katerih uporaba zahteva veterinarski nadzor in da so bili izvedeni vsi ukrepi, potrebni za preprečitev nedovoljene uporabe teh zdravil za druge živali.
12. člen
(razvrščanje zdravil po anatomsko-terapevtsko-kemični klasifikaciji in določitev definiranega dnevnega odmerka)
(1) Zdravila, ki so v prometu v Republiki Sloveniji, se razvrščajo po anatomsko-terapevtsko-kemični klasifikaciji zdravil (v nadaljnjem besedilu: ATC klasifikacija zdravil za zdravila za uporabo v humani medicini oziroma ATCvet za zdravila za uporabo v veterinarski medicini) in metodologiji določanja definiranega dnevnega odmerka (v nadaljnjem besedilu: DDD), ki je objavljena na spletnih straneh WHO Collaborating Centre for Drug Statistics Methodology, Oslo, Norveška (http://www.whocc.no), v njihovem vsakokratnem veljavnem besedilu.
(2) JAZMP zagotavlja prevod ATC klasifikacije zdravil in enotno nacionalno poimenovanje zdravilnih učinkovin ter DDD za zdravila za uporabo v humani medicini, in prevod ATCvet klasifikacije zdravil za zdravila za uporabo v veterinarski medicini, ki so v prometu v Republiki Sloveniji in jih objavlja na svoji spletni strani.
13. člen
(nacionalni identifikator zdravil)
(1) JAZMP določa nacionalni identifikator zdravil, ki enolično določa zdravilo na ravni učinkovine, farmacevtske oblike, jakosti, pakiranja in imetnika dovoljenja, s katerim se daje v promet v Republiki Sloveniji.
(2) Natančnejšo opredelitev, način in postopek določanja in evidentiranja nacionalnega identifikatorja zdravil in obvezne uporabnike določi minister.
14. člen
(razvrščanje zdravil glede na predpisovanje in izdajanje)
(1) Zdravila se glede na predpisovanje in izdajanje razvrščajo v:
– zdravila, za izdajo katerih je potreben zdravniški ali veterinarski recept,
– zdravila, za izdajo katerih zdravniški ali veterinarski recept ni potreben.
(2) Natančnejšo opredelitev, način razvrščanja ter način predpisovanja in izdajanja zdravil določi minister.
15. člen
(sprememba razvrstitve zdravila glede na predpisovanje in izdajanje ter zaščita podatkov)
(1) Imetnik dovoljenja za promet z zdravilom lahko pri JAZMP vloži vlogo za spremembo razvrstitve zdravil, za predpisovanje in izdajo katerih je potreben zdravniški ali veterinarski recept, med zdravila, za predpisovanje in izdajo katerih zdravniški ali veterinarski recept ni več potreben. V vlogi predloži rezultate nekliničnih farmakološko-toksikoloških preskusov ali kliničnih preskušanj zdravil, s katerimi utemeljuje spremembo razvrstitve zdravila.
(2) Kadar JAZMP izda dovoljenje za promet z zdravilom s spremenjeno razvrstitvijo iz prejšnjega odstavka na podlagi rezultatov pomembnih nekliničnih farmakološko-toksikoloških preskusov ali kliničnih preskušanj zdravila, v odločitvi za spremembo razvrstitve zdravila drugega imetnika dovoljenja za promet z zdravilom z isto učinkovino eno leto od izdaje dovoljenja za promet z zdravilom s spremenjeno razvrstitvijo ne sme upoštevati rezultatov preskusov ali preskušanj zdravila, ki jih je predložil imetnik dovoljenja iz prejšnjega odstavka.
(3) Sprememba razvrstitve zdravila iz tega člena se obravnava kot sprememba dovoljenja za promet z zdravilom v skladu z 62. členom tega zakona.
16. člen
(uvoz, izvoz, vnos in iznos zdravil za osebno porabo in uporabo pri svoji živali)
(1) Uvoz in izvoz zdravil s strani posameznikov je prepovedan.
(2) Ne glede na prejšnji odstavek lahko posameznik za svojo osebno uporabo, za osebno uporabo njegovih ožjih družinskih članov oziroma na podlagi pooblastila za osebno uporabo največ enega posameznika, ki ni njegov družinski član, ali za svojo posamezno žival, katere vrsta se ne uporablja za pridobivanje oziroma za proizvodnjo živil, vnese oziroma uvozi ali izvozi oziroma iznese v svoji osebni prtljagi zdravilo v količini, ki ustreza zadevni terapevtski uporabi, in sicer:
– za akutna stanja za največ tri tedne,
– za kronične bolezni oziroma stanja, pri katerih je potrebna dolgotrajna uporaba zdravil, za največ tri mesece skladno s predpisanim odmerjanjem, oziroma izjemoma za obdobje do 12 mesecev, če posameznik organu, pristojnemu za carinske zadeve, predloži dokazila o dovoljenem bivanju v tem obdobju v ciljni državi, če predpisi s področja prepovedanih drog ne določajo drugače.
(3) Pri uvozu oziroma vnosu zdravila za osebno uporabo iz prejšnjega odstavka, za katera je potreben zdravniški oziroma veterinarski recept, lahko organ, pristojen za carinske zadeve, od posameznika zahteva dokazilo o zdravniškem oziroma veterinarskem receptu za ta zdravila.
17. člen
(esencialna in nujno potrebna zdravila)
(1) Esencialna zdravila so zdravila, ki so na podlagi najnovejših dognanj v biomedicinskih znanostih in sistemskih opredelitev v okviru nacionalnih zdravstvenih prioritet ob upoštevanju vzdržnosti javnih sredstev prepoznana kot nujno potrebna za izvajanje zdravstvenega varstva ljudi oziroma živali in so uvrščena v seznam esencialnih zdravil.
(2) Zdravila so v seznamu esencialnih zdravil opredeljena s splošnim imenom, farmacevtsko obliko in jakostjo ter načinom predpisovanja in izdajanja.
(3) Pri uvrščanju zdravil v seznam esencialnih zdravil se upoštevajo naslednja merila:
– da je zdravilo pomembno z vidika varovanja javnega zdravja,
– da je zdravilo pomembno z vidika izvajanja prednostnih nalog programa zdravstvenega varstva,
– da je zdravilo pomembno pri izvajanju prednostnih področij zdravljenja oseb in preprečevanja stanj, ki so opredeljena v resoluciji, ki se nanaša na nacionalni plan zdravstvenega varstva, ali v dokumentu Svetovne zdravstvene organizacije o prioritetnih programih zdravstvenega varstva v Evropi, ali so zdravila izbora v izrednih primerih z namenom obvladovanja groženj javnemu zdravju (ob nesrečah večjih razsežnosti, infekcijah, epidemijah, pandemijah, zastrupitvah, sevanjih, vključno z jodno profilakso in podobno) ali iz drugih razlogov, ki so v interesu varovanja javnega zdravja ali
– da je zdravilo pomembno z etičnega vidika.
(4) Seznam esencialnih zdravil za uporabo v humani medicini določi minister na predlog JAZMP, seznam esencialnih zdravil za uporabo v veterinarski medicini pa minister, pristojen za veterinarstvo na predlog JAZMP.
(5) Nujno potrebna zdravila so zdravila, ki niso vključena v seznam esencialnih zdravil iz prvega odstavka tega člena in za katera izvajalec zdravstvene dejavnosti na terciarni ravni ali razširjeni strokovni kolegij za svoje področje pristojnosti utemelji nastanek nove zdravstvene potrebe in jih na tej podlagi ter ob upoštevanju meril iz tretjega odstavka tega člena JAZMP uvrsti v seznam nujno potrebnih zdravil.
(6) Seznama iz četrtega odstavka tega člena pristojna ministra objavljata najmanj enkrat letno, najpozneje do 31. januarja tekočega leta in pri tem upoštevata zdravila na seznamu iz prejšnjega odstavka.
(7) Opisu esencialnega zdravila v seznamu iz prvega odstavka tega člena oziroma opisu nujno potrebnega zdravila iz petega odstavka tega člena lahko hkrati ustreza več zdravil, ki so lahko v Republiki Sloveniji v prometu na podlagi prvega in drugega odstavka 20. člena tega zakona in imajo enako ATC klasifikacijsko oznako na peti ravni, enako sestavo učinkovin in ustrezno farmacevtsko obliko.
(8) Če v prometu v Republiki Sloveniji ni zdravil iz prvega ali drugega odstavka 20. člena tega zakona, ki bi ustrezala opisu esencialnega zdravila s seznama esencialnih zdravil ali opisu nujno potrebnega zdravila s seznama nujno potrebnih zdravil, JAZMP začasno dovoli promet z zdravilom, ki je lahko v prometu v skladu s tretjo alinejo tretjega odstavka 20. člena tega zakona.
(9) Opisu esencialnega zdravila s seznama iz prvega odstavka tega člena ter opisu nujno potrebnega zdravila iz seznama iz petega odstavka tega člena lahko ustreza tudi galensko zdravilo, ki je lahko v prometu v skladu z določbami tega zakona.
(10) Seznama esencialnih zdravil in seznam nujno potrebnih zdravil se objavijo na spletni strani JAZMP.
18. člen
(dajanje v promet in dostopnost zdravil sirot)
Pri dajanju zdravil sirot v promet in njihovi dostopnosti se upošteva strokovna doktrina na področju resnih in redkih bolezni v Republiki Sloveniji.
19. člen
(medsebojno zamenljiva zdravila)
(1) Medsebojno zamenljiva zdravila za uporabo v humani medicini so tista, ki jih JAZMP določi in objavi kot primerna za medsebojno zamenjavo, pri čemer upošteva, da mora biti pri teh zdravilih verjetnost nastanka klinično pomembnih razlik v učinkovitosti in varnosti ustrezno nizka oziroma zanemarljiva, in svojo odločitev opre na:
– ugotavljanje skupnih ali primerljivih lastnosti zdravil ali skupin zdravil v skladu z zahtevami tega zakona in na njegovi podlagi izdanih predpisov,
– upoštevanje dovoljenja za promet z zdravilom,
– vključevanje sodobnih spoznanj in izsledkov biomedicinske znanosti in stroke,
– farmakovigilančne podatke.
(2) Medsebojno zamenjevanje zdravil opravljajo osebe, pooblaščene za predpisovanje zdravil, ali osebe, pooblaščene za izdajanje zdravil, v skladu s posebnimi predpisi.
(3) JAZMP začne postopek za ugotavljanje medsebojne zamenljivosti zdravil:
– po uradni dolžnosti na lastno pobudo ali
– na pobudo pristojnega ministrstva, razširjenega strokovnega kolegija za zdravila ali nosilca pravic iz obveznega zdravstvenega zavarovanja (v nadaljnjem besedilu: nosilec OZZ), ali
– na podlagi vloge imetnika dovoljenja iz prvega odstavka 20. člena tega zakona.
(4) Postopek iz prve alineje prejšnjega odstavka se začne:
– z dnem začetka veljavnosti dovoljenja iz prvega odstavka 20. člena tega zakona;
– z dnem začetka veljavnosti podatkov iz drugega odstavka 20. člena tega zakona ali
– z dnem, ko JAZMP ugotovi nova dejstva in okoliščine, ki ustvarjajo podlago za ponovno ugotavljanje medsebojne zamenljivosti zdravil.
(5) JAZMP odloči o medsebojni zamenljivosti zdravil z odločbo v treh mesecih od dneva prejema popolne vloge oziroma začetka postopka, kadar se je ta začel po uradni dolžnosti. Pritožba ne zadrži izvršitve odločbe.
(6) JAZMP lahko od imetnika dovoljenja iz prvega odstavka 20. člena tega zakona zahteva dodano dokumentacijo oziroma podatke, v skladu s šestim odstavkom 3. člena tega zakona. Do izpolnitve zahtev postopek miruje.
(7) Natančnejše zahteve in postopek za ugotavljanje medsebojne zamenljivosti zdravil določi minister.
20. člen
(zdravilo v prometu)
(1) Zdravilo je lahko v prometu v Republiki Sloveniji, če ima dovoljenje za promet, dovoljenje za promet s paralelno uvoženim zdravilom oziroma potrdilo o priglasitvi paralelne distribucije ali dovoljenje za sočutno uporabo zdravil.
(2) Ne glede na prejšnji odstavek je lahko zdravilo, ki je dovoljenje za promet pridobilo po centraliziranem postopku, v prometu v Republiki Sloveniji, kadar na podlagi vloge imetnika dovoljenja za promet z zdravilom JAZMP zanj določi nacionalni identifikator zdravil in podatke iz 13. člena tega zakona.
(3) Ne glede na določbo prvega odstavka tega člena lahko JAZMP v naslednjih izjemnih primerih začasno dovoli promet z zdravilom, ki nima dovoljenja za promet:
– na podlagi zahteve lečečega zdravnika in mnenja odgovorne osebe klinike oziroma inštituta, oziroma za zdravila za uporabo v veterinarski medicini, na podlagi zahteve lečečega veterinarja, na njegovo osebno odgovornost, za potrebe enega ali več posameznih pacientov ali živali oziroma skupine živali,
– v izrednih primerih (infekcije, epidemije, pandemije, zastrupitve, sevanja in podobno), za namen izvajanja zaščitnih ukrepov ali iz drugih razlogov, ki so v interesu varovanja javnega zdravja,
– za zdravilo, ki je s svojo učinkovino, farmacevtsko obliko in jakostjo uvrščeno v seznam esencialnih zdravil ali nujno potrebnih zdravil iz 17. člena tega zakona, in v promet ni bilo dano enako zdravilo z dovoljenjem za promet oziroma zdravilo ni na trgu v Republiki Sloveniji v skladu s tem zakonom,
– za zdravila, zagotovljena iz proračunskih sredstev Republike Slovenije v skladu s 141. členom tega zakona, če ni v prometu zdravila z enako sestavo z dovoljenjem za promet v Republiki Sloveniji ali,
– ob pojavu epizootskih bolezni na predlog organa, pristojnega za veterinarstvo, z imunološkim zdravilom za uporabo v veterinarski medicini, ki nima dovoljenja za promet, če ni na voljo ustreznega zdravila, pri čemer organ, pristojen za veterinarstvo, vnaprej obvesti Evropsko komisijo o podrobnih pogojih uporabe.
(4) JAZMP v 30 dneh po prejemu popolne vloge izjemoma začasno dovoli promet z zdravili iz prejšnjega odstavka, razen v primerih iz druge in pete alineje prejšnjega odstavka, ko odloči najpozneje v sedmih dneh. JAZMP zahteva dopolnitev vloge za začasno dovoljenje za promet z zdravili iz druge in pete alineje prejšnjega odstavka najpozneje v petih dneh.
(5) JAZMP enkrat mesečno ministru oziroma ministru, pristojnemu za veterinarstvo, posreduje podatke o zdravilih, ki jim je bilo izdano začasno dovoljenje za promet z zdravilom.
(6) Predlagatelj za pridobitev začasnega dovoljenja za promet z zdravili iz tretjega odstavka tega člena je lahko veletrgovec z zdravili.
(7) Podrobnejše pogoje in postopek za izdajo začasnega dovoljenja za promet v primerih iz tretjega odstavka tega člena določi minister.
21. člen
(prepoved dajanja zdravila v promet)
Prepovedano je dajati v promet zdravilo, ki:
– nima dovoljenja iz prvega, drugega ali tretjega odstavka prejšnjega člena,
– nima odobritve iz petega in šestega odstavka 8. člena tega zakona,
– ni proizvedeno v skladu z dokumentacijo za dovoljenje za promet z zdravilom ali v skladu z dobro proizvodno prakso,
– mu je potekel rok uporabnosti ali
– mu je bila dokazana oporečnost njegove kakovosti, varnosti ali učinkovitosti.
22. člen
(odobritev posamičnega odstopa)
(1) Ne glede na določbe tretje alineje prejšnjega člena lahko JAZMP po izdaji dovoljenja za promet z zdravilom v izrednih primerih, ki so v interesu varovanja javnega zdravja, na predlog imetnika dovoljenja za promet odobri posamičen odstop od pogojev dovoljenja za promet z zdravilom, ki se nanaša na posamezno serijo ali manjše število serij posameznega zdravila. Imetnik dovoljenja za promet z zdravilom v vlogi predloži podatke o predlaganem obsegu ukrepa odobritve posamičnega odstopa, zagotovi dokazila, da odstop ne vpliva na kakovost, varnost in učinkovitost zdravila ter predlaga preventivne in korektivne ukrepe, ki jih bo izvedel za vzpostavitev preskrbe z zdravilom v okviru pogojev dovoljenja za promet.
(2) Podrobnejše pogoje in postopek odobritve posamičnega odstopa iz prejšnjega odstavka ter vsebino vloge določi minister.
23. člen
(ravnanje ob odstopanju od kakovosti in sumu na ponarejanje zdravila)
(1) Poslovni subjekti, ki so vključeni v promet z zdravilom, morajo JAZMP obvestiti o neustrezni kakovosti zdravila oziroma sumu na ponarejanje zdravila. JAZMP oceni podatke, zahteva in spremlja morebiten odpoklic zdravila ter odloči o načinu obveščanja javnosti o tem.
(2) Način in vsebino obveščanja poslovnih subjektov, ki so vključeni v promet z zdravilom, o odstopih od kakovosti zdravila in suma na ponarejanje zdravila določi minister.
24. člen
(obveščanje o dajanju zdravila v promet in sporočanje podatkov o obsegu prodaje, nabave, izdaje in porabe zdravil)
(1) Imetnik dovoljenja za promet z zdravilom, imetnik dovoljenja za promet s paralelno uvoženim zdravilom, imetnik potrdila o paralelni distribuciji in imetnik začasnega dovoljenja za promet z zdravilom iz tretje alineje tretjega odstavka 20. člena tega zakona najpozneje na dan prvega prihoda zdravila v promet v Republiki Sloveniji obvesti JAZMP o datumu dejanskega začetka prometa z zdravilom v Republiki Sloveniji oziroma o začetku dajanja zdravila v promet.
(2) O začasnem ali stalnem prenehanju opravljanja prometa z zdravilom ali motnjah v preskrbi z zdravilom imetnik iz prejšnjega odstavka obvesti JAZMP najpozneje dva meseca pred prenehanjem opravljanja prometa z zdravilom, razen v primeru višje sile. V obvestilu navede razloge za začasno ali stalno prenehanje opravljanja prometa z zdravilom, oceno tveganja za varovanje javnega zdravja v Republiki Sloveniji in ukrepe za zmanjševanje morebitnega tveganja.
(3) Kadar gre za zdravila za uporabo v humani medicini, JAZMP v petih delovnih dneh od prejema obvestila iz prvega in drugega odstavka tega člena o tem seznani nosilca OZZ in podatke o tem objavi na svoji spletni strani.
(4) Kadar gre za zdravila za uporabo v veterinarski medicini, JAZMP v petih delovnih dneh od prejema obvestila iz drugega odstavka tega člena o tem seznani organ, pristojen za veterinarstvo in podatke o tem objavi na svoji spletni strani.
(5) Zaradi spremljanja uporabe zdravil za zdravljenje živali JAZMP na zahtevo organa, pristojnega za veterinarstvo, posreduje in zagotavlja potrebne podatke iz dovoljenja za promet z zdravilom, iz dovoljenja za vnos oziroma uvoz, dovoljenja za promet s paralelno uvoženim zdravilom oziroma potrdila o prejemu obvestila o paralelni distribuciji zdravila.
(6) Na vsakokratno zahtevo JAZMP imetniki dovoljenja iz prvega odstavka tega člena in veletrgovci predložijo podatke o obsegu prodaje v Republiki Sloveniji.
(7) Upravljavec zbirk podatkov o porabi zdravil in nosilec OZZ posredujeta JAZMP in ministrstvu, pristojnemu za zdravje, podatke o porabi zdravil, ki jih na podlagi predpisov, ki urejajo zbirke podatkov s področja zdravstvenega varstva, prejmeta od izvajalcev zdravstvenih programov.
(8) Poslovni subjekti, ki izvajajo lekarniško dejavnost, posredujejo JAZMP in ministrstvu, pristojnemu za zdravje, podatke o nabavi in izdaji zdravil.
(9) Poslovni subjekti, ki izvajajo lekarniško dejavnost, in poslovni subjekti, ki opravljajo promet z zdravili na drobno v specializiranih prodajalnah, posredujejo JAZMP in ministrstvu, pristojnemu za zdravje, podatke o nabavi in izdaji zdravil, za katera ni potreben zdravniški recept.
(10) Izvajalci zdravstvene dejavnosti posredujejo JAZMP in ministrstvu, pristojnemu za zdravje, podatke o nabavi in porabi zdravil.
(11) Veletrgovci poročajo organu, pristojnemu za veterinarstvo, o obsegu prodaje zdravil za uporabo v veterinarski medicini in zdravil za uporabo v humani medicini, ki so bila prodana za izjemno uporabo v veterinarski medicini v Republiki Sloveniji.
(12) Veterinarske organizacije in druge organizacije, ki po predpisih o veterinarstvu opravljajo veterinarsko dejavnost in odobreni proizvajalci medicirane krme na zahtevo organa, pristojnega za veterinarstvo, poročajo o prometu z zdravili.
(13) Organ, pristojen za veterinarstvo, posreduje JAZMP podatke iz enajstega in dvanajstega odstavka tega člena enkrat letno.
(14) Podatki o obsegu prodaje, nabave, izdaje in porabe zdravil vključujejo količino posameznih zdravil in njihovo prodajno in nakupno vrednost za določeno časovno obdobje. Podrobnejše zahteve, način, pogostnost in obdobja za sporočanja podatkov ter podatkovne modele za komuniciranje in sporočanje podatkov določi minister, za področje zdravil za uporabo v veterinarski medicini pa minister, v soglasju z ministrom pristojnim za veterinarstvo.
25. člen
(sporočanje podatkov o obsegu predpisovanja in porabe zdravil)
(1) Izvajalci zdravstvene dejavnosti na zahtevo JAZMP sporočajo podatke o obsegu predpisovanja in porabe zdravil.
(2) Izvajalci veterinarske dejavnosti in odobreni proizvajalci medicirane krme o obsegu predpisovanja in porabe zdravil poročajo organu, pristojnemu za veterinarstvo.
(3) Podrobnejši način sporočanja podatkov iz tega člena določi minister.
26. člen
(izjemna uporaba zdravil v veterinarski medicini)
(1) Če ni na voljo nobenega zdravila za uporabo v veterinarski medicini z dovoljenjem za promet v Republiki Sloveniji za obravnavo bolezenskih stanj določenih živalskih vrst, lahko veterinar, odgovoren za zdravljenje živali, zlasti, da bi preprečil nesprejemljivo trpljenje živali, izjemno uporabi zdravila, ki nimajo dovoljenja za promet, za uporabo pri tej živalski vrsti ali za zadevno bolezensko stanje izjemoma uporabi:
– zdravilo za uporabo v humani medicini oziroma zdravi z zdravilom za uporabo v veterinarski medicini, ki je pridobilo dovoljenje za promet v drugi državi članici Evropske unije,
– če ni na voljo nobenega zdravila iz prejšnje alineje, mu zdravilo v skladu s pogoji veterinarskega recepta pripravijo za to pooblaščene osebe.
(2) Natančnejše pogoje uporabe in izjemne uporabe zdravil, ter naloge s področja izjemne uporabe zdravil, ki jih izvaja organ, pristojen za veterinarstvo, določi minister, pristojen za veterinarstvo.
27. člen
(odgovornosti)
(1) Imetnik dovoljenja za promet z zdravilom v Republiki Sloveniji je odgovoren za razvoj in dajanje zdravila v promet v skladu z dovoljenjem za promet in za v zvezi s tem nastalo morebitno škodo, vključno s škodo, nastalo zaradi neustrezne kakovosti zdravila, za katero je odgovoren proizvajalec zdravila.
(2) Če imetnik dovoljenja za promet z zdravilom ni proizvajalec zdravila, mora imeti sklenjeno pogodbo s proizvajalcem z namenom zagotavljanja, da je proizvodnja zdravila v skladu z veljavnimi predpisi in s procesi proizvodnje, navedenimi v dokumentaciji za pridobitev in vzdrževanje dovoljenja za promet z zdravilom.
(3) Proizvajalec zdravila, ki sprosti zdravilo v promet, je odgovoren za proizvodnjo, kontrolo kakovosti, opremljanje in označevanje zdravila, ne glede na to, ali je proizvedel zdravilo sam ali ga je v njegovem imenu proizvedla tretja oseba.
(4) Proizvajalec zdravila je odgovoren za škodo, ki nastane zaradi neustrezne kakovosti zdravila, tudi če dokaže, da svetovna raven znanosti in tehničnega napredka v času, ko je bilo zdravilo dano v promet, ni bila takšna, da bi bilo napako mogoče odkriti.
(5) Proizvajalec zdravila, ki je odstranil ali prekril zaščitni element na zdravilu in ga nadomestil z novim, je odgovoren za škodo, nastalo zaradi ponarejanja, če se ugotovi, da je to naredil na ponarejenem zdravilu.
(6) Imetnik dovoljenja za promet z zdravilom, proizvajalec, izvajalec zdravstvene dejavnosti in zdravstveni delavec ni odgovoren za posledice zdravljenja, ki nastanejo zaradi uporabe zdravila, ki ni v skladu z izdanim dovoljenjem za promet, ali zaradi uporabe zdravila, ki nima dovoljenja za promet, če je tako uporabo priporočila ali zahtevala JAZMP, ministrstvo, pristojno za zdravje, ali ministrstvo, pristojno za veterinarstvo, v primerih širjenja patogenih snovi, toksinov, kemičnih snovi ali jedrskega sevanja, ki lahko povzročijo škodo za zdravje ljudi, živali ali škodo za okolje.
28. člen
(farmakopeja)
(1) Zdravila, ki so v prometu v Republiki Sloveniji, morajo biti proizvedena in kontrolirana v skladu z metodami in zahtevami Evropske farmakopeje in v skladu s Slovenskim nacionalnim dodatkom k Evropski farmakopeji.
(2) Obvestilo o veljavnosti Evropske farmakopeje in Slovenskega nacionalnega dodatka k Evropski farmakopeji JAZMP objavi v Uradnem listu Republike Slovenije.
(3) Če Evropska farmakopeja in Slovenski nacionalni dodatek k Evropski farmakopeji metod proizvodnje in zahtev glede kakovosti zadevnega zdravila ne določata, so zdravila lahko proizvedena in kontrolirana tudi po metodah in zahtevah farmakopej drugih držav članic Evropske unije. Če farmakopeje drugih držav članic Evropske unije ne določajo metod proizvodnje in zahtev glede kakovosti zadevnega zdravila, se zanje lahko uporabljajo farmakopeje tretjih držav ali metode, ki jih predlaga proizvajalec zdravila.
29. člen
(strokovno svetovanje)
JAZMP lahko stranki oziroma zainteresiranemu poslovnemu subjektu na njihov predlog svetuje glede strokovne priprave dokumentacije s področja pristojnosti JAZMP, ob upoštevanju odsotnosti navzkrižja interesov, kar ne sme vplivati na poznejše morebitne drugačne odločitve v postopku, če se vmes spremenijo dejstva, okoliščine ali tehnično-znanstveni izsledki.
III. PRESKUŠANJE ZDRAVIL IN SOČUTNA UPORABA ZDRAVIL
30. člen
(preskušanje zdravil)
(1) Preden je zdravilo dano v promet, mora biti analizno, neklinično farmakološko-toksikološko in klinično preskušeno, da bi se lahko pridobila ocena njegove kakovosti, varnosti in učinkovitosti.
(2) Zdravilo se analizno, neklinično farmakološko-toksikološko in klinično preskuša tudi, ko je že pridobilo dovoljenje za promet oziroma je v prometu, če se preskušanje opravi zaradi pridobivanja dodatnih podatkov o zdravilu ali zaradi kontrole kakovosti zdravila.
(3) Zdravila analizno preskušajo poslovni subjekti, ki imajo dovoljenje JAZMP za proizvodnjo zdravil, ki vključuje aktivnost analiznega preskušanja zdravil.
(4) Zdravila neklinično farmakološko-toksikološko preskušajo poslovni subjekti, ki izpolnjujejo pogoje glede kadrov, prostorov, opreme in vodenja dokumentacije v skladu z načeli dobre laboratorijske prakse.
(5) Zdravila klinično preskušajo izvajalci zdravstvene oziroma veterinarske dejavnosti, ki razpolagajo s kadri, pooblaščenimi za predpisovanje zdravil, v skladu s predpisi in načeli dobre klinične prakse.
(6) Podatki o analiznem, nekliničnem farmakološko-toksikološkem in kliničnem preskušanju so sestavni del dokumentacije za pridobitev dovoljenja z promet z zdravilom in v skladu z zahtevami tudi za vzdrževanje dovoljenja za promet z zdravilom.
(7) Analizno, neklinično farmakološko-toksikološko in klinično preskušanje zdravil mora ustrezati sodobnim znanstvenim dosežkom ter načelom in smernicam dobrih praks. V dokumentaciji o zdravilu iz prejšnjega odstavka se navede postopek preskušanja na način, da je preskuse mogoče ponoviti in zagotoviti primerljivost rezultatov.
(8) Podrobnejši način in postopek analiznega, nekliničnega farmakološko-toksikološkega in kliničnega preskušanja zdravila, vsebino vloge za pridobitev dovoljenja dejavnosti analiznega preskušanja zdravil, pogoje, ki jih izpolnjujejo poslovni subjekti, ki preskušajo zdravila, in postopek njihovega preverjanja določi minister.
31. člen
(analizno preskušanje zdravila)
(1) Analizno preskušanje zdravila je mikrobiološko, kemično-fizikalno in biološko preskušanje kakovosti zdravila v skladu z načeli in smernicami dobre proizvodne prakse.
(2) Analizno preskušanje zdravila je namenjeno pridobivanju podatkov v farmacevtskem razvoju zdravila in opredeljuje kontrolo sestavin zdravila, ovojnine in končnega izdelka, ustreznost proizvodnih postopkov ter stabilnost učinkovin in končnega izdelka.
32. člen
(neklinično farmakološko-toksikološko preskušanje zdravila)
(1) Neklinično farmakološko-toksikološko preskušanje zdravila je postopek ugotavljanja varnosti zdravila in se opravlja v skladu z načeli in smernicami dobre laboratorijske prakse.
(2) Neklinično farmakološko-toksikološko preskušanje opredeljuje farmakodinamske, farmakokinetične in toksikološke lastnosti zdravila, ki so bile ugotovljene na laboratorijskih živalih, izoliranih organih in tkivih in drugih farmakoloških modelih, ter predvidi možne učinke na ljudeh oziroma ciljnih živalskih vrstah.
(3) Za zdravila za uporabo v veterinarski medicini neklinično farmakološko-toksikološko preskušanje poleg podatkov iz prejšnjega odstavka zagotovi tudi podatke o farmakokinetiki, zlasti presnovi zdravila in izločanju ostankov zdravil ter o rutinski analizni metodi, ki se lahko uporablja za določanje ostankov zdravil.
33. člen
(klinično preskušanje zdravila)
(1) Klinično preskušanje zdravila za uporabo v humani medicini je raziskava na zdravih posameznikih in pacientih, ki ima namen odkriti ali potrditi klinične in farmakološke učinke zdravila v preskušanju, odkriti neželene učinke zdravila v preskušanju ali preučiti absorpcijo, porazdelitev, presnovo in izločanje zdravila v preskušanju, da se dokaže njegova varnost ali učinkovitost pri uporabi v humani medicini.
(2) Klinično preskušanje zdravil za uporabo v veterinarski medicini je organizirano proučevanje delovanja zdravila na živalski organizem, ki ima namen odkriti ali potrditi klinične, farmakološke učinke zdravila v preskušanju za uporabo v veterinarski medicini, odkriti neželene učinke ali preučiti absorpcijo, porazdelitev, presnovo in izločanje zdravila v preskušanju in njegovih ostankov, da se dokaže njegova varnost ali učinkovitost pri ciljnih živalskih vrstah.
(3) Nerutinsko pripravljeno zdravilo za napredno zdravljenje se ne sme klinično preskušati.
34. člen
(pogoji za klinično preskušanje zdravila)
(1) Zdravilo se lahko začne klinično preskušati le po predloženih rezultatih o analiznem in nekliničnem farmakološko-toksikološkem preskušanju zdravila in če se preskuša zdravilo, ki ne vpliva na genetsko zasnovo v zarodni liniji preskušanca.
(2) Postopek kliničnega preskušanja zdravila, ki je opisan v dokumentaciji, predloženi za pridobitev dovoljenja za promet z zdravilom, se izvaja v skladu z zahtevami iz petega odstavka 30. člena tega zakona, načeli in smernicami dobre klinične prakse o kliničnem preskušanju, ki jih sprejme in objavi Evropska komisija, načeli etike v humani oziroma veterinarski medicini in zagotavljanjem varovanja osebnih podatkov.
35. člen
(začetek kliničnega preskušanja zdravila)
(1) Predlagatelj kliničnega preskušanja zdravila je lahko sponzor preskušanja ali zastopnik oziroma zastopnica (v nadaljnjem besedilu: zastopnik) sponzorja, kadar ima sponzor sedež zunaj Evropske unije, pri čemer ima zastopnik sedež na ozemlju Evropske unije.
(2) Pred začetkom kliničnega preskušanja zdravila je klinično preskušanje treba priglasiti na JAZMP.
(3) Ne glede na prejšnji odstavek je pred začetkom kliničnega preskušanja zdravila za uporabo v humani medicini, ki je namenjeno za gensko zdravljenje, za zdravljenje s somatskimi celicami, vključno s ksenogenimi celicami, in zdravila, ki vsebuje gensko spremenjene organizme, treba pridobiti dovoljenje JAZMP.
36. člen
(zavarovanje odgovornosti)
Predlagatelj preskušanja zdravil pred začetkom kliničnega preskušanja zdravil zavaruje svojo odgovornost za morebitno škodo, nastalo s preskušanjem zdravila.
37. člen
(odobritev in priglasitev kliničnega preskušanja)
(1) O priglasitvi kliničnega preskušanja zdravila iz drugega odstavka 35. člena tega zakona in o vlogah za odobritev kliničnega preskušanja zdravila iz tretjega odstavka 35. člena tega zakona odloča JAZMP. Komisija iz 4. člena tega zakona, ki deluje na področju kliničnih preskušanj, na zahtevo JAZMP da mnenje o predlaganem oziroma priglašenem kliničnem preskušanju.
(2) Vloga za priglasitev oziroma odobritev kliničnega preskušanja vsebuje najmanj podatke o sponzorju, zdravilu v preskušanju, namenu in poteku preskušanja.
(3) V vlogi iz prejšnjega odstavka za zdravila za uporabo v humani medicini predlagatelj priloži tudi mnenje Komisije Republike Slovenije za medicinsko etiko pri ministrstvu, pristojnem za zdravje (v nadaljevanju besedila: KME).
(4) O vlogi za odobritev kliničnega preskušanja odloči JAZMP v dveh mesecih od dneva prejema popolne vloge. Za zdravila, ki so pridobljena z biotehnološkim postopkom, se ta rok lahko s sklepom podaljša za 30 dni. Če se predlog nanaša na zdravila za uporabo v humani medicini, ki so namenjena za zdravljenje ljudi s ksenogenimi celicami, rok za odločitev JAZMP lahko podaljša do 90 dni. Klinično preskušanje se lahko začne, ko postane odločba o kliničnem preskušanju zdravila dokončna.
(5) O priglasitvi kliničnega preskušanja JAZMP odloči v dveh mesecih od dneva prejema popolne vloge za priglasitev. V primeru molka JAZMP se šteje, da je vloga za priglasitev pozitivno rešena.
(6) JAZMP lahko v postopku iz tretjega in četrtega odstavka tega člena upošteva oceno, ki jo je o zadevnem kliničnem preskušanju dala druga država članica Evropske unije.
38. člen
(spremembe v kliničnem preskušanju zdravila)
(1) Pri kliničnem preskušanju zdravila, ki že poteka, sponzor JAZMP priglasi klinično pomembne spremembe.
(2) Priglašena sprememba se lahko uvede, če JAZMP v 35 dneh od prejema popolne vloge o spremembi ne izda negativne odločbe. Ta rok lahko JAZMP s sklepom podaljša na 60 dni, če je takšno podaljšanje upravičeno glede na naravo spremembe oziroma, če se mora JAZMP posvetovati z Evropsko agencijo za zdravila (v nadaljnjem besedilu: EMA).
39. člen
(prekinitev kliničnega preskušanja zdravila)
JAZMP lahko zaradi varovanja javnega zdravja oziroma zdravja preskušancev odloči o začasni ali trajni prekinitvi kliničnega preskušanja.
40. člen
(neintervencijska klinična preskušanja zdravila)
(1) Neintervencijsko klinično preskušanje zdravil sponzor priglasi JAZMP.
(2) Vloga za priglasitev vsebuje najmanj:
– podatke o zdravilu v preskušanju,
– podatke o namenu preskušanja,
– za zdravila za uporabo v humani medicini pozitivno mnenje KME,
– za neintervencijska preskušanja zdravil za uporabo v humani medicini, za katera mora imetnik dovoljenja za promet predhodno pridobiti soglasje iz 138. člena tega zakona, zadevno soglasje k osnutku protokola in protokol neintervencijskega kliničnega preskušanja,
– soglasja delodajalcev iz šestega odstavka tega člena k naboru zdravnikov oziroma veterinarjev, ki bodo sodelovali v zadevnih neintervencijskih kliničnih preskušanjih,
– predvideno obdobje trajanja preskušanja z utemeljitvijo, če je to obdobje daljše od enega leta,
– oceno vrednosti in strukturo stroškov izvedbe preskušanja.
(3) O priglasitvi kliničnega preskušanja zdravila iz prvega odstavka tega člena se JAZMP izreče v dveh mesecih od dneva prejema popolne vloge za priglasitev. V primeru molka JAZMP se šteje, da je vloga za priglasitev pozitivno rešena.
(4) Sponzor neintervencijskega kliničnega preskušanja zdravila, posreduje poročilo JAZMP o poteku, rezultatih in stroških preskušanja.
(5) Izvajanje neintervencijskega kliničnega preskušanja ne sme spodbujati predpisovanja ali uporabe zdravila. O vključitvi v neintervencijsko klinično preskušanje mora biti pacient oziroma njegov skrbnik oziroma lastnik ali skrbnik živali obveščen. Vključitev pacienta v neintervencijsko preskušanje zdravil ne sme biti razlog za zamenjavo že obstoječe ustrezne terapije.
(6) Za sodelovanje pri neintervencijskih kliničnih preskušanjih zdravnik oziroma veterinar predhodno pridobi soglasje svojega delodajalca, če je ta financiran iz javnih sredstev. Plačilo zdravnikom oziroma veterinarjem za sodelovanje pri neintervencijskih kliničnih preskušanjih v delu, ki poteka v delovnem času, ni dovoljeno. Plačila zdravnikom oziroma veterinarjem za sodelovanje pri neintervencijskih kliničnih preskušanjih so omejena na nadomestilo za delo v njihovem prostem času in v zvezi s tem nastale stroške.
(7) Med opravljanjem neintervencijskega kliničnega preskušanja sponzor spremlja zbrane podatke in preuči morebiten vpliv izsledkov preskušanja na oceno razmerja med koristjo in tveganjem za to zdravilo. Vse nove informacije, ki bi lahko vplivale na oceno tega razmerja, sporoči JAZMP in vsem državam članicam Evropske unije, kjer ima zdravilo dovoljenje za promet oziroma pristojnemu odboru pri EMA, kadar se preskušanje izvaja v več državah članicah Evropske unije.
(8) Sponzor na zahtevo JAZMP predloži protokol in poročila o napredku JAZMP in za zdravila za uporabo v humani medicini organom, pristojnim za zdravila držav članic Evropske unije, v katerih se izvaja preskušanje.
(9) Po končanem neintervencijskem kliničnem preskušanju imetnik dovoljenja za promet z zdravilom za uporabo v humani medicini, za katero mora predhodno pridobiti soglasje iz 138. člena tega zakona, pošlje JAZMP oziroma pristojnemu odboru pri EMA, kadar se neintervencijsko klinično preskušanje izvaja v več državah članicah Evropske unije, končno poročilo skupaj s povzetkom za objavo v dvanajstih mesecih po končanem zbiranju podatkov, razen če JAZMP ali pristojni odbor pri EMA pisno umakneta zahtevo.
(10) Kadar imetnik dovoljenja za promet z zdravilom oceni, da rezultati neintervencijskega kliničnega preskušanja vplivajo na določbe dovoljenja za promet z zdravilom, pri JAZMP vloži vlogo za spremembo dovoljenja za promet z zdravilom v skladu z 62. členom tega zakona.
(11) Po začetku neintervencijskega kliničnega preskušanja imetnik dovoljenja za promet z zdravilom za uporabo v humani medicini, za katera mora imetnik dovoljenja za promet predhodno pridobiti soglasje iz 138. člena tega zakona, predloži JAZMP oziroma pristojnemu odboru pri EMA, kadar se preskušanje izvaja v več državah članicah Evropske unije, vsako vsebinsko spremembo protokola preskušanja, preden se ta začne izvajati.
(12) Podrobnejše pogoje za opravljanje neintervencijskih kliničnih preskušanj in podrobnejšo vsebino vloge določi minister.
41. člen
(vloga za sočutno uporabo zdravila)
(1) Vlogo za pridobitev dovoljenja za sočutno uporabo zdravila lahko pri JAZMP vloži:
– predlagatelj, katerega zdravilo je v postopku pridobitve dovoljenja za promet po centraliziranem postopku;
– sponzor kliničnega preskušanja, če je zdravilo v postopku kliničnega preskušanja zaradi pridobitve dovoljenja za promet po centraliziranem postopku.
(2) Vloga iz prejšnjega odstavka vsebuje naslednja dokazila, izjave in priloge:
– da je zdravilo bodisi v postopku pridobitve dovoljenja za promet po centraliziranem postopku bodisi v postopku kliničnega preskušanja, ki je namenjeno pridobitvi dovoljenja za promet po centraliziranem postopku,
– da ima zdravilo dovoljenje za promet v tretji državi, ki ima enakovredne zahteve glede kakovosti, varnosti in učinkovitosti zdravil in ga spremlja izvid o analizi kakovosti zdravila, če zdravilo nima dovoljenja za promet v nobeni državi članici Evropske unije,
– da zdravilo predstavlja pomembno terapevtsko, znanstveno in tehnično inovacijo,
– da je zdravilo namenjeno skupini pacientov s kronično ali resno izčrpavajočo boleznijo, ki je ni mogoče zadovoljivo zdraviti z zdravili, ki imajo dovoljenje za promet,
– da proizvajalec zdravila da izjavo, na podlagi katere se obvezuje, da bo zdravilo zagotavljal po koncu programa sočutne uporabe še eno leto, vsem pacientom, vključenim v ta program, ki poteka v Republiki Sloveniji, tudi kadar za ta zdravila po zaključku s programom predvidenega obdobja oskrbe z zdravilom, ne bodo zagotovljena javna sredstva za financiranje zdravila, če bo za paciente dokumentirana korist zdravljenja s tem zdravilom v skladu s protokolom iz šeste alineje tega odstavka,
– protokol zdravljenja z zdravili za sočutno uporabo v pisni ali v elektronski obliki, ki vsebuje merila za začetek zdravljenja, spremljanje učinkovitosti zdravljenja, merila za nadaljevanje zdravljenja ter spremljanje neželenih učinkov zdravljenja, ki ga pripravi ali potrdi pristojni klinični oddelek,
– izjavo proizvajalca zdravila, da daje zdravilo v program sočutne uporabe zdravila brezplačno, pri čemer sam krije vse dodatne stroške preskrbe s tem zdravilom, vključno s stroški prometa na debelo z zdravilom v programu,
– izjavo proizvajalca zdravila, da bo na zunanji ovojnini zdravil jasno označil, da gre za sočutno uporabo zdravila.
(3) Če je zdravilo v postopku kliničnega preskušanja iz druge alineje prvega odstavka tega člena, vloga vsebuje tudi pozitivno mnenje KME.
42. člen
(dovoljenje za sočutno uporabo zdravila)
(1) JAZMP odloči o izdaji dovoljenja za sočutno uporabo zdravila v 30 dneh po prejemu popolne vloge.
(2) JAZMP v skladu s 83. členom Uredbe 726/2004/ES pridobi mnenje Odbora za zdravila pri EMA. Do pridobitve tega mnenja rok iz prejšnjega odstavka ne teče.
(3) Podrobnejše pogoje, vsebino vloge, način in postopek pridobitve dovoljenja za sočutno uporabo zdravila določi minister.
IV. DOVOLJENJE ZA PROMET Z ZDRAVILOM
43. člen
(predlagatelj vloge za pridobitev dovoljenja za promet z zdravilom)
(1) Postopek za izdajo dovoljenja za promet z zdravilom se začne z vlogo predlagatelja, ki je poslovni subjekt s sedežem v Evropski uniji. To je lahko proizvajalec zdravila ali drug poslovni subjekt, ki ima s proizvajalcem zdravila sklenjeno pisno pogodbo.
(2) Za ustreznost in verodostojnost dokumentov ter točnost predloženih podatkov je odgovoren predlagatelj.
44. člen
(vloga za pridobitev dovoljenja za promet z zdravilom)
(1) Vloga za pridobitev dovoljenja za promet z zdravilom vsebuje naslednjo dokumentacijo:
1. splošni del, ki vsebuje podatke o proizvajalcu zdravila, pisno potrdilo proizvajalca zdravila, da je preveril skladnost proizvodnje učinkovine z načeli in smernicami dobre proizvodne prakse, povzetek sistema farmakovigilance, načrt za obvladovanje tveganj, sorazmeren z ugotovljenimi in možnimi tveganji, ki ga bo uvedel predlagatelj za zadevno zdravilo, skupaj s povzetkom načrta, podatke o zdravilu, podatke o vseh izdanih dovoljenjih za promet ali o zavrnitvi, vključno s podrobnostmi in razlogi za zavrnitev, ali preklicu dovoljenja za promet, povzetek glavnih značilnosti zdravila, navodilo za uporabo, osnutek ovojnine, podatke o statusu zdravila sirote, če ga je zadevno zdravilo pridobilo, izvedenska poročila in povzetke, oceno razmerja med koristjo in tveganjem zdravila, ter oceno tveganja za okolje;
2. farmacevtsko-kemični in biološki del, ki vsebuje podatke o kakovostni in količinski sestavi zdravila, opis načina proizvodnje, kontrolo kakovosti vhodnih snovi, kontrole kakovosti v procesu proizvodnje, kontrolo kakovosti končnega izdelka in stabilnostne študije;
3. neklinični farmakološko-toksikološki del, ki vsebuje podatke o farmakodinamičnih in farmakokinetičnih lastnostih zdravila, toksičnosti zdravila, vplivu na reprodukcijske funkcije, podatke o embrio-fetalni toksičnosti, mutagenosti in rakotvornem potencialu, podatke o lokalnem prenašanju in o izločanju. Za zdravila, ki se uporabljajo v veterinarski medicini, farmakološko-toksikološki del vsebuje tudi podatke o ostankih in predlog karence ter podatke o tveganjih za okolje;
4. klinični del, ki vsebuje splošne podatke o preskušanju, o izvedbi preskušanja, rezultate preskušanja, klinično-farmakološke podatke, če je potrebno podatke o biološki uporabnosti ali o bioekvivalenci, podatke o klinični varnosti in učinkovitosti, če je potrebno tudi dokumentacijo o izjemnih okoliščinah v preskušanju ter podatke o izkušnjah, pridobljenih po pridobitvi dovoljenja za promet v drugih državah.
(2) Na zahtevo JAZMP predlagatelj predloži tudi vzorce zdravil, za katere se predlaga dovoljenje za promet in referenčne standarde.
(3) Podrobnejše pogoje, obliko in vsebino vloge ter dokumentacije v postopkih za pridobitev dovoljenja za promet z zdravilom, določi minister.
45. člen
(vloga za pridobitev dovoljenja za promet z zdravilom za uporabo v humani medicini z zmanjšanim obsegom dokumentacije in obdobja zaščite)
(1) Ne glede na določbe prejšnjega člena, predlagatelju ni treba predložiti rezultatov nekliničnih farmakološko-toksikoloških in kliničnih preskušanj, če dokaže, da je predmet postopka generično zdravilo, katerega referenčno zdravilo je pridobilo dovoljenje za promet v Republiki Sloveniji ali Evropski uniji pred najmanj osmimi leti.
(2) Generično zdravilo iz prejšnjega odstavka ne sme biti dano v promet deset let od pridobitve dovoljenja za promet referenčnega zdravila.
(3) Če referenčno zdravilo iz prvega odstavka tega člena ni pridobilo dovoljenja za promet v Republiki Sloveniji, predlagatelj v vlogi za pridobitev dovoljenja za promet navede državo članico Evropske unije, v kateri je zdravilo pridobilo dovoljenje za promet. JAZMP pridobi od pristojnega organa izbrane države članice Evropske unije potrditev o izdanem dovoljenju za promet z referenčnim zdravilom, podatke o količinski in kakovostni sestavi referenčnega zdravila in po potrebi vso ostalo upoštevno dokumentacijo.
(4) Desetletno obdobje iz drugega odstavka tega člena se podaljša na največ 11 let, če v obdobju prvih osmih let trajanja tega obdobja imetnik dovoljenja za promet z zdravilom pridobi dovoljenje za eno ali več novih terapevtskih indikacij, za katere se ugotovi, da pomenijo pomembno klinično korist za pacienta v primerjavi z obstoječimi načini zdravljenja.
(5) Če se različne soli, estri, etri, izomeri, zmesi izomerov, kompleksi ali derivati učinkovine pomembno razlikujejo glede varnosti ali učinkovitosti ali obojega, predlagatelj predloži dodatne podatke o varnosti ali učinkovitosti različnih soli, estrov, derivatov učinkovine v zdravilu, ki je že pridobilo dovoljenje za promet z zdravilom. Različne peroralne oblike s takojšnjim sproščanjem se obravnavajo kot enake farmacevtske oblike. Študije biološke uporabnosti ni treba predložiti, kadar tako določajo navodila EMA, pripravljena v skladu z znanstveno tehničnimi dognanji.
(6) Če zdravilo ne ustreza opredelitvi generičnega zdravila ali če bioekvivalence ni mogoče dokazati s študijami biološke uporabnosti ali ob spremembah učinkovin, indikacij, jakosti, farmacevtske oblike ali poti uporabe glede na referenčno zdravilo, je treba predložiti rezultate ustreznih nekliničnih farmakološko-toksikoloških ali kliničnih študij.
(7) Za zdravilo, ki ima učinkovino z dobro uveljavljeno medicinsko uporabo in je predložena vloga za novo indikacijo, za katero so bile predložene pomembne neklinične farmakološko-toksikološke ali klinične študije, velja poleg določb iz prvega do četrtega odstavka tega člena tudi nekumulativno enoletno obdobje zaščite podatkov, v katerem se drugi predlagatelji ne morejo sklicevati na ta del dokumentacije.
(8) Ne glede na določbe predpisov, ki urejajo patentne pravice ali pravice dodatnega varstvenega certifikata za zdravilo, se izvajanje študij, potrebnih za izpolnitev zahtev tega zakona in izpolnitev drugih zahtev, ki se nanašajo na pridobitev dovoljenja za promet, ne šteje za kršitev patentnih pravic ali pravic dodatnega varstvenega certifikata za zdravilo.
(9) Določbe o obdobjih zaščite se ne uporabljajo za referenčna zdravila, za katera je bila vloga za pridobitev dovoljenja za promet vložena do 30. oktobra 2005. Zanje se upošteva obdobje podatkovne zaščite, ki je na dan vložitve vloge veljalo v državi članici Evropske unije, v kateri je referenčno zdravilo dobilo dovoljenje za promet.
46. člen
(vloga za pridobitev dovoljenja za promet z zdravilom za uporabo v veterinarski medicini z zmanjšanim obsegom dokumentacije in obdobja zaščite)
(1) Ne glede na določbe 44. člena tega zakona predlagatelju ni treba predložiti rezultatov nekliničnih farmakološko-toksikoloških in kliničnih preskušanj ter rezultatov testiranja ostankov, če dokaže, da je predmet postopka generično zdravilo, katerega referenčno zdravilo je pridobilo dovoljenje za promet v Republiki Sloveniji ali Evropski uniji pred najmanj osmimi leti.
(2) Generično zdravilo iz prejšnjega odstavka ne sme biti dano v promet deset let od pridobitve dovoljenja za promet referenčnega zdravila.
(3) Če referenčno zdravilo iz prvega odstavka tega člena ni pridobilo dovoljenja za promet v Republiki Sloveniji, predlagatelj v vlogi za pridobitev dovoljenja za promet navede državo članico Evropske unije, v kateri je zdravilo pridobilo dovoljenje za promet. JAZMP pridobi od pristojnega organa izbrane države članice Evropske unije potrditev o izdanem dovoljenju za promet z referenčnim zdravilom, podatke o količinski in kakovostni sestavi referenčnega zdravila in po potrebi vso ostalo upoštevno dokumentacijo.
(4) Desetletno obdobje iz drugega odstavka tega člena se podaljša na največ 13 let, če so zdravila za uporabo v veterinarski medicini namenjena ribam ali čebelam ali drugim živalskim vrstam, ki jih določi Evropska komisija v obdobju prvih osmih let trajanja desetletnega obdobja iz drugega odstavka tega člena, imetnik dovoljenja za promet pridobi dovoljenje za eno ali več novih terapevtskih indikacij, za katere se ugotovi, da prinašajo pomembno klinično korist v primerjavi z obstoječimi načini zdravljenja.
(5) Pri zdravilih za uporabo v veterinarski medicini, ki so predvidena za eno ali več vrst živali za proizvodnjo hrane in vsebujejo nove učinkovine in ki v Evropski uniji niso bile dovoljene do 30. aprila 2004, se desetletno obdobje iz drugega odstavka 48. člena tega zakona podaljša za eno leto za vsako razširitev dovoljenja za promet z zdravilom na drugo vrsto živali za proizvodnjo hrane, če se taka razširitev dovoljenja pridobi v petih letih po izdaji prvega dovoljenja za promet z zdravilom.
(6) Obdobje iz drugega odstavka tega člena skupaj s podaljšanji iz prejšnjega odstavka ne sme biti daljše od 13 let tudi za razširitve dovoljenja za promet z zdravilom, ki se nanašajo na štiri ali več vrst živali za proizvodnjo hrane.
(7) Podaljšanje desetletnega obdobja na 11, 12 ali 13 let za zdravilo za uporabo v veterinarski medicini, predvideno za živali za proizvodnjo hrane, se odobri samo, če je imetnik dovoljenja za promet z zdravilom že prvotno predložil vlogo za določitev najvišjih mejnih vrednosti ostankov zdravil za vrste, ki jih zajema dovoljenje za promet z zdravilom.
(8) Če se različne soli, estri, etri, izomeri, zmesi izomerov, kompleksi ali derivati učinkovine pomembno razlikujejo glede varnosti ali učinkovitosti, predlagatelj predloži dodatne informacije o varnosti ali učinkovitosti različnih soli, estrov, derivatov učinkovine v zdravilu, ki je že pridobilo dovoljenje za promet z zdravilom. Različne peroralne oblike s takojšnjim sproščanjem se obravnavajo kot enake farmacevtske oblike. Študije biološke uporabnosti ni treba predložiti, kadar tako določajo ustrezna navodila, pripravljena v skladu z znanstveno tehničnimi dognanji.
(9) Če zdravilo ne ustreza definiciji generičnega zdravila ali če bioekvivalence ni mogoče dokazati s študijami biološke uporabnosti ali ob spremembah učinkovin, indikacij, jakosti, farmacevtske oblike ali poti uporabe glede na referenčno zdravilo, je treba predložiti rezultate ustreznih nekliničnih farmakološko-toksikoloških ali kliničnih študij in rezultate ustreznih preskusov varnosti in ostankov zdravila.
(10) Ne glede na določbe predpisov, ki urejajo patentne pravice ali pravice dodatnega varstvenega certifikata za zdravilo, se izvajanje študij, potrebnih za izpolnitev zahtev tega zakona in izpolnitev drugih zahtev, ki se nanašajo na pridobitev dovoljenja za promet, ne šteje za kršitev patentnih pravic ali pravic dodatnega varstvenega certifikata za zdravilo.
(11) Določbe o obdobjih zaščite se ne uporabljajo za referenčna zdravila, za katera je bila vloga za pridobitev dovoljenja za promet vložena do 30. oktobra 2005. Zanje se upošteva obdobje podatkovne zaščite, ki je na dan vložitve vloge veljalo v državi članici Evropske unije, v kateri je referenčno zdravilo dobilo dovoljenje za promet.
47. člen
(dobro uveljavljena uporaba za zdravila za uporabo v humani medicini)
Ne glede na določbe 44. člena tega zakona predlagatelju v vlogi ni treba predložiti lastnih podatkov o nekliničnih farmakološko-toksikoloških ali kliničnih preskušanjih, če dokaže, da imajo učinkovine zdravila za zadevno indikacijo že dobro uveljavljeno medicinsko uporabo z znano učinkovitostjo in sprejemljivo ravnjo varnosti, je v uporabi v primernem obsegu že najmanj deset let na območju Evropske unije in če javno dostopna strokovna literatura o lastnostih in uporabi zdravil z zadevno učinkovino zagotavlja potrebne podatke za oceno varnosti in učinkovitosti zdravila. V vlogi namesto lastnih podatkov predloži ustrezne podatke iz literature.
48. člen
(dobro uveljavljena uporaba za zdravila za uporabo v veterinarski medicini)
(1) Ne glede na določbe 44. člena tega zakona predlagatelju v vlogi ni treba predložiti lastnih podatkov o nekliničnih farmakološko-toksikoloških, kliničnih preskušanjih in rezultatov testiranja ostankov za zdravila za uporabo v veterinarski medicini, če dokaže, da imajo učinkovine zdravila za zadevno indikacijo že dobro uveljavljeno veterinarsko uporabo z znano učinkovitostjo in sprejemljivo ravnjo varnosti, je v uporabi v primernem obsegu že najmanj deset let na območju Evropske unije in če javno dostopna strokovna literatura o lastnostih in uporabi zdravil z zadevno učinkovino zagotavlja potrebne podatke za oceno varnosti in učinkovitosti zdravila. V vlogi namesto lastnih podatkov predloži ustrezne podatke iz literature, lahko se uporabi tudi poročilo o oceni vloge za določitev najvišje mejne vrednosti ostankov, ki jo opravi in objavi EMA v skladu z Uredbo 470/2009/ES.
(2) Če predlagatelj uporabi znanstveno literaturo za pridobitev dovoljenja za promet z zdravilom za uporabo v veterinarski medicini za vrsto živali za proizvodnjo hrane in v zvezi z istim zdravilom ter zaradi pridobitve dovoljenja za drugo vrsto živali za proizvodnjo hrane predloži nove študije ostankov zdravil v skladu z Uredbo 470/2009/ES, skupaj z nadaljnjimi kliničnimi preskušanji, velja poleg določb 46. člena tega zakona tudi triletno obdobje zaščite podatkov, na podlagi katerega se drugi predlagatelji ne morejo sklicevati na ta del dokumentacije.
49. člen
(kombinacije učinkovin)
(1) Če se vloga za pridobitev dovoljenja za promet z zdravilom nanaša na novo zdravilo z učinkovinami, vsebovanimi v zdravilih, ki so že pridobila dovoljenje za promet, vendar v predlagani kombinaciji učinkovin še niso bile uporabljene za terapevtske namene, vloga za pridobitev dovoljenja za promet z zdravilom vsebuje rezultate nekliničnih farmakološko-toksikoloških in kliničnih preskušanj zadevne kombinacije učinkovin, ni pa jih treba predložiti za vsako posamezno učinkovino.
(2) Za zdravila za uporabo v veterinarski medicini vloga za pridobitev dovoljenja za promet z zdravilom, poleg podatkov iz prejšnjega odstavka, vsebuje tudi rezultate preskusov varnosti in ostankov, če predlagatelj tako presodi ali če to zahteva JAZMP.
50. člen
(uporaba dokumentacije s soglasjem)
Imetnik dovoljenja za promet z zdravilom, ki je veljavno v Republiki Sloveniji, lahko dovoli uporabo podatkov iz farmacevtsko-kemičnega, biološkega, nekliničnega farmakološko-toksikološkega in kliničnega dela dokumentacije, pri zdravilih za uporabo v veterinarski medicini pa tudi podatkov iz dokumentacije o preskusih varnosti in ostankih, ki je sestavni del vloge, na podlagi katere je pridobil dovoljenje za promet, za pripravo oziroma obravnavo poznejših vlog za druga zdravila, ki imajo enako kakovostno in količinsko sestavo zdravilnih učinkovin ter enako farmacevtsko obliko.
51. člen
(izjemne okoliščine)
Ne glede na določbe 44. člena tega zakona in v izjemnih okoliščinah v zvezi z imunološkimi zdravili za uporabo v veterinarski medicini predlagatelju ni treba predložiti rezultatov nekaterih preskušanj na ciljni živalski vrsti na terenu, če se ta preskušanja ne morejo izvesti zaradi utemeljenih razlogov.
52. člen
(zdravila rastlinskega izvora in tradicionalna zdravila rastlinskega izvora)
(1) Za zdravila rastlinskega izvora je treba pridobiti dovoljenje za promet z zdravili v skladu s 43. do 50. členom tega zakona.
(2) Ne glede na prejšnji odstavek tradicionalno zdravilo rastlinskega izvora lahko pridobi dovoljenje za promet po poenostavljenem postopku (v nadaljnjem besedilu: postopek registracije tradicionalnega zdravila), če izpolnjuje naslednje pogoje:
– ima terapevtske indikacije, primerne izključno za tradicionalna zdravila rastlinskega izvora, ki so zaradi svoje sestave in namena primerna za samozdravljenje;
– je namenjeno izključno za uporabo v skladu z določeno jakostjo in odmerjanjem;
– je za peroralno ali zunanjo uporabo ali za inhaliranje;
– da je obdobje tradicionalne uporabe zdravila poteklo;
– podatki o tradicionalni uporabi zdravila morajo biti zadostni, zlasti da izdelek dokazano ni škodljiv v določenih pogojih uporabe, farmakološki učinki ali učinkovitost zdravila pa so verjetni na podlagi dolgotrajne uporabe in izkušenj.
(3) Tradicionalna zdravila rastlinskega izvora lahko vsebujejo tudi vitamine in minerale, če zanje obstajajo dokumentirana dokazila o varnosti, pod pogojem, da vitamini ali minerali podpirajo delovanje rastlinskih učinkovin glede terapevtskih indikacij, ki se navajajo.
(4) Če JAZMP ugotovi, da tradicionalno zdravilo rastlinskega izvora izpolnjuje pogoje za pridobitev dovoljenja za promet z zdravilom ali registracijo homeopatskega zdravila, se določbe za tradicionalna zdravila rastlinskega izvora iz tega zakona ne uporabljajo.
(5) Vloga za pridobitev dovoljenja za promet s tradicionalnim zdravilom rastlinskega izvora po postopku registracije tradicionalnega zdravila vsebuje splošni del dokumentacije ter farmacevtsko-kemično in biološko dokumentacijo v skladu s 1. in 2. točko prvega odstavka 44. člena tega zakona, razen povzetka sistema farmakovigilance in načrta za obvladovanje tveganj. Namesto podatkov iz 3. in 4. točke prvega odstavka 44. člena tega zakona se predložijo:
1. bibliografski ali strokovni dokazi, da je bilo zadevno ali drugo ustrezno zdravilo v medicinski uporabi najmanj 30 let pred datumom vloge, od tega najmanj 15 let v Evropski uniji. Če se zdravilo manj kot 15 let uporablja v Evropski uniji in pri tem izpolnjuje pogoje za tradicionalno zdravilo rastlinskega izvora, predloži JAZMP dokaze o dolgotrajni uporabi tega ali drugega ustreznega zdravila EMA v oceno, in
2. bibliografski pregled podatkov o varnosti, skupaj s strokovnim mnenjem, ki ga predloži predlagatelj in na zahtevo JAZMP, dodatne podatke, ki so potrebni za oceno varnosti zdravila.
(6) Podrobnejše pogoje, obliko in vsebino zahtevane dokumentacije v postopkih za pridobitev, spremembe, podaljšanje, prenos in prenehanje dovoljenja za promet s tradicionalnim zdravilom rastlinskega izvora, ter način označevanja in oglaševanja tradicionalnih zdravil rastlinskega izvora določi minister.
53. člen
(homeopatska zdravila)
(1) Za homeopatska zdravila je treba pridobiti dovoljenje za promet z zdravilom v skladu s 43. do 50. členom tega zakona.
(2) Ne glede na prejšnji odstavek se za homeopatska zdravila, ki so namenjena za zunanjo ali peroralno uporabo, uporablja poenostavljeni postopek pridobitve dovoljenja za promet (v nadaljnjem besedilu: postopek registracije homeopatskega zdravila), če izpolnjujejo naslednje zahteve:
1. na ovojnini in v navodilih za uporabo, če so priložena, nimajo navedenih terapevtskih indikacij ali podatkov, ki se na te nanašajo in
2. imajo zadostno stopnjo razredčitve, da zagotavljajo varnost, kakor to določajo predpisi, ki urejajo homeopatska zdravila.
(3) Vloga za pridobitev dovoljenja za promet s homeopatskim zdravilom po postopku registracije homeopatskega zdravila vsebuje:
– splošni del, ki vsebuje podatke o zdravilu, podatke o proizvajalcu zdravila, predlagatelju, podatke o vseh izdanih registracijah ali dovoljenjih za promet v drugih državah članicah Evropske unije za isto zdravilo, enega ali več vzorcev ovojnine ali osnutkov stične in zunanje ovojnine ter navodilo za uporabo;
– dokumentacijo, v kateri je opisano, kako so homeopatske surovine pridobljene in kontrolirane ter utemeljitev njihove homeopatske narave;
– dokumentacijo o proizvodnji in kontroli vsake farmacevtske oblike z opisom postopka razredčevanja in potenciranja;
– podatke o stabilnosti končnega izdelka;
– dokumentacijo o varnosti homeopatskega zdravila.
(4) Podrobnejše pogoje, obliko in vsebino zahtevane dokumentacije v postopkih za pridobitev, spremembo, podaljšanje, prenos in prenehanje dovoljenja za promet s homeopatskim zdravilom, ter način označevanja in oglaševanja homeopatskih zdravil določi minister.
54. člen
(nujni ukrepi)
(1) Ne glede na določbe 44. do 51. člena tega zakona lahko JAZMP v interesu varovanja javnega zdravja in zdravja živali ob nevarnosti za zdravje in življenje ljudi in živali po uradni dolžnosti izda začasno dovoljenje za promet z zdravilom na podlagi dejstev, ki jih ugotovi v veljavnem dovoljenju za promet z zadevnim zdravilom v izbrani državi članici Evropske unije, ter iz poročila o oceni zdravila, ki ju pridobi od pristojnega organa za zdravila v izbrani državi članici Evropske unije, če je na voljo.
(2) JAZMP o predlogu za izdajo dovoljenja iz prejšnjega odstavka v zvezi z zadevnim zdravilom obvesti imetnika dovoljenja za promet z zdravilom v državi članici Evropske unije, v kateri ima zadevno zdravilo dovoljenje za promet.
(3) Poslovni subjekt, ki je imetnik začasnega dovoljenja za promet iz prvega odstavka tega člena, je odgovoren za označevanje, navodilo za uporabo, povzetek glavnih značilnosti zdravila, oglaševanje in sistem farmakovigilance.
55. člen
(postopek pridobitve dovoljenja za promet z zdravilom)
(1) JAZMP v 30 dneh od dneva prejema vloge preveri popolnost vloge za pridobitev dovoljenja za promet z zdravilom.
(2) Predlagatelj k vlogi, na zahtevo JAZMP, za ugotavljanje ustreznosti in ponovljivosti kontrolnih metod, ki jih je uporabil proizvajalec, uradnemu kontrolnemu laboratoriju predloži vzorce zdravila, njegove vhodne snovi ter po potrebi intermediate, vmesne izdelke in ostale materiale.
(3) JAZMP lahko v dokaznem postopku pred izdajo dovoljenja za promet z zdravilom odredi analizno preskušanje zdravila pri uradnem kontrolnem laboratoriju, preverjanje izpolnjevanja dobrih praks pri poslovnih subjektih, navedenih v dokumentaciji, preverjanje analiznih metod za odkrivanje in določanje ostankov zdravil za uporabo v veterinarski medicini, zahteva dodatne podatke in obrazložitve ter izvede druge upoštevne dokaze.
(4) JAZMP v ugotovitvenem postopku pred izdajo dovoljenja za promet oceni kakovost, varnost in učinkovitost zdravila ter razmerje med koristjo in tveganjem, preveri izpolnjevanje načel in smernic dobrih praks pri proizvajalcih in preskuševalcih, ki so navedeni v dokumentaciji, ter pripravi poročilo o oceni zdravila.
(5) JAZMP v ugotovitvenem postopku lahko poleg mnenja komisije iz 4. člena tega zakona pridobi tudi dodatno mnenje posameznih zunanjih strokovnjakov iz 4. člena tega zakona glede ustreznosti dokumentov, posameznih delov ali celotne predložene dokumentacije za oceno razmerja med koristjo in tveganjem.
(6) JAZMP o vlogi za pridobitev dovoljenja za promet z zdravilom odloči v 210 dneh od dneva prejema popolne vloge in na svoji spletni strani objavi oziroma omogoči dostop do javnega poročila o zdravilu.
(7) Dovoljenje za promet z zdravilom se izda za obdobje petih let, če ni s tem zakonom določeno drugače.
56. člen
(medsebojno priznavanje)
(1) Ne glede na določbe prejšnjega člena JAZMP pri vlogi za pridobitev dovoljenja po postopku z medsebojnim priznavanjem ali decentraliziranem postopku, v katerem je Republika Slovenija zadevna država članica Evropske unije, izda oziroma zavrne izdajo dovoljenja za promet z zdravilom na podlagi poročila o oceni zdravila, ki ga pripravi referenčna država članica Evropske unije.
(2) Podrobnejše pogoje za postopek z medsebojnim priznavanjem, za decentralizirani postopek in postopek iz prejšnjega člena določi minister.
57. člen
(napotitveni postopek)
(1) JAZMP lahko v imenu Republike Slovenije pri pristojnem odboru Evropske unije sproži napotitveni postopek zaradi varovanja javnega zdravja, zdravja živali ali varovanja okolja, kadar:
– ne more odobriti poročila o oceni zdravila v postopkih iz prvega odstavka prejšnjega člena,
– so države članice Evropske unije že sprejele različne odločitve v zvezi z dovoljenjem za promet z določenim zdravilom ali so ga začasno preklicale ali odvzele,
– je to v interesu Evropske unije zaradi farmakovigilančnih razlogov ali
– JAZMP oceni, da je potrebna sprememba dovoljenja za promet z zdravilom.
(2) Podrobnejše pogoje in postopek za napotitveni postopek iz prejšnjega odstavka določi minister.
58. člen
(dovoljenje za promet z zdravilom s posebnimi pogoji)
(1) JAZMP lahko izjemoma in po uskladitvi s predlagateljem izda dovoljenje za promet z zdravilom pod posebnimi pogoji, predvsem v zvezi z varnostjo zdravila, obveščanjem pristojnih organov Evropske unije in držav članic Evropske unije o vseh dogodkih v zvezi z uporabo zdravila ter potrebnimi ukrepi. Tako dovoljenje se lahko izda le, če predlagatelj dokaže, da obširnejših podatkov iz 44. člena tega zakona ne more predložiti iz objektivnih in preverljivih razlogov (npr. trenutno stanje znanstvenih dognanj, področje zdravljenja redkih bolezni, načela medicinske etike). Dovoljenje za promet z zdravilom določa roke za izpolnitev teh pogojev, kadar je to potrebno.
(2) JAZMP vsako leto preveri izpolnjevanje pogojev iz dovoljenja za promet z zdravilom iz prejšnjega odstavka.
(3) Imetniku že izdanega dovoljenja za promet z zdravilom iz tega zakona lahko JAZMP na podlagi utemeljenih razlogov naloži izvedbo študije o varnosti oziroma učinkovitosti zdravila ter mu pisno določi cilje in roke za predložitev in izvedbo študije.
(4) Imetnik dovoljenja za promet z zdravilom lahko JAZMP v roku, ki ga določi JAZMP, predloži pisna pojasnila kot odgovor na naloženo obveznost iz prejšnjega odstavka, če imetnik dovoljenja za promet z zdravilom za to zaprosi v 30 dneh od naložene obveznosti. JAZMP na podlagi predloženih pisnih pojasnil odloči o izvedbi študije o varnosti oziroma učinkovitosti zadevnega zdravila.
(5) Na podlagi obveznosti izvedbe študij iz tretjega odstavka tega člena in ob upoštevanju prejšnjega odstavka JAZMP izda dovoljenje za promet z zdravilom tako, da naloženo obveznost vključi kot pogoj v dovoljenje za promet z zdravilom.
(6) JAZMP na svoji spletni strani objavi seznam zdravil iz tega člena ter pogoje in roke za izpolnitev pogojev.
(7) Imetnik dovoljenja za promet z zdravilom pogoje in obveznosti iz prvega, tretjega in petega odstavka tega člena v zvezi z varnostjo zdravila vključi v sistem obvladovanja tveganj.
(8) Podrobnejše pogoje iz prvega, tretjega in petega odstavka tega člena določi minister.
59. člen
(krovno dovoljenje za promet z zdravilom)
(1) Ne glede na to, ali se za dodatne jakosti, farmacevtske oblike, poti uporabe, pakiranja ali druge spremembe ali razširitve dovoljenja za promet z zdravilom izda posamezno dovoljenje za promet ali so del osnovnega dovoljenja za promet, se vsa ta dovoljenja za promet štejejo kot del krovnega dovoljenja za promet, pri zdravilih za uporabo v veterinarski medicini pa tudi dovoljenje za promet za drugo živalsko vrsto.
(2) Krovno dovoljenje za promet se uporablja zlasti za potrebe izvajanja 45. in 46. člena tega zakona.
60. člen
(zavrnitev izdaje dovoljenja za promet z zdravilom)
(1) JAZMP zavrne izdajo dovoljenja za promet z zdravilom, če po preverjanju podatkov in dokumentacije ugotovi, da:
– razmerje med koristjo in tveganjem pri uporabi zdravila ni ugodno,
– predlagatelj z dokazi ni zadovoljivo podprl kakovosti, varnosti in terapevtske učinkovitosti zdravila,
– kakovostna in količinska sestava zdravila ne ustrezata navedbam v dokumentaciji,
– označevanje ali navodilo za uporabo, ki ga je predložil predlagatelj, ni v skladu s tem zakonom in na njegovi podlagi sprejetimi predpisi,
– navedbe v dokumentaciji ne ustrezajo dejanskemu stanju ali
– podatki v dokumentaciji niso v skladu s 44. do 50. členom tega zakona.
(2) JAZMP zavrne izdajo dovoljenja za promet z zdravilom za uporabo v veterinarski medicini, če poleg primerov iz prejšnjega odstavka ugotovi tudi, da:
– je učinkovitost zdravila pomanjkljivo utemeljena ali da zdravilo ni učinkovito,
– karenca, ki jo priporoča predlagatelj, ni dovolj dolga, da živila, pridobljena iz zdravljenih živali, ne bi vsebovala ostankov zdravil, ki bi lahko predstavljali tveganje za zdravje ljudi, ali ni dovolj utemeljena,
– zdravilo predstavlja tveganje za okolje,
– se zdravilo daje v promet za uporabo, ki je prepovedana s predpisi Evropske unije ali
– je zdravilo namenjeno za uporabo pri eni ali več vrstah živali za proizvodnjo hrane in vsebuje eno ali več učinkovin, ki niso dovoljene in so navedene v prilogi Uredbe 37/2010/EU ali v prilogah Uredbe 37/2010/EU niso navedene.
(3) Izdaja dovoljenja za promet s tradicionalnim zdravilom rastlinskega izvora se zavrne v primerih iz prvega odstavka tega člena in tudi, če se ugotovi, da:
– terapevtske indikacije niso v skladu s predpisanimi pogoji ali
– podatki o tradicionalni uporabi niso zadostni, zlasti če farmakološki učinki ali učinkovitost niso verjetni na podlagi dolgotrajne uporabe in izkušenj.
(4) Izdaja dovoljenja za promet s homeopatskim zdravilom se zavrne v primerih iz prvega odstavka tega člena in tudi, če se ugotovi, da homeopatsko zdravilo, za katerega je vložena vloga za pridobitev dovoljenja za promet po poenostavljenem postopku, ne izpolnjuje pogojev iz drugega odstavka 53. člena tega zakona.
61. člen
(obdobje za dajanje zdravila v promet)
(1) Če zdravilo z istim lastniškim imenom po začetku veljavnosti dovoljenja za promet z zdravilom tri zaporedna leta dejansko ni bilo dano v promet v Republiki Sloveniji, se dovoljenje za promet z zdravilom odvzame.
(2) Če zdravilo z istim lastniškim imenom, ki mu je JAZMP izdala dovoljenja za promet z zdravilom in je bilo predhodno dano v promet, vendar ga ni več na trgu v obdobju treh zaporednih let, se mu dovoljenje za promet odvzame.
(3) Ne glede na določbe prvega in drugega odstavka tega člena lahko JAZMP v upravičenih primerih zaradi nemotene preskrbe z zdravili ali zaradi varovanja javnega zdravja izjemoma ne odvzame dovoljenja za promet zdravilu, ki po izdaji dovoljenja za promet tri zaporedna leta dejansko ni v prometu.
(4) JAZMP o nameravanem odvzemu dovoljenja za promet obvesti imetnika dovoljenja za promet z zdravilom vsaj tri mesece pred izdajo odločbe o odvzemu dovoljenja za promet.
62. člen
(spremembe dovoljenja za promet z zdravilom)
(1) Po izdaji dovoljenja za promet z zdravilom imetnik dovoljenja za promet z zdravilom pri postopkih proizvodnje in nadzora proizvodnje zdravila upošteva znanstveni in tehnični napredek ter uvaja vse zahtevane spremembe, da se omogoči proizvodnja in preverjanje zdravila po splošno sprejetih znanstvenih postopkih. Imetnik dovoljenja za promet z zdravilom JAZMP sporoči nove podatke, ki lahko vplivajo na spremembo dovoljenja za promet z zdravilom ali na spremembo dokumentacije o zdravilu.
(2) Imetnik dovoljenja za promet z zdravilom JAZMP obvesti o vseh podatkih, ki lahko vplivajo na oceno razmerja med koristjo in tveganjem, in posebej o ukrepih, omejitvah ali prepovedih, ki so jih uvedle druge države članice Evropske unije. Podatki vključujejo pozitivne in negativne rezultate kliničnih preskušanj ali drugih študij za vse indikacije in populacije, ne glede na to, ali so vključene v dovoljenje za promet z zdravilom ali ne, ter podatke o uporabi zdravila, kadar je takšna uporaba izven okvira pogojev dovoljenja za promet.
(3) Imetnik dovoljenja za promet z zdravilom zagotovi, da se podatki o zdravilu sproti dopolnjujejo z novimi znanstvenimi spoznanji, vključno s sklepi in priporočili, objavljenimi na evropskem spletnem portalu o zdravilih, vzpostavljenem v skladu s 26. členom Uredbe 726/2004/ES.
(4) JAZMP lahko od imetnika dovoljenja za promet z zdravilom kadarkoli zahteva, da v sedmih dneh po prejemu zahteve predloži izvod glavnega dosjeja o sistemu farmakovigilance.
(5) Za spremembo pogojev dovoljenja za promet z zdravilom, ki se nanašajo na določbe prvega, drugega in tretjega odstavka tega člena, imetnik dovoljenja za promet z zdravilom pri JAZMP vloži vlogo.
(6) JAZMP sprejme oziroma zavrne vlogo za spremembo pogojev dovoljenja za promet z zdravilom v rokih in po postopku iz Uredbe 1234/2008/ES.
(7) Podrobnejše pogoje, obliko in vsebino dokumentacije v postopkih za spremembo dovoljenja za promet z zdravilom določi minister.
63. člen
(podaljšanje dovoljenja za promet z zdravilom)
(1) Za podaljšanje dovoljenja za promet z zdravilom imetnik dovoljenja za promet z zdravilom najmanj devet mesecev pred iztekom dovoljenja za promet z zdravilom za uporabo v humani medicini in najmanj šest mesecev pred iztekom dovoljenja za promet z zdravilom za uporabo v veterinarski medicini predloži vlogo za njegovo podaljšanje.
(2) Veljavnost dovoljenja za promet z zdravilom se lahko podaljša po izteku petih let na podlagi vloge za podaljšanje dovoljenja za promet z zdravilom in ponovne ocene razmerja med koristjo in tveganjem pri uporabi zdravila.
(3) JAZMP odloči o vlogi za podaljšanje dovoljenja za promet z zdravilom v 90 dneh od prejema popolne vloge.
(4) Dovoljenje za promet z zdravilom, ki je prvič podaljšano, velja praviloma za nedoločen čas oziroma do prenehanja njegove veljavnosti v skladu s tem zakonom.
(5) Ne glede na prejšnji odstavek JAZMP lahko na podlagi upravičenih razlogov v zvezi s podatki iz sistema farmakovigilance, vključno z nezadostnim številom pacientov, izpostavljenih zadevnemu zdravilu, odloči, da se dovoljenje za promet z zdravilom podaljša za določen čas za obdobje pet let.
(6) Pri postopkih z medsebojnim priznavanjem ali decentraliziranem postopku JAZMP podaljšanje dovoljenja za promet z zdravilom odobri oziroma zavrne na podlagi poročila o oceni zdravila, ki ga pripravi referenčna država članica Evropske unije.
(7) Podrobnejše pogoje, obliko in vsebino dokumentacije v postopkih za podaljšanje dovoljenja za promet z zdravilom določi minister.
64. člen
(spremembe in odvzem dovoljenja za promet z zdravilom za uporabo v humani medicini po uradni dolžnosti)
(1) JAZMP spremeni, začasno odvzame ali odvzame dovoljenje za promet z zdravilom za uporabo v humani medicini, če ugotovi, da:
– je zdravilo škodljivo,
– zdravilo terapevtsko ni učinkovito (če ugotovi, da z njim ni mogoče doseči terapevtskih rezultatov),
– pri zdravilu razmerje med koristjo in tveganjem ni ugodno oziroma to sledi iz ocene rednega posodobljenega poročila o varnosti zdravila ali drugih podatkov iz sistema farmakovigilance,
– imetnik dovoljenja za promet z zdravilom ne izpolni pogojev in obveznosti iz prvega in tretjega odstavka 58. člena tega zakona,
– kakovostna in količinska sestava zdravila ne ustrezata deklarirani,
– je bilo zdravilo v prometu v nasprotju z dovoljenjem za promet z zdravilom ali
– je bilo zdravilo v prometu v nasprotju s tem zakonom in na njegovi podlagi izdanimi predpisi oziroma predpisi Evropske unije o zdravilih.
(2) Dovoljenje za promet z zdravilom za uporabo v humani medicini se spremeni, začasno odvzame ali odvzame, če se naknadno ugotovi, da so podatki v vlogi nepravilni ali niso bili predloženi ali dopolnjeni v skladu s predpisi, ali kadar predpisane kontrole niso bile opravljene.
(3) JAZMP odvzame ali začasno odvzame dovoljenje za promet za posamezno zdravilo, za skupino zdravil ali za vsa zdravila za uporabo v humani medicini, ki se proizvajajo na podlagi dovoljenja za proizvodnjo zdravil, kadar katerikoli od pogojev iz dovoljenja za proizvodnjo zdravil ni izpolnjen.
(4) JAZMP lahko spremeni, začasno odvzame ali odvzame dovoljenje za promet z zdravilom za uporabo v humani medicini, če imetnik dovoljenja za promet z zdravilom ne izpolni zahtev v skladu s predpisi in v rokih za spremembo, začasni odvzem ali odvzem dovoljenja za promet z zadevnim zdravilom, ki jih določi JAZMP.
(5) V primerih nujnega ukrepanja za varovanje javnega zdravja JAZMP lahko začasno odvzame dovoljenje za promet z zdravilom za uporabo v humani medicini in prepove uporabo zadevnega zdravila v Republiki Sloveniji. O razlogih za takšno ukrepanje obvesti Evropsko komisijo, EMA in organe, pristojne za zdravila drugih držav članic Evropske Unije najpozneje naslednji delovni dan. Začasni odvzem dovoljenja za promet z zdravilom in prepoved uporabe zadevnega zdravila veljata do odločitve JAZMP, sprejete po uradni dolžnosti na podlagi sprejetih ukrepov na ravni Evropske unije.
(6) JAZMP spremeni, začasno odvzame ali odvzame dovoljenje za promet z zdravilom za uporabo v humani medicini po uradni dolžnosti na podlagi sprejetih ukrepov na ravni Evropske unije, ki jih v primerih nujnega ukrepanja sprožijo organi, pristojni za zdravila, drugih držav članic Evropske unije ali Evropske komisije.
65. člen
(spremembe in odvzem dovoljenja za promet z zdravilom za uporabo v veterinarski medicini po uradni dolžnosti)
(1) JAZMP spremeni, začasno odvzame ali odvzame dovoljenje za promet z zdravilom za uporabo v veterinarski medicini, kadar:
– je pri zdravilu ocena razmerja med koristjo in tveganjem neugodna glede na pogoje uporabe iz dovoljenja za promet, pri čemer se še posebej upoštevajo zdravje in dobrobit živali ter varnost potrošnikov, če gre za dovoljenje za zdravilo za zootehnično uporabo,
– zdravilo nima terapevtskega učinka na živalsko vrsto, ki ji je zdravljenje namenjeno,
– kakovostna in količinska sestava zdravila ni enaka deklarirani,
– je priporočena karenca neustrezna in ni zagotovljeno, da živila, pridobljena iz zdravljene živali, ne bodo vsebovala ostankov zdravil, ki bi lahko predstavljali tveganje za zdravje ljudi,
– se zdravilo v prometu ponuja ali oglašuje za uporabo, ki je prepovedana s predpisi,
– podatki v vlogi niso v skladu s predpisi, nepravilni ali niso bili ustrezno dopolnjeni ali kadar predpisane kontrole niso bile opravljene,
– podatki iz dokumentacije niso bili spremenjeni v skladu z znanstveno-tehničnim napredkom na področju proizvodnje in kontrole zdravil,
– pristojnim organom niso bili posredovani novi podatki o prepovedih in omejitvah uporabe zdravila v katerikoli državi članici Evropske unije in novi podatki o razmerju med koristjo in tveganjem,
– je bilo zdravilo v prometu v nasprotju z dovoljenjem za promet z zdravilom ali
– je bilo zdravilo v prometu v nasprotju s tem zakonom in na njegovi podlagi sprejetimi predpisi oziroma predpisi Evropske unije o zdravilih.
(2) Dovoljenje za promet z zdravilom za uporabo v veterinarski medicini se spremeni, začasno odvzame ali odvzame, če se naknadno ugotovi, da so podatki v vlogi nepravilni ali niso bili predloženi ali dopolnjeni v skladu s predpisi, ali kadar predpisane kontrole niso bile opravljene.
(3) JAZMP odvzame ali začasno odvzame dovoljenje za promet za skupino zdravil ali vsa zdravila za uporabo v veterinarski medicini, ki se proizvajajo na podlagi dovoljenja za proizvodnjo, kadar katerakoli od določb zadevnega dovoljenja za proizvodnjo ni izpolnjena, ter odvzame ali začasno odvzame dovoljenje za proizvodnjo za skupino zdravil ali za vsa zdravila.
(4) JAZMP lahko odvzame, začasno odvzame ali spremeni dovoljenje za promet z zdravilom za uporabo v veterinarski medicini, če imetnik dovoljenja za promet z zdravilom ne izpolni zahtev v skladu s predpisi, v rokih, ki jih določi JAZMP.
(5) V primerih nujnega ukrepanja za varovanje javnega zdravja JAZMP lahko začasno odvzame dovoljenje za promet z zdravilom za uporabo v veterinarski medicini in prepove uporabo zadevnega zdravila v Republiki Sloveniji. O razlogih za takšno ukrepanje obvesti Evropsko komisijo, EMA in organe, pristojne za zdravila drugih držav članic Evropske unije najpozneje naslednji delovni dan. Začasni odvzem dovoljenja za promet in prepoved uporabe zadevnega zdravila veljata do odločitve JAZMP, sprejete po uradni dolžnosti na podlagi sprejetih ukrepov na ravni Evropske unije.
(6) JAZMP spremeni, začasno odvzame ali odvzame dovoljenje za promet z zdravilom za uporabo v veterinarski medicini po uradni dolžnosti na podlagi sprejetih ukrepov na ravni Evropske unije, ki jih v primerih nujnega ukrepanja sprožijo organi, pristojni za zdravila, drugih držav članic Evropske unije ali Evropske komisije.
66. člen
(prenehanje veljavnosti dovoljenja za promet z zdravilom)
(1) Dovoljenje za promet z zdravilom preneha veljati:
– po izteku roka veljavnosti dovoljenja,
– na podlagi vloge predlagatelja za ukinitev dovoljenja za promet z zdravilom ali
– zaradi odvzema dovoljenja za promet z zdravilom v skladu s 64. ali 65. členom tega zakona.
(2) JAZMP začne postopek za prenehanje veljavnosti dovoljenja za promet z zdravilom iz druge in tretje alineje prejšnjega odstavka:
– po uradni dolžnosti ali
– na podlagi vloge imetnika zadevnega dovoljenja za promet z zdravilom.
(3) Podrobnejšo vsebino vloge in postopek v zvezi s prenehanjem dovoljenja za promet z zdravilom določi minister.
67. člen
(odprodaja zdravila po spremembi ali poteku veljavnosti dovoljenja za promet z zdravilom)
(1) Zdravilo, katerega dovoljenje za promet je bilo spremenjeno, in ki je bilo proizvedeno, vneseno ali uvoženo pred priglasitvijo oziroma odobritvijo spremembe dovoljenja za promet z zdravilom, je lahko v prometu do izteka roka uporabnosti zdravila, razen kadar JAZMP na podlagi ocene razmerja med koristjo in tveganjem v interesu varovanja javnega zdravja ne odloči drugače ali prepove promet s tem zdravilom.
(2) Zdravilo, katerega dovoljenje za promet je poteklo ali je prenehalo veljati na predlog imetnika dovoljenja za promet z zdravilom, in ki je bilo proizvedeno, vneseno ali uvoženo do izteka veljavnosti dovoljenja za promet z zdravilom, je lahko na predlog imetnika dovoljenja za promet z zdravilom, ki ga je JAZMP prejela najmanj dva meseca pred iztekom veljavnosti dovoljenja za promet, v prometu do izteka roka uporabnosti zdravila, vendar največ 18 mesecev po izteku veljavnosti dovoljenja za promet z zdravilom, razen če JAZMP v 30 dneh od dneva prejema predloga temu nasprotuje. Imetnik dovoljenja za promet z zdravilom, se v svojem predlogu zaveže, da bo zagotovil izvajanje nalog farmakovigilance.
(3) JAZMP lahko nasprotuje predlogu iz prejšnjega odstavka oziroma prepove promet z zdravilom kadarkoli v obdobju trajanja 18 mesečnega obdobja na podlagi ocene razmerja med koristjo in tveganjem v interesu varovanja javnega zdravja.
68. člen
(dokumentacija kot poslovna skrivnost)
Dokumentacija iz vloge za pridobitev, spremembo in podaljšanje dovoljenja za promet z zdravilom je last predlagatelja in je poslovna skrivnost, razen podatkov v dovoljenju za promet z zdravilom, povzetka glavnih značilnosti zdravila, navodila za uporabo zdravila in podatkov na ovojnini.
69. člen
(objave podatkov o dovoljenjih za promet z zdravilom)
JAZMP na svoji spletni strani objavi podatke oziroma povezave do podatkov o zdravilih, za katera je bilo izdano dovoljenje za promet ali za katera je dovoljenje za promet z zdravilom prenehalo veljati ali jim je bilo dovoljenje spremenjeno, podaljšano, začasno odvzeto ali odvzeto.
70. člen
(prenos dovoljenja za promet z zdravilom)
(1) Imetnik dovoljenja za promet z zdravilom lahko prenese dovoljenje za promet z zdravilom na poslovni subjekt, ki izpolnjuje pogoje po tem zakonu.
(2) Podrobnejši postopek prenosa dovoljenja za promet z zdravilom iz prejšnjega odstavka in dokumentacijo ter postopek preverjanja predpisanih pogojev in drugih dokazil določi minister.
V. NERUTINSKO PRIPRAVLJENA ZDRAVILA ZA NAPREDNO ZDRAVLJENJE
71. člen
(zdravila za napredno zdravljenje)
(1) Za zdravila za napredno zdravljenje je treba pridobiti dovoljenje za promet po centraliziranem postopku v skladu z Uredbo 1394/2007/ES in Uredbo 726/2004/ES, razen za nerutinsko pripravljena zdravila za napredno zdravljenje, za pripravo katerih je potrebno dovoljenje iz 83. člena tega zakona.
(2) Nerutinsko pripravljeno zdravilo za napredno zdravljenje za uporabo v humani ali veterinarski medicini lahko pripravi poslovni subjekt, ki je imetnik dovoljenja JAZMP za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje v skladu s standardi kakovosti oziroma pogoji za pripravo, določenimi s tem zakonom, v okviru izdanega dovoljenja. Nerutinsko pripravljeno zdravilo za napredno zdravljenje se pripravi na podlagi posamične pisne naročilnice zdravnika ali veterinarja, ki je vrsta zdravniškega oziroma veterinarskega recepta, s katerim zdravnik ali veterinar za potrebe zdravljenja pacientov ali živali pri izvajalcu zdravstvene ali veterinarske dejavnosti predpiše nerutinsko pripravljeno zdravilo za napredno zdravljenje.
(3) Za kakovost, varnost in učinkovitost nerutinsko pripravljenega zdravila za napredno zdravljenje je odgovoren imetnik dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje.
(4) Kadar zdravilo za napredno zdravljenje vsebuje človeške celice ali tkiva, se darovanje, pridobivanje in testiranje teh celic ali tkiv izvede v skladu s predpisi, ki urejajo preskrbo s človeškimi tkivi in celicami, namenjenimi za zdravljenje.
72. člen
(pogoji za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje)
(1) Poslovni subjekt, ki pripravlja nerutinsko pripravljena zdravila za napredno zdravljenje, izpolnjuje naslednje pogoje:
1. ima zaposleno ustrezno število strokovnjakov z ustrezno izobrazbo glede na obseg in zahtevnost priprave nerutinsko pripravljenega zdravila za napredno zdravljenje,
2. ima ustrezne prostore, naprave in opremo za pripravo, kontrolo, shranjevanje in transport nerutinsko pripravljenega zdravila za napredno zdravljenje,
3. med strokovnjaki iz 1. točke tega odstavka ima imenovano odgovorno osebo za kakovost nerutinsko pripravljenega zdravila za napredno zdravljenje, ki je odgovorna, da priprava nerutinsko pripravljenega zdravila za napredno zdravljenje poteka v skladu s tem zakonom in na njegovi podlagi sprejetimi predpisi,
4. ima sistem kakovosti in ga posodablja,
5. smiselno upošteva načela in smernice dobre proizvodne prakse, upoštevajoč specifične lastnosti nerutinsko pripravljenega zdravila za napredno zdravljenje, glede na izdelano oceno tveganja in zagotovi najmanj standarde, ki so v Republiki Sloveniji določeni s predpisi, ki urejajo preskrbo s človeškimi tkivi in celicami, namenjenimi za zdravljenje,
6. ima sklenjene ustrezne pogodbe s poslovnimi subjekti, ki zagotavljajo materiale in storitve, ki vplivajo na kakovost in varnost nerutinsko pripravljenih zdravil za napredno zdravljenje, v katerih so natančno določene odgovornosti in naloge ter strokovna usposobljenost vseh pogodbenih strank,
7. v skladu z dobro distribucijsko prakso zagotavlja ustrezen transport nerutinskega zdravila za napredno zdravljenje do naročnika oziroma naročnice (v nadaljnjem besedilu: naročnik).
(2) Pri pripravi in uporabi nerutinsko pripravljenih zdravil za napredno zdravljenje, ki vsebujejo ali so sestavljena iz človeških tkiv in celic, mora biti zagotovljena popolna sledljivost od darovalca oziroma darovalke (v nadaljnjem besedilu: darovalec) do prejemnika oziroma prejemnice (v nadaljnjem besedilu: prejemnik) teh zdravil.
(3) Podrobnejše pogoje glede zaposlenih, prostorov in opreme za pripravo nerutinsko pripravljenih zdravil za napredno zdravljenje ter način uporabe smernic in načel dobre proizvodne prakse za zdravila pri pripravi nerutinsko pripravljenih zdravil za napredno zdravljenje določi minister.
73. člen
(odgovorna oseba za kakovost)
Odgovorna oseba iz 3. točke prvega odstavka prejšnjega člena ima izobrazbo medicinske, farmacevtske, veterinarske ali biomedicinske smeri druge stopnje oziroma raven izobrazbe, ki v skladu z zakonom ustreza tej stopnji ter dodatna znanja s tega področja in najmanj dve leti praktičnih izkušenj s področja priprave nerutinsko pripravljenih zdravil za napredno zdravljenje.
74. člen
(obveznosti imetnika dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje)
(1) Imetnik dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje:
1. uporablja material in reagente, katerih kakovost je skladna z načeli in smernicami dobre proizvodne prakse, če ti ne obstajajo, pa na podlagi strokovne utemeljitve materiale in reagente najvišje kakovosti;
2. ima vzpostavljen sistem upravljanja s tveganji, ki smiselno upošteva načela in smernice dobre proizvodne prakse, upoštevajoč specifične lastnosti nerutinsko pripravljenega zdravila za napredno zdravljenje ter izdelano oceno tveganja, in zagotavlja najmanj standarde, ki so v Republiki Sloveniji določeni s predpisi, ki urejajo preskrbo s človeškimi tkivi in celicami, namenjenimi za zdravljenje;
3. ima vzpostavljen sistem kontrole kakovosti nerutinsko pripravljenega zdravila za napredno zdravljenje, ki smiselno upošteva načela in smernice dobre proizvodne prakse, upoštevajoč tudi specifične lastnosti nerutinsko pripravljenega zdravila za napredno zdravljenje ter oceno tveganja, in zagotavlja najmanj standarde, ki so v Republiki Sloveniji določeni s predpisi, ki urejajo preskrbo s človeškimi tkivi in celicami, namenjenimi za zdravljenje;
4. zagotovi, da se na vzorcih vhodnega materiala in končnega nerutinsko pripravljenega zdravila za napredno zdravljenje ali vmesnega izdelka izvedejo vsi testi, ki so potrebni za potrditev skladnosti s specifikacijami in standardi;
5. naročniku izda potrdilo o skladnosti priprave nerutinsko pripravljenega zdravila za napredno zdravljenje s specifikacijami in standardi, ki jih zagotavlja imetnik dovoljenja;
6. pridobi pozitivno mnenje KME za pripravo posamezne skupine zdravil za uporabo v humani medicini, in sicer ločeno za zdravila za gensko zdravljenje, zdravila za somatsko celično zdravljenje in izdelke tkivnega inženirstva;
7. s posebno skrbnostjo zagotovi, da so vsi podatki o vhodnih materialih, vmesnih izdelkih in končnem nerutinsko pripravljenem zdravilu za napredno zdravljenje, vključno s podatki o združljivosti posameznih komponent večkomponentnega nerutinsko pripravljenega zdravila za napredno zdravljenje in ovojnine, ki so upoštevne za oceno varnosti, kakovosti in učinkovitosti, resnične in nezavajajoče;
8. zagotovi, da so podatki iz prejšnje točke in vsi zapisi o podrobnostih priprave nerutinsko pripravljenega zdravila za napredno zdravljenje shranjeni v takšni obliki, da so dostopni in berljivi vsaj 30 let po uporabi nerutinsko pripravljenega zdravila za napredno zdravljenje.
(2) Imetnik dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje ne sme:
1. pripravljati nerutinsko pripravljenih zdravil za napredno zdravljenje, ki so izven obsega dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje;
2. pripravljati nerutinsko pripravljenih zdravil za napredno zdravljenje na lokacijah in v obratih, ki niso navedeni v dovoljenju za pripravo nerutinsko pripravljenih zdravil za napredno zdravljenje;
3. pripravljati nerutinsko pripravljenih zdravil za napredno zdravljenje v prostorih, ki niso navedeni v dokumentaciji, ki je bila podlaga za izdajo dovoljenja za pripravo nerutinsko pripravljenih zdravil za napredno zdravljenje;
4. opravljati drugih dejavnosti v istih prostorih, če za to ni pridobil soglasja JAZMP;
5. pripravljati nerutinsko pripravljenih zdravil za napredno zdravljenje, ki vsebujejo človeška tkiva in celice, če darovanje, pridobivanje človeških tkiv in celic ter testiranje darovalcev človeških tkiv in celic ni bilo izvedeno v skladu s četrtim odstavkom 71. člena tega zakona;
6. pripravljati nerutinsko pripravljenega zdravila za napredno zdravljenje za namen kliničnega preskušanja.
75. člen
(poročanje)
(1) Imetnik dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje JAZMP do 31. januarja tekočega leta za preteklo leto posreduje letno poročilo o svojih aktivnostih, ki vsebuje podatke o:
– številu nerutinsko pripravljenih zdravil za napredno zdravljenje,
– pripravljenih nerutinskih zdravilih za napredno zdravljenje iz skupin zdravil za napredno zdravljenje, za katero je JAZMP izdala dovoljenje,
– številu pacientov oziroma živali, zdravljenih s posameznim nerutinsko pripravljenim zdravilom za napredno zdravljenje,
– imenu zdravnika oziroma veterinarja, ki je predpisal nerutinsko pripravljeno zdravilo za napredno zdravljenje, in je odgovoren za spremljanje pacienta oziroma živali,
– imenu donorskega centra.
(2) Imetnik dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje v veterinarski medicini, podatke o zdravilih za uporabo pri živalih iz prejšnjega odstavka posreduje organu, pristojnemu za veterinarstvo, v roku iz prejšnjega odstavka.
76. člen
(iznos in izvoz ter vnos in uvoz nerutinsko pripravljenega zdravila za napredno zdravljenje)
Iznos in izvoz ter vnos in uvoz nerutinsko pripravljenih zdravil za napredno zdravljenje je prepovedan.
77. člen
(odgovornost zdravnika oziroma veterinarja)
(1) Zdravnik oziroma veterinar predpiše in uporabi nerutinsko pripravljeno zdravilo za napredno zdravljenje ob svoji izključni poklicni odgovornosti.
(2) Pri izvajalcu zdravstvene oziroma veterinarske dejavnosti zdravnik oziroma veterinar, ki predpiše in uporablja nerutinsko pripravljeno zdravilo za napredno zdravljenje, zavaruje svojo odgovornost za morebitno škodo, povzročeno pacientu oziroma živali, v višini najmanj 100.000 eurov.
(3) Zdravnik oziroma veterinar pred uporabo nerutinsko pripravljenega zdravila za napredno zdravljenje pacienta oziroma lastnika oziroma skrbnika živali seznani s postopkom zdravljenja in tveganji, povezanimi z zdravljenjem z nerutinsko pripravljenim zdravilom za napredno zdravljenje. O seznanitvi zdravnik oziroma veterinar hrani podpisano izjavo pacienta oziroma lastnika ali skrbnika živali na obrazcu, ki je objavljen na spletni strani JAZMP.
(4) Zdravnik oziroma veterinar ob uporabi nerutinsko pripravljenega zdravila za napredno zdravljenje pacientu oziroma lastniku ali skrbniku živali posreduje navodilo za uporabo.
(5) Zdravnik oziroma veterinar ne sme uporabiti nerutinsko pripravljenega zdravila za napredno zdravljenje brez potrdila o skladnosti priprave nerutinsko pripravljenega zdravila za napredno zdravljenje s specifikacijami ter smernicami in načeli dobre proizvodne prakse, ki ga izda imetnik dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje.
(6) Zdravnik oziroma veterinar, ki predpisuje in uporablja nerutinsko pripravljeno zdravilo za napredno zdravljenje, ima vzpostavljen sistem, ki omogoča sledljivost uporabljenega nerutinsko pripravljenega zdravila za napredno zdravljenje za vsakega pacienta oziroma žival.
(7) Zdravnik oziroma veterinar spremlja potek zdravljenja pri pacientu oziroma živali, pri kateri je uporabil nerutinsko pripravljeno zdravilo za napredno zdravljenje.
78. člen
(register zdravnikov oziroma veterinarjev, ki pri zdravljenju uporabljajo nerutinsko pripravljena zdravila za napredno zdravljenje)
(1) Zdravnik oziroma veterinar, ki predpiše in uporabi nerutinsko pripravljeno zdravilo za napredno zdravljenje, se pri JAZMP priglasi v register zdravnikov oziroma veterinarjev, ki pri zdravljenju uporabljajo nerutinsko pripravljena zdravila za napredno zdravljenje.
(2) Vlogo za vpis v register zdravnikov oziroma veterinarjev, ki pri zdravljenju uporabljajo nerutinsko pripravljena zdravila za napredno zdravljenje, vloži na JAZMP izvajalec zdravstvene oziroma veterinarske dejavnosti, najpozneje 15 dni pred začetkom predpisovanja in uporabe nerutinsko pripravljenega zdravila za napredno zdravljenje, ki vsebuje:
– ime, priimek, strokovni naziv ter biografske in bibliografske podatke zdravnikov oziroma veterinarjev z ustrezno specializacijo, ki pri zdravljenju uporabljajo nerutinsko pripravljena zdravila za napredno zdravljenje;
– ime in naslov izvajalca zdravstvene oziroma veterinarske dejavnosti, pri katerih zdravnik oziroma veterinar iz prejšnje alineje uporablja nerutinsko pripravljena zdravila za napredno zdravljenje;
– kopijo zavarovalne police za zavarovanje odgovornosti zdravnika oziroma veterinarja v skladu z drugim odstavkom prejšnjega člena.
(3) Izvajalec zdravstvene oziroma veterinarske dejavnosti vsako spremembo podatkov iz prejšnjega odstavka JAZMP sporoči najpozneje v sedmih dneh.
(4) JAZMP zdravnika oziroma veterinarja izbriše iz registra iz prvega odstavka tega člena na zahtevo izvajalca zdravstvene oziroma veterinarske dejavnosti iz prejšnjega odstavka.
(5) Podrobnejši postopek in vsebino vloge za vpis, spremembo in izbris iz registra zdravnikov oziroma veterinarjev, ki pri zdravljenju uporabljajo nerutinsko pripravljena zdravila za napredno zdravljenje, določi minister.
79. člen
(označevanje nerutinsko pripravljenega zdravila za napredno zdravljenje)
(1) Nerutinsko pripravljeno zdravilo za napredno zdravljenje mora biti ustrezno označeno in opremljeno z navodili za uporabo na način, ki zagotavlja njegovo sledljivost ter pravilno in varno uporabo.
(2) Podrobnejše zahteve glede označevanja nerutinsko pripravljenega zdravila za napredno zdravljenje določi minister.
80. člen
(sledljivost nerutinsko pripravljenega zdravila za napredno zdravljenje)
(1) Imetnik dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje vzpostavi in vzdržuje sistem, ki zagotavlja sledljivost nerutinsko pripravljenega zdravila za napredno zdravljenje ter vhodnih snovi in surovin, vključno z materiali, ki prihajajo v stik s tkivi in celicami, ki jih nerutinsko pripravljena zdravila za napredno zdravljenje lahko vsebujejo, od izvora, priprave, pakiranja, shranjevanja, transporta do izvajalca zdravstvene ali veterinarske dejavnosti, kjer se nerutinsko pripravljeno zdravilo za napredno zdravljenje uporablja.
(2) Imetnik dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje hrani podatke o sledljivosti najmanj 30 let po izteku roka uporabnosti nerutinsko pripravljenega zdravila za napredno zdravljenje.
(3) Imetnik dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje zagotovi, da so podatki o sledljivosti na voljo JAZMP tudi v primeru odvzema, preklica ali ukinitve tega dovoljenja. V primeru stečaja ali prenehanja opravljanja dejavnosti mora podatke o sledljivosti posredovati JAZMP.
(4) Imetnik dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje zagotovi, da sistem sledljivosti za nerutinsko pripravljeno zdravilo za napredno zdravljenje, ki vsebuje človeška tkiva in celice, dopolnjuje in je združljiv z zahtevami iz 8. in 14. člena Direktive 2004/23/ES Evropskega parlamenta in Sveta z dne 31. marca 2004 o določitvi standardov kakovosti in varnosti, darovanja, pridobivanja, testiranja, predelave, konzerviranja, shranjevanja in razdeljevanja človeških tkiv in celic (UL L št. 102 z dne 7. 4. 2004, str. 48), zadnjič spremenjene z Uredbo 596/2009/ES, ter 14. in 24. člena Direktive Evropskega parlamenta in Sveta 2002/98/ES z dne 27. januarja 2003 o določitvi standardov kakovosti in varnosti za zbiranje, preskušanje, predelavo, shranjevanje in razdeljevanje človeške krvi in komponent krvi ter o spremembi Direktive 2001/83/ES (UL L št. 33 z dne 8. 2. 2003, str. 30), zadnjič spremenjene z Uredbo 596/2009/ES.
81. člen
(oglaševanje nerutinsko pripravljenega zdravila za napredno zdravljenje)
Oglaševanje nerutinsko pripravljenega zdravila za napredno zdravljenje, priprave nerutinsko pripravljenega zdravila za napredno zdravljenje ali zdravljenja z nerutinsko pripravljenim zdravilom za napredno zdravljenje ni dovoljeno.
82. člen
(farmakovigilanca nerutinsko pripravljenega zdravila za napredno zdravljenje)
(1) Imetnik dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje ima vzpostavljen sistem farmakovigilance, ki zagotavlja zbiranje in vodenje dokumentacije o vseh domnevnih neželenih učinkih nerutinsko pripravljenega zdravila za napredno zdravljenje, na katere ga opozorijo zdravniki in pacienti oziroma veterinarji ali lastniki oziroma skrbniki živali, znanstveno vrednotenje vseh podatkov, spremljanje varnosti oziroma razmerja med koristjo in tveganjem zdravila, ugotavljanje sprememb razmerja med koristjo in tveganjem, proučevanje možnosti za zmanjšanje in preprečevanje tveganj, za obveščanje JAZMP o ugotovljenih novih ali spremenjenih tveganjih ter spremembah razmerja med koristjo in tveganjem ter za ustrezno ukrepanje.
(2) Imetnik dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje ima stalno na voljo pogodbeno vezano usposobljeno osebo, odgovorno za farmakovigilanco, ki je odgovorna za vzpostavitev in delovanje sistema farmakovigilance.
(3) Oseba, odgovorna za farmakovigilanco, ima izobrazbo medicinske oziroma veterinarske smeri druge stopnje oziroma raven izobrazbe, ki v skladu z zakonom ustreza tej stopnji znanja s področja farmakovigilance. Če odgovorna oseba za farmakovigilanco nima izobrazbe medicinske oziroma veterinarske smeri druge stopnje oziroma raven izobrazbe, ki v skladu z zakonom ustreza tej stopnji, mora imeti stalno in neprekinjeno možnost pridobitve strokovne podpore osebe, ki ima tako izobrazbo.
(4) Imetnik dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje na pisno zahtevo JAZMP predloži načrt za obvladovanje tveganj na področju farmakovigilance z opisom aktivnosti v sistemu farmakovigilance in ukrepov za prepoznavanje, opredelitev, preprečevanje ali zmanjševanje tveganj v zvezi z nerutinsko pripravljenim zdravilom za napredno zdravljenje, vključno z oceno učinkovitosti navedenih aktivnosti in ukrepov.
(5) Imetnik dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje o vseh domnevnih neželenih učinkih nerutinsko pripravljenega zdravila za napredno zdravljenje, na katere ga opozorijo zdravniki in pacienti oziroma veterinarji, lastniki ali skrbniki živali, takoj, najpozneje pa v 15 dneh od ugotovitve, obvesti JAZMP.
(6) Zdravnik oziroma veterinar o vseh domnevnih neželenih učinkih nerutinsko pripravljenega zdravila za napredno zdravljenje takoj, najpozneje pa v 15 dneh od ugotovitve, obvesti JAZMP.
(7) Pacienti oziroma lastniki ali skrbniki živali lahko poročajo o domnevnih neželenih učinkih nerutinsko pripravljenega zdravila za napredno zdravljenje zdravniku oziroma veterinarju ali neposredno JAZMP.
83. člen
(postopek za izdajo dovoljenja za pripravo nerutinsko pripravljenih zdravil za napredno zdravljenje)
(1) Poslovni subjekt s sedežem v Republiki Sloveniji lahko pripravlja nerutinsko pripravljena zdravila za napredno zdravljenje le na podlagi in v skladu z dovoljenjem JAZMP za pripravo nerutinsko pripravljenih zdravil za napredno zdravljenje.
(2) Postopek za izdajo dovoljenja za pripravo nerutinsko pripravljenih zdravil za napredno zdravljenje se začne z vlogo predlagatelja, ki je poslovni subjekt s sedežem v Republiki Sloveniji, za pripravo posamezne vrste nerutinsko pripravljenih zdravil za napredno zdravljenje, in sicer ločeno za zdravila za gensko zdravljenje, zdravila za somatsko celično zdravljenje in izdelke tkivnega inženirstva z navedbo posameznih zdravil v skupini.
(3) JAZMP izda oziroma zavrne izdajo dovoljenja za pripravo nerutinsko pripravljenih zdravil za napredno zdravljenje v 180 dneh od dneva prejema popolne vloge na podlagi mnenja strokovne komisije za ugotavljanje izpolnjevanja pogojev za opravljanje dejavnosti priprave nerutinsko pripravljenih zdravil za napredno zdravljenje, in če je to potrebno, zunanjih neodvisnih strokovnjakov s področja genskega zdravljenja, celičnega zdravljenja ali tkivnega inženirstva, o izpolnjevanju pogojev, določenih s tem zakonom.
(4) JAZMP lahko zahteva dodatno dokumentacijo oziroma podatke, ki so potrebni za odločitev o izdaji dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje, v skladu s šestim odstavkom 3. člena tega zakona.
84. člen
(vloga za izdajo dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje)
(1) Vloga za pridobitev dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje vsebuje:
– dokazila o izpolnjevanju pogojev glede zagotavljanja sistema kakovosti, osebja, prostorov, opreme, sledljivosti in sistema farmakovigilance,
– seznam nerutinsko pripravljenih zdravil za napredno zdravljenje iz skupine zdravil za napredno zdravljenje, na katera se vloga nanaša,
– opis postopkov priprave skupin nerutinsko pripravljenih zdravil, ki vsebuje podatke o dejavnikih tveganja, kot so podatki o izvoru in lastnostih celic, vrsti manipulacije celic in načinu uporabe,
– pozitivno mnenje KME za zadevno skupino zdravil za napredno zdravljenje za uporabo v humani medicini, na katero se vloga nanaša.
(2) Podrobnejšo vsebino vloge, zahteve glede opisa postopkov priprave za zadevno skupino nerutinsko pripravljenih zdravil za napredno zdravljenje, način ugotavljanja izpolnjevanja pogojev za pridobitev dovoljenja in vsebino zahtevane dokumentacije določi minister.
85. člen
(spremembe pogojev za pripravo nerutinsko pripravljenih zdravil za napredno zdravljenje)
(1) Imetnik dovoljenja za pripravo nerutinsko pripravljenih zdravil za napredno zdravljenje najpozneje v 15 dneh od dneva nastanka spremembe pogojev JAZMP obvesti o spremembah, ki vplivajo na izdajo dovoljenja za pripravo nerutinsko pripravljenih zdravil za napredno zdravljenje.
(2) JAZMP obravnava vlogo za spremembo iz prejšnjega odstavka in odloči o potrebnih postopkih. JAZMP odloči v 30 dneh od prejema popolne vloge. Če je potrebno preverjanje pogojev z ogledom ali pridobitev mnenja strokovne komisije za ugotavljanje izpolnjevanja pogojev za opravljanje dejavnosti priprave nerutinsko pripravljenih zdravil za napredno zdravljenje ali dodatnega mnenja zunanjega strokovnjaka iz tretjega odstavka 83. člena tega zakona, JAZMP izda odločbo v 180 dneh od dneva prejema popolne vloge.
(3) Podrobnejšo vsebino vloge za spremembo pogojev, na podlagi katerih je bilo izdano dovoljenje iz 83. člena tega zakona, natančnejše pogoje in način ugotavljanja izpolnjevanja pogojev, določi minister.
86. člen
(odvzem dovoljenja za pripravo nerutinsko pripravljenih zdravil za napredno zdravljenje)
(1) Dovoljenje za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje se začasno odvzame ali odvzame, če farmacevtski inšpektor ugotovi, da poslovni subjekt, ki mu je bilo dovoljenje izdano, ne izpolnjuje pogojev iz 72. člena tega zakona in predpisov, sprejetih na njegovi podlagi, ter odredi prepoved opravljanja dejavnosti.
(2) Če po vpogledu v Poslovni register Slovenije ugotovi, da je bil poslovni subjekt, ki mu je bilo dovoljenje izdano, izbrisan iz tega registra, JAZMP po uradni dolžnosti ugotovi, da je dovoljenje za pripravo nerutinsko pripravljenih zdravil za napredno zdravljenje prenehalo veljati.
(3) Dovoljenje za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje se lahko odvzame tudi na predlog imetnika dovoljenja za pripravo nerutinsko pripravljenih zdravil za napredno zdravljenje.
VI. OZNAČEVANJE IN NAVODILO ZA UPORABO
87. člen
(označevanje in navodilo za uporabo)
(1) Zdravila, ki se dajejo v promet na podlagi prvega ali drugega odstavka 20. člena tega zakona in za zdravila iz druge, tretje ali četrte alineje tretjega odstavka 20. člena tega zakona, ki so namenjena za izdajo v lekarnah ali v specializiranih prodajalnah, morajo biti označena v slovenskem jeziku na zunanji ali na stični ovojnini, če zunanje ovojnine ni, najmanj s podatki o zdravilu, imetniku dovoljenja za promet z zdravilom, načinu izdaje, načinu uporabe zdravila, potrebnimi opozorili, rokom uporabnosti ter drugimi podatki za zagotavljanje sledljivosti in varne uporabe zdravila. Podatki morajo biti čitljivi, razumljivi in neizbrisljivi.
(2) Določbe prejšnjega odstavka se ne uporabljajo za zdravila z dovoljenjem za sočutno uporabo.
(3) Zdravilo, ki se daje v promet, mora imeti priloženo navodilo za uporabo v slovenskem jeziku, ki je v skladu s povzetkom glavnih značilnosti zdravila, razen če so vsi podatki v skladu s predpisom iz sedmega odstavka tega člena navedeni na zunanji ovojnini ali če zunanje ovojnine ni, na stični ovojnini zdravila. Zagotovljeni morata biti čitljivost in primerna razumljivost za končnega uporabnika.
(4) Podatki o označevanju in navodilu za uporabo zdravila iz prvega in drugega odstavka tega člena so poleg v slovenskem jeziku lahko navedeni tudi v enem ali več tujih jezikih, ob zagotovljeni berljivosti podatkov v slovenskem jeziku.
(5) Ne glede na določbe prvega in drugega odstavka tega člena lahko JAZMP ob upoštevanju ukrepov, ki so potrebni za varovanje javnega zdravja, izjemoma dovoli:
– uporabo ovojnine v tujem jeziku z nalepko v slovenskem jeziku in navodila za uporabo v tujem jeziku, če je navodilo za uporabo v slovenskem jeziku zdravilu dodano na predpisan način v natisnjeni obliki in je lahko dostopno tudi v elektronski obliki za zdravila, za katera ugotovi, da so nujno potrebna za varovanje javnega zdravja in da bi bila zaradi omejenega obsega njihove uporabe zahteva za proizvodnjo zdravila z označevanjem in navodilom za uporabo v slovenskem jeziku nesorazmerna;
– celotno ali delno izjemo od določb prvega in drugega odstavka tega člena pri zdravilih, ki niso namenjena neposredni izdaji pacientom v lekarnah, ali za zdravila, pri katerih obstajajo resne težave v zvezi z dostopnostjo.
(6) Ime zdravila za uporabo v humani medicini mora biti na ovojnini izpisano tudi v Braillovi pisavi. Imetnik dovoljenja za promet z zdravilom zagotovi, da je na predlog organizacij pacientov navodilo za uporabo na voljo v oblikah, ki so primerne za slepe in slabovidne.
(7) Podrobnejši način označevanja zdravil, obliko ter vsebino navodila za uporabo in način uporabe nalepk, posebne pogoje za označevanje in navodilo za uporabo za posamezna zdravila ali skupine zdravil določi minister.
88. člen
(zaščitni element)
(1) Poleg obveznosti iz prejšnjega člena proizvajalec zdravil za uporabo v humani medicini pritrdi zaščitni element na zdravilo, ki omogoča preverjanje avtentičnosti zdravila in identifikacijo posameznega pakiranja.
(2) Proizvajalec pritrdi zaščitni element na zdravila, za izdajo katerih je potreben zdravniški recept, z izjemo tistih, ki so bila uvrščena na seznam, ki ga objavi Evropska komisija in so lahko v prometu brez zaščitnega elementa, ter na zdravila, za izdajo katerih ni potreben zdravniški recept in jih Evropska komisija opredeli kot tista, za katera se zaščitni elementi zahtevajo.
(3) Poleg zaščitnega elementa proizvajalec zagotovi tudi pripomoček za odkrivanje posega v zunanjo ovojnino.
(4) Zaščitnega elementa ni treba pritrditi na radiofarmacevtske izdelke.
(5) Zaščitni element na zdravilu lahko imetnik dovoljenja za proizvodnjo zdravil delno ali popolnoma odstrani ali prekrije, če:
– je pred tem ugotovil avtentičnost zdravila in ugotovil, da ni bilo posega v ovojnino;
– odstranjene ali prekrite zaščitne elemente nadomesti z novimi, ki so enakovredni glede možnosti preverjanja avtentičnosti, identifikacije in intaktnosti. Nadomestitev izvede brez odpiranja stične ovojnine;
– nadomestitev zaščitnih elementov izvede v skladu z dobro proizvodno prakso za zdravila.
(6) Značilnosti in specifikacije zaščitnih elementov ter pripomočke za odkrivanje posega v zunanjo ovojnino določi Evropska komisija.
89. člen
(sporočilo Evropski komisiji)
JAZMP lahko sporoči Evropski komisiji svojo drugačno obrazloženo oceno o primernosti uvrstitve posameznih zdravil ali kategorij zdravil glede na obveznost namestitve zaščitnih elementov.
VII. PROIZVODNJA ZDRAVIL, UČINKOVIN IN DOLOČENIH POMOŽNIH SNOVI
1. Zdravila
90. člen
(dovoljenje za proizvodnjo zdravil)
(1) Poslovni subjekt lahko proizvaja zdravila le na podlagi in v skladu z dovoljenjem za proizvodnjo zdravil. Dovoljenje vključuje proizvodnjo zdravil in njihovo prodajo poslovnim subjektom iz prve alineje drugega, iz tretjega in četrtega odstavka 104. člena tega zakona in ga je treba pridobiti za:
– posamezno mesto proizvodnje,
– posamezne aktivnosti proizvodnje,
– posamezne farmacevtske oblike in
– uvoz zdravil iz tretjih držav.
(2) Določbe prejšnjega odstavka veljajo tudi za proizvodnjo zdravil, ki so namenjena le za iznos, izvoz ali klinična preskušanja zdravil.
(3) Aktivnosti proizvodnje zdravil in farmacevtske oblike so določene z Zbirko postopkov Evropske unije, ki jo na svojih spletnih straneh objavi Evropska komisija (Compilation of Community Procedures on Inspection and exchange of Information (v nadaljnjem besedilu: Zbirka postopkov Evropske unije), v njenem vsakokrat veljavnem besedilu.
91. člen
(pogoji za proizvodnjo zdravil)
Proizvajalec zdravil izpolnjuje naslednje pogoje:
1. glede na obseg in zahtevnost proizvodnje zdravil ima zaposleno ustrezno število strokovnjakov z izobrazbo druge stopnje oziroma ravnijo izobrazbe, ki v skladu z zakonom ustreza tej stopnji s področja farmacije, kemije, kemijske tehnologije, medicine, stomatologije, veterinarske medicine in drugih ustreznih strok z ustreznimi znanji glede na predmet poslovanja,
2. ima s pogodbo zavezano odgovorno osebo, ki je usposobljena za sproščanje posamezne serije zdravila v promet in je stalno dosegljiva. V primeru kapitalsko povezanih družb je ta oseba lahko pogodbeno zavezana pri eni od njih, če je razmejitev odgovornosti in pristojnosti posameznih enot pravno in organizacijsko urejena,
3. razpolaga z ustreznimi prostori, napravami in opremo za proizvodnjo, kontrolo, shranjevanje in odpremo zdravil v skladu s smernicami in načeli dobre proizvodne prakse za zdravila,
4. proizvodnjo zdravil opravlja v skladu s smernicami in načeli dobre proizvodne prakse za zdravila in uporablja učinkovine, ki so bile proizvedene v skladu s smernicami dobre proizvodne prakse za učinkovine, katerih promet je potekal v skladu z dobro distribucijsko prakso za učinkovine,
5. odgovorni osebi iz 2. točke tega člena omogoča samostojno opravljanje njenih nalog, za katera ima na voljo vsa potrebna sredstva.
92. člen
(odgovorna oseba za sproščanje posameznih serij zdravil)
(1) Odgovorna oseba za sproščanje posameznih serij zdravil iz 2. točke prejšnjega člena ima izobrazbo druge stopnje oziroma raven izobrazbe, ki v skladu z zakonom ustreza tej stopnji na področju farmacije, medicine, veterinarske medicine, kemije, farmacevtske kemije, tehnologije ali biologije.
(2) Program pridobljene izobrazbe iz prejšnjega odstavka obsega znanja iz uporabne fizike, splošne kemije, anorganske kemije, organske kemije, analizne kemije, farmacevtske kemije, vključno z analizo zdravil, splošne in uporabne medicinske biokemije, fiziologije, mikrobiologije, farmakologije, farmacevtske tehnologije, toksikologije in farmakognozije.
(3) Če program študija ne vsebuje katerega od navedenih znanj iz prejšnjega odstavka, o njih odgovorna oseba predloži ustrezna dokazila o opravljenem dodatnem izobraževanju.
(4) Odgovorna oseba ima poleg zahtevane izobrazbe iz tega člena tudi delovne izkušnje pri proizvajalcih zdravil, ki imajo dovoljenje za proizvodnjo zdravil, od tega najmanj dve leti praktičnih izkušenj na področju analize kakovosti zdravil, količinske analize učinkovin ter preskušanja in preverjanja za potrebe zagotavljanja kakovosti zdravil. Obdobje zahtevanih praktičnih izkušenj se lahko skrajša za eno leto, če program študija iz drugega odstavka tega člena traja najmanj pet let, ali za leto in pol, če ta program traja najmanj šest let.
93. člen
(obveznosti proizvajalcev zdravil)
Proizvajalec zdravil:
1. ima na voljo in v promet lahko daje samo zdravila, proizvedena v skladu z dovoljenjem za promet z zdravili in dovoljenjem za proizvodnjo zdravil,
2. preveri skladnost proizvajalcev in dobaviteljev učinkovin z dobro proizvodno prakso za učinkovine oziroma dobro distribucijsko prakso za učinkovine oziroma z obojim z opravljanjem presoj,
3. zagotovi, da so pomožne snovi primerne za uporabo v zdravilih, na podlagi dokumentirane ocene tveganja v skladu s smernicami Evropske komisije, ki določajo dobro proizvodno prakso za pomožne snovi,
4. preveri in zagotovi, da so proizvajalci, uvozniki ali dobavitelji, od katerih je pridobil učinkovine, vpisani v registre pri organu, pristojnem za zdravila države članice Evropske unije, v kateri imajo sedež,
5. če pridobi informacije, da so na trgu zdravila, ki sicer sodijo v okvir njegovega dovoljenja za proizvodnjo zdravil, ponarejena, ali obstaja sum, da so ponarejena, o tem nemudoma obvesti JAZMP in imetnika dovoljenja za promet z zdravilom, ne glede na to ali so bili ponaredki v prometu prek nezakonite ali zakonite dobavne verige,
6. zagotovi avtentičnost in kakovost učinkovin in pomožnih snovi, ki jih uporabi,
7. zagotovi, da so pri zdravilih, namenjenih za dajanje v promet v Evropski uniji, zaščitni elementi iz 88. člena tega zakona pritrjeni na zunanji ovojnini in
8. če zaščitne elemente na zdravilu delno ali popolnoma odstrani ali prekrije, zagotovi, da so te aktivnosti izvedene v skladu s petim odstavkom 88. člena tega zakona.
94. člen
(postopek za pridobitev dovoljenja za proizvodnjo zdravil)
(1) Postopek za izdajo dovoljenja za proizvodnjo zdravil se začne na podlagi vloge poslovnega subjekta s sedežem v Republiki Sloveniji. Vloga za pridobitev dovoljenja za proizvodnjo zdravil vsebuje dokazila o izpolnjevanju pogojev iz 91. člena tega zakona.
(2) JAZMP izda oziroma zavrne izdajo dovoljenja za proizvodnjo zdravil v 90 dneh od dneva prejema popolne vloge na podlagi mnenja strokovne komisije za ugotavljanje izpolnjevanja pogojev za opravljanje proizvodnje zdravil.
(3) Dovoljenje iz prejšnjega odstavka se lahko izda za določen čas ali pogojno.
(4) JAZMP lahko zahteva dodatno dokumentacijo oziroma podatke, ki so potrebni za odločitev o izdaji dovoljenja za proizvodnjo zdravil, v skladu s šestimi odstavkom 3. člena tega zakona.
(5) Dokumentacija iz vloge za pridobitev dovoljenja za proizvodnjo zdravil je poslovna skrivnost, če jo v skladu s predpisi kot tako opredeli predlagatelj.
(6) Podrobnejšo vsebino vloge, pogoje in način ugotavljanja izpolnjevanja pogojev za pridobitev dovoljenja za proizvodnjo zdravil, obliko in vsebino zahtevane dokumentacije in dovoljenja ter poimenovanje aktivnosti proizvodnje določi minister.
95. člen
(potrdilo o dobri proizvodni praksi)
(1) Potrdilo o dobri proizvodni praksi izda farmacevtski inšpektor pregledanemu poslovnemu subjektu po uradni dolžnosti najpozneje v 90 dneh od dneva pregleda, če se izkaže, da poslovni subjekt izvaja proizvodnjo zdravil v skladu z načeli in smernicami dobre proizvodne prakse za zdravila ali za učinkovine, oziroma najpozneje 15 dni po izdaji ali spremembi dovoljenja za proizvodnjo zdravil ali vpisa oziroma spremembe vpisa v register proizvajalcev učinkovin.
(2) Po uradni dolžnosti farmacevtski inšpektor lahko z odločbo razveljavi potrdilo o dobri proizvodni praksi, če se ob inšpekcijskem pregledu izkaže, da imetnik dovoljenja za proizvodnjo zdravil oziroma poslovni subjekt, ki je vpisan v register proizvajalcev učinkovin, ne izvaja dejavnosti v skladu z načeli in smernicami dobre proizvodne prakse za zdravila oziroma za učinkovine.
(3) Potrdilo o dobri proizvodni praksi se izda na obrazcu v slovenskem in angleškem jeziku, določenim z Zbirko postopkov Evropske unije.
(4) Podrobnejši postopek izdaje in preklica potrdila o dobri proizvodni praksi določi minister.
96. člen
(spremembe pogojev za proizvodnjo zdravil)
(1) Imetnik dovoljenja za proizvodnjo zdravil vsako spremembo pogojev iz 91. člena tega zakona, na podlagi katerih je bilo izdano dovoljenje za proizvodnjo zdravil, sporoči JAZMP najpozneje v 15 dneh od nastanka spremembe.
(2) JAZMP obravnava vlogo za spremembo pogojev iz prejšnjega odstavka in odloči v 30 dneh od dneva prejema popolne vloge, razen kadar je potrebno preverjanje pogojev z ogledom, ko izda dovoljenje v 90 dneh od prejema popolne vloge.
(3) Podrobnejšo vsebino vloge za spremembo pogojev, na podlagi katerih je bilo izdano dovoljenje za proizvodnjo zdravil, natančnejše pogoje in način ugotavljanja izpolnjevanja pogojev za izdajo dovoljenja ali sklepa o oceni skladnosti in spremembe pogojev za opravljanje proizvodnje zdravil, določi minister.
97. člen
(odvzem dovoljenja za proizvodnjo zdravil)
(1) Dovoljenje za proizvodnjo zdravil se začasno odvzame ali odvzame, če farmacevtski inšpektor ugotovi, da proizvajalec zdravil ne izpolnjuje pogojev iz 91. člena tega zakona in predpisov, sprejetih na njegovi podlagi ter odredi prepoved opravljanja proizvodnje zdravil.
(2) Dovoljenje se odvzame tudi na predlog imetnika dovoljenja za proizvodnjo zdravil.
(3) Če JAZMP po vpogledu v Poslovni register Slovenije ugotovi, da je bil poslovni subjekt, ki mu je bilo izdano dovoljenje za proizvodnjo zdravil, izbrisan iz tega registra, po uradni dolžnosti ugotovi, da je dovoljenje prenehalo veljati.
98. člen
(ocena ustreznosti obvladovanja tveganj pri proizvodnji zdravil)
JAZMP lahko na predlog imetnika dovoljenja za proizvodnjo zdravil izda oceno ustreznosti obvladovanja tveganj pri uvedbi zdravil, ki vključujejo nove skupine specialnih snovi, v skladu z Zbirko postopkov Evropske unije v proces proizvodnje.
99. člen
(register odgovornih oseb za sproščanje zdravil)
(1) JAZMP vodi javno dostopen register odgovornih oseb za sproščanje posameznih serij zdravil, ki vsebuje odgovorne osebe za sproščanje posameznih serij zdravil, ki izpolnjujejo pogoje iz 92. člena tega zakona.
(2) Register odgovornih oseb za sproščanje posameznih serij zdravil vsebuje naslednje podatke:
– ime in priimek ter strokovni naziv odgovorne osebe za sproščanje posameznih serij zdravil,
– ime, naslov poslovnega subjekta, pri katerem opravlja naloge odgovorne osebe za sproščanje posameznih serij zdravil in
– ime in naslov mesta proizvodnje, na katerem opravlja naloge odgovorne osebe za sproščanje posameznih serij zdravil.
(3) Vlogo za vpis, spremembo in izbris iz registra iz prvega odstavka tega člena lahko dajo predlagatelji za pridobitev dovoljenja za proizvodnjo zdravil in imetniki dovoljenja za proizvodnjo zdravil v Republiki Sloveniji.
(4) JAZMP vpiše, spremeni oziroma izbriše odgovorno osebo za sproščanje posameznih serij zdravil iz registra iz prvega odstavka tega člena v osmih dneh po prejemu popolne vloge in na zahtevo predlagatelja o tem izda potrdilo.
(5) JAZMP iz registra iz prvega odstavka tega člena izbriše odgovorno osebo za sproščanje posameznih serij zdravil na predlog predlagatelja za vpis v register, kadar JAZMP odvzame dovoljenje za proizvodnjo zdravil in če je imetnik dovoljenja za proizvodnjo zdravil izbrisan iz Poslovnega registra Slovenije.
(6) Podrobnejšo vsebino vloge za vpis, spremembo oziroma izbris iz registra odgovornih oseb za sproščanje posameznih serij zdravil, natančnejše pogoje in način ugotavljanja izpolnjevanja pogojev za vpis, spremembo oziroma izbris iz registra, določi minister.
2. Učinkovine
100. člen
(pogoji za proizvodnjo učinkovin)
(1) Proizvajalec učinkovin izpolnjuje naslednje pogoje:
1. glede na obseg in zahtevnost proizvodnje učinkovin ima zaposleno ustrezno število strokovnjakov z ustrezno izobrazbo,
2. razpolaga z ustreznimi prostori, napravami in ustrezno opremo za proizvodnjo, kontrolo, shranjevanje in transport učinkovin v skladu s smernicami in načeli dobre proizvodne prakse za učinkovine in
3. dejavnost opravlja v skladu s smernicami in načeli dobre proizvodne prakse za učinkovine.
(2) Proizvajalec učinkovin o ponaredkih učinkovin ali sumu nanje takoj, ko o tem izve, obvesti JAZMP in imetnika dovoljenja za promet z zdravilom.
101. člen
(postopek vpisa v register proizvajalcev učinkovin)
(1) Proizvajalec učinkovin s sedežem v Republiki Sloveniji, lahko začne opravljati svojo dejavnost po vpisu v register proizvajalcev učinkovin, ki ga vodi JAZMP.
(2) Register proizvajalcev učinkovin vsebuje naslednje podatke:
– ime poslovnega subjekta in stalni naslov ter kontaktne podatke (telefon, faks, e-pošta) in
– učinkovine, ki jih proizvaja.
(3) JAZMP ob vpisu v register iz prvega odstavka tega člena izda potrdilo.
(4) Proizvajalci učinkovin priglasijo svojo dejavnost pri JAZMP najmanj 60 dni pred začetkom opravljanja dejavnosti s pisno vlogo, ki vsebuje dokazila o izpolnjevanju pogojev iz prvega odstavka prejšnjega člena in seznam učinkovin, ki jih nameravajo proizvajati.
(5) JAZMP vpiše proizvajalca učinkovin v register proizvajalcev učinkovin na podlagi pozitivnega mnenja strokovne komisije za izpolnjevanje pogojev proizvodnje učinkovin v 90 dneh oziroma v 60 dneh od dneva prejema popolne vloge, če oceni, da preverjanje izpolnjevanja pogojev ni potrebno.
(6) Če strokovna komisija iz prejšnjega odstavka izda negativno mnenje o izpolnjevanju pogojev za opravljanje proizvodnje učinkovin, JAZMP zavrne vpis v register proizvajalcev učinkovin in o tem izda odločbo.
(7) JAZMP lahko zahteva dodatno dokumentacijo oziroma podatke, ki so potrebni za odločitev o vpisu v register proizvajalcev učinkovin, v skladu s šestim odstavkom 3. člena tega zakona.
(8) JAZMP lahko proizvajalca učinkovin izbriše iz registra proizvajalcev učinkovin, če farmacevtski inšpektor ugotovi, da proizvajalec učinkovin ne izpolnjuje pogojev iz prejšnjega člena in predpisov, sprejetih na njegovi podlagi ter odredi prepoved proizvodnje učinkovin. JAZMP lahko proizvajalca učinkovin izbriše iz registra proizvajalcev učinkovin tudi na njegov predlog in če po vpogledu v Poslovni register Slovenije ugotovi, da je bil proizvajalec učinkovin izbrisan iz tega registra. JAZMP o izbrisu iz registra proizvajalcev učinkovin izda odločbo.
(9) Dokumentacija iz vloge za priglasitev v register proizvajalcev učinkovin, razen podatkov iz drugega odstavka tega člena, je poslovna skrivnost, če jo v skladu s predpisi tako opredeli predlagatelj.
(10) JAZMP objavlja seznam proizvajalcev učinkovin, vpisanih v register proizvajalcev učinkovin na svoji spletni strani, ki vsebuje ime poslovnega subjekta in njegov stalni naslov.
(11) Podrobnejšo vsebino vloge, natančnejše pogoje, način in postopke za priglasitev in izbris iz registra proizvajalcev učinkovin ter natančnejšo vsebino registra proizvajalcev učinkovin določi minister.
102. člen
(spremembe pogojev za proizvodnjo učinkovin)
(1) Proizvajalec učinkovin vsako spremembo pogojev iz 100. člena tega zakona, ki pomembno vpliva na kakovost ali varnost učinkovine, ki jo proizvaja, najpozneje v sedmih dneh sporoči JAZMP.
(2) JAZMP vpiše spremembo iz prejšnjega odstavka v register proizvajalcev učinkovin na podlagi mnenja strokovne komisije za ugotavljanje izpolnjevanja pogojev za opravljanje proizvodnje učinkovin v 90 dneh in o tem izda potrdilo, oziroma vpiše spremembo iz prejšnjega odstavka v register proizvajalcev učinkovin v 30 dneh od dneva prejema popolne vloge, če oceni, da preverjanje izpolnjevanja pogojev ni potrebno in o tem izda potrdilo.
(3) Če se sprememba iz prvega odstavka tega člena ne nanaša na podatke iz registra proizvajalcev učinkovin, JAZMP izda odločbo o oceni izpolnjevanja pogojev za opravljanje proizvodnje učinkovin v 30 dneh oziroma v 90 dneh od dneva prejema popolne vloge, če oceni, da je potrebno preverjanje izpolnjevanja teh pogojev.
(4) Če strokovna komisija iz drugega odstavka tega člena izda negativno mnenje o spremembi izpolnjevanja pogojev za opravljanje proizvodnje učinkovin, JAZMP spremembe ne vpiše v register proizvajalcev učinkovin in o tem izda odločbo.
(5) Ne glede na prvi odstavek tega člena proizvajalec učinkovin druge spremembe pogojev, ki so bili podlaga za vpis v register proizvajalcev učinkovin, prijavi letno v poročilu, ki ga JAZMP posreduje najpozneje do 15. decembra tekočega leta, in sicer za vse spremembe v tekočem letu. JAZMP v 30 dneh od dneva prejema popolnega poročila vpiše spremembe, če gre za spremembo podatkov registra proizvajalcev in o tem izda potrdilo.
(6) Podrobnejšo vsebino vloge za priglasitev sprememb pogojev in vsebino letnega poročila sprememb ter natančnejši postopek in način vpisa spremembe v register proizvajalcev učinkovin in izdaje odločbe o oceni izpolnjevanja pogojev za opravljanje proizvodnje učinkovin, določi minister.
3. Pomožne snovi
103. člen
(proizvajalci pomožnih snovi)
Poslovni subjekti, ki proizvajajo pomožne snovi, opravljajo proizvodnjo v skladu s smernicami in načeli dobre proizvodne prakse za pomožne snovi, ki jih sprejme in objavi Evropska komisija.
VIII. PROMET Z ZDRAVILI IN UČINKOVINAMI NA DEBELO
1. Zdravila
104. člen
(promet z zdravili na debelo)
(1) Poslovni subjekt, ki ima dovoljenje za promet z zdravili na debelo, je veletrgovec z zdravili, ki lahko kupuje zdravila le pri poslovnih subjektih, ki imajo dovoljenje za proizvodnjo zdravil ali dovoljenje za promet z zdravili na debelo.
(2) Veletrgovci z zdravili lahko prodajajo zdravila le poslovnim subjektom, ki opravljajo:
– dejavnosti prometa z zdravili na debelo,
– dejavnosti prometa z zdravili na drobno.
(3) Ne glede na prejšnji odstavek lahko veletrgovci z zdravili prodajajo zdravila neposredno izvajalcem zdravstvene dejavnosti, socialnovarstvenim zavodom in Slovenski vojski, če imajo ti v svoji sestavi organizirane lekarne ali imajo vzpostavljen sistem za sprejem, shranjevanje in sledljivost zdravil ter za to določeno odgovorno osebo, ki ima izobrazbo farmacevtske smeri druge stopnje oziroma raven izobrazbe, ki v skladu z zakonom ustreza tej stopnji.
(4) Ne glede na drugi odstavek tega člena lahko veletrgovci z zdravili prodajajo zdravila tudi veterinarskim in drugim organizacijam, ki po predpisih o veterinarstvu opravljajo veterinarsko dejavnost, in odobrenim proizvajalcem zdravilne krmne mešanice v skladu s predpisi in v obsegu, ki ga določa njihovo dovoljenje za opravljanje dejavnosti.
(5) Zdravila iz tretjega odstavka tega člena se lahko uporabljajo le za izvajanje zdravstvene dejavnosti oziroma za podporo zdravstvene oskrbe v socialnovarstvenih zavodih in Slovenski vojski, zdravila iz prejšnjega odstavka pa za izvajanje veterinarske dejavnosti.
(6) Podrobnejše pogoje za odgovorno osebo, sprejem, shranjevanje in sledljivost zdravil in postopek ugotavljanja izpolnjevanja pogojev iz tretjega odstavka tega člena določi minister.
105. člen
(pogoji za veletrgovce z zdravili)
(1) Promet z zdravili na debelo lahko opravljajo poslovni subjekti, ki imajo dovoljenje JAZMP za opravljanje te dejavnosti, če izpolnjujejo naslednje pogoje:
1. imajo obsegu dejavnosti primerno število s pogodbo zavezanih strokovnjakov, ki imajo izobrazbo farmacevtske smeri druge stopnje oziroma raven izobrazbe, ki v skladu z zakonom ustreza tej stopnji, po potrebi pa tudi strokovnjake drugih ustreznih smeri,
2. med strokovnjaki iz prejšnje točke določijo odgovorno osebo za sprejem, shranjevanje, izdajo in transport zdravil ter pregled dokumentacije, ki omogoča sledljivost zdravil. Odgovorna oseba ima izobrazbo farmacevtske smeri druge stopnje oziroma raven izobrazbe, ki v skladu z zakonom ustreza tej stopnji,
3. razpolagajo z ustreznimi prostori in potrebno opremo glede na vrsto zdravil, s katerimi opravljajo promet na debelo,
4. vodijo ustrezno dokumentacijo na način, ki omogoča takojšnji umik zdravila iz prometa in reševanje reklamacij,
5. organizirajo delo v skladu z načeli dobre distribucijske prakse in
6. imajo vzpostavljen sistem zagotavljanja kakovosti poslovanja, ki določa odgovornosti, postopke in ukrepe obvladovanja tveganja v zvezi z njihovimi dejavnostmi.
(2) Če odgovorna oseba iz 2. točke prvega odstavka tega člena nima izobrazbe farmacevtske smeri druge stopnje oziroma raven izobrazbe, ki v skladu z zakonom ustreza tej stopnji, mora imeti dodatna znanja iz uporabne fizike, splošne in anorganske kemije, organske kemije, analizne kemije, farmacevtske kemije, vključno z analizo zdravil, splošne in uporabne medicinske biokemije, fiziologije, mikrobiologije, farmakologije, farmacevtske tehnologije, toksikologije in farmakognozije. Če program študija ne vsebuje katerega od navedenih znanj, o njih odgovorna oseba predloži ustrezna dokazila.
(3) Veletrgovci z zdravili, ki so pridobili dovoljenje za promet z zdravili na debelo in imajo sedež v drugi državi članici Evropske unije ter nameravajo to dejavnost opravljati v Republiki Sloveniji, lahko začnejo opravljati promet z zdravili na debelo, ko se priglasijo pri JAZMP po postopku, ki ga določi minister.
(4) Podrobnejše pogoje za opravljanje prometa z zdravili na debelo, postopek ugotavljanja izpolnjevanja pogojev in postopek priglasitve veletrgovcev z zdravili iz prejšnjega odstavka ter obliko dovoljenja za promet z zdravili na debelo, določi minister.
106. člen
(obveznosti veletrgovcev z zdravili)
Veletrgovci z zdravili:
1. preverjajo, če ponudniki zdravil (proizvajalci, uvozniki, veletrgovci) svojo dejavnost opravljajo v skladu z načeli in smernicami dobrih distribucijskih praks in predpisi, ki urejajo zdravila države, v kateri imajo sedež ter imajo dovoljenje za proizvodnjo oziroma promet z zdravili na debelo,
2. preverjajo ali imajo poslovni subjekti, katerim prodajajo zdravila, dovoljenje za opravljanje prometa z zdravili na debelo ali na drobno oziroma dovoljenje za opravljanje lekarniške dejavnosti oziroma ali imajo poslovni subjekti iz tretjega odstavka 104. člena tega zakona preverjen sistem za sprejem, shranjevanje in sledljivost zdravil,
3. preverjajo zaščitne elemente na prejetem oziroma dobavljenem zdravilu in o ponaredkih ali sumu nanje takoj, ko o tem izvedo, obvestijo JAZMP in po potrebi imetnika dovoljenja za promet z zdravilom,
4. vodijo dokumentacijo za vsa zdravila v elektronski obliki, če te nima, pa v drugi obliki, in jo hranijo do pet let. Dokumentacija, ki jo izdajo ob prejetju ali odpremi zdravil, vsebuje najmanj naslednje podatke: datum, ime zdravila, nacionalni identifikator, datum prevzema ali izdana količina, ime in naslov dobavitelja ali prejemnika, za zdravila, ki nosijo zaščitni element, pa tudi številko serije zdravila in
5. upoštevajo dobro distribucijsko prakso, kadar izvajajo logistične funkcije transporta zdravila v okviru:
– izdaje zdravila v lekarnah ali specializiranih prodajalnah za zdravila končnim uporabnikom, ki so pacienti oziroma lastniki živali ali njihovi skrbniki, oziroma prodaje zdravila na drobno izvajalcu zdravstvene oziroma veterinarske dejavnosti, socialnovarstvenim zavodom in Slovenski vojski, ki nimajo sistema sprejema, shranjevanja in sledljivosti zdravil na podlagi sklenjene pogodbe z lekarno oziroma s specializirano prodajalno in
– prodaje zdravila, ki jo izvaja drug poslovni subjekt, izvajalcem zdravstvene dejavnosti iz tretjega odstavka 104. člena tega zakona na podlagi sklenjene pogodbe z zadevnim poslovnim subjektom, ki je lahko proizvajalec oziroma drug veletrgovec z zdravili.
107. člen
(izdaja dovoljenja za promet z zdravili na debelo)
(1) Postopek za izdajo dovoljenja za promet z zdravili na debelo se začne z vlogo poslovnega subjekta s sedežem v Republiki Sloveniji.
(2) JAZMP odloči o izdaji dovoljenja za promet z zdravili na debelo v 90 dneh po prejemu popolne vloge na podlagi mnenja strokovne komisije za ugotavljanje izpolnjevanja pogojev za promet z zdravili na debelo.
(3) JAZMP lahko izda dovoljenje za promet z zdravili na debelo:
– za poln obseg opravljanja dejavnosti prometa z zdravili na debelo, ki vsebuje opravljanje prometa na debelo z vsemi zdravili, ki so lahko v prometu na podlagi tega zakona vsem poslovnim subjektom iz drugega, tretjega in četrtega odstavka 104. člena tega zakona;
– za kontaktno omejen obseg opravljanja dejavnosti prometa z zdravili na debelo, ki vsebuje opravljanje prometa na debelo zdravil, ki so lahko v prometu na podlagi tega zakona, le drugim imetnikom dovoljenja za opravljanje prometa z zdravili na debelo ali
– za produktno omejen obseg opravljanja dejavnosti prometa z zdravili na debelo, ki vsebuje opravljanje prometa na debelo določenih zdravil, vsem poslovnim subjektom iz drugega, tretjega in četrtega odstavka 104. člena tega zakona;
– Zavodu Republike Slovenije za blagovne rezerve.
(4) Dovoljenje iz prejšnjega odstavka se lahko izda tudi za določen čas ali pogojno.
(5) Dovoljenje za promet z zdravili na debelo iz tretjega odstavka tega člena, se lahko začasno odvzame ali odvzame, če farmacevtski inšpektor ugotovi, da veletrgovec z zdravili ne izpolnjuje pogojev iz 105. člena tega zakona in odredi prepoved opravljanja prometa z zdravili na debelo.
(6) Aktivnosti prometa z zdravili na debelo so določene z Zbirko postopkov Evropske unije, v njenem vsakokrat veljavnemu besedilu.
(7) Dovoljenje za promet z zdravili na debelo se odvzame tudi na predlog imetnika dovoljenja za promet z zdravili na debelo ali če farmacevtski inšpektor na podlagi treh izrečenih prekrškov zaradi neizpolnjevanja obveznosti opravljanja storitev v javnem interesu iz 108. člena tega zakona, odredi prepoved opravljanja prometa z zdravili na debelo.
(8) Če JAZMP po vpogledu v Poslovni register Slovenije ugotovi, da je poslovni subjekt, ki mu je bilo izdano dovoljenje za promet z zdravili na debelo, izbrisan iz tega registra, po uradni dolžnosti ugotovi, da je dovoljenje za promet z zdravili na debelo prenehalo veljati.
108. člen
(obveznost opravljanja storitev v javnem interesu)
(1) Veletrgovec z zdravili, ki ima dovoljenje za poln obseg opravljanja dejavnosti prometa z zdravili na debelo, zagotavlja stalen in ustrezen nabor zdravil, ki so lahko v prometu v skladu z obveznostjo opravljanja storitev v javnem interesu, v ustrezno kratkem času, najpozneje v 24 urah med tednom oziroma najpozneje v 72 urah med vikendom in prazniki od prejetega naročila za zdravila iz prvega in drugega odstavka ter tretje alineje tretjega odstavka 20. člena tega zakona. Če izvajalec zdravstvene ali veterinarske dejavnosti ali lekarna potrebuje dostavo zdravil v krajših rokih od navedenih, to navede v naročilu veletrgovcu z zdravili na podlagi dokazljive zdravstvene potrebe ali zdravstvene dokumentacije.
(2) Veletrgovec z zdravili, ki ima dovoljenje za produktno omejeno opravljanje dejavnosti prometa z zdravili na debelo, zagotavlja stalen in ustrezen nabor zdravil iz dovoljenja JAZMP za opravljanje te dejavnosti, s katerim zadošča zahtevam nemotene preskrbe s temi zdravili v skladu z obveznostjo opravljanja storitev v javnem interesu v 24 urah med tednom oziroma najpozneje v 72 urah med vikendom in prazniki od prejetega naročila za zdravila iz prvega in drugega odstavka ter tretje alineje tretjega odstavka 20. člena tega zakona. Če izvajalec zdravstvene ali veterinarske dejavnosti ali lekarna potrebuje dostavo zdravil prej kot v navedenih rokih, to navede v naročilu veletrgovcu z zdravili na podlagi dokazljive zdravstvene potrebe ali zdravstvene dokumentacije.
109. člen
(potrdilo o dobri distribucijski praksi)
(1) Potrdilo o dobri distribucijski praksi izda farmacevtski inšpektor pregledanemu poslovnemu subjektu v 90 dneh od pregleda, če se izkaže, da poslovni subjekt opravlja promet z zdravili na debelo v skladu z načeli in smernicami dobre distribucijske prakse za zdravila ali za učinkovine oziroma najpozneje 15 dni po izdaji ali spremembi dovoljenja za promet z zdravili na debelo ali vpisa oziroma spremembe v register veletrgovcev z učinkovinami.
(2) Farmacevtski inšpektor lahko z odločbo razveljavi potrdilo dobre distribucijske prakse, če se ob inšpekcijskem pregledu izkaže, da imetnik dovoljenja za promet z zdravili na debelo oziroma poslovni subjekt, ki je vpisan v register veletrgovcev z učinkovinami, ne izvaja načel in smernic dobre distribucijske prakse za zdravila ali učinkovine.
(3) Potrdilo o dobri distribucijski praksi se izda na obrazcu v slovenskem in angleškem jeziku, določenim z Zbirko postopkov Evropske unije, v njenem vsakokrat veljavnem besedilu.
(4) Podrobnejši postopek izdaje ali preklica potrdila o dobri distribucijski praksi določi minister.
110. člen
(register odgovornih oseb za sprejem zdravil)
(1) JAZMP vodi javno dostopen register odgovornih oseb za sprejem, shranjevanje, izdajo in transport zdravil ter pregled dokumentacije, ki vsebuje odgovorne osebe, ki izpolnjujejo pogoje iz 105. člena tega zakona.
(2) Register odgovornih oseb za sprejem, shranjevanje, izdajo in transport zdravil ter pregled dokumentacije vsebuje naslednje podatke:
– ime in priimek ter strokovni naziv odgovorne osebe za sprejem, shranjevanje, izdajo in transport zdravil ter pregled dokumentacije in
– ime in naslov poslovnega subjekta, pri katerem opravljajo naloge odgovornih oseb za sprejem, shranjevanje, izdajo in transport zdravil ter pregled dokumentacije.
(3) JAZMP vpiše, spremeni oziroma izbriše odgovorno osebo za sprejem, shranjevanje, izdajo in transport zdravil ter pregled dokumentacije iz registra iz prvega odstavka tega člena v osmih dneh po prejemu popolne vloge in na zahtevo predlagatelja o tem izda potrdilo.
(4) Vlogo za vpis, spremembo in izbris iz registra iz prvega odstavka tega člena lahko da predlagatelj dovoljenja za promet z zdravili na debelo ali imetnik dovoljenja za promet z zdravili na debelo v Republiki Sloveniji.
(5) JAZMP iz registra iz prvega odstavka tega člena izbriše odgovorno osebo za sprejem, shranjevanje, izdajo in transport zdravil ter pregled dokumentacije na predlog predlagatelja za vpis v register iz prvega odstavka tega člena, če veletrgovcu z zdravili odvzame dovoljenje za promet z zdravili na debelo in če je veletrgovec z zdravili izbrisan iz Poslovnega registra Slovenije.
(6) Podrobnejšo vsebino vloge za vpis, spremembo oziroma izbris iz registra odgovornih oseb za sprejem, shranjevanje, izdajo in transport zdravil ter pregled dokumentacije, natančnejše pogoje in način ugotavljanja izpolnjevanja pogojev za vpis, spremembo oziroma izbris iz registra odgovornih oseb za sprejem, shranjevanje, izdajo in transport zdravil ter pregled dokumentacije, določi minister.
2. Učinkovine
111. člen
(promet z učinkovinami na debelo)
(1) Poslovni subjekt, ki opravlja promet z učinkovinami na debelo in je vpisan v register proizvajalcev učinkovin, je veletrgovec z učinkovinami. Veletrgovec z učinkovinami svojo dejavnost opravlja v skladu s smernicami in načeli dobre distribucijske prakse za učinkovine.
(2) Veletrgovec z učinkovinami izpolnjuje naslednje pogoje:
1. ima zaposleno ustrezno število strokovnjakov z ustrezno izobrazbo glede na obseg in zahtevnost prometa z učinkovinami na debelo,
2. ima ustrezne prostore, naprave in ustrezno opremo za shranjevanje in transport učinkovin v skladu s smernicami in načeli dobre distribucijske prakse za učinkovine in
3. dejavnost opravlja v skladu s smernicami in načeli dobre distribucijske prakse za učinkovine.
(3) Veletrgovec z učinkovinami o ponaredkih učinkovin ali sumu nanje obvesti JAZMP takoj, ko o tem izve.
(4) Veletrgovec z učinkovinami preveri, če ponudniki učinkovin izpolnjujejo zahteve smernic in načel dobre proizvodne in dobre distribucijske prakse za učinkovine in delujejo v skladu s predpisi, ki urejajo učinkovine, države, v kateri imajo sedež.
112. člen
(postopek vpisa v register veletrgovcev z učinkovinami)
(1) Veletrgovec z učinkovinami s sedežem v Republiki Sloveniji lahko začne opravljati svojo dejavnost na podlagi vpisa v register veletrgovcev z učinkovinami, ki ga vodi JAZMP.
(2) JAZMP ob vpisu v register veletrgovcev z učinkovinami izda potrdilo.
(3) Register veletrgovcev z učinkovinami vsebuje naslednje podatke:
– ime poslovnega subjekta in stalni naslov ter kontaktne podatke (telefon, faks, e-pošta);
– seznam učinkovin, s katerimi poslovni subjekt opravlja promet na debelo.
(4) Veletrgovec z učinkovinami 60 dni pred začetkom opravljanja dejavnosti priglasi svojo dejavnost pri JAZMP s pisno vlogo, ki vsebuje dokazila o izpolnjevanju pogojev iz drugega odstavka prejšnjega člena in seznam učinkovin, s katerimi bo opravljal promet.
(5) JAZMP vpiše veletrgovca z učinkovinami v register veletrgovcev z učinkovinami na podlagi pozitivnega mnenja strokovne komisije za ugotavljanje izpolnjevanja pogojev za opravljanje prometa na debelo z učinkovinami v 90 dneh oziroma v 60 dneh od dneva prejema popolne vloge, če oceni, da preverjanje izpolnjevanja pogojev ni potrebno.
(6) Če strokovna komisija iz prejšnjega odstavka izda negativno mnenje o izpolnjevanju pogojev za opravljanje prometa z učinkovinami na debelo, JAZMP z odločbo zavrne vpis v register iz prvega odstavka tega člena.
(7) JAZMP veletrgovca z učinkovinami izbriše iz registra, če farmacevtski inšpektor ugotovi, da ta ne izpolnjuje pogojev iz drugega odstavka prejšnjega člena in predpisov, sprejetih na njegovi podlagi ter na tej podlagi odredi prepoved opravljanja dejavnosti. JAZMP lahko veletrgovca z učinkovinami izbriše iz registra iz prvega odstavka tega člena tudi na njegov predlog in če po vpogledu v Poslovni register Slovenije ugotovi, da je bil veletrgovec z učinkovinami izbrisan iz tega registra. JAZMP o izbrisu izda odločbo.
(8) JAZMP lahko zahteva dodatno dokumentacijo oziroma podatke, ki so potrebni za odločitev o vpisu v register veletrgovcev z učinkovinami v skladu s šestim odstavkom 3. člena tega zakona.
(9) Dokumentacija iz vloge za vpis v register veletrgovcev z učinkovinami je poslovna skrivnost, če jo v skladu s predpisi kot tako opredeli predlagatelj.
(10) JAZMP objavlja seznam veletrgovcev, vpisanih v register veletrgovcev z učinkovinami, ki opravljajo promet z učinkovinami na debelo na svoji spletni strani. Seznam vsebuje ime veletrgovca z učinkovinami in njegov stalni naslov.
(11) Podrobnejšo vsebino vloge, natančnejše pogoje, način in postopke, potrebne za vpis v register veletrgovcev z učinkovinami in izbris iz tega registra ter natančnejšo vsebino registra, določi minister.
113. člen
(spremembe pogojev, ki so podlaga za vpis v register veletrgovcev z učinkovinami)
(1) Veletrgovec z učinkovinami spremembo pogojev iz drugega odstavka 111. člena tega zakona, ki pomembno vpliva na kakovost ali varnost učinkovine, s katero opravlja promet, takoj sporoči JAZMP.
(2) JAZMP vpiše spremembo iz prejšnjega odstavka v register veletrgovcev z učinkovinami na podlagi pozitivnega mnenja strokovne komisije za ugotavljanje izpolnjevanja pogojev za opravljanje prometa na debelo z učinkovinami v 90 dneh od dneva prejema popolne vloge in o tem izda potrdilo, oziroma vpiše spremembo iz prejšnjega odstavka v register veletrgovcev z učinkovinami v 30 dneh od dneva prejema popolne vloge, če oceni, da preverjanje izpolnjevanja pogojev ni potrebno in o tem izda potrdilo. Če se sprememba iz prejšnjega odstavka ne nanaša na podatke iz registra veletrgovcev z učinkovinami, JAZMP izda odločbo o oceni izpolnjevanja pogojev za opravljanje dejavnosti prometa z učinkovinami na debelo v 30 dneh, oziroma v 90 dneh od dneva prejema popolne vloge, če oceni, da je potrebno preverjanje izpolnjevanja teh pogojev.
(3) Če strokovna komisija iz prejšnjega odstavka izda negativno mnenje o izpolnjevanju pogojev za opravljanje dejavnosti prometa z učinkovinami na debelo, JAZMP spremembe ne vpiše v register veletrgovcev z učinkovinami in o tem izda odločbo.
(4) Ne glede na določbe prvega odstavka tega člena, veletrgovec z učinkovinami druge spremembe pogojev, ki so bili podlaga za vpis v register veletrgovcev z učinkovinami, prijavi letno v poročilu, ki ga posreduje JAZMP najpozneje do 15. decembra tekočega leta, in sicer za vse spremembe v tekočem letu. JAZMP v 30 dneh od dneva prejema popolnega poročila izda potrdilo o spremembi vpisa v register veletrgovcev z učinkovinami.
(5) Podrobnejšo vsebino vloge za priglasitev sprememb pogojev in vsebino letnega poročila sprememb ter natančnejši postopek in način vpisa spremembe v register veletrgovcev z učinkovinami, natančnejši postopek za izdajo odločbe o oceni izpolnjevanja pogojev za opravljanje dejavnosti prometa z učinkovinami določi minister.
IX. UVOZ IN VNOS ZDRAVIL IN UČINKOVIN
1. Zdravila
114. člen
(uvoz zdravil)
(1) Uvoz zdravil lahko opravljajo imetniki dovoljenja za proizvodnjo zdravil, ki vključuje aktivnost uvoza.
(2) Imetniki dovoljenja za proizvodnjo zdravil, ki uvažajo zdravila in sami nimajo ustreznih prostorov, opreme in naprav za kontrolo kakovosti vsake serije uvoženega zdravila, lahko za opravljanje storitev analiznega preskušanja zdravil sklenejo pogodbo s poslovnim subjektom, ki v okviru dovoljenja za proizvodnjo zdravil lahko opravlja dejavnost analiznega preskušanja zdravil.
(3) Za serije zdravil, proizvedenih v tretjih državah, pri katerih je bila, preden so v prometu v Republiki Sloveniji, v drugi državi članici Evropske unije že izvedena kontrola iz prejšnjega odstavka, te kontrole ni treba opravljati, priložijo pa se jim poročila o kontroli kakovosti, s podpisom odgovorne osebe, ki je sprostila serijo zdravila v zadevni državi.
(4) Pri zdravilih, uvoženih iz države, ki je z Evropsko unijo sklenila sporazum o medsebojnem priznavanju listin za področje zdravil, se priznava analizni izvid, ki je bil pridobljen v tej državi izvoznici.
115. člen
(vnos zdravil)
(1) Vnos zdravil lahko opravljajo veletrgovci z zdravili s sedežem v Republiki Sloveniji in veletrgovci z zdravili s sedežem v drugi državi članici Evropske unije, priglašeni pri JAZMP.
(2) Serije zdravil, pri katerih so bile v drugi državi članici Evropske unije izvedene kontrole vsake serije zdravila pred vnosom v Republiki Sloveniji, so oproščene teh kontrol.
116. člen
(vnos oziroma uvoz zdravil)
(1) Ob izpolnjevanju pogojev tega zakona sta vnos in uvoz zdravil prosta za zdravila, ki imajo:
– dovoljenje za promet,
– dovoljenje za promet s paralelno uvoženim zdravilom,
– dovoljenje za sočutno uporabo zdravila,
– potrdilo o priglasitvi paralelne distribucije zdravila ali
– dovoljenje za klinično preskušanje oziroma ustrezno priglašeno klinično preskušanje.
(2) Vnos in uvoz zdravil, ki nimajo dovoljenja iz prejšnjega odstavka, sta dovoljena le za zdravila iz tretjega odstavka 20. člena tega zakona.
(3) JAZMP lahko v 30 dneh od dneva prejema popolne vloge izjemoma začasno dovoli vnos oziroma uvoz zdravil iz prejšnjega odstavka, razen v primerih iz druge in pete alineje tretjega odstavka 20. člena tega zakona, ko odloči najpozneje v sedmih dneh.
(4) Predlagatelj za pridobitev dovoljenja za vnos zdravil iz drugega odstavka tega člena je lahko veletrgovec z zdravili, za uvoz zdravil pa proizvajalec z zdravili, ki ima v okviru dovoljenja za proizvodnjo zdravil odobreno aktivnost uvoza zdravil.
(5) Za zdravila, ki nimajo dovoljenja za promet z zdravilom v Republiki Sloveniji in se zanje lahko pridobi dovoljenje za vnos oziroma uvoz zdravil v skladu s tem zakonom, morajo predlagatelji pred pridobitvijo takega dovoljenja predhodno pridobiti sklep JAZMP o količinah zdravil in njihovih cenah na debelo brez DDV za posamezno obdobje.
(6) Sklep JAZMP iz prejšnjega odstavka se izda predlagatelju, ki je za razpisano letno količino zdravil, izraženo na ravni količine zadevnih učinkovin, ponudil najnižjo ceno na debelo brez DDV, če na trgu Republike Slovenije ni zdravila z dovoljenjem za promet z isto učinkovino, farmacevtsko obliko in jakostjo. JAZMP o tej izbiri obvesti vse ponudnike in izvajalce zdravstvene, veterinarske in lekarniške dejavnosti.
(7) JAZMP ugotovi letno potrebno količino zdravil iz prejšnjega odstavka na podlagi podatkov o količinah potrebnih zdravilih iz tretjega odstavka 20. člena tega zakona za obdobje enega leta, s predstavitvijo splošnih imen zdravil, navedbo farmacevtske oblike in jakosti, ki jih na njen poziv posredujejo izvajalci zdravstvene, veterinarske in lekarniške dejavnosti.
(8) Ne glede na določbe petega odstavka tega člena, predlagatelji pridobijo dovoljenje za vnos oziroma uvoz zdravil, če v svoji vlogi dokažejo, da potreb po vnosu oziroma uvozu zdravil ni bilo mogoče predvideti in pridobiti dovoljenja za vnos oziroma uvoz v skladu z določbami petega odstavka tega člena, ali če imetnik dovoljenja za vnos ali uvoz iz petega odstavka tega člena sporoči JAZMP, da določenega zdravila ne more zagotoviti v predvidenem obsegu ali v predvidenem roku.
(9) Imetnik dovoljenja za vnos oziroma uvoz zdravil, ki je pridobil dovoljenje na podlagi petega odstavka tega člena, zagotovi dobavo zdravil v skladu s tem dovoljenjem in v skladu z zahtevami za dobavo zdravil, kot jih določijo izvajalci zdravstvene, veterinarske ali lekarniške dejavnosti.
(10) Če imetnik dovoljenja iz prejšnjega odstavka ne dobavi zdravil izvajalcem zdravstvene, veterinarske ali lekarniške dejavnosti, za katera je pridobil dovoljenje za vnos ali uvoz, pri naslednjem postopku zbiranja ponudb iz šestega odstavka tega člena ne sme oddati svoje ponudbe.
(11) Vnos oziroma uvoz zdravil, ki se vnašajo oziroma uvažajo zaradi iznosa ali izvoza v druge države, z namenom dajanja v promet v drugih državah članicah Evropske unije in ne bodo prodana v Republiki Sloveniji, sta prosta, če se opravljata v okviru in na podlagi ustreznega dovoljenja za opravljanje proizvodnje zdravil oziroma prometa z zdravili na debelo.
(12) Podrobnejše pogoje, način in postopek vnosa in uvoza zdravil ter način poročanja izvajalcev zdravstvene, veterinarske ali lekarniške dejavnosti o potrebnih količinah zdravil iz tretjega odstavka 20. člena tega zakona, določi minister.
117. člen
(promet s paralelno uvoženimi zdravili)
(1) Postopek za pridobitev dovoljenja za promet s paralelno uvoženim zdravilom se začne z vlogo veletrgovca z zdravili, ki je pri prometu s tem zdravilom poslovno nepovezan z imetnikom dovoljenja za promet z zdravilom. JAZMP izda dovoljenje za promet s paralelno uvoženim zdravilom v 60 dneh od dneva prejema popolne vloge.
(2) Vloga za pridobitev, spremembo ali podaljšanje dovoljenja za promet s paralelno uvoženim zdravilom vsebuje podatke o predlagatelju vloge, zdravilu, za katerega se predlaga paralelni uvoz in zdravilu, ki ima dovoljenje za promet v Republiki Sloveniji in s katerim se primerja zdravilo, za katerega je vloga podana.
(3) Podrobnejšo vsebino vloge, postopek in pogoje za pridobitev, spremembo in podaljšanje dovoljenja za promet s paralelno uvoženim zdravilom, razloge za prenehanje veljavnosti dovoljenja in naloge imetnika dovoljenja za promet s paralelno uvoženim zdravilom določi minister.
118. člen
(paralelna distribucija zdravil)
(1) Pred začetkom paralelne distribucije z zdravilom morajo veletrgovci z zdravili, ki lahko opravljajo promet z zdravili na debelo v Republiki Sloveniji, posredovati JAZMP pisno obvestilo o začetku paralelne distribucije zdravil.
(2) Obvestilo iz prejšnjega odstavka vsebuje dokazila o tem, da je predlagatelj obvestil EMA o nameravani paralelni distribuciji, podatke o zdravilu, ki bo predmet paralelne distribucije, skupaj s podatki o opremljanju zunanje ovojnine zdravila in navodilu v slovenskem jeziku, podatke o proizvajalcu zdravila in mestu proizvodnje ter da EMA ne nasprotuje nameravani paralelni distribuciji zdravil.
(3) JAZMP po vložitvi popolne vloge iz prejšnjega odstavka izda potrdilo o prejemu obvestila o paralelni distribuciji zdravil.
(4) Podrobnejšo vsebino obvestila in postopek izdaje potrdila o prejemu obvestila o paralelni distribuciji zdravil določi minister.
2. Učinkovine
119. člen
(uvoz učinkovin)
(1) Uvoz učinkovin lahko opravljajo poslovni subjekti, vpisani v register uvoznikov učinkovin, ki so imetniki dovoljenja za proizvodnjo zdravil, proizvajalci učinkovin in veletrgovci z učinkovinami (v nadaljnjem besedilu: uvoznik učinkovin).
(2) Uvoznik učinkovin lahko uvaža samo učinkovine, ki so proizvedene v skladu s smernicami in načeli dobre proizvodne prakse za učinkovine, ki veljajo v Evropski uniji ali smernicami in načeli dobre proizvodne prakse, ki veljajo v tretji državi in so glede zahtev najmanj enakovredne tistim, ki jih določa Evropska unija.
(3) Uvoznik učinkovin, ki uvaža učinkovine, namenjene proizvodnji zdravil za uporabo v humani medicini, sme uvažati samo učinkovine, ki jih spremlja pisno potrdilo pristojnega organa iz tretje države izvoza:
– da so standardi dobre proizvodne prakse, ki se uporabljajo za mesto proizvodnje, v katerem se proizvaja izvožena učinkovina, najmanj enakovredni tistim, ki jih določa Evropska unija,
– da je proizvodni obrat pod redno kontrolo pristojnega organa in
– da bodo v primeru ugotovitve neskladnosti s standardi dobre proizvodne prakse takoj obvestili države članice Evropske unije, v katere se učinkovine izvažajo.
(4) Pisnega potrdila iz prejšnjega odstavka ni treba predložiti, če je zadevna tretja država uvrščena na seznam držav pri Evropski komisiji, ki imajo zahteve in standarde dobre proizvodne prakse enakovredne tistim v Evropski uniji.
(5) Izjemoma in kadar je to potrebno za zagotavljanje razpoložljivosti zdravil, pisnega potrdila iz tretjega odstavka tega člena ni treba predložiti, če je v zadnjih treh letih v državi izvoznici država članica Evropske unije opravila inšpekcijski pregled in ugotovila, da je proizvodnja skladna z dobro proizvodno prakso za učinkovine.
(6) Podrobnejše zahteve glede uvoza učinkovin določi minister.
120. člen
(pogoji za uvoz učinkovin)
(1) Uvozniki učinkovin izpolnjujejo naslednje pogoje:
1. ima zaposleno ustrezno število strokovnjakov z najmanj srednjo izobrazbo ustrezne smeri glede na obseg in zahtevnost uvoza učinkovin,
2. imajo ustrezne prostore, naprave in opremo za shranjevanje in transport učinkovin v skladu s smernicami in načeli dobre distribucijske prakse za učinkovine, in
3. dejavnost opravljajo v skladu s smernicami in načeli dobre distribucijske prakse.
(2) Uvoznik učinkovin o ponaredkih učinkovin ali sumu nanje obvesti JAZMP takoj, ko o tem izve.
(3) Uvoznik učinkovin preveri, če ponudniki učinkovin izpolnjujejo zahteve smernic in načel dobre proizvodne in dobre distribucijske prakse za učinkovine in delujejo v skladu s predpisi, ki urejajo učinkovine, države, v kateri imajo sedež.
121. člen
(postopek vpisa v register uvoznikov učinkovin)
(1) Uvozniki učinkovin s sedežem v Republiki Sloveniji, lahko začnejo opravljati svojo dejavnost po vpisu v register uvoznikov učinkovin, ki ga vodi JAZMP.
(2) JAZMP ob vpisu v register iz prejšnjega odstavka izda potrdilo.
(3) Register uvoznikov učinkovin vsebuje naslednje podatke:
– ime poslovnega subjekta in stalni naslov ter kontaktne podatke (telefon, faks, e-pošta);
– seznam učinkovin, ki jih poslovni subjekt uvaža.
(4) Uvoznik učinkovin 60 dni pred začetkom opravljanja dejavnosti priglasi svojo dejavnost pri JAZMP s pisno vlogo, ki vsebuje dokazila o izpolnjevanju pogojev in seznam učinkovin, ki jih namerava uvažati.
(5) JAZMP vpiše uvoznika učinkovin v register uvoznikov učinkovin na podlagi pozitivnega mnenja strokovne komisije za ugotavljanje izpolnjevanja pogojev za opravljanje uvoza učinkovin o izpolnjevanju pogojev iz prvega odstavka prejšnjega člena v 90 dneh oziroma v 60 dneh od dneva prejema popolne vloge, če oceni, da preverjanje izpolnjevanja pogojev ni potrebno.
(6) Če strokovna komisija iz prejšnjega odstavka izda negativno mnenje o izpolnjevanju pogojev za uvoz učinkovin, JAZMP zavrne vpis v register uvoznikov učinkovin in o tem izda odločbo.
(7) JAZMP lahko zahteva dodatno dokumentacijo oziroma podatke, ki so potrebni za vpis v register uvoznikov učinkovin v skladu s šestim odstavkom 3. člena tega zakona.
(8) JAZMP lahko uvoznika učinkovin izbriše iz registra uvoznikov učinkovin, če farmacevtski inšpektor ugotovi, da ta ne izpolnjuje pogojev iz prejšnjega člena in predpisov, sprejetih na njegovi podlagi in mu odredi prepoved opravljanja dejavnosti uvoza učinkovin. JAZMP lahko uvoznika učinkovin izbriše iz registra uvoznikov učinkovin tudi na njegov predlog in če po vpogledu v Poslovni register Slovenije ugotovi, da je bil poslovni subjekt izbrisan iz tega registra. JAZMP o izbrisu izda odločbo.
(9) Dokumentacija iz vloge za priglasitev v register uvoznikov učinkovin je poslovna skrivnost, če jo v skladu s predpisi kot tako opredeli predlagatelj.
(10) JAZMP objavlja seznam v register vpisanih uvoznikov učinkovin na svoji spletni strani. Seznam vsebuje ime poslovnega subjekta in njegov stalni naslov.
(11) Natančnejšo vsebino vloge, natančnejše pogoje, način in postopke, potrebne za priglasitev vpisa in izbrisa iz registra uvoznikov učinkovin ter natančnejšo vsebino registra uvoznikov učinkovin, določi minister.
122. člen
(spremembe pogojev za vpis v register uvoznikov učinkovin)
(1) Uvoznik učinkovin, ki je vpisan v register uvoznikov učinkovin, vsako spremembo pogojev iz prvega odstavka 120. člena tega zakona, ki pomembno vpliva na kakovost ali varnost učinkovine, ki jo uvaža, takoj sporoči JAZMP.
(2) JAZMP vpiše spremembo iz prejšnjega odstavka v register uvoznikov učinkovin na podlagi pozitivnega mnenja strokovne komisije za ugotavljanje izpolnjevanja pogojev za opravljanje uvoza učinkovin v 90 dneh od prejema popolne vloge in o tem izda potrdilo, oziroma vpiše spremembo v 30 dneh od dneva prejema popolne vloge, če oceni, da preverjanje izpolnjevanja pogojev ni potrebno in o tem izda potrdilo.
(3) Če se sprememba pogojev iz prvega odstavka tega člena ne nanaša na podatke iz registra uvoznikov učinkovin, JAZMP izda odločbo o oceni izpolnjevanja pogojev za uvoz učinkovin v 30 dneh od prejema popolne vloge, oziroma v 90 dneh od prejema popolne vloge, če oceni, da je potrebno preverjanje izpolnjevanja teh pogojev.
(4) Če strokovna komisija iz drugega odstavka tega člena izda negativno mnenje o izpolnjevanju pogojev za opravljanje dejavnosti uvoza učinkovin, JAZMP spremembe ne vpiše v register uvoznikov učinkovin in o tem izda odločbo.
(5) Ne glede na prejšnji odstavek, uvoznik učinkovin druge spremembe pogojev, ki so bile podlaga za priglasitev uvoza učinkovin, prijavi letno v poročilu, ki ga JAZMP posreduje najpozneje do 15. decembra tekočega leta, in sicer za vse spremembe v tekočem letu. JAZMP v 30 dneh od prejema popolnega poročila izda potrdilo o spremembi vpisa v register uvoznikov učinkovin.
(6) Podrobnejšo vsebino vloge za priglasitev sprememb pogojev in letne prijave sprememb, ter natančnejši način in postopek vpisa spremembe v register uvoznikov učinkovin in postopek za izdajo odločbe o oceni izpolnjevanja pogojev za uvoz učinkovin, določi minister.
X. POSREDNIŠTVO V PROMETU Z ZDRAVILI IN UČINKOVINAMI NA DEBELO
123. člen
(pogoji in obveznosti za posrednike)
Posredniki v prometu z zdravili in učinkovinami na debelo morajo:
– izpolnjevati zahteve dobre distribucijske prakse za tiste aktivnosti, ki se nanašajo na posredništvo,
– imeti vzpostavljen sistem sledljivosti zdravil oziroma učinkovin, ki omogoča podporo odpoklica zdravil ali učinkovin,
– voditi dokumentacijo o posredovanju zdravil in učinkovin,
– vzdrževati sistem kakovosti z jasno razdeljenimi odgovornostmi in opisanimi postopki ter opisanim načinom upravljanja s tveganji, ki se nanaša na njihove aktivnosti,
– zagotoviti, da imajo zdravila, na katera se nanaša posredništvo, dovoljenje za promet z zdravilom ali začasno izredno dovoljenje za promet z zdravilom,
– preveriti in zagotoviti svoje poslovanje le s ponudniki zdravil (proizvajalci, uvozniki, veletrgovci), ki izpolnjujejo zahteve dobre proizvodne ali distribucijske prakse in delujejo v skladu s predpisi, ki urejajo zdravila oziroma učinkovine države, v kateri imajo sedež, ter imajo dovoljenje za proizvodnjo zdravil oziroma dovoljenje za promet z zdravili na debelo,
– o ponaredkih zdravil ali učinkovin ali sumu nanje takoj, ko o tem izvedo, obvestiti JAZMP in
– voditi dokumentacijo v zvezi s posredništvom zdravil ali učinkovin, ki je dosegljiva JAZMP za potrebe inšpekcijskega nadzora in jo hraniti najmanj pet let.
124. člen
(register posrednikov v prometu z zdravili in učinkovinami)
(1) Poslovni subjekti s sedežem v Republiki Sloveniji, ki opravljajo dejavnost posredništva v prometu z zdravili ali učinkovinami na debelo, pred začetkom opravljanja dejavnosti priglasijo svojo dejavnost pri JAZMP za vpis v javno dostopen register posrednikov v prometu z zdravili in učinkovinami.
(2) JAZMP o vpisu v register posrednikov v prometu z zdravili in učinkovinami izda potrdilo.
(3) Priglasitev za vpis v register posrednikov v prometu z zdravili in učinkovinami vsebuje naslednje podatke:
– ime in sedež poslovnega subjekta,
– kontaktne podatke (kontaktna oseba, telefon, fax, e-pošta).
(4) O spremembi podatkov, ki so bili predmet vpisa v register iz prvega odstavka tega člena, posredniki v prometu z zdravili in učinkovinami takoj obvestijo JAZMP.
(5) Če farmacevtski inšpektor ugotovi, da posrednik ne izpolnjuje pogojev iz prejšnjega člena in na tej podlagi odredi prepoved opravljanja dejavnosti, JAZMP izbriše posrednika iz registra iz prvega odstavka tega člena in o tem izda odločbo.
(6) JAZMP lahko posrednika v prometu z zdravili in učinkovinami izbriše iz registra posrednikov v prometu z zdravili in učinkovinami tudi na njegov predlog in če po vpogledu v Poslovni register Slovenije ugotovi, da je bil poslovni subjekt izbrisan iz tega registra.
(7) Podrobnejšo vsebino vloge, natančnejše pogoje, način in postopke za vpis, spremembo in izbris iz registra posrednikov v prometu z zdravili in učinkovinami ter natančnejšo vsebino registra posrednikov v prometu z zdravili in učinkovinami določi minister.
125. člen
(obveščanje v bazo podatkov Evropske unije)
JAZMP posreduje v bazo podatkov Evropske unije (EudraGMDP) podatke o poslovnih subjektih, ki so pridobili dovoljenje za proizvodnjo zdravil in dovoljenje za promet z zdravili na debelo, potrdilih o dobri proizvodni praksi in o dobri distribucijski praksi ter podatke o poslovnih subjektih, ki so vpisani v registre na področju proizvodnje zdravil, prometa z zdravili na debelo, uvoza učinkovin ali dejavnosti posredništva v prometu z zdravili ali učinkovinami na debelo.
XI. PROMET Z ZDRAVILI NA DROBNO
126. člen
(promet z zdravili na drobno in izdaja zdravil prek medmrežja)
(1) Promet z zdravili za uporabo v humani medicini na drobno, ki ga spremlja ustrezna strokovna podpora s svetovanjem ter promet na drobno z zdravili za uporabo v humani medicini, ki se uporabljajo za zdravljenje živali, se izvaja v lekarnah in specializiranih prodajalnah, promet na drobno z zdravili za uporabo v veterinarski medicini pa tudi v veterinarskih organizacijah in drugih organizacijah, ki po predpisih o veterini, opravljajo veterinarsko dejavnost, ob storitvi za živali, ki jih imajo te organizacije v svoji evidenci oziroma, če pri lastniku ali skrbniku živali opravljajo veterinarske preventivne ali terapevtske posege na živalih.
(2) Ne glede na prejšnji odstavek, so lahko v prometu z zdravili na drobno v specializiranih prodajalnah zdravila, za katera ni potreben zdravniški ali veterinarski recept, in sicer samo tista, za katera tako odloči JAZMP v dovoljenju za promet z zdravilom.
(3) JAZMP pri opredelitvi zdravil, ki so v prometu na drobno v specializiranih prodajalnah, lahko uvede omejitve glede jakosti, velikosti pakiranja ali števila prodanih enot.
(4) JAZMP na svoji spletni strani objavi seznam zdravil, ki se lahko izdajajo v specializiranih prodajalnah. Na seznam razvrsti le tista zdravila rastlinskega in sinteznega izvora, ki imajo ugodno razmerje med koristjo in tveganjem, se uporabljajo za odpravljanje blažjih simptomov in zdravstvenih težav ter njihovi farmakovigilančni podatki kažejo majhno tveganje.
(5) V specializirani prodajalni lahko prodaja zdravila usposobljena oseba iz 1. točke prvega odstavka 127. člena tega zakona, ki kupca seznani z načinom uporabe zdravila, morebitnimi previdnostnimi ukrepi, neželenimi učinki in drugimi pomembnimi podatki o zdravilu.
(6) V specializiranih prodajalnah se zdravila lahko prodajajo samo polnoletnim osebam.
(7) Poslovni subjekti iz prvega odstavka tega člena o ponaredkih zdravil ali sumu nanje obvestijo JAZMP takoj, ko o tem izvedo.
(8) V primeru zahtevnejših zdravstvenih težav pacienta oseba iz 1. točke prvega odstavka 127. člena tega zakona v specializirani prodajalni z zdravili pacienta obvezno napoti k zdravniku ali magistru farmacije v lekarni.
(9) Način in mesto izdaje zdravila sta določena v dovoljenju za promet z zdravilom.
(10) Homeopatska zdravila se lahko izdajajo le v lekarnah, homeopatska zdravila za uporabo v veterinarski medicini pa tudi pri izvajalcu veterinarske dejavnosti ob storitvi za živali, ki jih ima izvajalec veterinarske dejavnosti v svoji evidenci oziroma, če izvajalec veterinarske dejavnosti pri lastniku ali skrbniku živali opravlja veterinarske preventivne ali terapevtske posege na živalih.
(11) V prometu z zdravili na drobno so prepovedane komercialne spodbude, ki končnega uporabnika usmerjajo v nepotreben ali prekomeren nakup ali uporabo zdravil.
(12) Zdravila, ki se ne izdajajo na podlagi zdravniškega ali veterinarskega recepta, se smejo z dovoljenjem ministra, izdajati prek medmrežja.
(13) Izdaja zdravila prek medmrežja je prodaja zdravila na drobno, vključno z ustrezno in strokovno neodvisno podporo s svetovanjem o uporabi zdravila in transportom ter vročitvijo zdravila, ki zagotavljata kakovost in varnost uporabe zdravila.
(14) Izdaja zdravil prek medmrežja se opravlja v lekarnah in specializiranih prodajalnah za zdravila. V specializiranih prodajalnah se izdajajo prek medmrežja le zdravila, ki se lahko prodajajo v specializiranih prodajalnah za zdravila v skladu z določbami drugega odstavka tega člena.
(15) Lekarna ali specializirana prodajalna za zdravila mora za opravljanje izdajanja zdravil prek medmrežja izpolnjevati naslednje pogoje:
– ima urejeno medmrežno prodajo v skladu s predpisi, ki urejajo elektronsko poslovanje in varstvo potrošnikov glede prodaje prek medmrežja,
– zagotavlja varnost pri ustvarjanju, pošiljanju, prejemanju, shranjevanju ali drugi obdelavi podatkov, v skladu z zakonom, ki ureja varstvo osebnih podatkov,
– zagotavlja sistem kakovosti, ki smiselno upošteva načela in smernice dobre distribucijske prakse za zdravila glede sledljivosti, transporta in dostave zdravil na mesto vročanja,
– zagotavlja strokovno svetovanje o posameznem zdravilu.
(16) Lekarna ali specializirana prodajalna za zdravila iz prejšnjega odstavka na svoji spletni strani uporablja skupni logotip, ki ga določi Evropska komisija na podlagi Direktive 2011/62/EU, in vključuje varno povezavo na seznam ponudnikov izdaje zdravil prek medmrežja pri ministrstvu, pristojnem za zdravje. Skupni logotip se navede na vsaki strani spletnega mesta lekarne ali specializirane prodajalne za zdravila.
(17) Ministrstvo, pristojno za zdravje, vzpostavi spletno mesto, ki vsebuje informacije o:
– nacionalni zakonodaji, ki ureja izdajo zdravil prek medmrežja,
– skupnem logotipu iz prejšnjega odstavka,
– seznamu ponudnikov izdaje zdravil prek medmrežja in njihovih spletnih naslovih,
– tveganjih, povezanih z zdravili, ki se javnosti nezakonito prodajajo prek medmrežja,
– povezavi na spletno stran EMA, ki vsebuje informacijo o veljavni zakonodaji Evropske unije o ponarejenih zdravilih in povezavo do spletnih strani pristojnih organov držav članic glede informacij iz prve, druge, tretje in četrte alineje tega odstavka.
(18) Spletno mesto ponudnika izdaje zdravil prek medmrežja iz prejšnjega odstavka, vsebuje naslednje podatke:
– ime in sedež lekarne z navedbo organizacijske enote, v kateri se izdaja zdravila prek medmrežja ali specializirane prodajalne za zdravila, ki opravlja izdajo zdravila prek medmrežja,
– odgovorno osebo za izdajo zdravil prek medmrežja,
– kontaktne podatke ministrstva, pristojnega za zdravje,
– povezavo na spletno mesto ministrstva, pristojnega za zdravje, iz sedemnajstega odstavka tega člena.
(19) Lekarna ali specializirana prodajalna za zdravila vloži vlogo za dovoljenje za izdajo zdravil prek medmrežja pri ministrstvu, pristojnem za zdravje. Vloga vsebuje naslednje podatke:
– ime in sedež lekarne z navedbo organizacijske enote, v kateri se bodo izdajala zdravila prek medmrežja ali specializirane prodajalne za zdravila z navedbo lokacije, na kateri se bodo izdajala zdravila prek medmrežja,
– številko in datum dokazila o izpolnjevanju pogojev za opravljanje lekarniške dejavnosti ali številko in datum dovoljenja za opravljanje prometa z zdravili na drobno v specializirani prodajalni, ki bo izdajala zdravila prek medmrežja,
– dokazila o izpolnjevanju pogojev iz petnajstega odstavka tega člena,
– datum začetka opravljanja izdaje zdravil prek medmrežja,
– naslov spletnega mesta oziroma druge informacije, ki so potrebne za prepoznavo spletnega mesta, ki izdaja zdravila.
(20) Ministrstvo, pristojno za zdravje, odvzame dovoljenje za izdajo zdravil prek medmrežja:
– če farmacevtski inšpektor odredi prepoved opravljanje izdaje zdravil prek medmrežja, ker lekarna ali specializirana prodajalna za zdravila ne izpolnjuje več pogojev iz petnajstega odstavka tega člena,
– na zahtevo lekarne ali specializirane prodajalne za zdravila, ki opravlja izdajo zdravil prek medmrežja.
(21) Poleg odgovornosti medmrežnega vira zdravila, ki vključuje odgovornost proizvajalca, imetnika dovoljenja za promet z zdravilom ali lekarne ali specializirane prodajalne za zdravila, ki je dala zdravilo v promet, in poslovnih subjektov, ki opravljajo promet z zdravili na debelo in drobno, je za tveganja ali škodo, ki nastane zaradi uporabe zdravil, pridobljenih iz nesledljivih medmrežnih virov, ali virov, ki ne ustrezajo zahtevam iz tega člena, odgovoren tudi končni uporabnik oziroma kupec zdravila.
(22) Promet zdravil na drobno prek medmrežja, za katera je potreben zdravniški oziroma veterinarski recept, ni dovoljen. Nadzor nad prometom s temi zdravili prek medmrežja opravlja organ, pristojen za carinske zadeve, v skladu s carinskimi predpisi.
(23) Podrobnejši način izdaje zdravil in z izdajo povezanega razvrščanja zdravil, natančnejše pogoje za oblikovanje in uporabo skupnega logotipa iz šestnajsti odstavka tega člena ter natančnejši postopek izdaje in odvzema dovoljenja za izdajo zdravil prek medmrežja določi minister.
127. člen
(specializirane prodajalne za zdravila)
(1) Promet z zdravili na drobno v specializirani prodajalni lahko opravljajo poslovni subjekti, ki imajo dovoljenje JAZMP za opravljanje te dejavnosti in, ki poleg splošnih pogojev za opravljanje dejavnosti trgovine na drobno izpolnjujejo naslednje pogoje:
1. imajo zaposleno najmanj eno usposobljeno osebo z najmanj srednjo strokovno izobrazbo farmacevtske smeri oziroma veterinarske smeri za zdravila za uporabo v veterinarski medicini z opravljenim strokovnim izpitom in dokazili o rednem strokovnem izpopolnjevanju na usposabljanjih in drugih ustreznih neodvisnih strokovnih izobraževanjih, ki so obvezna tudi za farmacevtske oziroma veterinarske tehnike, dodatnem izobraževanju strokovnega organa, ki izvaja lekarniško dejavnost, in ki je odgovorna za nabavo, skladiščenje in prodajo zdravil ter vodenje dokumentacije;
2. usposobljena oseba iz prejšnje točke je prisotna ves obratovalni čas specializirane prodajalne;
3. imajo potrebno opremo in ustrezne prostore, v katerih so zdravila oziroma dejavnost prometa z zdravili na drobno prostorsko oziroma drugače ustrezno fizično ločena od drugih izdelkov oziroma drugih dejavnosti ter primerno označena;
4. vodijo ustrezno dokumentacijo na način, ki omogoča takojšen odpoklic zdravila in reševanje reklamacij;
5. imajo ustrezno označeno specializirano prodajalno.
(2) Postopek za izdajo dovoljenja za opravljanje prometa z zdravili na drobno v specializirani prodajalni se začne na predlog poslovnega subjekta s sedežem v Republiki Sloveniji.
(3) JAZMP izda dovoljenje za opravljanje prometa z zdravili na drobno v specializirani prodajalni v 90 dneh od dneva prejema popolne vloge na podlagi mnenja strokovne komisije za ugotavljanje izpolnjevanja pogojev za opravljanje prometa z zdravili na drobno.
(4) Dovoljenje iz prejšnjega odstavka se lahko izda tudi za določen čas ali pogojno, če strokovna komisija iz prejšnjega odstavka ugotovi, da imetnik dovoljenja za opravljanje dejavnosti prometa z zdravili na drobno v specializirani prodajalni ne izpolnjuje predpisanih pogojev.
(5) Dovoljenje iz prvega odstavka tega člena se lahko začasno odvzame ali odvzame, če farmacevtski inšpektor ugotovi, da imetnik dovoljenja za promet z zdravili na drobno v specializirani prodajalni ne izpolnjuje predpisanih pogojev in odredi prepoved opravljanja dejavnosti.
(6) Dovoljenje za opravljanje prometa z zdravili na drobno v specializirani prodajalni se odvzame tudi na predlog imetnika dovoljenja.
(7) Če JAZMP po vpogledu v Poslovni register Slovenije ugotovi, da je bil poslovni subjekt, ki mu je bilo izdano dovoljenje za opravljanje prometa z zdravili na drobno v specializirani prodajalni, izbrisan iz tega registra, po uradni dolžnosti ugotovi, da je dovoljenje prenehalo veljati, odvzame dovoljenje za opravljanje prometa z zdravili na drobno in o tem izda odločbo.
(8) Podrobnejše pogoje, ki jih izpolnjujejo specializirane prodajalne za promet z zdravili na drobno, ter postopek in način ugotavljanja teh pogojev, določi minister.
128. člen
(lekarne)
Pogoje, ki jih za promet z zdravili na drobno izpolnjujejo lekarne, določa poseben zakon.
XII. FARMAKOVIGILANCA
1. Sistem farmakovigilance
129. člen
(obveznost poročanja o domnevnih neželenih učinkih zdravil)
(1) Zdravstveni delavec poroča nacionalnemu centru za farmakovigilanco o naslednjih neželenih učinkih zdravil za uporabo v humani medicini:
– vseh resnih domnevnih neželenih učinkih,
– vseh nepričakovanih domnevnih neželenih učinkih, ki niso resni in
– vseh domnevnih neželenih učinkih, ki so posledica napake, povezane z uporabo zdravila, nepravilne uporabe, zlorabe, prevelikega odmerjanja, neodobrene uporabe in poklicne izpostavljenosti zdravilu.
(2) Ne glede na prejšnji odstavek zdravstveni delavec poroča o vseh domnevnih neželenih učinkih zdravil za uporabo v humani medicini, ki so na seznamu zdravil pod dodatnim nadzorom, ki ga v skladu s 23. členom Uredbe 726/2004/ES objavi EMA.
(3) Veterinar, ki pri svojem delu ugotovi neželene učinke zdravil za uporabo v veterinarski medicini, ali sumi nanje, o tem v skladu s tem zakonom in na njegovi podlagi sprejetimi predpisi obvešča imetnika dovoljenja za promet z zdravilom. Ob resnih neželenih učinkih, ki se pojavijo pri živalih ali ljudeh po uporabi zdravil v veterinarski medicini, veterinar, poslovni subjekt oziroma institucija, ki deluje na področju veterine, poleg imetnika dovoljenja za promet z zdravilom obvesti tudi JAZMP.
130. člen
(poročanje pacientov o domnevnih neželenih učinkih zdravil)
Pacienti lahko poročajo o domnevnih neželenih učinkih zdravil iz prvega in drugega odstavka prejšnjega člena zdravstvenemu delavcu ali neposredno nacionalnemu centru za farmakovigilanco.
131. člen
(zbiranje in ocenjevanje poročil o domnevnih neželenih učinkih zdravil)
(1) Zbiranje poročil iz prvega in drugega odstavka 129. člena in 130. člena tega zakona o domnevnih neželenih učinkih zdravil za uporabo v humani medicini in njihovo ocenjevanje opravlja nacionalni center za farmakovigilanco.
(2) Nacionalni center za farmakovigilanco najpozneje v 24 urah po prejemu poročil iz prejšnjega odstavka JAZMP posreduje zbrane podatke o domnevnih neželenih učinkih in druge pomembne podatke, ki se nanašajo na varnost, učinkovitost in uporabo zdravil ter delovanje sistema farmakovigilance.
132. člen
(institucionalno sodelovanje)
Kadar JAZMP pri zbiranju, obravnavi in ocenjevanju poročil iz 129., 130. in 131. člena tega zakona, ugotovi potrebo po dodatnem opredeljevanju njihove klinične in javnozdravstvene upoštevnosti in z njo povezanih farmakovigilančnih aktivnosti, upošteva strokovno mnenje zunanjih strokovnjakov kliničnih in javno zdravstvenih strok.
133. člen
(naloge imetnika dovoljenja za promet z zdravilom)
(1) Imetnik dovoljenja za promet z zdravilom za uporabo v humani medicini:
– vzpostavi, vzdržuje in upravlja sistem farmakovigilance, ki zagotavlja zbiranje in vodenje dokumentacije o vseh domnevnih neželenih učinkih zdravil v Evropski uniji in v tretjih državah, znanstveno vrednotenje vseh informacij, preučevanje možnosti za zmanjšanje in preprečevanje tveganj, sprejetje potrebnih ukrepov in izmenjavo podatkov z organi, pristojnimi za zdravila v državah članicah Evropske unije,
– redno presoja svoj sistem farmakovigilance in vodii ter, na zahtevo JAZMP, da na voljo glavni dosje o sistemu farmakovigilance,
– upravlja sistem obvladovanja tveganj za vsako zdravilo in ga posodablja sorazmerno z ugotovljenimi tveganji ter spremlja podatke o farmakovigilanci,
– obvesti JAZMP o ugotovljenih novih ali spremenjenih tveganjih, o spremembah razmerja med koristjo in tveganjem pri zdravilih ter predhodno ali istočasno obvesti JAZMP, Evropsko komisijo in EMA o vsebini vsake objave informacij o vprašanjih farmakovigilance,
– na zahtevo JAZMP, takoj in v celoti predloži podatke, ki dokazujejo, da razmerje med koristjo in tveganjem ostaja ugodno,
– izpolnjuje zahteve in obveznosti za nadzor neintervencijskih študij o varnosti ali učinkovitosti zdravil po pridobitvi dovoljenja za promet z zdravilom v skladu s tem zakonom,
– posreduje podatke o vseh domnevnih neželenih učinkih zdravil v podatkovno bazo EudraVigilance, razen literaturnih poročil za zdravila z učinkovinami s seznama publikacij, ki jih spremlja EMA,
– izpolnjuje obveznosti v zvezi z rednimi posodobljenimi poročili o varnosti zdravil v skladu s prvim in tretjim odstavkom 107.b člena ter prvim, drugim, tretjim in šestim odstavkom 107.c člena Direktive 2001/83/ES,
– pri izvajanju nalog farmakovigilance upošteva postopke, kot so podrobno opisani v izvedbenih ukrepih Evropske komisije v skladu s 108. členom Direktive 2001/83/ES, v smernicah o dobrih praksah na področju farmakovigilance v skladu s 108.a členom Direktive 2001/83/ES ter znanstvene smernice o študijah učinkovitosti po pridobitvi dovoljenja za promet v skladu s 108.a členom Direktive 2001/83/ES.
(2) Imetnik dovoljenja za promet z zdravilom za uporabo v veterinarski medicini vzpostavi in vzdržuje lasten sistem farmakovigilance, ki zagotavlja zbiranje, vrednotenje ter izmenjavo podatkov z organi, pristojnimi za zdravila v drugih državah članicah Evropske unije in v Evropski uniji. Imetnik dovoljenja za promet z zdravilom za uporabo v veterinarski medicini poroča JAZMP o neželenih učinkih zdravil in opravlja druge naloge v rokih in na način, ki jih določata 74. in 75. člen Direktive 2001/82/ES.
(3) Imetnik dovoljenja za promet z zdravilom ima stalno na razpolago osebo, odgovorno za sistem farmakovigilance, ki je odgovorna za vzpostavitev in vzdrževanje sistema farmakovigilance.
(4) Odgovorna oseba iz prejšnjega odstavka ima ustrezno izobrazbo, znanja in izkušnje s področja farmakovigilance ter prebiva in deluje na območju Evropske unije.
(5) Ustrezna izobrazba iz prejšnjega odstavka je pri zdravilih za uporabo v humani medicini izobrazba medicinske smeri druge stopnje oziroma raven izobrazbe, ki v skladu z zakonom ustreza tej stopnji, pri zdravilih za uporabo v veterinarski medicini pa izobrazba veterinarske smeri druge stopnje oziroma raven izobrazbe, ki v skladu z zakonom ustreza tej stopnji. Če odgovorna oseba za sistem farmakovigilance nima ustrezne izobrazbe, mora imeti stalno in neprekinjeno možnost pridobivanja strokovne podpore osebe, ki ima ustrezno izobrazbo.
(6) Če imetnik dovoljenja za promet z zdravilom nima sedeža v Republiki Sloveniji, lahko poleg odgovorne osebe določi tudi kontaktno osebo za farmakovigilanco v Republiki Sloveniji, ki ima izobrazbo medicinske, veterinarske ali farmacevtske smeri druge stopnje oziroma raven izobrazbe, ki v skladu z zakonom ustreza tej stopnji in je ustrezno usposobljena. Kontaktno osebo za farmakovigilanco imenuje tudi, če to zahteva JAZMP in o tem izda sklep. Kontaktna oseba je lahko poslovni subjekt s sedežem v Republiki Sloveniji ali posameznik s stalnim ali z začasnim prebivališčem v Republiki Sloveniji, ki izvaja farmakovigilančne dejavnosti za potrebe enega ali več poslovnih subjektov iz prvega in tretjega odstavka 20. člena tega zakona oziroma enega ali več poslovnih subjektov, ki so imetniki dovoljenja za vnos oziroma uvoz zdravil.
134. člen
(naloge JAZMP na področju farmakovigilance)
(1) JAZMP na področju farmakovigilance opravlja naslednje naloge:
– upravlja sistem farmakovigilance za opravljanje nalog farmakovigilance in sodeluje v farmakovigilančnih dejavnostih Evropske unije,
– preverja izvajanje sistema farmakovigilance pri imetnikih dovoljenj za promet z zdravili in drugih udeležencih v sistemu farmakovigilance.
(2) JAZMP za zdravila za uporabo v humani medicini, poleg nalog iz prejšnjega odstavka, opravlja tudi naslednje naloge:
– evidentira vse domnevne neželene učinke zdravil, na katere jo opozorijo zdravstveni delavci in pacienti ter ugotavlja in znanstveno ovrednoti vse informacije o varnosti zdravil, preuči možnosti za zmanjšanje in preprečevanje tveganj in ukrepa z namenom zmanjševanja in preprečevanja tveganj, povezanih z zdravili za uporabo v humani medicini,
– redno presoja sistem farmakovigilance,
– poroča o domnevnih neželenih učinkih zdravil v podatkovno bazo EudraVigilance,
– vzpostavi in vzdržuje spletni portal o zdravilih in obvešča javnost o vprašanjih farmakovigilance prek spletnega portala in drugih sredstev obveščanja,
– upravlja s sredstvi, namenjenimi za dejavnosti, ki so povezane s farmakovigilanco, delovanjem komunikacijskih mrež in inšpekcijski nadzor na področju farmakovigilance tako, da se zagotovi neodvisnost pri opravljanju teh dejavnosti,
– glede zdravil, odobrenih v skladu s tem zakonom, v sodelovanju z organi Evropske unije, spremlja izid ukrepov za zmanjševanje tveganj iz načrtov za obvladovanje tveganj in pogojev iz 58. člena tega zakona ter ocenjuje posodobitve sistemov obvladovanja tveganj,
– spremlja podatke glede zdravil v podatkovni bazi EudraVigilance z namenom ugotavljanja ali je prišlo do novih tveganj, ali so se tveganja spremenila in ali pri posameznem zdravilu vplivajo na razmerje med koristjo in tveganjem. Če je potrebno ukrepanje, ravna po nujnem postopku v skladu s 107.i do 107.k členom Direktive 2001/83/ES,
– pri izvajanju nalog farmakovigilance upošteva postopke, kot so podrobno opisani v izvedbenih ukrepih Evropske komisije v skladu s 108. členom Direktive 2001/83/ES in v smernicah o dobri praksi na področju farmakovigilance v skladu s 108.a členom Direktive 2001/83/ES.
(3) Za zdravila za uporabo v veterinarski medicini, poleg nalog iz prvega odstavka tega člena, JAZMP opravlja tudi naslednje naloge:
– ugotavlja in znanstveno ovrednoti vse neželene učinke zdravil za uporabo v veterinarski medicini in druga spoznanja o varnosti teh zdravil in ukrepa z namenom upravljanja in zmanjševanja tveganja, povezanega z zdravili za uporabo v veterinarski medicini ter druge naloge v skladu z 92., 93. in 94. členom Direktive 2001/82/ES,
– o farmakovigilančnih ukrepih, ki jih izvaja v primeru resnega ogrožanja zdravja živali in zdravja ljudi, obvešča organ, pristojen za veterinarstvo.
(4) JAZMP lahko zdravstvenim delavcem naloži posebne obveznosti za spodbujanje poročanja o domnevnih neželenih učinkih zdravil ali za zbiranje informacij in za nadaljnje spremljanje poročil o domnevnih neželenih učinkih bioloških zdravil.
135. člen
(prenos nalog)
(1) JAZMP lahko, kadar so zaradi izjemnih razsežnosti farmakovigilančnega problema preseženi njeni razpoložljivi viri, prenese katero od nalog iz svoje pristojnosti na področju farmakovigilance zdravil za uporabo v humani medicini, v delu ali v celoti, na eno od držav članic Evropske unije na podlagi njenega pisnega soglasja.
(2) O prenosu nalog iz prejšnjega odstavka JAZMP obvesti ministrstvo, pristojno za zdravje.
136. člen
(farmakovigilanca pri homeopatskih zdravilih)
Določbe 131. do 135. člena tega zakona se uporabljajo tudi za homeopatska zdravila, razen za homeopatska zdravila iz drugega odstavka 53. člena tega zakona. Minister lahko predpiše sistem farmakovigilance za ta homeopatska zdravila.
137. člen
(natančnejši pogoji in zahteve za delovanje sistema farmakovigilance)
Podrobnejše pogoje, načine in postopke za delovanje sistema farmakovigilance določi minister.
2. Neintervencijsko klinično preskušanje na zahtevo pristojnega organa
138. člen
(postopek pridobitve soglasja k osnutku protokola neintervencijskega kliničnega preskušanja)
(1) Imetnik dovoljenja za promet z zdravilom, ki na zahtevo JAZMP ali EMA izvaja neintervencijsko klinično preskušanje zdravila po pridobitvi dovoljenja za promet z zdravilom v skladu z 58. členom tega zakona, pred začetkom preskušanja pridobi pisno soglasje JAZMP k osnutku protokola, kadar poteka klinično preskušanje zdravila le v Republiki Sloveniji, ali odobritev pristojnega odbora pri EMA v skladu s 107.n do 107.q členom Direktive 2001/83/ES, kadar klinično preskušanje zdravila poteka v več državah članicah Evropske unije.
(2) Za neintervencijska klinična preskušanja zdravila iz prejšnjega odstavka imetnik dovoljenja za promet z zdravilom predloži osnutek protokola JAZMP, kadar se preskušanje izvaja le v Republiki Sloveniji, oziroma pristojnemu odboru pri EMA v skladu s 107.n do 107.q členom Direktive 2001/83/ES, kadar se klinično preskušanje zdravila izvaja tudi v drugi državi članici Evropske unije.
(3) JAZMP v 60 dneh od predložitve osnutka protokola iz prejšnjega odstavka izda:
– sklep o soglasju k osnutku protokola iz prvega odstavka tega člena, ali
– sklep o nasprotovanju osnutku protokola z navedbo razlogov za nasprotovanje, če:
1. ugotovi, da izvajanje neintervencijskega kliničnega preskušanja pospešuje predpisovanje in porabo zdravila,
2. ugotovi, da načrt neintervencijskega kliničnega preskušanja ne zagotavlja doseganja ciljev preskušanja,
ali
– sklep o ugotovitvi, da je neintervencijsko klinično preskušanje zdravila v skladu s 33. do 40. členom tega zakona.
(4) Podrobnejše pogoje za pridobitev soglasja k osnutku protokola za neintervencijsko klinično preskušanje o varnosti ali učinkovitosti zdravila za uporabo v humani medicini po pridobitvi dovoljenja za promet z zdravilom določi minister.
3. Ukrepi pri neustrezni kakovosti zdravil in ukrepi v farmakovigilančnih primerih
139. člen
(ukrepi pri neustrezni kakovosti zdravil)
(1) Poslovni subjekti, ki proizvajajo zdravila ali opravljajo promet z zdravili, o neustrezni kakovosti zdravil, ki lahko vpliva na varnost ali učinkovitost zdravila, ali sumu nanjo, obvestijo JAZMP, imetnika dovoljenja za promet z zdravilom in poslovni subjekt, ki opravlja promet s temi zdravili.
(2) Imetnik dovoljenja iz 20. člena tega zakona umakne oporečno zdravilo iz prometa oziroma izvede druge potrebne ukrepe in o svojih aktivnostih sproti in brez odlašanja obvešča JAZMP.
(3) Imetnik dovoljenja iz 20. člena tega zakona takoj obvesti pristojne organe držav članic Evropske unije, v katerih je zdravilo v prometu, o vseh ukrepih glede umika zdravila iz prometa ali začasnega odvzema oziroma odvzema dovoljenja za promet z zdravilom, skupaj z razlogi za tako ukrepanje, če so ukrepi povezani z učinkovitostjo zdravila ali varovanjem javnega zdravja.
(4) JAZMP spremlja in po potrebi usmerja aktivnosti imetnika dovoljenja za promet z zdravilom v zvezi z ukrepi v primerih neustrezne kakovosti zdravil in o ugotovitvah v skladu s sistemom hitrega obveščanja obvešča organe, pristojne za zdravila držav članic Evropske unije in organe Evropske unije ter po potrebi organe tretjih držav.
(5) JAZMP takoj obvesti EMA, če gre za ukrepe, ki lahko vplivajo na varovanje javnega zdravja v državah članicah Evropske unije, po potrebi pa tudi Svetovno zdravstveno organizacijo.
(6) Podrobnejši postopek ukrepanja ob neustrezni kakovosti zdravil določi minister.
140. člen
(ukrepi v farmakovigilančnih primerih)
(1) Določbe prejšnjega člena se smiselno uporabljajo tudi v primerih nastanka povečanega tveganja zaradi neželenih učinkov, ki lahko ogrozijo zdravje ljudi ali živali oziroma vplivajo na oceno razmerja med koristjo in tveganjem zdravila ter zahtevajo obveščanje v skladu s sistemom hitrega obveščanja organov, pristojnih za zdravila držav članic Evropske unije in organov Evropske unije.
(2) Podrobnejši postopek ukrepanja v primerih iz prejšnjega odstavka določi minister.
XIII. ZAGOTAVLJANJE ZDRAVIL V IZJEMNIH RAZMERAH IN DONIRANJE
141. člen
(zagotavljanje zdravil v izrednih razmerah)
(1) Zdravila, ki jih na predlog ministra Republika Slovenija zagotovi iz proračunskih sredstev v skladu z zakonom, ki ureja blagovne rezerve v primeru naravnih in drugih nesrečah večjega obsega ter vojn, se zagotavljajo, če rok uporabnosti zdravila omogoča uporabo zdravila pred njegovim iztekom in:
– če ima zdravilo dovoljenje za promet ali začasno dovoljenje za promet v Republiki Sloveniji,
– če zdravilo nima dovoljenja za promet v Republiki Sloveniji, ima pa dovoljenje za promet v drugi državi članici Evropske unije, ali
– če zdravilo nima dovoljenja za promet v nobeni državi članici Evropske unije, ima pa dovoljenje za promet v tretji državi, ki ima enake zahteve glede kakovosti, varnosti in učinkovitosti zdravil in ga spremlja izvid o analizi kakovosti zdravila.
(2) Odgovornost za škodo, ki nastane zaradi neustrezne kakovosti zdravila iz prejšnjega odstavka, nosi imetnik dovoljenja za promet z zdravilom, kadar je škoda posledica njegovega ravnanja, kadar pa škoda nastane v prometu z zdravilom, pri vročanju oziroma razdeljevanju zdravila, nosi odgovornost za škodo poslovni subjekt, ki te aktivnosti izvaja.
(3) Če je zdravilo iz prvega odstavka tega člena zagotovljeno končnemu uporabniku, ki je posameznik, stroške zdravstvenih storitev predpisa, izdaje v lekarni ali vročitve oziroma aplikacije zdravila s strani izvajalca zdravstvene dejavnosti, izvedenih v skladu z navodilom iz osmega odstavka 141. člena tega zakona, krije nosilec OZZ in mu jih Republika Slovenija povrne iz proračunskih sredstev.
(4) Nosilec OZZ spremlja in beleži predpisovanje in vročanje zdravil iz prvega odstavka tega člena, ki se v skladu z navodilom iz osmega odstavka tega člena vročajo v lekarni, ter pripravlja finančne analize in poročila o predpisanih in vročenih zdravilih končnim uporabnikom. Za potrebe priprave finančnih analiz in poročil o predpisanih in vročenih zdravili iz prvega odstavka tega člena nosilec OZZ uporablja naslednje podatke:
– osebne podatke končnih uporabnikov, ki so zavarovane osebe, iz evidenc nosilca OZZ (identifikacijska številka (ZZZS številka) v skladu s predpisi o zdravstvenem varstvu in zdravstvenem zavarovanju, ime in priimek, spol, leto rojstva, stalno ali začasno prebivališče zavarovane osebe) in osebne podatke iz centralnega registra prebivalcev (enotna matična številka),
– osebne podatke končnih uporabnikov, ki so nezavarovane osebe in so državljani Republike Slovenije, iz centralnega registra prebivalcev (enotno matično številko, ime in priimek, leto rojstva, spol, stalno ali začasno prebivališče),
– osebne podatke iz osebnega dokumenta končnih uporabnikov, za osebe, ki niso državljani Republike Slovenije, in niso zavarovane osebe (ime in priimek, državljanstvo, leto rojstva, spol, stalno ali začasno prebivališče),
– podatke upravljavca zbirke podatkov, v skladu z zakonom, ki ureja zbirke podatkov s področja zdravstvenega varstva, o porabi zdravil, izvajalcih zdravstvene dejavnosti in izvajalcih lekarniške dejavnosti.
(5) Nosilec OZZ uporablja enotno matično številko za povezovanje podatkov končnih uporabnikov iz prve in druge alineje prejšnjega odstavka kot povezovalnega podatka za zbiranje, obdelovanje in posredovanje podatkov o predpisanih in vročenih zdravilih iz prvega odstavka tega člena, v skladu z navodilom ministra iz osmega odstavka tega člena.
(6) Nosilec OZZ pripravlja finančne analize in poročila o predpisanih in vročenih zdravilih iz prvega odstavka tega člena na podlagi pridobljenih podatkov iz prejšnjega odstavka, v skladu z navodilom iz osmega odstavka tega člena ter jih posreduje JAZMP, ministrstvu, pristojnemu za zdravje, ter v primerih izvajanj zaščitnih ukrepov tudi pooblaščeni instituciji za izvajanje določenega zaščitnega ukrepa.
(7) Poslovni subjekt, ki izvaja vročanje in razdeljevanje zdravila izven lekarne oziroma aplikacijo zdravila v skladu z navodilom iz osmega odstavka tega člena, poroča o vročenih zdravilih oziroma apliciranih zdravilih iz prvega odstavka tega člena JAZMP, ministrstvu, pristojnemu za zdravje ter v primerih izvajanj zaščitnih ukrepov tudi pooblaščeni instituciji za izvajanje določenega zaščitnega ukrepa v skladu z navodilom ministra iz osmega odstavka tega člena.
(8) Minister z navodilom določi način predpisovanja in vročanja oziroma aplikacije posameznega zdravila iz prvega odstavka tega člena končnim uporabnikom v lekarni oziroma na drugem mestu vročanja oziroma aplikacije zdravil ter obliko in vsebino finančnih analiz in poročil o predpisanih in vročenih oziroma apliciranih zdravilih iz prvega odstavka tega člena ter način posredovanja analiz in poročil JAZMP, ministrstvu, pristojnemu za zdravje, v primeru izvajanja zaščitnih ukrepov pa tudi pooblaščeni instituciji za izvajanje določenega zaščitnega ukrepa.
142. člen
(poslovna donacija zdravil in zagotavljanje zdravil za namen jodne profilakse)
(1) Poslovna donacija zdravil je namensko in brezpogojno darilo, ki ga poslovni subjekt brezplačno daje izvajalcu zdravstvene dejavnosti na podlagi njegove izražene in utemeljene potrebe po zdravilu, ki je predmet poslovne donacije in ga potrebuje za izvajanje zdravstvene dejavnosti.
(2) Prejemnik poslovne donacije je lahko izvajalec zdravstvene dejavnosti, ki je financiran iz javnih sredstev. Če je prejemnik poslovne donacije zdravil izvajalec zdravstvene dejavnosti, ki ima organizirano bolnišnično lekarno, morajo biti zdravila, ki so predmet poslovne donacije, prevzeta in evidentirana v tej bolnišnični lekarni.
(3) Prejemnik poslovne donacije ne sme biti lekarna, ki je samostojni poslovni subjekt.
(4) Poslovno doniranje ni dovoljeno za zdravila, ki so namenjena sočutni uporabi v skladu s tem zakonom.
(5) Poslovno donirana zdravila ne smejo biti predmet nadaljnje prodaje.
(6) Donator je poslovni subjekt oziroma posameznik, ki krije stroške doniranega zdravila, vključno s stroški prometa z zdravilom na debelo.
(7) Poslovno doniranje zdravila, za katerega je izvajalec zdravstvene dejavnosti izrazil in utemeljil potrebo, je dovoljeno:
– če so izpolnjeni pogoji iz tretjega odstavka 143. člena tega zakona,
– če je na zunanji ovojnini doniranega zdravila jasno označeno, da gre za donirano zdravilo,
– če donator zdravila poda izjavo, na podlagi katere se obvezuje, da bo zdravilo zagotavljal po zaključku programa poslovne donacije še eno leto vsem pacientom, vključenim v program donacije, pri katerih je dokumentirana korist zdravljenja s tem zdravilom, tudi če za ta zdravila po zaključku s programom donacije predvidenega obdobja oskrbe z doniranim zdravilom ne bodo zagotovljena javna sredstva za financiranje zdravila,
– če je donacija priglašena JAZMP in nosilcu OZZ ter je informacija o donaciji objavljena na njunih spletnih straneh.
(8) Poslovna donacija ne sme spodbujati k pospeševanju predpisovanja, izdajanja, prodaje ali uporabe zadevnega zdravila pri izvajalcih zdravstvene dejavnosti, financirane iz javnih sredstev oziroma zdravila, ki je bilo v postopku razvrščanja na listo ali vključitve v javno financirane zdravstvene programe zavrnjeno.
(9) Pri zdravilih, vključenih v postopke javnega naročanja, poslovno doniranje ne sme vplivati na potek teh postopkov, na njihove izide in na naročnikovo porabo izbranih zdravil v izvedbenem obdobju.
(10) Ne glede na prejšnji odstavek poslovno doniranje izvajalcu zdravstvene dejavnosti ni dovoljeno za zdravila, ki so predmet javnega naročanja in obdobje javnega naročanja še ni zaključeno.
(11) Donator mora priglasiti poslovno donacijo na JAZMP za zdravila:
– iz druge alineje prvega odstavka 143. člena tega zakona, na podlagi vloge, ki vključuje izraženo in utemeljeno potrebo prejemnika donacije,
– za katera dobavitelj, ki je izbran v postopku javnega naročanja zdravil, ne zagotavlja potrebnih količin zdravila.
(12) Tablete kalijevega jodida za območje polmera 10 km okrog NEK za namen izvajanja zaščitnega ukrepa jodne profilakse zagotavlja NEK in financira vse zdravstvene storitve predpisovanja in izdajanja zdravila v lekarnah oziroma na drugem mestu vročanja v skladu z navodilom iz osmega odstavka 141. člena tega zakona, ki so povezane s tem zaščitnim ukrepom. Za zaščitni ukrep jodne profilakse se uporabljajo četrti do osmi odstavek 141. člena tega zakona.
(13) Aktivnosti prometa z zdravili na debelo, ki se nanašajo na donirana zdravila ter na zdravila iz prejšnjega odstavka, lahko opravljajo veletrgovci z zdravili in priglašeni veletrgovci s sedežem v Evropski uniji.
(14) Podrobnejši način zagotavljanja tablet kalijevega jodida za namen izvajanja zaščitnega ukrepa jodne profilakse na celotnem območju Republike Slovenije predpiše minister.
143. člen
(merila za zagotavljanje zdravil iz proračunskih sredstev ter za poslovno doniranje zdravil)
(1) Zagotavljanje zdravil iz proračunskih sredstev in poslovno doniranje zdravil je dovoljeno:
– v primeru naravnih in drugih nesreč velikih razsežnostih (jedrska in ekološke nesreče, terorizem in industrijske nesreče) ali drugih izrednih razmer ali v primeru izvajanja obvladovanja groženj zdravju (ob nesrečah večjih razsežnosti, ogrožajočih infekcijah, epidemijah, pandemijah, zastrupitvah, ionizirajočih sevanjih, vključno z zaščito pred njimi in podobno) ali iz drugih razlogov, ki so v interesu varovanja javnega zdravja oziroma drugih okoliščin, ki ogrožajo javno zdravje in zdravje živali,
– če zdravilo, ki je predmet donacije, predstavlja pomembno terapevtsko, znanstveno in tehnično inovacijo.
(2) Določbe prejšnjega odstavka se nanašajo na zdravila, ki jim njihov rok uporabnosti omogoča uporabo pred njegovim iztekom.
(3) Zagotavljanje zdravil iz proračunskih sredstev in poslovno doniranje zdravil je v primerih iz prve alineje prvega odstavka tega člena dovoljeno ob izraženi potrebi Vlade Republike Slovenije oziroma prejemnika poslovne donacije iz drugega odstavka prejšnjega člena:
– če ima zdravilo dovoljenje za promet ali začasno dovoljenje za promet v Republiki Sloveniji,
– če zdravilo nima dovoljenja za promet v Republiki Sloveniji, ima pa dovoljenje za promet v drugi državi članici Evropske unije,
– če zdravilo nima dovoljenja za promet v nobeni državi članici Evropske unije, ima pa dovoljenje za promet v tretji državi, ki ima enake zahteve glede kakovosti, varnosti in učinkovitosti zdravil in ga spremlja izvid o analizi kakovosti zdravila.
(4) Uvoz zdravil, ki so predmet zagotavljanja iz proračunskih sredstev oziroma poslovne donacije, opravljajo poslovni subjekti, ki imajo dovoljenje za proizvodnjo zdravil, ki vključuje aktivnost uvoza.
(5) Odgovornost za škodo, ki nastane zaradi neustrezne kakovosti zdravila, ki je predmet zagotavljanja iz proračunskih sredstev oziroma poslovne donacije, nosi imetnik dovoljenja za promet z zdravilom, kadar je škoda posledica njegovega ravnanja. Kadar škoda nastane v distribuciji zdravila, nosi odgovornost za škodo distributer zdravila.
(6) Postopek izdaje soglasja k donacijam zdravil, vsebino vloge, dokumentacijo, natančnejša merila za izdajo soglasja k donaciji zdravil, natančnejše pogoje o vsebini, postopku priglasitve in objave iz četrte alineje sedmega odstavka prejšnjega člena določi minister.
144. člen
(humanitarna pomoč v obliki zdravil)
(1) Vlada Republike Slovenije je lahko prejemnica humanitarne pomoči iz drugih držav Evropske unije ali iz tretjih držav v obliki zdravil:
– v primeru naravnih ali drugih nesreč večjih razsežnosti (jedrska in ekološke nesreče, terorizem in industrijske nesreče),
– v primeru izvajanja obvladovanja groženj zdravju (ogrožajoče infekcije, epidemije, pandemije, množične zastrupitve, sevanja – ionizirajoče in podobno) ali
– v drugih izrednih razmerah, ki ogrožajo javno zdravje in zdravje živali.
(2) Če je zdravilo iz prejšnjega odstavka zagotovljeno končnemu uporabniku, ki je posameznik, stroške zdravstvenih storitev predpisa, izdaje v lekarni ali vročitve oziroma aplikacije zdravila s strani izvajalca zdravstvene dejavnosti izvedenih v skladu z navodilom iz osmega odstavka 141. člena tega zakona krije nosilec OZZ in mu jih Republika Slovenija povrne iz proračunskih sredstev.
(3) Vlada Republike Slovenije lahko izvede humanitarno pomoč v obliki zdravil prejemnikom v drugih državah članicah Evropske unije ali v tretjih državah. Humanitarna pomoč v obliki zdravil je namensko brezpogojno darilo, ki ga Vlada Republike Slovenije brezplačno daje prejemniku donacije, ki je druga država, nacionalna ali mednarodna vladna oziroma nevladna organizacija, ali mednarodna humanitarna organizacija, ki na ozemlju druge države ravna v skladu s humanitarnimi načeli in konvencijami, na podlagi izražene potrebe in je podarjeno brez zahteve po povratnih ugodnostih.
(4) Vlada Republike Slovenije krije stroške humanitarne pomoči in stroške njene dostave prejemniku iz prejšnjega odstavka.
(5) Humanitarna pomoč iz tretjega odstavka tega člena je dovoljena v primeru naravnih nesreč velikih razsežnosti ali drugih izrednih razmer, kot so vojna, teroristični napadi in drugo, kjer je ogroženo zdravje in življenje ljudi in če rok uporabnosti zdravila omogoča uporabo zdravila pred njegovim iztekom.
(6) Za namen izvedbe humanitarne pomoči iz tretjega odstavka tega člena, ministrstvo, pristojno za zunanje zadeve, v sodelovanju z ministrstvom, pristojnim za zdravje, izvede javno naročilo za nakup zdravil za namen humanitarne pomoči in pooblasti veletrgovca z zdravili za iznos oziroma izvoz zdravil oziroma dostavo zdravil prejemniku humanitarne pomoči.
(7) Aktivnosti prometa z zdravili, ki se nanašajo na humanitarno pomoč iz prvega in tretjega odstavka tega člena, izvedejo lahko poslovni subjekti, ki imajo dovoljenje za opravljanje dejavnosti prometa z zdravili na debelo in priglašeni veletrgovci z zdravili s sedežem v Evropski uniji.
(8) Za financiranje predpisovanja, vročanja, razdeljevanja oziroma aplikacije iz prvega odstavka tega člena ter za evidentiranje in poročanje o predpisanih, vročenih, razdeljenih oziroma apliciranih zdravilih se smiselno uporabljajo določila tretjega do osmega odstavka 141. člena tega zakona.
145. člen
(odprodaja zdravil iz državnih blagovnih rezerv)
Vlada Republike Slovenije lahko v izjemnih primerih odproda del zdravil iz blagovnih rezerv drugim državam članicam Evropske unije ali tretjim državam, če je v teh državah ogroženo zdravje in življenje ljudi ali živali na podlagi izražene potrebe zadevne države, če to ne povečuje tveganja za javno zdravje in zdravje živali na ozemlju Republike Slovenije in če rok uporabnosti zdravila omogoča porabo pred njegovim iztekom.
XIV. OGLAŠEVANJE ZDRAVIL
146. člen
(oglaševanje zdravil)
Oglaševanje zdravil so vse oblike obveščanja, vključno z obveščanjem od vrat do vrat, propagiranjem ali spodbujanjem, ki je namenjeno pospeševanju predpisovanja, izdajanja, prodaje ali uporabe zdravil.
147. člen
(pogoji oglaševanja)
(1) Imetniki dovoljenj za promet z zdravilom lahko oglašujejo zdravila v skladu s tem zakonom in na njegovi podlagi sprejetimi predpisi.
(2) Prepovedano je oglaševanje zdravil, ki nimajo dovoljenja za promet z zdravilom.
(3) Vsi elementi oglaševanja morajo biti skladni s povzetkom glavnih značilnosti zdravila.
(4) Oglaševanje zdravil mora spodbujati smotrno uporabo zdravil, pri čemer mora biti zdravilo predstavljeno objektivno in brez pretiravanja o njegovih lastnostih, prav tako ne sme biti zavajajoče.
148. člen
(oglaševanje v širši javnosti)
(1) V širši javnosti je dovoljeno oglaševati le zdravila, ki se izdajajo brez recepta.
(2) V širši javnosti je prepovedano oglaševanje zdravil:
– ki se izdajajo le na zdravniški ali veterinarski recept;
– ki vsebujejo psihotropne ali narkotične snovi iz mednarodnih konvencij, kakor sta Enotna konvencija Združenih narodov o mamilih iz leta 1961 in Konvencija Združenih narodov o psihotropnih snoveh iz leta 1971 in zdravila iz predpisa, ki ureja razvrščanje prepovedanih drog;
– za uporabo v veterinarski medicini, ki se lahko uporabljajo kot pospeševalci rasti ali spodbujevalci proizvodnosti (npr. hormoni, beta-agonisti, tireostatiki, goveji somatropini).
(3) Oglaševanje zdravila, za izdajo katerega zdravniški recept ni potreben, v širši javnosti ne sme vsebovati podatkov, ki:
– dajejo vtis, da sta posvet z zdravnikom oziroma veterinarjem ali kirurški poseg nepotrebna, zlasti s pripisovanjem diagnoze ali predlogom zdravljenja po pošti;
– nakazujejo, da so učinki jemanja zdravila zagotovljeni, da zdravilo nima neželenih učinkov ali da je boljše kakor ali enakovredno drugemu zdravljenju ali drugemu zdravilu;
– nakazujejo, da se zdravje osebe ali živali lahko izboljša le zaradi jemanja oglaševanega zdravila;
– nakazujejo, da bi se zdravje osebe ali živali lahko brez jemanja oglaševanega zdravila poslabšalo. Ta prepoved se ne uporablja za programe cepljenja;
– so usmerjeni izključno ali pretežno k otrokom;
– se sklicujejo na priporočila znanstvenikov, zdravstvenih strokovnjakov ali v javnosti znanih oseb, ki bi zaradi svojega medijskega vpliva lahko spodbujali porabo zdravila;
– nakazujejo, da je zdravilo živilo, kozmetični ali drugi izdelek;
– nakazujejo, da sta varnost in učinkovitost posledica naravnega izvora zdravila;
– bi zaradi opisa ali podrobne predstavitve anamneze lahko privedli do napačne samodiagnoze;
– uporabljajo neprimerne, vznemirljive ali zavajajoče izraze o možnostih okrevanja ali
– uporabljajo neprimerne, skrb vzbujajoče ali zavajajoče izraze, slikovne predstavitve sprememb v človeškem ali živalskem telesu, ki jih je povzročila bolezen ali poškodba, ali delovanje zdravila na človeško ali živalsko telo ali dele telesa.
(4) Prepovedano je neposredno razdeljevanje zdravil v promocijske namene končnim uporabnikom zdravil, zdravstvenim delavcem in izvajalcem zdravstvene dejavnosti.
(5) Ne glede na določbe prvega odstavka tega člena lahko JAZMP dovoli proizvajalcem zdravil opravljanje kampanj za cepljenja s potrebnimi podatki o cepivih, ki so v programu cepljenja in zaščite z zdravili, ob smiselnem upoštevanju določb tega člena na podlagi mnenja institucije, pooblaščene za pripravo programov za preprečevanje, obvladovanje, odstranitev (eliminacijo) in izkoreninjenje (eradikacijo) nalezljivih bolezni o možnostih cepljenja proti posameznim boleznim.
(6) Podrobnejše pogoje in način oglaševanja zdravil v širši javnosti določi minister.
149. člen
(oglaševanje strokovni javnosti)
(1) Imetniki dovoljenja za promet z zdravilom lahko oglašujejo zdravila, ki so pridobila dovoljenje za promet, strokovni javnosti v strokovnih publikacijah in z neposrednim obveščanjem oseb, ki so pooblaščene za predpisovanje ali izdajanje zdravil, in izjemoma z dajanjem vzorcev.
(2) Ne glede na prejšnji odstavek lahko imetniki dovoljenja za promet z zdravilom o zdravilu, za katerega je iz dovoljenja za promet ali iz pooblastila izvajalca zdravstvenih programov razvidno, da je za njegov varen in pravilen način dajanja nujno potrebno informiranje ali usposabljanje pacienta v okviru zdravstvene nege ali usposabljanje zdravstvenih delavcev, ki opravljajo zdravstveno nego, z neposrednim obveščanjem informirajo oziroma usposabljajo te zdravstvene delavce.
(3) Oglaševanje zdravil z neposrednim obveščanjem oseb, ki so pooblaščene za predpisovanje ali izdajanje zdravil oziroma zdravstvenih delavcev iz prejšnjega odstavka, ki jo opravljajo v okviru mreže javne zdravstvene službe, se lahko izvaja le v času strokovne priprave za delo, ki ni namenjen za neposredno delo s pacienti.
(4) Imetnik dovoljenja za promet z zdravilom mora:
– voditi seznam strokovnih sodelavcev, ki oglašujejo zdravila z neposrednim obveščanjem oseb, ki so pooblaščene za predpisovanje in izdajanje zdravil in oseb iz drugega odstavka tega člena, ki vsebuje tudi podatke o njihovi izobrazbi,
– voditi evidenco oglaševanja in komuniciranja iz prejšnjega odstavka,
– seznam iz prve alineje in evidenco iz prejšnje alineje posredovati JAZMP za namen izvajanja strokovnega nadzora, ki se izvaja v okviru farmacevtskega nadzorstva v skladu z zakonom.
(5) Določbe tretjega in četrtega odstavka tega člena se ne uporabljajo za oglaševanje zdravil z neposrednim obveščanjem oseb, ki opravljajo veterinarsko dejavnost.
(6) Pri oglaševanju zdravil strokovni javnosti je prepovedano dajati, ponujati ali obljubljati darila, finančne ugodnosti ali materialne koristi osebam, usposobljenim za predpisovanje ali izdajanje zdravil in osebam iz drugega odstavka tega člena, razen če so te male vrednosti in se lahko uporabljajo za opravljanje zdravstvene, veterinarske ali lekarniške dejavnosti. Vrednosti daril, finančnih ugodnosti ali materialnih koristi male vrednosti ne smejo presegati vrednosti, določenih za javne uslužbence.
(7) Organizacija, izvedba in gostoljubnost promocijskih srečanj so omejena na strokovni namen srečanja, ki je v pridobivanju dodatnih znanj o novih zdravilih, deležne pa jih smejo biti le osebe, pooblaščene za predpisovanje in izdajanje zdravil ter osebe iz drugega odstavka tega člena.
(8) Imetniki dovoljenja za promet z zdravilom, proizvajalci zdravil, poslovni subjekti, ki nastopajo v imenu proizvajalcev in tistih, ki opravljajo promet z zdravili, ter podružnice tujih proizvajalcev zdravil lahko omogočajo osebam, ki predpisujejo in izdajajo zdravila ter osebam iz drugega odstavka tega člena pridobivanje dodatnih znanj o novih zdravilih na znanstvenih in strokovnih srečanjih, vendar le v skladu z omejitvami iz šestega in sedmega odstavka tega člena.
(9) Osebe, pooblaščene za predpisovanje ali izdajanje zdravil ter osebe iz drugega odstavka tega člena, ne smejo sprejemati ali poskušati pridobiti kakršnihkoli materialnih koristi, ki so prepovedane na podlagi šestega in sedmega odstavka tega člena.
(10) Imetnik dovoljenja za promet z zdravilom ima vzpostavljeno strokovno službo za oglaševanje zdravil s strokovnimi sodelavci za oglaševanje zdravil pri osebah, ki predpisujejo ali izdajajo zdravila in pri osebah iz drugega odstavka tega člena. Strokovni sodelavci za zdravila imajo izobrazbo farmacevtske, medicinske, veterinarske smeri druge stopnje oziroma raven izobrazbe, ki v skladu z zakonom ustreza tej stopnji ali izobrazbo drugih smeri druge stopnje oziroma raven izobrazbe, ki v skladu z zakonom ustreza tej stopnji, v katerih so v skladu z veljavno klasifikacijo poklicev razvidna znanja o delovanju človeškega ali živalskega organizma ter dodatna znanja s področja zdravil in so vpisani v register strokovnih sodelavcev za oglaševanje zdravil pri JAZMP. Strokovni sodelavci za zdravila, ki se lahko izdajajo tudi v specializiranih prodajalnah, imajo najmanj srednjo strokovno izobrazbo farmacevtske smeri, ki izpolnjuje pogoje iz 1. točke prvega odstavka 127. člena tega zakona.
(11) Podrobnejše pogoje in način oglaševanja zdravil strokovni javnosti določi minister.
150. člen
(register strokovnih sodelavcev za oglaševanje zdravil)
(1) Imetniki dovoljenja za promet z zdravilom morajo pred začetkom oglaševanja zdravil pri JAZMP priglasiti strokovne sodelavce za oglaševanje zdravil za vpis v register strokovnih sodelavcev za oglaševanje zdravil, ki ga vodi JAZMP. JAZMP objavi podatke iz registra v skladu s predpisi, ki urejajo področje varovanja osebnih podatkov.
(2) Priglasitev za vpis v register iz prejšnjega odstavka vsebuje podatke o imenu in naslovu imetnika dovoljenja za promet z zdravilom ter imenu, priimku in strokovni izobrazbi strokovnega sodelavca za oglaševanje zdravil.
(3) Imetnik dovoljenja za promet z zdravilom vsako spremembo strokovnih sodelavcev za oglaševanje zdravil sporoči JAZMP.
(4) JAZMP izbriše iz registra strokovnih sodelavcev za oglaševanje zdravil strokovnega sodelavca na predlog imetnika dovoljenja za promet z zdravilom.
(5) Strokovni sodelavec za oglaševanje zdravil se pri izvajalcu zdravstvene, veterinarske in lekarniške dejavnosti izkaže s potrdilom o vpisu v register iz prvega odstavka tega člena.
(6) Podrobnejšo vsebino vloge, način in postopek za vpis, spremembo in izbris iz registra strokovnih sodelavcev za oglaševanje zdravil ter natančnejšo vsebino registra strokovnih sodelavcev za oglaševanje zdravil določi minister.
151. člen
(oglaševanje v izjemnih razmerah)
(1) Minister lahko izjemoma, če je to v javnem interesu zaradi preprečevanja epidemij in epizootij ter ob naravnih ali drugih nesrečah in izrednih dogodkih, dovoli obveščanje o uporabi določenih zdravil v javnih glasilih.
(2) V primerih iz prejšnjega odstavka, ki se nanašajo na zdravila za uporabo v veterinarski medicini, minister dovoli obveščanje o uporabi določenih zdravil v javnih glasilih v soglasju z ministrom, pristojnim za veterinarstvo.
152. člen
(izključitev iz obsega oglaševanja zdravil)
(1) Za oglaševanje oziroma oglaševalska gradiva se, pod pogojem, da niso namenjena pospeševanju predpisovanja, izdajanja ali uporabe zdravil, ne štejejo naslednje aktivnosti:
– informacije o zdravilu: povzetek glavnih značilnosti zdravila, ovojnina in navodilo za uporabo zdravila, odobreni v dovoljenju za promet z zdravilom, ki jih lahko dobi pacient na njegovo zahtevo,
– gradivo, ki ga odobri JAZMP v okviru načrta za obvladovanje tveganj,
– informativne objave v zvezi z odobrenimi spremembami na ovojnini, opozorila o neželenih učinkih in drugi splošni previdnostni ukrepi z namenom varnejše in učinkovitejše uporabe zdravila,
– prodajni katalogi in ceniki, ki ne vključujejo navedb o lastnostih zdravila,
– korespondenca o specifičnih vprašanjih glede določenega zdravila, vključno s priloženimi gradivi, ki niso promocijske narave,
– objave in gradiva institucije, pooblaščene za pripravo programov za preprečevanje, obvladovanje, odstranitev (eliminacijo) in izkoreninjenje (eradikacijo) nalezljivih bolezni o možnostih cepljenja proti posameznim boleznim,
– informacije v zvezi z zdravjem ljudi ali boleznimi, pod pogojem, da ni nobenega napotila, tudi posrednega ne, na zdravila.
(2) Vsi podatki, povezani z zdravilom, morajo biti kakovostni, objektivni, nepristranski, nedvoumni, celoviti, uravnoteženi, pacientom, zdravstvenim delavcem in izvajalcem zdravstvene dejavnosti razumljivi, preverljivi, posodobljeni, zanesljivi, točni, čitljivi, nezavajajoči in ne smejo vsebovati prvin neposrednega ali prikritega oglaševanja.
(3) Podrobnejše pogoje za obveščanje, povezano z zdravili, ki je izključeno iz obsega oglaševanja zdravil, določi minister.
XV. URADNA KONTROLA KAKOVOSTI ZDRAVIL
153. člen
(uradni kontrolni laboratorij)
(1) Naloge uradnega kontrolnega laboratorija, ki je vključen v Evropsko mrežo uradnih kontrolnih laboratorijev pri Evropskem direktoratu za kakovost zdravil (v nadaljnjem besedilu: EDQM), opravlja Nacionalni laboratorij za zdravje, okolje in hrano (v nadaljnjem besedilu: NLZOH), v skladu z dovoljenjem iz tretjega odstavka 30. člena tega zakona.
(2) NLZOH mora izpolnjevati zahteve standarda ISO 17025 ter se vključevati v medlaboratorijsko preverjanje usposobljenosti in periodične presoje sistema kakovosti, ki jih izvaja EDQM.
154. člen
(vrste uradnih kontrol)
(1) Vrste uradnih kontrol kakovosti zdravila so:
– redna kontrola kakovosti zdravil v prometu, ki se opravlja po uradni dolžnosti praviloma enkrat na pet let za vsako farmacevtsko obliko in jakost zdravila, razen če JAZMP na podlagi ocene tveganja, ne določi drugače. Redna kontrola kakovosti zdravil v prometu, ki so pridobila dovoljenje za promet po centraliziranem postopku, se opravlja po letnem programu, ki ga sprejme EMA v sodelovanju z EDQM,
– izredna kontrola kakovosti zdravil, ki se opravlja na zahtevo farmacevtskega inšpektorja v primeru suma na neustrezno kakovost ali ponarejanje zdravila,
– posebna kontrola kakovosti zdravil, ki jo pred dajanjem v promet zagotovijo imetniki dovoljenj iz prvega odstavka 20. člena tega zakona, razen imetnikov dovoljenj za sočutno uporabo zdravil, in imetniki dovoljenj iz prve, druge, tretje, četrte in pete alineje tretjega odstavka 20. člena tega zakona za vsako serijo cepiv, serumov in krvnih izdelkov človeškega izvora ter imunoloških zdravil za uporabo v veterinarski medicini, namenjenih diagnosticiranju stanja imunosti,
– kontrola kakovosti zdravil v okviru postopka za pridobitev dovoljenja za promet z zdravilom ali paralelno uvoženim zdravilom, ki se izvede na zahtevo JAZMP.
(2) Za izvajanje redne in izredne kontrole kakovosti zdravil imetnik dovoljenja iz prvega odstavka 20. člena tega zakona zagotovi potrebno dokumentacijo in referenčne materiale v 30 dneh od prejema zahteve NLZOH, razen če JAZMP ne določi drugače.
155. člen
(izvid o kontroli kakovosti zdravila)
(1) NLZOH o izvedeni kontroli kakovosti zdravil izda izvid o kontroli kakovosti zdravila in ga posreduje imetniku dovoljenja za promet z zdravilom, imetniku dovoljenja za paralelni uvoz zdravila, imetniku začasnega dovoljenja za promet z zdravilom oziroma predlagatelju kontrole kakovosti zdravila in JAZMP.
(2) Stroške uradne kontrole kakovosti zdravil nosi:
– pri redni kontroli kakovosti zdravil, imetnik dovoljenja za promet z zdravilom oziroma imetnik dovoljenja za promet s paralelno uvoženim zdravilom ali imetnik začasnega dovoljenja za promet z zdravilom,
– pri izredni kontroli kakovosti zdravil za zdravila z dovoljenjem za promet, imetnik dovoljenja za promet oziroma imetnik dovoljenja za promet s paralelno uvoženim zdravilom, za zdravila z začasnim dovoljenjem za promet pa imetnik začasnega dovoljenja za promet z zdravilom, če se izkaže, da je kakovost zdravila neustrezna. Če je bila kontrola kakovosti zdravila opravljena zaradi suma na ponarejenost zdravila, krije stroške izredne kontrole kakovosti poslovni subjekt, ki je dal zdravilo v promet. Če se izkaže, da je kakovost zdravila ustrezna ali da zdravilo ni ponarejeno, se stroški izredne kontrole kakovosti poslovnemu subjektu vrnejo iz proračuna Republike Slovenije,
– pri posebni kontroli kakovosti zdravil, predlagatelj posebne kontrole kakovosti iz tretje alineje prvega odstavka prejšnjega člena,
– pri kontroli kakovosti zdravil v okviru postopka za pridobitev dovoljenja za promet z zdravilom oziroma paralelno uvoženim zdravilom, predlagatelj iz 43. člena oziroma 117. člena tega zakona.
(3) Podrobnejšo vsebino in roke uradne kontrole kakovosti zdravila, način vzorčenja in višino cen storitev iz prejšnjega člena določi minister.
XVI. CENE ZDRAVIL
156. člen
(oblikovanje cen zdravil)
Cene zdravil se oblikujejo prosto po pogojih trga, razen v primerih, določenih s tem zakonom.
157. člen
(posredovanje podatkov o prosto oblikovanih cenah zdravil)
(1) V interesu varovanja javnega zdravja lahko minister oziroma minister, pristojen za veterinarstvo, določi zdravila ali skupine zdravil, ki niso financirana iz javnih sredstev in se cene teh zdravil oblikujejo prosto po pogojih trga, za katera morajo poslovni subjekti, ki sodelujejo v prometu z zdravili, JAZMP posredovati podatke o nabavnih in prodajnih cenah teh zdravil ter o količini prodanih zdravil v določenem časovnem obdobju.
(2) Zavezanci za sporočanje podatkov o cenah zdravil so poslovni subjekti, ki so imetniki dovoljenja iz prvega ali drugega odstavka ali tretje alineje tretjega odstavka 20. člena tega zakona, imetniki dovoljenja za dejavnost prometa z zdravili na debelo in lekarne ter specializirane prodajalne za zdravila.
(3) Podrobnejše zahteve za sporočanje podatkov za namen iz prvega odstavka tega člena, elemente cen, ki se sporočajo, zdravila oziroma skupine zdravil, katerih cene se sporočajo, način poročanja JAZMP ministrstvu, pristojnemu za zdravje, o prejetih podatkih in objavo veljavnih cen določi minister.
158. člen
(določanje cen zdravil)
(1) Zdravilom za uporabo v humani medicini, ki so lahko v prometu v skladu s prvim ali drugim odstavkom ali tretjo alinejo tretjega odstavka 20. člena tega zakona ter so financirana iz javnih sredstev oziroma so namenjena za financiranje iz javnih sredstev, JAZMP na podlagi vloge določi najvišjo dovoljeno ceno.
(2) Zdravilom iz prejšnjega odstavka lahko na podlagi vloge za zvišanje najvišje dovoljene cene, mnenja komisije iz četrte alineje petega odstavka 4. člena tega zakona ter ugotovljenega javnega interesa na področju zdravja in ekonomskih utemeljitev o tveganju, ki bi nastalo zaradi motene preskrbe z zdravili, oziroma o dokazljivih, neizogibnih in nesorazmernih stroških, ki bi nastali izključno zaradi izpolnjevanja obveznosti javnih storitev, JAZMP določi izredno višjo dovoljeno ceno.
(3) Način, merila, obvezne sestavine vloge, stopnjo prometa in postopek za določitev najvišje dovoljene cene zdravil in izredne višje dovoljene cene zdravil ter način, merila, postopek in obdobje za spreminjanje najvišje dovoljene cene zdravil določi minister.
(4) Cene zdravil za uporabo v veterinarski medicini, ki so lahko v prometu v skladu s prvim ali drugim odstavkom ali tretjo alinejo tretjega odstavka 20. člena tega zakona in katerih raven lahko vpliva na zdravstveno varstvo živali in s tem ogrožanje zdravja ljudi, se izjemoma (npr. ob epizootijah, epidemijah povezanih z epizootijami, zoonozah, pri boleznih, ki se zatirajo po predpisih, ki urejajo veterinarstvo, pri nesorazmernem vplivu cen zdravil na ceno hrane) oblikujejo oziroma določajo na način in na ravni prometa z zdravilom, ki ju določi minister, pristojen za veterinarstvo.
159. člen
(cene zdravil, nižje od njihovih najvišjih dovoljenih cen in od njihovih izrednih višjih dovoljenih cen)
(1) Cene zdravil so lahko nižje od njihovih najvišjih dovoljenih cen oziroma izrednih višjih dovoljenih cen na podlagi sklenjenega dogovora med imetniki dovoljenja iz prvega odstavka prejšnjega člena ali veletrgovci ter:
– nosilci zdravstvenega zavarovanja, ki poravnavajo stroške izdanih zdravil,
– izvajalci zdravstvene dejavnosti, financirane iz javnih sredstev, v postopkih javnega naročanja,
– izvajalci lekarniške dejavnosti, financirane iz javnih sredstev, v postopkih javnega naročanja,
– poslovnimi subjekti, v katerih se za njihove varovance oziroma varovanke izvajajo zdravstvene storitve v programih socialnega varstva,
– Slovensko vojsko za namen podpore zdravstvene oskrbe njenih pripadnikov ali
– nosilci sistemskih pristojnosti na področju javnega zdravja in državnih blagovnih rezerv.
(2) Imetniki dovoljenja iz 20. člena tega zakona, ki so osebe javnega prava, ustanovljene v Republiki Sloveniji, pri oblikovanju cen za zdravila iz prejšnjega odstavka upoštevajo izhodišča, ki temeljijo na stroškovno utemeljenem oblikovanju cen. S tako oblikovanimi cenami, za katere predhodno pridobijo soglasje ministrstva, pristojnega za zdravje, sklepajo dogovore s subjekti iz prejšnjega odstavka.
160. člen
(obvezni popusti)
(1) Kadar je to v javnem interesu za ohranitev vzdržnosti financiranja zdravil iz javnih sredstev ali v primerih odsotnosti ali neustreznosti konkurence na trgu zdravil, lahko minister z odredbo določi obvezni popust imetnikom dovoljenj iz prvega in drugega odstavka 20. člena tega zakona, razen imetnikom dovoljenja za sočutno uporabo zdravila. Obvezni popust se določi za enega ali več elementov najvišje dovoljene cene zdravila.
(2) Obvezni popust iz prejšnjega odstavka se določi le za zdravila, ki so financirana iz javnih sredstev:
1. če niso na seznamu esencialnih zdravil ali nujno potrebnih zdravil iz 17. člena tega zakona,
2. za katera je bila dana pobuda s strani enega ali več poslovnih subjektov iz prvega odstavka prejšnjega člena za sklenitev dogovora, s katerim bi bila dosežena nižja cena zdravila iz prvega odstavka prejšnjega člena za poslovne subjekte:
– katerih skupna vrednost nabav zadevnega zdravila oziroma vrednost zadevnega zdravila, ki je bila osnova za kritje stroškov v programih zdravstvenega zavarovanja v preteklem koledarskem letu, ali
– katerih skupna vrednost izraženih potreb po nabavah zadevnega zdravila v tekočem koledarskem letu
predstavlja najmanj tri četrtine vrednosti prodaje zadevnega zdravila v Republiki Sloveniji v preteklem koledarskem letu oziroma izraženih potreb po zadevnem zdravilu v tekočem letu, in dogovor ni bil sklenjen,
3. ki niso na seznamu medsebojno zamenljivih zdravil z najvišjo priznano vrednostjo, ali
4. ki nimajo določene izredne višje dovoljene cene.
(3) Obvezni popust se vsakokrat določi za obdobje največ 12 mesecev.
161. člen
(postopek za določitev cene zdravila)
(1) Postopek za določitev najvišje dovoljene cene zdravila iz prvega odstavka 158. člena tega zakona oziroma določitev izredne višje dovoljene cene zdravila iz drugega odstavka 158. člena tega zakona, se pri JAZMP začne na podlagi vloge imetnika dovoljenja iz prvega ali drugega odstavka ali tretje alineje tretjega odstavka 20. člena tega zakona.
(2) JAZMP določi najvišjo dovoljeno ceno zdravila v 90 dneh od dneva prejema popolne vloge.
(3) JAZMP določi izredno višjo dovoljeno ceno zdravila v 90 dneh od dneva prejema popolne vloge. Ta rok se lahko podaljša največ enkrat za 60 dni zaradi preobremenjenosti s številom vlog za določitev izredne višje dovoljene cene.
(4) JAZMP lahko v postopku določanja cene iz prvega odstavka tega člena od vlagatelja zahteva dodatne podatke oziroma dokumentacijo v skladu s šestim odstavkom 3. člena tega zakona.
(5) Rok iz drugega in tretjega odstavka tega člena ne teče v času od dneva vročitve poziva za izjasnitev glede predvidene določitve najvišje dovoljene cene oziroma izredne višje dovoljene cene zdravila do prejema odziva imetnika dovoljenja iz prvega ali drugega odstavka ali tretje alineje tretjega odstavka 20. člena tega zakona. Rok za odziv, ki ga določi JAZMP, ne sme biti krajši od 15 dni.
(6) Če JAZMP ne določi cene v rokih iz drugega in tretjega odstavka tega člena, se šteje, da je vlogi ugodeno in vlagatelj lahko trži zdravilo po ceni, ki je bila predlagana v vlogi.
(7) Pritožba zoper odločbo iz drugega in tretjega odstavka tega člena ne zadrži izvršitve odločbe.
162. člen
(odstop od ukrepa kontrole cen zdravil)
(1) Ne glede na zakon, ki ureja kontrolo cen, lahko imetnik dovoljenja iz prvega ali drugega odstavka ali tretje alineje tretjega odstavka 20. člena tega zakona vloži pri Vladi Republike Slovenije predlog za odstop od ukrepa kontrole cen, ki ga je Vlada Republike Slovenije uvedla na podlagi zakona, ki ureja kontrolo cen. Predlog mora vsebovati razloge, zaradi katerih se predlaga odstop. Vlada Republike Slovenije obrazložen predlog posreduje v mnenje ministrstvu, pristojnemu za kontrolo cen.
(2) Ministrstvo, pristojno za kontrolo cen, lahko od predlagatelja v 15 dneh od prejema predloga, ki ga je prejelo od Vlade Republike Slovenije, zahteva dodatne podatke in obrazložitve, ki jih predlagatelj mora predložiti v 30 dneh.
(3) Ministrstvo, pristojno za kontrolo cen, pri pripravi mnenja o utemeljenosti predloga iz prvega odstavka tega člena smiselno uporablja določila predpisov, ki urejajo kontrolo cen.
(4) Mnenje o utemeljenosti predloga iz prvega odstavka tega člena ministrstvo, pristojno za kontrolo cen, posreduje Vladi Republike Slovenije v 15 dneh od prejema predloga za odstop ali dopolnjenega predloga iz drugega odstavka tega člena, Vlada Republike Slovenije pa nato najkasneje v 75 dneh odloči o predlogu in z odločitvijo seznani predlagatelja.
(5) V primeru velikega števila predlogov za odstop iz tega člena, se rok za pripravo mnenja iz četrtega odstavka tega člena lahko enkrat podaljša za 60 dni, o čemer Vlada Republike Slovenije obvesti predlagatelja pred iztekom prvotnega roka.
163. člen
(obveznost uporabe veljavne cene)
(1) Poslovni subjekti, ki kupujejo in prodajajo oziroma izdajajo zdravila, uporabljajo veljavno ceno zdravila.
(2) Veljavna cena zdravila za uporabo v humani medicini po tem zakonu je lahko:
– izredna višja dovoljena cena zdravila,
– najvišja dovoljena cena zdravila,
– nižja cena zdravila od najvišje dovoljene na podlagi dogovora iz prvega odstavka 159. člena tega zakona,
– cena iz drugega odstavka 159. člena tega zakona,
– najvišja dovoljena cena z obveznim popustom iz 160. člena tega zakona ali
– cena zdravila, ki je oblikovana prosto po pogojih trga za zdravila, ki niso financirana iz javnih sredstev oziroma niso namenjena za financiranje iz javnih sredstev.
(3) Cene iz prve do pete alineje prejšnjega odstavka so najvišje cene zdravil, pri čemer poslovni subjekti ne smejo prodajati zdravila nad to ceno, lahko pa pod njo.
(4) Če poslovni subjekti cene iz prve do pete alineje drugega odstavka tega člena v času njihove veljavnosti znižajo, se te znižane cene štejejo kot veljavne cene zdravil, če je JAZMP o tem prejela obvestilo, ter ceno evidentirala in objavila na svoji spletni strani.
(5) Poslovni subjekti, ki oblikujejo veljavno znižano ceno zdravila v skladu z določbami prejšnjega odstavka, prodajajo zdravila, ki so financirana iz javnih sredstev oziroma so namenjena za financiranje iz javnih sredstev, v obdobju do njenega preklica s strani poslovnega subjekta, ki ga JAZMP evidentira in objavi na svoji spletni strani v petih delovnih dneh po prejemu preklica.
(6) Poslovni subjekt, ki prodaja oziroma izdaja zdravila, uporablja za zdravilo, ki se financira iz javnih sredstev, tisto veljavno ceno zdravila, ki je za zadevni poslovni subjekt iz druge do šeste alineje prvega odstavka 159. člena tega zakona stroškovno najugodnejša.
(7) Za namen spremljanja cen zdravil se vzpostavi centralna baza zdravil kot elektronska zbirka podatkov, katere upravljavec je nosilec OZZ. V njej se vodijo naslednji podatki o zdravilih:
– iz 1. do 4. točke 187. člena tega zakona;
– o cenah zdravil in začetku veljavnosti cen zdravil iz prve do pete alineje drugega odstavka in četrtega odstavka tega člena, o preklicu cene iz petega odstavka tega člena ter cen zdravil, določenih na podlagi zakona, ki ureja kontrolo cen;
– o najvišjih priznanih vrednostih zdravil, ki jih določi nosilec OZZ;
– o financiranju zdravil iz javnih sredstev;
– o prisotnosti zdravila na trgu.
(8) Podatke iz prejšnjega odstavka posredujejo v centralno bazo zdravil na podlagi računalniške izmenjave podatkov:
– JAZMP – za podatke o zdravilih iz prve alinee prejšnjega odstavka, podatke o cenah zdravil iz prve in druge alinee drugega odstavka in četrtega odstavka tega člena ter za podatke o prisotnosti zdravil na trgu iz pete alinee prejšnjega odstavka;
– subjekti iz prve do šeste alinee prvega odstavka 159. člena tega zakona – za podatke o cenah zdravil iz tretje alinee drugega odstavka tega člena;
– imetniki dovoljenja iz drugega odstavka 159. člena tega zakona – za podatke o cenah zdravil iz četrte alinee drugega odstavka tega člena;
– nosilec OZZ – za najvišje priznane vrednosti zdravil iz tretje alinee in za podatke o financiranju zdravil iz javnih sredstev iz četrte alinee prejšnjega odstavka;
– ministrstvo, pristojno za zdravje – za podatke o cenah zdravil iz pete alinee drugega odstavka tega člena;
– ministrstvo, pristojno za kontrolo cen – za podatke o cenah zdravil, določene na podlagi zakona, ki ureja kontrolo cen.
(9) Zavezanci iz prejšnjega odstavka posredujejo podatek o ceni zdravila ter začetku in prenehanju njene veljavnosti v centralno bazo zdravil najpozneje dva delovna dneva pred začetkom oziroma prenehanjem veljavnosti cene zdravila, druge podatke iz prejšnjega odstavka pa v osmih dneh od njihovega nastanka.
(10) Način posredovanja podatkov iz osmega in devetega odstavka tega zakona in dostopa do teh podatkov določi minister.
164. člen
(obveznost sporočanja podatkov o ceni zdravila)
Poslovni subjekti, ki imajo dovoljenje za opravljanje prometa z zdravili na drobno in prometa z zdravili na debelo oziroma ustrezno potrdilo o priglasitvi iz tretjega odstavka 105. člena tega zakona, JAZMP sporočijo vse podatke o cenah zdravil na način, določen s tem zakonom, za zdravila za uporabo v veterinarski medicini pa tudi organu, pristojnemu za veterinarstvo.
XVII. INŠPEKCIJSKI NADZOR
165. člen
(pristojnosti pri nadzoru nad izvajanjem tega zakona)
(1) Inšpekcijski nadzor nad izvajanjem tega zakona in na njegovi podlagi sprejetih predpisov opravljajo farmacevtski inšpektorji, uradni veterinarji in organi, pristojni za carinske zadeve.
(2) Naloge inšpekcijskega nadzora v mejah pristojnosti JAZMP opravljajo farmacevtski inšpektorji.
(3) Uradni veterinarji izvajajo inšpekcijski nadzor nad določbami tega zakona in na njegovi podlagi izdanih predpisov, ki se nanašajo na uporabo zdravil in z uporabo povezano sledljivostjo zdravil v veterinarski medicini.
(4) Nadzor nad uvozom zdravil opravlja organ, pristojen za carinske zadeve, pri čemer mu JAZMP in uradni veterinarji zagotavljajo strokovno podporo.
166. člen
(pristojnosti farmacevtskih inšpektorjev)
(1) Poleg nalog iz prejšnjega člena farmacevtski inšpektorji opravljajo tudi naloge inšpekcijskega nadzora na podlagi:
– zakona, ki ureja medicinske pripomočke,
– zakona, ki ureja preskrbo s krvjo,
– zakona, ki ureja kakovost in varnost človeških tkiv in celic, namenjenih za zdravljenje in
– zakona, ki ureja proizvodnjo in promet s prepovedanimi drogami v delu, ki se nanaša na prepovedane droge skupine II in III, ki so zdravila.
(2) Za določitev položaja, pravic, dolžnosti, pooblastil, postopka in ukrepov pri opravljanju nalog inšpekcijskega nadzora farmacevtskih inšpektorjev se uporabljajo določbe zakona, ki ureja inšpekcijski nadzor, razen če je s tem zakonom oziroma predpisi Evropske unije določeno drugače.
167. člen
(farmacevtski inšpektor)
(1) Za farmacevtskega inšpektorja je lahko imenovana oseba, ki izpolnjuje pogoje za opravljanje inšpekcijskega nadzora, določene v zakonu, ki ureja inšpekcijski nadzor.
(2) Za posamezna področja nadzora mora imeti farmacevtski inšpektor v skladu s posebnimi predpisi dodatna strokovna znanja, ki jih določi minister.
(3) Farmacevtski inšpektorji so pri opravljanju nalog v skladu s pooblastili samostojni ter jih opravljajo v okviru in na podlagi ustave in zakonov.
(4) Farmacevtski inšpektor se stalno strokovno usposablja in izpopolnjuje po programu, ki ga določi direktor JAZMP, v obsegu kot je določeno za posamezna področja nadzora.
(5) Farmacevtski inšpektor podpiše izjavo o morebitni finančni ali drugi povezanosti oziroma nepovezanosti s poslovnimi subjekti, ki so predmet inšpekcijskih nadzorov, kar se upošteva pri razporejanju nalog farmacevtskih inšpektorjev za opravljanje posameznih inšpekcijskih nadzorov v skladu z internim aktom, ki ga sprejme direktor JAZMP.
(6) Če farmacevtski inšpektor odkloni podpis izjave iz prejšnjega odstavka, se ga lahko razporedi na druga sistemizirana dela in naloge JAZMP.
168. člen
(imenovanje v strokovno komisijo)
Farmacevtski inšpektorji so lahko imenovani v strokovno komisijo iz osmega odstavka 4. člena tega zakona.
169. člen
(preverjanje izpolnjevanja pogojev dobrih praks v tujini)
(1) Na podlagi sodelovanja med državami članicami Evropske unije, zahteve pristojnega organa države članice Evropske unije, Evropske agencije za zdravila ali Evropske komisije, zaprosila pristojnega organa ali poslovnega subjekta iz Evropske unije ali tretje države, farmacevtski inšpektorji v skladu z Uredbo 726/2004/ES, Direktivo 2001/83/ES, Direktivo 2001/82/ES, Direktivo 2001/20/ES, Direktivo 2005/28/ES in v skladu z Zbirko postopkov Evropske unije, opravljajo strokovne naloge v zvezi s preverjanjem izpolnjevanja dobrih proizvodnih praks in dobrih distribucijskih praks za zdravila, učinkovine in nekatere pomožne snovi ter dobre klinične in farmakovigilančne prakse pri poslovnem subjektu s sedežem v katerikoli državi članici Evropske unije ali v tretji državi.
(2) O rezultatih preverjanja iz prejšnjega odstavka farmacevtski inšpektor izda potrdilo o dobri proizvodni oziroma distribucijski praksi, če poslovni subjekt izvaja načela in smernice dobre proizvodne prakse ali dobre distribucijske prakse.
170. člen
(opravljanje inšpekcijskega nadzora)
(1) Farmacevtski inšpektorji opravljajo inšpekcijski nadzor s področja pristojnosti v Republiki Sloveniji kot redni, izredni in ponovni nadzor, ki so lahko tudi nenapovedani.
(2) Redni inšpekcijski nadzor opravi farmacevtski inšpektor po uradni dolžnosti ali na predlog poslovnega subjekta. Pogostnost rednih inšpekcijskih nadzorov se določi glede na oceno tveganja in v skladu z zahtevami predpisov za posamezno področje nadzora.
(3) Izredni inšpekcijski nadzor se opravi na podlagi utemeljenega suma o neupoštevanju zahtev iz predpisov ali ocene tveganja v posamezni zadevi, če tako odloči JAZMP, ali na podlagi zahteve organov, pristojnih za zdravila držav članic Evropske unije ali pristojnih organov Evropske unije.
(4) Ponovni inšpekcijski nadzor se lahko opravi po preteku roka, določenega za odpravo pomanjkljivosti, ugotovljenih v okviru rednega ali izrednega inšpekcijskega nadzora ter izvršitev naloženih ukrepov in nalog.
(5) O načrtovanih in izvedenih inšpekcijskih nadzorih farmacevtski inšpektorji izmenjujejo informacije z organi, pristojnimi za zdravila držav članic Evropske unije in pristojnimi organi Evropske unije.
(6) Farmacevtskega inšpektorja na inšpekcijskem nadzoru lahko spremlja tudi drugi zaposleni v JAZMP ali zunanji strokovnjak z zadevnega področja.
(7) Farmacevtski inšpektor sestavi zapisnik o izvedenem inšpekcijskem nadzoru in ga vroči pregledanemu poslovnemu subjektu najpozneje v 30 dneh od opravljenega inšpekcijskega nadzora. Zapisnik na področju nadzora dobrih proizvodnih in distribucijskih praks se pripravi v obliki, kot je določen v Zbirki postopkov Evropske unije.
171. člen
(izvajanje inšpekcijskih nadzorov na področju nerutinsko pripravljenih zdravil za napredno zdravljenje)
Farmacevtski inšpektorji opravljajo inšpekcijski nadzor iz prejšnjega člena tudi pri izvajalcih zdravstvene dejavnosti in veterinarske dejavnosti, ki naročajo in uporabljajo nerutinsko pripravljena zdravila za napredno zdravljenje.
172. člen
(medsebojno priznavanje listin o inšpekcijskih nadzorih)
Listine o inšpekcijskih nadzorih, ki jih izdajo pristojni organi držav članic Evropske unije ali držav, ki so z Evropsko unijo sklenile sporazum o medsebojnem priznavanju listin za področje zdravil, se medsebojno priznavajo.
173. člen
(ukrepi farmacevtskih inšpektorjev na področju zdravil)
(1) Farmacevtski inšpektorji, ki pri opravljanju inšpekcijskega nadzora ugotovijo kršitve določb tega zakona in na njegovi podlagi sprejetih predpisov, imajo poleg pravic in dolžnosti, določenih v zakonu, ki ureja inšpekcijski nadzor, tudi pravico in dolžnost:
– prepovedati opravljanje dejavnosti zaradi neizpolnjevanja predpisanih pogojev;
– prepovedati promet ali odrediti uničenje ali odpoklic določenih serij zdravil iz prometa, če ugotovijo, da:
a) je zdravilo v predpisanih pogojih uporabe škodljivo,
b) zdravilo nima terapevtskega učinka,
c) razmerje med koristmi in tveganji ni ugodno v predpisanih pogojih uporabe,
d) kakovost in količinska sestava zdravila ne ustreza deklarirani,
e) če ni bilo opravljeno preskušanje zdravila ali sestavin ter preskušanje vmesnih faz proizvodnega procesa ali če niso bile izpolnjene nekatere druge zahteve ali obveznosti v zvezi z izdanim dovoljenjem za promet z zdravilom,
f) je zdravilo ponarejeno,
g) zdravilo po določbah tega zakona ne sme biti v prometu;
– obvestiti vse države članice Evropske unije, poslovne subjekte v dobavni verigi in javnost, če se za zadevno zdravilo domneva, da predstavlja resno tveganje za javno zdravje;
– prepovedati vnos oziroma uvoz zdravila, ki nima ustreznega dovoljenja JAZMP;
– odrediti odstranitev ali uničenje materiala, uporabljenega za nedovoljeno oglaševanje zdravil;
– prepovedati oglaševanje in obveščanje, ki je v nasprotju z določbami tega zakona;
– odrediti druge ukrepe in opraviti dejanja, potrebna za izvajanje tega zakona in na njegovi podlagi sprejetih predpisov;
– obvestiti druge države članice Evropske unije, Evropsko komisijo in EMA o rezultatih inšpekcijskega nadzora na področju farmakovigilance in predlaganimi ukrepi.
(2) Pritožba zoper ukrepe iz prejšnjega odstavka, ki jih odredi farmacevtski inšpektor v upravnem postopku, ne zadrži njihove izvršitve.
(3) Farmacevtski inšpektor, ki pri svojem delu ugotovi kršitve s področja uporabe zdravil v veterinarski medicini, o tem nemudoma obvesti organ, pristojen za veterinarstvo.
174. člen
(pristojnosti farmacevtskih inšpektorjev na področju nerutinsko pripravljenih zdravil za napredno zdravljenje)
Za zagotovitev izpolnjevanja zahtev iz tega zakona farmacevtski inšpektorji izvajajo redne, izredne in ponovne nadzore tudi pri zdravnikih in veterinarjih, ki naročajo in uporabljajo nerutinsko pripravljena zdravila za napredno zdravljenje.
175. člen
(odvzem vzorcev zdravil v prometu)
Jemanje vzorcev za kontrolo kakovosti zdravil v prometu izvajajo pooblaščene osebe NLZOH.
176. člen
(pristojnosti farmacevtskih inšpektorjev na področju cen zdravil)
(1) Če udeleženci v prometu z zdravilom niso upoštevali veljavne cene, jim farmacevtski inšpektor z odločbo naloži, da:
– upoštevajo veljavno ceno zdravila;
– plačniku vrnejo neupravičeno pridobljeno razliko v ceni s pripadajočimi obrestmi.
(2) Če udeleženec v prometu z zdravilom ni upošteval cene zdravila, določene v skladu s tem zakonom in predpisi iz 158. in 160. člena tega zakona, in je zaračunaval plačnikom previsoke cene zdravil, mora v 15 dneh po pravnomočnosti odločbe farmacevtskega inšpektorja razliko v ceni s pripadajočimi obrestmi brez posebnega poziva vrniti plačnikom.
(3) Obresti po tem členu so enake zamudnim obrestim pri gospodarskih poslih po obligacijskem pravu.
(4) Farmacevtski inšpektor o svoji odločitvi pri zdravilih za uporabo v veterinarski medicini seznani organ, pristojen za veterinarstvo.
177. člen
(obveznost preskrbe trga po odločbi farmacevtskega inšpektorja)
(1) Če zaradi določitve cene zdravila v skladu s tem zakonom in predpisi iz 158. in 160. člena tega zakona udeleženci v prometu s tem zdravilom na lastno pobudo ne začnejo prodajati ali prenehajo prodajati zdravilo in če bi to resno ogrozilo preskrbo prebivalstva z zdravili, lahko farmacevtski inšpektor v odločbi iz prvega odstavka prejšnjega člena udeležencem v prometu z zdravili naloži, da nemudoma začnejo oziroma nadaljujejo prodajati zdravilo in pri tem upoštevajo cene zdravila, določene v skladu s tem zakonom in na njegovi podlagi sprejetimi predpisi iz 158. in 160. člena tega zakona.
(2) Farmacevtski inšpektor v odločbi določi rok, do katerega velja obveznost udeležencev v prometu z zdravilom iz prejšnjega odstavka, vendar ta obveznost ne sme trajati dlje kot tri mesece po pravnomočnosti odločbe.
178. člen
(izvršitev odločb)
Pritožba zoper odločbo iz 177. člena tega zakona ne zadrži izvršitve odločb, razen glede obveznosti vračila preveč plačanih zneskov na podlagi drugega odstavka navedenega člena.
179. člen
(pristojnosti uradnih veterinarjev)
Uradni veterinar ima poleg pravic in nalog, določenih v zakonu, ki ureja inšpekcijski nadzor, tudi:
– pravico in dolžnost voditi prekrškovni postopek in izreči sankcije za prekršek,
– odrediti pravni oziroma fizični osebi, da uskladi svoje poslovanje z določbami tega zakona in na njegovi podlagi sprejetimi predpisi,
– odrediti prepoved uporabe zdravil in učinkovin za zdravljenje živali, ki niso v skladu s tem zakonom,
– odvzeti lastniku oziroma skrbniku živali zdravila, ki niso v skladu s tem zakonom,
– odrediti lastniku oziroma skrbniku živali na njegove stroške uničenje zdravil, ki niso v skladu s tem zakonom.
XVIII. JAVNA AGENCIJA ZA ZDRAVILA IN MEDICINSKE PRIPOMOČKE
180. člen
(delovanje in nadzor)
(1) JAZMP je pravna oseba javnega prava.
(2) Ustanovitelj JAZMP je Republika Slovenija. Pravice ustanovitelja izvršuje Vlada Republike Slovenije.
(3) Pri izvajanju nalog je JAZMP samostojna.
(4) Nadzor nad delom JAZMP opravlja ministrstvo, pristojno za zdravje.
(5) Za JAZMP se uporabljajo določbe zakona, ki ureja javne agencije, razen če ta zakon ne določa drugače.
181. člen
(upravljanje s kadri)
(1) JAZMP v programu dela in finančnem načrtu določi kadrovski načrt v soglasju z ministrstvom.
(2) Program dela in finančni načrt JAZMP sprejme svet JAZMP in ga posreduje v soglasje ustanovitelju.
(3) Za plače zaposlenih v JAZMP velja zakon, ki ureja sistem plač v javnem sektorju.
182. člen
(naloge JAZMP)
(1) JAZMP opravlja naslednje naloge na področju zdravil:
– upravne in strokovne naloge na področju dovoljenj za promet z zdravili v nacionalnih in mednarodnih postopkih vrednotenja kakovosti, varnosti in učinkovitosti ter razmerja med koristjo in tveganjem pri uporabi zdravil;
– upravne, strokovne in nadzorstvene naloge na področju kliničnih preskušanj zdravil;
– naloge v sistemu farmakovigilance za upravljanje in zmanjševanje tveganja, povezanega z zdravili, obveščanje javnosti, vzpostavitev in vzdrževanje spletnega portala o varnosti zdravil ter sodelovanje v farmakovigilančnih dejavnostih Evropske unije;
– strokovne naloge in sodelovanje pri delitvi dela med državami članicami Evropske unije na področju normativnega urejanja zdravil;
– strokovne naloge pri delu odborov in delovnih skupin EMA, drugih institucij in vključevanje v mednarodne iniciative v skladu s sistemskimi usmeritvami Republike Slovenije;
– upravne in strokovne naloge razvrščanja izdelkov, za katere obstaja dvom, ali se razvrščajo med zdravila ali v druge skupine izdelkov;
– upravne in strokovne naloge pri ugotavljanju izpolnjevanja pogojev ter načel smernic dobre proizvodne prakse na področju zdravil, učinkovin in pomožnih snovi;
– upravne in strokovne naloge pri ugotavljanju izpolnjevanja pogojev in načel dobre distribucijske prakse na področju zdravil in učinkovin;
– upravne in strokovne naloge pri ugotavljanju izpolnjevanja pogojev in načel dobre klinične prakse v kliničnem preskušanju zdravil;
– upravne in strokovne naloge pri ugotavljanju izpolnjevanja pogojev in načel dobre farmakovigilančne prakse;
– upravne in strokovne naloge pri ugotavljanju izpolnjevanja pogojev za opravljanje dejavnosti priprave nerutinsko pripravljenih zdravil za napredno zdravljenje;
– nadzor nad zdravili, učinkovinami in pomožnimi snovmi na področju zdravil za uporabo v humani medicini in nerutinsko pripravljenih zdravil za napredno zdravljenje;
– upravne, nadzorstvene in strokovne naloge na področju obravnave posamičnih odstopov od pogojev dovoljenja za promet z zdravilom;
– nadzorstvene naloge na področju zdravil za uporabo v veterinarski medicini, razen z veterinarsko stroko povezanega določanja doktrinarnih rešitev na ravni varne uporabe zdravil v veterinarski medicini in nadzora nad uporabo in z uporabo povezano sledljivostjo zdravil v veterinarski medicini;
– upravne in strokovne naloge na področju cen zdravil in nadzor nad cenami zdravil;
– upravne, strokovne in nadzorstvene naloge pri spremljanju prisotnosti zdravil na trgu, dodeljevanja nacionalnega identifikatorja zdravil;
– upravne in strokovne naloge na področju zdravil, ki v Republiki Sloveniji nimajo
– dovoljenja za promet;
– upravne in strokovne naloge na področju esencialnih zdravil in nujno potrebnih zdravil;
– upravne in strokovne naloge na področju donacij zdravil;
– upravne in strokovne naloge na področju medsebojno zamenljivih zdravil;
– upravne in strokovne naloge na področju vrednotenja zdravstvenih tehnologij;
– naloge na področju farmakoepidemiološkega in farmakoekonomskega spremljanja trga zdravil ter pripadajočih metodologij, evidenc in analiz porabe in uporabe zdravil;
– strokovna podpora nalogam uradnega kontrolnega laboratorija;
– naloge in ukrepi na področju ponarejenih zdravil;
– zasnova, izdelava in vodenje uradnih evidenc na področju zdravil, učinkovin in pomožnih snovi, ki obsegajo izdelke in poslovne subjekte;
– sodelovanje pri izdelavi Evropske farmakopeje in priprava Nacionalnega dodatka k Evropski farmakopeji;
– zagotavljanje prevoda ATC klasifikacije zdravil Svetovne zdravstvene organizacije, spletna objava vrednosti definiranih dnevnih odmerkov za zdravila, ki so v prometu v Republiki Sloveniji in enotno nacionalno poimenovanje zdravilnih učinkovin;
– sodelovanje z organi, pristojnimi za zdravila držav članic Evropske unije na področju normativnega urejanja zdravil in urejanja cen zdravil;
– sodelovanje z uradnim kontrolnim laboratorijem pri njegovem vključevanju v Evropsko mrežo kontrolnih laboratorijev pri EDQM;
– druge naloge na področju zdravil za uporabo v humani in veterinarski medicini.
(2) JAZMP opravlja tudi naslednje naloge:
– sodelovanje pri pripravi zakonov in podzakonskih aktov s področja pristojnosti JAZMP;
– vodenje uradnih evidenc na podlagi tega zakona;
– naloge vzpostavljanja in vzdrževanja informacijskega sistema v okviru uradnih evidenc;
– naloge vzpostavljanja mednarodno prepoznavnega sistema kakovosti poslovanja v okviru dobre prakse normativnega urejanja na področju zdravil;
– strokovna podpora pri uveljavljanju sistemskih usmeritev na področju zdravil;
– naloge, ki vključujejo sodelovanje z drugimi upravnimi, strokovnimi in znanstvenimi institucijami na področjih pristojnosti doma in v tujini in
– druge naloge v okviru svoje pristojnosti.
(3) Poleg nalog iz prvega in drugega odstavka tega člena JAZMP opravlja tudi naloge na področju medicinskih pripomočkov, krvi in krvnih pripravkov, kakovosti in varnosti človeških tkiv in celic, namenjenih za zdravljenje ter proizvodnje in prometa s prepovedanimi drogami skupin II. in III., v skladu s posebnimi predpisi.
183. člen
(viri financiranja JAZMP)
(1) Viri financiranja JAZMP so:
– pristojbine,
– sredstva iz proračuna Republike Slovenije,
– plačila za druge storitve,
– drugi prihodki.
(2) Plače, stroške materiala in storitev ter stroške investicij za tista delovna mesta v okviru JAZMP, ki so potrebna za izvajanje nalog in storitev na posameznih področij pristojnosti, za izvajanje katerih ta zakon ali drugi predpisi Republike Slovenije oziroma Evropske unije ne dopuščajo zaračunavanja pristojbin, se financirajo iz proračuna Republike Slovenije.
(3) Minister in minister, pristojen za veterinarstvo določita vrsto in obseg nalog in programov JAZMP, ki se financirajo iz sredstev proračuna Republike Slovenije.
184. člen
(organi JAZMP)
(1) Organa JAZMP sta direktor in svet JAZMP.
(2) Sestavo in število članov sveta določi ustanovitelj v ustanovitvenem aktu.
(3) Direktor ali član sveta JAZMP ne sme biti zaposlen ali opravljati kakršnegakoli dela v organizacijah, ki opravljajo katero od pridobitnih dejavnosti s področja zdravil in medicinskih pripomočkov, in ne sme imeti nobene funkcije v takih organizacijah.
(4) Poleg razlogov, določenih v zakonu, ki ureja javne agencije, Vlada Republike Slovenije razreši direktorja ali člana sveta JAZMP, če:
– mu je odvzeta opravilna sposobnost ali postane zdravstveno nesposoben za opravljanje dela,
– nastopi razlog iz prejšnjega odstavka,
– je pravnomočno obsojen za kaznivo dejanje na zaporno kazen ali povzročitev gospodarske škode.
185. člen
(poročanje o delu JAZMP)
(1) JAZMP najmanj enkrat letno, najpozneje do 28. februarja za preteklo leto, predloži ustanovitelju letno poročilo.
(2) Poročilo iz prejšnjega odstavka JAZMP objavi na javnosti dostopen način. Pred objavo se iz poročila izločijo osebni podatki in podatki, ki so poslovna skrivnost v skladu s tem zakonom.
186. člen
(upravno odločanje in odločanje v postopkih o prekrških)
(1) JAZMP v skladu s tem zakonom v upravnih zadevah odloča v upravnem postopku na prvi stopnji po zakonu, ki ureja splošni upravni postopek, če ta zakon ne določa drugače.
(2) O pritožbah zoper odločbe JAZMP odloča ministrstvo, pristojno za zdravje, razen o pritožbah zoper odločbe, za katere je na podlagi tega zakona pristojen uradni veterinar, o katerih odloča ministrstvo, pristojno za veterinarstvo.
(3) JAZMP je prekrškovni organ za področja v pristojnosti farmacevtskega inšpektorja.
(4) Postopek o prekršku vodi in v njem odloča farmacevtski inšpektor, ki izpolnjuje pogoje po zakonu, ki ureja prekrške, in na njegovi podlagi sprejetih predpisih.
187. člen
(uradne evidence JAZMP)
JAZMP vodi uradne evidence za namene varovanja javnega zdravja:
1. podatkov o zdravilih iz dovoljenja za promet z zdravilom (ime, farmacevtska oblika, jakost, pakiranje, razvrstitev zdravila glede na predpisovanje in izdajanje, imetnik dovoljenja za promet, najvišja dovoljena cena in izredna višja dovoljena cena);
2. podatkov o zdravilih iz dovoljenja za promet s paralelno uvoženim zdravilom (ime, farmacevtska oblika, jakost, pakiranje, imetnik dovoljenja za promet s paralelno uvoženim zdravilom, najvišja dovoljena cena in izredna višja dovoljena cena);
3. podatkov o zdravilih z začasnim dovoljenjem za promet (ime, farmacevtska oblika, jakost, pakiranje, imetnik dovoljenja);
4. podatkov o zdravilih z dovoljenjem za vnos oziroma uvoz (ime, farmacevtska oblika, jakost, pakiranje, količina, imetnik dovoljenja);
5. podatkov o zdravilih z dovoljenjem za sočutno uporabo (ime, farmacevtska oblika, jakost, pakiranje, imetnik dovoljenja);
6. podatkov o doniranih zdravilih (ime, farmacevtska oblika, jakost, pakiranje, količina, donator);
7. imetnikov dovoljenja za dejavnost proizvodnje zdravil (ime in sedež, pravno organizacijska oblika, ime in priimek usposobljene osebe, ki je odgovorna za sproščanje posamezne serije zdravila);
8. imetnikov dovoljenja za dejavnost prometa z zdravilom na debelo (ime in pravno organizacijska oblika, sedež, ime in priimek usposobljene osebe, ki je odgovorna za sprejem, shranjevanje in transport zdravil ter pregled dokumentacije);
9. imetnikov dovoljenja za dejavnost priprave nerutinsko pripravljenega zdravila za napredno zdravljenje (ime in sedež, pravno organizacijska oblika, ime in priimek usposobljene osebe, ki je odgovorna za kakovost);
10. priglašenih tujih veletrgovcev (ime in pravno organizacijska oblika, sedež);
11. posrednikov v prometu z zdravili in učinkovinami (ime poslovnega subjekta in sedež);
12. proizvajalcev, uvoznikov in distributerjev učinkovin (ime in pravno organizacijska oblika, sedež);
13. strokovnih sodelavcev za področje oglaševanja zdravil;
14. zdravnikov oziroma veterinarjev, ki naročajo in uporabljajo nerutinsko pripravljena zdravila za napredno zdravljenje (ime, priimek, strokovni naziv, ime in naslov poslovnega subjekta, pri katerem opravljajo zdravstveno dejavnost);
15. imetnikov dovoljenja za dejavnost prometa z zdravilom na drobno (ime in pravno organizacijska oblika, sedež).
188. člen
(objavljanje publikacij)
JAZMP lahko objavlja strokovne in splošno informativne publikacije s področja svojih pristojnosti.
189. člen
(pristojbine)
(1) Za stroške izvajanja upravnih nalog, ki so del javnega pooblastila in jih izvaja JAZMP, plača predlagatelj pristojbine, razen če zakon ne določa drugače.
(2) Imetniki dovoljenj za promet z zdravilom oziroma paralelno uvoženim zdravilom in imetniki dovoljenj za opravljanje dejavnosti, ki jih izdaja JAZMP, plačujejo tudi letne pristojbine za stroške spremljanja zdravila na trgu, ki se nanašajo na posamezno zdravilo glede na število farmacevtskih oblik.
190. člen
(tarifa)
Za stroške izvajanja strokovnih nalog in storitev s področja pristojnosti JAZMP, izda svet JAZMP tarifo, s katero določi višino plačil zanje. Tarife in njene spremembe veljajo, ko da nanje soglasje ustanovitelj.
XIX. KAZENSKE DOLOČBE
191. člen
(prekrški)
(1) Z globo od 800 do 4.000 eurov se za prekršek kaznuje pravna oseba, če:
– izdaja galensko zdravilo dlje kot šest mesecev po prihodu na trg enakega ali primerljivega industrijsko proizvedenega zdravil (tretji odstavek 8. člena tega zakona),
– pri uvozu in vnosu zdravil za osebno uporabo in uporabo pri svoji živali ravna v nasprotju s 16. členom tega zakona,
– ravna v nasprotju z drugim odstavkom 16. člena, točko (d) drugega odstavka 23. člena, petim odstavkom 24. člena in 26. členom Uredbe 726/2004/ES,
– ne sporoči podatkov iz 24. člena tega zakona,
– ne sporoči podatkov o predpisovanju in obsegu uporabe zdravil (25. člen tega zakona),
– spodbuja uporabo zdravila in zamenjavo obstoječe terapije brez drugega razloga (peti odstavek 40. člena tega zakona),
– izvaja neintervencijsko preskušanje zdravila v nasprotju s šestim oziroma sedmim odstavkom 40. člena tega zakona,
– ne obvesti JAZMP o novih informacijah, ki bi lahko vplivale na oceno razmerja med koristjo in tveganjem v skladnu s sedmim odstavkom 40. člena tega zakona,
– pacienta ali lastnika oziroma skrbnika živali ne seznani s postopkom zdravljenja in tveganji, povezanimi z zdravljenjem z nerutinsko pripravljenim zdravilom za napredno zdravljenje ali ne hrani podpisane izjave (tretji odstavek 77. člena tega zakona),
– pacientu ali lastniku oziroma skrbniku živali ne posreduje navodila za uporabo v skladu s četrtim odstavkom 77. člena tega zakona,
– ne sporoči spremembo podatkov kot določa tretji odstavek 78. člena tega zakona,
– ne obvesti JAZMP o spremembah, ki vplivajo na pogoje za izdajo dovoljenja za pripravo nerutinsko pripravljenih zdravil za napredno zdravljenje kot določa prvi odstavek 85. člena tega zakona,
– pri JAZMP ne priglasi svoje dejavnosti v skladu s četrtim odstavkom 101. člena tega zakona,
– pri JAZMP ne priglasi opravljanja dejavnosti prometa z zdravilom na debelo v Republiki Sloveniji v skladu s tretjim odstavkom 105. člena tega zakona,
– pri JAZMP ne priglasi svoje dejavnosti v skladu s četrtim odstavkom 112. člena tega zakona,
– pri JAZMP ne priglasi svoje dejavnosti v skladu s četrtim odstavkom 121. člena tega zakona,
– pri JAZMP ne priglasi svoje dejavnosti v skladu s prvim odstavkom 124. člena tega zakona,
– pred začetkom opravljanja oglaševanja zdravil pri JAZMP ne priglasi strokovnih sodelavcev za vpis v register strokovnih sodelavcev za oglaševanje zdravil (prvi odstavek 150. člena tega zakona),
– ne sporoči sprememb strokovnih sodelavcev za oglaševanje zdravil (tretji odstavek 150. člena tega zakona),
– ne zagotovi dokumentacije in referenčnih materialov za izvajanje redne in izredne kontrole kakovosti zdravil v skladu z drugim odstavkom 154. člena tega zakona,
– ne posreduje podatkov o nabavnih in prodajnih cenah zdravil, ki niso financirana iz javnih sredstev in se cene teh zdravil oblikujejo prosto po pogojih trga ter o količini prodanih zdravil v določenem časovnem obdobju (prvi odstavek 157. člena tega zakona),
– JAZMP ne sporoči vseh podatkov o cenah zdravil na način, določen s tem zakonom, za zdravila za uporabo v veterinarski medicini pa tudi organu, pristojnemu za veterinarstvo (164. člen tega zakona).
(2) Z globo od 500 do 3.000 eurov se kaznuje samostojni podjetnik posameznik ali posameznik, ki samostojno opravlja dejavnost, če stori prekršek iz prejšnjega odstavka.
(3) Z globo od 200 do 1.000 eurov se kaznuje tudi odgovorna oseba pravne osebe, odgovorna oseba samostojnega podjetnika posameznika in odgovorna oseba posameznika, ki samostojno opravlja dejavnost, če stori prekršek iz prvega odstavka tega člena.
(4) Z globo od 100 do 500 eurov se kaznuje posameznik, če stori prekršek iz prvega odstavka tega člena.
192. člen
(hujši prekrški)
(1) Z globo od 8.000 do 120.000 eurov se za prekršek kaznuje pravna oseba, če:
– preseže izdelano količino na letni ravni 50.000 pakiranj (prvi odstavek 8. člena tega zakona),
– galensko izdeluje zdravila v nasprotju z drugim odstavkom 8. člena tega zakona,
– uporablja industrijsko proizvedena zdravila, intermediate, vmesne izdelke ali polizdelke za izdelavo galenskih zdravil v nasprotju s četrtim odstavkom 8. člena tega zakona,
– izdeluje galenska zdravila v večji količini brez predhodne odobritve JAZMP (peti odstavek 8. člena tega zakona),
– oglašuje ali da v promet izdelke kakorkoli predstavljene z lastnostmi za zdravljenje ali preprečevanje bolezni pri ljudeh ali živalih, če po tem zakonu ne veljajo za zdravila (prvi odstavek 9. člena tega zakona),
– izdelke, ki po tem zakonu ne veljajo za zdravila, predstavlja pacientom ali kupcem z lastnostmi za zdravljenje in preprečevanje bolezni (drugi odstavek 9. člena tega zakona),
– pri predpisovanju in izdajanju zdravil ne ravna v skladu s 14. členom tega zakona,
– da v promet zdravilo iz 21. člena tega zakona,
– JAZMP ne obvesti o neustrezni kakovosti zdravila oziroma sumu na ponarejanje zdravila (23. člen tega zakona),
– nima sklenjene pogodbe s proizvajalcem v skladu z drugim odstavkom 27. člena tega zakona,
– zdravilo ni proizvedeno in kontrolirano v skladu z 28. členom tega zakona,
– klinično preskuša nerutinsko pripravljeno zdravilo za napredno zdravljenje (tretji odstavek 33. člena tega zakona),
– kliničnega preskušanja zdravil ne opravi v skladu s 34. in 35. členom tega zakona,
– ne zavaruje svoje odgovornosti za morebitno škodo, nastalo s preskušanjem zdravila v skladu s 36. členom tega zakona,
– JAZMP ne priglasi pomembnih sprememb pri kliničnih preskušanjih, ki že potekajo (prvi odstavek 38. člena tega zakona),
– ne priglasi neintervencijskega kliničnega preskušanja JAZMP v skladu s prvim odstavkom 40. člena tega zakona,
– ne pripravi poročila JAZMP o poteku in rezultatih preskušanja v skladu s četrtim odstavkom 40. člena tega zakona,
– ne obvesti pacienta o vključitvi v neintervencijsko klinično preskušanje zdravila (peti odstavek 40. člena tega zakona),
– če da v promet generično zdravilo v nasprotju s 45. in 46. členom tega zakona,
– pogojev in obveznosti v zvezi z varnostjo zdravila ne vključi v sistem obvladovanja tveganj (sedmi odstavek 58. člena tega zakona),
– JAZMP ne sporoči novih podatkov oziroma vseh podatkov v skladu s prvim in drugim odstavkom 62. člena tega zakona,
– odproda zdravila po spremembi ali izteku dovoljenja za promet v nasprotju s 67. členom tega zakona,
– daje v promet zdravilo za napredno zdravljenje v nasprotju s prvim odstavkom 71. členom tega zakona,
– da v promet oziroma pripravi nerutinsko pripravljena zdravila za napredno zdravljenje v nasprotju z 71. členom tega zakona,
– ne izpolnjuje pogojev iz 72. člena tega zakona,
– ravna v nasprotju s prvim in drugim odstavkom 74. člena tega zakona,
– ne posreduje letnega poročila v skladu s 75. členom tega zakona,
– iznaša in izvaža ter vnaša in uvaža nerutinsko pripravljena zdravila za napredno zdravljenje (76. člen tega zakona),
– nima zavarovane odgovornosti za morebitno škodo, povzročeno pacientu ali živali (drugi odstavek 77. člena tega zakona),
– uporabi nerutinsko pripravljeno zdravilo za napredno zdravljenje brez pridobitve in pregleda potrdila o skladnosti (peti odstavek 77. člena tega zakona),
– nima vzpostavljenega sistema, ki za vsakega pacienta oziroma žival in izdelek omogoča dovolj podatkov za sledljivost ter ne spremlja poteka zdravljenja (šesti in sedmi odstavek 77. člena tega zakona),
– ni priglašen v register zdravnikov oziroma veterinarjev (prvi odstavek 78. člena tega zakona),
– ne sporoči JAZMP spremembe podatkov v skladu s tretjim odstavkom 78. člena tega zakona,
– ne označi ali opremi nerutinsko pripravljenega zdravila za napredno zdravljenje z navodili za uporabo v skladu z 79. členom tega zakona,
– nima vzpostavljenega in ne vzdržuje sistema, ki zagotavlja sledljivost nerutinsko pripravljenega zdravila za napredno zdravljenje ter vhodnih snovi in surovin, vključno z materiali, v skladu s prvim odstavkom 80. člena tega zakona,
– ne hrani oziroma zagotavlja podatkov o sledljivosti v skladu z drugim in tretjim odstavkom 80. člena tega zakona,
– ne zagotavlja sistema sledljivosti nerutinsko pripravljenega zdravila za napredno zdravljenje v skladu s četrtim odstavkom 80. člena tega zakona,
– ne obvesti JAZMP o domnevnih neželenih učinkih v skladu s petim odstavkom 82. člena tega zakona,
– oglašuje nerutinsko pripravljena zdravila za napredno zdravljenje, njegovo pripravo ali zdravljenje z njim (81. člen tega zakona),
– nima vzpostavljenega sistema farmakovigilance v skladu s prvim odstavkom 82. člena tega zakona,
– nima odgovorne osebe za farmagovilanco v skladu z drugim in tretjim odstavkom 82. člena tega zakona,
– na zahtevo JAZMP ne predloži načrta za obvladovanje tveganj v skladu s četrtim odstavkom 82. člena tega zakona,
– če pripravlja nerutinsko pripravljeno zdravilo v nasprotju s prvim odstavkom 83. člena tega zakona,
– če ne obvesti JAZMP o spremembah v skladu s prvim odstavkom 85. člena tega zakona,
– zdravilo ni označeno in nima navodila za uporabo v skladu s 87. členom tega zakona,
– zdravilo za uporabo v humani medicini nima pritrjenega zaščitnega elementa za zdravilo v skladu z 88. členom tega zakona,
– ne zagotovi pripomočka za odkrivanje posega v zunanjo ovojnino (tretji odstavek 88. člena tega zakona),
– če zaščitni element na zdravilu delno ali v celoti odstrani ali prekrije v nasprotju s petim odstavkom 88. člena tega zakona,
– proizvaja zdravila v nasprotju z dovoljenjem za promet z zdravilom (90. člen tega zakona),
– ne izpolnjuje pogojev za proizvodnjo zdravil iz 91. člena tega zakona,
– odgovorna oseba za sproščanje posameznih serij zdravil ne izpolnjuje pogojev iz 92. člena tega zakona,
– ravna v nasprotju z obveznostmi za proizvajalce zdravil iz 93. člena tega zakona,
– JAZMP ne sporoči vsake spremembe pogojev iz 91. člena tega zakona (96. člen tega zakona),
– ne izpolnjuje pogojev za proizvodnjo učinkovin (prvi odstavek 100. člena tega zakona),
– ne obvesti JAZMP in imetnika dovoljenja za promet z zdravilom o ponaredkih učinkovin ali sumu nanje (drugi odstavek 100. člena tega zakona),
– opravlja dejavnost v nasprotju s 101. členom tega zakona,
– JAZMP ne sporoči vsake spremembe pogojev iz 100. člena tega zakona, ki pomembno vpliva na kakovost ali varnost učinkovine, ki jo proizvaja (102. člen tega zakona),
– opravlja proizvodnjo pomožnih snovi v nasprotju s smernicami in načeli dobre proizvodne prakse za pomožne snovi (103. člen tega zakona),
– ravna v nasprotju s 104. členom tega zakona,
– ne izpolnjuje pogojev za veletrgovce z zdravili v skladu s prvim in drugim odstavkom 105. člena tega zakona,
– ne izpolnjuje obveznosti veletrgovcev v skladu s 106. členom tega zakona,
– ne zagotavlja izpolnjevanja obveznosti storitev v javnem interesu v skladu s 107. členom tega zakona,
– ne opravlja dejavnosti prometa z učinkovinami na debelo v skladu s prvim, drugim in četrtim odstavkom 111. členom tega zakona,
– JAZMP ne obvesti o ponaredkih učinkovin v skladu s tretjim odstavkom 111. člena tega zakona,
– JAZMP takoj ne sporoči vsake spremembe pogojev iz drugega odstavka 111. člena tega zakona, ki pomembno vpliva na kakovost ali varnost učinkovine, s katero opravlja promet (113. člen tega zakona),
– uvaža zdravila v nasprotju s 114. členoma tega zakona,
– vnaša oziroma uvaža zdravila v nasprotju z drugim odstavkom 116. člena tega zakona,
– izvajalcem zdravstvene, veterinarske ali lekarniške dejavnosti ne zagotovi dobave zdravil v skladu z devetim odstavkom 116. člena tega zakona,
– pred začetkom paralelne distribucije o tem ne obvesti JAZMP v skladu s prvim in drugim odstavkom 118. člena tega zakona,
– uvaža učinkovine v nasprotju s 119. členom tega zakona,
– ne izpolnjuje pogojev za uvoz učinkovin v skladu s 120. členom tega zakona,
– ne obvesti JAZMP o ponaredkih učinkovin ali sumu nanje (drugi odstavek 120. člena tega zakona),
– izvaja dejavnost uvoza učinkovin brez vpisa v register uvoznikov učinkovin (četrti odstavek 121. člena tega zakona),
– ne sporoči vsake spremembe pogojev iz prvega odstavka 120. člena tega zakona, ki pomembno vpliva na kakovost ali varnost učinkovine, ki jo uvaža (prvi odstavek 122. člena tega zakona),
– ravna v nasprotju z obveznostmi za posrednika v skladu s 123. členom tega zakona,
– opravlja posredništvo zdravil ali učinkovin brez vpisa v register posrednikov zdravil in učinkovin pri JAZMP (prvi odstavek 124. člena tega zakona),
– ne obvesti JAZMP o spremembi podatkov iz četrtega odstavka 124. člena tega zakona,
– opravlja promet z zdravili na drobno v nasprotju s 126. členom tega zakona,
– izdaja zdravila prek medmrežja v nasprotju s 126. členom tega zakona,
– ne izpolnjuje pogojev za promet z zdravili na drobno v specializirani prodajalni v skladu s prvim odstavkom 127. člena tega zakona,
– ne opravlja nalog, določenih v 133. členu tega zakona,
– opravlja neintervencijsko klinično preskušanje zdravil brez soglasja JAZMP k osnutku protokola v skladu s prvim odstavkom 138. člena tega zakona,
– opravlja neintervencijsko klinično preskušanje zdravil brez soglasja iz tretjega odstavka 138. člena tega zakona,
– ne obvesti JAZMP, imetnika dovoljenja za promet z zdravilom in poslovne subjekte, ki opravljajo promet z zadevnimi zdravili, o primerih neustrezne kakovosti zdravil, ki lahko vplivajo na varnost ali učinkovitost zdravila, ali sumu nanje (prvi odstavek 139. člena tega zakona),
– ne umakne oporečnega zdravila iz prometa oziroma ne izvede drugih potrebnih ukrepov in o svojih aktivnostih sproti in brez odlašanja ne obvešča JAZMP (drugi odstavek 139. člena tega zakona),
– takoj ne obvesti pristojnih organov držav članic Evropske unije, v katerih je zdravilo v prometu, o vseh ukrepih glede umika zdravila iz prometa ali začasnega odvzema oziroma odvzema dovoljenja za promet z zdravilom, skupaj z razlogi za tako ukrepanje, če so ukrepi povezani z učinkovitostjo zdravila ali varovanjem javnega zdravja (tretji odstavek 139. člena tega zakona),
– ne ravna v skladu s sedmim odstavkom 141. člena tega zakona,
– poslovno donira zdravila v nasprotju s tretjim odstavkom 142. člena tega zakona,
– poslovno donira zdravila, ki so namenjena sočutni uporabi (četrti odstavek 142. člena tega zakona),
– nadalje prodaja poslovno donirana zdravila (peti odstavek 142. člena tega zakona),
– donira zdravila v nasprotju s sedmim, osmim in devetim odstavkom 142. člena tega zakona,
– poslovno donira zdravila v nasprotju z desetim odstavkom 142. člena tega zakona,
– ne ravna v skladu z osmim odstavkom 144. člena tega zakona,
– ne priglasi poslovne donacije v skladu z enajstim odstavkom 142. člena tega zakona,
– oglašuje zdravila v nasprotju s 147. členom tega zakona,
– oglašuje zdravila širši javnosti v nasprotju s 148. členom tega zakona,
– oglašuje zdravila strokovni javnosti v nasprotju s 149. členom tega zakona,
– ne posreduje podatkov oziroma jih ne posreduje v rokih iz devetega odstavka 163. člena tega zakona,
– ne prodaja zdravil po ceni iz petega odstavka 163. člena tega zakona,
– ne zaračunava cene v skladu s šestim odstavkom 163. člena tega zakona,
(2) Z globo od 500 do 3.000 eurov se kaznuje samostojni podjetnik posameznik ali posameznik, ki samostojno opravlja dejavnost, če stori prekršek iz prejšnjega odstavka.
(3) Z globo od 500 do 5.000 eurov se kaznuje tudi odgovorna oseba pravne osebe, odgovorna oseba samostojnega podjetnika posameznika in odgovorna oseba posameznika, ki samostojno opravlja dejavnost, če stori prekršek iz prvega odstavka tega člena.
(4) Z globo od 400 do 4.000 eurov se kaznuje posameznik, če stori prekršek iz prvega odstavka tega člena.
193. člen
(pooblastilo za izrek globe v razponu)
V primerih iz 191. in 192. člena tega zakona lahko farmacevtski inšpektor v hitrem postopku o prekršku izreče globo v katerikoli višini znotraj razpona, ki je predpisana v posameznem členu.
XX. PREHODNE IN KONČNE DOLOČBE
194. člen
(izdaja podzakonskih aktov)
(1) Podzakonski predpisi iz tega zakona se sprejmejo v 18 mesecih po uveljavitvi tega zakona.
(2) Ne glede na prejšnji odstavek se podzakonski predpisi sprejmejo:
1. v dveh mesecih od uveljavitve tega zakona:
– iz tretjega odstavka 44. člena tega zakona,
– iz osmega odstavka 58. člena tega zakona,
– iz sedmega odstavka 62. člena tega zakona,
– iz sedmega odstavka 63. člena tega zakona,
– iz sedmega odstavka 87. člena tega zakona,
– iz 137. člena tega zakona,
– iz četrtega odstavka 138. člena tega zakona in
– iz drugega odstavka 140. člena tega zakona;
2. v treh mesecih od uveljavitve tega zakona:
– iz šestega odstavka 94. člena zakona,
– iz četrtega odstavka 95. člena tega zakona,
– iz tretjega odstavka 96. člena tega zakona,
– iz šestega odstavka 99. člena tega zakona,
– iz enajstega odstavka 101. člena tega zakona,
– iz šestega odstavka 102. člena tega zakona,
– iz šestega odstavka 104. člena tega zakona,
– iz četrtega odstavka 105. člena tega zakona,
– iz četrtega odstavka 109. člena tega zakona,
– iz šestega odstavka 110. člena tega zakona,
– iz enajstega odstavka 112. člena tega zakona,
– iz petega odstavka 113. člena tega zakona,
– iz šestega odstavka 119. člena tega zakona,
– iz enajstega odstavka 121. člena tega zakona,
– iz šestega odstavka 122. člena tega zakona in
– iz sedmega odstavka 124. člena tega zakona.
(3) Do uveljavitve podzakonskih predpisov, izdanih na podlagi tega zakona, se uporabljajo naslednji podzakonski predpisi, izdani na podlagi Zakona o zdravilih (Uradni list RS, št. 31/06 in 45/08), če niso v nasprotju s tem zakonom ali če zakon ne določa drugače:
– Pravilnik o natančnejših pogojih za opravljanje dejavnosti izdelave zdravil in ugotavljanju izpolnjevanja teh pogojev ter o postopku izdajanja ali odvzema potrdila o izvajanju dobre proizvodne prakse (Uradni list RS, št. 91/08),
– Pravilnik o pogojih, načinu in postopku za pridobitev dovoljenja za vnos oziroma uvoz zdravil za uporabo v humani medicini (Uradni list RS, št. 65/12 in 20/13),
– Pravilnik o natančnejših pogojih za opravljanje dejavnosti prometa z zdravili na debelo in ugotavljanju izpolnjevanja teh pogojev ter o postopku priglasitve dejavnosti ali pridobitve dovoljenja za promet z zdravili na debelo (Uradni list RS, št. 46/09),
– Pravilnik o pridobitvi dovoljenja za promet s paralelno uvoženim zdravilom in paralelni distribuciji zdravil (Uradni list RS, št. 49/09),
– Pravilnik o natančnejših pogojih, ki jih morajo izpolnjevati specializirane prodajalne z zdravili na drobno, in o postopku ugotavljanja teh pogojev (Uradni list RS, št. 64/09),
– Pravilnik o pogojih, ki jih morajo izpolnjevati preskuševalci za analizno preskušanje zdravil in postopek preverjanja pogojev (Uradni list RS, št. 16/10),
– Pravilnik o označevanju in navodilu za uporabo zdravil za uporabo v humani medicini (Uradni list RS, št. 21/12 in 52/12),
– Pravilnik o tradicionalnih zdravilih rastlinskega izvora (Uradni list RS, št. 55/06),
– Pravilnik o dovoljenju za promet z zdravilom za uporabo v humani medicini (Uradni list RS, št. 109/10),
– Pravilnik o barvilih, ki se smejo dodajati zdravilom (Uradni list RS, št. 86/08),
– Pravilnik o razvrščanju, predpisovanju in izdajanju zdravil za uporabo v humani medicini (Uradni list RS, št. 86/08, 45/10 in 38/12),
– Pravilnik o homeopatskih zdravilih za uporabo v humani medicini (Uradni list RS, št. 94/08),
– Pravilnik o oglaševanju zdravil (Uradni list RS, št. 105/08, 98/09 – ZMedPri in 105/10),
– Pravilnik o pristojbinah na področju zdravil (Uradni list RS, št. 65/11),
– Pravilnik o načinu in postopku analiznega, farmakološko-toksikološkega in kliničnega preskušanja zdravil za uporabo v humani medicini (Uradni list RS, št. 86/08 in 37/10),
– Pravilnik o analiznem preskušanju zdravil z namenom kontrole kakovosti zdravil (Uradni list RS, št. 10/12),
– Pravilnik o kliničnem preskušanju zdravil (Uradni list RS, št. 54/06),
– Pravilnik o radiofarmacevtskih izdelkih (Uradni list RS, št. 86/08),
– Pravilnik o določitvi enotnega nacionalnega poimenovanja zdravilnih učinkovin in sistemu razvrščanja zdravil po anatomsko-terapevtsko-kemični klasifikaciji (Uradni list RS, št. 86/08),
– Pravilnik o določanju cen zdravil za uporabo v humani medicini (Uradni list RS, št. 102/10, 6/12 in 16/13),
– Pravilnik o natančnejših pogojih in postopku za ugotavljanje medsebojne zamenljivosti zdravil (Uradni list RS, št. 102/10),
– Pravilnik o farmakovigilanci zdravil za uporabo v veterinarski medicini (Uradni list RS, št. 53/06),
– Pravilnik o razvrščanju, predpisovanju in izdajanju zdravil za uporabo v veterinarski medicini (Uradni list RS, št. 91/08),
– Pravilnik o načinu in postopku analiznega, farmakološko-toksikološkega in kliničnega preskušanja zdravil za uporabo v veterinarski medicini (Uradni list RS, št. 91/08 in 79/09),
– Pravilnik o označevanju in navodilu za uporabo zdravila za uporabo v veterinarski medicini (Uradni list RS, št. 101/09),
– Pravilnik o izjemni uporabi zdravil za zdravljenje živali in evidencah o zdravljenju živali (Uradni list RS, št. 53/06),
– Pravilnik o metodologiji za oblikovanje cen preskušanja zdravil pri izvajanju kontrole kakovosti zdravil (Uradni list RS, št. 68/09),
– Pravilnik o strokovnem izpitu za farmacevtskega nadzornika (Uradni list RS, št. 86/08),
– Pravilnik o določitvi nacionalnega dodatka k Evropski farmakopeji (Uradni list RS, št. 118/06),
– Pravilnik o farmakovigilanci zdravil za uporabo v humani medicini (Uradni list RS, št. 53/06 in 16/11),
– Pravilnik o odpoklicu zdravil (Uradni list RS, št. 105/08),
– Pravilnik o sistemu za sprejem, shranjevanje in sledljivost zdravil (Uradni list RS, št. 81/09),
– Pravilnik o uporabi tablet kalijevega jodida ob jedrski ali radiološki nesreči (Uradni list RS, 59/10),
– Pravilnik o dovoljenju za promet za zdravilo za uporabo v veterinarski medicini (Uradni list RS, št. 16/11),
– Odredba o določitvi pravne osebe za spremljanje neželenih škodljivih učinkov zdravil in neželenih učinkov medicinskih pripomočkov (Uradni list RS, št. 100/00 in 61/10).
(4) Z uveljavitvijo tega zakona prenehajo veljati naslednji podzakonski predpisi:
– Pravilnik o razvrstitvi vitaminskih in mineralnih izdelkov za peroralno uporabo, ki so v farmacevtskih oblikah, med zdravila (Uradni list RS, št. 86/08),
– Pravilnik o razvrstitvi zdravilnih rastlin (Uradni list RS, št. 103/08).
195. člen
(postopki po uveljavitvi tega zakona)
(1) Za postopke, ki so se začeli pred uveljavitvijo tega zakona in na njegovi podlagi izdanih podzakonskih predpisov ali glede katerih je bilo ob uveljavitvi tega zakona že vloženo pravno sredstvo, se uporablja Zakon o zdravilih (Uradni list RS, št. 31/06 in 45/08) in na njegovi podlagi izdani predpisi, razen če so določbe tega zakona ugodnejše za stranko.
(2) Ne glede na prejšnji odstavek lahko JAZMP od predlagatelja, ki je vložil vlogo pred uveljavitvijo tega zakona in do končanega postopka zahteva dodatno ali drugačno dokumentacijo oziroma upošteva dodatna dokazila v skladu s tem zakonom, če je to potrebno za varovanje javnega zdravja.
196. člen
(prehodne določbe glede nerutinsko pripravljenih zdravil za napredno zdravljenje)
(1) Poslovni subjekti, ki opravljajo dejavnost priprave nerutinsko pripravljenega zdravila za napredno zdravljenje, morajo v primeru, da to dejavnost opravljajo brez veljavnega dovoljenja, najpozneje v 60 dneh od dneva uveljavitve podzakonskih predpisov, izdanih na podlagi tega zakona, ki urejajo to področje, vložiti vlogo za pridobitev dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje v skladu s tem zakonom in podzakonskimi predpisi, ki urejajo to področje.
(2) Poslovni subjekti, ki opravljajo dejavnost priprave nerutinsko pripravljenega zdravila za napredno zdravljenje, morajo v primeru, da to dejavnost opravljajo na podlagi veljavnega dovoljenja o preskrbi s tkivi in celicami, najpozneje v enem letu od uveljavitve podzakonskih predpisov, izdanih na podlagi tega zakona, ki urejajo to področje, vložiti vlogo za pridobitev dovoljenja za pripravo nerutinsko pripravljenega zdravila za napredno zdravljenje v skladu s tem zakonom.
(3) Če vloge iz prvega in drugega odstavka tega člena v roku poslovni subjekti ne vložijo, ne smejo opravljati dejavnost priprave nerutinsko pripravljenega zdravila za napredno zdravljenje.
197. člen
(obveznosti imetnikov dovoljenj za izdelavo zdravil po uveljavitvi podzakonskih predpisov)
(1) Imetniki dovoljenj za izdelavo zdravil, veljavnih na dan uveljavitve tega zakona, morajo najpozneje v 30 dneh od uveljavitve podzakonskih predpisov, izdanih na podlagi tega zakona, ki urejajo vpis v register proizvajalcev učinkovin, in podzakonskih predpisov, ki urejajo proizvodnjo zdravil, predlagati spremembo dovoljenja za opravljanje te dejavnosti.
(2) Če vloge iz prejšnjega odstavka v navedenem roku poslovni subjekti ne vložijo, ne smejo opravljati dejavnost iz prejšnjega odstavka.
198. člen
(obveznosti imetnikov dovoljenj za opravljanje dejavnosti prometa z zdravili na debelo po uveljavitvi podzakonskih predpisov)
(1) Imetniki dovoljenj za opravljanje dejavnosti prometa z zdravili na debelo, veljavnih na dan uveljavitve tega zakona, morajo najpozneje v 30 dneh od uveljavitve podzakonskih predpisov, izdanih na podlagi tega zakona, ki urejajo vpis v register veletrgovcev z učinkovinami, in podzakonskih predpisov, izdanih na podlagi tega zakona, ki urejajo področje prometa z zdravili na debelo, predlagati spremembo dovoljenja za opravljanje dejavnosti prometa z zdravili na debelo.
(2) Če vloge v roku iz prejšnjega odstavka poslovni subjekti ne vložijo, ne smejo opravljati dejavnost iz prejšnjega odstavka.
199. člen
(prehodno obdobje za opravljanje dejavnosti proizvodnje, prometa in uvoza učinkovin)
(1) Poslovni subjekti, ki opravljajo dejavnost proizvodnje, prometa in uvoza učinkovin, opravljajo svojo dejavnost na podlagi veljavnih dovoljenj JAZMP, vendar na tej podlagi ne dlje kot do zaključka postopka vpisa v register proizvajalcev, veletrgovcev in uvoznikov učinkovin na podlagi tega zakona.
(2) Vlogo za vpis v registre iz prejšnjega odstavka morajo poslovni subjekti vložiti najpozneje v 60 dneh od uveljavitve podzakonskih predpisov, izdanih na podlagi tega zakona, ki urejajo vpis v register proizvajalcev, veletrgovcev in uvoznikov učinkovin.
(3) Do vzpostavitve mehanizmov iz tretjega in četrtega odstavka 119. člena tega zakona lahko uvozniki učinkovin uvažajo učinkovine, namenjene proizvodnji zdravil za uporabo v humani medicini na podlagi inšpekcijskega pregleda, ki ga je v zadnjih treh letih v državi izvoznici opravila država članica Evropske unije in ugotovila, da je proizvodnja skladna z dobro proizvodno prakso za učinkovine, ali na podlagi izjave odgovorne osebe za sproščanje proizvajalca zdravil, da je učinkovina, ki se uvaža, izdelana v skladu z dobro proizvodno prakso za učinkovine.
200. člen
(prehodno obdobje za strokovne sodelavce za oglaševanje zdravil)
(1) Strokovni sodelavci za oglaševanje zdravil, ki na dan uveljavitve tega zakona izpolnjujejo pogoje iz 88. člena Zakona o zdravilih (Uradni list RS, št. 31/08 in 45/08) in katerih podatke imetniki dovoljenja za promet z zdravilom sporočijo JAZMP na podlagi določb Pravilnika o oglaševanju zdravil (Uradni list RS, št. 105/08, 98/09 – ZMedPri in 105/10) ter z uveljavitvijo tega zakona ne izpolnjujejo pogojev glede izobrazbe, imajo pa vsaj dveletne izkušnje na področju oglaševanja zdravil, ki vključujejo dokumentiran program usposabljanja s področja znanj o delovanju človeškega ali živalskega organizma, lahko opravljajo svojo dejavnost tudi naprej.
(2) Vlogo za vpis v register strokovnih sodelavcev za oglaševanje zdravil morajo imetniki dovoljenja za promet z zdravilom za strokovne sodelavce za oglaševanje zdravil iz prejšnjega odstavka, vložiti najpozneje v 30 dneh od dneva uveljavitve predpisa, izdanega na podlagi tega zakona, ki ureja vpis v register strokovnih sodelavcev za oglaševanje zdravil.
201. člen
(veljavnost dovoljenj za vnos oziroma uvoz zdravil)
Dovoljenja za vnos oziroma uvoz zdravil, izdana na podlagi Zakona o zdravilih (Uradni list RS, št. 31/06 in 45/08), ki so veljavna na dan uveljavitve tega zakona, veljajo do izteka v njih določenega roka.
202. člen
(veljavnost dovoljenj za opremljanje zdravil v tuji ovojnini z nalepko v slovenskem jeziku)
Dovoljenja za opremljanje zdravil v tuji ovojnini z nalepko v slovenskem jeziku in dovoljenja za drugačno označevanje zdravil, izdana na podlagi Zakona o zdravilih (Uradni list RS, št. 31/06 in 45/08), ki so veljavna na dan uveljavitve tega zakona, veljajo do izteka v njih določenega roka.
203. člen
(prehodne določbe za področje farmakovigilance)
(1) Za zdravila, za katera je bilo dovoljenje za promet izdano pred 21. julijem 2012, obveznost vodenja glavnega dosjeja o sistemu farmakovigilance in dostopa JAZMP do njega velja od podaljšanja dovoljenja za promet z zdravilom ali od 21. julija 2015, kar nastopi prej.
(2) Imetnikom dovoljenj za promet z zdravili, za katera je bilo dovoljenje za promet izdano pred 21. julijem 2012, ni treba izvajati sistema obvladovanja tveganj za vsako zdravilo, razen kadar obstajajo varnostni zadržki, ki bi lahko vplivali na razmerje med koristjo in tveganjem zdravila in to zahteva JAZMP.
(3) Postopek iz 107.m do 107.p člena Direktive 2001/83/ES se uporablja samo za študije iz tretjega odstavka 58. člena tega zakona, ki so bile odrejene po 21. juliju 2012.
(4) Obveznost elektronskega poročanja iz tretjega odstavka 107. člena Direktive 2001/83/ES začne veljati šest mesecev po obvestilu EMA o vzpostavitvi funkcionalnosti podatkovne baze EudraVigilance, kot so določene v 24. členu Uredbe 726/2004/ES.
(5) Do roka iz prejšnjega odstavka imetnik dovoljenja za promet z zdravilom v 15 dneh od dneva seznanitve z resnim domnevnim neželenim učinkom zdravila, ki se je pojavil na ozemlju Republike Slovenije, poroča JAZMP. O resnem domnevnem neželenem učinku zdravila, ki se je pojavil na ozemlju tretjih držav, imetnik dovoljenja za promet z zdravilom poroča neposredno v bazo EudraVigilance. O domnevnih neželenih učinkih, ki niso resni in se pojavijo na ozemlju Republike Slovenije, imetnik dovoljenja za promet z zdravilom poroča JAZMP na podlagi njene javno objavljene zahteve v 90 dneh od dneva seznanitve z njimi.
(6) Imetnik dovoljenj za promet z zdravili mora vzpostaviti elektronsko posredovanje rednih posodobljenih poročil o varnosti zdravil, kot je določeno v prvem odstavku 107.b člena Direktive 2001/83/ES, EMA najpozneje 12 mesecev po tem, ko EMA vzpostavi elektronski arhiv in to objavi.
204. člen
(prehodno obdobje glede količinskih potreb zdravil)
Zbiranje količinskih potreb zdravil v skladu s šestim in sedmim odstavkom 116. člena tega zakona JAZMP začne najpozneje tri mesece po uveljavitvi predpisa, ki ureja to področje ter začne izdajati potrdila in dovoljenja v skladu z določbami petega in osmega odstavka 116. člena tega zakona za vnos oziroma uvoz zdravil devet mesecev po začetku zbiranja količinskih potreb.
205. člen
(prehodno obdobje za nadaljevanje dela nadzornikov in za izdajo zdravil prek medmrežja ter vzpostavitev centralne baze zdravil)
(1) Z uveljavitvijo tega zakona farmacevtski nadzorniki iz 101., 102. in 104. člena Zakon o zdravilih (Uradni list RS, št. 31/06 in 45/08), nadzorniki iz 7. člena Zakona o preskrbi s krvjo (Uradni list RS, št. 104/06) in nadzorniki iz 9. člena Zakona o kakovosti in varnosti človeških tkiv in celic, namenjenih za zdravljenje (Uradni list RS, št. 61/07), ki imajo ob uveljavitvi tega zakona opravljen strokovni izpit za inšpektorja in za farmacevtskega nadzornika v skladu s Pravilnikom o strokovnem izpitu za farmacevtskega nadzornika (Uradni list RS, št. 86/08) in ki na dan uveljavitve tega zakona opravljajo naloge farmacevtskih nadzornikov oziroma nadzornikov, nadaljujejo z delom kot farmacevtski inšpektorji.
(2) Farmacevtski inšpektorji iz prejšnjega odstavka morajo pridobiti dodatna strokovna znanja v 60 dneh od uveljavitve predpisa iz drugega odstavka 166. člena tega zakona.
(3) Glede položaja, načina dela, ukrepov in pooblastil farmacevtskih inšpektorjev iz prvega odstavka tega člena se uporabljajo določbe 166., 167. in 173. člena tega zakona.
(4) Minister izda predpis iz triindvajsetega odstavka 126. člena tega zakona, ki se nanaša na natančnejše pogoje za oblikovanje in uporabo skupnega logotipa ter natančnejši postopek izdaje in odvzema dovoljenja za izdajo zdravil prek medmrežja, v šestih mesecih od objave izvedbenih ukrepov Evropske komisije na podlagi Direktive 2011/62/EU glede skupnega logotipa.
(5) Poslovni subjekti, ki izdajajo zdravila prek medmrežja na dan uveljavitve tega zakona, uskladijo svoje delovanje z določbo 126. člena tega zakona, v enem letu od uveljavitve predpisa iz prejšnjega odstavka.
(6) Centralna baza zdravil iz 163. člena tega zakona se vzpostavi v enem letu od uveljavitve tega zakona.
206. člen
(začetek delovanja uradnega kontrolnega laboratorija v okviru NLZOH)
(1) NLZOH in JAZMP začneta s postopkom za vključitev NLZOH v Evropsko mrežo kontrolnih laboratorijev pri EDQM najkasneje v roku enega meseca od dneva uveljavitve tega zakona.
(2) NLZOH začne izvajati naloge uradnega kontrolnega laboratorija v skladu s tem zakonom po vključitvi v Evropsko mrežo kontrolnih laboratorijev pri EDQM najprej šest mesecev od uveljavitve tega zakona, vendar najkasneje v enem letu od uveljavitve tega zakona.
(3) Do začetka izvajanja nalog iz prejšnjega odstavka naloge uradnega kontrolnega laboratorija izvaja JAZMP.
207. člen
(prostori, oprema in materiali uradnega kontrolnega laboratorija v okviru NLZOH)
(1) NLZOH od JAZMP prevzame poslovne prostore, opremo, materiale za izvajanje analiznega preskušanja zdravil,dokumentacijo, arhiv in nedokončane zadeve, ki se nanašajo na izvajanje naloge uradnega kontrolnega laboratorija.
(2) Delavci JAZMP, ki so do začetka izvajanja nalog uradnega kontrolnega laboratorija v NLZOH v delovnem razmerju na JAZMP in izvajajo naloge uradnega kontrolnega laboratorija, ostanejo v delovnem razmerju na JAZMP tako, da se jim ponudi drugo zaposlitev na JAZMP, ki ustreza enaki vrsti in stopnji izobrazbe, kot se je zahtevala za opravljanje dela, za katero so imeli delavci sklenjene pogodbe o zaposlitvi na dan pred dnevom, ko je NLZOH začel izvajati naloge uradnega kontrolnega laboratorija.
208. člen
(prehodno obdobje za cene storitev uradne kontrole kakovosti zdravil)
Do prve objave cenika storitev uradne kontrole kakovosti zdravil na spletni strani NLZOH, NLZOH zaračunava te storitve po ceniku, ki je objavljen na spletni strani JAZMP na dan začetka izvajanja nalog uradnega kontrolnega laboratorija v skladu z drugim odstavkom 206. člena tega zakona.
209. člen
(začetek veljavnosti določb glede zaščitnega elementa in sporočila Evropski komisiji)
Določbe 88. člena tega zakona, ki se nanašajo na namestitev, prekritje in odstranitev zaščitnega elementa, začnejo veljati tri leta od dneva objave delegiranih aktov Evropske komisije, ki na podlagi Direktive 2011/62/ES o spremembi Direktive 2001/83/ES o zakoniku skupnosti o zdravilih za uporabo v humani medicini glede preprečevanja vstopa ponarejenih zdravil v zakoniti dobavno verigo (UL L št. 174 z dne 1. 7. 2011, str. 74) določajo značilnosti in tehnične specifikacije za zaščitne elemente in sezname zdravil ali kategorij zdravil, ki morajo ali jim ni treba nositi zaščitnega elementa.
210. člen
(začetek uporabe določb glede poročanja organa, pristojnega za veterinarstvo)
Določbe trinajstega odstavka 24. člena tega zakona se začnejo uporabljati tri leta po uveljavitvi tega zakona.
211. člen
(prenehanje veljavnosti)
Z dnem uveljavitve tega zakona prenehata veljati Zakon o zdravilih (Uradni list RS, št. 9/96 in 19/96) in Zakon o zdravilih (Uradni list RS, št. 31/06 in 45/08).
212. člen
(začetek veljavnosti)
Ta zakon začne veljati petnajsti dan po objavi v Uradnem listu Republike Slovenije.
Št. 520-01/13-4/62
Ljubljana, dne 24. februarja 2014
EPA 1508-VI
Državni zbor
Republike Slovenije
Janko Veber l.r.
Predsednik
“,”Jaka Verbic Miklic”,1521991560,1521991560,sl,12436,306,12417,43,0,NULL,,”Zakon o zdravilih (ZZdr-2) UL št. 17/2014, 7. 3. 2014″,zakon-o-zdravilih-(zzdr-2)-ul-st-17-2014-7-3-2014,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521991641,1524643493
265,12437,”Pravilnik o razvrščanju zdravil na listo “,”UL 35, 26/04/2013″,”
Na podlagi desetega in enajstega odstavka 23.c člena ter 26. člena Zakona o zdravstvenem varstvu in zdravstvenem zavarovanju (Uradni list RS, št. 72/06 – uradno prečiščeno be¬sedilo, 114/06 – ZUTPG, 91/07, 76/08 in 62/10 – ZUPJS, 87/11 in 40/12 – ZUJF), 1. točke prvega odstavka 70. člena in prvega odstavka 71. člena Statuta Zavoda za zdravstveno zavarovanje Slovenije (Uradni list RS, št. 87/01 in 1/02 – popr.) je Skupščina Zavoda za zdravstveno zavarovanje Slovenije na13. seji dne 3. 4. 2013 sprejela
P R A V I L N I K o razvrščanju zdravil na listo
I. SPLOŠNE DOLOČBE
1. Člen
(področja, ki jih ureja pravilnik)
Ta pravilnik določa:
1. natančnejši postopek in podrobnejša merila za razvr¬ščanje zdravil na listo zdravil,
2. natančnejši postopek in podrobnejša merila za izločitev zdravil z liste zdravil,
3. pogoje in postopek za določanje omejitev predpisova¬nja ali izdajanja posameznega zdravila,
4. stroške postopka,
5. način, postopek in merila ter roke za določanje naj¬višjih priznanih vrednosti za posamezne skupine medsebojno zamenljivih zdravil,
6. natančnejši postopek in natančnejše pogoje za dolo¬čanje terapevtskih skupin zdravil ter njihovih najvišjih priznanih vrednosti,
7. merila ter pogoje in postopek za sklenitev dogovora o ceni zdravil z Zavodom za zdravstveno zavarovanje Slovenije (v nadaljnjem besedilu: Zavod) in
8. evidence o zdravilih, ki so razvrščena na listo zdravil, najvišjih priznanih vrednostih za posamezne skupine med¬sebojno zamenljivih zdravil, terapevtskih skupinah zdravil in njihovih najvišjih priznanih vrednosti.
(2) Zavod razvršča zdravila na listo zdravil, prerazvršča zdravila z ene liste zdravil na drugo listo, izloča zdravila z liste zdravil, določa omejitev predpisovanja ali izdajanja posame¬znega zdravila in določa terapevtske skupine zdravil na podlagi strokovnega mnenja komisije za razvrščanje zdravil na listo zdravil iz 32. člena tega pravilnika.
2. člen
(izrazi)
Izrazi, uporabljeni v tem pravilniku, imajo naslednji pomen:
1. “Analiza finančnih učinkov (Budget Impact Analysis)” je analiza, katere cilj je natančna ocena finančnih posledic no¬vega načina zdravljenja v breme zdravstvenega zavarovanja.
2. “Analiza občutljivosti” je ocena posledic nezanesljivosti pri parametrih vrednotenja in pri predpostavkah, na katerih temelji farmakoekonomski model v analizi stroškovne učinko¬vitosti in analizi stroškovne koristnosti.
3. “Analiza stroškov (Cost Analysis)” je vrsta ekonomske analize, ki upošteva le stroške zdravljenja ne glede na izide zdravljenja.
4. “Analiza stroškovne učinkovitosti (Cost-Effectiveness Analysis)” je vrsta ekonomske analize, ki primerja stroške zdravljenja, izražene v monetarnih enotah, in izide zdravljenja, izražene v enotah kliničnih izidov, kot so dodatno leto življenja.
5. “Analiza stroškovne koristnosti (Cost-Utility Analysis)” je podvrsta analize stroškovne učinkovitosti, kjer je izid zdra¬vljenja izražen v enotah humanističnih izidov, kot so leta zdra¬vstveno kakovostnega življenja (QALY), ki temelji na pacientovi subjektivni oceni kakovosti njegovega zdravstvenega stanja.
6. “Analiza zmanjševanja stroškov (Cost-Minimization Analysis)” je vrsta ekonomske analize, ki primerja le stroške zdravljenja, ker med izidi zdravljenj ni razlik.
7. “Bolnišnica” je izvajalec zdravstvene dejavnosti, ki opravlja specialistično bolnišnično dejavnost ali specialistično ambulantno dejavnost na sekundarni ali terciarni ravni zdra¬vstvene dejavnosti.
8. “Bolnišnično zdravilo” je zdravilo, ki ga je zaradi njego¬vih lastnosti mogoče dajati le v bolnišnici.
9. “Cena zdravila” je veljavna cena zdravila, dogovorjena ali določena v skladu z zakonom, ki ureja zdravila, in je podlaga za obračun zdravila zdravstvenemu zavarovanju ali izvajalcem zdravstvene dejavnosti.
10. “Definirani dnevni odmerek” je enota Svetovne zdra¬vstvene organizacije za porabo zdravil.
11. “Diskontna stopnja” je stopnja, s katero se izračuna sedanja vrednost prihodnjih denarnih tokov.
12. “Dodana vrednost zdravila” je vrednost zdravila, ki se izrazi z relativno terapevtsko vrednostjo ali ekonomsko pred¬nostjo glede na primerjalno zdravilo.
13. “Galensko zdravilo” je zdravilo za uporabo v humani medicini, kakor je opredeljeno v zakonu, ki ureja zdravila.
14. “Generično zdravilo” je zdravilo, kakor je opredeljeno v zakonu, ki ureja zdravila.
15. “Imetnik dovoljenja” je skupni izraz za imetnika do¬voljenja za promet z zdravilom oziroma njegovega zastopnika v Republiki Sloveniji, imetnika dovoljenja za promet s paralel¬no uvoženim zdravilom, imetnika dovoljenja za vnos ali uvoz zdravila, razvrščenega na seznam nujno potrebnih zdravil za uporabo v humani medicini, ter imetnika pozitivnega mnenja Evropske agencije za zdravila za paralelno distribucijo zdravila.
16. “Izločitev z liste zdravil” pomeni ukinitev kritja obve¬znega zdravstvenega zavarovanja za zdravilo, ker ni več pred¬met razvrščanja iz 3. člena tega pravilnika ali ker ne izpolnjuje več meril iz 5. člena tega pravilnika ali ker je prišlo do izpolnitve enega od meril iz 16. člena tega pravilnika.
17. “Izredna višja dovoljena cena” je cena, kakor je opre¬deljena v zakonu, ki ureja zdravila.
18. “Izvajalec zdravstvene dejavnosti” je fizična ali pravna oseba, ki ima z Zavodom sklenjeno pogodbo za opravljanje zdravstvene dejavnosti.
19. “Javna agencija” je Javna agencija Republike Slove¬nije za zdravila in medicinske pripomočke.
20. “Končni izid zdravljenja” je izid, ki se nanaša na čas podaljšanja življenja za zdravljeno bolezen ali čas do njene ponovitve.
21. “Lista zdravil” je skupni izraz za pozitivno in vmesno listo zdravil na recept ter seznam bolnišničnih zdravil.
22. “Magistralno zdravilo” je zdravilo za uporabo v humani medicini, kakor je opredeljeno v zakonu, ki ureja zdravila.
23. “Nadomestno zdravilo” je zdravilo, ki nima dovoljenja za promet v Republiki Sloveniji, ima pa posebno dovoljenje za vnos ali uvoz, in lahko v primeru motnje v preskrbi z razvršče¬nim zdravilom, ki ima enako učinkovino, tega nadomesti.
24. “Nadomestni izid zdravljenja” je rezultat kliničnega izida (vrednost krvnega tlaka, holesterola, glikiranega hemo¬globina, hospitalizacije in podobno), na podlagi katerega je mogoče sklepati na učinkovitost zdravljenja.
25. “Najvišja dovoljena cena” je cena, kakor je opredelje¬na v zakonu, ki ureja zdravila.
26. “Najvišja priznana vrednost (NPV)” je cenovni stan¬dard, ki ga Zavod določi za posamezno zdravilo v skupini medsebojno zamenljivih zdravil in v terapevtski skupini zdravil, ki se krije iz obveznega zdravstvenega zavarovanja v celoti ali v ustreznem odstotnem deležu na podlagi zakona, ki ureja zdravstveno varstvo in zdravstveno zavarovanje (v nadaljnjem besedilu: zakon) in glede na razvrstitev zdravila na listo zdravil.
27. “Novo zdravilo” pomeni, da zdravilo z enako učinko¬vino še ni razvrščena na listo zdravil.
28. “Omejitev izdajanja” pomeni, da farmacevt v lekarni lahko izda zdravilo v breme obveznega zdravstvenega zava¬rovanja le v okviru določene omejitve.
29. “Omejitev predpisovanja” pomeni, da zdravnik lahko predpiše zdravilo v breme obveznega zdravstvenega zavaro¬vanja le v okviru določene omejitve.
30. “Oznaka razvrščenega zdravila” je sestavljena ozna¬ka, ki poleg oznake liste zdravil in odstotnega deleža, ki se krije iz obveznega zdravstvenega zavarovanja, lahko vsebuje ozna¬ko za zdravilo z določeno omejitvijo predpisovanja ali izdajanja in oznako za zdravilo z določeno najvišjo priznano vrednostjo.
31. “Oznaka zdravila iz seznama bolnišničnih zdravil” je sestavljena oznaka, ki poleg oznake seznama lahko vsebuje oznako za zdravilo z določeno omejitvijo predpisovanja in oznako za zdravilo z določeno najvišjo priznano vrednostjo.
32. “Podobno biološko zdravilo” je zdravilo, kakor je opre¬deljeno v zakonu, ki ureja zdravila.
33. “Postopek” je skupni izraz za postopek razvrščanja, prerazvrščanja, izločitve z liste zdravil ter postopek določitve ali spremembe omejitve predpisovanja ali izdajanja, ki se vodijo na podlagi tega pravilnika.
34. “Prerazvrščanje” je sprememba razvrstitve zdravila z ene liste zdravil na drugo listo zdravil.
35. “Prilagoditev farmakoekonomske analize” pomeni za slovenski prostor s slovenskimi vhodnimi podatki metodološko prilagoditev analize, narejene za eno od držav članic Evropske¬ga gospodarskega prostora.
36. “Primerjalno zdravilo” je zdravilo, ki je osnova za primerjavo zdravila v postopku pri ugotavljanju relativne tera¬pevtske vrednosti in v farmakoekonomskih analizah.
37. “Primerljiva oblika zdravila” je različna farmacevtska oblika zdravila s primerljivim sproščanjem in enako uporabo.
38. “Primerljivi odmerek” je odmerek zdravila, ki, glede na podatke iz povzetka glavnih značilnosti zdravila in strokovne literature, daje primerljiv klinični učinek glede na primerjalno zdravilo.
39. “Priporočeni odmerek” je vzdrževalni odmerek zdra¬vila za 70 kilogramov težko odraslo osebo za določeno tera¬pevtsko indikacijo.
40. “Razmerje stroškovne učinkovitosti (Incremental Cost–Effectiveness Ratio – ICER)” je razmerje prirastka stroškov in prirastka učinkovitosti ali koristnosti novega zdravljenja v primerjavi s standardnim zdravljenjem v Republiki Sloveniji.
41. “Razvrščanje” je odločanje o razvrstitvi zdravila na listo zdravil.
42. “Relativna terapevtska vrednost” je razlika med učin¬kovitostjo dveh ali več zdravil ali terapevtskih postopkov, ki predstavljajo primerljive alternative za doseganje želenega izi¬da zdravljenja v običajni klinični praksi. Za ugotavljanje relativ¬ne terapevtske vrednosti se uporabi zdravilo z isto terapevtsko indikacijo, v primerjavo pa se vključijo tudi ostala zdravila v farmakološko-terapevtski skupini, zlasti zdravila izbora iz tera¬pevtskih smernic in ostala najpogosteje uporabljana zdravila.
43. “Seznam medsebojno zamenljivih zdravil z NPV” je seznam Zavoda, ki vsebuje najvišje priznane vrednosti za raz¬vrščena zdravila s seznama medsebojno zamenljivih zdravil, ki ga objavlja Javna agencija.
44. “Terapevtska indikacija zdravila” je v povzetku glavnih značilnosti zdravila navedena bolezen ali motnja, pri kateri lah¬ko zdravilo učinkuje v smislu ozdravitve ali izboljšanja.
45. “Terapevtska skupina zdravil” je skupina zdravil, razvr¬ščenih na pozitivno in vmesno listo zdravil z enako terapevtsko indikacijo, ki lahko vključuje posamezna zdravila, kombinirana zdravila in različne farmacevtske oblike zdravila, ki jo določi Zavod.
46. “Zdravila na recept” so zdravila, ki jih Zavod razvrsti na pozitivno ali vmesno listo zdravil in jih osebni ali napotni zdravnik predpiše na recept ter se jih izda v lekarnah.
47. “Zdravilo sirota” je zdravilo za zdravljenje redkih bole¬zni, ki je pridobilo ta status od Evropske agencije za zdravila.
48. “Zdravljenje” je zdravstvena storitev, ki vključuje tudi zdravila.
49. “Zdravstvena institucija” je izvajalec zdravstvene de¬javnosti.
50. “Zdravstveno zavarovanje” je skupni izraz za obvezno in dopolnilno zdravstveno zavarovanje.
(2) V tem pravilniku imajo oznake in kratice naslednji pomen:
1. “ATC” pomeni anatomsko-terapevtsko-kemijsko klasi¬fikacijo zdravil,
2. “B” pomeni zdravilo s seznama bolnišničnih zdravil,
3. “C” ob oznaki liste zdravil pomeni zdravilo z določeno najvišjo priznano vrednostjo,
4. “IVDC” pomeni izredno višjo dovoljeno ceno,
5. “N” je oznaka za zdravilo, ki je izločeno z liste zdravil,
6. “NDC” pomeni najvišjo dovoljeno ceno,
7. “NPV” pomeni najvišjo priznano vrednost,
8. “P” pomeni pozitivno listo zdravil na recept,
9. “V” pomeni vmesno listo zdravil na recept,
10. “*” zvezdica ob razvrstitvi pomeni zdravilo z omejitvijo predpisovanja ali izdajanja.
3. člen
(predmet razvrščanja)
(1) Na listo zdravil se razvrščajo:
1. zdravila, ki imajo dovoljenje za promet v Republiki Sloveniji,
2. zdravila z dovoljenjem za promet za paralelni uvoz,
3. zdravila s pozitivnim mnenjem Evropske agencije za zdravila za paralelno distribucijo,
4. zdravila s seznama nujno potrebnih zdravil za uporabo v humani medicini, ki nimajo dovoljenja za promet, imajo pa posebno dovoljenje za vnos ali uvoz,
5. nadomestna zdravila,
6. galenska zdravila za uporabo v humani medicini, in
7. magistralna zdravila.
(2) Bolnišnično zdravilo se razvršča, če njegova cena v priporočenem odmerku presega vrednost 5.000 eurov na ose¬bo v enem letu v breme zdravstvenega zavarovanja.
4. člen
(lista zdravil)
(1) Zdravila na recept se razvrstijo na pozitivno listo zdra¬vil ali na vmesno listo zdravil.
(2) Bolnišnična zdravila se razvrstijo na seznam bolni¬šničnih zdravil.
(3) Zdravila se razvrstijo z lastniškimi imeni, razen magi¬stralnih zdravil.
II. MERILA ZA RAZVRŠČANJE IN PRERAZVRŠČANJE
5. člen
(merila)
V postopku razvrščanja in prerazvrščanja se zdravila oce¬njuje na podlagi naslednjih meril:
1. pomen zdravila z vidika javnega zdravja,
2. prednostne naloge izvajanja programa zdravstvenega varstva,
3. terapevtski pomen zdravila,
4. relativna terapevtska vrednost zdravila,
5. ocena farmakoekonomskih podatkov za zdravilo,
6. ocena etičnih vidikov,
7. prioritete programov zdravstvenega varstva ter
8. podatki in ocene iz referenčnih virov.
6. člen
(pomen za javno zdravje in prioritete programov zdravstvenega varstva)
(1) Za oceno pomena posameznega zdravila z vidika jav¬nega zdravja, prednostnih nalog izvajanja programa zdravstve¬nega varstva in prioritete programov zdravstvenega varstva se upoštevajo prednostna področja preprečevanja in zdravljenja oseb in stanj, ki so:
1. določena v 23. členu zakona,
2. opredeljena v resoluciji, ki se nanaša na nacionalni plan zdravstvenega varstva, ali
3. opredeljena v dokumentih Svetovne zdravstvene or¬ganizacije o prioritetnih programih zdravstvenega varstva v Evropi.
(2) Pri oceni iz prejšnjega odstavka se upošteva tudi pomen področij, ki niso posebej našteta v dokumentih iz prej¬šnjega odstavka, kadar imajo velik javno zdravstven pomen.
7. člen
(terapevtski pomen zdravila)
(1) Zdravilo se opredeli glede na terapevtski pomen kot:
1. zdravilo z dokazanim pozitivnim vplivom na končne izide zdravljenja,
2. zdravilo z dokazanim pozitivnim vplivom na nadome¬stne izide zdravljenja ali
3. zdravilo s pozitivnim vplivom na kakovost življenja.
(2) Pri oceni terapevtskega pomena zdravila se upošteva stopnja priporočila za zdravila v terapevtskih smernicah sloven¬skih in evropskih strokovnih združenj:
1. razred I: zdravilo je prepričljivo in nedvomno učinkovito, zato ga je treba obvezno uporabljati,
2. razred IIa: dokazi o učinkovitosti zdravila niso enotni, vendar prevladujejo dokazi, da je zdravilo učinkovito, zato priporočajo uporabo,
3. razred IIb: obstaja premalo dokazov o učinkovitosti, zato ne priporočajo uporabe zdravila, razen v izjemnih prime¬rih, ali
4. razred III: zdravilo nima dokazov o klinični učinkovitosti, zato uporabo odsvetujejo.
8. člen
(relativna terapevtska vrednost zdravila)
Zdravilo se opredeli glede na relativno terapevtsko vre¬dnost kot:
1. zdravilo z novo terapevtsko vrednostjo, kadar gre za zdravilo za zdravljenje ali preprečevanje bolezni, za katero doslej ni bilo učinkovitega zdravljenja ali
2. zdravilo z dodano terapevtsko vrednostjo, kadar gre v primerjavi s primerjalnim zdravilom za:
a) ugodnejši vpliv na končni izid zdravljenja,
b) ugodnejši vpliv na nadomestni izid zdravljenja,
c) učinkovitejše zdravljenje simptomov bolezni,
d) izboljšan varnostni profil zdravila ali
e) pacientu prijaznejšo uporabo zdravila.
9. člen
(ocena farmakoekonomskih podatkov za zdravilo)
(1) Zavod ocenjuje zdravilo na podlagi rezultatov farma-koekonomske analize in analize finančnih učinkov, ki mora biti prikazana za obdobje prvih treh let kritja zdravstvenega zavarovanja.
(2) V primeru analize stroškovne učinkovitosti oziroma koristnosti, narejene ali prilagojene za slovenski prostor, se kot podlaga za oceno zdravila upošteva tudi mejno razmerje stroškovne učinkovitosti, kot razmerje prirastka stroškov in prirastka učinkovitosti ali koristnosti med novim in standardnim zdravljenjem, ki ga s sklepom določi upravni odbor Zavoda na podlagi načrtovanih sredstev obveznega zdravstvenega zava¬rovanja za zdravila, določenih s finančnim načrtom Zavoda.
(3) V primeru analize finančnih učinkov se kot podlaga za oceno zdravila upošteva vidik načrtovanih sredstev obveznega zdravstvenega zavarovanja za zdravila, določenih s finančnim načrtom Zavoda.
10. člen
(vrste in rezultati farmakoekonomskih analiz)
(1) Pri pripravi farmakoekonomskih analiz iz prejšnjega člena se lahko uporabi:
1. celostno vrednotenje z analizo stroškov in izidov zdra¬vljenja, ali
2. delno vrednotenje z analizo stroškov.
(2) Farmakoekonomske analize, ki se lahko uporabijo kot temelj za oceno farmakoekonomskih podatkov, so:
1. analiza stroškovne učinkovitosti,
2. analiza stroškovne koristnosti,
3. analiza zmanjševanja stroškov ali
4. analiza stroškov.
(3) Rezultati farmakoekonomske analize se praviloma izražajo kot:
1. razmerje prirastka stroškov in prirastka učinkovitosti ali koristnosti med novim in standardnim zdravljenjem za dodatno leto zdravstveno kakovostnega življenja ali
2. razmerje prirastka stroškov in prirastka učinkovitosti ali koristnosti med novim in standardnim zdravljenjem za dodatno leto življenja, za čas do napredovanja bolezni, ali za število preprečenih bolezenskih stanj ali
3. primerjava stroškov med novim in standardnim zdra¬vljenjem na letni ravni.
11. člen
(vidik farmakoekonomskih podatkov)
(1) Farmakoekonomska analiza se izvaja z vidika zdra¬vstvenega zavarovanja. Analiza se lahko izvede tudi z družbe¬nega vidika, zlasti kadar se lahko pričakuje pomembna razlika med družbenim vidikom in vidikom zdravstvenega zavarovanja. V tem primeru morata biti oba vidika prikazana ločeno.
(2) Analiza finančnih učinkov se izvaja z vidika zdravstve¬nega zavarovanja.
12. člen
(vsebina farmakoekonomskih podatkov)
(1) Farmakoekonomska analiza mora vsebovati naslednje postavke:
1. osnovne informacije o analizi:
a) naročnika analize,
b) izvajalca analize,
c) razkritje potencialnih navzkrižnih interesov izvajalca,
2. ključna izhodišča analize, ki vključujejo:
a) namen analize,
b) vidik,
c) terapevtsko indikacijo,
d) ciljno populacijo,
e) običajno ali standardno zdravljenje,
f) zdravljenje z novim zdravilom,
g) navedba primerjalnih zdravil,
h) primerjava varnostnega vidika novega in običajnega zdravljenja,
i) obdobje, na katerega se analiza nanaša,
j) opis vhodnih podatkov (stroški, epidemiološki podatki, podatki o učinkovitosti),
k) vire vhodnih podatkov skupaj s prednostmi, slabostmi, zanesljivostjo virov ter merili izbire raziskav in datotek,
l) postopek pridobivanja vhodnih podatkov,
3. vrsto analize,
4. opis modela in njegove validacije, če je modelna ana¬liza,
5. jasen zapis izidov zdravljenja, ki so klinični in humani¬stični (kakovost življenja),
6. vir informacij o izidih zdravljenja (sistematični pregled literature ali meta-analizo),
7. diskontiranje stroškov oziroma izidov zdravljenja,
8. predpostavke analize,
9. analizo občutljivosti,
10. rezultate s komentarjem,
11. metodologijo prenosa v slovenski prostor, kadar gre za tuje analize,
12. povzetek analize in
13. v primeru modelne analize, računalniški model v ele¬ktronski preglednici z nezaščiteno vsebino.
(2) Priporočena fiksna diskontna stopnja iz 7. točke prej¬šnjega odstavka znaša tri do pet odstotkov, v analizi občutlji¬vosti pa variira od nič do osem odstotkov.
(3) Analiza finančnih učinkov mora vsebovati naslednje postavke:
1. uvodne informacije:
a) epidemiološke podatke (prevalenca in incidenca bole¬zni, starost, spol in dejavniki tveganja) za Slovenijo, če zanjo podatki obstajajo, sicer iz tujih virov,
b) klinične podatke (opis patologije, napredovanja bolezni in obstoječih možnosti zdravljenja),
c) ekonomske podatke (upoštevane farmakoekonomske analize),
2. opis novega zdravljenja v primerjavi s standardnim, vključno z morebitnimi spremembami izvajanja zdravljenja,
3. cilj analize finančnih učinkov (upoštevati je treba vidik zdravstvenega zavarovanja),
4. metode in obliko analize:
a) določitev populacije (po letih, z upoštevanjem vseh znanih ukrepov, kot so omejitve predpisovanja, spodbujeno povpraševanje, neželeni učinki),
b) umestitev novega zdravila v postopke zdravljenja,
c) obdobje, na katerega se analiza nanaša,
d) opis modela,
e) opis vhodnih podatkov,
f) vire podatkov, skupaj s prednostmi, slabostmi, zaneslji¬vostjo virov ter merili izbire, raziskav in datotek,
g) postopek pridobivanja podatkov,
h) opis metod(e) za izdelavo analize ter 5. rezultate:
a) prikaz vpliva uvedbe novega zdravila v breme zdra¬vstvenega zavarovanja za vsako posamezno leto za pesimi¬stično, optimistično in srednjo varianto,
b) prikaz vsakoletnih stroškov uvedbe novega zdravila (skupni stroški in stroški po posameznih postavkah) za pesimi¬stično, optimistično in srednjo varianto,
c) analizo občutljivosti, če je narejena,
d) grafično predstavitev modela, če je uporabljen,
e) navedbo uporabljenih predpostavk modela, če je upo¬rabljen, in
f) računalniški model v obliki preglednih listov v elektron¬ski preglednici z nezaščiteno vsebino, če je uporabljen.
(4) Za prikaz rezultatov analize zmanjševanja stroškov ali analize stroškov se lahko uporabi obrazec E iz Priloge 1 tega pravilnika.
13. člen
(obveznost farmakoekonomskih podatkov)
(1) Farmakoekonomski podatki z analizo stroškovne učin¬kovitosti ali analizo stroškovne koristnosti in analizo finančnih učinkov, narejeni ali prilagojeni za slovenski prostor, so obve¬zna priloga vloge, kadar gre za:
1. novo zdravilo,
2. novo terapevtsko indikacijo razvrščenega zdravila,
3. prerazvrščanje ali
4. določitev ali spremembo omejitve predpisovanja ali izdajanja.
(2) V primeru iz prejšnjega odstavka, ko gre za prilagodi¬tev farmakoekonomske analize, je obvezna priloga vloge tudi izvorna analiza ali njen prevod v slovenskem jeziku ali jeziku, ki je Zavodu razumljiv.
(3) Za zdravilo iz prvega odstavka tega člena, ki ima v vseh jakostih in oblikah v analizi finančnih učinkov v prvih treh letih kritja predvideni skupni promet v breme zdravstvenega zavarovanja do vključno 500.000 eurov, zadostuje, da je vlogi iz prvega odstavka tega člena, namesto farmakoekonomske analize, priložena izvorna analiza ali njen prevod v slovenskem jeziku ali jeziku, ki je Zavodu razumljiv in ki je bila opravljena za eno od držav članic Evropskega gospodarskega prostora.
(4) Če zdravilo iz prejšnjega odstavka po preteku tretje¬ga leta kritja ali prej preseže skupni znesek 500.000 eurov v breme zdravstvenega zavarovanja, mora imetnik dovoljenja v šestih mesecih od prejema poziva Zavoda predložiti farmako-ekonomsko analizo v skladu s prvim odstavkom tega člena. Če imetnik dovoljenja v tem roku analize ne predloži, Zavod začne postopek za izločitev zdravila z liste zdravil.
(5) Za zdravilo iz prvega odstavka tega člena, pri katerem ni klinično pomembnih razlik v učinkovitosti in varnosti glede na primerjalno zdravilo, se vlogi iz prvega odstavka tega člena predloži analiza zmanjševanja stroškov ali analiza stroškov.
(6) Vse zahtevane analize za zdravila iz tega člena mora¬jo temeljiti na rezultatih javno dostopnih metaanaliz ali visoko kakovostnih randomiziranih raziskav. Dopolnilne podatke, če so potrebni, se lahko povzame iz opazovalnih raziskav. Če ni na voljo dovolj realnih podatkov, se za analizo lahko uporabijo metode modeliranja.
14. člen
(ocena etičnih vidikov)
Etični vidik se kot merilo upošteva zlasti pri oceni zdravil za zdravljenje hudih ali redkih bolezni.
15. člen
(podatki in ocene iz referenčnih virov)
V okviru merila podatkov in ocen iz referenčnih virov se upoštevajo podatki iz strokovnih in znanstvenih publikacij, terapevtskih smernic, izsledkov in ocen referenčnih strokovnih združenj, podatki in smernice Svetovne zdravstvene organi¬zacije in drugih ustanov ter organov, pristojnih za cene zdravil in kritje iz javnih sredstev, kot tudi podatki iz drugih javno dostopnih virov.
16. člen
(merila za nerazvrščanje)
Ne glede na 5. člen tega pravilnika na listo zdravil ne morejo biti razvrščena zdravila, ki:
1. ne izkazujejo enake ali dodane vrednosti v terapev¬tskem ali ekonomskem smislu v primerjavi z zdravili v isti tera¬pevtski skupini, ki so že razvrščena na listo zdravil, ali
2. se uporabljajo za blažitev simptomov oziroma zdravlje¬nje stanj, ki so z javnozdravstvenega vidika manj pomembna, ali
3. se uporabljajo pri obravnavi stanj, ki jih je mogoče urediti ali pozdraviti zgolj s spremenjenim načinom življenja.
III. IZLOČITEV Z LISTE ZDRAVIL
17. člen
(izločitev z liste zdravil)
(1) Zdravilo se izloči z liste zdravil, če ni več predmet razvrščanja iz 3. člena tega pravilnika ali če ne izpolnjuje več meril iz 5. člena tega pravilnika ali ko pride do izpolnitve enega od meril iz prejšnjega člena.
(2) Ne glede na prejšnji odstavek se lahko zdravilo izloči z liste zdravil po predhodnem pisnem soglasju imetnika dovoljenja, če zdravilo ni prisotno na trgu v Republiki Sloveniji več kot leto dni, kar Zavod preverja na podlagi podatkov o njegovi porabi in podatkov, ki jih mora imetnik dovoljenja posredovati Zavodu.
IV. OMEJITVE PREDPISOVANJA IN OMEJITVE IZDAJANJA
18. člen
(omejitve predpisovanja in omejitve izdajanja)
(1) Zavod lahko za zdravilo v postopku razvrščanja ali prerazvrščanja in za razvrščeno zdravilo določi ali spremeni omejitev predpisovanja ali omejitev izdajanja ali obe omejitvi hkrati. Omejitev se lahko nanaša na:
1. populacijsko skupino, ki lahko zdravilo prejema, določe¬no s starostjo ali drugimi populacijskimi značilnostmi,
2. indikacijsko področje, za katero se zdravilo lahko pred¬piše; izbere se lahko ena ali več odobrenih terapevtskih indika¬cij iz povzetka glavnih značilnosti zdravila; v okviru indikacijskega področja se lahko omeji tudi čas zdravljenja,
3. stopnjo izraženosti bolezni, za katero se zdravilo lahko predpiše,
4. vrsto specializacije zdravnika, ki zdravilo lahko predpi¬še, to je klinično specialnost ali skupino pooblaščenih zdravni¬kov, ki lahko predpišejo zdravila,
5. obveznost predhodne odobritve strokovne komisije, ki odloča o predpisovanju določenih zdravil, pridobljenih z bioteh-nološkimi postopki,
6. časovno ali količinsko omejitev izdajanja,
7. bolnišnico, ki v skladu z dovoljenjem ministrstva, pristoj¬nega za zdravje, izvaja zdravstveni program s tem zdravilom.
(2) Besedilo omejitve predpisovanja ali izdajanja se objavi na spletni strani Zavoda skupaj z razvrstitvijo oziroma prera-zvrstitvijo. Zdravilo z omejitvijo predpisovanja ali izdajanja se označi z zvezdico ob oznaki liste zdravil.
V. POSTOPEK
19. člen
(začetek postopka)
(1) Imetnik dovoljenja lahko vloži pri Zavodu vlogo za raz¬vrščanje, prerazvrščanje in za določitev ali spremembo omeji¬tve predpisovanja ali izdajanja.
(2) Zdravstvena institucija lahko na Zavod naslovi pobudo za začetek postopka. Zavod pisno obvesti zdravstveno institucijo o sprejetju ali zavrnitvi pobude. V primeru sprejete pobude postopek nadaljuje kot z vlogo in izda odločbo iz 34. člena tega pravilnika.
(3) Zavod lahko začne postopek na lastno pobudo.
(4) Zavod o pobudi iz drugega in tretjega odstavka tega člena obvesti imetnika dovoljenja za zdravilo, na katerega se pobuda nanaša, ali lekarno, ki izdeluje galensko zdravilo. Ime¬tnik dovoljenja oziroma lekarna posredujeta Zavodu na njegovo pisno zahtevo dokumentacijo, potrebno za odločitev Zavoda. V nasprotnem primeru Zavod odloči na podlagi dokazov, s katerimi razpolaga.
20. člen
(vrste vlog in pobud)
(1) Vloga oziroma pobuda za razvrščanje zdravila na listo zdravil se lahko nanaša na:
1. novo zdravilo,
2. novo terapevtsko indikacijo razvrščenega zdravila,
3. novo kombinacijo zdravil,
4. podobno biološko zdravilo,
5. generično zdravilo in zdravilo z dovoljenjem za paralelni uvoz ali paralelno distribucijo,
6. novo obliko, jakost ali pakiranje razvrščenega zdravila,
7. zdravilo s seznama nujno potrebnih zdravil za uporabo v humani medicini,
8. nadomestno zdravilo,
9. galensko zdravilo ali
10. magistralno zdravilo.
(2) Vloga se lahko nanaša tudi na:
1. prerazvrščanje in
2. določitev ali spremembo omejitve predpisovanja ali izdajanja.
(3) Pobuda se lahko nanaša tudi na:
1. prerazvrščanje,
2. določitev ali spremembo omejitve predpisovanja ali izdajanja in
3. izločitev z liste zdravil.
21. člen
(vloga)
(1) Vloga mora vsebovati podatke o imetniku dovoljenja, tehnične in strokovne podatke o zdravilu, navedene v tem pravilniku, in odločbo o najvišji dovoljeni ceni ali izredni višji dovoljeni ceni.
(2) Vloga se pošlje Zavodu v tiskani obliki in na elektron¬skem nosilcu podatkov.
(3) Če se v času postopkov spremeni imetnik dovoljenja ali njegov zastopnik, se v osmih dneh od spremembe vloga do¬polni s podatki o novem imetniku dovoljenja oziroma njegovem zastopniku in z dokazilom o tej spremembi.
(4) Podatki in dokumenti v vlogi se pošljejo Zavodu zloženi po vrstnem redu, kot je določen za posamezno vrsto vloge s tem pravilnikom, in na način, kot je določen v posamezni vrsti vloge.
22. člen
(pobuda)
(1) Pobuda mora vsebovati podatke o zdravstveni insti¬tuciji, ki naslovi pobudo na Zavod, podatke o zdravilu, na ka¬terega se pobuda nanaša, in strokovno obrazložitev predloga.
(2) Pobudo se pošlje Zavodu v pisni ali elektronski obliki.
(3) Če ni s tem pravilnikom drugače določeno glede posa¬meznih vprašanj v zvezi s pobudo, veljajo zanjo določbe tega pravilnika, ki veljajo za vlogo.
23. člen
(vloga za novo zdravilo, novo terapevtsko indikacijo, prerazvrščanje in določitev ali spremembo omejitve predpisovanja ali izdajanja)
(1) Vloga za razvrščanje novega zdravila ali nove terapev¬tske indikacije razvrščenega zdravila, vloga za prerazvrščanje in vloga za določitev ali spremembo omejitve predpisovanja ali izdajanja mora vsebovati naslednje podatke in dokumente:
1. spremni dopis (obrazec A v Prilogi 1 tega pravilnika),
2. povzetek vloge (obrazec B v Prilogi 1 tega pravilnika), ki vsebuje:
a) podatke iz povzetka glavnih značilnosti zdravila (B.1.),
b) informacije o zdravljenju (B.2.),
c) strokovno obrazložitev (B.3.),
d) morebitno vključitev v strokovne smernice in stopnjo priporočila (B.4.),
e) raven kritja iz javnih sredstev v državah članicah Evrop¬ske unije in drugod in morebitne omejitve predpisovanja ali izdajanja (B.5.),
f) podatke o trženju (B.6.),
g) podatke o ceni (B.7.),
h) podatke o stroških za zdravilo (B.8.),
i) podatke o vplivu na zdravstvene storitve (B.9.), j) podatke o farmakoekonomski raziskavi (B.10.), k) podatke o analizi finančnih učinkov (B.11.),
l) morebitni predlog imetnika dovoljenja (B.12.), m) podatke in ocene referenčnih virov (B.13),
3. listine (obrazec C v Prilogi 1 tega pravilnika):
a) dovoljenje (C.1.),
b) odločbo o NDC oziroma IVDC (C.2.),
c) dokazilo o morebitnem statusu zdravila sirote (C.3.),
d) izjavo o plačilu stroškov (C.4.),
e) pooblastilo, ko je vlagatelj vloge oziroma pobude prav¬na ali fizična oseba, ki daje vlogo za razvrščanje v imenu ime¬tnika dovoljenja (C.5.), ter
4. dodatno strokovno dokumentacijo (obrazec D v Prilogi 1 tega pravilnika):
a) povzetek glavnih značilnosti zdravila, ki ga je potrdila Javna agencija ali Evropska agencija za zdravila (D.1.),
b) evropsko javno poročilo o oceni zdravila, če je zdravilo registrirano po centraliziranem postopku (D.2.),
c) klinične raziskave, na katere je v povzetku vloge sklic
(D.3.),
d) farmakoekonomsko analizo (D.4.),
e) analizo finančnih učinkov (D.5.).
(2) Vloga iz prejšnjega odstavka mora vsebovati tudi protokol zdravljenja, vključitvena in izključitvena klinična merila in navedbo zdravil ali zdravljenj, ki se že uporabljajo za isto terapevtsko indikacijo, in podatke o učinkovitosti novega zdra¬vljenja v primerjavi z dosedanjim zdravljenjem.
24. člen
(vloga za novo kombinacijo zdravil)
Vloga za razvrščanje nove kombinacije zdravil mora vse¬bovati naslednje podatke in dokumente:
1. spremni dopis (obrazec A v Prilogi 1 tega pravilnika),
2. povzetek vloge (obrazec B v Prilogi 1 tega pravilnika), ki vsebuje:
a) podatke iz povzetka glavnih značilnosti zdravila (B.1.),
b) informacije o zdravljenju (B.2.),
c) strokovno obrazložitev (B.3.),
d) raven kritja iz javnih sredstev v državah članicah Evrop¬ske unije in drugod in morebitne omejitve predpisovanja ali izdajanja (B.5.),
e) podatke o trženju (B.6.),
f) podatke o ceni (B.7.),
g) podatke o stroških za zdravilo (B.8.),
h) farmakoekonomske podatke (B.10.3)
i) morebitni predlog imetnika dovoljenja (B.12.), j) podatke in ocene referenčnih virov (B.13),
3. listine (obrazec C v Prilogi 1 tega pravilnika):
a) dovoljenje (C.1.),
b) odločbo o NDC oziroma IVDC (C.2.),
c) dokazilo o morebitnem statusu zdravila sirote (C.3.),
d) izjavo o plačilu stroškov (C.4.),
e) pooblastilo, ko je vlagatelj vloge oziroma pobude prav¬na ali fizična oseba, ki daje vlogo za razvrščanje v imenu ime¬tnika dovoljenja (C.5.), ter
4. dodatno strokovno dokumentacijo (obrazec D v Prilogi 1 tega pravilnika):
a) povzetek glavnih značilnosti zdravila, ki ga je potrdila Javna agencija ali Evropska agencija za zdravila (D.1.),
b) evropsko javno poročilo o oceni zdravila, če je zdravilo registrirano po centraliziranem postopku (D.2.),
c) klinične raziskave, na katere je v povzetku vloge sklic
(D.3.).
25. člen
(vloga za podobno biološko zdravilo)
Vloga za razvrščanje podobnega biološkega zdravila mora vsebovati naslednje podatke in dokumente:
1. spremni dopis (obrazec A v Prilogi 1 tega pravilnika),
2. povzetek vloge (obrazec B v Prilogi 1 tega pravilnika), ki vsebuje:
a) podatke iz povzetka glavnih značilnosti zdravila (B.1.),
b) strokovno obrazložitev (B.3.),
c) raven kritja iz javnih sredstev v državah članicah Evrop¬ske unije in drugod in morebitne omejitve predpisovanja ali izdajanja (B.5.),
d) podatke o trženju (B.6.),
e) podatke o ceni (B.7.),
f) podatke o stroških za zdravilo (B.8.),
g) morebitni predlog imetnika dovoljenja (B.12.),
h) podatke in ocene referenčnih virov (B.13),
3. listine (obrazec C v Prilogi 1 tega pravilnika):
a) dovoljenje (C.1.),
b) odločbo o NDC oziroma IVDC (C.2.),
c) dokazilo o morebitnem statusu zdravila sirote (C.3.),
d) izjavo o plačilu stroškov (C.4.),
e) pooblastilo, ko je vlagatelj vloge oziroma pobude prav¬na ali fizična oseba, ki daje vlogo za razvrščanje v imenu ime¬tnika dovoljenja (C.5.), ter
4. dodatno strokovno dokumentacijo (obrazec D v Prilogi 1 tega pravilnika):
a) povzetek glavnih značilnosti zdravila, ki ga je potrdila Javna agencija ali Evropska agencija za zdravila (D.1.),
b) evropsko javno poročilo o oceni zdravila, če je zdravilo registrirano po centraliziranem postopku (D.2.),
c) klinične raziskave, na katere je v povzetku vloge sklic
(D.3.).
26. člen
(vloga za generično zdravilo in za zdravilo z dovoljenjem za paralelni uvoz ali paralelno distribucijo)
(1) Vloga za razvrščanje generičnega zdravila, generič¬nega kombiniranega zdravila in zdravila z dovoljenjem za pa¬ralelni uvoz ali paralelno distribucijo mora vsebovati naslednje podatke in dokumente:
1. spremni dopis (obrazec A v Prilogi 1 tega pravilnika),
2. povzetek vloge (obrazec B v Prilogi 1 tega pravilnika), ki vsebuje:
a) podatke iz povzetka glavnih značilnosti zdravila (B.1.),
b) strokovno obrazložitev (B.3),
c) podatke o trženju (B.6.),
d) podatke o ceni (B.7.),
e) podatke o stroških za zdravilo (B.8.),
f) morebitni predlog imetnika dovoljenja (B.12.),
3. listine (obrazec C v Prilogi 1 tega pravilnika):
a) dovoljenje (C.1.),
b) odločbo o NDC oziroma IVDC (C.2.),
c) izjavo o plačilu stroškov (C.4.),
d) pooblastilo, ko je vlagatelj vloge oziroma pobude prav¬na ali fizična oseba, ki daje vlogo za razvrščanje v imenu ime¬tnika dovoljenja (C.5.), ter
4. dodatno strokovno dokumentacijo (obrazec D v Prilogi 1 tega pravilnika):
a) povzetek glavnih značilnosti zdravila, ki ga je potrdila Javna agencija ali Evropska agencija za zdravila (D.1.),
b) evropsko javno poročilo o oceni zdravila, če je zdravilo registrirano po centraliziranem postopku (D.2.).
(2) Glede vloge za razvrščanje zdravila z dovoljenjem za paralelni uvoz ali s pozitivnim mnenjem Evropske agencije za zdravila za paralelno distribucijo se uporablja prejšnji odstavek, razen glede 3.a) točke, kjer se priloži odločba o dovoljenju za paralelni uvoz oziroma pozitivno mnenje Evropske agencije za zdravila za paralelno distribucijo.
27. člen
(vloga za novo obliko, jakost ali pakiranje razvrščenega zdravila)
(1) Vloga za razvrščanje nove oblike, jakosti ali pakiranje razvrščenega zdravila mora vsebovati:
1. spremni dopis (obrazec A v Prilogi 1 tega pravilnika),
2. povzetek vloge (obrazec B v Prilogi 1 tega pravilnika), ki vsebuje:
a) podatke iz povzetka glavnih značilnosti zdravila (B.1.),
b) strokovno obrazložitev (B.3.),
c) raven kritja iz javnih sredstev v državah članicah Evrop¬ske unije in drugod in morebitne omejitve predpisovanja ali izdajanja (B.5.),
d) podatke o trženju (B.6.),
e) podatke o ceni (B.7.),
f) podatke o stroških za zdravilo (B.8.),
3. listine (obrazec C v Prilogi 1 tega pravilnika):
a) dovoljenje (C.1.),
b) odločbo o NDC oziroma IVDC (C.2.),
c) dokazilo o morebitnem statusu zdravila sirote (C.3.),
d) izjavo o plačilu stroškov (C.4.),
e) pooblastilo, ko je vlagatelj vloge oziroma pobude prav¬na ali fizična oseba, ki daje vlogo za razvrščanje v imenu ime¬tnika dovoljenja (C.5.), ter
4. dodatno strokovno dokumentacijo (obrazec D v Prilogi 1 tega pravilnika):
a) povzetek glavnih značilnosti zdravila, ki ga je potrdila Javna agencija ali Evropska agencija za zdravila (D.1.),
b) klinične raziskave, na katere je v povzetku vloge sklic
(D.3.).
(2) Vloga iz prejšnjega odstavka mora vsebovati tudi farmakoekonomske podatke iz rubrike B.10.3. v Prilogi 1 tega pravilnika, če nova oblika zdravila vpliva na stroške zdravljenja v primerjavi z razvrščeno obliko.
28. člen
(vloga za zdravilo s seznama nujno potrebnih zdravil in za nadomestno zdravilo)
Vloga za razvrščanje zdravila s seznama nujno potrebnih zdravil za uporabo v humani medicini in nadomestnega zdravila mora vsebovati naslednje podatke in dokumente:
1. spremni dopis (obrazec A v Prilogi 1 tega pravilnika),
2. povzetek vloge (obrazec B v Prilogi 1 tega pravilnika), ki vsebuje:
a) podatke iz povzetka glavnih značilnosti zdravila (B.1.),
b) strokovno obrazložitev (B.3),
c) podatke o trženju (B.6.),
d) podatke o ceni (B.7.),
3. listine (obrazec C v Prilogi 1 tega pravilnika):
a) dovoljenje (C.1.),
b) odločbo o NDC oziroma IVDC (C.2.), za nadomestno zdravilo pa ceno na debelo,
c) dokazilo o morebitnem statusu zdravila sirote (C.3.),
d) pooblastilo, ko je vlagatelj vloge oziroma pobude prav¬na ali fizična oseba, ki daje vlogo za razvrščanje v imenu ime¬tnika dovoljenja (C.5.), ter
4. dodatno strokovno dokumentacijo (obrazec D v Pri¬logi 1 tega pravilnika), ki vključuje povzetek glavnih značil¬nosti zdravila v slovenskem jeziku ali jeziku, ki je Zavodu razumljiv.
29. člen
(pobuda za galensko zdravilo)
Pobuda za razvrščanje galenskega zdravila mora vsebo¬vati naslednje podatke in dokumente:
1. spremni dopis (obrazec A v Prilogi 1 tega pravilnika),
2. povzetek vloge (obrazec B v Prilogi 1 tega pravilnika), ki vsebuje:
a) podatke iz navodila o uporabi (B.1.),
b) strokovno obrazložitev (B.3.),
c) podatke o trženju (B.6.),
d) podatke o ceni (B.7.),
e) podatke o stroških za zdravilo (B.8.),
f) morebitni predlog zdravstvene institucije (B.12.), ter
3. dodatno strokovno dokumentacijo (obrazec D v Prilogi 1 tega pravilnika), ki vključuje navodilo za uporabo.
30. člen
(pobuda za magistralno zdravilo)
Pobuda za razvrščanje magistralnega zdravila mora vse¬bovati naslednje podatke in dokumente:
1. spremni dopis (obrazec A v Prilogi 1 tega pravilnika) in
2. povzetek vloge (obrazec B v Prilogi 1 tega pravilnika), ki vsebuje:
a) strokovno obrazložitev zdravstvene institucije, z naved¬bo terapevtske indikacije in recepture (B.3.1., B.3.12.),
b) podatek o ceni: okviren izračun cene, skupaj z lekar¬niško storitvijo,
c) morebitni predlog zdravstvene institucije (B.12.).
31. člen
(obravnava vlog oziroma pobud)
(1) Zavod obravnava popolne vloge oziroma pobude. Vloga oziroma pobuda je popolna, če vsebuje vse podatke in listine, določene s tem pravilnikom. Če vloga oziroma pobuda ni popolna, Zavod v petih dneh po njenem prejemu pozove imetnika dovoljenja oziroma zdravstveno institucijo k njeni do¬polnitvi.
(2) Zavod lahko na podlagi posredovanih in pridobljenih podatkov od imetnika dovoljenja oziroma zdravstvene instituci¬je zahteva dodatne podatke in analize, pomembne za nadaljnje odločanje.
32. člen
(komisija za razvrščanje zdravil na listo zdravil)
(1) Zavod v postopkih iz drugega odstavka 1. člena tega pravilnika odloča na podlagi strokovnega mnenja komisije za razvrščanje zdravil na listo zdravil (v nadaljnjem besedilu: komi¬sija). Člane komisije imenuje upravni odbor Zavoda za obdobje štirih let.
(2) Komisija je strokovno in neodvisno telo, ki ga sesta¬vljajo strokovnjaki s področja medicine in farmacije, z znanji s področja klinične farmakologije ter drugi strokovnjaki s sistemskimi znanji s področja zdravil. Člani komisije svoje delo opravljajo v skladu z etičnimi pravili stroke in veljavnimi predpisi.
(3) Komisija sprejme poslovnik o svojem delu.
33. člen
(dodatna strokovna mnenja)
Zavod lahko v postopku in ko določa terapevtske skupine zdravil pridobi mnenja strokovnih združenj, klinik ali posame¬znih strokovnjakov s področja medicine, farmacije ali z drugih področij.
34. člen
(odločba)
(1) Zavod izda odločbo o razvrstitvi oziroma odločbo o nerazvrstitvi najpozneje v 90 dneh od prejema popolne vloge. Ta rok se lahko podaljša le, če je Javna agencija določila naj¬višjo dovoljeno ceno pred iztekom 90 dni. Postopek določanja najvišje dovoljene cene v skladu s predpisi, ki urejajo cene zdravil, in postopek razvrščanja zdravila na listo zdravil, vključ¬no z uveljavitvijo razvrstitve, ne smeta skupaj presegati 180 dni.
(2) Ne glede na prejšnji odstavek, Zavod izda odločbo o razvrstitvi galenskega zdravila najpozneje v 180 dneh od prejema popolne pobude.
(3) Zavod izda odločbo o prerazvrstitvi oziroma odločbo o zavrnitvi prerazvrstitve, odločbo o izločitvi z liste zdravil ter odločbo o določitvi ali spremembi omejitve predpisovanja ali izdajanja, oziroma odločbo o zavrnitvi določitve ali spremembe omejitve predpisovanja ali izdajanja najpozneje v 180 dneh od prejema popolne vloge oziroma pobude.
35. člen
(obrazložitev)
Odločba iz prejšnjega člena mora biti obrazložena z na¬vedbo, da gre za predmet razvrščanja iz 3. člena tega pravilni¬ka in z navedbo razlogov, ki temeljijo na merilih iz 5. in 16. člena tega pravilnika, vključno s strokovnimi mnenji, na katerih temelji odločitev.
36. člen
(pritožba in sodno varstvo)
(1) Zoper odločbo iz 34. člena tega pravilnika ima imetnik dovoljenja oziroma lekarna pravico do pritožbe. Pritožba se vloži v 30 dneh od dneva vročitve odločbe iz 34. člena tega pravilnika. Pritožba se vloži na Zavod, ki jo v petih dneh po prejemu posreduje na ministrstvo, pristojno za zdravje. Pritožba ne zadrži izvršitve odločbe.
(2) O pritožbi iz prejšnjega odstavka odloči minister, pri¬stojen za zdravje, v 60 dneh od vložitve pritožbe na Zavod.
(3) Odločitev ministra, pristojnega za zdravje, iz prej¬šnjega odstavka lahko imetnik dovoljenja oziroma lekarna v 30 dneh od prejema odločbe izpodbija s tožbo v upravnem sporu pred Upravnim sodiščem Republike Slovenije.
VI. STROŠKI POSTOPKA
37. člen (stroški postopka)
(1) V postopku plača imetnik dovoljenja stroške postopka v skladu s tem pravilnikom. Stroške postopka je treba plačati ob vložitvi vloge na račun Zavoda.
(2) Glede na vrsto vloge stroški postopka znašajo:
1. za razvrščanje novega zdravila: 2.000 eurov,
2. za razvrščanje nove terapevtske indikacije razvrščene¬ga zdravila: 1.500 eurov,
3. za razvrščanje nove kombinacije zdravil: 1.000 eurov,
4. za razvrščanje podobnega biološkega zdravila: 500 eurov,
5. za razvrščanje generičnega zdravila, generičnega kom¬biniranega zdravila in zdravila z dovoljenjem za paralelni uvoz ali paralelno distribucijo: 300 eurov,
6. za razvrščanje novih oblik in jakosti razvrščenih zdravil: 500 eurov,
7. za razvrščanje novih pakiranj razvrščenih zdravil: 300 eurov,
8. za prerazvrščanje: 1.000 eurov in
9. za določitev in spremembo omejitve predpisovanja ali izdajanja: 1.500 eurov.
(3) Stroški postopka iz prejšnjega odstavka se nanašajo na eno zdravilo z eno delovno šifro zdravila. Za vsako dodatno delovno šifro se stroški postopka zvišajo za 25 eurov.
(4) Stroški postopka se ne plačajo, če gre za razvrščanje:
1. zdravila s seznama nujno potrebnih zdravil za uporabo v humani medicini,
2. nadomestnega zdravila,
3. galenskega zdravila in
4. magistralnega zdravila.
VII. TERAPEVTSKE SKUPINE ZDRAVIL
38. člen
(določanje terapevtskih skupin zdravil)
(1) Zavod na lastno pobudo določa terapevtske skupine zdravil med zdravili, razvrščenimi na pozitivno in vmesno listo zdravil. Podlaga za vključitev zdravila v terapevtsko skupino zdravil so terapevtska indikacija in merila iz 5. člena tega pravilnika.
(2) V vsaki terapevtski skupini zdravil se določi zdravilo z najugodnejšim razmerjem med stroški in učinki zdravljenja na podlagi cen primerljivih odmerkov zdravil, vključenih v terapev¬tsko skupino zdravil.
(3) Pri določanju zdravila iz prejšnjega odstavka se upo¬števajo le učinkovine zdravila oziroma kombinacije učinkovin zdravila, ki dosegajo tržni delež, izračunan z enačbo:
najmanjši tržni delež = 100 % / (n + 1),
kjer pomeni:
n – število učinkovin oziroma kombinacij v terapevtski skupini zdravil.
Tržni delež učinkovin zdravila oziroma kombinacij učinkovin se izračuna iz podatkov Zavoda o izdanih zdravilih, izraženih v definiranih dnevnih odmerkih, dostopnih v zadnjih 12 mesecih.
(4) Terapevtsko skupino zdravil se lahko razdeli na razre¬de primerljivih odmerkov glede na jakost zdravil (v nadaljnjem besedilu: razredi). Če zdravilo iz drugega odstavka tega člena ni zastopano v vseh razredih, se določi še druga zdravila, tako da so vsa določena zdravila v vseh jakostih znotraj NPV.
(5) Če med zdravili v terapevtski skupini zdravil ali v posameznem razredu ni pomembnih razlik v učinkovitosti, varnosti, farmacevtskih oblikah ali načinu uporabe, je zdravilo z najugodnejšim razmerjem med stroški in učinki zdravljenja tisto z najnižjo ceno primerljivega odmerka v času vsakokra¬tne določitve NPV za terapevtsko skupino zdravil oziroma NPV za razrede.
(6) Če je v terapevtski skupini zdravilo, ki ima zaradi far¬macevtske oblike v smislu načina uporabe ali kliničnih lastnosti v smislu učinkovitosti in varnosti prednost za zavarovano ose¬bo, se mu določi dodana vrednost, izražena v odstotku cene primerljivega odmerka. Dodana vrednost ne sme presegati od¬stotka, ki bi na podlagi podatkov, veljavnih ob pripravi sklepa iz osmega odstavka tega člena o terapevtski skupini po postopku za določanje NPV iz 39. do 43. člena tega pravilnika, določil višjo NPV, kot je cena zdravila.
(7) Kombiniranemu zdravilu, ki je vključeno v terapevtsko skupino zdravil, se določi dodana vrednost kot razlika med vso¬to NPV posameznih učinkovin ter NPV kombiniranega zdravila brez dodane vrednosti, določenih na podlagi podatkov, veljav¬nih ob pripravi sklepa iz osmega odstavka tega člena o terapev¬tski skupini po postopku za določanje NPV iz 39. do 43. člena tega pravilnika. Dodana vrednost je izražena v odstotku cene primerljivega odmerka. Če NPV kombiniranega zdravila brez dodane vrednosti presega vsoto NPV posameznih učinkovin, se dodana vrednost ne določi. Če za posamezno učinkovino ni mogoče izračunati NPV, se upošteva cena zdravila. Če ni razvrščenega zdravila z učinkovino kombiniranega zdravila, se njena cena določi na podlagi cene primerljivega zdravila v Republiki Sloveniji ali Evropski uniji.
(8) Terapevtske skupine zdravil in njihove spremembe s sklepom določi upravni odbor Zavoda.
VIII. NPV
39. člen (podatki za določanje NPV)
(1) Pri določanju NPV iz 40. in 41. člena tega pravilnika se upoštevajo podatki, veljavni na prvi delovni dan v mesecu, v katerem se določa NPV.
(2) Podlaga za določitev NPV so le zdravila na recept gle¬de na nacionalno šifro, katerih delež izdanih pakiranj v zadnjem mesecu dosega v skupini medsebojno zamenljivih zdravil, te¬rapevtski skupini zdravil ali njenem razredu vsaj 0,5 %. Zavod upošteva zadnje dostopne mesečne podatke o izdanih zdravilih iz prejšnjega stavka.
40. člen
(določanje NPV za skupine medsebojno zamenljivih zdravil)
(1) Zavod določa NPV za skupine medsebojno zamen¬ljivih zdravil, razvrščenih na pozitivno in vmesno listo zdravil, na ravni najcenejšega zdravila glede na primerljivi odmerek v skupini medsebojno zamenljivih zdravil.
(2) Podlaga za določitev NPV iz prejšnjega odstavka so se¬znam medsebojno zamenljivih zdravil, lista zdravil in cene zdravil.
(3) Skupino medsebojno zamenljivih zdravil iz prvega od¬stavka tega člena sestavljata najmanj dve zdravili z lastniškim imenom glede na delovno šifro in jo opredeljujejo učinkovina, ATC oznaka, jakost in primerljiva oblika zdravila.
(4) NPV iz prvega odstavka tega člena se določijo tako, da se najnižja cena primerljivega odmerka, izračunana na štiri decimalna mesta natančno, pomnoži s številom odmernih enot posameznega zdravila in zaokroži na dve decimalni mesti tako, da če je tretje decimalno mesto enako ali večje od 5, se zaokroži navzgor, sicer navzdol.
41. člen
(določanje NPV za terapevtske skupine zdravil)
(1) Zavod določa NPV za terapevtsko skupino zdravil na ravni cene zdravila z najugodnejšim razmerjem med stroški in učinki zdravljenja, tako, da krije vse odmerke vsaj enega zdravila v tej terapevtski skupini zdravil.
(2) NPV iz prejšnjega odstavka se določijo tako, da se cena primerljivega odmerka zdravila z najugodnejšim razmer¬jem med stroški in učinki zdravljenja, izračunana na štiri de¬cimalna mesta natančno, pomnoži s številom odmernih enot posameznega zdravila in zaokroži na dve decimalni mesti tako, da če je tretje decimalno mesto enako ali večje od 5, se zao¬kroži navzgor, sicer navzdol. Na podlagi primerljivih odmerkov se določijo NPV za vsa zdravila v terapevtski skupini zdravil, upoštevajoč morebitno dodano vrednost iz četrtega odstavka 38. člena tega pravilnika.
42. člen
(pravilo nižje NPV)
Če ima zdravilo določen NPV v skladu s postopkom iz 40. in 41. člena tega pravilnika, se kot njegova NPV določi nižja NPV med obema.
43. člen
(sklep o določitvi NPV in oznaka zdravila)
(1) NPV iz 40. in 41. člena tega pravilnika in njihove spremembe praviloma enkrat na dva meseca s sklepom določi upravni odbor Zavoda ali po njegovem pooblastilu generalni direktor Zavoda.
(2) Vsa zdravila z NPV iz 40. in 41. člena tega pravilnika dobijo poleg oznake liste zdravil še oznako C.
IX. DOGOVOR O CENI ZDRAVILA
44. člen
(dogovor o ceni zdravila)
(1) Dogovor o ceni zdravila se lahko nanaša na naslednje načine financiranja zdravila:
1. dogovorjeno ceno zdravila,
2. popust ali rabat,
3. razmerje cena zdravila – obseg prodaje zdravila,
4. povračilo prekoračenih izdatkov za zdravilo,
5. delitev tveganja.
(2) Dogovor o ceni zdravila se lahko nanaša na eno ali več zdravil. Sklenitev dogovora o ceni zdravila lahko predlaga Zavod ali imetnik dovoljenja oziroma lekarna, ko je predmet dogovora o ceni zdravila galensko zdravilo. Sestavni del do¬govora o ceni zdravil je obrazec Dogovor o ceni zdravila, ki je v Prilogi 2 tega pravilnika. Dogovor o ceni zdravila mora biti sklenjen v pisni obliki in v slovenskem jeziku, sicer ni veljaven. Če je dogovor o ceni zdravila sklenjen v slovenskem in tujem jeziku, se za presojo spornih vprašanj vedno uporablja dogovor o ceni zdravila v slovenskem jeziku.
(3) Imetniki dovoljenja oziroma lekarne, ko so predmet do¬govora o ceni zdravila galenska zdravila, Zavodu posredujejo dogovor o ceni zdravila oziroma njegov dodatek najmanj pet delovnih dni pred dnem uveljavitve cene, navedene v obrazcu Dogovor o ceni zdravila, pri čemer slednjega posredujejo tudi v elektronski obliki v obliki excel preglednice na elektronski naslov zdravila.cene@zzzs.si.
(4) Dogovorjena cena zdravila je cena zdravila, ki jo Za¬vod dogovori na podlagi zakona, ki ureja zdravila.
(5) Popust na ceno zdravila pomeni, da imetnik dovoljenja zniža ceno zdravila pod pogoji, dogovorjenimi v dogovoru o ceni zdravila.
(6) Rabat pomeni finančni ali količinski popust za zdravilo, ki ga imetnik dovoljenja izvede po določenem obdobju in pod pogoji, dogovorjenimi v dogovoru o ceni zdravila.
(7) Dogovor o razmerju cena zdravila – obseg prodaje zdravila pomeni, da se cena zdravila s povečanjem obsega njegove prodaje zniža za delež, dogovorjen v dogovoru o ceni zdravila.
(8) Dogovor o povračilu prekoračenih izdatkov za zdra¬vilo pomeni, da imetnik dovoljenja po zaključku dogovor¬jenega obdobja povrne Zavodu dogovorjeno razliko med realiziranim in dogovorjenim zneskom za zdravilo, če je bil slednji presežen.
(9) Dogovor o delitvi tveganja pomeni delitev financira¬nja zdravila med imetnikom dovoljenja in Zavodom glede na doseganje kliničnih meril, določenih v dogovoru o ceni zdravila.
45. člen
(prenehanje dogovorjene cene zdravila)
Kadar se NDC zdravila zniža na dogovorjeno ceno tega zdravila ali pod njo, preneha veljati dogovor o ceni zdravila za to zdravilo v delu, ki se nanaša na njegovo dogovorjeno ceno, če imetnik dovoljenja in Zavod predhodno ne dogovorita nove dogovorjene cene za to zdravilo.
46. člen
(uveljavitev dogovorjenih cen zdravil)
Imetniki dovoljenja oziroma lekarne, ko so predmet dogo¬vora o ceni zdravila galenska zdravila, o dogovorjenih cenah svojega zdravila obvestijo pravne in fizične osebe, ki imajo do¬voljenje za opravljanje dejavnosti prometa na debelo z zdravili, oziroma imajo z njimi sklenjene pogodbe o sodelovanju, takoj po sklenitvi dogovora o ceni zdravila ali najpozneje v osmih dneh po datumu veljavnosti, navedenem na obrazcu Dogovor o ceni zdravila, oziroma najpozneje v osmih dneh pred prihodom zdravila na trg v Republiko Slovenijo.
X. EVIDENCE O ZDRAVILIH
47. člen
(evidence)
Zavod vodi evidenco o zdravilih, ki so razvrščena na listo zdravil in o NPV za razvrščena zdravila ter evidenco o dogo¬vorjenih cenah zdravil.
48. člen
(objavljanje)
(1) Spremembe liste zdravil z datumom začetka veljavno¬sti spremembe Zavod objavi na svoji spletni strani najpozneje 14 dni pred njihovo uveljavitvijo. Zavod objavlja na svoji spletni strani čistopis liste zdravil.
(2) Seznam zdravil z NPV oziroma njegove spremembe Zavod objavi na svoji spletni strani naslednji delovni dan po določitvi NPV. Zavod objavlja na svoji spletni strani prečiščeno besedilo seznama zdravil z NPV.
(3) Dogovorjene cene zdravil Zavod objavi na svoji spletni strani, če imetnik dovoljenja oziroma lekarna dovoli njihovo javno objavo, kar označi na obrazcu Dogovor o ceni zdravila. V nasprotnem primeru Zavod objavi dogovorjene cene zdravil le za izvajalce zdravstvene dejavnosti.
(4) Zavod obvešča imetnike dovoljenj, zdravstvene insti¬tucije, ki naslovijo na Zavod pobudo, in izvajalce zdravstve¬ne dejavnosti o razvrstitvah, prerazvrstitvah, izločitvah z liste zdravil ter določitvah in spremembah omejitev predpisovanja in izdajanja ter o NPV tudi prek sistema Zavoda za avtomatsko elektronsko obveščanje, v katerega se imetniki dovoljenj, zdra¬vstvene institucije, ki naslovijo na Zavod pobudo, in izvajalci zdravstvene dejavnosti lahko vključijo prek spletne aplikacije, ki je javno objavljena na naslovu http://www.zzzs.si/egradiva.
XI. PREHODNI IN KONČNA DOLOČBA
49. člen
(vloge in pobude, prejete pred uveljavitvijo pravilnika)
Vloge za razvrščanje, prerazvrščanje, izločitev z liste zdravil in določitev ali spremembo omejitve predpisovanja ali izdajanja, ki jih je Zavod prejel pred uveljavitvijo tega pravilnika, se obravnavajo po določbah Pravilnika o razvrščanju zdravil na listo (Uradni list RS, št. 110/10).
50. člen
(prenehanje veljavnosti)
Z dnem uveljavitve tega pravilnika preneha veljati Pra¬vilnik o razvrščanju zdravil na listo (Uradni list RS, št. 110/10).
51. člen
(začetek veljavnosti)
Ta pravilnik se objavi v Uradnem listu Republike Slo¬venije, ko da nanj soglasje minister, pristojen za zdravje, in začne veljati petnajsti dan po objavi v Uradnem listu Republike Slovenije.
Št. 9000-3/2013-DI/11 Ljubljana, dne 3. aprila 2013 EVA 2012-2711-0050
Predsednik skupščine Zavoda za zdravstveno zavarovanje Slovenije Vladimir Tkalec l.r.
Priloga 1: Vsebina vlog
Priloga 2: Obrazec Dogovor o ceni zdravila
“,”Jaka Verbic Miklic”,1521991800,1521991800,sl,12437,306,12418,43,0,NULL,,”Pravilnik o razvrščanju zdravil na listo, UL št. 35, 26. 4. 2013″,pravilnik-o-razvrscanju-zdravil-na-listo-ul-st-35-26-4-2013,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521991868,1524644288
266,12438,”Pravilnik o pogojih, načinu in postopku za pridobitev dovoljenja za vnos oziroma uvoz zdravil za uporabo v humani medicini “,”UL 65, 24/08/2012″,”
Na podlagi četrtega odstavka 77. člena Zakona o zdravilih (Uradni list RS, št. 31/06 in 45/08) minister za zdravje izdaja
P R A V I L N I K
o pogojih, načinu in postopku za pridobitev dovoljenja za vnos oziroma uvoz zdravil za uporabo v humani medicini
I. SPLOŠNE DOLOČBE
1. člen
(1) Ta pravilnik podrobneje določa pogoje, način in postopek za pridobitev dovoljenja, ki ga izda Javna agencija Republike Slovenije za zdravila in medicinske pripomočke (v nadaljnjem besedilu: Agencija), za vnos oziroma uvoz naslednjih zdravil za uporabo v humani medicini (v nadaljnjem besedilu: zdravila):
– imunskih serumov, cepiv, izdelkov iz krvi in radiofarmacevtskih izdelkov, ki imajo dovoljenje za promet v Republiki Sloveniji;
– zdravil, ki nimajo dovoljenja za promet v Republiki Sloveniji, v nujnih primerih posamičnega zdravljenja na predlog pravne osebe, ki opravlja zdravstveno dejavnost na terciarni ravni in na osebno odgovornost lečečega zdravnika;
– zdravil, ki so razvrščena na seznam nujno potrebnih zdravil za uporabo v humani medicini in ki nimajo dovoljenja za promet v Republiki Sloveniji;
– zdravil, ki nimajo dovoljenja za promet v Republiki Sloveniji, v izrednih primerih ali v primeru drugih razlogov, ki so v interesu varovanja javnega zdravja;
– zdravil, ki so namenjena za razvojno in raziskovalno delo in na odgovornost institucije, ki opravlja razvojno in raziskovalno delo.
(2) Ta pravilnik podrobneje ureja tudi pogoje, način in postopek za pridobitev dovoljenja za vnos oziroma uvoz zdravil, ki nimajo dovoljenja za promet v Republiki Sloveniji in so v postopku pridobitve dovoljenja za promet z zdravilom po centraliziranem postopku na predlog lečečega zdravnika – zdravljenja bolnika z zdravilom za sočutno uporabo v skladu s 83. členom Uredbe (ES) št. 726/2004 Evropskega parlamenta in Sveta z dne 31. marca 2004 o postopkih Skupnosti za pridobitev dovoljenja za promet in nadzor zdravil za humano in veterinarsko uporabo ter o ustanovitvi Evropske agencije za zdravila (UL L št. 136 z dne 30. 4. 2004, str. 1), zadnjič spremenjene z Uredbo (EU) št. 1235/2010 Evropskega parlamenta in Sveta z dne 15. decembra 2010 o spremembah Uredbe (ES) št. 726/2004 o postopkih Skupnosti za pridobitev dovoljenja za promet in nadzor zdravil za humano in veterinarsko uporabo ter o ustanovitvi Evropske agencije za zdravila in Uredbe (ES) št. 1394/2007 o zdravilih za napredno zdravljenje, glede farmakovigilance zdravil za uporabo v humani medicini (UL L št. 348 z dne 31. 12. 2010, str. 1).
2. člen
Poleg definicij in izrazov, ki so opredeljeni v 5. in 6. členu Zakona o zdravilih (Uradni list RS, št. 31/06 in 45/08; v nadaljnjem besedilu: zakon), se v tem pravilniku uporabljajo še definicije in izrazi, ki imajo naslednji pomen:
– tuji dobavitelj je pravna ali fizična oseba, ki je lahko izdelovalec, proizvajalec, ali veletrgovec, in ima sedež izven Republike Slovenije;
– končni uporabnik je zdravstveni zavod ali druga pravna ali fizična oseba, ki je pristojna za izdajo zdravil za posamično zdravljenje ali zdravilo uporablja pri opravljanju lastne dejavnosti;
– vnosnik je imetnik dovoljenja za promet z zdravili na debelo, ki vnosi zdravilo iz drugih držav članic EU v Republiko Slovenijo;
– predlagatelj za pridobitev dovoljenja za vnos zdravila je:
– imetnik dovoljenja za opravljanje dejavnosti prometa z zdravili na debelo oziroma priglašeni veletrgovec, ki je pridobil dovoljenje za opravljanje dejavnosti prometa z zdravil na debelo v drugi državi članici Evropske unije (v nadaljnjem besedilu EU),
za uvoz pa:
– imetnik dovoljenja za izdelavo zdravil, ki lahkov okviru tega dovoljenja opravljati tudi dejavnost uvoza zdravil;
– uvoz pomeni dokončen uvoz po carinski sprostitvi.
3. člen
(1) Vnos oziroma uvoz zdravil, ki se vnašajo oziroma uvažajo zaradi nadaljnje prodaje v Republiki Sloveniji in imajo dovoljenje za promet v Republiki Sloveniji, sta prosta.
(2) Vnos oziroma uvoz zdravil, ki se vnašajo oziroma uvažajo zaradi iznosa ali izvoza v druge države, z namenom dajanja v promet v drugih državah in ne bodo prodana v Republiki Sloveniji, sta prosta, če se opravljata v okviru in na podlagi ustreznega dovoljenja za opravljanje dejavnosti izdelave zdravil, oziroma prometa na debelo z zdravili.
II. POSTOPEK ZA PRIDOBITEV DOVOLJENJA ZA VNOS OZIROMA UVOZ ZDRAVIL
1. Vnos oziroma uvoz imunskih serumov, cepiv, izdelkov iz krvi in radiofarmacevtskih izdelkov, ki imajo dovoljenje za promet v Republiki Sloveniji
4. člen
(1) Postopek za pridobitev dovoljenja za vnos oziroma uvoz imunskih serumov, cepiv, izdelkov iz krvi in radiofarmacevtskih izdelkov se začne s pisno vlogo, ki jo predlagatelj pošlje Agenciji, in vsebuje izpolnjen obrazec, objavljen na spletni strani Agencije, z naslednjimi podatki:
– ime zdravila, jakost, farmacevtsko obliko, pakiranje, mednarodno nelastniško ime (INN), količino in serijsko številko;
– ime in sedež predlagatelja;
– številko in datum izdaje dovoljenja za promet z zdravilom;
– ime in sedež tujega dobavitelja.
(2) Pred dajanjem vnesenih oziroma uvoženih rizičnih zdravil, ki so določeni v tretji alinei drugega odstavka 92. člena zakona, v promet, mora biti izvedena posebna kontrola kakovosti v skladu s pravilnikom, ki ureja analizno preskušanje zdravil z namenom kontrole kakovosti.
2. Vnos oziroma uvoz zdravil, ki nimajo dovoljenja za promet v Republiki Sloveniji, v nujnih primerih posamičnega zdravljenja
5. člen
(1) Postopek za pridobitev dovoljenja za vnos zdravil, ki nimajo dovoljenja za promet v Republiki Sloveniji, v nujnih primerih posamičnega zdravljenja, se začne s pisno vlogo, ki jo predlagatelj pošlje Agenciji, in vsebuje izpolnjen obrazec, objavljen na spletni strani Agencije, z naslednjimi podatki:
– ime zdravila, jakost, farmacevtsko obliko, pakiranje, mednarodno nelastniško ime (INN), ATC klasifikacijo in količino; pri imunskih serumih, cepivih in izdelkih iz krvi tudi serijsko številko;
– ime in sedež predlagatelja;
– ime in sedež izdelovalca oziroma izdelovalcev;
– številko in datum izdaje oziroma veljavnost dovoljenja za promet z zdravilom ter ime organa, ki je izdal dovoljenje za promet z zdravilom v drugi državi članici EU;
– ime in sedež tujega dobavitelja;
– ime in sedež končnega uporabnika.
(2) Predlagatelj mora k vlogi za pridobitev dovoljenja za vnos zdravil iz prejšnjega odstavka priložiti še naslednja dokazila:
– obrazložen predlog pristojne klinike ali inštituta za vnos potrebne količine zdravila, iz katerega je razvidno, zakaj z zdravili določenimi s smernicami zdravljenja, ki so že pridobila dovoljenje za promet v Republiki Sloveniji in so na trgu, ni možno zagotoviti ustreznega zdravljenja z navedbo zdravnikov, ki so predlagali vnos zdravila, ki nima dovoljenja za promet v Republiki Sloveniji in so osebno odgovorni za zdravljenje s temi zdravili. Predlog mora v imenu strokovnega kolegija podpisati njegov predstojnik. Kadar je končni uporabnik zdravstveni zavod, ki nima naziva klinike, kliničnega inštituta ali kliničnega oddelka, mora obrazložen predlog končnega uporabnika potrditi predstojnik strokovnega kolegija izvajalca zdravstvene dejavnosti na terciarni ravni na obrazcu, objavljenem na spletni strani Agencije;
– strokovno utemeljeno izjavo končnega uporabnika, da vnos zdravila ni predlagan izključno zato, ker je cena vnesenega zdravila konkurenčna ceni zdravila z dovoljenjem za promet, če je na trgu Republike Slovenije zdravilo z dovoljenjem za promet z enako učinkovino, farmacevtsko obliko, jakostjo in pakiranjem, kot zdravilo, ki je predmet vloge za izdajo dovoljenja za vnos;
– izjavo končnega uporabnika zdravila, da bodo upoštevane farmakovigilančne obveznosti, kot v primeru zdravil, ki imajo dovoljenje za promet v Republiki Sloveniji;
– izjavo končnega uporabnika, da zdravila ne bodo uporabljena za klinična preskušanja;
– originalno naročilnico končnega uporabnika in naročilnico dobavitelja zdravila vnosniku, če vnosnik in dobavitelj nista isti pravni osebi, oziroma naročilnico končnega uporabnika, če je vnosnik in dobavitelj ista pravna oseba;
– izjavo Inštituta za varovanje zdravja Republike Slovenije o skladnosti z nacionalnim programom imunoprofilakse in kemoprofilakse za tekoče leto, če gre za vnos imunskih serumov in cepiv in zadevno cepljenje sodi v ta program;
– mnenje Zavoda Republike Slovenije za transfuzijsko medicino, ali je zadevni vnos izdelkov iz krvi v skladu z načelom samozadostnosti;
– opis poti zdravila od izdelovalca do predlagatelja;
– izjavo vnosnika zdravila, da bo upošteval farmakovigilančne obveznosti glede vzpostavitve in dopolnjevanja sistema farmakovigilance, kot to velja za imetnike dovoljenja za promet z zdravili.
6. člen
Postopek za pridobitev dovoljenja za uvoz zdravil, ki nimajo dovoljenja za promet v Republiki Sloveniji, v nujnih primerih posamičnega zdravljenja, se začne s pisno vlogo, ki jo predlagatelj pošlje Agenciji, in vsebuje izpolnjen obrazec, objavljen na spletni strani Agencije, ki poleg podatkov iz prejšnjega člena vsebuje tudi potrdilo, da je zdravilo izdelano po načelih dobre proizvodne prakse (DPP), ki ni starejše od treh let (certifikat DPP) ali certifikat o zdravilu (CertificateofPharmaceuticalProduct – CPP), oziroma izjemoma, v posebej utemeljenih primerih, drugo ustrezno dokazilo, ki zagotavlja kakovost zdravila.
3. Vnos oziroma uvoz zdravil, ki so razvrščena na seznam nujno potrebnih zdravil za uporabo v humani medicini in ki nimajo dovoljenja za promet v Republiki Sloveniji
7. člen
(1) Postopek za pridobitev dovoljenja za vnos zdravil, ki so razvrščena na seznam nujno potrebnih zdravil za uporabo v humani medicini in ki nimajo dovoljenja za promet v Republiki Sloveniji, se začne s pisno vlogo predlagatelja Agenciji, ki vsebuje izpolnjen obrazec, objavljen na spletni strani Agencije, z naslednjimi podatki:
– ime zdravila, jakost, farmacevtsko obliko, pakiranje, mednarodno nelastniško ime (INN), ATC klasifikacijo in količino; pri imunskih serumih, cepivih in izdelkih iz krvi tudi serijsko številko;
– ime in sedež predlagatelja;
– številko in datum izdaje oziroma veljavnost dovoljenja za promet z zdravilom ter ime organa, ki je izdal dovoljenje za promet z zdravilom v drugi državi članici Evropske unije;
– ime in sedež tujega dobavitelja;
– ime in sedež končnega uporabnika.
(2) Predlagatelj mora k vlogi za pridobitev dovoljenja za vnos zdravil iz prejšnjega odstavka priložiti še naslednja dokazila:
– mnenje Zavoda Republike Slovenije za transfuzijsko medicino, ali je zadevni vnos izdelkov iz krvi v skladu z načelom samozadostnosti;
– opis poti zdravila od izdelovalca do predlagatelja;
– izjavo predlagatelja, da bo zdravilo opremil s prevodom navodila za uporabo v slovenskem jeziku ter z nalepko v slovenskem jeziku, oziroma da je zagotovljena zunanja ovojnina v slovenskem jeziku, kadar gre za nujno zdravilo, ki se izdaja na recept v lekarnah v skladu z določbami 13. in 22. člena Pravilnika o označevanju in navodilu za uporabo zdravil za uporabo v humani medicini (Uradni list RS, št. 21/12). Izjava mora vsebovati tudi zagotovilo predlagatelja, da bo zdravilo opremila na ta način pravna oziroma fizična oseba, ki ima dovoljenje Agencije za ta del izdelave zdravil z navedbo te osebe. Zdravila, ki so samo za bolnišnično uporabo ali za uporabo v javnih zdravstvenih zavodih ter pri pravnih in fizičnih osebah, ki opravljajo zdravstveno dejavnost, morajo biti označena v enem od jezikov držav članic EU, in sicer v latinici. Predlagatelj mora uporabnika oskrbeti z navodili za uporabo v slovenskem ali angleškem jeziku oziroma izjemoma v drugem jeziku, ki je razumljiv naročniku;
– izjavo vnosnika zdravila, da bo upošteval farmakovigilančne obveznosti glede vzpostavitve in dopolnjevanja sistema farmakovigilance, kot to velja za imetnike dovoljenja za promet z zdravili.
8. člen
Postopek za pridobitev dovoljenja za uvoz zdravil, ki so razvrščena na seznam nujno potrebnih zdravil za uporabo v humani medicini in ki nimajo dovoljenja za promet v Republiki Sloveniji, se začne s pisno vlogo, ki jo predlagatelj pošlje Agenciji, in vsebuje izpolnjen obrazec, objavljen na spletni strani Agencije, ki poleg podatkov iz prejšnjega člena vsebujejo tudi potrdilo, da je zdravilo izdelano po načelih dobre proizvodne prakse (DPP), ki ni starejše od treh let (certifikat DPP) ali certifikat o zdravilu (Certificate of Pharmaceutical Product – CPP), oziroma izjemoma, v posebej utemeljenih primerih, drugo ustrezno dokazilo, ki zagotavlja kakovost zdravila.
4. Vnos oziroma uvoz zdravil, ki nimajo dovoljenja za promet v Republiki Sloveniji, v izrednih primerih ali v primeru drugih razlogov, ki so v interesu varovanja javnega zdravja
9. člen
(1) Postopek za pridobitev dovoljenja za vnos zdravil, ki nimajo dovoljenja za promet v Republiki Sloveniji, v izrednih primerih ali v primeru drugih razlogov, ki so v interesu varovanja javnega zdravja se začne s pisno vlogo predlagatelja Agenciji, ki vsebuje izpolnjen obrazec, objavljen na spletni strani Agencije, z naslednjimi podatki:
– ime zdravila, jakost, farmacevtsko obliko, pakiranje, mednarodno nelastniško ime (INN), ATC klasifikacijo in količino; pri imunskih serumih, cepivih in izdelkih iz krvi tudi serijsko številko;
– ime in sedež predlagatelja;
– ime in sedež izdelovalca;
– številko in datum izdaje oziroma veljavnost dovoljenja za promet z zdravilom ter ime organa, ki je izdal dovoljenje za promet z zdravilom v drugi državi članici EU;
– ime in sedež tujega dobavitelja;
– ime in sedež končnega uporabnika.
(2) Predlagatelj mora k vlogi za pridobitev dovoljenja za vnos zdravil iz prejšnjega odstavka priložiti še naslednja dokazila oziroma izjave:
– navedba in obrazložitev izrednih razlogov oziroma drugih razlogov, ki so v interesu varovanja javnega zdravja, ki so razlog za vložitev vloge;
– podatke o moteni dobavi zdravila, ki so bila Agenciji sporočena v skladu s 44. členom zakona, v primeru motene dobave zdravila, če na trgu Republike Slovenije ni zdravila z dovoljenjem za promet, ki ima enako učinkovino, farmacevtsko obliko, jakost in pakiranje, z navedbo razlogov za motnje v dobavi in predvideno trajanje motene dobave;
– dokazilo o porabi zdravila po mesecih v preteklem letu;
– obrazložen predlog pristojne klinike ali inštituta za vnos potrebne količine zdravila, iz katerega je razvidno, zakaj z zdravili določenimi s smernicami zdravljenja, ki so že pridobila dovoljenje za promet v Republiki Sloveniji in so na trgu, ni možno zagotoviti ustreznega zdravljenja z navedbo zdravnikov, ki so predlagali vnos zdravila, ki nima dovoljenja za promet v Republiki Sloveniji in so osebno odgovorni za zdravljenje s temi zdravili. Predlog mora v imenu strokovnega kolegija podpisati njegov predstojnik. Kadar je končni uporabnik zdravstveni zavod, ki nima naziva klinike, kliničnega inštituta ali kliničnega oddelka, mora obrazložen predlog končnega uporabnika potrditi predstojnik strokovnega kolegija izvajalca zdravstvene dejavnosti na terciarni ravni na obrazcu, objavljenem na spletni strani Agencije;
– opis poti zdravila od izdelovalca do predlagatelja;
– izjavo predlagatelja, da bo zdravilo opremil s prevodom navodila za uporabo v slovenskem jeziku ter z nalepko v slovenskem jeziku, oziroma da je zagotovljena zunanja ovojnina v slovenskem jeziku, kadar gre za nujno zdravilo, ki se izdaja na recept v lekarnah v skladu z določili 13. in 22. člena Pravilnika o označevanju in navodilu za uporabo zdravil za uporabo v humani medicini (Uradni list RS, št. 21/12). Izjava mora vsebovati tudi zagotovilo predlagatelja, da bo zdravilo opremila na ta način pravna oziroma fizična oseba, ki ima dovoljenje Agencije za ta del izdelave zdravil z navedbo te osebe. Zdravila, ki so samo za bolnišnično uporabo ali za uporabo v javnih zdravstvenih zavodih ter pri pravnih in fizičnih osebah, ki opravljajo zdravstveno dejavnost, morajo biti označena v enem od jezikov držav članic EU, in sicer v latinici. Predlagatelj mora uporabnika oskrbeti z navodili za uporabo v slovenskem ali angleškem jeziku oziroma izjemoma v drugem jeziku, ki je razumljiv naročniku;
– izjavo Inštituta za varovanje zdravja Republike Slovenije o skladnosti z nacionalnim programom imunoprofilakse in kemoprofilakse za tekoče leto, če gre za vnos imunskih serumov in cepiv in zadevno cepljenje sodi v ta program;
– mnenje Zavoda Republike Slovenije za transfuzijsko medicino, ali je zadevni vnos izdelkov iz krvi v skladu z načelom samozadostnosti;
– izjavo vnosnika zdravila, da bo upošteval farmakovigilančne obveznosti glede vzpostavitve in dopolnjevanja sistema farmakovigilance, kot to velja za imetnike dovoljenja za promet z zdravili.
10. člen
Postopek za pridobitev dovoljenja za uvoz zdravil, ki nimajo dovoljenja za promet v Republiki Sloveniji, v izrednih primerih ali v primeru drugih razlogov, ki so v interesu varovanja javnega zdravja, se začne s pisno vlogo, ki jo predlagatelj pošlje Agenciji, in vsebuje izpolnjen obrazec, objavljen na spletni strani Agencije, ki poleg podatkov iz prejšnjega člena vsebuje tudi potrdilo, da je zdravilo izdelano po načelih dobre proizvodne prakse (DPP), ki ni starejše od treh let (certifikat DPP) ali certifikat o zdravilu (Certificate of Pharmaceutical Product – CPP), oziroma izjemoma, v posebej utemeljenih primerih, drugo ustrezno dokazilo, ki zagotavlja kakovost zdravila.
5. Vnos oziroma uvoz zdravil, ki nimajo dovoljenja za promet v Republiki Sloveniji in so v postopku pridobitve dovoljenja za promet z zdravilom po centraliziranem postopku na predlog lečečega zdravnika – sočutna uporaba zdravila
11. člen
(1) Postopek za pridobitev dovoljenja za vnos zdravil, ki nimajo dovoljenja za promet v Republiki Sloveniji, in so v postopku pridobitve dovoljenja za promet z zdravilom po centraliziranem postopku na predlog lečečega zdravnika – sočutna uporaba zdravila, ki se začne s pisno vlogo predlagatelja Agenciji, ki vsebuje izpolnjen obrazec, objavljen na spletni strani Agencije, z naslednjimi podatki:
– ime zdravila, jakost, farmacevtsko obliko, pakiranje, mednarodno nelastniško ime (INN), ATC klasifikacijo, ki je v postopku pridobitve dovoljenja za promet po centraliziranem postopku;
– ime zdravila, jakost, farmacevtsko obliko, pakiranje, mednarodno nelastniško ime (INN), ATC klasifikacijo in količino, za katerega se predlaga izdaja dovoljenja za vnos;
– ime in sedež predlagatelja;
– ime in sedež izdelovalca;
– ime in sedež tujega dobavitelja;
– ime in sedež končnega uporabnika.
(2) Predlagatelj mora k vlogi za pridobitev dovoljenja za vnos zdravil iz prejšnjega odstavka priložiti še naslednja dokazila oziroma izjave:
– izjavo, da je zdravilo v postopku pridobitve dovoljenja po centraliziranem postopku;
– izjavo lečečega zdravnika glede uporabe zdravila, ki vsebuje navedbe:
– da gre za bolnike s kronično in resno izčrpavajočo boleznijo ali ogrožajočo boleznijo,
– da bolnike, za katere se predlaga zdravljenje z vnesenim zdravilom, ni mogoče učinkovito zdraviti z zdravilom iz iste terapevtske skupine, ki že ima dovoljenje za promet, oziroma na trgu v Republiki Sloveniji ni drugega ustreznega zdravila ali druge možnosti zdravljenja,
– da bo upošteval farmakovigilančne obveznosti, kot v primeru zdravil, ki imajo dovoljenje za promet,
– izjavo bolnika oziroma njegovega zakonitega zastopnika, da je seznanjen in da se strinja s predlagano možnostjo zdravljenja;
– dokumentacijo – povzetek podatkov o kakovosti, varnosti in učinkovitosti zdravila;
– izobraževalno gradivo za zdravnike in bolnike (tudi v prevodu v slovenski jezik);
– seznam držav, kjer je odobren program sočutne uporabe z zadevnim zdravilom;
– izjavoizdelovalca, da bo zagotovil potrebne količine zdravila za zdravljenje bolnikov, ki so udeleženi v zadevnem programu do zagotovitve financiranja tega zdravila iz javnih sredstev pri vseh bolnikih, pri katerih je dokumentirana korist zdravljenja s tem zdravilom.
(3) Agencija lahko od predlagatelja zahteva tudi predložitev mnenje Evropske agencije za zdravila v zvezi z vnosom zdravila v Republiko Slovenijo, če oceni, da je to mnenje potrebno za izdajo dovoljenja na podlagi tega pravilnika z vidika varnosti zdravljenja bolnikov.
12. člen
Postopek za pridobitev dovoljenja za uvoz zdravil, ki nimajo dovoljenja za promet v Republiki Sloveniji, in so v postopku pridobitve dovoljenja za promet z zdravilom po centraliziranem postopku na predlog lečečega zdravnika – sočutna uporaba zdravila, se začne s pisno vlogo, ki jo predlagatelj pošlje Agenciji, in vsebuje izpolnjen obrazec, objavljen na spletni strani Agencije, ki poleg podatkov iz prejšnjega člena vsebujejo tudi potrdilo, da je zdravilo izdelano po načelih dobre proizvodne prakse (DPP).
4. Vnos oziroma uvoz zdravil, ki so namenjena za razvojno in raziskovalno delo
13. člen
Postopek za pridobitev letnega dovoljenja za vnos oziroma uvoz zdravil, ki so namenjena za razvojno in raziskovalno delo, se začne s pisno vlogo, ki jo predlagatelj pošlje Agenciji, in vsebuje izpolnjen obrazec, objavljen na spletni strani Agencije, s podatki o imenu in sedežu predlagatelja, potrdilom končnega uporabnika o namenu uporabe z izjavo, da zdravila ne bodo uporabljena za klinično preskušanje ali zdravljenje ter izjavo, da bo predlagatelj s trimesečnimi poročili seznanjal o izvedenih vnosih oziroma uvozih zdravil z naslednjimi podatki:
– trgovsko ime ali kodo zdravila, farmacevtsko obliko, jakost, pakiranje, mednarodno nelastniško ime (INN) in količino zdravila;
– ime in sedež izdelovalca;
– ime in sedež tujega dobavitelja.
5. Izdaja dovoljenja za vnos oziroma uvoz zdravil
14. člen
(1) Agencija izda dovoljenje za vnos oziroma uvoz zdravil v 30 dneh po prejemu popolne vloge.
(2) Dovoljenja za vnos oziroma uvoz zdravil, ki ga izda Agencija, mora vključevati delovno šifro zdravila, ki je sestavni del dovoljenja za vnos oziroma uvoz zdravil.
(3) Dovoljenje za vnos oziroma uvoz zdravila je veljavno do končne izvedbe vnosa oziroma uvoza v dovoljenju navedene količine zdravila, oziroma najdlje eno leto od datuma izdaje dovoljenja.
(4) Dovoljenje velja le v izvirniku.
15. člen
Agencija lahko zavrne izdajo dovoljenja za vnos oziroma uvoz zdravil:
– če predlagane količine zdravila presegajo predvideni namen pri vnosu oziroma uvozu zdravil v nujnih primerih posamičnega zdravljenja, če je na trgu Republike Slovenije zdravilo, ki ima dovoljenje za promet z zdravilom z enako učinkovino, farmacevtsko obliko in jakostjo;
– če je zdravilo, ki je uvrščeno na seznam nujno potrebnih zdravil, pridobilo dovoljenje za promet z zdravilom in je dostopno na trgu Republike Slovenije.
III. SPREMLJANJE SLEDLJIVOSTI PROMETA ZDRAVILA IN UVOZA OZIROMA VNOSA ZARADI IZVOZA ALI IZNOSA
16. člen
(1) Na zahtevo Agencije mora imetnik dovoljenja za vnos oziroma uvoz zdravil Agenciji predložiti poročilo o opravljenem prometu z zdravilom, ki je predmet izdanega dovoljenja za vnos oziroma uvoz, oziroma druge podatke o teh zdravilih, pomembne za varovanje javnega zdravja.
(2) Na zahtevo Agencije mora imetnik ustreznega dovoljenja za opravljanje dejavnosti izdelave zdravil oziroma prometa na debelo z zdravili Agenciji predložiti poročilo o opravljenem uvozu oziroma vnosu zdravil zaradi izvoza ali iznosa oziroma druge podatke o teh zdravilih, pomembne za varovanje javnega zdravja.
IV. PREHODNE IN KONČNE DOLOČBE
17. člen
Agencija o vlogah, ki jih je prejela do uveljavitve tega pravilnika, odloči na podlagi določb Pravilnika o pogojih, načinu in postopku za pridobitev dovoljenja za vnos oziroma uvoz zdravil za uporabo v humani medicini (Uradni list RS, št. 30/09).
18. člen
Z dnem uveljavitve tega pravilnika preneha veljati Pravilnik o pogojih, načinu in postopku za pridobitev dovoljenja za vnos oziroma uvoz zdravil za uporabo v humani medicini (Uradni list RS, št. 30/09).
19. člen
Ta pravilnik začne veljati petnajsti dan po objavi v Uradnem listu Republike Slovenije.
Št. 715-9/2012
Ljubljana, dne 23. maja 2012
EVA 2012-2711-0026
Tomaž Gantar l.r.
Minister
za zdravje
“,”Jaka Verbic Miklic”,1521991980,1521991980,sl,12438,306,12419,43,0,NULL,,”Pravilnik o pogojih, načinu in postopku za pridobitev dovoljenja za vnos oziroma uvoz zdravil za uporabo v humani medicini, UL š”,pravilnik-o-pogojih-nacinu-in-postopku-za-pridobitev-dovoljenja-za-vnos-oziroma-uvoz-zdravil-za-uporabo-v-humani-medicini-ul-st-,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521992908,1523615424
267,12439,”Pravilnik o oglaševanju zdravil “,”UL 105, 24/12/2010″,”
Neuradno prečiščeno besedilo št.1 vsebuje:
– Pravilnik o oglaševanju zdravil (Uradni list RS št.105/08),
– Pravilnik o spremembah in dopolnitvah Pravilnika o oglaševanju zdravil (Uradni list RS št. 105/10).
I. SPLOŠNE DOLOČBE
1. člen
(področje urejanja)
Ta pravilnik določa podrobnejše pogoje in način oglaševanja zdravil za uporabo v humani in veterinarski medicini (v nadaljnjem besedilu: zdravila) v skladu z Direktivo 2001/83/ES Evropskega parlamenta in Sveta z dne 6. novembra 2001 o zakoniku Skupnosti o zdravilih za uporabo v humani medicini (UL L št. 311 z dne 28. 11. 2001, str. 67), zadnjič spremenjeno z Direktivo 2008/29/ES Evropskega parlamenta in Sveta z dne 11. marca 2008 o spremembi Direktive 2001/83/ES o zakoniku Skupnosti o zdravilih za uporabo v humani medicini, glede Komisiji podeljenih izvedbenih pooblastil (UL L št. 81 z dne 20. 3. 2008, str. 51) (v nadaljnjem besedilu: Direktiva 2001/83/ES) in z Direktivo 2001/82/ES Evropskega parlamenta in Sveta z dne 6. novembra 2001 o zakoniku Skupnosti o zdravilih za uporabo v veterinarski medicini (UL L št. 311 z dne 28. 11. 2001, str. 1), zadnjič spremenjeno z Direktivo 2004/28/ES Evropskega parlamenta in Sveta z dne 31. marca 2004 o spremembi Direktive 2001/82/ES o zakoniku Skupnosti o zdravilih za uporabo v veterinarski medicini (UL L št. 136 z dne 30. 4. 2004, str. 58) (v nadaljnjem besedilu: Direktiva 2001/82/ES).
2. člen
(opredelitev oglaševanja)
(1) Oglaševanje zdravil so vse oblike obveščanja, vključno z obveščanjem od vrat do vrat, propagiranjem ali spodbujanjem, ki je namenjeno pospeševanju predpisovanja, izdajanja, prodaje in uporabe zdravil.
(2) Glede na ciljne skupine se oglaševanje deli na:
– oglaševanje v širši javnosti in
– oglaševanje v strokovni javnosti.
3. člen
(opredelitev širše in strokovne javnosti)
(1) Širša javnost so laične skupine in posamezniki, ki ne pripadajo strokovni javnosti kot jo opredeljuje ta pravilnik.
(2) Strokovna javnost so osebe, pooblaščene za predpisovanje in izdajanje zdravil.
4. člen
(obseg oglaševanja)
(1) Oglaševanje v širši javnosti so vse promocijske oblike in načini obveščanja laičnih skupin in posameznikov.
(2) Oglaševanje v strokovni javnosti je:
– informiranje oseb, ki so pooblaščene za predpisovanje in izdajanje zdravil, z lastnostmi in učinki zdravil, vključno z neposrednim obveščanjem teh oseb;
– pokroviteljstvo in organizacija promocijskih srečanj, ki se jih udeležujejo osebe, pooblaščene za predpisovanje in izdajanje zdravil;
– pokroviteljstvo nad znanstvenimi kongresi, ki se jih udeležujejo osebe, pooblaščene za predpisovanje in izdajanje zdravil;
– dajanje vzorcev v skladu z 22. členom tega pravilnika.
(3) Za oglaševanje v strokovni javnosti se šteje tudi vzpodbujanje k predpisovanju ali izdajanju z obljubljanjem ali dajanjem finančnih ali materialnih dobrin v skladu z 20. členom tega pravilnika.
5. člen
(izključitev iz obsega oglaševanja)
Za oglaševanje oziroma oglaševalska gradiva se ne štejejo:
– ovojnina in navodilo za uporabo zdravila, odobreni v dovoljenju za promet z zdravilom;
– informativne objave v zvezi z odobrenimi spremembami na ovojnini, opozorila o neželenih učinkih in drugi splošni previdnostni ukrepi z namenom varnejše in učinkovitejše uporabe zdravila;
– prodajni katalogi in ceniki, ki ne vključujejo navedb o lastnostih zdravila;
– korespondenca o specifičnih vprašanjih glede določenega zdravila, vključno s priloženimi gradivi, ki niso promocijske narave;
– objave in gradiva institucije, pooblaščene za pripravo programov za preprečevanje, obvladovanje, odstranitev (eliminacijo) in izkoreninjenje (eradikacijo) nalezljivih bolezni o možnostih cepljenja proti posameznim boleznim, pri katerih niso neposredno omenjena posamezna cepiva, njihovo učinkovanje in druge specifične lastnosti;
– informacije v zvezi z zdravjem ljudi ali boleznimi, pod pogojem, da ni nobenega napotila, tudi posrednega ne, na zdravila. Informacije morajo biti kakovostne, objektivne, nedvoumne, celovite, uravnotežene, uporabnikom razumljive in ne smejo vsebovati prvin neposrednega ali prikritega oglaševanja.
II. POGOJI OGLAŠEVANJA
6. člen
(dovoljenje za promet z zdravilom)
Dovoljeno je samo oglaševanje tistih zdravil, ki imajo dovoljenje za promet z zdravilom v skladu z Zakonom o zdravilih (Uradni list RS, št. 31/06 in 45/08, v nadaljnjem besedilu: zakon).
7. člen
(skladnost s povzetkom glavnih značilnosti zdravila)
Vsak posamezen element oglaševanja in vsi deli, ki za prejemnika sporočila predstavljajo povezano celoto, morajo biti skladni z odobrenim povzetkom glavnih značilnosti zdravila. Vse lastnosti zdravila morajo biti predstavljene uravnoteženo.
8. člen
(smotrna in varna uporaba zdravila)
(1) Oglaševanje zdravila mora vzpodbujati njegovo smotrno in varno uporabo, tako da je predstavljeno objektivno in brez pretiravanja o njegovih lastnostih.
(2) Za doseganje cilja iz prejšnjega odstavka lahko organ, pristojen za zdravila, v postopku pridobitve ali vzdrževanja dovoljenja za promet z zdravilom zahteva posebna opozorila, ki morajo biti del vsakega posameznega oglaševanja.
9. člen
(zavajajoče oglaševanje)
Oglaševanje ne sme biti zavajajoče glede morebitnih koristi ali tveganj pri uporabi zdravila, pri čemer je treba upoštevati celovitost oglasa in vtis sporočila.
10. člen
(zaščita slovenskega jezika)
(1) Oglaševalska sporočila morajo biti v slovenskem jeziku, na območjih občin v katerih živita italijanska in madžarska narodna skupnost, pa so lahko tudi v jeziku narodne skupnosti.
(2) Ne glede na prejšnji odstavek je literatura, ki je priložena oglaševalskemu gradivu za strokovno javnost, lahko tudi v izvirnem jeziku članka. Na mednarodnih strokovnih srečanjih na območju Republike Slovenije so oglaševalska sporočila in gradiva lahko tudi v jeziku dogodka ali jezikih udeležencev teh dogodkov.
11. člen
(odgovornost)
Za zagotavljanje skladnosti oglaševanja s tem pravilnikom je odgovoren predvsem imetnik dovoljenja za promet z zdravilom oziroma naročnik oglaševanja, vendar je za neupoštevanje določb o oglaševanju zdravil odgovorna katerakoli oseba, ki je vpletena v nepravilno promocijo zdravil.
III. OGLAŠEVANJE V ŠIRŠI JAVNOSTI
12. člen
(oglaševanje v širši javnosti)
(1) V širši javnosti je dovoljeno oglaševati le zdravila, ki se izdajajo brez recepta in za katera v dovoljenju za promet z zdravilom tako odloči organ, pristojen za zdravila.
(2) Prepovedano je oglaševanje in objavljanje informacij v širši javnosti o zdravilih, ki vsebujejo psihotropne ali narkotične snovi iz mednarodnih konvencij, kakor sta Enotna konvencija Združenih narodov o mamilih iz leta 1961 in Konvencija Združenih narodov o psihotropnih snoveh iz leta 1971.
(3) Prepovedano je oglaševanje zdravil za uporabo v veterinarski medicini, ki se lahko uporabljajo kot pospeševalci rasti ali spodbujevalci proizvodnosti (npr. hormoni, beta-agonisti, tireostatiki, goveji somatropini).
13. člen
(pogoji oglaševanja v širši javnosti)
Oglaševanje zdravil v širši javnosti mora biti izvedeno tako, da je oglaševalni značaj sporočila jasno prepoznaven in da je izdelek nedvoumno predstavljen kot zdravilo.
14. člen
(vsebina oglaševanja v širši javnosti)
(1) Oglaševanje vsakega zdravila brez recepta v širši javnosti mora vsebovati najmanj naslednje podatke:
– ime zdravila in splošno ime, če zdravilo vsebuje le eno učinkovino;
– podatki, ki so nujni za smotrno, pravilno in racionalno uporabo zdravila;
– vidno in čitljivo pisno, slikovno ali govorno opozorilo o pomenu navodila za uporabo, ki je priloženo zdravilu in se glasi pri zdravilu za uporabo v humani medicini: »Pred uporabo natančno preberite navodilo! O tveganju in neželenih učinkih se posvetujte z zdravnikom ali s farmacevtom.«;
– vidno in čitljivo pisno, slikovno ali govorno opozorilo o pomenu navodila za uporabo, ki je priloženo zdravilu in se glasi pri zdravilu za uporabo v veterinarski medicini: »Pred uporabo natančno preberite navodilo! O tveganju in neželenih učinkih se posvetujte z veterinarjem ali s farmacevtom.«.
(2) Pisno opozorilo iz prejšnjega odstavka mora biti navedeno poudarjeno (npr.: krepko, barvno izstopajoče, v okvirju) v velikosti najmanj ene desetine velikosti oglasa in v ustrezni velikosti črk, tako da ga je mogoče brez težav prebrati in ga ni mogoče spregledati. Pri televizijskih oglasih mora biti opozorilo na ekranu samostojno ter podano v slikovni (besedilo) in govorni obliki. Govorno opozorilo mora biti povedano v knjižnem jeziku razločno in razumljivo in mora zagotoviti resnost sporočila. Pri oglasih na elektronskih medijih mora biti opozorilo prikazano kot sestavni del glavne strani oglasa in ne kot povezava nanjo. Biti mora poudarjeno (npr.: krepko, barvno izstopajoče, v okvirju) v velikosti, ki pri prikazu na celotnem zaslonu ni manjša od ene četrtine zaslona in z velikostjo črk, ki ni manjša od ene desetine stranice polja opozorila.
15. člen
(prepovedi za oglaševanje v širši javnosti)
(1) Oglaševanje zdravil brez recepta v širši javnosti ne sme vsebovati podatkov, ki:
– dajejo vtis, da sta posvet z zdravnikom oziroma veterinarjem ali kirurški poseg nepotrebna, zlasti s pripisovanjem diagnoze ali predlogom zdravljenja po pošti;
– nakazujejo, da so učinki jemanja zdravila absolutno zagotovljeni, da zdravilo nima neželenih učinkov ali da je boljše kakor drugo zdravilo ali enakovredno drugemu zdravljenju ali drugemu zdravilu;
– nakazujejo, da se zdravje osebe ali živali lahko izboljša le zaradi jemanja oglaševanega zdravila;
– nakazujejo, da bi se zdravje osebe ali živali lahko brez jemanja oglaševanega zdravila poslabšalo; ta prepoved se ne uporablja za programe cepljenja in oglaševanje cepiv v skladu s 24. členom tega pravilnika;
– so usmerjeni izključno ali pretežno k otrokom;
– se sklicujejo na priporočila znanstvenikov, strokovnjakov s področja humane oziroma veterinarske medicine ali v javnosti znanih drugih oseb, ki bi zaradi svojega medijskega vpliva lahko spodbujali porabo zdravil;
– nakazujejo, da je zdravilo živilo, kozmetični ali drug potrošniški izdelek;
– nakazujejo, da sta varnost in učinkovitost posledica naravnega izvora zdravila;
– bi zaradi opisa ali podrobne predstavitve anamneze lahko privedli do napačne samodiagnoze;
– uporabljajo neprimerne, vznemirljive ali zavajajoče izraze o možnostih okrevanja ali
– uporabljajo neprimerne, skrb vzbujajoče ali zavajajoče izraze, slikovne predstavitve sprememb v človeškem ali živalskem telesu, ki jih je povzročila bolezen ali poškodba, ali delovanje zdravila na človeško ali živalsko telo ali dele telesa.
(2) Prepovedano je neposredno razdeljevanje zdravil končnim uporabnikom v promocijske namene.
IV. OGLAŠEVANJE V STROKOVNI JAVNOSTI
16. člen
(oglaševanje v strokovni javnosti)
(1) Imetnik dovoljenja za promet z zdravilom oziroma oglaševalec je dolžan poskrbeti, da je kakršnokoli oglaševanje v strokovni javnosti namenjeno in posredovano samo osebam, pooblaščenim za predpisovanje oziroma izdajanje zdravil.
(2) Informacijsko gradivo, namenjeno strokovni javnosti, mora biti praviloma označeno z oznako »Samo za strokovno javnost.«.
17. člen
(oglaševanje v strokovnih publikacijah in z neposrednim obveščanjem)
(1) Imetniki dovoljenja za promet z zdravilom lahko oglašujejo zdravila, ki so pridobila dovoljenje za promet, strokovni javnosti v strokovnih knjigah, strokovnih revijah in drugih strokovnih publikacijah.
(2) Imetniki dovoljenja za promet z zdravilom lahko oglašujejo zdravila tudi z neposrednim obveščanjem oseb, ki so pooblaščene za predpisovanje in izdajanje zdravil..
18. člen
(podatki in informacije o zdravilih)
(1) Vse informacije o zdravilih, namenjene strokovni javnosti in osebam, ki so pooblaščene za njihovo predpisovanje in izdajanje, morajo vsebovati zlasti naslednje podatke:
– ime zdravila;
– pri zdravilih za uporabo v humani medicini bistvene informacije iz povzetka glavnih značilnosti zdravila kot so: sestava zdravila, terapevtske indikacije, odmerjanje in način uporabe, povzetek neželenih učinkov, previdnostnih ukrepov in opozoril, kontraindikacij in interakcij, ime, znak in naslov imetnika dovoljenja za promet;
– pri zdravilih za uporabo v veterinarski medicini bistvene informacije iz povzetka glavnih značilnosti zdravila kot so: sestava zdravila, terapevtske indikacije, odmerjanje in način uporabe, povzetek neželenih učinkov, previdnostnih ukrepov in opozoril, kontraindikacij in interakcij, ime, znak in naslov imetnika dovoljenja za promet, vrste živali, ki jim je zdravilo namenjeno, karenca;
– način in režim predpisovanja ter izdaje zdravila;
– datum priprave informacije.
(2) Poleg podatkov iz prejšnjega odstavka lahko informacije vsebujejo tudi podatek o plačniku zdravila oziroma razvrstitvi zdravila na ustrezno listo.
(3) Vse informacije iz tega člena morajo biti točne, nedvoumne, aktualne in preverljive, da omogočajo oceno delovanja in terapevtske vrednosti zdravila.
(4) Vse navedbe in preglednice ter ostalo slikovno gradivo iz medicinskih revij ali drugih znanstvenih del morajo biti verodostojno povzete s točno navedbo virov.
19. člen
(obiski strokovnih sodelavcev)
(1) Neposredno obveščanje o zdravilih lahko opravljajo strokovni sodelavci, če izpolnjujejo naslednje pogoje:
– strokovni sodelavci za zdravila za uporabo v humani medicini morajo imeti univerzitetno izobrazbo farmacevtske ali medicinske smeri oziroma univerzitetno izobrazbo naravoslovne ali biomedicinske smeri in dodatna znanja s področja zdravil;
– strokovni sodelavci za zdravila za uporabo v veterinarski medicini morajo imeti univerzitetno izobrazbo farmacevtske ali veterinarske smeri oziroma univerzitetno izobrazbo naravoslovne ali biomedicinske smeri in dodatna znanja s področja zdravil;
– morajo biti ustrezno usposobljeni za dajanje točnih in popolnih strokovnih informacij o zdravilu.
(2) Oglaševanje zdravil z neposrednim obveščanjem oseb, ki so pooblaščene za predpisovanje in izdajanje zdravil in opravljajo zdravstveno dejavnost v okviru mreže javne zdravstvene službe, se lahko izvaja le v času strokovne priprave za delo, ki ni namenjen za neposredno delo s pacienti.
(3) Strokovni sodelavci morajo ob informiranju posredovati osebam, ki so pooblaščene za njihovo predpisovanje in izdajanje, podatke o zdravilu v skladu z odobrenim povzetkom glavnih značilnosti zdravila. Ta povzetek morajo posredovati tudi v pisni obliki oziroma ga morajo imeti na voljo.
(4) Strokovni sodelavci so dolžni prenesti imetniku dovoljenja za promet z zdravilom, vse informacije o neželenih učinkih zdravila, kakor tudi vse druge klinično pomembne informacije v zvezi z uporabo zdravila, ki jih dobijo pri osebah, pooblaščenih za predpisovanje ali izdajanje zdravil.
20. člen
(dajanje daril)
Imetniki dovoljenj za promet z zdravili, proizvajalci zdravil, pravne ali fizične osebe, ki nastopajo v imenu proizvajalcev ter pravne ali fizične osebe, ki opravljajo dejavnost prometa z zdravili in podružnice tujih proizvajalcev ne smejo osebam, pooblaščenim za predpisovanje in izdajanje zdravil dajati, ponujati ali obljubljati nobenih daril, denarnih ugodnosti ali prejemkov v naravi, razen če so ti majhne oziroma simbolične vrednosti in se lahko uporabljajo za opravljanje zdravstvene, veterinarske ali lekarniške dejavnosti.
21. člen
(promocijska srečanja)
(1) Ne glede na določbe prejšnjega člena lahko imetniki dovoljenj za promet z zdravili, proizvajalci zdravil, pravne ali fizične osebe, ki nastopajo v imenu proizvajalcev ter pravne ali fizične osebe, ki opravljajo promet z zdravili in podružnice tujih proizvajalcev, omogočajo osebam, pooblaščenim za predpisovanje ali izdajanje zdravil, pridobivanje dodatnih znanj o novih dognanjih o zdravilih. Pridobivanje dodatnih znanj ne sme prekoračiti strokovnih in znanstvenih ciljev takšnega izobraževanja, podrejeno mora biti izključno pridobivanju znanja in namenjeno le osebam, odgovornim za predpisovanje in izdajanje zdravil.
(2) Gostoljubnost na promocijskih srečanjih mora biti na zmerni ravni in drugotnega pomena v primerjavi z glavnim namenom srečanja ter ne sme biti razširjena na osebe, ki niso odgovorne za predpisovanje in izdajanje zdravil.
(3) Osebe, pooblaščene za predpisovanje in izdajanje zdravil, ne smejo poskušati pridobiti ali sprejeti nobene ugodnosti, ki je v nasprotju s prvim in drugim odstavkom tega člena, ali jo poskušati pridobiti.
22. člen
(dajanje vzorcev)
(1) Izjemoma lahko proizvajalci zdravil ter pravne ali fizične osebe, ki nastopajo v imenu proizvajalcev, pooblaščenim osebam za predpisovanje zdravil posredujejo brezplačne vzorce zdravil, ki se sicer izdajajo na recept, kadar je potrebno pacienta poučiti o načinu uporabe novega zdravila, če to ni namenjeno za peroralno uporabo, in so izpolnjeni naslednji pogoji:
– zdravilo ima dovoljenje za promet v skladu z zakonom;
– od pridobitve dovoljenja za promet z zdravilom ali od odobritve spremembe dovoljenja za promet, ki zahteva novo vlogo, ni preteklo več kot dve leti;
– pooblaščena oseba za predpisovanje zdravil lahko na leto prejme le en vzorec posameznega zdravila v najmanjšem pakiranju, za katero je pridobljeno dovoljenje za promet in za katerega je imetnik dovoljenja za promet organ, pristojen za zdravila pisno obvestil o dejanskem začetku prometa v skladu s 44. členom zakona;
– prejemnik mora za brezplačne vzorce zaprositi pisno. Prošnjo mora podpisati in opremiti z datumom;
– prejemnik mora o prejetih vzorcih voditi evidenco;
– prejemnik ne sme prejetih vzorcev prodajati;
– proizvajalci zdravil ter pravne ali fizične osebe, ki nastopajo v imenu proizvajalcev, morajo voditi evidence in imeti vzpostavljen sistem nadzora in odgovornosti nad brezplačnimi vzorci;
– vsak vzorec mora biti v ovojnini in opremljen z navodilom za uporabo, odobrenima v dovoljenju za promet z zdravilom, ter označen z navedbo, da gre za brezplačen vzorec, ki ni namenjen za prodajo;
– pri vsakem vzorcu mora biti priložen odobren povzetek glavnih značilnosti zdravila;
– vzorec ne sme vsebovati narkotičnih in psihotropnih snovi.
(2) Posredovanje vzorcev, ki zahtevajo posebne pogoje shranjevanja, kot je hladna veriga, je prepovedano.
V. STROKOVNA SLUŽBA
23. člen
(strokovna služba)
(1) Imetniki dovoljenj za promet z zdravilom morajo imeti organizirano službo, ki skrbi za pripravo informacij o zdravilih, ki jih dajejo v promet.
(2) Odgovorna oseba imetnika dovoljenja za promet z zdravilom mora:
– zagotoviti, da so organu, pristojnemu za nadzor nad oglaševanjem zdravil in drugim organom nadzora na razpolago vzorci vseh promocijskih materialov, skupaj z navedbo ciljnih skupin, ki so jim bili namenjeni, z načinom razpošiljanja in datumom prvega razpošiljanja;
– zagotoviti vodenje evidence o posredovanih brezplačnih vzorcih zdravil, ki mora vsebovati pisne prošnje pooblaščenih oseb za predpisovanje zdravil v skladu s četrto alineo prvega odstavka prejšnjega člena. Evidence mora hraniti vsaj tri leta;
– zagotoviti, da se zdravila oglašujejo v skladu s tem pravilnikom;
– preverjati, ali so strokovni sodelavci ustrezno usposobljeni za dajanje točnih in popolnih strokovnih informacij o zdravilu ter ali opravljajo naloge v skladu s tem pravilnikom;
– voditi seznam strokovnih sodelavcev, ki oglašujejo zdravila z neposrednim obveščanjem oseb, ki so pooblaščene za predpisovanje in izdajanje zdravil, s podatkom o njihovi izobrazbi;
– seznam iz prejšnje alinee posredovati organu, pristojnemu za zdravila za namen izvajanja strokovnega nadzora, ki se izvaja v okviru farmacevtskega nadzorstva v skladu z zakonom;
– posredovati organu, pristojnemu za nadzor nad oglaševanjem zdravil in drugim organom nadzora, vse informacije, ki jih zahtevajo v zvezi z oglaševanjem;
– zagotoviti, da se odločitve organov, pristojnih za nadzor, takoj in v celoti upoštevajo.
(3) Spremembe podatkov iz pete alinee prejšnjega odstavka mora odgovorna oseba imetnika dovoljenja za promet z zdravilom sporočiti organu, pristojnemu za zdravila najpozneje v 15 dneh od njihove spremembe.
VI. OGLAŠEVANJE CEPIV
24. člen
(oglaševanje cepiv)
(1) Oglaševanje zdravil, ki se uporabljajo pri programih cepljenja, širši javnosti lahko dovoli organ, pristojen za zdravila.
(2) Vsako dovoljeno oglaševanje iz prejšnjega odstavka mora vključevati opozorilo: »Pred cepljenjem se o tveganju in neželenih učinkih posvetujte z zdravnikom.«, ki mora smiselno izpolnjevati pogoje, kot so opredeljeni v 14. členu tega pravilnika.
25. člen
(odobritev oglaševanja cepiv)
(1) Za predhodno odobritev oglaševanja iz prejšnjega člena mora imetnik dovoljenja za promet z zdravilom pri organu, pristojnem za zdravila, vložiti vlogo, ki vsebuje:
– spremni dopis,
– predlog podrobno utemeljenih oglaševalskih materialov skupaj z navedbo ciljnih skupin, načinom ter časovnim potekom oglaševanja in
– potrdilo o plačilu stroškov postopka in upravne takse.
(2) Organ, pristojen za zdravila o vlogi odloči v 60 dneh od prejema popolne vloge.
(3) Zdravila, ki se uporabljajo pri programih cepljenja, se lahko oglašujejo širši javnosti le z mednarodnimi nelastniškimi imeni. Oglaševanje mora biti v skladu s 15. členom tega pravilnika in ne sme vsebovati elementov, ki bi zmanjševali objektivnost obveščanja o zdravilih, ki se uporabljajo pri programih cepljenja in cepljenju.
(4) Oglaševanje zdravil, ki se uporabljajo pri programih cepljenja, mora vsebovati informacije o vseh zdravilih z isto indikacijo, ki so prisotna na trgu v Republiki Sloveniji.
VII. OGLAŠEVANJE DRUGIH POSEBNIH SKUPIN ZDRAVIL
26. člen
(oglaševanje tradicionalnih in homeopatskih zdravil)
(1) Tradicionalna zdravila rastlinskega izvora se smejo oglaševati v skladu s tem pravilnikom in pravilnikom, ki ureja tradicionalna zdravila rastlinskega izvora.
(2) Homeopatska zdravila se smejo oglaševati v skladu s tem pravilnikom in pravilnikom, ki ureja homeopatska zdravila.
VIII. SPREMLJANJE OGLAŠEVANJA
27. člen
(spremljanje oglaševanja)
(1)Organ, pristojen za zdravila, lahko ustanovi začasno komisijo, v katero povabi strokovnjake s področja oglaševanja zdravil oziroma predstavnike zainteresirane javnosti, za prostovoljno spremljanje skladnosti oglaševanja s tem pravilnikom.
(2) Na podlagi podatkov iz seznama strokovnih sodelavcev iz pete alinee drugega odstavka 23. člena tega pravilnika organ, pristojen za zdravila v okviru strokovnega nadzora opravi splošno preverjanje izpolnjevanja pogojev za strokovne sodelavce, ki opravljajo delo pri imetnikih dovoljenj za promet z zdravilom.
IX. PREHODNA IN KONČNA DOLOČBA
28. člen
(prenehanje veljavnosti)
Z dnem uveljavitve tega pravilnika preneha veljati Pravilnik o oglaševanju zdravil in medicinskih pripomočkov (Uradni list RS, št. 76/01) v delu, ki se nanaša na zdravila, in Pravilnik o oglaševanju zdravil za uporabo v veterinarski medicini (Uradni list RS, št. 70/03).
29. člen
(uveljavitev pravilnika)
Ta pravilnik začne veljati petnajsti dan po objavi v Uradnem listu Republike Slovenije.
———————————————–
Pravilnik o spremembah in dopolnitvah Pravilnika o oglaševanju zdravil (Uradni list RS št. 105/10) vsebuje naslednjo prehodno in končno določbo:
8. člen
Imetniki dovoljenj za promet z zdravilom posredujejo organu, pristojnemu za zdravila, seznam strokovnih sodelavcev iz pete alinee drugega odstavka 23. člena pravilnika najpozneje v enem mesecu od uveljavitve tega pravilnika.
“,”Jaka Verbic Miklic”,1521993120,1521993120,sl,12439,306,12420,43,0,NULL,,”Pravilnik o oglaševanju zdravil, UL št. 105, 24.12.2010″,pravilnik-o-oglasevanju-zdravil-ul-st-105-24-12-2010,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521993184,1621760711
268,12440,”Pravilnik o natančnejših pogojih in postopku za ugotavljanje medsebojne zamenljivosti zdravil “,”UL 102, 17/12/2010″,”
I. SPLOŠNI DOLOČBI
1. člen
(področje urejanja)
Ta pravilnik določa natančnejše pogoje in postopek za ugotavljanje medsebojne zamenljivosti zdravil za uporabo v humani medicini ter način objave seznama medsebojno zamenljivih zdravil (v nadaljnjem besedilu: seznam).
2. člen
(opredelitev izrazov)
Poleg definicij in izrazov, ki so opredeljeni v 6. členu Zakona o zdravilih (Uradni list RS, št. 31/06 in 45/08; v nadaljnjem besedilu: zakon) se v tem pravilniku uporabljajo tudi naslednji izrazi:
– bioekivalentni sta zdravili, ki vsebujeta isto učinkovino, če sta farmacevtsko ekvivalentni ali sta farmacevtsko alternativni in sta njuni biološki uporabnosti (hitrost in obseg) po aplikaciji enakega molarnega odmerka v sprejemljivih in vnaprej določenih mejah, ki zagotavljajo primerljive lastnosti teh dveh zdravil v pogojih in vivo, t.j. podobnost v smislu njune varnosti in učinkovitosti. Bioekvivalenca je opredeljena v veljavnem besedilu navodila Evropske agencije za zdravila »Guideline on the investigation of bioequivalence« na spletni strani: http:// http://www.ema.europa.eu/ema/index.jsp? curl=pages/includes/document/document_detail.jsp ?webContentId=WC500070039&murl=menus/ document_library/document_library.jsp&mid= WC0b01ac058009a3dc;
– farmacevtsko ekvivalentni sta zdravili, če imata enako kakovostno in količinsko sestavo učinkovin v isti farmacevtski obliki in ustrezata istim ali primerljivim standardom. Farmacevtska ekvivalenca ne pomeni vedno, da sta zdravili tudi bioekvivalentni, ker lahko razlike v pomožnih snoveh oziroma postopku izdelave vodijo do hitrejšega ali počasnejšega raztapljanja oziroma absorpcije;
– farmacevtsko alternativna zdravila so zdravila, ki vsebujejo različne soli, estre, etre, izomere, zmesi izomerov, komplekse ali derivate aktivnega dela učinkovine, ali se razlikujejo v farmacevtski obliki ali jakosti.
II. NATANČNEJŠI POGOJI ZA UGOTAVLJANJE MEDSEBOJNE ZAMENLJIVOSTI ZDRAVIL
3. člen
(pogoji za medsebojno zamenljivost zdravil)
Medsebojno zamenljiva zdravila so tista bioekivalentna, farmacevtsko ekvivalentna in farmacevtsko alternativna zdravila za katera Javna agencija za zdravila in medicinske pripomočke (v nadaljnjem besedilu: JAZMP) izda odločbo o medsebojni zamenljivosti. JAZMP lahko izda odločbo o medsebojni zamenljivosti zdravil kadar:
– je verjetnost nastanka klinično pomembnih razlik v učinkovitosti in varnosti zdravil, ki imajo enako kakovostno in količinsko sestavo učinkovin ter primerljivo farmacevtsko obliko, ustrezno majhna oziroma zanemarljiva;
– so predložena dokazila o skupnih ali primerljivih lastnostih teh zdravil v skladu s pogoji, ki jih določata zakon in ta pravilnik;
– so pri obravnavi zdravil upoštevana sodobna spoznanja oziroma izsledki sodobne biomedicinske znanosti in stroke;
– so upoštevane določbe dovoljenja za promet in
– imajo zdravila ugoden primerljiv farmakovigilančni profil oziroma razmerje med koristjo in tveganjem.
4. člen
(zdravila, ki niso medsebojno zamenljiva)
Ne glede na določbo prejšnjega člena JAZMP odločbe o medsebojni zamenljivosti zdravil ne sme izdati za:
– zdravila z ozkim terapevtskim oknom, za specifično terapevtsko področje ali drugo posebno tveganje, ki bi nastalo zaradi medsebojnega zamenjevanja zdravil;
– zdravila v farmacevtskih oblikah z različnimi načini prirejenega sproščanja, med katerimi so ugotovljene pomembne razlike v lastnostih sproščanja učinkovine;
– zdravila, ki imajo različne pripomočke za odmerjanje ali uporabo, zaradi katerih so ugotovljene pomembne razlike, ki bi vplivale na izid zdravljenja, ali
– zdravila za parenteralno uporabo in zdravila, ki delujejo ozko na mestu uporabe in se pomembno razlikujejo v pomožnih snoveh (na primer: zdravila za dermalno uporabo, zdravila za oko).
III. POSTOPEK ZA UGOTAVLJANJE MEDSEBOJNE ZAMENLJIVOSTI ZDRAVIL
5. člen
(začetek postopka za ugotavljanje medsebojne zamenljivosti zdravil)
(1) Postopek za ugotavljanje medsebojne zamenljivosti zdravil lahko začne JAZMP:
– po uradni dolžnosti po pridobitvi ali spremembi dovoljenja za promet z zdravilom ali po pridobitvi dovoljenja za promet po centraliziranem postopku, ki so pri JAZMP pridobila podatke, potrebne za prihod na trg ali
– na predlog imetnika dovoljenja za promet z zdravilom, imetnika dovoljenja za promet s paralelno uvoženim zdravilom oziroma imetnika pozitivnega mnenja Evropske agencije za zdravila za paralelno distribucijo zdravila (v nadaljnjem besedilu: predlog) ali
– na pobudo ministrstva, pristojnega za zdravje, razširjenega strokovnega kolegija, za zdravila iz svoje pristojnosti in Zavod za zdravstveno zavarovanje Slovenije.
(2) Pobudniki iz tretje alinee prejšnjega odstavka niso stranka v postopku.
6. člen
(predlog in pobuda)
(1) Predlog mora vsebovati dokazila o izpolnjevanju pogojev iz 3. člena tega pravilnika.
(2) Pobuda mora vsebovati obrazložitev z navedbo javno dostopnih podatkov iz neodvisne strokovne literature o izpolnjevanju pogojev iz 3. člena tega pravilnika.
7. člen
(dokazila o izpolnjevanju pogojev)
(1) V postopku odločanja o medsebojni zamenljivosti zdravil JAZMP upošteva:
– podatke iz dokumentacije o zdravilih,
– podatke iz uradnih evidenc o zdravilih,
– podatke iz evidenc in objav Evropske agencije za zdravila ali pristojnih organov za zdravila držav članic Evropske unije,
– podatke o zdravilu, ki jih predloži imetnik dovoljenja za promet z zdravilom,
– obrazložitev pobude in javno dostopne podatke iz neodvisne strokovne literature, če se postopek začne na pobudo,
– sodobna spoznanja oziroma izsledke biomedicinske znanosti in stroke in
– mnenje stalne komisije za zdravila.
(2) Imetniki dovoljenja za promet z zdravilom, imetniki dovoljenja za promet s paralelno uvoženim zdravilom oziroma imetniki mnenja Evropske agencije za zdravila o paralelni distribuciji zdravila morajo posredovati JAZMP, na njeno pisno zahtevo, dodatne podatke, dokazila ali obrazložitve, potrebne za ugotavljanje medsebojne zamenljivosti zdravil.
8. člen
(mnenje stalne komisije za zdravila)
Mnenje stalne komisije za zdravila mora biti obrazloženo z utemeljitvijo izpolnjevanja pogojev za medsebojno zamenljivost zdravil iz prve, tretje in pete alinee 3. člena tega pravilnika oziroma prve in druge alinee 4. člena tega pravilnika.
9. člen
(roki za izdajo odločbe in vložitev pritožbe)
(1) JAZMP izda odločbo o medsebojni zamenljivosti zdravil v 60 dneh od začetka postopka.
(2) Zoper odločbo iz prejšnjega odstavka je dovoljena pritožba v 15 dneh od vročitve odločbe. O pritožbi odloči ministrstvo, pristojno za zdravje.
10. člen
(sprememba odločitve o medsebojni zamenljivosti zdravil)
Kadar JAZMP ugotovi, da medsebojno zdravilo ne izpolnjuje več pogojev iz 3. člena tega pravilnika oziroma kadar nastopi eden od pogojev iz 4. člena tega pravilnika, izda novo odločbo s katero ugotovi, da zdravilo ne izpolnjuje več pogojev za medsebojno zamenljivost.
IV. OBJAVA MEDSEBOJNO ZAMENLJIVIH ZDRAVIL V SEZNAMU
11. člen
(objava medsebojno zamenljivih zdravil v seznamu)
(1) JAZMP objavlja medsebojno zamenljiva zdravila v seznamu medsebojno zamenljivih zdravil (v nadaljnjem besedilu: seznam) na svoji spletni strani. Medsebojno zamenljiva zdravila v seznamu se objavljajo v skupinah, urejenih na peti ravni ATC klasifikacije in vsebujejo naslednje podatke:
– ATC oznako zdravila;
– splošno ime zdravila;
– identifikacijsko oznako zdravila;
– ime zdravila;
– jakost, farmacevtsko obliko in pakiranje zdravila;
– ime imetnika dovoljenja za promet oziroma dovoljenja za promet s paralelno uvoženim zdravilom oziroma imetnika mnenja Evropske agencije za zdravila o paralelni distribuciji zdravila.
(2) JAZMP v petih dneh od dokončnosti odločbe o medsebojni zamenljivosti posameznih zdravil oziroma o prenehanju medsebojne zamenljivosti zdravil objavi v seznamu oziroma zdravilo umakne iz seznama.
(3) JAZMP umakne iz seznama zdravilo, ki mu je poteklo dovoljenje za promet najpozneje 18 mesecev po izteku ali spremembi dovoljenja za promet z zdravilom, razen kadar je zaradi varovanja javnega zdravja potreben takojšen umik zdravila iz seznama.
V. PREHODNA IN KONČNA DOLOČBA
12. člen
(uporaba podzakonskega predpisa)
(1) Ne glede na določbe tega pravilnika se šteje, da so zdravila iz Sklepa o določitvi seznama medsebojno zamenljivih zdravil (Uradni list RS, št. 86/10) medsebojno zamenljiva tudi po tem pravilniku, dokler JAZMP ne odloči drugače.
(2) JAZMP odloči o zamenljivosti zdravil, ki do uveljavitve tega pravilnika niso vključena v seznam iz prejšnjega odstavka in po določbah tega pravilnika izpolnjujejo pogoje medsebojne zamenljivosti v treh mesecih od uveljavitve tega pravilnika.
13. člen
(prenehanje veljavnosti)
Z dnem uveljavitve tega pravilnika preneha veljati Pravilnik o natančnejših zahtevah in postopku za ugotavljanje medsebojne zamenljivosti zdravil (Uradni list RS, št. 86/08 in 63/09).
14. člen
(uveljavitev pravilnika)
Ta pravilnik začne veljati petnajsti dan po objavi v Uradnem listu Republike Slovenije.
Št. 0070-42/2010
Ljubljana, dne 25. novembra 2010
EVA 2010-2711-0037
Dorijan Marušič l.r.
Minister
za zdravje
“,”Jaka Verbic Miklic”,1521995040,1521995040,sl,12440,306,12421,43,0,NULL,,”Pravilnik o natančnejših pogojih in postopku za ugotavljanje medsebojne zamenljivosti zdravil, UL št. 102, 17.12.2010″,pravilnik-o-natancnejsih-pogojih-in-postopku-za-ugotavljanje-medsebojne-zamenljivosti-zdravil-ul-st-102-17-12-2010,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521995074,1524652076
269,12441,”Zakon o integriteti in preprečevanju korupcije”,”UL 45, 04/06/2010″,”
I. SPLOŠNE DOLOČBE
1. člen
(vsebina zakona)
Ta zakon z namenom krepitve delovanja pravne države določa ukrepe in metode za krepitev integritete in transparentnosti ter za preprečevanje korupcije in preprečevanje in odpravljanje nasprotja interesov.
2. člen
(uresničevanja namena zakona)
Namen tega zakona se uresničuje tako, da se:
1. z omejevanjem in preprečevanjem korupcije ter nadzorom nad nezdružljivostjo funkcij z drugimi funkcijami in dejavnostmi zagotovi neodvisno izpolnjevanje ustavno in zakonsko določenih funkcij;
2. z uresničevanjem resolucije, ki ureja preprečevanje korupcije, oblikovanjem strokovnih mnenj in standardov dobre prakse, nudenjem pomoči pri izobraževanju, zagotavljanju ozaveščenosti ter načrtovanju in ocenjevanju integritete na vseh ravneh vzpodbuja in krepi sposobnost posameznikov in institucij, da prevzamejo odgovornost za razvoj integritete in s tem tudi za preprečevanje in odkrivanje korupcije;
3. z nadzorom nad premoženjem in sprejemanjem daril funkcionarjev, preprečevanjem in odpravljanjem nasprotja interesov ter koruptivnih ravnanj ter nadzorom nad lobiranjem vzpodbuja in krepi transparentnost v procesih in postopkih izvrševanja javne oblasti pri opravljanju javnih funkcij in pri upravljanju javnih zadev;
4. z določitvijo pogojev za opravljanje dejavnosti lobiranja pri delovanju javnega sektorja, zagotovi transparentnost te dejavnosti na način, ki bo podpiral dobre, omejeval in kaznoval neetične prakse lobiranja;
5. z zaščito prijaviteljev koruptivnih ravnanj vzpodbuja in krepi odkrivanje, preprečevanje ter odpravljanje koruptivnih ravnanj;
6. z uresničevanjem mednarodnih obveznosti Republike Slovenije vzpodbuja, podpira in krepi sodelovanje in strokovno pomoč pri preprečevanju in zatiranju korupcije na mednarodni ravni;
7. z ustanovitvijo in zagotavljanjem pogojev za delovanje Komisije za preprečevanje korupcije kot samostojnega in neodvisnega državnega organa za krepitev integritete in protikorupcijskega delovanja, ter določitvijo njenih nalog in pristojnosti vzpodbuja in krepi sodelovanje državnih organov in organov samoupravnih lokalnih skupnosti (v nadaljnjem besedilu: organi lokalne skupnosti), organizacij javnega sektorja, oseb z javnimi pooblastili, institucij civilne družbe, medijev in pravnih ter fizičnih oseb pri dvigu integritete v Republiki Sloveniji, preprečevanju korupcije in učinkovitem odzivu države proti vsem oblikam koruptivnih ravnanj.
3. člen
(veljavnost zakona)
(1) Ta zakon velja za javni sektor, če drug zakon vprašanj, ki so urejena s tem zakonom, ne ureja drugače.
(2) Če ta zakon tako določa, velja tudi za zasebni sektor.
4. člen
(pomen izrazov)
Izrazi, uporabljeni v tem zakonu, imajo naslednji pomen:
1. »korupcija« je vsaka kršitev dolžnega ravnanja uradnih in odgovornih oseb v javnem ali zasebnem sektorju, kot tudi ravnanje oseb, ki so pobudniki kršitev ali oseb, ki se s kršitvijo lahko okoristijo, zaradi neposredno ali posredno obljubljene, ponujene ali dane oziroma zahtevane, sprejete ali pričakovane koristi zase ali za drugega;
2. »mednarodna korupcija« je korupcija, v kateri je udeležena najmanj ena fizična ali pravna oseba iz tujine;
3. »integriteta« je pričakovano delovanje in odgovornost posameznikov in organizacij pri preprečevanju in odpravljanju tveganj, da bi bila oblast, funkcija, pooblastilo ali druga pristojnost za odločanje uporabljena v nasprotju z zakonom, pravno dopustnimi cilji in etičnimi kodeksi;
4. »javni sektor« ima isti pomen kot javni sektor po zakonu, ki ureja javne uslužbence vključno z javnimi podjetji in gospodarskimi družbami, v katerih ima večinski delež oziroma prevladujoč vpliv država ali lokalna skupnost;
5. »zaposleni v javnem sektorju« so funkcionarji in javni uslužbenci;
6. »funkcionarji oziroma funkcionarke« (v nadaljnjem besedilu: funkcionarji) so: poslanci državnega zbora, člani državnega sveta, predsednik republike, predsednik vlade, ministri, državni sekretarji, sodniki ustavnega sodišča, sodniki, državni tožilci, funkcionarji v drugih državnih organih in samoupravnih lokalnih skupnosti (v nadaljnjem besedilu: lokalne skupnosti), poslanci iz Republike Slovenije v Evropskem parlamentu, kjer njihove pravice in obveznosti niso drugače urejene z akti Evropskega parlamenta in drugi funkcionarji iz Slovenije v evropskih institucijah in drugih mednarodnih institucijah, generalni sekretar vlade, bivši funkcionarji, dokler prejemajo nadomestilo plače v skladu z zakonom, ter funkcionarji Banke Slovenije, če njihove pravice in obveznosti niso drugače urejene z zakonom, ki ureja Banko Slovenije in drugimi predpisi, ki obvezujejo Banko Slovenije;
7. »družinski člani funkcionarja« so: njegov zakonec, otroci, posvojenci, starši, posvojitelji, bratje, sestre in osebe, ki s funkcionarjem živijo v skupnem gospodinjstvu ali v zunajzakonski skupnosti.
8. »uradniki oziroma uradnice na položaju« (v nadaljnjem besedilu: uradniki na položaju) so: generalni direktorji, generalni sekretarji ministrstev, predstojniki organov v sestavi ministrstev, predstojniki vladnih služb, načelniki upravnih enot, direktorji oziroma tajniki občinskih uprav;
9. »poslovodne osebe« so direktorji in člani kolektivnih poslovodnih organov: javnih agencij, javnih skladov, javnih zavodov, javnih gospodarskih zavodov ter drugih oseb javnega prava, ki so posredni uporabniki državnega proračuna ali proračuna lokalne skupnosti, ter javnih podjetij in gospodarskih družb, v katerih ima večinski delež država ali lokalna skupnost;
10. »uradne osebe« so osebe, ki so kot takšne določene v kazenskem zakoniku;
11. »osebe, odgovorne za javna naročila«, so: osebe, ki jih naročniki imenujejo v strokovne komisije za oddajo naročila in osebe, ki odločajo, potrjujejo in predlagajo vsebino razpisne dokumentacije, ocenjujejo ponudbe oziroma naročniku predlagajo izbor ponudnika, kadar gre za postopke zbiranja ponudb po predhodni objavi ali po postopkih javnih naročil, katerih vrednost je višja od ocenjene vrednosti javnih naročil, za katere je potrebno izvesti postopke zbiranja ponudb z objavo v skladu z zakonom, ki ureja javno naročanje;
12. »nasprotje interesov« so okoliščine, v katerih zasebni interes uradne osebe vpliva ali ustvarja videz, da vpliva na nepristransko in objektivno opravljanje njenih javnih nalog;
13. »zasebni interes uradne osebe« pomeni premoženjsko korist zanjo, za njene družinske člane in osebe javnega ali zasebnega prava, s katerimi ima ali je imela poslovne ali politične stike;
14. »lobiranje« je delovanje lobistov, ki za interesne organizacije izvajajo nejavno vplivanje na odločanje državnih organov in organov lokalnih skupnosti ter nosilcev javnih pooblastil pri obravnavi in sprejemanju predpisov in drugih splošnih aktov, pa tudi na odločanje državnih organov in organov ter uprav lokalnih skupnosti, ter nosilcev javnih pooblastil o drugih zadevah razen tistih, ki so predmet sodnih in upravnih postopkov ter postopkov, izvedenih po predpisih, ki urejajo javna naročila, in drugih postopkov, pri katerih se odloča o pravicah ali obveznostih posameznikov. Za dejanje lobiranja šteje vsak nejavni stik lobista z lobiranci, ki ima namen vplivati na vsebino ali postopek sprejemanja prej navedenih odločitev;
15. »lobist oziroma lobistka« (v nadaljnjem besedilu: lobist) je oseba, ki opravlja dejanja lobiranja;
16. »lobiranci oziroma lobiranke« (v nadaljnjem besedilu: lobiranci) so funkcionarji in javni uslužbenci v državnih organih in organih lokalne skupnosti ter pri nosilcih javnih pooblastil, ki odločajo ali sodelujejo pri obravnavi in sprejemanju predpisov in drugih splošnih aktov ter odločitev iz 14. točke tega člena, s katerimi z namenom lobiranja komunicira lobist;
17. »interesne organizacije« so vse organizacije, v imenu in na račun katerih lobist opravlja dejavnost lobiranja;
18. »nosilci ukrepov« so organi in organizacije, ki so z akcijskim načrtom za uresničevanje resolucije določeni kot izvajalci ukrepov za dosego ciljev resolucije.
II. KOMISIJA ZA PREPREČEVANJE KORUPCIJE
1. Opredelitev, sestava in nadzor nad delom Komisije za preprečevanje korupcije
5. člen
(položaj komisije)
Komisija za preprečevanje korupcije (v nadaljnjem besedilu: komisija) je samostojen in neodvisen državni organ, ki z namenom krepitve učinkovitega delovanja pravne države in preprečevanja njenega ogrožanja s koruptivnimi dejanji v okviru in na podlagi zakonov samostojno izvršuje pristojnosti in opravlja naloge, določene v tem in v drugih zakonih.
6. člen
(sredstva za delo komisije)
Sredstva za delo komisije se zagotavljajo v proračunu Republike Slovenije na predlog komisije. Komisija samostojno odloča o porabi proračunskih sredstev.
7. člen
(imenovanje funkcionarjev komisije)
(1) Komisija ima predsednika komisije in dva namestnika predsednika komisije. Predsednik komisije in namestnika predsednika komisije so funkcionarji.
(2) Predsednik komisije in njegova namestnika morajo biti državljani Republike Slovenije, imeti morajo najmanj izobrazbo, pridobljeno po študijskih programih druge stopnje, ali raven izobrazbe, ki v skladu z zakonom, ki ureja visoko šolstvo, ustreza izobrazbi druge stopnje, in najmanj deset let delovnih izkušenj pri opravljanju nalog, za katere je zahtevana ta izobrazba, ter ne smejo biti pravnomočno obsojeni na kazen zapora.
(3) Predsednik komisije in njegov namestnik mora biti oseba, za katero je na podlagi dosedanjega dela, ravnanja ali vedenja možno utemeljeno sklepati, da bo funkcijo v komisiji opravljala zakonito in v skladu s pravili stroke.
(4) Funkcija predsednika in namestnika predsednika komisije ni združljiva z opravljanjem funkcije ali delom v drugi osebi javnega ali zasebnega prava, ki deluje na področjih, kjer komisija izvršuje pristojnosti po tem zakonu.
(5) Predsednik in namestnika predsednika komisije morajo najkasneje v roku enega meseca po nastopu funkcije prenehati opravljati delo ali funkcijo iz prejšnjega odstavka.
(6) Predsednik komisije je imenovan za dobo šestih let, namestnika predsednika za dobo petih let, na svoje funkcije pa so lahko imenovani dvakrat zapored.
8. člen
(pogoji za delovanje komisije)
(1) Predsednik in namestnika predsednika komisije opravljajo svojo funkcijo polni delovni čas.
(2) Pri komisiji je zaposleno potrebno število javnih uslužbencev. Vrste in število delovnih mest javnih uslužbencev se določijo z aktom o sistemizaciji.
2. Izbirni postopek, imenovanje, delovanje, naloge in pristojnosti komisije
9. člen
(imenovanje komisije)
(1) Predsednik komisije pol leta pred iztekom mandata predsednika in namestnikov predsednika o tem obvesti predsednika republike, ta pa pozove predlagatelje za člane izbirne komisije, da imenujejo svoje člane v roku 30 dni od prejema obvestila predsednika republike. Hkrati s pozivom za imenovanje članov izbirne komisije predsednik republike izvede javni poziv za zbiranje kandidatur za predsednika komisije in namestnika predsednika komisije. Za zbiranje kandidatur določi rok, ki ne sme biti krajši od 14 in ne daljši od 30 dni. Zbrane kandidature posreduje izbirni komisiji.
(2) Izbirni postopek za izbiro primernih kandidatov za predsednika in namestnika izvede izbirna komisija, sestavljena iz petih članov. V izbirno komisijo po enega člana imenujejo:
– Vlada Republike Slovenije (v nadaljnjem besedilu: vlada),
– Državni zbor Republike Slovenije (v nadaljnjem besedilu: državni zbor),
– neprofitne organizacije zasebnega sektorja s področja preprečevanja korupcije izmed svojih članov,
– Sodni svet izmed svojih članov,
– Uradniški svet izmed svojih članov
in imenovanja sporočijo Uradu predsednika Republike Slovenije (v nadaljnjem besedilu: urad predsednika republike).
(3) Prvo sejo izbirne komisije skliče generalni sekretar urada predsednika republike v sedmih dneh po poteku roka iz tretjega stavka prvega odstavka tega člena. Na prvi seji izbirna komisija določi način svojega dela in če se člani izbirne komisije ne odločijo drugače, jo vodi njen najstarejši član.
(4) Če predlagatelji za člane izbirne komisije v roku iz prvega odstavka tega člena, niso imenovali svojih članov v izbirno komisijo, jih generalni sekretar urada predsednika republike pozove, da to storijo v naslednjih petih dneh od dne prejema poziva ter jih opozori, da bo v nasprotnem primeru izbirna komisija pričela s svojim delom v sestavi, z do tedaj imenovanimi člani. Izbirna komisija v tem primeru odločitev sprejme z večino glasov imenovanih članov.
(5) Izbirna komisija preveri izpolnjevanje pogojev iz drugega odstavka 7. člena tega zakona ter oceni primernost kandidatov skladno s tretjim odstavkom 7. člena tega zakona. Izbirna komisija v 30 dneh po izteku roka iz prejšnjega odstavka posreduje predsedniku republike seznam kandidatov, ki izpolnjujejo pogoje in so primerni za imenovanje.
(6) Predsednik republike izmed kandidatov, ki mu jih je posredovala izbirna komisije, imenuje predsednika komisije in namestnika predsednika komisije v 30 dneh po prejemu kandidatur.
(7) Če predsednik republike izmed predlaganih kandidatov ne imenuje nobenega kandidata za predsednika oziroma namestnika predsednika komisije, o tem obvesti izbirno komisijo in takoj ponovi postopek javnega poziva za zbiranje kandidatur. Rok za zbiranje predlogov v tem primeru ne sme biti krajši od 14 in ne daljši od 30 dni. Izbirna komisija izvede postopek izbire primernih kandidatov v roku 14 dni od poteka roka za zbiranje kandidatur. Če tudi ponovljen postopek ni uspešen, se ponavlja toliko časa, dokler niso imenovani predsednik in oba namestnika predsednika komisije, pri čemer se upoštevajo roki iz tega odstavka.
(8) Funkcionar komisije, ki mu je potekel mandat, opravlja funkcijo do imenovanja novega funkcionarja na njegovo funkcijo.
(9) Naloge iz tega člena, potrebne za izvedbo zbiranja kandidatur in izbor primernih kandidatov, opravlja urad predsednika republike.
10. člen
(pristojnosti predsednika komisije)
(1) Predsednik komisije zastopa komisijo ter vodi in organizira njeno delo.
(2) Predsednik komisije izmed imenovanih namestnikov predsednika komisije določi prvega in drugega namestnika.
(3) Predsednik komisije lahko pooblasti posameznega namestnika, da organizira in vodi delo na posameznih področjih.
(4) Predsednika komisije v primeru njegove odsotnosti ali zadržanosti nadomešča prvi namestnik, v primeru odsotnosti ali zadržanosti predsednika komisije in prvega namestnika pa ga nadomešča drugi namestnik. Če je predsednik komisije razrešen v skladu z 22. členom tega zakona, do imenovanja novega predsednika opravlja naloge predsednika prvi namestnik.
11. člen
(način delovanja komisije)
(1) Komisija deluje in odloča kot kolegijski organ, ki ga sestavljajo funkcionarji iz prvega odstavka 7. člena tega zakona. Zadeve obravnava na sejah, kjer sprejema mnenja, stališča in druge odločitve, ki morajo biti sprejete vsaj z dvema glasovoma.
(2) Komisija svoje poslovanje uredi s poslovnikom in drugimi splošnimi akti. Poslovnik se objavi v Uradnem listu Republike Slovenije.
12. člen
(naloge in pristojnosti komisije)
(1) Komisija:
– pripravlja strokovne podlage za krepitev integritete in za programe usposabljanja;
– usposablja osebe, ki so odgovorne za načrte integritete;
– s predstavniki istovrstnih oseb javnega prava ali njihovih združenj pripravi vzorce njihovih načrtov integritete;
– svetuje pri krepitvi integritete in preprečevanju ter odpravljanju tveganj za korupcijo v javnem in zasebnem sektorju;
– spremlja in analizira podatke o stanju in uresničevanju nalog za preprečevanje korupcije v Republiki Sloveniji;
– spremlja zadeve s področja mednarodne korupcije;
– opravlja naloge v zvezi z lobiranjem;
– izdaja načelna mnenja, stališča, priporočila in pojasnila o vprašanjih, povezanih z vsebino tega zakona;
– skrbi za izvajanje resolucije, ki ureja preprečevanje korupcije v Republiki Sloveniji;
– pripravlja spremembe resolucije, ki ureja preprečevanje korupcije v Republiki Sloveniji in jih predlaga v obravnavo vladi, ki jih predloži v sprejem državnemu zboru;
– daje soglasje k načrtom aktivnosti za uresničevanje resolucije, ki ureja preprečevanje korupcije v Republiki Sloveniji, posameznim organom, opredeljenim v resoluciji;
– opozarja pristojne organe v Republiki Sloveniji na uresničevanje obveznosti, ki izhajajo iz mednarodnih aktov s področja preprečevanja korupcije in jim daje predloge glede načina uresničevanja teh obveznosti;
– sodeluje s pristojnimi državnimi organi pri pripravi predpisov s področja preprečevanja korupcije;
– spremlja uresničevanje predpisov iz prejšnje alineje in daje pobude za njihove spremembe in dopolnitve;
– lahko daje mnenje k predlogom zakonov ter ostalih predpisov pred njihovo obravnavo na vladi o usklajenosti določb predlogov zakonov ter ostalih predpisov z zakoni in predpisi, ki urejajo področje preprečevanja korupcije in preprečevanja in odpravljanja nasprotja interesov;
– lahko daje državnemu zboru in vladi pobude za spremembe zakonov in drugih pravnih aktov iz njene pristojnosti;
– sodeluje s podobnimi organi drugih držav in mednarodnih integracij ter mednarodnimi neprofitnimi organizacijami zasebnega sektorja s področja preprečevanja korupcije;
– sodeluje z znanstvenimi, strokovnimi, medijskimi in neprofitnimi organizacijami zasebnega sektorja s področja preprečevanja korupcije;
– pripravlja izhodišča za kodekse ravnanja;
– objavlja strokovno literaturo;
– odplačno izvaja strokovne naloge v zvezi s pripravo in izdelavo načrtov integritete in pripravo ukrepov za preprečevanje korupcije za uporabnike iz zasebnega sektorja;
– vodi evidence v skladu s tem zakonom;
– opravlja druge naloge, določene s tem in drugimi zakoni.
(2) V zvezi z uresničevanjem naloge iz šeste alineje prejšnjega odstavka so policija in državno tožilstvo ter sodišče dolžni komisijo obveščati o zaključeni obravnavi kaznivih dejanj korupcije, v katerih so istočasno osumljeni, ovadeni, obtoženi ali obsojeni slovenski in tuji državljani oziroma pravne osebe s sedežem v Republiki Sloveniji in tujini, v roku 30 dni po zaključku zadev, in sicer policija z obvestilom o načinu zaključka zadeve, državno tožilstvo z aktom o zavrženju ovadbe ali odstopu od pregona ter sodišče s sodbo ali s sklepom.
(3) Cenik za izvajanje nalog iz enaindvajsete alineje prvega odstavka tega člena določi komisija in ga objavi na svoji spletni strani. Pri obračunu stroškov in načinu vplačil za izvajanje prej navedenih nalog se upoštevajo predpisi sprejeti na podlagi zakona, ki ureja javne finance.
13. člen
(načelna mnenja komisije)
(1) Komisija na lastno pobudo ali na podlagi prijav o sumih korupcije v konkretnih zadevah oblikuje načelna mnenja do posameznih ravnanj, kar ne pomeni odločanja o odgovornosti udeleženih fizičnih ali pravnih oseb.
(2) V načelnih mnenjih iz prejšnjega odstavka ne smejo biti navedeni osebni podatki. Osnutek načelnega mnenja se pred njegovo javno predstavitvijo pošlje osebi, ki je obravnavana v mnenju z zaprosilom, da v roku 14 delovnih dni odgovori na osnutek mnenja. Komisija obravnava odgovor in če izda načelno mnenje, ga skupaj z odgovorom obravnavane osebe predstavi javnosti brez osebnih podatkov.
(3) Komisija načelno mnenje iz prvega odstavka tega člena izda tudi na podlagi zahteve organa, organizacije ali fizične osebe.
(4) Komisija v roku 30 dni od prejema zahteve vlagatelja iz prejšnjega odstavka, le tega obvesti o roku, v katerem bo podala načelno mnenje.
(5) Komisija na podlagi zahtevkov organov, organizacij in fizičnih oseb iz tretjega odstavka tega člena oblikuje tudi mnenja in pojasnila o drugih vprašanjih iz svojega delovnega področja.
14. člen
(protikorupcijska klavzula)
(1) Pogodba, pri kateri kdo v imenu ali na račun druge pogodbene stranke, predstavniku ali posredniku organa ali organizacije iz javnega sektorja obljubi, ponudi ali da kakšno nedovoljeno korist za:
– pridobitev posla ali
– za sklenitev posla pod ugodnejšimi pogoji ali
– za opustitev dolžnega nadzora nad izvajanjem pogodbenih obveznosti ali
– za drugo ravnanje ali opustitev, s katerim je organu ali organizaciji iz javnega sektorja povzročena škoda ali je omogočena pridobitev nedovoljene koristi predstavniku organa, posredniku organa ali organizacije iz javnega sektorja, drugi pogodbeni stranki ali njenemu predstavniku, zastopniku, posredniku;
je nična.
(2) Organi in organizacije javnega sektorja so dolžni v pogodbe v vrednosti nad 10.000 eurov, ki jih sklepajo s ponudniki, prodajalci blaga, storitev ali z izvajalci del, kot obvezno sestavino pogodb ob upoštevanju konkretnega primera, vključiti vsebino iz prejšnjega odstavka, lahko pa vključijo tudi dodatne določbe za preprečevanje korupcije ali drugega poslovanja v nasprotju z moralo ali javnim redom. Ta določba velja tudi za sklepanje pogodb s ponudniki, prodajalci oziroma izvajalci del ali storitev izven ozemlja Republike Slovenije.
(3) Organ ali organizacija javnega sektorja, ki je sklenila pogodbo, mora na podlagi svojih ugotovitev o domnevnem obstoju dejanskega stanja iz prvega odstavka tega člena ali obvestila komisije ali drugih organov, glede njegovega domnevnega nastanka, pričeti z ugotavljanjem pogojev ničnosti pogodbe iz prejšnjega odstavka oziroma z drugimi ukrepi v skladu s predpisi Republike Slovenije.
(4) Komisija v primeru, da obstaja sum o nepravilnostih pri izvajanju drugega odstavka tega člena, od organov in organizacij javnega sektorja zahteva, da ji posredujejo vse pogodbe, sklenjene v določenem obdobju ali z določeno pogodbeno stranko. Če komisija ugotovi kršitev določb drugega odstavka tega člena ali domnevni obstoj dejanskega stanja iz prvega odstavka tega člena, o tem obvesti organ ali organizacijo, ki je sklenila pogodbo, in druge pristojne organe.
15. člen
(pravila postopka)
(1) Če s tem zakonom ni določeno drugače, pri svojih postopkih komisija uporablja zakon, ki ureja splošni upravni postopek.
(2) Zoper odločbo komisije ni mogoča pritožba, dopusten pa je upravni spor.
16. člen
(obveznost posredovanja podatkov in dokumentov komisiji)
(1) Državni organi, organi lokalnih skupnosti in nosilci javnih pooblastil ter druge pravne osebe javnega in zasebnega prava morajo komisiji na njeno obrazloženo zahtevo, ne glede na določbe drugih zakonov in ne glede na obliko podatkov, najkasneje v roku 15 dni od prejema poziva komisije, brezplačno posredovati vse podatke, tudi osebne, in dokumente, ki so potrebni za opravljanje zakonskih nalog komisije. Če je naslovnik zahteve komisije Banka Slovenije, izmenjava podatkov poteka skladno s pravom Evropske unije, ki ureja izmenjavo nadzornih in statističnih informacij ter varovanje poklicne skrivnosti, ter z določbami predpisov, ki glede navedenih vsebin zavezujejo Banko Slovenije.
(2) Obrazložena zahteva iz prejšnjega odstavka mora vsebovati navedbo pravne podlage za pridobitev podatkov in razloge ter namen, za katerega se zahtevajo podatki.
(3) Prvi odstavek se ne uporablja za podatke, ki jih pri svojem delu v zaupnem razmerju pridobi odvetnik, zdravnik, socialni delavec, psiholog, duhovnik, ali kakšna druga oseba, kateri zakon nalaga dolžnost varovanja podatkov iz zaupnega razmerja in glede podatkov, ki jih pristojni organi pridobijo z izvajanjem zakona, ki ureja policijska ali obveščevalna pooblastila, in zakona, ki ureja kazenski postopek.
(4) Če je mogoče utemeljeno sklepati, da oseba prikriva svoje premoženje ali dohodke z namenom izogibanja nadzoru po tem zakonu in komisija nalog iz V. poglavja tega zakona ne more izvršiti drugače, o tem poda obvestilo pristojnim organom pregona in nadzora v Republiki Sloveniji, s pozivom, da v okviru svojih pristojnosti ugotovijo dejansko stanje glede premoženja. Ti organi o svojih ukrepih in ugotovitvah obvestijo komisijo.
(5) Na zahtevo komisije so se zaposleni v javnem sektorju in poslovodne osebe po tem zakonu dolžni udeležiti seje komisije in na njej dajati pojasnila ter odgovarjati na vprašanja komisije iz njene pristojnosti.
3. Sodelovanje z neprofitnimi organizacijami zasebnega sektorja s področja preprečevanja korupcije
17. člen
(neprofitne organizacije zasebnega sektorja)
(1) Komisija za uresničevanje namena tega zakona ter za krepitev integritete sodeluje z neprofitnimi organizacijami zasebnega sektorja s področja preprečevanja korupcije in reprezentativnimi sindikati javnega sektorja (v nadaljnjem besedilu: sindikati).
(2) Komisija lahko v okviru svojega finančnega načrta financira neprofitne organizacije zasebnega sektorja s področja preprečevanja korupcije pri izvajanju nalog na področju usposabljanja, informiranja ter osveščanja javnosti in organov javnega sektorja ter prenašanja dobrih praks na področju uresničevanja namena tega zakona.
4. Nadzor nad delom in poslovanjem komisije
18. člen
(obveščanje javnosti)
(1) Komisija o svojem delu obvešča javnost.
(2) Komisija javnost obvešča z objavo svojih načelnih mnenj, stališč in odločitev ter sklicev sej in njihovih zapisnikov.
(3) Na svoje seje lahko komisija vabi predstavnike neprofitnih organizacij zasebnega sektorja s področja preprečevanja korupcije in sindikatov iz prejšnjega člena.
19. člen
(obveznost poročanja komisije)
Komisija o svojem delu enkrat letno poroča državnemu zboru. Letno poročilo mora predložiti najkasneje do 31. maja tekočega leta za preteklo leto.
20. člen
(nadzor nad komisijo)
Nadzor nad opravljanjem nalog komisije opravlja državni zbor. Predsednik komisije enkrat letno poroča državnemu zboru brez navajanja podatkov, ki bi omogočali identifikacijo obravnavanih fizičnih ali pravnih oseb, o vsebini in obsegu dela, o svojih sklepih, ugotovitvah, mnenjih komisije povezanih s pristojnostmi komisije, ter poda oceno trenutnega stanja na področju preprečevanja korupcije in preprečevanja ter odpravljanja nasprotja interesov.
21. člen
(pristojnosti državnega zbora pri nadzoru)
Državni zbor s smiselno uporabo določb tega zakona nadzira premoženjsko stanje, sprejemanje daril, nasprotje interesov ter nezdružljivost funkcije s pridobitno dejavnostjo predsednika komisije za preprečevanje korupcije in obeh namestnikov predsednika komisije.
22. člen
(razrešitev komisije)
(1) Predsednik republike predsednika komisije ali namestnika predsednika komisije razreši:
– če predsednik komisije ali namestnik predsednika komisije to zahteva,
– če je s pravnomočno sodbo obsojen na kazen zapora,
– zaradi trajne izgube delovne zmožnosti za opravljanje funkcije,
– če ne ravna v skladu s petim odstavkom 7. člena tega zakona.
(2) O dejstvih iz druge in tretje alineje prejšnjega odstavka mora predsednik komisije ali namestnik predsednika komisije predsednika republike seznaniti v roku treh dni od dne nastanka prej navedenih dejstev.
(3) Če se ugotovi, da predsednik komisije in namestnik predsednika komisije ne ravna v skladu s petim odstavkom 7. člena tega zakona, ga predsednik republike razreši na predlog državnega zbora.
(4) Predsednik republike lahko na predlog državnega zbora razreši predsednika komisije ali namestnika predsednika komisije, če funkcije ne opravlja v skladu z ustavo in zakonom.
(5) Kadar je predsednik ali namestnik predsednika predčasno razrešen, se za obdobje mandata imenuje nov funkcionar v skladu s postopkom iz 9. člena tega zakona.
III. ZAŠČITA PRIJAVITELJEV
23. člen
(prijava korupcije in zaščita prijavitelja)
(1) Vsakdo lahko komisiji ali drugemu pristojnemu organu poda prijavo o koruptivnem ravnanju v državnem organu, lokalni skupnosti, pri nosilcu javnih pooblastil ali drugi pravni osebi javnega ali zasebnega prava, za katero verjame, da ima znake korupcije. Komisija in drugi pristojni organi morajo na te navedbe prijavitelju odgovoriti najkasneje v 30 dneh, za zahtevnejše zadeve pa morajo v tem roku izdati vsaj obvestilo o nadaljnjem ukrepanju oziroma postopanju. Ta določba ne posega v pravico prijavitelja, da o koruptivnem ravnanju obvesti javnost.
(2) Prijavo, ki vsebuje podatke, za katere je z zakonom določena stopnja tajnosti, sme prijavitelj posredovati le organom odkrivanja in pregona kaznivih dejanj ali komisiji.
(3) Če komisija ugotovi, da prijava iz prejšnjih odstavkov vsebuje znake kaznivega dejanja, katerega storilec se preganja po uradni dolžnosti, obvesti o tem organe odkrivanja in pregona po zakonu, ki ureja kazenski postopek, z zaprosilom, da jo ti obvestijo o nadaljnjem postopku.
(4) Identitete prijavitelja iz prvega odstavka tega člena, ki je prijavo podal v dobri veri oziroma je utemeljeno sklepal, da so njegovi podatki v zvezi s prijavo resnični, kar ocenjuje komisija, ni dovoljeno ugotavljati ali razkrivati. Zlonamerna prijava se kaznuje kot prekršek po tem zakonu, če niso podani znaki za kaznivo dejanje.
(5) Pri oceni, ali je prijava podana v dobri veri oziroma, ali je prijavitelj utemeljeno sklepal, da so njegovi podatki resnični, komisija upošteva predvsem naravo in težo prijavljenega ravnanja, z njim grozečo ali povzročeno škodo, morebitno prijaviteljevo kršitev dolžnosti varovanja določenih podatkov ter status organa ali osebe, kateri je bila zadeva prijavljena.
(6) Če so v zvezi s prijavo korupcije podani pogoji za zaščito prijavitelja oziroma njegovih družinskih članov po zakonu, ki ureja zaščito prič, lahko komisija poda Komisiji za zaščito ogroženih oseb predlog za njihovo vključitev v program zaščite ali pobudo generalnemu državnemu tožilcu za izvedbo nujnih zaščitnih ukrepov.
(7) Ko Komisija za zaščito ogroženih oseb odloča o predlogu komisije, se lahko njene seje udeleži tudi predstavnik komisije.
(8) Samo sodišče lahko odloči, da se razkrijejo podatki in identiteta oseb iz četrtega odstavka tega člena, če je to nujno potrebno za zavarovanje javnega interesa ali pravic drugih.
24. člen
(prijava neetičnega oziroma nezakonitega ravnanja)
(1) Uradna oseba, ki iz utemeljenih razlogov meni, da se od nje zahteva nezakonito ali neetično ravnanje ali se s tem namenom nad njo izvaja psihično ali fizično nasilje, lahko takšno dejanje prijavi nadrejenemu ali osebi, ki jo ta pooblasti (v nadaljnjem besedilu: pristojna oseba).
(2) Če ni pristojne osebe, če se ta na prijavo pisno ne odzove v roku petih delovnih dni ali če je pristojna oseba tista, ki od uradne osebe zahteva nezakonito ali neetično ravnanje, je za prijavo iz prejšnjega odstavka in za postopek z njo pristojna komisija.
(3) Pristojna oseba ali komisija na podlagi prijave oceni dejansko stanje, po potrebi izda ustrezna navodila za ravnanje in ukrene, kar je potrebno, da se preprečijo nezakonite ali neetične zahteve ter nastanek škodljivih posledic.
25. člen
(ukrepi za zaščito prijavitelja)
(1) Če so prijavitelji zaradi prijave iz 23. ali 24. člena tega zakona izpostavljeni povračilnim ukrepom in so nastale za njih škodljive posledice, imajo pravico od svojega delodajalca zahtevati povračilo protipravno povzročene škode.
(2) Komisija prijaviteljem lahko nudi pomoč pri ugotavljanju vzročne zveze med škodljivimi posledicami in povračilnimi ukrepi iz prejšnjega odstavka.
(3) Če komisija v postopku iz prejšnjega odstavka ugotovi vzročno zvezo med prijavo in povračilnimi ukrepi zoper prijavitelja, od delodajalca zahteva, da zagotovi takojšnje prenehanje takšnega ravnanja.
(4) Če so prijavitelji iz prvega odstavka tega člena javni uslužbenci, lahko v primeru, ko se povračilni ukrepi nadaljujejo, kljub zahtevi komisije iz prejšnjega odstavka, in je nadaljevanje dela na njihovem delovnem mestu nemogoče, od svojega delodajalca zahtevajo premestitev na drugo enakovredno delovno mesto in o tem obvestijo komisijo.
(5) Če prijavitelj v primeru spora navaja dejstva, ki opravičujejo domnevo, da je bil zaradi prijave s strani delodajalca izpostavljen povračilnim ukrepom, je dokazno breme na strani delodajalca.
(6) Uresničitev zahteve iz četrtega odstavka tega člena zagotovi delodajalec javnega uslužbenca najkasneje v roku 90 dni in o tem obvesti komisijo.
IV. PREPREČEVANJE NASPROTJA INTERESOV IN NADZOR NAD SPREJEMANJEM DARIL
1. Nezdružljivost
26. člen
(nezdružljivost opravljanja funkcije in izjeme)
(1) Poklicni funkcionar ob javni funkciji ne sme opravljati poklicne ali druge dejavnosti, namenjene pridobivanju dohodka ali premoženjske koristi.
(2) Ne glede na določbo prejšnjega odstavka lahko poklicni funkcionar opravlja pedagoško, znanstveno, raziskovalno, umetniško, kulturno, športno in publicistično dejavnost ter vodi kmetijo in upravlja z lastnim premoženjem, razen če drug zakon ne določa drugače.
(3) Če drug zakon ne določa drugače, lahko komisija poklicnemu funkcionarju dovoli tudi opravljanje druge dejavnosti, namenjene pridobivanju dohodka, če ni možnosti, da bi opravljanje te dejavnosti lahko vplivalo na objektivno in nepristransko opravljanje funkcije. Če želi poklicni funkcionar dohodek pridobiti od organa, v katerem opravlja svojo funkcijo, komisija dovoljenja ne izda.
27. člen
(prepoved članstva in dejavnosti)
(1) Poklicni funkcionar ne sme biti član oziroma opravljati dejavnosti upravljanja, nadzora ali zastopanja v gospodarskih družbah, gospodarskih interesnih združenjih, zadrugah, javnih zavodih, javnih skladih, javnih agencijah in drugih osebah javnega ali zasebnega prava, razen v društvih, ustanovah in političnih strankah.
(2) Nepoklicni funkcionar ne sme biti član oziroma opravljati dejavnosti upravljanja, nadzora ali zastopanja v osebi javnega ali zasebnega prava iz prejšnjega odstavka, če po svoji funkciji opravlja neposredni nadzor nad njihovim delom.
(3) Prepoved iz prvega odstavka tega člena glede članstva oziroma opravljanja dejavnosti upravljanja, nadzora ali zastopanja v javnih zavodih, javnih skladih, javnih agencijah in drugih osebah javnega ali zasebnega prava, če je oseba zasebnega prava nosilec javnega pooblastila ali izvajalec javne službe, velja tudi za nepoklicne župane in podžupane.
28. člen
(prenehanje opravljanja dejavnosti, funkcije ali članstva)
(1) Funkcionar, ki je pred nastopom funkcije opravljal dejavnost ali funkcijo, ki po tem zakonu ni združljiva z opravljanjem njegove funkcije oziroma je v nasprotju s prejšnjim členom, mora najpozneje v 30 dneh po izvolitvi ali imenovanju oziroma po potrditvi mandata prenehati opravljati dejavnost oziroma funkcijo.
(2) Funkcionar, ki je bil pred nastopom funkcije član organov, katerih članstvo po tem zakonu ni združljivo z opravljanjem njegove funkcije oziroma je v nasprotju s prejšnjim členom, mora takoj podati odstopno izjavo oziroma zahtevo za razrešitev članstva, to pa mu mora v 30 dneh od imenovanja na funkcijo prenehati.
29. člen
(opozorilo komisije in posledice neupoštevanja)
(1) Če funkcionar v roku iz prejšnjega člena ne preneha opravljati dejavnosti, članstva ali funkcije, ki po tem zakonu ni združljiva z opravljanjem njegove funkcije, ga komisija na to opozori in mu v opozorilu določi rok, v katerem mora prenehati opravljati to dejavnost ali funkcijo. Rok, ki ga določi komisija, ne sme biti krajši od 15 dni in ne daljši od treh mesecev.
(2) Če komisija ugotovi, da funkcionar po roku, ki ga je določila komisija na podlagi prvega odstavka tega člena, še naprej opravlja nezdružljivo dejavnost, članstvo ali funkcijo, o tem obvesti pristojni organ, ki je pristojen predlagati ali začeti s postopkom za prenehanje funkcije tega funkcionarja. O svoji končni odločitvi pristojni organ obvesti komisijo.
(3) Določbe prejšnjega odstavka ne veljajo za neposredno voljene funkcionarje. Če v njihovem primeru komisija ugotovi dejstva iz prejšnjega odstavka, o svojih ugotovitvah obvesti javnost in svoje ugotovitve objavi na spletnih straneh komisije.
2. Prepoved in omejitve sprejemanja daril
30. člen
(prepoved in omejitve sprejemanja daril funkcionarjev)
(1) Funkcionar ne sme sprejemati daril ali drugih koristi (v nadaljnjem besedilu: darila) v zvezi z opravljanjem funkcije, razen protokolarnih daril in priložnostnih daril manjše vrednosti.
(2) Protokolarna darila so darila funkcionarjem, dana s strani predstavnikov drugih državnih organov, drugih držav in mednarodnih organizacij in institucij, ob obiskih, gostovanjih ali drugih priložnostih, ter druga darila, dana v podobnih okoliščinah.
(3) Priložnostna darila manjše vrednosti so darila, dana ob posebnih priložnostih, ki ne presegajo vrednosti 75 eurov in katerih skupna vrednost v posameznem letu ne presega 150 eurov, če so prejeta od iste osebe. V nobenem primeru se kot darilo manjše vrednosti ne sme sprejeti denarja, vrednostnih papirjev ali dragocenih kovin.
(4) Ne glede na njihovo vrednost funkcionar ne sme sprejemati daril, ki so ali bi lahko vplivala na objektivno in nepristransko opravljanje njegove funkcije.
(5) Prepovedi in omejitve iz tega člena veljajo tudi za družinske člane funkcionarja.
31. člen
(seznam daril)
(1) Sprejeta darila in njihovo vrednost vpiše v seznam daril organ oziroma organizacija, v kateri funkcionar, ki je sprejel darilo, opravlja funkcijo.
(2) V seznam daril iz prejšnjega odstavka se ne vpisujejo darila, katerih vrednost ne presega vrednosti 25 eurov.
(3) Protokolarna ali priložnostna darila, ki presegajo vrednost 75 eurov, postanejo last Republike Slovenije, lokalne skupnosti oziroma organizacije, v kateri funkcionar opravlja svojo funkcijo.
(4) Če komisija ugotovi, da prejeto protokolarno ali priložnostno darilo presega vrednosti iz prejšnjega odstavka ali v primeru iz četrtega odstavka prejšnjega člena, darilo na podlagi odločbe komisije postane last Republike Slovenije, lokalne skupnosti oziroma organizacije, v kateri funkcionar opravlja svojo funkcijo.
(5) Darilo iz tretjega odstavka tega člena funkcionar preda v upravljanje organu oziroma organizaciji, v kateri opravlja funkcijo. Če darilo fizično ne obstaja več ali ga iz drugih razlogov ni mogoče predati v upravljanje organu oziroma organizaciji, v kateri funkcionar opravlja svojo funkcijo, funkcionar na podlagi odločbe komisije vplača vrednost darila v državni oziroma občinski proračun.
(6) Način razpolaganja z darili, vodenja in vsebino seznama daril, ki jih v zvezi z opravljanjem funkcije prejemajo funkcionarji, ter glede drugih izvedbenih vprašanj v zvezi s prepovedmi, omejitvami in dolžnostmi funkcionarjev pri sprejemanju daril določi komisija.
32. člen
(posredovanje seznamov daril komisiji)
(1) Državni in drugi organi ter organizacije, ki so dolžne voditi sezname daril, kopije teh seznamov za preteklo leto posredujejo komisiji do 31. marca tekočega leta.
(2) Če komisija pri pregledu seznama ugotovi odstopanje od zakonskih meril, določenih v 30. členu tega zakona, o tem obvesti organ oziroma organizacijo, ki ji je posredovala seznam.
(3) Na podlagi zbranih podatkov komisija pripravi javni katalog daril, sprejetih v preteklem letu, in ga objavi na svoji spletni strani.
33. člen
(darila in objektivnost opravljanja funkcije)
(1) Komisija pri spremljanju izvajanja določb tega zakona glede sprejemanja daril ocenjuje, ali je posamezen funkcionar sprejemal darila ali si pridobival koristi, ki so ali bi lahko vplivale na objektivno in nepristransko opravljanje njegove funkcije.
(2) Če komisija oceni, da je posamezen funkcionar sprejemal darila ali si pridobival koristi, ki so ali bi lahko vplivale na objektivno in nepristransko opravljanje njegove funkcije, o tem nemudoma obvesti organe odkrivanja in pregona, po potrebi pa tudi druge pristojne organe.
(3) Če komisija ugotovi, da je funkcionar sprejemal darila, ki so ali bi lahko vplivala na objektivno in nepristransko opravljanje njegove funkcije, darila na podlagi odločbe komisije postanejo last Republike Slovenije oziroma lokalne skupnosti.
34. člen
(darila državnim in lokalnim organom ter nosilcem javnih pooblastil)
(1) Državni organi, lokalne skupnosti in nosilci javnih pooblastil lahko sprejemajo darila samo v primerih in pod pogoji, kot jih določa zakon.
(2) Državni organi, organi lokalnih skupnosti in nosilci javnih pooblastil ne glede na določbe drugih zakonov ne smejo sprejemati daril, ki vplivajo ali bi lahko vplivala na zakonitost, objektivnost in nepristranskost njihovega delovanja.
(3) Državni organi, organi lokalnih skupnosti in nosilci javnih pooblastil skupaj s seznamom daril iz prvega odstavka 31. člena tega zakona komisiji posredujejo tudi seznam daril, sprejetih po prvem odstavku tega člena.
(4) Če komisija ugotovi, da je državni organ, organ lokalne skupnosti ali nosilec javnih pooblastil sprejel darilo, ki vpliva ali bi lahko vplivalo na zakonitost, objektivnost in nepristranskost njegovega delovanja, darilo na podlagi odločbe komisije postane last Republike Slovenije oziroma lokalne skupnosti.
3. Omejitve poslovanja
35. člen
(omejitve poslovanja in posledice kršitev)
(1) Naročnik, ki posluje po predpisih o javnem naročanju, ne sme poslovati s subjekti, v katerih je funkcionar, ki pri tem naročniku opravlja funkcijo ali njegov družinski član, član poslovodstva ali je neposredno ali preko drugih pravnih oseb v več kot 5% udeležen pri ustanoviteljskih pravicah, upravljanju oziroma kapitalu.
(2) Prepoved iz tega člena smiselno velja tudi za državne pomoči in druge oblike pridobivanja sredstev od naročnikov, ki poslujejo po predpisih o javnem naročanju ter za koncesije in druge oblike javno-zasebnega partnerstva, razen za državne pomoči v primeru naravnih nesreč.
(3) Funkcionarji v enem mesecu po nastopu funkcije komisiji posredujejo naziv, matično številko in sedež subjektov, s katerimi so oni in njihovi družinski člani v razmerju iz prvega odstavka tega člena.
(4) Komisija na svoji spletni strani mesečno objavlja seznam subjektov, za katere veljajo omejitve po določbah tega člena.
(5) Omejitve po določbah tega člena ne veljajo za poslovanje na podlagi pogodb, ki so bile sklenjene pred funkcionarjevim nastopom funkcije.
(6) Pogodba, sklenjena v nasprotju z določbami tega člena, je nična.
36. člen
(začasna prepoved poslovanja po prenehanju funkcije)
(1) V roku dveh let po prenehanju funkcije funkcionar v razmerju do organa, pri katerem je opravljal svojo funkcijo, ne sme nastopiti kot predstavnik poslovnega subjekta, ki s tem organom ima ali vzpostavlja poslovne stike.
(2) Organ, v katerem je funkcionar opravljal funkcijo, v roku enega leta po prenehanju funkcije ne sme poslovati s subjektom, v katerem je bivši funkcionar neposredno ali preko drugih pravnih oseb v več kot 5% udeležen pri ustanoviteljskih pravicah, upravljanju oziroma kapitalu.
(3) O primeru iz prvega odstavka tega člena organ, pri katerem je funkcionar opravljal svojo funkcijo, nemudoma, najpozneje pa v roku 30 dni, obvesti komisijo.
4. Nasprotje interesov
37. člen
(dolžnost izogibanja nasprotju interesov)
(1) Uradna oseba mora biti pozorna na vsako dejansko ali možno nasprotje interesov in mora storiti vse, da se mu izogne.
(2) Uradna oseba svoje funkcije ali službe ne sme uporabiti zato, da bi sebi ali komu drugemu uresničila kakšen nedovoljen zasebni interes.
38. člen
(posledice neupoštevanja dolžnosti izogibanja)
(1) Če z drugim zakonom ni določeno drugače, mora uradna oseba, ki ob nastopu službe ali funkcije ali med njenim izvajanjem, ugotovi nasprotje interesov ali možnost, da bi do njega prišlo, o tem takoj pisno obvestiti svojega predstojnika, če predstojnika nima, pa komisijo. Ob tem mora takoj prenehati z delom v zadevi, v kateri je prišlo do nasprotja interesov, razen, če bi bilo nevarno odlašati.
(2) Predstojnik oziroma komisija o obstoju nasprotja interesov odločita v 15 dneh in s svojo odločitvijo takoj seznanita uradno osebo.
39. člen
(postopek ugotavljanja nasprotja interesov)
(1) Če obstaja verjetnost, da je pri uradnih ravnanjih uradnih oseb obstajalo nasprotje interesov, lahko komisija uvedbe postopek ugotavljanja dejanskega obstoja nasprotja interesov in njegovih posledic.
(2) Če je na podlagi izvedenega postopka ugotovljeno nasprotje interesov, komisija s tem seznani pristojni organ ali delodajalca in mu določi rok, v katerem jo je dolžan obvestiti o sprejetih ukrepih.
(3) Če komisija ugotovi, da je uradna oseba v obravnavani situaciji vedela oziroma bi morala in mogla vedeti, da obstaja nasprotje interesov, vendar je kljub temu ravnala v nasprotju z določbami o preprečevanju nasprotja interesov, komisija o tem obvesti druge pristojne organe.
(4) Komisija lahko uvede postopek iz prvega odstavka tega člena v roku dveh let od opravljenih uradnih dejanj.
40. člen
(izjeme uporabe tega poglavja)
Določbe tega poglavja se ne uporabljajo za postopke, v katerih je izločitev uradne osebe urejena z drugim zakonom.
V. NADZOR NAD PREMOŽENJSKIM STANJEM
41. člen
(dolžnost prijave premoženjskega stanja)
(1) Zavezanci po tem poglavju so: poklicni funkcionarji, nepoklicni župani in podžupani, uradniki na položaju, poslovodne osebe in osebe, odgovorne za javna naročila.
(2) Zavezanec mora takoj, najpozneje pa v enem mesecu po nastopu in prenehanju funkcije ali dela, sporočiti komisiji podatke o svojem premoženjskem stanju. V primeru razlogov za sum, da sporočeno premoženjsko stanje odstopa od dejanskega, mora zavezanec na zahtevo komisije tej, v enem letu po prenehanju funkcije oziroma zaključenega zadnjega postopka po predpisih o javnem naročanju, ponovno posredovati podatke o svojem premoženjskem stanju.
(3) Organi in organizacije, kjer so zaposleni zavezanci, komisiji posredujejo sezname teh zavezancev v 30 dneh po vsaki spremembi.
42. člen
(podatki o premoženjskem stanju)
(1) Podatki o premoženjskem stanju zavezanca obsegajo:
– osebno ime,
– EMŠO,
– davčno številko zavezanca,
– podatke o funkciji oziroma delu,
– delu, ki ga je opravljal neposredno pred nastopom funkcije,
– drugih funkcijah oziroma dejavnostih, ki jih opravlja,
– lastništvu oziroma deležih, delnicah in upravljavskih pravicah v gospodarski družbi, zasebnem zavodu ali drugi zasebni dejavnosti z opisom dejavnosti in oznako firme, oziroma imena organizacije,
– deležih, delnicah, pravicah, ki jih imajo subjekti iz prejšnje alineje v drugi družbi, zavodu ali zasebni dejavnosti z oznako firme oziroma imena organizacije, (v nadaljnjem besedilu: posredno lastništvo),
– letnih dohodkih, ki so osnova za dohodnino,
– nepremičninah z vsemi zemljiškoknjižnimi podatki,
– denarnih sredstvih pri bankah, hranilnicah in hranilno-kreditnih službah, katerih skupna vrednost na posameznem računu presega 10.000 eurov,
– skupni vrednosti gotovine, če njena skupna vrednost presega 10.000 eurov,
– vrstah in vrednosti vrednostnih papirjih, če njihova skupna vrednost ob času prijave premoženja presega 10.000 eurov,
– dolgovih, obveznostih oziroma prevzetih jamstvih in danih posojilih, katerih vrednost presega 10.000 eurov,
– premičninah, katerih vrednost presega 10.000 eurov.
(2) Podatke iz prejšnjega odstavka za zavezanca, ki jih je možno pridobiti iz uradnih evidenc, pridobi komisija sama.
(3) Če komisija na podlagi primerjave podatkov iz prvega odstavka tega člena in drugih podatkov ugotovi neskladje, lahko zahteva od zavezanca, da podatkom iz prvega odstavka tega člena priloži ustrezna dokazila.
43. člen
(dolžnost sporočanja sprememb premoženjskega stanja)
(1) Podatke o letnih dohodkih iz devete alineje prvega odstavka prejšnjega člena v obliki letne odločbe o dohodnini pridobi komisija od pristojnega organa.
(2) Vsako spremembo glede funkcije, dejavnosti oziroma lastništva iz sedme in osme alineje prvega odstavka prejšnjega člena in vsako spremembo v premoženjskem stanju iz desete do petnajste alineje prvega odstavka prejšnjega člena, ki presega 10.000 eurov, mora zavezanec sporočiti komisiji do 31. januarja tekočega leta za preteklo leto.
(3) Komisija lahko kadarkoli zahteva od zavezanca, da ji predloži podatke iz 42. člena tega zakona. Zavezanec mora komisiji predložiti te podatke najkasneje v 15 dneh po prejemu zahteve.
(4) Če je ob primerjavi predloženih podatkov z dejanskim stanjem mogoče utemeljeno sklepati, da zavezanec svoje premoženje oziroma dohodke, z namenom izogibanja nadzoru po tem zakonu, prenaša na družinske člane, lahko komisija od njih zahteva, da v enem mesecu po prejemu zahteve komisiji predložijo podatke iz devete do petnajste alineje prvega odstavka prejšnjega člena.
44. člen
(poziv za predložitev podatkov premoženjskega stanja)
(1) Če komisija ugotovi, da ji zavezanec ni sporočil podatkov o svojih funkcijah, dejavnostih, premoženju in dohodkih v skladu s tem zakonom, ga pozove, da ji v roku, ki ne sme biti krajši od 15 in ne daljši od 30 dni, predloži predpisane podatke.
(2) Če zavezanec v roku iz prejšnjega odstavka ne predloži zahtevanih podatkov, komisija odloči, da se mu plača oziroma nadomestilo plače vsak mesec po tem, ko je pretekel rok, zniža za znesek v višini deset odstotkov njegove osnovne plače, vendar največ do višine minimalne plače. Odločbo je dolžan izvršiti delodajalec.
(3) Drugi odstavek tega člena se ne uporablja za nepoklicne župane, podžupane in lobiste.
45. člen
(nesorazmerno povečanje premoženja)
(1) Če komisija na podlagi podatkov o premoženjskem stanju ali na podlagi drugih podatkov ugotovi, da se je premoženje zavezanca, od zadnje prijave nesorazmerno povečalo glede na njegove dohodke iz opravljanja funkcije ali dejavnosti, ki jo sicer opravlja v skladu z določbami in omejitvami iz tega in drugih zakonov ali pa da vrednost njegovega dejanskega premoženja, ki je osnova za odmero davčnih obveznosti, znatno presega prijavljeno vrednost premoženjskega stanja, pozove zavezanca, da najkasneje v 15 dneh pojasni način povečanja premoženja oziroma razliko med dejanskim in prijavljenim premoženjem.
(2) Če zavezanec iz prejšnjega odstavka ne pojasni načina povečanja premoženja ali razlike med dejanskim in prijavljenim premoženjem ali tega ne stori na razumljiv način, komisija o tem obvesti organ, pri katerem zavezanec opravlja funkcijo, oziroma organ, pristojen za izvolitev ali imenovanje zavezanca, v primeru suma storitve drugih kršitev pa tudi druge pristojne organe.
(3) Organ, pri katerem zavezanec opravlja funkcijo ali delo, oziroma organ, pristojen za izvolitev ali imenovanje zavezanca, lahko razen pri neposredno izvoljenih funkcionarjih, na podlagi obvestila komisije iz prejšnjega odstavka, v skladu z ustavo in zakonom začne postopek za prenehanje mandata ali za razrešitev ali druge postopke in o tem obvesti komisijo.
(4) Organi iz drugega in prejšnjega odstavka komisijo o svojih ugotovitvah in odločitvah obvestijo v treh mesecih od prejetja obvestila komisije.
(5) Če komisija utemeljeno sumi, da se je premoženje zavezanca iz prvega odstavka tega člena znatno povečalo, pa za to povečanje zavezanec ni podal utemeljenega pojasnila, hkrati pa obstaja utemeljena nevarnost, da bo zavezanec s tem premoženjem razpolagal, ga skril ali odtujil, lahko komisija državnemu tožilstvu ali pristojnemu organu s področja preprečevanja pranja denarja, davkov ali finančnega nadzora predlaga, da ta v okviru svojih zakonskih pristojnosti ukrene vse potrebno za začasno zaustavitev transakcij ali zavarovanja denarja in premoženja z namenom odvzema protipravno pridobljene premoženjske koristi oziroma denarja in premoženja nezakonitega izvora.
(6) Državno tožilstvo ali drug organ iz prejšnjega odstavka mora komisiji najpozneje v roku 72 ur pisno sporočiti, katere ukrepe je sprejel.
46. člen
(javnost podatkov)
(1) Podatki o dohodkih in premoženjskem stanju zavezancev in oseb, odgovornih za javna naročila, so ne glede na omejitve, ki jih določa zakon o varovanju osebnih podatkov in davčnih tajnostih, javno dostopni v delu, ki se nanaša na dohodke in premoženje, pridobljeno v obdobju opravljanja javne funkcije oziroma dejavnosti in še eno leto po prenehanju opravljanja funkcije oziroma dejavnosti.
(2) Komisija na svoji spletni strani objavi podatke o dohodkih in premoženju, ki je bilo pridobljeno v obdobju opravljanja javne funkcije oziroma dejavnosti in še eno leto po prenehanju opravljanja funkcije oziroma dejavnosti, in sicer o:
– osebnem imenu in funkciji zavezanca,
– lastništvu oziroma deležih in številu delnic ter pravic v gospodarski družbi, zavodu ali zasebni dejavnosti z oznako firme oziroma imena organizacije,
– lastništvu oziroma deležih, delnicah in upravljavskih pravicah v gospodarski družbi, zasebnem zavodu ali drugi zasebni dejavnosti z opisom dejavnosti in oznako firme, oziroma imena organizacije,
– letnih dohodkih, ki so osnova za dohodnino,
– številu in vrednosti nepremičnin brez zemljiškoknjižnih podatkov,
– skupni vrednosti denarnih sredstev pri bankah, hranilnicah in hranilno-kreditnih službah, če ta presega 10.000 eurov,
– skupni vrednosti gotovine, če ta presega 10.000 eurov,
– skupni vrednosti vrednostnih papirjev, če ta presega 10.000 eurov,
– skupni vrednosti dolgov, obveznosti oziroma prevzetih jamstev, če ta presega 10.000 eurov,
– skupni vrednosti danih posojil, če ta presega 10.000 eurov,
– premičninah, katerih vrednost presega 10.000 eurov, na način, ki ne omogoča njihove identifikacije.
(3) Podatki iz prejšnjega odstavka se objavijo na način, ki omogoča njihovo medsebojno primerljivost.
VI. NAČRTI INTEGRITETE
47. člen
(vsebina načrta integritete)
(1) Državni organi, organi lokalnih skupnosti, javne agencije, javni zavodi, javni gospodarski zavodi in javni skladi morajo skladno s tem zakonom oblikovati in sprejeti načrt integritete in o tem obvestiti komisijo.
(2) Načrt integritete vsebuje zlasti:
– oceno korupcijske izpostavljenosti institucije,
– osebna imena ter delovna mesta oseb, odgovornih za načrt integritete,
– opis tipičnih delovnih procesov in načina odločanja z oceno izpostavljenosti tveganjem za korupcijo in predloge za izboljšave integritete,
– ukrepe za pravočasno odkrivanje, preprečevanje in odpravljanje tveganj za korupcijo ter
– druge dele načrta, opredeljene v smernicah iz 50. člena tega zakona.
(3) Komisija usposablja osebe iz druge alineje prejšnjega odstavka.
48. člen
(nadzor načrtov integritete)
Komisija preverja, ali so organi oziroma organizacije iz prejšnjega člena sprejeli načrt integritete in njegovo uresničevanje.
49. člen
(prošnja za oceno načrta integritete)
Komisija lahko tudi na predlog drugih pravnih oseb, ki niso določene v prvem odstavku 47. člena tega zakona in na njihove stroške ob uporabi določbe drugega odstavka 47. člena tega zakona, izdela oceno integritete ali poda predloge za njeno izboljšanje.
50. člen
(objava smernic oblikovanja načrta integritete)
Komisija izdela in na svojih spletnih straneh objavi smernice za oblikovanje načrtov integritete, preverjanje delovanja načrtov integritete in ocenjevanje integritete.
VII. RESOLUCIJA O PREPREČEVANJU KORUPCIJE V REPUBLIKI SLOVENIJI
51. člen
(namen in cilj)
(1) Resolucija je akt, ki ga na predlog vlade sprejme državni zbor.
(2) Z resolucijo se teži k realnim, postopnim in premišljenim ukrepom za odpravo korupcije, njeni osnovni cilji so usmerjeni preventivno: dolgoročna in trajna odprava pogojev za nastanek in razvoj korupcije, vzpostavitev ustreznega pravnega in institucionalnega okolja za preprečevanje korupcije, dosledna uveljavitev odgovornosti za nezakonita dejanja, izgradnja splošno sprejemljivega sistema ničelne tolerance do vseh korupcijskih ravnanj skozi razne oblike izobraževanj in učinkovita uporaba mednarodno uveljavljenih standardov na tem področju.
(3) Komisija spremlja uresničevanje resolucije na podlagi akcijskega načrta, ki ga v sodelovanju z nosilci ukrepov iz resolucije sprejme v roku treh mesecev po sprejemu resolucije ali njenih sprememb.
(4) Za uresničevanje obveznosti iz prejšnjega odstavka lahko komisija daje predloge za sprejem in spremembo predpisov ter usmeritve glede načina izvrševanja ukrepov iz resolucije in načrtov za njeno uresničevanje.
52. člen
(aktivnosti)
(1) Pri uresničevanju resolucije in načrtov za njeno uresničevanje komisija sodeluje z organizacijami iz javnega in zasebnega sektorja, neprofitnimi organizacijami zasebnega prava s področja preprečevanja korupcije ter z državljankami in državljani.
(2) Sodelovanje iz prejšnjega odstavka se nanaša na skupne dejavnosti pri izvajanju resolucije in načrtov za njeno uresničevanje, analize stanja na področju korupcije, izvajanje medijskih kampanj in druge dejavnosti, pomembne za krepitev integritete in preprečevanje korupcije.
53. člen
(akcijski načrt)
(1) Nosilci ukrepov iz akcijskega načrta za uresničevanje resolucije iz javnega sektorja komisiji do konca meseca februarja vsako leto poročajo o dejavnostih za uresničitev teh ukrepov v preteklem letu.
(2) Komisija v roku treh mesecev po prejemu poročil iz prejšnjega odstavka sestavi poročilo o izvajanju resolucije z navedbo ključnih dosežkov, problemov, dejavnikov tveganja in ocene uspešnosti in ga vključi v letno poročilo o delu iz 19. člena tega zakona.
(3) Zaradi neizvajanja ukrepov iz akcijskega načrta za uresničevanje resolucije lahko komisija zoper odgovorne osebe za izvajanje ukrepov predlaga ugotavljanje odgovornosti pristojnemu organu.
54. člen
(spremembe in dopolnitve resolucije)
(1) Če nosilci ukrepov iz resolucije in iz načrtov za njeno uresničevanje v svojih poročilih predlagajo spremembe ali dopolnitve resolucije, komisija o njih sprejme mnenje ter s predlogi nosilcev in svojimi lastnimi predlogi v poročilu iz drugega odstavka prejšnjega člena seznani državni zbor.
(2) Če komisija ugotovi, da bi bili potrebni takojšnji popravki resolucije ali izvedba drugih nujnih ukrepov za njeno uresničitev, pristojne pozove, da začnejo z njihovo izvedbo in o tem takoj obvesti državni zbor.
(3) Če se komisija s predlogi nosilcev ukrepov iz prvega odstavka tega člena ne strinja, jih o tem obvesti in obrazloži svojo odločitev.
55. člen
(spremembe resolucije)
Komisija vsaka tri leta preveri, ali je potrebno spremeniti ali dopolniti resolucijo. Ugotovitve in predloge vključi v prvo naslednje redno poročilo državnemu zboru.
VIII. LOBIRANJE
1. Lobiranja
56. člen
(lobiranje in lobist)
(1) Lobiranje lahko opravljajo samo registrirani lobisti.
(2) Lobist je lahko vsaka polnoletna oseba, ki ni zaposlena v javnem sektorju in ji ni bila odvzeta poslovna sposobnost ter ni bila zaradi naklepnega kaznivega dejanja, ki se preganja po uradni dolžnosti, v Republiki Sloveniji pravnomočno obsojena na več kot šest mesecev zapora.
(3) Funkcionar ne sme opravljati dejavnosti lobiranja pred pretekom dveh let, odkar mu je prenehala funkcija.
2. Združenje lobistov
57. člen
(združenje lobistov)
Lobisti se lahko združujejo v združenja lobistov, ki sprejmejo kodeks poklicne etike.
3. Registracija lobistov
58. člen
(vpis v register)
(1) Dejanja lobiranja lahko izvaja domača ali tuja fizična oseba, ki je vpisana v registru lobistov v Republiki Sloveniji, ki ga vodi komisija. Vpis v register je pogoj za pričetek izvajanja lobiranja.
(2) Za pravno osebo lahko izvajajo lobiranje samo fizične osebe, ki so vpisane v register lobistov v Republiki Sloveniji.
(3) Lobisti se vpišejo v register, ki vsebuje naslednje podatke: osebno ime lobista, davčno številko, naslov, kamor želi prejemati obvestila in vabila iz drugega odstavka 67. člena tega zakona, firmo oziroma ime in sedež gospodarske družbe, samostojnega podjetnika, ali interesne organizacije, če je lobist pri teh zaposlen, ter področja, glede katerih je registriral interes.
(4) Za vpis v register se plača taksa v skladu z zakonom, ki ureja upravne takse.
(5) Podatki v registru, razen davčne številke, so javni.
(6) Tuji lobisti se v register vpišejo na podlagi uradno prevedenih dokazil, ki smiselno dokazujejo izpolnjevanje pogojev iz tretjega odstavka tega člena.
(7) Lobist mora prijaviti vsako spremembo podatkov za vpis v register v osmih dneh po nastanku sprememb.
59. člen
(listine vpisa)
Tuja fizična oseba mora priložiti za vpis v register tudi izpisek iz javnega registra za lobista samostojnega podjetnika, gospodarsko družbo ali interesno organizacijo, če je lobist pri teh zaposlen.
60. člen
(izdaja odločbe)
Komisija izda odločbo o vpisu v register oziroma odločbo o izbrisu iz registra v 15 dneh po prejemu vloge za vpis oziroma po nastopu razlogov za izbris iz registra.
61. člen
(dopolnitev podatkov vpisa)
(1) Če komisija ugotovi, da kandidat za lobista za vpis oziroma za obnovitev vpisa v register ni predložil vseh potrebnih podatkov in prilog, ga najkasneje v petih dneh pozove, naj jih v določenem roku posreduje. Ta rok ne sme biti krajši od petih dni in ne daljši od 15 dni.
(2) Če kandidat za lobista v določenem roku posreduje podatke, mu komisija izda odločbo o vpisu v register v nadaljnjih 15 dneh.
(3) Če kandidat za lobista v roku iz prvega odstavka tega člena ne posreduje podatkov, se njegova vloga za vpis v register zavrže.
62. člen
(izbris iz registra)
Lobista komisija izbriše iz registra, če:
– se ugotovi, da so podatki in dokazila, na podlagi katerih je bil vpisan v register, lažni,
– je bil zaradi naklepnega kaznivega dejanja, ki se preganja po uradni dolžnosti, v Republiki Sloveniji pravnomočno obsojen na več kot šest mesecev zapora,
– ugotovi, da ne izpolnjuje več pogojev za vpis v register,
– pisno izjavi, da ne želi biti več lobist in opravljati lobiranja.
4. Poročanje lobistov
63. člen
(poročilo lobista)
(1) Lobist mora komisiji pisno poročati o svojem delu, in sicer:
– do 31. januarja tekočega leta za preteklo leto,
– najkasneje v 30 dneh po prenehanju veljavnosti registracije.
(2) Lobist mora dokumentacijo, ki je osnova za poročanje komisiji, hraniti pet let od dneva podaje poročila iz prejšnjega odstavka.
64. člen
(vsebina poročila)
Poročilo iz prejšnjega člena vsebuje:
– davčno številko lobista,
– podatke o interesnih organizacijah, za katere je lobiral,
– podatke o višini plačila, ki ga je prejel od teh organizacij za vsako zadevo, v kateri je lobiral, če pa je proces lobiranja sestavni del storitvene pogodbe, ki vključuje tudi druge dejavnosti in vrednost lobiranja ni mogoče enoznačno opredeliti, se poroča o vrednosti storitvene pogodbe, kjer lobist označi, kolikšen delež v odstotkih je plačilo za proces lobiranja,
– navedbo namena in cilja, zaradi katerega je lobiral za posamezno interesno organizacijo,
– navedbo državnih organov in lobirancev, pri katerih je lobiral,
– navedbo vrst in načinov lobiranja za posamezno zadevo, v kateri je lobiral,
– navedbo vrste in vrednosti donacij političnim strankam in organizatorjem volilnih ter referendumskih kampanj.
65. člen
(preizkus poročila in dopolnitev)
Komisija preizkusi, ali poročilo vsebuje vse predpisane podatke. Če ugotovi, da je poročilo glede predpisanih podatkov pomanjkljivo, zahteva, naj lobist v določenem roku poročilo ustrezno dopolni. Ta rok ne sme biti krajši od 20 dni in ne daljši od 30 dni.
66. člen
(preverjanje resničnosti podatkov in navedb)
Komisija lahko preverja resničnost podatkov in navedb v poročilu:
– z vpogledom v dokumentacijo lobista iz 64. člena tega zakona,
– s poizvedbami pri interesnih organizacijah, za katere je lobist lobiral,
– s poizvedbami pri državnih organih in lobirancih, pri katerih je lobist lobiral,
– s poizvedbami pri političnih strankah in organizatorjih volilnih ter referendumskih kampanj,
– s predlogom pristojnim organom, da opravijo revizijo poslovanja pri lobistu, ali gospodarski družbi, samostojnem podjetniku ali interesni organizaciji, kjer je lobist zaposlen, ali pri interesnih organizacijah, za katere je lobist lobiral.
4. Informiranje
67. člen
(pravica do informiranosti lobista)
(1) V pisni zahtevi za dostop do informacij javnega značaja po zakonu, ki ureja dostop do informacij javnega značaja, lobirancu ni treba izpolniti pogojev iz prvega odstavka 69. člena tega zakona.
(2) Lobist ima v zvezi s področji, za katere je registriral interes, pravico biti vabljen na vse javne predstavitve in na vse oblike javnih posvetovanj, o čemer so ga dolžni obveščati državni organi in lokalne skupnosti.
68. člen
(informiranje lobirancev in zapis lobiranja)
(1) Lobist lahko lobirancem posreduje pisne in ustne informacije in gradivo v zadevah, v katerih lobira za interesne organizacije.
(2) Lobist se pri izvajanju lobiranja lahko sestaja z lobiranci. Lobiranec o vsakem stiku z lobistom, ki ima namen lobirati, sestavi zapis, v katerem navede podatke o lobistu: osebno ime, podatek, ali se je identificiral v skladu z določbami tega zakona, področje lobiranja, ime interesne organizacije, ali druge organizacije, za katero lobira lobist, navedba morebitnih prilog in datum, kraj obiska lobista ter podpis lobiranca. Lobiranec zapis posreduje v roku treh dni v vednost svojemu predstojniku in komisiji. Obveznost izdelave zapisa za lobirance velja tudi v primeru stikov iz tretjega odstavka 69. člena tega zakona. Zapise komisija hrani za dobo petih let.
69. člen
(dolžnost identifikacije lobista)
(1) Lobist se mora lobirancem identificirati in pokazati pooblastilo interesne organizacije za lobiranje v določeni zadevi. Lobist mora navesti tudi namen in cilj, zaradi katerega lobira.
(2) Lobiranci lahko privolijo v stike z lobistom samo po predhodni preveritvi, ali je lobist vpisan v register lobistov.
(3) Če bi pri stiku z določenim lobistom pri lobirancu nastalo nasprotje interesov, je lobiranec stik dolžan odkloniti.
5. Prepovedi
70. člen
(prepovedana ravnanja lobistov)
(1) Lobist ne sme lobirati izven okvirov, kot je določeno v 14. točki 4. člena tega zakona.
(2) Lobist lobirancem ne sme posredovati netočnih, nepopolnih ali zavajajočih informacij.
(3) Lobist pri lobiranju ne sme ravnati proti predpisom, ki določajo prepoved sprejemanja daril v zvezi z opravljanjem funkcije ali javnimi nalogami lobirancev.
71. člen
(prijava prepovedanih ravnanj lobistov)
Če lobist ne ravna v skladu s prejšnjim členom ali če ni vpisan v register lobistov v skladu z 58. členom, ga lobiranec v roku desetih dni od poskusa lobiranja prijavi komisiji.
72. člen
(pravica izjaviti se o prijavi)
(1) Komisija v primeru prijave iz prejšnjega člena obvesti lobista oziroma prijavljeno osebo in ji določi rok, v katerem se lahko o tem izjavi. Ta rok ne sme biti krajši od 15 dni in ne daljši od 30 dni.
(2) Izjavo iz prejšnjega odstavka lahko lobist oziroma prijavljena oseba da pisno ali ustno na zapisnik pred komisijo.
(3) Resničnost podatkov iz prijave in izjave lobista ali prijavljene osebe lahko komisija preverja v skladu s 66. členom tega zakona.
73. člen
(sankcije zaradi neupoštevanja določil tega zakona)
(1) Lobistu, ki ni poslal poročila iz 63. člena tega zakona ali ni dopolnil poročila v skladu s 65. členom tega zakona ali je po 66. členu tega zakona ugotovljeno, da je v poročilu navedel neresnične podatke, komisija lahko izreče naslednje sankcije:
– pisni opomin,
– prepoved lobiranja za določen čas, ki ne sme biti krajši od treh mesecev in ne daljši od 24 mesecev,
– izbris iz registra.
(2) Sankcije iz prejšnjega odstavka se vpišejo v register lobistov.
(3) Komisija sankcijo izreče v odvisnosti od teže kršitve, od posledic, ki so zaradi nje nastale in od tega, ali gre za prvo ali ponavljajočo kršitev.
74. člen
(sankcije zaradi kršitev identifikacije in prepovedi ravnanja lobistov)
(1) Lobistu, ki je ravnal v nasprotju z 69. ali 70. členom tega zakona, komisija lahko izreče naslednje sankcije:
– pisni opomin,
– prepoved nadaljnjega lobiranja v določeni zadevi,
– prepoved lobiranja za določen čas, ki ne sme biti krajši od 3 mesecev in ne daljši od 24 mesecev,
– izbris iz registra.
(2) Komisija sankcijo izreče v odvisnosti od teže kršitve, od posledic, ki so zaradi nje nastale in od tega, ali gre za prvo ali ponavljajočo kršitev. Sankcije iz prejšnjega odstavka se vpišejo v register lobistov.
IX. UPORABA PODATKOV IN VODENJE EVIDENC
75. člen
(uporaba podatkov)
Podatki, pridobljeni v skladu s tem zakonom ter podatki, določeni v evidencah v tem zakonu, se smejo obdelovati le za izvajanje ukrepov in metod za krepitev integritete, za zagotavljanje transparentnosti delovanja javnega sektorja, za preprečevanje korupcije in nasprotja interesov, za nadzor nad premoženjem in sprejemanjem daril in za vodenje registra lobistov.
76. člen
(evidence podatkov in rok hranjenja)
(1) Komisija podatke, informacije in dokumentacijo, pridobljeno na podlagi tega zakona, hrani deset let, nato se dokumentacija s podatki in informacijami arhivira.
(2) Komisija vodi naslednje evidence podatkov:
– evidenco funkcionarjev, uradnikov na položaju, poslovodnih oseb, uradnih oseb, oseb odgovornih za javna naročila iz 4. člena tega zakona (osebno ime, EMŠO, davčna številka, funkcija oziroma položaj, naslov stalnega bivališča), za namene ugotavljanja zavezancev, njihove istovetnosti in preverjanja podatkov ter odločanja po tem zakonu,
– evidenco zadev s področja mednarodne korupcije v skladu s šesto alinejo 12. člena tega zakona (osebno ime osumljene, ovadene, obtožene ali obsojene osebe, EMŠO, kvalifikacija kaznivega dejanja, vrsta zaključka zadeve), za namene ugotavljanja vzrokov mednarodne korupcije, oblikovanja ukrepov, za potrebe poročanja mednarodnim organizacijam, odkrivanja primerov mednarodne korupcije v skladu s pooblastili po tem zakonu in sodelovanja z drugimi pristojnimi državnimi organi,
– evidenco zadev s področja zaščite prijaviteljev koruptivnih ravnanj iz četrtega, petega in šestega odstavka 23. člena tega zakona (osebno ime prijavitelja ali njegov psevdonim, odločitev o tem, ali je bila prijava podana v dobri veri in ali je bila za zaščito prijavitelja in njegovih družinskih članov odrejena zaščita po zakonu, ki ureja zaščito prič), za namene izvajanja zaščite prijaviteljev koruptivnih ravnanj, spremljanja učinkovitosti zaščite in pomoči prijaviteljem,
– evidenco zadev s področja zaščite uradnih oseb, od katerih se zahteva nezakonito oziroma neetično ravnanje iz 24. člena tega zakona (osebno ime prijavitelja komisiji, osebno ime osebe, ki zahteva nezakonito oziroma neetično ravnanje, navedba organa in seznam izdanih navodil komisije za ravnanje), za namene izvajanja zaščite uradnih oseb, spremljanja učinkovitosti zaščite in pomoči uradnim osebam,
– evidenco o obstoju vzročne zveze iz tretjega odstavka 25. člena tega zakona in evidenco zahtevkov za premestitev iz četrtega odstavka 25. člena tega zakona (osebno ime prijavitelja, osebno ime osebe, ki zahteva nezakonito oziroma neetično ravnanje, navedba organa, vsebina ocene oziroma zahtevka za premestitev), za namene ugotavljanja obstoja povračilnih ukrepov, ukrepanja proti povračilnim ukrepom ter spremljanja učinkovitosti ukrepov komisije,
– evidenco seznamov daril iz prvega odstavka 31. člena tega zakona (naziv organa, ki je prejel darilo, osebno ime obdarovanca in njegova funkcija, vrsta darila) in evidenco iz tretjega odstavka 34. člena tega zakona (naziv organa, ki je prejel darilo, osebno ime prejemnika darila in njegova funkcija ali položaj, vrsta in vrednost darila), za namene ugotavljanja in odločanja o kršitvah glede prepovedi in omejitev sprejemanja daril, nadzora komisije nad vodenjem seznamov daril ter njihovega objavljanja,
– evidenco poslovnih subjektov iz 35. člena tega zakona (naziv poslovnega subjekta, matična številka in sedež), za namene izvajanja nadzora nad omejitvami poslovanja, sporočanja podatkov, objavljanja podatkov o poslovnih subjektih za katere veljajo omejitve poslovanja z njimi,
– evidenco uradnih oseb, glede katerih komisija po drugem odstavku 38. člena in drugem odstavku 39. člena tega zakona ugotavljala obstoj nasprotja interesov (osebno ime uradne osebe, funkcija oziroma položaj, naslov stalnega prebivališča, vsebina odločitve komisije), za namene ugotavljanja in odločanja o nasprotju interesov ter sodelovanja s pristojnimi državnimi organi,
– evidenco zavezancev iz prvega odstavka 41. člena, ki vsebuje podatke iz prvega odstavka 41. člena in prvega odstavka 42. člena, pri čemer se podatki o premoženjskem stanju vodijo ločeno, za namene ugotavljanja zavezancev in njihove istovetnosti, preverjanja podatkov in odločanja po tem zakonu ter za objavo podatkov in izvajanje pristojnosti komisije in drugih državnih organov na področju preprečevanja korupcije,
– evidenco zadev s področja nesorazmerno povečanega premoženja iz 45. člena tega zakona (osebno ime, funkcija oziroma položaj zavezancev iz prvega odstavka 41. člena tega zakona, seznam obvestil po drugem odstavku 45. člena tega zakona, seznam obvestil iz četrtega odstavka 45. člena tega zakona, seznam sprejetih odločitev po petem odstavku 45. člena tega zakona in seznam ukrepov po šestem odstavku 45. člena tega zakona), za namene ugotavljanja premoženjskega stanja zavezancev, za odločanje o kršitvah ter sodelovanja s pristojnimi državnimi organi,
– evidenco oseb iz druge alineje drugega odstavka 47. člena tega zakona (osebno ime, delovno mesto, organ), za namene učinkovitega izvajanja načrta integritete ter usposabljanja oseb, odgovornih za načrt integritete,
– evidenco funkcionarjev, zoper katere je komisija predlagala uveljavljanje odgovornosti zaradi neizvajanja ukrepov iz resolucije (tretji odstavek 53. člena), ki vsebuje podatke iz prve alineje tega odstavka, za namene uresničevanja resolucije, in predlaganja ukrepov v primeru njihovega neizvajanja,
– evidenco – register lobistov, ki vsebuje podatke iz tretjega odstavka 58. člena tega zakona, za namene zagotavljanja zakonitosti, ugotavljanja, odločanja ter nadzora na lobiranjem,
– evidenco samostojnih podjetnikov, gospodarskih družb oziroma interesnih organizacij, za katere lobirajo lobisti (naziv, davčna številka) iz 58. člena tega zakona, za namene zagotavljanja zakonitosti, ugotavljanja, odločanja ter nadzora na lobiranjem,
– evidenco izrečenih sankcij lobistom po 73. in 74. členu tega zakona (osebno ime lobista, davčna številka, vrsta kršitve, vrsta sankcije), za namene zagotavljanja zakonitosti in transparentnosti lobiranja, varnosti pravnega prometa, spremljanja vzrokov in kršitev ter oblikovanja ukrepov.
X. KAZENSKE DOLOČBE
77. člen
(prekrški fizičnih oseb)
(1) Z globo od 400 do 1.200 EUR se kaznuje za prekršek posameznik, ki:
– se v nasprotju z določbo petega odstavka 16. člena tega zakona brez opravičila ne udeleži seje komisije,
– v nasprotju z določbo četrtega odstavka 23. člena tega zakona ugotavlja identiteto prijavitelja, ki je prijavo podal v dobri veri oziroma je utemeljeno sklepal, da so njegovi podatki resnični ali poda zlonamerno prijavo iz četrtega odstavka 23. člena tega zakona,
– v nasprotju z določbo 28. člena tega zakona ne preneha opravljati nezdružljive funkcije, članstva ali dejavnosti,
– v nasprotju z določbami 30. člena tega zakona sprejme darilo ali drugo korist v zvezi z opravljanjem funkcije,
– v nasprotju z določbami 31. člena tega zakona sprejetega darila in njegove vrednosti ne vpiše v seznam daril pri organu ali organizaciji, v kateri opravlja svojo funkcijo ali ga ne preda v upravljanje organu oziroma organizaciji, v kateri opravlja funkcijo,
– v nasprotju z določbo tretjega odstavka 35. člena tega zakona komisiji ne sporoči podatkov o subjektih, s katerimi so on in njegovi družinski člani povezani na način iz prvega odstavka 35. člena tega zakona,
– v nasprotju z določbo prvega odstavka 36. člena tega zakona v roku dveh let po prenehanju funkcije v razmerju do organa, v katerem je opravljal svojo funkcijo, nastopi kot predstavnik pravne osebe, ki s tem organom ima ali vzpostavlja poslovne stike,
– v nasprotju z določbo prvega odstavka 38. člena tega zakona svojega predstojnika ali komisije ne obvesti takoj o nasprotju interesov oziroma možnosti, da bi do njega prišlo,
– ki v prijavo o premoženjskem stanju iz 42. in 43. člena tega zakona ali v njene dopolnitve ne vpiše potrebnih podatkov ali vpiše lažne podatke,
– kot nepoklicni župan ali podžupan komisiji v nasprotju z določbo prvega odstavka 44. člena tega zakona ne predloži predpisanih podatkov,
– ki kot lobiranec v skladu z drugim odstavkom 68. člena tega zakona ne izdela zapisa o lobiranju,
– ki kot lobiranec v nasprotju z določbo 69. člena tega zakona ne odkloni stika z lobistom, ki ni vpisan v register lobistov ali stika, pri katerem bi nastalo nasprotje interesov,
– ki lobira v nasprotju s 70. členom tega zakona,
– ki kot lobiranec v roku iz 71. člena tega zakona ne prijavi komisiji lobista, ki ravna v nasprotju s 70. členom ali ni vpisan v register lobistov v skladu z 58. členom.
(2) Z globo od 400 do 4.000 eurov se kaznuje za prekršek odgovorna oseba organa ali organizacije iz javnega sektorja, če v nasprotju z določbo drugega odstavka 14. člena tega zakona v pogodbo, ki jo sklene organ ali organizacija javnega sektorja, ne vključi besedila prvega odstavka 14. člena tega zakona ali po obvestilu komisije ali drugih organov, o domnevnem obstoju dejanskega stanja iz prvega odstavka 14. člena ne prične s postopkom ugotavljanja ničnosti pogodbe ali z drugimi ustreznimi ukrepi v skladu s predpisi Republike Slovenije.
(3) Z globo od 400 do 4.000 eurov se kaznuje za prekršek odgovorna oseba državnega organa, organa lokalne skupnosti, nosilca javnih pooblastil in pravne osebe javnega ali zasebnega prava, če komisiji v nasprotju z določbo prvega odstavka 16. člena tega zakona ne predloži vseh podatkov ali dokumentov, ki so potrebni za opravljanje nalog komisije.
(4) Z globo od 400 do 4.000 eurov se kaznuje za prekršek odgovorna oseba državnega organa, organa lokalne skupnosti, nosilca javnih pooblastil in pravne osebe javnega ali zasebnega prava, če stori dejanje iz druge alinee prvega odstavka tega člena ali v nasprotju z določbo četrtega odstavka 23. člena tega zakona začne postopek za ugotavljanje odgovornosti prijavitelja zaradi prijave.
(5) Z globo od 400 do 4.000 eurov se kaznuje za prekršek odgovorna oseba državnega organa, organa lokalne skupnosti, nosilca javnih pooblastil ali druge pravne osebe javnega ali zasebnega prava, ki v nasprotju s prvim odstavkom 25. člena tega zakona prijaviteljem povzroči škodljive posledice oziroma jih izpostavi povračilnim ukrepom.
(6) Z globo od 400 do 4.000 eurov se kaznuje za prekršek odgovorna oseba državnega organa, organa lokalne skupnosti, nosilca javnih pooblastil ali druge pravne osebe javnega ali zasebnega prava, ki v nasprotju z zahtevo komisije iz tretjega odstavka 25. člena tega zakona ne preneha takoj s povračilnimi ukrepi.
(7) Z globo od 400 do 4.000 eurov se kaznuje za prekršek odgovorna oseba državnega organa, organa lokalne skupnosti, nosilca javnih pooblastil ali druge pravne osebe javnega prava, ki v nasprotju s četrtim in šestim odstavkom 25. člena tega zakona brez utemeljenega razloga ne premesti javnega uslužbenca.
(8) Z globo od 400 do 4.000 eurov se kaznuje za prekršek odgovorna oseba državnega organa, organa lokalne skupnosti ali nosilca javnih pooblastil, ki sprejme darilo v nasprotju z določbo prvega ali drugega odstavka 34. člena tega zakona.
(9) Z globo od 400 do 4.000 eurov se kaznuje za prekršek odgovorna oseba državnega organa, organa lokalne skupnosti ali nosilca javnih pooblastil, ki v nasprotju s prvim odstavkom 32. člena in tretjim odstavkom 34. člena komisiji ne posreduje seznamov prejetih daril.
(10) Z globo od 400 do 4.000 eurov se kaznuje za prekršek odgovorna oseba naročnika, ki posluje po predpisih o javnem naročanju, če posluje v nasprotju z določbami prvega ali drugega odstavka 35. člena tega zakona.
(11) Z globo od 400 do 4.000 eurov se kaznuje za prekršek odgovorna oseba organa, v katerem je funkcionar opravljal svojo funkcijo, če v nasprotju z drugim odstavkom 36. člena posluje s poslovnim subjektom funkcionarja.
(12) Z globo od 400 do 4.000 eurov se kaznuje za prekršek odgovorna oseba organa, pri katerem je funkcionar opravljal svojo funkcijo, če v nasprotju s tretjim odstavkom 36. člena tega zakona komisije ne obvesti o ravnanju funkcionarja v nasprotju s prvim odstavkom 36. člena tega zakona.
(13) Z globo od 400 do 4.000 eurov se kaznuje za prekršek odgovorna oseba organa oziroma organizacije iz prvega odstavka 47. člena tega zakona, ki v nasprotju s 47. členom tega zakona ne oblikuje in sprejme načrta integritete.
(14) Z globo od 400 do 4.000 eurov se kaznuje za prekršek odgovorna oseba državnega organa, organa lokalne skupnosti in nosilca javnih pooblastil kot nosilca izvajanja ukrepov iz akcijskega načrta za uresničevanje resolucije, ki v nasprotju s prvim odstavkom 53. člena tega zakona komisiji ne poroča o dejavnostih za uresničitev teh ukrepov.
78. člen
(prekrški pravnih oseb)
Z globo od 400 do 100.000 eurov se kaznuje za prekršek nosilec javnih pooblastil in druga pravna oseba javnega ali zasebnega prava, razen Republike Slovenije in lokalnih skupnosti, če stori dejanje iz drugega, tretjega, četrtega, petega, šestega, sedmega, osmega ali štirinajstega odstavka 77. člena tega zakona.
79. člen
(prekršek interesne organizacije)
(1) Z globo od 400 do 100.000 eurov se kaznuje za prekršek interesna organizacija, za katero z njeno vednostjo lobira posameznik, ki v nasprotju z 58. členom tega zakona ni registriran kot lobist.
(2) Z globo od 400 do 100.000 eurov se kaznuje za prekršek interesna organizacija, po naročilu katere lobist lobira v nasprotju s 70. členom tega zakona.
80. člen
(izvajanje nadzora)
(1) Za izvajanje in za nadzor nad izvajanjem določb tega zakona je pristojna komisija.
(2) Globe, predpisane s tem zakonom, se lahko v hitrem postopku izrekajo tudi v višjem znesku, kot je najnižji predpisan znesek globe, ne smejo pa presegati najvišjih zneskov glob, ki so za prekršek predpisane po tem zakonu.
XI. PREHODNE IN KONČNE DOLOČBE
81. člen
(pristojnosti Komisije za preprečevanje korupcije v preostalem mandatu članov)
(1) Predsednik, namestnik predsednika in člani Komisije za preprečevanje korupcije po Zakonu o preprečevanju korupcije (Uradni list RS, št. 2/04, 20/06 – ZNOJF-1 in 33/07 – odločba US; v nadaljnjem besedilu: Zakon o preprečevanju korupcije) nadaljujejo z delom v skladu z nalogami in pristojnostmi, ki jih imajo člani komisije po tem zakonu, do imenovanja in nastopa dela predsednika komisije in obeh namestnikov predsednika komisije imenovanih po tem zakonu.
(2) Predsednik, namestnik predsednika in člani komisije za preprečevanje korupcije po Zakonu o preprečevanju korupcije sprejemajo odločitve z večino glasov vseh članov.
82. člen
(prepoved ponovnega imenovanja)
Predsednik in namestnik predsednika ter člani komisije, imenovani po Zakonu o preprečevanju korupcije, po preteku svojih mandatov iz prvega odstavka prejšnjega člena ne morejo biti ponovno imenovani na funkcijo v komisiji.
83. člen
(prenehanje članstva, dejavnosti ali funkcije in omejitve poslovanja)
(1) Funkcionarji, ki na dan uveljavitve tega zakona opravljajo funkcijo ali dejavnost, ki po 26. členu oziroma 27. členu tega zakona ni združljiva z opravljanjem funkcije, morajo ravnati v skladu s prvim odstavkom 28. člena tega zakona v roku dveh mesecev po uveljavitvi zakona.
(2) Funkcionarji, ki so na dan uveljavitve tega zakona člani organov v nasprotju s 27. členom tega zakona, morajo ravnati v skladu z drugim odstavkom 28. člena tega zakona v roku dveh mesecev po uveljavitvi zakona.
(3) Tretji odstavek 27. člena se za nepoklicne župane in podžupane ne uporablja do poteka njihovih mandatov v subjektih iz prvega odstavka 27. člena tega zakona.
(4) Pogodbe, ki so jih naročniki sklenili pred uveljavitvijo tega zakona, ostanejo ne glede na določbe prvega odstavka 35. člena v veljavi do izteka pogodbenega roka. Če na dan uveljavitve zakona poteka postopek javnega naročila, v katerem je udeležen ponudnik, s katerim naročnik v skladu s prvim in drugim odstavkom 35. člena ne sme poslovati, mora ponudnik v roku petih dni po uveljavitvi tega zakona umakniti svojo ponudbo.
84. člen
(zaključitev postopkov)
(1) Postopki, začeti po Zakonu o preprečevanju korupcije, se zaključijo po določbah Zakona o preprečevanju korupcije.
(2) Začeti postopek imenovanja predsednika in namestnika predsednika ter novih članov komisije v skladu z Zakonom o preprečevanju korupcije, se z dnem začetka veljavnosti tega zakona ustavi.
(3) Predsednik republike v primeru iz prejšnjega odstavka v roku sedmih dni po začetku veljavnosti tega zakona začne postopek imenovanja funkcionarjev komisije tako, da pozove predlagatelje za člane izbirne komisije, da imenujejo svoje člane ter izvede javni poziv v skladu z 9. členom tega zakona. Hkrati pozove predlagatelje možnih kandidatov, ki so posredovali predloge v skladu s pozivom na podlagi zakona o preprečevanju korupcije iz prejšnjega odstavka, ali se njihov predlog šteje kot kandidatura po 9. členu tega zakona ob upoštevanju pogojev iz tega zakona. Postopek se nadaljuje v skladu z določbami tega zakona, ki urejajo postopek imenovanja funkcionarjev komisije.
85. člen
(vzpostavitev evidenc)
Komisija vzpostavi oziroma uskladi evidence podatkov po tem zakonu najkasneje v šestih mesecih po uveljavitvi tega zakona.
86. člen
(roki za opravo dejanj)
(1) Zavezanci iz 41. člena tega zakona, ki še niso prijavili premoženja, svoje premoženje prvič prijavijo v roku 75 dni od uveljavitve tega zakona.
(2) Zavezanci iz drugega odstavka 56. člena tega zakona svoje poročilo iz 63. člena tega zakona pošljejo komisiji po poteku enega leta od uveljavitve tega zakona.
(3) Delodajalec, pri katerem so zaposleni zavezanci iz 41. člena tega zakona, mora prvič komisiji predložiti sezname teh zavezancev v 30 dneh po uveljavitvi zakona.
(4) Načrti integritete iz prvega odstavka 47. člena tega zakona morajo biti sprejeti najkasneje v roku enega leta po uveljavitvi tega zakona.
87. člen
(smernice za načrte integritete)
Komisija izdela in na svojih spletnih straneh objavi smernice za oblikovanje načrtov integritete, preverjanje delovanja načrtov integritete in ocenjevanje integritete v roku treh mesecev od uveljavitve zakona.
88. člen
(podzakonska predpisa)
(1) Podzakonska predpisa, sprejeta na podlagi Zakona o preprečevanju korupcije, se uporabljata, če nista v nasprotju z določili tega zakona, in sicer:
– Poslovnik Komisije za preprečevanje korupcije (Uradni list RS, št. 105/04) do sprejetja poslovnika komisije iz 11. člena tega zakona,
– Pravilnik o načinu razpolaganja z darili, ki jih sprejme funkcionar (Uradni list RS, št. 17/05) do določitve načina razpolaganja z darili komisije iz šestega odstavka 31. člena tega zakona.
(2) Poslovnik komisije iz 11. člena tega zakona sprejme komisija v roku 60 dni od uveljavitve tega zakona.
(3) Pravilnik o načinu razpolaganja z darili iz šestega odstavka 31. člena tega zakona sprejme komisija v roku 30 dni od uveljavitve tega zakona.
89. člen
(prenehanje veljavnosti predpisov)
(1) Z dnem uveljavitve tega zakona preneha veljati Zakon o nezdružljivosti opravljanja javne funkcije s pridobitno dejavnostjo (Uradni list RS, št. 20/06 in 33/07 – odločba US).
(2) Z dnem uveljavitve tega zakona preneha veljati četrta alineja drugega odstavka 52. člena Zakona o prekrških (Uradni list RS, št. 3/07 – uradno prečiščeno besedilo, 17/08, 21/08 – popr., 76/08 – ZIKS-1C, 108/09 in 109/09 – odločba US), v delu, ki se nanaša na prekrške s področja nezdružljivosti javnih funkcij s pridobitno dejavnostjo.
90. člen
(začetek veljavnosti)
(1) Ta zakon začne veljati naslednji dan po objavi v Uradnem listu Republike Slovenije.
(2) Določbe VIII. poglavja tega zakona se začnejo uporabljati šest mesecev po objavi v Uradnem listu Republike Slovenije.
Št. 214-02/10-59/243
Ljubljana, dne 26. maja 2010
EPA 926-V
Državni zbor
Republike Slovenije
dr. Pavel Gantar l.r.
Predsednik
“,”Jaka Verbic Miklic”,1521995100,1521995100,sl,12441,306,12422,43,0,NULL,,”Zakon o integriteti in preprečevanju korupcije, UL št. 45, 4.6.2010″,zakon-o-integriteti-in-preprecevanju-korupcije-ul-st-45-4-6-2010,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521995175,1523615811
270,12445,”Zakon o medicinskih pripomočkih “,”UL 98, 04/12/2009″,”
I. SPLOŠNE DOLOČBE
1. člen
(področje urejanja)
(1) Ta zakon določa:
– medicinske pripomočke in njihove dodatke za uporabo pri ljudeh,
– pogoje in ukrepe za zagotavljanje ustrezne kakovosti, varnosti in zmogljivosti medicinskih pripomočkov,
– pogoje in postopke za ugotavljanje skladnosti medicinskih pripomočkov,
– označevanje in pogoje za pritrditev oznake CE,
– pogoje za izdelavo medicinskih pripomočkov in promet z njimi,
– pogoje in postopke za klinične raziskave medicinskih pripomočkov,
– spremljanje zapletov z medicinskimi pripomočki,
– naloge in pristojnosti priglašenega organa,
– naloge in pristojnosti organa, pristojnega za medicinske pripomočke,
– nadzor nad izvajanjem tega zakona zaradi varovanja javnega zdravja.
(2) S tem zakonom se vsebinsko prenašajo v pravni red Republike Slovenije naslednje direktive ter urejajo vprašanja izvajanja naslednjih odločb in uredb:
– Direktiva Sveta z dne 20. junija 1990 o približevanju zakonodaje držav članic o aktivnih medicinskih pripomočkih za vsaditev (UL L št. 189 z dne 20. 7. 1990, str. 17), zadnjič spremenjena z Direktivo 2007/47/ES Evropskega parlamenta in Sveta z dne 5. septembra 2007 o spremembah Direktive Sveta 90/385/EGS o približevanju zakonodaje držav članic o aktivnih medicinskih pripomočkih za vsaditev, Direktive Sveta 93/42/EGS o medicinskih pripomočkih in Direktive 98/8/ES o dajanju biocidnih pripravkov v promet (UL L št. 247 z dne 21. 9. 2007, str. 21), (v nadaljnjem besedilu: Direktiva 90/385/EGS);
– Direktiva Sveta 93/42/EGS z dne 14. junija 1993 o medicinskih pripomočkih (UL L št. 169 z dne 12. 7. 1993, str. 1), zadnjič spremenjena z Direktivo 2007/47/ES Evropskega parlamenta in Sveta z dne 5. septembra 2007 o spremembah Direktive Sveta 90/385/EGS o približevanju zakonodaje držav članic o aktivnih medicinskih pripomočkih za vsaditev, Direktive Sveta 93/42/EGS o medicinskih pripomočkih in Direktive 98/8/ES o dajanju biocidnih pripravkov v promet (UL L št. 247 z dne 21. 9. 2007, str. 21), (v nadaljnjem besedilu: Direktiva 93/42/EGS);
– Direktiva 98/79/ES Evropskega parlamenta in Sveta z dne 27. oktobra 1998 o in vitro diagnostičnih medicinskih pripomočkih (UL L št. 331 z dne 7. 12. 1998, str. 1), zadnjič spremenjena z Uredbo (ES) št. 596/2009 Evropskega parlamenta in Sveta z dne 18. junija 2009 o prilagoditvi nekaterih aktov, za katere se uporablja postopek iz člena 251 Pogodbe, Sklepu Sveta 1999/468/ES glede regulativnega postopka s pregledom (UL L št. 188 z dne 18. 7. 2009, str. 14), (v nadaljnjem besedilu: Direktiva 98/79/ES);
– Odločba Komisije z dne 7. maja 2002 o skupnih tehničnih specifikacijah za in vitro diagnostične medicinske pripomočke (UL L št. 131 z dne 16. 5. 2002, str. 17), zadnjič spremenjena z Odločbo Komisije z dne 3. februarja 2009 o spremembi Odločbe Komisije 2002/364/ES o skupnih tehničnih specifikacijah za in vitro diagnostične medicinske pripomočke (UL L št. 39 z dne 10. 2. 2009, str. 34), (v nadaljnjem besedilu: Odločba 2002/364/ES);
– Uredba (ES) št. 1882/2003 Evropskega parlamenta in Sveta z dne 29. septembra 2003 o prilagoditvi določb glede odborov, ki pomagajo Komisiji pri uresničevanju njenih izvedbenih pooblastil, predvidenih v aktih, za katere se uporablja postopek iz člena 251 Pogodbe ES, Sklepu Sveta 1999/468/ES (UL L št. 284 z dne 31. 10. 2003, str. 1), zadnjič spremenjena z Uredbo (ES, EURATOM) št. 1101/2008 Evropskega parlamenta in Sveta z dne 22. oktobra 2008 o prenosu zaupnih podatkov na Statistični urad Evropskih skupnosti (UL L št. 304 z dne 14. 11. 2008, str. 70), (v nadaljnjem besedilu: Uredba 1882/2003/ES);
– Uredba (ES) št. 1394/2007 Evropskega parlamenta in Sveta z dne 13. novembra 2007 o zdravilih za napredno zdravljenje ter o spremembi Direktive 2001/83/ES in Uredbe (ES) št. 726/2004 (UL L št. 324 z dne 10. 12. 2007, str. 121).
(3) Pogoje in postopke uveljavljanja pravic uporabnikov ali uporabnic (v nadaljnjem besedilu: uporabnik) do medicinskih pripomočkov, predpisovanje, njihovo financiranje in druga vprašanja, povezana z medicinskimi pripomočki za rehabilitacijo, urejajo predpisi s področja socialne varnosti.
2. člen
(izjeme glede uporabe tega zakona)
Določbe tega zakona se ne uporabljajo za:
1. zdravila, ki jih urejajo predpisi o zdravilih;
2. kozmetične proizvode, ki jih urejajo predpisi o kozmetičnih proizvodih;
3. človeško kri, izdelke iz človeške krvi, človeško plazmo ali krvne celice človeškega izvora, ki se urejajo v skladu s predpisi o preskrbi s krvjo, razen tistih, ki jih ureja peti odstavek 15. člena tega zakona;
4. organe človeškega izvora za presaditev, ki jih urejajo predpisi o odvzemu in presaditvi delov človeškega telesa zaradi zdravljenja, razen tistih, ki jih ureja peti odstavek 15. člena tega zakona;
5. tkiva in celice človeškega izvora ter izdelke, ki vsebujejo tkiva ali celice človeškega izvora ali so iz njih pridobljeni ter jih urejajo predpisi o kakovosti in varnosti človeških tkiv in celic, namenjenih za zdravljenje;
6. organe ali tkiva ali celice živalskega izvora za presaditev, razen če je medicinski pripomoček izdelan iz neživih tkiv ali neživih izdelkov iz živalskega tkiva;
7. izdelke s kombinacijo zdravila in medicinskega pripomočka, ki vsebujejo žive celice ali tkiva ali nežive celice ali tkiva, pri čemer imajo tkiva ali celice na človeško telo glavni učinek, in se urejajo v skladu s predpisi Evropske unije o zdravilih za napredno zdravljenje;
8. in vitro diagnostične medicinske pripomočke, izdelane in uporabljene v isti zdravstveni ustanovi in v prostorih njihove izdelave ali uporabljene v prostorih v neposredni bližini, ne da bi bili preneseni v drug poslovni subjekt, ki jih urejajo predpisi o zdravstveni dejavnosti;
9. urejanje varovanja zdravja delavcev ali delavk in prebivalstva pred nevarnostjo ionizirajočega sevanja ali za varovanje zdravja posameznikov zaradi izpostavljenosti sevanju pri izvajanju zdravstvene dejavnosti, kar urejajo predpisi o varstvu pred ionizirajočimi sevanji in jedrski varnosti.
3. člen
(medicinski pripomoček)
(1) Medicinski pripomoček je vsak instrument, aparatura, naprava, programska oprema, material ali drug predmet, ki se uporablja samostojno ali v kombinaciji z dodatki, vključno s programsko opremo, ki jo je proizvajalec ali proizvajalka (v nadaljnjem besedilu: proizvajalec) medicinskih pripomočkov predvidel izrecno za uporabo pri diagnostiki oziroma v terapevtske namene in je potrebna za pravilno uporabo tega pripomočka, in ki ga je proizvajalec medicinskih pripomočkov predvidel za uporabo na ljudeh za:
– diagnosticiranje, preprečevanje, spremljanje, zdravljenje ali lajšanje bolezni,
– diagnosticiranje, spremljanje, zdravljenje, lajšanje posledic poškodb ali okvar ali kompenziranje okvare ali invalidnosti,
– preiskovanje, nadomeščanje ali spreminjanje anatomskih funkcij ali fizioloških procesov organizma ali
– nadzor spočetja, in ki svojega glavnega predvidenega učinka na človeško telo ne dosega na farmakološki, imunološki ali metabolični način, vendar pa so mu lahko ti procesi pri njegovem delovanju v pomoč.
(2) Dodatek k medicinskemu pripomočku je predmet, ki sicer ni medicinski pripomoček, vendar ga proizvajalec medicinskih pripomočkov izrecno namenja za uporabo skupaj z medicinskim pripomočkom, da ta lahko deluje v skladu z namenom, ki ga je predvidel proizvajalec medicinskega pripomočka.
4. člen
(aktivni medicinski pripomoček)
Aktivni medicinski pripomoček je medicinski pripomoček, ki mu delovanje omogoča črpanje iz vira električne energije ali drugega vira energije, razen tiste, ki izhaja iz človeškega telesa ali težnosti.
5. člen
(aktivni medicinski pripomoček za vsaditev)
(1) Aktivni medicinski pripomoček za vsaditev je aktivni medicinski pripomoček, namenjen temu, da se v celoti ali delno, kirurško ali z drugim medicinskim posegom vsadi v človeško telo ali da se z zdravstvenim posegom vstavi v naravno odprtino človeškega telesa in po takem postopku tam ostane.
(2) Za dodatek k aktivnemu medicinskemu pripomočku za vsaditev se uporabljajo določbe tega zakona, ki urejajo aktivne medicinske pripomočke za vsaditev.
6. člen
(in vitro diagnostični medicinski pripomoček)
(1) In vitro diagnostični medicinski pripomoček je medicinski pripomoček, ki je reagent, reagenčni izdelek, umerjevalec, kontrolni material, komplet, instrument, aparat, oprema ali sistem, ki se uporablja sam ali v kombinaciji, proizvajalec medicinskih pripomočkov pa ga je namenil za uporabo in za preiskave vzorcev, vključno z darovano krvjo in tkivi, ki izhajajo iz človeškega telesa, samo ali večinoma za zagotavljanje podatkov:
– v zvezi s fiziološkim ali patološkim stanjem,
– v zvezi s prirojeno nepravilnostjo,
– za določitev varnosti in združljivosti z možnimi prejemniki ali
– za spremljanje terapevtskih ukrepov.
(2) Posode za vzorce, ki se razvrščajo med in vitro diagnostične medicinske pripomočke, so tisti pripomočki, vakuumski ali ne, ki jih je proizvajalec medicinskih pripomočkov namenil predvsem temu, da vsebujejo in hranijo vzorce, ki izhajajo iz človeškega telesa, za in vitro diagnostične preiskave.
(3) Izdelki za splošno laboratorijsko uporabo niso in vitro diagnostični medicinski pripomočki, razen če jih je proizvajalec medicinskih pripomočkov glede na njihove značilnosti posebej predvidel za uporabo pri diagnostični preiskavi in vitro.
(4) Dodatek k in vitro diagnostičnemu medicinskemu pripomočku je predmet, ki ni in vitro diagnostični medicinski pripomoček, vendar ga je proizvajalec medicinskih pripomočkov namenil izrecno za uporabo skupaj s tem medicinskim pripomočkom, da se ta lahko uporablja v skladu s predvidenim namenom.
(5) Invazivni medicinski pripomoček za vzorčenje ali tisti, ki se neposredno uporabi na človeškem telesu, da bi pridobili vzorec, ni dodatek k in vitro diagnostičnemu medicinskemu pripomočku.
(6) In vitro diagnostični medicinski pripomoček za samotestiranje je medicinski pripomoček, ki ga je proizvajalec medicinskih pripomočkov namenil nestrokovnjakom za uporabo na domu.
(7) In vitro diagnostični medicinski pripomoček za ovrednotenje delovanja in vitro diagnostičnega medicinskega pripomočka je pripomoček, ki ga je proizvajalec medicinskih pripomočkov namenil eni ali več študijam ovrednotenja delovanja v laboratorijih za medicinske analize ali v drugem ustreznem okolju zunaj svojih prostorov.
7. člen
(medicinski pripomoček, izdelan za posameznega uporabnika)
(1) Medicinski pripomoček, izdelan za posameznega uporabnika, je medicinski pripomoček, ki je posebej izdelan z načrtovanimi lastnostmi v skladu s pisno zahtevo zdravnika ali zdravnice (v nadaljnjem besedilu: zdravnik) in je namenjen izključno uporabi pri tem uporabniku.
(2) Pisno zahtevo iz prejšnjega odstavka lahko izda tudi druga oseba, če je v skladu s predpisi za to pooblaščena na podlagi svojih poklicnih kvalifikacij.
(3) Medicinski pripomočki, ki se izdelujejo v množični proizvodnji in jih je treba prilagoditi, da bi izpolnjevali posebne zahteve zdravnika ali drugega strokovnjaka ali strokovnjakinje (v nadaljnjem besedilu: strokovnjak), niso medicinski pripomočki, izdelani za posameznega uporabnika.
8. člen
(medicinski pripomoček ali aktivni medicinski pripomoček za vsaditev, namenjen za klinične raziskave)
(1) Medicinski pripomoček ali aktivni medicinski pripomoček za vsaditev, namenjen za klinične raziskave, je medicinski pripomoček, ki ga uporablja zdravnik pri izvajanju raziskav na ljudeh v ustreznem kliničnem okolju.
(2) Kot ustrezno usposobljena oseba za izvajanje kliničnih raziskav se šteje tudi druga oseba, ki je na podlagi svojih poklicnih kvalifikacij usposobljena za izvajanje klinične raziskave.
9. člen
(drugi izrazi)
Izrazi, uporabljeni v tem zakonu, pomenijo:
1. Dajanje na trg pomeni prvič odplačno ali neodplačno dati na voljo medicinski pripomoček na trgu Evropske unije za opravljanje prometa ali uporabo, razen medicinskih pripomočkov, namenjenih kliničnim raziskavam, ter in vitro diagnostičnih medicinskih pripomočkov, namenjenih za ovrednotenje delovanja, ne glede na to, ali so novi ali popolnoma prenovljeni.
2. Dajanje v uporabo pomeni, da je medicinski pripomoček na voljo končnemu uporabniku in je prvič pripravljen za uporabo na trgu Evropske unije v skladu s predvidenim namenom. Začetek uporabe aktivnega medicinskega pripomočka za vsaditev pomeni dajanje tega pripomočka na razpolago za opravljanje zdravstvene dejavnosti.
3. Certifikat ES je listina, s katero priglašeni organ zagotavlja, da proizvodni postopek oziroma medicinski pripomoček ustreza zahtevam iz predpisov Evropske unije, ki urejajo medicinske pripomočke, ter iz tega zakona in na njegovi podlagi izdanih podzakonskih predpisov.
4. Harmonizirani standard je standard, ki ga je sprejel eden od organov za standardizacijo iz Priloge I k Direktivi 98/34/ES Evropskega parlamenta in Sveta z dne 22. junija 1998 o določitvi postopka za zbiranje informacij na področju tehničnih standardov in tehničnih predpisov (UL L št. 204 z dne 21. 7 1998), zadnjič spremenjeni z Direktivo Sveta 2006/96/ES z dne 20. novembra 2006 o prilagoditvi nekaterih direktiv na področju prostega pretoka blaga zaradi pristopa Bolgarije in Romunije (UL L št. 363 z dne 20. 12. 2006, str. 81), (v nadaljnjem besedilu: Direktiva 98/34/ES), na podlagi predloga, ki ga je pripravila Evropska komisija v skladu s 6. členom Direktive 98/34/ES.
5. Izjava ES o skladnosti je listina, s katero proizvajalec medicinskih pripomočkov zagotavlja, da proizvodni postopek oziroma medicinski pripomoček ustreza zahtevam iz predpisov Evropske unije, ki urejajo medicinske pripomočke, ter iz tega zakona in na njegovi podlagi izdanih podzakonskih predpisov.
6. Klinični podatki so podatki o varnosti oziroma zmogljivosti medicinskega pripomočka, pridobljeni z njegovo uporabo. Pridobijo se v kliničnih raziskavah o tem pripomočku ali kliničnih raziskavah ali drugih študijah o podobnih medicinskih pripomočkih, objavljenih v znanstveni literaturi, za katere je mogoče dokazati enakovrednost z zadevnim medicinskim pripomočkom, ali v objavljenih oziroma neobjavljenih poročilih o drugih kliničnih izkušnjah s tem ali podobnim medicinskim pripomočkom, za katerega je mogoče dokazati enakovrednost z zadevnim medicinskim pripomočkom.
7. Medicinski pripomoček za enkratno uporabo je medicinski pripomoček, namenjen temu, da se uporabi enkrat za enega bolnika ali bolnico (v nadaljnjem besedilu: bolnik).
8. Navodilo za uporabo je informacija za uporabnika, ki je v pisni obliki priložena medicinskemu pripomočku.
9. Odpoklic je vsak ukrep za vrnitev medicinskega pripomočka, ki ne ustreza bistvenim zahtevam iz tega zakona in predpisov Evropske unije, ki urejajo medicinske pripomočke, ter je že na voljo končnemu uporabniku, poslovnemu subjektu, ki ga je dal na trg.
10. Oznaka CE je oznaka, s katero proizvajalec medicinskih pripomočkov izjavlja, da je medicinski pripomoček skladen z zahtevami iz tega zakona in predpisi Evropske unije, ki urejajo medicinske pripomočke.
11. Podkategorija pripomočkov je sklop pripomočkov, ki imajo skupno področje predvidene uporabe ali skupno tehnologijo izdelave.
12. Pooblaščeni predstavnik ali predstavnica (v nadaljnjem besedilu: predstavnik) proizvajalca medicinskih pripomočkov (v nadaljnjem besedilu: predstavnik proizvajalca) je poslovni subjekt s sedežem v Evropski uniji, ki ga izrecno pisno pooblasti proizvajalec medicinskih pripomočkov s sedežem v tretji državi in deluje namesto njega ter na katerega se lahko obračajo pristojni organi v zvezi z obveznostmi proizvajalca medicinskih pripomočkov.
13. Poslovni subjekti so pravne osebe, samostojni podjetniki posamezniki ali samostojne podjetnice posameznice (v nadaljnjem besedilu: samostojni podjetnik posameznik) in drugi posamezniki ali posameznice (v nadaljnjem besedilu: posameznik), ki samostojno opravljajo dejavnost, vpisano v sodni ali poslovni register, ali s predpisom ali aktom o ustanovitvi določeno dejavnost.
14. Predvideni namen uporabe pomeni uporabo medicinskega pripomočka v skladu s podatki, ki jih navaja proizvajalec medicinskih pripomočkov pri označevanju, v navodilih za uporabo ali v oglaševalskem gradivu.
15. Priglašeni organ je organ, ki izvaja postopke ugotavljanja skladnosti iz tega zakona in na njegovi podlagi izdanih predpisov ter iz predpisov Evropske unije, ki urejajo medicinske pripomočke, ter izpolnjuje pogoje in je imenovan in priglašen pri Evropski komisiji v skladu s tem zakonom ali predpisi države članice Evropske unije, v kateri ima sedež.
16. Proizvajalec medicinskih pripomočkov je poslovni subjekt, odgovoren za načrtovanje, izdelavo, pakiranje in označevanje medicinskega pripomočka, preden je ta dan na trg pod njegovim lastnim imenom, ne glede na to, ali te postopke opravlja ta oseba ali pa v njenem imenu tretja oseba.
17. Promet z medicinskimi pripomočki na debelo je nakupovanje medicinskih pripomočkov in njihova nadaljnja prodaja poslovnim subjektom, ki jih kupujejo za opravljanje svoje poklicne ali registrirane dejavnosti.
18. Promet z medicinskimi pripomočki na drobno je nakupovanje medicinskih pripomočkov in njihova nadaljnja prodaja posameznikom za osebno uporabo.
19. Skupina generičnih medicinskih pripomočkov je sklop medicinskih pripomočkov, ki imajo enako ali podobno predvideno uporabo ali skupno tehnologijo izdelave, kar jim omogoča, da so razvrščeni generično, ne da bi to odražalo njihove posebne lastnosti.
20. Tretje države so tiste države, ki niso članice Evropske unije ali podpisnice Sporazuma o Enotnem gospodarskem prostoru.
21. Umik je ukrep za preprečitev dostopnosti medicinskega pripomočka na trgu.
22. Uvoz je promet medicinskega pripomočka na debelo iz tretjih držav na ozemlje Evropske unije.
23. Vigilanca medicinskih pripomočkov (v nadaljnjem besedilu: vigilanca) je sistem ugotavljanja, zbiranja in vrednotenja zapletov z medicinskimi pripomočki ter drugih spoznanj o varnosti v zvezi z njimi in ukrepanja za zmanjševanje tveganja, povezanega z njimi.
24. Zaplet z medicinskim pripomočkom je vsako nepravilno delovanje ali poslabšanje lastnosti ali zmogljivosti medicinskega pripomočka z medicinskega ali tehničnega vidika, pa tudi vse neskladnosti pri označevanju oziroma pri navodilih za uporabo, ki bi lahko povzročile ali so že povzročile smrt ali resno poslabšale zdravstveno stanje bolnika, uporabnika ali tretjih oseb.
10. člen
(pristojnosti)
(1) Pristojni minister ali ministrica (v nadaljnjem besedilu: minister) za medicinske pripomočke je minister, pristojen za zdravje, če ta zakon ne določa drugače.
(2) Organ, pristojen za medicinske pripomočke, je Javna agencija Republike Slovenije za zdravila in medicinske pripomočke.
(3) Organ, pristojen za medicinske pripomočke, odloča v upravnih zadevah na prvi stopnji po zakonu, ki ureja splošni upravni postopek, če s tem zakonom ni določeno drugače.
(4) Organ, pristojen za medicinske pripomočke, mora v upravnih zadevah v 30 delovnih dneh po prejemu vloge zahtevati njeno dopolnitev, če je nepopolna, in določiti predlagatelju ali predlagateljici (v nadaljnjem besedilu: predlagatelj) rok, v katerem jo mora dopolniti.
(5) O pritožbah zoper odločbe organa, pristojnega za medicinske pripomočke, odloča ministrstvo, pristojno za zdravje.
11. člen
(sodelovanje med organi in sporočanje podatkov)
(1) Organ, pristojen za medicinske pripomočke, sodeluje z organi, pristojnimi za medicinske pripomočke drugih držav članic, z Evropsko komisijo in drugimi pristojnimi institucijami ter izmenjuje podatke z namenom enotne uporabe predpisov, ki urejajo medicinske pripomočke.
(2) Organ, pristojen za medicinske pripomočke, oziroma poslovni subjekti morajo za vpis v evropsko bazo podatkov za medicinske pripomočke (v nadaljnjem besedilu: Eudamed) sporočati podatke o:
– registraciji proizvajalcev medicinskih pripomočkov, predstavnikov proizvajalcev in medicinskih pripomočkov, razen podatkov o medicinskih pripomočkih, izdelanih za posameznega uporabnika,
– certifikatih ES,
– vigilanci in
– kliničnih raziskavah medicinskih pripomočkov.
(3) Podatke iz prejšnjega odstavka in način sporočanja teh podatkov natančneje določi minister.
12. člen
(strokovno svetovanje)
Organ, pristojen za medicinske pripomočke, poslovnim subjektom na njihovo zahtevo strokovno svetuje glede:
– prevoda navodil za uporabo in označevanja medicinskega pripomočka,
– razmejitve med medicinskimi pripomočki in drugimi izdelki na podlagi 15. člena tega zakona,
– razvrstitve medicinskega pripomočka v razred na podlagi 16. člena tega zakona.
13. člen
(komisije in izvedenci)
(1) Pri organu, pristojnem za medicinske pripomočke, delujejo komisije za medicinske pripomočke in izvedenci ali izvedenke (v nadaljnjem besedilu: izvedenci). Komisije za medicinske pripomočke in izvedenci imajo posvetovalno vlogo ter so strokovno neodvisni in samostojni na svojem področju delovanja.
(2) Komisije za medicinske pripomočke in izvedence imenuje organ, pristojen za medicinske pripomočke, med uveljavljenimi strokovnjaki s področja farmacije, medicine, ali drugih naravoslovnih in tehničnih ved, za obravnavo in dajanje mnenj s strokovnih področij, ki zahtevajo posebno znanje.
(3) Člani komisij za medicinske pripomočke in izvedenci morajo pri svojem delu ravnati nepristransko in skladno s predpisi, ne smejo omogočati neupravičenih koristi ali dajati prednosti posameznim predlagateljem postopkov ter morajo spoštovati zaupnost podatkov, s katerimi se seznanijo pri opravljanju svojih nalog.
14. člen
(izvedenci v organih Evropske unije)
Izvedence, ki sodelujejo pri delu pristojnih organov Evropske unije za medicinske pripomočke in njihovih delovnih skupin, imenuje organ, pristojen za medicinske pripomočke.
15. člen
(razmejitev med medicinskimi pripomočki in drugimi izdelki)
(1) Pri odločanju o razvrstitvi izdelka med medicinske pripomočke ali med druge izdelke je treba upoštevati glavni namen njegovega delovanja.
(2) Če je medicinski pripomoček dan na trg le za uporabo zdravila, se obravnava v skladu s tem zakonom.
(3) Če je medicinski pripomoček dan na trg tako, da hkrati z zdravilom predstavlja enoten izdelek, namenjen izključno uporabi v dani kombinaciji in ne ponovni uporabi, se ta enotni izdelek obravnava v skladu s predpisi o zdravilih. Lastnosti medicinskega pripomočka, povezane z njegovo varnostjo in zmogljivostjo, morajo ustrezati bistvenim zahtevam iz tega zakona.
(4) Če medicinski pripomoček kot svoj sestavni del vsebuje snov, ki bi, če bi bila uporabljena ločeno, lahko veljala za zdravilo v skladu s predpisi o zdravilih in na telo deluje z učinkom, ki je dopolnilen učinku medicinskega pripomočka, se ta izdelek obravnava kot medicinski pripomoček.
(5) Če medicinski pripomoček kot sestavni del vsebuje snov, ki je v skladu s predpisi o zdravilih, če se uporablja ločeno, sestavina zdravila ali zdravilo, pridobljeno iz človeške krvi ali človeške plazme (derivat človeške krvi), in ki ima ob tem medicinskem pripomočku na telo verjetno dopolnilni učinek, se ta izdelek obravnava kot medicinski pripomoček.
(6) Če je namen proizvajalca medicinskih pripomočkov, da se medicinski pripomoček uporabi kot osebna varovalna oprema v skladu s predpisi o osebni varovalni opremi, mora izdelek izpolnjevati tudi ustrezne zahteve za varnost in zdravje v skladu s predpisi o osebni varovalni opremi.
(7) V primeru dvoma o razvrstitvi izdelka med medicinske pripomočke o razvrstitvi odloča organ, pristojen za medicinske pripomočke, na podlagi vloge predlagatelja ali po uradni dolžnosti.
(8) Natančnejšo vsebino vloge iz prejšnjega odstavka določi minister.
II. RAZVRSTITEV MEDICINSKIH PRIPOMOČKOV
16. člen
(razvrstitev medicinskih pripomočkov)
(1) Medicinski pripomočki se razvrstijo glede na stopnjo tveganja za uporabnika, mesto in način uporabe, vezanost na vir energije, trajanje uporabe in druge lastnosti.
(2) Glede na stopnjo tveganja za uporabnika se medicinski pripomočki razvrščajo v:
– razred I – medicinski pripomočki z nizko stopnjo tveganja za uporabnika,
– razred IIa – medicinski pripomočki z večjo stopnjo tveganja za uporabnika,
– razred IIb – medicinski pripomočki z visoko stopnjo tveganja za uporabnika in
– razred III – medicinski pripomočki z najvišjo stopnjo tveganja za uporabnika.
(3) Glede na mesto in način uporabe ter druge lastnosti izdelka se medicinski pripomočki razvrščajo na invazivne in neinvazivne.
(4) Glede na vezanost na vir energije se medicinski pripomočki razvrščajo na aktivne in neaktivne.
(5) In vitro diagnostični medicinski pripomočki se glede na stopnjo tveganja za uporabnike razvrstijo na:
– Seznam A,
– Seznam B,
– in vitro diagnostične medicinske pripomočke za samotestiranje, ki niso zajeti s seznamom A ali B, in
– druge in vitro diagnostične medicinske pripomočke.
(6) Natančnejša pravila za razvrstitev medicinskih pripomočkov in razvrstitev in vitro diagnostičnih medicinskih pripomočkov določi minister.
17. člen
(odločitev glede razvrstitve)
Ob morebitnem nesoglasju glede pravilne razvrstitve medicinskega pripomočka v razred v skladu s prejšnjim členom o razvrstitvi odloči organ, pristojen za medicinske pripomočke.
18. člen
(klavzula o odstopanju)
Organ, pristojen za medicinske pripomočke, predloži Evropski komisiji utemeljeno zahtevo za sprejetje potrebnih ukrepov, kadar meni, da:
– uporaba razvrstitvenih pravil zahteva odločitev o razvrstitvi medicinskega pripomočka ali kategorije medicinskih pripomočkov,
– bi moral biti medicinski pripomoček ali skupina medicinskih pripomočkov razvrščena v drug razred,
– je treba ugotoviti skladnost medicinskega pripomočka, aktivnega medicinskega pripomočka za vsaditev, in vitro diagnostičnega medicinskega pripomočka ali skupine medicinskih pripomočkov z drugim postopkom ugotavljanja skladnosti,
– je potrebna odločitev o tem, ali nek izdelek ali skupina izdelkov spada med medicinske pripomočke iz 3. do 8. člena tega zakona.
III. ZAHTEVE ZA MEDICINSKE PRIPOMOČKE
19. člen
(pogoji za dajanje na trg in v uporabo ali začetek uporabe)
(1) Medicinski pripomočki se lahko dajejo na trg ali v uporabo ali se lahko začnejo uporabljati, če izpolnjujejo zahteve iz tega zakona in na njegovi podlagi izdanih podzakonskih predpisov, kadar so ustrezno dobavljeni, pravilno nameščeni, vzdrževani in uporabljeni v skladu s predvidenim namenom.
(2) Poslovni subjekti, ki medicinske pripomočke uporabljajo pri opravljanju svoje dejavnosti, jih morajo vzdrževati v skladu z navodili proizvajalca medicinskih pripomočkov.
20. člen
(bistvene zahteve za medicinske pripomočke)
(1) Medicinski pripomočki morajo ustrezati bistvenim zahtevam, ki so splošne in posebne.
(2) Splošne zahteve za medicinske pripomočke so naslednje:
– načrtovani, izdelani, vgrajeni, vzdrževani in uporabljeni morajo biti tako, da pri uporabi pod pogoji in za namen, za katerega so izdelani, ne ogrožajo kliničnega stanja ali varnosti bolnikov ali varnosti in zdravja uporabnikov ali drugih oseb, ter da je zagotovljeno, da je vsako morebitno tveganje, povezano z njihovo uporabo, sprejemljivo v primerjavi s koristjo za bolnika ter združljivo z visoko ravnijo zaščite zdravja in varnosti;
– pri njihovem načrtovanju je upoštevano zmanjševanje tveganja za napako pri uporabi zaradi njihovih ergonomskih značilnosti in okolja, v katerem naj bi se medicinski pripomoček uporabljal (načrtovanje za varstvo bolnikov);
– pri načrtovanju so upoštevani tehnično znanje, izkušnje, izobraževanje, usposabljanje ter, če je to primerno, zdravstveno in fizično stanje predvidenih uporabnikov (načrtovanje za invalide, laične, strokovne in druge uporabnike).
(3) Posebne zahteve za medicinske pripomočke se nanašajo na:
– kemične, fizikalne in biološke lastnosti medicinskih pripomočkov;
– mikrobiološko kakovost medicinskih pripomočkov;
– načrtovanje in značilnosti medicinskih pripomočkov glede na okolje;
– medicinske pripomočke z merilno funkcijo;
– varstvo pred sevanjem;
– medicinske pripomočke, ki so povezani ali opremljeni z virom energije;
– označevanje medicinskih pripomočkov in navodilo za uporabo.
(4) Če obstaja ustrezna stopnja nevarnosti, morajo medicinski pripomočki in aktivni medicinski pripomočki, ki so tudi stroji, ustrezati tudi osnovnim zdravstvenim in varnostnim zahtevam v skladu s predpisi o tehničnih zahtevah za proizvode in o ugotavljanju skladnosti, ko so zdravstvene in varnostne zahteve bolj specifične od bistvenih zahtev, določenih s tem zakonom.
(5) Natančnejše bistvene zahteve za medicinske pripomočke določi minister.
21. člen
(uporaba standardov ali tehničnih predpisov)
(1) Za medicinske pripomočke, ki ustrezajo zahtevam nacionalnih standardov, sprejetih na podlagi harmoniziranih standardov, se domneva, da so skladni z zahtevami, določenimi s tem zakonom in na njegovi podlagi izdanimi podzakonskimi predpisi. Minister v Uradnem listu Republike Slovenije objavi seznam standardov, ob uporabi katerih se domneva, da je medicinski pripomoček skladen z zahtevami iz tega zakona in na njegovi podlagi izdanimi predpisi.
(2) Sklicevanje na standarde vključuje tudi monografije v Evropski farmakopeji ali v Slovenskem dodatku k Evropski farmakopeji, če gre za izdelek s kombinacijo zdravila in medicinskega pripomočka.
(3) Če organ, pristojen za medicinske pripomočke, meni, da harmonizirani standardi iz prvega odstavka tega člena ne ustrezajo zahtevam iz tega zakona, sproži izvajanje zaščitne klavzule skladno s 26. členom tega zakona.
(4) Za in vitro diagnostične medicinske pripomočke s Seznama A in, kjer je potrebno za in vitro diagnostične medicinske pripomočke s Seznama B, sklicevanje na standarde pomeni tudi sklicevanje na skupne tehnične specifikacije. Te skupne tehnične specifikacije določijo ustrezna merila za ovrednotenje in ponovno ovrednotenje delovanja, merila za izdajo serije, referenčne metode in referenčne materiale ter se objavijo v Uradnem listu Evropske unije. Proizvajalci medicinskih pripomočkov morajo zagotoviti, da in vitro diagnostični medicinski pripomočki ustrezajo skupnim tehničnim specifikacijam. Če jih iz upravičenih razlogov ne izpolnjujejo, morajo sprejeti rešitve, katerih raven je vsaj enakovredna ravni navedenih specifikacij.
IV. POSTOPEK UGOTAVLJANJA SKLADNOSTI MEDICINSKIH PRIPOMOČKOV
22. člen
(postopek ugotavljanja skladnosti)
(1) Postopek ugotavljanja skladnosti je postopek, v katerem se posredno ali neposredno ugotavlja in ocenjuje, ali medicinski pripomočki, njihova proizvodnja oziroma kakovost poslovanja ustreza pogojem, določenim s predpisi Evropske unije, ki urejajo medicinske pripomočke, s tem zakonom in na njegovi podlagi izdanimi podzakonskimi predpisi.
(2) Postopek ugotavljanja skladnosti iz prejšnjega odstavka je odvisen od razvrstitve medicinskega pripomočka glede na stopnjo tveganja za uporabnika, in sicer:
– za medicinske pripomočke razreda I proizvajalec medicinskih pripomočkov ocenjuje skladnost tega izdelka s predpisanimi zahtevami. Izjema so medicinski pripomočki razreda I z merilno funkcijo in tisti, ki se dajejo na trg sterilni in ki se glede merilne funkcije in zagotavljanja sterilnosti obravnavajo kot medicinski pripomočki razreda II;
– za medicinske pripomočke razreda IIa, IIb in III priglašeni organ ugotavlja skladnost izdelka, njegove proizvodnje oziroma kakovosti poslovanja s predpisanimi zahtevami.
(3) Postopki ugotavljanja skladnosti obsegajo:
– sistem za celovito zagotavljanje kakovosti;
– tipski preskus ES;
– overjanje ES;
– sistem za zagotavljanje kakovosti proizvodnje;
– sistem za zagotavljanje kakovosti izdelka;
– izjavo ES o skladnosti.
(4) Kjer postopek ugotavljanja skladnosti vključuje posredovanje priglašenega organa, lahko proizvajalec medicinskih pripomočkov ali predstavnik proizvajalca vloži zahtevo pri katerem koli priglašenem organu s sedežem v državi članici Evropske unije v okviru nalog, za katere je ta pristojen. O poteku in zaključku postopkov ugotavljanja skladnosti se priglašeni organ in proizvajalec medicinskih pripomočkov ali predstavnik proizvajalca pisno dogovorita.
(5) Postopke ugotavljanja skladnosti podrobneje določi minister.
23. člen
(certifikat ES in izjava ES o skladnosti)
(1) Za medicinske pripomočke razreda IIa, IIb in III, aktivne medicinske pripomočke za vsaditev ter in vitro diagnostične medicinske pripomočke se postopek ugotavljanja skladnosti začne pri priglašenem organu z vlogo predlagatelja. Vloga mora vsebovati dokazila o izpolnjevanju pogojev, ki jih določa predpis iz petega odstavka prejšnjega člena.
(2) Priglašeni organ lahko zahteva vse podatke, potrebne za postopek ugotavljanja skladnosti. Vloga, dokazila in dopisi v zvezi s postopki ugotavljanja skladnosti morajo biti v slovenskem jeziku ali v jeziku, ki ga priglašeni organ razume.
(3) Priglašeni organ mora pred začetkom postopka ugotavljanja skladnosti preveriti razvrstitev izdelka med medicinske pripomočke, ki jo izvede proizvajalec v skladu s tem zakonom.
(4) Po ugotovljeni skladnosti priglašeni organ izda certifikat ES z veljavnostjo največ pet let. Veljavnost se lahko podaljša za največ pet let na podlagi vloge proizvajalca medicinskih pripomočkov ali predstavnika proizvajalca, vložene v roku, za katerega se pisno dogovorita priglašeni organ in predlagatelj.
(5) Ne glede na določbo prejšnjega odstavka izda priglašeni organ po ugotovljeni skladnosti medicinskega pripomočka v postopku overjanja ES certifikat ES z neomejeno veljavnostjo.
(6) Pred dajanjem na trg medicinskih pripomočkov, razen tistih, ki so izdelani za posameznega uporabnika ali namenjeni za klinične raziskave, proizvajalec medicinskih pripomočkov sestavi izjavo ES o skladnosti in na medicinski pripomoček pritrdi oznako CE.
(7) Proizvajalec medicinskih pripomočkov ali predstavnik proizvajalca mora hraniti izjavo ES o skladnosti, tehnično dokumentacijo o medicinskem pripomočku in potrdila, ki so jih izdali priglašeni organi, ter jih dati na razpolago pristojnemu inšpektorju ali inšpektorici (v nadaljnjem besedilu: inšpektor) še pet let po izdelavi zadnjega medicinskega pripomočka oziroma 15 let po izdelavi zadnjega aktivnega medicinskega pripomočka za vsaditev, na katerega se dokumentacija nanaša.
24. člen
(izjava o medicinskih pripomočkih, izdelanih za posameznega uporabnika, in medicinskih pripomočkih, namenjenih za klinične raziskave)
(1) Za medicinske pripomočke, izdelane za posameznega uporabnika, in medicinske pripomočke, namenjene za klinične raziskave, mora proizvajalec medicinskih pripomočkov ali predstavnik proizvajalca sestaviti pisno izjavo, ki vsebuje podatke o proizvajalcu medicinskih pripomočkov in medicinskem pripomočku ter druge pomembne podatke.
(2) Pri dajanju na trg ali v uporabo medicinskih pripomočkov razreda IIa, IIb in III, ki so izdelani za posameznega uporabnika, mora biti pisna izjava iz prejšnjega odstavka na razpolago uporabniku, za katerega je medicinski pripomoček izdelan. Izjava vsebuje osebno ime uporabnika ali njegove podatke v kodirani obliki.
(3) Izjavo iz prvega odstavka tega člena mora proizvajalec medicinskih pripomočkov hraniti najmanj pet let, v primeru medicinskih pripomočkov za vsaditev pa najmanj 15 let.
(4) Natančnejšo vsebino izjave iz prvega odstavka tega člena in vrsto dokumentacije ter vsebino izjave za in vitro diagnostične medicinske pripomočke za ovrednotenje delovanja iz drugega odstavka 38. člena tega zakona določi minister.
25. člen
(izjeme v izrednih razmerah)
Organ, pristojen za medicinske pripomočke, lahko na podlagi ustrezno utemeljene zahteve predlagatelja odobri dajanje na trg oziroma v uporabo v Republiki Sloveniji tudi medicinskih pripomočkov, za katere niso bili izvedeni postopki ugotavljanja skladnosti, v izrednih razmerah (epidemije, zastrupitve, jedrska ali radiološka nesreča ali podobno) ali iz drugih razlogov, če gre za varovanje javnega zdravja.
26. člen
(zaščitna klavzula)
(1) Če organ, pristojen za medicinske pripomočke, ugotovi, da medicinski pripomočki ob pravilni namestitvi, vzdrževanju in uporabi za predvideni namen škodljivo vplivajo na zdravje ali varnost bolnikov, uporabnikov ali tretjih oseb ali varnost premoženja nemudoma sprejme začasni ukrep, s katerim določi umik, prepoved ali omejitev njihovega dajanja na trg oziroma v uporabo.
(2) O ukrepih iz prejšnjega odstavka organ, pristojen za medicinske pripomočke, nemudoma obvesti Evropsko komisijo z navedbo razlogov za tako odločitev. Pri tem posebej navede, ali je razlog v neizpolnjevanju bistvenih zahtev iz tega zakona, v nepravilni uporabi standardov iz 21. člena tega zakona ali v pomanjkljivosti standardov samih.
(3) Organ, pristojen za medicinske pripomočke, sprejme ukrepe proti vsakomur, ki pritrdi oznako CE na medicinski pripomoček, ki ni v skladu s tem zakonom. O izvedenih ukrepih obvesti Evropsko komisijo in organe drugih držav članic Evropske unije, pristojne za medicinske pripomočke.
(4) O ukrepih iz prvega odstavka tega člena organ, pristojen za medicinske pripomočke, seznani javnost z objavo v medijih.
27. člen
(posebni ukrepi za spremljanje zdravstvenega stanja)
(1) Če organ, pristojen za medicinske pripomočke, v zvezi z obravnavanim medicinskim pripomočkom ali skupino medicinskih pripomočkov meni, da bi jih bilo treba za zagotovitev varovanja zdravja in varnosti ali za zagotovitev spoštovanja zahtev javnega zdravja umakniti s trga ali jih ne dati na trg, ali njihovo dajanje v uporabo prepovedati ali omejiti, ali zanje sprejeti posebne zahteve, lahko sprejme vse potrebne in upravičene začasne ukrepe.
(2) Organ, pristojen za medicinske pripomočke, o izvedenih ukrepih iz prejšnjega odstavka obvesti Evropsko komisijo in druge države članice Evropske unije ter navede razloge za svojo odločitev.
(3) O ukrepih iz prvega odstavka tega člena organ, pristojen za medicinske pripomočke, seznani javnost z objavo v medijih.
V. OZNAKA CE
28. člen
(oznaka CE)
(1) Medicinski pripomočki, ki izpolnjujejo zahteve iz tega zakona in na njegovi podlagi izdanih podzakonskih predpisov ter predpisov Evropske unije, ki urejajo medicinske pripomočke, morajo, ko se dajejo na trg, nositi oznako CE. Oznaka CE mora biti v vidni, berljivi in neizbrisni obliki tudi na sterilnem zavoju, prodajni embalaži in v navodilih za uporabo.
(2) Na medicinskih pripomočkih razreda IIa, IIb in III, na aktivnih medicinskih pripomočkih za vsaditev in na in vitro diagnostičnih medicinskih pripomočkih mora oznako CE spremljati identifikacijska številka priglašenega organa, odgovornega za izvajanje postopkov ugotavljanja skladnosti.
(3) Oznako CE določi minister.
29. člen
(izjeme glede oznake CE)
(1) Določbe prejšnjega člena se ne uporabljajo za medicinske pripomočke, ki so namenjeni za klinične raziskave, za medicinske pripomočke, izdelane za posameznega uporabnika, in za in vitro diagnostične medicinske pripomočke za ovrednotenje delovanja iz 38. člena tega zakona.
(2) Za medicinske pripomočke, ki so predstavljeni na sejmih, razstavah in predstavitvah, oznaka CE ni potrebna, če je na vidnem mestu navedeno, da niso namenjeni za dajanje na trg ali v uporabo.
30. člen
(prepoved pritrditve oznake CE)
(1) Prepovedano je pritrditi oznako CE na izdelke, ki na podlagi tega zakona niso medicinski pripomočki.
(2) Prepovedano je na medicinski pripomoček pritrditi oznako CE, če ni skladen s tem zakonom.
(3) Prepovedano je na medicinski pripomoček pritrditi oznako CE v nasprotju z določbami tega zakona.
(4) Prepovedano je pritrjevanje oznak ali napisov, podobnih oznaki CE, ki bi bili lahko zavajajoči glede pomena ali grafičnega videza oznake CE.
(5) Prepovedano je na medicinski pripomoček, embalažo ali priložena navodila za uporabo pritrditi kakršno koli drugo oznako, ki bi zmanjšala vidnost ali čitljivost oznake CE, jo prekrila ali povzročila nejasnosti glede označevanja.
31. člen
(poseben postopek za sisteme in pakete medicinskih pripomočkov)
(1) Če so medicinski pripomočki, ki nosijo oznako CE, združeni v sistem ali paket z namenom dajanja na trg v takšni obliki v okviru njihovega predvidenega namena in v mejah uporabe, ki jo je predvidel proizvajalec medicinskih pripomočkov, na sistemu ali paketu ni treba izvesti postopka za ugotavljanje skladnosti in pritrditi dodatne oznake CE.
(2) Sistemu in paketu medicinskih pripomočkov morajo biti priloženi podatki, ki so predpisani zanje, kjer je to ustrezno, pa jim morajo biti priloženi tudi podatki o medicinskih pripomočkih, ki so združeni v sistemu in paketu.
(3) Poslovni subjekt, ki daje na trg sisteme ali pakete medicinskih pripomočkov, mora dati pisno izjavo, da:
– je preveril medsebojno združljivost medicinskih pripomočkov in izpeljal postopke v skladu z navodili proizvajalca medicinskih pripomočkov,
– je zapakiral sistem ali paket in priložil bistvene podatke za uporabnike in
– so bile vse aktivnosti izpeljane v skladu z ustreznimi metodami notranjega preverjanja in nadzora.
(4) Izjavo iz prejšnjega odstavka mora poslovni subjekt hraniti najmanj pet let in jo dati na voljo organu, pristojnemu za medicinske pripomočke, na njegovo zahtevo.
(5) Kadar sistemi ali paketi medicinskih pripomočkov vsebujejo medicinske pripomočke brez oznake CE ali kadar izbrana kombinacija teh pripomočkov ni združljiva z njihovo izvirno namensko uporabo, se sistem ali paket obravnava kot medicinski pripomoček sam po sebi in se mu po izvedenem postopku ugotavljanja skladnosti iz 22. člena tega zakona pritrdi oznaka CE.
32. člen
(sterilizacija sistemov in paketov)
(1) Poslovni subjekt, ki za dajanje na trg sterilizira sisteme ali pakete medicinskih pripomočkov ali druge medicinske pripomočke z oznako CE, ki so jih proizvajalci medicinskih pripomočkov predvideli za sterilizacijo pred uporabo, izvede postopek ocenjevanja sistema za celovito zagotavljanje kakovosti ali sistema za zagotavljanje kakovosti proizvodnje, v skladu s predpisom iz 22. člena tega zakona. Postopek in posredovanje priglašenega organa se uporabita, da se zagotovi sterilnost do odprtja ali poškodbe sterilne ovojnine. Po izvedeni sterilizaciji pritrditev nove oznake CE ni potrebna.
(2) Poslovni subjekt da pisno izjavo, da je bila sterilizacija opravljena v skladu z navodili proizvajalca medicinskega pripomočka. Izjavo mora hraniti najmanj pet let in jo predložiti organu, pristojnemu za medicinske pripomočke, na njegovo zahtevo.
VI. OZNAČEVANJE IN NAVODILO ZA UPORABO
33. člen
(označevanje in navodilo za uporabo)
(1) Medicinskemu pripomočku morajo biti priloženi podatki, potrebni za varno in pravilno uporabo, ob upoštevanju usposobljenosti in znanja morebitnih uporabnikov, ter za identifikacijo proizvajalca medicinskih pripomočkov. Ti podatki so navedeni na prodajni embalaži ali nalepki in v navodilu za uporabo.
(2) Če je izvedljivo in primerno, morajo biti podatki, potrebni za varno in pravilno uporabo medicinskega pripomočka, navedeni na medicinskem pripomočku samem ali na embalaži vsake enote ali, kjer je to primerno, na prodajni embalaži. Če pakiranje ali označevanje posameznih enot ni mogoče, morajo biti navedeni v navodilu za uporabo, ki je priloženo enemu ali več medicinskim pripomočkom.
(3) Na prodajni embalaži morajo biti navedeni podatki, ki označujejo medicinski pripomoček in namen uporabe ter ime in naslov proizvajalca medicinskih pripomočkov ali predstavnika proizvajalca.
(4) Navodilo za uporabo mora biti vključeno v prodajni embalaži medicinskega pripomočka, razen za medicinske pripomočke razreda I in IIa ali v upravičenih in izjemnih primerih za in vitro diagnostične medicinske pripomočke, če jih je mogoče uporabljati varno tudi brez navodila za uporabo, vendar je treba podatke o medicinskem pripomočku dati na voljo uporabniku na njegovo zahtevo.
(5) Navodila za uporabo morajo biti napisana v slovenskem jeziku, čitljiva in uporabniku razumljiva ter morajo vsebovati datum izdaje ali datum zadnjega popravka ali spremembe. Če so v slovenski jezik prevedena, mora biti vsebina prevoda enaka izvirnemu navodilu za uporabo. Če je medicinski pripomoček namenjen izključno za uporabo pri opravljanju dejavnosti, vpisane v sodni ali poslovni register, je navodilo za uporabo lahko napisano v uporabniku razumljivem jeziku.
(6) Natančnejše podatke, ki jih mora imeti medicinski pripomoček ali sistemi in paketi medicinskih pripomočkov na prodajni embalaži, nalepki in v navodilu za uporabo, določi minister.
VII. PRIGLAŠENI ORGANI
34. člen
(pogoji za priglašeni organ)
(1) Poslovni subjekt s sedežem v Republiki Sloveniji mora biti pred začetkom izvajanja postopkov ugotavljanja skladnosti iz 22. člena tega zakona imenovan z odločbo organa, pristojnega za medicinske pripomočke, in biti priglašen pri Evropski komisiji.
(2) Priglašeni organi morajo glede na vrsto in obseg postopkov ugotavljanja skladnosti izpolnjevati naslednje pogoje:
– imeti primerno število strokovnjakov z ustreznim znanjem in poznavanjem postopkov za presojanje medicinske funkcionalnosti in delovanja medicinskih pripomočkov, njihove kakovosti oziroma sistema kakovosti proizvodnje;
– imeti ustrezne prostore, naprave in opremo za ugotavljanje skladnosti medicinskih pripomočkov;
– imeti vzpostavljen sistem zagotavljanja kakovosti poslovanja;
– voditi ustrezno dokumentacijo o postopkih ocenjevanja ter preverjanja medicinskih pripomočkov in proizvajalcev medicinskih pripomočkov.
(3) Natančnejše pogoje, ki jih mora izpolnjevati priglašeni organ, in vsebino vloge za imenovanje organa za izvajanje postopkov ugotavljanja skladnosti določi minister.
35. člen
(postopek imenovanja in priglasitve)
(1) Postopek imenovanja organa za izvajanje postopkov ugotavljanja skladnosti, ki ima sedež v Republiki Sloveniji, se začne z vlogo predlagatelja pri organu, pristojnem za medicinske pripomočke. V vlogi mora predlagatelj navesti podatke in predložiti dokazila o izpolnjevanju pogojev iz prejšnjega člena in navesti, za katere medicinske pripomočke glede na določbe 16. in 22. člena tega zakona bo ugotavljal skladnost, ter priložiti listine, s katerimi izkazuje svojo usposobljenost za izpolnjevanje zahtev iz tega zakona (npr. akreditacijska listina ali poročilo o usposobljenosti, če obstaja).
(2) Organ, pristojen za medicinske pripomočke, po prejemu popolne vloge imenuje komisijo za verifikacijo (v nadaljnjem besedilu: komisija), ki jo sestavljajo strokovnjaki s področja delovanja organa za izvajanje postopkov ugotavljanja skladnosti. Komisija izda mnenje o izpolnjevanju pogojev predlagatelja in o morebitnih ukrepih za odpravo ugotovljenih pomanjkljivosti.
(3) Organ, pristojen za medicinske pripomočke, na podlagi mnenja komisije o izpolnjevanju zahtev iz tega zakona izda odločbo o imenovanju organa za izvajanje postopkov ugotavljanja skladnosti ali zavrnitvi imenovanja v 60 dneh po prejemu popolne vloge.
(4) Organ, pristojen za medicinske pripomočke, ob izdaji odločbe o imenovanju organa za izvajanje postopkov ugotavljanja skladnosti pošlje ministrstvu, pristojnemu za trg, odločbo za priglasitev pri Evropski komisiji.
(5) Minister, pristojen za trg, obvesti Evropsko komisijo in druge države članice Evropske unije o imenovanju organa za izvajanje postopkov ugotavljanja skladnosti skupaj s podatki o nalogah, za katere je organ imenovan, v 15 dneh po prejemu odločbe iz prejšnjega odstavka.
(6) Potem ko Evropska komisija opravi postopek ugotavljanja izpolnjevanja zahtevanih pogojev, organ za izvajanje postopkov ugotavljanja skladnosti pridobi identifikacijsko številko in lahko začne opravljati naloge priglašenega organa.
36. člen
(spremljanje in preklic imenovanja)
(1) Organ, pristojen za medicinske pripomočke, spremlja izvajanje postopkov ugotavljanja skladnosti iz 22. člena tega zakona, ki jih izvaja priglašeni organ, in izpolnjevanje pogojev glede priglašenega organa iz 34. člena tega zakona.
(2) Organ, pristojen za medicinske pripomočke, prekliče odločbo o imenovanju, če ugotovi, da priglašeni organ ne izpolnjuje pogojev iz 34. člena tega zakona, in o tem nemudoma obvesti ministrstvo, pristojno za trg.
(3) Minister, pristojen za trg, o preklicu imenovanja iz prejšnjega odstavka nemudoma obvesti Evropsko komisijo in druge države članice Evropske unije.
(4) Imenovanje in preklic imenovanja se objavita na spletni strani organa, pristojnega za medicinske pripomočke.
37. člen
(način dela priglašenega organa)
(1) Priglašeni organ mora pri izvajanju svojih nalog in pristojnosti ravnati nepristransko.
(2) Priglašeni organ ne sme biti načrtovalec, proizvajalec, dobavitelj ali dobaviteljica (v nadaljnjem besedilu: dobavitelj) ali uporabnik medicinskih pripomočkov, ki jih pregleduje, ali predstavnik teh oseb.
(3) Osebje priglašenega organa zaradi nezdružljivosti interesov ne sme omogočati neupravičenih koristi ali dajati prednosti posameznim predlagateljem postopkov. Spoštovati mora zaupnost tehničnih podatkov o medicinskih pripomočkih in poslovnih podatkov o proizvajalcih medicinskih pripomočkov.
(4) Priglašeni organ mora organ, pristojen za medicinske pripomočke, obvestiti o izdanih, spremenjenih in dopolnjenih certifikatih ES in mu jih predložiti v 30 dneh po njihovi izdaji.
(5) Priglašeni organ mora obvestiti organ, pristojen za medicinske pripomočke, in druge priglašene organe s sedežem v državah članicah Evropske unije o začasno preklicanih oziroma umaknjenih certifikatih ES ali zavrnjenih zahtevkih za njihovo izdajo, na zahtevo pa tudi o izdanih certifikatih ES in drugih ustreznih informacijah najpozneje v 15 dneh po preklicu, umiku, zavrnitvi zahtevka oziroma po zahtevi.
(6) Če priglašeni organ ugotovi, da zahteve iz tega zakona niso bile izpolnjene, da jih proizvajalec medicinskih pripomočkov ne izpolnjuje več ali da certifikat ES ne bi smel biti izdan, ob upoštevanju načela sorazmernosti začasno prekliče ali umakne izdani certifikat ES ali ga omeji, če proizvajalec medicinskih pripomočkov z izvajanjem ustreznih korektivnih ukrepov ne zagotovi izpolnjevanja zahtev iz tega zakona. Priglašeni organ ob začasnem preklicu ali umiku certifikata ES ali njegove omejitve ali kadar je potrebno posredovanje organa, pristojnega za medicinske pripomočke, slednjega o tem obvesti.
(7) Organ, pristojen za medicinske pripomočke, mora o ukrepih iz prejšnjega odstavka obvestiti Evropsko komisijo in organe, pristojne za medicinske pripomočke, drugih držav članic Evropske unije.
(8) Priglašeni organ mora organu, pristojnemu za medicinske pripomočke, in pristojnemu inšpektorju na njegovo zahtevo predložiti dokumentacijo o postopkih ugotavljanja skladnosti medicinskih pripomočkov in preverjanja proizvajalcev medicinskih pripomočkov, vključno s finančnimi dokumenti o poslovanju priglašenega organa.
(9) Podatki o certifikatih ES iz četrtega in petega odstavka tega člena, razen podatkov o zavrnjenih zahtevkih za izdajo certifikatov ES, se ne štejejo za zaupne.
VIII. KLINIČNE RAZISKAVE MEDICINSKIH PRIPOMOČKOV
38. člen
(klinične raziskave medicinskih pripomočkov)
(1) Klinična raziskava medicinskega pripomočka je ugotavljanje njegove varnosti in zmogljivosti v skladu z namenom uporabe, ki jo je predvidel proizvajalec medicinskih pripomočkov.
(2) Za in vitro diagnostične medicinske pripomočke se za ugotavljanje varnosti in zmogljivosti izvedejo študije ovrednotenja njihovega delovanja.
39. člen
(postopek priglasitve klinične raziskave medicinskih pripomočkov)
(1) Predlagatelj klinične raziskave je lahko proizvajalec medicinskih pripomočkov ali predstavnik proizvajalca.
(2) Predlagatelj mora klinično raziskavo pred njenim začetkom priglasiti pri organu, pristojnem za medicinske pripomočke. Vloga za klinično raziskavo mora vsebovati podatke o medicinskem pripomočku, načrt klinične raziskave, mnenje komisije Republike Slovenije za medicinsko etiko in druge podatke oziroma dokumentacijo, ki jih določi minister.
(3) Predlagatelj mora študijo ovrednotenja delovanja in vitro diagnostičnega medicinskega pripomočka pred njenim začetkom priglasiti pri organu, pristojnem za medicinske pripomočke. Vloga mora vsebovati podatke o in vitro medicinskem pripomočku, načrt ovrednotenja delovanja in druge podatke oziroma dokumentacijo, ki jih določi minister.
(4) Določbe prejšnjega odstavka se uporabljajo tudi za medicinske pripomočke z oznako CE, kadar je cilj klinične raziskave uporaba medicinskih pripomočkov v namene, ki niso predmet postopka ugotavljanja skladnosti.
(5) O vlogi za priglasitev klinične raziskave odloča organ, pristojen za medicinske pripomočke. O priglasitvi se organ, pristojen za medicinske pripomočke, izreče v 60 dneh od prejema popolne vloge in o tem izda odločbo. V primeru molka organa se šteje, da je priglasitev ugodno rešena in da se klinična raziskava lahko začne.
(6) Če organ, pristojen za medicinske pripomočke, zavrne priglasitev klinične raziskave, v odločbi navede razloge za zavrnitev in jih utemelji z vidika varovanja javnega zdravja ali varovanja javnega interesa. O zavrnitvi klinične raziskave mora obvestiti organe, pristojne za medicinske pripomočke, v državah članicah Evropske unije in Evropsko komisijo.
(7) Vsebino vloge za priglasitev klinične raziskave in spremembe klinične raziskave natančneje določi minister.
40. člen
(potek klinične raziskave medicinskih pripomočkov)
(1) Izvajanje kliničnih raziskav medicinskih pripomočkov glede na cilje in metode ter vrednotenje kliničnih podatkov in druge zahteve za klinične raziskave medicinskih pripomočkov določi minister.
(2) O zapletih z medicinskimi pripomočki med klinično raziskavo predlagatelj obvesti organ, pristojen za medicinske pripomočke, najpozneje v sedmih dneh od dogodka.
41. člen
(priglasitev spremembe v klinični raziskavi medicinskih pripomočkov)
(1) Pri klinični raziskavi, ki že poteka, mora predlagatelj klinične raziskave pri organu, pristojnem za medicinske pripomočke, priglasiti spremembe v klinični raziskavi.
(2) Priglašena sprememba se lahko uvede, če organ, pristojen za medicinske pripomočke, v 30 dneh od prejema popolne vloge o spremembi ne izda negativne odločbe.
42. člen
(prekinitev klinične raziskave medicinskih pripomočkov)
(1) Organ, pristojen za medicinske pripomočke, lahko zaradi varovanja javnega zdravja ali zdravja preizkušancev ustavi klinično raziskavo, jo začasno prekine ali zahteva njene spremembe.
(2) Organ, pristojen za medicinske pripomočke, o ustavitvi klinične raziskave in o razlogih zanjo obvesti organe, pristojne za medicinske pripomočke, drugih držav članic Evropske unije in Evropsko komisijo. O zahtevi za spremembe oziroma začasni prekinitvi klinične raziskave in razlogih zanje obvesti organe, pristojne za medicinske pripomočke, zadevnih držav članic Evropske unije.
(3) Za prekinitev klinične raziskave se kadar koli lahko odloči tudi predlagatelj klinične raziskave in o razlogih prekinitve obvesti organ, pristojen za medicinske pripomočke, najpozneje v 15 dneh po prekinitvi. Ob predčasni prekinitvi zaradi varnostnih razlogov mora organ, pristojen za medicinske pripomočke, o tem obvestiti pristojne organe drugih držav članic Evropske unije in Evropsko komisijo.
43. člen
(zaključek klinične raziskave medicinskih pripomočkov)
Predlagatelj priglašene klinične raziskave medicinskega pripomočka mora v 30 dneh po njenem zaključku o tem obvestiti organ, pristojen za medicinske pripomočke, in mu poslati zaključno poročilo.
IX. PROIZVODNJA MEDICINSKIH PRIPOMOČKOV
44. člen
(zahteve za proizvajalca medicinskih pripomočkov)
(1) Proizvajalec medicinskih pripomočkov mora za izdelavo medicinskih pripomočkov zagotoviti:
– ustrezno usposobljeno osebje, prostore, opremo in proizvodne postopke ter voditi dokumentacijo glede na vzpostavljeni sistem kakovosti poslovanja, da je zagotovljena proizvodnja medicinskih pripomočkov, ki so skladni z bistvenimi zahtevami tega zakona, ki ne ogrožajo zdravja in varnosti bolnikov, uporabnikov ali tretjih oseb, ki so izdelani ob upoštevanju dosežkov znanosti in tehnologije ter tako, da je zmanjšano ali odstranjeno tveganje v zvezi z njihovo uporabo;
– odgovorno osebo za spremljanje in poročanje o zapletih z medicinskimi pripomočki ter ukrepanje ob morebitnem tveganju;
– zavarovanje svoje odgovornosti za morebitno škodo, ki bi nastala pri bolniku, uporabniku ali tretji osebi zaradi neustrezne kakovosti ali varnosti medicinskega pripomočka.
(2) Natančnejše zahteve za proizvajalce medicinskih pripomočkov iz prejšnjega odstavka določi minister.
45. člen
(vpis v register proizvajalcev medicinskih pripomočkov)
(1) Proizvajalec medicinskih pripomočkov s sedežem v Republiki Sloveniji se mora najpozneje v 15 dneh po dajanju medicinskih pripomočkov, ki jih izdeluje, na trg, priglasiti organu, pristojnemu za medicinske pripomočke, za vpis v register proizvajalcev medicinskih pripomočkov in navesti ime ali firmo, sedež ali naslov in naslov proizvodnih enot ter seznam medicinskih pripomočkov, ki jih izdeluje.
(2) O podatkih iz prejšnjega odstavka organ, pristojen za medicinske pripomočke, na njihovo zahtevo obvesti Evropsko komisijo in pristojne organe držav članic Evropske unije.
(3) Podatke iz prvega odstavka tega člena natančneje določi minister.
46. člen
(sprememba podatkov in izbris iz registra proizvajalcev medicinskih pripomočkov)
(1) Proizvajalec medicinskih pripomočkov mora najpozneje v 15 dneh sporočiti organu, pristojnemu za medicinske pripomočke, vsako spremembo podatkov iz prejšnjega člena.
(2) Organ, pristojen za medicinske pripomočke, izbriše proizvajalca medicinskih pripomočkov iz registra proizvajalcev medicinskih pripomočkov po uradni dolžnosti, če proizvajalec medicinskih pripomočkov preneha delovati, ali na podlagi pisne zahteve proizvajalca medicinskih pripomočkov.
47. člen
(predstavnik proizvajalca)
(1) Predstavnik proizvajalca s sedežem v Republiki Sloveniji se mora pri organu, pristojnemu za medicinske pripomočke, najpozneje v 15 dneh od dajanja medicinskega pripomočka, za katerega je pooblaščen, na trg, priglasiti za vpis v register proizvajalcev medicinskih pripomočkov.
(2) Predstavnik proizvajalca mora ob priglasitvi navesti svoje ime ali firmo in naslov ali sedež, ime ali firmo in naslov ali sedež proizvajalca medicinskih pripomočkov, ki ga predstavlja, pisno pooblastilo proizvajalca medicinskih pripomočkov in seznam medicinskih pripomočkov, ki jih je dal na trg in za katere ga je proizvajalec medicinskih pripomočkov pooblastil.
(3) Predstavnik proizvajalca mora organu, pristojnemu za medicinske pripomočke, sporočiti spremembe podatkov iz prejšnjega odstavka najpozneje v 15 dneh od nastanka spremembe.
(4) Organ, pristojen za medicinske pripomočke, izbriše predstavnika proizvajalca iz registra proizvajalcev medicinskih pripomočkov po uradni dolžnosti, če ta ni več predstavnik proizvajalca ali če preneha delovati, ali na podlagi pisne zahteve predstavnika proizvajalca medicinskih pripomočkov.
(5) O podatkih iz drugega odstavka tega člena organ, pristojen za medicinske pripomočke, na njihovo zahtevo obvesti Evropsko komisijo in pristojne organe držav članic Evropske unije.
(6) Podatke iz drugega odstavka tega člena natančneje določi minister.
48. člen
(obveznosti poslovnih subjektov, ki dajejo medicinske pripomočke na trg pod svojim imenom)
(1) Poslovni subjekti, ki sestavljajo, pakirajo, obdelujejo, v celoti prenavljajo ali označujejo enega ali več gotovih izdelkov ali jim določijo predvideni namen delovanja ali uporabe kot medicinskemu pripomočku, ali jih sterilizirajo, vse zaradi dajanja na trg pod svojim imenom, morajo izpolnjevati obveznosti, ki po tem zakonu veljajo za proizvajalce medicinskih pripomočkov.
(2) Določbe prejšnjega odstavka ne veljajo za poslovne subjekte, ki sestavljajo ali prilagajajo medicinske pripomočke, ki so že na trgu, za njihov predvideni namen za posameznega uporabnika.
49. člen
(priglasitev medicinskih pripomočkov)
(1) Proizvajalec medicinskih pripomočkov oziroma predstavnik proizvajalca s sedežem v Republiki Sloveniji mora organu, pristojnemu za medicinske pripomočke, priglasiti medicinske pripomočke za vpis v register medicinskih pripomočkov najpozneje v 15 dneh od začetka njihovega dajanja na trg.
(2) Proizvajalci medicinskih pripomočkov in predstavniki proizvajalcev morajo organu, pristojnemu za medicinske pripomočke, na njegovo zahtevo predložiti dokumentacijo o aktivnih medicinskih pripomočkih za vsaditev, medicinskih pripomočkih razreda IIa, IIb in III, o medicinskih pripomočkih, ki so izdelani za posameznega uporabnika, in o in vitro diagnostičnih medicinskih pripomočkih, ki jih dajejo v uporabo v Republiki Sloveniji.
50. člen
(vpis v register medicinskih pripomočkov)
(1) Postopek za vpis v register medicinskih pripomočkov se začne z vlogo proizvajalca medicinskih pripomočkov oziroma predstavnika proizvajalca s sedežem v Republiki Sloveniji. Vloga poleg splošnih podatkov o proizvajalcu medicinskih pripomočkov oziroma predstavniku proizvajalca vsebuje podatke in dokumentacijo o zadevnih medicinskih pripomočkih, in sicer:
– ime ali generično ime medicinskega pripomočka,
– razred ali razvrstitev medicinskega pripomočka,
– opis in namen uporabe medicinskega pripomočka,
– izjavo ES o skladnosti,
– kopijo certifikata ES,
– navodilo za uporabo in
– posebno navedbo, kadar gre za nov in vitro diagnostični medicinski pripomoček, ki ga ni bilo na trgu Evropske unije v zadnjih treh letih za ustrezni analit ali drug parameter, ali se za njegovo izdelavo uporablja tehnologija, ki se v Evropski uniji ni uporabljala v zadnjih treh letih za ustrezni analit ali drug parameter.
(2) Organ, pristojen za medicinske pripomočke, najpozneje v 60 dneh od prejema popolne vloge izda odločbo o vpisu v register medicinskih pripomočkov in medicinski pripomoček ali skupino pripomočkov vpiše v register medicinskih pripomočkov.
(3) Proizvajalec medicinskih pripomočkov oziroma predstavnik proizvajalca s sedežem v Republiki Sloveniji mora sporočiti organu, pristojnemu za medicinske pripomočke, spremembe podatkov iz prvega odstavka tega člena najpozneje v 15 dneh od nastanka spremembe.
(4) Natančnejšo vsebino vloge za vpis v register medicinskih pripomočkov določi minister.
51. člen
(izjava o prosti prodaji medicinskega pripomočka)
(1) Organ, pristojen za medicinske pripomočke, lahko proizvajalcu medicinskih pripomočkov s sedežem v Republiki Sloveniji na njegovo zahtevo izda izjavo, s katero potrjuje, da je zadevni medicinski pripomoček ali skupina medicinskih pripomočkov na trgu v skladu s predpisi Evropske unije, ki urejajo področje medicinskih pripomočkov, s tem zakonom in na njegovi podlagi izdanimi podzakonskimi predpisi ter da za ta medicinski pripomoček ni nobenih omejitev za dajanje na trg.
(2) Natančnejšo vsebino vloge za izdajo izjave o prosti prodaji medicinskega pripomočka iz prejšnjega odstavka določi minister.
X. PROMET Z MEDICINSKIMI PRIPOMOČKI
52. člen
(promet z medicinskimi pripomočki na debelo)
(1) Promet z medicinskimi pripomočki na debelo lahko opravljajo poslovni subjekti, ki izpolnjujejo pogoje za opravljanje trgovinske dejavnosti, določene s predpisi o trgovini.
(2) Poslovni subjekt iz prejšnjega odstavka se mora najpozneje v 15 dneh od začetka opravljanja prometa z medicinskimi pripomočki na debelo priglasiti organu, pristojnemu za medicinske pripomočke, za vpis v register poslovnih subjektov, ki opravljajo promet z medicinskimi pripomočki na debelo.
(3) Poslovni subjekti, ki opravljajo promet z medicinskimi pripomočki na debelo, morajo:
– delovati s potrebno skrbnostjo za zagotovitev, da so vsi medicinski pripomočki, ki jih dajejo v promet, skladni z zahtevami tega zakona;
– preden dajo medicinske pripomočke v promet, preveriti, ali imajo predpisano oznako CE ter ali so opremljeni z navodili za uporabo in drugimi podatki, ki jih določa ta zakon;
– zagotoviti pogoje skladiščenja in prevoza, ki ohranjajo skladnost medicinskega pripomočka z zahtevami iz tega zakona;
– imeti odgovorno osebo za vigilanco medicinskih pripomočkov z najmanj V. stopnjo izobrazbe in usposobljenostjo za medicinske pripomočke, s katerimi opravljajo promet na debelo.
(4) Če je poslovni subjekt dal v promet medicinski pripomoček, za katerega meni ali utemeljeno domneva, da ni skladen z zahtevami tega zakona, takoj obvesti proizvajalca medicinskih pripomočkov ali predstavnika proizvajalca in zagotovi potrebne ukrepe za odpravo pomankljivosti ali če je to potrebno, umakne ali odpokliče medicinski pripomoček. Če medicinski pripomoček ogroža zdravje ali življenje ljudi, poslovni subjekt takoj obvesti tudi organ, pristojen za medicinske pripomočke, z navedbo držav članic Evropske unije, v katere je dal medicinski pripomoček v promet, ter mu predloži podatke o neizpolnjevanju zahtev in sprejetih ukrepih za odpravo pomankljivosti.
(5) Poslovni subjekt, ki opravlja promet na debelo z medicinskimi pripomočki, mora na podlagi zahteve organa, pristojnega za medicinske pripomočke, predložiti vse potrebne podatke in dokumentacijo o medicinskih pripomočkih, s katerimi opravlja promet na debelo, ter sodelovati pri izvajanju korektivnih ukrepov v okviru vigilance medicinskih pripomočkov.
(6) Poslovni subjekt, ki opravlja promet z medicinskimi pripomočki na debelo, mora organu, pristojnemu za medicinske pripomočke, najpozneje v 15 dneh sporočiti spremembo podatkov iz osmega odstavka tega člena.
(7) Organ, pristojen za medicinske pripomočke, izbriše poslovni subjekt, ki opravlja promet z medicinskimi pripomočki na debelo, iz registra poslovnih subjektov, ki opravljajo promet z medicinskimi pripomočki na debelo po uradni dolžnosti, če ta preneha delovati, ali na podlagi njegove pisne zahteve.
(8) Podatke za priglasitev poslovnega subjekta, ki opravlja promet z medicinskimi pripomočki na debelo, natančneje določi minister.
53. člen
(promet z medicinskimi pripomočki na drobno)
(1) Promet z medicinskimi pripomočki na drobno se lahko opravlja v lekarnah in specializiranih ali drugih prodajalnah, ki izpolnjujejo pogoje za opravljanje trgovinske dejavnosti, določene s predpisi o trgovini.
(2) Promet na drobno se lahko opravlja le z medicinskimi pripomočki, ki izpolnjujejo zahteve tega zakona.
(3) Promet na drobno z in vitro diagnostičnimi medicinskimi pripomočki za samotestiranje HIV se lahko opravlja le v lekarnah.
(4) Promet na drobno z medicinskimi pripomočki v specializirani prodajalni lahko opravljajo poslovni subjekti, ki izpolnjujejo pogoje za opravljanje trgovinske dejavnosti, imajo ustrezne prostore in osebje za strokovno svetovanje uporabnikom medicinskih pripomočkov z ustrezno poklicno kvalifikacijo in usposobljenostjo za medicinske pripomočke, s katerimi opravljajo promet na drobno.
(5) Poslovni subjekt iz prejšnjega odstavka se mora najpozneje v 15 dneh od začetka opravljanja prometa z medicinskimi pripomočki na drobno v specializirani prodajalni priglasiti organu, pristojnemu za medicinske pripomočke, za vpis v register specializiranih prodajaln, ki opravljajo promet z medicinskimi pripomočki na drobno. Tak poslovni subjekt mora organu, pristojnemu za medicinske pripomočke, najpozneje v 15 dneh po nastanku sporočiti spremembo podatkov iz osmega odstavka tega člena.
(6) Organ, pristojen za medicinske pripomočke, izbriše poslovni subjekt, ki opravlja promet z medicinskimi pripomočki na drobno v specializirani prodajalni, iz registra poslovnih subjektov, ki opravljajo promet z medicinskimi pripomočki na drobno po uradni dolžnosti, če preneha delovati, ali na podlagi njegove pisne zahteve.
(7) V drugih prodajalnah se lahko opravlja promet na drobno z medicinskimi pripomočki, katerim v skladu s četrtim odstavkom 33. člena tega zakona v prodajno embalažo ni treba vključiti navodila za uporabo, in medicinskimi pripomočki, ki so namenjeni zaščiti pred prenosom nalezljivih bolezni.
(8) Pogoje iz četrtega odstavka tega člena in podatke za priglasitev poslovnega subjekta, ki opravlja promet z medicinskimi pripomočki na drobno v specializirani prodajalni, natančneje določi minister.
54. člen
(uvoz medicinskih pripomočkov)
(1) Poslovni subjekt lahko uvaža le medicinske pripomočke, ki so skladni z zahtevami tega zakona in za katere ima proizvajalec medicinskih pripomočkov iz tretje države pooblaščenega predstavnika s sedežem na ozemlju Evropske unije.
(2) Poslovni subjekt, ki uvaža medicinske pripomočke (v nadaljnjem besedilu: uvoznik), mora izpolnjevati pogoje za opravljanje trgovinske dejavnosti, ki jih določajo predpisi o trgovini.
(3) Uvoznik ali uvoznica (v nadaljnjem besedilu: uvoznik) mora poleg pogojev iz prejšnjega odstavka izpolnjevati tudi zahteve iz tretjega, četrtega in petega odstavka 52. člena tega zakona in:
– zagotoviti, da je proizvajalec medicinskih pripomočkov izvedel ustrezni postopek ugotavljanja skladnosti medicinskega pripomočka, ki se uvaža;
– zagotoviti, da je proizvajalec medicinskih pripomočkov pripravil tehnično dokumentacijo o medicinskem pripomočku, ki se uvaža;
– na medicinskem pripomočku, če to ni mogoče, pa na embalaži ali v navodilu za uporabo navesti ime ali firmo, sedež ali naslov, na katerem je dosegljiv v zvezi s podatki o medicinskem pripomočku;
– dati na vpogled izjavo ES o skladnosti medicinskega pripomočka organu, pristojnemu za medicinske pripomočke, na njegovo zahtevo v obdobju, v katerem je ta pripomoček v uporabi.
(4) Uvoznik, ki opravlja promet z medicinskimi pripomočki na drobno, mora poleg pogojev iz prejšnjega odstavka izpolnjevati tudi pogoje iz prejšnjega člena.
(5) Uvoznik se mora pri organu, pristojnemu za medicinske pripomočke, priglasiti za vpis v register poslovnih subjektov, ki opravljajo promet z medicinskimi pripomočki na debelo, v skladu z 52. členom tega zakona.
(6) Uvoznik iz četrtega odstavka tega člena se mora organu, pristojnemu za medicinske pripomočke, priglasiti tudi za vpis v register specializiranih prodajaln, ki opravljajo promet z medicinskimi pripomočki na drobno, v skladu s prejšnjim členom.
55. člen
(prosti pretok medicinskih pripomočkov)
Prepovedano je ovirati dajanje na trg ali v uporabo ali začetek uporabe medicinskih pripomočkov, ki ustrezajo zahtevam iz tega zakona in na njegovi podlagi izdanih podzakonskih predpisov.
XI. VIGILANCA MEDICINSKIH PRIPOMOČKOV
56. člen
(obveščanje o zapletih z medicinskimi pripomočki)
(1) Proizvajalci medicinskih pripomočkov, predstavniki proizvajalcev in poslovni subjekti, ki opravljajo promet z medicinskimi pripomočki na debelo, morajo vzpostaviti in vzdrževati lasten sistem vigilance medicinskih pripomočkov, ki zagotavlja zbiranje, vrednotenje in izmenjavo podatkov o zapletih z medicinskimi pripomočki in sodelovati z organom, pristojnim za medicinske pripomočke.
(2) Zbiranje poročil o zapletih z medicinskimi pripomočki in njihovo ocenjevanje izvaja organ, pristojen za medicinske pripomočke, ki sodeluje s pristojnimi organi držav članic Evropske unije.
(3) Proizvajalci medicinskih pripomočkov, predstavniki proizvajalcev, poslovni subjekti, ki opravljajo promet z medicinskimi pripomočki na debelo ali na drobno in uvozniki s sedežem v Republiki Sloveniji, morajo najpozneje v 24 urah, ko so bili seznanjeni z zapletom, o tem obvestiti organ, pristojen za medicinske pripomočke.
(4) Izvajalci ali izvajalke (v nadaljnjem besedilu: izvajalci) zdravstvene, lekarniške ali druge dejavnosti morajo najpozneje v 24 urah po zapletu oziroma po tem ko so bili z njim seznanjeni, o zapletu obvestiti organ, pristojen za medicinske pripomočke. O tem zapletu lahko obvestijo tudi proizvajalca medicinskih pripomočkov ali predstavnika proizvajalca.
(5) Poročilo o zapletu z medicinskim pripomočkom iz tretjega in četrtega odstavka tega člena mora vsebovati ime ali firmo in naslov ali sedež poslovnega subjekta oziroma izvajalca dejavnosti in osebno ime poročevalca ali poročevalke.
(6) Proizvajalec medicinskih pripomočkov ali predstavnik proizvajalca mora raziskati vsak zaplet z medicinskim pripomočkom, o katerem je bil obveščen, in o svojih ugotovitvah obvestiti organ, pristojen za medicinske pripomočke, v skladu s predpisom iz devetega odstavka tega člena.
(7) Organ, pristojen za medicinske pripomočke, po oceni zapleta z medicinskim pripomočkom, ki jo izvede, če je to možno, skupaj s proizvajalcem ali predstavnikom proizvajalca, o ukrepih za odpravo zapleta z medicinskim pripomočkom obvesti Evropsko komisijo in organe, pristojne za medicinske pripomočke drugih držav članic Evropske unije.
(8) Izvajalci zdravstvene dejavnosti, ki vsadijo medicinske pripomočke, morajo za zagotavljanje njihove sledljivosti in ukrepanje ob zapletih z njimi voditi seznam oseb, ki se jim medicinski pripomočki vsadijo. Seznam obsega bolnikovo osebno ime, njegov naslov in telefonsko številko, datum vsaditve, podatke o medicinskem pripomočku (tip in serijsko številko) ter o proizvajalcu medicinskih pripomočkov.
(9) Natančnejšo vsebino poročila iz petega odstavka tega člena in pogoje celovitega delovanja sistema vigilance medicinskih pripomočkov določi minister.
XII. OGLAŠEVANJE MEDICINSKIH PRIPOMOČKOV
57. člen
(oglaševanje medicinskih pripomočkov)
Oglaševanje medicinskih pripomočkov so vse oblike obveščanja o medicinskih pripomočkih, vključno z obveščanjem od vrat do vrat, propagiranjem ali spodbujanjem, ki je namenjeno pospeševanju prodaje ali uporabe medicinskih pripomočkov.
58. člen
(pogoji oglaševanja medicinskih pripomočkov)
(1) Prepovedano je oglaševanje medicinskih pripomočkov, ki ne izpolnjujejo zahtev iz tega zakona.
(2) Ne glede na prejšnji odstavek lahko poslovni subjekti na sejmih, razstavah, predstavitvah in podobnih dogodkih predstavljajo medicinske pripomočke, ki niso skladni s tem zakonom, če je na vidnem mestu označeno, da se ne prodajajo ali dajejo v uporabo, dokler ne bodo usklajeni s tem zakonom in na njegovi podlagi izdanimi podzakonskimi predpisi.
(3) Medicinski pripomočki, ki se uporabljajo le pri opravljanju zdravstvene dejavnosti, se lahko oglašujejo v strokovni javnosti. Strokovna javnost so zdravstveni delavci ali zdravstvene delavke (v nadaljnjem besedilu: zdravstveni delavci), kakor jih opredeljuje zakon, ki ureja zdravstveno dejavnost.
59. člen
(način oglaševanja)
(1) Oglaševanje medicinskih pripomočkov ne sme vsebovati podatkov, ki:
– nakazujejo, da so učinki uporabe medicinskega pripomočka popolnoma zagotovljeni ali da je njegova uporaba enakovredna drugemu zdravljenju;
– nakazujejo, da se zdravje osebe lahko izboljša le zaradi uporabe oglaševanega medicinskega pripomočka;
– nakazujejo, da bi se zdravje osebe brez uporabe medicinskega pripomočka lahko poslabšalo;
– so usmerjeni izključno ali pretežno k otrokom;
– se sklicujejo na priporočila znanstvenikov ali znanstvenic, zdravstvenih delavcev ali v javnosti znanih drugih oseb, ki bi zaradi svojega medijskega vpliva lahko spodbujali uporabo medicinskega pripomočka;
– bi zaradi opisa ali podrobne predstavitve anamneze lahko privedli do napačne samodiagnoze;
– uporabljajo neprimerne, vznemirljive ali zavajajoče izraze o možnostih okrevanja;
– uporabljajo neprimerne, vznemirljive ali zavajajoče izraze, slikovne predstavitve sprememb v človeškem telesu, ki jih je povzročila bolezen ali poškodba, razen če so te spremembe predstavljene v skladu z etiko in moralo, ali
– kršijo oziroma posegajo v človekovo dostojanstvo.
(2) Pri oglaševanju medicinskih pripomočkov strokovni javnosti je prepovedano dajati, ponujati ali obljubljati darila, finančne ugodnosti ali materialne koristi, razen če so te majhne vrednosti, v višini, kakršna velja za javne uslužbence ali uslužbenke (v nadaljnjem besedilu uslužbenec).
(3) Prepovedano je zavajajoče predstaviti medicinski pripomoček glede njegovih lastnosti in namena uporabe.
(4) Dovoljeno je dajanje vzorcev medicinskih pripomočkov strokovni in splošni javnosti pod pogoji, ki jih določi minister.
60. člen
(prepoved zavajajoče predstavitve izdelkov)
Prepovedano je dajati na trg ali v uporabo izdelke, predstavljene z lastnostmi medicinskega pripomočka, če se na podlagi tega zakona ne razvrščajo med medicinske pripomočke.
61. člen
(uradne evidence)
Organ, pristojen za medicinske pripomočke, upravlja:
– register medicinskih pripomočkov, katerih proizvajalci oziroma predstavniki proizvajalcev imajo sedež v Republiki Sloveniji, ki vsebuje ime ali generično ime medicinskih pripomočkov, njihovo razvrstitev in ime ali firmo proizvajalca medicinskih pripomočkov oziroma predstavnika proizvajalca;
– register proizvajalcev medicinskih pripomočkov s sedežem v Republiki Sloveniji, ki vsebuje ime ali firmo, naslov ali sedež proizvajalca medicinskih pripomočkov oziroma predstavnika proizvajalca ter vrsto medicinskih pripomočkov, ki jih proizvaja oziroma za katere je pooblaščen;
– register poslovnih subjektov, ki opravljajo promet z medicinskimi pripomočki na debelo, ki vsebuje ime ali firmo, naslov ali sedež poslovnega subjekta;
– register specializiranih prodajaln, ki opravljajo promet z medicinskimi pripomočki na drobno, ki vsebuje ime ali firmo, naslov ali sedež poslovnega subjekta in specializirane prodajalne;
– seznam priglašenih organov s sedežem v Republiki Sloveniji, ki vsebuje ime ali firmo, naslov ali sedež priglašenega organa ter vrsto nalog, za katere je imenovan.
XIII. PRISTOJBINE
62. člen
(pristojbine)
(1) Za stroške postopkov, ki jih določa ta zakon, plača predlagatelj organu, pristojnemu za medicinske pripomočke, naslednje pristojbine, razen, če zakon ne določa drugače:
– za stroške strokovnega svetovanja iz 12. člena tega zakona,
– za postopek razvrstitve izdelka med medicinske pripomočke iz 15. člena tega zakona,
– za postopek imenovanja priglašenega organa iz 35. člena tega zakona,
– za postopek priglasitve klinične raziskave oziroma njene spremembe iz 39. in 41. člena tega zakona,
– za postopke v zvezi z vpisom v register medicinskih pripomočkov iz 50. člena tega zakona,
– za izjavo o prosti prodaji medicinskega pripomočka iz prvega odstavka 51. člena tega zakona.
(2) Priglašeni organi s sedežem v Republiki Sloveniji plačujejo organu, pristojnemu za medicinske pripomočke, letne pristojbine za spremljanje postopkov ugotavljanja skladnosti in izpolnjevanja pogojev v skladu s prvim odstavkom 36. člena tega zakona.
(3) Višino pristojbin iz prvega in drugega odstavka tega člena določi minister.
XIV. NADZOR
63. člen
(pristojnosti pri nadzoru)
(1) Nadzor nad medicinskimi pripomočki opravlja organ, pristojen za medicinske pripomočke. Naloge nadzora opravljajo inšpektorji oziroma inšpektorice za medicinske pripomočke (v nadaljnjem besedilu: inšpektorji).
(2) Tržni inšpektorji oziroma tržne inšpektorice opravljajo inšpekcijski nadzor nad izvajanjem določb prvega odstavka 52. člena, prvega in četrtega odstavka 53. člena in drugega odstavka 54. člena tega zakona, ki se nanašajo na izpolnjevanje pogojev iz predpisov o trgovini.
64. člen
(imenovanje inšpektorja)
(1) Za inšpektorja iz prvega odstavka prejšnjega člena je lahko imenovana oseba, ki ima:
– univerzitetno izobrazbo,
– najmanj pet let delovnih izkušenj in
– opravljen strokovni izpit za inšpektorja po zakonu, ki ureja inšpekcijski nadzor.
(2) Inšpektorje iz prvega odstavka prejšnjega člena imenuje predstojnik ali predstojnica organa, pristojnega za medicinske pripomočke, v skladu z zakonom, ki ureja javne uslužbence.
65. člen
(pristojnosti inšpektorjev)
(1) Inšpektorji imajo položaj, pravice in obveznosti, ki jih za inšpektorje določata zakon, ki ureja inšpekcijski nadzor, in zakon, ki ureja javne uslužbence.
(2) Inšpektor ima poleg pristojnosti iz prejšnjega odstavka še naslednje pristojnosti in naloge:
– odredi poslovnemu subjektu, da uskladi svoje poslovanje z določbami tega zakona in na njegovi podlagi izdanih predpisov v roku, ki ga določi;
– prepove dajanje na trg ali odredi umik ali odpoklic medicinskih pripomočkov, ki niso skladni s tem zakonom;
– prepove dajanje v uporabo ali začetek uporabe, omeji ali odredi prenehanje uporabe medicinskih pripomočkov, ki niso skladni s tem zakonom;
– prepove izdelavo, klinično raziskavo ali promet z medicinskimi pripomočki zaradi neizpolnjevanja pogojev iz tega zakona;
– zahteva od poslovnega subjekta vse potrebne podatke ter vpogled v izdane listine in drugo dokumentacijo;
– odredi izvajanje ustreznih pregledov in preizkusov medicinskih pripomočkov glede skladnosti s predpisi tudi po tem, ko so bili dani na trg ali so se začeli uporabljati;
– odredi uničenje neskladnih medicinskih pripomočkov, če je to potrebno za zavarovanje zdravja in varnost ljudi;
– odvzame vzorce medicinskih pripomočkov in jih odda v pregled skladnosti;
– prepove predstavljanje ali oglaševanje medicinskih pripomočkov, ki je v nasprotju z določbami tega zakona;
– odredi odstranitev ali uničenje materiala, uporabljenega za nedovoljeno oglaševanje medicinskih pripomočkov;
– odredi odpravo ugotovljenih neskladnosti s tem zakonom in na njegovi podlagi izdanimi predpisi;
– odredi ukrepe poslovnemu subjektu v zvezi z izvajanjem sistema vigilance v skladu s tem zakonom in na njegovi podlagi izdanimi predpisi;
– odredi priglašenemu organu uskladitev poslovanja z zahtevami tega zakona;
– odredi druge ukrepe, potrebne za izvajanje tega zakona in na njegovi podlagi izdanih predpisov.
(3) Pritožba zoper ukrepe iz prejšnjega odstavka, ki jih odredi inšpektor v upravnem postopku, ne zadrži njihove izvršitve.
XV. KAZENSKE DOLOČBE
66. člen
(kazenske določbe)
(1) Z globo od 1.000 do 10.000 eurov se za prekršek kaznuje pravna oseba, če:
1. ne vzdržuje medicinskih pripomočkov v skladu z navodili proizvajalca (drugi odstavek 19. člena);
2. ne hrani v predpisanem obdobju ali ne da na razpolago dokumentacije iz sedmega odstavka 23. člena tega zakona;
3. ne hrani pisne izjave o medicinskih pripomočkih, izdelanih za posameznega uporabnika, in medicinskih pripomočkih, namenjenih za klinične raziskave, v rokih v skladu s tretjim odstavkom 24. člena tega zakona;
4. sistemu in paketu medicinskih pripomočkov, ki so namenjeni dajanju na trg ali v uporabo, niso priloženi predpisani podatki (drugi odstavek 31. člena);
5. ne da pisne izjave, je ne hrani najmanj pet let ali je ne da na voljo organu, pristojnemu za medicinske pripomočke, na njegovo zahtevo (tretji in četrti odstavek 31. člena);
6. ne izvede postopka za ocenjevanje sistema za celovito zagotavljanje kakovosti ali postopka za ocenjevanje sistema za zagotavljanje kakovosti proizvodnje (prvi odstavek 32. člena);
7. ne da pisne izjave, je ne hrani najmanj pet let ali je ne da na voljo organu, pristojnemu za medicinske pripomočke, na njegovo zahtevo (drugi odstavek 32. člena);
8. medicinskemu pripomočku ne priloži oziroma ne navede predpisanih podatkov ali jih priloži oziroma navede v nasprotju s 33. členom tega zakona ali na podlagi tega zakona izdanimi podzakonskimi predpisi;
9. k medicinskemu pripomočku priloži navodilo za uporabo, ki ni v skladu s petim odstavkom 33. člena tega zakona ali na njegovi podlagi izdanim podzakonskim predpisom;
10. ne priglasi spremembe klinične raziskave, v skladu z 41. členom tega zakona;
11. ne obvesti organa, pristojnega za medicinske pripomočke, o prekinitvi klinične raziskave (tretji odstavek 42. člena);
12. v predpisanem roku organa, pristojnega za medicinske pripomočke, ne obvesti o zaključku klinične raziskave oziroma mu ne pošlje zaključnega poročila (43. člen);
13. ne sporoči sprememb podatkov v skladu s 46. členom tega zakona;
14. se ne vpiše v register proizvajalcev medicinskih pripomočkov ali ne sporoči sprememb podatkov v skladu s 47. členom tega zakona;
15. ne izpolnjuje obveznosti, ki veljajo za proizvajalce medicinskih pripomočkov v skladu s prvim odstavkom 48. člena tega zakona;
16. kot proizvajalec ne priglasi medicinskih pripomočkov v skladu z 49. členom tega zakona;
17. kot proizvajalec ne sporoči sprememb podatkov v skladu s tretjim odstavkom 50. člena tega zakona;
18. se ne priglasi organu, pristojnemu za medicinske pripomočke, za vpis v register poslovnih subjektov, ki opravljajo promet z medicinskimi pripomočki na debelo, ali ne sporoči sprememb podatkov (drugi in šesti odstavek 52. člena);
19. se ne priglasi organu, pristojnemu za medicinske pripomočke, za vpis v register specializiranih prodajaln, ki opravljajo promet z medicinskimi pripomočki na drobno, ali ne sporoči sprememb podatkov v skladu s petim odstavkom 53. člena tega zakona;
20. opravlja promet z medicinskimi pripomočki na drobno, ki ni v skladu s 53. členom tega zakona;
21. ne obvesti organa, pristojnega za medicinske pripomočke, o zapletu z medicinskim pripomočkom (tretji odstavek 56. člena);
22. ne vodi seznama oseb v skladu s 56. členom tega zakona.
(2) Z globo od 500 do 5.000 eurov se za prekršek iz prejšnjega odstavka kaznuje samostojni podjetnik posameznik in posameznik, ki samostojno opravlja dejavnost.
(3) Z globo od 200 do 2.000 eurov se za prekršek iz prvega odstavka tega člena kaznuje odgovorna oseba pravne osebe ali odgovorna oseba samostojnega podjetnika posameznika.
67. člen
(kazenske določbe)
(1) Z globo od 15.000 do 150.000 eurov se za prekršek kaznuje pravna oseba, če:
1. daje na trg ali v uporabo medicinske pripomočke, ki niso skladni z zahtevami tega zakona (prvi odstavek 19. člena);
2. ne izdela izjave ES o skladnosti v skladu s šestim odstavkom 23. člena tega zakona;
3. ne pritrdi oznake CE v skladu s šestim odstavkom 23. člena tega zakona;
4. pritrdi oznako CE na izdelek, ki na podlagi tega zakona ni medicinski pripomoček (prvi odstavek 30. člena);
5. pritrdi oznako CE na medicinski pripomoček, ki ni skladen s tem zakonom oziroma jo pritrdi v nasprotju z določbami tega zakona (drugi in tretji odstavek 30. člena);
6. pritrdi oznako ali napis, podoben oznaki CE, ki je zavajajoč glede pomena ali grafičnega videza oznake CE (četrti odstavek 30. člena);
7. na medicinski pripomoček, embalažo ali navodila za uporabo pritrdi kakršno koli oznako tako, da prekrije oznako CE ali povzroči nejasnosti glede označevanja (peti odstavek 30. člena);
8. opravlja naloge priglašenega organa, ne da bi bil imenovan in priglašen v skladu s prvim odstavkom 34. člena tega zakona;
9. ne obvesti organa, pristojnega za medicinske pripomočke, oziroma mu ne predloži certifikatov ES v skladu s četrtim odstavkom 37. člena tega zakona;
10. ne obvesti organa, pristojnega za medicinske pripomočke, o certifikatih ES v skladu s petim odstavkom 37. člena tega zakona;
11. začne klinično raziskavo, če niso izpolnjeni pogoji iz 39. člena tega zakona in na podlagi tega zakona izdanimi podzakonskimi predpisi;
12. izvaja klinično raziskavo v nasprotju s 40. členom tega zakona in na njegovi podlagi izdanimi predpisi;
13. ne izpolnjuje pogojev iz 44. člena tega zakona;
14. se ne vpiše v register proizvajalcev medicinskih pripomočkov (prvi odstavek 45. člena);
15. ne izpolnjuje pogojev ali obveznosti iz tretjega, četrtega in petega odstavka 52. člena tega zakona;
16. opravlja promet na drobno z in vitro diagnostičnimi medicinskimi pripomočki za samotestiranje HIV izven lekarne (tretji odstavek 53. člena);
17. opravlja promet z medicinskimi pripomočki na drobno brez osebja z ustrezno poklicno kvalifikacijo in ustrezno usposobljenostjo za strokovno svetovanje (četrti odstavek 53. člena);
18. opravlja promet z medicinskimi pripomočki v nasprotju s sedmim odstavkom 53. člena tega zakona;
19. ne izpolnjuje pogojev iz tretjega in četrtega odstavka 54. člena tega zakona;
20. se ne priglasi organu, pristojnemu za medicinske pripomočke, v skladu s petim ali šestim odstavkom 54. člena tega zakona;
21. ovira prosti pretok medicinskih pripomočkov (55. člen);
22. ne izpolni obveznosti iz šestega odstavka 56. člena tega zakona;
23. oglašuje medicinski pripomoček v nasprotju s prvim ali tretjim odstavkom 58. člena tega zakona;
24. oglašuje medicinski pripomoček s podatki iz prvega odstavka 59. člena tega zakona;
25. pri oglaševanju medicinskih pripomočkov strokovni javnosti daje, ponuja ali obljublja darila, finančne ugodnosti ali materialne koristi, razen če so te majhne vrednosti (drugi odstavek 59. člena);
26. zavajajoče predstavlja lastnosti in namen uporabe medicinskih pripomočkov (tretji odstavek 59. člena);
27. daje vzorce medicinskih pripomočkov v nasprotju s četrtim odstavkom 59. člena tega zakona;
28. daje na trg ali v uporabo izdelke, predstavljene z lastnostmi medicinskega pripomočka, ki se na podlagi tega zakona ne razvrščajo med medicinske pripomočke (60. člen).
(2) Z globo od 700 do 7.000 eurov se za prekršek iz prejšnjega odstavka kaznuje samostojni podjetnik posameznik in posameznik, ki samostojno opravlja dejavnost.
(3) Z globo od 300 do 3.000 eurov se za prekršek iz prvega odstavka tega člena kaznuje odgovorna oseba pravne osebe ali odgovorna oseba samostojnega podjetnika posameznika.
XVI. PREHODNE IN KONČNE DOLOČBE
68. člen
(izdaja podzakonskih predpisov)
(1) Podzakonski predpisi na podlagi tega zakona se izdajo do začetka uporabe tega zakona.
(2) Do začetka uporabe tega zakona, se uporabljajo naslednji podzakonski predpisi, izdani na podlagi Zakona o medicinskih pripomočkih (Uradni list RS, št. 101/99, 70/00, 7/02, 13/02 – Zkrmi, 67/02, 47/04 – ZdZPZ in 31/06 – ZZdr-1), kolikor niso v nasprotju s tem zakonom ali če ta zakon ne določa drugače:
– Pravilnik o pogojih, ki jih morajo izpolnjevati specializirane prodajalne za promet z medicinskimi pripomočki na drobno (Uradni list RS, št. 73/00);
– Pravilnik o medicinskih pripomočkih (Uradni list RS, št. 71/03, 51/04 in 98/06);
– Pravilnik o in vitro diagnostičnih medicinskih pripomočkih (Uradni list RS, št. 47/02, 75/03 in 51/04);
– Pravilnik o oglaševanju zdravil in medicinskih pripomočkov (Uradni list RS, št. 76/01 in 105/08).
69. člen
(postopki po uveljavitvi zakona)
(1) Medicinski pripomočki, katerih proizvajalci oziroma predstavniki proizvajalcev imajo sedež v Republiki Sloveniji in so na trgu na dan začetka uporabe tega zakona, se vpišejo v register medicinskih pripomočkov v skladu s tem zakonom do 21. 9. 2010.
(2) Registri, vzpostavljeni po določbah Zakona o medicinskih pripomočkih (Uradni list RS, št. 101/99, 70/00, 7/02, 13/02 – ZKrmi, 67/02, 47/04 – ZdZPZ in 31/06 – ZZdr-1), se od začetka uporabe tega zakona upravljajo kot registri po tem zakonu, njihovo vsebino pa je treba uskladiti z določbami tega zakona do 21. 9. 2010.
(3) Priglašeni organ, ki je bil imenovan do začetka uporabe tega zakona, mora pridobiti imenovanje po tem zakonu najkasneje do 21. 9. 2010.
70. člen
(postopki pred uveljavitvijo zakona)
Postopki, ki so se začeli pred začetkom uporabe tega zakona, se dokončajo po določbah tega zakona.
71. člen
(razveljavitev)
Z dnem uveljavitve tega zakona preneha veljati Zakon o medicinskih pripomočkih (Uradni list RS, št. 101/99, 70/00, 7/02, 13/02 – ZKrmi, 67/02, 47/04 – ZdZPZ in 31/06 – ZZdr-1), ki se uporablja do začetka uporabe tega zakona.
72. člen
(uveljavitev zakona in začetek uporabe zakona)
Ta zakon začne veljati petnajsti dan po objavi v Uradnem listu Republike Slovenije, uporabljati pa se začne 21. marca 2010.
Št. 520-04/09-1/79
Ljubljana, dne 25. novembra 2009
EPA 579-V
Državni zbor
Republike Slovenije
dr. Pavel Gantar l.r.
Predsednik
“,”Jaka Verbic Miklic”,1521998220,1521998220,sl,12445,306,12423,43,0,NULL,,”Zakon o medicinskih pripomočkih, UL št. 98, 4.12.2009″,zakon-o-medicinskih-pripomockih-ul-st-98-4-12-2009,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521998501,1524652258
271,12446,”Pravilnik o pogojih za opravljanje dejavnosti prometa z zdravili na debelo “,”UL 46, 19/06/2009″,”
I. SPLOŠNE DOLOČBE
1. člen
(področje urejanja)
Ta pravilnik določa natančnejše pogoje, ki jih morajo poleg splošnih pogojev, določenih z zakonom, ki ureja področje trgovinske dejavnosti, glede kadrov, prostorov, opreme in vodenja dokumentacije izpolnjevati pravne in fizične osebe za opravljanje dejavnosti prometa z zdravili za uporabo v humani in veterinarski medicini na debelo na območju Republike Slovenije (v nadaljnjem besedilu: zdravila), postopek izdaje, spremembe in odvzema dovoljenja za opravljanje te dejavnosti ter strokovni nadzor nad izpolnjevanjem pogojev za opravljanje dejavnosti prometa z zdravili na debelo v skladu z Direktivo 2001/83/ES Evropskega parlamenta in Sveta z dne 6. novembra 2001 o zakoniku Skupnosti o zdravilih za uporabo v humani medicini (UL L št. 311 z dne 28. 11. 2001, str. 67), zadnjič spremenjeno z Direktivo 2008/29/ES Evropskega parlamenta in Sveta z dne 11. marca 2008 o spremembi Direktive 2001/83/ES o zakoniku Skupnosti o zdravilih za uporabo v humani medicini, glede Komisiji podeljenih izvedbenih pooblastil (UL L št. 81 z dne 20. 3. 2008, str. 51), (v nadaljnjem besedilu: Direktiva 2001/83/ES) in z Direktivo 2001/82/ES Evropskega parlamenta in Sveta z dne 6. novembra 2001 o zakoniku Skupnosti o zdravilih za uporabo v veterinarski medicini (UL L št. 311 z dne 28. 11. 2001, str. 1), zadnjič spremenjeno z Direktivo 2004/28/ES Evropskega parlamenta in Sveta z dne 31. marca 2004 o spremembi Direktive 2001/82/ES o zakoniku Skupnosti o zdravilih za uporabo v veterinarski medicini (UL L št. 136 z dne 30. 4. 2004, str. 58), (v nadaljnjem besedilu: Direktiva 2001/82/ES).
2. člen
(izrazi in definicije)
Poleg izrazov, ki so opredeljeni v 5. in 6. členu Zakona o zdravilih (Uradni list RS, št. 31/06 in 45/08; v nadaljnjem besedilu: zakon), se v tem pravilniku uporabljajo še izrazi, ki imajo naslednji pomen:
1. organ, pristojen za zdravila, je Javna agencija Republike Slovenije za zdravila in medicinske pripomočke;
2. dobre skladiščne prakse (DSP) so del sistema kakovosti, ki se nanaša na organizacijo, izvajanje in nadzor shranjevanja zdravil, z namenom zagotavljanja ohranjanja kakovosti zdravil;
3. odpoklic je odpoklic zdravila ali določene serije zdravila. Je vsaka aktivnost z namenom umika zdravila iz prometa in iz uporabe zaradi neustrezne kakovosti zdravila oziroma farmakovigilančnih razlogov. Odpoklic zdravila je lahko le delen, kar pomeni, da se odpoklic lahko izvede le pri določenih veletrgovcih z zdravili in uporabnikih zdravil ali pa se odpokliče le določena serija zdravila;
4. rok uporabnosti je časovno obdobje, v katerem se pričakuje, da bo zdravilo ob pravilnem skladiščenju skladno s specifikacijo, kot je ugotovljeno s študijami o stabilnosti, ki se opravijo na večjem številu serij izdelka;
5. serija je določena količina zdravila, ki je izdelana iz istovrstnih sestavin v okviru enega procesa ali vrste procesov v določenem obdobju;
6. številka serije je razločevalna kombinacija številk oziroma črk, ki enolično določa serijo, na primer na nalepkah, dokumentaciji serije in ustreznih potrdilih o analizi;
7. validacija je dokumentiran postopek preizkušanja in potrjevanja, da snov, postopek, metoda, sistem ali oprema dosega in bo dosegala pričakovane rezultate;
8. distribucija zdravil je postopek organizirane razdelitve in premeščanja zdravil od prostorov izdelave zdravil oziroma izdelovalca zdravila, direktno ali posredno, prek drugih pravnih ali fizičnih oseb, do kupca, do njegovega končnega uporabnika ali do vmesne prevzemne lokacije, z različnimi prevoznimi načini, direktno do kupca ali posredno, prek drugih pravnih ali fizičnih oseb.
3. člen
(promet na debelo)
(1) Promet z zdravili na debelo pomeni dejavnosti nakupa, shranjevanja, prodaje, vnosa, iznosa, uvoza ali izvoza zdravil, razen izdaje zdravil posameznim fizičnim in pravnim osebam za njihovo osebno uporabo ali uporabo pri opravljanju zdravstvene in veterinarske dejavnosti.
(2) Promet z zdravili na debelo lahko opravljajo pravne ali fizične osebe, ki izpolnjujejo predpisane pogoje in imajo veljavno dovoljenje organa, pristojnega za zdravila, za opravljanje dejavnosti prometa z zdravili na debelo (v nadaljnjem besedilu: veletrgovci).
(3) Veletrgovec mora pridobiti dovoljenje organa, pristojnega za zdravila, tudi za dejavnost izdelave zdravil, če namerava izvajati katerega od postopkov izdelave ali uvoz zdravil.
(4) Veletrgovci smejo kupovati zdravila le pri pravnih in fizičnih osebah, ki imajo dovoljenje za opravljanje dejavnosti izdelave ali prometa z zdravili na debelo ali druga ustrezna dovoljenja.
(5) Veletrgovci smejo prodajati zdravila le tistim pravnim in fizičnim osebam, ki imajo dovoljenje za opravljanje dejavnosti prometa z zdravili na debelo ali drobno ter lekarnami, v primeru prodaje zdravil izven območja Republike Slovenije pa druga ustrezna dovoljenja v skladu z zakonodajo teh držav.
(6) Veletrgovci lahko prodajajo zdravila tudi neposredno zdravstvenim zavodom oziroma pravnim in fizičnim osebam, ki imajo dovoljenje pristojnega organa za opravljanje zdravstvene dejavnosti, zdravila za uporabo v veterinarski medicini ter zdravila za uporabo v humani medicini, ki so namenjena za izjemno uporabo pri živalih pa veterinarskim in drugim organizacijam, pod pogoji, določenimi v zakonu in podzakonskih predpisih.
(7) Veletrgovci morajo omogočiti organu, pristojnemu za zdravila, ob vsakem času preverjanje izpolnjevanja vseh pogojev, navedenih v tem pravilniku.
(8) Zaradi varovanja zdravja ljudi morajo veletrgovci zagotavljati stalen in ustrezen izbor zdravil, s katerim zadoščajo zahtevam določenega geografskega območja in v ustrezno kratkem času dostavljati zahtevane dobave celotnemu zadevnemu območju.
4. člen
(predmet opravljanja dejavnosti)
(1) Veletrgovci lahko opravljajo promet z zdravili na debelo.
(2) Imetnikom ustreznih dovoljenj v Republiki Sloveniji, lahko veletrgovci prodajajo samo zdravila z ustreznim dovoljenjem iz 17. člena zakona.
5. člen
(razvrščanje zdravil glede na režim in pogoje shranjevanja)
(1) Glede na poseben režim shranjevanja, se zdravila razvrščajo v naslednje skupine:
– prepovedane droge skupine II in III;
– vnetljive in nevarne snovi;
– medicinski plini;
– radiofarmacevtski izdelki;
– rastlinske snovi.
(2) Glede na pogoje shranjevanja se zdravila razvrščajo v naslednji skupini:
– zdravila, ki se hranijo pri običajnih pogojih;
– zdravila, ki se hranijo pod posebnimi pogoji (npr. “hladna veriga”).
II. NAČELA IN SMERNICE DOBRE DISTRIBUCIJSKE PRAKSE
6. člen
(sistem zagotavljanja kakovosti)
Veletrgovci morajo vzpostaviti, izvajati in posodabljati učinkovit sistem zagotavljanja kakovosti pri vseh aktivnostih opravljanja svoje dejavnosti tako, da je v zagotavljanju sistema kakovosti aktivno udeleženo vodstvo in osebje notranjih organizacijskih enot.
7. člen
(osebje)
(1) Veletrgovci morajo glede osebja izpolnjevati naslednje pogoje:
– imajo obsegu dejavnosti primerno število s pogodbo zavezanih strokovnjakov z univerzitetno izobrazbo farmacevtske smeri, in, glede na naravo delovnega procesa, s pogodbo zavezane strokovnjake drugih ustreznih smeri;
– imajo določeno odgovorno osebo za sprejem, shranjevanje, izdajo in transport zdravil ter pregled dokumentacije, ki omogoča sledljivost zdravil. Odgovorna oseba mora imeti univerzitetno izobrazbo farmacevtske smeri.
(2) Če odgovorna oseba iz druge alinee prejšnjega odstavka nima univerzitetne izobrazbe farmacevtske smeri, mora imeti dodatna znanja, kakor jih določa drugi odstavek 49. člena Direktive 2001/83/ES oziroma drugi odstavek 53. člena Direktive 2001/82/ES. Če program študija ne vsebuje katerega od navedenih znanj, mora o njih odgovorna oseba predložiti ustrezna dokazila. Odgovorna oseba mora imeti tudi delovne izkušnje, ki jih določa tretji odstavek 49. člena Direktive 2001/83/ES oziroma tretji odstavek 53. člena Direktive 2001/82/ES.
(3) Veletrgovec je dolžan osebju in še posebej odgovorni osebi omogočiti stalno izobraževanje in usposabljanje.
8. člen
(prostori in oprema)
Veletrgovci morajo pri opravljanju svoje dejavnosti razpolagati z ustreznimi prostori in opremo v skladu z načeli dobre distribucijske prakse in načeli dobre skladiščne prakse.
9. člen
(dokumentacija)
(1) Veletrgovci morajo vzpostaviti, voditi in posodabljati pisne postopke, ki se nanašajo na celoten distribucijski proces in voditi evidence o zagotavljanju pogojev distribucije zdravil (kalibracije, kvalifikacije opreme, validacije, čiščenja in vzdrževanja prostorov …).
(2) Veletrgovci morajo voditi dokumentacijo in evidence iz prejšnjega odstavka na način, ki omogoča takojšen odpoklic zdravila iz prometa in nadzor reklamacij. Da se zagotovi sledljivost zdravila, mora biti zabeleženo vsako ravnanje z zdravilom.
(3) Dokumentacija iz prejšnjega odstavka mora vsebovati najmanj:
– datum vsakega prejetja oziroma izdaje zdravila;
– ime zdravila, farmacevtsko obliko, jakost in pakiranje;
– številko serije zdravila in datum izteka roka uporabnosti zdravila;
– količino prejetega oziroma izdanega zdravila;
– ime in naslov izdelovalca zdravila;
– rezultate analize kakovosti in datum sprostitve vsake serije zdravila;
– ime in naslov dobavitelja zdravila;
– ime in naslov prejemnika zdravila;
– ime in naslov družbe, odgovorne za transport zdravila.
(4) Dokumentacijo iz prejšnjega odstavka mora veletrgovec hraniti še najmanj eno leto po izteku roka uporabnosti ali po umiku zdravila iz prometa oziroma dlje, če tako določajo predpisana načela dobre distribucijske prakse.
(5) Veletrgovci z zdravili za uporabo v veterinarski medicini in z zdravili za uporabo v humani medicini za izjemno uporabo v veterinarski medicini morajo pošiljati četrtletna poročila Veterinarski upravi Republike Slovenije.
(6) Poročila iz prejšnjega odstavka morajo vsebovati najmanj:
– količino izdanih zdravil za vsako posamezno zdravilo;
– posameznega prejemnika z navedbo podatkov obdobja, na katero se poročilo nanaša;
– navedbo odgovorne osebe za poslovanje z zdravili.
Poročila je treba posredovati v elektronski obliki, katere standard določi Veterinarska uprava Republike Slovenije.
(7) Veletrgovec mora vzpostaviti, preverjati in posodabljati pisne postopke skladno z načeli dobre distribucijske prakse.
10. člen
(smernice dobre distribucijske prakse)
Veletrgovec mora pri izvajanju dejavnosti upoštevati smernice dobre distribucijske prakse.
III. POSTOPEK ZA PRIDOBITEV DOVOLJENJA
11. člen
(vloga)
(1) Postopek za pridobitev dovoljenja za promet z zdravili na debelo (v nadaljnjem besedilu: dovoljenje) se začne z vlogo za pridobitev dovoljenja, ki jo predlagatelj predloži organu, pristojnemu za zdravila, v fizični ali elektronski obliki.
(2) Vloga iz prejšnjega odstavka mora vsebovati naslednje podatke in dokumente:
– kratek opis predlagatelja in aktivnosti, ki jih predlagatelj namerava izvajati (npr. uvoz, izvoz, vnos, iznos, nakup, prodaja, skladiščenje, distribucija, kontrola kakovosti);
– navedbo skupin zdravil glede na poseben režim in pogoje shranjevanja;
– navedbo dejavnosti prometa z zdravili na debelo glede na promet z:
– rizičnimi zdravili;
– ostalimi zdravili;
– zdravilnimi učinkovinami;
– sistemizacijo in zasedbo delovnih mest v skladu s tem pravilnikom;
– pogodbo z odgovorno osebo in drugimi osebami iz 7. člena tega pravilnika, v obsegu, ki dokazuje zaposlitev;
– dokazila o razpolaganju s poslovnimi prostori, opis poslovnih prostorov in tloris prostorov v merilu, ki ustreza dejanskemu dimenzijskemu razmerju prostorov;
– dokazila o razpolaganju z opremo in tehnične podatke o opremi;
– seznam pisnih navodil z opisom standardnih operativnih postopkov o izvajanju dobre distribucijske prakse, dobre skladiščne prakse, dobre transportne prakse in dobre kontrolne laboratorijske prakse (če izvaja kontrolo kakovosti zdravil v lastnem laboratoriju) ter o postopku odpoklica zdravila iz prometa in o postopku uničenja zdravil;
– pisno izjavo predlagatelja, da bo za odpadna zdravila zagotovil prevzemanje in nadaljnje ravnanje v skladu s predpisi, ki urejajo ravnanje z odpadnimi zdravili;
– v primeru uvoza zdravil, pogodbo s pravno ali fizično osebo, ki ima dovoljenje organa, pristojnega za zdravila, za opravljanje dejavnosti analiznega preskušanja zdravil, če kontrole kakovosti ne opravlja v lastnem laboratoriju;
– dokazilo o plačilu stroškov postopka;
– dokazilo o plačilu predpisane upravne takse za vlogo in izdajo odločbe.
12. člen
(dopolnitev vloge)
Če organ, pristojen za zdravila, ugotovi, da je vloga iz prejšnjega člena nepopolna, v 30 dneh po prejemu vloge zahteva dopolnitev vloge in hkrati določi rok, v katerem jo mora predlagatelj dopolniti.
13. člen
(preverjanje izpolnjevanja predpisanih pogojev)
(1) Po ugotovitvi uradnih oseb organa, pristojnega za zdravila, da je vloga iz 11. člena tega pravilnika formalno popolna, organ, pristojen za zdravila, s sklepom imenuje najmanj dvočlansko komisijo za pregled izpolnjevanja pogojev, ki izvede ogled pri predlagatelju, in določi rok izvedbe ogleda.
(2) O poteku pregleda se vodi zapisnik, ki ga podpišejo vsi člani komisije in predlagatelj postopka. Komisija da pisno mnenje o izpolnjevanju pogojev v petnajstih dneh od pregleda. Zapisnik o pregledu je sestavni del mnenja.
14. člen
(izdaja dovoljenja)
(1) Na podlagi pisnega mnenja komisije iz prejšnjega člena organ, pristojen za zdravila, v 90 dneh po prejemu popolne vloge iz 11. člena tega pravilnika odloči o izdaji dovoljenja. Dovoljenje za opravljanje dejavnosti prometa z zdravili na debelo se izda po posameznih skupinah zdravil iz 5. člena tega pravilnika in vrsto aktivnosti iz 3. člena tega pravilnika.
(2) Organ, pristojen za zdravila, lahko kadarkoli med postopkom do izdaje dovoljenja za opravljanje dejavnosti prometa z zdravili na debelo od predlagatelja zahteva dodatna pojasnila ali dokumentacijo, in postavi dodatni rok za odgovor oziroma za odpravo pomanjkljivosti. Čas do izteka dodatno postavljenega roka se ne šteje v 90-dnevni rok za izdajo odločbe.
IV. POSTOPEK V ZVEZI S SPREMEMBO POGOJEV, KI SO BILI PODLAGA ZA IZDAJO DOVOLJENJA
15. člen
(sprememba pogojev)
(1) Imetnik dovoljenja mora o vsaki spremembi pogojev, ki so bili podlaga za izdajo dovoljenja za promet z zdravili na debelo, takoj, najpozneje pa v 15 dneh od nastanka spremembe, pisno obvestiti organ, pristojen za zdravila, in mu predložiti podatke in dokumente iz 11. člena tega pravilnika, ki se na to spremembo nanašajo.
(2) Farmacevtsko nadzorstvo glede na vrsto priglašene spremembe oceni, ali je potrebno ponovno preverjanje izpolnjevanja pogojev za opravljanje dejavnosti prometa z zdravili na debelo in izvede postopek iz 13. člena tega pravilnika.
(3) V primeru ocene organa, pristojnega za zdravila, da poseben ugotovitveni postopek ni potreben, organ, pristojen za zdravila, o priglašeni spremembi odloči v 30 dneh od prejema popolne vloge.
V. NADZOR
16. člen
(vrste nadzora)
(1) Farmacevtsko nadzorstvo v skladu z zakonom pri imetnikih dovoljenja za promet z zdravili na debelo opravlja redne in izredne strokovne nadzore.
(2) Redni strokovni nadzor farmacevtsko nadzorstvo izvaja po uradni dolžnosti na 2 do 3 leta. V primeru ugotovitve neizpolnjevanja pogojev oziroma bistveno spremenjenih okoliščin, izda odločbo, s katero se lahko že izdana odločba odpravi, razveljavi ali spremeni.
(3) Izredni strokovni nadzor farmacevtsko nadzorstvo izvaja v primeru ugotovitve kršenja ali obstoja utemeljenega suma kršenja določil dobre distribucijske prakse.
VI. POSTOPEK PRIGLASITVE DEJAVNOSTI PROMETA Z ZDRAVILI NA DEBELO V REPUBLIKI SLOVENIJI
17. člen
(vloga)
(1) Pravne oziroma fizične osebe, ki so pridobile dovoljenje za opravljanje dejavnosti prometa z zdravili na debelo v katerikoli državi članici Evropske unije in bodo opravljale promet z zdravili na debelo v Republiki Sloveniji, se morajo pred začetkom opravljanja dejavnosti prometa z zdravili na debelo v Republiki Sloveniji priglasiti pri organu, pristojnemu za zdravila.
(2) Vloga za priglasitev mora vsebovati:
– spremni dopis s kratko predstavitvijo predlagatelja;
– veljavno dovoljenje za opravljanje dejavnosti prometa z zdravili na debelo;
– navedbo aktivnosti iz 3. člena tega pravilnika, ki jih želi izvajati v Republiki Sloveniji;
– navedbo skupin zdravil iz 5. člena tega pravilnika, ki so predmet prometa z zdravili na debelo v Republiki Sloveniji;
– navedbo lokacij skladišč zdravil;
– navedbo distribucijske poti in območja poslovanja;
– kontaktno osebo za 24-urno dosegljivost;
– pisno izjavo predlagatelja, da bo za odpadna zdravila zagotovil prevzemanje in nadaljnje ravnanje v skladu s predpisi, ki urejajo ravnanje z odpadnimi zdravili.
(3) Predlagatelj vlogo iz prejšnjega odstavka predloži v fizični ali elektronski obliki.
(4) Če organ, pristojen za zdravila, ugotovi, da je vloga iz drugega odstavka tega člena nepopolna, v 30 dneh po prejemu vloge zahteva dopolnitev vloge in hkrati določi rok, v katerem jo mora predlagatelj dopolniti.
(5) Rok za izdajo potrdila, s katerim se pravno ali fizično osebo vpiše v uradno evidenco pravnih in fizičnih oseb, ki so pridobile dovoljenje za opravljanje dejavnosti prometa z zdravili na debelo v državi članici Evropske unije in so se priglasile pri organu, pristojnem za zdravila v Republiki Sloveniji, je 90 dni od popolne vloge.
(6) Organ, pristojen za zdravila, pred izdajo potrdila, s katerim se pravno ali fizično osebo vpiše v uradno evidenco pravnih in fizičnih oseb, ki so pridobile dovoljenje za opravljanje dejavnosti prometa z zdravili na debelo v državi članici Evropske unije in so se priglasile pri organu, pristojnem za zdravila v Republiki Sloveniji, lahko kljub popolnosti vloge od predlagatelja zahteva dodatna pojasnila ali dokumentacijo, ter postavi dodatni rok za odgovor. Čas do izteka dodatno postavljenega roka se ne šteje v 90-dnevni rok za izdajo potrdila.
VII. PREHODNE IN KONČNE DOLOČBE
18. člen
(uskladitev)
Imetniki dovoljenj za promet z zdravili na debelo morajo uskladiti svojo organiziranost in delovanje s tem pravilnikom v treh mesecih po njegovi uveljavitvi.
19. člen
(prenehanje uporabe)
Z dnem uveljavitve tega pravilnika prenehata veljati Pravilnik o natančnejših pogojih za promet na debelo z zdravili (Uradni list RS, št. 75/03) in Pravilnik o pogojih za promet na debelo z zdravili za uporabo v veterinarski medicini (Uradni list RS, št. 75/00 in 1/04).
20. člen
(uveljavitev pravilnika)
Ta pravilnik začne veljati petnajsti dan po objavi v Uradnem listu Republike Slovenije.
“,”Jaka Verbic Miklic”,1521998580,1521998580,sl,12446,306,12424,43,0,NULL,,”Pravilnik o pogojih za opravljanje dejavnosti prometa z zdravili na debelo, UL št. 46, 19.6.2009″,pravilnik-o-pogojih-za-opravljanje-dejavnosti-prometa-z-zdravili-na-debelo-ul-st-46-19-6-2009,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521998656,1523616053
272,12447,”Kodeksi sodelovanja in javne objave prenosov vrednosti”,”Z deležniki na vseh ravneh sodelujemo etično in transparentno”,”
Dopis organizatorjem strokovnih dogodkov – marec 2024
Javna objava prenosov vrednosti ZD, ZO in DB 2022
Javna objava prenosov vrednosti ZD, ZO in DB 2023
Javna objava prenosov vrednosti ZD, ZO in DB 2024
Javna objava prenosov vrednosti društvom bolnikov
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
“,”Jaka Verbic Miklic”,1522014900,1751972400,sl,12447,306,12302,43,0,NULL,,Kodeksi,kodeksi,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1522014973,1751980150
273,12449,”3. strateška konferenca Vrednost inovacij”,”Zdravje – bogastvo posameznika, gospodarstva in celotne družbe”,”
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, ki združuje 21 inovativnih farmacevtskih podjetij v Sloveniji, svoja prizadevanja in bistvo že tretje strateške konference Vrednost inovacij povzema v dveh ključnih besedah, ki zaznamujeta status družbe: Zdravje in rast. Skrb za zdravje ljudi je ena osrednjih skrbi vsake sodobne družbe.
Danes se soočamo z dvema na videz protislovnima pojavoma. Po eni strani se življenjska doba ljudi podaljšuje, saj se je pričakovana življenjska doba moških v zadnjih 60 letih zvišala za devet, žensk pa kar za 11 let. Po drugi strani se zmanjšuje število zdravih let življenja, kar z drugimi besedami pomeni, da vse mlajši iščemo zdravstveno varstvo zaradi različnih razlogov, v marsičem povezanih tudi z življenjskim slogom.
K podaljševanju pričakovane življenjske dobe je uvajanje inovativnih zdravil prispevalo velik delež. Iz tega lahko sklepamo, da so prizadevanja farmacevtskih družb za zdravje in boljše življenje ljudi eden izmed ključnih faktorjev. Da skrb za zdravje ni samo nujni strošek, temveč na drugi strani ponuja tudi priložnost za gospodarsko rast, je na današnji konferenci poudarila doc. dr. Petra Došenovič Bonča z Ekonomske fakultete v Ljubljani. Zdravstvena industrija je ena najbolj intenzivnih panog glede na vlaganja v raziskave in razvoj in tako je skrb za zdravje lahko tudi eno osrednjih gonil gospodarske rasti. Industrija zdravja prispeva velik delež k vsem segmentom rasti: tako je raziskava dr. Denisa Ostwalda iz leta 2013 pokazala, da je v letu 2012 industrija zdravja v Nemčiji prispevala 11 odstotkov bruto dodane vrednosti v gospodarstvu, 7 odstotkov izvoza, kar 20 odstotkov končne porabe in 15 odstotkov celotne zaposlenosti v državi. Današnja konferenca je v središče postavila bolnike, saj so bolniki tisti, ki inovacije najbolj potrebujejo in pri razvoju inovacij tudi sodelujejo. Ti danes veliko bolje poznajo in obvladujejo svoje bolezni ter aktivneje prispevajo k izboljševanju svojega zdravstvenega stanja kot v preteklosti. Od vseh deležnikov v zdravstvu pričakujejo daljšo življenjsko dobo, upočasnitev napredovanja bolezni ter manj stranskih učinkov in hospitalizacij.

Poleg tehnoloških inovacij in razvoja novih terapij so za vzdržnost zdravstvenega sistema in kakovostno obravnavo potrebne tudi organizacijske inovacije, torej nove metode obravnave ter izboljšane poti bolnika skozi zdravstveni sistem. Ena takšnih, zdaj že dobro uveljavljenih sprememb, so referenčne ambulante. Kot je povedala doc. dr. Antonija Poplas Susič, referenčne ambulante na kratki rok prinašajo nekaj dodatnih stroškov zaradi zaposlitve večjega števila medicinskih sester, a te opravijo pomembno preventivno delo, poskrbijo za vzgojo bolnikov, da ti redno in pravilno jemljejo zdravila, zaradi česar so redkeje pri zdravniku, verjetnost poslabšanja zdravstvenega stanja je manjša, a tudi spremljajoče faktorje tveganja prepoznajo hitreje in zato lahko pravočasno ukrepajo. Vse to pa pomembno vpliva na zdravje, kakovost življenja kroničnih bolnikov in dolgoročno pomeni tudi manjše stroške zdravstvene blagajne.
Nujne so sistemske rešitve za zagotavljanje uvajanja organizacijskih in tehnoloških inovacij, pri čemer so oboje pomembne tako za bolnike kot za vzdržnost zdravstvenega sistema, so se strinjali udeleženci okrogle mize Samo Fakin, dr. med., direktor Zavoda za zdravstveno zavarovanje Slovenije, doc. dr. Antonija Poplas Susič, specialistka družinske medicine, strokovna direktorica Zdravstvenega doma Ljubljana, doc. dr. Petra Došenović Bonča z Ekonomske fakultete v Ljubljani, Aladar Belec iz Društva revmatikov Slovenije in Anja Šalehar, mag. farm., članica uprave Foruma. Organizacijske spremembe se praviloma uvajajo bolj postopoma in z več napora, a na dolgi rok prinašajo pomembne finančne in procesne učinke, vplivajo na kakovost obravnave bolnikov in zagotavljajo sredstva za tehnološke inovacije in inovativna zdravila. Te pa na dolgi rok prav tako nižajo stroške zdravljenja in zdravja družbe. Zato ni dovolj, da se pomena inovacij samo zavedamo; prav bi bilo, da te dobijo jasne spodbude, tako na makroekonomski ravni kot na ravni zdravstvenega sistema in na ravni izvajalcev.
S staranjem prebivalstva narašča pojavnost bolezni, povezanih s staranjem; predvidoma se bo v Evropi pojavnost Alzheimerjeve bolezni do leta 2050 podvojila na 7,5 milijona ljudi, projekcije napovedujejo 400 tisoč bolnikov z novo odkritim rakom med letoma 2010 in 2020. Kar 75 % denarja, skupaj preko 700 milijard evrov, za zdravstveno oskrbo v Evropi se porabi za zdravljenje kroničnih bolezni.
Učinkovito obvladovanje bolezni sodobnega časa pomeni večja vlaganja, ne samo v zdravje, ampak v celotno industrijo zdravja. Bolniki bodo pričakovali vse več inovacij, ta vlaganja pa se bodo vračala v obliki splošne gospodarske rasti. Kot je poudarila predsednica Foruma, Nataša Jenčič, »inovativna farmacevtska industrija med deležniki v zdravstvu igra pomembno vlogo; v preteklosti so zdravila pomembno doprinesla k podaljšanju življenjske dobe, danes v ospredje vedno bolj prihaja doprinos k izboljšanju kakovosti življenja in preprečevanju zapletov. Vse skupaj pa pomembno izboljšuje blaginjo celotne družbe.«
Foto: Jernej Lasič
“,”Jaka Verbic Miklic”,1413437580,1413437580,sl,12449,306,12448,43,0,NULL,,”3. strateška konferenca Vrednost inovacij”,3-strateska-konferenca-vrednost-inovacij,Post,”/sites/43/files/images/news/3. strateska/2014-10-15_Forum_za_farmacevte-90271_b.jpg”,1,0,1522042463,1522491282
275,12464,”EFPIA in Evropska komisija sofinancirata projekt »IMI2« “,”O javno-zasebnem partnerstvu, poslanstvu in viziji projekta »IMI2«”,”
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ, ki združuje 21 inovativnih farmacevtskih družb, vas obvešča o prvem pozivu k sodelovanju v strokovnemu delu raziskovalnega projekta IMI2 (Innovative Medicines Initiative – v slovenskem jeziku: Inovativna Medicinska Iniciativa). Evropska zveza farmacevtske industrije in združenj (EFPIA) skupaj z Evropsko komisijo v okviru javno-zasebnega partnerstva, poimenovanega IMI2, že drugič sofinancira razvojne in raziskovalne projekte s področja razvoja najpotrebnejših zdravil, pa tudi druge projekte na področju zdravstva, ki uresničujejo strategiji Evropa 2020 in Obzorje 2020.
Poslanstvo projekta IMI je omogočiti in spodbujati integrirani pristop k raziskavam in razvoju na področju celotnega zdravstva ter podpreti raziskovalne projekte, ki v iskanju najboljših rešitev povezuje institucije ali celo države. Z 3,276 milijarde evrov sredstev (IMI2), kar je za polovico več kot v prejšnjem obdobju (IMI1), bodo lahko izpeljani raziskovalni projekti, ki jih posamezne institucije sicer ne bi mogle izpeljati same. Bolje izkoriščen bo tako tudi potencial, ki ga prinašajo prelomni znanstveni dosežki na področju razvoja zdravil. Z vključitvijo vseh pomembnejših deležnikov bo uresničitev vizije projekta IMI2 – omogočiti bolniku na področju prioritetnih bolezni pravo terapijo ob pravem času – boljša, učinkovitejša in bolje prilagojena potrebam družbe. IMI2 vzpostavlja transparentno platformo za lažje vključevanje in koordinirano sodelovanje vseh ključnih deležnikov v zdravstvenem sistemu, tako zdravnikov, raziskovalcev, regulatorjev, bolnikov in plačnikov. Omogočila bo prenos in vključevanje znanstvenih dosežkov v inovativne, učinkovite produkte, strategije, ukrepe in storitve.
Raziskovalni projekti bodo prinesli orodja, metode za preventivo in nove terapevtske možnosti, ki bodo širile prakso personaliziranega zdravljenja in preventive. Z zagotavljanjem okvira, potrebnega za podporo sodelovanja med znanstveniki, regulatorji, plačniki, bolniki, izvajalci zdravstvenih storitev in gospodarstvom, bo IMI2 omogočil, da bodo raziskave in njihovi izsledki vključeni v rešitve, ki bodo lahko uporabljene za konkretne odgovore na trenutno največje izzive v zdravstvu. Iniciative ne bodo osredotočene izključno na razvoj novih zdravil, ampak bodo stremele k zagotavljanju celovitega in posamezniku prilagojenega paketa zdravljenja ter pripravi različnih orodij, kot na primer orodja za lažjo oceno stroškov in koristi, za nadzor raziskav, za boljšo integracijo podatkov o poteku in izidih zdravljenja. Tako bodo prebivalci EU tudi v zrelejšem življenjskem obdobju bolj zdravi in bodo lahko prispevali k produktivnosti celotne družbe. IMI2 bo prispeval k ohranitvi in oživitvi raziskav in dejavnosti na družbeno pomembnih področjih, ki trenutno, zaradi gospodarske krize, trpijo zaradi zmanjšanja investicij.
IMI2 bo osredotočen na več različnih znanstvenih izzivov, za njihovo financiranje in uspešno izvedbo pa so ključni kriteriji:
1) povezovanje različnih deležnikov v skupnem raziskovalnem projektu (javno-zasebna partnerstva);
2) da je raziskava v okviru prioritet strategij Evropa 2020 in Svetovne zdravstvene organizacije;
3) čezmejno sodelovanje, znotraj EU ali širše, ki bo povečalo sinergije in zmanjšalo podvajanje raziskovalnih prizadevanj.
Ključna
Ključna področja raziskovanja lahko razdelimo na 4 glavna področja:
1) Raziskave novih tarč in bioloških označevalcev (biomarkerjev)
Področje zajema identifikacijo in validacijo novih ali alternativnih konceptov tarčnega zdravljenja, biomarkerjev in testov.
2) Sprejetje inovativnih paradigem kliničnih preskušanj
Zajema vzpostavitev okvirov s točno določenimi pravili, etičnimi standardi ter ukrepi za varovanje podatkov, ki bodo podpirali interakcije med različnimi ključnimi deležniki, vključeno z bolniki, udeleženimi v kliničnem razvoju novih zdravil. Eden izmed ciljev bo tudi razvoj/določitev novih kliničnih izidov zdravljenja, ki bodo bolje odražali vrednost zdravljenja za bolnika in plačnika.
3) Razvoj novih zdravil
Načrtovanje in izvajanje raziskav z namenom odkritja intervencij, ki bi lahko prinesle največje izboljšanje izidov zdravljenja s perspektive bolnika in zdravstvenega tima pri boleznih, ki predstavljajo veliko breme za bolnike in družbo.
4) Programi podpore bolnikom za izboljšanje sodelovanja pri zdravljenju
Področje zajema raziskave obnašanja bolnikov, da bi bolje razumeli ovire za sodelovanje pri zdravljenju, in načrtovanje prilagojenih rešitev, ki bodo bolnikom omogočile aktivnejšo vlogo pri zdravljenju.
Projekt IMI2 za zgoraj našteta raziskovalna področja v evropski prostor prinaša 3,276 milijarde evrov v obdobju 2014–2024, stroški za raziskave so kriti v celoti (+25 odstotkov za kritje ostalih materialnih stroškov).
Prvi razpisi zanje bodo objavljeni predvidoma septembra 2014.
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ (Forum) že 12 let združuje 21 inovativnih farmacevtskih družb, ki imajo skupaj več kot 50-odstotni vrednostni tržni delež v Sloveniji in zaposlujejo preko 700 visoko usposobljenih strokovnjakov. Poslanstvo Foruma je zagotoviti oskrbo z najnovejšimi inovativnimi, učinkovitimi in varnimi zdravili ter storitvami v Sloveniji. Pri tem stremimo k temu, da je dostop do zdravil in inovativnih terapij bolnikom zagotovljen v sistemu, ki je obenem finančno vzdržen in učinkovit v skrbi za zdravje ljudi.
Kot član EFPIA, vas s strani Foruma vabimo in spodbujamo kot potencialne partnerje v slovenskem prostoru, da se v projekt vključite v strokovnem delu, ki ga že pokrivate, ali v delu, ki predstavlja vaš bodoči strateški razvoj. V skladu s svojim poslanstvom v Forumu pomagamo pri predstavitvi projektov IMI2 ter njihovem kar najboljšem vključevanju v razvoj slovenskih razvojnih institucij, znanj in zadovoljevanju potreb nacionalnega zdravstvenega sistema. Pri vključevanju v raziskovalne projekte IMI2 vam želimo obilo uspeha.
“,”Jaka Verbic Miklic”,1404910800,1404910800,sl,12464,306,12463,43,0,NULL,,”EFPIA in Evropska komisija sofinancirata projekt »IMI2« “,efpia-in-evropska-komisija-sofinancirata-projekt-imi2,Post,”/sites/43/files/images/news/IMI2/EFPIA in Evropska komisija sofinancirata projekt IMI2 .jpg”,1,0,1522068495,1522771344
277,12466,”Pomembne povezave”,”Hiter dostop do informacij o zdravilih in farmacevtski industriji”,”
Javna agencija Republike Slovenije za zdravila in medicinske pripomočke (JAZMP)
Evropska federacija farmacevtske industrije in združenj (EFPIA)
Ameriško združenje farmacevtskih proizvajalcev (PhRMA)
Mednarodna federacija farmacevtskih proizvajalcev in združenj (IFPMA)
Evropska agencija za zdravila (EMA)
Spletna stran s pomembnimi informacijami o cepljenju – www.cepljenje.info
“,”Jaka Verbic Miklic”,1522087560,1522087560,sl,12466,306,12305,43,0,NULL,,Povezave,povezave,Post,”/sites/43/files/images/O nas/Povezave/Povezave.jpg”,1,0,1522087649,1579850093
284,12491,”Zdravje in rast – usmeritve EFPIA in FIRDPC”,” “,”
Prihajajoče volitve evropskih poslancev so znova velika priložnost za javno razpravo o prihodnosti Evrope in Evropske unije. To je obenem tudi priložnost, da problematiko zdravja, zdravstvenih sistemov in politik postavimo ponovno na sam vrh zastavljenih prioritet, saj gre za eno usodnejših vprašanj evropskega razvoja v prihodnje.
Evropsko združenje farmacevtskih podjetij (EFPIA) je zato pripravilo platformo in usmeritve z naslovom Zdravje in rast, ki jih podpiramo tudi v Mednarodnem forumu znanstvenoraziskovalnih farmacevtskih družb in ki temeljijo na treh stebrih:
• prizadevanju za boljše rezultate zdravljenja,
• za stabilno financiranje zdravstva in
• vzdržen družbeni sistem.
EFPIA in Forum si bosta zato v javnih razpravah o bodoči usodi evropskega zdravja in zdravstva prizadevala za rešitve, ki bodo med seboj usklajeno zagotovile razvoj na navedenih treh ključnih področjih.
Zaradi tega želimo za začetek te razprave na temelju platforme ZDRAVJE IN RAST opozoriti evropske odločevalce o zdravstvu na naslednjih 10 ključnih dejstev o zdravstvu v Evropi:
1. Vsak Evropejec v svojem življenju povprečno preživi 18,4 leta z boleznimi in poškodbami, kar za celotno prebivalstvo Evrope pomeni 9 milijard let. Ta številka se je v absolutnem in relativnem merilu v obdobju 1990–2010 povečevala v vseh 28 članicah EU, razen v dveh. Zaradi tega je vse več Evropejcev omejenih pri njihovih dnevnih aktivnostih, kar vpliva na evropski ekonomski sistem, tako na mikro kot na makro ravni.
2. Kronične bolezni predstavljajo 75 odstotkov vseh stroškov (v vrednosti 700 milijard evrov) evropskih zdravstvenih sistemov in prinašajo 7-odstotno izgubo BDP-ja v nekaterih državah članicah EU. Vsi dejavniki tveganja za nastanek kroničnih boleznih (starost, urbanizacija itd) se bodo samo še krepili. Zgodnje in učinkovito jemanje zdravil izboljšuje rezultate zdravljenja in znižuje stroške v vseh sistemih.
3. Države članice EU (27) porabijo veliko večji delež socialnih izdatkov za zdravljenje bolezni in nadomestila za poškodbe kot pa za transfere za brezposelne. Zaradi tega so bolezni veliko večja obremenitev za nacionalne proračune kot brezposelnost.
4. Družbene spremembe – starajoče se prebivalstvo in vse bolj nezdravi življenjski slogi – pomenijo največje izzive za prihodnost. Staranje prebivalstva povečuje prevlado bolezni, ki jih to povzroča (predvidevamo dvakratno povečanje Alzheimerjeve bolezni v pozni fazi na 7,5 milijona ljudi v letu 2050), medtem ko bodo spremembe v načinu življenja povečale število na novo obolelih ljudi za rakom (400 tisoč novih bolnikov med 2010 in 2020).
5. Uspešnost zdravljenja se zelo razlikuje med posameznimi državami EU. V letu 2010 je bila razlika v pričakovani življenjski dobi med Španijo in Romunijo 9 let, kar izvira iz velikih razlik v dostopnosti do zdravstvenih storitev in zdravil.
6. Zdravila niso glavni vir povečanja stroškov zdravljenja. V zadnjem desetletju so bili stroški za zdravila manj kot 15 odstotkov vseh stroškov za zdravstvo v Evropi. Zaradi konkurenčnosti na trgu kot tudi zaradi omejevanja rasti stroškov je povprečna cena zdravil padla za 16 odstotkov od leta 2000, medtem ko so se povprečne cene proizvodov zvišale za 25 odstotkov.
7. Zdravje je globalni trg priložnosti za rast. Povpraševanje po zdravstvenih storitvah raste dvakrat hitreje kot povpraševanje v drugih ključnih panogah v Evropi. Več kot 70 odstotkov povečanja uporabe zdravil v letih 2011–2016 bo prišlo z rastočih trgov. To je tudi priložnost za rast vodilnih svetovnih podjetij, ki prihajajo iz Evrope.
8. Farmacevtski proizvodi pomenijo najboljši vzvod za trgovinsko ravnovesje v visokotehnoloških industrijskih sektorjih v EU. V letu 2012 je farmacevtska industrija ustvarila pozitivno trgovinsko bilanco v vrednosti več kot 54,4 milijarde evrov, s čimer je močno presegla druge visokotehnološke industrije kot telekomunikacije, elektronika itd.
9. Produktivnost zaposlenih je najvišja v farmacevtski industriji. Ta sektor močno prekaša druge vodilne industrije v dveh ključnih kazalcih, v dodani vrednosti na zaposlenega in pri dobičku na zaposlenega.
10. Evropske vlade zaostajajo za drugimi razvitimi območji, ko gre za njihove zaveze glede vlaganj v zdravstvene sisteme. Stroški evropskih držav za raziskave in razvoj v zdravstvu znašajo 0,07% BDP, kar je precej manj od ZDA (0,24%), Kanade (0,11%) ali Južne Koreje (0,08%).
Ključno za razvoj in blaginjo držav Evropske unije je, da poskrbimo za okolje, ki bo inovativnim farmacevtskim družbam še naprej omogočala vlaganje v raziskave in razvoj, saj to na eni strani prispeva k spodbujanju gospodarske rasti, na drugi pa zagotavlja inovativna zdravila, ki aktivno prispevajo k obvladovanju kroničnih in drugih obolenj. Dolgoročno naravnane politike in razvojno usmerjeni ukrepi pomembno prispevajo k bolj zdravi družbi ter s tem k razvoju produktivnosti in konkurenčnosti Evropske unije in Slovenije.
“,”Jaka Verbic Miklic”,1398182400,1398182400,sl,12491,306,12490,43,0,NULL,,”Zdravje in rast – usmeritve EFPIA in FIRDPC”,zdravje-in-rast-usmeritve-efpia-in-firdpc,Post,”/sites/43/files/images/news/Zdravje in rast/Zdravje in rast – usmeritve EFPIA in FIRDPC.jpg”,1,0,1522167134,1522771444
285,12493,”Stališče o terapevtskih skupinah zdravil “,” “,”
Forum kot združenje inovativne farmacevtske industrije lahko zavzame le splošno stališče k uvajanju terapevtskih skupin zdravil (TSZ), ne more pa komentirati odločitev posameznih članic o morebitnem znižanju cen zdravil zaradi uvedbe TSZ, ker je to stvar poslovne politike vsake od družb članic.
Inovativna farmacevtska industrija je pri zniževanju izdatkov za zdravila, ki sicer v primerjavi z drugimi stroški obsegajo le manjši del (12,1% v letu 2012) vseh izdatkov javne zdravstvene blagajne in obenem predstavljajo tudi najbolj regulirani del zdravstvenih izdatkov, v zadnjih nekaj letih že prispevala preko 120 milijonov evrov. Pri tem je potrebno izpostaviti, da delež stroškov za zdravila že zadnjih nekaj let upada, kar pomeni, da se prihranki ustvarjeni z nižanjem cen zdravil, ne porabljajo za uvajanje novih zdravil, poleg tega pa je Slovenija ena redkih držav, kjer lahko beležimo padec stroškov za zdravila. Strošek razvoja novega zdravila se giblje okrog 1,8 milijarde ameriških dolarjev, zato bi nadaljnje, predvsem pa tako drastično zniževanje cen zdravil, kot ga pričakuje ZZZS, zaradi referenčnega statusa Slovenije, ki ga predstavljamo v nadaljevanju, vplivalo tudi na področje vlaganj v raziskave in razvoj. To bi dolgoročno upočasnilo razvoj novih zdravil in s tem privedlo do kasnejšega dostopa bolnikov do njih.
Čeprav je Slovenija majhen trg, je obenem tudi referenčna država za še 14 drugih držav s skupaj 228 milijoni prebivalcev. Podružnice inovativnih farmacevtskih podjetij v Sloveniji so del globalnih družb, zato lahko pričakujemo, da ne bodo dobile soglasja svojih matičnih družb (principalov) k dodatnemu nižanju cen. Zato obstaja tveganje, da bo novo zdravilo poslej enačeno s starejšim zdravilom na tržišču, kar utegne zmanjšati dostopnost do novejših zdravil ter zmanjšati vlaganja v raziskave in razvoj novih zdravilnih učinkovin, to pa po drugi strani bistveno omejuje konkurenčnost inovativne farmacevtske industrije in jo postavlja v neenakopraven položaj na trgu.
Zaskrbljujoče pri tem je tudi premajhno upoštevanje stroke pri uvedbi in oblikovanju posameznih terapevtskih skupin zdravil; ZZZS namreč pri razvrščanju sledi predvsem kriteriju cene zdravila, takšnih odločitev pa nikakor ne bi smel sprejemati sam, temveč le v sodelovanju z neodvisno stroko. ZZZS se pogosto sklicuje na nekatere države, kjer so uvedli terapevtske skupine zdravil, pri tem pa namenoma ali ne namenoma izpušča razlike v samem pristopu k oblikovanju terapevtskih skupin zdravil in razlike v zdravstvenem sistemu tudi zaradi zdravstvenega zavarovanja.
V tujini, po kateri se pri tem ukrepu menda zgleduje ZZZS, imajo ločena telesa za oblikovanje terapevtskih skupin zdravil in za oblikovanje najvišjih priznanih vrednosti. To pomeni, da so takšni ukrepi izpeljani dovolj strokovno, da ne ogrožajo učinkovitosti in varnosti zdravljenja bolnikov, obenem pa so doseženi tudi prihranki, ki so glavni cilj tega ukrepa.
Polega tega nas skrbijo tudi druge pomanjkljivosti, povezane z uvajanjem terapevtskih skupin zdravil (TSZ), na katere že ves čas opozarja zdravniška stroka. Tako sistem TSZ ne upošteva odziva bolnikov na zdravila in predstavlja velika tveganja za njihovo zdravje – bolniki z isto boleznijo se namreč lahko različno odzovejo na isto zdravilo, kar v primeru menjave zdravila zaradi doplačil lahko vodi do poslabšanja zdravljenja, zapletov ali celo potrebe po zdravljenju v bolnišnici. Obstaja možnost, da bo v primeru nepripravljenosti na doplačila določena zdravila treba menjati vsaka dva meseca ali pa bo bolnik celo prekinil zdravljenje, kar predstavlja zlasti nevarnost za kronične bolnike.
Poleg tega sistem TSZ omejuje avtonomijo zdravnikov, ki bo poslej ogrožena in bo zdravnikom onemogočala, da bi se odločali, kaj je najbolje za bolnika, če morajo zdravila predpisovati prvenstveno z vidika cene, s tem pa se bo otežil tudi odnos in zaupanje med zdravnikom in bolnikom. Hkrati bo ta sistem povzročil večjo obremenjenost zdravnikov, ki bodo del že tako skromnega časa za paciente zdaj morali nameniti za razpravljanja o doplačilih namesto o stanju bolnika.
Omejevanje dostopnosti zdravil lahko dolgoročno poveča tudi stroške zdravstvenega sistema, saj ovira dostop do novih inovativnih zdravil z dokazanimi prednostmi glede izidov zdravljenja, s tem zvišuje možnosti in stroške potrebnega dodatnega zdravljenja ter zmanjšuje kakovost življenja bolnikov. Kar z drugimi besedami pomeni, da sistem TSZ lahko prinese dolgoročne negativne posledice za zdravstveni sistem kot celoto.
V Forumu zato ponovno pozivamo pristojne, da razmislijo o smiselnosti nadaljnjega uvajanja terapevtskih skupin zdravil, zlasti pa o nesmiselnosti implementacije TSZ v skladu z dosedanjo prakso. Če se uvajanju tega za bolnike škodljivega ukrepa res nikakor ni mogoče izogniti, potem od odgovornih pričakujemo vsaj dve temeljni spremembi sistema, s katerima bi povečali strokovnost pri oblikovanju TSZ in zmanjšali nevarnost za slabše zdravljenje bolnikov. In sicer predlagamo:
– da se loči odločanje o tem, katera zdravila so vključena v posamezno terapevtsko skupino, od odločanja o najvišji priznani vrednosti zdravil;
– poleg tega bi bilo za dostop bolnikov do inovativnih in s tem do najučinkovitejših in najvarnejših zdravil pomembno, da so iz TSZ izvzeta inovativna zdravila s še veljavno patentno zaščito. Tudi to je praksa v državah, s katerimi se tako radi primerjamo, na primer v Nemčiji.
“,”Jaka Verbic Miklic”,1398355200,1398355200,sl,12493,306,12492,43,0,NULL,,”Stališče o TSZ”,stalisce-o-tsz,Post,”/sites/43/files/images/news/Stalisce o TZS/Foto-Terapevtske-skupine-zdravil.jpg”,1,0,1522167271,1522769578
287,12497,”Sprejeta sta Kodeks JOPS in Kodeks OSZRp”,” “,”
Samoregulativa v farmacevtski industriji je že od nekdaj pomembna, njen osnoven namen pa je postaviti še strožje etične standarde pri delovanju tako na evropski kot na nacionalni ravni.
Kodeks o transparentnosti (Kodeks JOPS) zavezuje farmacevtske družbe k javni objavi plačil zdravstvenim delavcem in zdravstvenim organizacijam, dodatek h Kodeksu sodelovanja z zdravstvenimi delavci (Kodeks OSZRp) pa omejuje načine promocije zdravil zdravstvenim delavcem in organizacijam. Med drugim se nanaša na razdeljevanje kakršnih koli izdelkov, ki niso neposredno namenjeni izobraževanju, strokovni javnosti.
Oba kodeksa sta stopila v veljavo 1. januarja 2014, s tem, da je za prvo obdobje poročanja prenosov sredstev zdravstvenim delavcem in zdravstvenim organizacijam predvideno koledarsko leto 2015. Podrobnosti teh kodeksov bomo tako skozi leto 2014 natančno predstavili vsem ključnim deležnikom, najprej tistim, ki so v ta proces neposredno vpleteni, potem pa tudi splošni javnosti, s čimer bomo – o tem smo prepričani – bistveno povečali transparentnost odnosov med zdravniki in farmacevtsko industrijo; odnosov, ki so mnogokrat predmet javne presoje, pa tudi kritike.
Vsebina kodeksov je dostopna v zavihku Kodeksi.
“,”Jaka Verbic Miklic”,1395680400,1395680400,sl,12497,306,12496,43,0,NULL,,”Sprejeta sta Kodeks JOPS in Kodeks OSZRp”,sprejeta-sta-kodeks-jops-in-kodeks-oszrp,Post,”/sites/43/files/images/news/Sprejeta sta dva nova kodeksa/Sprejeta sta Kodeks JOPS in Kodeks OSZRp.jpg”,1,0,1522168520,1522771879
288,12499,”Forum predstavil dva nova etična kodeksa”,” “,”
S temi prizadevanji želimo bistveno izboljšati preglednost delovanja farmacevtske industrije v razmerju do zdravstvenih delavcev in zdravstvenih organizacij. Kodeks OSZRp med drugim uvaja popolno prepoved dajanja daril ter postavlja omejitve pri vrednosti za informativna ali izobraževalna gradiva in za izdelke za medicinsko rabo, in sicer na raven, ki velja za javne uslužbence, in pri gostoljubnosti.
Kodeks JOPS uvaja javno objavo vseh prenosov sredstev na zdravstvene organizacije in zdravstvene delavce, kar vključuje donacije in prispevke za izobraževanje, prispevke za kritje stroškov, povezanih z dogodki in nadomestila za storitve in svetovanje. Podatki bodo prvič objavljeni leta 2016 za leto 2015.

Medsebojno sodelovanje z zdravstvenimi delavci in organizacijami poteka na več področjih, pri različnih študijah, raziskavah in izobraževanju. Na vseh teh področjih z roko v roki peljemo razvoj stroke naprej, kar je dobro in nujno za kakovostno delo posameznih zdravstvenih delavcev ter zdravstvenih ustanov, kot tudi za razvoj zdravstvenih storitev. Upamo, da bo s temi ukrepi javnosti omogočen primeren nadzor nad temi odnosi, njihovo razumevanje, s tem pa želimo prispevati h krepitvi zaupanja vseh deležnikov in javnosti do zdravstvenih delavcev, institucij ter farmacevtske industrije.
Vsebino kodeksov smo že predstavili strokovni in širši javnosti.
Vsebino kodeksov najdete v zavihku Kodeksi.
“,”Jaka Verbic Miklic”,1394215260,1394215260,sl,12499,306,12498,43,0,NULL,,”Forum predstavil dva nova etična kodeksa”,forum-predstavil-dva-nova-eticna-kodeksa,Post,”/sites/43/files/images/news/Eticna kodeksa/infozajtrk_b.jpg”,1,0,1522170140,1522483279
289,12501,”2. strateška konferenca Vrednost inovacij 2013″,”Boljše zdravje je gonilo gospodarske rasti in pomemben parameter družbene blaginje.”,”
Na drugi strateški konferenci Vrednost inovacij, ki je v organzaciji Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb potekal v ljubljanskem hotelu Slon, se je govorilo o pomenu inovacij v zdravstvu za bolj učinkovito in prijazno zdravljenje bolnikov in s tem zdravo in produktivno družbo, gostje na okrogli mizi pa so govorili predvsem o tem, da je uvajanje inovacij v zdravstvu sicer nujno, a zaradi varčevanja hkrati vse večji izziv ter o tem, da je treba bolnika kot enega ključnih deležnikov bolj vključiti v soodločanje.
Iz predstavitev osrednjih govorcev dr. Dennisa A. Ostwalda z inštituta WifOR, Françoisja Laméranta iz Evropskega združenja farmacevtske industrije in združenj, dr. Jelke Zaletel iz UKC LJ in prof. dr. Franka Lichtenberga z Univerze v Kolumbiji, ZDA ter iz mnenj gostov okrogle mize, prof. dr. Rasta Ovina z Ekonomsko-poslovne fakultete Maribor, Mojce Gobec z ministrstva za zdravje, mag. Jurija Starihe s klinike Golnik in Sama Fakina iz ZZZS, je bilo v odgovorih na vprašanja moderatorke dr. Petre Došenović Bonča z Ekonomske fakultete v Ljubljani in vprašanja gostov zaslediti veliko zanimivih mnenj in usmeritev za prihodnost razvijanja in uvajanja inovacij v zdravstvu.
Zdrava družba je tudi bolj produktivna družba, torej se zdravje prebivalstva posredno in neposredno odraža na gospodarski uspešnosti družbe. S podaljševanjem življenjske dobe, ki se je, na primer, zaradi novih protivnetnih zdravil in bolj učinkovitega zdravljenja kroničnih bolezni ter rakavih obolenj v zadnjih 60 letih podaljšala za 9 let, se podaljšuje tudi produktivnost posameznika in s tem gospodarska produktivnost družbe kot celote.
Inovativni značaj nemške zdravstvene industrije je bil recimo eden od razlogov za gospodarsko rast v tej državi v zadnjem času. V letu 2010 so tamkajšnja podjetja realizirala okrog 10,4 milijarde evrov bruto dodane vrednosti; od leta 2005 do 2010 se je ta tako povečala za okrog 2,9 milijarde evrov (za 38 odstotkov), kar pomeni 6,6-odstotno letno stopnjo rasti, ta pa je višja od stopnje rasti nemške industrije (2,2-odstotna stopnja). Farmacevtska industrija je med najbolj intenzivnimi panogami glede na obseg vlaganj v raziskave in razvoj ter glede na dodano vrednost na vsak vložen evro.
Dve tretjini zmanjšanja števila potencialno izgubljenih let življenja pred 70. letom starosti je zasluga farmacevtskih inovacij. Med letoma 2003 in 2009 je povečanje skupnega števila novih zdravil zmanjšalo število bolnišničnih sprejemov za 7 odstotkov. Nova zdravila, ki so bila uvedena med letoma 1995 in 2005, pa so zmanjšala (starostno korigirano) stopnjo umrljivosti zaradi raka v letu 2007 za 15 odstotkov.
Združenje Forum se zaveda gospodarske krize in njenih posledic, zaradi katerih smo prisiljeni sprejemati različne ukrepe za zmanjševanje stroškov zdravstvenega sistema. Že večkrat smo pokazali svojo pripravljenost pomagati v teh težkih časih. Toda pri tem je bistveno, da se vprašanja, povezana z dostopnostjo do zdravil, uskladijo z nagrajevanjem inovativnosti. Poleg tega je treba pri iskanju rešitev za zmanjševanje stroškov upoštevati temeljne elemente uspešnega gospodarstva: stabilnost, predvidljivost, konkurenčnost, vzdržnost in gotovost. Zato Vladi Republike Slovenije ponujamo v obravnavo in sprejetje Okvirni dogovor o stabilnosti zdravstvenega varstva in dostopu do zdravil v RS.
Namesto kratkotrajnih in hitrih ukrepov za krpanje zdravstvenega proračuna, ki so usmerjeni le v zmanjšanje izdatkov za zdravila, bi morali pri oblikovanju ustreznega sistema za razvrščanje in cenovno vrednotenje zdravil uveljaviti sistem poslovnega načrtovanja za ustrezno dolgoročno oskrbo z zdravili in spodbujati naložbe v raziskave in razvoj novih zdravil.
• Vsi deležniki v zdravstvu potrebujemo jasno in izvršljivo nacionalno strategijo na področju zdravstvenega varstva ter dolgoročno nacionalno politiko za področje zdravil, pri čemer so Forum in njene članice pripravljeni aktivno sodelovati.
• Potrebujemo spremembo sistema financiranja zdravstva, saj bi financiranje iz zasebnih sredstev preko različnih oblik zasebnih programov zdravstvenega zavarovanja ali preko uvedbe sistema participacije pripomoglo k vzdržnosti in razvoju zdravstvenega varstva ter omogočilo nadaljnjo dostopnost do inovativnih zdravil. V tem pogledu ocenjujemo trenutni sistem uvajanja terapevtskih skupin zdravil kot pomanjkljiv in strokovno neusklajen oziroma nedodelan.
• Hkrati želimo nadgraditi lanskoletni predlog o delovni skupini za promocijo zdravja in inovativnega zdravljenja bolezni sodobnega časa, ki bi vključevala vse deležnike v zdravstvenem sistemu s ciljem kakovostnega informiranja vseh o inovativnih zdravilih in možnostih zdravljenja. Kakovostne informacije namreč pomagajo ljudem preprečevati bolezni in omogočajo boljše zdravljenje, dobro informiran bolnik pa je ključen pri sprejemanju odločitev, ki vplivajo na njegovo zdravje. To pa je tudi dobra pot k novi fazi, ko bolnik ne bo samo odlično informiran, ampak bo za svoje zdravljenje tudi motiviran in opolnomočen za aktivno sodelovanje v zdravstvenem sistemu.
V Forumu se zavedamo, da lahko uspešno (so)delujemo le kot eden od ključnih parametrov vsakega zdravstvenega sistema v družbi, ki se pomena zdravja zaveda in ga neguje kot enega od osnovnih stebrov generiranja trenutne in še zlasti bodoče gospodarske rasti. Zaradi tega bi želeli naše znanje, inovacije, izkušnje in pripravljenost deliti, da tudi Slovenija obstane in se razrašča v okolje, ki bo stimuliralo visoko kakovostno zdravstvo v funkciji zdrave družbe in posameznika.
“,”Jaka Verbic Miklic”,1381942800,1381942800,sl,12501,306,12500,43,0,NULL,,”2. strateška konferenca Vrednost inovacij 2013″,2-strateska-konferenca-vrednost-inovacij-2013,Post,”/sites/43/files/images/news/2. strateska/okrogla_miza_sp_b.jpg”,1,0,1522170498,1522611329
290,12503,”Forum, zlati sponzor konference Management in vodenje v zdravstvu 2013″,” “,”
Letošnja konferenca Management in vodenje v zdravstvu, ki je potekla pod zlatim pokroviteljstvom Foruma, je postavila v središče vrednost zdravja.
Mag. Natalija Petkovič, predstavnica Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, je spregovorila o pomenu in vrednosti inovativnih zdravil. Spomnila je, da so desetletja investiranja v inovativnost zdravil pripomogla k temu, da danes uspešno zdravimo in preprečujemo vrsto bolezni bolje kot kdaj koli prej. Inovativna zdravila so pomembno zmanjšala porabo drugih zdravstvenih storitev in hospitalizacij ter izboljšala kakovost življenja bolnikov in njihovih svojcev: »Inovativne terapije bolnikom prinašajo upanje na boljše, daljše in kvalitetnejše življenje,« je poudarila Natalija Petkovič in odločevalce spodbudila k ustreznejšemu vrednotenju inovativnih zdravil, ki naj odseva stopnjo inovativnosti, resnost bolezni, stopnjo medicinske potrebe ter vpliv zdravila na obravnavanje bolezni. Opozorila je, da bo potreben sodobnejši pristop k zdravstveni reformi. Takšen, ki se ne osredotoča le za zniževanje stroškov, pač pa postavlja v središče učinkovitost zdravstvenih rešitev ter usmerja finančna sredstva v rešitve z dokazano visoko dodano vrednostjo.
Prof. dr. Zlatko Fras, dr. med., Univerzitetni klinični center Ljubljana, je spregovoril o poslanstvu sodobne medicine ter poudaril pomen kakovosti, inovativnosti in preventive za boljše zdravje državljanov. Pozval je k spremljanju in spoštovanju kliničnih in zdravstvenih izidov, ki naj bodo osnova za zdravstveno-ekonomske odločitve. Predvsem pa je pozval k sodelovanju vseh deležnikov v zdravstvu s ciljem opolnomočenja bolnikov. Opozoril je, da potrebujemo učinkovitejši zdravstveni sistem, obenem pa je poudaril, da brez povišanja prispevne stopnje za zdravstvo ne bo mogoče vzdrževati visoke ravni zdravstvene oskrbe.
Dr. Rasto Ovin, Ekonomska poslovna fakulteta v Mariboru, je poudaril, da je država tista, ki mora določiti obseg pravic, obenem pa bo mora v ospredje stopiti socialna družba.
Samo Fakin, generalni direktor ZZZS, pa se je zavzel za optimalnejšo organizacijo zdravstvenih ustanov ter za sodelovanje in dogovor vseh akterjev v zdravstvu brez fige v žepu.
Prof. dr. Pavel Poredoš, dr. med., predsednik Slovenskega zdravniškega društva, je apeliral na jasno definiranje prioritet glede obsega zdravstvene košarice ter na upoštevanje in vključevanje stroke pri odločitvah, ki zadevajo zdravje pacientov. Pri tem je izpostavil napovedane terapevtske skupine zdravil, ki so izjemno občutljivo strokovno vprašanje, zato odločitve o tem, »ali lahko vsa zdravila zmečemo v isti koš«, ne morejo in ne smejo biti sprejete mimo stroke. Spomnil je, da si moramo vsi skupaj prizadevati za kakovostno zdravstvo in ustrezen dostop do zdravstvenih storitev v dobro pacientov.

Letošnja konferenca se je dotaknila tudi aktualnih zakonodajnih novosti – novele Zakona o pacientovih pravicah, prostega pretoka delovne sile in priznavanja poklicnih kvalifikacij ter novosti s področja novega Zakona o zdravilih in Zakona o lekarniški dejavnosti. V okviru plenuma o odličnosti v zdravstvu je Biserka Simčič, vodja sektorja Kakovost in varnost sistema zdravstvenega varstva na Ministrstvu za zdravje RS, predstavila poročilo o vodenju kakovosti v slovenskih bolnišnicah.
Prim. Andrej Možina, dr. med., predsednik Zdravniške zbornice Slovenije, pa je spomnil, da zdravstveni sistem temelji na vedno bolj skromnem številu zdravnikov, ljudje pa so vedno bolj bolni. Poudaril je, da bo le s kakovostjo in razumom mogoče iziti iz kriznih razmer v zdravstvu, zato je pozval k nadaljevanju projekta kakovosti v zdravstvu, tokrat pod okriljem Ministrstva za zdravje RS.
“,”Jaka Verbic Miklic”,1364407860,1364407860,sl,12503,306,12502,43,0,NULL,,”Forum, zlati sponzor konference Management in vodenje v zdravstvu 2013″,forum-zlati-sponzor-konference-management-in-vodenje-v-zdravstvu-2013,Post,”/sites/43/files/images/news/Zlati sponzor/okrogla_miza_b.jpg”,1,0,1522170740,1522481938
291,12505,”Terapevtske skupine zdravil so v škodo pacientom”,” “,”
Med ukrepi za ohranjanje finančne vzdržnosti zdravstvenega sistema so izdatki za zdravila segment, ki ga zdravstveni politiki in vlada zelo podrobno obravnavajo predvsem pa finančno nenehno omejujejo. Zdravila so namreč tisti del zdravstvenega sistema, kjer so podatki o izdatkih in porabi transparentni, njihovo krčenje pa predstavlja za odločevalce sorazmerno lahek ukrep, ki sicer lahko prinese hitre kratkoročne prihranke ob tem pa tudi negativne dolgoročne posledice za bolnike.
Forum se zaveda gospodarske krize in njenih posledic, zaradi katerih je naša vlada prisiljena sprejemati različne ukrepe za zmanjševanje stroškov. Že večkrat smo pokazali svojo pripravljenost pomagati v teh težkih časih. Toda pri tem je bistveno, da se vprašanja, povezana z dostopnostjo, uskladijo z nagrajevanjem inovativnosti, zagotavljanjem stalnih in stabilnih možnosti zdravljenja za slovenske bolnike ter dostopom do novih zdravil. Inovativna farmacevtska industrija se že sooča s cenovnimi limiti, ki bodo ob potencialni uvedbi terapevstkih skupin za zdravila močno povečali potrebe po doplačilih zdravil.
Potrebne bodo tudi širše spremembe sistema financiranja, prek uvedbe sistema participacije ali razvoja nekaterih oblik zasebnih programov zdravstvenega zavarovanja, kar bi pripomoglo k okrepitvi vzdržnosti in razvoja zdravstvenega varstva visoke kakovosti za slovenske državljane ter omogočilo nadaljnjo dostopnost inovativnih zdravil.
Neustrezni ukrepi na področju zdravil lahko povzročijo nestabilnost trga zdravil, poslabšanje dostopnosti zdravil za bolnike, poslabšanje konkurenčnosti trga zdravil, in s tem na dolgi rok povečanje izdatkov za zdravila.
Predlog uvedbe sistema medsebojne zamenljivosti zdravil po terapevtskih skupinah sodi med neustrezne ukrepe, saj (je) sistem:
• škodljiv za bolnike, saj omejuje dostop do inovativnih zdravil in njihovo izbiro,
• ne upošteva različnosti bolnikov in povzroča dvom v presojo zdravnika,
• kakovost zdravljenja je lahko zmanjšana, posebno v primerih številnih zamenjav zdravil,
• omejuje strokovno delovanje zdravnikov, saj bo njihovo izbiro zdravila deloma omejuje na zdravila, ki ustrezajo kriterijem zamenljivosti,
• po trenutnem predlogu je za sestavo terapevtskih skupin izrecno odgovoren upravni odbor ZZZS, kar za bolnike predstavlja veliko tveganje,
• zaradi usmerjenosti ZZZS k finančnim ciljem bi bolniki lahko kmalu utrpeli zmanjšano dostopnost do novih zdravil,
• iz cenovnih razlogov predpostavlja, da so različna zdravila enaka; različne komponente preprosto niso zamenljive;
• lahko okrni pravice intelektualne lastnine, saj združevanje zdravila s patentno zaščito in zdravil brez nje preprosto ni dopustno,
• zanika naravo inovacij in ogroža bodoče inovacije, saj so farmacevtske inovacije postopne in prinašajo dodatne koristi, edinstvene posameznim skupinam bolnikov,
• izkrivlja in preprečuje konkurenco.

Strokovna izhodišča, ki bi jih bilo zaradi varnosti pacientov potrebno upoštevati v pravilniku o razvrščanju zdravil na listo
O terapevtskih skupinah zdravil naj odloča neodvisna komisija, sestavljena iz zdravnikov in farmacevtov. Komisija naj ima naslednje pristojnosti:
• Določanje terapevtskih skupin na način, da bolniki ne bodo oškodovani.
• Določanje osnovnih in premijskih cen znotraj terapevtskih skupin.
• Določanje meril za najustreznejšo ceno in najustreznejšo terapevtsko učinkovitost.
S stališča politike javnega zdravstva je edina sprejemljiva oblika referenčnih cen zdravil takšen sistem, ki znotraj ene skupine uvršča samo kemično identične bioekvivalentne sestavine na nivoju ATC -5.
V Sloveniji imamo trenutno za določena področja zdravljenja preko Liste medsebojno zamenljivih zdravil, že uveden sistem referenčnih cen na ravni ATC-5, kar pomeni, da se izda bolniku zdravilo brez doplačila v okviru najvišje dovoljene cene. Takšen varčevalni mehanizem je učinkovit pri zniževanju stroškov, hkrati pa še omogoča avtonomijo zdravnikom ter bolnikovo možnost do individualne obravnave.
• S patentom zaščiteni proizvodi naj imajo zavarovalniško kritje izven in neodvisno od sistema terapevtskih skupin zdravil.
• Različne formulacije zdravil z isto molekulo zdravilne učinkovine naj se razlikujejo v ceni.
• Za zdravila izven sistema terapevtskih skupin zdravil naj bo zagotovljena ustrezna pravna podlaga za možnost doplačila.
• 12 mesecev po vzpostavitvi prvih terapevtskih skupin naj se ovrednoti njihov vpliv kot predpogoj za vsake nadaljnje spremembe in odločitve glede sistema terapevtskih skupin zdravil.
Navedeni strokovni argumenti pri pripravi predlogov niso bili upoštevani.
Trenutno je za sestavo terapevtskih skupin izrecno odgovoren upravni odbor ZZZS (na podlagi strokovnega mnenja komisije za razvrščanje zdravil na ZZZS). To za bolnike predstavlja veliko tveganje. Bolniki bi lahko kmalu utrpeli zmanjšano dostopnost do novih zdravil, če ne bo ustanovljena neodvisna, profesionalna znanstvena komisija, ki bi zaščitila njihove interese. ZZZS pri odločanju namreč lahko deluje pristransko zaradi temeljne usmerjenosti k finančnim ciljem.
• Naj se pri izbiri najprimernejšega zdravila za bolnika prepustimo presoji računovodje (po sistemu »vsa zdravila so si podobna«) ali vseeno raje zdravnikovi (ki deluje po načelu »moj bolnik je edinstven«)? Sistem terapevtskih skupin zdravil zdravnikom neposredno jemlje svobodo predpisovanja zdravil, saj jih v veliki meri omejuje s proizvodi, ki zadoščajo merilom zavarovalniškega kritja.
• Sistem terapevtskih skupin zdravil bolnikom omejuje možnost izbire in dostopnost do novih inovativnih zdravil; različne učinkovine namreč niso preprosto zamenljive, četudi imajo skupen način delovanja in podobne lastnosti. Si denimo upamo zagovarjati zamenljivost tudi, ko gre za končni izid zdravljenja bolezni, ali ko gre za pripravljenost bolnika, da bo redno jemal zdravilo?
• Sistem terapevtskih skupin zdravil lahko močno poslabša kakovost oskrbe, še posebej ko prenapotovanje bolnikov, ki so imeli do tedaj bolezen pod nadzorom, vodi do pogostega menjavanja njihovih zdravil. Če se je bolnikom poprej ob njihovih stalnih zdravilih dobro godilo, bi zaradi sistema terapevtskih skupin zdravil, ki bi jih prisilil v posledično spreminjanje zdravil, lahko prišlo do poslabšanja zdravja.
• Načini uveljavljanja sistema terapevtskih skupin zdravil se lahko močno spreminjajo (spremembe obdobij določanja skupin, spremembe načinov preračunavanja, itd.) in tako diskriminatorno delujejo na skupine bolnikov. Če spremembe namreč vplivajo na določene terapevtske razrede, bodo bolniki s temi zdravili prizadeti v primerjavi z drugimi, katerih zdravila bodo manj ali nič pod vplivom sprememb terapevtskih skupin zdravil.
• Če na doplačila ne želimo gledati le kot na sredstvo omejevanja porabe zdravil, terapevtske skupine zdravil povečujejo potrebo po boljšem informiranju o zdravilih. Potrebno je boljše informiranje bolnikov o možnih različicah zdravljenja in možnostih doplačil.
• Resničen strošek družbe so bolezni. Zdravljenje je najboljši način zmanjševanja tega stroška.
• Farmacevtske inovacije so postopne in prinašajo dodatne koristi, edinstvene posameznim skupinam bolnikov.
• Sistem terapevtskih skupin zdravil onemogoča nagrajevanje postopnih izboljšav zdravil, nagrajevanje napredka v prejemanju različnih oblik in dnevnih doz zdravil ter nagrajevanje bolniku primernejših novih oblik zdravila. Zato posledično ogroža razvoj inovativnih zdravil.

Nekaj raziskav in analiz o rezultatih in »učinkovitosti« sistema terapevtskih skupin zdravil v drugih državah EU:
• Sood et al.(2009) so raziskovali vplive tržnih ukrepov (nadzor dobička, neposredni nadzor cen, nadzor proračuna izvajalcev, terapevtske skupine, gospodarske ocene in spodbude za uporabo generikov) v 19 državah OECD med leti 1992 in 2004. Analiza je pokazala, da je sistem terapevtskih skupin zdravil najmanj učinkovit ukrep za zmanjševanje farmacevtskih prihodkov. Nasprotno so imeli največje učinke ukrepi omejevanja razpoložljivih sredstev izvajalcem in ukrepi neposrednega cenovnega nadzora.
• Stargardt (2009) je raziskal vključitev statinov v nemški sistem terapevtskih skupin leta 2005 in učinke posledičnih sprememb zdravil na porabo in stroške zdravstvenih storitev. V primerjavi z bolniki, ki jih uvedba sistema terapevtskih skupin zdravil ni prizadela, so bolniki, ki so predhodno prejemali atorvastatin, v večji meri prenehali z zdravljenjem, ali se ga niso držali po navodilih. V primerjavi z bolniki, ki so nadaljevali zdravljenje z atorvastatinom, so morali bolniki, ki so morali zamenjati zdravilo, večkrat na zdravljenje v bolnišnico. Pri bolnikih, ki so zdravilo zamenjali vsaj dvakrat, je bil porast bolnišničnega zdravljenja zaradi srčno žilnih bolezni izrazit v primerjavi z bolniki, ki zdravila niso menjali. V ambulantnem zdravljenju med skupinama ni bilo pomembne razlike.
• Več drugih raziskav je potrdilo, da sprememba zdravila slabo vpliva na vztrajanje bolnikov pri zdravljenju po navodilih zdravnika. V raziskavi, ki so jo opravili Thiebaud et al. (2005) so se bolniki po zamenjavi statina v 18.9-odstotka primerov odrekli ustreznemu jemanju zdravila, določeno z verjetnostjo posedovanja zdravila s količnikom 0,8 ali več. Vztrajanje pri jemanju zdravila je bilo izrazito manjše za 20,9-odstotka do 48,3-odstotka, odvisno od dolžine obdobja, uporabljenega za določitev prenehanja zdravljenja.
• Podobni izidi so bili doseženi v Britanski Kolumbiji v Kanadi. Skinner et al. (2009) so povzeli: “Videti je, da obstaja neodvisna povezava med medicinsko nepotrebno zamenjavo zdravil, povzročeno s sistemom terapevtskih skupin zdravil in večjo splošno uporabo zdravstvenih storitev.”
• Njihova študija iz leta 2003 kaže da izvajanje politike terapevtskih skupin zdravil v skupini IPČ v Britanski Kolumbiji verjetno ustvarja pomembne neposredne, nepotrebne, neto stroške zdravstvenega sistema v obdobju 2003-2005, v potencialni višini do 42,51 milijonov $.
Literatura in viri:
• Sood N, et al.: The effect of regulation on pharmaceutical revenues experience in nineteen countries. Health affairs, 28(19)2009
• Stargardt T.: The impact of reference pricing on switching behavior and healthcare utilization: the case of statins in Germany. Eur J Health Econ. 2009 Jul 29
• Thiebaud P, et al.: The effect of switching on compliance and persistence: the case of statin treatment. Am J Mnag Care. 2005, 11(11)670-4
• Skinner BJ, et al: Increased health costs from mandated therapeutic substitution of proton pump inhibitors in British Columbia. Alimentary pharmacology & Therapeutics, 29(8):882-91, 2009
“,”Jaka Verbic Miklic”,1363025640,1363025640,sl,12505,306,12504,43,0,NULL,,”Terapevtske skupine zdravil”,terapevtske-skupine-zdravil,Post,”/sites/43/files/images/news/Terapevtske skupine zdravil/IMG_1_b.jpg”,1,0,1522170953,1522481922
292,12507,”1. strateška konferenca Vrednost inovacij”,” “,”
Oktobra 2012 je v organizaciji Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb potekala strateška konferenca Vrednost inovacij, ki predstavlja pomemben prispevek k razumevanju doprinosa farmacevtskih inovacij k podaljševanju življenjske dobe in izboljšanju kakovosti življenja, pa tudi k družbeni blaginji in gospodarski rasti. Konferenca je osvetlila trende razvoja evropskih zdravstvenih sistemov ter soočila mnenja o inovacijah s strani bolnikov, plačnika zdravstvenih storitev in akademske sfere. Ključne vsebine strateške konference Vrednost inovacij so zdaj na voljo v pričujoči publikaciji.
“,”Jaka Verbic Miklic”,1356545940,1356545940,sl,12507,306,12506,43,0,NULL,,”1. strateška konferenca Vrednost inovacij”,1-strateska-konferenca-vrednost-inovacij,Post,”/sites/43/files/images/news/1. strateska/brosura_Vrednost_inovacij_b.png”,1,0,1522171371,1522480287
293,12510,”»Povezani lahko bolje uresničujemo svoje interese« “,”Osrednje sporočilo dogodka o vlogi združenj bolnikov pri oblikovanju zdravstvenih politik v Sloveniji”,”
Za predstavnike slovenskih združenj bolnikov je Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ, konec januarja 2018 organiziral dogodek na temo vloge združenj bolnikov pri oblikovanju zdravstvenih politik v Sloveniji. Udeleženci so se strinjali, da so povezani lahko močnejši, da pa bodo morali v prihodnje veliko pozornosti nameniti poglobljenemu izobraževanju in profesionalizaciji. Želijo si, da bi postali partner, katerega volje v odločevalskih procesih ne bo mogoče prezreti. V prihodnosti želijo biti udeleženi tako pri snovanju strokovnih smernic kot v vseh organih, ki odločajo o dostopu bolnikov do različnih pravic znotraj zdravstvenega sistema.
Okoli 50 predstavnikov slovenskih združenj bolnikov in drugih udeležencev je sprva prisluhnilo predstavnici Evropskega foruma bolnikov, Eleni Balestra, ki je predstavila, kako pomemben partner v odločevalskih procesih institucij Evropske unije so lahko povezani bolniki. Izobraževalne module EUPATI in pomen visoke ravni znanja o najnovejših izsledkih in terapijah na področjih posameznih bolezni je udeležencem v nadaljevanju posveta približala Tanja Španić, predsednica Europe Donne Slovenija in članica EUPATI. Sledile so praktične delavnice, na katerih so se udeleženci razdelili v skupine in se aktivno vključevali v razpravo o pomenu, vlogi, vrednosti in vplivu, ki ga bodo imela združenja bolnikov v družbi, zdravstvu in vsakdanjem življenju bolnikov leta 2030.
Ugotovili so, da imajo združenja bolnikov kot del civilne družbe pri oblikovanju prihodnosti izjemno pomembno vlogo, toda njen vpliv v prihodnje bo odvisen zlasti od profesionalizacije in tesnejšega povezovanja. Strinjali so se, da lahko slogan »Nič o nas brez nas« polno zaživi le, če so predstavniki združenj bolnikov dobro usposobljeni in kakovostno izobraženi na področjih, na katerih delujejo. Da bi potrebe svojih članov kvalificirano zastopali, potrebujejo poglobljena izobraževanja in verodostojne informacije, hkrati pa je po njihovem mnenju nujno predvsem proaktivno delovanje in vpetost na vseh ravneh oblikovanja zdravstvenih ter socialnih politik ter enakopravna vključenost predstavnikov bolnikov v odločevalske procese, ki se kakorkoli dotikajo njihovega članstva.
Pričakujejo tudi, da se bo v prihodnosti vsakdanje življenje bolnikov s kroničnimi boleznimi močno spremenilo. Upajo, da bodo mnoge, zdaj življenje ogrožajoče bolezni, v bližnji prihodnosti postale dobro obvladljive kronične bolezni, življenje kroničnih bolnikov pa posledično lažje, saj bodo terapije učinkovitejše, bolnišnično zdravljenje pa bo v mnogih primerih lahko nadomestila ambulantna obravnava. Obetajo si tudi spremenjeno paradigmo v medicini, ki bo prešla na bolj osebno obravnavo. Ta bo mnogim bolnikom omogočala zdravljenje pretežno na domu, kjer jim bodo na voljo tudi številne aplikacije, s katerimi bodo v prihodnje enostavneje nadzorovali svojo bolezen. Poleg tega udeleženci ugotavljajo, da bo vodenje bolezni in rehabilitacija enako kot doslej v rokah zdravstvenih in drugih strokovnjakov, ki bodo v prihodnosti vse bolj specializirani.
Udeleženci srečanja so se strinjali, da prihodnost prinaša številne izzive, od dolgožive družbe, posledičnega naraščanja števila kroničnih bolnikov, vedno novih zdravstvenih inovacij in pomanjkanja sredstev, s katerimi bi lahko vse te izzive naslovili. V prihodnjih dveh desetletjih bo zato vloga združenj bolnikov po njihovem mnenju pomembnejša kot kadarkoli prej. Njihov vpliv pa bo odvisen predvsem od profesionalizacije in medsebojne povezanosti. Zato so udeleženci izrazili željo in neformalno namero po tesnejšem sodelovanju in pripravi nacionalnega posveta, na katerem bi, po zgledu nekaterih drugih evropskih držav, preučili različne možnosti sodelovanja in povezovanja združenj bolnikov ter se posvetovali tudi o možnostih oblikovanja slovenske nacionalne koalicije bolnikov.
“,”Jaka Verbic Miklic”,1522260480,1522260480,sl,12510,306,12509,43,0,NULL,,”»Povezani lahko bolje uresničujemo svoje interese« “,povezani-lahko-bolje-uresnicujemo-svoje-interese,Post,”/sites/43/files/images/news/Povezani lahko/Povezani lahko bolje uresničujemo svoje interese.jpg”,1,0,1522260686,1523014320
294,12515,”Vrednost inovacij”,”Inovacije na področju zdravstva imajo pomemben vpliv na družbo in posameznika. Inovativna zdravila omogočajo višjo kakovost življenja, podaljšujejo življenjsko dobo, z njihovim razvojem pa farmacevtska industrija prispeva k dvigu družbene blaginje in gospodarski rasti.
Raziščite, zakaj osebne in družbene koristi inovativnih zdravil bistveno presegajo njihove stroške.”,”
Inovacije na področju zdravstva imajo pomemben vpliv na družbo in posameznika. Inovativna zdravila omogočajo višjo kakovost življenja, podaljšujejo življenjsko dobo, z njihovim razvojem pa farmacevtska industrija prispeva k dvigu družbene blaginje in gospodarski rasti.
Raziščite, zakaj osebne in družbene koristi inovativnih zdravil bistveno presegajo njihove stroške.
Strateške konference, ki smo jih organizirali:
“,,1513197900,1513197900,sl,12515,306,12299,43,0,NULL,,”Vrednost inovacij”,vrednost-inovacij,Post,/sites/43/files/images/Fokus/Human.jpg,1,0,1522393329,1716480094
301,12547,”Vabilo na 2. strateško konferenco inovacij”,” “,”
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ 15. oktobra 2013 v Hotelu Slon v Ljubljani organizira drugo strateško konferenco Vrednost inovacij, posvečeno vplivu inovativnosti na izboljšanje zdravja prebivalstva in na gospodarsko rast. Na konferenci bodo gostje:
Na okrogli mizi se jim bodo pridružili Samo Fakin, generalni direktor Zavoda za zdravstveno zavarovanje Slovenije, mag. Jurij Stariha, namestnik direktorja za upravno in poslovno področje, Univerzitetna klinika za pljučne bolezni in alergije Golnik, prof. dr. Rasto Ovin z Ekonomsko-poslovne fakultete Maribor in Mojca Gobec, generalna direktorica Direktorata za javno zdravje na Ministrstvu za zdravje RS.
“,”Jaka Verbic Miklic”,1362128400,1362128400,sl,12547,306,12546,43,0,NULL,,”Vabilo na 2. strateško konferenco inovacij”,vabilo-na-2-stratesko-konferenco-inovacij,Post,”/sites/43/files/images/news/Vabilo 2. strateska/ppt_preview_b.jpg”,1,0,1522482796,1522768594
319,12637,”Še verjamemo v znanost?”,”Vabilo na okroglo mizo”,”
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb v sredo, 18. aprila 2018, organizira okroglo mizo z naslovom »Še verjamemo v znanost?«, ki bo potekala od 11. ure v Prešernovi dvorani Slovenske akademije znanosti in umetnosti na Novem trgu 4 v Ljubljani.
Svoj razmislek o razmerju med znanostjo in psevdoznanostjo, razlogih in posledicah nezaupanja strokovnim stališčem, tudi kadar gre za naše zdravje, ter o tem, kako znanstvena dognanja približati javnosti, bodo z Renato Dacinger, urednico oddaje Ugriznimo znanost na Televiziji Slovenija, delili:
– akademik prof. dr. Franc Strle, Klinika za infekcijske bolezni in vročinska stanja UKCL
– dr. Simona Borštnar, Onkološki inštitut Ljubljana
– prof. dr. Andrej Janež, KO za endokrinologijo, diabetes in presnovne bolezni UKCL
– mag. Mojca Gobec, Direktorat za javno zdravje na Ministrstvu za zdravje
– mag. Urban Krajcar, Direktorat za znanost na Ministrstvu za izobraževanje, znanost in šport in
– Dragica Bošnjak, novinarka Delove priloge Znanost.
Vjudno vabljeni!
“,”Jaka Verbic Miklic”,1523538660,1523538660,sl,12637,306,12636,43,0,NULL,,”Vabilo na okroglo mizo Še verjamemo v znanost”,vabilo-na-okroglo-mizo-se-verjamemo-v-znanost,Post,”/sites/43/files/images/news/Se verjamemo v znanost?/Se verjamemo v znanost.jpg”,0,0,1523538883,1580454792
320,12639,”Z referenčnim sistemom preprečevanja vstopa ponarejenih zdravil Slovenija med prvimi v EU”,” “,”
Ljubljana, 9. april 2018 – Evropska organizacija za verifikacijo zdravil je Zavodu za preverjanje avtentičnosti zdravil (ZAPAZ), ki je pooblaščen za zagotavljanje avtentičnosti in varnosti zdravil v Republiki Sloveniji, kot prvemu v Evropski uniji (EU) 4. aprila 2018 poslala pozitivno revizijsko poročilo. S tem je omogočila priklop slovenskega nacionalnega informacijskega sistema na produkcijsko EU vozlišče ter vzpostavitev sledljivosti zdravil v celotni oskrbni verigi od proizvajalca do končnega uporabnika, torej bolnika.
Z Delegirano uredbo 2016/161/ES, ki jo morajo vse države članice EU začeti izvajati 9. februarja 2019, Evropska komisija krepi boj proti vstopu ponarejenih zdravil v zakonito dobavno verigo. Uredba od proizvajalcev zdravil, ki tržijo izdelke v EU, zahteva, da zunanjo ovojnino vsake škatlice zdravila opremijo z edinstvenimi oznakami.
Gre za dodatne zaščitne elemente, poleg šifre proizvoda, serializacijske številke, datuma izteka uporabnosti in številke serije, tudi dvodimenzionalno črtno kodo, ki bo ob vsaki izdaji zdravila na recept v splošnih in bolnišničnih lekarnah zagotavljala preverjanje avtentičnosti. Pred izdajo zdravila bo farmacevt edinstveno oznako preveril s standardnim čitalcem dvodimenzionalnih črtnih kod, ki bo prebrane podatke primerjal s podatki, shranjenimi v evropskem in nacionalnem informacijskem sistemu. Ob tem se bodo podatki o edinstveni oznaki deaktivirali in ponovna izdaja zdravila s to oznako ne bo več mogoča.
Po uredbi mora namreč vsaka država članica EU vzpostaviti tudi nacionalni informacijski sistem za preverjanje in deaktivacijo edinstvenih oznak. Ta bo povezan z Evropsko organizacijo za verifikacijo zdravil – EMVO, ki je odgovorna za vzpostavitev in vzdrževanje centralnega evropskega vozlišča, prek katerega bodo proizvajalci zdravil vnašali podatke, ti pa se bodo izmenjevali z nacionalnimi informacijskimi sistemi.
Vzpostavitev in upravljanje nacionalnega sistema za zagotavljanje avtentičnosti in varnosti zdravil za uporabo v humani medicini vodi Zavod ZAPAZ, ki so ga 6. oktobra 2016 ustanovili Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ, Združenje proizvajalcev zdravil Slovenije, Lekarniška zbornica Slovenije in Trgovinska zbornica Slovenije – sekcija veletrgovcev z zdravili. Poldrugo leto prizadevnega dela majhne skupine strokovnjakov na ZAPAZ-u je botrovalo uspešni vzpostavitvi Nacionalnega sistema za zagotavljanje avtentičnosti in varnosti zdravil:
»Na ZAPAZ smo prevzeli pobudo in odgovornost, da v Sloveniji med prvimi vzpostavimo zahtevane procese in standarde vodenja kakovosti ter prevzamemo koordinacijo in izvedbo testiranja sistema za preverjanje avtentičnosti zdravil. Zato smo tudi prevzeli vodenje delovnih skupin, sestavljenih iz predstavnikov ostalih evropskih držav, ki bodo uvedle enak sistem kot Slovenija. Po pregledu obširne projektne dokumentacije nam je 4. aprila 2018 krovna evropska organizacija EMVO poslala pozitivno revizijsko poročilo in nam kot prvi državi v Evropi, ki uvaja tako imenovani »blueprint sistem«, omogočila priklop Nacionalnega sistema za zagotavljanje avtentičnosti in varnosti zdravil na produkcijsko EU vozlišče. To pomeni, da lahko prvi proizvajalci zdravil že začno pošiljati podatke v slovenski sistem«, je pojasnil Mitja Pirman, direktor ZAPAZ.
Sodelujoče države z enakim sistemom bodo lahko zdaj od ZAPAZ-a prevzele obsežno dokumentacijo in tako na primeru dobre prakse hitreje oblikovale nacionalne sisteme v svojih državah.
V pilotni fazi bodo na Nacionalni sistem za zagotavljanje avtentičnosti in varnosti zdravil priključili izbrane slovenske splošne in bolnišnične lekarne ter veletrgovce, do 9. februarja 2019 pa se morajo po določilih EU Direktive in Delegirane uredbe na sistem priključiti tudi ostali.
Nadzor nad izvajanjem zakonskih podlag bo zagotavljala Javna agencija za zdravila in medicinske pripomočke, ki je skupaj z Ministrstvom za zdravje pripravila predlog nacionalne uredbe o izvajanju Delegirane uredbe.
Več informacij je na voljo na telefonski številki 08 200 7278, elektronskem naslovu pisarna@zapaz.si in na spletni strani www.zapaz.si
“,”Jaka Verbic Miklic”,1523285520,1523285520,sl,12639,306,12638,43,0,NULL,,ZAPAS,zapas,Post,”/sites/43/files/images/news/ZAPAS/ZAPAS small.JPG”,1,0,1523544962,1523545721
321,12645,”Pravilnik o določanju cen zdravil za uporabo v humani medicini “,”UL 19/2018, 23/03/2018″,”

Pravilnik o določanju cen zdravil za uporabo v humani medicini
ZBIRNI PODATKI
Uradni list RS, št. 32/2015, 15/2016, 19/2018
Čistopis, veljaven na dan: 28.3.2018
– veljavnost/uporaba: od 24.3.2018
Povezava do dokumenta na portalu IUS-INFO
I. SPLOŠNE DOLOČBE
1. člen
Ta pravilnik ureja:
– merila, način ter postopek za oblikovanje in določanje najvišje dovoljene cene in izredne višje dovoljene cene zdravil za uporabo v humani medicini, ki se financirajo iz javnih sredstev oziroma so namenjena za financiranje iz javnih sredstev (v nadaljnjem besedilu: cene zdravil);
– merila, postopek ter način za spreminjanje oziroma usklajevanje (v nadaljnjem besedilu: usklajevanje) najvišje dovoljene cene in izredne višje dovoljene cene zdravil;
– obvezne sestavine vloge za določanje najvišje dovoljene cene in izredne višje dovoljene cene zdravil;
– stopnjo prometa, na kateri se določajo oziroma spreminjajo cene zdravil;
– način objavljanja in posredovanja cen zdravil;
– obdobje veljavnosti najvišje dovoljene cene in izredne višje dovoljene cene zdravil.
2. člen
Poleg definicij in izrazov, opredeljenih v 6. členu Zakona o zdravilih (Uradni list RS, št. 17/14; v nadaljnjem besedilu: zakon), se v tem pravilniku uporabljajo tudi naslednji izrazi:
1. Zavezanec za oblikovanje cen zdravil (v nadaljnjem besedilu: zavezanec) je:
– imetnik dovoljenja za promet z zdravilom oziroma njegov predstavnik;
– imetnik dovoljenja za uvoz oziroma vnos zdravil za zdravilo, ki nima dovoljenja za promet in je razvrščeno v seznam esencialnih ali nujno potrebnih zdravil na podlagi zakona;
– imetnik začasnega dovoljenja za promet z zdravilom za zdravilo, ki nima dovoljenja za promet in je razvrščeno v seznam esencialnih ali nujno potrebnih zdravil na podlagi zakona;
– imetnik dovoljenja za vnos paralelno uvoženega zdravila;
– imetnik potrdila o prejemu obvestila o paralelni distribuciji zdravil na podlagi določb 118. člena zakona.
2. Najvišja dovoljena cena zdravila je cena zdravila, ki je določena na podlagi tega pravilnika, in se lahko uporablja v prometu na debelo.
3. Izredna višja dovoljena cena zdravila je cena zdravila, ki je določena na podlagi tega pravilnika in se lahko uporablja v prometu na debelo ter presega najvišjo dovoljeno ceno zdravila.
4. Primerjalna cena zdravila je podatek, ugotovljen na podlagi:
– cen zdravil v primerjalnih državah, preračunanih iz javno objavljenih podatkov, ali
– cen zdravil v drugih državah članicah Evropske unije (v nadaljnjem besedilu: EU) in državah podpisnicah Sporazuma o Evropskem gospodarskem prostoru (v nadaljnjem besedilu: EGP).
5. Proizvajalčev element cene zdravila na debelo (v nadaljnjem besedilu: PEC) je strukturni del najvišje dovoljene cene zdravila na debelo oziroma izredne višje dovoljene cene zdravila na debelo, ki predstavlja administrativno priznane stroške proizvajalca zdravila, izračunane na podlagi primerjalne cene zdravila.
6. Oznaka “CIP kupec” pomeni, da so v ceno zdravila na debelo vključeni administrativno priznani stroški proizvajalca ter prevoz in zavarovanje blaga do končnega kupca in delež za kritje stroškov prometa na debelo.
7. Administrativno priznani stroški proizvajalca so stroški proizvodnje zdravil, ki jih Javna agencija Republike Slovenije za zdravila in medicinske pripomočke (v nadaljnjem besedilu: JAZMP) prizna po tem pravilniku pri določanju cen zdravil na debelo.
8. Prisotnost zdravila na trgu v Republiki Sloveniji pomeni prisotnost zdravila, ugotovljena v skladu s 24. členom zakona.
9. Prisotnost zdravila na trgu v primerjalnih državah pomeni navedbo zdravila v publikacijah iz drugega odstavka 11. člena tega pravilnika.
10. Prisotnost zdravila na trgu v drugih državah članicah EU in državah podpisnicah Sporazuma o EGP pomeni navedbo zdravila v spletnih virih organov, pristojnih za cene in plačevanje zdravil iz javnih sredstev teh držav.
11. Skupni letni promet zdravila na drobno v vseh njegovih farmacevtskih oblikah in jakostih v vrednosti je skupna letna vrednost sredstev iz obveznega zdravstvenega zavarovanja in doplačil, vključno z lekarniškimi storitvami in davkom na dodano vrednost v koledarskem letu.
12. Skupni letni promet zdravila v količini je skupno letno število pakiranj zdravila v vseh farmacevtskih oblikah in jakostih zdravila, ki jih je zavezanec imel v prometu na debelo v koledarskem letu.
13. Skupni letni promet zdravila na ravni proizvajalca v vrednosti je skupna letna vrednost prodaje zdravil v vseh njegovih farmacevtskih oblikah in jakostih v koledarskem letu, skladna s podatki, ki jih zavezanec sporoča JAZMP na podlagi 24. člena zakona.
14. Originalno zdravilo je zdravilo, ki je ne glede na vrsto postopka pridobilo dovoljenje za promet v skladu s:
– 44. členom zakona oziroma tretjim odstavkom 8. člena Direktive 2001/83/ES Evropskega parlamenta in Sveta z dne 6. novembra 2001 o zakoniku Skupnosti o zdravilih za uporabo v humani medicini (UL L št. 311 z dne 28. 11. 2001, str. 67), zadnjič spremenjene z Direktivo 2012/26/EU Evropskega parlamenta in Sveta z dne 25. oktobra 2012 o spremembi Direktive 2001/83/ES, kar zadeva farmakovigilanco (UL L št. 299 z dne 27. 10. 2012, str. 1), (v nadaljnjem besedilu: Direktiva 2001/83/ES),
– 47. členom zakona oziroma 10.a členom Direktive 2001/83/ES, če zavezanec izkaže pravice originalnega proizvajalca,
– 49. členom zakona oziroma 10.b členom Direktive 2001/83/ES ali
– 50. členom zakona oziroma 10.c členom Direktive 2001/83/ES pred iztekom podatkovne zaščite.
15. Obrazec v elektronski obliki je obrazec na elektronski predlogi, naloženi s spletne strani JAZMP.
16. Kalkulativni elementi proizvodne cene zdravila so materialni stroški, stroški dela, stroški energije in drugi poslovni stroški.
3. člen
(1) Ne glede na izraze, opredeljene v 6. členu zakona, se v tem pravilniku uporabljajo naslednji izrazi:
1. Generično zdravilo je zdravilo, ki je ne glede na vrsto postopka:
a) pridobilo dovoljenje za promet v skladu s:
– 45. členom zakona oziroma prvim odstavkom 10. člena Direktive
2001/83/ES ali
– 52. členom zakona oziroma 16.a členom Direktive 2001/83/ES ali
b) pridobilo dovoljenje za promet v skladu s:
– šestim odstavkom 45. člena zakona oziroma tretjim odstavkom 10. člena Direktive 2001/83/ES;
– 47. členom zakona oziroma 10.a členom Direktive 2001/83/ES, ali
– 50. členom zakona oziroma 10.c členom Direktive 2001/83/ES po izteku podatkovne zaščite originalnega zdravila, pri čemer zavezanec ne izkazuje dokazil o originalnem izvoru zdravila v smislu določb prejšnje točke tega člena;
2. Podobno biološko zdravilo je zdravilo, ki je pridobilo dovoljenje za promet v skladu s šestim odstavkom 45. člena zakona oziroma četrtim odstavkom 10. člena Direktive 2001/83/ES in ustreza definiciji iz 58. točke 6. člena zakona.
(2) Izrazi iz prejšnjega odstavka se smiselno uporabljajo tudi za zdravila, ki so financirana iz javnih sredstev oziroma so namenjena za financiranje iz javnih sredstev in v Republiki Sloveniji nimajo dovoljenja za promet, imajo pa:
– dovoljenje iz tretje alineje tretjega odstavka 20. člena zakona;
– dovoljenje za uvoz oziroma vnos zdravil, za zdravilo, ki nima dovoljenja za promet in je razvrščeno v seznam esencialnih ali nujno potrebnih zdravil na podlagi zakona,
– dovoljenje za promet s paralelno uvoženim zdravilom ali
– potrdilo o prejemu obvestila o paralelni distribuciji zdravil na podlagi določb 118. člena zakona.
4. člen
Ta pravilnik določa cene zdravil v prometu na debelo brez davka na dodano vrednost CIP kupec.
II. OBLIKOVANJE IN DOLOČANJE NAJVIŠJIH DOVOLJENIH IN IZREDNIH VIŠJIH DOVOLJENIH CEN ZDRAVIL
5. člen
(1) Najvišje dovoljene cene zdravil se oblikujejo in določajo na podlagi:
1. primerjav cen zdravil v primerjalnih državah,
2. primerjav cen zdravil v drugih državah članicah EU in državah podpisnicah Sporazuma o EGP, če zdravila ni na trgih primerjalnih držav ali
3. primerjav cen zdravil v drugih evropskih državah, če zdravila ni na trgu v državah iz 1. in 2. točke tega odstavka.
(2) Izredne višje dovoljene cene zdravil se določajo na podlagi meril, postopkov in načina iz tega pravilnika.
6. člen
(1) Datum začetka veljavnosti najvišje dovoljene cene zdravila se določi z odločbo in ne sme presegati 90 dni od prejema popolne vloge. Če v tem roku ni odločeno, je datum začetka veljavnosti te cene dan po izteku tega roka.
(2) Datum začetka veljavnosti izredne višje dovoljene cene zdravila se določi z odločbo. Če v 90 dneh od prejema popolne vloge oziroma v podaljšanem 60 dnevnem roku o predlagani izredni višji dovoljeni ceni zdravila odločba ni izdana, je datum začetka veljavnosti te cene dan po izteku navedenih rokov.
(3) Kadar zaradi preobremenjenosti z vlogami za določanje izrednih višjih dovoljenih cen JAZMP predvidi podaljšanje postopka v 60 dnevnem roku iz prejšnjega odstavka, o tem pred iztekom 90 dnevnega roka iz prejšnjega odstavka izda sklep.
(4) Če odločba iz prvega ali drugega odstavka tega člena ni izdana v rokih iz tega člena se zdravilo lahko trži po ceni, kot je bila v vlogi predlagana, vendar najdlje do izdaje nove odločbe, izdane na podlagi vloge, vložene v rokih iz prvega odstavka 23. člena tega pravilnika.
7. člen
(1) Najvišja dovoljena cena zdravila velja do uveljavitve nove najvišje dovoljene cene zdravila.
(2) Ne glede na prejšnji odstavek najvišja dovoljena cena zdravila preneha veljati 30. dan po preteku roka za oddajo vlog iz prvega odstavka 23. člena tega pravilnika, če zavezanec v tem roku ne odda vloge.
(3) Določena izredna višja dovoljena cena zdravila lahko velja največ eno leto.
8. člen
(1) Če se dovoljenje za promet zdravila prenese na drugega zavezanca, se za zadevno zdravilo uporablja cena, ki je že določena, in nova vloga za določitev najvišje dovoljene cene in izredne višje dovoljene cene zdravila ni potrebna, če ta ostane nespremenjena.
(2) Zavezanec JAZMP sporoči podatke o prenosu dovoljenja najpozneje v petnajstih dneh od prejema odločbe o prenosu.
1. Merila, postopek in način za oblikovanje in določanje najvišjih dovoljenih cen zdravil
9. člen
(1) Zavezanci vložijo pri JAZMP vlogo za določitev najvišjih dovoljenih cen zdravil v pisni in elektronski obliki za zdravila iz prvega odstavka 158. člena zakona, ki so financirana iz javnih sredstev oziroma so namenjena za financiranje iz javnih sredstev.
(2) Sestavni del vloge iz prejšnjega odstavka je izpolnjen obrazec Bi iz Priloge 1 tega pravilnika v elektronski obliki v pdf in xls formatu. Vlogi je treba priložiti dokazila o podatkih, navedenih v vlogi.
(3) Zavezanec za cene zdravil, ki je oseba javnega prava, ustanovljena v Republiki Sloveniji in:
– ni proizvajalec, JAZMP predloži tudi dokumentacijo, iz katere je razvidna proizvajalčeva prodajna cena, po kateri oseba javnega prava, ustanovljena v Republiki Sloveniji, kupuje zdravilo;
– je proizvajalec zdravila v celoti ali delno, JAZMP predloži tudi speciikacije in vsote kalkulativnih elementov proizvodne cene
10. člen
Najvišje dovoljene cene zdravil se oblikujejo in določajo na podlagi izračuna vrednosti PEC, ki ni višja od najvišje dovoljene vrednosti PEC, in dodanega deleža oziroma določene vrednosti, namenjene kritju stroškov prometa na debelo (v nadaljnjem besedilu: delež veletrgovine), v skladu z izračunom cene zdravila na debelo v Prilogi 3, ki je sestavni del tega pravilnika.
11. člen
(1) Vrednost PEC se izračuna na podlagi primerjalne cene zdravil.
(2) Osnova za izračun primerjalne cene zdravil so cene zdravil, ki so inancirana iz javnih sredstev v primerjalnih državah Avstriji, Franciji in Nemčiji (v nadaljnjem besedilu: primerjalne države). Za ugotavljanje vrednosti PEC se uporabljajo zadnje izdaje tiskanih ali elektronskih publikacij oziroma pripadajoči spletni viri z navedbo primerjalnih cen zdravil in datuma zajema podatkov:
– Avstrija: Erstattungskodex, izdajatelj Hauptverband der osterreichischen Sozialversicherungstrager (publikacija ali spletni vir) izračun iz cene zdravila na drobno;
– Francija: Vidal, izdajatelj Vidal France (neposredni spletni vir ali izdajateljev licenčni vir) izračun iz cene zdravila na drobno oziroma uporaba cenovnega standarda UCD, kadar cena na drobno ni podana in zdravilo izključno oziroma pretežno in v okviru svojih storitev uporabljajo osebe, ki izvajajo zdravstveno dejavnost na sekundarni ali terciarni ravni;
– Nemčija: Lauer-Taxe, izdajatelj Lauer-Fischer GmbH (elektronska izdaja ali spletni vir); ali cenik ABDA Datenbank, izdajatelj Bundesvereinigung Deutscher Apothekerverbande (elektronska izdaja ali spletni vir); izračun iz cene zdravila na debelo z upoštevanjem najnižje cene zdravila na debelo, ki se nanaša na javno inanciranje zdravila.
(3) Ne glede na prejšnji odstavek se pri primerjalni državi Avstriji za zdravila, ki jih publikacija Erstattungskodex ne navaja, uporablja publikacija Warenverzeichnis, izdajatelj Osterreichische Apotheker-Verlagsgesellschaft m.b.H. (spletni vir), izračun iz cene zdravila na drobno, inancirane iz javnih sredstev brez davka na dodano vrednost.
(4) Cene iz publikacij primerjalnih držav se za posamezno primerjalno državo preračunajo na naslednji način:
– za Nemčijo se cene preračunajo tako, da se uporabi Enačba 1, ki je v Prilogi 2, ki je sestavni del tega pravilnika;
– za Francijo se cene preračunajo tako, da se uporabita Enačba 2 in Tabela 1, ki sta v Prilogi 2 tega pravilnika;
– za Avstrijo se cene preračunajo tako, da se uporabi Tabela 2, ki je v Prilogi 2 tega pravilnika.
(5) Ne glede na prejšnji odstavek zavezanci kot primerjalne cene zdravil pri zdravilih, ki se v primerjalnih državah prodajajo izvajalcem zdravstvenih storitev neposredno mimo veletrgovcev, neposredno upoštevajo cene, navedene v publikaciji primerjalne države.
(6) Zavezanci v primeru iz prejšnjega odstavka predložijo:
– izjavo o obstoju tega načina prodaje zdravil;
– preračun cene v skladu s tem pravilnikom z upoštevanjem dejanske prodajne cene na debelo in z obrazložitvijo za vsako od primerjalnih držav ter
– dokazilo o dejanski prodajni ceni na debelo, ki, če predstavlja plačilni dokument, ne sme biti starejše od treh mesecev.
12. člen
(1) Vrednost PEC originalnega zdravila se ugotovi na podlagi primerjalne cene zdravila, ki je za originalno zdravilo najnižja preračunana cena enakega zdravila v katerikoli od primerjalnih držav. Če je zdravilo prisotno na trgu le v eni ali v dveh primerjalnih državah, se upoštevajo le preračunane cene v teh državah. Vrednost PEC originalnega zdravila lahko dosega največ 100 odstotkov primerjalne cene zdravila.
(2) Vrednost PEC generičnega zdravila se ugotovi na podlagi cen generičnih zdravil v primerjalnih državah na naslednji način:
– če je generično zdravilo prisotno na trgu v vseh primerjalnih državah, je primerjalna cena zdravila povprečje srednjih vrednosti preračunanih cen v teh državah. Srednja vrednost preračunanih cen v posamezni primerjalni državi je aritmetična sredina vrednosti najnižje in najvišje preračunane cene. Če je v posamezni državi prisotno le eno generično zdravilo, se upošteva preračunana cena tega. Vrednost PEC generičnega zdravila lahko dosega največ 72 odstotkov primerjalne cene;
– če je generično zdravilo prisotno na trgu v dveh primerjalnih državah, je primerjalna cena zdravila povprečje srednjih vrednosti preračunanih cen v teh dveh primerjalnih državah. Srednja vrednost preračunanih cen v posamezni državi je aritmetična sredina vrednosti najnižje in najvišje preračunane cene. Če je v posamezni državi prisotno le eno generično zdravilo, se upošteva cena tega. Vrednost PEC generičnega zdravila lahko dosega največ 72 odstotkov primerjalne cene;
– če je generično zdravilo prisotno na trgu le v eni primerjalni državi ali če v primerjalnih državah na trgu ni generičnega zdravila, lahko vrednost PEC generičnega zdravila dosega največ 68 odstotkov primerjalne cene originalnega zdravila iz prejšnjega odstavka;
– če je generično zdravilo prisotno na trgu le v eni primerjalni državi, v kateri ni originalnega zdravila, je primerjalna cena zdravila povprečje najvišje in najnižje vrednosti preračunane cene v tej državi. Če je v tej državi prisotno le eno generično zdravilo, se upošteva njegova cena. Vrednost PEC generičnega zdravila lahko dosega največ 72 odstotkov primerjalne cene.
(3) Vrednost PEC podobnega biološkega zdravila se ugotovi na podlagi primerjalne cene zdravila, ki je, kadar:
– je enako podobno biološko zdravilo prisotno na trgih primerjalnih držav, najnižja preračunana cena enakega zdravila v katerikoli od primerjalnih držav. Če je zdravilo prisotno na trgu le v eni ali v dveh primerjalnih državah, se upoštevajo le preračunane cene v teh državah. Vrednost PEC podobnega biološkega zdravila lahko dosega največ 92 odstotkov primerjalne cene zdravila;
– enakega podobnega biološkega zdravila ni na trgih primerjalnih držav, enaka mediani proizvajalčevih cen tega podobnega biološkega zdravila v vseh drugih državah članicah EU oziroma državah podpisnicah Sporazuma o EGP, v katerih se po podatkih zavezanca zdravilo trži. V primeru parnega števila teh držav se primerjalna cena zdravila ugotovi kot srednja vrednost proizvajalčevih cen dveh primerjalnih držav, ki sta po položaju v sredini nabora. Vrednost PEC podobnega biološkega zdravila lahko dosega največ 92 odstotkov primerjalne cene zdravila;
– enakega biološko podobnega zdravila ni na trgih primerjalnih držav in tudi ne na trgih drugih držav članic EU oziroma držav podpisnic Sporazuma o EGP, se primerjalna cena tega zdravila ugotovi kot primerjalna cena referenčnega biološkega zdravila, ki mu je zadevno biološko zdravilo podobno. Vrednost PEC podobnega biološkega zdravila lahko dosega največ 68 odstotkov primerjalne cene zdravila. Če obstajajo razlike v učinkovitosti zdravila, se dodatno upoštevajo tudi podatki o razliki v učinkovitosti zdravila, navedeni v Evropskem poročilu o oceni zdravila (EPAR) oziroma v dokumentih organov, pristojnih za vrednotenje zdravstvenih tehnologij v državah članicah EU, ki se izračuna z enačbo:
PEC (BPZ) = PEC (RBZ)*0,68* (delež učinkovitosti BPZ po EPAR),
kjer pomenijo:
PEC (BPZ) – PEC biološko podobnega zdravila
PEC (RBZ) – PEC referenčnega biološkega zdravila.
13. člen
(1) V primeru različnega števila enot odmerjanja zdravila v pakiranju, se za vsako posamezno primerjalno državo posebej upoštevajo po številu enot primerljiva pakiranja. Primerjalna cena zdravila se nato preračuna na število enot odmerjanja pri zdravilu zavezanca.
(2) Primerjalna cena zdravila se za vsako posamezno primerjalno državo posebej ugotavlja za vsako farmacevtsko obliko posebej. Če v primerjalnih državah ni enake farmacevtske oblike, se lahko primerja sorodna farmacevtska oblika (npr. tableta – dražeja), pri čemer farmacevtskih oblik zdravil z nadzorovanim sproščanjem učinkovin ni mogoče enačiti s farmacevtskimi oblikami s hitrim sproščanjem.
(3) Primerjalna cena zdravila se ugotavlja za vsako jakost posebej. Če v nobeni od primerjalnih držav ni iste jakosti, se smiselno uporabi preračun iz cen ostalih jakosti.
14. člen
Vrednost PEC paralelno uvoženega ali paralelno distribuiranega zdravila se ugotovi s primerjavo preračunanih cen zdravila, na katerega dovoljenje za promet v Republiki Sloveniji se je skliceval imetnik dovoljenja za paralelni uvoz zdravila ali imetnik potrdila iz tretjega odstavka 118. člena zakona, na način, da je primerjalna cena paralelno uvoženega ali paralelno distribuiranega zdravila enaka preračunani ceni zdravila, na katero se to zdravilo sklicuje. Vrednost PEC lahko dosega največ 100 odstotkov primerjalne cene zdravila.
15. člen
(1) Ne glede na določbo drugega odstavka 9. člena tega pravilnika vloga, če v primerjalnih državah ni niti generičnega niti originalnega zdravila, vsebuje naslednje sestavine:
– obrazloženi predlog najvišje dovoljene cene zdravila na debelo;
– podatek o dosedanji veljavni ceni zdravila na debelo oziroma najvišji dovoljeni ceni zdravila in podatke o njeni strukturi (delež, namenjen pokritju stroškov izdelave, ki vključujejo tudi stroške, ki izhajajo iz zahtev pristojnih organov na podlagi predpisov, ki urejajo zdravila, cene zdravil, kritja zdravil iz zdravstvenega zavarovanja in stroškov trgovine na debelo), če so bile te cene določene;
– podatke o proizvajalčevih cenah in cenah zdravil na debelo brez davka na dodano vrednost CIP kupec v drugih državah članicah EU oziroma državah podpisnicah Sporazuma o EGP oziroma če zdravilo ni prisotno na trgu v teh državah, ustrezne podatke za druge evropske države, v katerih je po podatkih zavezanca to zdravilo prisotno na trgu, z navedbo vira in na obrazcu B3 iz Priloge 1 tega pravilnika v elektronski obliki v pdf in xls formatu;
– podatke o inanciranju zdravila iz javnih sredstev v drugih državah članicah EU oziroma državah podpisnicah Sporazuma o EGP, v katerih je po podatkih zavezanca to zdravilo prisotno na
trgu;
– dokazila o podatkih iz vloge.
(2) Vrednost PEC se ugotovi kot mediana proizvajalčevih cen na podlagi podatkov zavezanca v drugih državah članicah EU oziroma državah podpisnicah Sporazuma o EGP, v katerih se po podatkih zavezanca zdravilo trži in je inancirano iz javnih sredstev. Če zdravilo ni prisotno na trgu držav članic EU in držav podpisnic Sporazuma o EGP, se vrednost PEC ugotovi kot mediana proizvajalčevih cen v drugih evropskih državah, v katerih je zdravilo prisotno na trgu.
(3) Najvišja dovoljena cena zdravila je enaka vrednosti PEC iz prejšnjega odstavka, povečana največ za dodani delež veletrgovine, na podlagi tabele iz Priloge 3, ki je sestavni del tega pravilnika.
Pravilnik o določanju cen zdravil za uporabo v humani medicini
2. Merila in elementi odločanja za določanje izredne višje dovoljene cen zdravil 16. člen
(1) Zavezanec lahko vloži vlogo za določitev izredne višje dovoljene cene zdravila, kadar:
– ima zdravilo določeno najvišjo dovoljeno ceno oziroma je zavezanec pri JAZMP istočasno vložil vlogo za določitev najvišje dovoljene cene in izredne višje dovoljene cene zdravil;
– na trgu v Republiki Sloveniji ni zdravila z enako učinkovino, farmacevtsko obliko in enako jakostjo, katerega veljavna cena je nižja od predlagane izredne višje dovoljene cene zdravila;
– na trgu v Republiki Sloveniji ni zdravila z isto terapevtsko indikacijo in enakim farmakološkim mehanizmom, katerega veljavna cena je nižja od predlagane izredne višje dovoljene cene zdravila in
– vrednost skupnega letnega prometa zdravila v vseh njegovih farmacevtskih oblikah in jakostih, ob upoštevanju njihove cene, veljavne na dan vloge, ne presega 400.000 eurov za preteklo koledarsko leto oziroma vrednost skupnega letnega prometa ne presega 100.000 eurov za preteklo koledarsko leto pod pogojem, da vrednost skupnega letnega prometa v preteklem letu ne presega indeksa rasti 150 na letni ravni.
(2) Ne glede na določbo četrte alinee prejšnjega odstavka lahko zavezanec vloži vlogo za določitev izredne višje dovoljene cene zdravila, kadar skupni promet z zdravilom v zadnjem koledarskem letu presega 400.000 eurov, kadar na trgu ni ustreznega nadomestnega zdravila.
(3) Vloga za določitev izredne višje dovoljene cene zdravila se vloži pri JAZMP v dveh pisnih izvodih in v elektronski obliki.
(4) Vloga za določitev izredne višje dovoljene cene za zdravila, ki niso uvrščena v seznam esencialnih ali nujno potrebnih zdravil iz 17. člena zakona, vsebuje:
– utemeljitev predloga, da najvišja dovoljena cena zdravila na podlagi meril iz tega pravilnika zavezancu ne omogoča preskrbe trga v Republiki Sloveniji, vključno s podatki o dejanskih stroških, ki dodatno bremenijo zdravilo in so podlaga za zahtevo za izredno višjo dovoljeno ceno zdravila;
– informativni izračun najvišje dovoljene cene zdravila na debelo na podlagi meril iz tega pravilnika na obrazcu B1 iz Priloge 1 tega pravilnika v pdf in xls formatu;
– izračun predlagane izredne višje dovoljene cene zdravila na obrazcu B2 iz Priloge 1 tega pravilnika v pdf in xls formatu;
– podatke o obsegu prodaje vseh farmacevtskih oblik, jakosti in pakiranj zdravila v Republiki Sloveniji za obdobje zadnjih treh let do vložitve vloge, pri čemer se za zdravila, ki so na trgu krajše obdobje od zahtevanega oziroma šele prihajajo na trg, navede predviden obseg prodaje;
– podatke o proizvajalčevih cenah in o cenah na debelo istega zdravila, inanciranega iz javnih sredstev ter podatke o količinskem prometu s tem zdravilom v drugih državah članicah EU oziroma državah podpisnicah Sporazuma o EGP, v katerih se po podatkih zavezanca zdravilo trži, z navedbo vira, ali podatke za zdravila, ki se ne tržijo v državah članicah EU oziroma državah podpisnicah Sporazuma o EGP, v drugih evropskih državah, kjer se zdravilo trži, na obrazcu B3 iz Priloge 1 v xls formatu;
– analizo vpliva na javna sredstva za zdravila, pri katerih je v državah članicah EU oziroma državah podpisnicah Sporazuma o EGP od vključitve zadnje dodane terapevtske indikacije v dovoljenje za promet, preteklo več kot deset let, za druga zdravila pa tudi farmakoekonomsko analizo, obe pa sta pripravljeni na podlagi upoštevanih podatkov za Republiko Slovenijo, oziroma na podlagi podatkov iz drugih držav članic EU oziroma držav podpisnic Sporazuma o EGP, ki so ustrezno metodološko in podatkovno prevedeni z upoštevanjem podatkov za Republiko Slovenijo;
– oceno relativne terapevtske vrednosti zdravila ali ustrezno oblikovane farmakoepidemiološke podatke, ki vključujejo upoštevne podatke za Republiko Slovenijo.
(5) Za zdravila, katerih promet na drobno, v vseh njegovih farmacevtskih oblikah, jakostih in pakiranjih, prisotnih na trgu v Republiki Sloveniji, ne presega 50.000 eurov na letni ravni v preteklem koledarskem letu, k vlogi ni treba predložiti analiz in podatkov iz šeste in sedme alinee prejšnjega odstavka.
(6) Za zdravila, ki nimajo dovoljenja za promet, imajo pa dovoljenje za vnos oziroma uvoz zdravil ali začasno dovoljenje za promet z zdravilom in so uvrščena v seznam esencialnih ali nujno potrebnih zdravil iz 17. člena zakona, k vlogi ni treba predložiti podatkov iz pete, šeste in sedme alineje četrtega odstavka tega člena.
17. člen
JAZMP pri odločitvi o izredni višji dovoljeni ceni zdravila upošteva:
– mnenje komisije iz četrte alineje petega odstavka 4. člena zakona (v nadaljnjem besedilu: komisija);
– ugotovljen javni interes na področju zdravja;
– ugotovljeno oceno tveganja zaradi morebitnih motenj v preskrbi z obravnavanim zdravilom z ekonomsko utemeljitvijo oziroma dokazljive, neizogibne in nesorazmerne stroške, ki bi nastali zaradi izpolnjevanja obveznosti javnih storitev.
18. člen
(1) Komisija se v svojem mnenju, oblikovanem na podlagi podatkov iz popolne vloge, podatkov o zdravilu in drugih podatkov, ki odražajo stanje razvoja znanosti in stroke, opredeli
do:
– pomena zdravila v okviru nacionalnih zdravstvenih prioritet,
Pravilnik o določanju cen zdravil za uporabo v humani medicini
upoštevajoč njegovo nujnost, pomembnost in nenadomestljivost;
– javnozdravstvenega tveganja, ki bi nastalo zaradi motene preskrbe z zdravilom, vključno z njegovim ekonomskim vidikom;
– vpliva na javnoinančna sredstva zaradi odobritve izredne višje dovoljene cene zdravila.
(2) Komisija vrednoti podatke iz popolne vloge na podlagi tega pravilnika in pripravi mnenje, v katerega vključi svoje ugotovitve, izražene v obliki točkovanja, pri katerem upošteva naslednja merila:
1. relativna terapevtska vrednost, ki pomeni dodatno učinkovitost z izboljšanjem zdravstvenih izidov (ocenjuje se kot stopnja strinjanja komisije z utemeljenostjo zahtevka za določitev izredne višje dovoljene cene zdravila na intervalu 1-5 točk);
2. stroškovna učinkovitost zdravila oziroma so podane ustrezne inančno-ekonomske utemeljitve v primerjavi z drugimi možnimi načini zdravljenj (ocenjuje se kot stopnja strinjanja komisije z utemeljenostjo zahtevka za določitev izredne višje dovoljene cene zdravila na intervalu 1-5 točk);
3. uravnoteženost predlagane izredne višje dovoljene cene zdravila s cenami zadevnega zdravila v drugih državah članicah EU oziroma državah podpisnicah Sporazuma o EGP, upoštevajoč bistvene značilnosti primerjanih trgov, in sicer:
– 5 točk – predlog več kot 10 odstotkov pod mediano cene zdravila na primerjanih trgih;
– 4 točke – predlog med 5 in 10 odstotki pod mediano cene zdravila na primerjanih trgih;
– 3 točke – predlog na intervalu med 0 in 5 odstotki pod mediano cen zdravila na primerjanih trgih;
– 2 točki – znotraj 5 odstotnega presežka mediane cen zdravila na primerjanih trgih;
– 1 točka – več kot 5 odstotno preseganje mediane cen zdravila na primerjanih trgih;
4. obstoj speciičnih dejavnikov, pomembnih za umeščanje obravnavanega zdravila v nacionalne zdravstvene programe, skladno s podanimi prioritetami in etičnimi vidiki (ocenjuje se kot stopnja strinjanja komisije z utemeljenostjo zahtevka za določitev izredne višje dovoljene cene zdravila na intervalu 1-5 točk).
(3) Pri vrednotenju podatkov iz vlog za zdravila, ki nimajo dovoljenja za promet, imajo pa dovoljenje za vnos oziroma uvoz zdravil ali začasno dovoljenje za promet z zdravilom in so uvrščena v seznam esencialnih oziroma nujno potrebnih zdravil iz 17. člena zakona, komisija upošteva merila iz 1. in 4. točke prejšnjega odstavka.
19. člen
(1) Komisija se v svojem mnenju, poleg opredelitev iz prejšnjega člena, opredeli do višine predlagane izredne višje dovoljene cene zdravila, na enega od naslednjih načinov:
1. s pozitivnim mnenjem predlaga izredno višjo dovoljeno ceno zdravila, kot je bila predlagana v vlogi, kadar je vsota točk iz drugega odstavka prejšnjega člena enaka ali večja od 18 za zdravila, ki so pridobila dovoljenje za promet ali dovoljenje s paralelno uvoženim zdravilom ter 10 ali več za zdravila, ki nimajo dovoljenja za promet, imajo pa dovoljenje za vnos oziroma uvoz ali začasno dovoljenje za promet z zdravilom in so uvrščena v seznam iz 17. člena zakona, ali
2. s pozitivnem mnenjem predlaga izredno višjo dovoljeno ceno zdravila, ki je nižja od predlagane v vlogi, in sicer v višini, ki se izračuna z enačbo:
PEC(DIVDC) = PEC(NDC) + DT/MT * (PEC(PIVDC)-PEC(NDC)) *
(min(PEC(mediana(ER)) / PEC(PIVDC); (PEC(PIVDC) – PEC(NDC)) /
max(PEC(mediana(ER)); PEC(NDC))),
kjer pomenijo:
PEC(DIVDC) – določen PEC izredne višje dovoljene cene
PEC(PIVDC) – predlagan PEC izredne višje dovoljene cene
PEC(NDC) – PEC najvišje dovoljene cene
DT – število doseženih točk
MT – možno število točk
PEC(mediana(ER)) – mediana proizvajalčevih cen v državah članicah EU oziroma državah podpisnicah
Sporazuma o EGP, kjer se zdravilo trži, in sicer:
– če so na voljo podatki le iz dveh držav, se upošteva aritmetična sredina cen teh dveh držav;
– če je na voljo samo podatek iz ene države, se upošteva podatek za to državo;
– če je ta država Republika Slovenija, se upošteva najvišja dovoljena cena;
3. s pozitivnim mnenjem predlaga, da se določi izredna višja dovoljena ceno zdravila, in sicer v višini, ki jo ugotovi in utemelji komisija, pri čemer sorazmerno upošteva tudi izid ocenjevanja iz drugega odstavka prejšnjega člena;
4. z negativnim mnenjem predlaga, da se izredna višja dovoljena cena zdravila ne določi.
(2) Če komisija da negativno mnenje, ga utemelji, pri čemer navede opredelitve iz prvega odstavka prejšnjega člena in število doseženih točk iz vrednotenja podatkov iz vloge iz drugega odstavka prejšnjega člena.
20. člen
(1) JAZMP ugotavlja prisotnost javnega interesa na področju zdravja glede na prisotnost zdravila na trgu v okviru nacionalnih zdravstvenih prioritet z upoštevanjem podatkov o zdravilu, njegovi porabi, stroških zdravljenja ob primerjavi s stroški zdravljenja z zdravili za isto indikacijsko področje v okviru iste skupine zdravil na področju zadevne farmakoterapije, pridobljenih na podlagi protokolov o izmenjavi podatkov med Nacionalnim inštitutom za javno zdravje (v nadaljnjem besedilu: NIJZ) in Zavodom za zdravstveno zavarovanje Slovenije (v nadaljnjem besedilu: ZZZS).
(2) JAZMP lahko pri ugotavljanju javnega interesa na področju zdravja za obravnavano zdravilo v programih zdravstvenega varstva, inanciranih iz javnih sredstev, zaprosi področni razširjeni strokovni kolegij ali klinični oddelek oziroma pridobi izjave treh zdravnikov specialistov, dejavnih na področju zadevne farmakoterapije.
21. člen
JAZMP lahko pred odločanjem o najvišji dovoljeni ceni zdravila in izredni višji dovoljeni ceni zdravila od ZZZS zahteva podatke o vplivu predlagane cene na javnoinančne odhodke na ravni posameznih zdravil, skupin zdravil oziroma področja zadevne farmakoterapije.
III. USKLAJEVANJE NAJVIŠJIH DOVOLJENIH CEN ZDRAVIL IN IZREDNIH VIŠJIH DOVOLJENIH CEN ZDRAVIL
22. člen
Najvišje dovoljene cene zdravil se usklajujejo z določbami tega pravilnika dvakrat letno.
23. člen
(1) Za uskladitev cen zavezanci oblikujejo najvišje dovoljene cene zdravil v skladu z merili iz tega pravilnika in pri JAZMP vložijo vlogo za uskladitev najvišjih dovoljenih cen zdravil, in sicer v obdobju:
– od 1. marca do vključno 1. aprila tekočega leta in
– od 1. septembra do vključno 1. oktobra tekočega leta.
(2) Vloga za uskladitev najvišjih dovoljenih cen zdravil vsebuje zahtevek za določitev usklajene najvišje dovoljene cene zdravila, seznam zdravil in predlog najvišjih dovoljenih cen zdravil z izračunom, danim na obrazcu B1 iz Priloge 1, v pisni in elektronski obliki.
(3) V vlogi za uskladitev najvišjih dovoljenih cen zdravil se uporabljajo naslednje izdaje predpisanih publikacij:
1. v obdobju iz prve alinee prvega odstavka tega člena:
– Avstrija: Erstattungskodex: izdaja 1. januar tekočega leta oziroma Warenverzeichnis: podatki iz spletnega vira z datumom zajema v februarju tekočega leta;
– Francija: Vidal, datum zajema podatkov v februarju tekočega leta;
– Nemčija: Lauer-Taxe ali ABDA Datenbank: izdaja 15. februar tekočega leta;
2. v obdobju iz druge alinee prvega odstavka tega člena:
– Avstrija: Erstattungskodex: izdaja 1. januar tekočega leta in dopolnitev 1. julij tekočega leta oziroma Warenverzeichnis: podatki iz spletnega vira z datumom zajema v avgustu tekočega leta;
– Francija: Vidal, datum zajema podatkov v avgustu tekočega leta;
– Nemčija: Lauer-Taxe ali ABDA Datenbank: izdaja 15. avgust tekočega leta.
(4) Najvišje dovoljene cene zdravil se usklajujejo na način iz tega člena tudi v obdobju, ko je zdravilu dovoljenje za promet že poteklo in je lahko v skladu z zakonom v prometu do izteka roka uporabnosti zdravila, vendar največ 18 mesecev.
(5) Izredne višje dovoljene cene zdravil in najvišje dovoljene cene zdravil lahko JAZMP zniža pred potekom njihove veljavnosti na podlagi vloge zavezanca, v kateri v pisni in elektronski obliki v pdf in xls formatu navede:
– predlagano znižano najvišjo dovoljeno ceno zdravila na obrazcu B1 oziroma predlagano znižano izredno višjo dovoljeno ceno zdravila na obrazcu B2 iz Priloge 1 tega pravilnika in
– datum uveljavitve predlagane znižane cene.
IV. OBJAVLJANJE IN POSREDOVANJE CEN
24. člen
(1) JAZMP najmanj enkrat mesečno objavlja najvišje dovoljene cene zdravil in izredne višje dovoljene cene zdravil, ki jih je določila na podlagi tega pravilnika, na svoji spletni strani z navedbo:
– nacionalnega identifikatorja zdravila;
– imena in predstavitve zdravila;
– splošnega imena zdravila;
– klasifikacijske oznake zdravila;
– imena zavezanca;
– najvišje dovoljene cene zdravila oziroma izredne višje dovoljene cene zdravila;
– datuma začetka veljavnosti cene zdravila;
– režima izdaje zdravila;
– statusa zdravila (originalno, generično ali podobno biološko);
– drugih upoštevnih podatkov.
(2) Ne glede na prejšnji odstavek se v primeru iz prve alinee prvega odstavka 16. člena tega pravilnika in ko izredna višja dovoljena cena zdravila ni bila določena, najvišja dovoljena cena zdravila brez predhodnega soglasja zavezanca, ne objavi.
(3) JAZMP enkrat letno Evropski komisiji sporoči veljavne najvišje dovoljene cene zdravil in izredne višje dovoljene cene zdravil.
(4) JAZMP posreduje ZZZS, ministrstvu, pristojnemu za zdravje (v nadaljnjem besedilu: ministrstvo) in NIJZ najmanj enkrat mesečno najvišje dovoljene cene zdravil in izredne višje dovoljene cene zdravil skupaj z vrednostmi PEC in odstotki primerjalne cene v elektronski obliki.
(5) JAZMP posreduje ZZZS podatke o zdravilih iz drugega odstavka 7. člena do 25. aprila oziroma do 25. oktobra tekočega leta.
(6) ZZZS v elektronski obliki pošilja JAZMP in ministrstvu cene zdravil na debelo, dogovorjene na podlagi prve alineje prvega odstavka 159. člena zakona in datume začetka veljavnosti teh cen, in sicer na njuno zahtevo.
(7) NIJZ posreduje JAZMP, ministrstvu in ZZZS najmanj enkrat letno podatke o porabi zdravil in stroških za zdravila.
(8) JAZMP posreduje ministrstvu podatke, ki jih je prejela od osebe javnega prava, ustanovljene v Republiki Sloveniji, na podlagi tretjega odstavka 9. člena tega pravilnika, najpozneje v 30 dneh od njihovega prejema oziroma ob vsaki uskladitvi najvišje dovoljene cene zdravila za zdravilo, za katero je zavezanec oseba javnega prava, ustanovljena v Republiki Sloveniji.
25. člen
Zavezanci o najvišjih dovoljenih cenah zdravil in izrednih višjih dovoljenih cenah zdravil, ki se oblikujejo v skladu s tem pravilnikom, obvestijo poslovne subjekte, ki imajo dovoljenje za promet z zdravili na debelo oziroma dovoljenje za proizvodnjo zdravil ter imajo z njimi sklenjene pogodbe o sodelovanju, takoj oziroma najpozneje v osmih dneh po določitvi najvišje dovoljene cene zdravil oziroma izredne višje dovoljene cene zdravil in najmanj treh delovnih dneh pred njeno prvo uporabo na trgu.
V. PREHODNE IN KONČNE DOLOČBE
26. člen
Vloge, ki so bile prejete do dneva uveljavitve tega pravilnika, in o njih do tega dneva še ni bilo odločeno, se obravnavajo v skladu s tem pravilnikom.
27. člen
Z dnem uveljavitve tega pravilnika preneha veljati Pravilnik o določanju cen zdravil za uporabo v humani medicini (Uradni list RS, št. 102/10, 6/12, 16/13 in 71/13).
28. člen
Ta pravilnik začne veljati naslednji dan po objavi v Uradnem listu Republike Slovenije.
“,”Jaka Verbic Miklic”,1523610000,1523610000,sl,12645,306,12644,43,0,NULL,,”Pravilnik o določanju cen zdravil za uporabo v humani medicini, UL št. 19/2018, 23. 3. 2018″,pravilnik-o-dolocanju-cen-zdravil-za-uporabo-v-humani-medicini-ul-st-19-2018-23-3-2018,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,1,0,1523610491,1524642787
322,12647,”Zdravstveno komuniciranje med aferami in znanstvenimi dognanji”,”Posvet na Fakulteti za družbene vede”,”
Ljubljana, 7. februar 2017 – “Moč novinarskega peresa je primerljiva s skalpelom kirurga, zato je nujno nenehno izboljševanje kakovosti in odličnosti v procesu komunikacije in v novinarstvu samem,” je na strokovnem posvetu z naslovom Zdravstveno komuniciranje med aferami in znanstvenimi dognanji, ki je potekal na Fakulteti za družbene vede, dejala Diana Zajec, dolgoletna novinarka v zdravstvu prva prejemnica Hipokratovega priznanja, ki ne prihaja iz zdravniških vrst. Predstavniki medijev in zdravstva, farmacije in društev bolnikov so spregovorili o ključnih izzivih, s katerimi se srečujejo v medsebojni komunikaciji.
Strinjali so se, da sta stalna časovna stiska in kadrovska podhranjenost na vseh straneh med ključnimi razlogi za težave. Kot je pokazala razprava, dodatne izzive pri sodelovanju prinaša tudi to, da v procesu zdravstvenega komuniciranja sodelujoče strani pomanjkljivo poznajo specifične zahteve in omejitve poklicev partnerjev, s katerimi komunicirajo. Na posvetu so udeleženci opozorili na veliko odgovornost medijev v odnosu do bolnikov ter na pomen točnih in preverjenih informacij, tudi in še posebej pri poročanju o alternativnih poteh do zdravja. Bili so si enotni, da so ključ do uspeha medsebojno spoštovanje, vzpostavljanje in ohranjanje zaupanja, odprtost ter pravočasnost in resničnost informacij.
Primož Cirman, podpredsednik Društva novinarjev Slovenije, je v razpravi dejal, da po raziskavah sodeč upada zaupanje tako v zdravnike kot v medicinske sestre, čeprav slednje niso bile vpletene v nobeno afero. “Zato krivde za upadanje tega zaupanja ne bi pripisoval množičnim medijem, temveč splošnemu stanju v družbi, katerega del je tudi težak položaj slovenskih medijev in novinarjev,” je menil Primož Cirman. Dodal je, da gre javna razprava v medijih pogosto v skrajnosti, na srečo pa je prav zdravstveno novinarstvo tisto področje, kjer so novi lastniki vsaj v večjih medijskih hišah kljub vsemu ohranili specializirane novinarje. “To je namreč kompleksna tematika, ki zahteva multidisciplinarna znanja in za katero potrebuješ čas, zgodovinski spomin, mrežo virov informacij, izkušnje, poznavanje materije, številnih inštitucij in zakonov,” je opisal Primož Cirman.

Kako pomembne so točne, preverjene in resnične informacije za paciente, sta nazorno predstavili Mojca Senčar in Tanja Španič iz združenja Europa Donna. Opozorili sta na poplavo spletnih medijev, ki brez premisleka in preverjanja znanstvene utemeljenosti objavljajo velike količine prispevkov o čudežnih zdravilih, prehranskih dodatkih in alternativnih oblikah zdravljenja. “Z novinarji uglednih medijev imamo odlične izkušnje, a tu je še veliko drugih medijev, ki objavljajo zelo škodljive informacije, zbujajo lažno upanje, in posameznike vodijo celo do opuščanja učinkovitega zdravljenja,” je bila kritična Mojca Senčar.
Ena od specializiranih novinark, ki o zdravju in zdravstvu poroča že dve desetletji, je Delova novinarka Diana Zajec. Izpostavila je, da je novinar kot vrvohodec – biti mora kritičen, a konstruktivno, glavni postulat novinarskega dela pa mora ostati preverjanje informacij in objava resnice. “Za zdravstvene novinarje je zelo pomembno tudi sodelovanje s strokovnjaki za odnose z javnostmi, je pa ključno, da so odzivni ter da so njihove informacije verodostojne in ažurne. Če želimo, da sta obveščanje in osveščanje javnosti uspešna, mora biti želja po sodelovanju prisotna pri vseh in vsi se moramo izogibati komunikacijskim vrzelim. Novinarji nismo zaprti za dobre informacije, za novice o uspehih in odkritjih, vendar moramo odkrito govoriti tudi o slabih plateh. Le tako lahko skupaj naredimo ogromno za premik naprej.” Dejala je, da se je nekaj takšnih premikov v zadnjih dvajsetih letih že zgodilo. “Danes sogovorniki ne bodo rekli ne, ne želimo govoriti z vami, ne bomo odgovorili na vaša vprašanja. Včasih se je to dogajalo. Včasih tudi bolniki niso govorili z mediji o svojih boleznih, danes pa o tem skupaj odkrito govorimo. Kar nekaj vrat smo skupaj torej že odprli, do kratkih stikov pa prihaja tam, kjer stvari še niso narejene, kot denimo zdravstvena reforma ali skrajšanje čakalnih dob.”
Svoj pogled na zdravstveno komuniciranje sta predstavila tudi predstavnika zdravstva Zdenka Čebašek Travnik, predsednica Zdravniške zbornice Slovenije, in Janez Lavre, v.d. direktorja UKC Maribor. “Zdravniki smo sicer vajeni komunikacije s pacienti, svojci in sodelavci. A ta komunikacija je nadzorovana, njen končni rezultat je pogosto nek pisni izdelek, v njej uporabljamo jezik, ki ga razumemo. Komunikacija z mediji pa ni naše vsakdanje delo, nad njo nimamo nadzora, saj nikoli ne vemo, kaj bo zares nastalo iz informacij, ki jih damo medijem. Zato smo pri komuniciranju z mediji pazljivi, radi vidimo, da vprašanja dobimo v pisni obliki, mnogi med nami pa tega zaradi negotovosti enostavno nočejo početi,” je iskreno povedala Zdenka Čebašek Travnik. Opozorila je, da se novinarji premalo zavedajo, da so zdravniki v komunikaciji z njimi tudi pravno omejeni: “Novinarji hočejo zgodbe, a ne pomislijo, da je pacientova zgodba le ena plat. Če bi želel zdravnik povedati kaj v svoj zagovor, bi moral za to razkriti informacije o pacientu, česar pa ne sme. Še posebej težko nam je ob tragičnih dogodkih. Nanje nikoli nisi pripravljen, vedno si ob njih v stiski, medijske ekipe pa so že pred vrati in sprašuješ še, kaj naj povem in komu, da ne bo še več škode in več prizadetih.”
Pa vendar imamo v zdravstvu, medicini in farmaciji tudi dobre zgodbe, o tem ni dvoma. A mediji, kot je opazila Zdenka Čebašek Travnik, o slabih stvareh, aferah in napakah poročajo več mesecev, o dobrih stvareh, kot so uspehi pri zdravljenju, pridobitev nove opreme ali znanstvena odkritja pa le enkratno. Janez Lavre je menil, da je eno od poslanstev javne zdravstvene ustanove tudi posredovanje dobrih zgodb, Majda Hostnik, nekdanja novinarka v zdravstvu in danes vodja službe za odnose z javnostmi na Ministrstvu za zdravje, pa ga je dopolnila, da dobre zgodbe nikakor niso iz mode in da jih imamo veliko v vsaki bolnišnici. “A če se ves čas ukvarjamo z drugimi vrstami odgovorov medijem, sploh ne pridemo do tega, da bi novinarjem lahko ponudili dobre zgodbe. Me pa zelo veseli, da je nekaj medijev že spoznalo, da se gledanost dviguje tudi z dobrimi zgodbami, torej brez krvi, solza in seksa.”
Sogovorniki so se med drugim spraševali, ali bi uvedba jasnih, sistematiziranih smernic oziroma komunikacijskih protokolov v zdravstvu resnično pripomogla k manjšemu številu zapletov in k več pozitivnim zgodbam. Zdenka Čebašek Travnik je dejala, da bi morali takšne protokole sprejeti na novinarski in zdravstveni strani: “Menim, da niso le nepotrebna administracija, temveč bi nam pomagali, da bi hitreje prišli skupaj.” Diana Zajec je menila, da bo do sprejetja protokolov zagotovo minilo še veliko časa, “vmes pa lahko že sami veliko naredimo. Ključno je, da novinarji ne naletimo na molk. Če zdravnik noče, ne more ali si ne upa dati izjave, imamo v vseh sistemih odgovorne osebe, te pa morajo dati informacije. Novinar bo zadovoljen, tudi če dobi zelo splošne informacije.” Tudi Primož Cirman je poudaril, se z vsako minuto molka povečuje možnost za različne interpretacije dogodka, ki lahko zajadrajo v smer, ki je druga stran ne more več nadzirati: “Sploh pri izrednih dogodkih je čas za novinarja ključen, hkrati pa se ne smemo slepiti, da nekateri ne ravnajo tudi mrhovinarsko.”
“V zdravstvu res nimamo vzpostavljenih ustreznih pogojev za javno komuniciranje, zato smo seveda ranljivi. V tujini imajo protokole posredovanja informacij na vseh ravneh. Poleg smernic, kako zdraviti pljučnico, imajo tudi smernice, kako o zdravljenju pljučnice komunicirati z bolnikom in s splošno javnostjo. Njihove izkušnje potrjujejo, da sistematično komuniciranje z vsemi deležniki pozitivno vpliva na vse. Zato upam, da bo ta dogodek spodbudil odločevalce k vpeljavi strateškega komuniciranja v zdravstveni sistem,” je ob začetku posveta izpostavila Saška Terseglav, vodja odnosov z javnostmi na Združenju zdravstvenih zavodov Slovenije.
Dogodku ob bok je Barbara Stegel, generalna sekretarka Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, ki je bil pobudnik posveta, poudarila, da so skupaj s Fakulteto za družbene vede in Združenjem zdravstvenih zavodov Slovenije strokovni posvet pripravili z željo po odkrivanju težav, a predvsem tudi z željo po iskanju rešitev za te težave. “Veseli nas, da je bila debata tako odprta in iskrena. Vsekakor je bil dogodek vzpodbuda za naprej in za odličnost v zdravstvenem komuniciranju si bomo prizadevali tudi v prihodnje. Danes smo si lahko enotni, da bo sodelovanje med zdravstvom, medicino in farmacijo ter mediji v prihodnje moralo postati bolj poglobljeno in intenzivno, hkrati pa tudi bolj poljudno in sproščeno. Le tako lahko skupaj zagotovimo, da se zdravstvene, medicinske in farmacevtske vsebine ne bodo izgubile v poplavi rumenega tiska, nepreverjenih in površnih objav, kar ne more in ne sme biti v interesu nikogar od sodelujočih v tem procesu. Naša skupna naloga je, da kakovostne, relevantne in objektivne informacije, ki bodo hkrati zanimive in razumljive, pridejo do najširše javnosti,” je dejala Barbara Stegel.
“,”Jaka Verbic Miklic”,1486468800,1486468800,sl,12647,306,12646,43,0,NULL,,”Zdravstveno komuniciranje med aferami in znanstvenimi dognanji”,zdravstveno-komuniciranje-med-aferami-in-znanstvenimi-dognanji,Post,”/sites/43/files/images/news/Medical reporting/Medical reporting 1.jpg”,1,0,1523617995,1523618597
326,12671,”Okrogla miza Še verjamemo v znanost?”,”Psevdoznanstvena zatrjevanja sejejo strah med ljudmi, a zdravnikom in znanosti zaupamo”,”
Ljubljana, 18. april 2018 – Na okrogli mizi »Še verjamemo v znanost?«, ki je potekala na Slovenski akademiji znanosti in umetnosti, so udeleženci soočili poglede na razmerje med znanostjo in mejno znanostjo. Strinjali so se, da kljub poplavi psevdoznanstvenih zatrjevanj, ki krepijo predvsem dvom na področju sodobne medicine ter sejejo strah med ljudmi, zdravnikom in znanosti zaupamo, še več – znanstveniki se po vseh doslej opravljenih raziskavah javnega mnenja v Sloveniji uvrščajo med najbolj zaupanja vredne poklice. In vendar je, v izogib negativnim posledicam psevdoznanstvenih trditev za javno zdravje, prebivalstvo potrebno verodostojno informirati in ozaveščati o pomenu preprečevanja nalezljivih in kroničnih nenalezljivih bolezni, varnosti zdravil in cepiv, krepiti zaupanje v znanost ter dosledno opozarjati na zavajajoče trditve.
Na okrogli mizi v organizaciji Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, ki je potekala na SAZU, so udeleženci razmišljali o razlogih in posledicah vse pogostejših izrazov nezaupanja v dosežke sodobne medicine. Tako smo zadnja leta priče glasnemu nasprotovanju obveznemu cepljenju, ki je ključno za preprečevanje širjenja nalezljivih bolezni. Zato so na Ministrstvu za zdravje lani okrepili komunikacijske aktivnosti o dobrobitih cepljenja, je pojasnila generalna direktorica Direktorata za javno zdravje Mojca Gobec, dr. med., in dodala: »Do lanskega leta smo opažali trend padanja precepljenosti, ta je bil še posebej zaskrbljujoč pri cepljenju proti ošpicam, ker ostaja realno tveganje, da bolezen uvozimo in se ta tudi razširi. Zato smo skupaj s pediatri že v lanskem letu začeli intenzivne aktivnosti za večjo informiranost tako strokovne kot splošne javnosti, s katero bi se približali predvsem tistim, ki te informacije potrebujejo. Ministrstvo za zdravje je naročilo obsežno študijo, da bi ugotovili, kdo so dvomljivci v cepljenje in kaj jih skrbi. Pokazala je, da manj kot polovica mater brezpogojno zaupa v cepljenje, ampak pokazala je tudi to, da je zelo majhen odstotek tistih, ki o cepljenju dvomijo, ter da obstaja slaba tretjina staršev, ki jih cepljenje skrbi in si želijo več pojasnil. Prav tem je treba več informacij in pojasnil tudi zagotoviti.«
Da se je nezaupanje v zdravnike posebej okrepilo decembra leta 2016, je pokazala javnomnenjska raziskava Ogledalo Slovenije, ki jo je opravila družba Valicon. Takrat je namreč zdravnikom zaupalo le še 14% anketiranih. Po zadnji meritvi iste raziskave, opravljeni v začetku tega meseca, zdravnikom sicer zaupa 40% anketiranih, znanstveniki pa so v samem vrhu zaupanja, takoj za gasilci in medicinskimi sestrami. Andraž Zorko iz družbe Valicon najnižjo stopnjo zaupanja zdravnikom, decembra leta 2016, pripisuje predvsem poročanju medijev: »Pogosto se zdi, da nekemu pojavu pripišemo večjo težo, zato ker je pozornost medijev večja od obsega problema. Tipičen primer so vegani in vegetarijanci. Če bi sodili po družbenih omrežjih, bi sklepali, da se tretjina prebivalstva pri nas tako prehranjuje, pa imamo le 4% veganov in vegetarijancev. Podobno je tudi s temi kampanjami proti cepljenju.«
Čeprav smo priče neslutenemu razvoju in inovacijam v zdravstvu, so področja, kjer medicina še nima vseh odgovorov. Ko so možnosti zdravljenja izčrpane, se onkološki bolniki pogosto zatekajo k alternativnim oblikam pomoči. Onkologinja dr. Simona Borštnar, dr. med., z Onkološkega inštituta Ljubljana meni, da imajo bolniki pravico vselej upati na ozdravitev, zdravniki pa dolžnost povedati resnico in pravico zdravljenje prilagoditi posameznemu bolniku: «Ko bolniku povemo, da mu z zdravili ne moremo več pomagati, da lahko lajšamo le še simptome, bolnik seveda ne izgubi upanja. Normalno in človeško je, da upa, da se bo mogoče pozdravil s kakšno drugo metodo. Tukaj pa prihajajo na vrsto nepreverjene in celo zdravju škodljive metode, kot so na primer stradanje in soda bikarbona, ki lahko človeka v resnici ubije, ne pa mu pomaga. Alternativnih metod ne bomo izkoreninili, je pa treba pogledati, kdo jih ponuja. Teh ponudnikov namreč nihče ne nadzoruje in nihče ne kaznuje!«
Zavajajoče zdravstvene trditve so pogoste tudi pri drugih vrstah kroničnih bolezni. Tudi bolniki s sladkorno boleznijo so pogosto tarča prodajalcev različnih pripomočkov in prehranskih dopolnil, s katerimi naj bi bilo mogoče sladkorno bolezen pozdraviti. Prof. dr. Andrej Janež, dr. med., predstojnik KO za endokrinologijo, diabetes in presnovne bolezni UKCL opozarja: »Diabetologi smo zelo pozorni, zadržani in ostro odreagiramo, ko naletimo na alternativne oblike zdravljenja, še posebej, ker so polpretekli dogodki botrovali skorajšnji smrti treh mladih ljudi, ki jim je bilo svetovano, naj opustijo inzulinsko zdravljenje. Ob tem je v bistvu treba govoriti o mazaštvu in šarlatanstvu, ne le o alternativnih metodah, saj je bolnikom s sladkorno boleznijo tipa 1 inzulin življenjsko potreben.«
Najboljše zagotovilo za informirane odločitve o svojem zdravju je prav gotovo ozaveščenost prebivalstva. Tu imajo največjo moč mediji. A specializiranemu novinarstvu in poročanju o znanosti, slovenski medijski prostor zadnje desetletje ni naklonjen. Dragica Bošnjak, novinarka Delove priloge Znanost, ki ji je zapisana že skoraj štiri desetletja, ugotavlja, da je poročanje o znanosti za izdajatelje medijev navadno predvsem strošek. Toda po meritvah branosti, tako Bošnjakova, je priloga Znanost pri bralcih zelo dobro sprejeta in brana: »Delova priloga Znanost izhaja od leta 1986. Seveda se v vseh teh letih nismo mogli izogniti ponudbam, da bi pisali bolj prijazno, ampak smo vztrajali, čeprav niti v naši hiši nismo bili najbolj popularni. Učili smo se skupaj z našimi raziskovalci in znanstveniki, zaradi česar nas resno jemljeta tako strokovna kot najširša javnost. To se nam še danes obrestuje.«
Z zdravstvenimi inovacijami, ki jih brez predaha razvijajo raziskovalci v inovativni farmacevtski industriji so nekoč neozdravljive bolezni postale dobro obvladljive kronične bolezni, inovativna zdravila, terapije in cepiva pa rešujejo življenja in znižujejo stroške zdravljenja in rehabilitacije. V naslednjih petih letih je pričakovati nove preboje v raziskavah in razvoju inovativne farmacevtske industrije, ki bodo dodobra spremenili življenja bolnikov: »Najbolj očiten preboj si obetamo na področjih raziskovanja CAR – T celične terapije, celične terapije za zdravljenje sladkorne bolezni, genske terapije, kombinacije zdravil proti raku, novih terapij za Alzheimerjevo bolezen in protibakterijskih monoklonskih protiteles. Rekla bi torej, da bo razvoj potekal predvsem v dveh smereh – na področju nalezljivih bolezni iščemo najbolj učinkovita zdravila, na področju kroničnih bolezni, ki predstavljajo kar 86% bremena vseh bolezni v Evropi, pa gre razvoj pričakovati v smeri bolj enostavne uporabe terapij, z manj neželenimi učinki in še večjo učinkovitostjo. Sam razvoj znanosti v farmacevtski industriji je zelo intenziven. Mnogi veste, da za novo zdravilo potrebujemo deset tisoč idej, da ena na koncu morda doseže bolnika. Za to pa je potrebnih deset do petnajsti let intenzivnih raziskav. Verjamem, da bo inovativna farmacevtska industrija v prihodnosti prispevala k boljšemu življenju bolnikov, pravzaprav vseh nas«, je razpravo »Še verjamemo v znanost?« sklenila članica uprave Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb Anja Šalehar.
“,”Jaka Verbic Miklic”,1524144180,1524144180,sl,12671,306,12670,43,0,NULL,,”Okrogla miza Še verjamemo v znanost?”,okrogla-miza-se-verjamemo-v-znanost,Post,”/sites/43/files/images/news/Se verjamemo v znanost?/skupinska1.jpg”,1,0,1524144384,1535100941
329,12320,#WeWontRest,”Illness never sleeps so medical innovation can’t rest either. Breakthroughs in pharmaceuticals which save lives only come about because of the passion and commitment of those who have dedicated their lives to discovering and developing new medicines for patients.
Take a look why #WeWon’tRest and how we fight to make the world a better place for everyone. “,”
The innovative pharmaceutical industry urges policymakers to support robust incentives for research and development of orphan medicines to give hope to patients living with rare diseases

To give hope to the 30 millioni (1 in 17) Europeans living with a rare disease, all partners in healthcare need to work together to ensure that patients get access to currently available treatments. In addition, we need to further incentivise the research and development of new treatments for patients, where, currently, no treatment options exist. Neither of these two imperatives will be addressed by jeopardising a proven, effective Regulation – they require separate approaches and different solutions.
Incentivisation of research and development of orphan medicines is a good example of how an EU Industrial Strategy can channel research and innovation towards meeting patients’ unmet needs, and also strengthen the European economy. Meanwhile, any concerns on the good functioning of the Orphan Medicinal Products Regulation can be best addressed in the framework of an EU multi-stakeholder Forum for Better Access to Health Innovation.
In the context of the current evaluationii of the OMP Regulation, EFPIA calls on European institutions to ensure a stable and predictable regulatory and incentives’ framework. This will support further research and development into much needed new treatments for rare diseases.
The EU Orphan Regulation has brought hope to people living with rare diseases.
Rare diseases are often genetic in origin, mostly emerging in childhood and result in a severe burden of illness. Diseases such as amyotrophic lateral sclerosis (ALS), chronic lymphocytic leukaemia, Duchenne Muscular Dystrophy, or Wilson’s disease, to name a few, are complex, scientifically challenging and heterogenous diseases in nature, which despite being rare or very rare, collectively affect 30 million Europeansiii.
In 2000, the European Union adopted the Regulation on Orphan Medicinal Productsiv (“Orphan Regulation”) to address the needs of Europeans living with such a rare disease. Prior to its introduction, research in this area was limited and “too few and did not lead to significant progress in research”. Given the small patient populations associated with each rare condition, the complexity and risk associated with drug discovery and developments, and the corresponding limited commercial viability, there was mounting concern that without incentives to encourage research and innovation, no or too few new specific treatments would be developed for these serious conditionsv.
The Orphan Regulation has stimulated the development of new treatments for patients living with previously untreatable rare diseases – we have seen an increase from just 8vi authorised products for rare diseases before the entry into force of the Regulation, to 164 todayvii.
Europe has benefited greatly from the adoption of the Orphan Regulation and the targeted incentives it established. It stimulates R&D (e.g., via fee reduction and protocol assistance) into treatments showing great potential, and it rewards with 10-year market exclusivity those that ultimately make it through the long and complex development process, to become a new treatment and hope for patients. The benefits of the Orphan Regulation have led to:
Since the adoption of the Regulation, 23 European countries also adopted at least 1 national rare disease planx.
These incentives have transformed the lives of patients and their families, improving health outcomes and contributing to a thriving economy. They are central to developing treatment options for previously untreatable conditions, they advance medical knowledge more broadly, as well as foster a supportive research, innovation and investment environment in Europe.
We believe that no patient should be left behind. The Orphan Regulation is critical to foster further investment and innovation in Europe to deliver new treatments for these remaining rare diseases.
Despite these significant advances, 95%xi of rare conditions remain without a treatment option. This is due to the many distinct rare diseases that exist globally (estimated 5000 to 8000), small and scattered patient populations associated with each condition, lack of validated biomarkers and end-points, poor diagnostics and limited clinical expertise as well as the complexity and risk associated with drug discovery and developmentsxii.
In addition to our collective responsibility to find new treatment options for patients living with rare diseases, the Orphan Regulation can play a role in a future EU industrial strategy, helping to promote sustainable innovation. According to the Economic and Societal Footprint study among biopharmaceutical companiesxiii, “(…) phasing out current incentives in Europe would have a material negative effect on their European operations, with over half [of the respondents] indicating that this scenario would lead to a reduction in their R&D and commercial footprints of more than 25%. (…) Weaker intellectual property regimes limit the willingness of companies to invest in R&D [in Europe].”
In view of the needs regarding access to novel orphan treatments, the research-based pharmaceutical industry is committed to working together with stakeholders to find new pricing models to finance these, thus ensuring access for patients and improving sustainability for health systems. Re-opening the Regulation, designed to support research into new treatment options, will not improve patient access – now or in the future. Finding new and collaborative approaches involving all relevant stakeholders, will.
New hope comes from new treatments and early diagnosis both in child and adult patients. The success and value of the Regulation in stimulating the development of new treatments can only be fully realised if patients get access to them.
There are challenges regarding access to novel orphan treatments and considerable inequalities between, and sometimes even within, Member States. According to the 2018 PATIENT W.A.I.T. Indicatorxiv, not only are orphan medicines less available but they also take more time to reach patients following European Medicines Agency approval in over 80% of the 28 analysed European countries.
Ensuring patient access to the new treatments of today and tomorrow is a shared goal and responsibility. It requires regulators, health system partners, patients, governments and industry sitting together to find new ways to finance these innovative treatments and to ensure access for patients and sustainability for health systems at national level. There has been some progress:
EFPIA believes that is time for a different type of conversation calls on the European Institutions to implement the EU Health Coalition’s call to establish a multi-stakeholder Forum on Better Access to Health Innovationxv that brings all actors together to discuss how to ensure access to new treatments and technologies today, medical innovation for tomorrow and sustainable healthcare systems in a globally competitive Europe. Only through such a dialogue a meaningful response to the challenges of healthcare systems can be identified and implemented.
i http://www.orpha.net/national/data/NO-NO/www/uploads/Orphanet_publication_pointprev_2019.pdf
ii https://www.who.int/medicines/areas/priority_medicines/BP6_19Rare.pdf
iii https://ec.europa.eu/info/research-and-innovation/research-area/health/rare-diseases_en
iv https://ec.europa.eu/health/sites/health/files/files/eudralex/vol-1/reg_2000_141_cons-2009-07/reg_2000_141_cons-2009-07_en.pdf
v https://ec.europa.eu/health/sites/health/files/files/orphanmp/doc/orphan_inv_report_20160126.pdf
vi Mark L Flear, Anne-Maree Farrell, Tamara K Hervey and Therese Murphy (eds) (2013) European law and New Health Technologies. Oxford Studies in European Law.
vii https://www.ema.europa.eu/en/documents/other/orphan-medicines-figures-2000-2018_en.pdf
viii https://www.pugatch-consilium.com/reports/Benchmarking_success.pdf
ix https://www.ema.europa.eu/en/documents/other/orphan-medicines-figures-2000-2018_en.pdf
x http://www.europlanproject.eu/NationalPlans?idMap=1
xi Global Genes, Rare diseases: Facts and Statistics, https:// globalgenes.org/rare-diseases-facts-statistics/
xii https://www.pugatch-consilium.com/reports/Benchmarking_success.pdf and https://www.who.int/medicines/areas/priority_medicines/BP6_19Rare.pdf
xiii https://www.efpia.eu/media/412939/efpia-economic-societal-footprint-industry-final-report-250619.pdf
xiv https://www.efpia.eu/media/412747/efpia-patient-wait-indicator-study-2018-results-030419.pdf
xv https://www.euhealthcoalition.eu/recommendations/
Illness never sleeps. When everyone else is having 40 winks, illness is running round the block. Illness doesn’t sleep like a log or doze in an armchair. You might think it does, but it always gives itself a shake, ups its game and gets on with it. Illness never sleeps, and medical innovation needs to be one step ahead, so that breakthroughs can be made. And we won’t rest until we’ve helped make the world a healthier place for everyone.
Within the next 5 years cutting edge developments in medicine will transform the lives of patients. These are the 6 therapy areas set to make the biggest difference.
We won’t rest until CAR-T cell therapies are able to help the body fight back against cancer and potentially replace a lifetime of aggressive chemotherapy treatment.
Gene therapies offer a potential life change for patients with haemophilia B, and we won’t rest until similar rare diseases can be relieved or even cured.
Combining cancer treatments increases their power, helping people live healthier lives; we won’t rest until NSCLC can be kept under control or even cured.
Alzheimer’s disease is one of Europe’s largest public health crises, but we won’t rest until new treatments can halt it in its tracks.
We won’t rest until cell therapy can replace a lifetime of continuous insulin therapy for patients with diabetes
We won’t rest until antibacterial monoclonal antibodies can slow antibiotic resistance and fight bacterial infections.
“,,1513197900,1513197900,en,12320,306,12296,43,0,NULL,,#BrezPredaha,brezpredaha,Post,/sites/43/files/images/Fokus/Microskop.jpg,1,0,1521558538,1583260440
330,12671,”Do we still believe in science?”,”Pseudo-scientific claims spread fear but we still trust doctors and science”,”
Ljubljana, April 18 2018 – At “Do we still believe in science” round table, which took place at The Slovenian Academy of Sciences and Arts, participants presented their views about the relationship between science and borderline science. The consensus was that despite a flood of pseudo-scientific claims, which strengthen doubts about modern medicine and spread fear among people, we still trust doctors and science. Even more – all public opinion research shows that scientists are among the most trustworthy professions in Slovenia. Nevertheless, the awareness needs to be raised and the public needs to be informed with credible information about the importance of prevention from contagious diseases and chronic non-contagious diseases, about medicine and vaccines safety, we also need to strengthen our belief in science and be diligent in pointing out misleading claims if we want to avoid negative consequences pseudo-scientific claims could have on public health.
The round table discussion, organized by Forum of International Research and Development Pharmaceutical Companies, EIG (Forum) had participants thinking about the reasons for and the consequences of ever more frequent expressions of distrust in modern medicine’s achievements. In the past few years we have witnessed loud objections to mandatory vaccinations which are crucial for preventing contagious diseases from spreading. That is why Ministry of Health strengthened their communication activities about vaccination benefits, explained Mojca Gobec, dr. med., Director General at Directorate for Public Health and added: »Up until last year we were seeing a drop in vaccinations and this was especially alarming for chicken pox because the risk of importing this disease and it spreading is very real. That is why last year, in co-operation with paediatricians, we have launched intensive information campaign to raise awareness among expert and general publics and to reach those who really need these information. Ministry of Health ordered a comprehensive study to find out who the doubters are and what exactly worries them. The study showed that less than half of the mothers trust the vaccinations unconditionally but it also showed that there is a very small percentage of those who doubt the vaccinations and that about a third of parents are worried about vaccinations and wish they could have more information about them. These are exactly the people we need to provide more information and explanations to.”
Another public opinion study called Mirror of Slovenia, executed by Valicon, showed, that distrust in doctors grew significantly in 2016. At that time only 14% of people trusted doctors. The latest results of the same study, published at the beginning of April 2018, show that 40% of people now trust doctors while scientist are among the most trusted professionals, right behind fire-fighters and medical nurses. Andraž Zorko from Valicon attributed the low trust rate in doctors of 2016 to media reporting: »It seems that we often attribute a bigger importance to a phenomenon when media attention to that phenomenon is larger than the scope of the problem itself. A typical example of this are vegetarians and vegans. Based of the prominence of these two on social media one could conclude that at least a third of Slovenians follow these diets when in fact we only have 4% of vegans and vegetarians in this country. This is what happens with anti-vaxwers campaigns as well.«
Although we are witnessing an unprecedented development and innovations in healthcare there are still areas where medicine does not have all the answers yet. When treatment options are exhausted, oncology patients often look to the alternatives for help. An oncologist dr. Simona Borštnar, dr. med, from Institute of Oncology Ljubljana believes that patients always have the right to hope for recovery and that it is the doctors’ duty to tell the truth and to adapt the treatment to an individual patient.
»When we tell the patient there is nothing we can do for him any more with medication, that we can only alleviate symptoms, the patient does not loose hope. It is normal and human to hope one will recover using a different method. But this is where unverified and even harmful methods come in such as starvation or using baking soda which can even kill you, not help you. We won’t be able to eliminate alternative methods but we need to look at who is offering them. These providers are not monitored by anyone nor punished by anyone!”
Misleading medical claims are common about other chronic diseases as well. Diabetic patients, for example, are often targeted by those selling a myriad of nutritional supplements and other things claiming they would cure diabetes. Prof. dr. Andrej Janež, dr. med., head of University Medical Centre Ljubljana’s Clinical department of Endocrinology, Diabetes and Metabolic Diseases, warns: »Diabetologists are very attentive, restrained and react sharply when we encounter alternative treatments, especially since recently three young people nearly died when they were advised to discontinue their insuline treatments. We really should talk about quacks and charlatans not just about alternative medicine because insulin is of life importance for patients with type 1 diabetes.«
The best guarantee for informed decisions about health is a high awareness of the general population. Media hold the most power when it comes to that. But Slovenian media space has not favoured specialized journalism and reporting about science during the last decade. Dragica Bošnjak, Delo newspaper’s Znanost (Science) supplement reporter of the past four decades, finds that reporting about science is little more than an unnecessary cost for the media publishers. But, she says, reach research shows that Znanost supplement is very well received and read: »Znanost has been in circulation since 1986. Of course we have received offers enticing us to be kinder in our reporting but we stood firmly although that made us less popular, even within our own publishing house. We’ve learned together with our researchers and scientists and as a result are now taken seriously by the expert and the general public. Our decisions have paid off.«
Medical innovations which are continuously being developed by researchers in innovative pharmaceutical industry have turned once incurable diseases into manageable chronic diseases. Innovative medicines, therapies and vaccines save lives and lower the overall costs of treatment and rehabilitation. In the next five years we can expect breakthroughs in research and development by innovative pharmaceutical industry which will thoroughly change the lives of patients: »The progress will be most prominent in CAR-T cell therapies research, gene therapy, combining cancer treatments, new Alzheimer’s treatments, cell therapy in diabetes and antibacterial monoclonal antibodies research. I would say that development will go further in two ways – we are looking for most efficient medicines for contagious diseases and we are developing simpler therapies with fewer side effects and higher efficiency for chronic diseases which represent a whopping 86% of all disease burden in Europe. Scientific development in pharmaceutical industry is very intense. As you may know one new medicine takes 10.000 ideas so that one might reach the patients in the end. This one component takes 10 to 15 years of intensive research. I firmly believe that innovative pharmaceutical industry will have a major impact on not only patients’ but all of our lives,« Anja Šalehar, Forum’s board member concluded the round table discussion.
“,,1524144180,1524144180,en,12671,306,12670,43,0,NULL,,”Okrogla miza Še verjamemo v znanost?”,okrogla-miza-se-verjamemo-v-znanost,Post,”/sites/43/files/images/news/Se verjamemo v znanost?/skupinska1.jpg”,1,0,1524144384,1535100941
331,12313,”6th strategic Value of Innovation Conference”,”Sustainable and goal oriented healthcare system”,”
Ljubljana, 12. october 2017 – Innovations in healthcare save lives, but the system continues to lack relevant evaluation of health technologies and the necessary registers that would allow for effective treatment of patients and access to healthcare innovations. The system also needs to institute incentives for healthcare employees and, above all, develop a vision of long term sustainability so that the system can adapt to the challenges of the future.
Only a sustainable healthcare system and evidence supported decision-making can enable rapid access to innovative medicines, vaccinations, therapies and technologies that change the treatment of many diseases and extend or even save the lives of patients. Since they also reduce the costs of specialist and hospital treatments and increase productivity, investments in research and development are not only cost efficient, they are absolutely necessary. But we are faced with an aging society and increasingly common chronic diseases, propulsive innovations, important developmental shifts in medicine and limited financial resources. All of the above factors are already severely threatening the sustainability of the Slovenian healthcare system. Medicinal product prices have already contributed to slowing the growth of current healthcare expenditures as prices are now nearly a third lower than in the years before the global economic crisis while the prices of consumer goods have increased. Costs of prescription medicinal products represent only 14 percent of public health expenditures.

Panel discussion (left to right: Tanja Mate of the Ministry of Health, dr. Iva Hafner Bratkovič, researcher at the National Institute of Chemistry, Ass. Prof. dr. Petra Došenović Bonča from the Faculty of Economics of the University of Ljubljana, Marjan Sušelj, General Director of the Health Insurance Institute of Slovenia, dr. Vasilisa Sazonov, Vice President of the Forum of International Research and Development Pharmaceutical Companies and Aladar Belec from the Slovenian Association of Rheumatic Patients)
At the strategic conference Minister of Health Milojka Kolar Celarc emphasised that amendments to the Health Protection and Health Insurance Act and the Long Term Care Act will provide permanent and stable sources for long-term healthcare financing and assure a high quality and accessible system that will be open to innovations. She also noted upon the importance of innovations in healthcare, including the introduction of e-prescriptions, e-referral notes and the Intravizor project that monitors the consumption and pricing of medicinal products in Slovenian hospitals, as well as the importance of pharmacological innovations and the introduction of new medicines that extend life, improve the quality of life and ability to work and added: “We are seeing especially good treatment outcomes with biological medicines that received marketing authorisation in the past 15 years and have greatly improved the health outcomes of patients with multiple sclerosis and slowed down its advance. New methods of treating rheumatoid arthritis are also slowing down the advance of the illness and even improving the condition. Over the past 20 years new therapies have led to a 20 percent decrease in cancer mortality. We have also seen great advances in the treatment of HIV patients where mortality has decreased by 80 percent, … Besides the economic aspect, procurements also consider the ethical aspect and although our market is diminutive we have succeeded in assuring a wide range of new innovative medicines that the patients can receive comparatively quickly in comparison to other European states even though Slovenia is spending much less on the healthcare budget per capita then certain other countries.”
National Council Member mag. Peter Požun, President of the Commission for Social Security, Labour, Healthcare and the Disabled of the National Council of the Republic of Slovenia initially explained: “We are all aware that the economic crisis has left great consequences in the healthcare system. As we noted on several occasions in our discussions in the National Assembly, the crisis period caused a marked lack of funds for even established healthcare practices, let alone investments in innovations and development. Shapers of public healthcare policies are therefore faced with difficult challenges. They are expected to develop policies that focus on patients and assure a high degree of safety for their treatments while maintaining efficiency and sustainability from an economic standpoint. Unfortunately the mention of system sustainability still primarily conjures up the thought of costs – either the progressively increasing costs of treatment or, particularly in the initial phases, the rather sizeable investments into progress. We should know there is a substantial difference between the two – prudent and deliberate investments can directly or indirectly cause reductions of costs.”
Prior to the 6th strategic Value of Innovation Conference: Sustainable and goal oriented healthcare systems, that will be taking place in the National Council of the Republic of Slovenia today, representatives of healthcare policy implementors, academic research institutions, pharmaceutical industry and patients exchanged views and positions on the value of innovations in healthcare and the future of the Slovenian healthcare system which will need to adapt to new circumstances and challenges. So what should a healthcare system be like in order to enable key investments into research and development for the progress of Slovenian society, provide patients with fast and uninterrupted access to future innovations and also maintain long term sustainability?
Progress in treatment is usually linked to medicine while high costs are linked to medicines, emphasised Dr. Vasilisa Sazonov, Vice-President of the Management Board of the Forum of International Research and Development Pharmaceutical Companies which organised the 6th strategic conference in collaboration with the National Institute of Chemistry: “Medicines are expensive, we have the most expensive medicines in Europe, medicinal product expenditures are rising rapidly … these are the most often repeated assumptions that make up one of the greatest myths in Slovenian healthcare. They have absolutely nothing to do with reality. A recent comparative analysis of official prices in Europe showed that Slovenian official prices are among the lowest in the EU. Medicinal product expenditures in Slovenia are similar to those recorded before the global economic crisis in 2009. Results of analyses have clearly shown that prices of prescription medicines have contributed to slowing the growth of current healthcare expenditures in spite of an aging population whose demand for medicines has increased. Expenditures reduced by as much as 31 percent between 2010 and 2016. Meanwhile prices of consumer goods increased by 5.9%. The public will certainly be delighted by the fact that a Slovenian patient receives nearly the same range of medicines for 200 Euros per year as a Belgian patient for almost 450 Euros. All this data shows that Slovenia has the lowest medicinal product expenditures when compared with European countries with a similar access to medicines. It also shows that there is simply no more space in the field of medicinal product pricing for any further administrative measures.”

Guests of the Panel discussion
With currently recorded multi-million losses of public healthcare institutions and emergency measures for financial consolidation of public healthcare, reduction of waiting periods and upcoming package of amendments to healthcare legislation that is currently being reviewed by the Parliament, a thorough examination of the required conditions for a long term sustainable healthcare system is certainly necessary. Mag. Marjan Sušelj, General Director of the Health Insurance Institute of Slovenia emphasises: “The financing of existing rights under mandatory health insurance and ever new innovations in healthcare requires that a certain percentage of funds should be allocated each year for investments into development, however such investments must be accompanied by practical measures towards a more effective and successful operation of the healthcare system (effective organisation of public healthcare, integrated patient care, favorable balance between costs and benefits of new medicines, …). Investments will only return if we are able to manage our systems towards achieving set systemic objectives such as healthier and higher quality life and effective management of chronic illnesses.”
Ass. Prof. Dr. Petra Došenović Bonča of Ljubljana’s Faculty of Economics presented the challenges and new roles that public healthcare systems will face in the future, as well as some templates for financial consolidation of the existing state. She reported: “Existing measures, such as for example the renovation of hospitals, are not a sufficient response to the challenges of the future when the implementation of the fundamental principles of the healthcare system – solidarity, quality, accessibility and effectiveness – due to massive social changes and new approaches in medicine requires changes in financing with the service providers and support environment for the dispersion of information because there is a danger of modern medicine becoming accessible to only part of the population due to lack of financial resources. That is why we need to establish clear decision-making on the content of the basket that is solidarily financed, reform the health insurance scheme and increase the role of life-long financing, institute real prices of health services, modernise the payment models of service providers, provide incentives to employees in healthcare, evaluate health technologies, institute evidence based decision-making, increase transparency and efficiency of the healthcare system. The latter is absolutely necessary in order to assure healthcare similar to that in other developed countries with available resources, lest we continue to lag behind the needs.”
Slovenian scientific groups have gained international renown and respect and place into the very top in innovative research due to numerous internationally recognised scientific achievements and prestigious awards. Researcher Dr. Iva Hafner Bratkovič from the National Institute of Chemistry explained the role of academic institutions in the development of new medicines, diagnostics and innovative methods of treatment and emphasised: “Investments in basic research is a key factor in the research of the mechanisms of incurable diseases that results in the development of new medicines and advanced treatment methods. It would be my pleasure to see Slovenian science flourish if it were not malnourished in just about every respect and heavily encumbered by bureaucracy.”
The true value of innovations in healthcare is perhaps best known by patients and their families in fields where we have yet to reach a decisive breakthrough treatment, as well as those who have had their lives changed by innovations in healthcare. One such person is Aladar Belec, a patient with juvenile rheumatoid artritis from the Slovenian Association of Rheumatic Patients, whose message on today’s world arthritis day is: “Innovative medicines mean life for me – they enable me to move, take care of myself, be a father, partner, friend and as good and beneficial a citizen as I can be.Arthritis does not kill, but without timely healthcare, appropriate therapy and professional help, the life of an arthritis patient with all the pains and troubles the disease brings is not a dignified and full life.”
Participants agreed that innovations in healthcare save lives, but the system continues to lack relevant evaluation of health technologies and the necessary registers that would allow for effective treatment of patients and access to healthcare innovations. The system also needs to institute incentives for healthcare employees and, above all, develop a vision of long term sustainability so that the system can adapt to the challenges of the future.
“,Administrator,1507833720,1507833720,en,12313,306,12310,43,0,NULL,,”6. strateška konferenca Vrednost inovacij”,6-strateska-konferenca-vrednost-inovacij,Post,”/sites/43/files/images/news/6. strateska konferenca/6._strateska_konferenca_MAIN.jpg”,1,0,1521488291,1538997803
334,12315,”5. strategic conference Value of innovation”,”Continuing insufficient role of data in deciding on innovations in healthcare, with more than enough arguments in favor”,”
Ljubljana, 11 October 2016 – The development of policies in healthcare and decisions on the inclusion and financing of innovations should be supported with evidence in all areas to assure sustainability and quality of the healthcare system and based on coordinated data collection between all institutions and the findings should be made available to a wider audience, including healthcare service users.
Demographic indicators and increasing disparities between needs and available financial resources are one of the key challenges of healthcare politics. The fact that current finances no longer suffice for all available healthcare technologies, let alone the coming ones, has been the reality of our healthcare system for some time. It is therefore more important than ever for decisions to be deliberate and adopted on the basis of different data on their effectiveness and the economy of their introduction in the widest sense. At the 5th Value of Innovation Strategic Conference that took place today in the hall of the National Council of the Republic of Slovenia, developers of healthcare policies, representatives of institutions involved in data collection, keeping and processing and patients or civil society agreed that there is sufficient data available in the form of studies and registers in certain areas, but that there is plenty of room in other areas for improved monitoring of treatment outcomes and thus more deliberate further decision-making.
The first speakers to offer their view of the collection and importance of data in deciding to introduce and finance innovations in healthcare were President of the National Council Mr. Mitja Bervar and Chairman of the Committee on Health Mr. Tomaž Gantar. In his introductory speech, the President of the National Council emphasised the importance of information as the basis for the development of fundamentals for further decision making, whereby good quality and timely information is of key importance to assure that healthcare politics do not lose their effectiveness or degrade into conflicts. Regarding the role of the National Council in this process, Mr. Bervar said that practical experience shows the Council as an organisation with close ties to civil society. Chairman of the Committee on Health Mr. Tomaž Gantar believes we have finally reached a point where we need to decide how to proceed in the future and find solutions for the current state of the healthcare system so that we can take the same pride in the results as we do today over the coming ten or fifteen years. Of course, this requires increased investments, in part due also to increased numbers of patients with non-infectious illnesses.
State Secretary at the Ministry of Health Ms. Sandra Tušar stated that evidence, data and correct methodologies bring rationality, consistency and enable a systematic approach to the decision-making process and policy development in healthcare. As Tomaž Gantar before her, she too touched on the fact that the decisions made today will have a great impact on the health parameters of the future. It is therefore prudent to approach every decision making process with the question of which evidence to use and when to include it into the process. Ms. Tušar also mentioned the fact that there is plenty of data being collected in different fields within healthcare, but the links between them is far from optimal. According to Ms. Tušar, the Ministry is open for suggestions that would improve the process of linking together various databases. In the introduction of Health Technology Assessment elements into the decision-making processes, the Ministry of Health sees itself in conjunction with the National Institute of Public Health as the body coordinating different stakeholders involved in the process.
Mircha Poldrugovac from the National Institute of Public Health brought forth the importance and methodology of bringing various stakeholders into the discussion. The process of evidence supported decision making has a tendency to degrade into confrontation, a debate instead of the necessary dialogue. He emphasised the opportunity offered by EVIPNet (Evidence-informed Policy Network) for strengthening knowledge transfer mechanisms and promotion of evidence supported decision making along with the potential the bridging of the gap between researchers and decision makers could bring. All with the goal of creating good quality and useful starting points for the decision making process.
The role of patients is becoming increasingly desirable and accepted in the (collaborative) decision-making, but the voice of civil society is often ignored in practice and, in terms of providing different data, often also undervalued. Matija Cevc, President of the executive board of the network of non-governmental organisations in public healthcare 25 x 25, sees the role of non-governmental organisations in providing suggestions to decision makers, establishing dialogue and exchanging best practices. Optimal patient advocacy also requires access to data and findings. According to Mr. Cevc, the data platform exists, but one needs to be an expert in order to gain anything from the data as it is heavily fragmented. Truly accessing the data also requires certain specialised skills, so patients are hardly able to use them.
Guests of at the round table discussion, including Stanislav Primožič from the Public Agency for Medicinal Products and Medical Devices and Marjan Sušelj, acting Director of the Health Insurance Institute, agreed that plenty of data is already available and much more could be monitored, but the main challenge remains the connectivity of varying data. All participants expressed a hope that the introduction of HTA elements into the decision making process will optimise the exchange of information. The European Union requires all member countries to establish a body for the evaluation of healthcare technologies and its inclusion into the European network, but as Stanislav Primožič emphasised, the question of who will take over and manage the implementation of HTA at the national level remains open. Participants at the round table agreed that the range of innovations in healthcare will continue to grow, but the needs of insured persons are growing much faster than the abilities to introduce new healthcare technologies, particularly with the limited budget available for their inclusion into the public financing scheme. According to Tomaž Ganter, other more pressing issues are currently moving the discussion on the introduction of innovations further into the background in spite of evidence and arguments between decision makers.
Professor Nils Wilking from the Swedish Karolina Institute presented the newest report and overview of the treatment of cancer patients across Europe and in Slovenia and a comparison to the prior report. It is interesting to note that in spite of a 30 percent increase in the occurrence of cancer in Europe between 1995 and 2013, the introduction of new therapies led to an increase in mortality of only 11 percent while also extending survival. On average, the costs of cancer care and treatment remained at the same level at 6.7 percent of total healthcare expenditures. Mr. Wilking’s report also notes on differences in access to medicines and therapies in various countries and supports a well planned and transparent collection and processing of data on incidence and treatment outcomes. The field of oncology is growing ever more complex due to the introduction of new healthcare technologies, so permanent solutions must be found for its financing with the cooperation of all stakeholders in order to assure sustainability.
Data being collected by various public institutions, programs, studies and trials and through civil society structures is an excellent and necessary source of information for forecasting trends and reviewing of evidence on the effect of individual innovative therapies, thereby allowing for efficient and well substantiated introduction of innovations into the healthcare system with regard to limited resources. However, certain steps should be made towards better possibilities for linking data with a view to improve transparency and quality and such steps require accurately defined roles and competences, as well as a common will and use of modern technologies.
Maintaining a focus on evidence can assure the introduction of appropriate organisational, technological and other innovations. Access to appropriate data and information maintains access to high quality and effective treatments and reduces costs in the system that often occur due to arbitrary decisions and resistance to the introduction of new solutions. Innovative medicines and other innovations in healthcare have an important influence on the quality of life of patients with formerly untreatable and unmanageable illnesses, they extend life expectancy and quality and reduce direct and indirect costs of society in the mid and long term. But only if patients and healthcare workers can actually access them.
“,,1478809260,1478809260,en,12315,306,12314,43,0,NULL,,”5. strateška konferenca Vrednost inovacij”,5-strateska-konferenca-vrednost-inovacij,Post,”/sites/43/files/images/news/5. strateska/IRM_4_b.jpg”,1,0,1521490665,1524590975
335,12317,”8th FIRDPC info breakfast”,”The influence of healthcare professionals co-operation with pharmaceuticals industry on the profession, the individual and the society”,”
On June 7, 2016 FIRDPC held its 8th Media Breakfast, this time with the title “The influence of HCPs’ co-operation with pharmaceuticals industry on the profession, the individual and the society”. The goal was to talk about why HCPs need pharmaceutical companies, why the latter need HCPs and how this co-operation is changing the lives of people and the fabric of society.
In a welcome statement Katarina Verhnjak, FIRDPC board president, spoke about how development of new medicines is always a result of combining expert knowledge with practical experiences and that is why co-operation between all sides – patients, doctors and pharmaceutical industry – is so important. »But this co-operation is often questioned and sometimes misinterpreted. That is why we chose it as a topic for our 8th InfoBreakfast, « said Katarina Verhnjak.
After the introduction two patients shared their stories. Marko Korenjak has Willebrand disease (a type of hemophilia) and his life would have been over in early adolescence had it not been for the development of new medicines in co-operation between HCPs and pharmaceutical industry. He spent his childhood in constant care not to get injured, eating large quantities of peanuts and liver which were both believed to help hemophiliacs. Today medicines enable him to be an active member of society, he can travel and do sports.
For Aladar Belec who too was diagnosed as a child with juvenile rheumatoid arthritis sport is also incredibly important. His childhood was spent in bed and in hospital but today he can lift weights of 85 kg at the gym. “A very important result of co-operation between patients, doctors and pharmaceutical industry is education. The stereotype of rheumatic illnesses being reserved for elderly people is successfully being torn apart and today children with this disease get help quickly. Early recognition and effective treatment prevent a number of possible permanent consequences,” emphasized Aladar Belec.

8th infobreakfast
Education of doctors was the focal topic of conversation with Prof. Dr. Matija Tomšič, head of Clinical department of Rheumatology in University Medical Centre Ljubljana. It is in education that support from pharmaceutical industry plays a key role due to lack of funds for education provided by the state. “Tomorrow several members of my team and myself are travelling to a congress in London where we are all actively participating. Without a donation from pharmaceutical industry we simply couldn’t go,” described Prof. Dr. Tomšič and added that doctors never make arrangements for these things themselves but arrangements are handled by the department. Although travelling to congresses abroad is what tends to capture the public’s imagination, Prof. Dr. Tomšič emphasized the importance of education and lectures by specialists to general practitioners around Slovenia. “That is another thing we couldn’t do without the help of pharmaceutical industry, we couldn’t write and publish manuals for family doctors and other info materials,” listed Prof. Dr. Tomšič.
Prof. dr. Mitja Košnik from University Clinic of Pulmonary and Allergic Diseases Golnik Slovenia added his view of the importance of co-operation in the field of clinical research via a recorded video statement as he couldn’t be present at the breakfast and then the meeting turned to the other half, dedicated to shedding light on why the pharmaceutical industry needs HCPs and on broader social consequences of co-operation between them.
Forum’s Secretary General, Barbara Stegel, pointed out that doctors are the ones who have direct contact with the patients, therefore co-operating with them in the field of research and monitoring of medicines’ effectiveness is crucial. She also emphasized the importance of education: “We can all find ourselves in the shoes of a patient and when that happens we all want to have a doctor with knowledge on whole spectrum of the latest and most efficient medicines and treatments available by our side,” she said. One of the most positive but often overlooked effects of HCPs’ co-operation with pharmaceutical industry in developing innovative medicines are huge direct savings for healthcare system and indirect savings for society. “This means that each day patients don’t have to spend in a hospital or on sick leave brings great savings to the society.”
Katarina Verhnjak spoke about numerous rules which regulate the relationship between HCPs and pharmaceutical industry. “These rules are very strict and we are bound by them on different levels. We are regulated by the legislation, by EFPIA Codes of Conduct and by internal rules each company has. When all these levels regulate a certain issue we always abide by whichever level is the strictest. Besides the aviation industry we are the most regulated one,” she stated.
Prof. dr. Bojana Beovič, representative of Medical Chamber of Slovenia, also emphasized the important role that pharmaceutical industry has in enabling the education of doctors and pointed out how important it is that HCPs and pharmaceutical industry enter in these relationships and conduct them in a transparent manner.
Speakers:
• Mag. Katarina Verhnjak, FIRDPC Board President
• Mag. Barbara Stegel, FIRDPC Secretary General
• Prof. Dr. Matija Tomšič, head of Clinical department of Rheumatology in University Medical Centre Ljubljana
• Prof. Dr. Mitja Košnik, University Clinic of Pulmonary and Allergic Diseases Golnik Slovenia
• Marko Korenjak, patient with Willebrand disease and president of Slovenija HEP;
• Aladar Belec, patient with juvenile rheumatoid arthritis
Focal topics:
• Why do HCPs need pharmaceutical companies?
• Why does the pharmaceutical industry need HCPs?
• How is this co-operation changing the lives of people and the fabric of society?
“,Administrator,1465501140,1465501140,en,12317,306,12316,43,0,NULL,,”8. infozajtrk za medije”,8-infozajtrk-za-medije,Post,”/sites/43/files/images/news/8. infozajtrk/Gostje_med_razpravo_b.jpg”,1,0,1521491788,1538638797
336,12447,”Cooperation codes and transfer of value disclosures”,”We cooperate transparently and ethically with stakeholders on all levels”,”
Public disclosure of transfers of value to HCPs and HCOs in 2022
Public disclosure of transfers of value to HCPs and HCOs in 2023
Public disclosure of transfers of value to HCPs and HCOs in 2024
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
“,,1522014900,1522014900,en,12447,306,12302,43,0,NULL,,Kodeksi,kodeksi,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1522014973,1751980150
337,12399,”Code on cooperation with healthcare professionals”,”Code on the informing and communication of prescription-only medicines to, and cooperation with, healthcare professionals”,”
CODE ON THE INFORMING AND COMMUNICATION OF PRESCRIPTION-ONLY MEDICINES TO, AND COOPERATION WITH, HEALTHCARE PROFESSIONALS
(HCP Code)
Adopted by the General Assembly of Forum International Research and Development Pharmaceutical Companies, EIG on 20 January 2012
as amended on 21 November 2013, 4 July 2014, 27 May 2016, 23 March 2018 and 22 March 2019.
(CONSOLIDATED VERSION – MARCH 2018)
IMPLEMENTATION OF CODE PROVISIONS
The Forum of International Research and Development Pharmaceutical Companies, EIG (hereinafter: Forum) is introducing appropriate procedures to assure that companies, members of the Forum, operate in accordance with the European (as adopted by the European Federation of Pharmaceutical Industries and Associations (hereinafter: EFPIA)) and appropriate national codes (Code on the informing and communication of prescription-only medicines to, and cooperation with, healthcare professionals (hereinafter: HCP Code)) and resolve eventual complaints due to failure to meet obligations pursuant to the above procedures.
The Forum has established a Committee for supervision of the provisions of ethical codes (hereinafter: Committee), which is composed of independent experts in various fields with appropriate expert knowledge and representatives of the Forum.
The Committee oversees the implementation of this Code and other Forum Codes and proposes amendments to codes or procedures adopted for their implementation.
The Committee has been established to assess information on medicinal products, assess the appropriateness of member cooperation with healthcare professionals and patient organisations and compliance of publishing transfers of funds from member companies to healthcare professionals and healthcare organisations. The Committee operates as a voluntary and self-regulating body for all Forum members.
INTRODUCTION
The main task of the pharmaceutical industry is the development of new and effective medicinal products and improvement of existing ones to aid patients and the provision of reliable information regarding such products.
To that end, the pharmaceutical industry pursues activities of marketing such medicinal products and also organises expert meetings, thereby contributing to a constant elevation of knowledge and expertise in public healthcare. The level of scientific expertise at such events must be high, while other elements should remain reasonable.
Marketing of medicinal products is carried out pursuant to the following national and international rules:
1. All Forum member companies are obliged to operate in line with the applicable Medicinal Products Act and other applicable legislation. All pharmaceutical companies must provide healthcare professionals with relevant, reliable and appropriate information regarding the medicinal products they market.
2. Provisions of the HCP code are based on the rules adopted by EFPIA, the representing body of the European pharmaceutical industry, of which the Forum is an associate member. The EFPIA Code on the promotion of prescription-only medicines to, and interactions with, healthcare professionals has been adopted with the purpose of harmonisation with Council Directive 2001/83/EC of November 2001 and its amendments. Forum member companies are also obliged to observe the provisions of applicable Slovenian legislation in the field of marketing, advertising and informing of medicinal products.
3. The Forum promotes competition among pharmaceutical companies. The HCP Code is not intended to restrain fair competition. Rather, it seeks to ensure honest and truthful promotion activities, avoid deceptive practices and potential conflicts of interest with healthcare professionals, and operation in compliance with applicable laws and regulations. The HCP code aims to foster an environment where the general public can be confident that choices regarding their medicines are being made on the basis of the merits of each product and the healthcare needs of each individual patient.
SCOPE OF IMPLEMENTATION OF CODE PROVISIONS
Provisions apply for all forms of marketing. This includes all information and activities pertaining to promotion of sales, performed either by the manufacturer of medicinal products or another party on its behalf, of such a nature that they may influence the prescription, marketing, sales and consumption of medicinal products of such a manufacturer.
The HCP code regulates the promotion of prescription-only medicinal products to healthcare professionals. The term “promotion”, as used in the HCP code, includes any activity undertaken, organised or sponsored by a pharmaceutical company, or with its authority, which promotes the prescription, supply, sale, administration, recommendation or consumption of its medicinal product(s).The HCP code covers promotional activity and communication directed towards physicians or other members of medical, dental, pharmacy or nursing professions or any other person who in the course of his or her professional activities may prescribe or administer medicinal products (hereinafter: “healthcare professional”).
The HCP code is not intended to restrain or regulate the provision of non-promotional medical, scientific and factual information; nor is it intended to restrain or regulate activities directed towards the general public which relate solely to non-prescription medicinal products.
The HCP code does not cover the following:
– packaging, SmPC, package leaflets and other documents approved by a competent body at issuing of marketing authorization or later;
– correspondence and other materials of a informative nature, needed to answer a specific question about a particular pharmaceutical product;
– specific or informative publications, e.g. regarding new packaging or adverse-reaction warnings, trade catalogues and price lists, provided they include no product information;
– information related to human health or illnesses, provided there is no reference, even implied, to a medicinal product and that information is quality, unambiguous, integral, balanced, comprehensible to users and do not contain elements of direct or hidden advertising;
– activities pertaining exclusively to non-prescription medicinal products;
– non-promotional, general information about companies (such as information directed to investors or to current/prospective employees), including financial data, descriptions of research and development programmes, and discussion of regulatory developments affecting a company and its products.
PROVISIONS OF THE CODE
1. MARKETING
1.1. A medicinal product must not be promoted prior to the grant of the marketing authorization.
1.2. All the elements of promotion must be consistent with the particulars listed in the summary of product characteristics (SmPC), and must be limited to approved indications.
1.3. All promotional materials shall in accordance with applicable national legislation and regulations contain the following information, provided in a clear and legible manner:
a) essential information consistent with the summary of product characteristics (composition of medicinal product, therapeutic indications, dosage and manner of application, summary of adverse reactions, precautionary measures and warnings, contraindications and interactions, name, sign and address of the marketing authorisation holder), specifying the date on which such essential information was generated or last revised;
b) product classification with regard to the manner and regime of dispensing.
2. PROMOTION
2.1. PROMOTION
a) Information on medicinal products shall be accurate, balanced, fair, objective and sufficiently complete to enable the recipient to form his or her own opinion of the therapeutic value of the medicinal product concerned. It should be based on an up-to-date evaluation of all relevant materials and shall reflect that evidence clearly. Information must not mislead by distortion, exaggeration, undue emphasis, omission or in any other way. Information on medicinal products must normally be marked as “only for the expert public”.
b) The word “safe” shall never be used without appropriate explanation.
c) The word »new« must not be used to describe any medicinal product or marketing form that is generally accessible, or any therapeutic indications that are being promoted for more than one year from the date of first availability in the Slovenian market.
d) No claims may be made that the medicinal product has no side-effects and no risks of causing poisoning or addiction.
e) When promotional materials refer to published studies, data must be stated correctly and clear references should be given.
f) Promotion activities must be capable of substantiation which must be promptly provided in response to reasonable requests from healthcare professionals. In particular, promotional claims about side-effects must reflect available evidence or be capable of substantiation by clinical experience. Substantiation need not be provided, however, in relation to the validity of indications approved in the marketing authorization.
g) Promotion must encourage the rational use of medicinal products by presenting them objectively and without exaggerating their properties. Claims must not imply that a medicinal product, or an active ingredient, has some special merit, quality or property unless this can be substantiated.
h) Any comparison made between different medicinal products must be based on relevant and comparable aspects of the products. Comparative advertising must not be misleading or disparaging.
i) All artwork, including graphs, illustrations, photographs and tables taken from published studies included in promotional material should:
– clearly indicate the precise source(s) of the artwork;
– be faithfully reproduced, except where adaptation or modification is required in order to comply with any applicable code(s), in which case it must be clearly stated that the artwork has been adapted and/or modified.
Artwork included in promotion must in no way mislead the prescriber or user about the nature of a medicine (for example whether it is appropriate for use in children) or mislead about a claim or comparison (for example by using incomplete or statistically irrelevant information or unusual criteria).
2.2. DOCUMENTATION
Any information included in promotion must be supported by documentation that can be provided on request.
Such documentation need not be provided for information that has been approved in the marketing authorization.
Clinical data that refers to unpublished company sources must be marked with the following notation: “Data is accessible at local company headquarters upon request.” Recipients of promotion materials must have sufficient information available to verify such materials, whereby such information must be an integral part of promotional materials, reference a published report or available upon request. The company must submit the sources of its claims within 15 days of the date of relevant request.
2.3. UNAPPROVED INDICATIONS
Promotions of medicinal products must be done in accordance with the marketing authorisation for the relevant medicinal product and using data listed in the summary of the main characteristics.
Promotion of indications not included in the marketing authorisation is prohibited. The medical department of a Forum member company may provide information on the indications of a medicinal product that are not included in the marketing authorisation (“unapproved indications”) at the request of a healthcare professional, but must not use such indications for promotion.
2.4. GIFTS
Expert associates may not offer any gifts or use pretences to assure a visit with a healthcare professional. Visits or talks with healthcare professionals must not be subject to any payment.
The term “gift” is understood in a wider sense of the word and is not limited only to direct financial or material incentives for healthcare professionals (e.g. expert associates are not allowed to make charity donations in exchange for visits with healthcare professionals).
2.5. USE OF QUOTATIONS IN PROMOTION
Quotations from medical and scientific literature or from personal communications must be faithfully reproduced (except where adaptation or modification is required in order to comply with the HCP Code, in which case it must be clearly stated that the quotation has been adapted and/or modified) and the precise sources identified.
2.6. ACCEPTABILITY OF PROMOTION
Companies must maintain high ethical standards at all times. Promotions must:
a) never bring discredit upon, or reduce confidence in the pharmaceutical industry;
b) be of a nature which recognises the special nature of medicines and the professional standing of the recipient(s);
c) not be likely to cause offence.
2.7. DISTRIBUTION OF PROMOTION MATERIALS
a) Promotion should only be directed at those healthcare professionals whose need for, or interest in, the particular information can reasonably be assumed.
b) Mailing lists of healthcare professionals must be kept up-to-date. Requests by healthcare professionals to be removed from such lists must be complied with.
c) Subject to applicable national laws and regulations, the use of faxes, e- mails, automated calling systems, text messages (SMS) and other electronic data communications for promotion is prohibited except with the prior permission, or upon the request, of the recipient.
2.8. TRANSPARENCY OF PROMOTION
a) Promotion and promotional materials must not be disguised or disguise their actual intent.
b) Clinical assessments, post-marketing programmes and post-authorization studies must not be disguised promotion. Such programmes and studies must be conducted with a primarily scientific or educational purpose.
c) Where a company pays for or otherwise secures or arranges the publication of promotional material in newspapers and magazines, such promotional material must not resemble independent editorial matter.
d) Material relating to medicines and their uses, whether promotional in nature or not, which is sponsored by a company must clearly indicate that it has been sponsored by that company.
2.9 INFORMATIONAL OR EDUCATIONAL MATERIALS AND ITEMS OF MEDICAL UTILITY
a) The transmission of informational or educational materials is permitted provided if is: (i) “of reasonable value”; (ii) directly relevant to the practice of medicine or pharmacy; and (iii) directly beneficial to the care of patients. The distribution of such materials or items shall not constitute an incentive to prescribe, purchase, supply, sell or administer a Medicinal Product.
b) Items of medical utility, aimed directly at the education of healthcare professionals and patient care can be provided if they are “of reasonable value” and do not offset routine business practices of the recipient.
c) The scope of Informational or educational materials and Items of medical utility considered may not constitute of the prohibition on gifts defined under Article 4 of this Code.
The meaning of the term “reasonable value” as used herein, shall be defined by an exception set out by the Income Tax Act which states that individual gifts are not included in the tax base if their value does not exceed 42 EUR (including VAT), or if the total annual value of all gifts received in a fiscal year from the same legal person does not exceed 84 EUR (including VAT).
2.10. PROMOTION TO THE GENERAL PUBLIC SHALL NOT BE CARRIED OUT
a) Promotion of the following medicinal products to the general public shall be prohibited:
– prescription-only medicinal products;
– medicinal products containing active substances classified as psychotropic or narcotic by an international convention, e.g. the UN Conventions of 1961 and 1971;
– any other medicinal products the promotion of which to the general public is prohibited by law. This prohibition shall not apply to notifications of vaccinations carried out by the pharmaceutical industry and approved by competent bodies.
b) In the case of requests from individual members of the general public for advice on personal medical matters, the enquirer should be advised to consult a healthcare professional.
2.11. EVENTS AND HOSPITALITY
1) All promotional, scientific or professional meetings, congresses, conferences, symposia, and other similar events (hereinafter: “event”) organised or sponsored by a company must be held in an “appropriate” venue that is appropriate to the main purpose of the event, costs may only be covered when this is appropriate and otherwise complies with legally prescribed amounts and the provisions of the HCP Code.
An “appropriate” location or venue in the sense of the present item shall mean any location or venue normally used for organising such events, with the exception of “leisure” or “luxury” locations.
A “leisure” location or venue in the sense hereof means a location known predominantly for providing special types of entertainment (outside the scope of congress activity), such as for example a casino or a golf course.
An “extravagant” location in the sense hereof means a 5* hotel or a similar venue of luxury category, whereby the categorization of the congress facilities at a particular location is considered to be the same as the categorization of a hotel or venue in which or in the immediate vicinity of the which they are located.
2) No company may organise or sponsor an event that takes place outside its home country (international event) unless:
a) most of the invitees are from outside of its home country and, given the countries of origin of most of the invitees, it makes greater logistical sense to hold the event in another country;
b) given the location of a relevant resource or expert that is the object or subject matter of the event, it makes greater logistical sense to hold the event in another country (“international event”).
3) Coverage of costs related to promotion, expert or scientific events shall be limited to travel, meals, accommodation and participation fees and shall not exceed the amounts set out by the Medicinal Products Act or another act referred to in the Medicinal Products Act. Costs of travel, accommodation, food and participation fees shall not be deemed as gifts pursuant to the Public Employees Act.
Reasonable costs of travel, accommodation and food shall be presented in a transparent manner.
4) Costs shall be covered only to event participants and not also to accompanying persons.
5) Companies shall not provide any meal (food and beverages) to healthcare professionals, unless the value of such individual meals (food and beverages) does not exceed 60 EUR (including VAT) if the event is set in Slovenia. If the event is set abroad the monetary threshold set in the country where the event takes place (i.e. “host country”) shall prevail. All forms of hospitality offered shall be “reasonable” in level and strictly limited to the main purpose of the event. As a general rule, the hospitality provided must not exceed what healthcare professional recipients would normally be prepared to pay for themselves.
“Reasonable” hospitality in the sense of the present Item shall mean hospitality within the limitations healthcare organisations would normally observe in the organisation of events for their own needs, whereby events aimed predominantly at leisure should be avoided.
Healthcare professionals must not be provided or have paid any individual leisure activities or other extra-curricular or social activities. Moderate (simple) entertainment1 at events is allowed, but must be of secondary importance in comparison to refreshing beverages and/or food. Members shall avoid organising events at “leisure” locations or venues “renowned” for their entertainment offer or for being “extravagant”.
6) Costs of sponsoring or organisation of entertainment (e.g. sports or leisure) events may not be covered. Companies should avoid venues that are renowned for their entertainment offers.
3. QUALITY OF INFORMATION
Promotion materials must be of satisfactory quality and must not cause offence.
4. PROHIBITION OF GIFTS
Healthcare professionals may not be given, offered or promised any gifts, financial benefits or benefits in kind.
5. SPONSORSHIP OF HEALTHCARE PROFESSIONALS
Companies must comply with criteria governing the selection and sponsorship of healthcare professionals to attend training or events as provided in the applicable Medicinal Products Act or the HCP Code or pertaining thereto. Funding must not be offered to compensate merely for the time spent by healthcare professionals in attending events. In the case of international events for which a company sponsors the attendance of a healthcare professional, if any funding is provided to such healthcare professional in accordance with the provisions of Article 5, such funding is subject to the rules of the country where such healthcare professional carries out his/her profession, as opposed to those in which the international event takes place. (For the avoidance of doubt, Article 5 is not a prohibition of the extension of hospitality to healthcare professionals in accordance with Article 2.11.)
6. DONATIONS AND GRANTS THAT SUPPORT HEALTHCARE, RESEARCH OR EDUCATION2
Giving donations, grants and material or other benefits to institutions, organisations or associations that are comprised of healthcare professionals and/or that provide healthcare or conduct research (that are not otherwise covered by the EFPIA Code on the promotion of prescription-only medicines to, and interactions with, healthcare professionals or the EFPIA Code of Practice on relationships between the pharmaceutical industry and patient organisations) are only allowed if: (i) they are made for the purpose of supporting healthcare, research or education; (ii) they are documented and kept on record by the donor/grantor; and (iii) they do not constitute an inducement to recommend, prescribe, purchase, supply, sell or administer specific medicinal products; and (iv) if the donor has no influence on the selection of participants of an event and the selection is carried out independently by the institution receiving a donation. Donations and grants to individual healthcare professionals and/or independent entrepreneurs are not permitted under this section.
Company sponsorship of healthcare professionals to attend international events is covered by Article 5. Companies are encouraged to make available publicly information about donations and grants (in cash or in kind or otherwise) made by them covered in this Article 6.
7. FEES FOR SERVICE
Contracts between companies and institutions, organisations or associations of healthcare professionals under which such institutions, organisations or associations provide any type of services to companies (or any other type of funding not covered under Article 8 or not otherwise covered by the Code) are only allowed if such services (or other funding): (i) are provided for the purpose of supporting healthcare or research; and (ii) do not constitute an inducement to recommend, prescribe, purchase, supply, sell or administer specific medicinal products.
8. THE HIRING OF CONSULTANTS
8.1. It is permitted to use healthcare professionals as consultants and advisors, whether in groups or individually, for services such as speaking at and chairing meetings, involvement in medical/scientific studies, clinical trials or training services, participation at advisory board meetings, and participation in market research where such participation involves remuneration and/or travel. The arrangements that cover these genuine consultancy or other services must, to the extent relevant to the particular arrangement, fulfil all the following criteria:
a) a written contract or agreement is concluded in advance of the commencement of the services which specifies the nature of the services to be provided and, subject to clause (g) below, the basis for payment of those services;
b) a legitimate need for the services is clearly identified in advance of requesting the services and entering into arrangements with the prospective consultants;
c) the criteria for selecting consultants is directly related to the identified need and the persons responsible for selecting the consultants shall have the expertise necessary to evaluate whether the particular healthcare professionals meet those criteria;
d) the number of healthcare professionals retained is not greater than the number reasonably necessary to achieve the identified need;
e) the contracting company maintains records concerning, and makes appropriate use of, the services provided by consultants;
f) the hiring of healthcare professionals to provide the relevant service is not an inducement to recommend, prescribe, purchase, supply, sell or administer a particular medicinal product; and
g) the compensation for the services is reasonable and reflects the fair market value of the services provided. In this regard, token consultancy arrangements should not be used to justify compensating healthcare professionals.
8.2. In their written contracts with consultants, companies are strongly encouraged to include provisions regarding the obligation of the consultant to declare that he/she is a consultant to the company whenever he/she writes or speaks in public about a matter that is the subject of the agreement or any other issue relating to that company. Similarly, companies that on a part-time basis employ healthcare professionals that are still practising their profession are strongly encouraged to ensure that such persons have an obligation to declare his/her employment arrangement with the company whenever he/she writes or speaks in public about a matter that is the subject of the employment or any other issue relating to that company. The provisions of this Article 8.2. apply even though the Code does not otherwise cover non-promotional, general information about companies.
8.3. Limited market research, such as one-off phone interviews or mail/e- mail/internet questionnaires are excluded from the scope of this Article 8, provided that the healthcare professional is not consulted in a recurring manner (either with respect to the frequency of calls generally or of calls relating to the same research) and that the remuneration does not exceed 20 EUR (including VAT) per questionnaire or interview.
8.4. If a healthcare professional attends an event (an international event or otherwise) in a consultant, the relevant provisions of Article 2.11. shall apply.
9. NON-INTERVENTIONAL CLINICAL STUDIES OF MEDICINAL PRODUCTS
9.1. A non-interventional clinical study of a marketed medicine is defined as a study where the medicinal product(s) is (are) prescribed in the usual manner in accordance with the terms of the marketing authorisation. The assignment of the patient to a particular therapeutic strategy is not decided in advance by a trial protocol but falls within current practice and the prescription of the medicine is clearly separated from the decision to include the patient in the study. No additional diagnostic or monitoring procedures shall be applied to the patients and epidemiological methods shall be used for the analysis of collected data. Patients must be informed that data is collected on them that shall be used for studies and must be assured that the confidentiality will be strictly enforced.
9.2. Non-interventional clinical studies that are prospective in nature and that involve the collection of patient data from or on behalf of individual, or groups of, healthcare professionals specifically for the study must comply with all of the following criteria:
a) the study is conducted with a scientific purpose;
b) (i) there is a written study plan and (ii) there are written contracts between healthcare professionals and/or the institutes at which the study will take place, on the one hand, and the company sponsoring the study, on the other hand, which specify the nature of the services to be provided and, subject to clause (c) immediately below, the basis for payment of those services;
c) any remuneration provided is reasonable and reflects the fair market value of the work performed;
d) prior to commencement of study the consent of the competent medical ethics committee must be acquired;
e) local laws, rules and regulation on personal data privacy (including the collection and use of personal data) must be respected;
f) the study must not constitute an inducement to recommend, prescribe, purchase, supply, sell or administer a particular medicinal product;
g) the study plan must be approved by the company’s medical department and the conduct of the study must be supervised by the company’s medical department as described in Section 10.2.c);
h) the study results must be analysed by or on behalf of the contracting company and summaries thereof must be made available within a reasonable period of time to the company’s service responsible for conducting clinical studies (as described in Article 10.2.b), which shall maintain records of such reports for a reasonable period of time. The company should submit the summary report to all healthcare professionals that participated in the study and should make the summary report available to the competent medical ethics committee upon its request. If the study shows results that are important for the assessment of benefit-risk, the summary report should be immediately forwarded to the relevant competent authority;
i) expert associates may only be involved in an administrative capacity and such involvement must be under the supervision of the company’s medical department that shall also ensure that the expert associates are adequately trained. Such involvement must not be linked to the promotion of any medicinal product.
9.3. Members are obliged to observe additional stricter conditions, as stipulated by applicable legislation.
9.4. To the extent applicable, companies are encouraged to comply with Article 9.2. for all other types of studies covered by Section 9.1, including epidemiological studies and registries and other studies that are retrospective in nature. In any case, such studies are subject to Article 8.1.
10. PERSONS EMPLOYED IN PHARMACEUTICAL PROMOTIONAL ACTIVITIES
10.1. EXPERT ASSOCIATES OF PHARMACEUTICAL COMPANY
a) Each company shall ensure that its expert associates, including personnel operating on behalf of the company and any other company representatives who call on healthcare professionals, pharmacies, hospitals or other healthcare facilities in connection with the promotion of medicinal products (each, an “expert associate”) are familiar with the relevant requirements of the applicable code(s), and all applicable laws and regulations, and are adequately trained and have sufficient scientific knowledge to be able to provide precise and complete information about the medicinal products they promote.
b) Expert associates must approach their duties responsibly and ethically.
c) Expert associates shall perform their activities in accordance with the Forum Code and all applicable laws and regulations, while companies shall be obliged to assure compliance.
d) During each visit, and subject to applicable laws and regulations, expert associates must give the visited healthcare professionals, or have available for them, a summary of the product characteristics for each medicinal product they present.
e) Expert associates must transmit to the company forthwith any information they receive in relation to the use of their company’s medicinal products, particularly reports of side-effects.
f) Expert associates must ensure that the frequency, timing and duration of visits to healthcare professionals, pharmacies, hospitals or other healthcare facilities, remain within appropriate boundaries.
g) Expert associates must not use any inducement or subterfuge to gain an interview. In an interview, or when seeking an appointment for an interview, expert associates must, from the outset, take reasonable steps to ensure that they do not mislead as to their identity or that of the company they represent.
10.2. OTHER STAFF
a) All company staff that is in any way concerned with the preparation or approval of promotional material or information must be fully conversant with the requirements of the Rules on advertising of medicines.
b) Every company must have a department or a responsible person in charge of information about its products and supervision of non-interventional studies. Such a medical department shall employ a physician or pharmacist responsible for the approval of promotion materials prior to publishing. Such person must certify that he or she has examined the final form of the promotional material and that in his or her belief it is in accordance with the requirements of the applicable code(s) and any applicable advertising laws and regulations, is consistent with the summary of product characteristics and is a fair and truthful presentation of the facts about the medicine. In addition, the company must ensure a medical doctor or a pharmacist, who will be responsible for the oversight of any non-interventional study (including the review of any responsibilities relating to such studies, particularly with respect to any responsibilities assumed by expert associates). Such person must certify that he or she has examined the protocol relating to the non-interventional study and that in his or her belief it is in accordance with the requirements of the applicable code(s).
c) Each company must appoint a responsible person for supervising the company to ensure that the standards of the applicable code(s) are met.
11. MEDICINAL PRODUCT SAMPLES
11.1. In accordance with the EU Directive 2001/83/EC and current Rules on advertising of medicinal products, in principle, no medical samples should be given to persons authorized to prescribe medicinal products, except exceptionally under the following conditions:
– the medicinal product has due marketing authorisation;
– the medicinal product does not require any special storage conditions, such as a cold chain;
– no more than two years have elapsed from acquisition of the marketing authorisation or approval of a change of marketing authorisation that requires a new application;
– samples may only be delivered upon a written request signed and dated by the prescriber;
– the recipient must keep a record of received samples and must not resell them;
– samples must be in the smallest packaging on the market;
– samples must be accompanied by SmPC;
– each sample has to be in packaging with leaflet enclosed as approved by marketing authorisation, and marked “free medical sample – not for sale”;
– samples must not contain narcotic and psychotropic substances.
Members are obliged to observe additional stricter conditions, as stipulated by applicable legislation.
Medical samples must not be given as an inducement to recommend, prescribe, purchase, supply, sell or administer specific medicinal products, and should not be given for the sole purpose of treating patients.
Medical samples are provided to health professionals when the patient needs to be instructed on the method of use of the new medicinal product, if not intended for oral use.
11.2. Companies must have adequate systems of recording, control and accountability for samples which they distribute and for all medicines handled by its representatives. These systems shall also clearly establish that each health professional authorised to prescribe medicinal products may receive only one sample of each medicinal product in its smallest packaging registered in the market and for which the Marketing Authorization Holder has informed in writing the regulatory authority of actual launch in the market.
Each sample must be marked “free medical sample – not for sale” or words to that effect and must be accompanied by a copy of the summary of product characteristics.
12. SANCTIONS
If the Forum finds out or is informed about a violation of the HCP code, it shall request the violating company to immediately cease the violation and sign a statement that it shall not repeat it. Sanctions must be proportionate to the nature of the violation, have a deterrent effect and take into account repeated violations of the same type or patterns of various violations. Generally the most effective sanction is the combination of notifying all the Forum members and financial fine for the violating company, however, the Forum may impose any other effective sanction to enforce the implementation of the HCP code. The Forum must also study all the applicable legal or financial requirements that could influence the nature of sanctions.
13. RESPONSIBILITY
13.1. SCOPE OF RESPONSIBILITY
Responsibility for pharmaceutical information shall apply to information as a whole: for form and content.
13.2. RESPONSIBLE PERSONS
Responsibility for assuring compliance with the present HCP code is borne by all Forum members. Authorised representatives of Forum members are responsible also for compliance with this code.
14. SUPERVISION
The Committee as a Forum body assesses information on medicinal products and the appropriateness of member cooperation with healthcare professionals and patient organisations and provides guidelines.
15. COMPLAINTS
Complaints regarding violations of these rules shall be submitted to the Committee within 30 days from the occurrence of violation.
16. AMENDMENTS
Amendments or adjustments of the HCP code may be instituted on the basis of an opinion of the majority of Forum members. The HCP code may be amended several times per year:
a) Upon amendment of the EFPIA Code on the promotion of prescription-only medicines to, and interactions with, healthcare professionals.
b) Upon a request submitted to the Forum Board by a member company (or several thereof), which shall be submitted for approval to the Forum General Assembly.
Adoption shall require the majority of present votes at a General Assembly.
17. ENFORCEMENT
This code entered into force on 20 January 2012 when approved by Forum`s General Assembly.
MEMBERS OF THE FORUM OF INTERNATIONAL RESEARCH AND DEVELOPMENT PHARMACEUTICAL COMPANIES:
Abbvie
Amgen
Astellas
AstraZeneca
Bayer
Baxalta
Biogen Idec
Boehringer Ingelheim
Celgene
Chiesi
Eli Lilly
GlaxoSmithKline
Janssen
Lundbeck
Merck d.o.o.
Merck Sharp & Dohme
Novartis
Novo Nordisk
Pfizer
Roche
Sanofi-aventis
Servier
“,,1521786060,1521786060,en,12399,306,12398,43,0,NULL,,”Kodeks sodelovanja z zdravstvenimi delavci “,kodeks-sodelovanja-z-zdravstvenimi-delavci,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1521786158,1567593476
338,12396,”Disclosure code”,”Code on disclosure of transfers of value from pharmaceutical companies to healthcare professionals and healthcare organisations”,”
CODE ON DISCLOSURE OF TRANSFERS OF VALUE FROM PHARMACEUTICAL COMPANIES TO HEALTHCARE PROFESSIONALS AND HEALTHCARE ORGANISATIONS
(Disclosure code)
Adopted by the General Assembly of Forum International Research and Development Pharmaceutical Companies, EIG on 21 November 2013
as amended on 4 July 2014, 5 December 2014 and May 27 2016
IMPLEMENTATION OF CODE PROVISIONS
The Forum of International Research and Development Pharmaceutical Companies, EIG (hereinafter: Forum) is introducing appropriate procedures to assure that companies, members of the Forum, operate in accordance with the European code (as adopted by the European Federation of Pharmaceutical Industries and Associations (hereinafter: EFPIA)) and the appropriate national code (Code on disclosure of transfers of value from pharmaceutical companies to healthcare professionals and healthcare organisations: Disclosure code)) thereby assuring transparency of payments and transfers of value and resolving possible complaints regarding their in-appropriacy.
INTRODUCTION
Healthcare professionals (HCP) and healthcare organisations (HCO) with whom they work provide the pharmaceutical industry with valuable, independent and expert knowledge derived from their clinical and management experience. This expertise makes an important contribution to the industry’s efforts to improve the quality of patient care, with benefits for individuals and society at large. Healthcare professionals and healthcare organisations should be fairly compensated for the legitimate expertise and services they provide to the industry.
Prescription medicines developed by the industry are complex products designed to address the needs of patients and educating healthcare professionals about medicines and the diseases they treat benefits patients. The pharmaceutical industry can provide a legitimate forum for the education of healthcare professionals and the exchange of knowledge between healthcare professionals and industry.
The Forum emphasizes that interactions between the pharmaceutical industry and healthcare professionals have a profoundly positive influence on the quality of patient treatment and the value of future research. At the same time, the integrity of the decision of a healthcare professional to prescribe a medicine is one of the pillars of the healthcare system. The Forum recognizes that interactions between the industry and healthcare professionals can create the potential for conflicts of interest. Consequently, professional and industry associations, including EFPIA and its member associations, have adopted codes and guidelines to ensure that these interactions meet the high standards of integrity that patients, governments and other stakeholders expect.
In order to continue to be successful, self-regulation needs to respond to the evolving demands of the society. Beside integrity in the cooperation between corporations and society, complete transparency of such processes is an ever increasing requirement. Following the adoption of the EU Commission initiative on Ethics & Transparency in the pharmaceutical sector, a multi-stakeholders’ platform – including, among others, EFPIA – has adopted a “List of Guiding Principles Promoting Good Governance in the Pharmaceutical Sector”.
In line with these “Guiding Principles”, the Forum believes that it is critical to the future success of the pharmaceutical industry to respond to society’s heightened expectations. The Forum has therefore decided that its existing regulations, such as the Code on the Promotion of Prescription-Only Medicines to, and Interactions with, Healthcare Professionals (the “HCP Code”) and Code of Practice on Relationships between the Pharmaceutical Industry and Patient Organisations (the “PO Code”) should be supplemented by requirements for public disclosure of the nature and scale of interactions between the industry and healthcare professionals and organisations. The Forum hopes that, by taking this step, it can enable public scrutiny and understanding of these relationships and thus contribute to the confidence of stakeholders in the pharmaceutical industry.
The Forum also believes that the interest of patients and other stakeholders in the transparency of these interactions is completely justified. The Forum recognizes that disclosure can raise data privacy concerns and seeks to work with healthcare professionals to ensure that these concerns are addressed. The Forum nonetheless believes that transparency can be achieved without sacrificing the legitimate privacy interests of healthcare professionals and legislation should not therefore impose excessive restrictions on disclosure by the industry.
The following Disclosure code sets out disclosures of payments and other transfers of value to healthcare professionals, whether directly or indirectly via healthcare organisations or made by third parties (such as contractors, agents, partner or subsidiaries (including foundations)). When deciding how a transfer of value should be disclosed, companies are encouraged to publish data at the level of individual healthcare professional (rather than healthcare organisation) level, as long as this can be achieved with accuracy, consistency and compliance with applicable law.
The following code imposes obligations to disclose payments and other transfers of value to healthcare professionals and healthcare organisations commencing with reporting in 2016 in respect of transfers of value for the calendar year 2015. The provisions of this Code shall be implemented by the Forum in a manner consistent with applicable competition and data protection laws and regulations and all other applicable legal requirements.
SCOPE OF IMPLEMENTATION OF CODE PROVISIONS
This Code governs disclosures regarding payments and transfers of value pertaining to certain interactions with HCPs and HCOs. The purpose of this Code is its application to regulate the transparency of interactions with HCPs and HCOs within the same scope of the current HCP and PO codes. This Code applies to all Forum member companies.
PROVISIONS OF THE CODE
1. DISCLOSURE OBLIGATION
1.1. General obligation. Subject to the terms of this Code, each Member Company shall document and disclose payments and transfers of value it makes, directly or indirectly, to or for the benefit of a Recipient, as described in more detail in Article 3.
1.2. Consent of Recipient. Each Member is obliged to acquire consent for disclosure of information from each clearly identifiable HCP prior to such disclosure of payments and other transfers of value. When concluding a contract, which includes transfer of value to a HCP, members are encouraged to include in the contract provisions relating to HCP’s consent to disclose transfers of value in accordance with the provisions of this Code. The same applies to the existing contracts, for which the members are encouraged to include such consent for disclosure at their earliest convenience.
1.3. Excluded Disclosures. The following transfers of value are not subject to disclosure: (i) transfers that are solely related to over-the-counter medicines; (ii) which are not listed in Article 3 hereof, that is informational and educational materials and items of medical utility (Art. 2.9. HCP Code); meals and drinks at the events (Art. 2.11. HCP Code with special reference to point 5) and medical samples (Art. 11. HCP Code) (iii) and which are part of the ordinary course of purchases and sales of medicinal products by and between a Member Company and an HCP (such as a pharmacist) or an HCO.
1.4. Appendices. Each of the attached Annexes forms part of this Code.
Definitions of capitalised terms are included in Appendix 1 to ensure consistent understanding of such terms.
A standardised template for disclosure of transfers of value is enclosed in Appendix 2.
2. FORM OF DISCLOSURE
2.1. Annual disclosure cycle. Data on payments and transfers of value shall be made on an annual basis and each reporting period shall cover a full calendar year (the “Reporting Period”). The first Reporting Period shall be the calendar year 2015, whereby the relevant data shall be published in the first half of 2016.
2.2. Time of disclosures. Disclosures shall be made by each Member Company within 6 months after the end of the relevant Reporting Period and the information disclosed shall be required to remain in the public domain for a minimum of 3 years after the time such information is first disclosed in accordance with Section 2.4, unless, in each case, (i) a shorter period is required under applicable national data privacy or other laws or regulations, or (ii) the Recipient’s consent relating to a specific disclosure has been revoked.
2.3. Template. Subject to Section 2.4., for consistency purposes, disclosures will be made using standardised template set forth in Appendix 2.
2.4. Platform of disclosures. Disclosures shall be made on the website of the relevant member company pursuant to Section 2.5., provided access to the website is not limited.
2.5. Applicable national code. Disclosures shall be made pursuant to the national code of the country where the Recipient has its place of main practice or registered headquarters. If the Forum Member is not resident or does not have a subsidiary or an affiliate in the country where the Recipient has its place of main practice, the Forum Member shall disclose such Transfer of Value in a manner consistent with the national code to which it is subject.
2.6. Language of disclosures. Disclosures shall be made in Slovenian language. Member Companies are encouraged to make disclosures in English in addition to the mandatory disclosures in the Slovenian language.
2.7. Documentation and Retention of Records. Each Member Company shall document all transfers of value required to be disclosed pursuant to Section 1.1. and maintain the relevant records of the disclosures made under this Code for a minimum of 10 years after the end of the relevant Reporting Period.
3. INDIVIDUAL AND AGGREGATE DISCLOSURE
3.1. Individual disclosure. Except as expressly provided by this Code, payments and transfers of value shall be disclosed on an individual basis. Each Member Company shall disclose, on an individual basis for each clearly identifiable Recipient, the amounts attributable to Transfers of Value to such Recipient in each Reporting Period which can be reasonably allocated to one of the categories set out below. Reasonable costs of travel, accommodation and registration shall be presented in a transparent manner, as set out below. Such payments and Transfers of Value may be aggregated on a category-by-category basis, provided that itemised disclosure shall be made available upon request to the relevant Recipient and/or the relevant authorities.
3.1.1. For Transfers of Value to an HCO, an amount related to any of the categories set forth below shall be disclosed:
3.1.1.1. Donations and grants for education. Donations and Grants for education to HCOs that support healthcare, including donations and grants (either cash or benefits in kind) to institutions, organisations or associations that are comprised of HCPs and/or that provide healthcare (governed by Article 6 of the HCP Code).
3.1.1.2. Contribution to costs related to Events. Contribution to costs related to Events, including direct sponsorship to attend Events for HCP or via HCO, such as:
i. Registration fees;
ii. Sponsorship agreements with HCOs or with third parties appointed by an HCO to manage an Event; and
iii. Costs of travel and accommodation (to the extent governed by Article 2.11. of the HCP Code).
3.1.1.3. Fees for Service and Consultancy. Transfers of Value resulting from or related to contracts between Member Companies and institutions, organisations or associations of HCPs under which such institutions, organisations or associations provide any type of services to a Member Company or any other type of funding not covered in the previous categories, if such services (or other financing) (x) are provided with the intent of supporting healthcare or research and (y) do not constitute an inducement to recommend, prescribe, purchase, supply or sell specific medicinal products (pursuant to Articles 7. and 8. of the HCP Code). Fees, on the one hand, and on the other hand Transfers of Value relating to expenses agreed in the written agreement covering the activity will be disclosed as two separate amounts.
3.1.2. For Transfers of Value to an HCP, an amount related to any of the categories set forth below shall be disclosed:
3.1.2.1. Contribution to costs related to Events. Contribution to costs related to Events, such as:
i. Registration fees; and
ii. Costs of travel and accommodation (to the extent governed by Article 2.11. of the HCP Code).
3.1.2.2. Fees for Service and Consultancy. Transfers of Value resulting from or related to contracts between Member Companies and HCPs under which such HCPs provide any type of services to a Member Company (or any other type of funding not covered in the previous categories, including agreed and/or contractually set costs related to remuneration for services) (Pursuant to Articles 7 and 8 of the HCP Code). Fees, on the one hand, and on the other hand Transfers of Value relating to expenses agreed in the written agreement covering the activity will be disclosed as two separate amounts.
3.2. Aggregate Disclosure. For Transfers of Value where certain information, which can be otherwise reasonably allocated to one of the categories set forth in Section 3.1, cannot be disclosed on an individual basis for legal reasons, a Member Company shall disclose the amounts attributable to such Transfers of Value in each Reporting Period on an aggregate basis. Such aggregate disclosure shall identify, for each category, (i) the number of Recipients covered by such disclosure, on an absolute basis and as a percentage of all Recipients, and (ii) the aggregate amount attributable to Transfers of Value to such Recipients.
3.3. Non duplication. Where a Transfer of Value required to be disclosed pursuant to Section 3.1. or 3.2. is made to an individual HCP indirectly via an HCO, such Transfer of Value shall only be required to be disclosed once. To the extent possible, such disclosure shall be carried out pursuant to Section 3.1.2.
3.4. Research and Development Transfers of Value. Research and Development Transfers of Value in each Reporting Period shall be disclosed by each Member Company on an aggregate basis. Costs related to events that are clearly related to activities covered in this section can be included in the aggregate amount under the “Research and Development Transfers of Value” category.
3.5. Methodology. Each Member Company shall publish a note summarising the methodologies used by it in preparing the disclosures and identifying Transfers of Value for each category described in Section 3.1. The note shall describe the recognition methodologies applied, and should include the treatment of multi-year contracts, VAT and other tax aspects, currency aspects and other issues related to the timing and amount of Transfers of Value for purposes of this Code.
4. SANCTIONS
If the Forum finds out or is informed a violation of the Disclosure Code, it shall request the violating company to immediately cease the violation and sign a statement that it shall not repeat it. Sanctions must be proportionate to the nature of the violation, have a deterrent effect and take into account repeated violations of the same type or patterns of various violations. Sanctions are set out in the Working Procedure of the Committee for supervision of the provisions of ethical codes. Generally the most effective sanction is the combination of notifying all the Forum members and financial fine for the violating company, however, the Forum may impose any other effective sanction to enforce the implementation of the Code. The Forum must also study all the applicable legal or financial requirements that could influence the nature of sanctions.
5. RESPONSIBILITY
5.1. Scope of responsibility
Responsibility for disclosure of payments and other transfers of value from pharmaceutical companies to HCP and HCO shall apply for disclosure as a whole: for categories of transfers, Recipients, for public disclosure and observation of deadlines.
5.2. Responsible persons
Responsibility for assuring compliance with the present Code shall be borne by all Forum members. Compliance with the provisions hereof shall also be the responsibility of authorised representatives of Forum members.
The Forum shall assure that the Disclosure Code and other codes and relevant information is readily available at least by means of publishing on the Forum website.
6. SUPERVISION
Committee for supervision of the provisions of ethical codes (Committee) as a Forum body assesses information regarding disclosure of payments and other transfers of value from pharmaceutical companies to HCP and HCO and provides guidelines regarding the same. The Committee shall decide by a procedure equal to that applied in the establishment of violations of the HCP Code.
7. COMPLAINTS
Complaints regarding violations of these rules shall be submitted to the Committee within 30 days of violation.
8. AMENDMENTS
Amendments or adjustments of the Disclosure Code may be instituted on the basis of an opinion of the majority of Forum members.
8.1. The Code may be amended several times per year:
8.1.1. upon amendment of the EFPIA Code on the transfer of value from pharmaceutical companies to HCP and HCO.
8.1.2. upon a request submitted to the Forum Board by a member company (or several thereof), which shall be submitted for approval to the Forum General Assembly.
8.2. Adoption shall require the majority of present votes at a General Assembly.
9. ENFORCEMENT
This code entered into force on 21 November 2013 when approved by Forum`s General Assembly.
Appendix 1:
Definition of terms used in the Disclosure code
Donations and grants
– Donations and Grants, collectively, means donations and in kind within the scope of Article 6 of the HCP Code.
Events
– All promotional, scientific or professional meetings, congresses, conferences, symposia, and other similar events (including, but not limited to, advisory board meetings, visits to research or manufacturing facilities, and planning, training or investigator meetings for clinical trials and non-interventional studies) (each, an “Event”) organised or sponsored by or on behalf of a company (Article 2.11. of the HCP Code).
Healthcare organisations (HCO)
– All single entrepreneurs and any legal person (i) that is a healthcare, medical or scientific association or organisation (irrespective of the legal or organisational form) such as a hospital, clinic, foundation, university or other teaching institution or learned society (except for patient organisations within the scope of the EFPIA PO Code) or (ii) through which one or more HCPs provide services.
Healthcare professionals (HCP)
– Any natural person that is a member of the medical, dental, pharmacy or nursing professions or any other person who, in the course of his or her professional activities, may prescribe, purchase, supply, recommend or administer a medicinal product and whose primary practice, principal professional address or place of incorporation is in the Republic of Slovenia.
For the avoidance of doubt, the definition of HCP includes: (i) any official or employee of a government agency or other organisation (whether in the public or private sector) that may prescribe, purchase, supply or administer medicinal products and (ii) any person employed in the Republic of Slovenia whose primary occupation is that of a practising HCP, but excludes (x) all other persons employed in the Republic of Slovenia and (y) a wholesaler or distributor of medicinal products.
HCP Code
– Forum Code on the Promotion of Prescription-Only Medicines to, and Interactions with, Healthcare Professionals, adopted by the Forum General Assembly on 20 January 2012, as may be amended, supplemented or modified from time to time.
Medicinal Products
– The term “Medicinal Products” as used in the present Code and HCP Code has the meaning set forth in Article 1 of the Directive 2001/83/EC, including: medicinal products, immunological medicinal products, radiopharmaceuticals, medicinal products derived from human blood or human plasma, for which a marketing authorisation has been delivered in the sense of Directive 2001/83/EC.
Member Companies
– Collectively, “members” (as defined in the HCP Code) of the Forum, their respective parent companies, if different, subsidiary companies (irrespective of whether a subsidiary is a company or such other form of enterprise or organisation) and any companies affiliated with corporate members or their subsidiaries, committed to compliance with the present Code.
PO Code
– Forum Code of Practice on Relationships between Pharmaceutical Industry and Patient Organisations, adopted by the General Assembly on 20 January 2012, and as may be amended, supplemented or modified from time to time.
Recipient
– Any HCP or HCO as applicable, in each case, whose primary practice, principal professional address or place of incorporation is in the Republic of Slovenia, or are employed in such HCO.
Research and Development Transfers of Value
– Transfers of Value to HCPs or HCOs related to the planning or conduct of (i) non-clinical studies (as defined in OECD Principles on Good Laboratory Practice); (ii) clinical trials (as defined in Directive 2001/20/EC); or (iii) non-interventional studies that are prospective in nature and that involve the collection of patient data from or on behalf of individual, or groups of, HCPs specifically for the study (Article 9 of the HCP Code).
Transfers of Value
– Direct and indirect transfers of value, whether in cash, in kind or otherwise, made, whether for promotional purposes or otherwise, in connection with the development and sale of generic or patented prescription-only Medicinal Products exclusively for human use. Direct transfers of value are those made directly by a Member Company for the benefit of a Recipient. Indirect transfers of value are those made by third parties (such as contractors, agents, partner or subsidiaries (including foundations)) in the name of a Member for the benefit of a Recipient, whereby the Member Company knows or can identify the Recipient.
Appendix 2:
Disclosure template (see appended Excel sheet)
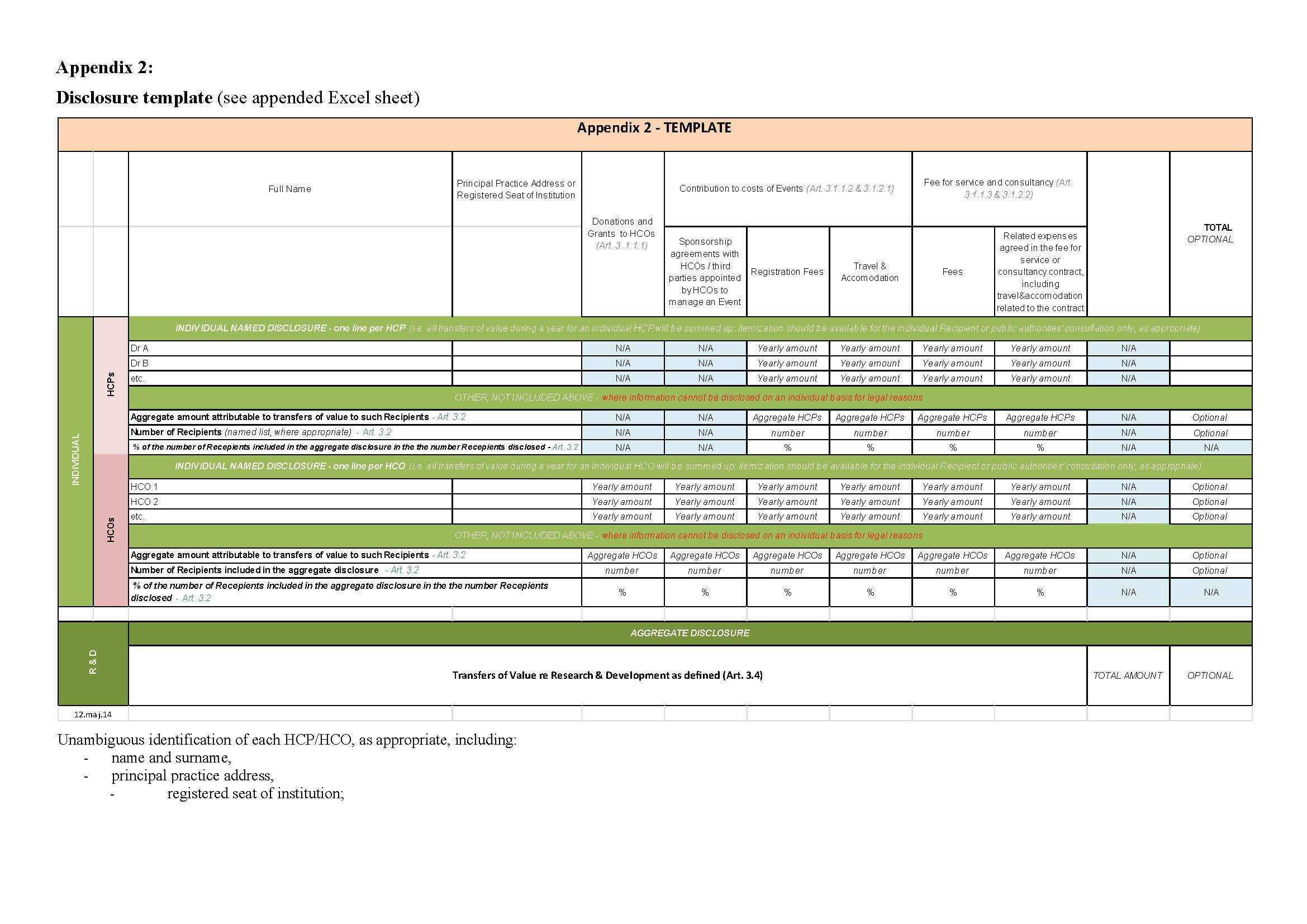
Unambiguous identification of each HCP/HCO, as appropriate, including:
– name and surname,
– principal practice address,
– registered seat of institutio
MEMBERS OF THE FORUM OF INTERNATIONAL RESEARCH AND DEVELOPMENT PHARMACEUTICAL COMPANIES:
– Abbvie
– Amgen
– Astellas
– AstraZeneca
– Bayer
– Biogen Idec
– Boehringer Ingelheim
– Celgene
– Eli Lilly
– GlaxoSmithKline
– Janssen
– Lundbeck
– Merck Sharp & Dohme
– Novartis
– Novo Nordisk
– Pfizer
– Roche
– Sanofi-Aventis
– Servier
“,,1521785520,1521785520,en,12396,306,12395,43,0,NULL,,”Kodeks transparentnosti”,kodeks-transparentnosti,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1521785625,1567593506
339,12402,”Patient Organization Code”,”Code of practice on relationships between the pharmaceutical industry and patient associations”,”
Adopted by EFPIA and Forum of International R&D Pharmaceutical Companies
As adopted by EFPIA Statutory General Assembly on 14.6.2011.
As adopted by General Assembly of Forum on 20.1.2012 and 7.12.2018.
The European Federation of Pharmaceutical Industries and Associations (EFPIA) is the representative body of the pharmaceutical industry in Europe. Its members are the national industry associations of countries in Europe (i.e. member associations) and leading pharmaceutical companies (i.e. corporate members)1. EFPIA membership also includes two specialised groups: the “European Biopharmaceutical Enterprises” (EBE) and the “European Vaccines Manufacturers” (EVM).
EFPIA’s primary mission is to promote the technological and economic development of the pharmaceutical industry in Europe and to assist in bringing to market medicinal products which improve human health.
The pharmaceutical industry recognises that it has many common interests with patient organisations, which represent and/or support the needs of patients and/or caregivers.
In order to ensure that relationships between the pharmaceutical industry and patient organisations take place in an ethical and transparent manner, EFPIA has adopted the EFPIA Code of Practice on Relationships between the Pharmaceutical Industry and Patient Organisations (The EFPIA Patient Organisation (PO) Code)
This Code builds upon the following principles that EFPIA, together with pan-European patient organisations, subscribed to:
1. The independence of patient organisations, in terms of their political judgement, policies and activities, shall be assured.
2. All partnerships between patient organisations and the pharmaceutical industry shall be based on mutual respect, with the views and decisions of each partner having equal value.
3. The pharmaceutical industry shall not request, nor shall patient organisations undertake, the promotion of a particular prescription-only medicine.
4. The objectives and scope of any partnership shall be transparent. Financial and non-financial support provided by the pharmaceutical industry shall always be clearly acknowledged.
5. The pharmaceutical industry welcomes broad funding of patient organisations from multiple sources.
This EFPIA Patient Organisation Code covers relationships between EFPIA corporate members including their subsidiaries and contracted third parties (e.g. agencies) and patient organisations which operate in Europe.
Patient organisations are defined as not-for-profit organisations (including the umbrella organisations to which they belong), mainly composed of patients and/or caregivers, that represent and/or support the needs of patients and/or caregivers.
The EFPIA Patient Organisation Code sets out the standards which EFPIA considers must apply. In a manner compatible with their respective national laws and regulations, member associations must adopt provisions in their national codes which are no less rigorous than the provisions contained in the EFPIA Patient Organisation Code.
Pharmaceutical companies must comply with the following applicable codes (‘Applicable Codes’) and any laws and regulations to which they are subject:
1. If the company is located within Europe, the industry code of the country in which the company is located or, if the company is located outside Europe, the EFPIA Patient Organisation Code; AND
2. a) in the case of partnerships and activities taking place in a particular country within Europe, the industry code of the country in which the activity takes place;
or
b) in the case of cross-border partnerships and activities, the industry code of the country in which the patient organisation has its main European location.
The requirements apply to activities or funding within Europe. ‘Europe’ as used in this EFPIA Patient Organisation Code, includes those countries in which the EFPIA member associations’ codes of practice apply.
The Applicable Codes that will apply must be specified in a written agreement between the company and the patient organisation. In the event of a conflict between the provisions of the Applicable Codes set forth above, the more restrictive of the conflicting provisions shall apply.
For the avoidance of doubt, the term “company” as used in this EFPIA Patient Organisation Code, shall mean any legal entity that provides funds or engages in activities with patient organisations covered by an Applicable Code, which takes place within Europe, whether such entity be a parent company (e.g. the headquarters, principal office, or controlling company of a commercial enterprise), subsidiary company or any other form of enterprise or organisation.
“Activity” as used above, shall mean any interaction covered by an Applicable Code, including the provision of funding.
Article 1
Non-promotion of prescription-only medicines
EU and national legislation and codes of practice, prohibiting the advertising of prescription-only medicines to the general public, apply.
Article 2
Written agreements
When pharmaceutical companies provide financial support, significant indirect support and/or significant non-financial support to patient organisations, they must have in place a written agreement. This must state the amount of funding and also the purpose (e.g. unrestricted grant, specific meeting or publication, etc). It must also include a description of significant indirect support (e.g. the donation of public relations agency’s time and the nature of its involvement) and significant non-financial support. Each pharmaceutical company should have an approval process in place for these agreements.
A template for a written agreement is available in Annex I.
Article 3
Use of logos and proprietary materials
The public use of a patient organisation’s logo and/or proprietary material by a pharmaceutical company requires written permission from that organisation. In seeking such permission, the specific purpose and the way the logo and/or proprietary material will be used must be clearly stated.
Article 4
Editorial control
Pharmaceutical companies must not seek to influence the text of patient organisation material they sponsor in a manner favourable to their own commercial interests. This does not preclude companies from correcting factual inaccuracies. In addition, at the request of Patient
Organisations, companies may contribute to the drafting of the text from a fair and balanced scientific perspective.
Article 5
Transparency
a) Each company must make publicly available a list of patient organisations to which it provides financial support and/or significant indirect/non-financial support. This should include a description of the nature of the support that is sufficiently complete to enable the average reader to form an understanding of the significance of the support. The description must include the monetary value of financial support and of invoiced costs. For significant non-financial support that cannot be assigned a meaningful monetary value the description must describe clearly the non-monetary benefit that the patient organisation receives. This information may be provided on a national or European level and should be updated at least once a year.
b) Companies must ensure that their sponsorship is always clearly acknowledged and apparent from the outset.
c) Each company must make publicly available a list of patient organisations that it has engaged to provide significant contracted services. This should include a description of the nature of the services provided that is sufficiently complete to enable the average reader to form an understanding of the nature of the arrangement without the necessity to divulge confidential information. Companies must also make public the total amount paid per patient organisation during a calendar year by end of June of the next calendar year.
Article 6
Contracted Services
Contracts between companies and patient organisations under which they provide any type of services to companies are only allowed if such services are provided for the purpose of supporting healthcare or research.
It is permitted to engage Patient Organisations as experts and advisors for services such as participation at advisory board meetings and speaker services. The arrangements that cover consultancy or other services must, to the extent relevant to the particular arrangement, fulfil all the following criteria:
a) A written contract or agreement is agreed in advance which specifies the nature of the services to be provided and, subject to clause (g) below, the basis for payment of those services;
b) A legitimate need for the services has been clearly identified and documented in advance of requesting the services and entering into the arrangements;
c) The criteria for selecting services are directly related to the identified need and the persons responsible for selecting the service have the expertise necessary to evaluate whether the particular experts and advisors meet those criteria;
d) The extent of the service is not greater than is reasonably necessary to achieve the identified need;
e) The contracting company maintains records concerning, and makes appropriate use of, the services;
f) The engaging of Patient Organisations is not an inducement to recommend a particular medicinal product;
g) The compensation for the services is reasonable and does not exceed the
fair market value of the services provided. In this regard, token consultancy arrangements must not be used to justify compensating patient organisations;
h) In their written contracts with Patient Organisations, companies are strongly encouraged to include provisions regarding an obligation of the Patient Organisation to declare that they have provided paid services to the company whenever they write or speak in public about a matter that is the subject of the agreement or any other issue relating to that company;
i) Each company must make publicly available a list of patient organisations that it has engaged to provide paid-for services – see Article 5.c. above.
Article 7
Single company funding
No company may require that it be the sole funder of a patient organisation or any of its major programmes.
Article 8
Events and hospitality
All events sponsored or organised by or on behalf of a company including scientific, business or professional meetings, must be held in appropriate locations and venues that are conducive to the main purpose of the event, avoiding those that are ‘renowned’ for their entertainment facilities or are ‘extravagant’.
All forms of hospitality provided by the pharmaceutical industry to patient organisations and their members shall be reasonable in level and secondary to the main purpose of the event, whether the event is organised by the patient organisation or the pharmaceutical industry.
Hospitality extended in connection with events shall be limited to travel, meals, accommodation and registration fees.
Hospitality may only be extended to persons who qualify as participants in their own right. In exceptional cases, in case of clear health needs (e.g. disability), the travel meals, accommodation and registration fees cost of an accompanying person considered to be a carer can be taken.
All forms of hospitality offered to patient organisations and their representatives shall be “reasonable” in level and strictly limited to the purpose of the event.
Hospitality shall not include sponsoring or organising entertainment (e.g. sporting or leisure events).
No company may organise or sponsor an event that takes place outside its home country unless:
a) most of the invitees are from outside of its home country and, given the countries of origin of most of the invitees, it makes greater logistical sense to hold the event in another country; or
b) given the location of the relevant resource or expertise that is the object or subject matter of the event, it makes greater logistical sense to hold the event in another country.
Article 9
Enforcement
Attached to this EFPIA Patient Organisation Code as Annex II, are “Implementation and Procedure Rules” which are binding upon member associations and corporate members and set forth the framework for the implementation of this EFPIA Patient Organisation Code, the processing of complaints and the initiation or administration of sanctions by member associations.
Forum Members shall within 3 months from adoption of this code adopt guidelines on the meaning of the terms ‘appropriate, ‘significant’, ‘major’, ‘reasonable’, ‘renowned’ and ‘extravagant’ as used in this code.
.
.
Annex I – Model template for written agreements between the pharmaceutical industry and patient organisations
Annex II – Implementation and Procedure Rules
ANNEX I
When pharmaceutical companies provide financial support, significant indirect support and/or significant non-financial support to patient organisations, they must have in place a written agreement.
Below is a model template, which may be used in its entirety or adapted as appropriate, setting out key points of a written agreement. It is intended as a straightforward record of what has been agreed, taking into account the requirements of EFPIA’ s Code of Practice on
Relationships between the Pharmaceutical Industry and Patient Organisations:
All parties are fully aware that sponsorship must be clearly acknowledged and apparent from the outset.
Arrangements for making transparent the details of the activities subject to the agreement
Code/s of practice that apply: to be completed
Signatories to the agreement:
Date of agreement:
.
.
ANNEX II
The Implementation and Procedure Rules set forth herein establish the framework for the implementation of the European Federation of Pharmaceutical Industries and Associations (“EFPIA”) Code on Relationships between the Pharmaceutical Industry and Patient Organisations (the “EFPIA PO Code”), the processing of complaints and the initiation or administration of sanctions by member associations.
SECTION 1. Member Associations’ Implementation
Each member association is required to:
a) establish national procedures and structures to receive and process complaints, to determine sanctions and to publish appropriate details regarding the same including, at a minimum, a national body of the member association that is designated to handle complaints and consists of a non-industry chairman and, besides any industry members, membership from other stakeholders;
b) ensure that its national code, together with its administrative procedures and other relevant information, are easily accessible through, at a minimum, publication of its national code on its website; and
c) prepare, and provide to the EFPIA Codes Committee (defined below), an annual report summarizing the work undertaken by it in connection with the implementation, development and enforcement of its national code during the year.
SECTION 2. EFPIA Codes Committee Implementation and Key Tasks
a) The EFPIA Codes Committee shall assist member associations to comply with their obligations under Section 1 above.
b) The EFPIA Codes Committee will be composed of all the national code secretaries, and chaired by the EFPIA Director General, assisted by one person from the EFPIA staff.
c) As a key part of its role of assisting member associations in their national code compliance activities, the EFPIA Codes Committee shall monitor the adoption of compliant national codes. The EFPIA Codes Committee will not participate in the adjudication of any individual complaint under any national code.
d) EFPIA Codes Committee will, at least annually, invite member associations and representatives to participate in a meeting at which the participants will be encouraged to share their respective relevant experiences relating to the EFPIA PO Code. Any conclusions from the meeting shall be summarised in the annual codes report (referred to under (e) of this Section 2 below) and be presented to the EFPIA Executive Committee, and to the EFPIA Board, if appropriate.
e) EFPIA shall publish an annual codes report, which summarizes the work and operations which have taken place in connection with the implementation, development and enforcement of the various national codes during the applicable year, based on the country reports provided by the member associations pursuant to Section 1(c) above.
f) On an annual basis, the EFPIA Codes Committee shall (i) advise the EFPIA Executive Committee, and the EFPIA Board, if appropriate, of its work and operations and the work and operations of the member associations, as summarized in the member association annual reports, and (ii) review with the EFPIA Executive Committee, and the EFPIA Board, if appropriate, any additional recommendations to improve the EFPIA PO Code with a view towards increasing transparency and openness within the pharmaceutical industry and among member associations and companies.
SECTION 3. Reception of Complaints
Complaints may be lodged either with a member association or with EFPIA. Adjudication of complaints shall be a matter solely for the national associations.
Complaints received by EFPIA shall be processed as follows:
i. EFPIA will forward any complaints it receives (without considering their admissibility or commenting upon them) to the relevant member association(s);
ii. EFPIA will send an acknowledgement of receipt to the complainant, indicating the relevant national association(s) to which the complaint has been sent for processing and decision;
iii. In addition, upon receipt by EFPIA of multiple external complaints (i.e. several complaints on the same or similar subjects lodged from outside the industry against several subsidiaries of a single company), EFPIA will communicate these complaints to the national association either of the parent company or of the EU subsidiary designated by the parent company.
SECTION 4. Processing of Complaints and Sanctions by Member Associations
a) Member associations shall ensure that industry and non-industry complaints are processed in the same manner, without regard to who has made the complaint. Complaints will be processed at the national level through the procedures and structures established by the member associations pursuant to Section 1(a) above.
b) Each member association’s national body shall take decisions and pronounce any sanctions on the basis of the national code in force in its country. Sanctions should be proportionate to the nature of the infringement, have a deterrent effect and take account of repeated offences of a similar nature or patterns of different offences.
c) Where a complaint fails to establish a prima facie case for a violation of an Applicable Code, such complaint shall be dismissed with respect to that national code. Member associations may also provide that any complaint which pursues an entirely or predominantly commercial interest shall be dismissed.
d) Each member association should establish effective procedures for appeals against the initial decisions made by its national body. Such procedures and appeals should also take place at the national level.
e) National committees shall ensure that any final decision taken in an individual case shall be published in its entirety or, where only selected details are published, in a level of detail that is linked to the seriousness and/or persistence of the breach as follows:
i. in cases of a serious/repeated breach, the company name(s) should be published together with details of the case;
ii. in cases of a minor breach, or where there is no breach, publication of the details of the case may exclude the company name(s).
f) National committees are encouraged to publish summaries in English of cases that have precedential value and are of international interest (keeping in mind that cases resulting in the finding of a breach as well as those where no breach is found to have occurred may each have such value and/or interest).
.
.
.
(Guidelines on meaning of the terms)*
* As adopted by General Assembly of Forum on March 7th, 2012.
Pursuant to Article 9(2) of the Code of Practice on Relationships between the Pharmaceutical Industry and Patient Organisations (“Code”) the Members of Forum of International R&D Pharmaceutical Companies adopted the guidelines of the following terms used in the Code:
– “APPROPRIATE” location or venue under Article 8 shall mean any location or venue which is usually used for organisation of similar events with exception of RENOWNED or EXTRAVAGANT venues as defined below.
– “SIGNIFICANT” support (Art. 2, Art. 5(a)) or contacted service (Art. 5(c)) shall mean any support or service with financial value, which can be attributed to it, not exceeding 150,00 EUR per transaction and 600,00 EUR per year.
– “MAJOR” programme in sense of Article 7 means a programme to which a patient association devotes more than 25% of its annual resources.
– “REASONABLE” hospitality under Article 8 shall mean hospitality within the boundaries of what members of patient associations would normally be prepared to pay for themselves and shall be understood to exclude the events with predominantly entertainment purpose. Entertainment events with other purpose than hospitality (e.g. fundraising or disease awareness) are allowed.
– “RENOWNED” location or venue in the meaning of Article 8 shall mean any location which is predominantly known to offer specific entertainment (rather than typical congress activity), such as casino, golf or spa (with exception of those spa resorts which carry out medical services as part of the public healthcare financed by the Health Insurance Fund of Slovenia).
– “EXTRAVAGANT” venue in the meaning of Article 8 shall mean a hotel or similar facility of high or luxurious category which is predominantly used for leisure or entertainment and rarely for scientific, business or professional meetings.
.
.
.
.
1 The complete list of EFPIA membership is available on www.efpia.eu.
“,Administrator,1545114540,1545114540,en,12402,306,12401,43,0,NULL,,”Kodeks sodelovanja z združenji bolnikov”,kodeks-sodelovanja-z-zdruzenji-bolnikov,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1521786621,1545138118
340,12404,”Public disclosure of transfers of value”,”from to HCPs and HCOs in 2015″,”
PUBLIC DISCLOSURE OF TRANSFERS OF VALUE FROM PHARMACEUTICAL COMPANIES TO HEALTHCARE PROFESSIONALS AND HEALTHCARE ORGANISATIONS
Collaboration between the pharmaceutical industry and the healthcare community is essential for the assurance of quality healthcare and a fundamental condition for the development of innovative medicines and methods of treatment for the benefit of patients. Research, development and introduction of new, innovative medicinal products into clinical practice is simply impossible without collaborating with healthcare professionals, organisations and other stakeholders.The industry and the wider medical community share a common goal – to provide patients with the best possible care and foster development of health care and well-being of society as a whole.
The pharmaceutical industry is one of the most regulated sectors of industry that has also been actively pursuing self-regulation for a number of years. Efforts towards maintaining the highest ethical standards are also a mainstay for the Forum of International Research and Development Pharmaceutical Companies, EIG, (hereinafter: Forum), which has adopted the Disclosure Code and thus bound its members to public disclosure of transfers of value to healthcare professionals and organisations. The Disclosure Code was adopted because we wish to maintain a fully transparent relationship between the pharmaceutical industry and healthcare professionals and organisations. It is an important step towards understanding our collaboration.
The Disclosure Code binds all members of the European Federation of Pharmaceutical Industries and Associations (EFPIA), international pharmaceutical companies and national associations of innovative pharmaceutical industry from 33 countries, to by the 30th June the latest publicly disclose all transfers of value to healthcare professionals and organisations. In accordance with EFPIA regulations, data is published annually by the end of June for the past calendar year. The first such disclosure will include transfers of value to healthcare professionals and organisations in the 2015 calendar year.
The implementation of fundamental transparency regulations, adopted by EFPIA in June of 2013 and common to all members, is assured in Slovenia by the Forum. As a representative of innovative pharmaceutical industry in Slovenia with 20 members, the Forum has adjusted regulations to the Slovenian legislation. The Forum adopted its Disclosure Code at the general assembly in November 2013 and the Code entered into force on the 1st of January 2014. It is binding on all Forum member companies and pharmaceutical companies owned by members of EFPIA.
Public disclosure of transfers of value includes data on the value of all assets received by individual healthcare professionals and organisations that collaborate with individual Forum members or the Forum itself, either directly or through third parties such as event organisation agencies. Disclosure also includes information on the type of activity or support – for education, coverage of expenses related to education or events, services and consultancy and research and development. Each Forum member publishes these transfers in Slovenian at its local, regional or international web page.
The first publication in this form at a European level will be completed by 30 June 2016. The disclosure contains data on transfers of value in the past calendar year and will enable the viewing of transfers from 1 January to 31 December 2015 on the web pages of individual members. Data will continue to be published periodically each year by the end of June.
All transfers to healthcare organisations, which under the Disclosure Code include public healthcare institutions, physician associations and societies, chambers and private companies (d.o.o. and s.p.), are published individually, with the full name of the recipient.
Transfers of value to individual healthcare professionals who are natural persons are, pursuant to the Personal Data Protection Act, only possible on the basis of advance written consent of the healthcare professional. If such consent is withheld, transfers are published in a group or aggregate form, with the number of recipients and total amount listed separately for each category of such recipients.
Data on payments in the field of research and development cannot be published otherwise than in a group or aggregated form due to legislative protection of competition and innovations being developed by separate companies.
In the 2015 calendar year, the Forum of International Research and Development Pharmaceutical Companies, EIG collaborated with 21 different individuals and organisations. For the services rendered in the field of consultancy (category of Fees for Service and Consultancy), the forum paid fees to 13 healthcare professionals via contracts for copyrighted work, sponsored the organisation of technical meetings and symposia to 3 healthcare organisations and covered the costs of lectures or technical event organisation for 5 organisations.
The total value of transfers of value from the Forum to individual healthcare professionals in 2015 was EUR 11,839.03 and the value of transfers to healthcare organisations amounted to EUR 23,200.00. All transfers were disclosed with the full name of the recipient.
Publicly disclosed data includes transfers of value actually executed in the financial system of the Forum in the 2015 calendar year, from 1 January 2015 to 31 December 2015.
Transfers to individual healthcare workers are listed as gross values of the relevant contracts.
Transfers to healthcare organisations are listed as net amounts of the relevant contracts without VAT.
Transfers of value pertaining to travel expenses, accommodation and registration fees are published in the calendar year in which activities actually took place.

The data published in this report is an expression of our efforts towards observing the provisions of the EFPIA Disclosure Code. Should it be found that the report contains incomplete or inaccurate data in spite of our best efforts towards assuring accurate publications, we will research the situation and appropriately correct false data.
Notes to table “Data on transfers of value to healthcare professionals and healthcare organisations from the Forum of international research and development pharmaceutical companies, EIG, for 2015”:
1 Area regulated by Disclosure Code, Art. 3.1.1.1
2 Area regulated by Disclosure Code, Art. 3.1.1.2 and 3.1.2.1
3 Area regulated by Disclosure Code, Art. 3.1.1.3 and 3.1.2.2
4 Area regulated by Disclosure Code, Art. 3.2
5 Area regulated by Disclosure Code, Art. 3.2
6 Area regulated by Disclosure Code, Art. 3.4
The “/” mark denotes no transfers of value were performed.
All listed amounts represent total values for 2015.
All listed transactions were performed in the 2015 calendar year, from and including 1 January 2015 to and including 31 December 2015.
Amounts of transfers of value to HCPs in 2015 are listed as gross amounts.
Amounts of transfers of value to HCOs in 2015 are listed as net amounts (not including VAT).
The Disclosure Code defines healthcare organisations (HCO) as all single entrepreneurs and any legal person (i) that is a healthcare, medical or scientific association or organisation (irrespective of the legal or organisational form) such as a hospital, clinic, foundation, university or other teaching institution or learned society (except for patient organisations within the scope of the EFPIA PO Code) or (ii) through which one or more HCPs provide services.
The Disclosure Code defines healthcare professionals (HCP) as any natural person that is a member of the medical, dental, pharmacy or nursing professions or any other person who, in the course of his or her professional activities, may prescribe, purchase, supply, recommend or administer a medicinal product and whose primary practice, principal professional address or place of incorporation is in the Republic of Slovenia.
For the avoidance of doubt, the definition of HCP includes: (i) any official or employee of a government agency or other organisation (whether in the public or private sector) that may prescribe, purchase, supply or administer medicinal products and (ii) any person employed in the Republic of Slovenia whose primary occupation is that of a practising HCP, but excludes (x) all other persons employed in the Republic of Slovenia and (y) a wholesaler or distributor of medicinal products.
The Disclosure Code is available at here.
“,,1521787740,1521787740,en,12404,306,12403,43,0,NULL,,”Javna objava prenosov vrednosti zdravstvenim delavcem in zdravstvenim organizacijam s strani farmacevtskih družb”,javna-objava-prenosov-vrednosti-zdravstvenim-delavcem-in-zdravstvenim-organizacijam-s-strani-farmacevtskih-druzb,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1521787867,1524655072
341,12406,”Public disclosure of transfers of value”,”from to HCPs and HCOs in 2016″,”
PUBLIC DISCLOSURE OF TRANSFERS OF VALUE FROM PHARMACEUTICAL COMPANIES TO HEALTHCARE PROFESSIONALS AND HEALTHCARE ORGANISATIONS
Pursuant to provisions from the Disclosure Code, members of The Forum of International Research and Development Pharmaceutical Companies, GIZ (hereinafter referred to as: Forum) are this year again publishing the values of transfers to healthcare professionals and healthcare organizations, respectively. As provided for under the Code, all innovative pharmaceutical companies that are members of the Forum will publish their data by up to 30 June 2017 inclusive.
The publication includes data on transfers of value in the past calendar year and provides disclosure of transfer in the period from 1 January to 31 December 2016 on the website’s of individual members. According to EFPIA provisions, data is disclosed publically periodically, namely on an annual basis by no later than the end of June, namely for the past calendar year.
Public disclosure of transfers of value includes data on the value of all funds received by individual healthcare professionals and healthcare organizations that collaborate with individual Forum members or the Forum itself, either directly or through third parties such as event organization agencies. Disclosure also includes information on the type of activity or support:
Each Forum member publishes these transfers in Slovenian at its local, regional or international web page.
All transfers to healthcare organizations, which under the Disclosure Code include public healthcare institutions, physician associations and societies, chambers and private companies (d.o.o. and s.p.), are published individually, with the full name of the recipient.
Transfers of value to individual healthcare professionals who are natural persons are, pursuant to the Personal Data Protection Act, only possible on the basis of advance written consent of the healthcare professional. If such consent is withheld, transfers are published in a group or aggregate form, with the number of recipients and total amount listed separately for each category of such recipients.
Data on payments in the field of research and development cannot be published otherwise than in a group or aggregated form due to legislative protection of competition and innovations being developed by separate companies.
The data published in this report is an expression of our efforts towards observing the provisions of the EFPIA Disclosure Code. Should it be found that the report contains incomplete or inaccurate data in spite of our best efforts towards assuring accurate publications, we will research the situation and appropriately correct false data.
In calendar year 2016, the Forum of International Research and Development Pharmaceutical Companies, EIG collaborated with 14 different individuals and organizations. For the services rendered in the field of consultancy (category of Fees for Service and Consultancy), the Forum paid fees to 6 healthcare professionals via contracts for copyrighted work, sponsored the organization of technical meetings and symposia to 3 healthcare organizations and contributed for the costs of lectures or technical event organization for 5 organizations.
The total value of transfers of value from the Forum to individual healthcare professionals in 2016 was EUR 6,756.33 and the value of transfers to healthcare organizations amounted to EUR 49,529.50. All transfers were disclosed with the full name of the recipient.
Publicly disclosed data includes transfers of value actually executed in the financial system of the Forum in the 2016 calendar year, from 1 January 2016 to 31 December 2016.
Transfers to individual healthcare workers are listed as gross values of the relevant contracts.
Transfers to healthcare organizations are listed as net amounts of the relevant contracts without VAT.
Transfers of value pertaining to travel expenses, accommodation and registration fees are published in the calendar year in which activities actually took place.

Notes to the table ” Data on transfers of value to healthcare professionals and healthcare organisations from the Forum of international research and development pharmaceutical companies, EIG, for 2016″:
1 Field regulated by Disclosure Code, Article 3.1.1.1
2 Field regulated by Disclosure Code, Article 3.1.1.2 in 3.1.2.1
3 Field regulated by Disclosure Code, Article 3.1.1.3 and Article 3.1.2.2
4 Field regulated by Disclosure Code, Article 3.2
5 Field regulated by Disclosure Code, Article 3.2
6 Field regulated by Disclosure Code, Article 3.4
The “/” mark denotes no transfers of value were performed.
All listed amounts represent total values for 2016.
All listed transactions were performed in the 2016 calendar year, from and including 1 January 2016 to and including 31 December 2016.
Amounts of transfers of value to HCPs in 2016 are listed as gross amounts.
Amounts of transfers of value to HCOs in 2016 are listed as net amounts (not including VAT).
The Disclosure Code defines healthcare organizations (HCO) as:
All single entrepreneurs and any legal person:
The Disclosure Code defines healthcare professionals (HCP) as:
Any natural person that is a member of the medical, dental, pharmacy or nursing professions or any other person who, in the course of his or her professional activities, may prescribe, purchase, supply, recommend or administer a medicinal product and whose primary practice, principal professional address or place of incorporation is in the Republic of Slovenia.
For the avoidance of doubt, the definition of HCP includes:
The Disclosure Code is available in full here.
“,,1521787740,1521787740,en,12406,306,12405,43,0,NULL,,”Javna objava prenosov sredstev ZD in ZO 2016″,javna-objava-prenosov-sredstev-zd-in-zo-2016,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1521788562,1529661077
342,12408,”Temporary: Disclosure of transfers of value to HCPs and HCOs from the company MSD at the web pages of the Forum”,” “,”
The web page www.msd.si of the company Merck Sharp & Dohme, inovativna zdravila d.o.o. (MSD) is inaccessible due to technical difficulties, so disclosures of transfers of value to healthcare professionals and healthcare organizations for the year 2016 is temporarily published at the web page of the FORUM.
MSD will publish data on transfers of value on its web page www.msd.si in accordance with the provisions of the Disclosure Code as soon as possible. At that time, the data will be removed from the FORUM web page.
Thank you for your understanding.


“,,1521788640,1521788640,en,12408,306,12407,43,0,NULL,,”Začasno: Javna objava prenosa sredstev ZD in ZO družbe MSD na spletni strani FORUM-a”,zacasno-javna-objava-prenosa-sredstev-zd-in-zo-druzbe-msd-na-spletni-strani-forum-a,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,0,0,1521788700,1541417880
343,12466,”Important links”,”Quick access to information about medicines and pharmaceutical industry”,”
Agency for Medicinal Products and Medical Devices of the Republic of Slovenia (JAZMP)
European Federation of Pharmaceutical Industries and Associations (EFPIA)
Pharmaceutical Research and Manufacturers of America (PhRMA)
International Federation of Pharamceutical Manufacturers & Associations (IFPMA)
European Medicines Agency (EMA)
Website with important information about vaccination – www.cepljenje.info (in Slovenian only)
“,,1522087560,1522087560,en,12466,306,12305,43,0,NULL,,Povezave,povezave,Post,”/sites/43/files/images/O nas/Povezave/Povezave.jpg”,1,0,1522087649,1579850093
344,12515,”Value of Innovation”,”Healthcare innovations have an important influence on society and individuals. Innovative medicines improve the quality of life and prolong life expectancy. By developing these medicines pharmaceutical industry contributes to society’s prosperity and to economic growth.
Discover why personal and social benefits of innovative medication far surpass their costs.”,”
Innovative medicines improve the quality of life and prolong life expectancy. By developing these medicines pharmaceutical industry contributes to society’s prosperity and to economic growth. Discover why personal and social benefits of innovative medication far surpass their costs.
We have organized the following strategic conferences about the value of innovation:

“,,1513197900,1513197900,en,12515,306,12299,43,0,NULL,,”Vrednost inovacij”,vrednost-inovacij,Post,/sites/43/files/images/Fokus/Human.jpg,1,0,1522393329,1716480094
346,12412,”Regulations and legislation”,”Medicines are strictly regulated in Slovenia”,”
Regulation (EU) on clinical trials on medicinal products for human use
Rules Amending the Rules Determining the Prices of Medicinal Products For Human Use
Rules amending the Rules on advertising of medicinal products
Medicinal Products Act, Official Gazette of RS, no. 17/2014
Rules of Reimbursement, Official Gazette of RS, no. 35/2013
Rules amending the Rules on Advertising of Medicinal Products, Official Gazette of RS, 105/2010
Interchangeability Rules, Official Gazette of RS, no. 102/2010
Medical Devices Act, Official Gazette of RS, no. 98/2009
“,Administrator,1521891000,1521891000,en,12412,306,12304,43,0,NULL,,Predpisi,predpisi,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,1,0,1521891082,1712245727
347,12645,”Rules on determining the prices of medicinal products for human use”,”Official Gazette of RS, 19/2018 “,”

Rules on determining the prices of medicinal products for human use
AGGREGATED DATA
Official Gazette of the Republic of Slovenia, no. 32/2015, 15/2016, 19/2018
Official consolidated text valid on the day: 28 March 2018
Valid from: 24 March 2018
The document can be accessed at the IUS-INFO portal
I. GENERAL PROVISIONS
Article 1
These Regulate:
– The criteria, method and procedure for determining maximum allowed prices and exceptional higher allowed prices of medicinal products for human use that are financed from public funds or earmarked to be financed from public funds (hereinafter: prices of medicinal products);
– The criteria, procedure and method for changing or coordination (hereinafter: coordination) of maximum allowable prices and exceptionally allowed higher prices of medicinal products;
– The mandatory elements of the application for determining of maximum allowable price and exceptionally allowed higher price of a medicinal product;
– The level of marketing at which prices of medicinal products are determined or changed;
– The method for publishing and communicating medicinal product prices;
– The period of validity of maximum allowable price and exceptionally allowed higher price of medicinal products.
Article 2
Beside the definitions and terms set out in Article 6 of the Medicinal Products Act (Official Gazette of RS, no. 17/14; hereinafter: the Act), these Rules also utilise the following terms:
1. Party subject to determination of prices of medicinal products (hereinafter: subject) shall be:
– The holder of marketing authorisation for a medicinal product or its representative;
– The holder of authorisation for import or input of a medicinal product, for the medicinal product that is not authorised for marketing and is classified into the list of essential or indispensable medicinal products pursuant to the Act;
– The holder of temporary marketing authorisation for a medicinal product that is not authorised for marketing and is classified into the list of essential or indispensable medicinal products pursuant to the Act;
– The holder of authorisation for input of a parallel imported medicinal product;
– The holder of certificate of received notification on parallel distribution of medicinal product based on the provisions of Article 118 of the Act.
2. The maximum allowed price of a medicinal product is the price determined pursuant to these Rules and may be used in wholesale.
3. The exceptionally allowed higher price of a medicinal product is the price determined pursuant to these Rules and may be used in wholesale, which is higher than the maximum allowed price of a medicinal product.
4. The comparative price of a medicinal product is established pursuant to:
– Prices of medicinal products in comparative countries, calculated from publicly available data, or
– Prices of medicinal products in other EU member states (hereinafter: EU) and countries signatories of the Agreement on the European Economic Area (hereinafter: EEA).
5. The manufacturer’s element of the wholesale price (hereinafter: PEP) is a structural part of the maximum allowed wholesale price of a medicinal product or exceptionally allowed higher wholesale price that represents administratively recognized costs of the medicinal product manufacturer, calculated from the comparative price of a medicinal product.
6. The marking “CIP buyer” denotes that the wholesale price of a medicinal product includes administratively recognized costs of the manufacturer, transportation and insurance of goods to the end buyer and share for covering the costs of wholesale.
7 Administratively recognized costs of the manufacturer are the costs of manufacturing of medicinal products the Public Agency of the Republic of Slovenia for Medicinal Products and Medical Devices (hereinafter: JAZMP) recognizes pursuant hereto when determining wholesale prices of medicinal products.
8. Market presence of a medicinal product in the Republic of Slovenia means presence of a medicinal product, established pursuant to Article 24 of the Act.
9. Market presence of a medicinal product in comparative countries means the listing of such a medicinal product in publications detailed in Paragraph two of Article 11 hereof.
10. Market presence of a medicinal product in other EU member states and signatories of the EEA Agreement means the listing of such a medicinal product in online resources of bodies competent for pricing and payment of medicinal products from the public funds of such countries.
11. Total annual turnover of a medicinal product in value in all its pharmaceutical forms and strength is the overall annual value of funds from mandatory health insurance and
copayments, including pharmacy services and value added tax in a calendar year.
12. Total annual turnover of a medicinal product in quantity is the overall annual number of packages of a medicinal product in all pharmaceutical forms and strengths marketed in wholesale in a calendar year.
13. Total annual turnover of a medicinal product at the level of manufacturer in terms of value is the overall annual value of sales of a medicinal product in all its pharmaceutical forms and strength in a calendar year in accordance with data reported by the party subject to price determination to the JAZMP pursuant to Article 24 of the Act.
14. An original medicinal product is a medicinal product that has been granted marketing authorisation regardless of the type of procedure in accordance with:
– Article 44 of the Act or paragraph 3 of Article 8 of Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code related to medicinal products for human use (OJ L 311, 28. 11. 2001, p. 67), last amended by 2012/26/EU of the European Parliament and of the Council of 25 October 2012 amending Directive 2001/83/EC as regards pharmacovigilance (OJ L 299, 27.10.2012, p. 1), (hereinafter: Directive 2001/83/EC).
– Article 47 of the Act or Article 10a of Directive 2001/83/EC, if the subject possesses the rights of original manufacturer;
– Article 49 of the Act or Article 10b of Directive 2001/83/EC or
– Article 50 of the Act or Article 10c of Directive 2001/83/EC prior to expiry of data protection.
15. Form in electronic form means the form in an electronic template downloaded from the JAZMP website.
16. Calculative elements of the manufacturing cost of a medicinal product are costs of materials, labor and energy and other operating charges.
Article 3
(1) Notwithstanding the terms defined in Article 6 of the Act, the present Rules also utilise the following terms:
1. A generic medicinal product is a medicinal product that has, regardless of the type of procedure:
a) acquired marketing authorisation pursuant to:
– Article 45 of the Act or Paragraph one of Article 10 of Directive
2001/83/EC or
– Article 52 of the Act or Article 10b of Directive 2001/83/EC or
b) Acquired marketing authorisation pursuant to:
– Paragraph six of Article 45 of the Act or Paragraph three of Article 10 of Directive 2001/83/EC;
– Article 47 of the Act or Article 10a of Directive 2001/83/EC or
– Article 50 of the Act or Article 10c of Directive 2001/83/EC prior to expiry of data protection of the original medicinal product, whereby the subject does not possess evidence on the primary origin of the medicinal product in the sense of the provisions of the above Item hereof.
2. A similar biological medicinal product is a medicinal product that has acquired marketing authorisation pursuant to Paragraph 6 of Article 45 of the Act or Paragraph four of Article 10 of Directive 2001/83/EC and corresponds to the definition under item 58 of Article 6 of the Act.
(2) Terms set out in the above paragraph shall apply mutatis mutandis to medicinal product that are financed by public funds or are intended to be financed by public funds and do not have marketing authorisation in the Republic of Slovenia, but do have:
– Authorization under the third Paragraph of Article 20 of the Act;
– Authorisation for import or input of a medicinal product, for the medicinal product that is not authorised for marketing and is classified into the list of essential or indispensable medicinal products pursuant to the Act;
– Marketing authorisation for parallel imported medicinal product; or
– Certificate of received notification on parallel distribution of medicinal product based on the provisions of Article 118 of the Act.
Article 4
These rules set out the wholesale prices of medicinal product without VAT CIP buyer.
II. DETERMINATION OF MAXIMUM ALLOWED AND EXCEPTIONALLY ALLOWED HIGHER PRICES OF MEDICINAL PRODUCTS
Article 5
(1) Maximum allowed prices of medicinal products are determined on the basis of:
1. Comparison of prices in comparative countries;
2. Comparison of prices in other EU member countries and countries signatories of the EEA Agreement, if the medicinal product is not marketed in comparative countries or
3. Comparison of prices in other European countries, if the medicinal product is not marketed in countries listed in Items 1 and 2 above.
(2) Exceptionally allowed higher prices of medicinal products are determined on the basis of criteria, procedures and method detailed herein.
Article 6
(1) The effective date of the highest allowed price of a medicinal product shall be set out by a decision and shall not exceed 90 days from reception of complete application. If a decision is not issued in the above period, the effective date for the prices shall be a day after expiry of said period.
The effective date of the exceptionally allowed higher price of a medicinal product shall be set out by a decision. If a decision on the proposed exceptionally allowed higher price of a medicinal product is not issued within 90 days of reception of a complete application or within an extended 60 day period, the effective date for such a price shall be a day after expiry of the above periods.
(3) When JAZMP foresees a 60 day extension of the deadline due to an excessive number of applications, it shall issue a decision on extension prior to expiry of the 90 day deadline referenced above.
(4) If the decision detailed in Paragraphs one or two above is not issued within the deadlines set out herein, the medicinal product may be marketed at the proposed price until a new decision is issued on the basis of the application submitted within the deadlines set out in Paragraph one of Article 23 hereof.
Article 7
(1) A maximum allowable price of a medicinal product shall remain in force until a new maximum allowable price for the same medicinal product has been established.
(2) Notwithstanding the former paragraph, the maximum allowed price of medicinal product shall cease to apply on the 30th day from the date of deadline for submission of applications in accordance with first paragraph of Article 23 hereof, provided the applicant does not submit an application in the above deadline.
(3) The determined exceptionally allowed higher price of medicinal product shall remain in force for a maximum duration of one year.
Article 8
(1) If marketing authorisation for a medicinal product is transferred onto another subject, the previously determined price shall continue to apply to the medicinal product and a new application for determination of a maximum allowable price or extraordinary allowed higher price is not necessary if price is to remain as is.
(2) The party subject to price determination shall submit to JAZMP all the data pertaining to the transfer of authorisation within fifteen days of receiving a decision on said transfer.
1. Criteria, procedure and method for determination of maximum allowed prices of medicinal products.
Article 9
(1) Subjects shall submit an application to JAZMP for the determination of prices in written and electronic form for medicinal products detailed in Paragraph one of Article 158 of the Act that are financed from public funds or intended for financing from public funds.
(2) The application referenced above shall consist of a filled out B1 form, enclosed as Appendix 1 hereto, in electronic pdf and xls form. The application shall be supplemented by documentation evidencing the data listed on the application.
(3) The party subject to price determination, which is a public institution established in the Republic of Slovenia, and:
– Is not a manufacturer, shall also provide JAZMP with documentation showing the sales price of the manufacturer at which said public institution established in the Republic of Slovenia is purchasing the medicinal product;
– Is the manufacturer of the medicinal product, either partially or in full, shall also provide JAZMP with specifications and sums of calculated elements of the production price of the medicinal product.
Article 10
Maximum allowed prices of medicinal products shall be determined on the basis of calculated PEP values, which shall not exceed the maximum allowed PEP value and an added share or fixed amount to cover the costs of wholesale (hereinafter: wholesale margin), in accordance with the calculation of the wholesale price of the medicinal product from Appendix 3, which is a constituent part of these Rules.
Article 11
(1) The PEP value shall be calculated based on the comparative price of medicinal products.
(2) Comparative prices of medicinal products shall be calculated on the basis of prices of medicinal products financed from public funds in comparative countries Austria, France and Germany (hereinafter: comparative countries). Determination of the PEP value shall be made on the basis of latest issues of printed or electronic publications or appropriate online resources listing comparative prices of medicinal products and date of data capture:
– Austria: Erstattungskodex, issued by Hauptverband der osterreichischen Sozialversicherungstrager (publication or online resource), calculation from retail price of medicinal product;
– France: Vidal, issued by Vidal France (direct online resource or resource licensed from issuer), calculation from retail price of medicinal product or application of the UCD standard in cases where the retail price is not set and the medicinal product is exclusively or predominantly used within the scope of services of persons performing healthcare activities at a secondary or tertiary level;
– Germany: Lauer‑Taxe, issued by Lauer-Fischer GmbH (electronic publication or online resource); or price list ABDA Datenbank, issued by Bundesvereinigung Deutscher Apothekerverbande (electronic publication or online resource); calculation from wholesale price of medicinal product, taking into account the lowest wholesale price applicable to public financing of medicinal product.
(3) Notwithstanding the previous paragraph, data on medicinal products in the comparative country of Austria, which are not listed in the Ersattungskodex publication, shall be gained from the Warenverzeichnis publication, issued by Osterreichische Apotheker-Verlagsgesellschaft m.b.H. (online resource), calculation from retail price of medicinal product, financed from public resources, without VAT.
(4) Prices from publications of comparative countries shall be calculated for each comparative country in the following manner:
– Prices for Germany shall be recalculated using Equation 1 which is enclosed in Appendix 2 hereof;
– Prices for France shall be recalculated using Equation 2 and Table 1 which are enclosed in Appendix 2 hereof;
– Prices for Austria shall be recalculated using Table 2 which is enclosed in Appendix 2 hereof.
(5) Notwithstanding the above paragraph, in cases of medicinal products that are in comparative countries sold directly to healthcare service providers, thus bypassing wholesalers, subjects shall utilise prices listed in relevant publications as comparative prices.
(6) In cases of circumstances detailed in the above paragraph, subjects shall provide:
– A statement of the existence of such a method of sale of medicinal products;
– Recalculation of price pursuant to these Rules, taking into account the actual wholesale price and substantiation for each of these countries; and
– Evidence of actual wholesale price which, if it is in the form of a payment document, shall not be older than three months.
Article 12
(1) PEP value of original medicinal products shall be determined on the basis of the comparative price of a medicinal product, which is the lowest calculated price of an original medicinal product in any of the comparative countries. If the medicinal product is marketed in only one or two comparative countries, only recalculated prices from such countries shall be considered. The PEP value of an original medicinal product may not exceed 100 percent of the comparative price.
(2) PEP value of generic medicinal products shall be determined on the basis of generic medicinal products in comparative countries in the following manner:
– If a generic medicinal product is marketed in all comparative countries, the comparative price of the medicinal product shall be the average of median values of recalculated prices in these countries. The median value of recalculated prices in each comparative country is the arithmetic mean of the highest and lowest recalculated price. If only one generic medicinal product is marketed in a country, only the recalculated price of that medicinal product shall be considered. The PEP value of a generic medicinal product shall not exceed 72 percent of the comparative price;
– If a generic medicinal product is marketed in two comparative countries, the comparative price of a medicinal product shall be the average of median values of recalculated prices in these two comparative countries. The median value of recalculated prices in each country is the arithmetic mean of the highest and lowest recalculated price. If only one generic medicinal product is marketed in a country, only the price of that medicinal product shall be considered. The PEP value of a generic medicinal product shall not exceed 72 percent of the comparative price;
– If the generic medicinal product is marketed in only one comparative country or there is no generic medicinal product marketed in comparative countries, the PEP value of a generic medicinal product shall not exceed 68 percent of the comparative price of the original medicinal product detailed in the above paragraph;
– If a generic medicinal product is marketed in only one comparative country and there is no original medicinal product marketed in said country, the comparative price of a medicinal product shall be the average of the highest and lowest recalculated price in said country. If only one generic medicinal product is marketed in a country, only the price of that medicinal product shall be considered. The PEP value of a generic medicinal product shall not exceed 72 percent of the comparative price.
(3) PEP value of a similar biological medicinal product shall be determined on the basis of the comparative price of such a medicinal product, which is, when:
– The same biological medicinal product is marketed in comparative countries, the lowest recalculated price of the same medicinal product in any of the comparative countries. If the medicinal product is marketed in only one or two comparative countries, only recalculated prices from such countries shall be considered. The PEP value of a similar biological medicinal product shall not exceed 92 percent of the comparative price;
– The same similar biological medicinal product is not marketed in comparative countries, equal to the median of manufacturer’s prices for the similar biological medicinal product in all other EU member countries and countries signatories of the EEA Agreement in which the medicinal product is marketed according to data of the subject. If the number of such countries is even, the comparative price of a medicinal product shall be established as the median value of manufacturer’s prices in two countries in the middle of the price range. The PEP value of a similar biological medicinal product shall not exceed 92 percent of the comparative price.
– The same similar biological medicinal product is not marketed in comparative countries, other EU member countries or countries signatories of the EEA Agreement, the comparative price of such a medicinal product shall be established as the comparative price of the reference biological medicinal product the medicinal product in question is similar to. The PEP value of a similar biological medicinal product shall not exceed 68 percent of the comparative price. If there are differences in the effectiveness of the medicinal product, data on differences in medicinal product effectiveness listed in the European public assessment reports (EPAR) or documents of bodies competent for assessment of healthcare technologies in EU member states shall also be considered and calculated using the following equation:
PEP (BSM) = PEP (RBM)*0.68* (share of BSM efficiency according to EPAR),
whereby the following elements shall have the following meanings:
PEP (SBMP) – PEP of similar biological medicinal product
PEP (RBM) – PEP of reference biological medicinal product.
Article 13
(1) In case of a varying number of dosages per package, comparable packagings in terms of the number of units shall be considered separately for each comparative state. The comparative price of a medicinal product shall then be recalculated to the number of dosage units of the medicinal product of the Person subject to price determination.
(2) The comparative price of medicinal products shall be established separately for each comparative state for each separate pharmaceutical form. If no comparable pharmaceutical form is present in comparative countries, a similar pharmaceutical form may be used for comparison (eg. tablets and lozenges), whereby pharmaceutical forms with controlled release of active substances cannot be compared to pharmaceutical forms with rapid release.
(3) The comparative price of medicinal products shall be established separately for each strength.
If the strength in question is not present in any comparative country, a reasonable recalculation of prices of other strengths shall be used.
Article 14
The PEP value of parallel imported or parallel distributed medicinal product shall be determined by comparing the calculated prices of the medicinal product to the authorisation of which the authorisation holder for parallel import of medicinal products or holder of the certificate pursuant to Paragraph three of Article 118 of the Act, whereby the comparative price of a parallel imported or parallel distributed medicinal product shall equal the calculated price of the medicinal product to which the reference is made. The PEP value may not exceed 100 percent of the comparative price.
Article 15
(1) Notwithstanding the provision of the second paragraph of Article 9 hereof, the application, in case there is no generic or original medicinal product in the comparative country, shall contain the following components:
– Substantiated proposal for the maximum allowed wholesale price of the medicinal product;
– Data on the previously applicable wholesale price of the medicinal product or the maximum allowed wholesale price of medicinal product and its structure (the share covering production costs, including those arising from the requirements of the competent bodies based on the provisions regulating medicinal products, prices of medicinal products, coverage from health insurance and wholesale costs), if it was determined;
– Data on producer prices and wholesale prices of medicinal products without value added tax CIP buyer in other EU Member States or in the signatories of the EEA Agreement or, if the medicinal product is not present on the market of these countries, adequate data for other European countries in which the medicinal product is present on the market, according to the subject’s data, indicating the source on the form B3 from Annex 1 hereof in the electronic form in pdf and xls format;
– Data on the financing of a medicinal product from public sources in other EU Member States or signatories of the EEA Agreement in which the medicinal product is present on the market, to the best knowledge of the subject;
– Evidence on data in the application.
(2) The PEP value is determined as the median of producer prices based on the subject’s data in other EU Member States or signatories of the EEA Agreement in which the medicinal product is marketed, to the best knowledge of the subject, and financed from public funds. If the medicinal product is not present on the markets of the EU Member states and the signatories of the EEA Agreement, the PEP value is determined as the median of producer prices in other European countries in which the medicinal product is present on the market.
(3) The maximum allowed price of the medicinal product shall equal the PEP value referred to in the previous paragraph hereunder topped by the maximum wholesale margin, in accordance with the table in Annex 3 which is attached hereto as a constituent part.
Rules on determining the prices of medicinal products for human use
2. Criteria and elements for determining exceptionally allowed higher prices of medicinal products. Article 16
(1) The subject may submit an application for the determination of an exceptional higher allowed price of a medicinal product in the following cases:
– The maximum allowed price has been determined for a medicinal product or the subject has simultaneously submitted to JAZMP an application for the determination of both the maximum allowed price and the exceptional higher allowed price of the medicinal product;
– There is no medicinal product on the market of the Republic of Slovenia with the same active substance, pharmaceutical form and strength whose valid price was lower than the proposed exceptionally allowed higher price of medicinal product;
– There is no medicinal product on the market of the Republic of Slovenia with the same therapeutic indication and the same pharmacological mechanism, whose valid price was lower than the proposed exceptionally allowed higher price of medicinal product; and
– The value of the total annual turnover of the medicinal product in all its pharmaceutical forms and strengths, taking into account their price, valid on the day of application, does not exceed 400,000 Euros for the previous calendar year or the value of the total annual turnover does not exceed 100,000 Euros for the previous calendar year, provided that the value of the total annual turnover for the previous calendar year did not exceed the growth index of 150 at the annual level.
(2) Notwithstanding the provision of the fourth indent of the preceding paragraph, the subject may submit an application for the determination of the exceptional higher allowed price if the total annual turnover of the medicinal product exceeded 400,000 Euro in the last calendar year and when there is no adequate substitute medicinal product on the market.
(3) The application for determination of exceptionally allowed higher price shall be submitted to JAZMP in two hard copies and in electronic form.
(4) The application for the determination of the exceptional higher allowed price for the medicinal products not listed as essential or indispensable as referred to in Article 17 of the Act shall include:
– The grounds supporting the claim that the maximum allowed price pursuant to the criteria set out by this Rules does not allow the subject to ensure market supply in the Republic of Slovenia, including data on actual costs that additionally encumber the medicinal product and are the basis for the request to allow an exceptional higher allowed price;
– Informative calculation of the maximum allowed wholesale price of the medicinal product based on criteria specified herein; on Form B1 from Annex 1 hereof in .pdf and .xls formats;
– A calculation of the proposed exceptionally allowed higher allowed price of the medicinal product, provided on form B2 from Attachment 1 hereof in pdf and xls formats;
– Data on the volume of sales of all pharmaceutical forms, strengths and packagings of this medicinal product in the Republic of Slovenia for the period of the last three years since the submission of the application, stating the anticipated volume of sales for the medicinal products that have been on the market for a period shorter than the required one, or that are only coming on the market;
– Data on producer prices and wholesale prices for the same medicinal product financed from public funds and data on quantity turnover for the same medicinal product in other EU Member States or the signatories to the EEA Agreement in which, according to the subject’s information, the medicinal product is marketed, indicating the source, or data on the medicinal products not marketed in the EU Member States or the signatories of the EEA Agreement for other European countries where the medicinal product is marketed, provided on form B3 from Attachment 1 hereof in xls format;
– Analysis of influence on public funds for medicinal products for which more than 10 years have passed since the addition of the last therapeutic indication into the marketing authorisation in EU member countries or countries signatories of the EEA Agreement, and pharmacoeconomic analysis for other medicinal products, both of which shall be prepared on the basis of data for the Republic of Slovenia or data from other EU member countries or countries signatories of the EEA Agreement which is duly translated using correct methodology and information relevant to the Republic of Slovenia;
– Assessment of the relative therapeutic value of the medicinal product or appropriate pharmacoepidemiological data including relevant data for the Republic of Slovenia.
(5) For the medicinal products with a retail turnover of all pharmaceutical forms, strengths and package sizes on the market in the Republic of Slovenia not exceeding 50,000 Euro at the annual level in the previous calendar year, no analyses or data referred to in the sixth and seventh indents of the preceding paragraph need to be submitted with the application.
(6) For medicinal products without marketing authorisation but with authorisation for import or entry or temporary marketing authorisation, which are included in the list of essential and indispensable medicinal products stipulated by Article 17 of the Act, no data from the fifth, sixth and the seventh indent of the previous paragraph need to be attached to the application.
Article 17
Upon deciding on the exceptionally allowed higher price of a medicinal product, JAZMP shall consider the following:
– Opinion of the Committee under indent four of Paragraph five of Article 4 of the Act (hereinafter: the Committee);
– Established public interest in the field of healthcare;
– Established assessment of risk arising from any disturbances in the supply of the relevant medicinal product with an economic substantiation, or evidenced, unavoidable and disproportionate costs arising from fulfilment of public service obligations.
Article 18
(1) In its opinion, based on the data contained in a complete application, data on the medicinal product and other information that shows the state of professional and scientific development, JAZMP states its opinions on:
– The significance of the medicinal product within national healthcare priorities,
Rules on determining the prices of medicinal products for human use
taking into account its urgency, importance and irreplaceability;
– The risk to public health that may arise from a disrupted supply of the medicinal product, including the economic aspect;
– Impact on public finance because of approved extraordinary allowed higher price of medicinal product.
(2) The Committee evaluates the data submitted in a complete application based on these Rules and issues an opinion that comprises of its findings in the form of points, whereby the following criteria are considered:
1. Relative therapeutic value, which means added effectiveness through the improvement of health outcomes (assessed with a grade ranging from 1 to 5 points, indicating to what extend does the Committee agree with the merits of the request for the determination of an exceptional higher allowed price for the medicinal product);
2. Cost efficiency of the medicinal product or presence of appropriate financial and economic merits in comparison to other possible treatments (assessed with a grade ranging from 1 to 5 points, indicating to what extend does the Committee agree with the merits of the request for the determination of an exceptional higher allowed price for the medicinal product);
3. Balance between the proposed exceptional higher allowed price for the medicinal product and the prices of the relevant medicinal product in other EU Member States or the states signatories to the EEA Agreement, taking into consideration the key characteristics of the compared markets, namely:
– 5 points – proposal more than 10 percent below median price of medicinal product on comparative markets;
– 4 points – proposal between 5 and 10 percent below the median price of the medicinal product on the compared markets;
– 3 points – proposal between 0 and 5 percent below median price of medicinal product on comparative markets;
– 2 points – within 5 percent over median price of medicinal products on comparative markets;
– 1 point – more than 5 percent over the median price of the medicinal product on the compared markets;
4. Existence of specific factors relevant for the placement of the medicinal product in question in national healthcare programs in accordance with given priorities and ethical aspects (assessed as the rate of Committee agreement with the substantiation of the request for determining an exceptionally allowed higher medicinal product price, between 1 and 5 points).
(3) When assessing applications for medicinal products without marketing authorisation, which do have authorisation for entry or import of medicinal products or temporary marketing authorisation and are placed on the list of essential or indispensable medicinal products referenced in Article 17 of the Act, the Committee shall consider criteria detailed in Items one and four of the previous paragraph.
Article 19
(1) In its opinion, the Committee states its views on the items detailed above and the proposed amount of the extraordinary allowed higher price of a medicinal product in one of the following manners:
1. By a positive opinion the Committee proposes the exceptionally allowed higher price of medicinal product as proposed in the application if the points detailed in Paragraph 2 of the above Article amount to 18 or more for medicinal products with due marketing authorisation or authorisation for a parallel imported medicinal product and 10 or more for medicinal products with no marketing authorisation, but do have authorisation for entry or import or temporary marketing authorisation and are placed on the list referenced in Article 17 of the Act, or
2. By a positive opinion the Committee proposes the exceptionally allowed higher price of medicinal product which is lower than that proposed in the application, in the amount calculated by the equation:
PEP(DPEHAP) = PEP(MAP) + DT/MT * (PEP(PPEHAP)-PEP(MAP)) *
(min(PEP(median(ER)) / PEP(PPEHAP); (PEP(PPEHAP) – PEP(MAP)) /
max(PEP(median(ER)); PEP(MAP))),
whereby the following elements shall have the following meanings:
PEP(DEAHP) – determined PEP of extraordinary allowed higher price
PEP(PEAHP) – proposed PEP of extraordinary allowed higher price
PEP(MAP) – PEP of maximum allowed price
DT – achieved points
MT – possible points
PEP(median(ER)) – median of producer prices in the EU Member States or countries signatories of the EEA Agreement, where the medicinal product is marketed, namely:
– If data from only two states is available, the arithmetic mean of the prices in these two countries shall be used;
– If data from only one country is available, data from this country shall be used;
– If this country is the Republic of Slovenia, the maximum allowed price shall be used.
3. The Committee gives a positive opinion and proposes that the exceptional higher allowed price for the medicinal product be set in the amount determined and substantiated by the Committee, whereby the results of the assessments referred to in paragraph two of the preceding Article are also considered proportionately;
4. By a negative opinion the Committee proposes that an exceptionally allowed higher price not be set for the relevant medicinal product.
(2) If the Committee issues a negative opinion, such opinion must be substantiated, stating the definitions referred to in paragraph one of the preceding Article and the number of the points achieved in the evaluation of data provided in the application referred to in paragraph two of the preceding Article.
Article 20
(1) JAZMP identifies the public interest in the field of health, considering the presence of the medicinal product on the market in the context of national health priorities and taking into account the data on the medicinal product, its use, costs of treatment in comparison with the costs of treatment with the medicinal products for the same indication area within the same therapeutic group of medicinal products and in the field of the relevant pharmacotherapy, obtained on the basis of the protocols on data exchange between the Institute of Public Health of the Republic of Slovenia (hereinafter: NIJZ) and Health Insurance Institute of Slovenia (hereinafter: HEALTH INSURANCE INSTITUTE OF SLOVENIA).
(2) JAZMP may in the process of establishing public interest also obtain a second opinion on the presence of public interest in the medicinal product concerned in the scope of health care programmes financed from the regional expanded expert committee or a clinical department or three statements of specialists practicing medicine in the area of relevant pharmacotherapy.
Article 21
Prior to deciding on the maximum allowed price for a medicinal product and the exceptional higher allowed price for a medicinal product, JAZMP may request from ZZZS the data on the impact of the proposed price on public expenditure at the level of individual medicinal products, groups and the entire field of the relevant pharmacotherapy.
III. COORDINATING THE MAXIMUM ALLOWED PRICES OF MEDICINAL PRODUCTS AND EXCEPTIONALLY ALLOWED HIGHER PRICES OF MEDICINAL PRODUCTS
Article 22
The maximum allowed prices of medicinal products are coordinated with the provisions of these Rules twice annually
Article 23
(1) For purposes of coordination, the subjects shall establish the maximum allowed prices of medicinal products in accordance with the criteria specified herein and submit an application for coordination of maximum allowed prices to the JAZMP, in the period:
– 1 March to 1 April of the current year; and
– 1 September to 1 October of the current year, including.
(2) Application for coordination of maximum allowed prices shall contain a request for determination of coordinated maximum allowed price of a medicinal product, list of products and proposed maximum allowed prices of medicinal products with calculation given on Form B1 from Annex 1, in written and electronic form.
(3) The following issues of the prescribed publications shall be used in the application for coordination of maximum allowed prices of medicinal products:
1. In the period referred to in the first indent of the first paragraph hereunder:
– Austria: Erstattungskodex: The issue of 1 January of the current year or Warenverzeichnis: data from a web source with the date of acquisition in February of the current year;
– France: Vidal, date of acquisition in February of the current year;
– Germany: Lauer-Taxe or ABDA Datenbank: issued on 15 February of the current year;
2. In the period referred to in the second indent of the first paragraph hereunder:
– Austria: Erstattungskodex: The issue of 1 January of the current year and amendment of 1 July of the current year, or Warenverzeichnis: data from a web source with the date of acquisition in August of the current year;
– France: Vidal, date of acquisition in August of the current year;
– Germany: Lauer-Taxe or ABDA Datenbank: issued on 15 August of the current year.
(4) The maximum allowed prices of medicinal products shall be coordinated in the manner specified hereunder also in the period when the marketing authorisation for a medicinal product has already expired and the medicinal product can be marketed, pursuant to the Act, until its expiry date but not longer than 18 months.
(5) JAZMP may reduce the exceptionally allowed higher prices and maximum allowed prices of medicinal products prior to the expiry of their validity on the basis of an application submitted by the subject in written or electronic form in pdf and xls format, in which the following shall be listed:
– Proposed reduced maximum allowed price of medicinal product on Form B1 or proposed reduced exceptionally allowed higher price on Form B2 from Annex 1 hereof and
– Date of enforcement of the proposed reduced price.
IV. PUBLISHING AND FORWARDING OF PRICES;
Article 24
(1) The JAZMP shall at least once a month publish the maximum allowed prices of medicinal products and extraordinary allowed higher prices of medicinal products which it has determined in accordance herewith on its website by specifying the following:
– National identifier of medicinal products;
– Name and presentation of the medicinal product;
– General name of the medicinal product;
– Classification marking of the medicinal product;
– Name of the subject;
– Maximum allowed price of a medicinal product or exceptionally allowed price of a medicinal product;
– Date of entry into force of the price of the medicinal product;
– Medicinal product dispensing regime;
– Medicinal product status (original, generic or biosimilar);
– Other relevant data.
(2) Notwithstanding the first paragraph, the maximum allowed price shall not be published without the subject’s consent in the case of the first Paragraph of Article 16 hereof and when the exceptionally allowed higher price of medicinal product had not been determined.
(3) JAZMP shall once a year report to the European Commission the applicable maximum allowed prices and extraordinary allowed higher prices of the medicinal products.
(4) At least once a month, JAZMP shall submit to the Institute, the ministry responsible for health (hereinafter: the Ministry) and the IVZ the maximum allowed prices of medicinal products and extraordinary allowed higher prices of medicinal products together with PEP values and percentages of comparative price in the electronic form.
(5) JAZMP shall submit data on medicinal products under Paragraph two of Article 7 to ZZZS until 25 April or 25 October of the current year.
(6) ZZZS shall submit wholesale prices, agreed on the basis of the first paragraph of Article 159 of the Act and dates of entry into force to JAZMP and the Ministry at their request.
(7) NIJZ shall provide JAZMP, the Ministry and ZZZS with data on the use of medicinal products and their costs at least once annually.
(8) JAZMP shall provide the Ministry with data acquired from the public body established in the Republic of Slovenia pursuant to Paragraph three of Article 9 hereof, within 30 days of receiving such information or upon each coordination of the maximum allowed price of a medicinal product, the subject of which is a public body established in the Republic of Slovenia.
Article 25
The subjects shall notify maximum allowed prices and exceptionally allowed higher prices of the medicinal products devised in accordance herewith to business entities with authorisation for wholesale trade in medicinal products or authorisation for production of medicinal products and concluded agreements on cooperation with them, immediately or not later than within eight days after determining the maximum allowed prices and exceptionally allowed higher prices of the medicinal products and at least three business days prior to their first use on the market.
V. TRANSITIONAL AND FINAL PROVISIONS
Article 26
Applications received until the day of enforcement hereof, for which no price had been determined, shall be subject to the present Rules.
Article 27
Rules on the determination of prices of medicinal products for human use (Official Gazette of the Republic of Slovenia, nos 102/10, 6/12, 16/13 and 71/13) shall cease to apply on the date the present Rules enter into force.
Article 28
These Rules shall enter into force on the next day after their publication in the Official Gazette of the Republic of Slovenia.
“,”Jaka Verbic Miklic”,1523610000,1523610000,en,12645,306,12644,43,0,NULL,,”Pravilnik o določanju cen zdravil za uporabo v humani medicini, UL št. 19/2018, 23. 3. 2018″,pravilnik-o-dolocanju-cen-zdravil-za-uporabo-v-humani-medicini-ul-st-19-2018-23-3-2018,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,1,0,1523610491,1524642787
348,12435,”Rules on the pharmacovigilance of medicinal products for human use”,”Official Gazette of RS, 57/2014″,”
Pursuant to item 39 of Article 6, Article 137, paragraph four of Article 138 and paragraph two of Article 140 of the Medicinal Products Act (Official Gazette of RS, no. 17/14), the Minister of Health hereby issues the following
RULES
on the pharmacovigilance of medicinal products for human use
I. GENERAL PROVISIONS
Article 1
(Scope of application)
(1) Pursuant to Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code related to medicinal products for human use (OJ L 311, 28. 11. 2001, p. 67), last amended by 2012/26/EU of the European Parliament and of the Council of 25 October 2012 amending Directive 2001/83/EC as regards pharmacovigilance (OJ L 299, 27.10.2012, p. 1), (hereinafter: Directive 2001/83/EC) and Implementing Regulation (EU) no. 520/2012 of 19 June 2012 on the performance of activities in the field of pharmacovigilance, set out by Directive (EC) no. 726/2004 of the European Parliament and Council and Directive 2001/83/EC of the European Parliament (OJ L no. 159 of 20 June 2012, p. 5; hereinafter: Directive 520/2012/EC) regulating the pharmacovigilance system in the field of medicinal products for human use (hereinafter: medicinal products), as follows:
– method of reporting on adverse reactions to medicinal products;
– method of collecting and evaluating of adverse reactions to medicinal products and other data regarding pharmacovigilance of the medicinal product;
– measures to be taken with the aim of managing and reducing the risks associated with medicinal products;
– obligations of the marketing authorization holder and the temporary marketing authorisation holder (hereinafter: marketing authorization holder), wholesale marketing authorization holder, manufacturer with authorization for importing medicinal products, holder of authorization for marketing parallel imported medicinal products, holder of parallel distribution certificate and holder of authorization for compassionate use;
– tasks of the national pharmacovigilance center;
– tasks of the Public Agency for Medicinal Products and Medicinal Devices (hereinafter: Agency) in pharmacovigilance;
– detailed conditions for obtaining consent to the draft protocol for non-interventional clinical trials of a medicinal product according to Article 138 of the Medicinal Products Act (Official Gazette of RS, no. 17/14; hereinafter: non-interventional trial of safety of a medicinal product).
(2) Pharmacovigilance of advanced therapy medicinal product prepared on a non-routine basis shall be governed by Article 82 of the Act.
Article 2
(More detailed instructions)
More detailed instructions for the marketing authorization holder and the Agency on the management of the pharmacovigilance system are set out in guidelines on good practices in the field of pharmacovigilance, published on the website of the European Medicines Agency
http://www.ema.europa.eu/ ema/index.jsp?curl= pages/ regulation/ document_listing/ document_listing_000345.jsp &mid= WC0b01ac058058f32c.
Article 3
(Definition of terms)
In addition to the terms delineated in Articles 5 and 6 of the Act, the following expressions shall also be used in these Rules and shall have the following meaning:
1. Assessment of the report on adverse effect of a medicinal product means a review of the report in terms of its compliance with the requirements pursuant to paragraph one of Article 5 hereof, establishment of severity, expectedness and causal relation of the suspect adverse effect with the medicinal product in question. It also includes an initial assessment of the report, acquisition of data required for the assessment, if the report does not contain sufficient data, further monitoring of information on suspect adverse effects of the medicinal product and keeping of detailed documentation.
2. Pharmacovigilance Risk Assessment Committee (PRAC) is the expert body with the European Medicines Agency (hereinafter: EMA), competent for assessment and monitoring of the risk of medicinal products for human use and consists of representatives of EU member states (hereinafter: EU), individually appointed experts, representatives of associations of healthcare workers and patient organisations.
3. Committee for Medicinal Products for Human Use (CHMP) is the EMA expert body competent of assessing medicinal products for human use and consists of representatives of EU member and individually appointed experts.
4. Reporting party is the persons that reports on supposed adverse reactions to a medicinal product.
5. A regularly updated report on the safety of a medicinal product is an intermittent report submitted at predetermined times or at the request of the Agency by the marketing authorisation holder. The report contains predetermined information on medicinal product safety and a risk-benefit assessment.
6. Severe supposed adverse reactions of medicinal products shall include adverse reactions that cause another medically relevant clinical state.
7. The List of European Union Reference Dates and frequency of submission of Periodic safety update reports (hereinafter: List of reference dates of the EU is the list prepared pursuant to paragraph seven of Article 107c of Directive 2001/83/EC by the EMA at the European medicinal products portal, established pursuant to Article 26 of Directive (EC) no. 726/2004/EC of the European Parliament and of the Council of 31 March 2004 laying down Community procedures for the authorisation and supervision of medicinal products for human and veterinary use and establishing a European Medicines Agency (OJ L 136, 30. 4. 2004, p. 1), last amended by Regulation No 1027/2012 of the European Parliament and of the Council of 25 October 2012 amending the Regulation No 726/2004/EC regarding pharmacovigilance (Official Journal L 316 of 14.11.2012, p. 38), (hereinafter: Regulation 726/2004/EC).
8. Coordination Group is a group that works on behalf of bodies responsible for medicinal products within the Member States of the EU. It studies matters related to acquisition and maintenance of marketing authorizations by the mutual recognition or decentralised procedure and pharmacovigilance of medicinal products.
9. Safety signal is information gathered from one or more sources, including monitoring and experimentation, that shows a possible new causal relationship or another aspect of a known causal relationship between exposure to a medicinal product or series of interconnected events, adverse or beneficial, that is deemed probable enough to warrant examination.
10. Scientific assessment of a report on supposed adverse reaction to a medicinal product is the consideration of the report following assessment for possible influence on the risk benefit ratio, taking into account other pharmacovigilance data and clinical benefits of the medicinal product.
II. TASKS OF HEALTHCARE PROFESSIONALS
Article 4
(Reporting on supposed adverse reactions to medicinal products)
(1) A healthcare professional shall report to the national pharmacovigilance centre about the following adverse reactions to medicinal products in accordance with the first and second paragraph of Article 129 of the Act.
(2) Healthcare professionals shall also report:
– when the use of a medicinal product caused or is suspected to have caused a harmful interaction with another medicinal product;
– any suspicion of an increase of frequency of the occurrence of supposed adverse reaction of a medicinal product;
– any suspicion of inefficiency of a medicinal product, the consequences of which are assessed as clinically relevant.
(3) A healthcare professional shall report supposed adverse reactions to the national pharmacovigilance centre under paragraphs one and two hereof immediately and no later than within 15 days of the day of establishment.
(4) If the healthcare professional reports supposed adverse reactions, pertaining to the use of a vaccine, to the institution which is in accordance with the rules on databases in the field of healthcare responsible for keeping a register of adverse reactions to vaccination, the institution shall submit such a report to the national pharmacovigilance centre. Supposed severe adverse reactions shall be reported immediately and not later than within seven days, while less severe supposed adverse reactions shall be reported immediately or no later than within 15 days of receiving notification of alleged adverse reaction.
(5) The Agency shall submit reports on supposed adverse reactions of vaccinations it received directly to the institution which is in accordance with the rules on databases in the field of healthcare responsible for keeping a register of adverse reactions to vaccination.
(6) Reports on supposed adverse reactions to medicinal products shall be submitted in the manner published on the Agency’s website: http://www.jazmp.si.
Article 5
(Form and content of a report on adverse reactions)
(1) Reports suspected adverse reaction to a medicinal product shall contain at least the following information:
– data on the relevant medicinal product (name, pharmaceutical form, strength, indications for which it was prescribed, application method, duration of therapy);
– description of the adverse reaction to the medicinal product;
– data on the reporter;
– encoded data on the patient (initials and/or age and/or date of birth, gender);
– medicinal product batch number, of the report relates to a biological medicinal product.
(2) The reporting party shall assure any eventual additional data required to assess the supposed adverse reaction to the medicinal product, if so requested by the Agency or the national pharmacovigilance center.
Article 6
(Data confidentiality)
(1) Personal data from the Article above shall be deemed confidential and may only be used for the performance of the Act, these Rules and measures necessary for assuring safety and effectiveness of medicinal products.
(2) Reports on supposed adverse reactions to the medicinal product in accordance with paragraphs one and two of Article 4 hereof shall be treated as a confidential document, which shall not serve as basis for any assessment of liability of the healthcare professional who prescribed or dispensed the medicinal product.
III. TASKS OF THE WHOLESALE MARKETING AUTHORIZATION HOLDER, MANUFACTURER WITH AUTHORIZATION FOR IMPORTING MEDICINAL PRODUCTS, HOLDER OF AUTHORIZATION FOR MARKETING PARALLEL IMPORTED MEDICINAL PRODUCTS, HOLDER OF PARALLEL DISTRIBUTION CERTIFICATE AND HOLDER OF AUTHORIZATION FOR COMPASSIONATE USE
Article 7
(Reporting on supposed adverse reactions to medicinal products)
(1) A wholesale marketing authorisation holder, a manufacturer with import authorization, holder of marketing authorisation for parallel imported medicinal product, holder of parallel distribution certificate and holder of authorization for compassionate use shall report any supposed adverse reactions to medicinal products referenced in paragraphs one and two of Article 4 hereof to the national pharmacovigilance center fortwith, and no later than in 15 days of receiving the report on supposed adverse reaction to the medicinal product.
(2) Reports on supposed adverse reactions to medicinal products shall be submitted in one of the possible methods published on the Agency’s website: http://www.jazmp.si.
(3) The business subject referenced in paragraph one of this Article shall inform the national pharmacovigilance center and the Agency within 24 hours of receiving information that warrants emergency measures due to a direct threat to public health.
Article 8
(Publishing of information on pharmacovigilance related issues)
The business subject in the first paragraph of the previous Article shall reasonably observe the provisions of Article 17 hereof when notifying the public of pharmacovigilance related issues.
Article 9
(Risk reduction measures)
(1) The business subject referenced in the first paragraph of Article 7 hereof shall carry out measures prescribed by the Agency for the purposes of reducing or preventing risks in relation to pharmacovigilance.
(2) The business subject referenced in the first paragraph of Article 7 hereof shall reasonably observe the provisions of paragraphs four, five and six of Article 16 hereof when notifying the expert public.
IV. OBLIGATIONS OF THE MARKETING AUTHORISATION HOLDER
Article 10
(Person responsible for pharmacovigilance)
(1) The person responsible for the pharmacovigilance system shall:
– be responsible for the establishment and maintenance of the pharmacovigilance system in a manner that assures collection and comparison of data on all supposed adverse reactions of medicinal products;
– have access to the main pharmacovigilance file and sufficient competences for assuring that the content of the main pharmacovigilance file presents an accurate and updated image of the pharmacovigilance system;
– have sufficient competences to influence the implementation of a system of quality and activity of pharmacovigilance;
– have an overview of the safety profiles of medicinal products and safety issues and shall observe and monitor the conditions of marketing authorizations and other obligations pertaining to the safety of medicinal products, and measures for reducing risk;
– have sufficient competences regarding the content of risk management plans;
– participate in the review and approval of post-authorisation clinical studies of medicinal products;
– assure appropriate quality, correctness and completeness of pharmacovigilance data for each medicinal product that is submitted to the Agency and immediatelly respond to any requests from the Agency for additional information required for the evaluation of the benefits and risks afforded by a medicinal product are answered fully and promptly, including the information on the volume of sales;
– submit to the Agency any other information relevant to the evaluation of the benefits and risks afforded by a medicinal product, including appropriate information on post-authorization clinical tests;
– assure 24-hour availability.
(2) The marketing authorisation holder shall promptly inform the Agency of any changes in relation to the responsible person for the pharmacovigilance system and changes in contact data thereof in accordance with implementing regulations governing marketing authorization for medicinal products for human use.
(3) A marketing authorisation holder that does not have its registered office in the Republic of Slovenia and has an appointed an appropriately qualified contact person in charge of pharmacovigilance in the Republic of Slovenia shall inform the Agency of said contact person and duly notify any relevant changes.
(4) The Agency may request the appointment of a contact person for pharmacovigilance in the Republic of Slovenia when the Agency within the course of inspection establishes that the marketing authorization holder referenced in the above paragraph is not performing its pharmacovigilance related tasks in accordance with the law and these Rules.
Article 11
(Keeping of documentation on supposed adverse reactions to medicinal products)
(1) The marketing authorisation holder shall keep detailed documentation on all supposed adverse reactions to medicinal products in the EU or third countries, as reported by healthcare workers, patients or other business subjects or arising within a post-registration non-interventional clinical trial.
(2) The marketing authorisation holder shall assure accessibility of data referenced in the above paragraph at a single location within the EU.
Article 12
(Reporting on supposed adverse reactions to medicinal products)
(1) The marketing authorisation holder shall:
– electronically submit reports on supposed severe adverse reactions to medicinal products occurring in the EU and third countries into the EudraVigilance database within 15 days of receiving notification of supposed adverse reactions;
– electronically submit reports on supposed non severe adverse reactions to medicinal products occurring in the EU into the EudraVigilance database within 90 days of receiving notification of supposed adverse reactions;
– establish procedures for acquiring accurate and verifiable data for scientific evaluation of reports on supposed adverse reactions to medicinal products, collect further information regarding such reports and submit updated information into the EudraVigilance database;
– cooperate with the Agency and EMA in discovering duplicate reports on adverse reactions to medicinal products;
– monitor any medical and scientific literature in the Republic of Slovenia that is not on the list of publications monitored by the EMA, and report on supposed adverse reactions to medicinal products to the EudraVigilance database within 15 days of receiving notification of supposed adverse reactions;
– immediately, or no later than within 24 hours of receiving notification of supposed severe adverse reaction, notify the Agency of supposed severe adverse reactions that warrant emergency measures due to a direct threat to public health.
(2) Beside the tasks listed in the above paragraph, the marketing authorisation holder shall fulfill additional requests regarding reporting on supposed adverse reactions to medicinal products as directed by the Agency based on substantiated reasons pertaining to the pharmacovigilance system.
Article 13
(Regularly updated report on the safety of medicinal products)
(1) The marketing authorisation holder shall submit a regularly updated report on the safety of a medicinal product in accordance with the frequency and submission dates set out in the marketing authorization. The frequency and submission date shall apply until the relevant marketing authorization states otherwise.
(2) The marketing authorisation holder shall electronically submit a regularly updated report on the safety of a medicinal product to the EMA in accordance with item eight of paragraph one of Article 133.
(3) Notwithstanding the first paragraph of the present Article, the marketing authorization holder referenced under Articles 45, 47, paragraph two of Article 52 and paragraph two of Article 53 of the Act shall submit a regularly updated report on the safety of a medicinal product only in the following cases:
– when the obligation of reporting is set out as a condition in the marketing authorization;
– when so required by the Agency for reasons of pharmacovigilance or because not enough regular updated reports on the safety of the relevant active substance is available after marketing authorization has been issued;
– if the active substance is included in the list of reference dates of the EU.
(4) The marketing authorisation holder shall submit an updated medicinal product safety report for medicinal products that gained marketing authorization prior to 21 July 2012 and for which the frequency and dates of submission of reports are not set out by the marketing authorization:
– immediately, if so requested by the Agency;
– at least every six months following the issue of marketing authorization in the period prior to putting the medicinal product on the market;
– after putting the medicinal product on the market:
– at least every six months during the first two years;
– after two years have elapsed since putting the medicinal product on the market once annually in the following two years;
– After four years of post-marketing period – in three-year intervals.
(5) The frequency and dates of submission of regular updated medicinal product safety reports as set out under paragraphs one, three and four of the present Article may change, if the active substance or combination of substances is subject to a coordinated frequency of submission and EU reference date in order to enable a unified assessment in relation to the process of division of labour, as published on the EMA website. The marketing authorisation holder shall in such a case submit to the Agency an application for a change in the marketing authorisation in accordance with the implementing regulation governing marketing authorization for medicinal products for human use.
(6) The marketing authorisation holder may, for reasons of pharmacovigilance or to prevent duplication of assessment, or to achieve international coordination, submit to the Committee for Medicinal Products for Human Use or the Coordination Group with a request for determination of an EU reference date or amendment of the frequency of submission of regular updated medicinal product safety reports. Applications shall be submitted in writing and appropriately substantiated.
(7) The marketing authorisation holder shall monitor the list of EU reference dates regarding amendments of dates or submission frequency at the European medicinal products portal and shall, if required, submit to the Agency an application for a change in the marketing authorisation in accordance with the implementing regulation governing marketing authorization for medicinal products for human use.
(8) Any amendment of the dates or frequency of submission of regular updated medicinal product safety reports for reasons listed under paragraphs five, six and seven of the present Article, shall enter into force six months from the date of publication of the List of EU reference dates at the European medicinal products portal.
(9) Regular updated reports on the safety of medicinal products shall include:
– summaries of data relevant for the benefits and risks of a medicinal product, including results of clinical testing after acquisition of marketing authorization, taking into account any eventual influence on the marketing authorization;
– scientific evaluation of the risk benefit ratio of the medicinal product, based on all available data, including data from clinical trials for unregistered indications and populations;
– all data pertaining to the scope of medicinal product sales and all data available to the marketing authorization holder regarding the number of prescriptions, including an assessment of the share of the general population exposed to the medicinal product.
Article 14
(Detection of safety signals)
(1) The marketing authorization holder shall monitor all available pharmacovigilance data with the aim of determining whether any new risk has arisen, whether the risks have changed and whether the risks of a medicinal product have affected the risk-benefit balance.
(2) The marketing authorization holder shall monitor data referenced in the above paragraph with a frequency proportionate to defined risks, possible risks and need for additional information pursuant to guidelines set out under Article 2 hereof.
(3) The marketing authorization holder shall inform the Agency of any newly established or changed risks, and influences of such risks on the risk-benefit balance.
Article 15
(Risk management system)
(1) The marketing authorization holder shall manage and update the risk management system for each medicinal product, with the exception of medicinal products listed under paragraph 2 of Article 203 of the Act.
(2) The marketing authorisation holder shall monitor the results of risk reduction measures contained in the risk management plan and measures set out in the relevant marketing authorization pursuant to Article 58 of the Act.
(3) The marketing authorization holder referenced in the second paragraph of Article 203 of the Act shall at the substantiated request of the Agency submit a risk management plan to be introduced for a specific medicinal product.
(4) The marketing authorisation holder may within 30 days of receiving notification of the obligation imposed by the Agency, request from the Agency the option of submitting written explanations as a response to said imposed obligation.
(5) The marketing authorisation holder shall provide an answer to the imposed obligation within the deadline set out by the Agency.
(6) Based on the submitted written explanations, the Agency shall cancel or confirm the obligation to submit a risk management plan for the relevant medicinal product.
Article 16
(Additional risk reduction measures)
(1) The marketing authorization holder shall implement additional measures for reducing risks within the risk management system in accordance with the guidelines under Article 2 hereof.
(2) The marketing authorization holder shall prior to the commencement of implementation of any additional risk reduction measures referenced in the above paragraph acquire the consent of the Agency, regardless of the type of procedure of marketing authorization acquisition.
(3) The marketing authorization holder shall submit to the Agency the educational materials for healthcare workers or patients, which are in accordance with the guidelines under Article 2 hereof a part of the additional risk reduction measures, and shall list target groups, method and timeframe for the submission of educational materials. If the Agency does not request supplementation or amendments within 30 days, it shall be deemed that the educational materials are appropriate.
(4) The marketing authorisation holder shall inform the expert public on pharmacovigilance issues with direct notification for healthcare workers in accordance with the guidelines under Article 2 hereof, or shall inform it of so directed by the Agency.
(5) The marketing authorization holder shall submit direct notifications for healthcare workers, as referenced in the above paragraph, shall be submitted in coordination with the Agency with regard to content, target groups, method and timeframe of notification.
(6) Envelopes containing notification sent in accordance with paragraphs four and five of the present Article must be clearly marked with the following text in red color: “Important notification regarding medicinal product safety”.
(7) Educational materials from the third paragraph of this Article and direct notification from the fourth paragraph of this Article shall not contain any elements of advertising.
(8) The marketing authorization holder shall carry out any other measures directed by the Agency towards reduction or prevention of risks.
(9) At the request of the Agency, the marketing authorisation holder shall submit an assessment of efficiency of additional risk reduction measures.
(10) If educational materials from the third paragraph of this Article and direct notification from the fourth paragraph of this Article relate to a medicinal product on the list of medicinal product that require additional monitoring of safety, as published by EMA in accordance with Article 23 of Directive 726/2004/EC, the materials shall be marked by a downturned filled out triangle in black. The symbol shall be followed by the notation “This medicinal product is subject to additional safety monitoring” and a short standard explanation in accordance with the guidelines set out by Article 2 hereof.
Article 17
(Publishing of information on pharmacovigilance related issues)
The marketing authorization holder shall assure that all published information regarding pharmacovigilance of a medicinal product are presented objectively, are not misleading and do not contain advertising elements.
Article 18
(Pharmacovigilance system master file)
(1) The marketing authorization holder shall keep a master file on the pharmacovigilance system in the content and form determined by Directive 520/2012/EU and guidelines under Article 2 hereof.
(2) The marketing authorization holder shall assure that the content of the master pharmacovigilance file shall represent an accurately and regularly updated image of the pharmacovigilance system and shall contain all available data on the safety of medicinal products which the holder is authorised to market in the EU.
(3) The master pharmacovigilance system file be kept in the EU member state in which the marketing authorization holder is performing the main pharmacovigilance tasks or in the EU member state in which the person responsible for pharmacovigilance is operating.
(4) The marketing authorization holder shall assure that the master pharmacovigilance file shall be permanently and immediately accessible at the location of its keeping.
(5) The marketing authorization holder shall regularly assess its pharmacovigilance system and shall enter any remarks on the main findings of its assessment into the master pharmacovigilance system file and prepare and implement and appropriate plan of measures for correcting the established shortcomings.
(6) A remark referenced above may be withdrawn from the master pharmacovigilance system file once measures for correcting the established shortcomings have been implemented in full.
V. TASKS OF THE NATIONAL PHARMACOVIGILANCE CENTER
Article 19
(Responsibilities)
The national pharmacovigilance center:
– collects and evaluates reports on supposed adverse reactions to medicinal products, including any data on inappropriate use, abuse or inefficacy of medicinal products, falsification of medicinal products and all other data relevant to safe use of medicinal products in accordance with guidelines in Article 2 hereof;
– submits assessments of reports on supposed adverse reactions to the Agency within seven days of receiving notification of supposed adverse reactions;
– provides the A with other relevant information concerning medicinal product safety;
– informs the Agency in case of a need for immediate action, within 24 hours of receiving notification that warrants emergency action.
VI. (TASKS OF THE AGENCY)
Article 20
(Assessment of reports on supposed adverse reactions to medicinal products)
Within the scope of the performance of tasks set out under Article 134 of the Act pertaining to assessment of reports on supposed adverse reactions, the Agency shall perform the following tasks:
– managing the pharmacovigilance system for collecting information on risks to health of patients or public health due to medicinal products. This information shall particularly concern supposed adverse reactions of medicinal products arising from the use of medicinal products within the conditions and/or use outside of the scope of the marketing authorization, including supposed adverse reactions of medicinal products arising from errors in medicinal product use, abuse, incorrect use, excessive dosage, unauthorised use and professional exposure;
– scientific evaluation of reports on supposed adverse reactions of medicinal products and adoption of measures for acquiring accurate and verifiable data for scientific evaluation of reports. Further monitoring of reports on supposed adverse reactions to medicinal products may include healthcare workers and patients, as is appropriate, and the marketing authorization holder for reports it submits to the Agency;
– electronic submission of reports on supposed severe adverse reactions to medicinal products within 15 days of receiving notification of supposed severe adverse reactions to a medicinal product into the EudraVigilance database in accordance with guidelines detailed in Article 2 hereof;
– electronic submission of reports on supposed severe adverse reactions to medicinal products into the EudraVigilance database in accordance with guidelines detailed in Article 2 hereof within 90 days of notification of supposed severe adverse reactions to a medicinal product;
– cooperation with marketing authorization holders and EMA in discovering duplicate reports on supposed adverse reactions to medicinal products;
– stimulate healthcare workers and patients to report on supposed adverse reactions to medicinal products, including into such activities also the national pharmacovigilance center and healthcare workers’ associations, associations of patients and consumers.
Article 21
(Measures taken in emergency pharmacovigilance cases)
(1) The Agency shall implement measures in emergency pharmacovigilance cases (hereinafter: emergency procedure of the EU) when it decides that action is required based on an assessment of data from the pharmacovigilance system.
(2) The Agency shall commence the procedure referenced in the above paragraph by notifying the European Commission, the EMA and authorities competent for medicinal products in other EU Member States when:
– it shall be revoking or temporarily suspending a marketing authorization;
– it shall be prohibiting the use of a medicinal product;
– it shall reject the extension of a marketing authorization;
– it shall receive notification from the marketing authorization holder that it has due to safety reasons ceased marketing the medicinal product in question, requested the Agency to terminate the marketing authorization or intended to do so or has not applied for an extension of marketing authorization.
(3) The Agency shall notify EMA in writing of the intended measures set out in the above paragraph and shall submit all relevant technical data, including results of its assessment.
(4) Until adoption of a final decision in the procedure referenced in paragraph one of this Article, the Agency may in the interest of protecting public health enforce measures set out under paragraph five of Article 64 of the Act.
(5) If the Agency on the basis of an assessment of data from the pharmacovigilance system finds that new contraindications, reduction of the suggested dose or a limitation of indications are required, the Agency shall inform the European Commission, the EMA and bodies competent for medicinal products in other EU member states. The Agency shall list reasons for such measures and shall commence an emergency procedure of the EU if it believes that emergency measures are required. If the Agency does not commence the procedure determined in paragraph one of the present Article and the medicinal product in question has acquired a marketing authorisation by the mutual recognition or decentralised procedure, the matter shall be submitted to the Coordination Group.
(6) Notwithstanding paragraphs one, two and five of this Article, a medicinal product that has been granted marketing authorisation solely for the Republic of Slovenia, the Agency shall process the pharmacovigilance case it it assesses that emergency measures are required, and shall notify the relevant marketing authorization holder of the commencement.
(7) The marketing authorisation holder may submit its written remarks on the assessment of the pharmacovigilance case referenced in the above paragraph.
(8) The Agency shall within 60 days of commencement of the procedure set out under paragraph 6 of the present Article:
– establish that further assessment of data and measures are not required;
– direct the marketing authorization holder to perform further assessments of data and monitor its results;
– direct the marketing authorization holder to perform a non-intervention clinical study on the safety of the medicinal product and assess its results;
– direct the marketing authorization holder to perform risk reduction measures, including conditions and limitations stipulated by the authorisation, as directed by the Agency;
– temporarily revoke the marketing authorization;
– revoke the marketing authorization, or
– amend the marketing authorisation.
Article 22
(Informing)
(1) The Agency shall via its website inform the public of at least:
– methods of reporting on supposed adverse reactions to medicinal products for healthcare workers and patients;
– pharmacovigilance related issues;
– list of medicinal products that require additional safety monitoring as published by EMA pursuant to Article 23 of the Regulation (EC) No. 726/2004;
– summaries of legally approved risk management plans for medicinal products;
– list of national medical and scientific literature monitored by the marketing authorization holder for the purpose of reporting on supposed adverse reactions to medicinal products.
(2) In publishing notifications on pharmacovigilance related issues, the Agency shall observe provisions of the Act, act governing companies and act governing protection of personal data.
VII. NON-INTERVENTIONAL STUDY ON POST-AUTHORIZATION MEDICINAL PRODUCT SAFETY
Article 23
(detailed conditions for acquisition of consent to the draft protocol of the non-interventional study of medicinal product safety)
(1) The marketing authorization holder shall submit to the Agency a draft protocol of a non-interventional study of medicinal product safety, that shall take place only in the Republic of Slovenia and that requires consent referred to in Article 138 of the Act.
(2) The content and form of the protocol stated in the above paragraph shall correspond to Appendix III to Directive 520/2012/EU and guidelines from Article 2 hereof.
(3) The Agency shall issue a resolution of consent to the draft protocol within 60 days of receiving said draft protocol, provided the following conditions are met:
– the content and form of the protocol fulfill the requirements set out in the previous paragraph;
– the plan of the non-interventional medicinal product safety study shall correspond to the definition of non-interventional clinical testing in accordance with the law and guidelines from Article 2 hereof;
– the study plan referenced in the above indent assures the achievement of the purpose and goals of the study;
– sufficient evidence is submitted that the person responsible for the pharmacovigilance system in included in the review and approval of the protocol;
– implementation of the non-interventional medicinal product safety study does not accelerate prescription and consumption of the medicinal product.
(4) When non-interventional medicinal product safety studies are performed also in another EU member state that requires consent set out under Article 138 of the Act, the marketing authorization holder shall submit to the Pharmacovigilance Risk Assessment Committee a draft protocol in accordance with the procedure set out under Articles 107n to 107q of Directive 2001/83/EC.
Article 24
(content related amendments to protocol of the non-interventional study of medicinal product safety)
(1) Following commencement of the medicinal product safety study referenced in the first paragraph of Article 23 hereof, the marketing authorisation holder shall submit any content related amendment of the protocol to the Agency prior to its implementation.
(2) Content related amendments shall mean substantial amendments to the protocol, as defined in the guidelines in Article 2 hereof.
(3) The Agency shall decide on the adequacy of the proposed amendment within 30 days.
(4) Following commencement of the study referenced in the fourth paragraph of Article 23 hereof, the marketing authorisation holder shall submit any content related amendment of the protocol to the Pharmacovigilance Risk Assessment Committee in accordance with Article 107o of Directive 2001/83/EC.
Article 25
(Post EU authorization submission of data into the electronic clinical trials register)
Prior to commencement of data collection, the sponsor shall submit data on all post-registration non-intervention studies on medicinal product safety into the electronic post-registration clinical trials register, the EU PAS Register, in accordance with the guidelines of Article 2 hereof, which is accessible vie the European medicines portal http://www.encepp.eu/encepp_studies/indexRegister.shtml.
VIII. FINAL PROVISIONS
Article 26
(Termination of validity)
Rules on the pharmacovigilance of medicinal products for human use (Official Gazette of the Republic of Slovenia, Nos 53/06 and 16/11) shall cease to apply on the date the present Rules enter into force.
Article 27
(Effective date)
These Rules shall enter into force on the fifteenth day after their publication in the Official Gazette of the Republic of Slovenia.
No. 0070-31/2014
Ljubljana, 16 June 2014
EVA 2014-2711-0041
in her capacity as Minister of Health
mag. Alenka Bratušek
President of the Government
“,”Jaka Verbic Miklic”,1521991320,1521991320,en,12435,306,12416,43,0,NULL,,”Pravilnik o farmakovigilanci zdravil za uporabo v humani medicini, UL št. 57/2014, 25. 7. 2014″,pravilnik-o-farmakovigilanci-zdravil-za-uporabo-v-humani-medicini-ul-st-57-2014-25-7-2014,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521991422,1524643039
349,12436,”Medicinal Products Act”,”Official Gazette of RS, 17/2014″,”
MEDICINAL PRODUCTS ACT (ZZdr-2)
Pursuant to indent two of Paragraph 1 of Article 107 and Paragraph 1 of Article 91 of the Constitution of the Republic of Slovenia I hereby issue the following
O R D E R
on the promulgation of the Medicinal Products Act (ZZdr-2)
I hereby promulgate the Medicinal Products Act (ZZdr-2) adopted by the National Assembly of the Republic of Slovenia at its session of 24 February 2014.
Št. 003-02-2/2014-3 Ljubljana, on this day of 4 March 2014
Borut Pahor l.r. President of the Republic of Slovenia
MEDICINAL PRODUCTS ACT (ZZdr-2)
view as pdf
I. GENERAL PROVISIONS
Article 1
(Scope of application and competences)
(1) This Act defines the area of medicinal products for use in human and veterinary medicine, stipulates the conditions and measures for assuring their quality, safety and efficacy, the conditions and procedures for their testing, manufacture, the preparation of advanced therapy medicinal products prepared on a non-routine basis, sales and consumption, prices, official control and supervision over the implementation of this Act with the aim of protecting public health for medicinal products that are industrially manufactured or manufactured in a manner that includes and industrial procedure, including pre-mixes for the preparation of medicated feedingstuffs, active substances used as starting materials and for certain substances that can be used as veterinary medicinal products that have anabolic, anti-infectious, anti-parasitic, anti-inflammatory, hormonal or psychotropic properties, as well as the tasks and competencies of the Agency for Medicinal Products and Medical Devices of the Republic of Slovenia (hereinafter: the Agency).
(2) Unless specified otherwise herein, this Act shall also apply to homeopathic medicinal products.
Article 2
(Transposition and implementation of the EU regulations)
(1) The purpose of this Act is to transpose into the legislation of the Republic of Slovenia the contents of the following directives:
Council Directive 89/105/EEC of 21 December 1988 relating to the transparency of measures regulating the prices of medicinal products for human use and their inclusion in the scope of national health insurance systems (Official Journal L 40, 11. 2. 1989, p. 8, hereinafter: Directive 89/105/EEC);
Commission Directive 91/412/EEC of 23 July 1991 laying down the principles and guidelines of good manufacturing practice for veterinary medicinal products (Official Journal L 228/70, 18.8.1991 p. 70; hereinafter: Directive 91/412/EEC);
Directive 2001/20/EC of the European Parliament and of the Council of 4 April 2001 on the approximation of the laws, regulations and administrative provisions of the Member States relating to the implementation of good clinical practice in the conduct of clinical trials of medicinal products for human use (Official Journal L 121, 1. 5. 2001, p. 34), last amended by Council Regulation (EC) No 596/2009 of the European Parliament and of the Council of 18 June 2009 adapting a number of instruments subject to the procedure referred to in Article 251 of the Treaty to Council Decision 1999/468/EC with regard to the regulatory procedure with scrutiny – Adaptation to the regulatory procedure with scrutiny – Part Four (Official Journal L 188, 18 July 2009, p. 7; hereinafter: the Regulation (EC) No 596/2009), (hereinafter: Directive 2001/20/EC);
Directive 2001/82/EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to veterinary medicinal products (OJ L 311, 28.11.2001, p. 1), last amended by Council Regulation (EC) No 569/2009 (hereinafter: Directive 2001/82/EC), except for the part related to the use of medicinal products and the related traceability of medicinal products, which is regulated by the act regulating veterinary conformity criteria;
Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code related to medicinal products for human use (OJ L 311, 28. 11. 2001, p. 67), last amended by 2012/26/EU of the European Parliament and of the Council of 25 October 2012 amending Directive 2001/83/EC as regards pharmacovigilance (OJ L 299, 27.10.2012, p. 1), (hereinafter: Directive 2001/83/EC);
Directive 2003/94/EC of the European Parliament and of the Council of 8 October 2003 laying down the principles and guidelines of good manufacturing practice in respect of medicinal products for human use and investigational medicinal products for human use (OJ L 262, 14. 10. 2003, p. 22; hereinafter: Directive 2003/94/EC);
Commission Directive 2005/28/EC of 8 April 2005 laying down principles and detailed guidelines for good clinical practice as regards investigational medicinal products for human use, as well as the requirements for authorisation of the manufacturing or importation of such products (OJ L 91, 9.4.2005, p. 13; hereinafter: Directive 2005/28/EC).
(2) This Act regulates the implementation of the following regulations:
No 726/2004/EC of the European Parliament and of the Council of 31 March 2004 laying down Community procedures for the authorisation and supervision of medicinal products for human and veterinary use and establishing a European Medicines Agency (OJ L 136, 30. 4. 2004, p. 1), last amended by Regulation No 1027/2012 of the European Parliament and of the Council of 25 October 2012 amending the Regulation No 726/2004/EC regarding pharmacovigilance (Official Journal L 316 of 14.11.2012, p. 38), (hereinafter: Regulation 726/2004/EC);
Regulation (EC) No 1394/2007 of the European Parliament and of the Council of 13 November 2007 on advanced therapy medicinal products and amending Directive 2001/83/EC and Regulation (EC) No 726/2004 (Official Journal L 324, 10. 12. 2007, p. 121), last amended by Regulation (EU) No 1235/2010 of the European Parliament and of the Council of 15 December 2010 amending, as regards pharmacovigilance of medicinal products for human use, Regulation (EC) No 726/2004 laying down Community procedures for the authorisation and supervision of medicinal products for human and veterinary use and establishing a European Medicines Agency, and Regulation (EC) No 1394/2007 on advanced therapy medicinal products (Official Journal L No 348, 31. 12. 2010, p. 1), (hereinafter: Regulation 1394/2007/EC);
Commission Regulation (EC) No 1234/2008 of 24 November 2008 concerning the examination of variations to the terms of marketing authorisations for medicinal products for human use and veterinary medicinal products (Official Journal L 334, 12. 12. 2008, p. 7), last amended by the Commission Regulation (EU) No 712/2012 of 3 August 2012 amending Regulation (EC) No 1234/2008 concerning the examination of variations to the terms of marketing authorisations for medicinal products for human use and veterinary medicinal products (Official Journal L 209, 4. 8. 2012, p. 4); (hereinafter: Regulation 1234/2008/EC);
Regulation (EC) No 470/2009 of the European Parliament and of the Council of 6 May 2009 laying down Community procedures for the establishment of residue limits of pharmacologically active substances in foodstuffs of animal origin, repealing Council Regulation (EEC) No 2377/90 and amending Directive 2001/82/EC of the European Parliament and of the Council and Regulation (EC) No 726/2004 of the European Parliament and of the Council (Official Journal L 152, 16. 6. 2009, p. 11; hereinafter: Regulation 470/2009/EC).
Article 3
(Authority)
(1) The competent minister for medicinal products regulated by this Act shall be the minister competent for health (hereinafter: the minister), unless otherwise stipulated herein.
(2) The implementing regulations for the area of veterinary medicinal products shall be issued by the minister in agreement with the minister competent for veterinary medicine (hereinafter: the minister competent for veterinary medicine).
(3) The authority competent for medicinal products covered by this Act shall be the Agency.
(4) The Agency shall decide on administrative matters in accordance with the act governing the general administrative procedure, unless otherwise determined by this Act.
(5) Unless otherwise determined by this Act, the Agency shall in administrative matters, within five working days of receiving an incomplete application request its supplementation and set a deadline in which the applicant must supplement such application.
(6) In matters where the Agency decides pursuant hereto, it may by means of a decision request applicants to submit additional documentation or data within a set deadline. With finality of such a decision, the deadline for deciding as set out herein is suspended and begins again once the deadline for submission of documentation or data expires or data is submitted, whichever is first.
Article 4
(Strategic council for medicinal products, committees and external experts of the Agency)
(1) Strategic Council for Medicinal Products is a consulting body of the minister dealing with strategic issues in the area of medicinal products. The minister shall appoint the members to the Strategic council for medicinal products as well as determine its tasks and work method.
(2) The Agency may include in resolution of the issues that fall within its competence external experts, if while carrying out the tasks it assesses that expert knowledge which it does not possess is required to resolve issues. External experts shall be the persons or organisations possessing expert knowledge required for clarifying the state of affairs. If an organisation is appointed an external expert, one or more authorised persons shall act on its behalf in the procedure.
(3) External experts may be included in expert committees, expert working bodies and other expert groups of the European Medicines Agency and the European Commission as well as in the activities of other authorities and institutions and other international connections dealing with expert contents in the areas covered by this Act.
(4) The minister shall draw up the list of external experts referred to in the second and third paragraph hereunder and include in it the experts in the field of pharmacy, medicine, veterinary medicine and other related fields. A list of experts for the field of veterinary medicine shall be drawn up by the Minister in coordination with the minister competent for veterinary medicine. Exceptionally and provided the minister gives consent, the Agency may use an external expert who is not included in the current list of external experts, to ensure uninterrupted work process.
(5) The minister shall appoint commissions, committees and groups into which the Agency shall include the representatives and external experts referred to in the previous paragraph for solving the issues that fall within the competence of the Agency. The commissions, committees and groups shall prepare opinions and proposals in the following areas:
procedures for obtaining a marketing authorisation for a medicinal product;
procedures for obtaining an authorisation for a clinical trial;
drafting the proposed list of essential medicinal products and indispensable medicinal products;
determining exceptionally allowed higher prices of medicinal products for human use;
pharmacopeias.
(6) The criteria for determining professional qualifications and conflict of interest of candidates for external experts, the work method of individual external experts and of the committees and commissions referred to in the previous paragraph hereunder shall be determined by the Agency based on previous approval of the minister.
(7) External experts may not be biased in their work and must respect data confidentiality. They shall not have conflicts of interest that may enable them to gain unjustified benefits or prioritise individual parties in procedures.
(8) The Agency shall appoint an expert commission for determining the fulfilment of conditions of anufacturing and marketing of medicinal products and active substances and preparation of advanced therapy medicinal products prepared on a non-routine basis.
(9) The minister competent for veterinary medicine shall appoint commissions for doctrinary solutions for medicinal products for veterinary medicine.
Article 5
(Definition of medicinal product)
(1) Medicinal product shall mean any substance or combination of substances presented for treating or preventing disease in human beings or animals.
(2) Any substance or a combination of substances which may be used on or administered to human beings or animals with a view to restoring, improving or modifying their physiological functions by pharmacological, immunological or metabolic means, or making a medical diagnosis, shall likewise be considered a medicinal product.
(3) Substances referred to in the first and second paragraph of this Article may be:
of human origin,
of animal origin,
of plant origin,
of microbial origin,
of chemical origin,
chemical products obtained by chemical change or synthesis; or
developed by means of by biotechnological procedures.
Article 6
(Definition of terms)
The expressions used herein shall have the following meaning:
Quality analysis of a medicinal product shall mean a qualitative analysis of all constituents, a quantitative analysis of at least all active substances and all other tests, requisite for assessing the quality of medicinal products in compliance with the marketing authorisation requirements or testing methods consistent with Article 28 hereof or developed and validated for the purpose of assessing quality of medicinal products.
Biological medicinal product shall mean a medicinal product that contains biological substances or substances obtained through a process including biological systems. A biological substance is a substance obtained from, or through the use of, a biological source, the quality of which is determined by means of a combination of physico-chemical and biological testing, together with the manufacturing process and supervision. These are for example medicinal products made by means of a biological or biotechnical process, including cell cultures and similar.
Centralised procedure shall mean the procedure for obtaining a marketing authorisation for the medicinal product in the European Union, as defined by Regulation 726/2004/EC.
Placing medicinal product on the market shall mean to supply the market in medicinal products or make the medicinal product available in the Republic of Slovenia in return for payment or free of charge.
Decentralised procedure shall mean the procedure for obtaining a marketing authorisation for the medicinal product initiated simultaneously in the reference Member State and the EU Member States concerned. It is mandatory for those medicinal products not subjected to centralised procedure which have not yet obtained the marketing authorisation for the medicinal product in the European Union and which will be marketed in more than one EU Member State, as required by Directive 2001/83/EC and Directive 2001/82/EC.
Good distribution practice shall mean a qualitative system governing the organisation, implementation and control of product storage in accordance with a defined regime prior to their further use or putting into circulation and transportation of medicinal products from the manufacturer to the end user (hereinafter: the user) according to the principles and guidelines for medicinal products or active substances adopted and published by the European Commission.
Good pharmacovigilance practice shall mean the guidelines on the implementation of pharmacovigilance activities according to Article 108a of Directive 2001/83/EC.
Good clinical practice in clinical trials in human medicine shall mean an international ethical and scientific system of quality control, planning, implementation, recording, controlling and reporting on clinical trials on humans, providing for the credibility of data acquired through trials and the protection of rights and the safety of trial subjects pursuant to the Declaration of Helsinki of the World Medical Association on biomedical testing on human subjects (1964), to this Act and any regulations adopted on the basis hereof, and to the regulations adopted by the European Union.
Good clinical practice in clinical trials in veterinary medicine shall mean an international ethical and scientific system of quality control, planning, implementation, recording, controlling and reporting on clinical trials on target animals providing for the credibility of data acquired through trials and the safety of animals pursuant to this Act, any regulations adopted on the basis hereof and the regulations on animal protection.
Good control laboratory practice shall mean a qualitative system of the analytical testing of a medicinal product, which can also be part of good manufacturing practice used for controlling the quality of products.
Good laboratory practice shall mean a qualitative system governing organisational processes and conditions of planning, implementing, controlling, recording and archiving non-clinical medical and environmental studies and reporting thereon according to the principles and guidelines adopted and published by the European Commission.
Good manufacturing practice shall mean a qualitative system providing for the consistent manufacture and control of medicinal products and active substances according to quality standards relevant for their intended use in line with the principles and guidelines adopted and published by the European Commission.
Supposed adverse reaction to a medicinal product is a suspected adverse reaction, where the causal relationship between the medicinal product and the adverse event is at least reasonably possible.
European Pharmacopoeia shall mean the pharmacopoeia as defined by the Council of Europe Convention on the elaboration of a European Pharmacopoeia (1964), published at the website http://www.edqm.eu and published by the European Directorate for the Quality of Medicines (EDQM).
Pharmaceutical form shall mean the form of a medicinal product into which through technological procedures an active substance(s) is (are) incorporated, enabling its (their) administration considering physiological conditions and physico-chemical characteristics of the active substance and excipients.
Pharmacopoeia shall mean a collection of monographs and other provisions for regulating the development, preparation or manufacture of medicinal products, their identification, establishing their purity and testing the other quality parameters and other characteristics of the medicinal product and other substances used for manufacturing them, as well as other data on medicinal products.
Pharmacovigilance shall mean a system of identifying, evaluating, understanding and preventing the adverse reactions to medicinal products and other findings about the safety of a medicinal product and measures taken with the aim of managing and reducing the risks arising from medicinal products.
Galenic medicinal product for human use shall mean a medicinal product prepared for stock in a pharmacy or its galenic laboratory from active substances and/or excipients according to applicable pharmacopoeia and the formulas from applicable pharmacopoeia or according to the formulas (for the purpose of hospital activity) that are at the common proposal of a wider expert collegium competent for the field of treatment and expanded expert committee for the pharmacy industry approved by the Agency and which is intended to be dispensed to end users of the services of the pharmacy in question according to the regulations governing the pharmacy activity.
galenic medicinal product for use in veterinary medicine shall mean a medicinal product prepared for stock in a pharmacy or its galenic laboratory from active substances and/or excipients according to applicable pharmacopoeia and the formulas from applicable pharmacopoeia.
A galenic product can also be prepared according to the formulas that are at the proposal of the expert body representing veterinary activity and wider expert collegium for pharmacy, approved by the Agency and the authority competent for veterinary medicine, and which is intended to be dispensed to end users of the services of the pharmacy in question according to the regulations governing the pharmacy activity.
Generic medicinal product shall mean a medicinal product with the same qualitative and quantitative composition, active substance(s) and pharmaceutical form as the reference medicinal product whose bioequivalence with the reference medicinal product has been proved by suitable bioavailability studies. Various salts, esters, ethers, isomers, mixed isomers, complexes or active substance derivatives shall be treated as equal active substance unless they differ considerably in terms of safety or efficacy or both.
Pharmacovigilance system master file shall mean a detailed description of the pharmacovigilance system used by marketing authorisation holders for one or more medicinal products that have been granted a marketing authorisation.
Homeopathic medicinal product shall mean a medicinal product prepared from substances called homeopathic stock by a homeopathic method described in the European Pharmacopoeia or the existing Pharmacopoeias of the EU Member States, if the European Pharmacopoeia does not contain such provisions. A homeopathic medicinal product may also contain a number of essential constituents.
The name given to a medicinal product may be either an invented name which shall not be liable to confusion with the common name or scientific name, together with a trade mark or the name of the marketing authorisation holder.
Immunological medicinal products consist of vaccines, toxins and serums used to:
produce active immunity;
produce passive immunity or
diagnose the state of immunity; and
allergens intended to identify or induce a specific acquired alteration in the immunological response to an allergising agent.
Intermediate is an intermediate product of a multi-level synthesis of the active substance that is usually subjected to further molecular changes or refinement and can be isolated or not before it becomes an active substance. This definition refers to the substances manufactured following the level of synthesis which is defined by the manufacturer as the beginning of the synthesis of the active substance.
The issue of a medicinal product in retail sales shall mean the retail sales and delivery of a medicinal product in retail sales, delivery of a medicinal product in part or completely to the debit against public funds or delivery of a medicinal product which has been donated or provided from budgetary funds to the end user, accompanied with adequate independent expert support and consultancy.
Off-label use shall mean the use of a veterinary medicinal product which is not consistent with the summary of the product characteristics but nevertheless allowed under this Act and the act regulating veterinary conformity criteria.
Exit of a medicinal product shall mean the wholesale from the Republic of Slovenia into other EU Member States. Exit of a medicinal product shall also mean the transfer of a medicinal product from the territory of the Republic of Slovenia to the territory of other Member States of the European whenever the medicinal product is brought in by an individual for personal use or the needs of his/her household or an authorisation for personal use of a maximum of one individual who is not a member of the family, or his/her respective animal.Exports of a medicinal product shall mean the wholesale from the Republic of Slovenia into third countries. Export of a medicinal product shall also mean the transfer of a medicinal product from the territory of the Republic of Slovenia to third countries whenever the medicinal product is brought in by an individual for personal use or the needs of his/her household or an authorisation for personal use of a maximum of one individual who is not a member of the family, or his/her respective animal.
Providers of healthcare activity shall mean public health institutes and other natural and legal persons that provide healthcare activity in accordance with the healthcare regulations, with the exception of pharmacy services.
Providers of veterinary activity shall mean veterinary organisations and other organisations performing veterinary activity pursuant to the veterinary regulations.
The strength of a medicinal product shall mean the content of the active substances expressed quantitatively per dosage unit, per unit of volume or weight according to the pharmaceutical form.
Withdrawal period shall mean the period necessary between the last administration of the veterinary medicinal product to animals under normal conditions of use pursuant to this Act and any regulations issued on the basis hereof and the beginning of the production of foodstuffs from such animals, in order to ensure that such foodstuffs do not contain residues in quantities in excess of the maximum limits laid down in Regulation (EC) No 470/2009 and Commission Regulation (EU) No 37/2010 of 22 December 2009 on pharmacologically active substances and their classification regarding maximum residue limits in foodstuffs of animal origin (Official Journal L 15, 20. 1. 2010, p. 1), last amended by the Commission Implementing Regulation (EU) No 489/2013 of 27 May 2013 amending the Annex to Regulation (EU) No 37/2010 on pharmacologically active substances and their classification regarding maximum residue limits in foodstuffs of animal origin, as regards the substance: double stranded ribonucleic acid homologous to viral ribonucleic acid coding for part of the coat protein and part of the intergenic region of the Israel Acute Paralysis Virus (Official Journal L 141, 28. 5. 2013, p. 4), (hereinafter: Regulation 37/2010/EU).
End user of a medicinal product for human use shall mean an individual who was prescribed or issued the medicinal product (hereinafter: the patient) or a provider of healthcare activity using the medicinal product in performance of healthcare services.
End user of a medicinal product in veterinary medicine shall mean the owner or the keeper of the animal that was prescribed or issued the medicinal product or a business entity using the medicinal product in performance of veterinary activity.
Magistral formula for human use shall mean a medicinal product prepared in a pharmacy on prescription for an individual patient or a group of patients and issued directly after preparation when there is no industrially or galenically produced medicinal product available on the market to achieve the therapeutic effect with the same composition of active substances and excipients in adequate strength or pharmaceutical form.
Magistral formula for use in veterinary medicine shall mean a medicinal product prepared in a pharmacy on veterinary prescription for a specific animal or a small group of animals and issued directly after preparation.
Interruption in the supply of medicinal product is a market situation in which the business entities in charge of supplying the market of the Republic of Slovenia fail to provide sufficient quantities of a medicinal product in adequate time.
National centre for pharmacovigilance shall mean a legal person performing the tasks specified herein in the field of pharmacovigilance of medicinal products for human use and meets the conditions as regards staff, premises and equipment specified by the minister for the respective activity.
National identifier of a medicinal product placing the medicinal product on the market in the Republic of Slovenia is a label assigned to a medicinal product by the Agency that represents a unique identification of a medicinal product in terms of active substance, pharmaceutical form, strength, packaging and authorisation holder.
National procedure for obtaining a marketing authorisation for a medicinal product in the Republic of Slovenia shall mean the procedure for obtaining a marketing authorisation for those medicinal products which are not subject to centralised procedure and for which marketing authorisation will only be issued for the sales in the Republic of Slovenia.
Risk management plan in the field of pharmacovigilance shall mean a detailed description of the risk management system.
Maximum residue limit shall mean the maximum residue limit of medicinal products for use in veterinary medicine as stipulated by Regulation No 470/2009/EC.
Error in use of a medicinal product shall mean any unintentional incorrect prescription, issue or use of a medicinal product by a healthcare professional, patient or end user.
Package insert shall mean the information for the end user attached in written form to the medicinal product, as a rule in the form of an insert.
Non-interventional clinical trial shall mean a clinical trial of a medicinal product where the selection of patients, method of treatment, selection of a medicinal product, prescribing of a medicinal product, determining of tests and monitoring of a patient is consistent with the standard therapy that complies with the approved or prescribed dosage, form of administration or indication area.
Unauthorised use of a medicinal product shall mean any intentional inadequate use of the medicinal product for a medical purpose that is contrary to the marketing authorisation for the specific medicinal product.
Incorrect use of a medicinal product shall mean any intentional inadequate use of the medicinal product that is contrary to the marketing authorisation for the specific medicinal product.
Unexpected adverse reaction to a medicinal product shall mean an adverse reaction, the nature, severity or outcome of which is not consistent with the summary of the product characteristics.
Advanced therapy medicinal products prepared on a non-routine basis shall mean any advanced therapy medicinal product which is prepared on a non-routine basis in the Republic of Slovenia according to the quality standards specified herein and used within the Republic of Slovenia by a provider of healthcare or veterinary activity who is:
performing healthcare activity, subject to exclusive professional liability of the doctor in accordance with each individual order for each advanced therapy medicinal product prepared on a non-routine basis for a specific patient; or
performing veterinary activity, subject to exclusive professional liability of the veterinarian in accordance with each individual order for an animal or a group of animals from the same estate.
Adverse reaction to a medicinal product for human use shall mean a patient’s reaction which is noxious and unintended.
Adverse reaction to a veterinary medicinal product shall mean a reaction which is noxious and unexpected and which occurs at doses normally used in animals for the prophylaxis, diagnosis or therapy of disease or for the restoration, correction or modification of physiological function.
Adverse reaction to a medicinal product in clinical trials shall mean any noxious or unexpected response to an investigational medicinal product related to any dose administered.
Public service obligation shall mean the obligation placed on wholesalers to guarantee permanently an adequate range of medicinal products to meet the requirements in the Republic of Slovenia and in its entire territory and to deliver the supplies requested in the Republic of Slovenia within a reasonably short time which is determined by the healthcare provider based on provable medical need or medical documentation.
Recall of a batch of a medicinal product shall mean any activity related to withdrawing a batch of a medicinal product from the market or use due to inadequate quality of a batch of a medicinal product or a pharmacovigilance system measure.
Labelling of a medicinal product shall mean information on the immediate or outer packaging.
Parallel distribution shall mean the entry of a medicinal product for which marketing authorisation was obtained in accordance with the centralised procedure from one Member State of the European Union or the European Economic Area (hereinafter: the EEA) to another, if performed in accordance with regulations by a wholesaler who is not in a business relationship for the marketing of such medicinal product with the holder of marketing authorisation, in accordance with the applicable regulations.
Similar biological medicinal product is a medicinal product that is similar to the biological reference medicinal product and is authorised for marketing. The active ingredient of a similar biological medicinal product is similar to the active ingredient of the biological reference medicinal product. Similarity to the reference medicinal product must be evidenced in the sense of quality, bioactivity, safety and efficiency on the basis of comparative studies. Dosing and method of administration must be equal to those of the reference biological medicinal product. Any deviation in the design of the medicinal product or its excipients must be appropriately based on and supported by additional research.
Parallel import shall mean the entry of a medicinal product for which marketing authorisation was obtained in the exporting country that is similar enough to the medicinal product for which marketing authorisation was obtained in the Republic of Slovenia according to the national procedure, the mutual recognition procedure or the decentralised procedure and is entered into the Republic of Slovenia on the basis of the marketing authorisation for parallel imported medicinal product issued by the Agency, if parallel import is performed by a wholesaler who is not in a business relationship for the marketing of such medicinal product with the holder of marketing authorisation.
Occupational exposure to a medicinal product shall mean exposure to a medicinal product at the place of work.
A semi-product is a product that went through all phases of manufacturing except for the insertion into the outer packaging.
Falsified medicinal product shall mean any medicinal product with a false representation of:
its identity, including the packaging and labelling, its name or composition as regards any of its constituents including excipients and the strength thereof;
its source, including its manufacturer, country of manufacturing, its country of origin or its marketing authorisation holder; or
its history, including the records and documents relating to the distribution channels used.
This definition shall not apply to unintended quality defects and shall not infringe intellectual property rights.
Excipient shall mean any constituent of a medicinal product other than the active substance and the packaging material.
An individual (hereinafter: Individual) shall mean an identified or identifiable natural person who may be identified directly or indirectly.
A manufacturing site shall mean a restricted area that in relation to the surroundings represents an integral unit within which the manufacturing authorisation holder performs the activity of medicinal product manufacturing.
Individual manufacturing activities shall mean the activities of medicinal product manufacturing defined as manufacturing of semi-products, manufacturing of final forms in the narrow sense, primary packaging, secondary packaging, release of final medicinal product batches, quality control and import of medicinal products. Based on the intended purpose of a medicinal product they are divided into manufacturing of medicinal products for human use and veterinary medicinal products and based on the development level they are divided into the activities of medicinal product manufacturing and the activities of medicinal product manufacturing in clinical trial. The activities of manufacturing final forms in the narrow sense are divided according to pharmaceutical forms. The activities of quality control are divided on the basis of the type of trials performed in respect of the manufacturing of medicinal products for human and veterinary use and based on the development level they are divided into the activities of medicinal product manufacturing and the activities of medicinal product manufacturing in clinical trial. The activities of manufacturing final forms in the narrow sense are divided according to pharmaceutical forms. Quality control activities are divided according to the type of tests conducted.
Business entities shall mean domestic and foreign legal persons, individual sole proprietors, individual independently engaging in an activity and other natural persons engaging in a registered activity or performing such activity on the basis of a regulation or articles of association.
Brokering of medicinal products or active substances or both shall mean the activities in relation to the sale or purchase of medicinal products or active substances or both, except for wholesale distribution, that do not include physical handling of medicinal product or active substance and that consist of negotiating independently and on behalf of another business entity.
Mutual recognition procedure shall mean the procedure for obtaining marketing authorisation for the medicinal product initiated after the approval in the reference Member State also in other EU Member States concerned and is mandatory for those medicinal products not subjected to centralised or decentralised procedure for the issue of marketing authorisation which will be marketed in more than one EU Member State, as set out by Directive 2001/83/EC and Directive 2001/82/EC.
Pre-mixes for medicated feedingstuffs shall mean any medicinal product prepared in advance for use in veterinary medicine, intended for the subsequent manufacture of medicated feedingstuffs.
The advantage of supply with industrially made medicinal products from Slovenian plasma (i.e. fresh frozen plasma for processing, collected in the Republic of Slovenia) is the principle based on which the supply of medicinal products from the European Union made from foreign plasma is provided on the basis of marketing authorisation, if medicinal products made from Slovenian plasma are not sufficient to cover the needs for such products in the Republic of Slovenia, except in cases the import or entry of a specific medicinal product made from foreign plasma is adequately justified or if there is a strategic reason decided upon by the Strategic Council for Medicinal Products and the Expert Council for Supply of Blood and Plasma-Derived Medicinal Products.
Overdosing shall mean the use of such a quantity of medicinal product in a single dose or cumulatively which exceed the maximum allowed dose pursuant to the marketing authorisation and taking into account the clinical trials.
Placing a medicinal product on the market shall mean the first performed activity of marketing a medicinal product that enables supplying the market with such medicinal product and makes the medicinal product available to the end user.
Wholesale distribution of active substances and excipients shall mean the activity of purchasing, storing, selling, entering, importing, exiting or exporting of active substances.
Wholesale distribution of medicinal products shall mean the activity of purchasing, storing, selling, entering, exiting or exporting of medicinal products, except for the issuing of medicinal products in retail trade to end users.
Retail trade in medicinal products shall mean purchasing, storing and issuing of medicinal products or the use of such product while providing healthcare or veterinary services.
Radiopharmaceuticals shall mean radiopharmaceuticals, radionuclide precursors, radionuclide generators and radionuclide kits, namely:
radiopharmaceutical shall mean a medicinal product which, when ready for use, contains one or more radionuclides (radioactive isotopes) intended for human and veterinary use;
radionuclide generator shall mean any system incorporating a fixed parent radionuclide from which is produced a daughter radionuclide which is to be obtained by elution or by any other method and used as a radiopharmaceutical or a radionuclide precursor;
radionuclide precursor shall mean any radionuclide used in the process of producing a radiopharmaceutical for the labelling of another substance prior to administration to a patient;
radionuclide kit shall mean any preparation to be reconstituted or combined with radionuclides (radionuclide precursors) in the final radiopharmaceutical, usually prior to its administration.
Risk-benefit balance shall mean an assessment of the positive effects of therapy with a medicinal product in comparison with the risks, as stipulated herein.
Reference Member State shall mean the Member State which compiles, in the mutual recognition procedure or the decentralised procedure, the report on the assessment of the medicinal product on the basis of which the EU Member States concerned shall decide on the acceptability of the risk-benefit balance and/or the assessment of quality, safety and efficacy of a medicinal product in accordance with Directives 2001/83/EC and 2001/82/EC.
Reference medicinal product shall mean a medicinal product for which marketing authorisation has been issued on the basis of Article 44 hereof and to whose documentation other applicants refer taking into account the provisions of Article 59 of this Act.
Serious adverse reaction to a medicinal product for use in human medicine shall mean any adverse reaction which results in death, is life-threatening, requires inpatient hospitalisation or prolongation of existing hospitalisation, results in persistent or significant disability or incapacity, or a congenital anomaly or a birth defect.
Serious adverse reaction to a medicinal product for use in veterinary medicine shall mean any adverse reaction which results in death, is life-threatening, results in significant disability or incapacity, or a congenital anomaly, birth defect, or causes a constant or prolonged occurrence of signs and symptoms of disease in a treated animal.
A batch of medicinal product is a specific quantity of the medicinal product with expected homogeneity manufactured in the scope of a single process or a series of processes and identified with a clearly defined combination of characters, which can be letters or numbers. It includes all units of the pharmaceutical form manufactured from the same initial quantity of the substance, which have been included in the same series of manufacturing processes or the same sterilisation process. In the case of uninterrupted manufacturing process, it includes all units manufactured within a specific time interval.
Pharmacovigilance system shall mean a system of monitoring and reporting, managed by marketing authorisation holders and the European Union Member States to fulfil the tasks and responsibilities on the basis of this Act, aimed at monitoring the medicinal products that have been issued a marketing authorisation, and at discovering the changes in the risk-benefit balance in the use of medicinal products.
Rapid alert system is a communication system for authorities competent for medicinal products of European Union Member States and of the European Union, which is established with the aim of immediate mutual and ,if required, broader notification of the appearance of a new risk for public health relating to the safety and quality of medicinal products, and with the aim to diminish such risk.
Risk management system shall mean a set of activities within the pharmacovigilance system and of measures intended for detecting, identifying, preventing or reducing risks related to a medicinal product, including the assessment of efficiency of the said activities and measures.
Compassionate use shall mean making a medicinal product containing a new active substance that constitutes a significant therapeutic, scientific or technical innovation and is in the process of being granted a marketing authorisation or in the clinical trial process available to a group of patients with a chronically or seriously debilitating disease who cannot be treated satisfactorily by authorised medicinal products, as stipulated in Article 83 of Regulation 726/2004/EC.
88. Specialised shop selling medicinal products shall mean a retail outlet selling those medicinal products which the Agency allows to be dispensed without prescription in pharmacies and specialised shops pursuant to this Act.
89. Common name of a medicinal product shall mean the international non-proprietary name recommended by the World Health Organisation, or, if one does not exist, the usual common name.
Sponsor shall mean a business entity or individual who takes responsibility for the initiation, management and/or financing of a clinical trial.
Immediate packaging shall mean a container or other form of packaging immediately in contact with the medicinal product.
Study of the safety of medicinal product after obtaining the marketing authorisation for a medicinal product used in human medicine shall mean any study on such medicinal product conducted with the aim of detecting, identifying or quantifying a safety hazard, confirming the safety characteristics of a medicinal product or measuring the efficiency of risk management measures.
Study of the safety of medicinal product after obtaining the marketing authorisation for a medicinal product used in veterinary medicine shall mean a pharmacoepidemiological study or a clinical trial of a medicinal product carried out in accordance with the terms of the marketing authorisation, conducted with the aim of identifying or investigating a safety hazard relating to a medicinal product.
Traditional herbal medicinal product shall mean a herbal medicinal product whose properties can be recognised on the basis of its traditional use and which meets the conditions stipulated by this Act and Directive 2001/83/EC.
Third countries shall mean the Non-Member States of the European Union or the European Economic Area.
96. Risk related to the use of a medicinal product shall mean:
any risk of the occurrence of environmentally harmful adverse reactions;
or
any risk to the health of a patient or animal or public health, related to the quality, safety or efficacy of a medicinal product.
Active substance or medicinal substance shall mean any substance or mixture of substances intended to be used in the manufacture of a medicinal product and that, when used in its production, becomes an active ingredient of that product intended to exert a pharmacological, immunological or metabolic action with a view to restoring, correcting or modifying physiological functions or to make a medical diagnosis.
Official quality control of a medicinal product shall mean the process of determining the quality of a medicinal product according to the marketing authorisation or the provisions hereof, including analytical testing or verifying of labelling and package insert or both.
Official control laboratory shall mean a laboratory conducting the official quality control of medicinal products, which is a member of the network of official control laboratories (GEON).
Import of a medicinal product shall mean marketing of a medicinal product from third countries in the territory of the Republic of Slovenia that may be performed only by manufacturing authorisation holders if the manufacturing authorisation covers the import activity. Import of a medicinal product shall also mean the transfer of a medicinal product from third countries to the territory of the Republic of Slovenia whenever the medicinal product is brought in by an individual for personal use or the needs of his/her household or an authorisation for personal use of a maximum of one individual who is not a member of the family, or his/her respective animal.
Wholesaler in medicinal products shall mean a business entity wholesaling medicinal products on the basis of the authorisation issued by the Agency with the aim of generating profit or not.
An intermediate product is partially processed material that needs to be processed with further procedures before it becomes a semi-product.
Entry of a medicinal product shall mean the wholesale from other European Union Member States to the Republic of Slovenia. Entry of a medicinal product shall also mean the transfer of a medicinal product from the territory of other Member States of the European Union to the territory of the Republic of Slovenia whenever the medicinal product is brought in by an individual for personal use or the needs of his/her household or an authorisation for personal use of a maximum of one individual who is not a member of the family, or his/her respective animal.
Protective element shall mean the information on the outer packaging of a medicinal product for human use enabling wholesalers and the competent persons for retailing medicinal products to the public in pharmacies and specialised stores to verify the authenticity of a medicinal product and identify packaging.
Member State concerned shall mean the Member State which shall decide, in the mutual recognition procedure or the decentralised procedure, on the acceptability of the risk-benefit balance and/or the assessment of quality, safety and efficacy of a medicinal product on the basis of the report on the assessment of the medicinal product compiled by a reference EU Member State.
Medicinal products derived from blood or plasma shall mean the medicinal products manufactured by means of industrial procedures, for instance medicinal products which contain above all albumin, coagulating factors and immunoglobulins of human origin, which are manufactured by specialised business entities from blood components obtained in accordance with the regulations governing blood supply and blood preparation supply and the regulations governing medicinal products.
Medicated feedingstuffs shall mean any mixture of a veterinary medicinal product or products and feed or feeds which is ready prepared for marketing and intended to be fed to animals without further processing, because of its curative or preventive properties or other properties as a medicinal product.
108. Herbal medicinal product shall mean a medicinal product which contains only one or more herbal substances, one or more herbal preparations or one or more herbal substances in combination with one or more herbal preparations.
An orphan medicinal product is a medicinal product intended for the treatment of very serious and very rare diseases for which no other approved treatment, prevention and diagnosis method is available, but whose marketing is without incentives not sufficiently profitable to justify the investment in its development and marketing, and which is defined as an orphan in accordance with the terms of the Regulation (EC) No 141/2000 of the European Parliament and of the Council of 16 December 1999 on orphan medicinal products (Official Journal L 18, 22. 1. 2000), last amended by Regulation (EC) 596/2009.
Advanced therapy medicinal product is a medicinal product defined in Article 2 of Regulation No 1394/2007/EC.
Medical or veterinary prescription shall mean a document issued in accordance with the applicable regulations by an expert qualified and authorised to prescribe medicinal products.
Abuse of a medicinal product shall mean persistent or sporadic, intentional excessive use of a medicinal product which is accompanied by harmful physical or psychological effects.
Outer packaging of a medicinal product shall mean the packaging into which the medicinal product in the immediate packaging is placed.
II. MEDICINAL PRODUCTS ON THE MARKET
Article 7
(Relationship between medicinal and other products)
(1) If, by definition and taking into account all its characteristics, a medicinal product can simultaneously be classified as medicinal product and as product subject to other provisions, the provisions of this Act shall apply in the case of doubt.
(2) The classification referred to in the previous paragraph shall be decided by the Agency in an administrative procedure by a special declaratory procedure based on the application or the manufacturer or the business entity which markets or intends to market the product referred to in the previous paragraph, or ex officio. In the process of deciding the following shall be considered:
qualitative and quantitative composition of the medicinal product;
purpose and method of administration;
whether the medicinal product or its constituents have pharmacological, immunological or metabolic action;
is the medicinal product ascribed direct or indirect effects of treatment, prophylaxis or diagnosis of disease;
presentation of the medicinal product and impression the medicinal product makes on the end user and/or customer;
possible adverse reactions and related risks for an individual and public health;
knowledge of the medicinal product by the end users and/or customers;
the latest scientific findings, and
the guidelines of the European Union, which are published by the Agency on its website and the national guidelines, which are prepared and published by the Agency on its website.
The application referred to in the previous paragraph shall contain information about the qualitative and quantitative composition of the medicinal product, the safety of the medicinal product, the presentation of the medicinal product to the end users and/or customers on the leaflets or brochures attached to the packaging, websites, verbally or in any other manner, and about the status of the medicinal product in the EU Member States.
The costs of the procedure based on the application referred to in the second paragraph hereunder shall be paid by the manufacturer or the business entity which markets or intends to market the product referred to in the first paragraph hereunder.
Article 8
(Relationship between industrially produced medicinal products and galenic medicinal products)
(1) Medicinal products, whereby starting materials are used to produce less than 50,000 packages per year in pharmacies or galenic laboratories, shall be treated as galenic medicinal products subject to the regulations governing pharmacy activity.
(2) The following are not permitted to be manufactured as galenic medicinal products:
medicinal products with identical composition of active substances of the same or comparative form, with identical or comparable composition of excipients, pharmaceutical form or strength as those of medicinal products authorised for marketing in the Republic of Slovenia and present on the market;
homeopathic medicinal products; or
medicinal products which are not used in the EU Member States and third countries that have in place requirements concerning quality, safety and efficacy of medicinal products comparable to that of the European Union.
(3) A galenic medicinal product may be dispensed until the expiry of its shelf life, but no more than six months following the date of publication of entry on the market of the same or comparable industrially produced medicinal product, as published by the Agency at it website pursuant to paragraph three of Article 24 hereof.
(4) Industrially produced medicinal products, intermediates, intermediate products or semi-products may not be used for manufacturing galenic medicinal products, except in extraordinary situations in the interest of protecting public health in the event of a threat to the health of people and animals, subject to approval of the minister at the proposal of the expanded expert collegium for the pharmacy industry and opinion of the Strategic council for medicinal products.
(5) Notwithstanding the first paragraph hereunder, a pharmacy may manufacture a greater quantity of a galenic medicinal product based on previous approval of the Agency, if an industrially manufactured medicinal product classified in the list of essential medicinal products or list of indispensable medicinal products of the Republic of Slovenia has not been placed on the market.
(6) The Agency may approve a pharmacy for manufacturing a galenic medicinal product referred to in the previous paragraph in a special declaratory procedure on the basis of the pharmacy’s application in which the pharmacy proves that the increase in quantity is justified.
Article 9
(Prohibition of inappropriate presentation of products)
(1) It is prohibited to advertise and place on the market any products with an alleged healing properties or disease prevention properties for use in human or veterinary medicine which pursuant to this Act are not considered a medicinal product.
(2) The providers of healthcare, veterinary and pharmacy activity may not present to patients or customers the products which pursuant to this Act are not considered a medicinal product as products with healing properties or disease prevention properties.
Article 10
(Equal manufacturing and import requirements)
The provisions of this Act on manufacturing and import of medicinal products shall also apply to medicinal products intended for placement on the market outside the territory of the Republic of Slovenia and for intermediates, intermediate products, semi-products, active substances and excipients.
Article 11
(Exceptions to the application of this Act)
The provisions of this Act shall not apply to the following:
magistral formulas regulated by the provisions on pharmacy activity;
galenic medicinal products regulated by the regulations on pharmacy activity, except in the part which specifies the quantity distinction between medicinal products produced industrially and medicinal products produced galenically in pharmacies and/or their galenic laboratories;
medicinal products intended for research and development trials, without prejudice to the implementation of the provisions on clinical trials of medicinal products;
intermediates, intermediate products and semi-products intended for further processing by manufacturing authorisation holders into medicinal products that shall be authorised for marketing, except for manufacturing and import of medicinal products according to the provisions of the previous Article;
radioactive isotopes in the form of sealed sources regulated by the provisions on protection against ionising radiation and nuclear safety;
blood, plasma or blood cells regulated by the provisions on blood supply, except for plasma produced in a way that includes industrial procedures and which is used for manufacturing medicinal products;
human tissues and cells intended for treatment of humans, regulated by the provisions on quality and safety of human tissues and cells intended for treatment;
medicated feedingstuffs regulated by the provisions on feedingstuffs;
9. feed additives stipulated by the provisions on feedingstuffs;
10. Medicinal products for use in veterinary medicine foreseen exclusively for aquarium fish, cage birds, terrarium animals, small rodents and ferrets, considering the provisions from Articles 5 through 8 of the Directive 2001/82/EC, provided that such products do not contain substances the use of which requires veterinary control and that all necessary measures have been taken to prevent unauthorised use of the products for other animals.
Article 12
(Classifying medicinal drugs according to their anatomic-therapeutic-chemical classification and determining of defined daily dose)
(1) Medicinal products marketed in the Republic of Slovenia shall be classified according to the anatomic-therapeutic-chemical classification (hereinafter: ATC classification of medicinal products for human use or ATCvet for veterinary medicinal products) and the methodology of determining defined daily dose (hereinafter: DDD), which is published on the website of the WHO Collaborating Centre for Drug Statistics Methodology, Oslo, Norway (http://www. whocc.no), in its applicable form.
(2) The Agency shall provide the translation of the ATC classification and uniform national naming of active substances and DDD for medicinal products for use in human medicine and translation of ATC classification of medicinal products for veterinary use, marketed in the Republic of Slovenia, and shall publish them on its website.
Article 13
(National identifier of medicinal products)
(1) The Agency shall determine the national identifier of medicinal products for human use that represents a unique identification of a medicinal product in terms of active substance, pharmaceutical form, strength, packaging and authorisation holder placing the medicinal product on the market in the Republic of Slovenia.
(2) More detailed definition, method and procedure for determining and recording the national identifier of medicinal products and mandatory users shall be determined by the Minister.
Article 14
(Classification of medicinal products on the basis of prescribing and dispensing)
(1) In terms of prescribing and dispensing practices, medicinal products shall be classified as follows:
medicinal products dispensed on the basis of medical or veterinary prescription,
medicinal products for dispensing of which medical or veterinary prescription is not required.
(2) The minister shall determine more detailed definition, classification and the manner of prescribing and dispensing medicinal products.
Article 15
(Changed classification of a medicinal product regarding the prescription and dispensing regime, and data protection)
(1) A marketing authorisation holder may submit to the Agency an application for a change in the classification, whereby a medicinal product which may be prescribed and dispensed only based on a medical or veterinary prescription is classified among the medicinal products which may be prescribed and dispensed without a medical or veterinary prescription. In the application it shall submit the results of non-clinical pharmacotoxicological studies or clinical trials that justify the change in the classification of a medicinal product.
(2) If the Agency issues an authorisation for marketing a medicinal product with changed classification referred to in the previous paragraph on the basis of the results of significant non-clinical pharmacotoxicological studies or clinical trials, it shall, for one year of issuing the marketing authorisation for the medicinal product with changed classification, not consider the results of the tests or trials submitted by the holder of the marketing authorisation referred to in the previous paragraph when deciding on a change in the classification of a medicinal product of another holder of a marketing authorisation for a medicinal product with the same active substance.
(3) The change in the classification of a medicinal product referred to in this Article shall be treated as an amendment to the marketing authorisation under Article 62 herein.
Article 16
(Import, export, entry and exit of medicinal products for personal use and use on their animal)
(1) Individuals are prohibited from importing or exporting medicinal products.
(2) Notwithstanding the prior paragraph, an individual may for their personal use, the personal use of members of close family or pursuant to authorisation for the personal use of at most one individual who is not their family member, or their individual animal which is not of a food producing animal species, import or export in their personal luggage a medicinal product in the quantity consistent with the relevant therapeutic use, as follows:
for a maximum of three weeks for acute conditions;
for a maximum of three months according to prescribed dosage for chronic diseases and conditions that require long-term use of medicinal products or exceptionally for up to 12 months if an individual submits to the competent customs authority proof of permitted residence in the target country in the respective period, unless the regulations on illicit drugs specify otherwise.
(3) In the import or entry of medicinal products for personal use as set out in the paragraph above, for which a medical or veterinary prescription is required, the customs authority may demand that the individual provide proof of medical or veterinary prescriptions for such medicinal products.
Article 17
(Essential and indispensable medicinal products)
(1) Essential medicinal products are those medicinal products that have been on the basis of the latest findings of biomedical science and systemic definitions in the framework of the national health priorities, taking into account the sustainability of public funds, recognised as essential for the provision of human and/or animal healthcare and classified in the list of essential medicinal products.
(2) In the list of essential medicinal products, medicinal products shall be defined by their common name, pharmaceutical form and strength, and the manner of prescribing and dispensing.
(3) The following criteria shall be applied when classifying medicinal products in the list of essential medicinal products:
that the medicinal product is significant in terms of public health protection;
that the medicinal product is significant in terms of implementation of healthcare programme priorities;
that the medicinal product is significant in the implementation of priorities of treatment of humans and the prevention of conditions defined in the resolution referring to the national healthcare plan or in the document of the World Health Organisation on priority healthcare programmes in Europe, or if the medicinal product is a selected medicinal product in exceptional circumstances with the aim of managing public health threats (in the event of large-scale accidents, infections, epidemics, pandemics, poisoning, radiation, including iodine prophylaxis and similar) or for other reasons in the interest of public health protection, or
that the medicinal product is significant in ethical terms.
(4) The list of essential medicinal products for human use shall be determined by the minister on the proposal of the Agency, and the list of essential medicinal products for veterinary use shall be determined by the minister competent for veterinary medicine at the proposal of the Agency.
(5) Indispensable medicinal products shall be medicinal products not included in the list of essential medicinal products referred to in the first paragraph hereunder and for which the provider of tertiary healthcare services or an expanded expert committee for its area of competence justifies new healthcare needs and which the Agency, on such basis and in view of the criteria referred to in the third paragraph hereunder, classifies in the list of indispensable medicinal products.
(6) The competent ministers shall publish the lists referred to in the fourth paragraph hereunder at least once annually, by no later than 31 January of the current year taking into account the medicinal products on the list referred to in the preceding paragraph.
(7) Several medicinal products marketed in the Republic of Slovenia based on the first and second paragraph of Article 20 hereof and having the same ATC classification code on the fifth level, same composition of active substances and appropriate pharmaceutical form, may simultaneously fit the description of an essential medicinal product from the list referred to in first paragraph hereunder and the description of indispensable medicinal products referred to in the fifth paragraph hereunder.
(8) If no medicinal products referred to in the first and second paragraph of Article 20 hereof, that fit the description of an essential medicinal product from the list of essential medicinal products or the description of an indispensable medicinal product from the list of indispensable medicinal products, are marketed in the Republic of Slovenia, the Agency may issue a temporary authorisation for marketing a medicinal product in line with indent 3 of the third paragraph of Article 20 hereof.
(9) A galenic medicinal product, which may be marketed according to the provisions of this Act, may fit the description of an essential medicinal product from the list referred to in the first paragraph hereunder or the description of an indispensable medicinal product from the list referred to in the fifth paragraph hereunder.
(10) The two lists of essential medicinal products and indispensable medicinal products shall be posted on the Agency’s website.
Article 18
Placement on the market and availability of orphan medicinal products)
When placing orphan medicinal products on the market and ensuring their availability, the professional doctrine in the area of serious and rare diseases in the Republic of Slovenia shall be taken into account.
Article 19
(Interchangeable medicinal products)
(1) Interchangeable medicinal products for human use are those medicinal products that the Agency defines and publishes as suitable for interchanging, taking into account the fact that the probability of the occurrence of clinically significant differences in the efficacy and safety of such medicinal products is adequately low or negligible; such decision must be supported by:
identification of common or comparable characteristics of medicinal products or groups of medicinal products pursuant to this Act or the regulations issued on its basis;
consideration of marketing authorisation;
incorporation of the latest findings and discoveries of biomedical science and profession;
data on pharmacovigilance.
(2) Medicinal products shall be interchanged by the persons authorised to prescribe medicinal products or issue medicinal products according to special regulations.
(3) The Agency shall initiate the procedure for establishing interchangeability of medicinal products:
ex officio based on its own initiative; or
at the initiative of the competent ministry, expanded expert committee for medicinal products or the holder of rights arising from compulsory health insurance (hereinafter: the OZZ provider); or
based on the application of the marketing authorisation holder from the first paragraph of Article 20 hereof.
(4) The procedure referred to in the indent 1 of the previous paragraph shall commence:
on the day the authorisation referred to in the first paragraph of Article 20 hereof becomes applicable; or
on the day the data referred to in the second paragraph of Article 20 hereof become applicable; or
on the day the Agency discovers new facts and circumstances that provide the basis for re-establishing interchangeability of medicinal products.
(5) The Agency shall decide on interchangeability by a decision issued in three months of receiving a complete application or from the commencement of the procedure that had been initiated ex officio. An appeal shall not stay the execution of such decision.
(6) The Agency may require the marketing authorisation holder referred to in the first paragraph of Article 20 hereof to provide additional documentation or data pursuant to paragraph six of Article 3 hereof. The procedure shall be suspended until the requirements have been fulfilled.
(7) The minister shall determine more detailed requirements and procedures for establishing interchangeability of medicinal products.
Article 20
(Marketed medicinal product)
(1) A medicinal product can be marketed in the Republic of Slovenia provided that it has been granted a marketing authorisation, a parallel import authorisation or a parallel distribution certificate or a compassionate use certificate.
(2) Notwithstanding the previous paragraph, a medicinal product that has been granted a marketing authorisation under centralised procedure, may be marketed in the Republic of Slovenia if on the basis of the marketing authorisation holder’s application the Agency determines the national identifier of medicinal products and data from Article 13 hereof for the product.
(3) Notwithstanding the first paragraph hereunder, the Agency may in exceptional cases temporarily allow marketing of a medicinal product without a marketing authorisation:
for the needs of one or more patients or an animal or a group animals, on the basis of a request of the treating physician and the opinion of the responsible person of the clinic or institute, or in the event of a veterinary medicinal product, on the basis of a request of the treating veterinary, at their personal responsibility;
in exceptional cases (infections, epidemics, pandemics, poisoning, radiation and similar) for the purpose of implementing protective measures or for other reasons in the interest of public health protection;
for a medicinal product whose active substance, pharmaceutical form and strength are classified in the list of essential medicinal products or indispensable medicinal products referred to in Article 17 hereof, provided the same medicinal product has not been placed on the market with a marketing authorisation or is not present on the market of the Republic of Slovenia in accordance with this Act;
for medicinal products covered from the budget of the Republic of Slovenia pursuant to Article 141 of this Act, if there is no other medicinal product with the same composition and a marketing authorisation available in the Republic of Slovenia; or
in the event of epizootic diseases, on the proposal of the authority competent for veterinary medicine, for an immunological veterinary medicinal product without marketing authorisation, if no appropriate medicinal product is available, in which case the authority competent for veterinary medicine shall inform the European Commission in advance of the detailed conditions of use.
(4) The Agency may within 30 days of receiving a complete application exceptionally temporarily allow the marketing of a medicinal product referred to in the previous paragraph, except in the cases referred to in indents 2 and 5 of the previous paragraph, where it shall decide in no later than seven days. The Agency shall request that the application for temporary marketing of a medicinal product referred to in indent 2 and 5 of the previous paragraph be supplemented in five days at the latest.
(5) The Agency shall once a month submit to the minister or the minister competent for veterinary medicine the data on medicinal products authorised for temporary marketing.
(6) The applicant for obtaining a temporary marketing authorisation referred to in the third paragraph hereunder can be a wholesaler in medicinal products.
(7) The minister shall determine more specific conditions and the procedure for the issue of a temporary marketing authorisation in cases referred to in the third paragraph hereunder.
Article 21
(Prohibition to place medicinal product on the market)
It is prohibited to place on the market a medicinal product:
that does not have a marketing authorisation referred to in the first, second or third paragraph of the previous Article;
that does not have the approval referred to in the fifth and sixth paragraph of Article 8 herein;
that has not been manufactured according to the documentation for the marketing authorisation or good manufacturing practice;
that is past its shelf life, or
whose quality, safety and efficacy has been found to be deficient.
Article 22
(Approval of specific deviation)
(1) Notwithstanding the indent 3 of the previous Article, after the issue of a marketing authorisation, the Agency may, on the proposal of the marketing authorisation holder, approve in exceptional cases, when such approval is in the interest of public health protection, specific deviation from the terms of the marketing authorisation if such refers to a single batch or few batches of a medicinal product. The marketing authorisation holder shall submit in the application the data about the proposed scope of approval of specific deviation and provide evidence that the deviation does not affect the quality, safety and efficacy of a medicinal product as well as propose preventive and corrective measures which it shall implement to establish supply of the medicinal product in respect of the terms of the marketing authorisation.
(2) The minister shall determine more specific conditions and the procedure for approval of the specific deviation referred to in the previous paragraph as well as the contents of the application.
Article 23
(Measures upon quality deviations and suspected falsification of medicinal product)
(1) Business entities involved in marketing of a medicinal product shall inform the Agency about inadequate quality of a medicinal product or suspected falsification of a medicinal product. The Agency shall assess the data, require and monitor a recall of a medicinal product as well as decide on the manner of informing the public thereof.
(2) The minister shall decide on the manner and contents to be observed by business entities involved in marketing of a medicinal product when informing about quality deviations and suspected falsification of medicinal product.
Article 24
(Informing about placement of a medicinal product on the market and submission of data about the volume of sales, purchase, issue and consumption of medicinal products)
(1) A marketing authorisation holder, a marketing authorisation holder for parallel imported medicinal product, a holder of parallel distribution certificate and a holder of temporary marketing authorisation for a medicinal product referred to in the indent 3 of the third paragraph of Article 20 hereof shall inform the Agency about the date of the actual beginning of distribution of the medicinal product in the Republic of Slovenia or the date of placement of the medicinal product on the market no later than on the day of the first placement of the medicinal product on the market of the Republic of Slovenia.
(2) The holder referred to in the previous paragraph shall notify the Agency on any temporary or permanent suspension of such marketing or interrupted supply of such medicinal product at least two months prior to the suspension of such marketing, except in the case of force majeure. In the notification the marketing authorisation holder shall provide the reasons for temporary or permanent suspension of marketing the medicinal product, its assessment of the risk to public health protection in the Republic of Slovenia as well as its measures for reducing potential risk.
(3) In the case of medicinal products for human use the Agency shall inform the OZZ provider within five business days of receiving the notification from the first and second paragraph of the present Article, as well as publish such data on its website.
(4) In the case of medicinal products for veterinary use, the Agency shall inform, the authority competent for veterinary medicine within five business days of receiving the notification from the second paragraph hereunder and publish such data on its website.
(5) For the purpose of monitoring the use of medicinal products for treatment of animals, the Agency must, upon a request of the authority competent for veterinary medicine, forward to and provide the latter with the necessary data from the marketing authorisation or import or entry authorisation and the marketing authorisation for parallel imported medicinal product or the certificate of the receipt of notification on parallel distribution of medicinal product.
(6) If requested by the Agency, the holders of authorization referred to in the first paragraph hereunder and the wholesalers shall submit data on the volume of sales in the Republic of Slovenia.
(7) The manager of databases on the consumption of medicinal products and the OZZ provider shall submit to the Agency and the ministry competent for health the data on the consumption of medicinal products received from the providers of healthcare programmes based on regulations governing the healthcare databases.
(8) Business entities providing the pharmacy activity shall submit to the Agency and the ministry competent for health the data on the purchasing and issue of medicinal products.
(9) Business entities providing the pharmacy activity and business entities retailing medicinal products in specialised stores shall submit to the Agency and the ministry competent for health the data on the purchasing and issue of medicinal products for which no prescription is required.
(10) Healthcare providers shall submit to the Agency and the ministry competent for health the data on the purchasing and consumption of medicinal products.
(11) Wholesalers shall report to the authority competent for veterinary medicine on the volume of sale of medicinal products for use in veterinary medicine and medicinal products for human use sold for exceptional use in veterinary medicine in the Republic of Slovenia.
(12) Veterinarian organisations and other organisations performing veterinary activity pursuant to the regulations on the veterinary activity and the authorised manufacturers of medicated feedingstuffs must report on the marketing of medicinal products upon the request of the authority competent for veterinary medicine.
(13) The authority competent for veterinary medicine shall submit to the Agency the data from the eleventh and twelfth paragraph hereunder once a year.
(14) The data about the volume of sale, purchase, issue and consumption of medicinal products shall include the quantity of individual medicinal product and the selling and purchase value for the respective period. The detailed requirements, methods, frequency and periods of reporting data and data models for the communication and submission of data shall be determined by the Minister. In the field of medicinal products for veterinary medicine, these shall be determined by the minister competent for veterinary medicine.
Article 25
(Notification of data on the volume of prescribing and consumption of medicinal products)
(1) Healthcare providers shall on the request of the Agency notify the data about the volume of prescribing medicinal products and their consumption.
(2) Providers of veterinary activity and authorised manufacturers of medicated feedingstuffs shall report to the authority competent for veterinary medicine on the volume of prescribing and use of medicinal products.
(3) The minister shall prescribe the detailed method of notifying data referred to in this Article.
Article 26
(Off-label use of veterinary medicinal products)
(1) If no suitable veterinary medicinal product authorised for marketing in the Republic of Slovenia is available to treat the disease state of certain animal species, the veterinary responsible for the treatment of animals may, especially in order to prevent unacceptable suffering of animals, exceptionally use medicinal products without marketing authorisation for the use in such species or to treat the disease state concerned, namely:
a medicinal product for human use or treat by another medicinal product for veterinary use authorised for marketing in another EU Member State;
if none of the medicinal products referred to in the previous indent is available, the medicinal product shall be prepared by the authorised persons according to the conditions of the veterinary prescription.
(2) More detailed conditions of use and off-label use of veterinary medicinal products, and the tasks related to off-label use carried out by the authority competent for veterinary medicine shall be determined by the minister competent for veterinary medicine.
Article 27
(Responsibilities)
(1) Marketing authorisation holder for the Republic of Slovenia shall be responsible for the development and placing of the medicinal product on the market according to the marketing authorisation and any damage arising in this relation, including the damage resulting from inadequate quality of the medicinal product which is the responsibility of the manufacturer.
(2) If the marketing authorisation holder is not the manufacturer of the medicinal product, it shall have concluded an agreement with the manufacturer in order to provide that the medicinal product is manufactured according to the applicable regulations and the manufacturing processes stated in the documentation for acquiring and maintaining a medicinal product marketing authorisation.
(3) The manufacturer of a medicinal product, putting it on the market, shall be responsible for the manufacture, quality control, packaging and labelling of a medicinal product irrespective of whether medicinal product was manufactured by itself or on its behalf by a third party.
(4) The manufacturer of the medicinal product shall be responsible for the damage caused by inadequate quality of the medicinal product even if it is proved that it would not be possible to discover the defect, in view of the current level of global science and technological development in the moment the medical product was placed on the market.
(5) The manufacturer who removed or covered the safety feature on the medicinal product and replaced with a new one shall be responsible for the damage caused by falsification if it is established that the safety feature was removed or covered on a falsified medicinal product.
(6) A marketing authorisation holder, manufacturer, healthcare provider and healthcare professional shall not be responsible for the consequences of treatment arising from the use of medicinal product which is not in accordance with the issued marketing authorisation or the use of medicinal product without a marketing authorisation, if such use was recommended or requested by the Agency or the ministry competent for health or the ministry competent for veterinary medicine in the event of the spread of pathogenic substances, toxins, chemical substances or nuclear radiation which could be harmful to the health of humans or animals or damage the environment.
Article 28
(Pharmacopoeia)
(1) Medicinal products marketed in the Republic of Slovenia must be manufactured and controlled according to the requirements of the European Pharmacopoeia and the Slovenian national supplement thereof.
(2) The notification of the validity of the European Pharmacopoeia and the Slovenian national supplement thereof shall be published by the Agency in the Official Gazette of the Republic of Slovenia.
(3) Should the European Pharmacopoeia and the Slovenian national supplement thereof not prescribe the methods of manufacture and requirements concerning quality of medicinal products concerned, such medicinal products may be manufactured and controlled according to the methods and requirements of pharmacopoeias of other EU Member States. Should the pharmacopoeias of other EU Member States not prescribe the methods of manufacture and requirements concerning quality of medicinal products concerned, such medicinal products may subjected to the methods and requirements of the pharmacopoeias of third countries or to the methods proposed by the manufacturer of the medicinal product.
Article 29
(Expert advice)
The Agency may provide to the party or interested business entity, on its proposal, consultancy about the professional preparation of documentation within the relevant field of the Agency’s competence, taking into account the absence of the conflict of interest which may not have bearing on any subsequent different decision in the procedure, should the facts, circumstances or technical and scientific findings change in the meantime.
III. TESTING OF MEDICINAL PRODUCTS AND COMPASSIONATE USE OF MEDICINAL PRODUCTS
Article 30
(Testing of medicinal products)
(1) Prior to being placed on the market, a medicinal product must undergo analytical and non-clinical pharmacotoxicological tests as well as clinical trials in order to obtain the assessment of its quality, safety and efficacy.
(2) A medicinal product shall undergo analytical and pharmacotoxicological tests as well as clinical trials even after it has already been granted a marketing authorisation or has been marketed, if such testing is performed with the purpose of regular quality control of medicinal products or for acquiring additional data on that product.
(3) Analyses of medicinal products shall be conducted by business entities holding the relevant authorisation of the Agency for manufacture of medicinal products and analytical testing.
(4) Non-clinical pharmacotoxicological testing of medicinal products is performed by those business entities that meet the conditions regarding personnel, premises, equipment and documentation keeping in compliance with the principles and guidelines of good laboratory practice.
(5) Medicinal products are clinically tested by providers of healthcare or veterinary activity, having the required personnel authorised to prescribe medicinal products in accordance with the provisions and principles of good clinical practice.
(6) Data on analytical and non-clinical pharmacotoxicological tests as well as clinical trials represent a constituent part of the documentation for obtaining a marketing authorisation and, according to requirements, also for maintaining a marketing authorisation.
(7) Analytical and non-clinical pharmacotoxicological tests of medicinal products as well as clinical trials must correspond to contemporary scientific knowledge and principles of good practices. They must be described in such a manner in the documentation on the medicinal product referred to in the previous paragraph so that the tests can be repeated in order to ensure data comparability.
(8) The minister shall determine more detailed methods and procedures of analytical non-clinical pharmacotoxicological tests as well as clinical trials, the contents of the application for obtaining the authorisation for analytical testing of medicinal products and the conditions which the business entities testing medicinal products must satisfy as well as the procedures of their verification.
Article 31
(Analytical testing of a medicinal product)
(1) Analytical testing shall mean microbiological, chemical-physical and biological quality testing of a medicinal product in compliance with the principles and guidelines of good manufacturing practice.
(2) The aim of analytical testing is to obtain data in pharmaceutical development of a medicinal product and to define control of medicinal product’s constituents, packaging and finished product, the adequacy of manufacturing procedures as well as the stability of the active substances and the finished product.
Article 32
(Non-clinical pharmacotoxicological testing of a medicinal product)
(1) Non-clinical pharmacotoxicological testing of a medicinal product is the procedure for establishing the safety of a medicinal product and shall be carried out in compliance with the principles and guidelines of good laboratory practice.
(2) Non-clinical pharmacotoxicological testing must define pharmacodynamic, pharmacokinetic and toxicological properties demonstrated on laboratory animals, isolated organs and tissues and other pharmacological models, and foresee any possible effects in human beings or target animal species.
The non-clinical pharmacotoxicological testing concerning medicinal products for use in veterinary medicine must provide, in addition to the data specified in the previous paragraph, also the data on pharmacokinetics, especially metabolism and elimination of medicinal product residues and routine analysis method that can be applied to determine the level of such residues.
Article 33
(Clinical trials of a medicinal product)
(1) Clinical trials of a medicinal product for human use are trials involving healthy individuals and patients, with the purpose of demonstrating or ascertaining any clinical and pharmacological effects of the investigational medicinal product, demonstrating any adverse reactions to it, or investigating its absorption, distribution, metabolism and elimination during investigation with a view to proving its safety and efficacy in human use.
(2) Clinical trials of veterinary medicinal products are the organised study of the effect of a medicinal product on an animal organism with the purpose of demonstrating or ascertaining any clinical or pharmacological effects of the investigational veterinary medicinal product, demonstrating any adverse reactions to it, or investigating its absorption, distribution, metabolism, elimination and residues during investigation with a view to proving its safety and efficacy in target animal species.
(3) Advanced therapy medicinal product prepared on a non-routine basis may not be clinically tried.
Article 34
(Conditions for clinical trial of a medicinal product)
(1) A medicinal product can be submitted to clinical trials only after the submission of the results on analytical and non-clinical pharmacotoxicological testing of a medicinal product and in the event of investigating a medicinal product that has no impact on the subject’s germ line genetic identity.
(2) The procedure for clinical trial of a medicinal product which is described in the documentation submitted for obtaining marketing authorisation must correspond to the requirements stipulated under the fifth paragraph of Article 30 hereof and the principles and guidelines of good clinical practice in clinical trials adopted and published by the European Commission as well as the principles of human medical and veterinary ethics and the guaranteed protection of personal data.
Article 35
(Commencement of clinical trial of a medicinal product)
(1) The applicant for a clinical trial of a medicinal product can be either the sponsor of such clinical trial or its representative if the sponsor’s registered office is located outside the European Union in which case the representative’s registered office must be located in the European Union.
(2) Prior to the commencement of the clinical trial of a medicinal product, such trial must be notified to the Agency.
(3) Notwithstanding the provisions of the previous paragraph, an authorisation must be issued by the Agency before commencing clinical trials involving a human medicinal product for gene therapy, somatic cell therapy including xenogenic cell therapy and a medicinal product containing genetically modified organisms.
Article 36
(Liability insurance)
Prior to the commencement of the clinical trial, the applicant for such trial must take up liability insurance for any possible damage resulting from the trial of a medicinal product.
Article 37
(Approval and notification of a clinical trial)
(1) The Agency shall decide on the applications for the approval of a clinical trial of a medicinal product from the third paragraph of Article 35 hereof and the notification of the clinical trial of a medicinal product from the second paragraph of Article 35 hereof. Upon the request of the Agency, the committee from Article 4 hereof, operating in the area of clinical trials, shall issue an opinion on the proposed or notified clinical trial.
(2) The application for notification or approval of a clinical trial shall contain at least the data about the sponsor, the investigational medicinal product as well as the purpose and progress of the trial.
(3) The applicant shall enclose with the application from the previous paragraph for medicinal products for human use the opinion of the National Medical Ethics Committee within the ministry competent for health (hereinafter: NMEC).
(4) The Agency shall adopt a decision on the application for a clinical trial within two months of the day of receiving a complete application. For medicinal products obtained through a biotechnology process, the said deadline can be extended for further 30 days by a decision. If the application concerns human medicinal products for xenogenic cell therapy the deadline for the issue of a decision can be extended by the Agency up to 90 days. Clinical trial can commence once the decision on the approval of such clinical trial has been made final.
(5) The Agency decide on the notification of a clinical trial within two months of the day of receiving a complete notification application. If there is no response from the Agency it shall be deemed that the application for notification has been approved and the clinical trial can commence.
(6) In the procedure referred to in the third and fourth paragraph hereunder, the Agency may consider the assessment about the relevant clinical trial given by another EU Member State.
Article 38
(Changes in clinical trial of a medicinal product)
(1) In the case of any material changes to ongoing clinical trials of a medicinal product, the sponsor must notify the Agency thereof.
(2) The notified change can be introduced if the Agency does not issue a negative decision within 35 days of receiving a complete application for such change. In exceptional cases, this period of time may be extended to 60 days by the Agency, if such an extension is justified given the nature of the change or if the Agency has to consult the European Medicines Agency (hereinafter: EMA).
Article 39
(Discontinuation of a clinical trial on a medicinal product)
The Agency may, for the purpose of protecting public health or health of investigated subjects, order that a trial be temporarily or permanently discontinued.
Article 40
(Non-interventional clinical trial of a medicinal product)
(1) Any non-interventional clinical trial shall be notified by the sponsor to the Agency.
(2) The application for notification shall at least include the following data:
data on the medicinal product subjected to the trial,
data on the purpose of the trial,
for medicinal products for human use a positive opinion from the NMEC,
for non-interventional clinical trials of medicinal products for human use, for which the market authorisation holder must obtain prior consent referred to in Article 138 hereof, the relevant consent to the draft protocol and the non-interventional clinical trial protocol,
employer consents referred to in the sixth paragraph hereunder to the selection of physicians or veterinarians who will participate in the relevant non-interventional clinical trials,
anticipated period for the clinical trial with the appropriate reasoning should this period extend over one year,
an estimate of the value and structure of costs associated with the trial.
(3) The Agency shall adopt a decision on the notification of a clinical trial referred to in the first paragraph hereunder within two months of the day of receiving a complete application for notification.
If there is no response from the Agency it shall be deemed that the application for notification has been approved and the clinical trial can commence.
(4) The sponsor of the non-interventional clinical trial shall submit a report to the Agency on the progress, results and costs of the trial.
(5) The non-interventional clinical trial shall not promote the prescribing and use of the medicinal product. The patient or their guardian, or owner or keeper of an animal shall be informed of the inclusion in a non-interventional clinical trial. The inclusion of a patient in a non-interventional clinical trial may not be the reason for replacing the existing appropriate therapy.
(6) Prior to their participation in non-interventional clinical trials, a physician or veterinarian must obtain the consent of their employer, provided the latter is financed from public funds. Any payment to physicians or veterinarians for participation in non-interventional clinical trials during working hours shall be prohibited. Payment to physicians or veterinarians for participation in non-interventional clinical trials shall be limited to remuneration for work in their free time and costs incurred in relation thereto.
(7) During the non-interventional clinical trial the sponsor shall monitor the collected data and study any effect of the trial’s results on the risk-benefit balance of such medicinal product. Any new information that could affect the assessment of the balance shall be reported to the Agency, all EU Member States that have granted a marketing authorisation for the medicinal product and the competent committee of the EMA if the trial is performed in several EU Member States, as the case may be.
(8) At the request of the Agency, the sponsor shall submit the protocol and progress reports to the Agency and for medicinal products for human use to the competent bodies for medicinal products of the EU Member States where the trial is performed.
(9) Following the completed non-interventional clinical trial the holder of the marketing authorisation for medicinal products for human use that are subject to prior consent referred to in Article 138 hereof, shall submit to the Agency or the competent committee of the EMA, whenever the non-interventional clinical trial is performed in several EU Member States, the final report including an abstract for publication within 12 months after the completed gathering of data unless the Agency or the competent committee of the EMA withdraw the request in writing.
(10) When the marketing authorisation holder assesses that the results of the non-interventional clinical trial affect the provisions of the marketing authorisation, it shall submit to the Agency an application for a change in the marketing authorisation for a medicinal product pursuant to Article 62 hereof.
(11) After the commencement of the non-interventional clinical trial, the holder of the marketing authorisation for medicinal products for human use, for which the marketing authorisation holder shall obtain prior consent referred to in Article 138 hereof, shall submit to the Agency or the competent committee of the EMA, whenever the trial is performed in several EU Member States, any substantive change of the trial’s protocol before it is enforced.
(12) The minister shall determine detailed conditions for the performance of non-interventional clinical trials and the detailed content of the application related thereto.
Article 41
(Application for compassionate use of medicinal products)
(1) The compassionate use of a medicinal product application may be filed with the Agency by:
the applicant whose medicinal product is the subject of an application for a centralised marketing authorisation;
the sponsor of a clinical trial if the medicinal product is undergoing clinical trial to obtain a marketing authorisation under a centralised procedure.
(2) The application from the previous paragraph shall contain the following evidence, statements and attachments:
the medicinal product is the subject of an application for a centralised marketing authorisation or is undergoing clinical trial for the purpose of obtaining a marketing authorisation under a centralised procedure;
the medicinal product is not authorised for marketing in any EU Member State, but is authorised for marketing in a third country that has equivalent requirements concerning quality, safety and efficacy of medicinal products, and is accompanied by a report on quality analysis of a medicinal product;
the medicinal product constitutes a significant therapeutic, scientific and technical innovation;
the medicinal product is intended for a group of patients with a chronically or seriously debilitating disease who cannot be treated satisfactorily by authorised medicinal products;
the manufacturer of the medicinal product submits a statement obligating them to supply the medicinal product even one year after the conclusion of the compassionate use programme to all patients included in the programme of compassionate use in the Republic of Slovenia even if, after the expiry of the projected programme supply period, public funds are not provided for this medicinal product, provided that the patients’ benefit of the treatment with such medicinal product is documented according to the protocol referred to in indent 6 of this paragraph;
the protocol of treatment with the medicinal products for compassionate use in written or electronic form, which shall contain the criteria for the start of treatment, monitoring of treatment efficacy, the criteria for continued treatment and monitoring of adverse reactions to treatment, and which shall be prepared or approved by the competent clinical department;
a statement of the manufacturer of the medicinal product that the medicinal product from the programme of compassionate use is free of charge and they themselves cover all additional costs of supplying the relevant medicinal product, including the costs of wholesale of the medicinal product from the programme;
a manufacturer’s statement that the outer packaging shall clearly state that the medicinal product is for compassionate use of a medicinal product.
(3) If a medicinal product is undergoing clinical trial referred to in the second indent of the first paragraph hereunder, the application shall contain a positive opinion of the NMEC.
Article 42
(Compassionate use authorisation)
(1) The Agency shall decide on the issue of compassionate use of a medicinal product authorisation in 30 days of receiving a complete application.
(2) Pursuant to Article 83 of Regulation (EC) No 726/2004 the Agency shall obtain an opinion of the Committee for Medicinal Products of the EMA. The deadline referred to in the previous paragraph shall not apply until such opinion is obtained.
(3) The minister shall determine in greater detail the conditions, the contents of the application, the method and the procedure for obtaining a compassionate use authorisation for a medicinal product.
IV. MARKETING AUTHORISATION
Article 43
(Applicant for a marketing authorisation)
(1) The procedure for the issue of marketing authorisation shall begin with the submission of an application by a business entity with registered office in the European Union. This can be either the manufacturer of the medicinal product or another business entity that has concluded a written agreement with the manufacturer of the medicinal product.
(2) The applicant shall be responsible for the adequacy and authenticity of documents and the accuracy of the submitted data.
Article 44
(Application for a marketing authorisation)
(1) The application for a marketing authorisation shall comprise the following documentation:
1. General part, including data on the manufacturer of the medicinal product, a written certificate of the manufacturer of the medicinal product that they have inspected the compliance of the manufacturing of active substance with the principles and guidelines of good manufacturing practice, the summary of the pharmacovigilance system, the risk management plan proportionate to the established and potential risks that shall be introduced by the applicant for marketing authorisation of the respective medicinal product, accompanied by a summary of the plan, data on the medicinal product, data on all previously issued or rejected marketing authorisations, including the specifics and reasons for rejection or the revocation of the marketing authorisation, the summary of product characteristics, package leaflet, draft packaging, data on the status of orphan medicinal products, if obtained, expert reports and summaries, estimates of risk-benefit balance, environmental risk assessment and other data necessary for public health protection;
2. Pharmaceutical-chemical and biological part including data on quality and quantity of the composition, description of the method of manufacturing, quality control of starting materials, quality control carried out at intermediate stages of the manufacturing process, quality control of the finished product and stability studies;
3. Non-clinical pharmacotoxicological part, including data on the pharmacodynamic and pharmacokinetic properties of a medicinal product, its toxicity and effect on the reproductive function, data on embryo-foetal toxicity, mutagenic potential and carcinogenic potential, data on local tolerance and excretion. The pharmacotoxicological part of the documentation related to veterinary medicinal products should also include data on residues and proposed withdrawal periods and data on environmental risks;
4. a clinical part, including general data on trials, how they have been carried out and ensuing results, clinical and pharmacological data, data on bioavailability or bioequivalence (if required), clinical safety and efficacy, documentation on exceptional circumstances in trials (if required) and data on experience with the product gained in other countries which have authorised marketing.
(2) On the request of the Agency the applicant shall also submit samples of medicinal products that are subject to the proposed marketing authorisation and reference standards.
(3) The competent minister shall determine more specific conditions, form and content of the application and documentation required for the issue of marketing authorisation.
Article 45
(Abbreviated application for marketing authorisation for a medicinal product for human use and period of protection)
(1) Notwithstanding the provisions of the previous paragraph, the applicant need not submit the results of non-clinical pharmacotoxicological tests or clinical trials, if proven that the subject of the procedure is a generic medicinal product whose reference medicinal product has been granted marketing authorisation in the Republic of Slovenia or the European Union at least eight years earlier.
(2) A generic medicinal product referred to in the previous paragraph may not be marketed for ten years after obtaining the marketing authorisation for the reference medicinal product.
(3) If the reference medicinal product referred to in the first paragraph hereunder did not obtain marketing authorisation in the Republic of Slovenia, the applicant shall state in the application for obtaining marketing authorisation the EU Member State in which such authorisation had been obtained. The Agency shall obtain from the competent authority of the selected EU Member State a certificate of issued marketing authorisation for the reference medicinal product concerned and the qualitative and quantitative particulars of the reference medicinal product composition and, if necessary, any other relevant documents.
(4) The ten-year period referred to in the second paragraph hereunder shall be extended to a maximum of 11 years if, during the first eight years of the period the marketing authorisation holder obtains an authorisation for one or more new therapeutic indications which are established to bring a significant clinical benefit for the patient in comparison with existing therapies.
(5) If various salts, esters, ethers, isomers, mixed isomers, complexes or active substance derivatives differ considerably in terms of safety or efficacy or both, the applicant shall submit additional information on the safety or efficacy of various salts, esters or active substance derivatives of the medicinal product that has been authorised for marketing. Different oral forms with immediate release are considered to be the same pharmaceutical forms. Bioavailability studies need not be submitted if so stipulated by the EMA instructions prepared in accordance with the scientific and technical knowledge.
(6) If a medicinal product does not correspond to the definition of a generic medicinal product or if bioequivalence cannot be proven by means of bioavailability studies or in case of changes in the active substances, indications, strength, pharmaceutical form or method of administration in respect to the reference medicinal product, it shall be necessary to submit the results of the relevant non-clinical pharmacotoxicological studies or clinical trials.
(7) If the active substance of the medicinal product has a well-established medicinal use and the application has been submitted for a new indication for which significant non-clinical pharmacotoxicological studies or clinical trials have been submitted, a non-cumulative one-year period of data protection shall apply in addition to the provisions of the first through fourth paragraphs hereunder, preventing other applicants from referring to this part of the documentation.
(8) Notwithstanding the provisions of regulations governing patent rights or rights of an additional protection certificate for a medicinal product, the implementation of studies required for the fulfilment of requirements of the present Act and other requirements related to the acquisition of a marketing authorization, shall not be deemed a violation of patent rights or rights of an additional protection certificate for medicinal products.
(9) The provisions on the periods of protection shall not apply to reference medicinal products for which an application for marketing authorisation was submitted by 30 October 2005. These applications shall be subject to the period of data protection that applied on the day the application was submitted in the EU Member State which authorised the reference medicinal product.
Article 46
(Abbreviated application for marketing authorisation for a medicinal product for veterinary use and period of protection)
(1) Notwithstanding the provisions of Article 44 of this Act, the applicant need not submit the results of non-clinical pharmacotoxicological tests or clinical trials nor the results of residue tests, if proven that the subject of the procedure is a generic medicinal product whose reference medicinal product has been granted marketing authorisation in the Republic of Slovenia or the European Union at least eight years earlier.
(2) A generic medicinal product referred to in the previous paragraph may not be marketed for ten years after obtaining the marketing authorisation for the reference medicinal product.
(3) If the reference medicinal product referred to in the first paragraph hereunder did not obtain marketing authorisation in the Republic of Slovenia, the applicant shall state in the application for obtaining marketing authorisation the EU Member State in which such authorisation had been obtained. The Agency shall obtain from the competent authority of the selected EU Member State a certificate of issued marketing authorisation for the reference medicinal product concerned and the qualitative and quantitative particulars of the reference medicinal product composition and, if necessary, any other relevant documents.
(4) The ten-year period referred to in the second paragraph hereunder shall be extended to a maximum of 13 years in respect of veterinary medicinal products for fish, bees and other animal species stipulated by the European Commission, if during the first eight years of the ten-year period referred to in the second paragraph hereunder, the marketing authorisation holder obtains an authorisation for one or more new therapeutic indications which are established to bring a significant clinical benefit in comparison with existing therapies.
(5) In veterinary medicinal products foreseen for one or more species of food producing animals which contain new active substances and have not been allowed in the European Union before 30 April 2004, the ten-year period stipulated by the second paragraph of Article 48 hereof shall be extended by one year in each case of extension to the marketing authorisation for another species of food producing animals, provided that such extension to the marketing authorisation is obtained within five days of issuing the first marketing authorisation for the medicinal product.
(6) The period stipulated by the second paragraph hereunder, together with any extensions under the previous paragraph may not be longer than 13 years which also applies to the extension to marketing authorisation for the medicinal product related to four or more species of food producing animals.
(7) The extension of the ten-year period to 11, 12 or 13 years for a veterinary medicinal product, foreseen for food producing animals, shall only be granted if the marketing authorisation holder has previously submitted the application for determination of maximum residue limit for those species covered by the marketing authorisation for the medicinal product.
(8) If various salts, esters, ethers, isomers, mixed isomers, complexes or active substance derivatives differ considerably in terms of safety or efficacy, the applicant shall submit additional information on the safety or efficacy of various salts, esters or active substance derivatives of the medicinal product that has been authorised for marketing. Different oral forms with immediate release are considered to be the same pharmaceutical forms. Bioavailability studies need not be submitted if so stipulated by the relevant instructions prepared in accordance with the scientific and technical knowledge.
(9) If a medicinal product does not correspond to the definition of a generic medicinal product or if bioequivalence cannot be proven by means of bioavailability studies or in case of changes in the active substances, indications, strength, pharmaceutical form or method of administration in respect to the reference medicinal product, it shall be necessary to submit the results of the relevant non-clinical pharmacotoxicological studies or clinical trials and the results of the safety trials and residues of the medicinal product.
(10) Notwithstanding the provisions of regulations governing patent rights or rights of an additional protection certificate for a medicinal product, the implementation of studies required for the fulfilment of requirements of the present Act and other requirements related to the acquisition of a marketing authorization, shall not be deemed a violation of patent rights or rights of an additional protection certificate for medicinal products.
(11) The provisions on the periods of protection shall not apply to reference medicinal products for which an application for marketing authorisation was submitted by 30 October 2005. These applications shall be subject to the period of data protection that applied on the day the application was submitted in the EU Member State which authorised the reference medicinal product.
Article 47
(Well established use of a medicinal product for human use)
(1) Notwithstanding the provisions of Article 44 hereof, the applicant need not submit own data on non-clinical pharmacotoxicological tests or clinical trials if it is able to prove that the active substance of the medicinal product for the relevant indication has a well-established medical use with recognised efficacy and an acceptable level of safety, and that it has been used on the territory of the European Union in appropriate scope for at least ten years and if sufficient publicly accessible expert literature on the characteristics and use of medicinal products with the active substance in question assures sufficient data for the assessment of the safety and effectiveness of the medicinal product. In such case, adequate data from the available literature shall be submitted in the application instead of own data.
Article 48
(Well established use of a medicinal product for veterinary use)
(1) Notwithstanding the provisions of Article 44 of this Act, the applicant need not submit own data on non-clinical pharmacotoxicological tests or clinical trials nor the results of residue tests of the veterinary medicinal products, if proven that the active substance of the medicinal product for the relevant indication has a well-established veterinary use, with recognised efficacy and an acceptable level of safety, and that it has been used on the territory of the European Union in appropriate scope for at least ten years and if sufficient publicly accessible expert literature on the characteristics and use of medicinal products with the active substance in question assures sufficient data for the assessment of the safety and effectiveness of the medicinal product. In such case, adequate data from the available literature shall be submitted in the application instead of own data and the applicant may also use the report on the assessment of the application for the establishment of maximum residue limits which is conducted and published by the EMA according to Regulation (EC) 470/2009.
(2) If the applicant has used scientific literature for obtaining marketing authorisation for a veterinary medicinal product for use in food producing animals and has submitted, in respect of the same medicinal product and for the needs of obtaining authorisation for another species of food producing animals, new studies on medicinal product residues in accordance with Regulation 470/2009/EC together with further clinical trials, then a three-year period of data protection shall apply in addition to the provisions of Article 46 hereof, preventing other applicants from referring to this part of the documentation.
Article 49
(Combination of active substances)
(1) If the marketing authorisation application concerns new medicinal products containing active substances present in the medicinal products for which marketing authorisations have already been issued, however, not hitherto used in the proposed combination of active substances for therapeutic purposes, the results of non-clinical pharmacotoxicological tests and of clinical trials relating to that combination shall be provided in the marketing authorisation application, but it shall not be necessary to provide references relating to each individual substance.
(2) In addition to the data from the previous paragraph, the marketing authorisation application for veterinary medicinal products must also contain the results of safety and residue tests, if so assessed by the applicant or required by
Article 50
(Approved use of documentation)
Holder of a marketing authorisation valid in the Republic of Slovenia may authorise the use of data from the pharmaceutical, chemical, biological, non-clinical pharmacotoxicological and clinical part of documentation for veterinary medicinal products as well as data from the documentation on safety and residue tests which is a constituent part of the application on the basis of which the marketing authorisation has been obtained, for compiling or processing the subsequent applications for other medicinal products with the same qualitative and quantitative composition in terms of active substances and the same pharmaceutical form.
Article 51
(Exceptional circumstances)
Notwithstanding the provisions of Article 44 of this Act and in exceptional circumstances related to immunological medicinal products for the use in veterinary medicine, the applicant need not submit the results of certain on-the-field tests carried out in the target species if such tests cannot be carried out because of well-grounded reasons.
Article 52
(Herbal medicinal products and traditional herbal medicinal products)
(1) Marketing authorisation for herbal medicinal products must be obtained pursuant to Articles 43 to 50 hereof.
(2) Notwithstanding the previous paragraph, a simplified procedure for obtaining the marketing authorisation (hereinafter: the traditional medicine registration procedure) shall be applied to a traditional herbal medicinal product, provided that it meets the following requirements:
it has therapeutic indications, suitable for traditional herbal medicinal products only, which, by virtue of their composition and purpose, are intended for self-medication;
it can only be used in accordance with the prescribed strength and dosage;
it is intended for oral or external use or for inhalation;
the period of its traditional use has expired;
the data on the traditional use of medicinal product must be sufficient; in particular, it must be proved that the product is not harmful if used as foreseen and that the pharmacological effects or efficacy of the medicinal product are probable on the basis of long-term use and experience.
(3) Traditional herbal medicinal products may also contain vitamins and minerals provided that there exists documented evidence on their safety and that such vitamins and minerals support the activity of herbal substances in terms of the stated therapeutic indications.
(4) If the Agency establishes that the traditional herbal medicinal product meets the conditions for obtaining the marketing authorisation or registration for the homeopathic medicinal product, the provisions applicable to traditional herbal medicinal product hereunder shall not apply.
(5) The application for acquiring the marketing authorisation for traditional herbal medicinal products under the traditional medicinal product registration procedure shall be comprised of a general part of documentation and the pharmaceutical-chemical and biological documentation in accordance with the first and the second item of the first paragraph of Article 44 hereof, except for the summary of the pharmacovigilance system and the plan for risk management. Instead of data referred to in items 3 and 4 of the first paragraph of Article 44 of this Act, the following shall be submitted:
Bibliographic or expert evidence that the medicinal product concerned, or other appropriate medicinal product had been used for medical purposes for at least 30 years prior to the date of application, of which at least 15 years in the European Union. If a medicinal product had been used in the European Union for less than 15 years and nevertheless meets the conditions prescribed for traditional herbal medicinal products, the Agency shall submit evidence of long-term use of such medicinal product or another adequate medicinal product to the EMA; and
Bibliographic overview of data on the safety, together with the expert opinion submitted by the applicant and, if requested by the Agency, other data needed for the assessment of safety of the medicinal product.
(6) More detailed conditions, form and content of the required documentation in the procedures for obtaining, modifying, extending, transferring and cancelling the marketing authorisation for a traditional herbal medicinal product, as well as the method of labelling and advertising traditional herbal medicinal products shall be determined by the competent minister.
Article 53
(Homeopathic medicinal products)
(1) Marketing authorisation for homeopathic medicinal products must be obtained pursuant to Articles 43 to 50 hereof.
(2) Notwithstanding the previous paragraph, a simplified procedure for obtaining the marketing authorisation (hereinafter: the homeopathic medicinal product registration procedure) shall be applied to homeopathic medicinal products for external or oral use, provided that they meet the following requirements:
The outer packaging and the package insert, if attached, do not indicate any therapeutic indication or information relating to them, and
Have a sufficient degree of dilution to guarantee the safety of the product, as stipulated by the regulations applicable to homeopathic medicinal products.
(3) The application for obtaining the marketing authorisation for homeopathic medicinal products under the homeopathic medicinal product registration procedure shall contain:
a general part, including data on medicinal product, data on the manufacturer, data on the applicant, data on issued registrations or marketing authorisations in other EU Member States for the same medicinal product, one or several samples of packaging or drafts of immediate or outer packaging and package insert;
documentation describing how homeopathic substances are obtained and controlled and justification of their homeopathic nature;
documentation on the manufacturing and control of each pharmaceutical form with a description of dilution or potentiation;
data on the stability of the final product;
documentation on the safety of homeopathic medicinal products.
(4) More detailed conditions, form and content of the required documentation in the procedures for obtaining, modifying, extending, transferring and cancelling the marketing authorisation for a homeopathic medicinal product, as well as the method of labelling and advertising homeopathic medicinal products shall be determined by the competent minister.
Article 54
(Emergency procedures)
(1) Notwithstanding the provisions of Articles 44 through 51 hereof, the Agency may, in order to protect public health and animal health in the event of a threat to human life or health, issue ex officio a temporary marketing authorisation on the basis of the facts established in the valid marketing authorisation for the medicinal product concerned in the Member State and the report on the assessment of medicinal product obtained from the body competent for medicinal products in the selected EU Member State, if available.
(2) The Agency shall inform the marketing authorisation holder in the Member State of the European Union in which the medicinal product concerned is authorised for marketing of the application to issue a marketing authorisation referred to in the previous Paragraph.
(3) A business entity holding a temporary marketing authorisation referred to in the first paragraph hereunder shall be responsible for labelling, package insert, summary of the product characteristics, advertising and pharmacovigilance system.
Article 55
(Procedure for obtaining marketing authorisation)
(1) The Agency shall verify the completeness of the application for marketing authorisation within 30 days of receiving it.
(2) The applicant shall enclose with the application, if requested by the Agency the samples of the medicinal product, its starting materials and, if need be, its intermediates, intermediate products and other materials, which will be submitted to the official control laboratory for establishing the adequacy and reproducibility of control methods used by the manufacturer.
(3) During the evidence-taking procedure prior to the issue of marketing authorisation, the Agency may order analytical testing of medicinal products in the official control laboratory, assessment of adherence to good practices by business entities stated in the documentation, verification of analytical methods aimed at discovering and defining residues of veterinary medicinal products, request additional data and explanations or other relevant evidence.
(4) In the fact-finding proceedings before the issue of the marketing authorisation, the Agency shall assess the quality, safety and efficacy of the medicinal product and the risk-benefit balance, check the compliance with the principles and guidelines of good practices at manufacturers and investigation institutions, indicated in the documentation, and compile a report on the assessment of the medicinal product.
(5) In the fact-finding proceedings, the Agency may obtain the opinion of the committee from Article 4 hereof and an additional opinion of individual external experts from Article 4 hereof regarding the adequacy of documents, individual parts or the complete submitted documentation for the assessment of the risk-benefit balance.
(6) The Agency shall adopt a decision on the application for marketing authorisation within 210 days of receiving a complete application and publish or enable access to a public report on the medicinal product on its website.
(7) Marketing authorisation shall, as a rule, be issued for a period of five years, unless otherwise determined by this Act.
Article 56
(Mutual recognition)
(1) Notwithstanding the provisions of the previous Article, the Agency shall issue or reject the issue of marketing authorisation in the application for obtaining marketing authorisation according to the mutual recognition procedure or the decentralised procedure, in which the Republic of Slovenia is the EU Member State concerned, on the basis of the assessment report compiled by the reference EU Member State.
(2) The competent minister shall lay down the detailed conditions for the mutual recognition procedure, the decentralosed procedure and the procedure from the previous Article.
Article 57
(Referral procedure)
(1) The Agency may initiate the referral procedure on behalf of the Republic of Slovenia before the competent committee of the European Union with the aim of protecting public health, animal health or environmental protection:
when it cannot approve the report on the assessment of medicinal product from the first paragraph of the previous Article;
when EU Member States have already adopted various decisions related to the marketing authorisation for a certain medicinal product or suspended or withdrew it temporarily;
when this is in the interest of the European Union for pharmacological reasons; or
when the Agency assesses that the marketing authorisation for a medicinal product must be amended.
(2) The competent minister shall lay down the detailed conditions and the procedures for the referral procedure from the previous paragraph.
Article 58
(Marketing authorisation with special conditions)
(1) In exceptional circumstances and following consultation with the applicant, the Agency may grant authorisation under special conditions, in particular concerning product safety, notification of the relevant authorities of the European Union and the EU Member States of any incident relating to its use, and action to be taken. Such authorisation can only be issued if the applicant proves that it cannot submit more detailed data from Article 44 hereof for objective and verifiable reasons (e.g. current state of scientific discoveries, area of treatment of rare illnesses, principles of medical ethics). If necessary, the marketing authorisation shall stipulate the deadlines for fulfilling these conditions.
(2) Each year, the Agency shall check the fulfilment of the conditions from the marketing authorisation for a medicinal product from the previous paragraph.
(3) The Agency may on well-substantiated grounds direct holders that have previously been issued a marketing authorisation in accordance with the law to conduct a study on the safety and/or efficacy of the medicinal product, including also written objectives and deadlines for submitting and implementing the study.
(4) The marketing authorisation holder can submit to the Agency, within the deadline set by the Agency, written explanations in response to the imposed obligation from the previous paragraph, provided that the marketing authorisation holder asks for this within 30 days imposition of obligation. Based on the submitted written explanations, the Agency shall decide on the execution of a study on the safety and/or efficacy of the medicinal product.
(5) Based on the obligation to conduct the study from the third paragraph hereunder and considering the previous paragraph, the Agency issues the marketing authorisation by including the imposed obligation as a condition in such marketing authorisation.
(6) The Agency shall on its website publish a list of medicinal products hereunder and the conditions and deadlines for fulfilling them.
(7) The marketing authorisation holder shall include the conditions and obligations from the first, third and fifth paragraphs hereunder, related to the safety of medicinal product, in its risk management system.
(8) Detailed conditions from the first, third and fifth paragraphs hereunder are laid down by the competent minister.
Article 59
(Umbrella marketing authorisation)
(1) Notwithstanding the fact whether a separate marketing authorisation is issued for additional strengths, pharmaceutical forms, indications, routes of administration, packaging or other changes or extensions to the marketing authorisation, or if they are part of the underlying authorisation, all such marketing authorisations, and in the case of veterinary medicinal products also addition of another species, shall be treated as part of the same umbrella marketing authorisation.
(2) The umbrella marketing authorisation is used particularly for the needs of implementing the provisions from Articles 45 and 46 of this Act.
Article 60
(Refused issue of marketing authorisation)
(1) The issue of marketing authorisation shall be withheld if, during the examination of the documents and data, the Agency establishes that:
the risk-benefit balance of the use of medicinal product is not favourable;
the applicant did not provide sufficient evidence in support of the quality, safety and therapeutic efficacy of the medicinal product;
its qualitative and quantitative composition is not in compliance with the documentation;
the label or the package insert, submitted by the applicant, is not in accordance with this Act and the regulations adopted on the basis hereof;
the indications in the documentation do not correspond to the actual state; or
the data in the documentation are not compliant with Articles 44 through 50 hereof.
(2) The marketing authorisation for a veterinary product shall be withheld by the Agency in the cases from the previous paragraph and if it establishes that:
the efficacy of the medicinal product is insufficiently substantiated or that the medicinal product is not efficient;
the withdrawal period recommended by the applicant is not long enough to ensure that foodstuffs obtained from the treated animal do not contain residues which might constitute a health hazard to humans, or is insufficiently substantiated;
the medicinal product represents an environmental risk;
the medicinal product is offered for use that is prohibited under the applicable EU regulations; or
the medicinal product is intended for use in one or more species of food producing animals and contains one or more active substances which are not allowed and are listed in the Annex to Commission Regulation (EU) No 37/2010 or are not listed in the Annexes to Commission Regulation (EU) No 37/2010.
(3) The marketing authorisation for traditional herbal medicinal product shall be rejected in cases referred to in the first paragraph hereunder and also, if it is established:
that its therapeutic indications are not in line with the prescribed conditions;
that the data on the traditional use of medicinal product are insufficient; in particular, the pharmacological effects or efficacy of the medicinal product are not probable on the basis of long-term use and experience.
(4) The marketing authorisation for homeopathic medicinal product shall be rejected in cases referred to in the first paragraph hereunder and also, if it is established that the homeopathic medicinal product for which the application for obtaining the marketing authorisation under the simplified procedure has been filed does not meet the conditions from the second paragraph of Article 53 hereof.
Article 61
(Period for the placement of medicinal product on the market)
(1) If the medicinal product with the same proprietary name has not been placed on the market on the territory of the Republic of Slovenia for three consecutive years after the entry into force of marketing authorisation for the medicinal product, such marketing authorisation shall be withdrawn.
(2) If the medicinal products with the same proprietary name, to which the Agency issued the marketing authorisation and have previously been placed on the market but none of which has been marketed in the period of three consecutive years, such marketing authorisation shall be withdrawn.
(3) Notwithstanding the provisions of the first and the second paragraphs hereunder, the Agency shall be entitled not to cancel marketing authorisation in justified well-justified cases and for the needs of uninterrupted supply of medicinal products or protecting public health even if the medicinal product has not been actually marketed for three consecutive years after the issue of marketing authorisation.
(4) The Agency shall inform the marketing authorisation holder of the intended revocation at least three months prior to the issue of a decision on revocation of marketing authorisation.
Article 62
(Amendments to marketing authorisation)
(1) After a marketing authorisation has been issued, the marketing authorisation holder shall, in respect of the methods of manufacture and control, take account of scientific and technical progress and introduce any variations that may be required to enable the medicinal product to be manufactured and checked by means of generally accepted scientific methods. The marketing authorisation holder must inform the Agency of any new information that could impact the variation of marketing authorisation or the change in documentation on a medicinal product.
(2) Marketing authorisation holder must inform the Agency of any data that could impact the assessment of the risk-benefit balance and particularly of any measures, restrictions or prohibitions introduced by other EU Member States. Information includes positive and negative results of clinical trials or other studies for all indications and populations, regardless of whether they have been included in the marketing authorisation or not, and data on the use of medicinal product when such use is not in the framework of conditions from the marketing authorisation.
(3) The marketing authorisation holder shall ensure that the information on the medicinal product be regularly supplemented with new scientific findings, including the decisions and recommendations published on the European web portal on medicinal products, established pursuant to Article 26 of Regulation (EC) 726/2004.
(4) The Agency may at any time request that the marketing authorisation holder submit a copy of the master file on the pharmacovigilance system within seven days of receiving the request.
(5) To change the conditions of the marketing authorisation for a medicinal product referring to the provisions of the first, second and third paragraphs hereunder, the marketing authorisation holder must submit an application to the Agency.
(6) The Agency shall accept or refuse the application for the change in marketing authorisation conditions within the deadlines and according to the procedure stipulated by the Regulation (EC) 1234/2008.
(7) The competent minister shall determine more specific conditions, form and content of the documentation required for the variation of marketing authorisation.
Article 63
(Extension of marketing authorisation)
(1) In order to extend the marketing authorisation for a medicinal product, the marketing authorisation holder must submit the application for its extension at least nine months prior to the expiry of the marketing authorisation for a medicinal product for human use and at least six months prior to the expiry of the marketing authorisation for a medicinal product for veterinary use.
(2) The validity of marketing authorisation can be extended after the expiry of the five-year period on the basis of the application for extending the marketing authorisation and reassessment of the risk-benefit balance of the use of medicinal product.
(3) The Agency shall adopt a decision on the extension of marketing authorisation within 90 days of receiving a complete application.
(4) Once the marketing authorisation has been extended for the first time, it shall, as a rule, be valid for an indefinite period of time or until the termination of validity stipulated hereby.
(5) Notwithstanding the previous paragraph, the Agency may, based on justified reasons related to the data from the pharmacovigilance system, including the insufficient number of patients exposed to a certain medicinal product, stipulate that the marketing authorisation is extended for a definite period of five years.
(6) The Agency shall accept or refuse the application for the extension of marketing authorisation according to the mutual recognition procedure or the decentralised procedure on the basis of the assessment report of the medicinal product compiled by the reference EU Member State.
(7) The competent minister shall determine more specific conditions, form and content of the documentation required for the extension of marketing authorisation.
Article 64
(Cancellation and variation of marketing authorisation for medicinal products for human use ex officio)
(1) The marketing authorisation for medicinal products for human use shall be suspended, revoked or amended if the Agency establishes that:
the medicinal product is harmful;
the therapeutic efficacy is lacking, i.e. when it is established that therapeutic results cannot be obtained with the medicinal product;
the risk-benefit balance is not favourable, or this is evident from the regular safety update report assessment or other data from the pharmacovigilance system;
If the marketing authorisation holder does not meet the conditions and obligations from the first and third paragraphs of Article 58 hereof;
its qualitative and quantitative composition is not as declared; the medicinal product was marketed contrary to the provisions of the marketing authorisation; or
the medicinal product was marketed contrary to this Act and the regulations issued on the basis hereof or the EU regulations on medicinal products.
(2) Marketing authorisation for medicinal products for use in human medicine shall also be suspended, revoked or amended if it is subsequently established that the particulars supporting the application are, incorrect, on the basis of applicable regulations, or have not been submitted or supplemented in accordance with such regulations, or where the prescribed controls have not been carried out.
(3) The Agency shall cancel or temporarily suspend the marketing authorisation for a medicinal product, a group of medicinal products or all medicinal products for human use which are produced on the basis of a manufacturing authorisation whenever any of the conditions of such manufacturing authorisation is not met.
(4) The Agency may cancel, suspend or amend the marketing authorisation for a medicinal product for human use if the marketing authorisation holder fails to meet the requirements pursuant to the regulations within the deadlines for the cancellation, suspension or variation of the marketing authorisation for the medicinal product concerned as set by the Agency.
(5) In case of urgent measures for the protection of public health, the Agency may temporarily suspend the marketing authorisation for human use and prohibit the use of the medicinal product concerned in the Republic of Slovenia. It shall inform the European Commission, the EMA and authorities competent for medicinal products in other EU Member States by no later than the following working day of the reasons for its actions. Suspension of the marketing authorisation and prohibition to use the medicinal product concerned apply until the Agency renders a decision, adopted ex officio based on measures adopted at the EU level.
(6) The Agency shall amend, suspend or cancel the marketing authorisation for a medicinal product for use in human medicine ex officio based on the adopted measures at the EU level, which in case of urgent action is induced by bodies competent for medicinal products of other EU Member States or of the European Commission.
Article 65
(Cancellation and variation of marketing authorisation for veterinary medicinal products ex officio)
(1) The marketing authorisation for medicinal products for veterinary use shall be suspended, revoked or amended if the Agency establishes that:
the assessment of the risk-benefit balance of such medicinal product is unfavourable in terms of the conditions of use as stated in the marketing authorisation, taking into account above all health and wellbeing of animals and safety of consumers in the event of marketing authorisation for use in zootechnics; the medicinal product does not have any therapeutic effect on the species of animal for which the treatment is intended;
its qualitative and quantitative composition is not as declared;
the recommended withdrawal period is inadequate to ensure that foodstuffs obtained from the treated animal do not contain residues which might constitute a health hazard for humans; the medicinal product is offered for sale or advertised for a use prohibited under other applicable regulations;
the data in the application are incompliant, incorrect, or have not been supplemented in accordance with the regulations, or where the prescribed controls have not been carried out;
the data from the documentation have not been changed in line with the scientific and technological development in the field of medicinal product manufacturing and control;
the competent authorities have not been submitted new information on any prohibitions or restrictions of the use of medicinal product in any EU Member State or new information on the risk-benefit balance;
the medicinal product was marketed contrary to the provisions of the marketing authorisation; or
medicinal product was marketed contrary to this Act and the regulations adopted on the basis hereof or the EU regulations on medicinal products.
(2) Marketing authorisation for medicinal products for use in veterinary medicine shall also be suspended, revoked or amended if it is subsequently established that the particulars supporting the application are, pursuant to relevant rules, incorrect, on the basis of applicable regulations, or have not been submitted or supplemented in accordance with such regulations, or where the prescribed controls have not been carried out.
(3) The Agency shall cancel or suspend the marketing authorisation for a group of medicinal products or all medicinal products for use in veterinary medicine which are produced on the basis of a manufacturing authorisation if any of the requirements of such manufacturing authorisation is not met and cancel or suspend the manufacturing authorisation for such group of medicinal products or all medicinal products.
(4) The Agency may cancel, suspend or amend the marketing authorisation of a medicinal product for use in veterinary medicine if the marketing authorisation holder fails to meet the requirements pursuant to the regulations within the deadlines it set.
(5) In case of urgent measures for the protection of public health, the Agency may temporarily suspend the marketing authorisation for use in veterinary medicine and prohibit the use of the medicinal product concerned in the Republic of Slovenia. It shall inform the European Commission, the EMA and authorities competent for medicinal products in other EU Member States by no later than the following working day of the reasons for its actions. Suspension of the marketing authorisation and prohibition to use the medicinal product concerned apply until the Agency renders a decision, adopted ex officio based on measures adopted at the EU level.
(6) The Agency shall amend, suspend or cancel the marketing authorisation for a medicinal product for use in veterinary medicine ex officio based on the adopted measures at the EU level, which in case of urgent action is triggered by authorities competent for medicinal products of other EU Member States or the European Commission.
Article 66
(Termination of validity of marketing authorisation)
(1) The validity of the marketing authorisation shall expire:
after the expiry of authorisation validity;
based on the applicants application for the cancellation of marketing authorisation; or
because of the withdrawal of the marketing authorisation for a medicinal product pursuant to Articles 64 or 65 hereof.
(2) The Agency shall initiate the procedure for the termination of validity of a marketing authorisation for a medicinal product referred to in indent 2 and 3 from the previous paragraph:
ex officio, or
based on the application of the relevant marketing authorisation holder.
(3) The competent minister shall determine the detailed content of the application and the procedure for the termination of marketing authorisation.
Article 67
(Sale of medicinal product following the amendment or expiry of validity of marketing authorisation)
(1) A medicinal product whose marketing authorisation has been amended and which has been manufactured, entered or imported prior to the notification or approval of amendment to the marketing authorisation may be marketed until the expiry date of such medicinal product, unless prohibited or stipulated otherwise by the Agency, based on the assessment of the risk-benefit balance, with the aim of protecting public health.
(2) A medicinal product whose marketing authorisation has expired or is no longer valid upon the proposal of the marketing authorisation holder for a medicinal product which has been manufactured, entered or imported prior to the expiry of marketing authorisation may be marketed until the expiry date of such medicinal product, subject to a proposal of the marketing authorisation holder, received by the Agency at least two months before the expiry of validity, but for no longer than 18 months after the expiry of the marketing authorisation, unless objected by the Agency in 30 days following the day of receipt of the proposal. The marketing authorisation holder shall commit, in its proposal, to provide for further implementation of pharmacovigilance tasks.
(3) The Agency may object to the proposal referred to in the previous paragraph or prohibit the sale of a medicinal product at any time within the 18-month period, based on the assessment of the risk-benefit balance in the interest of protecting public health.
Article 68
(Documentation as trade secret)
The documentation enclosed in the application for the issue of, amendment to or extension of a marketing authorisation is the property of the applicant and a trade secret, with the exception of data stated in the marketing authorisation, the summary of product characteristics of the medicinal product, its instructions for use and data on the packaging.
Article 69
(Publication of data on marketing authorisation for a medicinal product)
The Agency shall publish, on its website the data or links to the data on medicinal products for human use, for which a marketing authorisation has been issued or for which the validity of marketing authorisation has expired or has been amended, extended, suspended or revoked.
Article 70
(Transfer of marketing authorisation)
(1) A marketing authorisation holder may transfer its marketing authorisation to another business entity that meets the conditions stipulated herein.
(2) The competent minister shall prescribe the detailed procedure for the transfer of marketing authorisation stipulated in the previous paragraph and the documentation and procedure for verifying the prescribed conditions and other necessary evidence.
V. ADVANCED THERAPY MEDICINAL PRODUCTS PREPARED ON A NON-ROUTINE BASIS
Article 71
(Advanced therapy medicinal products)
(1) The marketing authorisation for advanced therapy medicinal products must be obtained according to the centralised procedure in line with Regulation (EC) 1394/2007 and Regulation (EC) 726/2004 except for advanced therapy medicinal products prepared on a non-routine basis, the preparation of which requires authorisation referred to in Article 83 hereof.
(2) Advanced therapy medicinal product prepared on a non-routine basis for human or veterinary use may be prepared by a business entity holding the Agency’s authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis in accordance with the quality standards and conditions for the preparation, stipulated hereby, in the framework of the issued authorisation. A medicinal product prepared on a non-routine basis is prepared on an individual written purchase order issued by a physician or veterinarian, which is a type of medical or veterinarian prescription on the basis of which a physician or veterinarian prescribes an advanced therapy medicinal product prepared on a non-routine basis for the treatment of a patient or an animal with the healthcare or veterinary activity provider.
(3) The holder of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis shall be responsible for the quality, safety and efficiency of advanced therapy medicinal products prepared on a non-routine basis.
(4) When an advanced therapy medicinal product contains human cells or tissues, the donation, procurement and testing of these cells or tissues is carried out pursuant to the regulations governing the supply of human cells or tissues intended for the treatment.
Article 72
(Conditions for the preparation of advanced therapy medicinal product prepared on a non-routine basis)
(1) A business entity that prepared advanced therapy medicinal products prepared on a non-routine basis shall fulfil the following conditions:
It shall employ an adequate number of experts with adequate qualifications depending on the extent and complexity of the preparation of the non-routine advanced therapy medicinal product;
It shall be equipped with adequate facilities, devices and equipment for the preparation, control, storage and transport of advanced therapy medicinal products prepared on a non-routine basis;
It shall appoint, from among the experts from item 1 hereunder a person responsible for the quality of advanced therapy medicinal products prepared on a non-routine basis who shall be responsible for ensuring that the preparation of the advanced therapy medicinal products prepared on a non-routine basis is in compliance with this Act and the implementing regulations based on it;
It shall maintain a quality assurance system that it updates regularly,
It shall mutatis mutandis comply with the guidelines and principles of good manufacturing practice, taking into account the specific features of advanced therapy medicinal products prepared on a non-routine basis and the produced risk assessment and shall ensure at least the standards stipulated in the regulations of the Republic of Slovenia covering the supply of human cells or tissues intended for treatment;
It shall have concluded adequate agreements with business entities providing materials and services that affect the quality and safety of advanced therapy medicinal products prepared on a non-routine basis, which specify the responsibilities and tasks, and professional qualification of all contracting parties;
It shall arrange, in accordance with good distribution practices, for the transport of advanced therapy medicinal products prepared on a non-routine basis to the client.
(2) Full traceability from the donor to the recipient of these medicinal products must be ensured for the preparation and use of advanced therapy medicinal products prepared on a non-routine basis containing or composed from human tissues and cells.
(3) The minister shall determine more detailed conditions regarding the employees, premises and equipment for the preparation of advanced therapy medicinal product prepared on a non-routine basis and the method of using the guidelines and the principles of good manufacturing practice in the preparation of advanced therapy medicinal products prepared on a non-routine basis.
Article 73
(Person responsible for quality)
The responsible person from item 3 of the first paragraph of the previous Article shall have a medical or veterinary degree or a degree in pharmacy or other relevant second cycle biomedical studies, or an equivalent degree corresponding to this level pursuant to the law, additional knowledge and skills in this area and at least two years of practical experience in the area of the preparation of advanced therapy medicinal products prepared on a non-routine basis.
Article 74
(Obligations of the holder of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis)
(1) A holder of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis shall:
Use material and reagents of appropriate quality in accordance with the principles and guidelines of good manufacturing practice and, if such do not exist, the material and reagents of the highest quality, based on expert justification;
Have established a risk management system which is mutatis mutandis compliant with the guidelines and principles of good manufacturing practice, taking into account the specific features of advanced therapy medicinal products prepared on a non-routine basis and the produced risk assessment and ensure at least the standards stipulated in the regulations of the Republic of Slovenia covering the supply of human cells or tissues intended for treatment;
Have established a quality control system for advanced therapy medicinal products prepared on a non-routine basis which is mutatis mutandis compliant with the guidelines and principles of good manufacturing practice, taking into account the specific features of advanced therapy medicinal product prepared on a non-routine basis and a risk assessment and ensure at least the standards stipulated in the regulations of the Republic of Slovenia covering the supply of human cells or tissues intended for treatment;
Ensure that all tests required for approving compliance with the specifications and standards are carried out on the samples of input material and the end product of advanced therapy medicinal product prepared on a non-routine basis or an intermediate product;
Issue the client a certificate of compliance for the preparation of advanced therapy medicinal products prepared on a non-routine basis with the specifications and standards provided by the authorisation holder;
Obtain a positive opinion of the NMEC for the preparation of individual groups of human medicinal products, namely separately for the medicinal products used for gene therapy, somatic cell therapy and tissue engineered products;
Pay special care to ensuring that all information on input material, intermediate products and final advanced therapy medicinal products prepared on a non-routine basis, including the data on incompatibility of individual components of a multi-component advanced therapy medicinal product prepared on a non-routine basis and the packaging, which are relevant for the assessment of safety, quality and efficiency, are true and are not misleading;
Ensure that the information referred to in the previous item and all records on the details of the preparation of advanced therapy medicinal products prepared on a non-routine basis are stored in such a form that they are available and readable for at least 30 years following the use of advanced therapy medicinal products prepared on a non-routine basis.
(2) A holder of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis may not:
Prepare advanced therapy medicinal products prepared on a non-routine basis that are not covered by the authorisation for preparation of non-routine advanced therapy medicinal products;
Prepare advanced therapy medicinal products prepared on a non-routine basis at locations and in facilities that are not specified in the authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis;
Prepare advanced therapy medicinal products prepared on a non-routine basis in premises not specified in the documentation used as the basis for the issue of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis;
Perform other activities in the same premises without having acquired the consent of the Agency;
Prepare advanced therapy medicinal products prepared on a non-routine basis which contain human tissues and cells if the donation, procurement of human tissues and cells and testing of donors of human tissues and cells had not been carried out in accordance with the fourth paragraph of Article 71 hereof;
Prepare advanced therapy medicinal products prepared on a non-routine basis for the purpose of clinical trials.
Article 75
(Reporting)
(1) The holder of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis shall submit to the Agency the annual report on its activities by 31 January of the current year for the previous year, which shall contain the following data:
number of advanced therapy medicinal products prepared on a non-routine basis;
prepared advanced therapy medicinal product prepared on a non-routine basis for advanced treatment for which the Agency has issued the authorisation;
number of patients or animals treated with individual advanced therapy medicinal product prepared on a non-routine basis;
name of the physician or veterinarian who prescribed the advanced therapy medicinal product prepared on a non-routine basis and is responsible for the monitoring of patient or animal;
name of the donor centre.
(2) A holder of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis for use in veterinary medicine shall submit the data on the medicinal product for veterinary use from the previous paragraph to the body competent for veterinary medicine within the deadline specified in the previous paragraph.
Article 76
(Exit and export and entry and import of advanced therapy medicinal product prepared on a non-routine basis)
Exit and export and entry and import of advanced therapy medicinal products prepared on a non-routine basis shall be prohibited.
Article 77
(Responsibility of the physician or veterinarian)
(1) A physician or veterinarian shall prescribe and use an advanced therapy medicinal product prepared on a non-routine basis subject to their exclusive professional liability.
(2) In the case of a provider of healthcare or veterinary services, the physician or the veterinarian prescribing and using advanced therapy medicinal products prepared on a non-routine basis shall cover their professional liability for potential damages caused to the patient or the animal in the amount of at least EUR 100,000.
(3) Before using an advanced therapy medicinal product prepared on a non-routine basis for a patient or the owner or keeper of an animal, the physician or veterinarian must inform the latter with the process of treatment and the risks involved in the treatment by advanced therapy medicinal products prepared on a non-routine basis. The physician or veterinarian shall store a statement signed by a patient or owner or keeper of animal that they have been duly informed, in the form available on the Agency’s website.
(4) Upon the use of an advanced therapy medicinal product prepared on a non-routine basis, the physician or veterinarian shall submit to the patient or owner or keeper of animal the package insert.
(5) The physician or veterinarian may not use the advanced therapy medicinal product prepared on a non-routine basis without the certificate of conformity of the preparation of advanced therapy medicinal products prepared on a non-routine basis with the specifications and guidelines and the principles of good manufacturing practice, issued by the holder of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis.
(6) The physician or the veterinarian prescribing and using an advanced therapy medicinal product prepared on a non-routine basis shall have established a system that enables traceability of the used advanced therapy medicinal product prepared on a non-routine basis for each patient or animal and product.
(7) The physician or veterinarian shall monitor the progress of treatment of a patient or animal for which an advanced therapy medicinal product prepared on a non-routine basis was used.
Article 78
(Register of physicians or veterinarians using advanced therapy medicinal products prepared on a non-routine basis for treatment)
(1) The physician or the veterinarian prescribing and using an advanced therapy medicinal product prepared on a non-routine basis shall be entered in the Agency register of physicians or veterinarians using advanced therapy medicinal products prepared on a non-routine basis for treatment.
(2) The application for entry in the register of physicians or veterinarians using advanced therapy medicinal products prepared on a non-routine basis for treatment shall be submitted to the Agency by the provider of healthcare or veterinary activity no later than 15 days prior to the beginning of prescribing and using advanced therapy medicinal products prepared on a non-routine basis and shall contain:
the name, surname, academic title and biographic and bibliographic details of physicians or veterinarians using advanced therapy medicinal products prepared on a non-routine basis for treatment, with appropriate specialisation;
the name and address of the provider of healthcare or veterinary activity in which the physician or veterinarian from the previous indent uses advanced therapy medicinal products prepared on a non-routine basis;
an insurance policy copy for covering the liability of a physician or veterinarian in accordance with the second paragraph of the previous Article.
(3) The provider of healthcare or veterinary activity shall inform the Agency of any change to the data indicated in the previous paragraph within seven days.
(4) The Agency shall delete a physician or veterinarian from the register referenced in the first paragraph hereunder upon a request of the provider of healthcare or veterinary activity from the previous paragraph.
(5) The minister shall determine in greater detail the procedure and the contents of the application for the entry into, change of or deletion from the register of physicians or veterinarians that use non-routine advanced therapy medicinal devices.
Article 79
(Labelling of advanced therapy medicinal product prepared on a non-routine basis)
(1) An advanced therapy medicinal product prepared on a non-routine basis must be adequately labelled and equipped with the package insert ensuring its traceability and correct and safe use.
(2) The competent minister shall determine the detailed requirements regarding the labelling of advanced therapy medicinal products prepared on a non-routine basis.
Article 80
(Traceability of advanced therapy medicinal products prepared on a non-routine basis)
(1) The holder of authorisation for the preparation of an advanced therapy medicinal product prepared on a non-routine basis shall set up and maintain a system that ensures traceability of advanced therapy medicinal products prepared on a non-routine basis and the input substances and raw materials, including the materials that come into contact with tissues and cells that can be contained in the advanced therapy medicinal products prepared on a non-routine basis, from the origin, through preparation, packaging, storage, transportation and up to the delivery to the provider of healthcare or veterinary activity in which the advanced therapy medicinal product prepared on a non-routine basis is used.
(2) The holder of authorisation for the preparation of an advanced therapy medicinal product prepared on a non-routine basis shall store data on traceability for at least 30 years after the expiry of the shelf life of an advanced therapy medicinal product prepared on a non-routine basis.
(3) The holder of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis shall ensure that the data on traceability is available to the Agency also in the event of revocation, cancellation or withdrawal of the authorisation. In case of bankruptcy or discontinuation of activity it shall deliver the data on traceability to
(4) The holder of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis must ensure that the system of traceability for an advanced therapy medicinal product prepared on a non-routine basis containing human tissues and cells supplements and is compatible with the requirements from Articles 8 and 14 of the Directive 2004/23/EC of the European Parliament and of the Council of 31 March 2004 on setting standards of quality and safety for the donation, procurement, testing, processing, preservation, storage and distribution of human tissues and cells (Official Journal L 102, 7. 4. 2004, p. 48), last amended by Regulation 596/2009/EC, and Articles 14 and 24 of the Directive 2002/98/EC of the European Parliament and of the Council of 27 January 2003 setting standards of quality and safety for the collection, testing, processing, storage and distribution of human blood and blood components and amending Directive 2001/83/EC (Official Journal, L 33, 8. 2. 2003, p. 30), last amended by Regulation 596/2009/EC.
Article 81
(Advertising of advanced therapy medicinal product prepared on a non-routine basis)
Advertising of advanced therapy medicinal products prepared on a non-routine basis, preparation of advanced therapy medicinal products prepared on a non-routine basis or treatment with advanced therapy medicinal products prepared on a non-routine basis shall be prohibited.
Article 82
(Pharmacovigilance of advanced therapy medicinal product prepared on a non-routine basis)
(1) The holder of authorisation for the preparation of advanced therapy medicinal product prepared on a non-routine basis shall have a pharmacovigilance system that supports the gathering and keeping of the documentation on all suspected adverse reactions of an advanced therapy medicinal product prepared on a non-routine basis pointed out by the physicians and patients or veterinarians or owners or keepers of animals, scientific evaluation of all information, monitoring safety or the risk-benefit balance, establishment of changes in the risk-benefit balance, studying the possibility to minimise or prevent risks, informing the Agency of identified new or changed risks and changed risk-benefit balances, and adoption of adequate measures.
(2) The holder of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis shall have at their disposal a qualified person responsible for pharmacovigilance, working under contract and being available at all times, who is responsible for the establishment and operation of the pharmacovigilance system.
(3) The person responsible for pharmacovigilance shall have a second cycle degree in medical or veterinary studies, or an equivalent degree corresponding to this level of knowledge pursuant to the law in the field of pharmacovigilance. If the person responsible for the pharmacovigilance does not have an adequate second cycle degree in medical or veterinary studies, or an equivalent degree corresponding to this level of knowledge pursuant to the law, they must receive permanent and uninterrupted professional support from a person with adequate education.
(4) The holder of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis shall, upon a written request of the Agency, submit a risk management plan in the area of pharmacovigilance with a description of activity in the pharmacovigilance system and measures for identifying, defining, preventing or minimising risks arising from advanced therapy medicinal product prepared on a non-routine basis, including the impact assessment of the indicated activities and measures.
(5) The holder of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis shall immediately and no latter later within 15 days of establishment, inform the Agency of all suspected adverse reactions of an advanced therapy medicinal product prepared on a non-routine basis pointed out by the physicians and patients or veterinarians, owners or keepers of animals.
(6) A physician or a veterinarian shall be obliged to report to the Agency, immediately and no later than within 15 days of the day of establishment, about all suspected adverse reactions of an advanced therapy medicinal product prepared on a non-routine basis.
(7) The patients or the owners or keepers of animals may report any suspected adverse reactions of an advanced therapy medicinal product prepared on a non-routine basis to the physician or veterinarian or directly to the Agency.
Article 83
(Procedure for the issue of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis)
(1) A business entity with the registered office in the Republic of Slovenia can prepare an advanced therapy medicinal product prepared on a non-routine basis only on the basis of and in compliance with the authorisation issued by the Agency for the preparation of advanced therapy medicinal products prepared on a non-routine basis.
(2) The procedure for the issue of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis shall begin with an application submitted by an applicant that is a business entity with the registered office in the Republic of Slovenia for the preparation of individual types of advanced therapy medicinal product prepared on a non-routine basis, namely separately for medicinal products used for gene therapy, somatic cell therapy and tissue engineered products, indicating individual medicinal products in a group.
(3) The Agency shall issue or refuse the issue of the authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis within 180 days of receiving a complete application on the basis of an opinion issued by an expert commission for the establishment of fulfilment of conditions for the activity of preparation of advanced therapy medicinal products prepared on a non-routine basis and, if necessary, independent external experts in gene therapy, somatic cell therapy and tissue engineering, on the fulfilment of conditions stipulated herein.
(4) The Agency may request additional documents and/or data it requires to adopt a decision on the issue of the authorisation for the preparation of an advanced therapy medicinal product prepared on a non-routine basis pursuant to paragraph six of Article 3 hereof.
Article 84
(Application for the issue of authorisation for the preparation of advanced therapy medicinal product prepared on a non-routine basis)
(1) An application for obtaining authorisation for the preparation of an advanced therapy medicinal product prepared on a non-routine basis shall contain:
evidence on the fulfilment of conditions regarding the assurance of quality system, personnel, premises, equipment, traceability and pharmacovigilance system;
list of advanced therapy medicinal product prepared on a non-routine basis from the group of advanced therapy medicinal products to which the application refers;
description of procedures for the preparation of advanced therapy medicinal products prepared on a non-routine basis which shall contain the data on risk factors, such as the data on the origin and characteristics of cells, type of cell manipulation and method of use;
a positive opinion of the NMEC for the relevant group of advanced therapy medicinal products for human use to which the application refers.
(2) The minister shall determine the detailed content of the application, the requirements regarding the description of the preparation procedures for the specific group of advanced therapy medicinal products prepared on a non-routine basis, the method of establishing the fulfilment of conditions for obtaining the authorisation as well as the content of the required documentation.
Article 85
(Change in the conditions for the preparation of advanced therapy medicinal products prepared on a non-routine basis)
(1) The holder of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis shall inform the Agency of the changes to conditions that affect the issue of an authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis within no later than 15 days of the occurrence of such change.
(2) The Agency shall consider the application for the change referred to in the previous paragraph and shall reach a decision on the required procedures. The Agency shall adopt the decision within 30 days of receiving a complete application. If it is required to verify the conditions on site or obtain an opinion from an expert commission for the establishment of fulfilment of conditions for the activity of preparation of advanced therapy medicinal products prepared on a non-routine basis or an additional opinion from an external expert, referred to in the third paragraph of Article 83 hereof, the Agency shall issue a decision within 180 days of the day of receiving a complete application.
(3) The competent minister shall determine in greater detail the contents of the application for the change of conditions on the basis of which the authorisation from Article 83 hereof has been issued and specify the conditions and the method of establishing that such conditions are met.
Article 86
(Revocation of authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis)
(1) The authorisation for the preparation of an advanced therapy medicinal product prepared on a non-routine basis shall be temporarily suspended or revoked should the pharmaceutical inspector ascertain that the business entity to which the authorisation has been issued fails to satisfy the requirements defined in Article 72 hereof and the regulations adopted on the basis hereof, which also serves as the basis for prohibiting the performance of the activity.
(2) Should the Agency establish, by perusing the Slovenian Business Register, that the business entity which is the authorisation holder has already been deleted therefrom, the Agency shall establish ex officio that the authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis ceased to be valid.
(3) The authorisation for the preparation of an advanced therapy medicinal product prepared on a non-routine basis shall also be revoked on the proposal of the holder of authorisation for preparation of advanced therapy medicinal products prepared on a non-routine basis.
VI. LABELLING AND PACKAGE INSERT
Article 87
(Labelling and package leaflet)
(1) A medicinal product put on the market on the basis of the first or the second paragraph of Article 20 hereof and medicinal products referred to in indent 2, 3, and 4 of the third paragraph of Article 20 hereof, intended for dispensing in pharmacies or specialised stores, shall be labelled in the Slovene language on the outer packaging or, if one does not exist, on the immediate packaging, at least with the data on medicinal product, the marketing authorisation holder, method of dispensing, method of use, required warnings, shelf life and other data for ensuring traceability and safe use of medicinal products. Data must be legible, understandable and indelible.
(2) The provisions of the previous paragraph shall not apply to medicinal products with authorisation for compassionate use.
(3) A medicinal product placed on the market there must be a package insert containing instructions for use in the Slovene language in line with the summary of product characteristics, unless the information stipulated in the provision of the seventh paragraph hereof is given on the outer packaging or, where there is no outer packaging, on the immediate packaging. Data must be legible and understandable for the end user.
(4) The data for labelling and package insert of a medicinal product, in accordance with the first and the second paragraph hereunder, can be provided in one or several foreign languages, in addition to the Slovene language, while ensuring the legibility of data in the Slovene language.
(5) Regardless of the provisions of the first and second paragraphs hereunder, the Agency may exceptionally allow, taking into account the measures required for protecting public health:
use of packaging in a foreign language with a label in the Slovene language and the package insert in a foreign language if the package insert in the Slovene language is added to the medicinal product in the prescribed way in printed form and can also be available in electronic form for medicinal products for which it is established that they are indispensable for the protection of public health and that the requirement for the manufacturing of the medicinal product with labelling and package insert in the Slovene language would be disproportionate because of the limited scope of their use;
full or partial exemption from the provisions of the first and second paragraph hereunder for medicinal products intended for direct dispensing to patients in pharmacies or in the case of serious problems related to accessibility.
(6) The name of the medicinal product for human use on the packaging must also be printed in Braille. Marketing authorisation holder shall ensure that the packaging insert is available in the forms suitable for the blind and the partially sighted, if proposed by competent patient organisations.
(7) The minister shall determine a more detailed manner of labelling medicinal products, the form and contents of the package insert and the manner of using the labels, special labelling conditions and package inserts for individual medicinal products or groups of medicinal products.
Article 88
(Safety feature)
(1) In addition to the obligations from the previous Article, the manufacturer of medicinal products for human use shall affix a safety feature to the medicinal product, which allows for the verification of authenticity of medicinal product and identification of individual packaging.
(2) The manufacturer shall attach the safety feature to the medicinal products dispensed upon prescription, with the exception of those put on the list published by the European Commission and can be marketed without the safety feature, and for medicinal products dispensed without prescription and which the European Commission defines as those requiring the safety features.
(3) In addition to the safety feature, the manufacturer shall also provide a device for discovering a breach in the outer packaging.
(4) The above safety feature need not to be attached to radiopharmaceuticals.
(5) The marketing authorisation holder may only partially or completely remove or cover the safety feature on the medicinal product:
if authenticity of a medicinal product has been identified in advance and established that there was no breach of packaging;
if the removed or covered safety features are replaced with new ones that are equal as regards the possibility of verifying authenticity, identification and intactness; The replacement is carried out without opening the immediate packaging;
if the replacement of safety features is carried out in accordance with good manufacturing practices for medicinal products.
(6) Characteristics and specifications of safety features and the devices for discovering a breach in the outer packaging shall be defined by the European Commission.
Article 89
(Message to the European Commission)
The Agency may communicate to the European Commission a different justified assessment of the adequacy of including individual medicinal products or categories of medicinal products in view of the obligation to affix protective elements.
VII. MANUFACTURE OF MEDICINAL PRODUCTS, ACTIVE INGREDIENTS AND CERTAIN EXCIPIENTS
1. MEDICINAL PRODUCTS
Article 90
(Authorisation for the manufacturing of medicinal products)
(1) Business entity may manufacture medicinal products only after they have been granted a manufacturing authorisation and in compliance with such authorisation.
The authorisation includes the manufacturing of medicinal products and their sales to business entities referred to in indent 1 of the second paragraph, the third and fourth paragraph of Article 104 hereof and must be obtained for:
an individual manufacturing site;
an individual manufacturing activity;
individual pharmaceutical forms, and
import of medicinal products from third countries.
(2) The provisions laid down in the preceding paragraph shall also apply to the manufacture of medicinal products intended exclusively for exit, export or clinical trials.
(3) The medicinal product manufacturing activities and the pharmaceutical forms are stipulated in the Compilation of European Union Procedures on Inspection and exchange of Information (hereinafter: The Compilation of Community Procedures), as currently valid and published by the European Commission on its websites.
Article 91
(Conditions for the manufacturing of medicinal products)
(1) The manufacturer of medicinal products shall fulfil the following conditions: 1. Given the volume and complexity of their medicinal product manufacture, to employ an adequate number of professionals holding second cycle degrees, or an equivalent degree corresponding to this level of knowledge in pharmacy, chemistry, chemical technology, medicine, stomatology, veterinary medicine or other appropriate discipline with adequate skills depending on the subject of operations;
(2) They shall have concluded a contract with a responsible person adequately skilled to release individual batches of medicinal products to the market who is available at all times. In the case of corporations and groups of companies, it is possible to appoint such person on the basis of a contract only in one of the members of the group, provided that there exists adequate legal and organisational delimitation of responsibilities and competencies.
(3) They shall have at their disposal adequate facilities, devices and equipment for the manufacture, control, storage and dispatching of medicinal products in accordance with the principles of good medicinal device manufacturing practice.
(4) Manufacturing of medicinal products shall be performed in accordance with the guidelines and good manufacturing practices for medicinal products and active substances may be used that have been produced in accordance with good manufacturing practices for active substances and distributed in accordance with good distribution practice for active substances;
(5) The qualified person referred to in the item 2 hereunder shall have the possibility to independently perform its tasks and have access to all necessary means.
Article 92
(Responsible person for releasing individual series of medicinal products)
(1) The responsible person for releasing individual batches of medicinal products from item 2 of the previous Article shall have a second cycle degree or other relevant level of education corresponding to this level pursuant to the law in pharmacy, medicine, veterinary medicine, chemistry, pharmaceutical chemistry, technology or biology.
(2) The obtained degree referred to in the previous paragraph shall comprise the knowledge of applied physics, general and inorganic chemistry, organic chemistry, analytical chemistry, pharmaceutical chemistry, including the analysis of medicinal products, general and applied medical biochemistry, physiology, microbiology, pharmacology, pharmaceutical technology, toxicology and pharmacognosy.
(3) If the programme of studies shall not comprise either of the skills from the previous paragraph, the qualified person must submit appropriate evidence of having obtained such additional training.
(4) In addition to the training required hereunder, the responsible person shall have acquired practical experience over at least two years, at manufacturers of medicinal products holding adequate authorisations, in the activities of qualitative analysis of medicinal products, quantitative analysis of active substances and testing and verification necessary to ensure the quality of medicinal products. The period of required of practical experience may be reduced by one year where a study programme from the second paragraph hereunder lasts for at least five years and by a year and a half where the course lasts for at least six years.
Article 93
(Obligations of manufacturers of medicinal products) Medicinal product manufacturer:
(1) Has available and may place on the market only medicinal products produced in accordance with the medicinal product marketing authorisation and the manufacturing authorisation;
(2) Verifies the compliance of the manufacturers and the suppliers of active substances with good manufacturing practice or good distribution practice for active substances or with both by carrying out audits;
(3) Ensures that excipients are suitable for use in medicinal products based on a documented assessment of risk in accordance with the guidelines of the European Commission stipulating good manufacturing practice in the area of excipients;
(4) Verifies and makes sure that manufacturers, importers or suppliers from which they obtained the active substances were duly entered into registers with the competent authority of the EU Member State in which they have a registered office;
(5) If it obtains information that medicinal products on the market that otherwise fell within the framework of their medicinal product marketing authorisation were falsified, or suspicion exists that they were falsified, it shall immediately inform the Agency and the marketing authorisation holder thereof, regardless of whether the falsified medicinal products were introduced on the market through an illegal or legal supply chain;
(6) Provides for the authenticity and quality of active substances and excipients used;
(7) Ensures that the safety features referred to in Article 88 hereof are attached to the external packaging in medicinal products intended to be marketed in the European Union;
(8) If the safety features on the medicinal product are partially or fully removed or covered, ensures that these activities are implemented in accordance with the fifth paragraph of Article 88 hereof.
Article 94
(Procedure for obtaining authorisation for manufacturing medicinal products)
(1) The procedure for issuing a manufacturing authorisation shall be initiated on the basis of an application submitted by a business entity with a registered office in the Republic of Slovenia. The application for obtaining a manufacturing authorisation shall contain evidence on the fulfilment of conditions set out in Article 91 hereof.
(2) The Agency shall issue or refuse to issue a manufacturing authorisation within 90 days of receiving a complete application on the basis of an opinion of the expert commission for establishing the fulfilment of conditions for manufacturing medicinal products.
(3) The authorisation referred to in the previous paragraph may be issued for a definite period of time or under certain conditions.
(4) The Agency may request additional documents and/or data it requires to decide on the issue of the manufacturing authorisation in accordance with paragraph six of Article 3 hereof.
(5) The documentation from the application for a manufacturing authorisation shall be deemed a business secret if defined as such by the applicant, in accordance with the regulations.
(6) The competent minister shall determine the detailed contents of the application, the conditions and the method of establishing the fulfilment of the conditions to obtain a manufacturing authorisation, the substance and form of the required documentation and authorization as well as the naming of the manufacturing activity.
Article 95
(Certificate of good manufacturing practice)
(1) The pharmaceutical inspector shall issue ex officio a certificate of good manufacturing practice to the inspected business entity within 90 days of the date of the inspection, should it be established that the business entity implements the activity of medicinal product manufacture in accordance with the guidelines and principles of good manufacturing practice for medicinal products or active substances or no later than within 15 days of the issue or change in the manufacturing authorisation or the entry or change in the register of manufacturers of active substances.
(2) The pharmaceutical inspector may ex officio by a decision invalidate the certificate of good manufacturing practice should it be established during the inspection that the holder of the manufacturing authorisation for medicinal products or the business entity, which is entered in the register of manufacturers of active substances, has failed to implement the activity in accordance with the guidelines and principles of good manufacturing practice for medicinal products or active substances.
(3) The certificate of good manufacturing practice shall be issued on a form written in the Slovenian and English languages, as defined in the Compilation of European Union Procedures.
(4) The competent minister shall determine in greater detail the procedure of issuing and revoking the certificate of good manufacturing practice.
Article 96
(Amended conditions for the manufacturing of medicinal products)
(1) The manufacturing authorisation holder shall inform the Agency of any change in the conditions stipulated under Article 91 hereof which served as the basis for issuing the manufacturing authorisation no later than within 15 days of the occurrence of such change.
(2) The Agency shall consider the application to change the conditions referred to in the previous paragraph and shall reach a decision within 30 days of receiving a complete application, except when special inspection is required for verifying the conditions on site, in which case authorisation shall be issued within 90 days of receiving the complete application.
(3) The competent minister shall determine in greater detail the contents of the application to change the conditions for issuing the medicinal product manufacturing authorisation and specify the conditions and the procedures for establishing whether such conditions for issuing a manufacturing authorisation or for issuing a decision on the assessed compliance of the change with the conditions for performing medicinal product manufacture have been met.
Article 97
(Revocation of manufacturing authorisation)
(1) A manufacturing authorisation shall be suspended or revoked, should the pharmaceutical inspector ascertain that the manufacturer of medicinal products did not meet the conditions defined in Article 91 hereof and the regulations adopted on the basis hereof, which also serves as the basis for prohibiting the performance of activity.
(2) The authorisation may also be revoked on the manufacturing authorisation holder’s proposal.
(3) Should the Agency establish, by perusing the Slovenian Business Register, that the business entity which is the holder of authorisation for the manufacturing of medicinal products has already been deleted therefrom, it shall establish ex officio that the authorisation ceased to be valid.
Article 98
(Assessment of risk management adequacy in medicinal product manufacture)
The Agency may, on the manufacturing authorisation holder’s proposal, issue an assessment of the risk management adequacy in the process of introducing medicinal products which contain new groups of special substances pursuant to the Compilation of Community Procedures in the manufacturing process.
Article 99
(Register of persons responsible for releasing medicinal products)
(1) The Agency shall keep a publicly available register of persons responsible for releasing individual batches of medicinal products, which shall include the persons responsible for releasing individual batches of medicinal products that comply with the conditions referred to in Article 92 hereof.
(2) The register of persons responsible for releasing individual batches of medicinal products shall include the following data:
name and surname and the professional title of the person responsible for releasing individual batches of medicinal products;
name and address of the business entity where they perform the tasks as the person responsible for releasing individual batches of medicinal products;
name and address of the manufacturing site where they perform the tasks as the person responsible for releasing individual batches of medicinal products.
(3) The application for the entry in, change of and deletion from the register referred to in the first paragraph hereunder may be filed by the applicants for and the holders of the manufacturing authorisations for medicinal products in the Republic of Slovenia.
(4) The Agency shall enter, change or delete the person responsible for releasing individual batches of medicinal products from the register referred to in the first paragraph hereunder within eight days of receiving a complete application and issue a certificate related thereto upon the request of the applicant.
(5) The Agency shall delete the person responsible for releasing individual batches of medicinal products from the register referred to in the first paragraph hereunder on the proposal by the applicant for the entry in the register, in the event the Agency cancels the manufacturing authorisation and in the event the manufacturing authorisation holder has been deleted from the Slovenian Business Register.
(6) The competent minister shall determine in greater detail the contents of the application for the entry in, change of or deletion from the register of the persons responsible for releasing individual batches of medicinal products as well as the conditions and the method of establishing whether the conditions for the entry in, change of or deletion from the register have been met.
2. Active substances
Article 100
(Conditions for the manufacturing of active substances)
(1) A manufacturer of active substances shall meet the following conditions:
Employ an adequate number of experts with adequate qualifications depending on the extent and complexity of the manufacture of active substances;
Shall have at their disposal adequate facilities, devices and equipment for the manufacture, control, storage and transport of active substances in accordance with the guidelines and principles of good manufacturing practice for active substances;
Shall perform the activity in accordance with the guidelines and principles of good manufacturing practice for active substances.
(2) A manufacturer of active substances shall forthwith inform the Agency and the manufacturing authorisation holder about any falsified active substances or any suspicion thereof.
Article 101
(Procedure for the entry in the register of manufacturers of active substances)
(1) A manufacturer of active substances with the registered office in the Republic of Slovenia, may start performing its activity after it has been entered in the register of manufacturers of active substances, kept by the Agency.
(2) The register of manufacturers of active substances shall include the following data:
name, permanent address and contact information of the business entity (telephone, fax and e-mail); and
active substances manufactured.
(3) The Agency shall issue a certificate upon entry in the register referred to in the first paragraph hereunder.
(4) The manufacturers of active substances shall notify their activity to the Agency at least 60 days before they start performing the activity, based on a written application which shall include the evidence that the conditions referred to in the first paragraph of the previous Article have been met, and a list of active substances they plan to manufacture.
(5) The Agency shall enter the manufacturer of active substances in the register of active substance manufacturers on the basis of a positive opinion of the expert commission for the establishment of fulfilment of conditions for manufacturing of medicinal products 90 days of receiving the complete application or 60 days if it estimates that the fulfilment of conditions need not be verified.
(6) Should the above referenced expert commission issue a negative opinion on the fulfilment of the conditions for performing the manufacture of active substances, the Agency shall refuse the entry in the register of manufacturers of active substances and issue a decision thereon.
(7) The Agency may request additional documents and/or data it requires to adopt a decision on the entry in the register of manufacturers of active substances in accordance with paragraph six of Article 3 hereof.
(8) The Agency may delete the manufacturer of active substances from the register of manufacturers of active substances, should the pharmaceutical inspector ascertain that the manufacturer of active substances did not meet the conditions from the previous article hereof and the regulations adopted on the basis hereof, which also serves as the basis for prohibiting the performance of activity. The Agency may delete the manufacturer of active substances from the register of manufacturers of active substances also on the manufacturer’s proposal and if it establishes, by perusing the Slovenian Business Register, that the manufacturer of active substances has been deleted therefrom. The Agency shall issue a decision on the deletion from the register of manufacturers of active substances.
(9) The documentation from the application for notification in the register of manufacturers of active substances shall be deemed a business secret if defined as such by the applicant, in accordance with the regulations, except for the data referred to in the second paragraph hereunder.
(10) The Agency shall publish on its website the list of manufacturers of active substances which have been entered in the register of manufacturers of active substances, containing the name of the business entity and its permanent address.
(11) The competent minister shall determine in greater detail the contents of the application, the conditions, the method and the procedures required for the notification and deletion from the register of manufacturers of active substances as well as the contents of the register of manufacturers of active substances.
Article 102
(Amended conditions for the manufacturing of active substances)
(1) The manufacturer of active substances shall inform the Agency about any change in the conditions referred to in Article 100 hereof that significantly affects the quality or safety of the active substance it manufactures within seven days at the latest.
(2) The Agency shall enter the change referred to in the previous paragraph into the register of manufacturers of active substances based on an opinion of the expert commission for the establishment of fulfilment of conditions for manufacturing active substances within 90 days and shall issue a certificate thereon and/or enter the change referred to in the previous paragraph into the register of manufacturers of active substances within 30 days of receiving the complete application, if it estimates that the fulfilment of conditions need not be verified and issues a certificate thereon.
(3) In the event the change referred to in the first paragraph hereunder does not concern the data from the register of manufacturers of active substances, the Agency shall issue a decision on the assessed fulfilment of conditions for the performance of the activity of manufacture of active substances within 30 days, or 90 day of receiving a complete application, if it estimates that the fulfilment of the conditions should be verified.
(4) Should the expert commission referenced in the second paragraph above issue a negative opinion on the change in the fulfilment of the conditions for performing the manufacture of active substances, the Agency shall not enter the change in the register of manufacturers of active substances and issue a decision thereon.
(5) Notwithstanding the provisions of the first paragraph above, the manufacturer of active substances shall notify about other changes of conditions which are the basis for the entry in the register of manufacturers of active substances in its annual report which it shall submit to the Agency by 15 December of the current year at the latest, namely the report shall specify all changes in the current year. The Agency shall enter the changes within 30 days of receiving a complete report in the event of changes made to the data in the register of manufacturers and issues a certificate thereon.
(6) The competent minister shall determine in greater detail the contents of the application for the notification of changes of conditions, the contents of the annual report on changes, the procedure and the method of entry of the change in the register of manufacturers of active substances and the issue of the decision on the assessed fulfilment of conditions for performing the manufacture of active substances.
3. Excipients
Article 103
(Manufacturers of excipients)
The business entities manufacturing excipients shall carry out the manufacture in accordance with the guidelines and principles of good manufacturing practice for excipients as adopted and published by the European Commission.
VIII. WHOLESALE OF MEDICINAL PRODUCTS AND ACTIVE SUBSTANCES 1. MEDICINAL PRODUCTS
Article 104
(Wholesaling of medicinal products)
(1) A business subject with the authorisation for the wholesaling of medicinal products, is a wholesaler and may only purchase medicinal products from business entities holding appropriate authorisation for manufacturing or wholesaling of medicinal products.
(2) The wholesalers of medicinal products may sell medicinal products only to business entities engaging in:
wholesaling of medicinal products;
retailing of medicinal products.
(3) Notwithstanding the previous paragraph, wholesalers may sell medicinal products directly to the providers of healthcare activity, social security institutes, Slovenian Armed Forces, provided that they have pharmacies in their organisational structure and/or have established a system for receiving, storing and tracing medicinal products, and appointed a person with a second cycle degree in pharmacy, or an equivalent degree corresponding to this level pursuant to the law.
(4) Notwithstanding the second paragraph hereunder, the wholesalers may sell medicinal products to veterinary and other organisations which perform the veterinary activity in accordance with the veterinary regulations, as well as to authorised manufacturers of medicated feedingstuffs in accordance with the regulations and in the scope covered by their authorisation.
(5) Medicinal products referred to in the third paragraph hereunder may only be used for the performance of health activity or healthcare support in social security organisations and the Slovenian Armed Forces and medicinal products referred to in the above paragraph hereunder for the performance of veterinary activity.
(6) The minister shall determine more specific conditions for the responsible person, the system for receiving, storing and tracing medicinal products and the procedure for establishing whether the conditions from the third paragraph hereunder have been met.
Article 105
(Conditions for wholesalers of medicinal products)
(1) The wholesale of medicinal products may be undertaken by business entities which hold an appropriate authorisation issued by the Agency and fulfil the following requirements:
Have at their disposal an adequate number of experts holding a second cycle degree in the field of pharmacy or an equivalent degree corresponding to this level pursuant to the law working under a contract, or experts in other appropriate fields, if necessary;
Appoint from among the experts referred to in the previous item a person responsible for receiving, storing, issuing and transporting medicinal products as well as examining the documentation that enables traceability of medicinal products. The responsible person shall have a second cycle degree in pharmacy or an equivalent degree corresponding to this level of knowledge pursuant to the law;
Have at their disposal adequate facilities and equipment, depending on the type of medicinal product that is the subject of wholesale trade;
Keep appropriate documentation so as to enable the immediate withdrawal of a medicinal product from the market and resolving of complaints;
Organise the work in accordance with the principles of good distribution practice; and
Establish a system to ensure high quality of operations and define the responsibilities, procedures and measures concerning risk management related to their activities;
(2) If the person referred to in item 2 of the first Paragraph of the present Article does not hold a second cycle degree in pharmacy or an equivalent degree corresponding to this level of knowledge pursuant to the law, they must possess additional knowledge of applied physics, general and inorganic chemistry, organic chemistry, analytical chemistry, pharmaceutical chemistry, including the analysis of medicinal products, general and applied medical biochemistry, physiology, microbiology, pharmacology, pharmaceutical technology, toxicology and pharmacognosy. If the study programme does not include any of the abovementioned skills, the responsible person shall submit appropriate evidence of having obtained such skills.
(3) Wholesalers having obtained the marketing authorisation for wholesaling of medicinal products and having their registered office in another EU Member State that intend to wholesale medicinal products in the Republic of Slovenia can start performing such activity in the Republic of Slovenia once they have notified themselves with the Agency in accordance with the procedure prescribed by the competent minister.
(4) The competent minister shall determine in greater detail the conditions for wholesaling medicinal products, the procedure for establishing the fulfilment of the conditions and the procedure of notifying of wholesalers of medicinal products referred to in the previous paragraph as well as the form of the authorisation for wholesaling of medicinal products.
Article 106
(Obligations of wholesalers of medicinal products)
Wholesalers of medicinal products shall:
Verify whether the suppliers of medicinal products (manufacturers, importers and wholesalers) perform their activities in accordance with the guidelines and principles of good distribution practice and the regulations on medicinal products in the country in which they have the registered office, as well as whether they hold the authorisation for manufacturing and/or wholesaling of medicinal products;
Verify whether the business entities to whom they sell medicinal products have the authorisation for wholesaling or retailing medicinal products or the authorisation for performing the pharmacy activity and whether the business entities from the third paragraph of Article 104 hereof have set up an accepted system for receiving, storing and tracing medicinal products;
Verify the safety features on the received and/or supplied medicinal product and forthwith inform the Agency and the manufacturing authorisation holder, if needed, about any falsified products or any suspicion thereof;
Keep the documentation pertaining to all medicinal products in an electronic or any other form for up to five years. The invoices that are issued upon the receipt or dispatch of medicinal products shall contain at least the following data: date, name of medicinal product, national identifier, date of receipt or the issued quantity, name and address of the supplier or recipient and, in case of medicinal products bearing a safety feature, also the batch number; and
Take into account the good distribution practice when implementing the logistics functions of transporting medicinal products in the framework of:
the dispensing of medicinal products in pharmacies or specialised stores for medicinal products sold to end users who are patients or owners of animals or their keepers, or the retail sale of medicinal products to a provider of healthcare or veterinary activity, social security institutes and the Slovenian Armed Forces, which had not introduced a system for receiving, storing and tracing medicinal products on the basis of a contract with a pharmacy and/or a specialised store;
selling medicinal products by another business entity to providers of healthcare activity from the third paragraph of Article 104 hereof, based on the concluded agreement with the business entity concerned, which can itself be a manufacturer or another medicinal products wholesaler.
Article 107
(Issue of authorisation for wholesale of medicinal products)
(1) The procedure for the issue of the authorisation for wholesale of medicinal products shall be initiated on the basis of an application submitted by a business entity with the registered office in the Republic of Slovenia.
(2) The Agency shall decide on the issue of the authorisation for wholesale of medicinal products within 90 days of receiving a complete application, based on the opinion of an expert commission for the establishment of fulfilment of conditions for wholesale of medicinal products.
(3) The Agency may issue authorisation for wholesaling medicinal products:
covering the full extent of the activity of wholesaling of medicinal products that includes wholesaling of all medicinal products that may be marketed pursuant to this Act to all business entities referred to in the second, third and fourth paragraphs of Article 104 hereof;
covering a contact-limited scope of the activity of wholesaling of medicinal products that includes wholesaling of all medicinal products that may be marketed pursuant to this Act only to other holders of authorisation for wholesaling of medicinal products; or
covering a product-limited scope of the activity of wholesaling of medicinal products that includes wholesaling of certain medicinal products to all business entities referred to in the second, third and fourth paragraphs of Article 104 hereof;
to the Institute of the Republic of Slovenia for Commodity Reserves.
(4) The authorisation referred to in the previous paragraph may also be issued for a limited period of time or under certain conditions.
(5) An authorisation for wholesale of medicinal products from the third paragraph hereunder shall be suspended or revoked, should the pharmaceutical inspector ascertain that the wholesaler of medicinal products did not meet the conditions defined in Article 105 hereof and issue a prohibition against wholesaling of medicinal products.
(6) The medicinal product wholesaling activities shall be defined in the Compilation of European Union Procedures as applicable at the time.
(7) The authorisation for wholesale of medicinal products shall also be revoked on the proposal by the holder of authorisation for wholesale of medicinal products and in case the pharmaceutical inspector, based on three pronounced fined resulting from the failure to meet the obligation to provide services in public interest from Article 108 hereof, orders prohibition to perform the activity of wholesaling of medicinal products.
(8) Should the Agency establish, by perusing the Slovenian Business Register, that the business entity which is the holder of authorisation for the wholesale of medicinal products has already been deleted therefrom, the Agency shall establish ex officio that the authorisation for wholesale of medicinal products has ceased to be valid.
Article 108
(Obligation to perform services in public interest)
(1) A wholesaler of medicinal products, whose authorisation covers the full extent of the activity of wholesaling of medicinal products, shall ensure a continuous and appropriate selection of medicinal products which can be marketed pursuant to the obligation to perform services in public interest in a relatively short time, namely within 24 hours during the week and 72 hours during weekends or holidays, from the received order for medicinal products from the first and the second paragraph and indent 3 of the third paragraph of Article 20 hereof. If the provider of medical or veterinary activity, or a pharmacy, requires delivery of medicinal products in shorter deadlines than those specified above, this shall be indicated in the order to the wholesaler based on an evidence-supported medical need or medical documentation.
(2) A wholesaler of medicinal products, whose wholesaling authorisation is product-limited, shall ensure a continuous and appropriate selection of medicinal products as specified in the authorisation issued by the Agency for performing this activity, so as to meet the requirements for an uninterrupted supply of medicinal products pursuant to the obligation to perform services in public interest within 24 hours during the week and 72 hours during weekends or holidays, from the received order for medicinal products from the first and the second paragraph and indent 3 of the third paragraph of Article 20 hereof. If the provider medical or veterinary activity, or a pharmacy, requires delivery of medicinal products in shorter deadlines than those specified above, this shall be indicated in the order to the wholesaler based on an evidence-supported medical need or medical documentation.
Article 109
(Certificate of good distribution practice)
(1) The pharmaceutical inspector shall issue a certificate of good distribution practice to the inspected business entity within 90 days of the date of inspection should it be established that the business entity’s wholesale of medicinal products is in accordance with the guidelines and principles of good distribution practice for medicinal products or active substances, or no later than within 15 days of the issue or change to the marketing authorisation or the entry or change in the register of wholesalers of active substances.
(2) The pharmaceutical inspector may issue a decision to revoke the certificate of good distribution practice if it is ascertained upon the inspection that the holder of the authorisation for wholesaling of medicinal products and/or the business entity which is entered in the register of wholesalers of active substances fails to implement the guidelines and principles of good distribution practice for medicinal products or active substances.
(3) The certificate of good distribution practice shall be issued on a form written in the Slovenian and English languages, as defined in the Compilation of European Union Procedures, as applicable at the time.
(4) The competent minister shall determine in greater detail the procedure of issuing or revoking the certificate of good distribution practice.
Article 110
(Register of persons responsible for receiving medicinal products)
(1) The Agency shall keep a publicly available register of persons responsible for receiving, storing, issuing and transporting of medicinal products and for examining of the documentation, which shall include the responsible persons who have fulfilled the conditions laid down in Article 105 hereof.
(2) The register of persons responsible for receiving, issuing and transporting of medicinal products as well as examining the documentation shall include the following data:
name and surname and professional title of the person responsible for receiving, issuing and transporting medicinal products as well as examining the documentation;
name and address of the business entity where they perform the tasks as the person responsible for receiving, issuing and transporting medicinal products as well as examining the documentation.
(3) The Agency shall enter, change or delete the person responsible for receiving, issuing and transporting medicinal products as well as examining the documentation in/from the register referred to in the first paragraph of this Article within eight days of receiving a complete application and issue a certificate thereon upon the request of the applicant.
(4) The application for the entry in, change of and deletion from the register referred to in the first paragraph hereunder may be filed by the applicant for the authorisation for wholesale of medicinal products or the holder of the authorisation for wholesale of medicinal products in the Republic of Slovenia.
(5) The Agency shall delete the person responsible for receiving, storing, issuing and transporting medicinal products as well as examining the documentation on the proposal by the applicant for the entry in the register referred to in the first paragraph of this Article, if the Agency cancels the wholesale authorisation and if the holder of the wholesale authorisation has been deleted from the Slovenian Business Register.
(6) The competent minister shall determine in greater detail the contents of the application for the entry in, change of or deletion from the register of the persons responsible for receiving, storing, issuing and transporting of medicinal products and examining of the documentation as well as the conditions and the method of establishing the fulfilment of conditions for the entry in, change of or deletion from the register of the persons responsible for receiving, storing, issuing and transporting of medicinal products and examining of the documentation.
2. Active substances
Article 111
(Wholesaling of active substances)
(1) A business subject pursuing wholesale of active substances and duly entered into the register of manufacturers of active substances shall be a wholesaler of active substances. Wholesalers of active substances shall perform their activity in accordance with the guidelines and principles of good distribution practice for active substances.
(2) Wholesalers engaged in the wholesale of active substances shall fulfil the following conditions:
They shall employ an adequate number of experts with adequate qualifications depending on the extent and complexity of the wholesale in active substances;
They shall have at their disposal adequate facilities, devices and equipment for the storage and transport of active substances in accordance with the guidelines and principles of good distribution practice for active substances, and
They shall perform the activity in accordance with the guidelines and principles of good distribution practice for active substances.
The wholesaler of active substances shall forthwith inform the Agency about any falsified active substances or any suspicion thereof.
The wholesaler of active substances shall verify whether the suppliers of active substances comply with the guidelines and principles of good manufacturing and distribution practices for active substances and whether they comply with the regulations governing active substances in the country in which they have their registered office.
Article 112
(Procedure of entry into the register of wholesalers of active substances)
(1) The wholesalers with registered office in the Republic of Slovenia may start carrying out their activity after they have been entered in the register of wholesalers of active substances kept by the Agency.
(2) The Agency shall issue a certificate upon the entry in the register of wholesalers of medicinal products.
(3) The register of wholesalers of active substances shall include the following data:
name, permanent address and contact information of the business entity (telephone, fax and e-mail);
list of active substances the business entities wholesale.
(4) Wholesalers of active substances shall notify their activity to the Agency 60 days before they start performing the activity, based on a written application which shall include the evidence that the conditions referred to in the second paragraph of the previous Article have been fulfilled, and a list of active substances they plan to wholesale.
(5) The Agency shall enter wholesalers of active substances in the register of active substance wholesalers on the basis of a positive opinion of the expert commission for the establishment of fulfilment of conditions for wholesale of active substances 90 days of receiving the complete application or 60 days if it estimates that the fulfilment of conditions need not be verified.
(6) Should the above referenced expert commission issue a negative opinion on the fulfilment of the conditions for the wholesale of active substances, the Agency shall refuse the entry in the register referred to in the first paragraph of this Article by way of rendering a decision.
(7) The Agency may delete a wholesaler of active substances from the register, should the pharmaceutical inspector ascertain that it did not meet the conditions referred to in paragraph two of the previous Article and the regulations adopted on the basis thereof, which also serves as the basis for prohibiting the performance of the activity. The Agency may delete the wholesaler of active substances from the register referred to in the first paragraph of this Article also on the manufacturer’s proposal and if it establishes, by perusing the Slovenian Business Register, that the wholesaler has been deleted therefrom. The Agency issues a decision on the deletion.
(8) The Agency may request additional documents and/or data so as to adopt a decision on the entry in the register of wholesalers of active substances pursuant to paragraph six of Article 3 hereof.
(9) The documentation pertaining to the application for the entry in the register of wholesalers shall be deemed a business secret if defined as such by the applicant, in accordance with the regulations.
(10) The Agency shall publish on its website the list of wholesalers that have been entered in the register of wholesalers engaged in the wholesale of active substances. The list shall contain the name of the wholesaler of active substances and its permanent address.
(11) The competent minister shall determine in greater detail the contents of the application, the conditions, the method and the procedures required for the entry into the register of wholesalers of active substances and deletion from the register as well as the contents of such register.
Article 113
(Change of conditions for the entry in the register of wholesalers of active substances)
(1) The wholesaler of active substances shall inform the Agency forthwith about any change in the conditions referred to in the second paragraph of Article 111 hereof that significantly affects the quality or safety of the active substance it wholesales.
(2) The Agency shall enter the change referred to in the previous paragraph in the register of wholesalers of active substances based on a positive opinion of an expert commission for establishing the fulfilment of conditions for wholesale of active substances within 90 days of receiving a complete application and shall issue a certificate thereon and/or enter the change referred to in the previous paragraph in the register of wholesalers of active substances within 30 days of receiving a complete application, if it estimates that the fulfilment of conditions need not be verified and issues a certificate thereon. If the change referred to in the previous paragraph does not concern the data from the register of wholesalers of active substances, the Agency shall issue a decision on the assessed fulfilment of conditions for the performance of the activity of wholesaling active substances within 30 days, or 90 days of receiving a complete application, if it estimates that the fulfilment of the conditions should be verified.
(3) Should the expert commission referred to in the previous paragraph issue a negative opinion on the fulfilment of the conditions for the wholesale of active substances, the Agency shall not enter the change in the register and shall issue a decision thereon.
(4) Notwithstanding the provisions of the first paragraph hereunder, the wholesaler which wholesales active substances shall notify about other changes of conditions which are the basis for the entry in the register of wholesalers of active substances in its annual report which it shall submit to the Agency by 15 December of the current year at the latest, namely the report shall specify all changes in the current year. The Agency shall, within 30 days of the day of receiving a complete report, issue a certificate on the change of entry in the register of wholesalers of active substances.
(5) The competent minister shall determine in greater detail the contents of the application for the notification of changes of conditions, the contents of the annual report on changes, the procedure and the method of entry of the change in the register of wholesalers of active substances and a detailed procedure the issue of the decision on the assessed fulfilment of conditions for performing the marketing of active substances.
IX. IMPORT AND ENTRY OF MEDICINAL PRODUCTS AND ACTIVE SUBSTANCES 1. MEDICINAL PRODUCTS
Article 114
(Import of medicinal products)
(1) The import of medicinal products may be performed by the holders of the manufacturing authorisation for medicinal products which also covers the import activity.
(2) Holders of authorisation for manufacturing of medicinal products importing medicinal products and who themselves have no appropriate facilities, equipment and devices to control the quality of each imported batch of medicinal products, can enter into a contractual relationship with a business entity for the provision of the services of analytical testing of medicinal products, provided that such entity holds the manufacturing authorisation for medicinal products which also covers the activity of analytical testing of medicinal products.
(3) Batches of medicinal products manufactured in third countries, which have undergone the controls referred to in the previous paragraph in another EU Member State prior to their marketing in the Republic of Slovenia, shall be exempt from the controls and shall be accompanied by the reports on quality controls, signed by the person who released the batch in the relevant country.
(4) In the case of medicinal products imported from a country that has concluded with the European Union a mutual recognition agreement for the area of medicinal products, the analysis certificate obtained in the exporting country shall be recognised.
Article 115
(Entry of medicinal products)
(1) Importing of medicinal products can be carried out by wholesalers of medicinal products with registered headquarters in the Republic of Slovenia and wholesalers of medicinal products with registered headquarters in another EU member state, which are notified with the Agency.
(2) Those batches of medicinal products that were individually controlled before their entry in the Republic of Slovenia, shall be exempt from the controls.
Article 116
(Import or entry of medicinal products)
(1) Subject to the fulfilment of the conditions hereof, the entry and import shall be allowed for medicinal products with:
marketing authorisation;
marketing authorisation for parallel imported medicinal product;
compassionate use authorisation;
certificate of notification of parallel distribution of medicinal product; or
authorisation for clinical trial or adequately notified clinical trial.
(2) The entry and import of medicinal products without the authorisation referred to in the previous paragraph shall only be allowed for the medicinal products referred to in the third paragraph of Article 20 hereof.
(3) The Agency may within 30 days of receiving the complete application temporarily allow the entry or import of the medicinal products referred to in the previous paragraph except in the cases referred to in indent 2 and indent 5 of the third paragraph of Article 20 hereof, when the decision is adopted within seven days.
(4) The applicant for the entry authorisation, as referred to in the second paragraph hereunder, may be a wholesaler in medicinal products and for the import authorisation, this may be a manufacturer of medicinal products whose manufacturing authorisation also covers the activity of import of medicinal products.
(5) For medicinal products without the marketing authorisation in the Republic of Slovenia, for which the entry or import authorisation can be obtained pursuant to this law, the applicants must obtain from the Agency, prior to obtaining such authorisation, a decision of the Agency on the quantities of medicinal products and their wholesale prices without VAT for each period.
(6) The decision of the Agency referred to in the previous paragraph shall be issued to the applicant that offered the lowest wholesale price without VAT for the tendered annual amount of medicinal products, expressed as the quantity of the relevant active substances, if there is no medicinal product with marketing authorisation containing the same active substance, pharmaceutical form and strength available on the Slovene market. The Agency informs all bidders and providers of healthcare, veterinary and pharmacy activity of the selection.
(7) The Agency establishes the required annual quantity of medicinal products from the previous paragraph based on the data on the quantities of necessary medicinal products from the third paragraph of Article 20 hereof for a period of one year with the presentation of the general names of medicinal products, the indication of pharmaceutical form and strength submitted by the providers of healthcare, veterinary and pharmacy activity upon its request.
(8) Notwithstanding the provisions of the fifth paragraph hereunder, the applicants may obtain the authorisation for the entry or import of medicinal products if they are able to prove in their application that the needs for the entry or import of medicinal products could not have been anticipated, so as to obtain the authorisation for the entry or import of medicinal products pursuant to the provisions of the fifth paragraph hereunder or if the holder of authorisation for the entry or import of medicinal products from the fifth paragraph hereunder informs the Agency that they cannot provide a specific medicinal product in the foreseen scope or within the foreseen deadline.
(9) A holder of authorisation for the entry or import of medicinal products that obtained the authorisation on the basis of the fifth paragraph hereunder shall provide the supply of medicinal products pursuant to this authorisation and in accordance with the requirements for the supply of medicinal products as specified by the providers of healthcare, veterinary and pharmacy activity.
(10) If the holder of authorisation from the previous paragraph fails to supply medicinal products to the providers of healthcare, veterinary and pharmacy activity for which the authorisation for entry or import was obtained, they shall not be allowed to submit their bids in the next process of collecting bids from the sixth paragraph hereunder.
(11) Entry or import of medicinal products entered or imported for the purpose of exit or export into other countries and placement on the market in such other EU Member States and not for sale on the market of the Republic of Slovenia shall be free if performed in the scope and on the basis of adequate manufacturing authorisation or wholesaling authorisation.
(12) The competent minister shall lay down detailed conditions, method and procedure of entry and import of medicinal products and the method of reporting by the providers of healthcare, veterinary or pharmacy activity on the necessary quantities of medicinal products from the third paragraph of Article 20 hereof.
Article 117
(Marketing of parallel imported medicinal products)
(1) The procedure for obtaining a marketing authorisation for a parallel imported medicinal product shall be initiated on the basis of an application submitted by the wholesaler in medicinal products which, in the marketing of such medicinal product, is not in a business relationship with the holder of marketing authorisation. The Agency shall issue the marketing authorisation for a parallel imported medicinal product within 60 days of receiving a complete application.
(2) The application for the obtaining, change or renewal of the marketing authorisation for a parallel imported medicinal product shall include the data on the applicant, the medicinal product for which parallel import is proposed, and the medicinal product which was issued the marketing authorisation in the Republic of Slovenia and against which the medicinal product in the application is compared.
(3) The competent minister shall determine in greater detail the contents of the application, the procedure and conditions for obtaining, changing and renewing the marketing authorisation for a parallel imported medicinal product, the reasons for cancelling the validity of the authorisation and the tasks of the holder of marketing authorisation for a parallel imported medicinal product.
Article 118
(Parallel distribution of medicinal products)
(1) Prior to starting parallel distribution of a medicinal product the wholesalers who are authorised for wholesaling medicinal products in the Republic of Slovenia shall notify the Agency in writing about the start of the parallel distribution.
(2) The notification referred to in the previous paragraph shall include evidence that the applicant has duly informed the EMA about the intended parallel distribution and that the EMA does not object to the intended parallel distribution, as well as data on the medicinal product which will be the subject of parallel distribution, along with the data on the outer packaging of the medicinal product, patient leaflet in the Slovenian language, data on the medicinal product manufacturer and the manufacturing site.
(3) After receiving the complete application referred to in the previous paragraph, the Agency shall issue a certificate of the receipt of notification on parallel distribution of medicinal products.
(4) The competent minister shall determine in greater detail the contents of the notification and the procedure for issuing the certificate of received notification on parallel distribution of medicinal product.
2. Active substances
Article 119
(Import of active substances)
(1) Active substances can be imported by business entities entered in the register of importers of active substances and holding the manufacturing authorisation for medicinal products as well as wholesalers of active substances (hereinafter: importer of active substances).
(2) The importer of active substances may only import those active substances which are manufactured in accordance with the guidelines and principles of good manufacturing practice for active substances, applicable in the European Union, or the guidelines and principles of good manufacturing practice applicable in a third country and at least equal, in terms of requirements, to those stipulated in the European Union.
(3) The importer of active substances that imports active substances intended for the manufacture of medicinal products for human use may only import those active substances that are accompanied by a written certificate of the competent authority from the exporting third country, namely that:
the standards of good manufacturing practice which are applied in the production site where the exported active substance is manufactured are at least equal to those prescribed by the European Union;
the manufacturing plant is subject to regular controls by the competent authority and
they shall immediately inform the EU Member States to which the active substances are being exported should incompliance with the standards of good manufacturing practice be ascertained.
(4) The written certificate referred to in the previous paragraph need not be submitted if the relevant third country has been included in the list of the European Commission as a country whose requirements and standards of good manufacturing practice are equivalent to those of the European Union.
(5) Only exceptionally and for the purpose of ensuring the availability of medicinal products, the written certificate referred to in the third paragraph hereunder need not be submitted, if the inspection was conducted in the exporting country by another EU Member State in the last three years, whereby it was established that the manufacture complied with the good manufacturing practice for active substances.
(6) The competent minister shall determine the detailed requirements regarding the import of active substances.
Article 120
(Conditions for the import of active substances)
(1) Importers of active substances shall meet the following conditions:
They shall employ an adequate number of experts with at least secondary degrees of an appropriate program depending on the extent and complexity regarding the importation of active substances;
They shall have at their disposal adequate facilities, devices and equipment for the storage and transport of active substances in accordance with the guidelines and principles of good distribution practice for active substances, and
They shall perform the activity in accordance with the guidelines and principles of good distribution practice.
(2) The importer of active substances shall forthwith inform the Agency about any falsified active substances or any suspicion thereof.
(3) The importer of active substances shall verify whether the suppliers of active substances comply with the guidelines and principles of good manufacturing and distribution practices for active substances and whether they comply with the regulations governing active substances in the country in which they have their registered office.
Article 121
(Procedure of entry in the register of importers of active substances)
(1) The importers of active substances with registered offices in the Republic of Slovenia, may start performing their activity after it has been entered in the register of importers of active substances, kept by the Agency.
(2) The Agency shall issue a certificate upon the entry in the register referred to in the previous paragraph.
(3) The register of importers of active substances shall include the following data:
name, permanent address and contact information of the business entity (telephone, fax and e-mail);
a list of active substances imported by the business entity.
(4) The importer of active substances shall notify its activity to the Agency 60 days prior to the commencement of activity, based on a written application that includes evidence that the conditions have been fulfilled and a list of active substances they intend to import.
(5) The Agency shall enter the importer of active substances in the register of importers of active substances, based on a positive opinion of an expert commission for establishing the fulfilment of conditions for importing active substances on the fulfilment of the conditions referred to in the first paragraph of the previous Article within 90 days or 60 days of receiving the complete application if it estimates that the fulfilment of conditions need not be verified.
(6) Should the expert commission referred to in the previous paragraph issue a negative opinion on the fulfilment of the conditions for performing the import of active substances, the Agency shall refuse entry in the register of importers of active substances and issue a decision thereon.
(7) The Agency may request additional documents and/or data required for the entry in the register of importers of active substances pursuant to paragraph six of Article 3 hereof.
(8) The Agency may delete the importer of active substances from the register of importers of active substances, should the pharmaceutical inspector ascertain that it failed to satisfy the requirements set out in the previous Article hereof and the regulations adopted on the basis hereof, and issue an order prohibiting the performance of the activity of importing active substances. The Agency may delete the importer of active substances from the register of importers of active substances also on the importer’s proposal and if it establishes, by perusing the Slovenian Business Register, that the business entity has been deleted therefrom. The Agency issues a decision on the deletion.
(9) The documentation pertaining to the application for notification in the register of importers of active substances shall be deemed a business secret if defined as such by the applicant, in accordance with the regulations.
(10) The Agency shall publish a list of registered importers of active substances on its website. The list shall contain the name of the business entity and its permanent address.
(11) The competent minister shall determine in greater detail the contents of the application, the conditions, the method and the procedures required for the notification of the entry and deletion from the register as well as the detailed content of the register of importers of active substances.
Article 122
(Change of conditions for the entry in the register of importers of active substances)
(1) The importer of active substances entered in the register of importers of active substances shall inform the Agency forthwith about any change in the conditions referred to in the first paragraph of Article 120 hereof that significantly affects the quality or safety of the active substance it imports.
(2) The Agency shall enter the change referred to in the previous paragraph in the register of importers of active substances based on a positive opinion of the expert commission for establishing the fulfilment of conditions for the import of active substances within 90 days of receiving a complete application and shall issue a certificate thereon and/or enter the change within 30 days of receiving a complete application, if it estimates that the fulfilment of conditions need not be verified and issues a certificate thereon.
(3) If the change in conditions referred to in the first paragraph hereunder does not concern the data from the register of importers of active substances, the Agency shall issue a decision on the assessed fulfilment of conditions for the import of active substances within 30 days of receiving a compete application or 90 days if it estimates that the fulfilment of the conditions should be verified.
(4) Should the expert commission referenced in the second paragraph above issue a negative opinion on the fulfilment of the conditions for the importing of active substances, the Agency shall not enter the change in the register of importers of active substances and issue a decision thereon.
(5) Notwithstanding the provisions of the previous paragraph, the importer of active substances shall notify any other changes of conditions which are the basis for the notification of the import of active substances in its annual report which it shall submit to the Agency by 15 December of the current year at the latest, namely the report shall specify all changes in the current year. The Agency shall, within 30 days of the date of receiving a complete report, issue a certificate on the change of entry in the register of importers of active substances.
(6) The competent minister shall determine in greater detail the contents of the application for notification of changes in the conditions and annual reporting on changes as well as the method and procedure of entry of the change in the register of importers of active substances and procedure for the issue of decision on the assesment of fulfilment of conditions for importing of active substances.
X. WHOLESALE BROKERING OF MEDICINAL PRODUCTS AND ACTIVE SUBSTANCES
Article 123
(Conditions and obligations for brokers)
The wholesale brokers of medicinal products and active substances shall:
comply with the requirements of good distribution practice for those activities concerning brokerage;
set up a traceability system for medicinal products or active substances which supports the recalling of medicinal products or active substances;
keep the documentation on brokering of medicinal products and active substances;
maintain a quality system with clearly defined responsibilities and described procedures as well as define the risk management method in relation to their activities;
ensure that the medicinal products which are subject to brokerage have the medicinal product marketing authorisation or a temporary extraordinary medicinal product marketing authorisation;
verify and ensure that they do business only with the providers of medicinal products (manufacturers, importers and wholesalers) which comply with the requirements of good manufacturing or distribution practices and the regulations governing medicinal products and/or active substances in the country in which they have their registered office as well as hold the authorisation for manufacturing of medicinal products or wholesaling of medicinal products;
forthwith inform the Agency about any falsified medicinal products or active substances or any suspicion thereof;
Keep the documents related to the brokerage of medicinal products or active substances which shall be available to the Agency for inspection, and keep such documentation for at least five years.
Article 124
(Register of brokers in the marketing of medicinal products and active substances)
(1) Business entities with the registered office in the Republic of Slovenia carrying out the activity of wholesale brokerage of medicinal products or active substances shall prior to starting their activity notify it with the Agency so as to be entered in the publicly available register of brokers with medicinal products or active substances.
(2) The Agency shall issue a certificate of the entry into the register of brokers with medicinal products and active substances.
(3) The Notification for the entry into the register of brokers with medicinal products and active substances shall include the following data:
name and registered office of the business entity;
contact data (contact person, telephone, fax, e-mail).
(4) The medicinal product and active substance brokers shall forthwith inform the Agency about any changes to data entered in the register referred to in the first paragraph of this Article.
(5) Should the pharmaceutical inspector establish that the broker failed to meet the conditions referred to in the previous Article and issue a prohibition to perform the activity, the Agency shall delete the broker from the register referred to in the first paragraph hereunder and issue a decision thereon.
(6) The Agency may delete the broker of medicinal products and active substances from the register of brokers of medicinal products and active substances on the broker’s proposal and if it establishes, by perusing the Slovenian Business Register, that the business entity has already been deleted therefrom.
(7) The competent minister shall determine in greater detail the contents of the application, the conditions, the method and the procedures for the entry in, change of and deletion from the register of brokers of medicinal products and active substances as well as the contents of the register of brokers of medicinal products and active substances.
Article 125
(Notification to the database of the European Union)
The Agency shall submit to the European Union (EudraGMDP) database the data on the business entities which were granted the manufacturing authorisation for medicinal products and the authorisation for wholesale of medicinal products, the information on the certificates of good manufacturing practice and good distribution practice as well as data on business entities which were entered in the registers applicable to manufacturing of medicinal products, wholesaling of medicinal products, importing of active substances or the activity of wholesale brokerage of medicinal products or active substances.
XI. RETAIL OF MEDICINAL PRODUCTS
Article 126
(Retail trade and dispensation of medicinal products through the Internet)
(1) Retail trade in medicinal products for human use, accompanied by adequate expert support and counselling, and retail trade in medicinal products for human use, used for the treatment of animals, shall only be carried out in pharmacies and specialised stores, whereas retail trade in medicinal products for veterinary use shall also be carried out in veterinary organisations and other organisations that perform veterinary activities in accordance with veterinary regulations, together with the service provided for those animals that are kept in the records of such organisations or in case of preventive or therapeutic veterinary procedures performed by the veterinary organisation on animals at the place of their owner or keeper.
(2) Notwithstanding the previous paragraph, only those medicinal products can be sold in specialised retail stores which are not subject to medical or veterinary prescription and are authorised by the Agency in the marketing authorisation for medicinal products.
(3) When defining medicinal products that can be retailed in specialised stores, the Agency may impose certain restrictions concerning the strength, packaging size or number of units sold.
(4) The Agency shall publish on its website the list of medicinal products that may be issued in specialised stores. It only includes those herbal and synthetic medicinal products which have a favourable risk-benefit balance and are used for the elimination of mild symptoms and health problems and their pharmacovigilance data indicates a minor risk.
(5) Only a qualified person pursuant to Point 1 of the first paragraph of Article 127 hereof may sell medicinal products in specialised stores and must inform the buyer of the method of use of the medicinal product, potential precautions, adverse reactions and other important information regarding the medicinal product.
(6) Medicinal products in specialised retail stores may only be sold to adult persons.
(7) The business entities referred to in the first paragraph hereunder shall forthwith inform the Agency about any falsified medicinal products or any suspicion thereof.
(8) In the case of more serious health problems of a patient, the person referred to in item 1 of the first paragraph of Article 127 of the present Act working in a specialised store selling medicinal products shall refer the patient to a physician or a Master of pharmacy at a pharmacy.
(9) The method and place of issuing medicinal products shall be defined in the relevant marketing authorisation.
(10) Homeopathic medicinal products shall only be dispensed in pharmacies, whereas the homeopathic medicinal products for veterinary use shall also be issued in providers of veterinary activity, together with the service, namely for those animals that are kept in the records of the provider of veterinary activity or in case of preventive or therapeutic veterinary procedures performed by the provider of veterinary activity on animals at the place of their owner or keeper.
(11) Commercial initiatives that encourage the end user to buy or use unnecessary or excessive medicinal products shall be prohibited in the retail trade in medicinal products.
(12) Medicinal products that are not dispensed based on a medical or veterinary prescription may be dispensed via the Internet with the permission of the minister.
(13) Dispensation of medicinal products via the Internet shall mean retail sale of medicinal products, including appropriate and expert independent support with consultation regarding the use of a medicinal product and transport and delivery of medicinal products that assures quality and safety of the use of medicinal products.
(14) Dispensation of medicinal products via the Internet shall be performed by pharmacies and specialised stores for medicinal products. Specialised stores may only dispense those medicinal products over the Internet that may be sold in specialised stores for medicinal products in accordance with the provisions of paragraph 2 hereof.
(15) A pharmacy or specialised store for medicinal products shall fulfil the following conditions for dispensing medicinal products via the Internet:
It shall have regulated Internet sales in accordance with regulations governing electronic commerce and protection of consumers in Internet sales;
It shall assure security in the creation, delivery, reception, storage or other form of data processing in accordance with the law regulating the protection of personal data.
It shall assure a system of quality that reasonably observes the principles and guidelines of good distribution practice for medicinal products regarding traceability, transport and delivery of medicinal products to the place of dispensation;
It shall assure expert consultancy on individual medicinal products.
(16) A pharmacy or specialised store for medicinal products detailed in the above paragraph shall apply to its website a common logo selected by the European Union on the basis of Directive 2011/62/EU and shall include a secure Internet link to the list of dispensation providers published by the ministry competent for health. The common logo shall be applied to every page of the website of the pharmacy or specialised store for medicinal products.
(17) The ministry competent for health shall establish a website that shall contain information on:
national legislation governing dispensation of medicinal products via the Internet;
common logo referenced in the prior paragraph;
list of providers of dispensation of medicinal products via the Internet and their website addresses;
risks related to medicinal products being illegally sold to the public via the Internet;
link to the website of EMA, containing information on applicable European Union legislation on counterfeit medicinal products and link to websites of competent bodies of member states with regard to information listed under indents one, two, three and four of the present paragraph.
(18) The website of the provider of dispensation of medicinal products via the Internet shall contain the following data:
name and registered address of the pharmacy with a listing of the organisational unit dispensing medicinal products or specialized store for medicinal products that dispenses medicinal products via the Internet;
person responsible for dispensing medicinal products via the Internet;
contact data of the ministry competent for health;
link to the website of the ministry competent for health, in accordance with paragraph seventeen of the present article.
(19) A pharmacy or specialised store for medicinal products shall apply for authorisation for dispensing medicinal products via the Internet at the ministry competent for health.
The application shall contain the following details:
name and registered address of the pharmacy with a listing of the organisational unit that shall dispense medicinal products via the Internet or specialized store for medicinal products with a listing of location at which medicinal products shall be dispensed via the Internet;
the number and date of certificate of fulfilment of conditions for performing pharmacy activities of number and date of authorisation for retail sale of medicinal products in specialised stores that shall be dispensing medicinal products via the Internet;
evidence on the fulfilment of conditions set out in paragraph fifteen of the present Article;
date of commencement of dispensation of medicinal products via the Internet;
address of the website or other information required for the identification of website that dispenses medicinal products.
(20) The ministry competent for health shall revoke authorisation for dispensation of medicinal products via the Internet:
should the pharmaceutical inspector prohibit the dispensation of medicinal products via the Internet due to the pharmacy of specialised store for medicinal products failing to fulfil the conditions set out in paragraph fifteen of the present Article;
at the request of the pharmacy or specialized store for medicinal products that dispenses medicinal products via the Internet.
(21) Besides the responsibility of the Internet source of a medicinal product – which includes the liability of the manufacturer, the holder of the marketing authorisation or the pharmacy or specialised store for medicinal products which placed the medicinal product on the market, the wholesalers and retailers – the end user or buyer of such medicinal product shall also be responsible for any risks and damages incurred through the use of medicinal products obtained from non-traceable Internet sources or sources that do not comply with the requirements referred to in the present Article.
(22) Retail sale of medicinal products that require a medical or veterinary prescription via the Internet is prohibited. Supervision of the sale of such medicinal products via the Internet shall be performed by the competent customs body in line with customs regulations.
(23) The competent minister shall determine a more detailed manner of dispensing medicinal products and associated classification, the conditions for the design and use of the common logo set out in paragraph sixteen of the present Article and procedure of issuing and revoking authorisation for sale of medicinal products via the Internet.
Article 127
(Specialised stores for medicinal products)
(1) The retail sale of medicinal products in specialised stores may be undertaken by business entities holding an appropriate authorisation issued by the Agency and satisfying, besides the general conditions for performing the retail sale activity and the following conditions:
They shall employ at least one qualified person with at least completed secondary education in the field of pharmacy (or veterinary medicine in case of medicinal products for veterinary use), who has passed the qualifying examination and can submit evidence on regular professional training and other independent professional trainings that are also mandatory for pharmacy or veterinary technicians, additional training of the expert body engaging in pharmacy activity and is put in charge of purchasing, storing and selling medicinal products and keeping the documentation;
The qualified person from the previous item shall be available at all times during the specialised store’s business hours;
They shall dispose of the necessary equipment and adequate facilities in which the medicinal products or the activity of retailing medicinal products must be spatially or otherwise physically separated from other products or activities and appropriately marked;
They shall keep appropriate documentation which facilitates immediate recall of a medicinal product from the market and the resolving of complaints;
They shall appropriately mark the specialised store.
(2) The procedure for the issue of the authorisation for retailing of medicinal products in a specialised store shall be initiated on the basis of an application submitted by a business entity with the registered office in the Republic of Slovenia.
(3) The Agency shall issue the authorisation for the retail sale of medicinal products in a specialised store within 90 days of receiving a complete application on the basis of an opinion issued by an expert commission for the establishment of fulfilment of conditions for retail trading of medicinal products.
(4) The authorisation referred to in the previous paragraph may also be issued for a limited period of time or conditionally, if the expert commission referenced in the previous paragraph ascertains that the holder of the authorisation for retailing of medicinal products in specialised stores has not fulfilled the prescribed conditions.
(5) The authorisation referred to in the first paragraph of the present Article may be revoked temporarily or permanently, should the pharmaceutical inspector ascertain that the holder of the authorisation for retailing of medicinal products in specialised stores has not fulfilled the prescribed conditions, on the basis of which a prohibition to perform the activity is issued.
(6) The retail authorisation for the sale of medicinal products in specialised stores shall also be cancelled on the proposal by the authorisation holder.
(7) Should the Agency establish, by perusing the Slovenian Business Register, that the business entity which is the holder of retail authorisation for the sale of medicinal products in specialised stores has already been deleted therefrom, it shall establish ex officio that the authorisation for retailing medicinal products ceased to be valid, it shall be revoked on the basis of an issued decision.
(8) The competent minister shall determine in greater detail the conditions to be fulfilled by specialised stores for the retailing of medicinal products as well as the procedure and method of establishing these conditions.
Article 128
(Pharmacies)
Requirements for retailing medicinal products imposed on pharmacies shall be regulated by a separate act.
XII. PHARMACOVIGILANCE
1. Pharmacovigilance system
Article 129
(Obligation to report on supposed adverse reactions to medicinal products)
(1) A healthcare professional shall report to the national pharmacovigilance centre about the following adverse reactions to medicinal products for human use:
all supposed serious adverse reactions;
all unexpected supposed adverse reactions which are not serious; and
all supposed adverse reactions which are the consequence of a mistake related to the use of medicinal product, incorrect use, abuse, overdosing, unauthorised use and professional exposure to the medicinal product.
(2) Notwithstanding the previous paragraph, a healthcare professional shall report on all supposed adverse reactions to medicinal products for human use which are included on the list of medicinal products under additional supervision as published by the EMA in compliance with Article 23 of the Regulation (EC) No 726/2004.
(3) A veterinarian who identifies or suspects any adverse reactions to medicinal products for veterinary use shall inform thereof the marketing authorisation holder in accordance with this Act and the regulations adopted on the basis hereof. In the event of serious adverse reactions caused to animals and human beings related to the use of veterinary medicinal products, the Agency shall also be informed thereon by the veterinarian, business entity or institution in the field of veterinary medicine, besides the marketing authorisation holder.
Article 130
(Patients’ reports on supposed adverse reactions to medicinal products)
The patients may report on suspected adverse reactions to medicinal products referred to in the first and second paragraphs of the previous Article to healthcare professionals or directly to the national pharmacovigilance centre.
Article 131
(Collection and assessment of reports on adverse reactions to medicinal products)
(1) The collection of reports referred to in the first and second paragraphs of Article 129 and Article 130 hereof on the supposed adverse reactions to medicinal products for human use and their assessment shall be performed by the national pharmacovigilance centre.
(2) The national pharmacovigilance centre shall no later than within 24 hours after receiving the reports referred to in the previous paragraph submit to the Agency the collected information on supposed adverse reactions and other relevant data related to safety, efficiency and use of medicinal products as well as the functioning of the pharmacovigilance system.
Article 132
(Institutional co-operation)
Should the Agency – while collecting, reviewing and assessing the reports referred to in Articles 129, 130 and 131 hereof – establish a need for additional definition of their clinical relevance and public-health relevance and the related pharmacovigilance activities, it shall use the expert and expert opinion of external specialists in clinical and public-health fields.
Article 133
(Duties of the marketing authorisation holder)
(1) The marketing authorisation holder for medicinal products for human use shall:
establish, maintain and manage the pharmacovigilance system so as to ensure the collection and management of the documents about all suspected adverse reactions to medicinal products in the European Union or in third countries, scientific evaluation of all information, explore the possibilities for reducing and preventing risks, adopt necessary measures as well as exchange data with the authorities competent for medicinal products in the EU Member States;
regularly evaluate their pharmacovigilance system, compile a Pharmacovigilance system master file and submit it to the Agency at its request;
manage the risk management system for each medicinal product and upgrade it to correspond to the established risks as well as monitor pharmacovigilance data;
inform the Agency about the established new or changed risks, the changed risk-benefit balance with medicinal products and, either beforehand or immediately inform the Agency, the European Commission and the EMA about the contents of every publication of the information concerning pharmacovigilance;
immediately submit, upon the request of the Agency, data proving that the risk-benefit balance remains favourable;
fulfil the requirements and obligations for the supervision of non-intervention studies onafety or efficiency of medicinal products after obtaining the marketing authorisation as defined herein;
submit data on all suspected adverse reactions to medicinal products into the EudraVigilance database, except for the bibliographic reports on medicinal products with active substances listed in the publications that are monitored by the EMA;
Fulfils the obligations concerning the regularly updated reports on the safety of medicinal products in compliance with the first and the third paragraphs of Article 107b and the first, second, third and sixth paragraphs of Article 107c of the Directive 2001/83/EC;
consider the procedures while carrying out pharmacovigilance tasks which are described in detail in the implementing measures of the European Commission pursuant to Article 108 of the Directive 2001/83/EC, the guidelines on good practices in the field of pharmacovigilance pursuant to Article 108a of the Directive 2001/83/EC and the scientific guidelines on the efficiency studies after obtaining the marketing authorisation pursuant to Article 108a of the Directive 2001/83/EC.
(2) The holder of the marketing authorisation for medicinal products for veterinary use shall establish and maintain their own pharmacovigilance system which ensures collection, evaluation and exchange of data with the authorities competent for medicinal products in other EU Member States and the European Union. Holders of marketing authorisation for medicinal products for veterinary use shall report to the Agency about the adverse reactions to medicinal products and perform other tasks within the deadlines and using the method defined in Articles 74 and 75 of the Directive 2001/82/EC.
(3) The medicinal product marketing authorisation holder shall have at their permanent disposal a person responsible for the pharmacovigilance system and responsible for the establishment and maintenance of the pharmacovigilance system who shall be available at all times.
(4) The responsible person referred to in the previous paragraph shall have an adequate education, knowledge and experience in the field of pharmacovigilance and shall live and work in the European Union.
(5) In terms of medicinal products for human use, adequate education from the previous paragraph shall mean second cycle medical studies or an equivalent degree corresponding to this level of knowledge pursuant to the law, and in terms of medicinal products for veterinary use, it shall mean second cycle veterinary studies, or an equivalent degree corresponding to this level of knowledge pursuant to the law. If the person responsible for the pharmacovigilance system does not have adequate education, they shall receive permanent and uninterrupted professional support from a person with adequate education.
(6) If the marketing authorisation holder does not have the registered office in the Republic of Slovenia, it can appoint, besides the responsible person, also an appropriately qualified contact person in charge of pharmacovigilance in the Republic of Slovenia with a second cycle degree in medical, veterinary or pharmaceutical fields or an equivalent degree corresponding to this level of knowledge pursuant to the law. A contact person shall also be appointed upon the request of the Agency issued in a form of a decision. A contact person can be a business entity with the registered office in the Republic of Slovenia or an individual with permanent or temporary residence in the Republic of Slovenia performing pharmacovigilance activities for the needs of one or more business entities referred to in the first and the third paragraphs of Article 20 hereof or one or more business entities holding the authorisation to enter or import medicinal products.
Article 134
(Tasks of the Agency in pharmacovigilance)
(1) The Agency shall perform the following tasks in the field of pharmacovigilance:
manage the pharmacovigilance system for performing the tasks of pharmacovigilance and participating in the activities of pharmacovigilance of the European Union;
supervise the implementation of the pharmacovigilance system by the marketing authorisation holders and other participants in the pharmacovigilance system.
(2) The Agency shall perform the following tasks concerning medicinal products for human use, in addition to the tasks set out in the previous paragraph hereunder:
record all supposed adverse reactions to medicinal products noted by healthcare professionals and patients and determine and scientifically evaluate all information on the safety of medicinal products, study the possibilities for reducing and preventing risks and take action with the aim of reducing and preventing risks associated with medicinal products for human use;
regularly assess the pharmacovigilance system;
report the supposed adverse reactions to medicinal products in the EudraVigilance database;
set up and maintain a web portal on medicinal products and inform the public on the issues of pharmacovigilance via the web portal and other media;
manage the funds earmarked for pharmacovigilance-related activities, operation of communication networks and inspection related to pharmacovigilance in order to ensure independence in performing of those activities;
as regards the medicinal products approved in accordance herewith and in co-operation with the bodies of the European Union, monitor the results of measures aimed at reducing risks specified in the risk management plans and the conditions laid down in Article 58 hereof, and assess risk management system updates;
monitor data on medicinal products in the EudraVigilance database with the aim of determining whether any new risk has arisen, whether the risks have changed and whether the risks of a medicinal product have affected the risk-benefit balance. If any action is necessary, it will be taken under the urgent procedure in accordance with Articles 107i through 107k of the Directive 2001/83/EC.
consider the procedures while carrying out pharmacovigilance tasks which are described in detail in the implementing measures of the European Commission pursuant to Article 108 of the Directive 2001/83/EC and the guidelines on good practices in the field of pharmacovigilance pursuant to Article 108a of the Directive 2001/83/EC.
(3) The Agency shall perform the following tasks concerning medicinal products for veterinary use, in addition to the tasks set out in the first paragraph hereunder:
determine and scientifically evaluate all adverse reactions to medicinal products for veterinary use and other knowledge on the safety of medicinal products for veterinary use, and other tasks pursuant to Articles 92, 93 and 94 of Directive 2001/82/EC.
the Agency shall inform the competent authority for veterinary medicine of the pharmacovigilance measures adopted by the Agency in the case of serious risk to the health of people and animals.
(4) The Agency may impose special obligations on healthcare professionals to encourage reporting supposed adverse reactions to medicinal products or collect information and follow up reports on any supposed adverse reactions to biological medicinal products.
Article 135
(Delegation of tasks)
(1) If, due to a large-scale pharmacovigilance problem, the Agency’s resources are exceeded, it may delegate any of its tasks in the area of pharmacovigilance of medicinal products for human use, in part or in full, to one of the EU Member States, subject to the latter’s written approval.
(2) The ministry competent for health shall notify the Agency of the delegation of tasks referred to in the previous paragraph.
Article 136
(Pharmacovigilance in homeopathic products)
The provisions of Articles 131 through 135 hereof shall apply to homeopathic products except those under the second paragraph of Article 53 hereof. The minister may prescribe a pharmacovigilance system for those homeopathic products.
Article 137
(Specific conditions and requirements for the pharmacovigilance system)
The competent minister shall prescribe the specific conditions, methods and procedures applying to the pharmacovigilance system.
2. Non-interventional clinical trial at the request of the competent authority
Article 138
(Procedure of obtaining consent to the draft protocol of the non-interventional clinical trial)
(1) The marketing authorisation holder who at the request of the Agency or EMA conducts a non-interventional clinical trial after obtaining a marketing authorisation pursuant to Article 58 hereof shall obtain prior to the trial a written consent from the Agency to the draft protocol whenever the clinical trial is performed only in the Republic of Slovenia or an approval from the competent committee of the EMA in accordance with Articles 107n through 107q of the Directive 2001/83/EC whenever the clinical trial is performed in several EU Member States.
(2) The marketing authorisation holder shall submit for non-interventional clinical trials referred to in the previous paragraph hereunder a draft protocol to the Agency whenever the trial is performed only in the Republic of Slovenia or to the competent committee of the EMA in accordance with Articles 107n through 107q of the Directive 2001/83/EC whenever the trial is performed in another EU Member State as well.
(3) Within 60 days of submitting the draft protocol referred to in the previous paragraph the Agency shall issue:
a decision on consent to the draft protocol referred to in the first paragraph hereunder or
a decision opposing the draft protocol by stating the reasons of opposition, provided:
It is established that the performance of the non-interventional clinical trial stimulates the prescription and consumption of medicinal products,
It is established that the non-interventional clinical trial plan fails to ensure the attainment of the trial objectives,
or
a decision establishing that the non-interventional clinical trial complies with Articles 33 through 40 hereof.
(4) The competent minister shall determine the detailed conditions for obtaining consent to the draft protocol for the non-interventional clinical trial on safety or efficacy of a medicinal product for human use after obtaining a marketing authorisation.
3. MEASURES IN THE CASE OF INAPPROPRIATE QUALITY OF MEDICINAL PRODUCTS AND MEASURES TAKEN IN PHARMACOVIGILANCE CASES
Article 139
(Measures taken in the event of inappropriate quality of medicinal products)
(1) Business entities manufacturing or marketing medicinal products shall report all events or suspected events regarding inappropriate quality of medicinal products, which could affect the safety or efficacy of the medicinal product, to the Agency, the marketing authorisation holder and the business entity marketing the medicinal products.
(2) The marketing authorisation holder referred to in Article 20 hereof shall withdraw the deficient medicinal product from the market and/or take any other necessary measures as well as regularly and promptly inform the Agency of the action taken.
(3) The marketing authorisation holder referred to in Article 20 hereof shall notify the competent authorities of the EU Member States in which the medicinal product is marketed forthwith of any action taken by him to withdraw a medicinal product from the market or to suspend or cancel the marketing authorisation, together with the reasons for such action if the latter concerns the efficacy of the medicinal product or the protection of public health.
(4) The Agency shall monitor and, if necessary, direct the activities of the marketing authorisation holder in relation to the measures taken in the event of inappropriate quality of medicinal products and report the findings according to the international rapid alert system of authorities responsible for medicinal products of EU Member States and of EU bodies as well as, if required, of authorities of third countries.
(5) The Agency shall immediately inform the EMA in the case of taking any measures that could influence the protection of public health in the EU Member States and, if necessary, also the World Health Organisation.
(6) The competent minister shall determine in greater detail the measures to be taken in the case of inappropriate quality.
Article 140
(Measures taken in pharmacovigilance cases)
(1) Provisions of the previous Article shall apply mutatis mutandis in the cases of increased risk arising from adverse reactions that could be harmful to the health of people or animals or impact the risk-benefit balance of the medicinal product and should be reported according to the international rapid alert system of authorities competent for medicinal products of EU Member States and of EU bodies.
(2) The competent minister shall determine more detailed measures to be taken in the cases stated in the previous paragraph.
XIII. PROVISION OF MEDICINAL PRODUCTS IN EXTRAORDINARY CASES AND DONATIONS
Article 141
(Provision of medicinal products in extraordinary cases)
(1) Medicinal products that are at the proposal of the Minister provided by the Republic of Slovenia in accordance with the law regulating commodity reserves in case of natural or other large scale disasters and wars, shall be provided if the shelf life of medicinal products allows consumption before expiry and:
if the medicinal product is authorised or temporarily authorised for marketing in the Republic of Slovenia;
If the medicinal product is not authorised for marketing in the Republic of Slovenia, but is authorised for marketing in another EU Member State, or
If the medicinal product is not authorised for marketing in any EU Member State, but is authorised for marketing in a third country that has equivalent requirements concerning quality, safety and efficacy of medicinal products, and has a report attached on quality analysis.
(2) The marketing authorisation holder shall be liable for any damage incurred as a result of inappropriate quality of the medicinal product listed in the above paragraph, if the damage arose from their action. If such damage results from distribution or dispensation of medicinal products, liability shall be assumed by the business subject carry out said activities.
(3) If a medicinal product from the first paragraph hereunder is provided to end users that are individuals and the medicinal product is intended to be dispensed to such individuals by a pharmacy or another place of delivery, as specified in the instruction in Paragraph eight of Article 141, the costs of healthcare services pertaining to prescribing and dispensing of a medicinal product shall be covered from the public funds of the compulsory health insurance provider or budgetary funds for persons without health insurance.
(4) The compulsory health insurance provider shall monitor and record the prescribing and dispensing of medicinal products detailed under paragraph one of the present Article, that are pursuant to provisions of paragraph eight hereof dispensed at pharmacies, and shall prepare financial analyses and reports on prescribed and dispensed medicinal products for end users. The compulsory health insurance provider shall use the following data for preparing financial analyses and reports on prescribed and dispensed medicinal products in line with paragraph one hereof:
personal data of end users – insured persons – from the records of the compulsory health insurance provider (ID number (Health Insurance Institute of Slovenia number) in line with regulations on healthcare and health insurance, name and surname, sex, date of birth, permanent or temporary residence of insured person) and personal data from the central population register (personal identification number);
personal data of end users who are uninsured and are citizens of the Republic of Slovenia from the central population register (personal identification number, name and surname, year of birth, sex, permanent or temporary residence);
personal data from personal identification documents of end users for persons who are not citizens of the Republic of Slovenia and are not insured (name and surname, citizenship, year of birth, sex, permanent or temporary residence);
data of the manager of databases pursuant to the act governing databases in the field of healthcare, on consumption of medicinal products, healthcare providers and providers of pharmacy services.
(5) The compulsory health insurance provider shall use the personal identification number to link data of end users listed under indents one and two of the prior paragraph for the purposes of collecting, processing and disclosure of data on prescribed and dispensed medicinal products detailed under paragraph one of the present Article in accordance with the directions of the minister under paragraph eight hereof.
(6) The compulsory health insurance provider shall prepare financial analyses and reports on prescribed and dispensed medicinal products detailed under paragraph one of the present Article based on acquired data under paragraph eight hereof and shall submit it to the Agency, the ministry competent for health and, in case of instituted protective measures, to the relevant authorised institution charged with implementation of such a protective measure.
(7) The business subject that carries out dispensing of medicinal products outside a pharmacy or applies medicinal products pursuant to instructions under paragraph eight of the present Article shall report on dispensed or applied medicinal products to the Agency, the ministry competent for health and, in case of instituted protective measures, to the relevant authorised institution charged with implementation of such a protective measure in accordance with the directions of the minister under paragraph eight hereof.
(8) The Minister shall issue a direction to prescribe the manner of prescribing and dispensing or application of each medicinal product under paragraph one of the present Article to end users at a pharmacy or another place of dispensing or application of medicinal products and the form and content of financial analyses and reports on presribed and dispensed or applied medicinal products from paragraph one of the present Act and the manner of submission of analyses and reports to the Agency, the ministry competent for health and, in case of instituted protective measures, to the relevant authorised institution charged with implementation of such a protective measure.
Article 142
(Business donation of medicinal products and assurance of medicinal products for the purpose of iodine prophylaxis)
(1) A business donation of medicinal products shall be a purposeful and unconditional gift a business entity provides to a healthcare provider free of charge on the basis of an expressed and substantiated need for the medicinal product that is the subject of a business donation and is required for the provision of healthcare activities.
(2) Recipient of a business donation may be a healthcare provider that is financed from public funds. If the recipient of a business donation of medicinal products is a healthcare provider that has an organised hospital pharmacy, the donated medicinal products shall be acquired and recorded in such a hospital pharmacy.
(3) Pharmacies that are independent business subjects may not be recipients of a business donation.
(4) Business donation shall not be allowed for medicinal products intended for compassionate use in accordance herewith.
(5) Medicinal products that are the subject of a business donation shall not be resold.
(6) The donor shall be the business entity or an individual who covers the cost of the donated medicinal product, including the costs of wholesale.
(7) Business donations of medicinal products for which the healthcare provider has expressed and substantiated a need, shall be allowed:
if conditions laid down in the third paragraph of Article 143 hereof are met;
if the outer packaging of the donated medicinal product clearly states that it is a donated medicinal product;
if the donor of the medicinal product submits a statement obligating them to supply the medicinal product even one year after the conclusion of the business donation programme to all patients included in the programme, provided that the patients’ benefit of the treatment with such medicinal product is documented even if, after the expiry of the projected programme supply period, public funds are not guaranteed for funding this medicinal product,
if the donation has been notified to the Agency and the compulsory healthcare insurance provider and information on the donation published on their websites.
(8) A business donation may not promote prescribing, dispensing, selling or using of the medicinal product concerned with the healthcare providers for activities financed from the public funds, or medicinal product that was rejected in the process of reimbursement classification or inclusion in publicly financed healthcare programmes.
(9) In medicinal products participating in public procurement procedures, business donation may not affect such procedures, their outcomes and the client’s use of selected medicinal products in the implementation period.
(10) Notwithstanding the previous paragraph, business donations of medicinal products, which are subject to public procurement and the term of public procurement is not yet completed, shall be prohibited.
(11) Donors must report business donations of the following medicinal products to the Agency:
under indent 2 of the first paragraph of Article 143 hereof, based on an application containing an expressed and justified position of the donation recipient;
for which the supplier selected in the public procurement process fails to provide the necessary quantities of the same medicinal product.
(12) Potassium Iodide tablets within a 10 km radius around NEK for the purpose of implementing the protective measure of prophylactic administration of iodine shall be provided by NEK, along with the financing of all healthcare services prescribing and dispensing medicinal products in pharmacies or at other delivery points according to instructions referred to in the eighth paragraph of Article 141 hereof associated with the protective measure. Protective measures of iodine prophylaxis shall be subject to paragraphs four through eight of Article 141 hereof.
(13) The activities related to wholesaling of medicinal products related to donated medicinal products and medicinal products detailed in the previous paragraph may be performed by wholesalers of medicinal products and notified wholesalers with registered office in the European Union.
(14) A more detailed manner of assurance of potassium iodide tablets for the purpose of implementing the protective measure of iodine prophylaxis on the entire territory of the Republic of Slovenia shall be prescribed by the Minister.
Article 143
(Criteria for the provision of medicinal products from budgetary funds and for business donation of medicinal products)
(1) The provision of medicinal products from budgetary funds and business donation of medicinal products shall be allowed:
in the case of large-scale natural or other disasters (nuclear, ecological disasters, terrorism or industrial disasters) or other emergency situations or in the case of managing threats to health (large-scale accidents, threatening infections, epidemics, pandemics, poisonings, ionising radiation, including protection against the above and similar events), or for other reasons in the interest of protection of public health or in the case of other circumstances endangering public health and animal health;
if the medicinal product that is subject to donation constitutes a significant therapeutic, scientific and technical innovation.
(2) Provisions of the previous paragraph refer to medicinal products, the shelf life of which enables their consumption prior to expiry.
(3) Provision of medicinal products from budgetary funds and business donation of medicinal products in the cases referred to in the indent 1 of the first paragraph hereunder shall be permitted subject to a need expressed by the Government of the Republic of Slovenia or the recipient of a business donation from the second paragraph of the previous Article:
if the medicinal product is authorised or temporarily authorised for marketing in the Republic of Slovenia;
If the medicinal product is not authorised for marketing in the Republic of Slovenia, but is authorised for marketing in another EU Member State,
If the medicinal product is not authorised for marketing in any EU Member State, but is authorised for marketing in a third country that has equivalent requirements concerning quality, safety and efficacy of medicinal products, and has a report attached on quality analysis.
(4) The import of medicinal products that are the subject of provision from budgetary funds or business donation is performed by business entities having authorisation to manufacture medicinal products, including the activity of import.
(5) The marketing authorisation holder shall be liable for any damage incurred as a result of inappropriate quality of the medicinal product that is the subject of provision from budgetary funds or business donation if the damage arose from their action. If damage was caused during the distribution of medicinal product, the liability for it shall lie with the distributor.
(6) The process of issuing consent to the donation of medicinal products, the content of the application, the documentation, detailed criteria for the issue of consent to the donation of medicinal products, detailed conditions on the substance, the process of notification and publication from indent 4 of the seventh paragraph of the previous Article shall be determined by the competent minister.
Article 144
(Humanitarian aid in the form of medicinal products)
(1) The Government of the Republic of Slovenia may receive humanitarian aid from other EU Member States or third countries in the form of medicinal products:
in cases of natural and other disasters on a larger scale (nuclear, ecological disasters, terrorism and industrial disasters);
in cases of managing threats to health (harmful infections, epidemics, pandemics, mass poisonings, radiation – ionising and similar), or
in other exceptional circumstances that pose a threat to public health and health of animals.
(2) If a medicinal product referred to in the previous paragraph is provided to an end user that is an individual, the costs of healthcare services pertaining to prescribing and dispensing, delivery or application of a medicinal product by a healthcare practitioner in accordance with the provisions of Article 181 shall be covered by the compulsory health insurance provider and shall be repaid by the Republic of Slovenia from budgetary funds.
(3) The Government of the Republic of Slovenia may provide humanitarian aid in the form of medicinal products to recipients in other EU member states or third countries. Humanitarian aid in the form of medicinal products is an unconditional gift for a specific purpose which the Government of the Republic of Slovenia or a business entity gives to the donation’s recipient which may be another country or national or international governmental or non-governmental or international humanitarian organisation which performs work in the territory of another country in accordance with the humanitarian principles and conventions, based on an expressed need and made without expecting any benefit in return.
(4) The Government of the Republic of Slovenia shall cover the expenses of humanitarian aid and the costs of its delivery to the recipient, as detailed in the above paragraph.
(5) Humanitarian aid detailed in Paragraph three above shall be permitted in the case of large-scale natural disasters or other emergency situations such as wars, terrorist attacks etc. in which health and life of people are endangered and if the medicinal product’s shelf life enables its consumption prior to its expiry.
(6) For the purpose of providing humanitarian aid referred to in the third paragraph hereunder, the competent ministry for foreign affairs in cooperation with the competent ministry for healthcare carries out a public procurement contract for the purchase of medicinal products for humanitarian aid and grants authorisation to a wholesaler of medicinal products to export such medicinal products or deliver them to the recipient of humanitarian aid.
(7) The activities of marketing of medicinal products pertaining to humanitarian aid detailed in the first and third paragraph above may be performed by business entities having an authorisation for wholesaling of medicinal products and notified wholesalers of medicinal products with registered office in the EU.
(8) Financing of prescribing, delivery, dispensation or application set out in the first paragraph of the present Article and recording and reporting on the prescribed, delivered, dispensed or applied medicinal products shall be subject to the provisions of paragraphs one through eight Article 141 hereof.
Article 145
(Sale of medicinal products from national commodity reserves)
The Government of the Republic of Slovenia may in exceptional cases sell-off part of its medicinal products from its commodity reserves to other EU Member States or third countries, provided that in such countries health and life of people or animals are endangered, based on the request made by such country, provided that this does not increase the risk to public health and life of people or animals on the territory of the Republic of Slovenia and where the medicinal product’s shelf life enables its consumption before expiry.
XIV. ADVERTISING OF MEDICINAL PRODUCTS
Article 146
(Advertising of medicinal products)
Advertising of medicinal products shall mean any form of information, including door-to-door information, publication or inducement designed to promote the prescription, dispensing, sale or consumption of medicinal products.
Article 147
(Terms and conditions of advertising)
(1) The marketing authorisation holders may advertise medicinal products in accordance with this Act and the regulations adopted on the basis of this Act.
(2) It is prohibited to advertise medicinal products which have not been granted a marketing authorisation.
(3) All parts of the advertising of a medicinal product must comply with the summary of product characteristics.
(4) Advertising of medicinal products must encourage the rational use of the medicinal product, by presenting it objectively and without exaggerating its properties, and may not be misleading.
Article 148
(Advertising in general public)
(1) It is only allowed to advertise in the mass media medicinal products dispensed without prescription.
(2) It is prohibited to advertise to the general public the following:
medicinal products dispensed only on medical or veterinary prescription;
medicinal products containing psychotropic or narcotic substances within the meaning of international conventions, such as the United Nations Convention on narcotic drugs of 1961 and the United Nations Convention on psychotropic substances of 1971;
medicinal products which can be used as growth promoters or production stimulator (for example, hormones, beta-agonists, thyrostatic substance, bovine somatrophin).
(3) The advertising of a medicinal product for which no prescription is required to the general public shall not contain any material:
giving the impression that a medical or veterinary consultation or surgical operation is unnecessary, in particular by offering a diagnosis or by suggesting treatment by mail;
suggesting that the effects of taking the medicinal product are absolutely guaranteed, are unaccompanied by adverse reactions or are better than, or equivalent to, those of another treatment or medicinal product;
suggesting that the health of the person or animal can be enhanced only by taking the advertised medicine;
suggesting that the health of the person or animal could deteriorate without taking the advertised medicine. This prohibition shall not apply to vaccination programmes;
directed exclusively or principally at children;
referring to a recommendation by scientists, healthcare professionals or publicly renowned persons who could encourage the use of medicinal product because of their media influence;
suggesting that the medicinal product is a foodstuff, cosmetic or other product;
suggesting that the safety and efficacy are due to the fact that it is natural;
That could, by a description or detailed representation of a case history, lead to erroneous self-diagnosis;
referring, in improper, alarming or misleading terms, to claims of recovery; or
using, in improper, alarming or misleading terms, pictorial representations of changes in the human or animal body caused by disease or injury, or of the action of a medicinal product on the human or animal body or parts thereof;
(4) Direct distribution of medicinal products for promotional purposes to the end users of medicinal products, healthcare professionals and performers of healthcare activity shall be prohibited.
(5) Notwithstanding the first paragraph hereunder, the Agency, based on the opinion of an institution authorised to develop programmes of prevention, management, elimination and eradication of infectious diseases, may permit the manufacturers of medicinal products to perform vaccination campaigns, including the relevant data on vaccines included in the program of vaccination and protection with medicinal products, to provide information on the possible vaccinations against individual diseases for those vaccinations that are included in the national programme by applying this Article mutatis mutandis.
(6) The competent minister shall determine in greater detail the conditions and method of advertising of medicinal products to the general public.
Article 149
(Advertising of medicinal products to the expert community)
(1) Marketing authorisation holders may advertise medicinal products with marketing authorisation to the expert community in professional publications and by directly informing experts who prescribe or dispense medicinal products and exceptionally handing out samples.
(2) Notwithstanding the above paragraph, holders of authorisation for marketing medicinal products may use direct information to inform or train healthcare workers in connection with a medicinal product, the trading authorisation or healthcare provider authorisation for marketing which shows that its correct and appropriate administration essentially requires informing or training of patients as part of their healthcare of training of healthcare professionals.
(3) Advertising of medicinal products by means of direct advertising to persons authorised to prescribe and dispense medicinal products or healthcare workers detailed above who are participating in the performance of their activity in the framework of public health service can only be carried out during the time of expert preparation for work not intended for direct work with the patients.
(4) The marketing authorisation holder shall:
keep a list of expert colleagues who advertise medicinal products by means of direct advertising to persons authorised to prescribe and dispense medicinal products and persons referenced in the second paragraph above, including data on their education;
keep a record of advertising and communication from the previous paragraph hereunder;
submit the list referred to in indent 1 and the record referred to in the previous indent hereunder to the Agency with the aim of performing expert supervision in the scope of pharmaceutical control pursuant to the law.
(5) The provisions of the third and fourth paragraph shall not apply to the advertising of medicinal products through direct informing of persons performing the veterinary activity.
(6) Where medicinal products are being promoted to expert community, persons qualified to prescribe or supply them and persons referred to in the second paragraph above shall be offered no gifts, pecuniary advantages or benefits in kind may be supplied, offered or promised, unless they are inexpensive and relevant to the practice of medicine, veterinary medicine or pharmacy. The value of small gifts, pecuniary advantages or benefits in kind may not exceed the value prescribed for civil servants.
(7) Organisation, implementation and hospitality of promotional meetings shall be strictly limited to the professional purpose of the meeting which includes obtaining of new skills and knowledge on new medicinal products and may only be provided to persons authorised to prescribe and dispense medicinal products and persons referenced in the second paragraph above.
(8) Marketing authorisation holders, manufacturers of medicinal products, business entities acting on behalf of manufacturers and business entities marketing medicinal products, as well as subsidiaries of foreign manufacturers may enable persons who prescribe or dispense medicinal products and persons referenced in the second paragraph above to acquire additional knowledge on new medicinal products in scientific and expert meetings, however, only subject to the restrictions referred to in the sixth and seventh paragraph hereof.
(9) Persons authorised to prescribe or supply medicinal products and persons from the second paragraph hereunder shall not solicit or accept any inducement prohibited under the sixth and seventh paragraph hereunder.
(10) The marketing authorisation holder shall establish a professional service for advertising medicinal products with experts to advertise medicinal products to persons prescribing and dispensing medicinal products and to persons referenced in the second paragraph of this Article.
The experts on medicinal products shall have a second cycle degree in pharmacy, medicine or veterinary medicine or a second cycle degree or a legally equivalent degree in another field which, in accordance with the applicable classification of professions, presents knowledge on the functioning of the human or animal organism and additional knowledge related to medicinal products, and shall be entered in the register of experts for advertising medicinal products kept by the Agency.
The experts on medicinal products that may be dispensed in specialised stores shall have at least completed secondary technical school education in pharmacy, subject to the conditions under item 1 of the first paragraph of Article 127 hereof.
(11) The minister shall determine in greater detail the conditions and method of advertising medicinal products to the expert community.
Article 150
(Register of experts for advertising medicinal products)
(1) Marketing authorisation holders shall notify to the Agency prior to commencement of advertising of medicinal products the experts for entry in the register of experts for advertising medicinal products, kept by the Agency. The Agency shall publish data from the register in accordance with the regulations governing the protection of personal data.
(2) The notification for entry in the register referred to in the previous paragraph hereunder shall include name and address of the marketing authorisation holder, and name, surname and professional qualifications of the expert for advertising medicinal products.
(3) The marketing authorisation holder shall notify the Agency on any change of experts for advertising medicinal products.
(4) The Agency shall delete an expert from the register of experts for advertising medicinal products upon a proposal of the marketing authorisation holder.
(5) The expert for advertising medicinal products shall present a certificate on entry in the register referred to in the first paragraph hereunder to providers of health care, veterinary and pharmacy services.
(6) The minister shall determine in greater detail the contents of the application, the conditions, the method and the procedures required for the entry, change and deleting from the register of experts for advertising medicinal products and the detailed contents of the register of experts for advertising medicinal products.
Article 151
(Advertising in extraordinary cases)
(1) The minister may, by way of exception and in the interest of the general public, with a view to preventing an epidemic, an epizootic, or in case of a natural or other disaster or in similar emergencies, allow information about the use of certain medicinal products to be distributed to the mass media.
(2) In the cases referred to in the previous paragraph concerning veterinary medicinal products, the minister shall allow information on the use of certain medicinal products in public media in agreement with the minister competent for veterinary medicine.
Article 152
(Exclusion from the scope of advertising of medicinal products)
(1) The following activities shall not be deemed advertising or advertising material, subject to the condition that their aim is not to promote prescribing, dispensing or consuming medicinal products:
information on a medicinal product: the summary of product characteristics, packaging and package leaflet approved in the marketing authorisation, which the patient can receive upon his request;
material approved by the Agency in the scope of risk management plan;
published information related to the approved changes in packaging, warnings of adverse reactions and other general precautionary measures aimed at safer and more efficient consumption of the medicinal product;
sales catalogues and pricelists not including statements on properties of medicinal product;
correspondence on specific issues concerning a medicinal product, including any non-promotional material enclosed;
publications and materials of an institution authorised to prepare programmes aimed at prevention, management, elimination and eradication of infectious diseases concerning the possibilities of vaccination against individual diseases;
information related to human health or diseases subject to the condition that no reference, including any indirect, is made to medicinal products.
(2) All information concerning the medicinal product have to be of quality, objective, impartial, unambiguous, integral, balanced, comprehensible to patients, healthcare professionals and entities performing healthcare activity, verifiable, updated, reliable, correct, eligible, not misleading and not containing elements of direct or hidden advertising.
(3) The minister shall prescribe in greater detail the conditions for information related to medicinal products excluded from the scope of advertising of medicinal products.
XV. OFFICIAL QUALITY CONTROL OF MEDICINAL PRODUCTS
Article 153
(Official control laboratory)
(1) The tasks of an official control laboratory included in the activities of the European network of Official Medicines Control Laboratories at the European Directorate for the Quality of Medicines and Healthcare (hereinafter: EDQM), shall be performed by the National Laboratory for Health, the Environment and Food (hereinafter: NLHEF), pursuant to permission referenced in Paragraph three, Article 30 hereof.
(2) NLHEF shall comply with the requirements of the ISO 17025 standard and provide for inter-laboratory verification of qualifications and periodic assessments of the quality assurance system implemented by EDQM.
Article 154
(Types of official controls)
(1) The types of official controls of the quality of medicinal products are as follows:
Regular control of the quality of marketed medicinal products performed ex officio as a rule once every five years for each pharmaceutical form and strength of a medicinal product unless the Agency determine otherwise based on a risk assessment. Regular control of the quality of marketed medicinal products for which a marketing authorisation has been granted under the centralised procedure shall be performed according to the annual programme adopted by the EMA in co-operation with EDQM;
Extraordinary control of quality of medicinal products performed upon a request of a pharmaceutical inspector in the case of suspected inappropriate quality or falsified medicinal products;
special control of quality of medicinal products to be assured before marketing by authorisation holders referred to in the first paragraph of Article 20 hereof, except for the holders of authorisations for compassionate use of medicinal products and holders of authorisations referred to in indents 1, 2, 3, 4, and 5 of the third paragraph of Article 20 hereof for each batch of vaccines, serums and blood products of human origin and immunological medicinal products for veterinary use intended for diagnosing the state of immunity;
quality control of medicinal products required by the Agency in the framework of the procedure for obtaining a marketing authorisation for a medicinal product or a parallel imported medicinal product.
(2) The marketing authorisation holder referred to in the first paragraph of Article 20 hereof shall provide the necessary documentation and reference material for regular and extraordinary quality controls of medicinal products within 30 days of receiving the request of NLHEF unless the Agency determines otherwise.
Article 155
(Report on the performed quality control of a medicinal product)
(1) NLHEF shall issue a report on the performed quality control of a medicinal product and submit it to the marketing authorisation holder, the parallel import authorisation holder, the temporary marketing authorisation holder or the entity proposing the control of quality of medicinal product and the Agency.
(2) The cost of official control of the quality of medicinal products is borne by:
in the case of regular quality control of medicinal products, the marketing authorisation holder, the parallel import marketing authorisation holder or the temporary marketing authorisation holder;
in the case of extraordinary quality control of medicinal products, the marketing authorisation holder or the parallel import marketing authorisation holder for medicinal products with a marketing authorisation and the temporary marketing authorisation holder for medicinal products without a marketing authorisation if it turns out that the quality of a medicinal product is deficient. If the quality control of a medicinal product is performed due to suspected falsification of the medicinal product, the cost of the extraordinary quality control shall be borne by the business entity marketing the medicinal product. If the medicinal product’s quality is deemed appropriate or if the medicinal product is not falsified, the cost of the extraordinary control of quality incurred on the business entity shall be remunerated from the budget of the Republic of Slovenia;
in the case of special quality control of medicinal products, the entity proposing the special quality control detailed in item three of Paragraph one of the previous Article;
In the case of quality control of medicinal products required in the framework of the procedure for obtaining a marketing authorisation or a parallel import marketing authorisation, the applicant specified in Article 43 or Article 117 hereof.
(3) The minister shall determine the detailed substance and the deadlines of official quality controls of medicinal products, the sampling method and the price of service.
INSPECTION PRICES OF MEDICINAL PRODUCTS
Article 156
(Pricing of medicinal products)
The prices of medicinal products are not regulated and follow the market conditions except in cases stipulated herein.
Article 157
(Submitting data on the free prices of medicinal products)
(1) In the interest of public health protection, the minister or the minister competent for veterinary medicine may specify medicinal products or groups thereof not financed from public funds with prices freely determined in the market for which the business entities participating in marketing of medicinal products must submit data to the Agency on purchase and sale prices of those medicinal products and on the quantities of medicinal products sold over a certain period.
(2) The reporting agents for data on prices of medicinal products shall be business entities having an authorisation referred to in the first and second paragraph and indent 3 of the third paragraph of Article 20 hereof, holders of authorisations for wholesaling of medicinal products, pharmacies and specialised stores for medicinal products
(3) The minister shall prescribe specific requirements for reporting data used for the purpose under the first paragraph hereunder, elements to be monitored, medicinal products or groups of medicinal products the prices of which are monitored, the method of the Agency reporting to the ministry competent for health on the monitoring of prices and publication of data on the monitored prices.
Article 158
(Setting prices of medicinal products)
(1) The Agency shall set the maximum allowed price based on an application for medicinal products for human use, which may be marketed in accordance with the first and second paragraph or indent 3 of the third paragraph of Article 20 hereof and are financed from public funds or intended to be financed from public funds.
(2) The Agency may, on the basis of an application for the increase of the maximum allowed price, an opinion issued by the competent committee detailed in indent 4 of the fifth paragraph of Article 4 hereof, and the established public interest in the area of health and economic justifications of risk that might arise from interrupted supply of the market with medicinal products and provable, unavoidable and disproportionate costs that would be incurred exclusively in meeting of public service obligations, determine exceptionally allowed higher price.
(3) The minister shall prescribe the method, criteria, obligatory elements of the application, the level of marketing and the procedure for determining the maximum allowed price of medicinal products and the exceptionally allowed higher price of medicinal products and the method, criteria and period for changing the maximum allowed price.
(4) The prices of medicinal products for veterinary use which may be marketed in accordance with the first or second paragraph or indent 3 of the third paragraph of Article 20 hereof, the level of which could impact animal health care and consequently harm the health of human beings, may in exceptional cases (e.g. epizootics, epidemics arising from epizootizcs, zoonoses, illnesses that are fought pursuant to regulations of veterinary medicine, in disproportionate influences of the price of medicinal products on the price of food) be formed or determined according to the method specified by the competent minister for veterinary medicine.
Article 159
(Prices of medicinal products that are lower than their maximum allowed price and exceptionally allowed higher prices)
(1) Prices of medicinal products may be lower than their maximum allowed price and exceptionally allowed higher price based on an agreement made between marketing authorisation holders referred to in the first paragraph of the previous Article or wholesalers and:
providers of healthcare insurance who settle the costs of dispensed medicinal products;
providers of healthcare services financed from public funds in public procurement procedures;
providers of pharmacy services financed from public funds in public procurement ocedures;
business entities at which healthcare activities are performed for their care recipients in social security programmes;
the Slovenian Armed Forces for the purpose of providing healthcare support to its members; or
holders of system competencies in public health and national commodity reserves.
(2) Holders of authorisation under Article 20 hereof, which are public law entities established in the Republic of Slovenia, shall set prices under the previous paragraph considering the standpoints based on cost-justified setting of prices.
With such prices they shall enter into agreements with the entities from the previous paragraph, subject to prior consent of the competent ministry of health.
Article 160
(Mandatory discounts)
(1) If it is in the public interest of maintaining sustainable financing of medicinal products from public funds or in case of absent or inappropriate competition in the market for medicinal products, the minister may set by a decree a mandatory discount to marketing authorisation holders referred to in the first and second paragraph of Article 20 hereof, except for the holders of authorisation for compassionate use of medicinal product. A mandatory discount is set for one or more elements of the maximum allowed price of the medicinal product.
(2) The mandatory discount referred to in the previous paragraph hereunder may only be set for medicinal products financed from public funds:
If they are not on the list of essential or indispensable medicinal products referred to in Article 17 hereof;
For which one or more business subjects from paragraph one of the prior Article have submitted an incentive for the conclusion of an agreement that would achieve a lower price of the medicinal product from paragraph one of the prior Article for business subjects:
the total value of purchases of which or the value of the medicinal product in question that was the basis for coverage of costs in medical insurance programs in the past calendar year, or
the total value of expressed needs for purchase of the medicinal product in question in the current calendar year represents at least three quarters of the value of sale of the medicinal product in question in the Republic of Slovenia in the past calendar year or expressed need for said medicinal product in the current year, the agreement for which was not concluded;
3. which are not on the list of interchangeable medicinal products with the highest recognised value; or
4. which do not have determined exceptionally allowed higher price.
(3) A mandatory discount is set for a period not exceeding 12 months.
Article 161
(Procedure for setting prices of medicinal products)
(1) The procedure for setting the maximum allowed price of a medicinal product referred to in the first paragraph of Article 158 hereof or setting the exceptionally allowed higher price of a medicinal product referred to in the second paragraph of Article 158 hereof shall be initiated by the Agency based on an application from the authorisation holder referred to in the first or second paragraph or the indent 3 of the third paragraph of Article 20 hereof.
(2) The Agency shall set the maximum allowed price of a medicinal product in 90 days of receiving a complete application.
(3) The Agency shall set an exceptionally allowed higher price of a medicinal product in 90 days of receiving a complete application. In the case of excessive workload related to the number of applications for the increase of exceptionally allowed higher prices, the deadline may be extended once, by a maximum of 60 days.
(4) The Agency may request additional evidence or documentation from the applicant in accordance with paragraph six of Article 3 hereof in the procedure of setting prices referred to in the first paragraph hereunder.
(5) The deadline set out in the second and third paragraph of the present Article shall be suspended from the date of serving of notification for hearing in the procedure for setting the maximum allowed price or exceptionally allowed higher price of a medicinal product to the date of receiving a response from the authorisation holder referred to in the first or second paragraph or the indent 3 of the third paragraph of Article 20 hereof. The response period set out by the Agency shall not be less than 15 days.
(6) If the price is not set within the deadlines from the second and third paragraph hereunder, it shall be deemed that the application has been granted and the applicant can market the medicinal product at the price proposed in the application.
(7) Appeal against the decision from the second and the third paragraphs of this Article shall not stay the execution of the decision.
Article 162
(Withdrawal of the measure of pricing regulation of medicinal products)
(1) Regardless of the law regulating pricing regulation, the authorisation holder referred to in the first or second paragraph or the indent 3 of the third paragraph of Article 20 may submit a proposal to the Government of the Republic of Slovenia on the withdrawal of the measure of pricing control which the Government of the Republic of Slovenia has introduced based on the law regulating pricing regulation. The proposal must state the reasons for the proposed withdrawal. The Government of the Republic of Slovenia shall submit a substantiated proposal for assessment to the ministry competent for pricing regulation.
(2) The ministry competent for price regulation may within 15 days of receiving the proposal from the Government of the Republic of Slovenia require the applicant to submit additional data and substantiations that the applicant is obliged to submit within 30 days.
(3) The ministry competent for pricing regulation shall apply the provisions of regulations for pricing regulation in preparing its opinion on the substantiation of the above proposal.
(4) The opinion on substantiation of the proposal under paragraph one of the present Article shall be submitted by the ministry competent for pricing regulation to the Government of the Republic of Slovenia within 15 days of receiving the proposal for withdrawal or supplemented proposal under paragraph two of the present Article, whereby the Government of the Republic of Slovenia shall within 75 days decide on the proposal and notify the applicant of the decision.
(5) In case of a great number of proposals for withdrawal from this Article, the deadline for preparing the opinion set out in paragraph four of the present Article may be extended one time for a period of 60 days, of which the Government of the Republic of Slovenia shall notify the applicant before the primary deadline expires.
Article 163
(Obligation to use the applicable price)
(1) Business entities that purchase and sell or issue medicinal products shall use the valid price of a medicinal product.
(2) The valid price of a medicinal product for human use hereunder can be:
the maximum allowed price of a medicinal product;
the maximum allowed price of a medicinal product;
the lower price of medicinal product than the maximum allowed price based on agreement from the first paragraph Article 159 hereof;
the price from the second paragraph of Article 159 hereof.
the maximum allowed price with mandatory discount form Article 160 hereof; or
the price of medicinal product that is set freely under the conditions of the market of medicinal products which are not financed from public funds or are not earmarked to be financed from public funds.
(3) Prices detailed in indents 1 through 5 of the previous paragraph shall be the maximum prices of medicinal products, whereby business subjects shall not be allowed to sell medicinal products above the price, but shall be allowed to sell at a lesser price.
(4) If business subjects reduce the prices detailed in points one to five in the second Paragraph of the present Article during the term of their validity, such reduced prices shall be deemed valid prices of medicinal products, provided the Agency was duly notified and has recorded and published the price on its website.
(5) Business entities that set a valid reduced price of a medicinal product in accordance with the provisions of the above paragraph, sell medicinal products, that are financed from public funds or are intended for financing from public funds in the period until its revocation by the business subject that the Agency records and publishes at its website within five working days of receiving notice of revocation.
(6) A business entity that purchases and sells or issues medicinal products shall invoice medicinal products financed from public funds at the applicable medicinal product price that is most cost effective for the business entity listed in the first paragraph of Article 159 hereof.
(7) A central medicinal product database shall be established for the purpose of monitoring the prices of medicinal products and shall be managed by the compulsory health insurance provider. The database shall keep the following data on medicinal products:
under items 1 to 4 of Article 187 hereof;
on the prices and beginning of validity of prices from indents one through five of the second and fourth paragraph hereunder, on the withdrawal of price set out under paragraph five hereof and prices of medicinal products set out pursuant to the law regulating pricing;
on maximum recognised values of medicinal products as set out by the compulsory health insurance provider.
on financing of medicinal products from public funds;
on presence of medicinal products on the market.
(8) Data from the above paragraph shall be submitted to the central database of medicinal products on the basis of computerised data exchange by the following:
the Agency – for data on medicinal products under indent one of the prior paragraph, data on prices of medicinal products from indents one and two of the second and fourth paragraph hereof and data on presence of medicinal products on the market as set out by indent five of the previous paragraph;
subjects from indents one through six of paragraph one of Article 159 hereof – for data on medicinal product pricing from indent three of paragraph two hereof;
holders of authorisation pursuant to paragraph two of Article 159 hereof – for data on medicinal product pricing from indent four of paragraph two hereof;
the compulsory health insurance provider – for highest recognised values of medicinal product from indent thee and data on medicinal product financing from public funds from indent four of the prior paragraph;
ministry competent for health – for data on medicinal product pricing from indent five of paragraph two hereof;
ministry competent for pricing regulation – for data on medicinal product pricing set out pursuant to the law governing pricing regulation.
(9) Subjects listed in the above paragraph shall submit data on medicinal product prices and the commencement and expiry of their validity into the central medicinal product database no later than two working days prior to commencement or expiry of validity of price of a medicinal product, while other data listed in the prior paragraph shall be entered within 8 days of its creation.
(10) The manner of submission of data under paragraphs eight and nine hereof and access to such data shall be set out by the Minister.
Article 164
(Obligation to report medicinal product pricing data)
Business entities authorised for retail and wholesale of medicinal products or holding an appropriate certificate of notification, specified in the third paragraph of Article 105 hereof shall submit to the Agency all data on the prices of medicinal products in a manner stipulated herein, while data on medicinal products for veterinary use shall also be submitted to the authority competent for veterinary medicine.
XVII. INSPECTION
Article 165
(Competencies in supervising the implementation of the Act)
(1) The inspection of the implementation of this Act and the regulations issued on the basis hereof shall be performed by pharmaceutical inspectors, official veterinarians, market inspectors and customs authorities.
(2) Pharmaceutical inspectors shall perform inspections within the competencies of the Agency.
(3) The official veterinarians supervise the provisions of this Act and the regulations issued on the basis hereof relating to the use of medicinal products and the related traceability of medicinal products for veterinary use.
(4) The import of medicinal products shall be supervised by the customs authorities with expert support provided by the Agency and the official veterinarians.
Article 166
(Competencies of pharmaceutical inspectors)
(1) In addition to the tasks specified in the previous Article hereof, pharmaceutical inspectors shall perform inspection tasks based on:
the law governing medical devices;
the law governing supply of blood;
the Act regulating the quality and safety of human tissues and cells intended for treatment; and
the Act regulating manufacturing of and trade in illicit drugs in the part related to illicit drugs of groups II and III which are medicinal products.
(3) The Act regulating inspections shall apply to the rights, duties, powers, procedures and measures in performing of inspection tasks by pharmaceutical inspectors unless specified otherwise by this Act or the regulations and laws of the European Union.
Article 167
(Pharmaceutical inspector)
(1) A pharmaceutical inspector may be a person meeting the conditions for performing inspections laid down by the Act regulating inspections.
(2) The Minister shall prescribe the additional expertise of a pharmaceutical inspector in individual areas of inspections in accordance with the specific regulations.
(3) Pharmaceutical inspectors shall be independent in performing of their tasks in accordance with their powers and within and based on the Constitution and the law.
(4) Pharmaceutical inspectors shall undertake ongoing professional training and education in accordance with a programme prescribed by the director of the Agency within the scope set for individual areas of inspection.
(5) Pharmaceutical inspectors shall sign a statement on any financial or other relation or otherwise with business entities subject to inspections, which shall be taken into account when individual inspection tasks are given to pharmaceutical inspectors in accordance with internal acts adopted by the Director of the Agency.
(6) If a pharmaceutical inspector declines to sign the statement set out above, he may be allocated to other systemised jobs and tasks within the Agency.
Article 168
(Appointment to expert commission)
Pharmaceutical inspectors may be appointed to an expert commission detailed in the eighth paragraph of Article 4 hereof.
Article 169
(verification of fulfilment of the conditions of good practices abroad)
(1) Based on co-operation between European Union Member States, a request from the competent body of a European Union Member State, the European Medicines Agency or the European Commission or a request from the competent body or business entity from the European Union or a third country, pharmaceutical inspectors perform expert tasks related to verifying compliance with the good manufacturing or distribution practice related to medicinal products, active substances and certain excipients at any business entity with a registered office in any European Union Member State or a third country, in accordance with the Regulation (EC) 726/2004, Directive 2001/83/EC, Directive 2001/82/EC, Directive 2001/20/EC, Directive 2005/28/EC and the Compilation of European Union Procedures.
(2) The pharmaceutical inspector shall issue a certificate on good manufacturing or distribution practice based on the results of the verification referred to in the previous paragraph hereunder if it is established that the business entity is implementing the principles and guidelines of good manufacturing or distribution practice.
Article 170
(Method of exercising inspections)
(1) Pharmaceutical inspectors shall perform inspections within their powers in the Republic of Slovenia as regular, extraordinary and repeated inspections, which may be unannounced.
(2) Regular pharmaceutical inspections shall be performed by pharmaceutical inspectors ex officio or based on an application submitted by a business entity. The frequency of regular inspections shall be determined with regard to the risk assessment and in accordance with the requirements set out by the regulations governing the relevant area of inspection.
(3) Extraordinary inspections shall be performed based on a grounded suspicion of non-compliance with the regulatory requirements or risk assessment in a case, a decision of the Agency or a request from bodies competent for medicinal products of European Union Member States or competent authorities of the European Union.
(4) Repeated inspections may be performed after the deadline set to eliminate deficiencies identified within the scope of regular or extraordinary inspection and to implement the imposed measures and tasks has expired.
(5) Pharmaceutical inspectors shall exchange information on the planned and performed inspections with the competent medicinal product bodies of European Union Member States and other authorities of the European Union.
(6) The pharmaceutical inspector may be accompanied at an inspection by another Agency employee or external expert in the relevant field.
(7) The pharmaceutical inspector shall draw up a record of the performed inspection and shall deliver it to the inspected business subject no later than within 30 days of the performed inspection. A record of inspection of good manufacturing and distribution practices shall be drawn up in the form set out in the Compilation of European Union Procedures.
Article 171
(Inspections in the area of advanced therapy medicinal products prepared on a non-routine basis)
Pharmaceutical inspectors carry out inspection referred to in the previous Article hereof also at providers of healthcare or veterinary services ordering and using advanced therapy medicinal products prepared on a non-routine basis.
Article 172
(Mutual recognition of documents on inspections)
Documents on inspections performed by competent bodies of European Union Member States or countries having concluded an agreement on mutual recognition of documents concerning medicinal products with the European Union shall be mutually recognised.
Article 173
(Measures of pharmaceutical inspectors in the field of medicinal products)
(1) Pharmaceutical inspectors determining in the course of an inspection violations of the law and the regulations issued on the basis thereof concerning their areas of competence shall have the following rights and duties in addition to the rights and duties laid down in the Act regulating inspections:
Prohibit performing of an activity due to non-meeting of the prescribed conditions;
prohibit marketing or order destruction or recall of certain batches of medicinal products; if it is found that:
a. the medicinal product is harmful in the normal conditions of use;
b. the medicinal product is lacking in therapeutic efficacy;
c. the risk-benefit balance is unfavourable under the prescribed condition of consumption;
d. its quality and quantitative composition is not as declared;
e. if the medicinal product and/or its ingredients have not been tested and the interim stages of the manufacturing process have not been tested or if certain other requirements or obligations related to the issued marketing authorisation for the medicinal product have not been met;
f. the medicinal product is falsified;
g. the medicinal product should not be marketed in accordance herewith;
inform all European Union Member States, business entities in the supply chain and the general public; if it is assumed that the medicinal product concerned poses a serious risk to public health;
prohibit entry or import of a medicinal product without due authorisation granted by the Agency;
order the removal or destruction of the material used for illegal advertising of medicinal products;
prohibit the advertising and information that are not in compliance with the provisions hereof;
order other measures and perform tasks necessary for the implementation of this Act and the regulations issued on the basis hereof;
notify other European Union Member States, the European Commission and the EMA of the results of inspections related to pharmacovigilance and the proposed measures.
(2) An appeal against the measures stipulated under the previous paragraph, ordered by the pharmaceutical inspector, shall not prevent their implementation.
(3) Should a pharmaceutical inspector establish any violations in the area of the use of veterinary medicinal products, the authority competent for veterinary medicine shall be informed thereof immediately.
Article 174
(Competencies of pharmaceutical inspectors in the area of advanced therapy medicinal products prepared on a non-routine basis)
To ensure compliance with the requirements laid down herein, pharmaceutical inspectors conduct regular, extraordinary and repeated supervision inspections also at the medical practitioners and veterinarians ordering and using advanced therapy medicinal products prepared on a non-routine basis.
Article 175
(Sampling of marketed medicinal products)
Sampling of marketed medicinal products for the purpose of quality assurance shall be performed by authorised persons of NLHEF.
Article 176
(Competencies of pharmaceutical inspectors related to prices of medicinal products)
(1) If the persons marketing medicinal products failed to comply with the applicable prices, the market inspector shall be entitled to issue a decision and demand the following:
Observation of the valid price of medicinal product;
that they refund to the payer the undue amounts resulting from the difference in the price, with accrued interest.
(2) If a participant in the marketing of a medicinal product failed to comply with the price stipulated on the basis of the present Act and regulations under Articles 158 and 160 hereof and charged too high prices of medicinal products to the payers, such participant shall refund such unduly charged amounts to the payers within 15 days of the issue of a final decision by the pharmaceutical inspector, together with the accrued interest, without a specific request.
(3) Interest stipulated hereunder shall equal the default interest in economic transactions based on the law of obligations.
(4) The pharmaceutical inspector shall inform of its decision the authority competent for veterinary medicine in the case of medicinal products for veterinary use.
Article 177
(Obligation to supply the market in accordance with the decision issued by the pharmaceutical inspector)
(1) If the participants in the marketing of a medicinal product fail to start or stop selling a medicinal product due to setting prices of a medicinal product pursuant to this Act or regulations specified in Articles 158 and 160 hereof upon their own initiative and if such action could seriously jeopardise the supply of medicinal products to the population, the pharmaceutical inspector may issue a decision referred to in the first paragraph of the previous Article imposing on them to immediately start or continue selling such medicinal product, applying the prices stipulated herein or in regulations adopted on its basis referred to in Articles 158 and 160 hereof.
(2) In such decision, the pharmaceutical inspector shall lay down a deadline by which the persons marketing medicinal products must meet the obligation stipulated under the previous paragraph; nevertheless, such obligation may not last more than three months after the decision is final.
Article 178
(Execution of decisions)
An appeal against the decision referred to in Article 177 hereof shall not prevent its execution with the exception of refunding the unduly charged amounts in accordance with the second paragraph of the stated Article.
Article 179
(Competences of official veterinarians)
Official veterinarians shall have the following rights and duties in addition to those laid down by the Act regulating inspections:
right and duty to conduct the violations procedure and impose sanctions for such violations;
impose on the legal entity or natural person to harmonise the operations with the provisions of this Act and the regulations adopted on its basis;
order prohibition of the use of medicinal products and active substances for the treatment of animals that are not compliant with the provisions hereof;
confiscate medicinal products in violation of this Act from the owner or keeper of the animal;
order the owner or keeper of the animal to destroy medicinal products in violation of this Act at their own cost.
XVIII. PUBLIC AGENCY FOR MEDICINAL PRODUCTS AND MEDICAL DEVICES
Article 180
(Operation and supervision)
(1) The Agency is a legal entity of public law.
(2) The founder of the Agency shall be the Republic of Slovenia. Rights of the founder shall be exercised by the Government of the Republic of Slovenia.
(3) The Agency shall be independent in performing its tasks.
(4) Operations of the Agency shall be supervised by the ministry competent for health.
(5) The law regulating public agencies shall apply to the Agency, unless the present Act provides otherwise.
Article 181
(Personnel management)
(1) In its working program and financial plan, the Agency also determines a staffing plan in coordination with the ministry.
(2) The work program and financial plan of the Agency shall be adopted by the Agency council and submitted to the founder for consent.
(3) The employees of the Agency are subject to the act governing the public sector salary system.
Article 182
(Tasks of the Agency)
(1) The Agency shall perform the following tasks concerning medicinal products:
administrative and expert tasks related to marketing authorisations for medicinal products in national and international procedures of assessing quality, safety and efficacy and the risk-benefit balance in consumption of medicinal products;
administrative, expert and supervisory tasks related to clinical trials;
tasks in the pharmacovigilance system for managing and reducing risks related to medicinal products, informing of the public, setting up and maintenance of a web portal on safety of medicinal products and participation in pharmacovigilance activities of the European Union;
expert tasks and participation in the distribution of work among European Union Member States related to regulation of medicinal products;
expert tasks in the work of committees and task forces of the EMA and other institutions and inclusion in international initiatives in accordance with the system guidelines of the Republic of Slovenia;
administrative and expert tasks related to classification of products for which there is a serious doubt whether they should be classified among medicinal products or in another product group;
administrative and expert tasks related to determining meeting of the conditions and principles and guidelines of good manufacturing practice concerning medicinal products, active substances and excipients;
administrative and expert tasks related to determining the fulfilment of the conditions and principles of good distribution practice in the field of medicinal products and active substances;
administrative and expert tasks related to determining meeting of the conditions and principles of good clinical practice in clinical trials of medicinal products;
administrative and expert tasks related to determining meeting of the conditions and principles of good pharmacovigilance practice;
administrative and expert tasks related to determining meeting of the conditions for the activity of preparation of advanced therapy medicinal products prepared on a non-routine basis;
supervision over medicinal products, active substances and excipients concerning medicinal products for human use and advanced therapy medicinal products prepared on a non-routine basis;
administrative, supervisory and expert tasks related to handling specific deviations from the conditions specified in the marketing authorisation;
supervision tasks related to medicinal products for veterinary use with the exception of defining doctrinal solutions in terms of safe use of medicinal products in veterinary medicine and the supervision over use and use-related traceability of medicinal products for veterinary use;
administrative and expert tasks related to pricing of medicinal products and supervision over prices of medicinal products;
administrative, expert and supervisory tasks related to the monitoring of presence of medicinal products in the market and assigning the national identifier of medicinal products;
administrative and expert tasks related to medicinal products without amarketing authorisation in the Republic of Slovenia;
administrative and expert tasks related to essential and indispensable medicinal products;
administrative and expert tasks related to donations of medicinal products;
administrative and expert tasks related to interchangeable medicinal products;
administrative and expert tasks related to evaluating health technologies;
tasks related to pharmacoepidemiological and pharmacoeconomic monitoring of the market in medicinal products and the pertaining methodologies, records and analyses of consumption and use of medicinal products;
expert support for the tasks of the official control laboratory;
tasks and measures related to falsified medicinal products;
devising, preparing and keeping official records related to medicinal products, active substances and excipients, which comprise products and business entities;
participation in preparation of the European Pharmacopoeia and preparation of the National Annex to the European Pharmacopoeia;
providing for translation of the ATC classification of medicinal products by the World Health Organisation, web publication of the defined daily doses for medicinal products marketed in the Republic of Slovenia and uniform national naming of active substances;
Participation with in the European network of competent bodies for medicinal products in the area of normative regulation of medicinal products and pricing of medicinal products;
Participation with the official control laboratory and its inclusion into the European network of Official Medicines Control Laboratories with EDQM;
other tasks related to medicinal products for human and veterinary use.
(2) The Agency shall also perform the following tasks:
participation in drafting laws and implementing regulations concerning the Agency’s area of competence;
keeping of official records based on this Act;
tasks associated with establishing and maintaining an information system within the scope of official records;
the tasks establishing an internationally recognised quality assurance system within the framework of good practices of normative administration in the field of medicinal products;
expert support in implementing system policies associated with medicinal products;
the tasks that involve co-operation with other management, expert and scientific institutions within the areas of its competence in Slovenia and abroad, and
other tasks within its area of competence.
(3) In addition to the tasks specified in the first and second paragraph hereunder, the Agency shall also perform tasks related to medical devices, blood and blood preparations, quality and safety of human tissue and cells intended for treatment, and production of and trade in Schedule II and Schedule III illicit drugs, in accordance with the specific regulations.
Article 183
(Sources of Agency financing)
(1) Funding for the Agency is provided from:
fees;
funds from the budget of the Republic of Slovenia;
compensation for other services;
other revenues.
(2) Funds from the budget of the Republic of Slovenia shall be provided for salaries, costs of material and services and costs of investments for those jobs within the Agency necessary for performing the tasks and services in individual areas of competencies for which this Act or other regulations of the Republic of Slovenia or the European Union do not foresee or allow the charging of fees or tariffs.
(3) The minister and minister competent for veterinary medicine shall define the nature and scope of tasks and programmes of the Agency to be financed from the budget of the Republic of Slovenia.
Article 184
(Bodies of the Agency)
(1) The bodies of the Agency shall be its Director and the Council of the Agency.
(2) The composition and the number of council members shall be determined by the founder in the Articles of Association.
(3) The Director and the council members may not be either employed by, or perform any form of work in, any organisation engaged in any form of for-profit activities activity in the area of medicinal products and medical devices, and may not have any function whatsoever in such organisations.
(4) Besides the reasons, stipulated by the act regulating public agencies, the Government of the Republic of Slovenia shall dismiss the Director or a council member of the Agency also in the following cases:
if the Director is declared unfit to conduct business or becomes incapable of performing the function for health reasons,
if the reason listed in the prior paragraph comes into existence;
In the event of final judgement sentencing the Director to imprisonment for a criminal offence or for causing economic losses.
Article 185
(Reporting on the work of the Agency)
(1) The Agency shall submit an annual report to the founder at least once a year by 28 February.
(2) The Agency shall make the report from the previous paragraph hereunder available to the public. Prior to publication, personal data and any data constituting a business secret shall be removed from the report.
Article 186
(Administrative decisions and decision in violation procedures)
(1) The Agency shall decide in accordance herewith in administrative matters at first instance pursuant to the act governing the general administrative procedure, unless otherwise stipulated by this Act.
(2) Appeals against decisions adopted by the Agency shall be decided on by the ministry competent for health, with the exception of the decisions falling within the competence of the official veterinarian, which shall be decided on by the ministry competent for veterinary medicine.
(3) The Agency shall be the minor offence authority for the areas lying within the competence of a pharmaceutical inspector.
(4) A violations procedure shall be conducted and decided upon by a pharmaceutical inspector, who fulfils the conditions laid down in the act regulating violations, and regulations adopted on the basis thereof.
Article 187
(Official records of the Agency)
The Agency shall keep the following official records for the purpose of protecting public health:
Records on data on medicinal products arising from marketing authorisation for medicinal products (name, pharmaceutical form, strength, packaging, classification with regard to prescribing and dispensing, marketing authorisation holder, maximum allowed price and exceptionally allowed higher price);
Records on data on medicinal products arising from marketing authorisation for parallel import of medicinal products (name, pharmaceutical form, strength, packaging, parallel import marketing authorisation holder, maximum allowed price and exceptionally allowed higher price);
Records on medicinal products with temporary marketing authorisation (name, pharmaceutical form, strength, packaging and authorisation holder);
Records on data on medicinal products with authorisation for import (name, pharmaceutical form, strength, packaging and authorisation holder);
Records on data on medicinal products with marketing authorisation for compassionate use (name, pharmaceutical form, strength, packaging and authorisation holder);
Records on donated medicinal products (name, pharmaceutical form, strength, packaging, quantity and donor);
Data on holders of authorisations for manufacturing of medicinal products (name, registered office and legal form of organisation and name and surname of qualified person in charge of release of individual batches of medicinal products);
Data on holders of authorisations for wholesaling of medicinal products (name and legal form of organisation, registered office, name and surname of qualified person in charge of receiving, storing and transporting medicinal products as well as examining documentation);
Records on holders of authorisations for preparation of advanced therapy medicinal products prepared on a non-routine basis (name, registered office and legal form of organisation, and name and surname of qualified person in charge of quality);
Records on notified foreign wholesalers (name and legal form of organisation, and registered office);
Records on brokers of medicinal products and active substances (name and registered office of the business entity);
Records on manufacturers, importers and distributors of active substances (name and legal form of organisation, and registered office).
Records on experts for advertising medicinal products;
Records on physicians and veterinarians ordering and using advanced therapy medicinal products prepared on a non-routine basis (name, surname and professional title, and name and address of the business entity where they perform healthcare activity);
Records on holders of authorisation for retailing of medicinal products (name and legal form of organisation, and registered office);
Article 188
(Publications)
The Agency may publish professional and general informative publications in its areas of competence.
Article 189
(Fees)
(1) The applicant shall pay fees to cover the cost of performing administrative tasks subject to the public authority carried out by the Agency, unless stipulated otherwise by law.
(2) The holders of marketing authorisations or the authorisations for parallel import of medicinal products and the holders of authorisation to perform activity, issued by the Agency, shall also pay the annual fees for the monitoring of medicinal products on the market concerning individual medicinal products depending on the number of pharmaceutical forms.
Article 190
(Tariffs)
The Agency Council shall issue Tariffs setting the amounts due for performing expert tasks and rendering services related to its areas of competence. Tariffs and their amendments shall come into force once the founder issues consent.
XIX. PENAL PROVISIONS
Article 191
(Offences)
(1) A fine of 800 to 4,000 euros shall be imposed for an offence on a legal entity:
dispensing galenic medicinal products more than six months after the entry of an equivalent or comparable industrially manufactured medicinal product on the market (third paragraph of Article 8 hereof);
acting contrary to Article 16 hereof in the import and entry of medicinal products for personal use and use on their animal;
for acting contrary to the second paragraph of Article 16, Point (d) of the second paragraph of Article 23, the fifth paragraph of Article 24 and Article 26 of the Regulation (EC) 726/2004;
failing to submit information listed in Article 24 hereof;
failing to report data on prescription and volume of consumption of medicinal products (Article 25 hereof);
promoting the use of a medicinal product and replacement of an existing therapy without reason (paragraph five of Article 40 hereof);
carrying out non-interventional testing of medicinal products contrary to paragraphs six or seven of Article 40 hereof;
failing to inform the Agency of new information that could impact the assessment of the risk-benefit balance pursuant to the seventh paragraph of Article 40 hereof,
failing to inform the patient or the owner or keeper of animal of the treatment procedure and the risks related to the treatment with advanced therapy medicinal product prepared on a non-routine basis, or to store such signed statement (third paragraph of Article 77 hereof);
failing to issue to the patient or the owner or keeper of animal the package leaflet in accordance with the fourth paragraph of Article 77 hereof;
failing to communicate a change in the data in accordance with the third paragraph of Article 78 hereof;
failing to inform the Agency of the changes that affect the conditions for the issue of an authorisation for the preparation of advanced therapy medicinal product prepared on a non-routine basis as specified by the first paragraph of Article 85 hereof,
failing to register the activity with the Agency in accordance with the fourth paragraph of Article 101 hereof;
failing to register with the Agency the activity of wholesaling medicinal products in the Republic of Slovenia in accordance with the third paragraph of Article 105 hereof;
failing to register the activity with the Agency in accordance with the fourth paragraph of Article 112 hereof;
failing to register the activity with the Agency in accordance with the fourth paragraph of Article 121 hereof;
failing to register the activity with the Agency in accordance with the first paragraph of Article 124 hereof;
failing to notify the Agency prior to advertising medicinal products of the experts for entry in the register of experts for advertising medicinal products (first paragraph of Article 150 hereof);
failing to report changes to the list of experts for advertising medicinal products to the Agency (third paragraph of Article 150 hereof);
failing to provide documentation and reference material for the performance of ordinary and extraordinary quality control of medicinal products pursuant to the second paragraph of Article 154 hereof,
failing to forward data on the purchase and sale prices of medicinal products not financed from public funds with the prices of these medicinal products being freely determined under market conditions, and data on the quantities of medicinal products sold over a certain time period (first paragraph of Article 157 hereof),
failing to communicate to the Agency all data on the prices of medicinal products in a manner stipulated herein, with data on medicinal products for veterinary use also being submitted to the authority competent for veterinary medicine (Article 164 hereof).
(2) A fine of 500 to 3,000 euros shall be imposed for an offence listed in the previous paragraph hereunder on a sole proprietor or an individual engaging in a registered activity.
(3) A fine of 200 to 1,000 euros shall be imposed for an offence listed in the first paragraph hereunder on the responsible person of a legal person, the responsible person of a sole proprietor or the responsible person of an individual engaging in a registered activity.
(4) A fine of 100 to 500 euros shall be imposed on an individual committing an offence specified in the first paragraph hereunder.
Article 192
(Serious offences)
(1) A fine of 8,000 to 120,000 euros shall be imposed for an offence on a legal entity for:
exceeding the annual quantity manufactured exceeding 50,000 packaging units (first paragraph of Article 8 hereof);
manufacturing galenic medicinal products contrary to the second paragraph of Article 8 hereof;
using industrially manufactured medicinal products, intermediates or intermediate products or semi-finished products for producing galenic products contrary to the fourth paragraph of Article 8 hereof;
manufacturing galenic medicinal products in a greater quantity without prior approval from the Agency (fifth paragraph of Article 8 hereof),
advertising or placing on the market any products with an alleged healing properties or disease prevention properties for use in human or veterinary medicine which pursuant to this Act are not considered a medicinal product (first paragraph of Article 9 hereof);
presenting products that are not classified as medicinal products pursuant hereto to patients or customers as having healing properties or disease prevention properties (second paragraph of Article 9 hereof).
not acting in compliance with Article 14 hereof when prescribing and dispensing medicinal products;
marketing medicinal products listed in Article 21 hereof;
failing to inform the Agency about inadequate quality of a medicinal product or suspected falsification of a medicinal product (Article 23 hereof);
not having concluded a contract with the manufacturer according to the second paragraph of Article 27 hereof;
Failing to manufacture and control medicinal products in line with Article 28 hereof;
performing clinical trials with advanced therapy medicinal products prepared on a non-routine basis (third paragraph of Article 33 hereof);
not performing clinical trials of medicinal products in accordance with Articles 34 and 35 hereof;
failing to insure its responsibility for damages incurred during clinical trials in accordance with Article 36 hereof;
failing to notify the agency of any material changes to ongoing clinical trials (first paragraph of Article 38 hereof);
failing to notify the non-interventional clinical trial with the Agency in accordance with the first paragraph of Article 40 hereof;
failing to compile a report for the Agency on the progress and outcome of the trial pursuant to the fourth paragraph of Article 40 hereof;
failing to notifying patients on their inclusion in a non-interventional clinical trial (fifth paragraph of Article 40 hereof),
marketing a generic medicinal product contrary to Articles 45 and 46 hereof;
failing to include the conditions and obligations related to the safety of medicinal product in the risk management system (seventh paragraph of Article 58 hereof);
failing to inform the Agency of the new information or all information pursuant to the first and second paragraph of Article 62 hereof;
selling medicinal products after the change or expiry of the marketing authorisation contrary to Article 67 hereof;
placing medicinal products for advanced therapy on the market contrary to the first paragraph of Article 71 hereof,
marketing or preparing advanced therapy medicinal products prepared on a non-routine basis contrary to Article 71 hereof;
failing to fulfil the requirements under Article 72 hereof;
acting contrary to the first and the second paragraphs of Article 74 hereof;
Failing to submit the annual report in accordance with Article 75 hereof;
exit and exporting and entry and importing advanced therapy medicinal products prepared on a non-routine basis (Article 76 hereof);
failing to establish damage liability for potential damage caused to a patient or an animal (second paragraph of Article 77 hereof);
using advanced therapy medicinal products prepared on a non-routine basis without obtaining and reviewing the certificate of conformity (fifth paragraph of Article 77 hereof);
failing to establish a system that provides sufficient data for the traceability of each patient or animal and product and monitor the progress of treatment (sixth and the seventh paragraph of Article 77 hereof);
not being registered in the register of physicians or veterinarians (first paragraph of Article 78 hereof);
failing to notify the change in data to the Agency pursuant to the third paragraph of Article 78 hereof;
failing to mark or label the advanced therapy medicinal product prepared on a non-routine basis with the package insert pursuant to Article 79 hereof;
failing to establish and maintain a system that guarantees traceability of advanced therapy medicinal products prepared on a non-routine basis and the input substances and raw materials, including the materials pursuant to the first paragraph of Article 80 hereof;
failing to store or provide data on traceability pursuant to the second and third paragraph of Article 80 hereof;
failing to assure a system of traceability of advanced therapy medicinal products prepared on a non-routine basis in accordance with the fourth paragraph of Article 80 hereof;
failing to inform the Agency of possible adverse reactions in accordance with the fifth paragraph of Article 82 hereof;
advertising advanced therapy medicinal products prepared on a non-routine basis, its preparation or treatment method (Article 81 hereof);
failing to institute a system of pharmacovigilance in line with the first paragraph of Article 82 hereof;
failing to appoint a person responsible for pharmacovigilance pursuant to the second and third paragraph of Article 82 hereof;
failing to submit at the request of the Agency a risk management plan in accordance with the fourth paragraph of Article 82 hereof;
preparing non-routine medicinal products contrary to the first paragraph of Article 83 hereof;
if it fails to notify the Agency of the changes pursuant to the first paragraph of Article 85 hereof;
The medicinal product is not marked and does not have the package leaflet in line with Article 87 hereof;
the medicinal product for human use does not have attached a safety feature for the medicinal product as stipulated by Article 88 hereof;
failing to assure a device for discovering a breach in the outer packaging (Paragraph three of Article 88 hereof);
If the safety feature on the medicinal product is partially or fully removed or covered contrary to the fifth paragraph of Article 88 hereof;
manufacturing medicinal products contrary to the medicinal product marketing authorisation (Article 90 hereof);
failing to fulfil the requirements for manufacturing medicinal products pursuant to Article 91 hereof;
the responsible person for releasing individual batches of medicinal products failing to meet the conditions in line with Article 92 hereof;
acting contrary to the obligations of manufacturers of medicinal products as specified in Article 93 hereof;
failing to inform the Agency of any change to conditions from Article 91 hereof (Article 96 hereof);
failing to fulfil the conditions for manufacturing active substances (first paragraph of Article 100 hereof);
failing to inform the Agency and the marketing authorisation holder of any falsified active substances or any suspicion thereof (second paragraph of Article 100 hereof);
performing the activity contrary to Article 101 hereof;
failing to inform the Agency of any change to conditions from Article 100 hereof that significantly impact the quality or safety of the active substance it manufactures (Article 102 hereof);
manufacturing excipients contrary to the guidelines and principles of good manufacturing practice for excipients (Article 103 hereof);
acting contrary to Article 104 hereof;
failing to fulfil the provisions applicable to wholesalers of medicinal pursuant to the first and second paragraph of Article 105 hereof;
failing to meet the obligations of wholesalers from Article 106 hereof;
failing to ensure the fulfilment of public service obligations in line with Article 107 hereof;
failing to perform the activity of wholesale of active substances pursuant to the first, second and fourth paragraph of Article 111 hereof;
failing to inform the Agency of falsified active substances pursuant to the third paragraph of Article 111 hereof;
failing to immediately inform the Agency of any change to conditions from the second paragraph of Article 111 hereof that significantly impact the quality or safety of the active substance it markets (Article 113 hereof),
importing medicinal products contrary to Article 114 hereof;
entry or importing medicinal products contrary to the second paragraph of Article 116 hereof;
failing to ensure the supply of medicinal products to the providers of healthcare, veterinary and pharmacy services pursuant to the ninth paragraph of Article 116 hereof;
failing to inform the Agency prior to starting parallel distribution in accordance with the first and the second paragraph of Article 118 hereof;
importing active substances contrary to Article 119 hereof;
failing to fulfil the conditions for importing active substances specified in Article 120 hereof;
failing to notify the Agency of falsified active substances or the suspicion thereof (second paragraph of Article 120 hereof);
performing the activity of importing active substances without the entry in the register of importers of active substances (fourth paragraph of Article 121 hereof);
failing to inform the Agency of any change to conditions referred to in the first paragraph of Article 120 hereof that materially impact the quality or safety of the active substance it imports (first paragraph of Article 122 hereof);
acting contrary to broker obligations pursuant to Article 123 hereof;
performing the brokerage of medicinal products or active substances without the entry in the register of brokers of medicinal products and active substances kept by the Agency (first paragraph of Article 124 hereof);
failing to inform the Agency of changes to information listed under the fourth paragraph of Article 124 hereof;
retailing medicinal products contrary to Article 126 hereof;
dispensing medicinal products via the Internet contrary to Article 126 hereof;
failing to meet the conditions for retail of medicinal products in specialised stores in accordance with the first paragraph of Article 127 hereof;
failing to implement the tasks stipulated in Article 133 hereof;
performing non-interventional clinical trials without Agency consent to the draft protocol pursuant to paragraph one of Article 138 hereof;
performing non-interventional clinical trials without consent detailed in the third paragraph of Article 138 hereof;
failing to notify the Agency, the marketing authorisation holder and business entities marketing the medicinal products concerned of events or suspected events of inappropriate quality of medicinal products that could affect the safety or efficacy of a medicinal product (first paragraph of Article 139 hereof);
failing to withdraw a deficient medicinal product from the market or take other necessary measures and inform, forthwith and without delay, the Agency of its activities (second paragraph of Article 139 hereof);
failing to immediately notify the competent authorities of the EU Member States in which the medicinal product is marketed of any action taken by him to withdraw a medicinal product from the market or to suspend or cancel the marketing authorisation, together with the reasons for such action if the latter concerns the efficacy of the medicinal product or the protection of public health (third paragraph of Article 139 hereof);
not acting in line with the seventh paragraph of Article 141 hereof;
business donation of medicinal products contrary to the third paragraph of Article 142 hereof;
business donation of medicinal products intended for compassionate use (fourth paragraph of Article 142 hereof);
pursuing resale of medicinal products subject to business donation (fifth paragraph of Article 142 hereof);
donating medicinal products contrary to the seventh, eighth and ninth paragraph of Article 142 hereof;
business donation of medicinal products contrary to the tenth paragraph of Article 142 hereof;
not acting in line with the eighth paragraph of Article 144 hereof;
failing to report a business donation pursuant to the eleventh paragraph of Article 142 hereof;
advertising medicinal products contrary to Article 147 hereof;
advertising medicinal products to the general public contrary to Article 148 hereof;
advertising medicinal products to the expert public contrary to Article 149 hereof;
failing to submit data or failure to submit data within the deadlines set out under the ninth paragraph of Article 163 hereof;
failing to sell medicinal products at the price stipulated in the fifth paragraph of Article 163 hereof;
failing to charge the price in line with the sixth paragraph of Article 163 hereof;
(2) A fine of 500 to 3,000 euros shall be imposed for an offence listed in the previous paragraph hereunder on a sole proprietor or an individual engaging in a registered activity.
(3) A fine of 500 to 5,000 euros shall be imposed for an offence listed in the first paragraph hereunder on the responsible person of a legal person, the responsible person of a sole proprietor or the responsible person of an individual engaging in a registered activity.
(4) A fine of 400 to 4,000 euros shall be imposed on an individual committing an offence specified in the first paragraph hereunder.
Article 193
(Authorisation to impose a fine within the specified limits)
In the cases listed in Articles 191 and 192 hereof, a pharmaceutical inspector may impose a fine, in an expedited minor offence procedure, in any amount within the specified limits stipulated by individual Articles.
XX. XVIII. TRANSITIONAL AND FINAL PROVISIONS
Article 194
(Issuance of implementing regulations)
(1) The implementing regulations under this Act shall be adopted within 18 months of this Act entering into force.
(2) Notwithstanding the previous paragraph the implementing regulations shall be adopted:
1. within two months following the entry into force hereof:
under the third paragraph of Article 44 hereof;
under the eighth paragraph of Article 58 hereof;
under the seventh paragraph of Article 62 hereof;
under the seventh paragraph of Article 63 hereof;
under the seventh paragraph of Article 87 hereof;
under Article 137 hereof,
under the fourth paragraph of Article 138 hereof and
under the second paragraph of Article 140 hereof.
2. within three months following the entry into force hereof:
under the sixth paragraph of Article 94 hereof;
under the fourth paragraph of Article 95 hereof;
under the third paragraph of Article 96 hereof;
under the sixth paragraph of Article 99 hereof;
under the eleventh paragraph of Article 101 hereof;
under the sixth paragraph of Article 102 hereof;
under the sixth paragraph of Article 104 hereof;
under the fourth paragraph of Article 105 hereof;
under the fourth paragraph of Article 109 hereof;
under the sixth paragraph of Article 110 hereof;
under the eleventh paragraph of Article 112 hereof;
under the fifth paragraph of Article 113 hereof;
under the sixth paragraph of Article 119 hereof;
under the eleventh paragraph of Article 121 hereof;
under the sixth paragraph of Article 122 hereof;
under the seventh paragraph of Article 124 hereof;
(3) Until the implementation of the implementing regulations issued on the basis of this Act, the following implementing regulations issued on the basis of the Medicinal Products Act (Official Gazette of the Republic of Slovenia, Nos 31/06 and 45/08) shall apply, unless contrary to this Act or unless specified otherwise herein:
Regulations on conditions for completing activities of making medicinals and determining of conditions and procedure of publishing or revocation of execution good production practices (Official Gazette of the Republic of Slovenia, No 91/08),
Regulations on the conditions and procedures for granting import permit for medicinal products for human use (Official Gazette of the Republic of Slovenia, Nos. 65/12 and 20/13);
Regulations on detailed conditions of wholesale of medicinal products and determining of fulfilment of these conditions and procedure of gain the permission for traffic of wholesale of medicinal products (Official Gazette of the RS, no. 46/09),
Regulations on authorisation of parallel imported product and parallel distribution of medicines (Official Gazette of the Republic of Slovenia, No. 49/09),
Rules concerning the requirements to be met by specialized shops for retail trade in medicinal products and on the procedure for ascertaining their compliance (Official Gazette of the Republic of Slovenia, no. 64/09),
Regulations on the conditions to be met by analysts in analytical testing of medicinal products and procedure for the verification of these conditions (Official Gazette of the RS, no. 16/10);
Rules on labelling of medicinal products and on patient information leaflet of medicinal products for human use (Official Gazette of the RS, nos. 21/12 and 52/12),
Regulations on the traditional medicinal products of plant origin (Official Gazette of the Republic of Slovenia, no. 55/06);
Regulations on the marketing authorisation for medicinal products for human use (Official Gazette of the RS, no. 109/10),
Regulations on permitted colouring agents for medicinal products (Official Gazette of the RS, no. 86/08),
Rules on the Classification, Prescribing and Dispensing of Medicinal Products for Human Use (Official Gazette of the Republic of Slovenia, Nos 86/08, 45/10 and 38/12);
Regulations on homeopathic medicines for human use (Official Gazette of the Republic of Slovenia, No 94/08),
Rules on advertising of medicines (Official Gazette of the Republic of Slovenia, No 105/08, 98/09 – ZMedPri and 105/10);
Rules on the charges in the field of medicine (Official Gazette of the Republic of Slovenia, No 65/11);
Regulations on analytical, pharmacological- toxicological and clinical testing of medicinal products for human use (Official Gazette of the Republic of Slovenia, Nos 86/08 and 37/10);
Rules on analytical testing of medicinal products to perform state control of their quality (Official Gazette of the Republic of Slovenia, No. 10/12);
Rules on clinical testing of medicinal products (Official Gazette of the Republic of Slovenia, No 54/06);
Rules on radiopharmacological products (Official Gazette of the Republic of Slovenia, No 86/08);
Regulations on united national naming of medicinal active ingredients and system of arranging treated for round anatomically-therapeutic-chemical classification (Official Gazette of the RS, no. 86/08),
Regulations on determining the prices of medicinal products for human use (Official Gazette of the Republic of Slovenia, Nos 102/10, 6/12 and 16/13);
Regulations on more exact demands and procedure for determining interchangeable medicinal products (Official Gazette of the Republic of Slovenia, no. 102/10),
Regulations on the pharmacovigilance of veterinary medicinal products (Official Gazette of the Republic of Slovenia, No 53/06;,
Rules on the classification, prescription and administering of veterinary medicinal products (Official Gazette of the Republic of Slovenia, No 91/08);
Regulations on analytical, pharmacological-toxicological and clinical testing of veterinary medicinal products (Official Gazette of the Republic of Slovenia, Nos 91/08 and 79/09);
Rules on the identification and use instructions of veterinary medicinal products (Official Gazette of the Republic of Slovenia, No 101/09);
Rules on the exceptional use of medicinal products for the treatment of animals and on animal treatment records (Official Gazette of the Republic of Slovenia, No 53/06),
Regulations on pricing methodology for testing medicinal products in the quality control of medicinal products (Official Gazette of the Republic of Slovenia, no. 68/09),
Rules on the examination for pharmaceutical inspectors (Official Gazette of the Republic of Slovenia, No 86/08);
Rules determining national formulary addition to the European Pharmacopoeia (Official Gazette of the Republic of Slovenia, No 118/06);
Rules on the pharmacovigilance of medicinal products for human use (Official Gazette of the Republic of Slovenia, Nos 53/06 and 16/11);
Rules on recall of medicines (Official Gazette of the Republic of Slovenia, No 105/08);
Rules on the system of reception, storage and traceability of medicines (Official Gazette of the Republic of Slovenia, No 81/09);
Rules on the use of potassium iodine (Official Gazette of the Republic of Slovenia, No 59/10);
Rules on the authorisation for trade in veterinary medicinal products (Official Gazette of the Republic of Slovenia, No 16/11);
Order appointing a legal person for pharmacovigilance and medical devices vigilance (Official Gazette of the Republic of Slovenia, Nos 100/00 and 61/10).
(4) On the day of entry into force of this Act, the following implementing regulations shall cease to apply:
Rules classifying vitamin and mineral products for oral use that are in a pharmaceutical form as medicinal products (Official Gazette of the Republic of Slovenia, No, 86/08);
Rules on the classification of medical plants (Official Gazette of the Republic of Slovenia, No 103/08).
Article 195
(Procedures following the enforcement of this Act)
(1) All ongoing procedures initiated prior to the date of the implementation of this Act and the implementing regulations adopted on the basis hereof, or, in relation to which a claim or a legal remedy has been filed at the time of the entry into effect of this Act, shall be subject to according to the provisions of the Medicinal Products Act (Official Gazette of the Republic of Slovenia, Nos 31/06 and 45/08), and the implementing regulations issued on the basis thereof, unless the provisions of this Act are more favourable for the client.
(2) Notwithstanding the previous paragraph hereunder, the Agency may request from the applicant who filed the application prior to the enforcement of this Act and until the end of the procedure to submit additional or different documentation or comply with additional evidence in accordance herewith, should this be necessary for the protection of public health.
Article 196
(Transitional provisions regarding advanced therapy medicinal products prepared on a non-routine basis)
(1) Business entities performing the activity of the preparation of advanced therapy medicinal products prepared on a non-routine basis shall, if such activity is performed without a valid authorisation, submit the application to obtain the authorisation for the preparation of advanced therapy medicinal products prepared on a non-routine basis in accordance with this Act and the implementing regulations relevant for this area within 60 days of the enforcement of the implementing regulations relevant for this area, issued on the basis of this Act.
(2) Business entities performing the activity of the preparation of advanced therapy medicinal products prepared on a non-routine basis shall, if such activity is performed with a valid authorisation for the supply of tissues and cells, submit the application to obtain the authorisation for the preparation of advanced therapy medicinal product prepared on a non-routine basis in accordance with this Act within one year of the enforcement of the implementing regulations relevant for this area issued on the basis of this act.
(3) If the business entities fail to submit the application set out in paragraphs one and two of the present Article within the above-specified deadline, they must stop performing the activity of the preparation of advanced therapy medicinal products prepared on a non-routine basis.
Article 197
(Obligations of manufacturing authorisation holders after the implementation of implementing regulations)
(1) The holders of manufacturing authorisations, valid on the day of enforcement hereof, shall be obliged to propose an amendment to the authorisation to perform this activity no later than within 30 days of the enforcement of the implementing regulations, issued on the basis of this Act, regulating the entry in the register of manufacturers of active substances and implementing regulations governing the manufacturing of medicinal products.
(2) If the business entities fail to submit the application within the deadline specified in the previous paragraph hereunder, they must stop performing the activity referred to in the previous paragraph.
Article 198
(Obligations of the holders of the authorisation for wholesaling medicinal products after the implementation of implementing regulations)
(1) The holders of the authorisation for wholesaling medicinal products, valid on the day of enforcement hereof, shall be obliged to propose an amendment to the authorisation for wholesaling medicinal products no later than within 30 days of the day of enforcement of the implementing regulations, issued on the basis of this Act, regulating the field of entry in the register of wholesalers of active substances and implementing regulations, issued on the basis of this Act, governing the wholesaling of medicinal products.
(2) If the business entities fail to submit the application within the deadline specified in the previous paragraph hereunder, they must stop performing the activity referred to in the previous paragraph.
Article 199
(Transitional period for the activity of manufacturing, marketing and importing active substances)
(1) Business entities performing the activity of manufacturing, marketing and importing active substances perform such activity on the basis of valid authorisations, issued by the Agency; however, they can only perform it on this basis until the completion of the process of entry in the register of manufacturers, wholesalers and importers of active substances under this Act.
(2) The application for the entry in the registers from the previous paragraph must be submitted by the business entities no later than within 60 days of the enforcement of the implementing regulations, issued on the basis of this Act, regulating the entry in the register of manufacturers, wholesalers and importers of active substances.
(3) Up to the establishment of mechanisms specified in the third and the fourth paragraph of Article 119 hereof are set up, the importers of active substances may import active substances intended for manufacture of medicinal products for human use, based on an inspection conducted in the exporting country by another European Union Member State in the last three years, whereby it was established that the manufacture complied with the good manufacturing practice for active substances, or on the basis of a declaration made by the person responsible for the release of manufacturer medicinal products stating that the active substance being imported has been manufactured in accordance with the good manufacturing practice for active substances.
Article 200
(Transitional period for experts in advertising medicinal products)
(1) Experts for advertising medicinal products, that on the day of enforcement hereof meet the conditions listed in Article 88 of the Medicinal Products Act (Official Gazette of Republic of Slovenia, Nos 31/08 and 45/08) and the data of whom holders of authorisation for marketing of medicinal products report to the Agency in accordance with the Rules on advertising of medicines (Official Gazette of Republic of Slovenia, Nos 105/08, 98/09 – ZMedPri and 105/10) and with the enforcement hereof no longer fulfil the conditions regarding education, but have at least two years of experience in the field of advertising of medicinal products, which include a documented program of training in the field of knowledge on the operation of the human or animal organism, may continue to perform their activities.
(2) The holders of manufacturing authorisations shall be obliged to submit the application for the entry in the experts’ register for these experts for advertising medicinal products referred to in the previous paragraph hereunder no later than within 30 days following the enforcement of the regulations, issued on the basis of this Act, regulating the area of entry in the experts’ register for advertising medicinal products.
Article 201
Authorisations for the import and/or entry of medicinal products pursuant to the Medicinal Products Act (Official Gazette of the RS, no.
Authorisations for the entry or import of medicinal products issued on the basis of the Medicinal Products Act (Official Gazette of the Republic of Slovenia, No 31/06 and 45/08) valid on the day of enforcement hereof shall be valid until the expiry of the deadline, specified in the relevant authorisation issued by the Agency.
Article 202
(Validity of authorisations for the labelling of medicinal products in foreign packaging with a label in the Slovene language)
Authorisations for the labelling of medicinal products in foreign packaging with a label in Slovenian and authorisations for alternative marking of medicinal products granted pursuant to the Medicinal Products Act (Official Gazette of the Republic of Slovenia, No 31/06 and 45/08) valid on the day of enforcement hereof shall be valid until the expiry of the deadline, specified in the relevant authorisation.
Article 203
(Transitional provisions on pharmacovigilance)
(1) For medicinal products for which marketing authorisation had been issued prior to 21 July 2012, the obligation to keep the master file on the pharmacovigilance system and the Agency’s access to it shall be valid from the extension of marketing authorisation or from 21 July 2015, whichever is earlier.
(2) The holders of marketing authorisations issued prior to 21 July 2012 need not implement the system of risk management for each medicinal product, unless there exist any security restrictions that could affect the risk-to-benefit ratio and if required by the Agency.
(3) The procedure stipulated in Articles 107m through 107p of Directive 2001/83/EC is used for the studies from paragraph three of Article 58 hereof, ordered after 21 July 2012.
(4) The obligation of electronic reporting, as stipulated in the third paragraph of Article 107 of the Directive 2001/83/EC, shall enter into force six months after the notice by the EMA on the establishment of functionality of the EudraVigilance database, as specified in Article 24 of the Regulation (EC) 726/2004.
(5) Until the deadline specified in the previous paragraph hereunder, the marketing authorisation holder shall report to the Agency in 15 days of the day of acknowledgement of a suspected serious adverse reaction that occurred in the territory of the Republic of Slovenia.
The suspected serious adverse reaction occurring on the territory of third countries shall be reported by the medicinal product marketing authorisation holder directly to the EudraVigilance database.
The medicinal product marketing authorisation holder shall report on any suspected adverse reactions that are not serious and occur on the territory of the Republic of Slovenia to the Agency based on its previously published request within 90 days of acknowledging them.
(6) A marketing authorisation holder shall set up electronic forwarding of regularly updated reports on safety of medicinal products, as specified in the first paragraph of Article 107b of the Directive 2001/83/EC, to the EMA within 12 months after the EMA has set up the electronic archive and publishes it.
Article 204
(Transitional period regarding quantitative requirements for medicinal products)
The collection of quantity needs for medicinal products in accordance with the sixth and the seventh paragraph of Article 116 hereof shall be started by the Agency within three months after the entry into force of the regulation governing the area, with it starting the issuing of certificates and authorisations under the fifth and the eighth paragraph of Article 116 hereof for entry and import of medicinal products within nine months after the collection of quantity needs has begun.
Article 205
(Transitional period for the continuation of the work of supervisors and dispensation of medicinal products via the Internet and establishment of central medicinal product database)
(1) With the implementation of this act pharmaceutical supervisors under Articles 101., 102. and 104. of the Medicinal Products Act (Official Gazette of RS, no. 31/06 and 45/08), supervisors under Article 7 of the Supply of Blood Act and supervisors under Article 9 of the Act on Quality and Safety of Human Tissues and Cells for the Purposes of Medical Treatment (Official Gazette of the Republic of Slovenia, No 61/07), who have a valid professional certification examination for the position of inspector and pharmaceutical supervisor in accordance with the Rules on professional certification examination for pharmaceutical supervisors (Official Gazette of RS, no. 86/08), and are performing the tasks of pharmaceutical supervisors or supervisors on the day of implementation of the present Act, shall continue their work as pharmaceutical inspectors.
(2) Pharmaceutical inspectors referenced in the prior paragraph shall acquire additional expert knowledge within 60 days of enforcement of the regulations under paragraph two of Article 166 hereof.
(3) Positions, method of work, measures and powers of pharmaceutical inspectors referred to in first paragraph of the present Act shall be subject to the provisions of Articles 166, 167 and 173 hereof.
(4) The Minister shall issue the regulation detailed under paragraph twentythree of Article 126 hereof, pertaining to more detailed conditions for designing and use of a common logo and more detailed procedure of issuing and revocation of authorisation for sale of medicinal products via the Internet within six months of publication of implementing measures of the European Commission pursuant to Directive 2011/62/EU regarding the common logo.
(5) Business subjects that dispense medicinal products via the Internet on the day of implementation of this Act shall coordinate their operations with the provisions of Article 126 hereof within one year of enforcement of provisions of the prior paragraph.
(6) The central medicinal product database under Article 163 hereof shall be established within one year of the implementation of the present Act.
Article 206
(Initiation of operations of the official control laboratory within NLHEF)
(1) NLHEF and the Agency shall commence the procedure for inclusion of NLHEF into the European network of control laboratories with EDQM within one month of the implementation of this Act.
(2) NLHEF shall commence performing the tasks of an official control laboratory pursuant hereto after inclusion into the European network of control laboratories with EDQM, no sooner than six months from the implementation of this Act, but no later than within one year.
(3) Tasks of the official control laboratory shall be performed by the Agency until the commencement of tasks listed in the prior paragraph.
Article 207
(Premises, equipment and materials of the official control laboratory within NLHEF)
(1) NLHEF shall assume business premises, equipment, materials for performing analytical testing of medicinal products, documentation, records and unfinished matters pertaining to the tasks of an official control laboratory from the Agency.
(2) Agency employees that are up to the commencement of duties of the official control laboratory at NLHEF employed at the Agency and are performing the tasks of an official control laboratory, shall continue their employment at the Agency and shall be offered another position at the Agency that corresponds to the type and degree of education required for the performance of tasks that relevant Agency employees were employed for prior to the day that NLHEF commenced performing the tasks of an official control laboratory.
Article 208
(Transitional period for the prices of services of official quality control of medicinal products)
Until first publication of a pricelist of the services of official control of the quality of medicinal products at the website of NLHEF, NLHEF shall invoice such services based on the pricelist published on the website of the Agency on the day of commencement of tasks of official control laboratory pursuant to the second paragraph of Article 206 hereof.
Article 209
(Entry into force of provisions on safety features and notification to the European Commission)
The provisions of Article 88 hereof relating to the affixing, covering and removing safety features shall enter into force three years from the publication of the delegated acts of the European Commission, stipulating on the basis of Directive 2011/62/EC amending Directive 2001/83/EC on the Community code related to medicinal products for human use regarding prevention of entry of counterfeit medicinal products into the legal delivery chain (Official Gazette no. 174 of 1 July 2011, p. 74) the characteristics and technical specifications for protective elements and lists of medicinal products or categories of medicinal products that must or need not be equipped with a safety feature.
Article 210
(Initiation of use of provisions regarding reporting of the body competent for veterinary medicine)
Provisions of paragraph thirteen of Article 24 hereof shall enter into force three years after enforcement of the present Act.
Article 211
(Termination of validity)
On the day this Act enters into force the Medicinal Products Act – ZZdr (Official Gazette of the Republic of Slovenia Nos. 9/96 and 19/96) and the Medicinal Products Act – ZZdr-1 (Official Gazette of the Republic of Slovenia Nos. 31/06 and 45/08) shall cease to be valid.
Article 212
(Effective date)
This Act shall enter into force on the fifteenth day after its publication in the Official Gazette of the Republic of Slovenia.
No. 520-01/13-4/62
Ljubljana, 24 February 2014
EPA 1508-VI
National Assembly of the Republic of Slovenia Janko Veber l.r. Predsednik
“,”Jaka Verbic Miklic”,1521991560,1521991560,en,12436,306,12417,43,0,NULL,,”Zakon o zdravilih (ZZdr-2) UL št. 17/2014, 7. 3. 2014″,zakon-o-zdravilih-(zzdr-2)-ul-st-17-2014-7-3-2014,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521991641,1524643493
350,12437,”Rules of Reimbursement”,”Official Gazette of RS, 35/2013 “,”
Rules of Reimbursement
Pursuant to the tenth and eleventh paragraph of Article 23.c and Article 26 of the Health Care and Health Insurance Act (Official Gazette of the Republic of Slovenia, no. 72/06 – official consolidated text, 114/06 – Act Regulating Adjustments of Transfers to Individuals and Households in the Republic of Slovenia – ZUTPG, 91/07, 76/08 and 62/10 – Exercise of Rights to Public Funds Act – ZUPJS, 87/11 and 40/12 – Fiscal Balance Act – ZUJF) and Item 1 of the first paragraph of Article 70 and the first paragraph of Article 71 of the Articles of Association of the Health Insurance Institute of Slovenia (Official Gazette of the Republic of Slovenia nos. 87/01 and 1/02 – corr.) the General Meeting of the Health Insurance Institute of Slovenia, at its 13th meeting held on 3 April 2013, adopted the following
R U L E S of Reimbursement
I. GENERAL PROVISIONS
Article 1
(Areas covered by the Rules)
(1) These Rules stipulate:
1. Detailed procedure and criteria for reimbursed medicinal products;
2. Detailed procedure and criteria for non-reimbursed medicinal products;
3. Conditions and procedure for determining the restrictions in prescribing or dispensing individual medicinal products;
4. Costs of procedure;
5. The manner, procedure and criteria for determining the highest recognised value for each group of interchangeable medicinal products;
6. Detailed procedure and conditions for determining therapeutic groups of medicinal products and their highest recognised values;
7. Criteria, conditions and procedure for reaching an agreement on the prices of medicinal products with the Health Insurance Institute of Slovenia (hereinafter: the Institute); and
8. Records on reimbursed medicinal products, the highest recognised value for each group of interchangeable medicinal products, and therapeutic groups of medicinal products and their highest recognised values.
(2) The Institute puts medicinal products on the list, changes them between individual lists, excludes them from the list, lays down limitations to prescribing or dispensing individual medicinal products, and determines the therapeutic groups of medicinal products based on the expert opinion of the Reimbursement Committee from Article 32 hereof.
Article 2
(Terms)
(1) The terms used herein shall have the following meaning:
1. “Budget Impact Analysis” is an analysis evaluating in detail the budget impact of the introduction and use of a new method of treatment paid for by the health insurance system.
2. “Sensitivity Analysis” is an assessment of impacts of unreliability in evaluation parameters under assumptions underlying the pharmacoeconomic model in a cost- effectiveness analysis and a cost-utility analysis.
3. “Cost Analysis” is a type of economic analysis that only takes into account the cost of treatment regardless of its outcome.
4. “Cost-Effectiveness Analysis” is a type of economic analysis that compares the costs of treatment expressed in monetary units and its outcomes expressed in units of clinical outcomes such as additional years of life.
5. “Cost-Utility Analysis” is a sub-type of cost-effectiveness analysis in which the treatment outcome is expressed in units of humanistic outcomes such as quality-adjusted life-year (QALY) based the patient’s subjective assessments of the quality of their health.
6. “Cost Minimisation Analysis” is a type of economic analysis that only takes into account the cost of treatment because there is no difference in its outcomes.
7. “Hospital” is a provider of health care services engaging in specialised hospital treatment or specialised outpatient activity at the secondary or tertiary levels of health care.
8. “Hospital Medicinal Product” is a medicinal product that can only be dispensed at a hospital due to its properties.
9. “Price of Medicinal Product” is the applicable price of a medicinal product agreed or set in accordance with the law on medicinal products and forming the basis for charging the medicinal product to health insurance or health care providers.
10. “Defined Daily Dose” is the unit used by the World Health Organisation for the consumption of medicinal products.
11. “Discount rate” is the rate used to calculate the present value of future cash flows.
12. “Value Added of a Medicinal Product” is the medicinal product’s value expressed by its relative therapeutic value or economic advantage compared to a comparator.
13. “Galenic medicinal product” is a medicinal product for human use, as specified in the law on medicinal products.
14. “Generic Medicinal Product” is a medicinal product as specified in the law on medicinal products.
15. “Authorisation Holder” is a general term for a marketing authorisation holder for a medicinal product or its representative in the Republic of Slovenia, a holder of marketing authorisation for a parallel entered or imported medicinal product, a holder of authorisation for entry or import of a medicinal product included in the list of essential medicinal products for human use and a holder of positive opinion of the European Medicines Agency on a parallel distributed medicinal product.
16. “Non-Reimbursement” means excluding a medicinal product from the cover provided by compulsory health insurance because it is no longer reimbursed in accordance with Article 3 hereof, does not meet the criteria laid down in Article 5 hereof or one of the criteria laid down in Article 16 hereof is met.
17. “Exceptionally Allowed Higher Price” is a price as specified in the law on medicinal products.
18. “Health Care Provider” is a natural or legal person that has signed a contract with the Institute to provide health care.
19. “Public Agency” means the Public Agency of the Republic of Slovenia for Medicinal Products and Medical Devices.
20. “Final Treatment Outcome” means the outcome relating to the time of extension of life for the treated disease or the time until recurrence.
21. “List of Medicinal Products” is a common term for positive and intermediate lists of prescription medicinal products and the list of hospital medicinal products.
22. “Magistral medicinal product” is a medicinal product for human use, as specified in the law on medicinal products.
23. “Substitute Medicinal Product” is a medicinal product without a marketing authorisation in the Republic of Slovenia but having a special authorisation for entry or import that can substitute a reimbursed medicinal product with the same active substance in the case of interrupted supply.
24. “Substitute Treatment Outcome” means a clinical outcome result on the basis of which the effectiveness of treatment can be assumed, (value of blood pressure, cholesterol, glycogenic haemoglobin, hospitalisation, etc.).
25. “Maximum Allowed Price” is a price as specified in the law on medicinal products.
26. “Highest Recognised Value (HRV)“ is the price standard defined by the Institute for a medicinal product in a group of interchangeable medicinal products and a therapeutic group of medicinal products covered by compulsory insurance in full or in relevant percentage, depending on the act regulating health care and health insurance (hereinafter: the Act) and reimbursement or otherwise of a medicinal product.
27. “New Medicinal Product” means that no medicinal product with the same active substance has been reimbursed so far.
28. “Restricted Dispensing” means that a pharmacist in a pharmacy may dispense a medicinal product to the debit of compulsory health insurance only within the set limitations.
29. “Restricted Prescription” means that a physician may prescribe a medicinal product to the debit of compulsory health insurance only within the set limitations.
30. “Code of Reimbursed Medicinal Product” means a combined code which includes the code of the list of medicinal products and the percentage financed by compulsory health insurance and potentially also the code of a medicinal product with restricted prescription or dispensing and the code of a medicinal product with set HRV.
31. “Code of Medicinal Product from the List of Hospital Medicinal Products” is a combined code including the list code and possibly the code of a medicinal product with restricted prescription and the code of a medicinal product with set HRV.
32. “Similar Biological Medicinal Product” is a medicinal product as specified in the law on medicinal products.
33. “Procedure” is a common term for the process of listing, relisting, excluding from the list of medicinal products and the process of determining or changing the restriction of prescribing and dispensing conducted on the basis of these Rules.
34. “Relisting” is a change in the listing from one list of medicinal products to another.
35. “Adjustment of Pharmacoeconomic Analysis” is a methodological adjustment of an analysis made for one of the Member States of the European Economic Area to the Slovene territory with Slovene input data.
36. “Comparator” is a medicinal product used as the benchmark for a medicinal product in the procedure to determine the relative therapeutic value and in pharmacoeconomic analyses.
37. “Comparative Form of Medicinal Product” means different pharmaceutical forms with comparative release and the same application.
38. “Comparative Dose” is a dose of medicinal product which, based on the data from the Summary of Product Characteristics and professional literature, results in a comparative clinical effect in view of the comparator.
39. “Recommended Dose” is a maintenance dose of the medicinal product for an adult weighing 70 kg for a specific therapeutic indication.
40. “Incremental Cost-Effectiveness Ratio – ICER” is the incremental cost-effectiveness or utility ratio of a new treatment method compared to the standard treatment in the Republic of Slovenia.
41. “Listing” is deciding on reimbursement of a medicinal product.
42. Relative Therapeutic Value” of a medicinal product is the difference between the effectiveness of two or more medicinal products or therapeutic procedures which represent comparable alternatives for the achievement of desired outcome of treatment in the regular clinical practice. A medicinal product with the same therapeutic indication is used to determine the relative therapeutic value and other medicinal products in the pharmacological-therapeutic group are also included in the comparison, especially the selected medicinal products from the therapeutic guidelines and other most frequently used medicinal products.
43. “List of Interchangeable Medicinal Products with HRV” is the list of the Institute which contains the highest recognised values of classified medicinal products from the list of interchangeable medicinal products published by the Agency.
44. “Therapeutic Indication of Medicinal Product” is the disease or condition specified in the Summary of Product Characteristics which the medicinal product can cure or improve.
45. “Therapeutic Group of Medicinal Products” is a group of medicinal products determined by the Institute that are classified in the positive and intermediate lists of medicinal products with the same therapeutic indication, which may include individual medicinal products, combined medicinal products and various pharmaceutical forms of a medicinal product.
46. “Prescription Medicinal Products” are medicinal products included by the Institute on the positive or intermediate list of medicinal products, prescribed by the personal or referring physician and dispensed in pharmacies.
47. “Orphan Medicinal Product” is a medicinal product used for treating a rare illness which obtained the status from the European Medicines Agency.
48. “Treatment” is a health care service that includes the medicinal product.
49. “Health Care Institution” is a health care provider.
50. “Health Insurance” is a common term for compulsory and complementary health insurance.
(2) Designations and abbreviations in these Rules shall have the following meaning:
1. “ATC” means anatomic-therapeutic-chemical listing of medicinal products;
2. “B” means a medicinal product from the list of hospital medicinal products;
3. “C” in the designation of the list means a medicinal product with the highest recognised value;
4. “EAHP” means exceptionally allowed higher price;
5. “N” means a non-reimbursed medicinal product;
6. “MAP” means maximum allowed price;
7. “HRV” means the highest recognised value;
8. “P” means the positive list of prescription medicinal products;
9. “V” means the intermediate list of prescription medicinal products;
10. “*” asterisk in the listing means a medicinal product with limited prescription or dispensing.
Article 3
(Subject of listing)
(1) The following medicinal products shall be listed:
1. Medicinal products with marketing authorisation in the Republic of Slovenia;
2. Medicinal products with authorisation for parallel import;
3. Medicinal products with a positive opinion from the European Medicines Agency for parallel distribution;
4. Medicinal products from the list of essential medicinal products for human use which have not been granted marketing authorisation but a special authorisation for entry or import;
5. Substitute medicinal products;
6. Galenic medicinal products for human use; and
7. Magistral medicinal products.
(2) A hospital medicinal product shall be listed if the price of its recommended dose exceeds EUR 5,000 per person in one year to the debit of health insurance.
Article 4
(List of medicinal products)
(1) Prescription medicinal products are listed to the positive list of medicinal products or the intermediate list of medicinal products.
(2) Hospital medicinal products are included in the list of hospital medicinal products.
(3) Medicinal products are listed with their proprietary names, except for magistral medicinal products.
II. CRITERIA FOR MEDICINAL PRODUCT LISTING AND RELISTING
Article 5
(Criteria)
In the process of listing and relisting, medicinal products are assessed on the basis of the following criteria:
1. Significance of medicinal product in terms of public health;
2. Health care programme implementation priorities;
3. Therapeutic significance of the medicinal product;
4. Relative therapeutic value of a medicinal product;
5. Assessment of pharmacoeconomic data on the medicinal product;
6. Evaluation of ethical aspects;
7. Health care programme priorities; and
8. Data and assessments from reference sources.
Article 6
(Significance for public health and health care programme priorities)
(1) The priorities in the area of prevention and treatment of persons and conditions considered significant for the assessment of significance of individual medicinal products in terms of public health, health care programme implementation priorities and health care programme priorities are:
1. Set out in Article 23 of the Act;
2. Specified in the resolution concerning the national health care plan; or
3. Defined in the documents of the World Health Organisation on the priority health care programmes in Europe.
(2) In the assessment from the previous paragraph hereunder, the significance of the areas not specified in the documents referred to in the previous paragraph hereunder is also taken into account when they are significant for public health.
Article 7
(Therapeutic significance of the medicinal product)
(1) In terms of therapeutic significance, a medicinal product is defined as:
1. Medicinal product with a proven positive effect on final treatment outcomes;
2. Medicinal product with a proven positive effect on substitute treatment outcomes; or
3. Medicinal product with a positive effect on the quality of life.
(2) When assessing the therapeutic effect of a medicinal product, the level of medicinal product recommendation in the Slovenian therapeutic guidelines or the guidelines of the European expert associations is taken into account:
1. Class I: the medicinal product is convincing and without any doubt effective, which is why it must be used;
2. Class IIa: evidence on effectiveness of the medicinal product is inconsistent; however, evidence that it is effective prevails, which is why its use is recommended;
3. Class IIb: there is not enough evidence on the effectiveness which is why the use of the medicinal product is only recommended in special cases; or
4. Class III: there is no evidence of clinical effectiveness of the medicinal product which is why the use is not recommended.
Article 8
(Relative therapeutic value of a medicinal product)
In terms of relative therapeutic value, the medicinal product is defined as:
1. A medicinal product with new therapeutic value in case it is used for treating or preventing a disease for which no effective treatment has existed so far; or
2. A medicinal product with new therapeutic value in case the following issues are involved, compared to the comparator:
a) more favourable impact on the final treatment outcome,
b) more favourable impact on the substitute treatment outcome,
c) effective treatment of disease symptoms,
d) an improved safety profile of the medicinal product; or
e) a more patient-friendly use of the medicinal product.
Article 9
(Estimate of pharmacoeconomic data on the medicinal product)
(1) The Institute shall assess the medicinal product based on a pharmacoeconomic analysis and a budget impact analysis, which shall be presented for the first three years of cover by health insurance.
(2) The cost-efficiency or usefulness analysis conducted or adapted for Slovenia shall use as the basis for assessing the medicinal product also the incremental cost-effectiveness ratio as the ratio between incremental cost and incremental effectiveness or utility for the new and the standard treatment as determined by a resolution of the Management Board of the Institute based on the planned funds under the compulsory health insurance for medicinal products, as specified in the Institute’s budget.
(3) The budget impact analysis shall use as the basis for assessing the medicinal product the aspect of planned compulsory health insurance funds for medicinal products, as specified in the Institute’s budget.
Article 10
(Types and results of pharmacoeconomic analyses)
(1) The preparation of pharmacoeconomic analyses referred to in the previous article hereof may apply:
1. A complete evaluation with an analysis of costs and treatment outcomes; or
2. A partial evaluation with a cost analysis.
(2) The following pharmacoeconomic analyses can be used as the basis for assessing the pharmacoeconomic data:
1. Cost-effectiveness analysis;
2. Cost-utility analysis;
3. Cost-cutting analysis; or
4. Cost analysis.
(3) As a rule, the results of the pharmacoeconomic analyses are expressed as:
1. The incremental cost-effectiveness ratio between the new and the standard treatment for an additional year of quality-adjusted life years; or
2. The incremental cost-effectiveness ratio between the new and the standard treatment for an additional year of life or the time until disease progression or the number of prevented medical conditions; or
3. Comparison of costs of the new and the standard treatment at the annual level.
Article 11
(Aspect of pharmacoeconomic data)
(1) The pharmacoeconomic analysis is carried out from the aspect of health insurance. An analysis can also be conducted from the social aspect, particularly if significant difference is expected between the social aspect and the aspect of health insurance. In such case, both aspects must be shown separately.
(2) The budget impact analysis is carried out from the aspect of health insurance.
Article 12
(Content of pharmacoeconomic data)
(1) The pharmacoeconomic analysis must include the following items:
1. Basic data on the analysis:
a) the party ordering the analysis,
b) the party conducting the analysis,
c) disclosure of potential conflict of interests of the contractor,
2. Key starting points of the analysis, including:
a) the purpose of the analysis,
b) the aspect,
c) the therapeutic indication,
d) the target population,
e) common or standard treatment,
f) treatment with a new medicinal product,
g) list of comparators,
h) a comparison of the safety profile of the new and the common treatment,
i) period to which the analysis refers,
j) a description of the input data (costs, epidemiological data, data on effectiveness),
k) sources of input data, together with the strengths, weaknesses, source reliability and selection criteria for studies and files,
l) data collection process,
3. Analysis type;
4. A description of the model and its validation in the case of a model analysis;
5. A clear record of treatment outcomes, clinical and humanistic (quality of life);
6. Source of information on treatment outcomes (systematic overview of literature or meta-analysis);
7. Discounting the cost or outcome of treatment;
8. Analysis assumptions;
9. Sensitivity analysis;
10. Results with comments;
11. Methodology of transfer into Slovenia, in the case of a foreign analysis;
12. Summary of the analysis; and
13. In the case of a model analysis, the computer model in an electronic table with non-protected contents.
(2) The recommended fixed discount rate under Item 7 of the previous paragraph hereunder shall equal three to five percent and vary between nought and eight percent in the sensitivity analysis.
(3) The budget impact analysis must include the following items:
1. Introductory information:
a) epidemiological data (prevalence and incidence of disease, age, gender and risk factors) for Slovenia, if data exist, otherwise from foreign sources,
b) clinical data (description of pathology, progressing of disease and existing treatment possibilities),
c) economic data (relevant pharmacoeconomic analyses),
2. Description of the new treatment compared to the standard treatment, including potential changes in the treatment implementation;
3. The budget impact analysis (taking into account the aspect of health insurance);
4. Method and form of analysis:
a) determining the population (by years, taking into account all known measures, such as restricted prescription, stimulated demand, adverse effects),
b) integration of new medicinal product in the treatment processes,
c) period to which the analysis refers,
d) model description,
e) description of input data,
f) sources of data, together with the strengths, weaknesses source reliability and selection criteria, studies and files,
g) data collection process,
h) description of the method(s) for compiling the analysis; and
5. Results:
a) presentation of the impact of the introduction of a new medicinal product on health insurance expenses by year, based on pessimistic, optimistic and medium version;
b) presentation of annual cost of the introduction of a new medicinal product (total cost and cost by item), based on pessimistic, optimistic and medium version,
c) sensitivity analysis, if conducted,
d) graphic presentation of model, if used,
e) indication of used assumptions of the model, if used, and
f) computer model in the form of checklists in an electronic table, with non-protected contents, if used.
(4) The form E from Annex 1 hereto can be used for the presentation of an analysis of cost reduction or a cost analysis.
Article 13
(Mandatory pharmacoeconomic data)
(1) Pharmacoeconomic data with the cost-effectiveness analysis or cost-utility analysis and budget impact analysis, compiled or adjusted for Slovenia, are a mandatory enclosure to the application in the case of:
1. A new medicinal product;
2. A new therapeutic indication of a reimbursed medicinal product;
3. Relisting; or
4. Determination or change to the restriction on prescribing or dispensing.
(2) In the case under the previous paragraph hereunder, i.e. adjustment of a pharmacoeconomic analysis, the original analysis or its translation into Slovenian or a language understandable to the Institute shall be a mandatory enclosure to the application.
(3) In the case of a medicinal product under the first paragraph hereunder the foreseen total turnover of which does not exceed 500,000 euros to the debit of health insurance in all strengths and forms in the budget impact analysis for the first three years of financing, it shall be sufficient if the original analysis in the original language or its translation into Slovenian or a language understandable to the Institute, conducted in one of the Member States of the European Economic Area, is attached to the application instead of the pharmacoeconomic analysis under the first paragraph hereunder.
(4) If the medicinal product under the first paragraph hereunder exceeds the total amount of 500,000 euros to the debit of health insurance before or after the expiry of the three-year period, the marketing authorisation holder shall be obliged to submit a pharmacoeconomic analysis in accordance with the first paragraph hereunder within six months of receiving a request from the Institute to do so. If the marketing authorisation holder fails to submit the analysis within the specified deadline, the Institute shall initiate the procedure for non-reimbursement of the medicinal product.
(5) For a medicinal product under the first paragraph hereunder without significant differences in effectiveness and safety compared to the comparator, a cost-cutting analysis or a cost analysis will be attached to the application under the first paragraph hereunder.
(6) All required analyses for medicinal products hereunder shall be based on the results of publicly available meta-analyses or high-quality randomised studies. If required, any additional data may be derived from observation studies. If not enough real data are available, modelling methods can also be used for the analysis.
Article 14
(Evaluation of ethical aspects)
The ethical aspect is considered as a criterion mainly in the assessment of medicinal products for the treatment of severe or rare illnesses.
Article 15
(Data and estimates from reference sources)
In the scope of data and assessments from reference sources, data from expert and scientific publications, therapeutic guidelines, findings and estimates of reference expert associations, data and guidelines of the World Health Organisation and other institutions and bodies competent for prices of medicinal products and public financing as well as data from other publicly available sources shall be taken into account.
Article 16
(Criteria for non-reimbursement)
Notwithstanding Article 5 hereof, the following medicinal products shall not be reimbursed:
1. Not disclosing the same or added value in the therapeutic or economic sense compared to the reimbursed medicinal products in the same therapeutic group; or
2. Used for alleviating the symptoms or treating medical conditions that are less significant from the point of view of public health; or
3. Used in treating medical conditions that can be regulated or treated merely by changing the way of living.
III EXCLUSION FROM THE LIST OF MEDICINAL PRODUCTS
Article 17
(Exclusion from the list of medicinal products)
(1) A medicinal product shall be excluded from a list of medicinal products or if it is no longer the subject of listing under Article 3 hereof, does not meet the criteria from Article 5 hereof or when one of the criteria from the previous article is met.
(2) Notwithstanding the previous paragraph hereunder, a medicinal product can be excluded from the list of medicinal products based on a written consent of the marketing authorisation holder obtained beforehand, if the medicinal product is not available in the Slovenian market for more than one year, which the Institute verifies based on the data on its taking and the data that the authorisation holder is obliged to submit to the Institute.
IV RESTRICTED PRESCRIPTION AND DISPENSING
Article 18
(Restricted prescription and dispensing)
(1) The institute may define or change the restrictions on prescribing and/or dispensing a listed medicinal product in the process of listing or relisting. A restriction can refer to:
1. Population group entitled to receive the medicinal product, defined by age or other population characteristics;
2. Indication area for which the medicinal product may be prescribed; one or more approved therapeutic indications may be selected from the summary of product characteristics; treatment duration can also be limited in the scope of indication area,
3. The disease severity for which the medicinal product may be prescribed,
4. Type of specialisation of the physician entitled to prescribe the medicinal product, i.e. clinical specialty or a group of specialised physicians entitled to prescribe medicinal products;
5. Mandatory previous approval by an expert committee which decides on the prescription of specific medicinal products obtained with biotechnological procedures;
6. Time or quantity restriction of dispensing;
7. The hospital which, in accordance with an approval from the ministry of health, performs a health programme with the medicinal product.
(2) The text of the restriction on prescribing or dispensing is published on the website of the Institute together with the listing or relisting. A medicinal product with restricted prescription or dispensing shall be marked with an asterisk next to the list code.
V. PROCEDURE
Article 19
(Initiation of procedure)
(1) The marketing authorisation holder may submit to the Institute an application for listing, relisting and deciding on or changing of the restriction on prescribing or dispensing.
(2) The health institution may address to the Institute an initiative for starting the procedure. The Institute shall inform the health institution in writing of the acceptance or rejection of the initiative. If the initiative is accepted, the procedure is continued as in the case of application and a decision from Article 34 hereof is issued.
(3) The Institute may initiate the procedure upon its own initiative.
(4) The Institute shall inform of the initiative from the second and the third paragraphs hereunder the marketing authorisation holder to whom the initiative refers or the pharmacy producing the galenic medicinal product. The marketing authorisation holder or the pharmacy shall submit to the Institute upon its written request the relevant documentation needed for the Institute’s decision. Otherwise, the Institute shall decide on the basis of evidence available to it.
Article 20
(Types of applications and initiatives)
(1) The application or initiative for listing a medicinal product can refer to:
1. A new medicinal product;
2. A new therapeutic indication of a reimbursed medicinal product;
3. New combination of medicinal products;
4. Similar biological medicinal product;
5. Generic medicinal product and parallel entry or import or parallel distribution;
6. New form, strength or packaging of a reimbursed medicinal product;
7. A medicinal product from the list of urgently needed medicinal products for use in human medicine;
8. Substitute medicinal product;
9. Galenic medicinal product or
10. Magistral medicinal product.
(2) An application can also refer to:
1. Relisting; and
2. Determination or change to the restriction on prescribing or dispensing.
(3) An initiative can also refer to:
1. Relisting,
2. Determination or change to the restriction on prescribing or dispensing; and
3. Exclusion from the list of medicinal products.
Article 21
(Application)
(1) The application shall contain data on the marketing authorisation holder, technical and expert data on the medicinal product specified herein and the decision on the maximum allowed price or exceptionally allowed higher price.
(2) The application is sent to the Institute in printed copy and on an electronic data carrier.
(3) If the marketing authorisation holder or its representative change during the procedure, the application shall be supplemented with the data on the new marketing authorisation holder or its representative and the evidence on this change within eight days of the change.
(4) Data and documents in the application shall be sent to the Institute organised in the order as specified for each type of application hereunder and in the manner specified in individual type of application.
Article 22
(Initiative)
(1) The initiative must contain data on the health institution which addresses the initiative to the Institute, the data on the medicinal product to which the initiative refers and the expert explanation of the proposal.
(2) The initiative shall be submitted to the Institute in written or electronic form.
(3) Unless stipulated otherwise herein regarding individual issues related to the initiative, it shall be subject to the same provisions hereof as those applying to the application.
Article 23
(Application for a new medicinal product, new therapeutic indication, relisting and determination of or change to limitations of prescribing and dispensing)
(1) An application for listing of a new medicinal product or a new therapeutic indication of a reimbursed medicinal product, an application for relisting and an application for determination of or change to restrictions on prescribing or dispensing shall contain the following data and documents:
1. Cover letter (form A in Annex 1 hereto);
2. Application summary (form B in Annex 1 hereto), containing:
a) data from the summary of product characteristics (B.1.),
b) data on the treatment (B.2.),
c) expert justification (B.3.),
d) possible inclusion in the expert guidelines and the level of recommendation (B.4.),
e) rate of reimbursement from public funds in the EU Member States and potential other countries and potential limitations of prescription and dispensing (B.5.),
f) data on the marketing (B.6.),
g) data on the price (B.7.),
h) data on the cost of medicinal product (B.8.),
i) data on the impact on health care services (B.9.),
j) data on the pharmacoeconomic research (B.10.),
k) data on the budget impact analysis (B.11.),
l) potential proposal by the marketing authorisation holder (B.12.),
m) data and estimate from reference sources (B.13),
3. Documents (form C in Annex 1 hereto):
a) authorisation (C.1.),
b) decision on MAP or EAHP (C.2.),
c) evidence on potential status of an orphan medicinal product (C.3.),
d) certificate that the costs have been paid (C.4.),
e) authorisation, in case the applicant or proposer of initiative is a legal or natural person applying for the listing on behalf of the marketing authorisation holder (C.5.), and
4. Additional expert documentation (form D in Annex 1 hereto):
a) summary of product characteristics approved by the Public Agency or the European Medicines Agency (D.1.),
b) European Public Assessment Report (EPAR) if the medicinal product is registered according to the centralised procedure (D.2.),
c) clinical research referred to in the application summary (D.3.),
d) pharmacoeconomic analysis (D.4.),
e) budget impact analysis (D.5.).
(2) The application under the previous paragraph hereunder shall also contain the treatment protocol, the inclusion and exclusion clinical criteria and medicinal products or treatments already used for the same therapeutic indication, and data on the effectiveness of the new treatment compared with the existing treatment.
Article 24
(Application for a new combination of medicinal products)
Application for reimbursing a new combination of medicinal products shall contain the following data and documents:
1. Cover letter (form A in Annex 1 hereto);
2. Application summary (form B in Annex 1 hereto), containing:
a) data from the summary of product characteristics (B.1.),
b) data on the treatment (B.2.),
c) expert justification (B.3.),
d) rate of reimbursement from public funds in the EU Member States and potential other countries and potential limitations of prescription and dispensing (B.5.),
e) data on the marketing (B.6.),
f) data on the price (B.7.),
g) data on the cost of medicinal product (B.8.),
h) pharmaceutical particulars (B.10.3),
i) potential proposal by the marketing authorisation holder (B.12.),
j) data and estimate from reference sources (B.13),
3. Documents (form C in Annex 1 hereto):
a) authorisation (C.1.),
b) decision on MAP or EAHP (C.2.),
c) evidence on potential status of an orphan medicinal product (C.3.),
d) certificate that the costs have been paid (C.4.),
e) authorisation, in case the applicant or proposer of initiative is a legal or natural person applying for the listing on behalf of the marketing authorisation holder (C.5.), and
4. Additional expert documentation (form D in Annex 1 hereto):
a) summary of product characteristics approved by the Public Agency or the European Medicines Agency (D.1.),
b) European Public Assessment Report (EPAR) if the medicinal product is registered according to the centralised procedure (D.2.),
c) clinical research referred to in the application summary (D.3.).
Article 25
(Application for similar biological medicinal product)
Application for reimbursing a similar biological medicinal product shall contain the following data and documents:
1. Cover letter (form A in Annex 1 hereto);
2. Application summary (form B in Annex 1 hereto), containing:
a) data from the summary of product characteristics (B.1.),
b) expert justification (B.3.),
c) rate of reimbursement from public funds in the EU Member States and potential other countries and potential limitations of prescription and dispensing (B.5.),
d) data on the marketing (B.6.),
e) data on the price (B.7.),
f) data on the cost of medicinal product (B.8.),
g) potential proposal by the marketing authorisation holder (B.12.),
h) data and estimate from reference sources (B.13),
3. Documents (form C in Annex 1 hereto):
a) authorisation (C.1.),
b) decision on MAP or EAHP (C.2.),
c) evidence on potential status of an orphan medicinal product (C.3.),
d) certificate that the costs have been paid (C.4.),
e) authorisation, in case the applicant or proposer of initiative is a legal or natural person applying for the listing on behalf of the marketing authorisation holder (C.5.), and
4. Additional expert documentation (form D in Annex 1 hereto):
a) summary of product characteristics approved by the Public Agency or the European Medicines Agency (D.1.),
b) European Public Assessment Report (EPAR) if the medicinal product is registered according to the centralised procedure (D.2.),
c) clinical research referred to in the application summary (D.3.).
Article 26
(Application for generic medicinal product and medicinal product with authorisation for parallel import or parallel distribution)
(1) The application for reimbursing a generic medicinal product, a combined generic medicinal product and a medicinal product with authorisation for parallel import or parallel distribution shall contain the following data and documents:
1. Cover letter (form A in Annex 1 hereto);
2. Application summary (form B in Annex 1 hereto), containing:
a) data from the summary of product characteristics (B.1.),
b) expert justification (B.3.),
c) data on the marketing (B.6.),
d) data on the price (B.7.),
e) data on the cost of medicinal product (B.8.),
f) potential proposal by the marketing authorisation holder (B.12.),
3. Documents (form C in Annex 1 hereto):
a) authorisation (C.1.),
b) decision on MAP or EAHP (C.2.),
c) certificate that the costs have been paid (C.4.),
d) authorisation, in case the applicant or proposer of initiative is a legal or natural person applying for the listing on behalf of the marketing authorisation holder (C.5.); and
4. Additional expert documentation (form D in Annex 1 hereto):
a) summary of product characteristics approved by the Public Agency or the European Medicines Agency (D.1.),
b) European Public Assessment Report (EPAR) if the medicinal product is registered according to the centralised procedure (D.2.).
(2) The application for reimbursing a medicinal product with authorisation for parallel import or a positive opinion of the European Medicines Agency for parallel distribution shall be prepared pursuant to the previous paragraph hereunder, except for Item 3.a, where the authorisation for parallel import or a positive opinion of European Medicines Agency for parallel distribution shall be enclosed.
Article 27
(Application for a new form, strength or packaging of a reimbursed medicinal product)
(1) The application for new form, strength or packaging of a reimbursed medicinal product shall contain:
1. Cover letter (form A in Annex 1 hereto);
2. Application summary (form B in Annex 1 hereto), containing:
a) data from the summary of product characteristics (B.1.),
b) expert justification (B.3.),
c) rate of reimbursement from public funds in the EU Member States and potential other countries and potential limitations of prescription and dispensing (B.5.),
d) data on the marketing (B.6.),
e) data on the price (B.7.),
f) data on the cost of medicinal product (B.8.),
3. Documents (form C in Annex 1 hereto):
a) authorisation (C.1.),
b) decision on MAP or EAHP (C.2.),
c) evidence on potential status of an orphan medicinal product (C.3.),
d) certificate that the costs have been paid (C.4.),
e) authorisation, in case the applicant or proposer of initiative is a legal or natural person applying for the listing on behalf of the marketing authorisation holder (C.5.), and
4. Additional expert documentation (form D in Annex 1 hereto):
a) summary of product characteristics approved by the Public Agency or the European Medicines Agency (D.1.),
b) clinical research referred to in the application summary (D.3.).
(2) If the new form of the medicinal product affects the cost of treatment compared to the reimbursed form, the application referred to in the previous paragraph hereunder shall also contain the pharmacoeconomic data from Section B.10.3 from Annex 1 hereto.
Article 28
(Application for medicinal product from the list of essential medicinal products and for substitute medicinal product)
The application for reimbursing a medicinal product from the list of essential medicinal products for human use and a substitute medicinal product shall contain the following data and documents:
1. Cover letter (form A in Annex 1 hereto);
2. Application summary (form B in Annex 1 hereto), containing:
a) data from the summary of product characteristics (B.1.),
b) expert justification (B.3.),
c) data on the marketing (B.6.),
d) data on the price (B.7.),
3. Documents (form C in Annex 1 hereto):
a) authorisation (C.1.),
b) decision on MAP or EAHP (C.2) and, for the substitute medicinal product, the wholesale price;
c) evidence on potential status of an orphan medicinal product (C.3.),
d) authorisation, in case the applicant or proposer of initiative is a legal or natural person applying for the listing on behalf of the marketing authorisation holder (C.5.); and
4. Additional expert documentation (form D in Annex 1 hereto) including the Summary of Product Characteristics in Slovenian or a language understandable to the Institute.
Article 29
(Initiative for galenic medicinal product)
An initiative for reimbursing a galenic medicinal product shall contain the following data and documents:
1. Cover letter (form A in Annex 1 hereto);
2. Application summary (form B in Annex 1 hereto), containing:
a) data from the patient information leaflet (B.1.),
b) expert justification (B.3.),
c) data on the marketing (B.6.),
d) data on the price (B.7.),
e) data on the cost of medicinal product (B.8.),
f) any proposal by a health care institution (B.12.), and
3. Additional expert documentation (form D in Annex 1 hereto) including the patient information leaflet.
Article 30
(Initiative for magistral medicinal product)
An initiative for reimbursing a magistral medicinal product shall contain the following data and documents:
1. Cover letter (form A in Annex 1 hereto); and
2. Application summary (form B in Annex 1 hereto), containing:
a) expert explanation of the health care institution stating the therapeutic indication and prescription (B.3.1., B.3.12.),
b) data on the price: framework calculation together with pharmacy service,
c) potential proposal of a healthcare institution (B.12.).
Article 31
(Processing of applications and initiatives)
(1) The Institute shall process complete applications and initiatives. An application or initiative shall be deemed complete if it contains all data and documents stipulated herein. If an application or initiative is incomplete, the Institute shall, within five days of receiving it, ask the marketing authorisation holder or the healthcare institution to supplement it.
(2) The Institute may, based on submitted and obtained data, request from the authorisation holder or the health care institution additional data and analyses significant for further decisions.
Article 32
(Reimbursement Committee)
(1) In the process specified in the second paragraph of Article 1 hereof, the Institute shall decide on the basis of an expert opinion from the Reimbursement Committee (hereinafter: the Committee). Members of the Committee shall be appointed by the Management Board of the Institute for a four-year term.
(2) The Committee shall be an expert and independent body consisting of experts in the field of medicine and pharmacy, with knowledge in clinical pharmacology, and other experts with systemic knowledge in the area of medicinal products. The Committee members shall perform their work in compliance with the code of medical ethics and the applicable regulations.
(3) The Committee shall adopt its Rules of Procedure.
Article 33
(Additional expert opinions)
In the process and when determining therapeutic groups of medicinal products, the Institute may obtain opinions from professional associations, clinics or individual experts in medicine, pharmacy or other areas.
Article 34
(Decision)
(1) The Institute shall issue the decision on reimbursement or non-reimbursement no later than within 90 days of receiving the complete application. This deadline can be extended only in case the Agency has determined the maximum allowed price prior to the expiry of 90 days. The process of determining the maximum allowed price in accordance with the provisions regulating the prices of medicinal products and the process of reimbursement of medicinal products, including the implementation of reimbursement may together not last more than 180 days.
(2) Notwithstanding the previous paragraph hereunder, the Institute shall issue a decision on reimbursing a galenic medicinal product within 180 days of receiving a complete initiative.
(3) The Institute shall issue a decision on relisting or a decision on rejecting the relisting, a decision on non-reimbursement of medicinal products and a decision on the determination or change of restrictions on prescribing or dispensing, or a decision on rejecting the determination or change of restrictions on prescribing or dispensing within 180 days of receiving a complete application or initiative.
Article 35
(Explanation)
The decision under the previous article hereunder shall be explained with the statement that this was the subject of listing under Article 3 hereof, indicating the reasons based on the criteria specified in Articles 5 and 16 hereof, including the expert opinions on which the decision is based.
Article 36
(Appeal and judicial protection)
(1) The marketing authorisation holder or the pharmacy may lodge an appeal against a decision in accordance with Article 34 hereof. An appeal should be submitted within 30 days following the service of the decision under Article 34 hereof. The appeal shall be lodged with the Institute, which forwards it to the ministry of health within five days of receiving it. An appeal shall not stay the execution of such decision.
(2) A decision on the appeal shall be adopted by the minister of health within 60 days of receiving of the appeal by the Institute.
(3) The marketing authorisation holder or the pharmacy may contest the decision of the minister of health referred to in the previous paragraph hereunder within 30 days of receiving the decision by filing a lawsuit in an administrative dispute to the Administrative Court of the Republic of Slovenia.
VI. COSTS OF PROCEDURE
Article 37
(Costs of procedure)
(1) The marketing authorisation holder shall pay the costs of procedure in accordance herewith. The costs of procedure shall be paid upon the submission of the application into the account of the Institute.
(2) Depending on the type of application, the costs of procedure shall be as follows:
1. For reimbursement of a new medicinal product: EUR 2,000,
2. For reimbursement of a new therapeutic indication of a reimbursed medicinal product: EUR 1,500,
3. For reimbursement of a new combination of medicinal products: EUR 1,000,
4. For reimbursement of a similar biological medicinal product: EUR 500,
5. For reimbursement of a generic medicinal product, combined generic medicinal product and a medicinal product with authorisation for parallel import or parallel distribution: EUR 300,
6. For reimbursement of new forms and strengths of reimbursed medicinal products: EUR 500,
7. For reimbursement of a new packaging of reimbursed medicinal products: EUR 300,
8. For relisting: EUR 1,000; and
9. For the determination or change to the restricted prescription or dispensing: EUR 1,500.
(3) The costs of procedure from the previous paragraph hereunder shall refer to one medicinal product with one working code. The costs of procedure shall be increased by EUR 25 for each additional working code.
(4) The costs of procedure shall not be paid in the case of reimbursing a:
1. Medicinal product from the list of urgently needed medicinal products for human use;
2. Substitute medicinal product;
3. Galenic medicinal product; and
4. Magistral medicinal product.
VII. THERAPEUTIC GROUPS OF MEDICINAL PRODUCTS
Article 38
(Determining therapeutic groups of medicinal products)
(1) The Institute shall determine upon its initiative therapeutic groups of medicinal products among the medicinal products included in the positive and the intermediate list of medicinal products. The basis for inclusion of a medicinal product in a therapeutic group of medicinal products is therapeutic indication and the criteria under Article 5 hereof.
(2) The medicinal product with the most favourable treatment cost-effectiveness ratio based on the prices of reference doses of medicinal products included in the therapeutic group shall be set for every therapeutic group of medicinal products.
(3) When determining a medicinal product from the previous paragraph, only the active substances or combinations of active substances of the medicinal product shall be taken into account which achieve the market share calculated based on the following formula:
minimum market share = 100% / (n + 1),
where:
n – the number of active substances or combinations thereof in a therapeutic group of medicinal products.
The market share of active substances of a medicinal product or combinations thereof shall be calculated from the data of the Institute on dispensed medicinal products, expressed in defined daily doses, available in the last 12 months.
(4) A therapeutic group of medicinal products can be divided into classes of reference doses with regard to the strength of medicinal products (hereinafter: the Class). If a medicinal product from the second paragraph hereunder is not represented in all classes, other medicinal products are defined, so that all specified medicinal products are within HRV in all strengths.
(5) If no significant difference exists between medicinal products in a therapeutic group of medicinal products or a Class as regards effectiveness, safety, pharmaceutical forms and method of administering, the medicinal product with the most favourable treatment cost-effectiveness ratio shall be the one with the lowest price of a reference dose at a time the HRV is set for a therapeutic group of medicinal products or Class.
(6) If a therapeutic group features a medicinal product which is advantageous as regards the insured person due to its pharmaceutical form in the sense of method of administering or clinical properties, value added shall be determined and expressed as a percentage of the price of a reference dose. Value added may not exceed the percentage that would result in a higher HRV than the price of medicinal product based on the data, applicable upon the preparation of the resolution from the eighth paragraph hereunder on the therapeutic group, according to the procedure for determining the HRV from Articles 39 to 43 hereof.
(7) Value added of a combined medicinal product included in a therapeutic group of medicinal products is defined as the difference between the sum of HRV of individual active substances and the HRV of the combined medicinal product without value added, defined based on the data, applicable upon the preparation of the resolution from the eighth paragraph hereunder on the therapeutic group, according to the procedure for determining the HRV from Articles 39 to 43 hereof. Value added is expressed as percentage of price of a comparable dose. If the HRV of a combined medicinal product without value added exceeds the sum of HRV of individual active substances, value added is not specified. If HRV cannot be calculated for an individual active substance, the price of medicinal product is used. If no medicinal product with the active substance of the combined medicinal product is reimbursed, the price shall be set on the basis of a comparator in the Republic of Slovenia or the European Union.
(8) The therapeutic groups of medicinal products and any changes thereof shall be determined by a decision of the Institute’s Management Board.
VIII. HRV
Article 39
(Data for determining HRV)
(1) Data valid on the first business day of the month in which the HRV is set shall be used to determine the HRV in accordance with Articles 40 and 41 hereof.
(2) The basis for determining the HRV is prescription medicines only, based on the national code, the share of dispensed packaging of which reached at least 0.5% in the group of interchangeable products, a therapeutic group of medicinal products or its class in the last month. The Institute shall take into account the latest available monthly data on dispensed medicinal products from the previous paragraph.
Article 40
(Determining HRV for groups of interchangeable medicinal products)
(1) The Institute shall determine the HRV for the groups of interchangeable medicinal products listed in the positive and the intermediate list of medicinal products with regard to the cheapest medicinal product in view of the reference dose the group of interchangeable medicinal products.
(2) The basis for determining the HRV referred to in the previous paragraph hereunder is the list of interchangeable medicinal products, list of medicinal products and the prices of medicinal products.
(3) The group of interchangeable medicinal products referred to in the first paragraph hereunder shall comprise at least two medicinal products with a proprietary name with regard to the work code and specified by the active substance, ATC code, strength and comparable form of the medicinal product.
(4) The HRV referred to in the first paragraph hereunder is determined by multiplying the lowest price of a reference dose, rounded to four decimal places, with the number of doses of an individual medicinal product, rounded to two decimal places, namely upwards if the third decimal digit is 5 or more, and downwards if it is less.
Article 41
(Determining the HRV for therapeutic groups of medicinal products)
(1) The HRV is determined by the Institute for each therapeutic group of medicinal products at the level of the price of medicinal product with the most favourable ratio between the costs and effects of treatment so that it covers all doses of at least one medicinal product in the relevant therapeutic group of medicinal products.
(2) The HRV referred to in the previous paragraph hereunder is determined by multiplying the price of a reference dose of the medicinal product with the most favourable ratio between the costs and effects of treatment, rounded to four decimal places, with the number of doses of an individual medicinal product, rounded to two decimal places, namely upwards if the third decimal digit is 5 or more, and downwards if it is less. The HRV is determined on the basis of reference doses for all medicinal products in a therapeutic group of medicinal products accounting for any value added under the fourth paragraph of Article 38 hereof.
Article 42
(The rule of lower HRV)
If a medicinal product has the HRV determined in accordance with the procedure in accordance with Articles 40 and 41 hereof, the lower of the two HRV shall be set as its HRV.
Article 43
(Decision on the designation of HRV and marking of the medicinal product)
(1) The HRV in accordance with Articles 40 and 41 hereof and any changes thereof shall be determined, as a rule, once every two months, by a decision of the Institute’s Management Board or the Managing Director of the Institute, if authorised by the Management Board of the Institute.
(2) The medicinal products under Articles 40 and 41 hereof shall be assigned the designation C in addition to the list code.
IX. AGREEMENT ON THE PRICE OF MEDICINAL PRODUCT
Article 44
(Agreement on the price of medicinal product)
(1) The agreement on the price of medicinal product may refer to the following method of financing of the medicinal product:
1. The agreed price of the medicinal product;
2. Discount or rebate;
3. The price–sales volume ratio of a medicinal product;
4. Reimbursement of exceeded expenses for a medicinal product;
5. Risk sharing.
(2) The agreement on the price of medicinal product may refer to one or several medicinal products. The entry into agreement on the price of a medicinal product can be proposed by the Institute or a marketing authorisation holder, or a pharmacy if the subject of agreement on the price is a galenic medicinal product. The form Agreement on the price of medicinal product which is attached in Annex 2 herewith, is a constituent part of the agreement on the price of medicinal product. The agreement on the price of medicinal product must be made in writing and in Slovenian in order to be valid. If the agreement on the price of medicinal product was made in Slovenian and in a foreign language, the agreement on the price of medicinal product made in Slovenian shall be used for resolving any disputes.
(3) Authorisation holders or pharmacies if the subject of agreement on the price is a galenic medicinal product shall submit to the Institute an agreement on the price of medicinal product or an annex thereto at least five business days prior to entry into force of the price listed in the form Agreement on the price of medicinal product with the latter also submitted in electronic form, namely as an Excel sheet to the e-mail address zdravila.cene@zzzs.si.
(4) The agreed price of medicinal product is the price of medicinal product agreed by the Institute on the basis of the act regulating on medicinal products.
(5) Discounted price of medicinal product means that the marketing authorisation holder reduces the price of the medicinal product under the conditions agreed in the agreement on the price of medicinal product.
(6) Rebate means financial or quantity discount for a medicinal product granted by the marketing authorisation holder after a specific period of time and under the conditions agreed in the agreement on the price of medicinal product.
(7) Agreement on the price – sales volume ratio of a medicinal product means that the price of a medicinal product is reduced with the increase of the sales volume by the share agreed in the agreement on the price of medicinal product.
(8) The agreement on the reimbursement of exceeded expenses means that the marketing authorisation holder shall reimburse the Institute, after the end of the agreed period, the agreed difference between the actual and the agreed amount for a medicinal product if such amount was exceeded.
(9) The agreement on risk sharing means the sharing of the financing of medicinal product by the marketing authorisation holder and the Institute on the basis of the achievement of clinical criteria stipulated in the agreement on the price of medicinal product.
Article 45
(Termination of agreed price of medicinal product)
If the MAP of a medicinal product is reduced to or under the agreed price of such medicinal product, the agreement on the price of such medicinal product shall cease to be valid in the part relating to its agreed price unless the marketing authorisation holder and the Institute have previously agreed on a new agreed price of the medicinal product.
Article 46
(Enforcement of agreed prices of medicinal products)
Marketing authorisation holders or pharmacies, if the subject of the agreement on the price of medicinal product is galenic medicinal products, shall inform legal entities and natural persons with authorisation to perform wholesale trading in medicinal products or with whom they have entered into co-operation agreements of the agreed prices of their medicinal product, immediately after the conclusion of the agreement on the price of medicinal product or no later than within eight days following the date of validity, indicated on the form Agreement on the price of medicinal product or no later than eight days prior to the arrival in the market of the Republic of Slovenia.
X. RECORDS ON MEDICINAL PRODUCTS
Article 47
(Records)
The Institute shall keep the record of reimbursed medicinal products and on the HRV of reimbursed medicinal products and the record on agreed prices of medicinal products.
Article 48
(Publications)
(1) The Institute shall publish the amendments to the list with validity dates on its website at least 14 days prior to the enforcement. The Institute shall publish on its website the consolidated text of the list of medicinal products.
(2) The Institute shall publish the list of medicinal products with HRV or the amendments to it on its website on the next business day after determining the HRV. The Institute shall also publish on its website the consolidated text of the list of medicinal products with HRV.
(3) The agreed prices of medicinal products shall be published by the Institute on its website, if the marketing authorisation holder or the pharmacy allows such publication, which is marked on the form Agreement on the price of medicinal products. In the opposite case, the Institute shall only publish the agreed prices of medicinal products for health care providers.
(4) The Institute shall inform the marketing authorisation holders, the health care institutions that address the initiative to the Institute and the health care providers on the listing, relisting, exclusion from the list of medicinal products and changes to the restricted prescription or dispensing and on the HRV via the system of the Institute’s system for automatic electronic informing, in which the marketing authorisation holders, the health care institutions that address the initiative to the Institute and the health care providers can register through web application which is publicly available at the address http://www.zzzs.si/egradiva.
XI. TRANSITIONAL AND FINAL PROVISIONS
Article 49
(Applications and initiatives received prior to the enforcement of the Rules)
The applications for listing, relisting, exclusion from the list of medicinal products and changes to the restricted prescription or dispensing which the Institute received prior to the enforcement of the Rules shall be treated under the provisions of the Rules on Reimbursement (Official Gazette of the Republic of Slovenia no. 110/10).
Article 50
(Termination of validity)
The Rules on Reimbursement (Official Gazette of the Republic of Slovenia, No 110/10). shall cease to be valid.
Article 51
(Entry into force)
These Rules shall be published in the Official Gazette of the Republic of Slovenia after they have been approved by the minister of health and shall enter into force on the fifteenth day after publication in the Official Gazette of the Republic of Slovenia.
No. 9000-3/2013-DI/11
Ljubljana, 3 April 2013
EVA 2012-2711-0050
President of the General Meeting of the Health Insurance Institute of Slovenia
Vladimir Tkalec
Appendix 1: Contents of the applications
Appendix 2: The form Agreement on the price of medicinal product
“,”Jaka Verbic Miklic”,1521991800,1521991800,en,12437,306,12418,43,0,NULL,,”Pravilnik o razvrščanju zdravil na listo, UL št. 35, 26. 4. 2013″,pravilnik-o-razvrscanju-zdravil-na-listo-ul-st-35-26-4-2013,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521991868,1524644288
351,12439,”Rules amending the Rules on Advertising of Medicinal Products”,”Official Gazette of RS, 105/2010 “,”
Unofficial Consolidated Text of the Rules on the advertising of medicinal products includes:
– Rules on the advertising of medicinal products (Official Gazette of RS, no. 105/08 dated 7. 11. 2008),
– Rules amending the Rules on the advertising of medicinal products (Official Gazette of RS, no. 105/10 dated 24. 12. 2010).
Regulations
the advertising of medicinal products
(Unofficial Consolidated text no. 1)
I. GENERAL PROVISIONS
Article 1
(Scope)
This Regulation Lays Down Detailed Conditions and Manner of advertising of medicinal products for human and veterinary medicine (hereinafter: products) and accordance with Directive 2001/83 / EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to medicinal products for use and human use (OJ L no. 311 of 28. 11. 2001, p. 67), last Amended by Directive 2008/29 / EC of the European Parliament and of the Council of 11 March 2008 amending Directive 2001 / 83 / EC on the Community code relating to medicinal products for human use, as regards the Implementing Powers conferred on the Commission (OJ L 81 of 20. 3. 2008, p. 51) (hereinafter:Directive 2001/83 / EC) and Directive 2001/82 / EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to medicinal products for veterinary use (OJ L no. 311 dated 11. 28. 2001 p. 1) last Amended by Directive 2004/28 / EC of the European Parliament and of the Council of 31 March 2004 amending Directive 2001/82 / EC on the Community code relating to medicinal products for veterinary use (OJ L no. 136 of 30. 4. 2004, p. 58) (hereinafter: Directive 2001/82 / EC).
Article 2
(Definition of advertising)
(1) Advertising of medicinal products are all forms of information, including information from door to door, propaganda and promotion, which is intended to promote the prescription, supply, sale and use of drugs.
(2) In view of the target groups we divide advertising on:
– Advertising to the general public and
– Advertising in expert public.
Article 3
(Definition of general and professional public)
(1) The general public are secular groups and individuals who do not belong to the professional community as defined by this policy.
(2) Professional persons authorized for prescribing and dispensing of medicines.
Article 4
(Advertising)
(1) Advertising to the general public are all promotional forms and methods of communication secular groups and individuals.
(2) Advertising in expert public is:
– Providing information to persons who are authorized to prescribe or supply medicinal products to the properties and effects of medication, including informing those persons directly;
– Sponsorship and organization of promotional meetings attended by persons authorized for prescribing and dispensing of medicines;
– Sponsorship of scientific congresses attended by persons authorized for prescribing and dispensing of medicines;
– Placing the samples in accordance with Article 22 of this Regulation.
(3) Advertising in expert public is also considered an encouragement to prescribe or dispense with the promise or give any financial or material goods, in accordance with Article 20 of this Regulation.
Article 5
(Elimination from advertising)
Advertising or advertising material does not include:
– Labeling and package leaflet approved the authorization for a medicinal product;
– Informative announcements relating to the approved package changes, warnings of side effects and other general precautionary measures with a view to safer and more effective use of medicines;
– Sales catalogs and price lists that do not include no product claims;
– Correspondence on specific issues relating to a specific product, the accompanying materials, which are not promotional in nature;
– Publications and material institutions authorized to prepare programs for the prevention, control, removal (elimination) and the eradication (eradication) of infectious diseases on the vaccination against certain diseases for which no direct mention of individual vaccines, their effect and other specific characteristics;
– Information relating to human health or diseases, provided that there is no reference, even indirect, to medicinal products. Information should be high-quality, objective, unambiguous, comprehensive, balanced, comprehensible to users and should not contain elements of direct or disguised advertising.
II. ADVERTISING CONDITIONS
6. Article
(Marketing authorization)
It is allowed to advertise only those medicines that have marketing authorization in accordance with the Medicinal Products Act (Official Gazette of RS, Nos. 31/06 and 45/08, hereinafter: the Act).
Article 7
(Compliance with the summary of product characteristics)
Each individual element of advertising and all parts of the message recipient constitute a coherent whole, they must be consistent with the approved summary of product characteristics. All properties should be presented in a balanced way.
Article 8
(Rational and safe use of drugs)
(1) Advertising of medicinal products must encourage their rational and safe use, so that it is presented objectively and without exaggerating its properties.
(2) To achieve the objective set out in the preceding paragraph, the body responsible for the product, in the process of acquisition or maintenance of the marketing authorization require special warnings that should be part of every advertising.
Article 9
(Misleading advertising)
Advertising must not be misleading as to the potential benefits or risks of using the medicinal product, taking into account the integrity of the ad impression and messages.
Article 10
(Protection of the Slovenian language)
(1) Advertising must be in the Slovenian language in the municipalities where the Italian and Hungarian national communities, but may also be in the minority language.
(2) Notwithstanding the preceding paragraph, literature enclosed with advertising material for the professional public may also be in the original language of the article. At international expert meetings in Slovenia, advertisements and advertising material may also be in the language or languages of the event participants of these events.
Article 11
(Responsibility)
To ensure compliance with the advertising rules rests with the holder of the marketing authorization or client advertising, but for non-compliance with the provisions on advertising of medicinal products liable any person who is involved in the improper promotion of medicines.
III. ADVERTISING IN GENERAL PUBLIC
12. Article
(Advertising in general public)
(1) The general public is permitted to advertise only medicines that are available without prescription and for which the marketing authorization for the medicinal product so decides, the authority responsible for the product.
(2) The advertising and publishing information to the general public on medicinal products containing psychotropic or narcotic substances from international conventions such as the United Nations Single Convention on Narcotic Drugs of 1961 and the United Nations Convention on Psychotropic Substances of 1971st
(3) The advertising of medicinal products for veterinary use, which can be used as growth promoters, or enhancers (eg. Hormones, beta-agonists, thyrostatic substance, bovine somatrophin).
Article 13
(In terms of advertising to the general public)
Advertising of medicinal products to the general public must be made so that the advertising nature of the message clearly identified and that the product is clearly presented as a medicine.
Article 14
(Content advertising to the general public)
(1) Advertising of any non-prescription medicines to the general public must contain at least the following information:
– Product name and the common name if the product contains only one active ingredient;
– Information that is necessary for the efficient, correct and rational use of medicines;
– Visibly and legibly written, pictorial or verbal warning about the importance of the instructions for use accompanying the product and read the medicine for human use: “Always read the manual! About the risk of adverse effects with your doctor or pharmacist. “;
– Visibly and legibly written, pictorial or verbal warning about the importance of the instructions for use accompanying the product and read the medicine for use in veterinary medicine: “Always read the manual! On the risks and adverse reactions, contact your veterinarian or pharmacist. “.
(2) a written warning from the preceding paragraph must be stated highlighted (eg .: bold, colored, box), of at least one-tenth the size of the ad and the appropriate size of the font so that it can be easily read and can not be overlooked . TV ads should be a warning on the screen independent and delivered an image (text) and oral form. Oral warning must be stated in the standard language clearly and understandably and must ensure that the severity of the message. In the case of advertisements on electronic media should be a warning shown as an integral part of the main pages interesting and not as a link to it. It must be noted (eg .: bold, colored, box) in size, which when displayed on the entire screen is less than one-fourth of the screen and the font size of not less than one-tenth of the side box warning.
Article 15
(Ban on advertising to the general public)
(1) Advertising of OTC medicines to the general public shall not contain any material which:
– Give the impression that a medical consultation or veterinary or surgical operation is unnecessary, in particular by attributing a diagnosis or by suggesting treatment by mail;
– Suggesting that the effects of taking the medicine are absolutely guaranteed that the drug has no side effects or are better than other medicines or the equivalent of another treatment or medicinal product;
– Suggests that the health of a person or animal can only be improved by taking the advertised medicinal product;
– Suggests that the health of a person or animal without taking the advertised medicinal deteriorated; this prohibition shall not apply to vaccination programs and advertising vaccines in accordance with Article 24 of this Regulation;
– Is directed exclusively or principally at children;
– Referring to a recommendation by scientists, experts in the field of human or veterinary medicine or publicly known other people who, because of their celebrity, could encourage the consumption of medicinal products;
– Indicates that the product is a food, cosmetic or other consumer product;
– Indicate that the safety and effectiveness of the result of the natural origin of the product;
– Could, by a description or detailed representation of a case history, lead to erroneous self-diagnosis;
– Use improper, alarming or misleading terms, to claims of recovery or
– Use inappropriate, alarming or misleading terms, pictorial representations of changes in the human or animal body caused by disease or injury, or drug action on the human or animal body or body parts.
(2) It is prohibited to direct distribution of medicinal products to end-users for promotional purposes.
IV. Advertising in expert public
16. Article
(Advertising in expert public)
(1) The holder of the marketing authorization or advertiser is obliged to ensure that any advertising in expert public designed and communicated only to persons authorized to prescribe or supply medicinal products.
(2) Information material intended for professionals, would ordinarily be labeled “For professional public.”.
Article 17
(Advertising in professional publications and direct information)
(1) Holders of marketing authorization may advertise medicinal products which have obtained marketing authorization to expert public in professional books, journals and other professional publications.
(2) Holders of marketing authorization may also advertise medicines directly inform persons who are authorized to prescribe or supply medicinal products.
Article 18
(Data and information relating to medicinal products)
(1) All information on medicinal products intended for the professional public and the persons who are authorized for their prescribing and dispensing, shall in particular include the following information:
– The name of the product;
– For medicinal products for human use relevant information from the SPC such as the composition of medicines, therapeutic indications, dosage and method of use, a summary of adverse reactions, precautions and warnings, contraindications and interactions, name, logo and address of the marketing authorization marketing;
– Medicinal products for veterinary use relevant information from the SPC such as the composition of medicines, therapeutic indications, dosage and method of use, a summary of adverse reactions, precautions and warnings, contraindications and interactions, name, logo and address of the marketing authorization transport, the animal species to which the drug is intended, abstinence;
– The manner and mode of dispensing and prescribing medicines;
– The date of preparation of information.
(2) In addition to the data referred to in the preceding paragraph, the information shall also include information on the payer or the classification of a medicinal product on the appropriate list.
(3) All information contained in this Article shall be accurate, clear, current and verifiable to allow an assessment of the operation and the therapeutic value of the product.
(4) All quotations and tables and other illustrative matter taken from medical journals or other scientific works must be authentically summarized with exact list of resources.
Article 19
(Visits by professional staff)
(1) Direct medical information may be performed by medical staff if they meet the following conditions:
– Assistants for Medicinal Products for Human Use must have a university degree in pharmacy or medicine or a university degree in natural sciences or biomedicine, and additional knowledge in the field of medicinal products;
– Assistants for medicinal products for veterinary use must have a university degree in pharmacy or veterinary medicine or a university degree in natural sciences or biomedicine, and additional knowledge in the field of medicines;
– They must be properly trained to give accurate and complete technical information on this product.
(2) Advertising of medicinal products directly inform persons who are authorized to prescribe or supply medicinal products and practicing medicine within the public health service network, can be carried out only at the time of preparation for professional work, which is not designed to work directly with patients.
(3) Experts shall forward the information to persons who are authorized for their prescribing and dispensing, product information, in accordance with the approved summary of product characteristics. This summary must be submitted in writing or must be available.
(4) Experts are obliged to transfer the holder of the marketing authorization, any information on adverse drug reactions, as well as any other clinically relevant information in relation to the use of the product obtained by persons authorized to prescribe or supply medicinal products.
Article 20
(Give gifts)
Holders of marketing authorizations for medicinal products, manufacturers of drugs, legal or natural persons acting on behalf of producers and natural or legal persons who conduct business in medicinal and branches of foreign producers not to persons authorized to prescribe or supply medicinal products to be supplied, offered or promising any gifts, cash benefits or benefits in kind, unless they are small or symbolic value and can be used to perform medical, veterinary or pharmacy.
Article 21
(Promotional meetings)
(1) Notwithstanding the provisions of the preceding Article, holders of marketing authorizations for medicinal products, manufacturers of drugs, legal or natural persons acting on behalf of producers and natural or legal persons engaged in medicinal products and branches of foreign manufacturers allow persons authorized to prescribe or supply medicinal products to acquire additional knowledge about new findings about medicines. Acquiring additional knowledge may not exceed the technical and scientific objectives of such education be subordinated exclusively to the production of knowledge and is intended only for persons responsible for prescribing and dispensing of medicines.
(2) Hospitality at promotional meetings should be at a moderate level and secondary to the main purpose of the meeting and must not be extended to persons who are not responsible for prescribing and dispensing of medicines.
(3) The persons authorized to prescribe or supply medicinal products shall neither seek or accept any benefit that is contrary to the first and second paragraphs of this article, or to attempt to obtain.
Article 22
(Placing samples)
(1) In exceptional cases, manufacturers of medicinal products and the natural or legal person acting on behalf of producers of persons authorized to prescribe medicines forward free samples of medicines by prescription, where necessary, the patient be instructed on how to use a new drug if it is not for oral use and the following conditions are met:
– The medicinal product is authorized in accordance with the law;
– The acquisition of the marketing authorization or approval of the marketing authorization, which requires a new role, there has been more than two years;
– A person authorized to prescribe medicinal products can annually receive only one sample of each drug in the smallest package, which is authorized for marketing and for which the holder of the marketing authorization authority for medicines written notice of the actual start of the market in accordance with 44 Rule of Law;
– The recipient must apply for free samples writing. Application must be signed and dated;
– The recipient has received the samples kept;
– The recipient may not sell received samples;
– Manufacturers of medicinal products and the natural or legal person acting on behalf of producers must keep records and have a system of control and accountability over free samples;
– Each sample must be in the package, and is equipped with a package that was approved in the marketing authorization, and marked that it is a free sample, not for sale;
– In each sample it must be accompanied by an approved summary of product characteristics;
– The sample must not contain narcotic and psychotropic substances.
(2) Share of samples that require special storage conditions, such as cold chain, is prohibited.
V. PROFESSIONAL SERVICE
23 Article
(Professional service)
(1) Holders of marketing authorization must establish service, which is responsible for the preparation of information on medicinal products which are placed on the market.
(2) The responsible person is the holder of the marketing authorization must:
– Ensure that the body responsible for the supervision of advertising of medicines and other supervisory bodies in the samples of all promotional materials, together with an indication of the target groups to which they were intended, method of dispatching and date of the first shipment;
– Ensure the maintenance of records given free samples of medicinal products must contain a written request of persons authorized to prescribe drugs in accordance with the fourth indent of the first paragraph of the preceding article. Records must be kept for at least three years;
– Ensure that medicines are advertised in accordance with these Rules;
– Verify that medical sales representatives are properly trained to give accurate and complete technical product information and perform tasks in accordance with these Rules;
– Keep a list of assistants who advertise medicines directly inform persons who are authorized to prescribe or supply medicinal products, the particulars of their qualifications;
– The list referred to in the previous indent to the authority competent for medicinal products for the purpose of carrying out professional supervision is carried out under pharmaceutical supervision in accordance with the law;
– Provide to the body responsible for monitoring advertising of medicinal products and other supervisory bodies, all the information they require in connection with advertising;
– Ensure that the decisions of the authorities responsible for the control immediately and fully complied with.
(3) Changes in the data of the fifth indent of the preceding paragraph, the person responsible for the holder of the marketing authorization communicated to the authority competent for medicinal products within 15 days of their changes.
VI. Climbing VACCINE
24. Article
(Advertising vaccines)
(1) Advertising of medicinal products which are used in vaccination programs, the general public may authorize the authority responsible for the product.
(2) Any advertising is permitted under the preceding paragraph must include the warning: “Vaccination is the risk of adverse effects with your doctor.”, Which shall meet the requirements as defined in Article 14 of this Regulation.
(3) Medications used in vaccination programs may be advertised to the general public only with the international non-proprietary names. Advertising must be in accordance with Article 15 of this Regulation and should not contain elements which would reduce the objectivity of information on medicinal products used in vaccination and vaccination.
(4) Advertising of medicinal products which are used in immunization programs must contain information about all the medicines with the same indication, which are present on the market in the Republic of Slovenia.
Article 25
(Approval of advertising vaccines)
(1) For pre-approval of advertising in the preceding article, the holder of the marketing authorization by a competent authority for medicines, filed an application containing:
– Covering letter,
– Proposal grounded advertising materials together with an indication of target groups, method and timing of advertising and
– Proof of payment of the costs and administrative fees.
(2) The competent authority for medicinal decision on the application within 60 days of receipt of the complete application.
VII. Climbing Other special MEDICINES
Article 26
(Advertising traditional and homeopathic medicines)
(1) Traditional herbal medicinal products may be advertised in accordance with these rules and regulations governing traditional herbal medicinal products.
(2) Homeopathic medicinal products may be advertised in accordance with the rules and the rules governing homeopathic medicines.
VIII. ADVERTISING MONITORING
27 Article
(Monitoring of advertising)
(1) The competent authority for medicinal products may establish a permanent commission of expert in the field of advertising or representatives of interested public to monitor compliance of advertising with these rules.
(2) Based on data from the list of assistants in the fifth indent of the second paragraph of Article 23 of this Regulation, the authority responsible for the product within the professional supervision of an overall verification of the fulfillment of conditions for professional staff who work with the holders of marketing authorization.
Rules on the advertising of medicinal products (Official Gazette of RS, no. 105/08 ) contains the following transitional and final provisions:
“IX. TRANSITIONAL AND FINAL PROVISIONS
28 Article
(Termination)
The effective date of these Rules, the Rules on the advertising of medicinal products and medical devices (Official Gazette of RS, no. 76/01) in so far as it relates to drugs, and the Rules on advertising of medicinal products for veterinary use (Official Gazette of RS, No. . 70/03).
Article 29
(Enforcement Regulations)
This Regulation shall enter into force on the fifteenth day following its publication in the Official Gazette of the Republic of Slovenia. “.
Rules amending the Rules on the advertising of medicinal products (Official Gazette of RS, no. 105/10 ) contains the following transitional and final provisions:
»8th Article
Holders of marketing authorization communicated to the authority competent for medicinal products, the list of assistants in the fifth indent of the second paragraph of Article 23 of this Regulation no later than one month from the entry into force of this Regulation.
Article 9
This Regulation shall enter into force on the fifteenth day following its publication in the Official Gazette of the Republic of Slovenia. “.
“,”Jaka Verbic Miklic”,1521993120,1521993120,en,12439,306,12420,43,0,NULL,,”Pravilnik o oglaševanju zdravil, UL št. 105, 24.12.2010″,pravilnik-o-oglasevanju-zdravil-ul-st-105-24-12-2010,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521993184,1621760711
352,12440,”Interchangeability Rules”,”Official Gazette of RS, 102/2010 “,”
RULES
on more exact demands and procedure for determining interchangeable medicinal products
I. GENERAL PROVISIONS
Article 1
(Scope of application)
These Rules prescribe more exact demands and procedure for determining interchangeable medicinal products for human use and the method of publication of the list of interchangeable medicinal products (hereinafter: the List).
Article 2
(Definition of terms)
In addition to the definitions and expressions delineated in Article 6, of the Medicinal Products Act (Official Gazette of the RS, no 31/06 and 45/08; hereinafter referred to as: the Act), the following expressions shall also be used in these Rules:
– Two medicinal products containing the same active substance are considered bioequivalent if they are pharmaceutically equivalent or pharmaceutically alternative and their bioavailabilities (rate and extent) after administration in the same molar dose lie within acceptable predefined limits. These limits are set to ensure comparable in vivo performance, i.e. similarity in terms of safety and efficacy. Bioequivalence is defined in the valid text of the instruction of the European Medicines Agency “Guideline on the investigation of bioequivalence” at the website: http:// http://www.ema.europa.eu/ema/index.jsp? curl=pages/includes/document/document_detail.jsp ?webContentId=WC500070039&murl=menus/ document_library/document_library.jsp&mid= WC0b01ac058009a3dc;
– Two medicinal products are considered pharmaceutically equivalent if they have the same quality and quantity structure of active substances in the same pharmaceutical form and correspond to the same or comparable standards. Pharmaceutical equivalence does not always mean that the medicinal products are bioequivalent, since the differences in excipients or manufacturing procedure may lead to faster or slower dissolution or absorption;
– Pharmaceutically alternative medicinal products are medicinal products containing different salts, esters, ethers, isomers, mixed isomers, complexes or active substance derivatives or differing in terms of pharmaceutical form or strength.
II. MORE EXACT DEMANDS FOR DETERMINING INTERCHANGEABLE MEDICINAL PRODUCTS
Article 3
(Demands for interchangeable medicinal products)
Interchangeable medicinal products are those bioequivalent, pharmaceutically equivalent or pharmaceutically alternative medicinal products for which the Agency for Medicinal Products and Medical Devices of the Republic of Slovenia (hereinafter: the JAZMP), has issued a decision on interchangeability. The JAZMP may issue a decision on interchangeability in the following cases:
– The probability of the occurrence of clinically relevant differences in efficacy or safety of medicinal products with the same quality and quantity structure of active substances and comparable pharmaceutical form is adequately small or negligible;
– The submitted evidence of common or comparable characteristics of these medicinal products pursuant to the conditions stipulated by the Act and these Rules;
– The discussions of medicinal products take into account the latest findings and results of contemporary biomedicinal science and professional discipline;
– The provisions of marketing authorisation are taken into account and
– The medicinal products have a favourable comparable pharmacovigilance profile or risk-to-benefit ratio.
Article 4
(Non-interchangeable medicinal products)
Notwithstanding the provision of the previous article, the JAZMP may not issue the decision on interchangeability for:
– Medicinal products with a narrow therapeutic window, for a specific therapeutic area or other specific risk that would arise due to interchanging of medicinal products;
– Medicinal products in pharmaceutical forms with different manners of modified release, if significant differences were found in the characteristics of active substance release;
– Medicinal products with different tools for dosage or use which cause significant differences that could affect the outcome of the treatment, or
– Medicinal products for parenteral use and medicinal products with a narrow therapeutic range and significantly different excipients (e.g.: medicinal products for dermal use, eye).
III. PROCEDURE FOR DETERMINING INTERCHANGEABLE MEDICINAL PRODUCTS
Article 5
(Initiation of procedure for determining interchangeable medicinal products)
(1) The procedure for determining interchangeable medicinal products can be initiated by the JAZMP:
– Ex officio, after obtaining or amending the marketing authorisation for medicinal product or after obtaining the marketing authorisation through centralised procedure, which obtained from the JAZMP the data needed for entrance on the market or
– Upon the proposal of the marketing authorisation holder or the holder of authorisation for parallel imported medicinal products or the holder of a favourable opinion from the European Medicines Agency for parallel distribution of medicinal products (hereinafter: the Proposal) or
– Upon the initiative of the ministry competent for health, extended expert board, for medicinal products lying within its competence and the Health Insurance Institute of Slovenia.
(2) The initiators from the third indent of the previous paragraph are not a party in the procedure.
Article 6
(Proposal and initiative)
(1) The Proposal must contain evidence on the fulfilment of conditions from Article 3 hereof.
(2) The Initiative must contain explanation, indicating the publicly accessible data from independent professional literature on the fulfilment of conditions from Article 3 hereof.
Article 7
(Evidence on fulfilment of conditions)
When deciding on interchangeable medicinal products the JAZMP shall take into account the following:
– Data from the documentation on medicinal products,
– Data from the official records on medicinal products,
– Data from the records and publications of the European Medicines Agency or the competent bodies for medicinal products of the European Union Member States,
– Data on medicinal products submitted by the marketing authorisation holder,
– Explanation of the Initiative and publicly accessible data from independent professional literature, if the procedure begins upon the Initiative,
– The latest findings and results of contemporary biomedicinal science and professional discipline, and
– Opinion of the Permanent Medicinal Products Committee.
(2) Marketing authorisation holders, holders of authorisation for parallel imported medicinal products or holders of a favourable opinion from the European Medicines Agency for parallel distribution of medicinal products must submit to the JAZMP, upon its written request, additional data, evidence or explanations needed for determining interchangeable medicinal products.
Article 8
(Opinion of the Permanent Medicinal Products Committee)
The opinion of the Permanent Medicinal Products Committee must be provided with the grounds of fulfilled conditions for interchangeable medicinal products from the first, third and fifth indent of Article 3 hereof or the first and the second indent of Article 4 hereof.
Article 9
(Deadlines for issuing the decision and filing appeals)
The JAZMP shall issue a decision on interchangeable medicinal products within 60 days of the beginning of the procedure.
(2) An appeal may be launched against the decision from the previous paragraph within 15 days of serving. The Ministry responsible for health shall decide on the appeal.
Article 10
(Changing the decision on interchangeable medicinal products)
If the JAZMP establishes that interchangeable medicinal products no longer meet the conditions from Article 3 hereof or if one of the conditions of Article 4 hereof occurs, it shall issue a new decision, stating that a medicinal product no longer meets the conditions to be classified as interchangeable.
IV. PUBLICATION OF THE LIST OF INTERCHANGEABLE MEDICINAL PRODUCTS
Article 11
(Publication of the list of interchangeable medicinal products)
(1) The JAZMP shall publish interchangeable medicinal products in the list of interchangeable medicinal products (hereinafter: the List) on its website. Interchangeable medicinal products in the List shall be published in groups at Level 5 of the ATC classification, containing the following data:
– ATC code of medicinal product;
– Common name of medicinal product;
– Identification code of medicinal product;
– Name of medicinal product;
– Strength, pharmaceutical form and packaging of medicinal product;
– Name of marketing authorisation holder or the holder of authorisation for parallel imported medicinal products or the holder of a favourable opinion from the European Medicines Agency for parallel distribution of medicinal products.
(2) The JAZMP shall publish the medicinal product in the list or remove it from the list within five days of issuing the final decision on interchangeable medicinal products or termination of their interchangeability.
(3) The JAZMP shall remove from the list a medicinal product whose marketing authorisation has expired within 18 months of expiry or amendment of the marketing authorisation for a medicinal product, unless it has to be removed immediately in order to protect the public health.
V. TRANSITIONAL AND FINAL PROVISION
Article 12
(Application of implementing regulation)
(1) Notwithstanding the provisions of these Rules, it shall be deemed that the medicinal products from the Decision on the List of interchangeable medicinal products (Official Gazette of the Republic of Slovenia no. 86/10) are also interchangeable pursuant to these Rules, until otherwise determined by the JAZMP.
(2) The JAZMP shall decide on interchangeable medicinal products that have not been included in the list from the previous paragraph prior to the enforcement hereof and that meet the interchangeability conditions within three months of the enforcement hereof.
Article 13
(Cessation of validity)
With the day of enforcement of these Rules, the Rules on more exact demands and procedure for determining interchangeable medicinal products (Official Gazette of the Republic of Slovenia no. 86/08 and 63/09) shall cease to apply.
Article 14
(Entry into force)
These Rules shall enter into force on the fifteenth day after their publication in the Official Gazette of the Republic of Slovenia.
Number 0070-42/2010
Ljubljana, 25 November, 2010
EVA 2010-2711-0037
Dorijan Marušič
Minister of Health
“,”Jaka Verbic Miklic”,1521995040,1521995040,en,12440,306,12421,43,0,NULL,,”Pravilnik o natančnejših pogojih in postopku za ugotavljanje medsebojne zamenljivosti zdravil, UL št. 102, 17.12.2010″,pravilnik-o-natancnejsih-pogojih-in-postopku-za-ugotavljanje-medsebojne-zamenljivosti-zdravil-ul-st-102-17-12-2010,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521995074,1524652076
353,12445,”Medical Devices Act”,”Official Gazette of RS, 98/2009 “,”
MEDICAL DEVICES ACT (ZMedPri)
I. GENERAL PROVISIONS
Article 1
(Scope of application)
(1) This Act stipulates:
– medical devices and their accessories for human use,
– conditions and measures for assuring the quality, safety and efficacy of medical devices,
– conditions and procedures for assessing conformity of medical devices,
– labelling and conditions for affixing the CE mark,
– conditions for manufacturing and marketing medical devices,
– conditions and procedures for clinical trials of medical devices,
– monitoring complications related to medical devices,
– tasks and competencies of the notified body,
– tasks and competencies of the notified body, competent for medical devices,
– supervision over the implementation of this Act for the purpose of protecting public health.
(2) The purpose of this Act is to transpose into the legislation of the Republic of Slovenia the contents of the following directives and to regulate issues concerning the implementation of the following decisions and regulations:
– Council Directive 20/1990/EEC on the approximation of the laws of the Member States relating to active implantable medical devices (OJ L no. 189 of 20 July 1990, p. 17), last amended with Directive 2007/47/EC of the European Parliament and Council of 5 September 2007 amending the Council Directive 90/385/EEC on the approximation of the laws of the Member States relating to active implantable medical devices, Council Directive 93/42/EEC concerning medical devices and Directive 98/8/EC concerning the placing of biocidal products on the market (OJ L no. 247 of 21 September 2007, p. 21), (hereinafter: Directive 90/385/EEC);
– Council Directive 93/42/EEC of 14 June 1993 on medical devices (OJ L no. 169 of 12 July 1993, p. 1), last amended with Directive 2007/47/EC of the European Parliament and Council of 5 September 2007 amending the Council Directive 90/385/EEC on the approximation of the laws of the Member States relating to active implantable medical devices, Council Directive 93/42/EEC concerning medical devices and Directive 98/8/EC concerning the placing of biocidal products on the market (OJ L no. 247 of 21 September 2007, p. 21), (hereinafter: Directive 93/42/EEC);
– Directive 98/79/EC of the European Parliament and of the Council of 27 October 1998 on in vitro diagnostic medical devices (OJ L 331, 7 December 1998 p. 1), last amended with the Regulation (EC) no. 596/2009 of the European Parliament and of the Council of 18 June 2009, adapting a number of instruments subject to the procedure referred to in Article 251 of the Treaty to Council Decision 1999/468/EC with regard to the regulatory procedure with scrutiny (OJ L 188, 18 July 2009 p. 14), (hereinafter: Directive 98/79/EC);
– Commission Decision of 7 May 2002 on common technical specifications for in vitro-diagnostic medical devices (OJ L 131, 16 May 2002 p. 17), last amended by Commission Decision of 3 February 2009 amending the Commission Decision 2002/364 on common technical specifications for in vitro-diagnostic medical devices (OJ L 39, 10 February 2009 p. 34), (hereinafter: Decision 2002/364/EC);
– Directive 1882/2003/EC of the European Parliament and of the Council of 29 September 2003 adapting to Council Decision 1999/468/EC the provisions relating to committees which assist the Commission in the exercise of its implementing powers laid down in instruments subject to the procedure referred to in Article 251 of the EC Treaty (OJ L 284, 31 October 2003 p. 1), last amended with the Regulation (EC, EURATOM) no. 1101/2008 of the European Parliament and of the Council of 22 October 2008, on the transmission of data subject to statistical confidentiality to the Statistical Office of the European Communities (OJ L 304, 14 November 2008 p. 70), (hereinafter: Regulation 1882/2003/EC);
– Regulation (EC) No 1394/2007 of the European Parliament and of the Council of 13 November 2007 on advanced therapy medicinal products and amending Directive 2001/83/EC and Regulation (EC) No 726/2004 (OJ L 324 of 10 December 2007, p. 121).
(3) The terms and conditions of exercising the rights of users to medical devices, prescription, their financing and other issues related to medical devices for rehabilitation, are regulated by the provision on social security.
Article 2
(Exceptions to the application of this Act)
The provisions of this Act shall not apply to the following:
1. Medicinal products regulated by the provisions on medicinal products;
2. Cosmetic products regulated by the provisions on cosmetic products;
3. Human blood, products made from human blood, human plasma or blood cells of human origin regulated by the provisions on blood supply, with the exception of those regulated by the fifth paragraph of Article 15 hereof;
4. Organs of human origin for transplantation, regulated by the provisions on separation and transplantation of parts of human body, with the exception of those regulated by the fifth paragraph of Article 15 hereof;
5. Tissues and cells of human origin and products containing tissues and cells of human origin or produced from them, which are regulated by the provisions on the quality and safety of tissues and cells of human origin, intended for treatment;
6. Transplants or tissues or cells of animal origin, unless a device is manufactured utilizing non-viable animal tissue or non-viable products derived from animal tissue;
7. Products using the combination of medicinal product and medical device containing viable cells or tissues or non-viable cells or tissues, with the tissues or cells having the primary effect on the human body and being regulated in accordance with the provisions of the European Union on advanced therapy medicinal products;
8. In vitro medical devices manufactured and used only within the same health institution and on the premises of their manufacture or used on premises in the immediate vicinity without having been transferred to another legal entity, regulated by the provisions on medical activity;
9. Regulation of the protection of the health of workers and the general public against the dangers arising from ionising radiation or on health protection of individuals against the dangers of ionising radiation in relation to medical exposure, regulated by the provisions on protection against ionising radiation and nuclear safety.
Article 3
(Medical device)
Medical device means any instrument, apparatus, appliance, software, material or other article, whether used alone or in combination, including the software intended by its manufacturer to be used specifically for diagnostic and/or therapeutic purposes and necessary for its proper application, intended by the manufacturer to be used for human beings for the purpose of:
– diagnosis, prevention, monitoring, treatment or alleviation of disease,
– diagnosis, monitoring, treatment, alleviation of or compensation for an injury or handicap,
– investigation, replacement or modification of the anatomic functions or physiological processes of the organism, or
– control of conception and which does not achieve its principal intended action in or on the human body by pharmacological, immunological or metabolic means, but which may be assisted in its function by such processes.
(2) Accessory to a medical device means an article which whilst not being a medical device is intended specifically by its manufacturer to be used together with a medical device to enable it to be used in accordance with the use of the device intended by the manufacturer of the device;
Article 4
(Active medical device)
Active medical device means any medical device relying for its functioning on a source of electrical energy or any source of power other than that directly generated by the human body or gravity.
Article 5
(Active implantable medical device)
(1) Active implantable medical device means any active medical device which is intended to be totally or partially introduced, surgically or medically, into the human body or by medical intervention into a natural orifice, and which is intended to remain after the procedure.
(2) Accessory to active implantable medical device shall be subject to the provisions hereof, regulating active implantable medical devices.
Article 6
(In vitro diagnostic medical device)
(1) In vitro diagnostic medical device means any medical device which is a reagent, reagent product, calibrator, control material, kit, instrument, apparatus, equipment or system, whether used alone or in combination, intended by the manufacturer to be used in vitro for the examination of specimens, including blood and tissue donations, derived from the human body, solely or principally for the purpose of providing information:
– concerning a physiological or pathological state,
– concerning a congenital abnormality,
– to determine the safety and compatibility with potential recipients, or
– to monitor therapeutic measures.
(2) Specimen receptacles classified as in vitro diagnostic medical devices are those devices, whether vacuum-type or not, specifically intended by their manufacturers for the primary containment and preservation of specimens derived from the human body for the purpose of in vitro diagnostic examination.
(3) Products for general laboratory use are not in vitro diagnostic medical devices unless such products, in view of their characteristics, are specifically intended by their manufacturer to be used for in vitro diagnostic examination.
(4) Accessory to in vitro diagnostic medical device means an article which, whilst not being an in vitro diagnostic medical device, is intended specifically by its manufacturer to be used together with a device to enable that device to be used in accordance with its intended purpose.
(5) Invasive sampling medical device or that which is directly applied to the human body for the purpose of obtaining a specimen shall not be considered to be accessory to in vitro diagnostic medical device.
(6) In vitro diagnostic medical device for self-testing means any device intended by the manufacturer to be able to be used by lay persons in a home environment.
(7) In vitro diagnostic medical device for evaluation of performance of in vitro diagnostic medical device means any device intended by the manufacturer to be subject to one or more performance evaluation studies in laboratories for medical analyses or in other appropriate environments outside their own premises.
Article 7
(Medical device manufactured for an individual user)
(1) Medical device manufactured for an individual user is a medical device that is designed with specific characteristics in accordance with a written request of a doctor and intended exclusively for the use of a specific user.
(2) The abovementioned written request may also be made out by any other person authorized by virtue of his professional qualifications to do so.
(3) Medical devices which are manufactured in mass production and must be adjusted so as to meet specific requirements of a doctor or another expert are not medical devices manufactured for an individual user.
Article 8
(Medical device or active implantable medical device intended for clinical investigation)
(1) Medical device or active implantable medical device intended for clinical investigation means any medical device intended for use by a specialist doctor when conducting investigations in an adequate human clinical environment.
(2) Any other person qualified for performing clinical investigations based on his professional qualifications shall be deemed to be adequately qualified for performing clinical investigations.
Article 9
(Other terms)
For the purposes of this Act, the terms shall have the following meanings:
1. Placing on the market means the first making available in return for payment or free of charge of a medical device on the market of the European Union other than medical devices intended for clinical investigations or performance evaluation of in vitro diagnostic medical devices, regardless of whether it is new or fully refurbished.
2. Putting into service means the stage at which a medical device has been made available to the final user as being ready for use on the European Union market for the first time for its intended purpose. The beginning of the use of an active implantable medical device means making such a device available for performing medical activity.
3. An EC certificate means a document by means of which a notified body guarantees that the manufacturing process or medical device complies with the provisions of the European Union regulating medical devices and the implementing regulations arising from or issued on the basis of this act.
4. Harmonised standard means a standard adopted by one of the bodies for standardisation from Annex I to the Directive 98/34/EC of the European Parliament and of the Council of 22 June 1998 laying down a procedure for the provision of information in the field of technical standards and regulations (OJ L 204 of 21 July 1998), most recently amended with the Council Directive 2006/96/EC of 20 November 2006 adapting certain Directives in the field of free movement of goods, by reason of the accession of Bulgaria and Romania (OJ L 363 of 20 December 2006, p. 81), (hereinafter: Directive 98/34/EC), based on the proposal drafted by the European Commission in accordance with Article 6 of the Directive 98/34/EC.
5. An EC declaration of conformity means a document by means of which a manufacturer of medical devices guarantees that the manufacturing process or medical device complies with the provisions of the European Union regulating medical devices and the implementing regulations arising from or issued on the basis of this act.
6. Clinical data means data on safety or performance of medical device, obtained on the basis of its use. They are obtained from clinical investigations of this device or clinical investigations or other studies reported in the scientific literature, of a similar device for which equivalence to the device in question can be demonstrated, or from published and/or unpublished reports on other clinical experience of either the device in question or a similar device for which equivalence to the device in question can be demonstrated.
7. A single use medical device means a medical device intended to be used only once and for a single patient.
8. Package leaflet means the information for the user attached in written form to the medical device.
9. Recall means any measure aimed at achieving the return of a medical device that does not correspond to the essential requirements of this act and the provisions of the European Union regulating medical devices, which has already been made available to the final user, a legal entity that put it on the market.
10. The CE marking means a mark by means of which a manufacturer of medical devices guarantees that the medical device complies with the provisions of this act and the European Union regulating medical devices.
11. Device subcategory means a set of devices having common areas of intended use or common technology of production.
12. Authorised representative of the manufacturer of medical devices (hereinafter: manufacturer’s representative) means a legal entity with the registered office in the European Union which is explicitly authorised by the manufacturer of medical devices with the registered office in a third country to represent it and to which the competent authorities may turn in relation to the obligations of the manufacturer of medical devices.
13. Legal entities means legal persons, independent sole proprietors and other individuals engaging in a registered activity or performing such activity on the basis of a regulation or articles of association.
14. Intended purpose of use means the use for which the medical device is intended according to the data supplied by the manufacturer of the medical device on the labelling, in the instructions for use and/or in promotional materials.
15. Notified body means a body carrying out the procedures of establishing conformity with this act and the regulations issued on its basis and the provisions of the European Union regulating medical devices, meeting the terms and conditions, being appointed and notified with the European Commission in accordance with this act or the regulations of the European Union member state in which it has its registered office.
16. Manufacturer of medical devices means the legal entity with responsibility for the design, manufacture, packaging and labelling of a medical device before it is placed on the market under his own name, regardless of whether these operations are carried out by that person or on their behalf by a third party.
17. Wholesale of medical devices means purchasing of medical devices and selling them to legal entities which buy them to perform their profession or registered activity.
18. Retail of medical devices means purchasing of medical devices and their further sale to individuals for personal use.
19. Generic medical device group means a set of medical devices having the same or similar intended uses or commonality of manufacturing technology allowing them to be classified in a generic manner not reflecting their specific characteristics.
20. Third countries means Non-Member States of the European Union or signatories to the EEA Agreement.
21. Recall means a measure to prevent access to a medical device on the market.
22. Import of a medical device means wholesale from third countries into the territory of the European Union.
23. Vigilance of medical devices (hereinafter: vigilance) means the system of establishing, collecting and evaluating complications involving medical devices and other findings about their safety, as well as measures for reducing the related risk.
24. A complication involving a medical device means any malfunction or deterioration in the characteristics and/or performance of a medical device from medical or technical point of view, as well as any inadequacy in the labelling or the instructions for use which might lead to or might have led to the death of a patient, user or a third person, or to a serious deterioration in his state of health.
Article 10
(Authority)
(1) The competent minister (hereinafter: the minister) for medical devices shall be the minister competent for health, unless otherwise stipulated herein.
(2) The body competent for medical devices shall be the Public Agency of the Republic of Slovenia for Medicinal Products and Medical Devices.
(3) The body competent for medical devices shall decide in administrative matters at first instance in accordance with the act governing the general administrative procedure, unless otherwise stipulated by this Act.
(4) Unless otherwise stipulated by this Act, the body competent for medical devices must request that any incomplete applications be supplemented within 30 days of receiving such application and set a deadline in which the applicant (hereinafter: the applicant) must supplement such application.
(5) The ministry responsible for health shall decide on complaints against the decisions of the competent body responsible for medical devices.
Article 11
(Co-operation between bodies and communication of data)
(1) The body competent for medical devices shall co-operate with the authorities competent for medical devices from other Member States, with the European Commission and with other competent institutions, and exchange data with the aim of using harmonised provisions regulating medical devices.
(2) The body competent for medical devices, or legal entities, must provide the following data for the registration in the European database of medical devices (hereinafter: Eudamed):
– registration of manufacturers of medical devices, manufacturer representatives and medical devices, with the exception of data on medical devices made for individual users,
– EC certificates,
– vigilance and
– clinical investigations of medical devices.
(3) The minister shall lay down the details for the data referred to in the previous paragraph and the method of reporting them.
Article 12
(Expert advice)
The body competent for medical devices shall provide expert advice upon the request of the legal entities, regarding:
– translation of the instructions for use and labelling of a medical device,
– differentiations between medical devices and other products pursuant to Article 15 of this Act;
– classification of medical device into the adequate class pursuant to Article 16 of this Act.
Article 13
(Committees and specialists)
(1) The body competent for medical devices has established permanent and temporary committees and uses the services provided by individual specialists (hereinafter: the specialist). Within the scope of their operation the committees for medical devices and individual specialists shall have a consultative role and shall be professionally independent and autonomous.
(2) The committees for medical devices and individual specialists shall be appointed by the body competent for medical devices from among the established experts in pharmacy, medicine and other natural and technical sciences, to discuss and issue opinions in expert areas requiring special knowledge.
(3) Members of the committees for medical devices and individual specialists must not be biased and must act in accordance with the applicable regulations, and may not enable unjustified benefits or prioritise individual applicants and must comply with the provisions on confidentiality of data made available to them while performing tasks.
Article 14
(Specialists in the bodies of the European Union)
The specialists co-operating with the competent bodies of the European Union responsible for medical devices shall be appointed by the body competent for medical devices.
Article 15
(Differentiation between medical devices and other products)
(1) When deciding on the classification of the product among medical devices or other products, their main purpose of use needs to be taken into account.
(2) If a medical device was put on the market only for the purpose of using a medicinal product, it is subject to the provisions of this Act.
(3) If a medical device was put on the market to be combined with a medicinal product to represent a single product, intended only to be used in the given combination and not to be re-used, such single product is subject to the provisions of the act regulating medicinal products. The characteristics of the medical device, related to its safety and performance must correspond to the essential requirements from this Act.
(4) Where a medical device incorporates, as an integral part, a substance which, if used separately, may be considered to be a medicinal product within the meaning of the provisions on medicinal products and which is liable to act upon the body with action ancillary to that of the medical device, that products is considered a medical device.
(5) Where a medical device incorporates, as an integral part, a substance which, if used separately, may be considered to be a medicinal product constituent or a medicinal product derived from human blood or human plasma within the meaning the provisions regulating medicinal products and which is liable to act upon the human body with action that is ancillary to that of the device, that device shall be considered a medical device.
(6) If the purpose of the manufacturer of medical devices is for the medical device to be used as personal protection equipment in accordance with the provisions on personal protection equipment, the product must meet the appropriate requirements for the safety and health, in line with the provisions on personal protective equipment.
(7) In case of doubt regarding the classification of a product among medical devices, the classification shall be decided upon by the body competent for medical devices, either on the basis of the submitted application or ex officio.
(8) The detailed contents of the application referred to in the previous paragraph shall be laid down by the minister.
II. CLASSIFICATION OF MEDICAL DEVICES
Article 16
(Classification of medical devices)
(1) Medical devices shall be classified on the basis of the level of risk for the user, the location and method of use, dependence on the power source, useful life and other characteristics.
(2) According to their risk potential for the user, medical devices shall be classified as follows:
– Class I – medical devices constituting a low risk potential for users;
– Class IIa – medical devices constituting a higher risk potential for users;
– Class IIb – medical devices constituting a high risk potential for users; and
– Class III – medical devices constituting the highest risk potential for users.
(3) According to their place and method of use and other characteristics of the product, medical devices shall be classified into invasive and non-invasive.
(4) According to source of energy, medical devices shall be classified into active and inactive.
(5) According to their risk potential for the user, in vitro diagnostic medical devices shall be classified as follows:
– List A
– List B
– In vitro diagnostic medical devices for self-testing not included in List A or B and
– other in vitro diagnostic medical devices.
(6) The minister shall lay down more detailed rules for the classification of medical devices and classification of in vitro diagnostic medical devices.
Article 17
(Decision with regard to classification)
In case of disagreement regarding the correct classification of a medical device in accordance with the previous Article, the classification shall be decided upon by the body competent for medical devices.
Article 18
(Derogation clause)
The body competent for medical devices shall submit to the European Commission a grounded request for the adoption of the necessary measures, should they believe that:
– the use of classification rules requires a decision on the classification of a medical device or a category of medical devices,
– a medical device or a group of medical devices should be classified into another class,
– it is necessary to establish conformity of a medical device, active implantable medical device, in vitro diagnostic medical device or a group of medical devices with another procedure for determining conformity,
– a decision is required as to whether a particular product or product group belongs among medical devices referred to in Articles 3 to 8 hereof.
III. REQUIREMENTS FOR MEDICAL DEVICES
Article 19
(Conditions for placing on the market and putting into service or beginning of use)
(1) Medical devices may be placed on the market and/or put into service or use only if they comply with the requirements laid down in this Act and the regulations issued on its basis when duly supplied and properly installed, maintained and used in accordance with their intended purpose.
(2) Legal entities using medical devices while performing their activity must maintain them in accordance with the instructions of the manufacturer of medical devices.
Article 20
(Essential requirements for medical devices)
(1) Medical devices must satisfy both general and specific essential requirements.
(2) General requirements for medical devices are:
– they must be designed, manufactured, maintained and used in such a way that, when used under the conditions and for the purposes intended, they will not compromise the clinical condition or the safety of patients, or the safety and health of users or, where applicable, other persons, provided that any risks which may be associated with their intended use constitute acceptable risks when weighed against the benefits to the patient and are compatible with a high level of protection of health and safety;
– they must be designed so as to, as far as possible, the risk of use error due to the ergonomic features of the device and the environment in which the medical device is intended to be used (design for patient safety);
– their designing requires consideration of the technical knowledge, experience, education and training and where applicable the medical and physical conditions of intended users (design for lay, professional, disabled or other users).
(3) Specific requirements for medical devices are:
– chemical, physical and biological properties of medical devices;
– microbiological quality of medical devices;
– planning and characteristics of medical devices, depending on the environment;
– medical devices with a measuring function;
– protection against radiation;
– medical devices connected to or equipped with an energy source;
– labelling of medical devices and package leaflet.
(4) Where a relevant hazard exists, medical devices and active medical devices, which are also machinery shall meet the essential health and safety requirements set out in provisions on technical requirements and on the establishment of conformity, if the health and safety requirements are more specific than the essential requirements, stipulated hereby.
(5) More detailed essential requirements for medical devices are laid down by the minister.
Article 21
(Application of standards and technical regulations)
(1) Medical devices compliant with the requirements of national standards, adopted on the basis of harmonised standards, shall be deemed to be compliant with the requirements stipulated by this Act and the provisions issued on its basis. The minister shall publish in the Official Gazette of the Republic of Slovenia the list of standards to be used in order to ensure conformity of a medical device with the requirements of this Act and the provisions issued on its basis.
(2) Reference to the standards includes monographs in the European Pharmacopeia or in the Slovene national supplement to the European Pharmacopeia in case of a product that is a combination of a medicinal product and a medical device.
(3) If the body competent for medical devices believes that harmonised standards from the first paragraph hereunder do not comply with the requirements of this Act, it shall initiate the implementation of the protection clause in accordance with Article 26 hereof.
(4) In the case of in vitro diagnostic medical devices from the List A and, if necessary also for in vitro diagnostic medical devices from the List B, the reference to the standards shall also mean reference to common technical specifications. These common technical specifications shall establish appropriate performance evaluation and re-evaluation criteria, batch release criteria, reference methods and reference materials and shall be published in the Official Gazette of the European Union. Manufacturers of medical devices must ensure that in vitro diagnostic medical devices correspond to common technical specifications. If for duly justified reasons manufacturers do not comply with those specifications they must adopt solutions of a level at least equivalent thereto.
IV. CONFORMITY ASSESSMENT PROCEDURE OF MEDICAL DEVICES
Article 22
(Conformity assessment procedure)
(1) The conformity assessment procedure is a procedure used for direct or indirect establishment and assessment of whether medical devices, their production or performance quality corresponds to the conditions laid down by the provisions of the European Union regulating medical devices, to this Act and to the implementing regulations issued on its basis.
(2) The procedure for assessing the conformity of medical devices, described in the previous paragraph shall depend on the classification of the medical device in view of the risk for their users, namely:
– The conformity of medical devices of class I with the prescribed requirements shall be assessed by the manufacturer of the product. An exception is medical devices of class I with a measuring function and those put on the market sterile and considered products of class II in terms of the measuring function and assurance of sterility;
– The conformity, manufacturing and performance quality of medical devices of classes IIa, IIb and III with the prescribed requirements shall be assessed by the notified body.
(3) Conformity assessment procedures shall comprise:
– an integral quality assurance system;
– EC type-examination;
-EC verification;
– a manufacturing quality assurance system;
– a product quality assurance system;
– an EC declaration of conformity.
(4) Where the conformity assessment procedure involves the intervention of a notified body, the manufacturer of medical devices, or his authorised representative, may apply to a notified body of his choice with the registered office in a European Union Member State within the framework of the tasks for which the body has been notified. The notified body and the manufacturer of medical devices, or his authorised representative, may agree in writing about the process and conclusion of establishing conformity.
(5) Conformity assessment procedures shall be detailed by the minister.
Article 23
(EC certificate and EC declaration of conformity)
(1) The process of assessing conformity of medical devices of class IIa, IIb and III, active implantable medical devices and in vitro diagnostic medical devices starts with the notified body by submission of an application. The application must contain proof on the fulfilment of conditions stipulated by the provision from the fifth paragraph of the previous article.
(2) The notified body may require any information or data, which is necessary for assessing conformity. The application, evidence and letters related to the procedures of establishing conformity must be written in the Slovene language or another language understood by the notified body.
(3) Prior to initiating the process of assessing conformity, the notified body must check the classification of the product among medical devices, which is performed by manufacturer hereunder.
(4) After having assessed the conformity, the notified body shall issue an EC certificate with the validity of up to five years. The validity can be extended by a maximum of five years on the basis of an application of the manufacturer of medical devices or his representative, which must be submitted within the deadline agreed in writing by the notified body and the applicant.
(5) Notwithstanding the provision of the previous paragraph, the notified body shall issue an EC certificate of unlimited duration after having assessed the conformity of a medical device according to the process of EC verification.
(6) Before a medical device is put on the market, with the exception of those made for individual users or for clinical investigation, the manufacturer of medical devices shall draft an EC statement of conformity and affix a CE mark on the medical device.
(7) The manufacturer of medical devices or the manufacturer’s representative must keep the EC statement of conformity, technical documentation on a medical device and the certificates issued by the notified bodies and make them available to an inspector for five years after having manufactured the last medical device or 15 years after having manufactured the last active medical device to which the documentation refers.
Article 24
(Statement on medical devices made for an individual user and medical devices intended for clinical investigations)
(1) For medical devices made for an individual user and medical devices intended for clinical investigations, the manufacturer of medical devices or his representative must compile a written statement containing data on the manufacturer of medical devices, medical device and other relevant data.
(2) When putting on the market medical devices of class IIa, IIb and III, which were made for an individual user, the written statement referred to in the previous paragraph must be made available to the user of the specific medical device. The statement shall contain the user’s name or date in encoded form.
(3) The statement from the first paragraph hereunder shall be kept by the manufacturer of medical devices for a period of time of at least five years and in the case of implantable devices the period shall be at least 15 years.
(4) More detailed contents of the statement referred to in the first paragraph hereunder and the type of documentation and the content of the statement for in vitro diagnostic medical devices for evaluating their performance from the second paragraph of Article 38 hereof shall be laid down by the minister.
Article 25
(Emergency derogations)
Based on appropriately grounded request by the applicant, the body in charge of medical devices may approve the marketing and use in the Republic of Slovenia of those medical devices that have not been subjected to the conformity assessment procedures in emergency situations (epidemics, poisoning, nuclear or radiological accident or similar), or for other reasons, in the event of the protection of public health.
Article 26
(Safeguard clause)
(1) Where a body competent for medical devices ascertains that the devices, when correctly installed, maintained and used for their intended purpose may compromise the health and/or safety of patients, users or, where applicable, other persons, or the safety of property, it shall immediately take all appropriate interim measures to withdraw such devices from the market or prohibit or restrict their being placed on the market or put into service.
(2) The body competent for medical devices shall immediately inform the European Commission of any measures from the previous paragraph, stating the reasons for such a decision. It shall specifically indicate if the reason lies in non-compliance with the essential requirements hereof, incorrect application of standards referred to in Article 21 hereof or deficiencies in the standards themselves.
(3) The body competent for medical devices shall take measures against anybody who affixes the CE mark to a medical device which is not in compliance herewith. They shall inform the European Commission and the bodies of other Member States of the European Union, competent for medical devices, of any measures taken.
(4) The body competent for medical devices shall inform the public, through media release, of any measures taken in accordance with the first paragraph hereunder.
Article 27
(Particular health monitoring measures)
(1) Where a body competent for medical devices considers in relation to a given product or group of products that, in order to ensure protection of health and safety and/or to ensure that public health requirements are observed, such products should be withdrawn from the market, or their placing on the market and putting into service should be prohibited, restricted or subjected to particular requirements, it may take any necessary and justified transitional measures.
(2) The body competent for medical devices shall immediately inform the European Commission and other Member States of the European Union of any measures from the previous paragraph, stating the reasons for such a decision.
(3) The body competent for medical devices shall inform the public, through media release, of any measures taken in accordance with the first paragraph hereunder.
V. CE MARKING
Article 28
(CE marking)
(1) Medical devices meeting the requirements of this act and the regulations issued on its basis and the provisions of the European Union regulating medical devices must be labelled with the CE marking when put on the market. The CE marking must be clear, legible and indelible, also in the sterile pack, sales packaging and instructions for use.
(2) The CE marking affixed to medical devices of class IIa, IIb and III, on active implantable medical devices and on in vitro diagnostic medical devices must be accompanied by an identification number of the notified body in charge of implementing conformity assessment procedures.
(3) The CE marking is laid down by the minister.
Article 29
(Exceptions regarding the CE marking)
(1) The provisions of this act shall not apply to medical devices intended for clinical investigations, for medical devices made for individual user and for in vitro diagnostic medical devices for the evaluation of performance from Article 38 of this Act.
(2) For medical devices presented at fairs, exhibitions and presentations, no CE marking shall be required if they are visibly marked as intended to be put on the market or into service.
Article 30
(Prohibited affixing of the CE marking)
(1) It is prohibited to affix the CE marking to the products that are not medical devices on the basis of this Act.
(2) It is prohibited to affix the CE marking to the products that are not in compliance with this Act.
(3) It is prohibited to affix the CE marking to the products contrary to the provisions of this Act.
(4) It is prohibited to affix marks or inscriptions similar to the CE marking which are likely to mislead third parties with regard to the meaning or the graphics of the CE marking.
(5) It is prohibited to affix to a medical device, packaging or attached instructions for use any other marking that would reduce the visibility or legibility of the CE marking, cover it or cause any doubts as to the marking.
Article 31
(Particular procedure for systems and packs of medical devices)
(1) Where medical devices bearing the CE marking are joined into a system or package with the aim of putting it on the market in the form corresponding to their intended purpose and within the limits of use specified by their manufacturers, there is no need to perform the conformity assessment procedure and affix additional CE markings to the system or pack.
(2) The data prescribed for a system or pack of medical devices must be attached and, where appropriate, also the data on medical devices joined into the system or pack.
(3) A legal entity putting on the market the systems or packs of medical devices must issue a written statement that:
– he has verified the mutual compatibility of the devices in accordance with the manufacturers’ instructions and has carried out his operations in accordance with these instructions;
– he has packaged the system or procedure pack and supplied relevant information to users; and
– all activities were subjected to appropriate methods of internal control and inspection.
(4) The legal entity shall keep the statement referred to in the previous paragraph for at least five years and make it available to the body competent for medical devices, upon its request.
(5) Where systems or procedure packs incorporate devices which do not bear a CE marking or where the chosen combination of devices is not compatible in view of their original intended use, the system or procedure pack shall be treated as a medical device in its own right and as such be subjected to the relevant conformity assessment procedure pursuant to Article 22 hereof and afterwards affixed the CE marking.
Article 32
(Sterilisation of systems and packs)
(1) Any legal person who sterilises, for the purpose of placing on the market, systems or procedure packs or other CE-marked medical devices designed by their manufacturers to be sterilised before use, shall follow the conformity assessment procedure in order to ensure integral quality or production quality system in accordance with Article 22 hereof. The procedure and intervention of a notified body shall be used for assuring sterility until opening or damage to the sterile package. After sterilisation there is no need to affix a new CE marking.
(2) The legal entity shall draw up a written declaration stating that sterilization has been carried out in accordance with the manufacturer’s instructions. The legal entity shall keep the declaration for at least five years and make it available to the body competent for medical devices, upon its request.
VI. LABELLING AND PACKAGE LEAFLET
Article 33
(Labelling and package leaflet)
(1) Each device must be accompanied by the information needed to use it safely and properly, taking account of the training and knowledge of the potential users, and to identify the manufacturer of medical devices. Such information is stated on the packaging or label and in the instructions for use.
(2) As far as practicable and appropriate, the information needed to use the medical device safely and correctly must be set out on the device itself and/or on the packaging for each unit or, where appropriate, on the sales packaging. If individual packaging of each unit is not practicable, the information must be set out in the leaflet supplied with one or more medical devices.
(3) Information marking the medical device and the purpose of use, and the name and address of the manufacturer of the medical device or his representative must be stated on the sales packaging.
(4) The instructions for use must be included in the sales packaging of the medical device, with the exception of medical devices of class I and IIa or in justified and exceptional cases for in vitro diagnostic medical devices, if they can be used safely also without the instructions for use; nevertheless, such information must be made available to the user upon request.
(5) The instructions for use must be written in the Slovene language, legible and understandable for the user, and must contain the date of issue or the date of last revision or amendment. If they have been translated into the Slovene language, the content of the translation must be the same as that of the original instructions for use. If a medical device is intended solely to be used for performing a registered activity, the instructions for use can be written in the language understandable for the user.
(6) The minister shall lay down detailed information to be attached to the sales packaging, label and instructions for use of a medical device or systems and packs of medical devices.
VII. NOTIFIED BODIES
Article 34
(Conditions for notified body)
(1) Prior to carrying out the conformity assessment procedures from Article 22 hereof, a legal entity with the registered office in the Republic of Slovenia must be appointed by a decision of the body competent for medical devices and notified to the European Commission.
(2) In view of the type and scope of conformity assessment procedures, the notified bodies must meet the following conditions:
– have an adequate number of experts with adequate experience and knowledge necessary to assess the medical functionality and performance of devices, their quality or production quality system;
– have adequate premises, devices and equipment for assessing conformity of medical devices;
– have established operational quality assurance system;
– keep appropriate documentation on the procedures of assessment and verification of medical devices and manufacturers of medical devices.
(3) The minister shall lay down the detailed conditions to be met by a notified body and the content of the application for the appointment of the body for implementing procedures and establishing conformity.
Article 35
(Appointment and notification procedure)
(1) The procedure of appointing a the body for carrying out the conformity assessment procedures with the registered office in the Republic of Slovenia shall be initiated by the submission of an application with the body competent for medical devices. In the application, the applicant must provide information and evidence on the fulfilment of conditions from the previous article, indicating which medical devices are to be subjected to conformity assessment procedure in accordance with the provisions of Articles 16 and 22 hereof, and attach documents proving his qualification to meet the requirements hereof (e.g. accreditation document or qualification report, if available).
(2) After having received a complete application, the body competent for medical devices shall appoint a verification committee (hereinafter: the committee) which shall be composed of the experts in the operation of the body competent for performing conformity assessment procedures. The committee shall issue an opinion on the fulfilment of conditions by the applicant and on potential measures for eliminating the established deficiencies.
(3) After having received an opinion of the committee on the fulfilment of the requirements arising from this Act, the body competent for medical devices shall issue a decision on the appointment of a body competent for performing conformity assessment procedures or rejection of appointment within 60 days of receiving a complete application.
(4) When issuing the decision on the appointment of a body competent for performing conformity assessment procedures the body competent for medical devices shall send to the minister competent for the market a decision for notification with the European Commission.
(5) The minister competent for the market shall inform the European Commission and other Member States of the European Union on the appointment of the body competent for performing conformity assessment procedures together with the data on the tasks assigned to it within 15 days of receiving the decision referred to in the previous paragraph.
(6) After the European Commission has performed the procedure of establishing the fulfilment of the required conditions, the body competent for performing conformity assessment procedures shall obtain the identification number and can start performing tasks of the notified body.
Article 36
(Monitoring and revocation of appointment)
(1) The body competent for medical devices shall monitor the implementation of conformity assessment procedures from Article 22 hereof, carried out by the notified body, and the fulfilment of conditions regarding the notified body from Article 34 hereof.
(2) The body competent for medical devices shall revoke the decision on appointment should they find out that the notified body does not meet the conditions from Article 34 of this Act, of which it shall immediately inform the ministry competent for the market.
(3) The minister competent for the market shall immediately inform the European Commission and other Member States of the European Union of the revocation of appointment, referred to in the previous paragraph.
(4) The appointment and revocation of appointment shall be published on the website of the body competent for medical devices.
Article 37
(Working methods of the notified body)
(1) The notified body shall be independent and autonomous in performing its tasks and competences.
(2) A notified body may not be a designer, manufacturer, supplier or user of medical devices inspected, or a representative of such persons.
(3) Because of the conflict of interest, the personnel of the notified body may not enable unjustified benefits or prioritise individual applicants. They must respect the confidentiality of technical data on medical devices and business data on the manufacturers of medical devices.
(4) The notified body must inform the body competent for medical devices of the issued, amended and supplemented EC certificates and submit them within 30 days of their issue.
(5) The notified body must inform the body competent for medical devices and other notified bodies with the registered office in the Member States of the European Union on temporarily suspended or revoked EC certificates or rejected requests for their issue and, if requested, also on the issued EC certificates and other adequate information no later than within 15 days of revocation, cancellation, rejection of request or request.
(6) Where a notified body finds that pertinent requirements of this Act have not been met or are no longer met by the manufacturer of medical devices or where a certificate should not have been issued, it shall, taking account of the principle of proportionality, suspend or withdraw the certificate issued or place any restrictions on it unless compliance with the requirements hereunder is ensured by the implementation of appropriate corrective measures by the manufacturer. In the case of suspension or withdrawal of the certificate or of any restriction placed on it or in cases where an intervention of the body competent for medical devices may become necessary, the notified body shall inform its competent authority thereof.
(7) The body competent for medical devices shall immediately inform the European Commission and bodies competent for medical devices from other Member States of the European Union of any measures from the previous paragraph.
(8) Upon their request, the notified body must submit to the body competent for medical devices and the competent inspector the documentation on the procedures of assessing conformity of medical devices and verification of the manufacturers of medical devices, including the financial documents on the operations of the notified body.
(9) Information on EC certificates from the fourth and the fifth paragraph hereunder, with the exception of data on rejected requests for the issue of EC certificates shall not be considered confidential.
VIII. CLINICAL INVESTIGATIONS OF MEDICAL DEVICES
Article 38
(Clinical investigations of medical devices)
(1) Clinical investigation of a medical device shall mean any investigation whose objective is to establish that the safety and performance of a medical device complies with those indicated by the manufacturer of medical devices.
(2) The safety and performance of in vitro diagnostic medical devices shall be established on the basis of the studies of evaluating their performance.
Article 39
(Procedure of notifying a clinical investigation of medical devices)
(1) The applicant for a clinical investigation can be the manufacturer of medical devices or his representative.
(2) Before the start of a clinical investigation, the applicant must notify the clinical investigation to the body competent for medical devices. The application for a clinical investigation must contain data on the medical device, the plan of clinical investigation, the opinion of the National Medical Ethics Committee and other information or documentation determined by the minister.
(3) Before the start of a clinical investigation, the applicant must notify the study of the evaluation of performance of an in vitro diagnostic medical device to the body competent for medical devices. The application must contain data on in vitro medical device, the plan of performance evaluation and other information or documentation determined by the minister.
(4) The provisions from the previous paragraph shall also apply to medical devices with the CE marking where the objective of clinical investigation is the use of medical devices for the purposes that are not the subject of the conformity assessment procedure.
(5) The body competent for medical devices shall decide on the applications for notification of a clinical investigation. The body competent for medical devices shall issue a decision on the notification of a clinical investigation within 60 days of receiving a complete application. If there is no response from the competent body it shall be deemed that the notification has been approved and the clinical investigation can commence.
(6) If the body competent for medical devices rejects the notification of a clinical investigation, it shall give reasons for rejection in the decision and ground them in terms of the protection of public health or public interest. A rejection of a clinical investigation must be notified to the bodies competent for medical devices in the Member States of the European Union and the European Commission.
(7) The minister shall define the detailed contents of the application for notification of a clinical investigation and any changes to the clinical investigation.
Article 40
(The procedure of clinical investigation of medical devices)
(1) The objectives and methods of the implementation of clinical investigations of medical devices and the evaluation of clinical data and other requirements for clinical investigations of medical devices shall be determined by the minister.
(2) The applicant shall notify the body competent for medical devices of any complications related to medical devices that occurred during the clinical investigation within seven days of the event.
Article 41
(Notification of a change to a clinical investigation of medical devices)
(1) The applicant for the clinical investigation must inform the body competent for medical devices of any changes to an ongoing clinical investigation.
(2) The notified change can be introduced if the body competent for medical devices does not issue a negative decision within 30 days of receiving a complete application for such change.
Article 42
(discontinuation of a clinical investigation of medical devices)
(1) The body competent for medical devices may, for the purpose of protecting public health or health of investigated subjects, order that a trial be temporarily discontinued or adequately changed.
(2) The body competent for medical devices shall immediately inform the bodies competent for medical devices from other Member States of the European Union and the European Commission of the discontinuation of a clinical investigation and the reasons for that. The bodies competent for medical devices from the relevant Member States of the European Union shall be informed of the request for a change to or temporary discontinuation of a clinical investigation and the reasons for that.
(3) The applicant for a clinical investigation may at any point decide to discontinue a clinical investigation and inform the body competent for medical devices of the reasons for discontinuation within 15 days after the discontinuation. The body competent for medical devices must inform the bodies competent for medical devices from other Member States of the European Union and the European Commission of early discontinuation for safety reasons.
Article 43
(Completion of a clinical investigation of medical devices)
The applicant of a notified clinical investigation of a medical device must inform the body competent for medical devices of the completion of a clinical investigation within 30 days of the completion and send it the final report.
IX. MANUFACTURE OF MEDICAL DEVICES
Article 44
(Requirements for a manufacturer of medical devices)
(1) A manufacturer of medical devices must provide the following for the manufacturing of medical devices:
– adequately skilled personnel, premises, equipment and manufacturing procedures, keeping of documentation in view of the established operational quality assurance system, so as to guarantee that the manufactured medical devices are in compliance with the essential requirements hereof, which do not jeopardise the health and safety of patients, users or third persons and that they are manufactured in consideration of the scientific and technological achievements and in such a way that their risk of use is reduced or eliminated.
– a person in charge of monitoring and reporting on complications related to medical devices and measures to be taken in the event of potential risk;
– insurance of liability for potential damages caused to a patient, user or a third person as a result of inadequate quality or safety of a medical device.
(2) The detailed requirements for the manufacturers of medical devices referred to in the previous paragraph shall be laid down by the minister.
Article 45
(Entry in the register of the manufacturers of medical devices)
(1) A manufacturer of medical devices with the registered office in the Republic of Slovenia must notify itself to the body competent for medical devices for registration in the register of manufacturers of medical devices within 15 days of putting the manufactured medical devices on the market and state the name or company name, registered office or address and address of the manufacturing units and a list of manufactured medical devices.
(2) The body competent for medical devices shall immediately inform the European Commission and the competent bodies of the Member States of the European Union of the data from the previous paragraph.
(3) The data from the first paragraph hereunder shall be laid down by the minister.
Article 46
(Change of data and deletion from the register of the manufacturers of medical devices)
(1) A manufacturer of medical devices shall report any change of data referred to in the previous article to the body competent for medical devices within 15 days after the onset of the change.
(2) A body competent for medical devices shall delete a manufacturer of medical devices from the register of manufacturers of medical devices ex officio if the manufacturer of medical devices is dissolved or based on a written request of the manufacturer of medical devices.
Article 47
(Manufacturer representative)
(1) A representative of a manufacturer of medical devices with the registered office in the Republic of Slovenia must notify himself to the body competent for medical devices for registration of the manufacturer in the register of manufacturers of medical devices within 15 days of putting the manufactured medical devices, for which they are authorised, on the market.
(2) Upon notification, the manufacturer’s representative must state his name or company name and address or registered office of the represented manufacturer of medical devices and a list of medical devices put on the market under authorisation of the manufacturer of medical devices.
(3) A manufacturer’s representative shall report any change of data referred to in the previous paragraph to the body competent for medical devices within 15 days after the onset of the change.
(4) A body competent for medical devices shall delete a representative of a manufacturer of medical devices from the register of manufacturers of medical devices ex officio if he is no longer a representative of the manufacturer of medical devices or is dissolved, or based on a written request of the manufacturer of medical devices.
(5) The body competent for medical devices shall immediately inform the European Commission and the competent bodies of the Member States of the European Union of the data from the second paragraph hereunder.
(6) The data from the second paragraph hereunder shall be laid down by the minister.
Article 48
(Obligations of legal entities putting medical devices on the market under their own name)
(1) The obligations of this Act to be met by manufacturers of medical devices also apply to the legal entities who assemble, package, process, fully refurbish and/or label one or more ready-made products and/or assigns to them their intended purpose of functioning or use as a device, or sterilise them, all with a view to their being placed on the market under their own name.
(2) The provisions of the previous paragraph do not apply to persons who assemble or adapt medical devices already on the market to their intended purpose for an individual patient.
Article 49
(Notification of medical devices)
(1) A manufacturer of medical devices or his representative with the registered office in the Republic of Slovenia must notify to the body competent for medical devices any medical devices to be entered in the register of medical devices within 15 days of putting them on the market.
(2) Manufacturers of medical devices and representatives of manufacturers must submit to a body competent for medical devices, upon the latter’s request, any documentation on active implantable medical devices, medical devices of class IIa, IIb and III, medical devices made for an individual user and in vitro diagnostic medical devices put into use in the Republic of Slovenia.
Article 50
(Entry in the register of medical devices)
(1) The procedure for the entry into the register of medical devices shall be initiated by an application submitted by a manufacturer of medical devices or his representative with registered office in the Republic of Slovenia. In addition to the general information on the manufacturer of medical devices or his representative, the application shall also contain data and documents on medical devices concerned, namely:
– name or generic name of medical device,
– class or classification of medical device,
– description and purpose of use of medical device,
– EC declaration of conformity,
– copy of EC certificate,
– instructions for use, and
– special instruction in the case of new in vitro diagnostic medical device that has not been available on the market of the European Union in the last three years for the adequate analyte or another parameter or when made with a technology that has not been used in the European Union in the last three years for the adequate analyte or another parameter.
(2) A body competent for medical devices shall issue a decision on the entry of a device in the register of medical devices within 60 days of receiving a complete application and enter a medical device or a group of devices into the register of medical devices.
(3) A manufacturer of medical devices or his representative with the registered office in the Republic of Slovenia shall report any change of data referred to in the first paragraph hereunder to the body competent for medical devices within 15 days after the onset of the change.
(4) The detailed contents of the application for the entry in the register of medical devices shall be laid down by the minister.
Article 51
(Declaration of free sale of a medical device)
(1) A body competent for medical devices may issue a declaration to a manufacturer of medical devices with the registered office in the Republic of Slovenia, upon his request, to confirm that the relevant medical device or a group of medical devices was put on the market in accordance with the provisions of the European Union regulating medical devices and with this Act and any implementing regulations issued on its basis, and that there are no restrictions for putting the medical device concerned on the market.
(2) The detailed contents of the application for the issue of a declaration on free sale of a medical device referred to in the previous paragraph shall be laid down by the minister.
X. MARKETING OF MEDICAL DEVICES
Article 52
(Wholesaling of medical devices)
(1) Only the legal entities that meet the conditions for performing the trade activity, as laid down by the relevant regulations on trade, may wholesale medical devices.
(2) A legal entity referred to in the previous paragraph must notify itself to the body competent for medical devices for registration in the register of legal entities engaged in wholesaling medical devices within 15 days of the beginning of wholesaling medical devices.
(3) Legal entities wholesaling medical devices must:
– take due care to ensure that all medical devices put on the market are compliant with the provisions of this Act;
– verify if the prescribed CE marking had been affixed to medical devices before they are put on the market and if they had been equipped with the instructions for use and other data stipulated by this Act;
– provide such storage and transport conditions that preserve the compliance of a medical device with the requirements hereof;
– have appointed a person responsible for the vigilance of medical devices with the minimum level of education V and qualification for handling the wholesaled medical devices.
(4) If a legal entity placed on the market a medical device they believe or reasonably judge to be incompliant with the provisions of this Act, they shall immediately inform the manufacturer of medical devices or the manufacturer’s representative and ensure that adequate measures are taken to eliminate deficiencies or, if necessary, withdraw or recall a medical device. If a medical device threatens the life or health of people, a legal entity shall immediately inform the body competent for medical devices, indicating the Member States of the European Union in which the medical device concerned was put on the market and submitting the data on non-compliance with the requirements and measures adopted to eliminate them.
(5) Upon the request of a body competent for medical devices, a legal entity wholesaling medical devices must submit all the necessary information on wholesaled medical devices and co-operate in the implementation of corrective measures in the scope of vigilance of medical devices.
(6) A legal entity wholesaling medical devices shall report any change of data referred to in the eighth paragraph hereunder to the body competent for medical devices within 15 days after the onset of the change.
(7) The body competent for medical devices shall delete the legal entity wholesaling medical devices from the register of legal entities wholesaling medical devices ex officio, if the entity is dissolved or upon its written request.
(8) Detailed information for notifying a legal entity wholesaling medical devices shall be laid down by the minister.
Article 53
(Retailing of medical devices)
(1) Only the pharmacies and specialised or other stores that meet the conditions for performing the trade activity, as laid down by the relevant regulations on trade, may retail medical devices.
(2) Only medical devices that meet the requirements of this Act may be retailed.
(3) In vitro diagnostic medical devices for HIV self-testing may only be retailed in pharmacies.
(4) Medical devices may be retailed in specialised stores by legal entities that meet the conditions for performing the trade activity, have adequate premises and personnel qualified and trained to provide professional advice to the users of retailed medical devices
(5) A legal entity referred to in the previous paragraph must notify itself to the body competent for medical devices for registration in the register of legal entities engaged in retailing medical devices in specialised stores within 15 days of the beginning of retailing medical devices. Such legal entity shall report any change of data referred to in the eighth paragraph hereunder to the body competent for medical devices within 15 days after the onset of the change.
(6) The body competent for medical devices shall delete the legal entity retailing medical devices in specialised store from the register of legal entities retailing medical devices ex officio, if the entity is dissolved or upon its written request.
(7) Only medical devices that can be sold without the instructions for use inserted in the sales packaging, in accordance with the fourth paragraph of Article 33 hereof, and medical devices intended for protection against the spreading of contagious diseases can be retailed in other stores.
(8) The conditions from the fourth paragraph of this article and the information for notifying a legal entity retailing medical devices in a specialised store shall be laid down by the minister.
Article 54
(Import of medical devices)
(1) A legal entity may only import medical devices which are compliant with the requirements of this Act and for which the manufacturer of medical devices from a third country has an authorised representative with registered office on the territory of the European Union.
(2) A legal entity importing medical devices (hereinafter: an importer) must meet the conditions for performing the trade activity, as laid down by the relevant regulations on trade.
(3) In addition to the conditions stipulated by the previous paragraph, an importer must also meet the requirements laid down in the third, fourth and fifth paragraph of Article 52 hereof and:
– make sure that the manufacturer of medical devices carried out the adequate procedure of assessing conformity of the imported medical device;
– make sure that the manufacturer of medical devices compiled the adequate documentation on imported medical device;
– state on a medical device or, if that is not possible, on the packaging or instructions for use the name or company name, address or registered office to be contacted in relation to the information on medical device;
– make available for inspection the EC declaration of conformity of a medical device to the body competent for medical devices, upon its request, during the period in which the relevant medical device is being used.
(4) In addition to the conditions laid down in the previous paragraph, an importer retailing medical devices must also meet the conditions from the previous article.
(5) An importer must notify itself to the body competent for medical devices for registration in the register of legal entities engaged in wholesaling medical devices in accordance with Article 52 hereof.
(6) An importer from the fourth paragraph hereunder must also notify itself to the body competent for medical devices for registration in the register of specialised stores wholesaling medical devices in accordance with the previous article.
Article 55
(Free movement of medical devices)
It shall be prohibited to prevent the putting on the market or into use or service of medical devices that are compliant with the requirements of this Act and the implementing regulations issued on its basis.
XI. VIGILANCE OF MEDICAL DEVICES
Article 56
(Information on complications related to medical devices)
(1) Manufacturers of medical devices, their representatives and legal entities wholesaling medical devices must establish and maintain their own system of vigilance of medical devices that enables collection, evaluation and exchange of data on complications related to medical devices and co-operate with the body competent for medical devices.
(2) Collection of reports on complications related to medical devices and their evaluation shall be carried out by the body competent for medical devices which shall co-operate with the competent bodies of the Member States of the European Union.
(3) Manufacturers of medical devices, their representatives and legal entities wholesaling or retailing medical devices and importers with registered office in the Republic of Slovenia must inform the body competent for medical devices of any complication they are aware of within 24 hours.
(4) Providers of healthcare, pharmaceutical or other services must inform the body competent for medical devices of any complication they have been made aware of within 24 hours of the complication or their knowledge of it. They may also inform the manufacturer of medical devices or its representative of such complication.
(5) A report on a complication related to a medical device from the third and the fourth paragraph hereunder must indicate the name or company name and address or registered office of a legal entity or a provider of services and personal name of the reporter.
(6) A manufacturer of medical devices or its representative must research each complication related to a medical device of which they have been informed and inform the body competent for medical devices of its findings in accordance with the provision of the ninth paragraph hereunder.
(7) After having evaluated the complication related to a medical device, if possible in co-operation with the manufacturer or its representative, the body competent for medical devices shall inform the European Commission and bodies competent for medical devices from other Member States of the European Union of any measures taken to eliminate the complication related to a medical device.
(8) Providers of healthcare services who implant medical devices must keep a record of persons who have been implanted medical devices in order to ensure traceability and action in the event of any complications. The records shall comprise the patient’s personal name, address and telephone number, date of implantation, data on medical device (type and serial number) and on the manufacturer of medical devices.
(9) The minister shall lay down more detailed contents of the report from the fifth paragraph hereunder and the conditions for integral functioning of medical device vigilance system.
XII. ADVERTISING OF MEDICAL DEVICES
Article 57
(Advertising of medical devices)
Advertising of medical devices shall mean any form of information on medical devices, including door-to-door information, publication or inducement designed to promote the sale or use of medical devices.
Article 58
(Conditions for the advertising of medical devices)
(1) It shall be prohibited to advertise medical devices that do not meet the requirements from this Act.
(2) Notwithstanding the previous paragraph, legal entities may show medical devices that are not compliant with this Act at fairs, exhibitions, presentations and similar events, provided that they visibly indicate that the devices shall not be available for sale or use until they are made compliant with this Act or the implementing regulations issued on its basis.
(3) Medical devices used exclusively for performing medical activity may be advertised to the expert public. Expert public shall mean healthcare professionals as defined by the law regulating medical activity.
Article 59
(Method of advertising)
(1) The advertising of medical devices may not contain information which:
– indicates that the effects of the use of a medical device are guaranteed completely or that its usefulness equals that of any other treatment;
– indicates that the health of a person can only be enhanced by using the advertised medical device;
– indicates that the health of a person can only be enhanced by using the advertised medical device;
– are directed exclusively or principally at children;
– refers to a recommendation by scientists, health professionals or other publicly renowned persons who could encourage the use of a medical device because of their media influence;
– could, by a description or detailed representation of a case history, lead to erroneous self-diagnosis;
– refers, in improper, alarming or misleading terms, to claims of recovery;
– uses, in improper, alarming or misleading terms, pictorial representations of changes in the human body caused by disease or injury, unless presented in accordance with the established ethical and moral principles; or
– violate or abuse human dignity.
(2) Where medical devices are being promoted to expert community, no gifts, pecuniary advantages or benefits in kind may be given, offered or promised unless they are of small value, as prescribed for public officials.
(3) It shall be prohibited to present the characteristics and purpose of use of a medical device in a misleading way.
(4) Samples of medical devices may be given to the general and expert publics under the terms and conditions laid down by the minister.
Article 60
(Prohibition of misleading presentation of products)
It shall be prohibited to put on the market or into use any products presented with the characteristics of a medical device if not classified as such pursuant to this Act.
Article 61
(Official records)
A body competent for medical devices shall keep:
– a register of medical devices the manufacturers of which, or their representatives, have their registered office in the Republic of Slovenia, containing a name or generic name of medical devices, their classification and name or company name of the manufacturer of medical devices or its representative;
– a register of manufacturers of medical devices with registered office in the Republic of Slovenia, containing a name or company name of the manufacturer of medical devices or its representative and the type of medical device manufactured or authorised to represent;
– register of legal entities wholesaling medical devices, containing a name or company name, address or registered office of a legal entity;
– register of specialised stores retailing medical devices, containing a name or company name, address or registered office of a legal entity and specialised store;
– list of notified bodies with the registered office in the Republic of Slovenia, containing a name company name, address or registered office of a notified body and type of tasks for which it had been appointed.
XIII. FEES
Article 62
(Fees)
(1) The applicant shall pay the following fees for the procedures stipulated hereunder to the body competent for medical devices unless otherwise stipulated hereby:
– for the cost of expert consulting under Article 12 hereof,
– for the procedure of classifying a product among medical devices under Article 15 hereof,
– for the procedure of appointing a notified body under Article 35 hereof,
– for the procedure of notifying a clinical investigation or its change under Articles 39 and 41 hereof,
– for the procedure of entering in the register of medical devices under Article 50 hereof,
– for the declaration on free sale of a medical device under the first paragraph of Article 51 hereof.
(2) Notified bodies with registered offices in the Republic of Slovenia shall pay annual fees to the body competent for medical devices for monitoring the procedures and assessing conformity and fulfilment of conditions in accordance with the first paragraph of Article 36 hereof.
(3) The amount of fees under the first and the second paragraph hereunder shall be laid down by the minister.
XIV. SUPERVISION
Article 63
(Competence for supervision)
(1) The body competent for medical devices shall exercise supervision over medical devices. The supervision tasks shall be performed by the inspectors for medical devices.
(2) Market inspectors shall inspect the implementation of the provisions of the first paragraph of Article 52, the first and the fourth paragraph of Article 53 and the second paragraph of Article 54 hereof, relating to the fulfilment of conditions stipulated by the provisions on trade.
Article 64
(Appointment of inspector)
(1) In order to be appointed inspector under the first paragraph of the previous article, a person must have:
– university level education,
– at least 5 years of work experience, and
– passed the professional examination for inspectors according to the law regulating inspection.
(2) Inspectors from the first paragraph of the previous article shall be appointed by the head of the body competent for medical devices in accordance with the law regulating civil servants.
Article 65
(Competences of inspectors)
(1) Inspectors shall have the position, rights and obligations laid down for the inspectors by the law regulating inspection and the law regulating civil servants.
(2) In addition to the competences laid down in the previous paragraph, an inspector shall also have the following competences and tasks:
– impose on a legal entity to harmonise the operations with the provisions of this Act and the regulations adopted on its basis within the specified deadline;
– prohibit the putting on the market or ordering withdrawal or recall of medical devices not in compliance with this Act;
– prohibit the use or putting into service, restricting or ordering cessation of use of medical devices not in compliance with this Act;
– ban the manufacture, clinical investigation or marketing of medical devices on the grounds of incompliance with prescribed conditions hereof;
– request all necessary information from the legal entity and insight into issued conformity documents and other documentation;
– order execution of appropriate tests and checks of medical devices in order to assess their conformity with regulations also after such products have been put on the market or come into use;
– order the destruction of non-conforming medical devices, if necessary for protection of the health and safety of people;
– collect sample medical devices and submit them for conformity assessment procedure;
– prohibit the presentation or advertising of medical devices that is not in compliance with the provisions of this Act;
– order the removal or destruction of the material used for illegal advertising of medical devices;
– order elimination of established incompliance with this act and the provisions issued on its basis;
– order measures to be taken by the legal entity in relation to the implementation of the vigilance system in accordance with this Act and the regulations issued on its basis;
– order to a notified body to harmonise operations with the requirements of this Act;
– order other measures necessary for the implementation of this Act and the regulations issued on its basis.
(3) An appeal against the measures stipulated under the previous paragraph, ordered by the inspector, shall not prevent their implementation.
XV. PENAL PROVISIONS
Article 66
(Penal provisions)
(1) A fine from 1,000 to 10,000 euros shall be imposed for an offence on a legal entity:
1. for failing to maintain medical devices in accordance with the provision laid down in Article 19, paragraph 2);
2. for failing to keep during the prescribed period or making available the documentation from the seventh paragraph of Article 23 hereof;
3. for failing to keep the statement on medical devices made for an individual user and medical devices intended for clinical investigations, within the deadlines in accordance with the third paragraph of Article 24 hereof;
4. for failing to attach to the system and package of medical devices intended for putting on the market or into use the prescribed information (the second paragraph of Article 31);
5. for failing to issue a written declaration, keeping it for five years or failing to make it available to the body competent for medical devices (the third and the fourth paragraph of Article 31);
6. for failing to carry out the procedure for assessing the system for integral quality assurance or the procedure for assessing the production quality assurance system (the first paragraph of Article 32);
7. for failing to issue a written declaration, keeping it for five years or failing to make it available to the body competent for medical devices (the second paragraph of Article 32);
8. for failing to attach to the medical device the prescribed information or attaching or indicating them contrary to Article 33 hereof or on the basis of this Act and the related implementing regulations;
9. for failing to attach to the medical device the instructions for use contrary to the fifth paragraph of Article 33 of this Act or the implementing regulations issued on its basis;
10. for failing to notify the changes to clinical investigation in accordance with Article 41 hereof;
11. for failing to inform the body competent for medical devices of the discontinuation of a clinical investigation (the third paragraph of Article 42);
12. for failing to inform the body competent for medical devices of the discontinuation of a clinical investigation within the prescribed deadline or failing to send it the final report (Article 43);
13. for failing to communicate changes to data in accordance with Article 46 hereof;
14. for failing to register in the register of the manufacturers of medical devices or communicate changes to data in accordance with Article 47 hereof;
15. for failing to meet the obligations that apply to manufacturers of medical devices in accordance with the first paragraph of Article 48 hereof;
16. for failing to notify medical devices, as manufacturer, in accordance with Article 49 hereof;
17. for failing to communicate changes to data, as manufacturer in accordance with the third paragraph of Article 50 hereof;
18. for failing to notify itself to the body competent for medical devices for registration in the register of legal entities engaged in wholesaling medical devices of failing to communicate changes to data (the second and the sixth paragraph of Article 52 hereof);
19. for failing to notify itself to the body competent for medical devices for registration in the register of specialised stores engaged in retailing medical devices of failing to communicate changes to data pursuant to the fifth paragraph of Article 53 hereof;
20. for retailing medical devices contrary to Article 53 hereof;
21. for failing to inform the body competent for medical devices of a complication related to a medical device (the third paragraph of Article 56);
22. for failing to keep a list of persons in accordance with Article 56 hereof.
(2) A fine from 500 to 5,000 euros shall be imposed for an offence listed in the previous paragraph on an independent sole proprietor and an individual engaging in a registered activity.
(3) A fine from 200 to 2,000 euros shall be imposed on the responsible person of the legal entity or the responsible person of an individual sole proprietor for committing the offence referred to in the first paragraph hereunder.
Article 67
(Penal provisions)
(1) A fine from 15,000 to 150,000 euros shall be imposed for an offence on a legal entity that:
1. puts on the market or into use medical devices that are not compliant with the requirements hereof (the first paragraph of Article 19);
2. fails to produce an EC declaration of conformity in accordance with the sixth paragraph of Article 23 hereof;
3. fails to affix a CE marking in accordance with the sixth paragraph of Article 23 hereof;
4. affixes a CE marking to a product that is not a medical device (the first paragraph of Article 30);
5. affixes a CE marking to a medical device that is incompliant with this Act or affixes it contrary to the provisions of this Act (the second and the third paragraph of Article 30);
6. affixes a marking or inscription similar to the CE marking which is misleading as to the meaning or graphic representation of the CE marking (the fourth paragraph of Article 30);
7. covers the CE marking by affixing to a medical device, packaging or instructions for use any other label or causing ambiguity as to the labelling (the fifth paragraph of Article 30);
8. performs the tasks of a notified body without being appointed and notified as such in accordance with the first paragraph of Article 34 hereof;
9. fails to inform the body competent for medical devices of, or submit to it, the relevant EC certificates in accordance with the fourth paragraph of Article 37 hereof;
10. fails to inform the body competent for medical devices of the relevant EC certificates in accordance with the fifth paragraph of Article 37 hereof;
11. commences a clinical investigation even though the conditions from Article 39 hereof or the implementing regulations issued on the basis of this Act have not been met;
12. carries out a clinical investigation contrary to this Act and regulations issued on the basis of this Act,
13. no longer meets the requirements from Article 44 hereof;
14. fails to enter itself in the register of manufacturers of medical devices (the first paragraph of Article 45);
15. fails to meet the conditions or obligations laid down in the third, fourth and fifth paragraph of Article 52 hereof;
16. retails in vitro diagnostic medical devices for HIV self-testing outside a pharmacy (the third paragraph of Article 53);
17. retails medical devices without adequately qualified and trained personnel for professional consulting (the fourth paragraph of Article 53);
18. markets medical devices contrary to the seventh paragraph of Article 53 hereof;
19. fails to meet the conditions laid down in the third and fourth paragraph of Article 54 hereof;
20. fails to notify itself with the body competent for medical devices in accordance with the fifth or sixth paragraph of Article 54 hereof;
21. blocks free movement of medical devices (Article 55);
22. fails to meet the obligations from the sixth paragraph of Article 56 hereof;
23. advertises a medical device contrary to the first or third paragraph of Article 58 hereof;
24. advertises a medical device with information from the first paragraph of Article 59 hereof;
25. gives, offers or promises gifts, pecuniary advantages or benefits in kind to the expert public when advertising medical devices unless they are of small value (the second paragraph of Article 59);
26. presents the characteristics and purpose of use of medical devices in a misleading way (the third paragraph of Article 59);
27. gives samples of medical devices contrary to the fourth paragraph of Article 59 hereof;
28. puts on the market or into use any products presented with the characteristics of a medical device not classified as such pursuant to this Act (Article 60).
(2) A fine from 700 to 7,000 euros shall be imposed for an offence listed in the previous paragraph on an independent sole proprietor and an individual engaging in a registered activity.
(3) A fine from 300 to 3,000 euros shall be imposed on the responsible person of the legal entity or the responsible person of an individual sole proprietor for committing the offence referred to in the first paragraph hereunder.
XVI. TRANSITIONAL AND FINAL PROVISIONS
Article 68
(Issue of implementing regulations)
(1) The implementing regulations based on this Act shall be issued before the beginning of application hereof.
(2) Until the beginning of application of this Act, the implementing regulations issued on the basis of the Medical Devices Act (Official Gazette of the Republic of Slovenia nos. 101/99, 70/00, 7/02, 13/02 – Zkrmi, 67/02, 47/04 – ZdZPZ and 31/06 – ZZdr-1) shall apply, provided that they are not contrary to this Act or unless otherwise stipulated hereby:
– Rules concerning the requirements to be met by specialized retail traders in medical devices (Official Gazette of the RS, no. 73/00);
– Rules on medical devices (Official Gazette of the Republic of Slovenia, nos. 71/03, 51/04 and 98/06);
– Rules on in vitro diagnostic medical devices (Official Gazette of the Republic of Slovenia, nos. 47/02, 75/03 and 51/04);
– Rules on the advertising of medicinal products and medical devices (Official Gazette of the Republic of Slovenia, nos. 76/01 and 105/08).
Article 69
(Procedures following the enforcement of this Act)
(1) Medical devices the manufacturers or representatives of which have their registered offices in the Republic of Slovenia and which are available on the market on the date of the beginning of the application of this Act shall be entered in the register of medical devices in accordance herewith until 21 September 2010.
(2) As of the beginning of application of this Act, the registers established on the basis of the Medical Devices Act (Official Gazette of the Republic of Slovenia nos. 101/99, 70/00, 7/02, 13/02 – Zkrmi, 67/02, 47/04 – ZdZPZ and 31/06 – ZZdr-1) shall be kept as registers hereunder and their contents must be aligned with the provisions hereof until 21 September 2010.
(3) The notified body appointed before the beginning of application hereof must be appointed hereunder by no later than 21 September 2010.
Article 70
(Procedures prior to the enforcement of this Act)
Procedures initiated prior to the enforcement of this Act shall be finished pursuant to the provisions stipulated hereby.
Article 71
(Abrogation)
On the day this Act enters into force, the Medical Devices Act (Official Gazette of the Republic of Slovenia nos. 101/99, 70/00, 7/02, 13/02 – ZKrmi, 67/02 and 47/04 – ZdZPZ and 31/06 – ZZdr-1) which applies until the enforcement of this Act, shall cease to apply.
Article 72
(Enforcement and beginning of application of this Act)
This Act shall enter into force on the fifteenth day of its publication in the Official Gazette of the Republic of Slovenia and shall apply as of 21 March 2010.
“,”Jaka Verbic Miklic”,1521998220,1521998220,en,12445,306,12423,43,0,NULL,,”Zakon o medicinskih pripomočkih, UL št. 98, 4.12.2009″,zakon-o-medicinskih-pripomockih-ul-st-98-4-12-2009,Post,”/sites/43/files/images/O nas/Predpisi/shutterstock_461918101.jpg”,1,0,1521998501,1524652258
367,12333,”Medication Prices”,”Prices of prescription innovative medicines in Slovenia are subject of strict regulation. Pharmaceutical companies actively co-operate with relevant institutions in forming the prices of medication and strive to make medicine accessible.
Check out how the procedures of medication price forming work in Slovenia.”,”
We clarify basic terms and explain what has an effect on the price of medication
Medicines are one of the most regulated areas and are subject to strict control every step of the way – from the process of research and development all the way to their sales and use. Of course the prices of prescription medicines, which are funded by public means, are strictly regulated, a number of institutions are involved and a long list of legislation is applied.
In Slovenia prices of medicines are subject of the Medicinal Products Act and are the domain of Agency for Medicinal Products and Medical Devices of the Republic of Slovenia (JAZMP). Public funding of medicines is defined in the Healthcare and Health Insurance Act and is the domain of Health Insurance Institute of Slovenia (ZZZS). Additional control over innovative prescription medicines’ prices is guaranteed through Rules on determining the prices of medicinal products for human use and Rules of Reimbursement.
Maximum Allowed Price (MAP)
As most other countries do Slovenia also has a comparative model in place to determine the prices of medicinal products. This model considers medicinal products prices in Germany, Austria and France. The law determines that a MAP for an individual medicine must be the same as the lowest price for the same medicine in any of those three countries. MAPs are under strict control and JAZMP checks them regularly twice a year. Austria, Germany and France each in their own way consider medicinal products prices in other countries as well and relevant clinical contributions and values of the medicine. So MAPs in Slovenia are indirectly influenced by prices in other European countries, too.
Agreed price
Strictly regulated MAPs are, however, not the final prices for medicines in Slovenia. Suppliers, payers and buyers can negotiate about the prices which are lower than MAPs and so ZZZS and pharmaceutical industry can arrange discounts. The agreed price is therefore usually lower than the lowest price for that medicine in Austria, Germany and France. An in-depth analysis by Quintiles IMS (NYSE) company showed that additional discounts to MAPs in Slovenia average more than 20 percent.
Highest Recognised Value (HRV)
In addition to MAP and agreed price a Highest Recognised Value (HRV) needs to be explained to fully understand this subject. HRV is the price standard set by ZZZS for each medicine which is funded from mandatory health insurance either fully or in part depending on its classification. HRVs are adjusted every two months by ZZZS’s management board or by the Director General of ZZZS if so authorised by the Management Board. ZZZS sets HRVs for therapeutic and interchangeable medicinal products. If the sales price of a medicine is higher than its HRV then one must pay for the difference between them.
Therapeutic groups of medicinal products are defined by ZZZS at their own initiative. One such group includes innovative medicines with the same therapeutic indication with or without an approved generic alternative. An HRV for a therapeutic group equals the lowest price of a comparable dose of the medicine which has the best cost to effectiveness ratio within the therapeutic group. All doses of at least one medicine from a therapeutic group are fully covered by medical insurance.
Interchangeable medicinal products groups are comprised of innovative medicines with expired patent protection and with existing approved generic alternatives. One such group is defined by a number of parameters (active substance, ATC mark, strength and comparable form of medicine) and comprised of at least two medicines with a proprietary name regarding the work code. HRV for medicinal products from this group is set by the price of a comparable dose of the cheapest medicine in the group.
“,,1526201640,1526201640,en,12333,306,12298,43,0,NULL,,”Cene zdravil”,cene-zdravil,Post,/sites/43/files/images/Fokus/Flascs.jpg,1,0,1521579892,1551697965
386,12878,”Javna objava prenosov sredstev ZD in ZO 2017″,”Skladno z določili Kodeksa transparentnosti javno objavljamo prenose vrednosti zdravstvenim delavcem in zdravstvenim organizacijam s strani farmacevtskih družb”,”
Skladno z določili Kodeksa transparentnosti članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ (v nadaljevanju Forum) tudi v letošnjem letu javno objavljajo prenose vrednosti zdravstvenim delavcem in zdravstvenim organizacijam. Kot določa Kodeks, bodo vse inovativne farmacevtske družbe, članice Foruma, podatke objavile do vključno 30. junija 2018.
Objava zajema podatke o prenosih vrednosti v preteklem koledarskem letu in na spletnih straneh posameznih članic ponuja vpogled v prenose v obdobju od 1. januarja do 31. decembra 2017. Po določilih zveze EFPIA se podatki javno objavljajo periodično, vsako leto, najkasneje do konca meseca junija, in sicer za preteklo koledarsko leto.
Javna objava prenosov vrednosti vključuje podatke o vrednostih vseh sredstev, ki so jih prejeli posamezni zdravstveni delavci in zdravstvene organizacije, s katerimi sodelujejo posamezne članice Foruma ali Forum – bodisi neposredno ali prek tretjih oseb, kot so agencije za organizacijo dogodkov. Javna objava vsebuje tudi informacije o vrsti dejavnosti ali tipu podpore:
– za izobraževanje;
– za kritje stroškov, povezanih z izobraževalnimi oziroma strokovnimi dogodki;
– za storitve in svetovanje;
– za raziskave in razvoj.
Te prenose vsaka članica Foruma objavi v slovenskem jeziku na svoji lokalni, regijski ali mednarodni spletni strani.
Vsi prenosi zdravstvenim organizacijam, kamor se po Kodeksu transparentnosti uvrščajo javne zdravstvene institucije, zdravniška društva, združenja, zbornice in zasebna podjetja (d.o.o. in s.p.), so skladno z zakonodajo objavljeni individualno s polnim nazivom prejemnika.
Pri prenosih vrednosti posameznim zdravstvenim delavcem, fizičnim osebam, je objava v skladu z Zakonom o varstvu osebnih podatkov mogoča samo na podlagi predhodnega pisnega soglasja zdravstvenega delavca. V nasprotnem primeru se prenos objavi v skupinski obliki, pri čemer je v vsaki kategoriji navedeno število prejemnikov ter skupni znesek takim prejemnikom.
Podatki o plačilih na področju raziskav in razvoja zaradi varstva konkurence ter inovacij, ki jih razvijajo posamezne družbe, skladno z zakonodajo ne morejo biti objavljeni drugače kot v skupinski obliki.
Podatki, objavljeni v tem poročilu, so izraz naših prizadevanj za ravnanje skladno z zahtevami Kodeksa transparentnosti in zveze EFPIA (Disclosure Code). Če se kljub našim prizadevanjem za zagotovitev natančnih objav zgodi, da poročilo vsebuje nepopolne ali netočne podatke, bomo to raziskali in morebitne napačne podatke ustrezno popravili.
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ, je v koledarskem letu 2017 sodeloval s 14 različnimi posamezniki in organizacijami. Za izvedene storitve na področju svetovanja – kategorija Nadomestila za storitve in svetovanje – je na osnovi avtorskih pogodb izplačal nadomestila 6 zdravstvenim delavcem, sponzorsko podprl izvedbo strokovnih srečanj in simpozijev 2 zdravstvenih organizacij, 6 organizacijam pa prispeval sredstva za izvedbo predavanja oziroma organizacijo strokovnega dogodka.
Skupna vrednost prenosov Foruma posameznim zdravstvenim delavcem v letu 2017 je znašala 4.812,30 EUR, zdravstvenim organizacijam pa 22.297,20 EUR. Vsi prenosi so objavljeni poimensko oziroma s polnim nazivom prejemnika.
Javno objavljeni podatki zajemajo prenose vrednosti, ki so bili v finančnem sistemu Foruma dejansko izvršeni v koledarskem letu 2017, to je od vključno 1. januarja 2017 do vključno 31. decembra 2017.
Prenosi posameznim zdravstvenim delavcem so navedeni kot bruto vrednosti tovrstnih pogodb.
Prenosi zdravstvenim organizacijam so navedeni kot neto zneski tovrstnih pogodb, ki ne vključujejo DDV.
Prenosi vrednosti, povezani s potnimi stroški, nastanitvami in stroški prijav, so objavljeni v podatkih za koledarsko leto, v katerem so dejavnosti potekale.
Opombe k tabeli “Podatki o prenosu vrednosti zdravstvenim delavcem in zdravstvenim organizacijam s strani Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ, za leto 2017”:
1 Področje opredeljuje Kodeks transparentnosti, člen 3.1.1.1
2 Področje opredeljuje Kodeks transparentnosti, člen 3.1.1.2 in 3.1.2.1
3 Področje opredeljuje Kodeks transparentnosti, člen 3.1.1.3 in člen 3.1.2.2
4 Področje opredeljuje Kodeks transparentnosti, člen 3.2
5 Področje opredeljuje Kodeks transparentnosti, člen 3.2
6 Področje opredeljuje Kodeks transparentnosti, člen 3.4
Oznaka “/” pomeni, da na tem področju ni bilo izvedenih prenosov vrednosti.
Vsi navedeni zneski predstavljajo skupne vrednosti za leto 2017.
Vse navedene transakcije so bile izvršene v koledarskem letu 2017, torej od vključno 1. januarja 2017 do vključno 31. decembra 2017.
Vrednosti prenosov sredstev zdravstvenim delavcem v letu 2017 so navedene v bruto zneskih.
Vrednosti prenosov sredstev zdravstvenim organizacijam so navedene v neto zneskih (brez DDV).
Zdravstvene organizacije (ZO) Kodeks transparentnosti opredeljuje kot vse samostojne podjetnike (s.p.) in pravne osebe, ki so zdravstvena, medicinska ali znanstvena združenja ali organizacije (ne glede na pravno ali organizacijsko obliko), kot so bolnišnice, klinike, fundacije, univerze ali druge izobraževalne ustanove ali akademska združenja (razen organizacij bolnikov v okviru Kodeksa sodelovanja z združenji bolnikov) ali preko katerih eden ali več zdravstvenih delavcev izvaja svoje storitve.
Zdravstvene delavce (ZD) Kodeks transparentnosti opredeljuje kot vse fizične osebe, ki so članice zdravstvene, zobozdravstvene, farmacevtske ali negovalne stroke ali vse druge osebe, ki lahko pri opravljanju svojih poklicnih dejavnosti predpišejo, kupijo, zagotovijo ali odmerijo zdravilo in katerih primarna praksa, naslov glavne poklicne dejavnosti ali sedež je v Republiki Sloveniji.
V izogib dvomom opredelitev ZD vključuje vse uradnike ali zaposlene v vladni agenciji ali drugi organizaciji (ne glede na to, ali je v zasebnem ali javnem sektorju), ki lahko predpišejo, kupijo, zagotovijo ali odmerijo zdravila, in vse zaposlene v Republiki Sloveniji, katerih glavna poklicna dejavnost je izvajanje zdravstvene dejavnosti, to pa ne vključuje vseh drugih zaposlenih v Republiki Sloveniji in prodajalcev na debelo ali distributerjev zdravil.
Kodeks transparentnosti je v celoti dostopen tukaj.
Metodologija objavljenih podatkov ni enotna, je pa opisana pri posameznih objavah družb.
|
“,Administrator,1529653560,1529653560,sl,12878,306,12877,43,0,NULL,,”Javna objava prenosov sredstev ZD in ZO 2017″,javna-objava-prenosov-sredstev-zd-in-zo-2017,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1529652332,1541422632
387,12878,”Public disclosure of transfers of value”,”from to HCPs and HCOs in 2017″,”
PUBLIC NOTICE ON TRANSFERS OF VALUE FROM PHARMACEUTICAL COMPANIES TO HEALTHCARE PROFESSIONALS AND HEALTHCARE ORGANIZATIONS
Pursuant to provisions from the Disclosure Code, members of The Forum of International Research and Development Pharmaceutical Companies, GIZ (hereinafter referred to as: Forum) are this year again publishing the values of transfers to healthcare professionals and healthcare organizations, respectively. As provided for under the Code, all innovative pharmaceutical companies that are members of the Forum will publish their data by up to 30 June 2018 inclusive.
The publication includes data on transfers of value in the past calendar year and provides disclosure of transfer in the period from 1 January to 31 December 2017 on the websites of individual members. According to EFPIA provisions, data is disclosed publicly periodically, on annual basis no later than the end of June, for the past calendar year.
Public disclosure of transfers of value includes data on the value of all funds received by individual healthcare professionals and healthcare organizations that collaborate with individual Forum members or the Forum itself, either directly or through third parties such as event organization agencies. Disclosure also includes information on the type of activity or support:
– for education;
– for coverage of expenses related to education or events;
– for services and consultancy;
– for research and development.
Each Forum member publishes these transfers in Slovenian at its local, regional or international website.
All transfers to healthcare organizations, which under the Disclosure Code include public healthcare institutions, physician associations and societies, chambers and private companies (d.o.o. and s.p.), are published individually, with the full name of the recipient.
Transfers of value to individual healthcare professionals who are natural persons are, pursuant to the Personal Data Protection Act, only possible on the basis of advance written consent of the healthcare professional. If such consent is withheld, transfers are published in a group or aggregate form, with the number of recipients and total amount listed separately for each category of such recipients.
Data on payments in the field of research and development cannot be published otherwise than in a group or aggregated form due to legislative protection of competition and innovations being developed by separate companies.
The data published in this report is an expression of our efforts towards observing the provisions of the EFPIA Disclosure Code. Should it be found that the report contains incomplete or inaccurate data in spite of our best efforts towards assuring accurate publications, we will research the situation and appropriately correct false data.
Data on transfers of value to healthcare professionals and healthcare organizations from the Forum of international research and development pharmaceutical companies, EIG, for 2017
In calendar year 2017, the Forum of International Research and Development Pharmaceutical Companies, EIG, collaborated with 14 different individuals and organizations. For the services rendered in the field of consultancy (category of Fees for Service and Consultancy), the Forum paid fees to 6 healthcare professionals via contracts for copyrighted work, sponsored the organization of technical meetings and symposia to 2 healthcare organizations and contributed for the costs of lectures or technical event organization to 6 organizations.
The total value of transfers of value from the Forum to individual healthcare professionals in 2017 was EUR 4.812,30 and the value of transfers to healthcare organizations amounted to EUR 22.297,20. All transfers were disclosed with the full name of the recipient.
Publicly disclosed data includes transfers of value actually executed in the financial system of the Forum in the 2017 calendar year, from 1 January 2017 to 31 December 2017.
Transfers to individual healthcare workers are listed as gross values of the relevant contracts.
Transfers to healthcare organizations are listed as net amounts of the relevant contracts without VAT.
Transfers of value pertaining to travel expenses, accommodation and registration fees are published in the calendar year in which activities actually took place.

Notes to the table ” Data on transfers of value to healthcare professionals and healthcare organisations from the Forum of international research and development pharmaceutical companies, EIG, for 2017″:
1 Field regulated by Disclosure Code, Article 3.1.1.1
2 Field regulated by Disclosure Code, Article 3.1.1.2 in 3.1.2.1
3 Field regulated by Disclosure Code, Article 3.1.1.3 and Article 3.1.2.2
4 Field regulated by Disclosure Code, Article 3.2
5 Field regulated by Disclosure Code, Article 3.2
6 Field regulated by Disclosure Code, Article 3.4
The “/” mark denotes no transfers of value were performed.
All listed amounts represent total values for 2017.
All listed transactions were performed in the 2017 calendar year, from and including 1 January 2017 to and including 31 December 2017.
Amounts of transfers of value to HCPs in 2017 are listed as gross amounts.
Amounts of transfers of value to HCOs in 2017 are listed as net amounts (not including VAT).
The Disclosure Code defines healthcare organizations (HCO) as all single entrepreneurs and any legal person that is a healthcare, medical or scientific association or organization (irrespective of the legal or organizational form) such as a hospital, clinic, foundation, university or other teaching institution or learned society (except for patient organizations within the scope of the EFPIA PO Code) or through which one or more HCPs provide services.
The Disclosure Code defines healthcare professionals (HCP) as any natural person that is a member of the medical, dental, pharmacy or nursing professions or any other person who, in the course of his or her professional activities, may prescribe, purchase, supply, recommend or administer a medicinal product and whose primary practice, principal professional address or place of incorporation is in the Republic of Slovenia.
For the avoidance of doubt, the definition of HCP includes any official or employee of a government agency or other organization (whether in the public or private sector) that may prescribe, purchase, supply or administer medicinal products and any person employed in the Republic of Slovenia whose primary occupation is that of a practicing HCP, but excludes all other persons employed in the Republic of Slovenia and a wholesaler or distributor of medicinal products.
The Disclosure Code is available in full here.
The metodology of data is not the same for all the companies and it is explained in individial company announcements.
|
“,,1529659080,1529659080,en,12878,306,12877,43,0,NULL,,”Javna objava prenosov sredstev ZD in ZO 2017″,javna-objava-prenosov-sredstev-zd-in-zo-2017,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1529652332,1541422632
402,13399,”Regionalni izzivi in iniciative pri dostopnosti inovativnih zdravil”,”Hrvaško-slovenski farmakoekonomski kongres, Opatija, 18. september 2018″,”
V torek, 18. septembra 2018, bo v Opatiji potekal Hrvaško-slovenski farmakoekonomski kongres. Glavna tema srečanja bodo regionalni izzivi in iniciative pri dostopnosti inovativnih zdravil.
Med številnimi uglednimi govorci bo tudi predstavnik Mednarodnega foruma znanstveno raziskovalnih farmacevtskih družb. Marko Kušar bo namreč predaval o stroških in cenah zdravil v Sloveniji z vidika farmacevtske industrije.
Več informacij o dogodku najdete na spletni strani organizatorja.
“,”Rok Knafelj”,1537188180,1537188180,sl,13399,306,13397,43,0,NULL,,”Regionalni izzivi in iniciative pri dostopnosti inovativnih zdravil”,regionalni-izzivi-in-iniciative-pri-dostopnosti-inovativnih-zdravil,Post,”/sites/43/files/images/O nas/O nas/O_Na_FIRDPC.jpg”,1,1,1537188232,1537188271
407,13453,”Napoved: Brez predaha za zdrav jutri”,”Sedma strateška konferenca vrednost inovacij”,”
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb letos že sedmo leto zapored pripravlja strateško konferenco Vrednost inovacij. Tokrat bo potekala v sodelovanju z Javno agencijo za zdravila in medicinske pripomočke, JAZMP.
Konferenca bo v torek, 9. oktobra 2018, z začetkom ob 13. uri v dvorani Državnega sveta Republike Slovenije.
Na konferenco se lahko prijavite na tej povezavi.
Program konference
13.00-13.03 Otvoritev konference
13.03-13.15 Uvodni nagovori
Alojz Kovšca, predsednik Državnega sveta Republike Slovenije
Samo Fakin, minister za zdravje
13.15-13.30 Rastoče breme kroničnih nenalezljivih bolezni in vloga slovenskega zdravstva v razmerah hitro starajočega prebivalstva
Petra Došenović Bonča, Jože Sambt, Ekonomska fakulteta
13.30-13.45 Trendi na področju zagotavljanja inovativnih zdravil v Sloveniji
Marjan Sušelj, generalni direktor Zavoda za zdravstveno zavarovanje Slovenije
13.45-14.00 Različni obrazi pojavnosti kroničnih nenalezljivih bolezni
Rade Pribaković Brinovec, predstojnik Centra za upravljanje programov preventive in krepitve zdravja, NIJZ
14.00-14.15 Naložbe v javno zdravje: utemeljitev, strategije in izzivi
Dirk Poelaert, Vaccines Europe
14.15-14.30 Programi celostne rehabilitacije za čim prejšnje vračanje bolnikov v življenje
Kristina Modic, izvršna direktorica Slovenskega združenja bolnikov z limfomom in levkemijo, L&L
14.30-14.45 Sistemsko uvajanje novih tehnologij v Republiki Sloveniji kot odraz EU procesov/JAZMP
Stanislav Primožič, v.d. direktorja Javne agencije Republike Slovenije za zdravila in medicinske pripomočke
14.45-15.00 Odmor
15.00-16.00 Okrogla miza
Sodelujoči:
• Tanja Mate, Ministrstvo za zdravje
• Marjan Sušelj, Zavod za zdravstveno zavarovanje Slovenije
• Stanislav Primožič, Javna agencija za zdravila in medicinske pripomočke
• Katarina Verhnjak, Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb
• Petra Došenović Bonča, Ekonomska fakulteta Univerze v Ljubljani
16.00 Zaključni pozdrav Foruma
“,”Rok Knafelj”,1538383260,1538383260,sl,13453,306,13451,43,0,NULL,,”Brez predaha za zdrav jutri”,brez-predaha-za-zdrav-jutri,Post,/sites/43/files/images/VoI_2018a.jpg,1,1,1538383299,1538383299
409,13473,”Vabilo na novinarsko konferenco”,”BREZ PREDAHA ZA ZDRAV JUTRI”,”
Spoštovani,
pred 7. strateško konferenco Vrednost inovacij – Brez predaha za zdrav jutri Vas vljudno vabimo na novinarsko konferenco, ki bo v torek, 9. oktobra 2018, ob 11. uri, v Maxi klubskem salonu na Trgu republike 1 v Ljubljani.
Kot je znano, se prebivalstvo v Sloveniji pospešeno stara. Posledično naraščajo stroški obvladovanja kroničnih nenalezljivih bolezni in njihovih zapletov. Kakšna je vloga zdravstvene dejavnosti v starajoči se družbi, kakšen pomen investicij v preventivne programe in inovacije za učinkovito obvladovanje kroničnih bolezni? Kako ohranjati dober dostop do zdravil, zgodnji dostop do inovacij in vzdržen zdravstveni sistem hkrati? Kako zagotoviti pravočasno, učinkovito in celostno zdravstveno oskrbo?
• Marjan Sušelj, generalni direktor Zavoda za zdravstveno zavarovanje Slovenije,
• Stanislav Primožič, vršilec dolžnosti direktorja Javne agencije RS za zdravila in medicinske pripomočke,
• Rade Pribaković Brinovec, predstojnik Centra za upravljanje programov preventive in krepitve zdravja Nacionalnega inštituta za javno zdravje,
• Petra Došenović Bonča, izredna profesorica Ekonomske fakultete Univerze v Ljubljani,
• Kristina Modic, izvršna direktorica Slovenskega združenja bolnikov z limfomom in levkemijo in
• Katarina Verhnjak, predsednica uprave Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ
Veselimo se srečanja z Vami in Vas lepo pozdravljamo,
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ
Katarina Verhnjak, predsednica uprave
Vljudno prosimo, da svojo udeležbo na novinarski konferenci potrdite na elektronski naslov: isabela.kovacic@planetgv.si
Vabljeni tudi na 7. strateško konferenco Vrednost inovacij – Brez predaha za zdrav jutri, ki bo sledila novinarski konferenci – v Dvorani Državnega sveta na Šubičevi 4 v Ljubljani, s pričetkom ob 13. uri.
Več informacij: www.vrednostinovacij.si
“,Admin,1538997000,1538997000,sl,13473,306,13472,43,0,NULL,,”Vabilo na novinarsko konferenco”,vabilo-na-novinarsko-konferenco,Post,/sites/43/files/images/VoI_2018a.jpg,0,0,1538997155,1580454811
410,13485,”7. strateška konferenca Vrednost inovacij:
Brez predaha za zdrav jutri”,”Ključne so investicije, inovativne tehnologije in konstruktiven dialog “,”
Ljubljana, 9. oktober 2018 – Na 7. strateški konferenci Vrednost inovacij – Brez predaha za zdrav jutri, ki je potekala v Državnem svetu RS, so udeleženci izpostavili pomen dobrega dostopa do zdravil, celostnega vrednotenja in zgodnjega uvajanja inovacij ter vzdržnega zdravstvenega sistema za učinkovito obvladovanje naraščajočega bremena kroničnih nenalezljivih bolezni ter njihovih zapletov v dolgoživi družbi. Za zagotavljanje pravočasne, učinkovite in celostne zdravstvene oskrbe ter vzdržnost zdravstvenega sistema v razmerah starajočega prebivalstva so ključne investicije v preventivo, dodatna podporna okolja v lokalnih skupnostih, inovativne tehnologije in konstruktiven dialog vseh deležnikov v zdravstvu ter drugih družbenih podsistemih. Poudarili so, da je potrebno stroškovno učinkovitost inovacij in njene učinke presojati neodvisno in celostno ter skozi daljše časovno obdobje.

Zaradi napredka znanosti predvsem na področju medicine in farmacije živimo bistveno dlje, življenja naših potomcev pa bodo po demografskih napovedih še daljša. Inovativna zdravila, terapije in cepiva rešujejo življenja, saj nekoč smrtne bolezni spreminjajo v kronične in izboljšujejo kakovost življenja bolnikov. Dva od treh bolnikov z rakom danes živita vsaj pet let po postavljeni diagnozi, od leta 1991 pa se je umrljivost za rakom zaradi novih terapij znižala za 21 %. Inovativne terapije so prispevale tudi k znižanju umrljivosti bolnikov s HIV/ Aids, ki se je v zadnjih dvajsetih letih znižala za 80 %, s cepljenjem pa vsako leto rešimo od dva do tri milijone življenj po svetu.
Inovacije v zdravstvu so tudi donosna investicija, saj zmanjšujejo umrljivost, invalidnost, potrebo po dodatnih zdravstvenih posegih, hospitalizacijo, absentizem in izboljšujejo kakovost življenja bolnikov. Po podatkih OECD so v Sloveniji stroški za zdravila najnižji med državami s podobnim naborom zdravil. Tako Švica za podoben nabor zdravil na prebivalca na leto porabi 898 evrov, Nemčija 543 evre, Slovenija pa 229 evrov.
Predstavnica organizatorja 7. strateške konference Vrednost inovacij – Brez predaha za zdrav jutri, generalna sekretarka Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb Barbara Stegel je poudarila: »Čeprav se zaradi starajoče družbe poraba zdravil vsako leto povečuje, delež izdatkov ZZZS za zdravila in živila ne narašča in od leta 2010 do leta 2017 ostaja na podobni ravni, oziroma se celo znižuje, kar dokazuje, da je inovativna farmacevtska industrija k vzdržnosti zdravstvenega sistema že veliko prispevala. Če je namreč izdatek ZZZS za zdravila in živila leta 2010 znašal 15,67 %, je ta delež v letu 2017 padel na 15,16 %. Stroškovno učinkovitost inovativnih zdravil pa lahko ponazorimo tudi s primerom Kliničnega oddelka za revmatologijo UKC Ljubljana, kjer so zaradi inovativnih tehnologij od leta 2004 do leta 2014 prepolovili število akutno hospitaliziranih bolnikov z vnetnimi revmatičnimi boleznimi. To ne pomeni le nižjih stroškov neposredne zdravstvene in socialne oskrbe, ampak tudi manj izgubljenih delovnih dni ter predvsem bolj kakovostno življenje kroničnih bolnikov in njihovih družin. Predstavniki inovativne farmacevtske industrije v Sloveniji si želimo in pričakujemo, da nova, inovativna zdravila in terapije čim prej pridejo do vseh, ki jih potrebujejo.«
Slovenija za zdravstveno varstvo na prebivalca sicer porabi nekaj manj kot 2.000 evrov na leto, kar je 71% evropskega povprečja, stroški obvladovanja kroničnih nenalezljivih bolezni in njihovih zapletov pa strmo naraščajo. Generalni direktor Zavoda za zdravstveno zavarovanje Slovenije Marjan Sušelj je napovedal, da si bodo na Zavodu s številnimi ukrepi tudi v prihodnje prizadevali za ohranitev dostopa bolnikov do učinkovitih, kakovostnih in varnih zdravil ter za uvajanje inovativnih zdravil v sistem financiranja: »V ta namen bo ZZZS izvajal različne ukrepe, ki zagotavljajo kakovostno in finančno vzdržno predpisovanje zdravil ter njihovo varno in pravilno rabo s strani njihovih uporabnikov. Hiter razvoj inovativnih zdravil prinaša nove možnosti uspešnega zdravljenja, vendar pa je finančno breme tovrstnih zdravil v zadnjem obdobju tako veliko, da bi lahko povzročilo razvojni izostanek na drugih, tudi zelo pomembnih področjih zdravstvenih tehnologij. Zato ZZZS načrtuje dodatne sistemske ukrepe, s katerimi bo nova finančna tveganja delil tudi s proizvajalci zdravil.«
Pri vrednotenju inovacij kot ene izmed ključnih investicij v učinkovito obvladovanje kroničnih bolezni je nujna celovita ekonomska evalvacija opozarja izr. prof. dr. Petra Došenović Bonča z Ekonomske fakultete Univerze v Ljubljani: »Učinkovito obvladovanje kroničnih bolezni ni zgolj strošek, ampak je pomembna investicija, pri kateri moramo na tehtnico postaviti tako stroške kot dosežene učinke. Z vidika plačnika so takšni učinki investicije v inovativno zdravilo lahko znižanje izdatkov za ostale zdravstvene storitve in nadomestil za dolgotrajne bolniške odsotnosti. Ker pa zdravstvo financiramo kolektivno po solidarnostnih načelih, moramo učinke opazovati s širšega družbenega vidika. Tako moramo zajeti tudi manjše izgube produktivnosti iz naslova absentizma, prezentizma, nege družinskih članov in prezgodnje umrljivosti. Zlasti pri starejših, ki so v pokoju, pa ne moremo zanemariti učinkov, ki z ohranjanjem kakovosti življenja nastajajo pri vsakodnevnih aktivnostih, neplačanem gospodinjskem delu in skrbi za naše najmlajše.«
Dr. Stanislav Primožič, vršilec dolžnosti direktorja Javne agencije RS za zdravila in medicinske pripomočke je pojasnil, da je za odločitve o privzemu tehnoloških inovacij v nacionalne zdravstvene sisteme ključnega pomena vrednotenje zdravstvenih tehnologij – HTA: »V osnovi gre za primerjalno vrednotenje zdravil in medicinskih pripomočkov, ki ga izvajajo za HTA pristojni državni organi. Njegov namen je ugotoviti relativno učinkovitost neke nove tehnologije v razmerju do določenega primerjalnega in standardnega izdelka ali postopka. Ocena dodane vrednosti v postopkih HTA je lahko objektivna podlaga za določitev cene zdravila in z njo povezanih pogajanj kot tudi za naše odločitve o financiranju zdravila iz javnih sredstev. Nadvse pomembno je sodelovanje na HTA področju na regionalni in tudi na EU ravni (projekti EUnetHTA). Perspektiva tega sodelovanja je v veliki meri odvisna od izida obravnave predloga EU uredbe, ki ga je v začetku tega leta pripravila Evropska komisija in ki trenutno poteka v Svetu EU in v Evropskem parlamentu. Slednji je prav v preteklem tednu izglasoval podporo predlogu te uredbe, ki bi lahko v delu, ki ureja klinično vrednotenje, v nekaj letih postala zakon v celotni EU. Za Slovenijo kot majhno državo s pribl. 0,1 % vrednosti svetovnega trga zdravil, ki svojo nacionalno HTA institucijo šele vzpostavlja, je sodelovanje na EU ravni izrednega pomena.«
Predstojnik Centra za upravljanje programov preventive in krepitve zdravja NIJZ Rade Pribaković Brinovec je za manjše breme kroničnih nenalezljivih bolezni izpostavil pomen preventivnih in presejalnih programov: »Za vse osebe z urejenim obveznim zdravstvenim zavarovanjem so v Sloveniji na voljo preventivni zdravstveni programi, kot so nacionalni program integrirane preventive kroničnih nenalezljivih bolezni (od 30. leta starosti naprej) ter presejalni programi za zgodnje odkrivanje raka Dora, Zora in Svit. Pomemben del preventivnih programov so cepljenja, od katerih tokrat izpostavljamo cepljenje proti humanim papiloma virusom (HPV), hepatitisu B (HBV), gripi in pnevmokoku. Vsak od naštetih programov prispeva k boljšemu zdravju prebivalcev in k manjšemu bremenu kroničnih nenalezljivih bolezni. V Sloveniji, kot hitro starajoči družbi, so pomembna tudi podporna okolja v lokalnih skupnostih, kot so dnevni centri in službe za pomoč na domu.«
Dobra dostopnost do sodobne diagnostike in različnih učinkovitih oblik zdravljenja bolnikov z rakom prispevata k temu, da se je rak v zadnjih 20 letih iz smrtonosne bolezni v mnogih primerih spremenil v že ozdravljivo ali kronično bolezen, ki ob ustrezni celostni strokovni obravnavi omogoča povratek v življenje pred boleznijo. »Bolniki in njihovi zagovorniki, pričakujemo, da bo država z ustreznimi strategijami, ki ne bodo krčile pravic bolnikov z rakom, to omogočala tudi v prihodnje,« je ob predstavitvi inovativnega pilotnega projekta celostne rehabilitacije bolnikov s krvnimi raki Skupaj na poti do zdravja dejala Kristina Modic, izvršna direktorica Združenja L&L in dodala: »Izkušene organizacije bolnikov delujemo vedno bolj profesionalno, imamo veliko znanja, smo dobro povezane s stroko in zdravstveno politiko, razvijamo in bolnikom ponujamo vedno boljše in strokovne podporne programe, s katerimi se zdi, da celo prevzemamo del storitev, ki bi jih za bolnike moral zagotoviti zdravstveni sistem. Sposobni smo pripraviti in peljati tudi tako zahtevne projekte kot je na primer izvajanje kompleksnega pilotnega programa celostne rehabilitacije. V prihodnje si želimo, da bi naš pilotni program postal redni program, živel naprej in bil dostopen bolnikom po celotni Sloveniji. Pripravljene pa imamo tudi rešitve za vsebinsko nadgradnjo in dopolnitev programa, ki bo doprinesla k hitrejši in motivirani vrnitvi bolnikov nazaj v delovno okolje.«
Zagotavljanje kakovostne zdravstvene oskrbe in vzdržnega zdravstvenega sistema bo zaradi demografskih trendov v prihodnosti še zahtevnejše. Zato bodo vlaganja v preventivo in z dokazi podprte in celostno ovrednotene inovacijske tehnologije, informiranost ter prizadevanja za nenehen konstruktiven dialog in sodelovanje vseh deležnikov v zdravstvu in drugih družbenih podsistemih pomembnejši kot kadarkoli doslej.

“,”Rok Knafelj”,1539168240,1539168240,sl,13485,306,13484,43,0,NULL,,”7. strateška konferenca Vrednost inovacij: Brez predaha za zdrav jutri”,7-strateska-konferenca-vrednost-inovacij-brez-predaha-za-zdrav-jutri,Post,”/sites/43/files/images/news/7_strateška konferenca Vrednost inovacij_LEAD.jpg”,1,1,1539169005,1574263773
411,13485,”7th Value of Innovation Strategic Conference”,”Investments, innovative technology and constructive dialogue are the key”,”
Ljubljana, 9 October 2018 – Participants at the 7th strategic Value of Innovation Conference – Without Rest Towards a Better Tomorrow, that took place at the National Council of the Republic of Slovenia, emphasised the importance of good access to medicines, integrated assessment and early introduction of innovations and assurance of a sustainable healthcare system for effective management of the growing burden of chronic non-infectious diseases and their complications in a long living society. The assurance of timely, effective and comprehensive healthcare and sustainability of the healthcare system with an aging population requires investments in prevention, additional support networks in local communities, innovative technologies and constructive dialogue of all stakeholders in healthcare and other social subsystems. Participants also emphasised that the cost efficiency of innovations and their effects need to be assessed independently and comprehensively over a longer period of time.
Developments in science, particularly in medicine and pharmacy, have extended our lives and the lives of our descendants are set to be longer still. Innovative medicines, therapies and vaccines save lives, changing once deadly diseases into chronic ones and improving the quality of patients lives. Two of three cancer patients now live for at least five years after receiving their diagnosis. New therapies have reduced cancer mortality by 21 % since 1991. Innovative therapies have also contributed to reducing the mortality of HIV/Aids patients by 80 % over the last 20 years. Vaccines now save two to three million lives around the world. Healthcare innovations are also a profitable investment as they reduce mortality, disability, need for additional treatments, hospitalisation, absenteeism while improving the quality of patients’ lives. According to OECD data medicinalproduct costs in Slovenia are the lowest among countries with a similar range of medicines. Switzerland uses 898 Euros per inhabitant per year for a similar range of medicines, Germany uses 543 Euros and Slovenia uses 229 Euros. Representative of the organiser of the 7th strategic Value of Innovation Conference – Without Rest Towards a Better Tomorrow, Secretary General of the Forum of International Research and Development Pharmaceutical Companies Barbara Stegel commented: “Even though population aging is causing the consumption of medicines to increase each year, the share of the Health Insurance Institute of Slovenia’s expenditures for medicines and foodstuffs has not grown. It has remained steady between 2010 and 2017 and has even reduced somewhat, showing that the innovative pharmaceutical industry has already made a substantial contribution to the sustainability of the healthcare system. Expenditures of the national health insurance institute for medicines and foodstuffs amounted to 15.67 % in 2010 and in 2017 the share has decreased slightly to 15.16 %. Cost efficiency of innovative medicines can be illustrated using the example of the Clinical Department of Rheumatology at Ljubljana’s University Medical Centre, where the number of acute hospitalisations due to inflammatory rheumatic diseases has been halved from 2004 to 2014 due to innovative technologies. This does not only mean lower costs of direct health and social care, but also reduced absence from work and above all a higher quality of life for chronic patients and their families. Representatives of the innovative pharmaceutical industry in Slovenia wish and expect for new and innovative medicines and therapies to reach those who need them as soon as possible.”
Slovenian healthcare spending per capita amounts to just under 2,000 Euros per year, corresponding to 71 % of the European average, while the costs of managing chronic non-infectious diseases and their complications are rising rapidly. General Director of the Health Insurance Institute of Slovenia Marjan Sušelj said that the Institute will be adopting different measures in the future to maintain patient access to effective, quality and safe medicines and introduce innovative medicines into the financing system: “For this purpose the Institute will adopt different measures to assure quality and financially sustainable prescription of medicines and their safe and correct use by their respective users. Rapid development of innovative medicines is bringing new opportunities for successful treatment, but the financial burden of such medicines has been so great that it could cause a suspension of development in other equally important areas of health technology. That is why the Institute is planning additional systemic measures to share upcoming financial risks with medicinal product manufacturers.”
The valuation of information as a key investment in effective management of chronic diseases requires comprehensive economic evaluation, warns izr. prof. dr. Petra Došenovič Bonča from the Faculty of Economics of the University of Ljubljana: “Effective management of chronic diseases is not just a cost, it is an important investment that needs to consider the costs as well as achieved effects. From a payer’s viewpoint such effects of an investment into innovative medicines can include reduced expenditures for other healthcare services and compensation for long term absence due to disease. Since we finance healthcare collectively under the principles of solidarity, we need to view effects from a wider social standpoint. We should thus include minor losses of productivity due to absenteeism, presentism, care for family members and early mortality. With elderly and retired people we should also consider effects caused by maintaining quality of life in daily activities, unpaid work at home and care for our youngest.”
Dr. Stanislav Primožič, acting Director of the Public Agency of the Republic of Slovenia for Medicinal Products and Medical Devices explained that decisions on adopting technological innovations in national healthcare systems must be based on the evaluation of medical technologies – HTA: “Fundamentally the system includes a comparative evaluation of medicines and medical devices, performed by national authorities competent for HTA. Its aim is to establish the relative effectiveness of a new technology in relation to a certain comparative and standard product or procedure. The assessment of added value in HTA processes can serve as an objective basis for determining medicinal product prices and associated negotiations, as well as our decisions on financing a medicinal product with public funds. Collaboration in the field of HTA is very important at a regional and EU level (EUnetHTA project). The perspective of this collaboration greatly depends on the results of discussions on the proposed EU regulation that was drafted in early 2018 by the European Commission and is currently being reviewed by the Council of EU and the European Parliament. The latter has voted in support of the regulation last week and the document could, in the part that regulates clinical assessments, became law in the entire EU over the coming few years. For Slovenia, a small country with about 0.1 % of the value of the global medicines market, which is still establishing its HTA institution, the collaboration at EU level is exceptionally important.”
Head of the Chronic Diseases Prevention Centre at the National Institute of Public Health Rade Pribakovič Brinovec emphasised the importance of preventative and screening programs for the reduction of chronic non-infectious diseases: “All persons with mandatory health insurance in Slovenia have access to preventative healthcare examinations such as the national program of integrated prevention of chronic noninfectious diseases (from age 30 onwards) and screening programs for early detection of cancer Dora, Zora and Svit. Vaccinations are also an important part of preventative programs, of which we currently promote vaccinations against HPV, hepatitis B, influenza and pneumococcus. Each of these programs contributes to better health of our inhabitants and reduced burden of chronic non-infectious diseases. Slovenia as a rapidly aging society also needs support environments in local communities, including day centres and services that provide assistance at home.”
Good access to modern diagnostics and various effective forms of treatment of cancer patients have contributed to transforming many cases of cancer from a deadly disease into a treatable or chronic disease over the last 20 years. With appropriate comprehensive treatment, patients can return to their pre-disease lives. “Patients and their advocates expect that the country will employ appropriate strategies to enable such development in the future without encroaching upon the rights of cancer patients,” said Kristina Modic, Executive Director of the L&L Society at the presentation of the innovative pilot project of comprehensive rehabilitation of blood cancer patients called Together on The Way to Health, and added: “Experienced patient organisations are acting with increasing professionalism, have a mass of knowledge, good connections with the profession and health politics and are developing ever better and more comprehensive support programs that seemingly take over a part of the services that the healthcare system should provide for. We are able to prepare and execute demanding projects such as the complex pilot program of comprehensive rehabilitation. In the future we wish for our pilot program to become a regular program that is accessible to patients all over Slovenia. We have also prepared solutions to expand and add to the program to further contribute to a faster and better motivated return of patients to the working environment.”
Assurance of quality healthcare and a sustainable healthcare system will become more and more demanding in the future due to demographic trends. That is why investments into prevention and evidence based and comprehensively evaluated information technologies, information and efforts towards a constant constructive dialogue and cooperation of stakeholders in healthcare and other social subsystems are more important than ever before.
Developments in science, particularly in medicine and pharmacy, have extended our lives and the lives of our descendants are set to be longer still. Innovative medicines, therapies and vaccines save lives, changing once deadly diseases into chronic ones and improving the quality of patients lives. Two of three cancer patients now live for at least five years after receiving their diagnosis. New therapies have reduced cancer mortality by 21 % since 1991. Innovative therapies have also contributed to reducing the mortality of HIV/Aids patients by 80 % over the last 20 years. Vaccines now save two to three million lives around the world. Healthcare innovations are also a profitable investment as they reduce mortality, disability, need for additional treatments, hospitalisation, absenteeism while improving the quality of patients’ lives. According to OECD data medicinalproduct costs in Slovenia are the lowest among countries with a similar range of medicines. Switzerland uses 898 Euros per inhabitant per year for a similar range of medicines, Germany uses 543 Euros and Slovenia uses 229 Euros. Representative of the organiser of the 7th strategic Value of Innovation Conference – Without Rest Towards a Better Tomorrow, Secretary General of the Forum of International Research and Development Pharmaceutical Companies Barbara Stegel commented: “Even though population aging is causing the consumption of medicines to increase each year, the share of the Health Insurance Institute of Slovenia’s expenditures for medicines and foodstuffs has not grown. It has remained steady between 2010 and 2017 and has even reduced somewhat, showing that the innovative pharmaceutical industry has already made a substantial contribution to the sustainability of the healthcare system. Expenditures of the national health insurance institute for medicines and foodstuffs amounted to 15.67 % in 2010 and in 2017 the share has decreased slightly to 15.16 %. Cost efficiency of innovative medicines can be illustrated using the example of the Clinical Department of Rheumatology at Ljubljana’s University Medical Centre, where the number of acute hospitalisations due to inflammatory rheumatic diseases has been halved from 2004 to 2014 due to innovative technologies. This does not only mean lower costs of direct health and social care, but also reduced absence from work and above all a higher quality of life for chronic patients and their families. Representatives of the innovative pharmaceutical industry in Slovenia wish and expect for new and innovative medicines and therapies to reach those who need them as soon as possible.”
Slovenian healthcare spending per capita amounts to just under 2,000 Euros per year, corresponding to 71 % of the European average, while the costs of managing chronic non-infectious diseases and their complications are rising rapidly. General Director of the Health Insurance Institute of Slovenia Marjan Sušelj said that the Institute will be adopting different measures in the future to maintain patient access to effective, quality and safe medicines and introduce innovative medicines into the financing system: “For this purpose the Institute will adopt different measures to assure quality and financially sustainable prescription of medicines and their safe and correct use by their respective users. Rapid development of innovative medicines is bringing new opportunities for successful treatment, but the financial burden of such medicines has been so great that it could cause a suspension of development in other equally important areas of health technology. That is why the Institute is planning additional systemic measures to share upcoming financial risks with medicinal product manufacturers.”
The valuation of information as a key investment in effective management of chronic diseases requires comprehensive economic evaluation, warns izr. prof. dr. Petra Došenovič Bonča from the Faculty of Economics of the University of Ljubljana: “Effective management of chronic diseases is not just a cost, it is an important investment that needs to consider the costs as well as achieved effects. From a payer’s viewpoint such effects of an investment into innovative medicines can include reduced expenditures for other healthcare services and compensation for long term absence due to disease. Since we finance healthcare collectively under the principles of solidarity, we need to view effects from a wider social standpoint. We should thus include minor losses of productivity due to absenteeism, presentism, care for family members and early mortality. With elderly and retired people we should also consider effects caused by maintaining quality of life in daily activities, unpaid work at home and care for our youngest.”
Dr. Stanislav Primožič, acting Director of the Public Agency of the Republic of Slovenia for Medicinal Products and Medical Devices explained that decisions on adopting technological innovations in national healthcare systems must be based on the evaluation of medical technologies – HTA: “Fundamentally the system includes a comparative evaluation of medicines and medical devices, performed by national authorities competent for HTA. Its aim is to establish the relative effectiveness of a new technology in relation to a certain comparative and standard product or procedure. The assessment of added value in HTA processes can serve as an objective basis for determining medicinal product prices and associated negotiations, as well as our decisions on financing a medicinal product with public funds. Collaboration in the field of HTA is very important at a regional and EU level (EUnetHTA project). The perspective of this collaboration greatly depends on the results of discussions on the proposed EU regulation that was drafted in early 2018 by the European Commission and is currently being reviewed by the Council of EU and the European Parliament. The latter has voted in support of the regulation last week and the document could, in the part that regulates clinical assessments, became law in the entire EU over the coming few years. For Slovenia, a small country with about 0.1 % of the value of the global medicines market, which is still establishing its HTA institution, the collaboration at EU level is exceptionally important.”
Head of the Chronic Diseases Prevention Centre at the National Institute of Public Health Rade Pribakovič Brinovec emphasised the importance of preventative and screening programs for the reduction of chronic non-infectious diseases: “All persons with mandatory health insurance in Slovenia have access to preventative healthcare examinations such as the national program of integrated prevention of chronic noninfectious diseases (from age 30 onwards) and screening programs for early detection of cancer Dora, Zora and Svit. Vaccinations are also an important part of preventative programs, of which we currently promote vaccinations against HPV, hepatitis B, influenza and pneumococcus. Each of these programs contributes to better health of our inhabitants and reduced burden of chronic non-infectious diseases. Slovenia as a rapidly aging society also needs support environments in local communities, including day centres and services that provide assistance at home.”
Good access to modern diagnostics and various effective forms of treatment of cancer patients have contributed to transforming many cases of cancer from a deadly disease into a treatable or chronic disease over the last 20 years. With appropriate comprehensive treatment, patients can return to their pre-disease lives. “Patients and their advocates expect that the country will employ appropriate strategies to enable such development in the future without encroaching upon the rights of cancer patients,” said Kristina Modic, Executive Director of the L&L Society at the presentation of the innovative pilot project of comprehensive rehabilitation of blood cancer patients called Together on The Way to Health, and added: “Experienced patient organisations are acting with increasing professionalism, have a mass of knowledge, good connections with the profession and health politics and are developing ever better and more comprehensive support programs that seemingly take over a part of the services that the healthcare system should provide for. We are able to prepare and execute demanding projects such as the complex pilot program of comprehensive rehabilitation. In the future we wish for our pilot program to become a regular program that is accessible to patients all over Slovenia. We have also prepared solutions to expand and add to the program to further contribute to a faster and better motivated return of patients to the working environment.”
Assurance of quality healthcare and a sustainable healthcare system will become more and more demanding in the future due to demographic trends. That is why investments into prevention and evidence based and comprehensively evaluated information technologies, information and efforts towards a constant constructive dialogue and cooperation of stakeholders in healthcare and other social subsystems are more important than ever before.

“,”Rok Knafelj”,1541682960,1541682960,en,13485,306,13484,43,0,NULL,,”7. strateška konferenca Vrednost inovacij: Brez predaha za zdrav jutri”,7-strateska-konferenca-vrednost-inovacij-brez-predaha-za-zdrav-jutri,Post,”/sites/43/files/images/news/7_strateška konferenca Vrednost inovacij_LEAD.jpg”,1,1,1539169005,1574263773
416,13538,”Inovativna zdravila izboljšujejo kakovost življenja bolnikov”,”Zaradi napredka znanosti predvsem na področju medicine in farmacije živimo bistveno dlje, življenja naših potomcev pa bodo po demografskih napovedih še daljša.”,”
V Državnem svetu Republike Slovenije je 9. oktobera 2018 potekala že 7. strateška konferenca Vrednost inovacij – Brez predaha za zdrav jutri. Med predavatelji različnih strok sta bila tudi Alojz Kovšca, predsednik Državnega sveta Republike Slovenije in Samo Fakin, minister za zdravje.
Govorci so izpostavili pomen dobrega dostopa do zdravil, celostnega vrednotenja in zgodnjega uvajanja inovacij ter vzdržnega zdravstvenega sistema za učinkovito obvladovanje naraščajočega bremena kroničnih nenalezljivih bolezni ter njihovih zapletov v dolgoživi družbi.
Za zagotavljanje pravočasne, učinkovite in celostne zdravstvene oskrbe ter vzdržnost zdravstvenega sistema v razmerah starajočega prebivalstva so ključne investicije v preventivo, dodatna podporna okolja v lokalnih skupnostih, inovativne tehnologije in konstruktiven dialog vseh deležnikov v zdravstvu ter drugih družbenih podsistemih. Prav tako so poudarili, da je potrebno stroškovno učinkovitost inovacij in njene učinke presojati neodvisno in celostno ter skozi daljše časovno obdobje.
Preberite tudi celotno sporočilo za javnost in si oglejte fotografije z dogodka.
Poročilo s konference je objavil tudi Državni svet RS.
“,,1539719100,1539719100,sl,13538,306,13537,43,0,NULL,,”Inovativna zdravila izboljšujejo kakovost življenja bolnikov”,inovativna-zdravila-izboljsujejo-kakovost-zivljenja-bolnikov,Post,”/sites/43/files/images/news/7. strateska/Galerija/7.strateska_konferenca_026.jpg”,1,0,1539694221,1547475474
417,13539,”Za medije”,”Gradiva za predstavnike medijev”,”
10. strateška konferenca Vrednost inovacij: Čas za tehnologije jutrišnjega dne je danes
Pet korakov za nujno zagotavljanje enakopravnosti pri cepljenju proti COVID-19
9. strateška konferenca Vrednost inovacij: Čas za tehnologije jutrišnjega dne je danes
Forumovo sodelovanje na okrogli mizi Združenja slovenskih organizacij bolnikov z rakom – ONKO NET
8. strateška konferenca Vrednost inovacij: Izzivi zdravja in razvoja v 21. stoletju
7. strateška konferenca Vrednost inovacij: Brez predaha za zdrav jutri
6. strateška konferenca Vrednost inovacij
5. strateška konferenca Vrednost inovacij
4. strateška konferenca Vrednost inovacij
3. strateška konferenca Vrednost inovacij
2. strateška konferenca Vrednost inovacij
1. strateška konferenca Vrednost inovacij
“,”Rok Knafelj”,1539697080,1539697080,sl,13539,306,13575,43,0,NULL,,”Sporočila in materiali za medije”,sporocila-in-materiali-za-medije,Post,,1,0,1539697244,1634555503
418,13542,”Tabela prenosov sredstev”,Tabela,”
|
“,”Jaka Verbic Miklic”,1539869940,1539869940,sl,13542,306,13543,43,0,NULL,,Tabela,tabela,Post,”/sites/43/files/images/news/7_strateška konferenca Vrednost inovacij_LEAD.jpg”,0,0,1539870008,1541423454
419,13538,”We won’t rest for a better tomorrow”,”7th Value of Innovation Strategic Conference”,”
Participants at the 7th strategic Value of Innovation Conference – Without Rest Towards a Better Tomorrow, that took place at the National Council of the Republic of Slovenia, emphasised the importance of good access to medicines, integrated assessment and early introduction of innovations and assurance of a sustainable healthcare system for effective management of the growing burden of chronic non-infectious diseases and their complications in a long living society.
The conference was opened with addresses by Alojz Kovšca, the President of the National council of the Republic of Slovenia and Samo Fakin, the Slovenian Health minister.
The assurance of timely, effective and comprehensive healthcare and sustainability of the healthcare
system with an aging population requires investments in prevention, additional support networks in
local communities, innovative technologies and constructive dialogue of all stakeholders in healthcare
and other social subsystems. Participants also emphasised that the cost efficiency of innovations and
their effects need to be assessed independently and comprehensively over a longer period of time.
See full press release.
“,,1539950880,1539891900,en,13538,306,13537,43,0,NULL,,”Inovativna zdravila izboljšujejo kakovost življenja bolnikov”,inovativna-zdravila-izboljsujejo-kakovost-zivljenja-bolnikov,Post,”/sites/43/files/images/news/7. strateska/Galerija/7.strateska_konferenca_026.jpg”,1,0,1539694221,1547475474
425,13539,”For Media”,”Materials for media representatives”,”
10th Value of Innovation strategic conference
9th Value of Innovation Strategic Conference
Download press release (.pdf) ENG
.
8th Value of Innovation Strategic Conference
.
7th Value of Innovation Strategic Conference
“,”Rok Knafelj”,1541664120,1541664120,en,13539,306,13575,43,0,NULL,,”Sporočila in materiali za medije”,sporocila-in-materiali-za-medije,Post,,1,0,1539697244,1634555503
426,13591,”Na konferenci Zveze Sonček o vključevanju v družbo, ne v institucije”,”Osebe s posebnimi potrebami je treba vključevati v družbo, ne v institucije”,”
Maribor, 05. oktobra (STA) – Osebe s posebnimi potrebami je treba vključevati v družbo, ne v institucije, je bilo slišati na današnji konferenci Zveze Sonček v Mariboru. “S to konferenco želimo izpostaviti potrebo po storitvah v skupnosti za otroke, družine in odrasle osebe,” je povedal direktor zveze Iztok Suhadolnik.
Na strokovni konferenci, ki jo zveza društev za cerebralno paralizo Slovenije prireja v okviru svoje 35-letnice delovanja, bodo podrobno obravnavali zakone o celostni zgodnji obravnavi, o socialnem vključevanju invalidov in o osebni asistenci, ki se bodo začeli uporabljati v prihodnjem letu.
Nekdanja poslanka DZ in pobudnica zakona o celostni zgodnji obravnavi predšolskih otrok s posebnimi potrebami Jasna Murgel poziva novo vladajočo garnituro v državi, da poskrbi za uresničevanje teh zakonskih določil. “Zdaj je pomembno, da se omenjeni zakon implementira. Treba je napisati še vse podzakonske akte in protokole, hkrati pa je treba poskrbeti še za druge osebe s posebnimi potrebami, ne le otroke. V prvi vrsti je treba sprejeti strategijo, kaj bo država delala s temi osebami, kako bo urejala njihov status od rojstva do smrti,” je povedala za STA.
Storitve za takšne ljudi morajo biti po njenih besedah prilagojene njim, “da se bodo dejansko lahko vključevali v družbo, ne le v institucije”. “Gre za to, da bodo lahko živeli doma in imeli le neke podporne storitve, ki jim bodo omogočile enakopravno vključevanje v družbo,” je še dejala.
Pilotni projekt zakona o zgodnji obravnavi se trenutno izvaja v zdravstvenih domovih v Mariboru, Celju in Kranju in po prvih ocenah prinaša pozitivne rezultate, še posebej kar zadeva vključevanje celotne družine v obravnavo. “Treba pa je iti še naprej. Implementacija zakona bo zahtevna, saj je največ storitev na voljo v večjih centrih v državi, medtem ko jih je na periferiji malo. Treba je razširiti te storitve in imeti na razpolago dovolj resursov, da bomo lahko zajeli resnično vse družine,” je povedala vodja mariborskega društva Sonček Lidija Šestak Zorič.
Zakon med drugim omogoča terapevtsko obravnavo na domu, individualno obravnavo tako otroka kot njegove družine, povezovanje s centri za socialno delo in vrtci ter vključitev več različnih strokovnjakov v obravnavo otroka.
Današnja konferenca, ki nosi naslov Otrok, družina in odrasli potrebujejo podporo, je eden od dogodkov, s katerim obeležujejo 35 let delovanja Zveze Sonček, obenem z njo obeležujejo 6. oktober – svetovni dan cerebralne paralize. “Prepričani smo, da lahko vsak od nas, še posebej pa vsi skupaj, dosežemo, da bodo ljudje s cerebralno paralizo lahko živeli kakovostno življenje,” je v uvodnem govoru dejala vodja institucionalnega varstva v okviru Zveze Sonček Jelka Bratec.
“Sodelovanje je vodilo našo zvezo tako ob njeni ustanovitvi pred 35 leti kot danes. Le tako lahko delamo korake naprej,” je dodal predsednik zveze Lojze Tomaževič.
Direktorja zveze Suhadolnika žalosti, da smo v Sloveniji še vedno priča medicinsko skrbstvenemu modelu obravnave oseb z oviranostmi, tako odraslih kot otrok. “Še vedno se ne ugotavljajo potrebe posameznika, na podlagi katerih bi imel možnost izbire storitev za življenje v skupnosti. Namesto tega se izvajalci brez urejenega in poštenega sistema financiranja storitev ukvarjamo z iskanjem finančnih sredstev. Ko bo urejeno financiranje potreb uporabnikov, potem bo uporabnik lahko sam izbiral, pri katerem izvajalcu bo vzel storitev,” je prepričan.
“,STA,1538724420,1538724420,sl,13591,306,13590,43,0,NULL,,”Na konferenci Zveze Sonček o vključevanju v družbo, ne v institucije”,na-konferenci-zveze-soncek-o-vkljucevanju-v-druzbo-ne-v-institucije,Post,/sites/43/files/images/STA/sta1.jpg,1,0,1542616124,1544608523
427,13593,”Na svetovni dan za spremembo v odnosu do duševnega zdravja”,”Ob svetovnem dnevu duševnega zdravja je generalni sekretar Združenih narodov Antonio Guterres poudaril, da bomo spremenili svet, če bomo spremenili odnos do duševnega zdravja.”,”Ljubljana/New York/Ženeva, 10. oktobra (STA) – Ob svetovnem dnevu duševnega zdravja, 10. oktobru, je generalni sekretar Združenih narodov Antonio Guterres poudaril, da bomo spremenili svet, če bomo spremenili odnos do duševnega zdravja. Čas je za akcijo, je povabil. Svetovni dan letos poteka pod geslom Mladi in duševno zdravje v spreminjajočem se svetu.
Starši in učitelji lahko veliko pripomorejo k temu, da otroci in mladostniki pridobijo ustrezna znanja za soočanje z vsakdanjimi izzivi v šoli in doma, je opomnila Svetovna zdravstvena organizacija. Preventiva pa se po njihovem opozorilu začne že s prepoznavanjem prvih znakov duševnih težav.
Za današnjo generacijo mladih je značilno pogosto doživljanje stresa. Imajo občutke negotovosti, so zaskrbljeni ter socialno in psihološko ranljivi, so izpostavili na Nacionalnem inštitutu za javno zdravje (NIJZ).
Tradicionalnim oblikam nasilja in trpinčenja so se pridružile njihove spletne oblike. Vse več je zasvojenosti z video igrami in družbenimi omrežji. Mladostniki slabo prenašajo konflikte in notranje nezadovoljstvo, pojavljajo pa se nove oblike socialnih fobij, anksioznosti in nemira, so dodali na NIJZ.
Na primarni in sekundarni ravni se je število prvih obiskov otrok in mladostnikov zelo povečalo zaradi duševnih in vedenjskih motenj. V obdobju od leta 2008 do leta 2015 jih je bilo na primarni ravni več za četrtino, na sekundarni pa za nekaj manj kot tri četrtine.
Po opozorilu NIJZ je zaskrbljujoča tudi vse večja poraba zdravil za zdravljenje duševnih in vedenjskih motenj pri mlajših od 20 let, saj se je od leta 2008 do 2015 povečala za polovico. Vzroki za težave so bile podobno kot pri odraslih reakcije na hud stres in prilagoditvene motnje, druge anksiozne motnje, depresivne epizode in motnje hranjenja.
NIJZ bo danes v Ljubljani organiziral okroglo mizo o izzivih sodobnega časa, še zlasti pri prepoznavanju in preprečevanju duševnih stisk otrok in mladostnikov. V okviru programa za več znanja o motnjah razpoloženja OMRA pa bodo prav tako v Ljubljani potekala predavanja in delavnice, povezane s stresom in motnjami razpoloženja.
Namen svetovnega dneva duševnega zdravja je opozoriti širšo javnost na duševne težave in bolezni ter na problematiko, povezano z njimi. Prvič so ga obeležili leta 1992 na pobudo nevladne Svetovne federacije za duševno zdravje.
“,STA,1539157020,1539157020,sl,13593,306,13592,43,0,NULL,,”Na svetovni dan za spremembo v odnosu do duševnega zdravja”,na-svetovni-dan-za-spremembo-v-odnosu-do-dusevnega-zdravja,Post,/sites/43/files/images/STA/sta1.jpg,1,0,1542616742,1544611164
428,13595,”Svetovni dan boja proti bolečini posvečen izobraževanju o lajšanju bolečine”,”Bolečina je nekaj, kar nas spremlja praktično vsak dan in je do neke mere koristna, saj deluje kot opozorilo, da se v telesu ali njegovi neposredni okolici dogaja nekaj, kar nas ogroža”,”Ljubljana, 11. oktobra (STA) – Zadnjih 14 let je 11. oktober posvečen boju proti bolečini. “Bolečina je nekaj, kar nas spremlja praktično vsak dan in je do neke mere koristna, saj deluje kot opozorilo, da se v telesu ali njegovi neposredni okolici dogaja nekaj, kar nas ogroža,” pravi zdravnik Gorazd Požlep. V razvitem svetu dobra petina prebivalstva občasno trpi zaradi bolečine.
Predsednik Slovenskega združenja za zdravljenje bolečine Požlep je za STA povedal, da je sicer namen tega dneva bolnike in strokovno javnost opozoriti na pomembnost obravnavanja bolečine. Letošnji svetovni dan je tako po njegovih besedah posvečen izobraževanju o problemu in lajšanju bolečine, kajti na grobo ocenjeni posredni in neposredni “stroški kronične bolečine v EU znašajo okoli 440 milijard evrov letno”.
Zaradi bolečine bomo lahko primerno ukrepali in preprečili večjo poškodbo, do katere bi lahko prišlo. Problem pa nastane, če bolečina traja dalj časa, takrat govorimo o kronični bolečini, ki zelo pogosto izgubi svoj varovalni učinek, predstavlja samo breme in v veliki meri po Požlepovih besedah znižuje kakovost življenja milijonom ljudi po svetu.
“V grobem lahko rečemo, da v razvitem delu sveta dobra petina prebivalstva vsaj občasno trpi zaradi bolečine. Kljub vse večjemu znanju o mehanizmih nastanka in tudi lajšanju bolečine pa se stanje le zelo počasi izboljšuje. Lahko se vprašamo, kaj je vzrok za takšno stanje, vendar odgovor ni preprost,” je poudaril Požlep.
Ob tem je opozoril, da smo dolgo časa na kronično bolečino gledali le kot na biološki pojav, zanemarjali pa njeno psihosocialno komponento. V zadnjih desetletjih je namreč postalo jasno, da na doživljanje bolečine pogosto vplivajo tudi psihološki in socialni dejavniki. Samo zdravljenje pa je po njegovih navedbah še vedno pretežno usmerjeno v iskanje vzroka za doživljanje bolečine.
Tak pristop je po njegovem mnenju tudi najbolj pravilen in najbolj učinkovit v primerih, ko vzrok najdemo in ga tudi odpravimo. Jasen vzrok za bolečine imamo skoraj vedno pri bolnikih z rakom, pa tudi številnih revmatoloških, ortopedskih in še katerih, je dejal.
“Žal pa pri številnih bolnikih s kronično bolečino kljub številnim preiskavam pravega vzroka bolečin ne najdemo ali pa ta ni tak, da bi lahko pojasnil bolnikove močne bolečine,” je pojasnil Požlep in dodal, da je v teh primerih zdravljenje bolečine precej oteženo. Kajti tudi v razvitem svetu po njegovih navedbah ni dovolj možnosti za sočasno obravnavo bolnikov s strani različnih strokovnjakov, ki k problemu bolečine pristopijo na različne načine.
Takšen pristop je interdisciplinaren, pri čemer sodelujejo tako strokovnjaki medicinskih, kot tudi nemedicinskih strok. “Nujno je, da se tega problema začnemo zavedati in omogočiti stroki, da organizira primeren pristop lajšanju kronične bolečine,” je še poudaril predsednik združenja. Ob svetovnem dnevu boja proti bolečini združenje v prostorih zdravniške zbornice pripravlja mednarodni simpozij o racionalni obravnavi bolečine.
“,STA,1539244860,1539244860,sl,13595,306,13594,43,0,NULL,,”Svetovni dan boja proti bolečini posvečen izobraževanju o lajšanju bolečine”,svetovni-dan-boja-proti-bolecini-posvecen-izobrazevanju-o-lajsanju-bolecine,Post,/sites/43/files/images/STA/sta1.jpg,1,0,1542618160,1544608559
456,13657,”Svetovni dan poudarja pomen hitrega odkrivanja in zdravljenja luskavice”,”Luskavica oziroma psoriaza je kronična avtoimunska bolezen, za katero so značilna vnetna žarišča na koži. Svetovni dan luskavice, ki ga zaznamujemo danes, poudarja, da je bolezen potrebno čim prej odkriti in zdraviti, tudi zaradi nekaterih pridruženih bolezni. Z luskavico po svetu živi 125 milijonov ljudi, v Sloveniji pa je bolnikov okoli 40.000.”,”
Ljubljana, 29. oktobra (STA) – Luskavica oz. psoriaza je kronična avtoimunska bolezen, za katero so značilna vnetna žarišča na koži. Svetovni dan luskavice, ki ga zaznamujemo danes, poudarja, da je bolezen potrebno čim prej odkriti in zdraviti, tudi zaradi nekaterih pridruženih bolezni. Z luskavico po svetu živi 125 milijonov ljudi, v Sloveniji pa je bolnikov okoli 40.000.
Na strokovni konferenci, ki jo zveza društev za cerebralno paralizo Slovenije prireja v okviru svoje 35-letnice delovanja, bodo podrobno obravnavali zakone o celostni zgodnji obravnavi, o socialnem vključevanju invalidov in o osebni asistenci, ki se bodo začeli uporabljati v prihodnjem letu.
Kot so ob svetovnem dnevu pojasnili v Društvu psoriatikov Slovenije, se luskavica najpogosteje pojavlja pri ljudeh med 20. in 40. letom starosti. S sabo prinaša tudi nekatere tvegane pridružene bolezni, kot so srčno-žilne bolezni, zvišan krvni tlak in zvišane krvne maščobe, pri tretjini bolnikov pa tudi psoriatični artritis. Zgodnja diagnostika in hitro zdravljenje sta zato še posebej pomembna.
Luskavica nastane tako, da imunski sistem kože pomotoma sproži obrambni odziv. Pojavijo se zelo raznolike kožne spremembe, bolezen pa se najpogosteje kaže kot pordela koža, prekrita z luskami zlasti na komolcih, kolenih, ledvenem predelu in lasišču. Prizadene lahko tudi nohte, kožo na podplatih in dlaneh ter v genitalnem predelu.
Bolezenske spremembe so lahko omejene na manjše predele kože, lahko pa se razširijo in v redkih primerih zajamejo kožo celega telesa. Vzroki za nastanek luskavice niso povsem znani, med tiste, zaradi katerih nastane ali se poslabša bolezen, pa spadajo čustveni stres, kožne poškodbe, nekatere vrste okužb ter odziv telesa na določena zdravila in alkohol.
Raziskave so pokazale desetodstotno možnost, da bodo potomci zboleli za luskavico, če za njo trpi eden od staršev. Bolezen je potrebno zdraviti celostno, saj luskavica ni zgolj kožno obolenje, ampak resna sistemska bolezen. Bolniki z luskavico se soočajo tudi s predsodki v družbi. V društvu psoriatikov zato pripravljajo akcije ozaveščanja ljudi o bolezni.
Sicer lahko luskavica močno poslabša kakovost življenja, pogosto jo spremljajo tudi druge bolezni. Tako ima kar tretjina bolnikov z luskavico tudi psoriatični artritis, ki lahko, če ni dovolj zgodaj odkrit, povzroči trajne okvare sklepov ali celo invalidnost. Sodobna zdravila pa lahko bolnikom omogočijo, da bolezen ne le obvladujejo, ampak si povrnejo življenje na raven pred razvojem bolezni.
Namen zdravljenja luskavice je zmanjšati simptome in obvladovati vnetne procese v telesu. Zdravila tako pomagajo odstranjevati luske, gladiti kožo, upočasniti pretirano nastajanje kožnih celic ali zaustaviti vnetni proces. Vsa zdravila niso učinkovita pri vseh bolnikih. Zdravilo, ki pri eni osebi dobro učinkuje, je lahko pri drugi neučinkovito.
Da gre za zelo zahtevno bolezen, ki močno poslabša kakovost življenja, je prepoznala tudi Svetovna zdravstvena organizacija. Maja 2014 je namreč njena generalna skupščina sprejela resolucijo o luskavici. Prepoznala jo je kot kronično, nenalezljivo, bolečo bolezen, ki močno omeji ali celo iznakazi bolnike in za katero ne obstaja dokončna ozdravitev.
Resolucija poudarja tudi psiho-socialno breme bolezni.
“,STA,1540806780,1540806780,sl,13657,306,13656,43,0,NULL,,”Svetovni dan poudarja pomen hitrega odkrivanja in zdravljenja luskavice”,svetovni-dan-poudarja-pomen-hitrega-odkrivanja-in-zdravljenja-luskavice,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1544694911,1544695169
457,13659,”Puščanje brkov za ozaveščanje o boleznih moških”,”Začenja se mesec, ko si moški v podporo preventivni akciji Movember pustijo rasti brke.”,”
Ljubljana, 01. novembra (STA) – Začenja se mesec, ko si moški v podporo preventivni akciji Movember pustijo rasti brke. Namen akcije je namreč ozaveščanje o zdravju in boleznih, ki prizadenejo predvsem moške, kot sta rak prostate in testisov. Člani gibanja zbirajo tudi donacije in pripravijo dogodke, kot bosta Movember tek in improvizirana predstava.
Podporniki mednarodnega gibanja Movember torej nosijo novembra brke. Od tod tudi izvira ime, saj moustache, kot je angleška beseda za brke, in november dasta skupaj Movember, je na nedavni novinarski konferenci pred začetkom akcije dejal predstavnik gibanja v Sloveniji Martin Šala. Moški si zato prvega novembra obrijejo brke in jih nato pustijo rasti cel mesec.
Poudarek gibanja je ozaveščanje za zgodnje odkrivanje in pravočasno zdravljenje raka na prostati in testisih, o pravilnem pristopu k zdravljenju psiholoških bolezni pri moških in za preprečevanju samomorov.
Poleg ozaveščanja o zdravju in boleznih člani Movembra zbirajo tudi donacije, ki jih potem namenijo organizacijam, ki so povezane z moškim zdravjem. Denar, darovan na globalno spletno stran, pa se po besedah slovenskega predstavnika nameni financiranju raziskav o teh boleznih.
V Sloveniji v podporo gibanju vsako leto organizirajo nekaj dogodkov, tudi letos bosta potekala improvizirana predstava, ki se bo odvijala 16. novembra v Kulturno umetniškem društvu France Prešeren, in dobrodelni Movember tek z brki, ki bo potekal 24. novembra v Ljubljani. Štartnina in izkupiček prostovoljnih prispevkov predstave pa gresta v dobrodelni sklad.
Lani so organizatorji gibanja v Sloveniji zbrali 19.000 evrov, s katerimi so med drugim kupili aparat za drobljenje kamnov v sečnem mehurju Univerzitetnemu kliničnemu centru (UKC) Ljubljana. Letos bodo po besedah Šale zbirali denar za nov urodinamski aparat, ki ga bodo podarili kliničnemu oddelku za urologijo UKC Ljubljana.
Zaradi raka na prostati namreč v Sloveniji umre več kot 350 ljudi na leto, 1300 pa jih zboli, so opozorili na nedavni novinarski konferenci pred Movembrom.
Od samega začetka gibanja Movember v Avstraliji je sicer preteklo 15 let, hitro pa se je razširilo po celem svetu. V tem času se je več kot pet milijonov ljudi pridružilo gibanju in skupaj so zbrali več kot 650 milijonov evrov, s katerimi so podprli več kot 1300 projektov. Vsako leto se te številke povečujejo.
Danes je Movember globalni dobrodelni projekt in ena izmed najbolj prepoznavnih neprofitnih organizacij na svetu, piše na spletni strani slovenskega dela gibanja.
“,,1541067300,1541067300,sl,13659,306,13658,43,0,NULL,,”Puščanje brkov za ozaveščanje o boleznih moških”,puscanje-brkov-za-ozavescanje-o-boleznih-moskih,Post,,1,0,1544696117,1544696226
458,13661,”Novembra večji poudarek na preprečevanju zasvojenosti”,”November je v Sloveniji tudi mesec preprečevanja zasvojenosti.”,”Ljubljana, 01. novembra (STA) – November je v Sloveniji tudi mesec preprečevanja zasvojenosti. Različne organizacije zato ozaveščajo o zasvojenosti in njenih posledicah, spodbujajo k dialogu in reševanju problemov ter poudarjajo pomen preventivnih dejavnosti na področju preprečevanja in zmanjševanja zasvojenosti.
Tudi letos Nacionalni inštitut za javno zdravje (NIJZ) pripravlja nacionalno konferenco ob mesecu preprečevanja zasvojenosti, letos bo potekala pod naslovom Skupaj zmoremo več – prepoznajmo zasvojenost, odvijala pa se bo v 6. novembra v Radencih.
Osrednja tema 12. nacionalne konference bodo dejavniki tveganja in varovalni dejavniki, ki vplivajo na razvoj zasvojenosti pri otrocih in mladostnikih. Poleg tega bodo spregovorili tudi o tem, kako se z mladostniki pogovarjati ob njihovem prvem eksperimentiranju s prepovedano drogo in kako ukrepati, piše na spletni strani NIJZ.
Prav tako bodo predstavili primere dobrih praks na področju programov za preprečevanje zasvojenosti in programov pomoči, ki so na voljo v skupnosti. Nacionalno konferenco NIJZ sicer pripravlja v sodelovanju z ministrstvi za zdravje, za delo, družino, socialne zadeve in enake možnosti ter za izobraževanje, znanost in šport.
O zasvojenosti pri posamezniku govorimo, ko se določen vedenjski vzorec začne ponavljati iz dneva v dan in postane središče razmišljanja in dogajanja v njegovem življenju. Zasvojenost je po navedbah NIJZ bolezen, ki vpliva na telesno in duševno stanje zasvojenega, prizadene njegove odnose z okolico ter pusti posledice tako v družini zasvojenega kot v širši okolici.
Ob besedi zasvojenost navadno pomislimo na zlorabo drog, vendar pa ima beseda večjo razsežnost. Poleg kemičnih zasvojenosti ali zasvojenosti s psihoaktivnimi substancami, med katere sodijo tudi alkohol, tobak, zdravila in prepovedane droge, poznamo tudi nekemične ali vedenjske zasvojenosti, med katere uvrščamo zasvojenost z igrami na srečo, pornografijo, hrano, odnosi, delom, nakupovanjem in tudi sodobnimi tehnologijami.
Preventivne aktivnosti so po prepričanju strokovnjakov eden ključnih pristopov, ki pomaga krepiti in izboljševati zdravje, kakovost življenja ter blaginjo posameznika in skupnosti. Najbolj učinkovite so, če se z njimi srečajo že najmlajši in z njimi nadaljujejo v vseh življenjskih obdobjih. V Sloveniji se izvajajo številni preventivni programi, dostopni vsem, še piše na spletni strani NIJZ.
“,”Jaka Verbic Miklic”,1541069280,1541069280,sl,13661,306,13660,43,0,NULL,,”Novembra večji poudarek na preprečevanju zasvojenosti”,novembra-vecji-poudarek-na-preprecevanju-zasvojenosti,Post,,1,0,1544698212,1544698676
459,13663,”WHO opozarja na nevarno zlorabo antibiotikov”,”Svetovna zdravstvena organizacija (WHO) je danes posvarila, da je poraba antibiotikov v nekaterih delih sveta nevarno visoka”,”
Ženeva, 12. novembra (STA) – Svetovna zdravstvena organizacija (WHO) je danes posvarila, da je poraba antibiotikov v nekaterih delih sveta nevarno visoka, medtem ko jih v drugih primanjkuje, kar spodbuja nevarno zlorabo teh ključnih zdravil oz. širi pojavnost okužb z odpornimi superbakterijami. Organizacija s sedežem v Ženevi je zbrala podatke o antibiotikih iz večjega dela sveta in pri tem ugotovila občutna razhajanja pri njihovi porabi, poroča francoska tiskovna agencija AFP.
Poročilo WHO, ki temelji na podatkih iz 65 držav in regij za leto 2015, je tako na primer pokazalo, da na primer v Burundiju porabijo le štiri t. i. definirane dnevne odmerke antibiotikov na 1000 prebivalcev dnevno, v Mongoliji pa na drugi strani kar 64.
Definirani dnevni odmerek je statistično izračunan povprečni vzdrževalni odmerek, ki naj ga odrasli bolnik prejme v enem dnevu za glavno oziroma najpogostejšo indikacijo zdravila. Določa ga Center WHO za statistično obdelavo zdravil v Oslu, pojasnjuje Wikipedia.
Kot izhaja iz poročila WHO, velika razhajanja pri porabi antibiotikov obstajajo tudi znotraj posamičnih regij.
V Evropi, od koder je WHO dobila najpopolnejše podatke, je bila povprečna poraba antibiotkov skoraj 18 definiranih dnevnih odmerkov na 1000 prebivalcev dnevno.
A znotraj te regije je na primer Turčija, kjer je povprečna poraba antibiotikov kar 38 definiranih dnevnih odmerkov. Gre za na primer petkrat višjo porabo od Azerbajdžana, ki je država z najnižjo porabo v regiji Evropa. Tam porabijo manj kot osem definiranih dnevnih odmerkov antibiotikov.
Poraba antibiotikov v Sloveniji je bila v letu 2015 14,5 definiranih dnevnih odmerkov, v letu 2016 pa 13,9 definiranih dnevnih odmerkov, kaže lani objavljeno poročilo Evropskega centra za preprečevanje in obvladovanje bolezni.
“Velika razlika pri porabi antibiotikov po svetu kaže, da nekatere države verjetno zlorabljajo antibiotike, medtem ko druge nimajo zadostnega dostopa do teh zdravil, ki so ključna za reševanje življenj,” je v sporočilu za javnost posvarila WHO.
“Pretirana raba in zloraba antibiotikov ter drugih antimikrobikov sta glavni razlog antimikrobne odpornosti,” je ocenila direktorica oddelka za ključna zdravila in zdravstvene proizvode pri WHO Suzanne Hill. “Brez učinkovitih antibiotikov in drugih antimikrobikov ne bomo več zmožni zdraviti običajnih infekcij, kot je pljučnica,” je poudarila.
Antibiotiki, ki so jih odkrili v 20. letih minulega stoletja, so odtlej rešili na milijone življenj, saj so premagali bakterijske bolezni, kot so pljučnica, tuberkuloza in meningitis. A bakterije so se v zadnjih desetletjih naučile prilagoditi tem zdravilom in nanje razvile odpornost.
Odpornost lahko bakterije razvijejo takrat, ko bolniki uporabljajo antibiotike, ki jih dejansko ne potrebujejo, ali ko ne zaključijo zdravljenja, kot je bilo predpisano. V takih primerih na pol premagane bakterije dobijo priložnost za okrevanje in razvoj odpornosti.
Kot je še poudarila Hillova, poročilo WHO kaže, da je za zmanjšanje nepotrebne rabe antibiotikov nujno uveljavljanje takšnih zdravstvenih politiki, ki bodo določale, da je antibiotike mogoče dobiti zgolj na recept.
A poročilo WHO skrb izraža tudi zaradi nizke porabe antibiotikov v določenih delih sveta. “Odpornost se lahko pojavi, ko si ljudje ne morejo privoščiti celotnega cikla zdravljenja ali imajo dostop zgolj do zdravil nižjega standarda ali ponarejenih zdravil,” je poudarilo.
Pri WHO so priznali, da je slika porabe antibiotikov po svetu daleč od popolnosti, saj danes objavljeno poročilo vključuje le štiri države v Afriki, tri na Bližnjem vzhodu in šest v azijsko-tihomorski regiji. Na seznamu preučenih držav na primer ni ne ZDA ne Kitajske in ne Indije.
Pri WHO vedno znova opozarjajo, da svetu zmanjkuje učinkovitih antibiotikov, lani pa so države in velika farmacevtska podjetja pozvali, naj ustvari novo generacijo zdravil, ki bi se bila sposobna spopasti s smrtonosnimi superbakterijami.
WHO od 12. do 18. novembra obeležuje svetovni teden osveščenosti o antibiotikih.
“,”Jaka Verbic Miklic”,1542020160,1542020160,sl,13663,306,13662,43,0,NULL,,”WHO opozarja na nevarno zlorabo antibiotikov”,who-opozarja-na-nevarno-zlorabo-antibiotikov,Post,,1,0,1544698642,1544698708
460,13665,”Rak trebušne slinavke v nenehnem porastu, a se o njem malo govori”,”Rak trebušne slinavke je v nenehnem porastu, pri tem pa ga še vedno odkrivamo pozno, zaradi česar ima eno najslabših statistik preživetja.”,”
Ljubljana, 15. novembra (STA) – Rak trebušne slinavke je v nenehnem porastu, pri tem pa ga še vedno odkrivamo pozno, zaradi česar ima eno najslabših statistik preživetja. Kljub temu se o tej bolezni v širši javnosti malo govori. Kot so poudarili v Združenju EuropaColon Slovenija, je zato današnji svetovni dan trebušne slinavke priložnost, da to bolezen “postavimo na zemljevid”.
V Sloveniji je leta 2015 za rakom trebušne slinavke zbolelo 381 ljudi, umrlo jih je 365. Število obolelih je med moškimi in ženskami izenačeno. Večina obolelih je starejših od 60 let, a se starostna meja tako kot pri vseh rakih tudi pri tem spušča in niso več redki bolniki, ki so mlajši od 40 let. Stopnja umrljivosti je pri raku trebušne slinavke ena največjih.
Bolniki po diagnozi povprečno živijo manj kot pet mesecev. Po besedah podpredsednice Združenja EuropaColon Slovenija Maje Južnič Sotlar se ta statistika v zadnjih 40 letih ni spremenila. Pri vseh drugih rakih je krivulja petletnega preživetja v tem času strmo narasla, pri raku trebušne slinavke pa še vedno “ostaja ravna črta”.
“Skrajni čas je, da vsi, ki kakorkoli sodelujemo pri obravnavi raka – to pa smo v resnici kar vsi – naredimo vse, da ta trend končno le spremenimo in iz ravne črte naredimo krivuljo navzgor,” je ob svetovnem dnevu zapisala Južnič Sotlarjeva. Možnosti za daljše preživetje imajo le tisti bolniki, ki jim bolezen odkrijejo v zgodnjih stadijih, ko je še možna operacija.
Teh je zdaj na leto okoli 20 odstotkov vseh bolnikov z rakom trebušne slinavke. Razlogov za tako slabe rezultate zdravljenja in preživetja je več, eden najpomembnejših pa je zagotovo v praviloma (pre)poznem odkrivanju bolezni. Simptomi so pogosto nejasni in zlasti v začetnih stadijih jih ljudje pogosto spregledajo ali jim ne namenjajo zadostne pozornosti.
“Vsekakor je treba biti pozoren zlasti na nenadno slabo počutje, ki traja dlje časa, na izrazito temen urin in svetlo, skoraj sivo blato, naglo nenamerno in občutno izgubljanje teže, porumenelost kože in sluznic ter bolečine v predelu žličke ali na sredini hrbta,” je pojasnila Južnič Sotlarjeva. Pomembno je, da ob teh težavah nikakor ne čakamo, ampak gremo k zdravniku.
Med osrednjimi cilji skupne kampanje, ki jo društva bolnikov z rakom po svetu izvajajo v teh dneh, je prav to, da bi ljudje prej pomislili na možnost raka trebušne slinavke. Pot do diagnoze je pogosto težka in zahtevna tudi za zdravnike, saj trebušna slinavka leži globoko v trebušni votlini in je zato pogosto slabo vidna z ultrazvokom, ki je najširše dostopna in povsem neinvazivna preiskava.
Bistveno natančnejše so preiskave z računalniško tomografijo ali endoskopskim ultrazvokom. Številni raziskovalci se po besedah Južnič Sotlarjeve trudijo razumeti biološke značilnosti raka trebušne slinavke, da bi čim prej prišli do zdravila, ki bi učinkovalo in bi omogočilo pomembno daljše preživetje od zdajšnjega.
“Za zdaj je torej tako, da imajo največ upanja le tisti bolniki, ki so primerni za kirurški poseg, torej tisti, ki imajo bolezen omejeno na sam organ. To zares slabo stanje lahko spremenimo le z zgodnejšim odkrivanjem bolezni in stalnim ozaveščanjem širše javnosti,” je še dodala podpredsednica združenja.
V Društvu onkoloških bolnikov Slovenije so ob letošnjem svetovnem dnevu izdali zgibanko z naslovom Rak trebušne slinavke – Kaj mora vsakdo vedeti o tej bolezni, ki jo je pripravil zdravnik Borut Štabuc. Poleg tega bodo danes na ljubljanskem Gospodarskem razstavišču v okviru razstave Body World Vital organizirali pogovor o tej bolezni. Na pomen ozaveščanja o raku trebušne slinavke bo opomnil tudi v vijolično barvo odet Ljubljanski grad.
Sicer svetovni dan trebušne slinavke zaznamujemo tretji četrtek v novembru. Njegov namen je ozavestiti vladne predstavnike, ki so odgovorni za financiranje, znanstvenike, ki naj bi pospešili raziskave, in farmacevtske družbe, ki naj bi poiskale učinkovita zdravila. Ciljna skupina je seveda tudi širša javnost, ki bi morala z zdravim življenjskim slogom skrbeti za svoje zdravje in biti pozorna na simptome bolezni.
Ideja o svetovnem dnevu je zaživela leta 2015 na pobudo mednarodne zveze organizacij bolnikov. Nasploh je po svetu vse več bolnikov z raki prebavil, posebej zaskrbljujoč pa je porast raka trebušne slinavke. S to diagnozo živi v Evropi več kot 100.000 bolnikov, v Sloveniji pa okoli 400.
“,STA,1542279720,1542279720,sl,13665,306,13664,43,0,NULL,,”Rak trebušne slinavke v nenehnem porastu, a se o njem malo govori”,rak-trebusne-slinavke-v-nenehnem-porastu-a-se-o-njem-malo-govori,Post,,1,0,1544699022,1544699023
461,13667,”Odpornost mikrobov predstavlja globalno grožnjo javnemu zdravju”,”Pred evropskim dnevom antibiotikov danes v prostorih Zdravniške zbornice Slovenije poteka strokovni posvet o obvladovanju odpornosti mikrobov”,”
Ljubljana, 15. novembra (STA) – Pred evropskim dnevom antibiotikov danes v prostorih Zdravniške zbornice Slovenije poteka strokovni posvet o obvladovanju odpornosti mikrobov, ki je predvsem posledica pretirane in pogosto neprimerne uporabe antibiotikov. Že uvodna razprava je izpostavila, da odpornost mikrobov predstavlja naraščajočo globalno grožnjo javnemu zdravju. Porast odpornosti mikrobov pomeni, da antibiotik ni več učinkovit proti bakterijam, ki so povzročile okužbo. Zaradi naraščanja števila večkratno odpornih bakterij, v kombinaciji s pomanjkanjem novih antibiotikov, se medicina oz. zdravniki srečujejo z velikimi težavami pri zdravljenju okužb. Odpornost mikrobov ne pozna meja in je prisotna povsod po svetu.
“Če ne bomo pravočasno ukrepali, bi lahko večkratna odpornost na antibiotike do leta 2050 postala največji svetovni morilec,” je v uvodnem nagovoru udeležencem konference poudarila državna sekretarka na ministrstvu za zdravje Pia Vračko. Študije kažejo, da je v EU odpornost mikrobov neposredni vzrok za najmanj 33.000 smrti letno in za 1,5 milijarde evrov dodatnih stroškov za zdravstveno oskrbo.
Naraščajoča grožnja terja globalno ukrepanje. Zato so po besedah Vračkove Svetovna zdravstvena organizacija, Organizacija za zdravje živali in EU pozvale k skupnemu ukrepanju po načelu Eno zdravje, ki poudarja povezanost zdravja ljudi, živali in okolja. Bolezni se namreč prenašajo od ljudi na živali in obratno, zato je treba odpornost mikrobov obravnavati tako pri ljudeh kot živalih.
Obenem je treba posebno pozornost nameniti tudi prehranjevalni verigi in okolju, ki sta prav tako vir odpornih mikrobov. Kot je pojasnila Vračkova, je v Sloveniji pozornost problematiki odpornosti mikrobov namenjala predvsem strokovna javnost in rezultati niso izostali. V mednarodnih primerjavah se naša država uvršča med uspešnejše države po uporabi antibiotikov v medicini in veterini.
Vendarle pa tudi v Sloveniji ostaja skrb zaradi pretirane in neprimerne uporabe antibiotikov. Posebno pozornost terjajo zlasti razlike pri predpisovanju in uporabi antibiotikov med regijami in bolnišnicam ter uporaba antibiotikov pri otrocih, starejših in kroničnih bolnikih. Pozornost stroke je namenjena tudi preprečevanju in nadzoru okužb v bolnišnicah in ustanovah za dolgotrajno oskrbo.
Na današnjem posvetu bodo predstavili tudi predlog nacionalne strategije obvladovanja odpornosti mikrobov, ki jo spremlja akcijski načrt. Ministrstvo za zdravje ga je pripravilo skupaj s strokovnjaki na področju humane medicine, veterine in okolja. Ključna strateška cilja sta zmanjšati uporabo antibiotikov in doseči bolj preudarno uporabo.
Sicer je Evropski center za preprečevanje in obvladovanje bolezni (ECDC) danes sporočil, da v Evropi v bolnišnicah in ustanovah za dolgotrajno oskrbo vsako leto zabeležijo okoli 8,9 milijona okužb. To pomeni, da bolnišnične okužbe, ki jih je težko zdraviti, ostajajo resno vprašanje, v prihodnosti pa bi se lahko soočili še z večjo pojavnostjo odpornih mikrobov.
Tovrstne okužbe so zato velik problem javnega zdravja. Po ocenah ECDC ima namreč vsak dan v evropskih bolnišnicah vsak 15. bolnik eno izmed bolnišničnih okužb, enako velja za vsakega 26. prebivalca ustanov za dolgotrajno oskrbo. Številne izmed teh okužb pa so zakrivile na več antibiotikov odporne bakterije.
Evropski dan antibiotikov zaznamujemo 18. novembra, med 13. in 19. novembrom pa svetovni teden antibiotikov. Njun namen je predvsem ozaveščati ljudi, da antibiotiki ob pretirani uporabi izgubljajo učinkovitost v boju proti bakterijam. Ob letošnjem svetovnem tednu velja poziv zdravstvenim delavcem, naj z ustrezno higieno rok pomagajo preprečevati širjenje odpornosti mikrobov v zdravstvenih ustanovah.
“,STA,1542281880,1542281880,sl,13667,306,13666,43,0,NULL,,”Odpornost mikrobov predstavlja globalno grožnjo javnemu zdravju”,odpornost-mikrobov-predstavlja-globalno-groznjo-javnemu-zdravju,Post,,1,0,1544701128,1544701787
462,13669,”V EU vsako leto skoraj devet milijonov bolnišničnih okužb”,”V Evropi v bolnišnicah in domovih za oskrbo vsako leto zabeležijo okoli 8,9 milijona okužb”,”
Bruselj, 15. novembra (STA) – V Evropi v bolnišnicah in domovih za oskrbo vsako leto zabeležijo okoli 8,9 milijona okužb, je danes poudaril Evropski center za preprečevanje in obvladovanje bolezni (ECDC). To pomeni, da bolnišnične okužbe, ki jih je težko zdraviti, ostajajo resno vprašanje, v prihodnosti pa bi se lahko soočili še z večjo pojavnostjo odpornih bakterij. ECDC je ob evropskem dnevu preudarne rabe antibiotikov pozval k nadaljnjim prizadevanjem na področju antimikrobne odpornosti v bolnišničnih ustanovah. Pri tem je izpostavil, da, ko gre za uporabo antimikrobikov, države na območju Evropske unije in Evropskega gospodarskega prostora ravnajo različno.
Prav različne prakse pri preprečevanju in nadzoru nad boleznimi ter prekomerna raba antimikrobikov – v večini primerov antibiotikov – pa bi lahko vodile v večjo pojavnost in širjenje bakterij, ki so odporne na več zdravil in ki so sicer znane tudi kot superbakterije.
Kot so navedli na spletni strani agencije EU za zdravje, študije kažejo, da se antimikrobiki v bolnišnicah in dolgoročnih domovih za oskrbo, kot so domovi za starejše, še vedno uporabljajo prekomerno.
Izkazalo se je namreč, da uporaba širokospektralnih antimikrobikov v bolnišnicah Evropi niha med 16 in 62 odstotki – gre za zdravila, ki niso vedno potrebna in ki krepijo odpornost bakterij.
V povprečju sicer vsak dan v bolnišnicah v Evropi približno tretjina pacientov dobi antibiotike ali druga antimikrobna zdravila, v domovih za oskrbo je takih dvajsetina. Del bolnikov takšna zdravila prejema le za preprečevanje bolezni. V domovih za oskrbo je takih tretjina.
Samo okužbe, povezane z zdravljenjem, v bolnišnicah v Evropi zakrivijo več smrtnih primerov kot katerekoli druge infekcijske bolezni, ki jih spremlja ECDC. Vsako drugo tovrstno okužbo bi bilo možno preprečiti, vsaka tretja bakterija, ki se povezuje s temi okužbami, pa je odporna na običajne antibiotike.
Tovrstne infekcije so tudi velik problem za javno zdravje. Po ocenah ECDC ima namreč vsak dan v evropskih bolnišnicah vsak 15. bolnik eno izmed bolnišničnih okužb, enako velja za vsakega 26. prebivalca dolgoročnih domov za oskrbo. Številne izmed teh okužb so zakrivile na več zdravil odporne bakterije.
Evropski komisar za zdravje in varno hrano Vytenis Andriukaitis je ob današnjem dnevu izpostavil, da bi bilo številne smrti v Evropi možno preprečiti, če bi ustavili nepotrebno rabo antimikrobikov v zdravstvu in kmetijstvu, pa tudi z boljšo diagnostiko in preprečevanjem okužb v zdravstvenih ustanovah in v skupnostih.
Direktorica ECDC Andrea Ammon pa je spomnila na nedavno objavljeno študijo, ki je pokazala, da na območju EU in Evropskega gospodarskega prostora vsako leto zaradi odpornih bakterij umre 33.000 ljudi. Opozorila je tudi na letne izdatke za zdravstvo v višini milijarde evrov.
“Zato moramo zagotoviti, da se bodo ta zdravila uporabljala razumno in da bodo ukrepi za preprečevanje okužb in njihov nadzor vzpostavljeni v vseh zdravstvenih ustanovah po Evropi,” je poudarila.
“,STA,1542282900,1542282900,sl,13669,306,13668,43,0,NULL,,”V EU vsako leto skoraj devet milijonov bolnišničnih okužb”,v-eu-vsako-leto-skoraj-devet-milijonov-bolnisnicnih-okuzb,Post,,1,0,1544702199,1544702200
464,13674,”Boj proti aidsu: Tretjina za svojo okužbo s hiv sploh ne ve”,”V Sloveniji po ocenah Nacionalnega inštituta za javne zdravje (NIJZ) živi približno tisoč oseb, okuženih s hiv”,”
Ljubljana, 26. novembra (STA) – V Sloveniji po ocenah Nacionalnega inštituta za javne zdravje (NIJZ) živi približno tisoč oseb, okuženih s hiv, med njimi pa približno tretjina za svojo okužbo sploh ne ve. Ob tem na NIJZ in v društvu Legebitra izpostavljajo pomen pravočasnega testiranja, ki je ključno za uspešno zdravljenje in preprečevanje nadaljnjih okužb. Na NIJZ podatkov o številu na novo okuženih nimajo, saj je diagnoza številnih okužb postavljena šele leta po okužbi. V zadnjih dveh letih sicer opažajo nižje število prijavljenih primerov novih diagnoz okužbe s hiv, so pojasnili za STA.
Lani in letos so v Sloveniji beležili nižje število novih diagnoz hiv kot leta 2016. Takrat so zabeležili 56 novih diagnoz, kar je več kot kadarkoli prej. Letos je bilo do vključno 20. novembra prijavljenih 32 primerov novih diagnoz, lani pa 39 primerov. Delež poznih diagnoz, ko je imunski sistem že hudo prizadet, pa ostaja previsok, poudarjajo.
Opozorilom se pridružujejo tudi v društvu Legebitra, ki omogoča redna testiranja na hiv (pa tudi gonorejo, sifilis in okužbo z virusoma hepatitisa B in C) za moške, ki imajo spolne odnose z moškimi. Ravno ta skupina namreč nosi največje breme okužbe, najpogostejši način prenosa pa je z nezaščitenimi spolnimi odnosi. Kot so za STA pojasnili v društvu, je okoli polovica diagnoz poznih.
Relativno nizko število novih diagnoz okužbe s hiv v zadnjih dveh letih je po oceni NIJZ predvidoma posledica uspehov preventive, predvsem sprememb glede dostopnosti testiranja in kulture testiranja ter takojšnjega zdravljenja ob diagnozi okužbe s hiv. “Zgodnje zdravljenje je uspešnejše, izboljša kakovost in pričakovano trajanje življenja ter preprečuje prenos okužbe,” so še pojasnili.
Napredek v zdravljenju ima smisel samo, če se greš testirat in okužbo odkriješ dovolj zgodaj, poudarjajo tudi v Legebitri. V društvu so s testiranjem moških, ki imajo spolne odnose z moškimi, začeli leta 2009, ko so opravili 50 testov. Do 23. novembra letos pa se je ta številka povzpela na 1160 opravljenih testiranj.
Testiranje na vse spolno prenosljive bolezni v Legebitri priporočajo vsem spolno aktivnim posameznikom, parom na začetku zveze, partnerjem na katerikoli točki v odnosu in v katerikoli obliki odnosa. Skupno testiranje partnerjev je še posebej smiselno ob opuščanju kondomov v okviru partnerskega odnosa, opozarjajo v društvu.
Za zaupno testiranje na okužbo s hiv lahko vsak zaprosi svojega izbranega družinskega zdravnika, stroški pa so kriti iz obveznega zdravstvenega zavarovanja. Anonimno brezplačno testiranje na okužbo s hiv ter na okužbi s hepatitisoma B in C pa opravljajo tudi na Kliniki za infekcijske bolezni in vročinska stanja Univerzitetnega kliničnega centra Ljubljana vsak ponedeljek med 12. in 14. uro. V Evropskem tedna testiranja, ki se začenja danes, pa je testiranje na infekcijski kliniki možno vsak dan do petka med 14. in 15. uro.
STAklub v torek tudi pripravlja okroglo mizo z naslovom Hiv 30 let pozneje – zdravila so, stigma ostaja, na kateri bodo sogovorniki spregovorili o pomenu ozaveščenosti in zgodnjega prepoznavanja okužbe ter zdravljenja, pa tudi o stigmi, ki je kljub velikemu napredku znanosti še vedno prisotna.
“,STA,1543238760,1543238760,sl,13674,306,13673,43,0,NULL,,”Boj proti aidsu: Tretjina za svojo okužbo s hiv sploh ne ve”,boj-proti-aidsu-tretjina-za-svojo-okuzbo-s-hiv-sploh-ne-ve,Post,,1,0,1545139739,1545139740
465,13676,”Kaj je hiv in kaj aids? (pojmovnik)”,”Sindrom pridobljene imunske pomanjkljivosti oziroma aids je napredovana okužba s hiv”,”
Ljubljana, 26. novembra (STA) – Sindrom pridobljene imunske pomanjkljivosti oziroma aids je napredovana okužba s hiv, virusom človeške imunske pomanjkljivosti. Najpogosteje do prenosa virusa hiv pride pri nezaščitenih spolnih odnosih z okuženo osebo. Virus hiv napade in uniči določene bele krvničke, limfocite T pomagalke, ki so pomembne za odpornost proti nalezljivim boleznim in nekaterim rakavim obolenjem. Aids je definiran kot skupek simptomov in okužb, ki so posledica izčrpanosti imunskega sistema zaradi okužbe s hiv. Običajno se aids razvije po več letih inkubacijske dobe, če se okužena oseba ne zdravi.
Simptomi
Od izpostavljenosti okužb z virusom hiv do pojava prvih simptomov in znakov okužbe običajno mine nekaj tednov. Pri malo več kot polovici okuženih se v tem času pojavi akutni retrovirusni sindrom. Bolniki imajo povišano telesno temperaturo, bolijo jih mišice, povečajo se jim bezgavke. Navajajo glavobol, slabost, drisko, bolečine v žrelu, lahko se pojavijo rdečkasti izpuščaji in plitve razjede na koži, v ustih ali zadnjiku.
Simptomi nato v do štirih tednih izzvenijo, sledi večletno obdobje brez večjih težav. Pri nezdravljenih osebah imunski sistem postopoma propada, nato se vse pogosteje pojavljajo hujšanje, dolgotrajne driske, kognitivne motnje ter rakave bolezni in druge okužbe, ki bi pri zdravih osebah potekale bistveno lažje ali pa se sploh ne bi razvile.
Prenašanje
Hiv se nahaja v telesnih tekočinah. Do okužbe z virusom najpogosteje pride pri nezaščitenih spolnih odnosih z okuženo osebo in ob izpostavljenosti okuženi krvi, predvsem pri souporabi okuženih igel za injiciranje drog. Možen je tudi prenos z okužene matere na otroka med nosečnostjo, v času poroda ali po porodu z dojenjem. Okužba prek sline, znoja, solz ali pika okuženega komarja ni znana.
Vir: Nacionalni inštitut za javno zdravje in Wikipedia
“,STA,1543238940,1543238940,sl,13676,306,13675,43,0,NULL,,”Kaj je hiv in kaj aids? (pojmovnik)”,kaj-je-hiv-in-kaj-aids-(pojmovnik),Post,,1,0,1545139897,1545140067
466,13678,”Boj proti aidsu: Testiranje je odgovornost do samega sebe in do drugih”,”Sebastjan, ki je okužen z virusom hiv, je v pogovoru za STA izpostavil pomen testiranja.”,”
Ljubljana, 28. novembra (STA) – Sebastjan, ki je okužen z virusom hiv, je v pogovoru za STA izpostavil pomen testiranja. To razume kot odgovornost do samega sebe in do drugih. Pomembno pa je tudi ozaveščanje. “Bolj kot se informiramo, manj je strahu,” je prepričan in kot primer navaja manj znano dejstvo, da zdravljena oseba hiva ne more prenašati naprej. Sebastjan je za diagnozo, kot pravi, izvedel pred dvema letoma po spletu okoliščin. Opravljal je redna testiranja na okužbo z virusom hiv in jesenski izvid je bil še negativen. Nato pa je okoli novega leta zaradi zelo povišane telesne temperature in utrujenosti obiskal osebnega zdravnika, ki je ugotovil, da ima povišane vrednosti jetrnih parametrov in ga napotil na kliniko za infekcijske bolezni in vročinska stanja.
Tam so ga testirali tako na okužbo z virusom hiv kot tudi na hepatitis C, oba izvida sta bila pozitivna. Če za okužbo ne bi izvedel takrat, bi se to verjetno zgodilo na naslednjem testiranju čez dva meseca, saj je sledil priporočenemu urniku testiranja. V društvu Legebitra moškim, ki imajo spolne odnose z moškimi, namreč svetujejo, da se testirajo na tri mesece. Kot pravi, je imel redno testiranje “vedno v glavi”. “Nič me ne stane, če pridem na testiranje. Že zaradi tega, da sem sam pomirjen. To razumem kot odgovornost do samega sebe in do drugih,” je dejal.
Diagnoza ga je šokirala. “Nisem je pričakoval. Verjetno je nihče ne,” se spominja. Simptomov takrat namreč ni povezoval z okužbo s hivom. “Nato pa greš čez nekaj faz. Najprej, da se sprijazniš s tem in si rečeš, da ni konec sveta,” je izpostavil. Prepričan je, da se vse zgodi z razlogom, zato vedno poskuša najti pozitivno plat. Sedaj dela kot svetovalec v društvu Legebitra, pristaja pa tudi na intervjuje, saj se čuti dovolj opolnomočenega, da spregovori kot oseba s hivom. “Čas je, da damo glas tudi njim,” je prepričan.
S zdravljenjem je začel že na dan diagnoze in od takrat vsak dan ob isti uri vzame dve tableti, kot antibiotike. “Pride v navado, a imam še vedno nastavljeno budilko, ker v tem ritmu življenja, ko si nenehno v pogonu, lahko hitro pozabiš,” je dejal.
Ob začetku jemanja zdravila je občutil nekaj stranskih učinkov kot sta slabost in utrujenost, ki sta minili. Na polletnih pregledih na infekcijski kliniki preverijo krvno sliko ter stanje ledvic in jeter. “Če bi bila kakršnakoli odstopanja, bi zamenjali terapijo,” je dejal.
“Tako z osebnim zdravnikom kot infektologom imam zelo dobre odnose. Imam tudi osebno številko infektologa in če kdaj kaj potrebujem, lahko z njim vedno vstopim v stik,” izkušnje z zdravstvenim sistemom opisuje Sebastjan. Za potrebno kirurško odstranitev zoba pa je bil naročen zadnji na vrsti. “To je še vedno del stigme, ampak bolje, da te po nekih zastarelih protokolih vzame zadnjega na vrsti, kot da me na licu mesta zavrne zaradi neupravičenega razloga,” je bil optimističen.
Ocenjuje, da je spolnost še vedno tabu tema tudi v pogovoru z osebnim zdravnikom. “To je izgubljena priložnost. Če si odkrit do osebnega zdravnika, lahko primeru simptomov posumi in ustrezno ukrepa,” je poudaril.
Za diagnozo vedo njegova mama in prijatelji, pa tudi znotraj skupnosti. “Svojega statusa niti ne skrivam. Če me nekdo vpraša, mu to tudi povem,” je še dejal. Po njegovem mnenju se načeloma ve, kako se bolezen prenaša, manjka pa ozaveščenosti, da zdravljena oseba hiva ne more prenašati naprej. “Treba je verjeti znanosti, ne pa lastnim predsodkom,” je še izpostavil.
“,STA,1543411920,1543411920,sl,13678,306,13677,43,0,NULL,,”Boj proti aidsu: Testiranje je odgovornost do samega sebe in do drugih”,boj-proti-aidsu-testiranje-je-odgovornost-do-samega-sebe-in-do-drugih,Post,,1,0,1545140012,1545140013
467,13680,”Boj proti aidsu: Štiri desetletja po odkritju hiva izzivi ostajajo (ozadje)”,”Prvega decembra obeležujemo mednarodni dan boja proti aidsu, ki ga je leta 1988 razglasila Svetovna zdravstvena organizacija. “,”
Ljubljana, 29. novembra (STA) – Prvega decembra obeležujemo mednarodni dan boja proti aidsu, ki ga je leta 1988 razglasila Svetovna zdravstvena organizacija. Čeprav se z leti zmanjšuje število na novo okuženih in je tudi zaradi učinkovitih zdravil vse manj smrti za posledicami aidsa, strokovnjaki opozarjajo, da bi vse težko pridobljene dosežke lahko hitro izgubili. Po svetu je lani živelo 36,9 milijona ljudi, okuženih z virusom hiv, od teh se jih je 21,7 milijona zdravilo z antiretrovirusno terapijo. Za posledicami aidsa je lani umrlo 940.000 ljudi, leta 2016 pa 50.000 več. Na novo se je s hivom okužilo 1,8 milijona oseb, kažejo zadnji podatkih programa Združenih narodov za boj proti hivu in aidsu (UNAIDS). Tri četrtine okuženih oseb pozna svoj status.
V Evropi je bilo po podatkih Svetovne zdravstvene organizacije (WHO) lani na novo diagnosticiranih okoli 160.000 oseb, skoraj 130.000 v vzhodnem delu Evrope. Janez Tomažič z infekcijske klinike opozarja, da na primer v Rusiji stigma in družbene razmere popolnoma onemogočajo obvladovanje okužb s hivom. Med drugim kaznovalna politika v državi uživalce drog, med katerimi je okužba najbolj razširjena, sili v skrivanje, pri tem pa okužijo partnerje.
V državah članicah EU pa je po drugi strani število novih diagnoz močno upadlo, med moškimi, ki imajo spolne odnose z moškimi, od leta 2015 kar za petino. Izziv v boju proti aidsu v Evropi še vedno ostaja pozna diagnoza. Vsaka druga oseba je namreč diagnosticirana s hivom, ko je okužba že dosegla napredovano stopnjo.
Učinkovita zdravila niso vsem enako dostopna
Kljub vse večji dostopnosti učinkovitih načinov za preprečevanje novih okužb s hivom in napredka v zdravljenju v zadnjih letih pa se nove okužbe med mlajšimi odraslimi po svetu niso pričakovano zmanjšale. Deklaracija ZN o zavezi k soočanju z epidemijo hiva in aidsa iz leta 2016 namreč predvideva zmanjšanje novih okužb na manj kot pol milijona do leta 2020.
Po svetu namreč še vedno obstajajo velike razlike glede dostopnosti zdravil. V zahodni in osrednji Afriki ima do antiretrovirusne terapije, s katerimi se preprečuje razvoj aidsa, dostop samo 40 odstotkov okuženih s hivom. Pri tem so še posebej zaskrbljujoče razmere v Nigeriji, kjer so po podatkih UNAIDS zabeležili skoraj polovico novih okužb v regiji.
Hiv je ob zgodnjem odkritju okužbe in rednem zdravljenju sicer popolnoma obvladljiva okužba, ki se zdravljena ne more prenašati naprej. Od prvih zdravil, ki so imela precejšnje stranske učinke in je bilo na dan treba jemati več različnih tablet, so najnovejše terapije običajno združene v eni tableti z le malo neželenimi učinki in malo součinkovanji z drugimi zdravili. Kljub zdravljenju pa se po besedah Tomažiča osebe s hivom starajo nekoliko hitreje in se bolezni starejših pri njih pojavijo prej kot pri osebah brez okužbe.
Sodobna zdravila omogočajo zaščito pred hivom že pred samo izpostavitvijo. Priporočajo jih predvsem osebam s tveganim spolnim vedenjem, najpogosteje so to moški, ki imajo spolne odnose z moškimi in pogosto menjavajo partnerje. Še vedno pa je najbolj poceni, preprost in učinkovit preventivni ukrep uporaba kondoma, ki učinkovito ščiti tudi pred drugimi spolno prenosljivimi okužbami, kot so gonoreja, sifilis ter hepatitisa B in C.
Od odkritja virusa že skoraj štiri desetletja
Do okužbe z virusom hiv namreč najpogosteje pride pri nezaščitenih spolnih odnosih z okuženo osebo in ob izpostavljenosti okuženi krvi, predvsem pri souporabi okuženih igel za injiciranje drog. Možen je tudi prenos z okužene matere na otroka med nosečnostjo, med porodom ali z dojenjem.
Prvi primeri tedaj še neznane bolezni so zdravniki opazili leta 1981 v Los Angelesu, kmalu pa so o podobnih ugotovitvah poročali še iz drugih delov ZDA in zahodne Evrope. Med obolelimi so izstopali predvsem moški, ki so imeli spolne odnose z moškimi, in uživalci trdih drog. Bolezen se je pojavila tudi med bolniki s hemofilijo in heteroseksualnimi osebami, pri čemer je postalo jasno, da se neznana bolezen prenaša preko telesnih tekočin. Povzročitelja skrivnostne bolezni, virus hiv, je francoskih znanstvenikom uspelo identificirati leta 1983.
“,STA,1543498500,1543498500,sl,13680,306,13679,43,0,NULL,,”Boj proti aidsu: Štiri desetletja po odkritju hiva izzivi ostajajo (ozadje)”,boj-proti-aidsu-stiri-desetletja-po-odkritju-hiva-izzivi-ostajajo-(ozadje),Post,,1,0,1545140290,1545140291
468,13682,”Na okrogli mizi STAkluba danes tudi o življenju z virusom hiv”,”Več kot 30 let po odkritju virusa hiv se je zaradi učinkovitih zdravil življenjska doba okuženih močno podaljšala, kakovost njihovega življenja pa izboljšala. “,”
Ljubljana, 27. novembra (STA) – Več kot 30 let po odkritju virusa hiv se je zaradi učinkovitih zdravil življenjska doba okuženih močno podaljšala, kakovost njihovega življenja pa izboljšala. Kljub temu pa se okuženi še vedno srečujejo z mnogimi težavami, predvsem v družbenem okolju. O tem, zakaj je hiv danes še vedno aktualen, bodo spregovorili udeleženci današnjega STAkluba. Poskušali bodo odgovoriti na vprašanja, zakaj neozaveščenost predstavlja tveganje predvsem za mlade, zakaj je pomembno zgodnje prepoznavanje okužbe, kje je Slovenija na področju preventive in zdravljenja ter zakaj je stigma v družbi še vedno prisotna.
Janez Tomažič s klinike za infekcijske bolezni in vročinska stanja Univerzitetnega kliničnega centra Ljubljana namreč opaža, da bolj kot sam virus težave povzročajo ljudje iz okolice okužene osebe. “Ljudje se še vedno zavestno ali podzavestno bojijo nalezljive smrti,” je pojasnil za STA. Stigma je po njegovi oceni še vedno najhujša postranska škoda bolezni oseb, ki so okužene z virusom hiv.
Osebe okužbo zato skrivajo pred domačimi, prijatelji in sodelavci ter tudi pred zdravstvenimi delavci. “Če o tem vprašam svoje varovance, pravijo, da jim težav ne povzročajo zdravila in obiskovanje zdravnikov. Večina vseh težav je stigma in strah pred socialno osamitvijo, verbalnimi namigovanji, čudnimi pogledi,” je še dejal Tomažič.
Po oceni Nacionalnega inštituta za javno zdravje (NIJZ) v Sloveniji živi okoli tisoč oseb, okuženih s hiv, med njimi pa približno tretjina za svojo okužbo sploh ne ve. Tudi stigma, diskriminacija in strah namreč otežujejo preventivo, saj zaradi pretiranega strahu pred pozitivnim izidom na testiranje pridejo prepozno. Za uspešno zdravljenje in preprečevanje nadaljnjih okužb je namreč ključno takojšnje testiranje.
Tomažiču se bosta na današnji okrogli mizi pridružili tudi nacionalna koordinatorica zdravstvene vzgoje za hiv/aids na NIJZ Evita Leskovšek in Tanja Povšič iz programa Mladi, zdravi in ozaveščeni Mestne zveze prijateljev mladine Ljubljana. Prek video prispevka se bo v pogovor vključil tudi Mitja Ćosić iz društva Legebitra.
“,STA,1543326360,1543326360,sl,13682,306,13681,43,0,NULL,,”Na okrogli mizi STAkluba danes tudi o življenju z virusom hiv”,na-okrogli-mizi-stakluba-danes-tudi-o-zivljenju-z-virusom-hiv,Post,,1,0,1545140862,1545140863
469,13684,”Boj proti aidsu: Varna spolnost se začne z zaščito”,”Po svetu kljub upadanju novih okužb z virusom hiv narašča število okužb z drugimi spolno prenosljivimi boleznimi.”,”
Ljubljana, 30. novembra (STA) – Po svetu kljub upadanju novih okužb z virusom hiv narašča število okužb z drugimi spolno prenosljivimi boleznimi. Najzanesljiveje se lahko zaščitimo z uporabo kondoma. Pomembno vlogo o izobraževanju o zdravi in varni spolnosti v Sloveniji imajo različni prostovoljski projekti, saj te vsebine niso del rednega predmetnika v šolah. Spolno prenosljive okužbe, kot so virusni hepatitisi, gonoreja, sifilis in klamidijske okužbe, po vsem svetu in tudi v Sloveniji naraščajo, kažejo podatki Nacionalnega inštituta za javno zdravje (NIJZ). Najboljšo zaščito pred njimi pa tudi pred virusom hiv še vedno prinaša uporaba kondoma.
Razlogi za zvišanje spolno prenosljivih okužb v Sloveniji so po oceni Mojce Matičič s klinike za infekcijske bolezni in vročinska stanja Univerzitetnega kliničnega centra Ljubljana prav taki kot drugod po svetu. Vse bolj namreč popušča strah pred aidsom oziroma ga mlajše generacije sploh ne poznajo. Konec prejšnjega tisočletja je po njenih besedah namreč ravno strah pred okužbo s hivom spodbudil k zaščitenim spolnim odnosom in manj tveganemu spolnemu vedenju.
Med razlogi za več spolno prenosljivih okužb Matičičeva našteva tudi uporabo raznih pripomočkov za sproščeno spolnost, s katerimi popustijo zavore oziroma misel na možno tveganje pri spolno prenosljivih okužbah, in mobilnih aplikacij, ki vabijo k pogosto samo enkratnim spolnim odnosom z neznano osebo, katere zdravstvenega ozadja ne poznamo. Prav tako so, kot kažejo številne študije, tvegani spolni odnosi pogosti na potovanjih, je še izpostavila Matičičeva.
Starost, pri kateri imajo ljudje prvi spolni odnos, je v Sloveniji padla, zgodnja spolna aktivnost pa je povezana s tveganim vedenjem, kot so številnejši spolni partnerji, manjša uporaba kondoma, večji delež spolno prenosljivih okužb in neželene nosečnosti. Na NIJZ sicer ocenjujejo, da je večina mladih predvsem zaradi kampanj ob mednarodnem dnevu boja proti aidsu dobro informirana o hivu oziroma aidsu, a hkrati opozarjajo na slabo poznavanje drugih spolno prenosljivih okužb.
V Sloveniji vzgoja za zdravo spolnost ni del rednega predmetnika. “Kljub številnim prizadevanjem za izobraževanje izvajalcev vzgoje za zdravo spolnost in razvoju gradiv na področju spolne vzgoje, še vedno opažamo velika odstopanja v izvajanju,” so na NIJZ zapisali za STA.
Tri četrtine mladih, ki je zgodaj imelo spolni odnos, meni, da bi o spolnosti morali vedeti več. Med temi jih je večina dejala, da bi o spolnosti najraje izvedeli več od staršev in pri spolni vzgoji v šoli. Raziskava o spolni vzgoji med slovenskimi srednješolci je tudi pokazala, da sta skoraj dve tretjini informacije o spolnosti dobili prek interneta, kjer pa te niso vedno preverjene in strokovno korektne.
Izobraževalno vrzel na tem področju poskušajo zapolniti različni projekti izven šolskih učnih načrtov, kot sta projekt Mladi, zdravi in ozaveščeni Mestne zveze prijateljev mladine Ljubljana ter projekt Virus Društva študentov medicine Slovenije, ki na šolah izvajata delavnice o varni in zdravi spolnosti.
Kot je za STA pojasnila Lučka Marija Neudauer, so s projektom Virus, ki danes deluje na področju celotnega reproduktivnega zdravja, študenti medicine začeli pred 20 leti v okviru boja proti aidsu. V zadnjih letih pa so ena njihovih glavnih aktivnosti ravno delavnice varne spolnosti za dijake in učence.
Ti predznanje na tem področju zagotovo imajo, a kot je poudarila Neudaurejeva, je to generacija, ki veliko informacij dobi na spletu. “Pomembno je, da imajo nekoga, ki mu dovolj zaupajo, da ga te stvari upajo vprašati. Pogosto smo to ravno mi, saj je naša prednost, da smo jim po letih bližje in nas dojemajo kot mlade odprte osebe, poleg tega pa nas za razliko od njihovih profesorjev ne poznajo,” je še dejala. Tanja Povšič iz programa Mladi, zdravi in ozaveščeni pa poudarja, da lahko ključno vlogo pri pogovorih o spolnosti odigrajo tudi starši.
“,STA,1543585680,1543585680,sl,13684,306,13683,43,0,NULL,,”Boj proti aidsu: Varna spolnost se začne z zaščito”,boj-proti-aidsu-varna-spolnost-se-zacne-z-zascito,Post,,1,0,1545140987,1545140988
470,13686,”V šolskih in vrtčevskih obrokih dovolj sadja in zelenjave, a premalo rib in belega mesa”,”Spremljanje skladnosti šolske in vrtčevske prehrane s smernicami, ki ga je lani v 92 šolah in vrtcih opravil NIJZ”,”
Ljubljana, 26. novembra (STA) – Spremljanje skladnosti šolske in vrtčevske prehrane s smernicami, ki ga je lani v 92 šolah in vrtcih opravil NIJZ, je pokazalo, da obroki otrok in dijakov vsebujejo dovolj sadja in zelenjave, premalo pa rib in belega mesa. Preveč je pekovskih in slaščičarskih izdelkov. Otroci najpogosteje zavračajo zelenjavo in juhe, najredkeje pa sadje in meso. Kot je zapisano v poročilu, ki ga je po koncu strokovnega spremljanja pripravil Nacionalni inštitut za javno zdravje (NIJZ), velika večina zavodov oz. 77 odstotkov pripravlja vse obroke, ki jih priporočajo smernice zdravega prehranjevanja ministrstva za zdravje iz leta 2005, pri čemer ima večina zavodov urnik obrokov tudi sestavljen tako, da je med obroki vsaj dve uri presledka.
Pri vsakem obroku otroci in učenci po ugotovitvah NIJZ dobijo precejšen delež sadja ali zelenjave, so pa manj pogosto od priporočenega pri obrokih zastopane ribe in ribje jedi. Enako velja za belo meso in “izdelke z vidno strukturo”. Za belo meso in izdelke z vidno strukturo je namreč priporočilo, da se pojavljajo pri 40 odstotkih dnevnih obrokov, podatki pa kažejo, da so prisotni pri 28 odstotkih kosil, v 10 odstotkih dopoldanskih malic in v le treh odstotkih popoldanskih malic, so navedli na NIJZ.
Tudi polnozrnati izdelki v obroke niso vključeni tako pogosto, kot naj bi bili. Polnozrnate izdelke naj bi namreč otroci in učenci uživali pri polovici vseh obrokov, rezultati pregleda pa kažejo, da so vključeni v 42 odstotkov dopoldanskih malic, 28 odstotkov popoldanskih malic in 26 odstotkov kosil.
Na drugi strani se nekatera živali na mizah v vrtcih in šolah pojavljajo v večji meri, kot je priporočeno. Slednje velja za pekovske in slaščičarske izdelke z višjo vsebnostjo sladkorja in maščob, vključno z industrijskimi deserti in sladkarijami, ter za mlečne izdelke z dodanimi sladkorji in večjo vsebnostjo aditivov. Strokovnjaki NIJZ tudi ugotavljajo, da so “mesni izdelki s homogeno strukturo” ali večjo vsebnostjo maščob prepogosto vključeni v dopoldanske malice in kosila.
Pri strokovnem spremljanju 92 zavodov so na NIJZ preverjali tudi, katero hrano otroci in učenci najpogosteje zavračajo. Ugotovili so, da najpogosteje zavračajo zelenjavo in zelenjavne jedi ter različne vrste juh, najredkeje pa sadje in sadne jedi ter meso in mesne jedi. Ugotovili so tudi, da večina zavodov nabavi do 12 odstotkov ekoloških živil ter od 10 do 40 odstotkov lokalnih živil.
Na splošno pa na NIJZ ugotavljajo, da sta šolska in vrtčevska prehrana v slovenskem šolskem sistemu organizacijsko in zakonodajno dobro urejeni, primerno pozornost pa jima posvečajo tudi nacionalni strateški dokumenti.
“,STA,1543240440,1543240440,sl,13686,306,13685,43,0,NULL,,”V šolskih in vrtčevskih obrokih dovolj sadja in zelenjave, a premalo rib in belega mesa”,v-solskih-in-vrtcevskih-obrokih-dovolj-sadja-in-zelenjave-a-premalo-rib-in-belega-mesa,Post,,1,0,1545141335,1545141335
471,13688,”Dokler bodo ljudje umirali v nesrečah, povezanih z alkoholom, težko govorimo o uspehu alkoholne politike”,”Prekomerno pitje alkohola je vzrok velikega števila smrti v Sloveniji.”,”
Ljubljana, 26. novembra (STA) – Prekomerno pitje alkohola je vzrok velikega števila smrti v Sloveniji. V zadnjih nekaj letih se je na področju alkoholne politike sicer pojavilo več uspešnih praks, a dokler bodo ljudje umirali v nesrečah, povezanih z alkoholom, se ne da govoriti o uspehu, je opozorila državna sekretarka na ministrstvu za zdravje Pia Vračko. “Uspeh bo, ko bo ta številka nič,” je na letošnji, že 4. nacionalni konferenci o alkoholni politiki, poudarila državna sekretarka na ministrstvu za zdravje Pia Vračko. Po njenem mnenju bi morala družba imeti ničelno toleranco do tovrstnih primerov, prepovedati pa bi bilo treba tudi prodajo alkoholnih pijač na bencinskih servisih.
Državna sekretarka je izpostavila več uspešnih projektov na področju alkoholne politike, med katere sodi projekt NIJZ SOPA – Skupaj za odgovoren odnos do pitja alkohola. Osnovni namen projekta je zmanjšati prekomerno pitje alkohola pri odraslih prebivalcih Slovenije ter s tem preprečiti negativne posledice, ki jih ima na posameznika in njegove svojce tvegano in škodljivo pitja alkohola.
V Slovenji samo zaradi bolezni in stanj, ki so izključno povezana z alkoholom, ter prometnih nesreč, ki jih povzročijo alkoholizirani vozniki, letno v povprečju umre vsaj 1000 oseb. Alkohol pogosto vodi tudi v druge oblike nasilja. Ravno zato je osrednja tema letošnje konference povezava med alkoholom in nasiljem.
Alkoholna politika je po besedah Vračkove politično in interesno področje, kjer ni mogoče pričakovati hitrih rezultatov. Gre za trd oreh, ki zahteva inovativnost. Za inovativnost pa bi morali sodelovati vsi – družba, mediji, interesne skupine in politika. “Skupaj smo močnejši,” je svoj govor zaključila državna sekretarka.
Pomembnost sodelovanja je izpostavila tudi direktorica Nacionalnega inštituta za javno zdravje (NIJZ) Nina Pirnat. Kot pravi, vsak doprinos k zmanjšanju pitja alkohola šteje. Alkohol v Sloveniji namreč predstavlja velik problem, saj podatki kažejo, da skoraj polovica prebivalcev Slovenije (43 odstotkov) starih 25 do 64 let pije visoko tvegano, vsak drugi 17-letnik pa je bil v življenju že vsaj dvakrat opit.
Alkohol pogosto vodi tudi v nasilje, a je z alkoholom povezano nasilje pogosto neprepoznano in se kaže v različnih oblikah in na različnih ravneh, je izpostavila Pirnatova.
O težavah, ki jih povzroča alkohol, so spregovorili tudi udeleženci okrogle mize z naslovom Nasilje v povezavi z alkoholom: zdravstveni in družbeni problem. Sogovorniki so kot možne rešitve za tovrstne težave med drugim izpostavili omejevanje dostopa do alkohola, predvsem mladim, in prepoved pitja alkohola na javnih mestih po vsej Sloveniji. Tako so kot primer dobre prakse izpostavili javni odlok občine Jesenice o prepovedi pitja alkohola na vseh javnih površinah v občini.
Sodeč po besedah Boštjana Omerzela z Medobčinksega inšpektorata in redarstva na občini Jesenice se je že zmanjšalo število incidentov povezanih s pitjem alkohola na javnih krajih. Ta odlok se je izkazal kot uspešen tudi v času evropskega prvenstva v košarki, ko je bil iznos alkohola z dveh posebej določenih navijaških območij prepovedan. V tem času večjih kršitev javnega reda in miru zaradi alkohola niso zabeležili, je na okrogli mizi dejal Omerzel.
“Posledice pitja alkohola so številne in predstavljajo veliko breme za našo državo,” je še opozorila direktorica NIJZ. Škoda, povezana z alkoholom, predstavlja tudi veliko finančno breme za državo. Zdravstveni stroški, povezani s pitjem alkohola, so po oceni NIJZ v letih 2012-2016 v povprečju znašali 147 milijonov evrov letno. Če se k temu prišteje še grobo oceno drugih stroškov, kot so prometne nezgode, nasilje v družini in kriminalna dejanja, se ta številka poveča na kar 228 milijonov evrov, so v sporočilu za medije zapisali na nacionalnem inštitutu.
A Pirnatovo zelo veseli podpora slovenske javnosti ukrepom alkoholne politike. Kar 83 odstotkov Slovencev namreč podpira uvedbo obveznega navajanja sestavin in energijske vrednosti na embalaži alkoholnih pijač, 65 odstotkov pa jih podpira ničelno toleranco do alkohola za vse voznike, je še izpostavila direktorica nacionalnega inštituta.
“,STA,1543240620,1543240620,sl,13688,306,13687,43,0,NULL,,”Dokler bodo ljudje umirali v nesrečah, povezanih z alkoholom, težko govorimo o uspehu alkoholne politike”,dokler-bodo-ljudje-umirali-v-nesrecah-povezanih-z-alkoholom-tezko-govorimo-o-uspehu-alkoholne-politike,Post,,1,0,1545141492,1545141492
472,13690,”Mladoletnim in opitim je alkohol v lokalih še vedno preveč dostopen”,”Mladoletne osebe in opiti lahko danes v lokalih kljub prepovedi sorazmerno lahko pridejo do alkohola”,”
Ljubljana, 26. novembra (STA) – Mladoletne osebe in opiti lahko danes v lokalih kljub prepovedi sorazmerno lahko pridejo do alkohola, slednje pa bo mogoče spremeniti le s skupno in usklajeno akcijo vseh pristojnih, so ugotavljali na današnji okrogli mizi Nacionalnega inštituta za javno zdravje (NIJZ) o odgovorni strežbi alkohola. Po besedah Nataše Blažko z ministrstva za zdravje je v Sloveniji prepovedana prodaja alkohola mladoletnim osebam in opitim v lokalih, nadzor nad tem pa izvajata inšpektorat in policija. Pri tem se njihovi rezultati precej razlikujejo od dejanskih rezultatov na terenu. Ti namreč kažejo, da lahko mladoletni in opiti do alkohola pridejo precej lažje, je dejala.
Raziskava, ki jo je v nočnih lokalih v občini Kranj opravil Inštitut Utrip, je namreč po besedah njegovega predstavnika Mateja Koširja pokazala, da lokali mladoletnim in opitim praktično ne zavrnejo pijače. Ne zavrnejo je niti takrat, ko je jasno, da bodo ti nato vozili. Zavrnili so jo namreč le v 145 od 150 poskusov v raziskavi, ki so jo izvedli s pomočjo igralcev, pa še to šele takrat, ko je šlo za visoko opite osebe, je dejal.
Na drugi strani po besedah Barbare Kocjan inšpektorji zdravstvenega inšpektorata ugotovijo kršitve le v enem odstotku nadzorov. Letno namreč izvedejo od 3500 do 4000 nadzorov, pri čemer ugotovijo le od 30 do 40 kršitev.
In kaj je razlog, da lahko mladoletni in opiti do alkohola v gostinskih lokalih pridejo relativno lahko? Gostinec Matej Pust meni, da je težava pri opitih pogosto v tem, da nekateri dobro skrijejo opitost, po besedah Koširja pa tudi ta, da gostinci opitim dajo pijačo, ker ne želijo imeti težav z njimi. Pri mladoletnih osebah je po oceni Lucije Pečlin iz Mladinske zveze Brez izgovora Slovenija razlog ta, da natakarji pogosto sploh ne razmišljajo, ali gre za mladoletno osebo ali ne.
Po besedah Petra Mihelčiča z Višje strokovne šole za gostinstvo skušajo tudi zato turistične delavce vzgajati v duhu odgovorne strežbe. Skušajo jih naučiti, da je lahko točenje alkohola mladoletnim in opitim škodljivo tudi za sam lokal, saj lahko pride do primerov, ki se končajo tragično, je dejal.
Po Koširjevih besedah bi bilo mogoče težavo reševati tudi tako, da bi se pristojne institucije in drugi bolj vključili v reševanje problematike ter da bi pri tem nastopali usklajeno in enotno.
S tem se je strinjala tudi Branka Božank z NIJZ, ki tudi meni, da se ni mogoče izgovarjati, da se nič ne more narediti, ker pač živimo v takšni kulturi. “Z nekimi skupnimi in usklajenimi aktivnostmi lahko ta odnos spremenimo,” je dejala.
Okroglo mizo je NIJZ pripravil v okviru nacionalne konference o alkoholni politiki, ki je danes potekala v Ljubljani.
“,STA,1543240680,1543240680,sl,13690,306,13689,43,0,NULL,,”Mladoletnim in opitim je alkohol v lokalih še vedno preveč dostopen”,mladoletnim-in-opitim-je-alkohol-v-lokalih-se-vedno-prevec-dostopen,Post,,1,0,1545141583,1545141584
473,13692,”Stopnja umrljivosti novorojenčkov v Evropi se niža, narašča starost mater ob rojstvu”,”Evropsko poročilo o zdravstvenem stanju nosečnic in novorojenčkov za leto 2015 kaže, da se stopnja umrljivosti novorojenčkov niža. “,”
Ljubljana, 26. novembra (STA) – Evropsko poročilo o zdravstvenem stanju nosečnic in novorojenčkov za leto 2015 kaže, da se stopnja umrljivosti novorojenčkov niža. Narašča pa starost mater ob rojstvu, saj se je med letoma 2010 in 2015 delež mater, starejših od 35 let, povečal za 16 odstotkov. Po drugi strani je nosečnost v najstniških letih v Evropi vse manj običajna. Kot so sporočili iz Univerzitetnega kliničnega centra (UKC) Ljubljana, podatki iz danes objavljenega poročila še kažejo, da je bila stopnja umrljivosti pred oziroma ob rojstvu in umrljivosti pri novorojenčkih leta 2015 v primerjavi z letom 2010 v Evropi nižja, vendar sta se stopnja in obseg zmanjšanja močno razlikovala med državami. V Sloveniji je bila stopnja mrtvorojenosti po 28. tednu leta 2015 2,4 na 1000 rojenih otrok, kar je manj od evropske mediane, ki znaša 2,7 na 1000 rojenih otrok.
V Sloveniji je neonatalna umrljivost, torej prvih 28 dni po rojstvu, najnižja v Evropi in znaša 0,7 na 1000 živorojenih otrok, medtem ko je mediana za Evropo 2,2 na 1000 živorojenih otrok. Mediana umrljivosti dojenčkov do enega leta starosti je bila v Evropi 3,1 na 1000 živorojenih otrok, v Sloveniji pa 1,7 na 1000 živorojenih otrok.
V letu 2015 je 27 odstotkov Evropejk rodilo s carskim rezom, v Sloveniji pa 21,3 odstotka žensk. Na Islandiji, Finskem, Norveškem in Nizozemskem je ta delež nižji od 18 odstotkov. V Italiji, Romuniji, Bolgariji ter na Madžarskem, Poljskem in Cipru pa je delež porodov s carskim rezom višji od 35 odstotkov.
V Evropi tudi narašča starost mater ob rojstvu. Na splošno se je med letoma 2010 in 2015 odstotek mater, starih 35 let ali več, povečal za 16 odstotkov, največ na Cipru, na Madžarskem, Češkem in Portugalskem. V Sloveniji je bilo leta 2015 18,7 odstotka porodnic starejših od 35 let, odstotek pa se stalno povečuje.
Nosečnost v najstniških letih je v Evropi vse manj običajna. V 21 državah je bilo ob rojstvu otroka manj kot tri odstotke žensk mlajših od 20 let. Ta odstotek je v nekaj državah presegel šest odstotkov, in sicer na Slovaškem, Madžarskem, v Romuniji in Bolgariji.
Debelost v nosečnosti narašča, a je ne beležijo vsi. V Sloveniji je leta 2015 9,6 odstotka nosečnic imelo indeks telesne mase nad 30.
Zdravstveno stanje nosečnic, mater in novorojenčkov so eni od ključnih kazalcev zdravja in zdravstvene oskrbe prebivalstva. Poročilo o perinatalnem zdravju v letu 2015 je nastalo v okviru projekta Euro-Peristat in je četrto tovrstno poročilo ter tretje pri katerem je sodelovala Slovenija kot članica EU. Za izdelavo poročila je podatke iz svojih nacionalnih statističnih sistemov posredovalo več kot 100 sodelujočih članov iz vseh sedanjih držav članic EU ter Islandije, Norveške in Švice.
Poročilo bodo predstavili tudi na četrtkovi novinarski konferenci na ginekološki kliniki UKC Ljubljana.
“,STA,1543240800,1543240800,sl,13692,306,13691,43,0,NULL,,”Stopnja umrljivosti novorojenčkov v Evropi se niža, narašča starost mater ob rojstvu”,stopnja-umrljivosti-novorojenckov-v-evropi-se-niza-narasca-starost-mater-ob-rojstvu,Post,,1,0,1545141667,1545141667
474,13694,”V Franciji kondomi tudi na recept”,”V Franciji bodo v boju proti aidsu kondomi po novem na voljo tudi na recept, je danes sporočila francoska ministrica za zdravje Agnes Buzy.”,”
Pariz, 27. novembra (STA) – V Franciji bodo v boju proti aidsu kondomi po novem na voljo tudi na recept, je danes sporočila francoska ministrica za zdravje Agnes Buzy. Zdravniki bodo lahko predpisali določeno znamko kondomov, ki je ministrica ni navedla. Kot je pojasnila, je agencija za zdravje izdala pozitivno mnenje za predpisovanje kondomov poceni blagovne znamke na recept. Po besedah ministrice bodo zdaj lahko vsi, mladi, zdravstveno ogroženi, ženske in moški, odšli k svojemu zdravniku, ki jim bo lahko predpisal brezplačne kondome, poroča francoska tiskovna agencija AFP.
“Vsako leto odkrijemo 6000 novih primerov okužbe z virusom hiv, predvsem pri mladih, med 800 in 1000 primeri pri mlajših od 25 let, ki pogosto uporabijo kondom pri prvem spolnem odnosu, kasneje pa ne več,” je še povedala ministrica.
“,STA,1543327260,1543327260,sl,13694,306,13693,43,0,NULL,,”V Franciji kondomi tudi na recept”,v-franciji-kondomi-tudi-na-recept,Post,,1,0,1545141749,1545141749
475,13696,”Ljubljanska porodnišnica z novim aparatom za neinvazivno podporo dihanju novorojenčkov”,”Ljubljanska porodnišnica je danes prejela nov aparat, ki najmanjšim nedonošenčkom nudi nežno, neinvazivno podporo dihanju. “,”
Ljubljana, 27. novembra (STA) – Ljubljanska porodnišnica je danes prejela nov aparat, ki najmanjšim nedonošenčkom nudi nežno, neinvazivno podporo dihanju. Aparat bo omogočil še bolj varno oskrbo za dlan velikih malčkov v porodnišnici, medicinskemu osebju pa olajšal delo z nedonošenčki, so danes sporočili iz Društva za pomoč prezgodaj rojenim otrokom. V ljubljanski porodnišnici se rodi tretjina slovenskih novorojenčkov. Med njimi je vsako leto tudi okrog dvesto nedonošenčkov, ki ob rojstvu tehtajo manj kot 1,5 kilograma. Najmanjših, velikih komaj za dlan in težkih manj kot kilogram pa je več kot 80.
Ker je za oskrbo teh drobižkov pomembna odlična opremljenost oddelka z aparaturami in izobraženo ter izkušeno medicinsko osebje, v Sloveniji že več kot 30 let izvajajo t.i. transport in utero, kar pomeni, da nosečnice, ki jim grozi zelo prezgodnji porod, iz ostalih slovenskih porodnišnic premeščajo v ljubljansko, je navedla predsednica društva Lilijana Kornhauser Cerar, ki je tudi vodja službe za neonatologijo KO za perinatologijo ljubljanske ginekološke klinike.
Na ta način je mesto rojstva za njih hkrati tudi najbolj varen kraj, kjer prebivajo prve tedne ali mesece po rojstvu. V zadnjih letih se na kliniki po njenih besedah vse bolj zavedajo, kako je za te ranljive nedonošenčke pomembna čim manj agresivna oskrba.
Kadar zaradi nezrelih pljuč potrebujejo pomoč pri dihanju, jim zato skušajo najprej pomagati z aparatom, ki le podpira njihovo dihanje z nadtlakom ter nežno vpihuje mešanico ogretega ovlaženega zraka in kisika v dihala.
Ker denar Univerzitetnega kliničnega centra Ljubljana pogosto ne zadošča niti za nadomestitev starih, že odsluženih aparatov, so po njenih besedah zelo hvaležni donatorjem, tokrat družbi T2, ki je v okviru projekta T-2 življenje, prepoznalo njihovo stisko, zbralo denar za nakup aparata in pomagalo za varnejšo pot v življenje novorojenčkov.
Za donacijo se je v imenu ljubljanske bolnišnice zahvalil tudi generalni direktor Aleš Šabeder, ki je dejal, da se sedem odstotkov novorojenčkov rodi prezgodaj in potrebujejo najbolj vrhunsko opremo ter strokovno usposobljeno osebje. “Vsaka donacija, ki prispeva k boljšim pogojem bivanja pacientov in zaposlenih, bolj varni in kakovostni zdravstveni oskrbi, je za nas pomembna,” je poudaril.
“,STA,1543327380,1543327380,sl,13696,306,13695,43,0,NULL,,”Ljubljanska porodnišnica z novim aparatom za neinvazivno podporo dihanju novorojenčkov”,ljubljanska-porodnisnica-z-novim-aparatom-za-neinvazivno-podporo-dihanju-novorojenckov,Post,,1,0,1545141831,1545141832
476,13698,”Boj proti aidsu: Manj novih okužb, a s hivom živijo milijoni”,”Na svetu danes živi okoli 37 milijonov oseb, okuženih z virusom hiv.”,”
Ljubljana, 29. novembra (STA) – Na svetu danes živi okoli 37 milijonov oseb, okuženih z virusom hiv. Število novo diagnosticiranih okužb s hivom in smrti zaradi posledic aidsa, se sicer zmanjšuje, saj so učinkovita zdravila vse bolj dostopna, kažejo podatki programa Združenih narodov za boj proti hivu in aidsu (UNAIDS). STA objavlja tabelo s svetovnimi podatki o številu okuženih z virusom hiv, novih okužb, smrti zaradi aidsa in ljudi, ki imajo dostop do antiretrovirusne terapije, v milijonih.
|
leto |
okuženi |
nove okužbe |
smrt zaradi aidsa |
terapija |
|
2005 |
30,1 |
2,5 |
1,9 |
2,1 |
|
2010 |
32,4 |
2,2 |
1,4 |
8,0 |
|
2015 |
35,6 |
1,9 |
1,0 |
17,2 |
|
2017 |
36,9 |
1,8 |
0,9 |
21,7 |
“,STA,1543500240,1543500240,sl,13698,306,13697,43,0,NULL,,”Boj proti aidsu: Manj novih okužb, a s hivom živijo milijoni”,boj-proti-aidsu-manj-novih-okuzb-a-s-hivom-zivijo-milijoni,Post,,1,0,1545142136,1545142216
477,13700,”S pravočasno diagnozo do 60-odstotne možnosti ozdravitve raka pljuč”,”V Sloveniji za pljučnim rakom vsako leto zboli okoli 1400 ljudi.”,”
Ljubljana, 28. novembra (STA) – V Sloveniji za pljučnim rakom vsako leto zboli okoli 1400 ljudi. Medtem ko število novih primerov pri moških upada, pa pri ženskah še vedno narašča, opozarjajo v Društvu pljučnih in alergijskih bolnikov Slovenije. Čeprav bolezen še ni popolnoma ozdravljiva, pa je s pravočasno ugotovitvijo diagnoze možnost ozdravitve teh bolnikov 60-odstotna. Kot je na novinarski konferenci ob mesecu ozaveščanja o raku pljuč povedal predsednik društva Mirko Triller, pljučni rak ni več tabu, ampak počasi prehaja v kronično obolenje. “Zelo smo veseli že 60-odstotne ozdravitve teh bolnikov, če se pravočasno ugotovi diagnoza,” je pojasnil Triller in dodal, da so uspehi pri zdravljenju te bolezni, tesno povezane s kajenjem, iz meseca v mesec boljši.
Še bolj bi po njegovih besedah napredovali, če bi bila tudi laična javnost nekoliko bolj seznanjena s tem in bi tako razbijala stereotipe o rakih. “Je pa res, da je raka vedno več, bolniki so več ali manj stigmatizirani, pojavlja se depresija,” je dejal in opozoril na “črno piko” oziroma spletne forume, kjer je po njegovem mnenju veliko lažnih informacij.
“Pljučni rak je še vedno ubijalec številka ena med raki. Na začetku bolezen nima specifičnih simptomov, zato je pomembno zgodnje odkrivanje in predvsem zdravljenje pljučnega raka,” je poudarila onkologinja Mirjana Rajer s Klinike Golnik. Kot je izpostavila, nikoli ni dovolj poudarjati, kako sta pljučni rak in kajenje povezana. V bistvu današnje število bolnikov s pljučnim rakom po njenih navedbah odraža kadilske navade 20 ali 30 let nazaj. Če bomo zmanjševali kajenje, bo čez 20, 30 let tudi manj bolnikov s pljučnim rakom, je ocenila.
“A vedno bo nekaj ljudi, denimo okrog 15 odstotkov, ki niso nikoli kadili, niti niso bili izpostavljeni pasivnemu kajenju, zbolelo za pljučnim rakom. Ne vemo točno, kaj na to vpliva, morda zunanji dejavniki, genetika,” je dejala in izpostavila pomen zgodnjega odkrivanja in zdravljenja bolezni.
Na zdravljenje pljučnega raka v Sloveniji Rajerjeva gleda optimistično. Pred desetimi leti je bila na voljo samo kemoterapija, ki je slabo učinkovala, danes pa imamo tarčna zdravila in imunoterapijo, ki precej izboljša diagnozo teh bolnikov, je pojasnila. Poleg tega imajo bolniki veliko manj stranskih učinkov kot pri kemoterapiji.
O življenju s to boleznijo sta spregovorila tudi bolnika s pljučnim rakom. Njuno sporočilo bolnikom je, naj poskušajo aktivno živeti še naprej, predvsem pa naj se o tej smrtonosni bolezni pogovarjajo s svojci, prijatelji in sodelavci.
Na novinarski konferenci so predstavili še novo spletno stran društva, s katero želijo prispevati k lažjemu soočanju in premagovanju bolezni ter boljšemu obvladovanju pljučnega raka v Sloveniji.
“,STA,1543414260,1543414260,sl,13700,306,13699,43,0,NULL,,”S pravočasno diagnozo do 60-odstotne možnosti ozdravitve raka pljuč”,s-pravocasno-diagnozo-do-60-odstotne-moznosti-ozdravitve-raka-pljuc,Post,,1,0,1545142310,1545142311
478,13702,”Pri več kot polovici bolnikov za ankilozirajočim spondiloartritisom bolezen aktivna”,”Društvo revmatikov Slovenije je danes na novinarski konferenci med drugim predstavilo izsledke raziskave med bolniki za vnetno revmatično boleznijo – ankilozirajočim spondiloartritisom pri nas.”,”
Ljubljana, 28. novembra (STA) – Društvo revmatikov Slovenije je danes na novinarski konferenci med drugim predstavilo izsledke raziskave med bolniki za vnetno revmatično boleznijo – ankilozirajočim spondiloartritisom pri nas. Ugotovili so, da ima več kot polovica slovenskih bolnikov, vključenih v raziskavo, aktivno bolezen, so sporočili iz društva. Ankilozirajoči spondilitis je vnetna revmatična bolezen, ki trikrat pogosteje prizadene moške kot ženske. Ker je nevidna bolezen, pogosto prihaja do zakasnitev pri postavitvi diagnoze. Glavni simptom je vnetna bolečina v križu, ki se težko loči od mehanske bolečine v križu, za bolezen pa je značilna vodeča prizadetost hrbtenice. Poleg tega se bolezen praviloma začne v pozni adolescenci oziroma zgodnji odrasli dobi, so v društvu zapisali v sporočilu za javnost.
Umirjenost bolezni se meri z vprašalnikom BASDAI. Če je njegova skupna vrednost manj kot štiri, pomeni, da je bolezen zadovoljivo urejena in vodena. V raziskavi pa so ugotovili, da ima 57,83 odstotka slovenskih bolnikov, vključenih v raziskavo, aktivno bolezen, torej je vrednost indeksa BASDAI nad štiri. “To pomeni, da ti bolniki še vedno trpijo zaradi bolečin,” so poudarili.
Primerna gibalna dejavnost in redna terapija je za bolnike ključna za boljšo kakovost njihovega življenja. Izsledki raziskave društva pa so pokazali, da ima vsak šesti od desetih bolnikov prekomerno težo. K dobremu nadzoru bolezni namreč pripomore tudi ustrezna telesna teža, so izpostavili v društvu.
V primeru neustreznega zdravljenja ima bolezen močan negativni vpliv na kakovost življenja bolnika, ki se sooča z fizičnimi, psihičnimi in socialnimi izzivi. Rezultati raziskave so pokazali tudi, da ima kar 44 odstotkov bolnikov tveganje za pojav psihološkega stresa, zato v društvu menijo, da je pomembna celostna obravnava bolnika.
Društvo je tudi opozorilo, da so vsa revmatična obolenja v javnosti prepoznana kot bolezen starejših, ob pojavu bolečine v sklepih in hrbtenici med mlajšo populacijo pa se to najpogosteje pripiše mehanskim poškodbam, rasti, športnim aktivnostim ali pa pomanjkanju gibanja. “To pa ni vedno ustrezno,” so dodali.
Zato je v prihodnje po mnenju društva potrebno še več pozornosti usmeriti v ozaveščanje in izobraževanje bolnikov in zdravnikov za zgodnje prepoznavanje te bolezni in ločevanje med vnetno in nevnetno bolečino v hrbtenici.
Raziskavo so sicer izvedli v Sloveniji med avgustom in oktobrom 2017 v okviru projekta EMAS – Evropska mapa ankilozirajočega spondilitisa, so še zapisali v sporočilu za javnost.
“,STA,1543391640,1543391640,sl,13702,306,13701,43,0,NULL,,”Pri več kot polovici bolnikov za ankilozirajočim spondiloartritisom bolezen aktivna”,pri-vec-kot-polovici-bolnikov-za-ankilozirajocim-spondiloartritisom-bolezen-aktivna,Post,,1,0,1545206117,1545206118
479,13704,”Slovenija ena najbolj varnih držav za rojevanje, potrebno bi bilo še več preventive”,”Slovenija je ena najbolj varnih držav na svetu za rojevanje, kažejo podatki Evropskega poročila o zdravstvenem stanju nosečnic in novorojenčkov za leto 2015.”,”
Ljubljana, 29. novembra (STA) – Slovenija je ena najbolj varnih držav na svetu za rojevanje, kažejo podatki Evropskega poročila o zdravstvenem stanju nosečnic in novorojenčkov za leto 2015. Še več pa bi morali narediti na področju preventive kajenja in debelosti med nosečnicami, je danes ocenila porodničarka Nataša Tul Mandić. Evropsko poročilo o zdravstvenem stanju nosečnic in novorojenčkov za leto 2015 kaže, da se stopnja umrljivosti novorojenčkov niža. Narašča pa starost mater ob rojstvu, saj se je med letoma 2010 in 2015 delež mater, starejših od 35 let, povečal za 16 odstotkov. Na splošno je nosečnost v najstniških letih v Evropi vse manj običajna.
Kot je na današnji novinarski konferenci Ginekološke klinike Univerzitetnega kliničnega centra Ljubljana izpostavil statistik klinike Ivan Verdenik, je po podatkih za leto 2015 kadilo devet odstotkov nosečnic, desetina pa jih je bilo tako predebelih, da so imele indeks telesne mase več kot 30. Slovenija je sicer pri obeh kazalnikih bistveno bolj uspešna kot mnoge druge evropske države, a prostor za izboljšave je še, je poudarila Tul Mandićeva.
Dokaz je na primer uspeh Švedske in Norveške na področju zmanjševanja deleža nosečnic, ki kadijo. Od leta 2010 do 2015 so v teh dveh državah ta delež zmanjšali s sedem odstotkov na le 3,5 odstotka kadilk med nosečnicami. Po besedah Tul Mandićeve bi potrebovali več sredstev za preventivo, za organizacijo programov za dodatno podporo nosečnicam kadilkam, da bi lažje prenehale s kajenjem. Taki programi bi zagotovo še zmanjšali odstotek nosečnic, ki kadijo, je prepričana.
Še večjo skrb zbuja epidemija debelosti v Evropi, tudi med nosečnicami, je pojasnil Verdenik. Slovenija je z desetimi odstotki nosečnic z indeksom telesne teže več kot 30 sicer še daleč od Anglije, Škotske ali Walesa, kjer je bilo leta 2015 takih že četrtina vseh nosečnic. A delež predebelih nosečnic se povečuje tudi v Slovenji, je opozoril.
Maščoba ni le estetski problem, ženske s preveč maščobnega tkiva in indeksom telesne mase več kot 30 imajo lahko še druge internistične težave, ki privedejo do zapletov v nosečnosti, je razloge za zaskrbljenost ob naraščanju števila predebelih nosečnic pojasnila Tul Mandićeva. Pri predebelih nosečnicah so višji maternalna umrljivost, umrljivost novorojenčkov, pogosteje se jim rodijo pretežki novorojenčki, večkrat je pri takih nosečnicah potreben carski rez.
Otroci predebelih nosečnic so pogosteje tudi pozneje v življenju predebeli. Tul Mandićeva je opozorila, da je zelo pomembno vplivati že na mlade, da bi zanosile z ustrezno telesno maso, to pa je mogoče le z ustrezno preventivo. Kot je poudarila, se ves denar, vložen v preventivo v porodništvu, zelo hitro vrne v obliki boljših rezultatov.
Tul Mandićeva in vodja ljubljanske porodnišnice Gorazd Kavšek sta danes izpostavila tudi pomen spremljanja vseh perinatoloških statističnih podatkov, kar v Sloveniji počnejo že od leta 1987. To je v preteklosti omogočilo, da so še pravočasno zaznali določene neugodne trende in tudi pravočasno ukrepali. Tako so na primer ob prvi zaznavi povečevanja števila carskih rezov v Sloveniji zadeve analizirali in ukrepali.
Slovenija je po deležu carskih rezov v vseh porodih v vrhu evropskih držav, skupaj s Francijo, Norveško, Finsko. Pri nas se namreč opravi okoli 20 odstotkov porodov s carskim rezom. Druga skrajnost so države, kot so Romunija, Bolgarija, Poljska, Ciper, Madžarska in Romunija z 50 in več odstotki porodov s carskim rezom.
Porodničarja sta poudarila, da carski rez velika operacija, ki s seboj prinaša številne dejavnike tveganja in ima lahko za žensko tudi resne zdravstvene posledice, ki trajajo dlje od le nekaj tednov po porodu, vplivajo pa tudi na izid naslednjih porodov. Zato stroka skrbno presoja, kdaj je carski rez potreben.
“,STA,1543478160,1543478160,sl,13704,306,13703,43,0,NULL,,”Slovenija ena najbolj varnih držav za rojevanje, potrebno bi bilo še več preventive”,slovenija-ena-najbolj-varnih-drzav-za-rojevanje-potrebno-bi-bilo-se-vec-preventive,Post,,1,0,1545206242,1545206243
480,13706,”Na evropski konferenci tudi o javnem zdravju v luči migracij in o aktivnem staranju”,”S slovesnim odprtjem se je v Ljubljani danes začela evropska konferenca s področja javnega zdravja, eden največjih tovrstnih dogodkov na evropski ravni, ki bo trajal do sobote. “,”
Ljubljana, 29. novembra (STA) – S slovesnim odprtjem se je v Ljubljani danes začela evropska konferenca s področja javnega zdravja, eden največjih tovrstnih dogodkov na evropski ravni, ki bo trajal do sobote. Nanj je prijavljenih več kot 1600 udeležencev iz 61 držav. Med osrednjimi temami so pomen digitalnega sveta za zdravje mladih, aktivno staranje in zdravje v luči migracij. Zbrane na slovesnosti ob odprtju sta nagovorila evropski komisar za zdravje Vytenis Andriukaitis in evropska komisarka za promet Violeta Bulc. Andriukaitis je med ključnimi dejavniki tveganja za zdravje na evropski ravni izpostavil kajenje, alkohol, debelost in onesnaženost zraka. Kot je dodal za STA, je treba za ohranjanje zdravja uporabljati učinkovita orodja na različnih področjih evropske politike, tako na področju davkov, kmetijstva in izobraževanja kot tudi na različnih ravneh zdravstvenega varstva.
Tudi področje prometa je eden ključnih dejavnikov, ki vpliva na zdravje evropskega prebivalstva. Po besedah komisarke Bulčeve letno na cestah EU umre okoli 26.000 ljudi, vsaka smrt pa je preveč. Kot je poudarila, so se zato odločili za pomemben korak, ki je po njenih besedah uresničljiv, to je vizija nič.
Sodobne tehnologije, ki nam lajšajo življenje, so s seboj prinesle tudi mnogo negativnih posledic, je za STA opozorila Bulčeva. Kot je poudarila, jo zelo veseli, da je pri prizadevanju dobila podporo praktično v celotnem “prometnem ekosistemu”, od nevladnih organizacij do industrije in političnih odločevalcev. “Pogumno smo se odločili za vizijo nič,” je poudarila. Kot je pojasnila, vizija nič pomeni, da leta 2050 na evropskem prostoru ne bi bilo več smrtnih žrtev v prometu, prav tako ne bi bilo več onesnaževanja s strani prometa.
Zbrane je pozdravil tudi minister za zdravje Samo Fakin, človekoljubni aktivist Tomo Križnar pa jih je pozval k aktivnostim v pomoč afriškemu plemenu Nuba in plemenom v provinci Modri Nil. Ti nujno potrebujejo zdravila, ki bi preprečila hude bolezni, ki pestijo tamkajšnje prebivalstvo, tudi gobavost.
Osrednje teme konference so sicer predstavili že na dopoldanski novinarski konferenci. Te so stvarnost digitalnega sveta in njegov pomen za zdravje mladih; družba, staranje in zdravje; duševno zdravje v celotnem življenjskem obdobju ter migracije, narodnosti in zdravje. Predstavili so jih mednarodni strokovnjaki s področja javnega zdravja.
Direktorica EuroHealthnet Caroline Costongs je izpostavila vpliv digitalnega sveta na otroštvo in razvoj mladostnika. Na eni strani mladim predstavlja možnost vzpostavljanja številnih socialnih stikov, ponuja možnost za izobraževanje in učenje, skratka je del vsakdanjika. Na drugi strani pa ima negativne učinke na samozavest tistih posameznikov, ki v resničnem življenju nimajo veliko prijateljev, preko spleta pa vzpostavljajo lažna poznanstva. Digitalni svet mnogokrat potencira tveganja, s katerimi se mladi soočajo v vsakdanjem življenju. Če mladostnike torej zasramujejo v resničnem življenju, jih bodo tudi v digitalnem, je opomnila.
Rešitve Costongsova ne vidi v omejevanju dostopa do spleta, pač pa v okrepljenem delu z družinami oz. skrbniki mladih, da bi se slednji naučili odgovorne rabe spleta.
Predsednica Evropskega združenja za javno zdravje Jutta Lindert je spregovorila o pomenu duševnega zdravja v celotnem življenjskem obdobju. Med drugim je postregla z raziskavami, ki potrjujejo, da duševno zdravje ali pa duševne motnje izvirajo iz otroštva. Dogodki v otroštvu torej lahko zaznamujejo vse življenje.
Obravnava duševnega zdravja skozi celotno življenjsko obdobje omogoča razumevanje različnih vplivov nanj. Tako lahko ugotovimo, kakšen je prispevek genetike, socialnega in političnega okolja, pa tudi katera so občutljiva obdobja življenja, ko je treba duševnemu zdravju posvečati še posebno pozornost, je pojasnila.
Temo aktivnega staranja je predstavil Julian Mamo z oddelka za javno zdravje na Univerzi na Malti. Kot je poudaril, aktivnost tudi v zrelih letih vpliva na kakovost življenja in na zdravje. Na konferenci se bodo tako ukvarjali zlasti z dejavniki, ki bi starejše spodbudili k aktivnemu preživljanju časa.
Na konferenci bodo obravnavali tudi javno zdravje v luči vse pogostejših migracij v zadnjem obdobju. Kot je dejal Allan Krasnik iz Evropskega združenja za javno zdravje, so migracije eden bistvenih delov človeške zgodovine in lahko obogatijo družbo, njihovo ekonomijo in kulturo.
V zgodovini so migracije pogosto dojemali kot grožnjo javnemu zdravju, vendar pa v tem pogledu med migranti in večinskim prebivalstvom po njegovih izkušnjah ni bistvene razlike. Včasih je celo obratno, je pojasnil. Je pa posebej opozoril na ranljive skupine prebivalstva, denimo mladoletnike brez spremstva, ki v tem pogledu zahtevajo posebno skrb.
Na slovenski strani je soorganizator konference Nacionalni inštitut za javno zdravje (NIJZ). Ta je ob tej priložnosti pripravil t. i. Ljubljansko izjavo, ki poudarja potrebo, da vsi akterji, ki se ukvarjajo s politiko javnega zdravja v Evropi in širše, sprejmejo določene zaveze.
Te se med drugim nanašajo na zmanjševanje neenakosti v zdravju, znanstveno utemeljenost zdravstvenih podatkov, razvoj zdravstvene pismenosti in na vključevanje zdravja v vse politike. Nekdanji direktor NIJZ Ivan Eržen je na novinarski konferenci poudaril, da je to izjavo podpisalo že 19 nacionalnih in 11 mednarodnih organizacij.
“,STA,1543478280,1543478280,sl,13706,306,13705,43,0,NULL,,”Na evropski konferenci tudi o javnem zdravju v luči migracij in o aktivnem staranju”,na-evropski-konferenci-tudi-o-javnem-zdravju-v-luci-migracij-in-o-aktivnem-staranju,Post,,1,0,1545206339,1545206340
481,13708,”Boj proti aidsu: Po pomoč v ambulanto za spolno prenosljive okužbe”,”V ambulantah za spolno prenosljive bolezni svetujejo o tveganih spolnih vedenjih ter odkrivajo in zdravijo spolno prenosljive okužbe. “,”
Ljubljana, 30. novembra (STA) – V ambulantah za spolno prenosljive bolezni svetujejo o tveganih spolnih vedenjih ter odkrivajo in zdravijo spolno prenosljive okužbe. STA objavlja seznam ambulant, kjer se z napotnico osebnega zdravnika lahko naročimo na pregled po tveganem spolnem vedenju ali v primeru bolezenskih simptomov, ki nakazujejo na tovrstno okužbo. Ljubljana
Dermatovenerološka klinika UKC Ljubljana
Ambulanta za spolno prenosljive bolezni
Zaloška cesta 2
Informacije: 01 522 37 44
Klinika za infekcijske bolezni in vročinska stanja UKC Ljubljana
Ambulanta za spolno prenosljive okužbe
Japljeva 2
Informacije: 01 522 26 22
Maribor
Univerzitetni klinični center Maribor
Oddelek za kožne in spolne bolezni
Ljubljanska 5
Informacije: 02 321 26 66
Celje
Splošna bolnišnica Celje
Dermatovenerološki oddelek
Oblakova ulica 5
Informacije: 03 423 35 38
Zdravstveni dom Celje
Dermatologija
Gregorčičeva ulica 5
Informacije: 03 543 41 73
Novo mesto
Splošna bolnišnica Novo mesto
Dermatovenerološki oddelek
Šmihelska cesta 1
Informacije: 07 391 62 92
Izola
Splošna bolnišnica Izola
Dermatovenerološka ambulanta
Polje 40
Informacije: 05 660 63 43
“,STA,1543564740,1543564740,sl,13708,306,13707,43,0,NULL,,”Boj proti aidsu: Po pomoč v ambulanto za spolno prenosljive okužbe”,boj-proti-aidsu-po-pomoc-v-ambulanto-za-spolno-prenosljive-okuzbe,Post,,1,0,1545206416,1545206417
482,13710,”V Avstriji dokazali navzočnost nevarnega klopa”,”V Avstriji so strokovnjaki prvič potrdili navzočnost subtropske vrste klopa Hyalomma marginatum. “,”
Dunaj, 07. decembra (STA) – V Avstriji so strokovnjaki prvič potrdili navzočnost subtropske vrste klopa Hyalomma marginatum. Od običajnega občutno večji klop, ki se sicer nahaja na območju Sredozemlja, Azije in Severne Afrike, lahko med drugim prenaša virus nevarne krimsko-kongoške hemoragične mrzlice. V severnejših krajih se je očitno znašel zaradi vse bolj vročih poletij. Hyalommi marginatum, katerega ličinke in nimfe (razvojna faza ob prvi levitvi) potujejo s pticami selivkami, je doslej naselitev v severnejših krajih preprečevalo podnebje, a ob zelo vročih poletjih so sedaj krvosesi tudi tam našli idealne razmere. Gre za klope, ki se običajno prisesajo na večje živali – konje, govedo, koze ali ovce, a je lahko njihov gostitelj tudi človek.
Kot spominja avstrijska tiskovna agencija APA, so že poleti v Nemčiji odkrili odraslega klopa te vrste, sedaj pa so ga prvič potrdili tudi v Avstriji, za kar se gre zahvaliti pozornemu konjerejcu v spodnjeavstrijskem Melku.
Ti veliki klopi so tako kot običajni pogosto okuženi s povzročitelji bolezni. Poleg parazita babezija lahko prenašajo nevarne bakterije, kot je rickettsia aeschlimannii, ali viruse, kot so togotovirus, virus Zahodnega Nila ali življenjsko nevarni virus krimsko-kongoške hemoragične mrzlice, so poudarili avstrijski strokovnjaki.
Pri spolno zrelem zajedavcu, ki so ga odkrili v Avstriji, strokovnjaki z avstrijske agencije za zdravje (Ages) in medicinske univerze na Dunaju niso dokazali prisotnosti virusa krimsko-kongoške mrzlice, so pa odkrili za ljudi prav tako nevarno rickettsio aeschlimannii, ki je povzročitelj pegavice. Ta pri ljudeh povzroča spremembe na koži in vročino.
Kot je pojasnil Georg Duscher z dunajskega inštituta za parazitologijo, se je lahko zaradi nadpovprečno suhih in toplih razmer poleti in prav tako zelo tople jeseni nimfa v sicer zanjo neprimernem okolju razvila v odraslega klopa. “V za zdaj ne dovolj velikem številu, da bi se tu dokončno uveljavil,” je dodal.
Možno pa je, da bodo odrasli, krepkejši klopi sedaj prestali tudi zimo, kar pa bo jasno šele spomladi. Pri tem so avstrijski strokovnjaki posvarili, da bi se lahko ti paraziti pri višjih temperaturah začeli razvijati tudi v zanje doslej neobičajnih zemljepisnih širinah.
Klop Hyalomma marginatum se nahaja tudi v Sloveniji – na območju do Črnega kala, o njegovi pojavnosti v notranjosti, kjer se sicer zaradi podnebja naj ne bi nahajal, za zdaj ni podatkov, je za STA povedal dr. Tomi Trilar s Prirodoslovnega muzeja Slovenije. Morebitne nove informacije o tem bi lahko po njegovih besedah prinesli dve srednješolski raziskovalni nalogi.
V Sloveniji sicer glede na podatke, dostopne na spletu, živi skupaj 16 vrst klopov in Slovenci smo glede bolezni, ki jih prenašajo, ena izmed najbolj ogroženih populacij na svetu. Ogrožata predvsem klopni meningoencefalitis, pred katerimi se je mogoče zaščiti s cepljenjem, in lymska borelioza.
“,STA,1544169600,1544169600,sl,13710,306,13709,43,0,NULL,,”V Avstriji dokazali navzočnost nevarnega klopa”,v-avstriji-dokazali-navzocnost-nevarnega-klopa,Post,,1,0,1545206497,1545206497
483,13712,”Z izobraževanjem zdravstvenih delavcev do učinkovitejšega vodenja zdravstvenih ustanov”,” Izkušnje iz tujine kažejo, da so za vodenje zdravstvenih ustanov najboljši zdravstveni delavci z menedžerskimi znanji.”,”
Ljubljana, 07. decembra (STA) – Izkušnje iz tujine kažejo, da so za vodenje zdravstvenih ustanov najboljši zdravstveni delavci z menedžerskimi znanji. Zdravniška zbornica zato s programom izobraževanja, ki ga zaključuje prva skupina slušateljev, želi sistematično poglobiti znanja zdravnikov na vodstvenih položajih o komunikaciji, ekonomiki zdravstva in procesih vodenja. Izobraževalnega programa o vodstvenih kompetencah za zdravnike in zobozdravnike se je udeležilo 24 slušateljev. Skoraj polovica od njih že opravlja vodstvene naloge v svojih zdravstvenih zavodih. Oktobra pa je študij začela že druga skupina, je na današnji novinarski konferenci ob zaključku izobraževanja pojasnil Denis B. Ujčič iz Zavoda za razvoj zdravstvenega managementa.
Zdravniška zbornica je z veseljem sprejela pobudo zavoda, saj se zdravstveni delavci zavedajo pomanjkanja vodstvenih znanj, ki so ključna za uspešno in učinkovito vodenje zavodov, je na današnji novinarski konferenci povedala predsednica zbornice Zdenka Čebašek-Travnik. Ob tem je še opozorila, da so tudi člani sveta zavodov, ki jih imenujejo ustanovitelji, pogosto premalo seznanjeni z delovanjem zdravstvenih zavodov.
“Tisti, ki prihajamo iz zdravstva, na vodstvenih položajih kdaj zanemarjamo management, saj bi radi pomagali bolnikom in se ne sprašujemo toliko o cenah in podobnem,” je povedal eden od udeležencev izobraževanja, direktor Univerzitetne klinike za pljučne bolezni in alergijo Golnik Aleš Rozman. “Tudi naša komunikacija s sodelavci poteka v dobri veri, da nas bodo razumeli, vendar tu trčimo ob različne značaje ljudi,” je še dejal. Program pa mu je pomagal ozavestiti izzive, s katerimi se srečuje pri svojem delu in mu dal učinkovita orodja za spopadanje z njimi.
Z njim se je strinjala tudi vodja splošne službe v Zdravstvenem domu Ravne na Koroškem Zdenka Koželj Rekanović, ki po vsakem vsebinskem modulu pridobljeno znanje poskuša uporabiti na delovnem mestu. Med drugim se je v njenem delovnem okolju izboljšala komunikacija, olajšan je dostop do sodelavcev, imenovali pa so tudi komisijo za obravnavanje pritožbe. “Najbolj pomembni so urejeni odnosi na delovnem mestu,” je še izpostavila Koželj Rekanovićeva.
Zdravniki so posebna skupina slušateljev, so zelo motivirani in zagnani, jih je opisala predavateljica in profesorica na fakulteti za management Elizabeta Zirnstein. Po njenih besedah so nekateri že izrazili željo po poglabljanju vsebin, prav tako pa zaskrbljenost nad zakonodajo in sistemom financiranja zdravstva.
“,STA,1544169720,1544169720,sl,13712,306,13711,43,0,NULL,,”Z izobraževanjem zdravstvenih delavcev do učinkovitejšega vodenja zdravstvenih ustanov”,z-izobrazevanjem-zdravstvenih-delavcev-do-ucinkovitejsega-vodenja-zdravstvenih-ustanov,Post,,1,0,1545206614,1545206614
484,13714,”Na dobrodelni akciji pripravljajo darilca za onkološke bolnike v bolnišnicah”,”Krovno združenje slovenskih organizacij bolnikov z rakom Onko Net danes dopoldne v prostorih OnkoHuba na Vrazovem trgu na dobrodelni akciji pripravlja simbolična darilca za onkološke bolnike, ki bodo praznični čas preživeli v bolnišnicah. Na praznične okraske pišejo spodbudne besede, so povedali za STA.”,”
Ljubljana, 12. decembra (STA) – Krovno združenje slovenskih organizacij bolnikov z rakom Onko Net danes dopoldne v prostorih OnkoHuba na Vrazovem trgu na dobrodelni akciji pripravlja simbolična darilca za onkološke bolnike, ki bodo praznični čas preživeli v bolnišnicah. Na praznične okraske pišejo spodbudne besede, so povedali za STA. Združenje si vse leto prizadeva za kakovostno obravnavo bolnikov z rakom. “Negotovost, bolečina in strah, ki jih čutijo bolniki in njihovi svojci ob soočanju z boleznijo, se v prazničnih dneh še stopnjujejo,” so spomnili. Bolnikom zato želijo vliti upanje in pogum.
V Sloveniji za rakom vsako leto zboli 14.000 ljudi. Že več kot 100.000 ljudi pa je v svojem življenju že zbolelo za eno od rakavih bolezni.
“,STA,1544601840,1544601840,sl,13714,306,13713,43,0,NULL,,”Na dobrodelni akciji pripravljajo darilca za onkološke bolnike v bolnišnicah”,na-dobrodelni-akciji-pripravljajo-darilca-za-onkoloske-bolnike-v-bolnisnicah,Post,,1,0,1545206701,1545206702
485,13716,”Akcija Daruj kri spodbuja h krvodajalstvu tudi z e-čestitko”,”Vseslovenska krvodajalska iniciativa Daruj kri, ki obvešča o pomenu krvodajalstva”,”
Ljubljana, 19. decembra (STA) – Vseslovenska krvodajalska iniciativa Daruj kri, ki obvešča o pomenu krvodajalstva in spodbuja ljudi, da postanejo redni krvodajalci, je v osmih letih pripomogla k pridobitvi več kot 83.000 novih krvodajalcev. Ob prihajajočih praznikih h krvodajalstvu spodbujajo tudi personalizirane elektronske voščilnice.
Kot so sporočili iz Rdečega križa Slovenije, v podporo krvodajalski pobudi Daruj kri iz prazničnih voščil umikajo črke, ki predstavljajo krvne skupine A, 0, B in AB. Ljudi vabijo, naj se pridružijo srčni akciji in s spletno aplikacijo ustvarijo presonalizirano e-čestitko z osebnim sporočilom ter tako svoje bližnje, prijatelje in znance navdihnejo, da tudi oni podarijo najlepše darilo – upanje prejemnikom darovane krvi, da bo v letu 2019 krvi vseh krvnih skupin vedno dovolj in nikoli premalo.
Ob iztekajočem se letu se nosilci akcije Daruj kri zahvaljujejo vsem predanim krvodajalcem, ki s svojim darilom omogočajo, da življenja mnogih tečejo dalje. “Naj praznične trenutke spremlja misel, da je kri, ki rešuje življenja, lahko najlepše in najbolj srčno darilo,” poudarjajo.
Akcija Daruj kri je namenjena podpori slovenskemu krvodajalstvu in širjenju te pomembne vrednote med splošno javnost, predvsem v prazničnem času. Kot so prepričani v družbi Petrol, ki je pobudnik akcije Daruj kri, ter sodelujoči iz Rdečega križa Slovenije in Zavoda RS za transfuzijsko medicino, je redno ozaveščanje o krvodajalstvu izjemno pomembno.
Vseslovenska krvodajalska iniciativa Daruj kri že osmo leto zapored s sodobnimi pristopi uspešno obvešča o pomembnosti krvodajalstva ter spodbuja ljudi, da postanejo in ostanejo redni krvodajalci. “Rezultati akcije so nad pričakovanji, saj je v osmih letih tudi akcija pripomogla k pridobitvi več kot 83.000 novih krvodajalcev. Tudi zaradi tega imamo v Sloveniji zadostne količine krvi in do 100.000 krvodajalcev, ki se prijavijo na odvzem krvi,” so sporočili iz Rdečega križa Slovenije.
“,STA,1545215280,1545215280,sl,13716,306,13715,43,0,NULL,,”Akcija Daruj kri spodbuja h krvodajalstvu tudi z e-čestitko”,akcija-daruj-kri-spodbuja-h-krvodajalstvu-tudi-z-e-cestitko,Post,,1,0,1545992970,1545992971
486,13718,”Največ novih primerov raka v zasavski regiji”,”Rak je huda bolezen, zaradi katere se pojavlja vse pogosteje med vzroki obolevnosti in umrljivosti.”,”
Ljubljana, 02. januarja (STA) – Rak je huda bolezen, zaradi katere se pojavlja vse pogosteje med vzroki obolevnosti in umrljivosti. Kazalnik novih primerov raka kaže skupno obremenitev z najtežjimi vrstami rakov pri prebivalcih. Najvišja stopnja primerov novega raka je sicer v zasavski regiji, najnižja pa v primorsko-notranjski, kažejo podatki NIJZ. Ob tem so na Nacionalnem inštitutu za javno zdravje (NIJZ) poudarili, da znamo s sodobno diagnostiko odkriti številne primere tudi v zgodnji fazi. Intenziven razvoj metod zdravljenja pa prispeva k temu, da je rak vse bolj ozdravljiva bolezen in preživetje bolnikov z rakom vse daljše.
Na nastanek raka vplivajo številni dejavniki. Že lokalna skupnost lahko s svojimi ukrepi prispeva k zmanjšanju dejavnikov tveganja kot so nezdrava prehrana, kajenje, pitje alkohola, telesna neaktivnost, slab socialno ekonomski položaj in obremenitve s stresom. Prav tako lahko prispeva k zmanjšanju izpostavljenosti dejavnikom zunanjega okolja, kot so onesnaženost zraka, zemlje in vode z različnimi rakotvornimi snovmi, so opozorili na NIJZ.
STA objavlja tabelo s podatki o povprečni stopnji novih primerov raka na 100.000 prebivalcev med letoma 2010 in 2014. Kazalnik ne vključuje novih primerov nemelanomskega kožnega raka, saj v velikem deležu primerov ne zahtevajo intenzivnega zdravljenja in večinoma ne ogrožajo življenja.
| regija | stopnja |
| Primorsko-notranjska | 513 |
| Savinjska | 515 |
| Zasavska | 616 |
| Obalno-kraška | 526 |
| Podravska | 526 |
| Goriška | 535 |
| Posavska | 541 |
| Koroška | 551 |
| Pomurska | 567 |
| Gorenjska | 584 |
| Jugovzhodna Slovenija | 591 |
| Osrednjeslovenska | 600 |
| Slovenija | 559 |
Vir: NIJZ
“,STA,1546696620,1546696620,sl,13718,306,13717,43,0,NULL,,”Največ novih primerov raka v zasavski regiji”,najvec-novih-primerov-raka-v-zasavski-regiji,Post,,1,0,1546697145,1547026951
489,13724,”Pred vrhuncem sezone gripe v Bolnici Petra Držaja odprtje oddelka za epidemije”,”V Bolnici Petra Držaja Univerzitetnega kliničnega centra Ljubljana bodo v četrtek odprli začasni oddelek za epidemije.”,”
Ljubljana, 08. januarja (STA) – V Bolnici Petra Držaja Univerzitetnega kliničnega centra Ljubljana bodo v četrtek odprli začasni oddelek za epidemije. Število obolelih za gripo in respiratornimi okužbami se veča, vrhunec sezone gripe pa je tik pred vrati. Kljub temu se je še vedno smiselno cepiti, pozivajo zdravstveni delavci, ki so na večje število bolnikov dobro pripravljeni.
V bolnišnicah opažajo, da se število ljudi, ki imajo prehladne znake oziroma kažejo znake obolenja dihal, povečuje. Veča se tudi število bolnikov zaradi respiratornih okužb in drugih boleznih.
Prvi primer gripe v ljubljanskem univerzitetnem kliničnem centru (UKC) so zabeležili 10. decembra, do minulega tedna pa je bilo potrjenih 80 primerov gripe, kar je v pričakovanju in skladu s preteklimi sezonami gripe. Drastičen porast obolelih pričakujejo v drugi polovici januarja in začetku februarja, ko je običajno vrhunec sezone gripe, je v izjavi za medije pred odprtjem oddelka napovedala nadzorna zdravnica oddelka Tadeja Kotar.
Na oddelku za epidemije, ki ga odpirajo že osmič in ga letos vodi klinika za infekcijske bolezni in vročinska stanja, bo za bolnike z gripo in gripi podobnimi boleznimi na voljo 20 postelj. Lani so na oddelku, ki je bil odprt skoraj tri mesece, zdravili 210 bolnikov, je spomnila koordinatorica oddelka Mateja Klep Breskvar.
Kot je pojasnila nadzorna sestra oddelka Alma Kocijan, bo letos za bolnike z gripo skrbelo okoli 30 zaposlenih iz negovalnega oddelka, ki so se začasno preselili v prostore drugega nadstropja Bolnice Petra Držaja. Na sezono gripe so se zaposleni pripravljali tudi z dodatnimi izobraževanji, po besedah Kocijanove zato ne pričakujejo zapletov.
Bolniki z gripo se sicer najprej zdravijo na infekcijski kliniki in internih klinikah, nato pa dodatnem oddelku za epidemijo. Na infekcijski kliniki je že hudo pomanjkanje bolniških postelj tudi zaradi drugih respiratornih okužb, zato bo odprtje oddelka v Bolnici Petra Držaja več kot dobrodošlo. V primeru večje epidemije gripe pa ima ljubljanski UKC pripravljen pandemski načrt, ki natančno opredeljuje ravnanje v tem primeru.
Slovenija je po številu obolelih za gripo trenutno v skladu z drugimi evropskimi državami, kjer po besedah Kotarjeve za zdaj še ne beležijo večje epidemije gripe. Najbolj učinkovita zaščita pred gripo je cepljenje, je ob tem poudarila.
K temu v kliničnem centru spodbujajo tudi zaposlene, ki imajo možnost brezplačnega cepljenja proti gripi. Končnih podatkov o deležu cepljenih zaposlenih v UKC še nimajo, saj cepljenje še vedno poteka. Klep Breskvarjeva pričakuje, da se bodo gibali v okviru lanske statistike, ko je bila cepljena približno petina zaposlenih.
Širjenje gripe lahko preprečimo tudi s higieno kašlja, umivanjem in razkuževanjem rok ter izogibanjem zaprtih prostorov z veliko ljudmi. V ljubljanskem UKC so že pred novim letom omejili obiske na eno zdravo osebo s poostrenimi higienskimi ukrepi. Tudi po nekaterih drugih slovenskih bolnišnicah so že omejili obiske.
“,STA,1547026800,1547026800,sl,13724,306,13723,43,0,NULL,,”Pred vrhuncem sezone gripe v Bolnici Petra Držaja odprtje oddelka za epidemije”,pred-vrhuncem-sezone-gripe-v-bolnici-petra-drzaja-odprtje-oddelka-za-epidemije,Post,,1,0,1547026928,1547026929
496,13730,”Na Gorenjskem investicije v primarno zdravstvo in širitev programov”,”Osnovno zdravstvo Gorenjske letos širi programe, da bi se izboljšalo dostopnost občanov do zdravstvenih storitev.”,”
Kranj, 10. januarja (STA) – Osnovno zdravstvo Gorenjske letos širi programe, da bi se izboljšalo dostopnost občanov do zdravstvenih storitev. Hkrati izvaja vrsto investicij v objekte in opremo v skupni vrednosti okoli pet milijonov evrov. Še naprej pa se Gorenjska sooča z velikim pomanjkanjem zdravstvenega kadra.
Določene širitve zdravstvenih programov na primarni ravni se izvajajo že ta mesec. Tako se odpirajo štiri nove zobozdravstvene ambulante, in sicer v Žirovnici, Gorenji vasi, Radovljici in Cerkljah. Razširili so tudi program razvojne ambulante in program okulistike v Kranju.
“Veliko delamo na povečanju dostopnosti Gorenjcev do zdravstvenih storitev, zlasti na periferiji,” je na sredini novinarski konferenci, na kateri je napovedal uvedbo plačevanja nenujnih zdravstvenih storitev v ambulantah nujne medicinske pomoči na Gorenjskem, pojasnil direktor Osnovnega zdravstva Gorenjske Jože Veternik.
Ob tem je izpostavil tudi bogat nabor investicij v objekte in opremo. V načrtu je za skoraj 4,87 milijona evrov investicij ter še za 420.000 evrov investicijskega vzdrževanja. Večino investicij Osnovno zdravstvo Gorenjske financira iz lastnih sredstev.
Največja naložba je gradnja prizidka k Zdravstvenemu domu Radovljica, ki se izvaja že od septembra lani. Osnovno zdravstvo Gorenjske bo z 800.000 evri pokrilo polovico stroškov gradnje in kupilo celotno opremo v vrednosti 240.000 evrov. Drugo polovico sredstev za gradnjo, ki naj bi bila končana oktobra, prispeva Občina Radovljica.
Na Jesenicah medtem poteka prenova otroškega in šolskega dispanzerja ter razvojne ambulante v vrednosti okoli 220.000 evrov, ki naj bi bila končana do poletja.
V Zdravstvenem domu Kranj bodo v okviru projekta Centri za krepitev zdravja prenovili prostore, kjer je trenutno bazen. Vrednost investicije je okoli 420.000 evrov, od tega bo 300.000 evrov prispevala Mestna občina Kranj, ki je uspešno kandidirala za sredstva na razpisu ministrstva za zdravje.
V Tržiču in Bohinju bo Osnovno zdravstvo Gorenjske skupaj z občinami izvedlo energetske sanacije zdravstvenih domov. V Zdravstvenem domu Škofja Loka bodo kupili nov rentgenski aparat v vrednosti 380.000 evrov. Za Bled, Kranj in Jesenice pa bodo kupili tri nova reševalna vozila v skupni vrednosti 400.000 evrov.
Problematična medtem ostaja kadrovska podhranjenost primarnega zdravstva na Gorenjskem. “Kadrovska situacija je tista rak rana, ki nas še vedno zelo boli,” je povedal Veternik in pojasnil, da je kljub lanskemu prihodu nekaterih novih zdravnikov problematika pomanjkanja zdravnikov še vedno zelo pereča.
Pereče je zlasti pomanjkanje zdravnikov družinske medicine. V Kranju manjkajo kar štirje, problem pa je tudi na Bledu, na Jesenicah in v Radovljici. Zaradi trenutne stiske v Kranju, kjer nove bolnike sprejema le še ena zdravnica, predlagajo občanom, da se registrirajo pri zdravnikih v Tržiču, kjer deluje nova ambulanta, ki ima še proste zmogljivosti, ali v Škofji Loki, kjer so decembra odprli dve novi ambulanti družinske medicine.
Na Gorenjskem bi takoj zaposlili tudi štiri ali pet pediatrov, in sicer po enega na Jesenicah, v Bohinju, Kranju in Škofji Loki. Ob tem bi rešili tudi problematiko v Občini Železniki, ki je ena redkih občin brez pediatra.
Na območju Tržiča in Radovljice manjka okulist, na Gorenjskem pa manjkajo tudi trije radiologi, pri čemer bo Kranj zaradi odhoda dveh zdravnikov v kratkem ostal brez specialista radiologije. V Osnovnem zdravstvu Gorenjske iščejo tudi dermatologa, v Škofji loki pa bi za vodenje dežurne službe zaposlili specialista urgentne medicine.
“,STA,1547111700,1547111700,sl,13730,306,13729,43,0,NULL,,”Na Gorenjskem investicije v primarno zdravstvo in širitev programov”,na-gorenjskem-investicije-v-primarno-zdravstvo-in-siritev-programov,Post,,1,0,1547457429,1547457430
497,13732,”Novi predsednik Sindikata zdravstva Slovenije Andrej Dočinski”,”Sindikat zdravstva Slovenije je na današnjem rednem volilnem kongresu za svojega novega predsednika izvolil Andreja Dočinskega.”,”
Ljubljana, 10. januarja (STA) – Sindikat zdravstva Slovenije je na današnjem rednem volilnem kongresu za svojega novega predsednika izvolil Andreja Dočinskega, ki bo na tem mestu zamenjal Damirja Janekoviča. Potrdili so tudi strategijo delovanja sindikata za štiriletni mandat, so sporočili iz omenjenega sindikata.
Na kongresu, ki je danes dopoldne potekal v prostorih Univerzitetnega kliničnega centra (UKC) Ljubljana, so obravnavali tudi trenutno problematiko poklicnih skupin znotraj dejavnosti zdravstva, še posebej položaj zaposlenih v zvezi s sprejemanjem nove sistemizacije znotraj UKC Ljubljana.
V Sindikatu zdravstva Slovenije so si kot člani Konfederacije slovenskih sindikatov za cilj zastavili učinkovito proaktivno sindikalno delovanje, ki bi pritegnilo čim večje število zaposlenih različnih poklicnih skupin znotraj javnega sektorja v dejavnosti zdravstva in širše, je navedeno na njihovi spletni strani.
“,STA,1547111820,1547111820,sl,13732,306,13731,43,0,NULL,,”Novi predsednik Sindikata zdravstva Slovenije Andrej Dočinski”,novi-predsednik-sindikata-zdravstva-slovenije-andrej-docinski,Post,,1,0,1547457509,1547457510
499,13739,”Klinični register – ključ za z dokazi podprto klinično prakso”,”Klinični register – ključ za z dokazi podprto klinično prakso”,”
Na strokovnem srečanju o pomenu kliničnih registrov, ki je ob koncu leta 2018 potekalo na Slovenski akademiji znanosti in umetnosti v Ljubljani, so različni deležniki v zdravstvu izpostavili, da so klinični registri ključni za izboljšanje izidov zdravljenja, raziskovanje in sprejemanje z dokazi podprtih odločitev v zdravstvu. Ocenili so, da je vloga kliničnih registrov v procesu vrednotenja zdravstvenih tehnologij in zagotavljanja finančne vzdržnosti javnih zdravstvenih sistemov neprecenljiva in v tej zvezi opozorili na slabo izkoriščen potencial kliničnih registrov. Ker je vzpostavitev in dobro delovanje kliničnih registrov nesporen interes vseh deležnikov v zdravstvu, so se udeleženci strokovnega srečanja, ki ga je organiziral Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb v Sloveniji, strinjali, da sta sistemska ureditev in nadaljnji razvoj področja kliničnih registrov nujna.
Prof. dr. Petra Došenović Bonča z Ekonomske fakultete Univerze v Ljubljani je s pomočjo produkcijske funkcije nazorno prikazala večplastne koristi kliničnih registrov za različne deležnike v zdravstvu. Dobro vzpostavljeni in delujoči klinični registri zdravstvenim delavcem omogočajo razumevanje bolezni in njenega razvoja, različnih načinov in izidov zdravljenja ter dejavnikov njihovih variabilnosti. Klinični register omogoča tudi spremljanje in razumevanje časovnih zamikov v odzivanju bolnikov, bolj individualizirano zdravljenje ter prepoznavanje dejavnikov, ki vodijo v neželene učinke. S pomočjo kliničnih registrov je povezovanje s strokovnjaki iste ali sorodnih strok enostavnejše, klinični registri pa med drugim omogočajo tudi hitrejši razvoj novih strokovnih smernic za obravnavo bolnikov.
Vloga kliničnih registrov je nadvse pomembna tudi z vidika regulatorja, predvsem pa plačnika zdravstvenih storitev, saj klinični registri med drugim prispevajo k lažji opredelitvi dejanskih praks, kot je denimo uporaba medicinskih pripomočkov, zdravil in podobno. Pomembna pa je tudi vloga, ki jo imajo pri lažji presoji ne le kliničnih učinkov posameznih storitev, temveč tudi stroškovne učinkovitosti le teh. Podatki iz kliničnih registrov lahko služijo kot dobra podlaga za strateško dogovarjanje z izvajalci zdravstvenih storitev, javno poročanje, razvoj izobraževanj ter dogovore s farmacevtskimi podjetji za vključitev novih zdravil na liste. Bolnikom klinični registri omogočajo boljše razumevanje bolezni in njenega razvoja, dejavnikov tveganja ter izidov zdravljenja, proizvajalcem medicinskih pripomočkov, zdravil in zdravstvenih tehnologij pa lažjo opredelitev dejanske porabe, razumevanje razlik v izidih zdravljenja različnih populacijskih skupin, boljši vpogled v stroškovno učinkovitost ter za dogovore s plačniki zdravstvenih storitev o vključitvi zdravil na podlagi izidov zdravljenja na liste.
Kljub dokazanim koristim za vse deležnike v zdravstvu, je razvoj področja kliničnih registrov v Sloveniji okoren, potencial kliničnih registrov pa ostaja slabo izkoriščen. Podatki obstoječih kliničnih registrov se uporabljajo za zelo ozek nabor namenov, čeprav bi lahko na podlagi teh podatkov zdravstvene storitve razvijali v smeri bolj personalizirane medicine, odločali o košarici pravic in podobno. Obstoječi klinični registri zdravstvenim delavcem ne omogočajo ažurnih povratnih informacij, ki bi lahko služile za prilagoditev obravnave bolnikov, ne sledijo trendu digitalizacije in med drugim ne omogočajo povezovanje med posameznimi organizacijami in državami in slabo vključujejo bolnike v snovanje, razvoj in delovanje registrov, je še izpostavila ekonomistka prof. dr. Petra Došenović Bonča.
Register raka Republike Slovenije je bil ustanovljen leta 1950 kot posebna služba za zbiranje in obdelavo podatkov o incidenci raka in preživetju bolnikov z rakom v Sloveniji. Namen registra je po besedah vodje Registra raka RS izr. prof. dr. Vesne Zadnik predvsem spremljanje, načrtovanje in vrednotenje onkološkega varstva ter osnova za epidemiološke ter klinične študije. Viri podatkov za register so vsi državni presejalni programi, upravni registri, državne zdravstvene podatkovne zbirke, bolnišnični register Onkološkega inštituta Ljubljana, klinične in populacijske raziskave ter javnozdravstveni zavodi.
V Registru raka RS se zbirajo identifikacijski podatki bolnikov, podatki o boleznih in zdravljenju, histološke oz. citološke diagnoze in vitalno stanje bolnikov. V Državnem programu za obvladovanje raka 2017–2020 je zaveza o razširitvi nabora podatkov oziroma vzpostavitvi kliničnih registrov za posamezne vrste raka, ki bi omogočali pripravo kazalnikov za vrednotenje kakovosti obravnave onkoloških bolnikov. Trenutno testno že deluje klinični register Melanom, z Državnim programom za obvladovanje raka 2017–2020 pa želijo v prvi fazi vzpostaviti vsaj še klinične registre za raka pljuč, debelega črevesa in danke, dojk in prostate.
Predstojnica Zdravstveno podatkovnega centra NIJZ Metka Zaletel je izpostavila številne izzive, s katerimi se soočajo pri vzpostavitvi in razvoju organiziranega sistema zbiranja in analize podatkov o skupinah bolnikov, ki niso slovenska posebnost, saj se z njimi srečujejo tudi na evropski ravni. Registri pacientov niso vedno primerljivi in skladni, zato so podatki iz različnih virov med seboj slabo povezljivi in neuporabni za sekundarne namene. Nacionalni inštitut za javno zdravje je med leti 2012 in 2015 vodil skupni evropski programski ukrep Parent (Patient Registries Iniciative), s katerim želijo državam članicam EU zagotoviti podporo pri razvoju primerljivih in skladnih registrov bolnikov na ključnih področjih, kot so kronične bolezni, redke bolezni in medicinske tehnologije. V tem procesu so nastale smernice in metodološka priporočila za učinkovito in racionalno upravljanje registrov bolnikov. Vodja podatkovnega centra NIJZ je opozorila na nujnost nacionalnega dogovora o kliničnih registrih, povezovanja javnozdravstvenih in kliničnih registrov, jasnih opredelitev namena posameznih registrov ter ustreznih zakonodajnih podlag, ki bodo omogočile primerljivost registrov bolnikov v nacionalnem in evropskem kontekstu.
Kljub številnim izzivom in nedorečenostim na področju kliničnih registrov, pa se lahko v Sloveniji postavimo tudi s posameznimi dobrimi praksami kliničnih registrov, ki so predvsem plod entuziazma skupin zdravstvenih strokovnjakov. Na Kliničnem oddelku za revmatologijo UKC Ljubljana so že pred desetletjem vzpostavili klinični register BioRx.si. Gre za register bolnikov z revmatoidnim artritisom, ankilozirajočim spondilitisom in psoriatičnim artritisom, ki se zdravijo z biološkimi zdravili. Register BioRx.si, v katerega podatke vnašajo vsi slovenski revmatologi, omogoča standardizacijo učinkovitega in varnega zdravljenja v vsakdanji klinični praksi in služi tudi kot raziskovalno orodje.
Predstojnik Kliničnega oddelka za revmatologijo UKC Ljubljana prof. dr. Matija Tomšič je pojasnil, da se pri vzdrževanju registra, ki si ga želijo nadgraditi tudi z drugimi skupinami bolnikov, ki se zdravijo z dragimi biološkimi zdravili, soočajo z različnimi pravnimi vprašanji s področja varovanja osebnih podatkov. Kljub temu pa je prepričan, da so klinični registri nujni, saj revmatologom omogočajo podatke o učinkovitosti in varnosti posameznih protokolov zdravljenja in predstavljajo dober vir za raziskovalno delo. Na Kliničnem oddelku za otroško kirurgijo in intenzivno terapijo UKC Ljubljana so v zadnjih letih prešli iz papirnatega na popolnoma elektronsko poslovanje, ki jih je privedlo tudi do EMRAM 6 certifikata.
Digitalna transformacija, po besedah pediatra mag. Gorazda Kalana, omogoča podporo kliničnemu odločanju, oddaljen dostop, raziskovanje in presojo klinične učinkovitosti ter prinaša kadrovske, časovne in finančne prihranke. Na Kliničnem oddelku za hematologijo UKC Ljubljana so leta 2012 vzpostavili Slovenski register hematoloških novotvorb, v katerem se zbirajo podatki o nekaterih najpogostejših hematoloških novotvorbah. Podatke v register, ki je v lasti Združenja hematologov Slovenije, vnašajo v splošnih bolnišnicah ter v UKC Maribor in UKC Ljubljana. Namen analize podatkov je ocena incidence in prevalence pogostejših krvnih bolezni, kar omogoča načrtovanje potreb zdravljenja in kadrovskega sestava, poročanje o neželenih učinkih, ter oceno kakovosti kliničnega dela ter analizo poteka zdravljenja. Register je uporaben za podrobnejšo presojo diagnostičnih kriterijev in kriterijev za začetek zdravljenja ter oceno prognoze bolezni za posameznega bolnika, je razložil predstojnik Kliničnega oddelka za hematologijo UKC Ljubljana prof. dr. Samo Zver. Ker je za predpisovanje nekaterih zdravil potrebna posebna odobritev komisije Kliničnega oddelka za hematologijo UKC Ljubljana, je register uporaben tudi kot platforma za prenos prošnje in odobritve zdravljenja s strani omenjene komisije.
Doc. dr. Sabina Škrgat z Univerzitetne klinike za pljučne bolezni in alergijo Golnik pa je predstavila mednarodno povezavo, ki se ji je v želji po čim bolj učinkoviti obravnavi bolnikov s hudo obliko astme pridružila tudi Klinika Golnik. Gre za mednarodno mrežo, ki jo je ustanovilo več nemških kliničnih centrov German Asthma Net e. V. in ki združuje podatke o bolnikih s težko obliko astme. Ker je število bolnikov s tako obliko bolezni v posameznih centrih majhno, je z vidika optimizacije diagnostične ocene in obravnave bolnikov s težko obliko astme povezovanje podatkov v skupno bazo zelo koristno. Poleg Slovenije so se nemški mednarodni povezavi, katere namen je vzpostavitev kliničnega registra za bolnike s težko obliko astme, pridružile še Avstrija, Češka in Švica.
“,”Rok Knafelj”,1543327740,1543327740,sl,13739,306,13737,43,0,NULL,,”Klinični register – ključ za z dokazi podprto klinično prakso”,klinicni-register-kljuc-za-z-dokazi-podprto-klinicno-prakso,Post,”/sites/43/files/images/news/Stalisce o TZS/Foto-Terapevtske-skupine-zdravil.jpg”,1,1,1547474992,1551698760
501,13743,”Pred tednom boja proti raku na materničnem vratu o učinkovitem preprečevanju te bolezni”,”V prihodnjem tednu bomo obeležili 13. evropski teden boja proti raku materničnega vratu.”,”
Ljubljana, 18. januarja (STA) – V prihodnjem tednu bomo obeležili 13. evropski teden boja proti raku materničnega vratu. Strokovnjaki ob tem enotno ugotavljajo, da lahko s cepljenjem proti okužbi s HPV in presejalnim programom zgodnjega odkrivanja predrakavih sprememb materničnega vratu Zora preprečimo skoraj vsak nov primer tega raka v Sloveniji.
Zaradi učinkovitosti presejalnega programa Zora se Slovenija v zadnjih letih že uvršča med evropske države z najmanjšim bremenom te bolezni. Od uvedbe presejalnega programa leta 2003 se je incidenca raka materničnega vratu namreč prepolovila. Za rakom materničnega vratu v Sloveniji na leto tako zboli okoli 120 žensk, umre pa jih med 40 in 50. Lani so zabeležili 82 novih primerov raka na materničnem vratu.
Po oceni vodje programa Zora z ljubljanskega onkološkega inštituta Urške Ivanuš gre tak uspeh pripisati tudi zaupanju žensk v program, ki se ga redno udeležuje več kot 70 odstotkov žensk v starosti od 20 od 64 let. Zdravljenje raka na materničnem vratu, odkritega v zgodnjem stadiju, je namreč zelo uspešno.
Za rakom na materničnem vratu danes zbolevajo predvsem ženske, ki se presejalnih pregledov ne udeležujejo. Pri takih je rak v okoli 80 odstotkih odkrit v napredovani fazi, ko je zdravljenje manj učinkovito. Presejalnih pregledov se še vedno udeležuje premalo starejših žensk, zato pozivajo vse starejše od 50 let, da še naprej skrbijo za svoje reproduktivno zdravje.
Če ženske redno hodijo na preglede, imajo med 70 in 80 odstotkov manjšo možnost, da zbolijo za rakom materničnega vratu. Še manjša verjetnost za nastanek raka pa je pri ženskah, ki so bile cepljene proti okužbi HPV.
Kot je pojasnil Leon Meglič z ginekološke klinike Univerzitetnega kliničnega centra (UKC) Ljubljana, je cepljenje najboljša preventiva pred boleznimi, ki jih povzročajo okužbe s HPV, saj preprečuje večji del predrakavih sprememb materničnega vratu. Cepiva so varna in – kot so pokazali rezultati držav, ki so začele cepiti zgodaj in so uspele doseči visoko precepljenost – izjemno učinkovita.
V Sloveniji je od leta 2009 na voljo cepljenje deklic na sistematskih pregledih v šestem razredu, ki je plačano iz sredstev zdravstvenega zavarovanja. Približno polovica staršev se za cepljenje ne odloči, velike razlike po precepljenosti so tudi po regijah. Najvišja precepljenost, okoli 80 odstotkov, je v Ravnah na Koroškem, najnižja pa v Ljubljani, kjer je bila precepljenost po zadnjih podatkih okoli 36-odstotna.
Ti podatki kažejo, da preventivnih ukrepov za preprečevanje raka materničnega vratu v Sloveniji še ne izkoriščamo dovolj, ugotavljajo strokovnjaki. “Cepljenje je najbolj učinkovito pred vstopom v spolno življenje, vendar je priporočeno tudi kasneje, saj cepivo zaščiti pred sevi HPV, s katerimi se ženske še niso okužile,” je pojasnil Meglič in poudaril, da se s tem verjetnost predrakavih sprememb na materničnem vratu zmanjša 80 odstotkov.
“Na NIJZ tudi pripravljamo predlog širitve programa za cepljenje dečkov. Če bo sprejet na zdravstvenem svetu, bo cepljenje dečkov proti okužbi HPV iz sredstev obveznega zdravstvenega zavarovanja morda že v prihodnjem letu,” pa je napovedala specialistka javnega zdravja z Nacionalnega inštituta za javno zdravje (NIJZ) Nadja Šinkovec.
“,STA,1547816820,1547816820,sl,13743,306,13742,43,0,NULL,,”Pred tednom boja proti raku na materničnem vratu”,pred-tednom-boja-proti-raku-na-maternicnem-vratu,Post,,1,0,1547816949,1547816949
502,13745,”Na Hrvaškem sedem žrtev gripe”,”Na Hrvaškem so do četrtka zvečer zabeležili sedem smrtnih primerov gripe in 8460 obolelih”,”
Zagreb, 18. januarja (STA) – Na Hrvaškem so do četrtka zvečer zabeležili sedem smrtnih primerov gripe in 8460 obolelih, je potrdil vodja nacionalnega centra za influenco Vladimir Draženović. Ocenil je, da je število obolelih štirikrat večje, kot je prijavljenih primerov, ter da gre za najhujšo epidemijo gripe na Hrvaškem v zadnjih desetih letih.
Draženović je v pogovoru za hrvaško televizijo (HTV) v četrtek zvečer povedal, da je letošnja epidemija gripe dosegla vrhunec, bo pa s podobno intenziteto trajala še najmanj osem tednov. Po njegovih navedbah v zadnjih desetih letih na Hrvaškem niso zabeležili tolikšnega števila obolelih za gripo.
Pojasnil je, da letos na Hrvaškem razsaja virus gripe tipa A, ki je za 30 odstotkov bolj nevaren, kot je bil lanski virus. Kot je izpostavil, je največji problem v tem, da tega virusa na Hrvaškem ni bilo že nekaj let, zato je del prebivalstva izgubil odpornost nanj.
Direktorica zagrebške klinike za nalezljive bolezni Fran Mihaljević, Alemka Markotić je v pogovoru za HTV opozorila, da lahko letošnji virus gripe pusti hude posledice tudi pri mlajših ljudeh, ki sicer nimajo zdravstvenih težav. Posebej pa so ogrožene ranljive skupine ljudi, kot so majhni otroci, nosečnice, starejše osebe in kronični bolniki.
Povedala je, da ni nobenega razloga za preplah, čeprav gre za nekoliko hujšo obliko gripe, ki bolj pogosto povzroča pljučnice. Občanom je priporočila cepljenje, še posebej ranljivim skupinam, saj pričakujejo, da bo gripa razsajala še najmanj dva meseca.
“,STA,1547816940,1547816940,sl,13745,306,13744,43,0,NULL,,”Na Hrvaškem sedem žrtev gripe”,na-hrvaskem-sedem-zrtev-gripe,Post,,1,0,1547817048,1547817049
503,13755,”Oblikovanje in gibanje cen zdravil v Sloveniji “,”Oblikovanje in gibanje cen zdravil v Sloveniji “,”
Na srečanju z novinarji sta Katarina Verhnjak, predsednica Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb (Forum) in Tjaša Burnik, predstavnica Foruma, spregovorili o oblikovanju in gibanju cen zdravil v Sloveniji. Te so strogo nadzorovane in obvladane, hkrati pa pri nas ohranjamo dober dostop do inovativnih zdravil.
To nikakor ne drži, cene zdravil v Sloveniji so dobro obvladane. Slovenska družba se, podobno kot ostale evropske, pospešeno stara. Potrebe po zdravstvenih storitvah in zdravilih se povečujejo, pozivi po spremembah v zdravstvenem sistemu, ki bi prinesle večjo stroškovno učinkovitost pa se gostijo. In ker je naraščajoče izdatke v zdravstvu popularno kar počez pripisati domnevno visokim cenam zdravil, želimo predstaviti nekaj uradnih podatkov, ki take domneve zavračajo.
Dejstvo je, da so se celotni izdatki za zdravila na recept med leti 2010 in 2017 povišali za 1 odstotek, vendar predvsem, ker se je pomembno povečala količinska poraba zdravil. Stroški zdravstvenih storitev in zdravil bodo v prihodnje predvidoma še naraščali, saj živimo v dolgoživi družbi, kjer se tudi zaradi preventivnih ukrepov, cepiv, inovativnih zdravil in terapij življenjska doba prebivalstva močno podaljšuje, poraba zdravil pa posledično narašča. Vendar kljub temu lahko ugotovimo, da izdatki za zdravila iz obveznega in prostovoljnega zdravstvenega zavarovanja naraščajo počasneje kot poraba zdravil.
Cene zdravil so v Sloveniji strogo regulirane. Stroški za zdravila in živila z liste B, A ter zdravila na recept vključno z delom lekarn so predstavljali v letu 2017 le 15,2 odstotni delež izdatkov Zavoda za zdravstveno zavarovanje Slovenije (ZZZS).
Najvišjo dovoljeno ceno (NDC) za posamezno zdravilo določi Javna agencija Republike Slovenije za zdravila in medicinske pripomočke (JAZMP) na podlagi primerjalnega modela, v katerem upošteva najnižjo ceno posameznega zdravila v Nemčiji, Avstriji in Franciji. Po določitvi NDC bolnišnice izvedejo javna naročila za bolnišnična zdravila, kjer konkurenca med ponudniki ceno zdravila dodatno zniža. Po določitvi NDC za zdravila na recept med ZZZS in farmacevtskimi podjetji stečejo pogajanja o dodatnih popustih za posamezno zdravilo na recept.
Podatki OECD za leto 2016 kažejo, da je Švica za podoben nabor zdravil na prebivalca na leto porabila 898, Nemčija 543, Slovenija pa 229 evrov. V Sloveniji so stroški zdravil na recept v primerjavi z državami s podobnim naborom zdravil na recept tako med najnižjimi v Evropi.
Inovativne farmacevtske družbe po vsem svetu trenutno razvijajo več kot 7.000 novih inovativnih zdravil, za katera upajo, da bodo spremenila potek nekaterih danes neozdravljivih bolezni. Tako kot so inovacije v preteklosti omogočile preživetje in kakovostno življenje bolnikov z AIDS-om, nekatere oblike raka spremenile v dobro obvladane kronične bolezni, bolnikom z različnimi oblikami vnetnega revmatizma prihranile številne hospitalizacije, pojav zgodnje invalidnosti in invalidske upokojitve, delodajalcem na delovna mesta prej vrnile njihove zaposlene, prispevale k večji produktivnosti in družinam omogočile več dragocenih trenutkov z njihovimi najdražjimi.
Ob pogosto zelo posplošenih in včasih tudi zavajajočih razpravah o stroških zdravil je potrebno razmišljati in upoštevati predvsem neposredne in posredne koristih inovativnih zdravil za posameznika in družbo. Ko torej razpravljamo o ceni inovativnih zdravil, imejmo pred očmi tudi njihovo vrednost. Pa ne le za bolnika in njegove bližnje, temveč tudi vrednost v smislu posrednih prihrankov, ki jih inovacije dokazano prinašajo zdravstveni blagajni, gospodarstvu in družbi kot celoti.
V Forumu, ki povezuje 22 inovativnih farmacevtskih družb v Sloveniji, si želijo, da bi bili vključeni v javne razprave o zdravilih, zdravju in zdravstvu, predvsem pa, da bi bili inovativna zdravila in terapije še naprej dostopni in v pomoč slovenskim bolnikom.
“,”Rok Knafelj”,1548252840,1548252840,sl,13755,306,13753,43,0,NULL,”Oblikovanje in gibanje cen zdravil v Sloveniji “,”Oblikovanje in gibanje cen zdravil v Sloveniji “,oblikovanje-in-gibanje-cen-zdravil-v-sloveniji,Post,/sites/43/files/images/IRM_3546.JPG,1,0,1548253039,1551698691
506,13767,”Presaditev krvotvornih matičnih celic ena najbolj razširjenih oblik celičnega zdravljenja”,”Presaditev krvotvornih matičnih celic je ena od najbolj razširjenih oblik celičnega zdravljenja.”,”
Ljubljana, 21. januarja (STA) – Presaditev krvotvornih matičnih celic je ena od najbolj razširjenih oblik celičnega zdravljenja. Danes je z rutinsko presaditvijo mogoče zdraviti več kot 70 malignih in nemalignih bolezni, pri nekaterih hematoloških bolnikih je to še vedno glavna terapevtska in pogosto edina možnost za ozdravitev. Letno na svetu opravijo več kot 50.000 presaditev.
Prvi je s presaditvijo celic kostnega mozga pri bolnikih z napredovano levkemijo pričel Edward Donnall Thomas v ZDA v 50. letih prejšnjega stoletja. Prvi poizkusi so bili neuspešni, a je z novimi spoznanji po desetih letih presaditev postala vse bolj učinkovit način zdravljenja krvnih bolezni. Za svoje delo je Thomas leta 1990 prejel Nobelovo nagrado za medicino.
Prvi poizkusi zdravljenja s presaditvijo so v Sloveniji sledili kmalu za tem. V zgodnjih 60. letih je bilo opravljenih nekaj presaditev v Mariboru, Slovenj Gradcu, Brežicah in na Jesenicah. V Univerzitetnem kliničnem centru Ljubljana s presaditvijo krvotvornih matičnih celic tako zdravijo že 30 let.
Od presaditve kostnega mozga do pridobivanja krvotvornih matičnih celic iz krvi
Krvotvorne matične celice so celice, iz katerih nastanejo vse krvne celice. Pri odraslem se te celice nahajajo v kostnem mozgu. Matične celice, zbrane iz kostnega mozga, so bile dolgo edini dostopni vir za zdravljenje, zato se je ukoreninil izraz presaditev kostnega mozga, čeprav se danes ta način zbiranja razen pri otrocih, uporablja le izjemoma. Darovalcu odvzamejo kostni mozeg s posebnimi iglami iz zadnjih delov medeničnih kosti črevnic. Ker je postopek dolgotrajen in boleč, mora biti darovalec v splošni anesteziji.
S postopkom tako imenovane mobilizacije s kemoterapijo in rastnimi dejavniki pa se za presaditev zadostna količina matičnih celic zbere tudi iz venske krvi, še pojasnjujejo v Društvu bolnikov s krvnimi boleznimi Slovenije.
Krvotvorne matične celice se presajajo predvsem pri zdravljenju malignih ter nekaterih nemalignih bolezni kostnega mozga in drugih krvotvornih organov, na primer pri levkemiji. S presaditvijo krvotvornih matičnih celic se lahko zdravijo tudi nekatere podedovane in avtoimunske bolezni. Kot je razvidno s spletne stran zavoda za transfuzijsko medicino, je uspešnost zdravljenja s presaditvijo krvotvornih matičnih celic pri bolnikih z optimalnimi pogoji dosegla več kot 90 odstotkov.
Od vrste bolezni je tudi odvisno ali bolniku presadijo krvotvorne matičnih celic darovalca, ki jo imenujemo alogenska presaditev, ali pa bolnikove lastne. Pri alogenski presaditvi je darovalec lahko sorodnik, če pa ustreznega darovalca ni med družinskimi člani, lahko krvotvorne matične celice daruje tudi nesorodnik.
Z mednarodnimi registri več možnosti za ustreznega darovalca
Darovalec je najpogosteje brat ali sestra, ki pa mora biti z bolnikom tkivno skladen, kar pomeni, da se mora z njim ujemati v sicer izjemno raznolikih imunsko skladnih celicah. Možnost, da sta v družini z dvema otrokoma sorojenca, ki imata enake tkivne antigene, je le 25-odstotna.
Bolnik, ki nima sorojencev z ustrezni antigeni, ima le malo možnosti, da bi med naključnimi osebami našli skladnega dajalca krvotvornih matičnih celic. Zato so se v mednarodni skupnosti zdravniki odločili za ustanovitev večjih registrov tipiziranih prostovoljnih darovalcev krvotvornih matičnih celic.
Danes je po vsem svetu v mednarodnih registrih vpisanih več kot 20 milijonov prostovoljnih darovalcev. Razpoložljivost darovalcev se je s 25 do 40 odstotkov povečala na 70 do 80 odstotkov, navajajo na zavodu za transfuzijsko medicino. Podatki iz Svetovnega združenja darovalcev kostnega mozga kažejo, da skoraj polovica presaditev krvotvornih matičnih celic opravijo s pomočjo nesorodnih dajalcev.
Iskanje ustreznega darovalca je po besedah strokovne direktorice zavoda za transfuzijsko medicino Polonce Mali “kot bi iskali iglo v kopici sena”. V slovenskem registru nesorodnih darovalcev Slovenija Donor je trenutno vpisanih okoli 20.000 darovalcev. Po izračunih genetskega materiala naj bi za populacijo Slovenije tako število zadostovalo, da bi možnega darovalca našli v slovenskem registru.
“,STA,1548076260,1548076260,sl,13767,306,13766,43,0,NULL,,”Presaditev krvotvornih matičnih celic ena najbolj razširjenih oblik celičnega zdravljenja”,presaditev-krvotvornih-maticnih-celic-ena-najbolj-razsirjenih-oblik-celicnega-zdravljenja,Post,,1,0,1548421971,1548421971
507,13769,”Stres povečuje tveganje za Alzheimerjevo bolezen”,”Tveganje za razvoj Alzheimerjeve bolezni kot najpogostejšega vzroka demence povečujejo številni dejavniki”,”
Koebenhavn, 22. januarja (STA) – Tveganje za razvoj Alzheimerjeve bolezni kot najpogostejšega vzroka demence povečujejo številni dejavniki, med njimi starost, zgodovina bolezni v družini in genetski zapis. Najnovejša raziskava danskih znanstvenikov pa je pokazala, da lahko na razvoj bolezni vplivajo tudi psihološki dejavniki, predvsem stres.
Skupina znanstvenikov z univerze v Koebenhavnu pod vodstvom podoktorske študentke Sabrine Islamoske je raziskovala, ali obstaja povezava med izgorelostjo in Alzheimerjevo boleznijo. Kot se je izkazalo, imajo moški in ženske, ki se v srednjih letih pogosteje znajdejo v stresnih situacijah, večje tveganje za razvoj demence v starosti.
“Te ugotovitve prispevajo k našemu razumevanju psihološke stiske kot pomembnega dejavnika tveganja, ki bi ga morali bolj upoštevati pri preventivnem delovanju v izogib poznejšemu razvoju demence,” je po poročanju časnika Medical News Today komentirala Islamoska.
Kot so pojasnili znanstveniki, je izgorelost lahko odziv na “nerešljive težave” v življenju nekega posameznika, še posebej, kadar je stresnim dejavnikom izpostavljen dlje časa. Na izgorelost lahko torej gledamo kot na znak psihološke stiske.
Že prejšnje raziskave so pokazale, da lahko izgorelost med drugim poveča tveganje za srčno-žilne bolezni, presnovni sindrom, prezgodnjo smrt in debelost.
Znanstveniki pod vodstvom Islamoske so pregledali podatke 6807 sodelujočih v raziskavi o zdravju srca, ki so jo v mestu Koebenhavn izvedeli med letoma 1991 in 1994. Sodelujoči so bili takrat v povprečju stari 60 let. V okviru raziskave so jih spraševali tudi o izgorelosti.
Ekipa znanstvenikov je sodelujoče spremljala do konca leta 2016. Kot so ugotovili, obstaja povezava med izgorelostjo v srednjih letih ter poznejšim razvojem Alzheimerjeve bolezni. Za vsak dodatni simptom izgorelosti se je tveganje, da bodo zboleli za demenco, povečalo za dva odstotka.
Pri sodelujočih, ki so navedli od pet do devet simptomov izgorelosti, je bilo za 25 odstotkov večje tveganje za razvoj demence kot pri tistih brez simptomov izgorelosti. Pri sodelujočih z deset do 17 simptomi izgorelosti pa je bilo to tveganje večje celo za 40 odstotkov.
Pomembno je, da fiziološki odziv na stres, vključno s srčno-žilnimi spremembami in prekomerno proizvodnjo kortizola v daljšem obdobju, prav tako lahko prispeva k povezavi med psihološko stisko in povečanim tveganjem za demenco, je pokazala študija.
“Stres ima lahko hude in škodljive posledice ne le za zdravje naših možganov, pač pa tudi za zdravje na splošno,” je komentirala Islamoska.
Dognanja Islamoske in kolegov so dostopna na povezavi Journal of Alzheimer’s Disease.
“,STA,1548162780,1548162780,sl,13769,306,13768,43,0,NULL,,”Stres povečuje tveganje za Alzheimerjevo bolezen”,stres-povecuje-tveganje-za-alzheimerjevo-bolezen,Post,,1,0,1548422073,1548422074
508,13771,”Lanski prihodki ZZZS za 207 milijonov evrov višji kot v letu 2017″,”Čeprav je bilo leto 2018 za zdravstvo turbulentno, je bilo lansko poslovanje ZZZS ugodno”,”
Ljubljana, 23. januarja (STA) – Čeprav je bilo leto 2018 za zdravstvo turbulentno, je bilo lansko poslovanje ZZZS ugodno, je na današnji novinarski konferenci poudaril generalni direktor zavoda Marjan Sušelj. Po prvi oceni je ZZZS lani ustvaril 207 milijonov evrov več prihodkov kot v letu 2017. Skupni prihodki so bili od odhodkov višji za 32 milijonov evrov.
Preliminarni podatki o poslovanju Zavoda za zdravstveno zavarovanje Slovenije (ZZZS) v letu 2018 kažejo, da so bili prihodki realizirani v višini 2890,5 milijona evrov in so bili za 8,5 milijona evrov višji od načrtovanih, je pojasnila direktorica področja za finance in računovodstvo Daniela Dimić. Odhodki so bili realizirani v višini 2858,5 milijona evrov in so bili pod načrtovanimi za 23,5 milijona evrov.
Presežek prihodkov nad odhodki ZZZS v letu 2018 je torej znašal 32 milijonov evrov, kar povečuje splošni sklad zavoda in predstavlja vir financiranja v prihodnje. Na višje prihodke v primerjavi z načrtovanimi so vplivali predvsem višji prispevki za obvezno zdravstveno zavarovanje, ki so bili posledica večjega števila prejemnikov plač, višje rasti prispevne osnove in višje rasti bruto plač zaposlenih.
Prihodki od prispevkov so po besedah Dimićeve znašali 2761,3 milijona evrov. Predstavljali so 95,5 odstotka vseh prihodkov ZZZS v lanskem letu in so za 3,7 milijona evrov presegli načrtovane. Drugi prihodki so znašali 129,2 milijona evrov, načrtovane pa so presegli za 4,8 milijona evrov, največ zaradi višjih prihodkov po mednarodnih sporazumih.
V primerjavi z letom 2017 so bili odhodki ZZZS v lanskem letu višji za 176 milijonov evrov oziroma za 6,6 odstotka, še vedno pa so bili za 23,5 milijona evrov pod načrtovanimi. Največjo rast je zavod zabeležil pri odhodkih za zdravljenje v tujini (18,2 odstotka), odhodkih za cepiva (17 odstotkov) in odhodkih za nadomestila plače zaradi začasne zadržanosti od dela (10,5 odstotka).
Odhodki za zdravljenje v tujini so v letu 2018 znašali 56,4 milijona evrov in so bili za 3,4 milijona evrov oziroma 6,5 odstotka nad načrtovanimi ter za 4,3 milijona evrov oziroma 8,3 odstotka višji kot v letu 2017. Zvišanje odhodkov je bilo po Sušljevih besedah posledica večjega števila napotitev na zdravljenje v tujini zaradi izčrpanih možnosti zdravljenja v Sloveniji, ne pa posledica dolgih čakalnih dob.
Ugodne trende je ZZZS izkoristil predvsem za zvišanje cen zdravstvenih storitev. Tako so se cene lani zvišale za pet odstotkov, večino tega denarja pa je zavod po Sušljevih besedah namenil tudi za širitve na področju zdravstvenih storitev, predvsem za skrajševanje čakalnih dob na področjih, kjer so težave z dostopnostjo storitev še posebej velike.
“Skušali smo zapolniti vrzeli tudi na primarni zdravstveni ravni. Pripravljeni smo bili financirati 54 novih oziroma dodatnih timov družinske medicine in pediatrov. Na žalost nam vsega ni uspelo vzpostaviti, saj izvajalci niso prijavili dodatnih timov. Tako nam je decembra lani ostalo še 19 nepokritih timov,” je opozoril Sušelj.
Ob tem je generalni direktor ZZZS poudaril, da se po dvoletnih vlaganjih v dodatne programe od lanskega septembra kažejo tudi prvi pozitivni trendi pri skrajševanju čakalnih dob. Po njegovih besedah pri slikovni diagnostiki, magnetni resonanci, računalniški tomografiji ter tudi pri drugi radiološki diagnostiki “čakalnih dob praktično ni več”.
Podatki, ki jih Nacionalni inštitut za javno zdravje spremlja na področju e-naročanja, pa kažejo, da so se od aprila do konca leta 2018 pomembno skrajšali tudi skupni čakalni seznami. “Tako imamo v primerjavi z aprilom 11 odstotkov manj čakajočih, kar pomeni 17.341 oseb. V enakem obdobju so se za 5,6 odstotka skrajšale tudi najbolj boleče, nedopustno dolge čakalne dobe,” je navedel Sušelj.
Po njegovih besedah se kaže tudi, da denar ni več glavna ovira za skrajševanje čakalnih dob, ampak je to pomanjkanje kapacitet, predvsem na primarni zdravstveni ravni: “Ponovno pa je treba opozoriti, da je sistem načrtovanja, odobravanja in dogovarjanja programov zahteven in dolg. Tudi v letu 2018 smo bili pri tem počasni.”
Sušelj pa je tudi opozoril, da bo treba zavihati rokave pri pripravi sprememb zakonodaje na področju zdravstvenega zavarovanja. Želi si, da bi bila nova zakonodaja nared že do konca letošnjega leta ali najkasneje v prvi polovici prihodnjega.
“,STA,1548249300,1548249300,sl,13771,306,13770,43,0,NULL,,”Lanski prihodki ZZZS za 207 milijonov evrov višji kot v letu 2017″,lanski-prihodki-zzzs-za-207-milijonov-evrov-visji-kot-v-letu-2017,Post,,1,0,1548422189,1548422190
509,13773,”Kadri v primarnem zdravstvu: V Kranju družinski zdravniki ne vpisujejo več novih bolnikov”,”V Zdravstvenem domu Kranj se soočajo z velikim pomanjkanjem zdravnikov družinske medicine. “,”
Kranj, 30. januarja (STA) – V Zdravstvenem domu Kranj se soočajo z velikim pomanjkanjem zdravnikov družinske medicine. Noben od njih ne more več vpisovati novih bolnikov, zato občanom svetujejo, da si osebnega zdravnika izberejo drugje. Po besedah direktorice Lilijane Gantar Žura so razmere iz leta v leto slabše.
Kranjski zdravstveni dom ima 34 splošnih ambulant in 495 zaposlenih. Nove bolnike je v zadnjih tednih sprejemala le še ena zdravnica, sedaj pa je tudi ona dosegla opredeljeno kvoto registriranih bolnikov. Zato lahko v Kranju nove bolnike sprejemajo le izjemoma, in sicer tiste, ki so nepokretni ali starejši in res ne morejo imeti osebnega zdravnika v drugem kraju.
Preostali, ki še nimajo izbranega zdravnika, se bodo morali registrirati pri zdravnikih v drugih krajih. Vodja ambulant družinske medicine Tatjana Kitić Jaklič je na današnji novinarski konferenci v Kranju pojasnila, da je obremenjenost družinskih zdravnikov v Kranju 118-odstotna. Za drastičen ukrep, da prenehajo vpisovati nove bolnike, pa so se odločili, ker si želijo kakovostno obravnavati vsakega bolnika.
Kranjčane pozivajo, naj se v tej hudi stiski pomanjkanja zdravnikov registrirajo v Tržiču ali Škofji Loki, kjer so nove ambulante in imajo še proste zmogljivosti. Te naj bi bile na voljo tudi v Kamniku.
V Škofji Loki, kjer so prav tako dolgo imeli težave, konec lanskega leta pa so dobili dva nova zdravnika, lahko trenutno sprejmejo še okoli 1000 bolnikov, je povedal direktor tamkajšnjega zdravstvenega doma Aleksander Stepanović, ki je tudi strokovni vodja Osnovnega zdravstva Gorenjske.
Vendar je to le začasna rešitev. Problem se vleče že dolgo časa in nanj opozarjajo tudi drugi zdravstveni domovi po državi, vendar pa jim po Stepanovićem vedenju doslej še nikjer ni bilo treba potegniti tako drastične poteze, kot so jo sedaj v kranjskem zdravstvenem domu.
Ne bo pa okrnjena oskrba nujnih stanj in akutno zbolelih, je zagotovila Gantar Žura in dodala, da imajo ti še vedno vstopno točko v dežurni ambulanti, kjer jim nudijo nujne zdravniške storitve, vse ostale storitve, kot so napotnice, kronične terapije ali kontrola po akutnem obolenju, pa bodo morali urejati pri osebnem zdravniku, ki si ga bodo morali izbrati v drugem kraju.
V Kranju trenutno manjkajo štiri ambulante družinske medicine. Primanjkuje pa jim tudi nekaterih drugih kadrov, in sicer radiologov in pediatrov. Kot je pojasnila Gantar Žura, se te težave, zlasti kar se tiče zdravnikov družinske medicine, vlečejo že deset let.
Stalno opozarjajo na njih, vendar izboljšanja ni, situacija se celo slabša. Prepričana je, da bi morali najti sistemsko rešitev skupaj z zdravniško zbornico, zavarovalnico in ministrstvom za zdravje.
Tudi specializanti, ki jih imajo, ne bodo rešili problematike, saj jih je premalo, veliko zdravnikov pa je tik pred upokojitvijo. “Le malo zdravnikov se po diplomi odloča za specializacijo družinske medicine,” je opozorila Gantar Žura in kot osrednji razlog izpostavila preobremenjenost družinskih zdravnikov.
“Situacija je vse slabša. Nalaga se nam vse več dela. Hospitalizacije se denimo krajšajo in vse bolj kompleksni bolniki prihajajo v primarno oskrbo. To potegne za seboj vse od negovalnega kadra do zdravniške oskrbe, ki je veliko bolj zahtevna in vzame precej več časa, zdravniki pa imajo omejen čas za bolnike,” je opozorila na začaran krog.
Bolniki težko pridejo do osebnega zdravnika, težko ga že samo prikličejo, da se naročijo, saj imajo v vsaki od ambulant družinske medicine v Kranju tudi po 150 do 200 klicev na dan. Težko je delati triažo in vse bolnike pregledati. Dogaja se naval na dežurne ambulante, zaradi česar so bili primorani na Gorenjskem uvesti plačevanje nenujnih zdravstvenih storitev v dežurnih ambulantah.
“Naši zdravniki so zgarani, zato se dogajajo daljše bolniške odsotnosti in izgorelost. Zelo predana in delovna zdravnica nam je celo umrla na delovnem mestu. Zdravniki nam zaenkrat še ne uhajajo na druga delovna mesta, a bojim se, da bodo začeli,” je opozorila.
Tudi drugod na Gorenjskem primanjkuje kadra v primarnem zdravstvu, ki je bil po Stepanovićevih besedah zadnja leta močno zapostavljen, medtem ko se je vlagalo v sekundarni nivo. Splošnih zdravnikov primanjkuje na Bledu, Jesenicah in Radovljici. Na Jesenicah, Bohinju, Kranju in Škofji Loki je premalo pediatrov. V Tržiču in Radovljici manjka okulist. Na Gorenjskem bi potrebovali tudi več radiologov in še enega dermatologa.
“,STA,1548842400,1548842400,sl,13773,306,13772,43,0,NULL,,”Kadri v primarnem zdravstvu: V Kranju družinski zdravniki ne vpisujejo več novih bolnikov”,kadri-v-primarnem-zdravstvu-v-kranju-druzinski-zdravniki-ne-vpisujejo-vec-novih-bolnikov,Post,,1,0,1548926070,1548926544
510,13775,”Gensko spremenjene kokoši valijo zdravila”,”Raziskovalci z univerze v škotskem Edinburghu so kokoši genetsko spremenili tako, da v jajcih proizvajajo človeške beljakovine”,”
Edinburgh, 28. januarja (STA) – Raziskovalci z univerze v škotskem Edinburghu so kokoši genetsko spremenili tako, da v jajcih proizvajajo človeške beljakovine, ki so lahko osnova zdravil. Upajo, da bo njihov projekt nekega dne vodil v mnogo cenejše terapije, ki rešujejo življenja.
Zdravila na osnovi beljakovin, kot sta na primer terapiji za raka Herceptin in Avastin, so lahko učinkovita, ko odpovedo tradicionalna zdravila, a njihova pomanjkljivost je, da so zelo draga. Raziskava znanstvenikov inštituta Roslin, ki jo vodijo skupaj s povezanim podjetjem Roslin Technologies, pa bi lahko pomenila mnogo cenejše proizvodne procese, piše britanski BBC.
Ekipa raziskovalce z inštituta Roslin je genome kokoši spremenila tako, da njihova jajca vsebujejo velike količine visoko kakovostnih beljakovin. Samo tri jajca vsebujejo klinično pomembno dozo, so navedli. Te beljakovine bodo sedaj najprej uporabili v raziskavah, a laboratorijski preizkusi so že pokazali, da so najmanj tako učinkovite kot enakovredna zdravila.
Kokoši so za zdaj genetsko spremenili tako, da proizvajajo dva tipa beljakovin. Ena je makrofag CFS, ki jo razvijajo kot terapijo za stimulacijo poškodovanega tkiva, da bi se to samo popravilo. Razvijajo jo v človeški in prašičji različici.
Druga je interferon alfa-2a. Gre za človeku lastni protein, ki se odziva kot del človekovega imunskega sistema. Ima antivirusne lastnosti, pri njem pa so po besedah doktorice Lissa Herron iz podjetja Roslin Technologies odkrili tudi protikancerogene lastnosti. “Gre za protein, ki se že nekaj časa uporablja za zdravljenje hepatitisa pri določenih oblikah raka,” je dodala.
Ekipa raziskovalcev je prepričana, da lahko še razširi nabor beljakovin, ki jih bodo valile transgene kokoši. Samih kokoši navzočnost človeških proteinov v njihovem telesu ne prizadene, tudi živijo bolje kot kokoši v baterijski reji, saj pač valijo jajca, kot običajno.
Raziskava sicer poteka v zavarovanem objektu znotraj inštituta Roslin, kjer v prostornih kokošnjakih vzrejajo več deset transgenih živali, katerih naloga je zvaliti 300 jajc letno. Družbo jim delajo tudi petelini, ki imajo dvojno vlogo.
Kokoši namreč bolj valijo jajca, če je v njihovi bližini petelin. Poleg tega samce potrebujejo za vzrejo več transgenih kokoši. Te namreč niso kloni, ampak na svet pridejo na konvencionalen, biološki način.
“V kokošnjaku imamo petelina, ki lahko v zelo kratkem času proizvede zelo veliko piščet,” je povedala profesorica Helen Sang z inštituta Roslin
Jajca, ki jih zvalijo kokoši, nato potujejo v od kakofonije kokošnjakov ločeni laboratorij, kjer jih razbijejo in rumenjake ločijo od beljakov. Rumenjakov ne uporabijo, beljak pa je tisti, ki vsebuje velike količine medicinsko pomembnih beljakovin.
“Te proteine je resnično drago proizvesti, saj jih ni mogoče sintetizirati v laboratoriju,” je povedala doktorica Herron. “Zanje je potreben živeči sistem, saj so proteini zelo velike in zelo kompleksne molekule, ki za pravilno izdelavo potrebujejo ves ustroj celice,” je dodala Herronova.
Transgene kokoši bi tako lahko postale pionirke pri proizvodnji boljših in cenejših zdravil. Tudi pri tej raziskavi, tako kot pri vseh, ki obetajo, sicer obstaja težava. Do dejanskega nastanka prelomnega zdravila morajo poteči tudi desetletja nadaljnjih raziskav in preizkusov. A pot do t. i. zdravil sirote za redke bolezni je lahko precej krajša, zdravila za živali pa pridejo na trg še prej, še dodaja BBC.
“,STA,1548666900,1548666900,sl,13775,306,13774,43,0,NULL,,”Gensko spremenjene kokoši valijo zdravila”,gensko-spremenjene-kokosi-valijo-zdravila,Post,,1,0,1548926174,1548926175
511,13777,”Študija: Pozen večerni obrok vendarle ne škoduje zdravju”,”Ljudje, ki imajo navado jesti pozno zvečer, imajo zaradi tega pogosto slabo vest, saj je to po mnenju zdravnikov slabo za zdravje.”,”
Tokio, 28. januarja (STA) – Ljudje, ki imajo navado jesti pozno zvečer, imajo zaradi tega pogosto slabo vest, saj je to po mnenju zdravnikov slabo za zdravje. A, kot je pokazala nova japonska študija, to ni nujno.
Številni strokovnjaki zagovarjajo stališče, da se je treba pozno zvečer izogibati obrokom. Na Japonskem velja celo javno priporočilo, naj od zadnjega obroka do odhoda na počitek mineta vsaj dve uri.
Študija, ki so jo izvedli v deželi vzhajajočega sonca, pa je pokazala, da to ni potrebno. Do zdaj so strokovnjaki menili, da obrok, zaužit pred spanjem, povečuje tveganje za razvoj bolezni, povezanih s povišano ravnjo sladkorja v krvi, kot so sladkorna bolezen in bolezni srca.
Vendar ker za to niso imeli dokazov, so japonski znanstveniki analizirali zdravstvene podatke 1573 oseb srednjih let, ki niso imele zdravstvenih težav, povezanih z ravnjo sladkorja v krvi. Razdelili so jih v dve skupini – na tiste, ki so se morali držati dvournega razmika med zadnjim obrokom in spanjem, ter tiste, ki niso imeli te omejitve.
Raziskava je trajala tri leta in izkazalo se je, da med skupinama ni bilo nobenih pomembnih razlik v ravni sladkorja v krvi. Po drugi strani so podatki pokazali, da imajo drugi dejavniki, kot so telesna teža, kajenje in fizična aktivnost, veliko pomembnejšo vlogo pri razvoju bolezni, kot pa obrok pred spanjem.
“Veliko več pozornosti je treba posvetiti zdravi prehrani, zadostni količini spanca, izogibanju cigaretam in alkoholu kot tudi debelosti, saj so imele prav te spremenljivke večji vpliv na metabolizem kot pa pozen večerni obrok,” so ugotovili japonski znanstveniki.
“,STA,1548667020,1548667020,sl,13777,306,13776,43,0,NULL,,”Študija: Pozen večerni obrok vendarle ne škoduje zdravju”,studija-pozen-vecerni-obrok-vendarle-ne-skoduje-zdravju,Post,,1,0,1548926279,1548926279
513,13780,”Na področju paliativne oskrbe nujen prehod od besed k dejanjem”,”Paliativna oskrba presega stroge okvire zdravstva in mora biti prepoznana kot pomembna družbena vrednota”,”
Maribor, 30. januarja (STA) – Paliativna oskrba presega stroge okvire zdravstva in mora biti prepoznana kot pomembna družbena vrednota, je na današnjem posvetu v Mariboru povedala državna koordinatorica za paliativno oskrbo Mateja Lopuh. Po ocenah sodelujočih je ključno, da se na tem področju čim prej preide od besed k dejanjem in uredi ustrezno organizacijo.
Namen posveta z naslovom Gradimo mostove k ljudem, ki ga je v prostorih Univerzitetnega kliničnega centra (UKC) Maribor priredilo Slovensko združenje paliativne in hospic oskrbe, je povezovanje strokovne in laične javnosti s ciljem prepoznavanja potreb po ustrezni ureditvi paliativne oskrbe v državi in povezovanja med deležniki.
“Z izjemnim zadovoljstvom spremljamo razvoj mreže nujne medicinske pomoči in se seveda zavedamo, da je reševanje življenj v tem smislu zagotovo prioriteta države. A pogrešamo enako podporo razvoju paliativne mreže, ki je prav tako pomembna,” je povedala Lopuhova.
Na papirju so že nekatere rešitve, a manjka njihovo uresničevanje v praksi. Takšen primer so mobilne paliativne enote, čeprav so predvidene v državnem programu paliativne oskrbe iz leta 2010. Zaenkrat takšna enota deluje le v okviru jeseniške bolnišnice. “Naša bolnišnica ni čakala na sistemske ureditve, ampak smo to potrebo prepoznali in jo, tudi ob veliki politični podpori gorenjskih županov, speljali,” je povedala Lopuhova, ki vodi trenutno edino takšno enoto v Sloveniji. “Lahko se pohvalimo s tem, da lahko tudi nekdo, ki živi popolnoma sam, ostane v domačem okolju, ker zagotavljamo tudi negovalno pomoč.”
Ta enota deluje od leta 2011 in število ljudi, ki si želijo takšne pomoči na domu, se je do leta 2018 povečalo z 80 bolnikov letno na 500. “Naša enota zagotavlja 24-urno pripravljenost vseh sedem dni v tednu. Naši bolniki in njihovi svojci najbolj cenijo to stalno številko, kamor lahko pokličejo. Ob tem bi rada poudarila, da svojci ob zadostni podpori zmorejo neverjetno veliko. To je ena redka lastnost v Sloveniji, na katero moramo biti ponosni, jo spodbujati. Nikakor jih ne smemo pustiti samih, ampak še več naporov vložiti v to, da bodo to oskrbo zmogli,” je dejala.
Za delovanje ene mobilne enote, ki naj bi po državnem programu pokrila območje s 100.000 prebivalci, bi potrebovali okoli 350.000 evrov letno plus opremo, kot so vozilo, prostori in medicinski aparati. “To niso tako potratne strukture, kot smo jih sicer v zdravstvu navajeni. Majhen vložek lahko torej prinese veliko miru številnim bolnikom in njihovim družinam,” je poudarila Lopuhova.
Večina bolnikov si namreč želi svoje zadnje dni preživeti v domačem okolju. “Na žalost vsi ne zmorejo sami, zato potrebujejo pomoč,” je povedala predstojnica oddelka UKC Maribor za onkologijo Maja Ravnik. Določena mreža že obstaja, a zaenkrat preveč sloni na prostovoljstvu. “Potrebujemo organizacijo različnih služb. Moramo se spoznati in povezati, da omogočimo človeka vredno bivanje,” je dodala.
Dokler se to ne uredi, je po besedah direktorja UKC Maribor Vojka Flisa “cinično” razpravljati o vprašanjih, kot je evtanazija. Takšna srečanja, kot je današnje, se mu zdijo zelo pomembna, ker je treba širšo družbo opozoriti na nujnost ustrezne skrbi za ljudi do zadnjega dne njihovega življenja, preden bi odločali o možnostih njegovega končanja. “Premiki so nujno potrebni. Treba je to, kar je država na ravni institucij v zadnjih desetih letih že sprejela, spraviti v življenje in resnično pomagati ljudem,” je dodal.
Posveta se je udeležil tudi predsednik DZ Dejan Židan. “Na področju paliativne oskrbe se v Sloveniji od leta 2010 dogajajo koraki v pravo smer. V tem trenutku pa je treba narediti razmislek in korak v smer, da ljudi, ki so neozdravljivo bolni, ne potiskamo v institucije, ampak jim omogočimo, da ostanejo do konca svojega življenja doma,” je povedal.
Poudaril je, da je smrt del življenja, zato ne bi smela biti tabu v družbi. Zato tudi podpira razpravo o evtanaziji. “A mora biti vodena strokovno,” je dodal.
“,”Jaka Verbic Miklic”,1548840240,1548840240,sl,13780,306,13778,43,0,NULL,,”Na področju paliativne oskrbe nujen prehod od besed k dejanjem”,na-podrocju-paliativne-oskrbe-nujen-prehod-od-besed-k-dejanjem,Post,,1,0,1548926681,1548926681
514,13782,”Stroka svari pred elektronskimi cigaretami in alternativnimi tobačnimi izdelki”,”Svetovni dan brez cigarete, ki ga obeležujemo danes, naj vsem kadilcem pomeni priložnost za opustitev kajenja”,”
Ljubljana, 31. januarja (STA) – Svetovni dan brez cigarete, ki ga obeležujemo danes, naj vsem kadilcem pomeni priložnost za opustitev kajenja, so pozvali na NIJZ. Kljub ukrepom ministrstva za zdravje stroka opozarja, da tobačna industrija že ima alternative, kot so elektronske cigarete in alternativne tobačne izdelki, ki jih zakonodaja ne pokriva.
Ministrstvo za zdravje si skupaj s stroko in civilno družbo z različnimi ukrepi, od prepovedi kajenja v vseh zaprtih javnih in delovnih prostorih do številnih drugih učinkovitih ukrepov, ki so bili uvedeni leta 2017, prizadeva preprečevati začetek kajenja in spodbujati opuščanje kajenja, so v sporočilu zapisali na Nacionalnem inštitutu za javno zdravje (NIJZ).
Z novimi zakonskimi ukrepi se je Slovenija po oceni NIJZ pridružila najnaprednejšim državam v svetu na tem področju. Od januarja 2020 bodo cigarete in tobak za zvijanje na voljo le še v enotni embalaži, z enotno barvo obliko in velikostjo elementov na embalaži. Zaključujejo tudi izdajo dovoljenj za prodajo tobačnih in povezanih izdelkov. V primeru ugotovljenih pravnomočnih kršitev zakonodaje bodo prodajalcem dovoljenje odvzeli in s tem preprečili prodajo tobaka, tobačnih in povezanih izdelkov, so napovedali.
Pomembno spremembo, ki jo vsebuje tudi leta 2017 sprejet zakon o omejevanju uporabe tobačnih in povezanih izdelkov, predstavlja tudi prepoved prodaje cigaret in tobaka za zvijanje, ki v kateri koli od komponent, kot so filtri, papir, ovoji ali kapsule, vsebujejo aromo, kar je predvidela uredba Evropske unije. Nemško podjetje Planta Tabak je s tožbo nasprotovalo uredbi, ki pa jo je Sodišče EU v sredo ponovno potrdilo z utemeljitvijo, da aroma prikriva okus tobaka in spodbuja porabo, s čimer ogroža zdravje.
Ministrstvo je ob sprejetju zakona uspelo zagotoviti tudi občutno povišanje sredstev za izvajanje programov za preprečevanje začetka kajenja in za opuščanje kajenja.
“Znano je, da imajo kadilci v primerjavi z nekadilci skoraj 23-krat večje tveganje za to, da umrejo zaradi posledic pljučnega raka, 25-krat večje tveganje za smrt zaradi kronične obstruktivne pljučne bolezni, dvakrat večje tveganje za smrtni izid zaradi pljučnice, gripe in tuberkuloze ter ostalih pljučnih bolezni,” je opozorila Saša Kladivec s Klinike Golnik.
Helena Koprivnikar z NIJZ priporoča, da kadilci, ki želijo opustiti kajenje, pri tem uporabljajo preizkušeno in dokazano varne ter učinkovite izdelke, ki so na voljo v lekarnah ali jih predpiše zdravnik na recept, ne pa na primer elektronskih cigaret, za katere vplivi še niso dokazani.
Na NIJZ so kot zaskrbljujočo ocenili uporabo elektronske cigarete med mladostniki in mladimi odraslimi, saj zvišuje tveganje za začetek kajenja cigaret med tistimi, ki sicer ne kadijo. “V Sloveniji elektronske cigarete uporablja višji delež mladih kot odraslih. V raziskavi iz leta 2017 je 12 odstotkov anketiranih 17-letnih dijakov iz vse Slovenije poročalo, da so v zadnjih 30 dneh uporabili elektronske cigarete, medtem ko je v letu 2016 med odraslimi, starimi 25-74 let, elektronsko cigareto v zadnjih 30 dneh uporabilo manj kot odstotek vprašanih,” so zapisali na NIJZ.
Jan Peloza z Inštituta za mladinsko participacijo, zdravje in trajnostni razvoj je kot zanimivo izpostavil spremembe pri trendih kajenja med mladimi v desetih letih in kako se je v tem času odzvala tobačna industrija. “Če smo še pred nekaj leti verjeli, da bo enotna embalaža zabila še zadnji žebelj v krsto tobačnih podjetij, je zdaj jasno, da bodo še pred dejanskim začetkom izvajanja člena tobačnega zakona o enotni embalaži imela kar precej alternativnih možnosti, ki jih ta ukrep ne bo pokrival. Kot vidimo so to elektronske cigarete, pa tudi izdelki, ki se ogrevajo in ne gorijo, tobak za oralno rabo ipd. Zanimivo je, koliko potencialov za regulacijo te smrtonosne industrije še imamo pri nas, zato je po moji oceni stroga regulacija, ki smo jo v Sloveniji uvedli leta 2017, le začetek,” je ocenil Peloza.
V Sloveniji so vsem, ki želijo opustiti kajenje, na voljo različne vrste pomoči, kot so svetovanje pri osebnem zdravniku in farmacevtu, skupine za opuščanje kajenja v okviru zdravstvenovzgojnih delavnic v zdravstvenih domovih ter odvajanje z nikotinskimi nadomestili in zdravili na recept, so ob dnevu sporočili iz sekcije medicinskih sester in zdravstvenih tehnikov v pulmologiji pri Zbornici zdravstvene nege. Različne programa opuščanja kajenja izvajajo tudi nevladne organizacije.
“,STA,1548926220,1548926220,sl,13782,306,13781,43,0,NULL,,”Stroka svari pred elektronskimi cigaretami in alternativnimi tobačnimi izdelki”,stroka-svari-pred-elektronskimi-cigaretami-in-alternativnimi-tobacnimi-izdelki,Post,,1,0,1549271924,1549271925
515,13784,”Kadri v primarnem zdravstvu: Na Ptuju največ pomanjkanja v zobnem zdravstvu”,”V Zdravstvenem domu Ptuj posebej hudih težav s pomanjkanjem kadrov trenutno ne beležijo.”,”
Ptuj, 01. februarja (STA) – V Zdravstvenem domu Ptuj posebej hudih težav s pomanjkanjem kadrov trenutno ne beležijo. Kot je za STA povedala direktorica Metka Petek Uhan, to velja tako za medicinske sestre kot za zdravnike in ostalo osebje, saj ne beležijo morebitnih odpovedi in selitev v druge zdravstvene ustanove. Iščejo pa specialiste v zobnem zdravstvu.
Ptujski zdravstveni dom zaposluje 220 ljudi, med katerimi je trenutno 48 zdravnikov. Po besedah direktorice glede slednjih posebnih težav nimajo, še več, njihove vrste zadnje čase celo polnijo, tako da imajo na voljo dovolj kadra, razen v času bolj množičnih bolniških in porodniških dopustov, saj so dokaj mlad kolektiv.
V nasprotju z nekaterimi drugimi zdravstvenimi domovi ni težav niti na področju družinske medicine. Še boljše bo od letos, saj bodo v kratkem pridobili tri nove specialiste družinske medicine, zato je po besedah Petek Uhanove njihova prihodnost v primerjavi z nekaterimi drugimi kraji po Sloveniji precej svetla.
Primanjkuje pa jim specialistov v zobnem zdravstvu, a se trudijo, da bi jih dobili preko zdravniške zbornice. Začasno si pomagajo s tremi zunanjimi, a že imajo specializantko, ki bo vrzel v prihodnje pokrila. Enako velja za ortodontijo, kjer je ena od njihovih specialistk odšla, do prihoda novega specializanta pa so tudi to pokrili s pomočjo od zunaj.
Čeprav na Ptuju ni večjih težav, pa bi si v prihodnje želeli pridobiti še vsaj dva specialista urgentne medicine. Kot pravi direktorica, ni težava v tem, da jim specializacije ne bi odobrili, pač pa predvsem, da ni kandidatov, ki bi se odločili za to pot. Eno specialistko sicer dobijo v kratkem, še letos pa naj bi specializacijo končal še eden od kolegov, tako da bo tudi to področje kolikor toliko pokrito.
Petek Uhanova pravi, da so čakalne dobe v njihovi ustanovi v večini programov precej znižali in tako ne beležijo večjih težav, izjema pa je ortodontija, kjer so daljše čakalne vrste za aparate. “Tukaj bi dejansko morali pridobiti dodatni program, s tem pa seveda tudi dodatnega specialista,” je dejala direktorica ptujskega zdravstvenega doma.
Po njenih besedah bi bilo potrebno dodaten zdravstveni kader, kjer je to problematično, privabiti s primernim plačilom, kar še posebej velja zaradi načina dela, ki se uveljavlja v urgentni medicini. Izmensko delo namreč po njenem mnenju za vse zdravnike, predvsem mlajše, ni najbolj zanimivo, saj pomeni večje obremenitve.
“Vendar se bodo verjetno našli tudi taki, ki se bodo odločali za tako delo. Že zdaj so specialisti urgentne medicine uvrščeni za tri plačilne razrede višje, a očitno tudi to ni dovolj, da bi jih pritegnili v to delo,” pravi Petek Uhanova.
Na Ptuju bodo sicer v naslednjem obdobju kar izdatno zaposlovali, saj s 1. marcem začenjajo tudi novo dejavnost. Postali so namreč eden od petih zdravstvenih domov v Sloveniji, kjer bodo vzpostavili center za duševno zdravje. Za te potrebe bodo postopno zaposlili 30 ljudi, večinoma visoko izobražen kader, od zdravnikov in kliničnih psihologov, socialnih delavcev, delovnih terapevtov do ostalih zdravstvenih delavcev.
Zdravstveni dom Ptuj poleg ptujske občine izvaja primarno zdravstveno varstvo tudi za občine Hajdina, Kidričevo, Podlehnik, Žetale, Videm pri Ptuju in Zavrč, s čimer pokriva okoli 70.000 ljudi. Po besedah direktorice prvi podatki o poslovanju za lansko leto kažejo, da so ga zaključili brez izgube, za zdaj pa natančne bilance še izdelujejo.
“,STA,1549012740,1549012740,sl,13784,306,13783,43,0,NULL,,”Kadri v primarnem zdravstvu: Na Ptuju največ pomanjkanja v zobnem zdravstvu”,kadri-v-primarnem-zdravstvu-na-ptuju-najvec-pomanjkanja-v-zobnem-zdravstvu,Post,,1,0,1549271997,1549272007
517,13792,”Bolniki v EU odslej varnejši pred ponarejenimi zdravili”,”Nad ponarejena zdravila v EU z edinstvenimi zaščitnimi elementi “,”
Od 9. februarja 2019 dalje bodo vsa zdravila, izdana na recept, na evropski trg poslana z edinstvenimi zaščitnimi elementi za preverjanje avtentičnosti vsakega posameznega pakiranja zdravila, ki bodo zagotavljala sledljivost zdravil od proizvajalcev do končnih uporabnikov, boljšo zaščito proizvajalcev zdravil in najpomembnejše – večjo varnost bolnikom.
Ponarejena zdravila predstavljajo resno grožnjo javnemu zdravju, primerov ponaredkov zdravil pa je vse več. Za učinkovitejši boj proti ponaredkom v zakoniti verigi preskrbe z zdravili morajo države članice Evropske unije 9. februarja 2019 pričeti z izvajanjem določil Delegirane uredbe (2016/161/EU), ki zagotavlja sledljivost zdravil od proizvajalca do končnega uporabnika, večjo varnost za bolnike ter učinkovitejšo zaščito proizvajalcev zdravil.
Delegirana uredba predpisuje obvezno nameščanje zaščitnih elementov na vsa zdravila, ki se izdajajo na recept. Vsako pakiranje zdravila, ki se izdaja na recept, bo tako opremljeno z edinstveno oznako v obliki dvodimenzionalne črtne kode in berljivo obliko zapisa ter pripomočkom za zaščito pred poseganjem v zdravilo.
Za preprečevanje vstopa ponarejenih zdravil na evropski trg so morale po omenjeni uredbi države članice EU vzpostaviti nacionalne informacijske sisteme za preverjanje in deaktivacijo zaščitnih elementov zdravil (NMVS), Evropska organizacija za verifikacijo zdravil (EMVO) pa centralno evropsko vozlišče (EMVS), prek katerega proizvajalci zdravil vnašajo podatke o zaščitnih elementih na vsako pakiranje zdravila, ki se v nadaljevanju izmenjujejo z z nacionalnimi sistemi za preverjanje avtentičnosti zdravil.
V Sloveniji je za vzpostavitev in upravljanje nacionalnega informacijskega sistema pooblaščen Zavod za preverjanje avtentičnosti zdravil – ZAPAZ, ki so ga 6. oktobra 2016 ustanovili predstavniki vseh deležnikov v verigi preskrbe z zdravili: Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ; Združenje proizvajalcev zdravil Slovenije, GIZ; Lekarniška zbornica Slovenije in Trgovinska zbornica Slovenije – Sekcija veletrgovcev z zdravili na debelo.
ZAPAZ je v preteklih dveh letih uspešno vzpostavil nacionalni informacijski sistem za preverjanje avtentičnosti zdravil – SiMVS, ki se je aprila 2018 po pozitivnem revizijskem poročilu Evropske organizacije za verifikacijo zdravil (EMVO) kot prvi priključil na centralno evropsko vozlišče: »Odtlej smo z našimi storitvami pomagali lekarnam in veletrgovcem, da svoje informacijske sisteme prilagodijo in jih priklopijo na nacionalni informacijski sistem ter skladno z omenjeno uredbo pričnejo z izmenjavo podatkov zaščitnih elementov na pakiranjih zdravil. Poleg tega smo v zadnjem letu z več kot 200 imetniki dovoljenj za promet z zdravili in imetniki začasnih dovoljenj za izredni uvoz zdravil sklenili pogodbe, ki nas obvezujejo, da bomo nacionalni informacijski sistem ustrezno vzdrževali in da bodo prenosi podatkov potekali nemoteno. V prihodnje pa bo naša naloga predvsem zagotavljanje stične točke med proizvajalci na eni ter lekarnami in veletrgovci na drugi strani v primeru reševanja morebitnih alarmov, s katerimi informacijski sistem izdajatelju zdravila sporoča sum, da je zdravilo ponarejeno. Če se izkaže, da je sum utemeljen, nadzor nad inšpekcijskim postopkom prevzame Javna agencija RS za zdravila in medicinske pripomočke. V začetnem obdobju pričakujemo nekaj več tehničnih težav, saj se podatki v informacijski sistem še nalagajo, in vendar upamo, da bo teh težav čim manj,« je ob začetku izvajanja uredbe pojasnil direktor ZAPAZ-a Mitja Pirman.
Generalna sekretarka Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ, mag. Barbara Stegel pa je izrazila zadovoljstvo nad uspešno vzpostavitvijo novega sistema verifikacije zdravil, saj je bila prav inovativna farmacevtska industrija pobudnik za vzpostavitev sistema dodatne zaščite zdravil: »Forum je kot predstavnik inovativne farmacevtske industrije v Sloveniji priznan in zanesljiv partner v prizadevanjih za najboljše rešitve na področjih zdravil, zdravja in zdravstva. Ker se zavedamo nevarnosti, ki jo lahko za zdravje prebivalstva predstavljajo ponarejena zdravila, smo si vseskozi prizadevali za vzpostavitev sistema dodatne zaščite, ki bo omogočal sledljivost in preverjanje avtentičnosti vsakega posameznega pakiranja zdravila, onemogočal nepooblaščene posege v ovojnino zdravil in bolnikom zagotavljal večjo varnost. Čeprav so ponarejena zdravila najbolj razširjena in dostopna prek novih tehnologij na svetovnem spletu, pred njimi žal ni povsem varna niti zakonita veriga preskrbe z zdravili. Zato smo z veseljem pristopili k izvajanju evropske zakonodaje, s katero bomo v boju proti ponarejanju zdravil zagotovo uspešnejši. Forum je sicer tudi pobudnik ustanovitve in ustanovni član Zavoda za preverjanje avtentičnosti zdravil – ZAPAZ, znotraj katerega smo skupaj s preostalimi deležniki v verigi preskrbe zdravil v Sloveniji vzpostavili ustrezen informacijski sistem preverjanja avtentičnosti zdravil in odlično sodelovanje, ki omogočata učinkovitejše preprečevanje vdora ponarejenih zdravil v zakonito verigo preskrbe z zdravili in tlakujeta pot za čim hitrejše in usklajeno odzivanje ob morebitnih sumih ponarejenih zdravil. In najpomembnejše – prepričani smo, da nov sistem verifikacije zdravil zagotavlja večjo varnost bolnikom tako v Sloveniji, kot v drugih državah članicah Evropske unije.«
“,”Rok Knafelj”,1549444620,1549537500,sl,13792,306,13791,43,0,NULL,,”Bolniki v EU odslej varnejši pred ponarejenimi zdravili”,bolniki-v-eu-odslej-varnejsi-pred-ponarejenimi-zdravili,Post,/sites/43/files/images/news/shutterstock_467527682.jpg,1,0,1549444888,1551698133
518,13792,”Patients in the EU now safer from counterfeit medicines”,”Fighting counterfeit medicines in the EU with unique safety features “,”
Beginning with 9 February 2019 all prescription based medicinal products will be sent to the European market with unique safety features that will enable verification of authenticity of each separate packaging. This will assure traceability of medicines from manufacturers to end users, improved protection for medicinal product manufacturers and, what is most important, greater safety for patients.
Counterfeit medicinal products pose a serious threat to public health and numbers of counterfeit cases are on the rise. In order to step up the fight against counterfeit medicines in the legal supply chain, EU member states will begin implementing the provisions of Delegated Regulation (2016/161/EU) on 9 February 2019. The Regulation brings traceability of medicinal products from the manufacturer to the end user, greater safety for patients and more effective protection for medicinal product manufacturers.
The Delegated Regulation prescribes mandatory placement of security features on all prescription medicinal products. Each unit of packaging of a prescription medicine will bear a unique identifier in the form of a two-dimensional bar code and in human readable format and an anti-tampering device.
In order to prevent entry of counterfeit medicines into the European market EU member states established National Medicines Verification Systems (NMVS) and the European Medicines Verification Organisation (EMVO) established the central European hub (EMVO), through which medicinal product manufacturer will be able to enter their information on safety features on each packaging that will then be exchanged with national verification systems.
In Slovenia the task of establishing and managing the national verification system has been entrusted to the Medicines Verification Institute – MVI (Slovenian: Zavod za preverjanje avtentičnosti zdravil – ZAPAZ), which was founded on 6 October 2016 by representatives of all stakeholder in the medicinal product supply chain: the Forum of International Research and Development Pharmaceutical Companies, EIG, Association of Slovenian Medicinal Product Manufacturers, EIG, the Slovenian Chamber of Pharmacy and the Slovenian Chamber of Commerce, Section of medicinal product wholesalers.
Over the past two years the MVI successfully established a national information system for verification of medicinal product authenticity – SiMVS, which received a positive audit report from EMVO in April 2018 and became the first to connect to the central European hub: “Since then our services have helped pharmacies and wholesalers to adapt their information systems and connect to the national information system to begin exchanging information on safety features on product packaging as required by the Directive. Over the past year we concluded agreements with over 200 marketing authorisation holders and holders of temporary permits for exceptional import of medicines which bind us to maintain the national information system to provide uninterrupted exchange of information. In the future our primary role will be to serve as a point of contact between manufacturers on one side and pharmacies and wholesalers on the other in order to resolve any alarms raised due to suspected counterfeits in the system. If such suspicions are confirmed, the Public Agency for Medicinal Products and Medical Devices of the Republic of Slovenia will take over as the auditing body. We are expecting slightly more technical issues in the initial period since data is still being uploaded into the system, but we do hope the phase passes without major difficulty,” said MVI Director Mr. Mitja Pirman upon commencement of Directive implementation.
Secretary General of the Forum of International Research and Development Pharmaceutical Companies, EIG, mag. Barbara Stegel expressed her satisfaction with the successful establishment of the new medicinal product verification system since it was in fact the innovative pharmaceutical industry that promoted the establishment of an additional layer of protection: “The Forum as a representative of innovative pharmaceutical industry in Slovenia is a recognised and reliable partner in the efforts towards finding the best solutions in the field of medicines, health and healthcare. We are well aware of the dangers posed by counterfeit medicines, so we strived for the establishment of an additional safety system that would enable traceability and verification of authenticity of each separate medicinal product packaging, prevent unauthorized tampering and provide greater safety to patients. Counterfeit medicinal product are most commonly found through new technologies online, but they can and do find their way into the legal supply chain as well. That is why we gladly took on the task of implementing European legislation that will certainly make us more effective in the fight against medicinal product counterfeiting. The forum is also the initiator and founding member of the Medicines Verification Institute – MVI, with which we and other stakeholders in the Slovenian medicinal product supply chain established an effective system for verifying the authenticity of medicinal products and promoting collaboration that enables effective prevention of the entry of counterfeit medicines into the legal supply chain and pave the way for faster and better coordinated response to suspected cases of counterfeiting. And what is most important – we are certain that the new medicinal product verification system brings greater safety to patients in Slovenia and other EU member states.”
“,”Rok Knafelj”,1549444620,1549444620,en,13792,306,13791,43,0,NULL,,”Bolniki v EU odslej varnejši pred ponarejenimi zdravili”,bolniki-v-eu-odslej-varnejsi-pred-ponarejenimi-zdravili,Post,/sites/43/files/images/news/shutterstock_467527682.jpg,1,0,1549444888,1551698133
519,13794,”V EU zdravih več kot 95 odstotkov otrok”,”V Evropski uniji je bilo leta 2017 v povprečju zdravih ali zelo zdravih več kot 95 odstotkov otrok”,”
Bruselj, 05. februarja (STA) – V Evropski uniji je bilo leta 2017 v povprečju zdravih ali zelo zdravih več kot 95 odstotkov otrok, kažejo podatki, ki jih je danes objavil Eurostat. V Sloveniji je bilo zdravih ali zelo zdravih 93,8 odstotka otrok, dokaj zdravih 5,2 odstotka, slabega ali zelo slabega zdravja pa odstotek otrok.
Z omejitvami dejavnosti zaradi različnih zdravstvenih težav se je v EU leta 2017 po podatkih Eurostata v povprečju soočalo manj kot pet odstotkov otrok.
Nobenih omejitev dejavnosti zaradi zdravstvenih težav ni imelo 95,2 odstotka otrok (v Sloveniji 96,4 odstotka), 3,7 odstotka otrok v EU je imelo zmerne omejitve (v Sloveniji 2,3 odstotka), 1,2 odstotka otrok v EU pa je imelo hude omejitve dejavnosti zaradi zdravstvenih težav (v Sloveniji 1,3 odstotka).
Po podatkih Eurostata se odstotek zdravih otrok v EU nekoliko spreminja glede na starostno skupino. Delež otrok, katerih zdravje je slabo ali zelo slabo, je v povprečju v EU vseh starostnih skupinah nižji od enega odstotka.
V starostni skupini do pet let je bilo v EU leta 2017 zdravih ali zelo zdravih 96,5 odstotka otrok (v Sloveniji 93,9 odstotka), v starostni skupini med 5 do 9 let 95,9 odstotka (v Sloveniji 94,3 odstotka), v starostni skupini od 10 do 15 let pa 95,2 odstotka otrok (v Sloveniji 93,3 odstotka).
Več kot 99 odstotkov vseh otrok v starostni skupini do pet let je bilo zdravih ali zelo zdravih v Bolgariji, Romuniji, Italiji in na Malti. Najnižji delež tistih, ki so bili zdravi ali zelo zdravi, pa je bil v starostni skupini do pet let po podatkih Eurostata v Estoniji (92,4 odstotka), na Poljskem (93,1 odstotka), v Latviji in na Portugalskem (po 93,3 odstotka) ter v Sloveniji (93,9 odstotka).
V starostni skupini od 5 do 9 let je bil v EU delež otrok, ki so bili zdravi ali zelo zdravi, najnižji na Portugalskem (89,3 odstotka) in v Latviji (91,2 odstotka), najvišji pa v Romuniji (99,8 odstotka), na Cipru (98,9 odstotka), Italiji (98,8 odstotka) in v Grčiji (98,7 odstotka). V Sloveniji je bilo leta 2017 zdravih ali zelo zdravih 94,3 odstotka otrok, starih od 5 do 9 let.
V starostni skupini od 10 do 15 let je bil najnižji delež zdravih in zelo zdravih otrok v Latviji (88 odstotkov), na Portugalskem (88,7 odstotka) in Estoniji (89,6 odstotka), najvišji pa v Romuniji (99,1 odstotka), Italiji (98,4 odstotka) in Bolgariji (98,2 odstotka). V Sloveniji pa je bilo po teh podatkih zdravih ali zelo zdravih 93,3 odstotka otrok, starih med 10 in 15 let.
“,STA,1549359900,1549359900,sl,13794,306,13793,43,0,NULL,,”V EU zdravih več kot 95 odstotkov otrok”,v-eu-zdravih-vec-kot-95-odstotkov-otrok,Post,,1,0,1549446397,1549446397
524,13808,”Salmonela povzroča črevesne težave”,”Okužbe s salmonelami, ki so jih odkrili tudi v mesnem pripravku za kebab”,”
Ljubljana, 06. februarja (STA) – Okužbe s salmonelami, ki so jih odkrili tudi v mesnem pripravku za kebab, ki je v Slovenijo prišel iz Poljske, se kažejo kot črevesna bolezen. Pri bolniku se pojavi driska, bolečine v trebuhu, lahko tudi bruhanje in povišana telesna temperatura. Težave pri večini izzvenijo v nekaj dneh. Preventiva je tudi dobra toplotna obdelava živil.
Kot so zapisali na spletni strani Nacionalnega inštituta za javno zdravje (NIJZ), je salmoneloza zoonoza, nalezljiva bolezen, katere povzročitelj se iz živali posredno ali neposredno prenaša na ljudi. Z bakterijami salmonele je lahko okuženo na primer surovo meso, najpogosteje perutnina, in jajca. Okužimo pa se lahko, če omenjenih živil pred zaužitjem toplotno dobro ne obdelamo.
Salmonele se širijo tudi prek stika z okuženimi in obolelimi osebami. Te namreč izločajo salmonele z blatom. Od tod pridejo na roke oz. v okolje in na druge ljudi. Teoretično pa se s salmonelo lahko okužimo tudi s pitjem vode, kar pa je v Sloveniji izjemno redko. Prav tako se okužba lahko pojavi zaradi neposrednega stika z okuženimi živalmi.
Od okužbe do začetka bolezni običajno mine od šest do 72 ur, ponavadi od 12 do 36 ur. Bolj dovzetne za okužbo so osebe, ki prejemajo zdravila za zmanjšanje kislosti želodca in osebe z oslabljeno odpornostjo. Po okužbi se salmonele izločajo v blatu v povprečju pet tednov. Pri otrocih, mlajših od pet let, pa je čas izločanja bakterij daljši.
Pri večini obolelih težave postopoma izzvenijo v nekaj dneh, pri osebah, ki imajo kronične bolezni, pa lahko vztrajajo več tednov. Redko se ob črevesni okužbi s salmonelo tudi zaplete, ko bakterija pride v kri, povzroči sepso, vnetje v notranjih organih.
Bolniki morajo v času bolezni skrbeti predvsem za zadosten vnos tekočine. Posebna dieta ni potrebna, bolnik naj uživa lahko hrano. Če pa bolniku grozi dehidracija, je treba poiskati zdravniško pomoč, opozarjajo na NIJZ. Pomembna je tudi dosledna higiena, kar pomeni natančno umivanje rok in redno čiščenje sanitarij in drugih površin, ki se lahko onesnažijo s kontaminiranimi izločki. Zelo pomembno je tudi, da bolniki v tem času ostanejo doma.
Kot preventivno ravnanje pred okužbo na NIJZ svetujejo dobro osebno higieno, umivanje rok po uporabi stranišča, po menjavi plenic, pred in med pripravo hrane, po rokovanju s surovimi živili, zlasti surovo perutnino.
Da preprečimo t. i. navzkrižno kontaminacijo živil v kuhinji, za obdelavo surovega mesa, v katerem so lahko prisotne salmonele ali drugi mikrobi, uporabljajmo poseben pribor in deske. Hitro pokvarljiva živila hranimo v hladilniku pri temperaturi nižji od štiri stopinj Celzija. Poleg tega surova živila hranimo tako, da se v hladilniku ne dotikajo živil, ki so že pripravljena za zaužitje. Predvsem pa je pomembna dobra toplotna obdelava živil, zlasti surovega mesa.
Salmonele sicer delimo na tifusne in netifusne, ki so pogosti povzročitelji driske. Na NIJZ tako še izpostavljajo, da se pred potovanjem v kraje, kjer je tifus endemičen, lahko zaščitimo s cepljenjem.
“,STA,1549468440,1549468440,sl,13808,306,13807,43,0,NULL,,”Salmonela povzroča črevesne težave”,salmonela-povzroca-crevesne-tezave,Post,,1,0,1550159741,1550159771
525,13810,”Današnji dan posvečen bolnikom po vsem svetu”,”Danes obeležujemo 27. svetovni dan bolnikov, ki ga bodo slovesno obhajali v Kalkuti v Indiji. “,”
Ljubljana/Brezje, 11. februarja (STA) – Danes obeležujemo 27. svetovni dan bolnikov, ki ga bodo slovesno obhajali v Kalkuti v Indiji. Pri nas bo osrednja slovesnost že tradicionalno na Brezjah ob 10. uri. Vodil jo bo ljubljanski pomožni škof Anton Jamnik, so sporočili iz Slovenske škofovske konference.
Ob svetovnem dnevu bolnikov si v Slovenski škofovski konferenci želijo, da bi bili ljudje v teh dneh bolj pozorni do bolnikov in trpečih. Tudi pri katehezi naj bo poudarek na bolnikih, hvaležnost pa je treba pokazati tudi do vseh zaposlenih v zdravstvu in v drugih ustanovah, so še zapisali.
Papež Frančišek bo v Indiji prebral poslanico z geslom Zastonj ste prejeli, zastonj dajajte. “Skrb za bolne zahteva strokovnost, ljubeznivost ter iskrena, preprosta in svobodna dejanja, kot je objem, ki bližnjemu govori o tem, da je drugemu drag,” je navedeno v poslanici papeža.
Na ta dan bodo v Splošni bolnišnici Jesenice izvajali dodatne aktivnosti, s katerim želijo bolnikom povedati, da so v središču zdravstvene obravnave. Bolnike, ki so že dal časa hospitalizirani, bodo obiskali tudi dijaki Srednje šole Jesenice in študentje Fakultete za zdravstvo Angele Boškin, so sporočili iz Splošne bolnišnice Jesenice.
“,STA,1549900560,1549900560,sl,13810,306,13809,43,0,NULL,,”Današnji dan posvečen bolnikom po vsem svetu”,danasnji-dan-posvecen-bolnikom-po-vsem-svetu,Post,,1,0,1550159945,1550159946
526,13812,”Ob mednarodnem dnevu epilepsije strokovnjaki opozarjajo na stigmo in druge težave epileptikov “,”Na pobudo Mednarodnega urada za epilepsijo in Mednarodne lige proti epilepsiji danes obeležujemo mednarodni dan epilepsije.”,”
Ljubljana, 11. februarja (STA) – Na pobudo Mednarodnega urada za epilepsijo in Mednarodne lige proti epilepsiji danes obeležujemo mednarodni dan epilepsije. Ob tej priložnosti strokovnjaki opozarjajo na stigmo in druge težave epileptikov.
Ob mednarodnem dnevu poteka več spremljevalnih dogodkov, s katerimi bodo o epilepsiji izobraževali dijake in zaposlene na srednjih šolah pa tudi strokovno in laično javnost na dvodnevnem dogodku z naslovom Možgani in glasba.
Epilepsija je ena najpogostejših nevroloških bolezni. Po vsem svetu z njo živi okrog odstotek ljudi. V Sloveniji naj bi po ocenah pediatrične nevrologinje in predsednice Društva Liga proti epilepsiji Natalije Krajnc epilepsijo imelo okrog 20.000 ljudi, a natančnih podatkov ni, saj ne vodijo registra oseb s to motnjo. Najpogostejša je v otroški in mladostniški dobi ter v zreli odrasli dobi.
Okrog tri četrtine obolelih se uspešno zdravi z zdravili, ki so po besedah Krajnčeve pri nas zelo dobro dostopna oz. jih bolniki lahko na stroške zavarovalnice prevzamejo v tujini. Pri četrtini bolnikov, kjer zdravila nimajo učinka pa iščejo druge načine zdravljenja. Eden izmed njih je tudi kirurgija epilepsije – operacija jasno omejenega predela v možganih, v katerem prihaja do napadov.
“To dela usposobljena ekipa epileptologov v posebnih centrih, ki jih pri nas nimamo. Že več desetletij bolnike napotujemo na te posege v tujino,” je za STA povedala Krajnčeva in dodala, da pediatrične bolnike na operacije največ napotujejo v centre v Nemčiji, Franciji, tudi v Prago, Milano, London, odrasle pa najpogosteje v center v nemškem mestu Erlangen.
Eden izmed ključnih problemov, s katerimi se soočajo osebe z epilepsijo, je tudi stigma, ki se povsem praktično kaže v vsakdanjem življenju. Mnogi bolniki že sami ne sprejmejo svoje bolezni, v življenju pa se soočajo tudi s strahom drugih ljudi, ko ti vidijo epileptični napad, je za STA povedala koordinatorka društva Liga proti epilepsiji Slovenije Svetlana Simić Klobučarič in navedla nekaj primerov: “Otroci in mladostniki na primer brez spremljevalca ne smejo na ekskurzijo, odrasli ovire doživljajo pri zaposlitvi, nekateri so zaradi bolezni zavrnjeni tudi s strani partnerjev. Gre za strah vzbujajočo bolezni, ki se ne kaže navzven, je pa tudi odziv okolice odvisen tudi od vrste bolezni in pogostosti napadov.”
Javnost v ligi že dlje časa osveščajo o epilepsiji, zadnja leta v povezavi z umetnostjo. “Na ta način želimo razširiti pogled na epilepsijo in življenje oseb z epilepsijo, ki marsikdaj kljub bolezni in nelahkemu življenju, ki ga bremenijo psihosocialne težave in nerazumevanje pa tudi neznanje in predsodki okolice, zelo ustvarjalno razkrivajo svoje izkušnje in bogatijo naš pogled na svet,” je za STA dejal ambasador epilepsije Mednarodne lige proti epilepsiji Igor M. Ravnik.
Tako so že organizirali dogodke, ki so povezovali gledališče in epilepsijo ter likovno umetnost in epilepsijo. Letos prirejajo strokovni dogodek o vplivu glasbe na epilepsijo in bolezni z motnjami gibanja. “Dober učinek določene glasbe na epileptične motnje v možganih še ni pojasnjen, je pojasnil Ravnik in dejal, da bosta na letošnjem dogodku o svojih raziskavah na temo možgani in glasba pri kirurških bolnikih s težko epilepsijo poročala tuja gosta Ivan Rektor iz Brna in Cyrille Ferrier iz Utrechta.
Kot ključni izziv slovenskega zdravstva pri obravnavi epilepsije je ocenil potrebo pravočasni kakovostni diagnostiki in uvedbi zdravil, ki pri nas marsikje traja predolgo. Hkrati pri nas za predkirurško diagnostiko bolnikov, pri katerih zdravilna ne učinkujejo, nimamo dovolj kadra in hkrati predolge čakalne dobe. “Nevrologov je več, z epilepsijami se pa bolj malo ukvarjajo, kljub temu, da je to ena najpogostejših nevroloških motenj. Kar je malo paradoksalno, a dejansko je tako,” je povedala Natalija Krajnc.
“,STA,1549900800,1549900800,sl,13812,306,13811,43,0,NULL,,”Ob mednarodnem dnevu epilepsije strokovnjaki opozarjajo na stigmo in druge težave epileptikov “,ob-mednarodnem-dnevu-epilepsije-strokovnjaki-opozarjajo-na-stigmo-in-druge-tezave-epileptikov,Post,,1,0,1550160048,1550160049
527,13814,”Za slovenske bolnike z epilepsijo kljub nekaterim težavam lepo poskrbljeno”,”Bolniki z epilepsijo se soočajo s številni problemi, kot je na primer stigma”,”
Ljubljana, 11. februarja (STA) – Bolniki z epilepsijo se soočajo s številni problemi, kot je na primer stigma, a vsaj v Sloveniji ni vse tako črno, so se strinjali sogovorniki na današnji novinarski konferenci Društva Liga proti epilepsiji Slovenije ob mednarodnem dnevu epilepsije. Glede na to, kako sistem poskrbi za bolnike z epilepsijo, smo celo med boljšimi v Evropi.
V primeru, da stroka presodi, da je oseba primerna za kirurško zdravljenje, zavarovalnica krije tako stroške preiskav v tujini in sam operativni poseg. Če gre za osebo do 18. leta, krije tudi stroške spremljevalca. Težava vseeno nastopi, ko gre za odraslo osebo, saj samostojno potovanje bolnikov z epilepsijo ni najbolj ugodna stvar, je na novinarski konferenci v UKC Ljubljana dejal nevrolog Matevž Kržan. Med spremljevalci v tujino je zaželen tudi bolj strokovno usposobljen spremljevalec, zaradi česar v društvu nudijo možnost program laičnega spremljevalca.
Ambasador epilepsije pri Mednarodni Ligi proti epilepsiji Igor Ravnik je ob tem dodal, da poleg preiskav in posega zavarovalnica krije tudi potne stroške bolnika in spremljevalca, v primeru mladoletne osebe pa tudi stroške nastanitve spremljevalca. Slovenski model so predstavili že na nekaterih evropskih forumih, kjer so ga ocenili kot “svetilniški primer dobrih praks”.
Kar se tega odnosa tiče, so v Sloveniji tovrstni bolniki na nek način kar privilegirani, meni pediatrinja Natalija Kranjc. “Tisti, ki smo se učili v tujini, smo lahko videli, v kakšni stiski so ljudje v tako imenovanem razvitem svetu, celo v Ameriki, kjer morajo ljudje žrtvovati svoj socialni status, da si lahko privoščijo tako zdravljenje,” je situacijo v tujini predstavila Kranjčeva. Zelo pa je vesela, da se v Sloveniji lahko pokrije zdravljenje iz sredstev zdravstvenega zavarovanja. Zadovoljna je tudi z dostopnostjo zdravil v Sloveniji, tudi tistih, ki se jih v epileptologiji redkeje uporablja in so prav tako pokrita s strani zavarovanja.
Na novinarski konferenci je spregovorila tudi 20-letna Daša Kovačič, ki je od malih nog trpela za epilepsijo. “Ko sem izvedela, da imam epilepsijo, sem se odločila, da tega ne bom skrivala,” je povedala Daša. Epilepsijo je hitro sprejela, saj je bil to del nje in njenega življenja. Kar se tiče odziva družbe, pa je dejala, da so jo vsi lepo sprejeli in je nihče zaradi bolezni nikoli ni obravnaval drugače. Pred štirimi leti je prestala operacijo na Češkem in od takrat naprej nima več napadov. Daša o postopku pravi, da nima negativnih izkušenj. Skupaj s starši je bila lepo sprejeta, pohvalila pa je tudi odnos tamkajšnjega zdravniškega osebja. Operacija je trajala okoli pet ur.
Kirurgija epilepsije je dokaj mlada veja zdravstva, je na novinarski konferenci poudarila Kranjčeva in dodala, da bi bilo pametno razmisliti tudi o razvoju te stroke v Sloveniji.
“,STA,1549900860,1549900860,sl,13814,306,13813,43,0,NULL,,”Za slovenske bolnike z epilepsijo kljub nekaterim težavam lepo poskrbljeno”,za-slovenske-bolnike-z-epilepsijo-kljub-nekaterim-tezavam-lepo-poskrbljeno,Post,,1,0,1550160156,1550160157
528,13816,”Na NIJZ v letošnji sezoni razdelili za dobro tretjino več odmerkov cepiva proti gripi kot lani”,”Na območnih enotah NIJZ so izbranim zdravnikom in ambulantam v letošnji sezoni razdelili 117.500 odmerkov “,”
Ljubljana, 13. februarja (STA) – Na območnih enotah NIJZ so izbranim zdravnikom in ambulantam v letošnji sezoni razdelili 117.500 odmerkov cepiva proti gripi, v lanski pa okoli 84.500, kar kaže na večje zanimanje za cepljenje kot lani. Opozarjajo pa, da je to še vedno premalo za dobro precepljenost populacije. Sezonska gripa je še vedno v porastu, tako da cepljenje še priporočajo.
Kot poudarjajo na Nacionalnem inštitutu za javno zdravje (NIJZ), je cepljenje proti sezonski gripi dokazano najbolj učinkovit ukrep za preprečevanje obolevnosti in zapletov, ki so lahko posledica gripe. V zadnjih treh sezonah je zanimanje za cepljenje nekoliko večje, v letošnji so na NIJZ razdelili 117.500 odmerkov cepiva proti gripi, v lanski okoli 84.500 odmerkov, leto prej pa 62.830 odmerkov cepiva. Pred leti je bilo sicer zanimanje za cepljenje večje, po podatkih NIJZ se je takrat cepilo okoli 150.000, v sezoni 2006/2007 skoraj 170.000. V Sloveniji je precepljenost proti gripi med najnižjimi v EU.
V letošnji sezoni se je cepljenje proti sezonski gripi pri nas začelo 1. oktobra. Kot so navedli na NIJZ, se je cepiti smiselno do konca sezone gripe, kar je običajno v marcu, včasih je upad že v februarju, zelo redke pa so sezone, ko je več primerov gripe tudi v drugi polovici marca.
Trenutno je gripa še vedno v porastu, kakšno pa bo gibanje bolezni v naslednjih tednih, pa je težko napovedati, so pojasnili na NIJZ. Gripa običajno doseže vrh v januarju oz. februarju. V lanski sezoni je gripa v tem času že dosegla vrh, je pa obolevnost v letošnji sezoni do sedaj zelo podobna lanski.
Cepljenje na NIJZ priporočajo vsem, posebej pa občutljivejšim skupinam, kot so starejši od 65 let, nosečnice, otroci, kronični bolniki, osebe z izrazito povečano telesno težo, zdravstveni delavci in drugi delavci v nujnih službah, ki so pomembne za delovanje različnih dejavnosti.
V Sloveniji uporabljamo štirivalentno cepivo proti gripi, ki ga proizvaja in dobavlja francoska farmacevtska družba Sanofi Pasteur. Cena cepljenja je 14 evrov, za osebe z večjim tveganjem pa sedem evrov.
“,STA,1550073780,1550073780,sl,13816,306,13815,43,0,NULL,,”Na NIJZ v letošnji sezoni razdelili za dobro tretjino več odmerkov cepiva proti gripi kot lani”,na-nijz-v-letosnji-sezoni-razdelili-za-dobro-tretjino-vec-odmerkov-cepiva-proti-gripi-kot-lani,Post,,1,0,1550160260,1550160261
529,13739,”Clinical register – the key to evidence-based clinical practice”,”Clinical register – the key to evidence-based clinical practice”,”
At Forum’s professional meeting on the importance of clinical registries, held on 27 November 2018 at premises of Slovene Academy of Sciences and Arts in Ljubljana, various stakeholders in healthcare pointed out that clinical registries are key to improving treatment outcomes, researching and accepting evidence-based healthcare decisions. It was estimated that the role of clinical registries in the process of evaluating health technologies and ensuring the financial sustainability of public health systems is invaluable and, in this context, drew attention to yet un-exploited potential of clinical registries in Slovenia and abroad. Since the establishment and proper functioning of clinical registries is an undisputed interest of all stakeholders in health, participants at the expert meeting organized by the International Forum of Scientific Research Pharmaceutical Companies in Slovenia agreed that the systemic regulation and further development of the area of clinical registries is necessary.
Different roles of clinical registries
Prof. dr. Petra Došenović Bonča from the Faculty of Economics of the University of Ljubljana, through the production function, demonstrated the multifaceted benefits of clinical registries for various stakeholders in health care. Well-established and functioning clinical registers enable health professionals to understand the disease and its development, the different ways and outcomes of treatment, and the factors of their variability.
The clinical register also enables monitoring and understanding of time lags in patient response, more individualized treatment, and identification of factors leading to adverse events. Using clinical registries, it is easier to connect with experts of the same or related professions, and clinical registries also allow faster development of new professional guidelines for patient treatment.
The role of clinical registries is also extremely important from the regulator point of view, and especially the payer of health services, since clinical registries contribute, among other things, to the easier identification of actual practices, such as the use of medical devices, and medicines.
Also important is the role that they have in assessing not only the clinical effects of individual services but also the cost-effectiveness of these services. Data from clinical registries can serve as a good basis for strategic consultation with health service providers, public reporting, development of education, and agreements with pharmaceutical companies to include new drugs on the lists. Clinical registries enable patients to better understand the disease and its development, risk factors and outcomes of treatment, and to manufacturers of medical devices, medicines and health technologies to better define actual consumption, to understand the differences in treatment outcomes of different population groups, better insight into cost-effectiveness and for agreements with payers of health services on the inclusion of medicines on the reimbursement lists based on treatment outcomes.
Untapped potential
Despite proven benefits for all stakeholders in health care, the development of clinical registries in Slovenia is cumbersome and the potential of clinical registries remains poorly used. Data from existing clinical registers are used for a very narrow set of purposes, although based on these data, health services could be developed towards more personalized medicine, deciding on a basket of rights, and the like.
Existing clinical registries do not allow health professionals to provide up-to-date feedback, which could serve to accommodate patients’ treatment, do not follow the trend of digitization and, among other things, do not allow linkages between individual organizations and countries and poorly integrate patients into the design, development and operation of registers.
Cancer registry
The Cancer registry of the Republic of Slovenia was established in 1950 as a special service for the collection and processing of data on the incidence of cancer and the survival of cancer patients in Slovenia. The purpose of the registry is, according to the head of the RS Cancer Registry, prof. dr. Vesna Zadnik, primarily monitoring, planning and evaluation of oncological care and the basis for epidemiological and clinical studies.
Data sources for the register are all national screening programs, administrative registries, national health databases, hospital register of the Oncology Institute Ljubljana, clinical and population research and public health institutions. In the Cancer Register of the Republic of Slovenia, patient identification data are collected, data on diseases and treatment, histological cytological diagnosis and vital state of patients. The National Cancer Control Program 2017-2020 is committed to expand the data set or to establish clinical registries for individual types of cancer, which would enable the preparation of indicators for evaluating the quality of treatment of oncological patients. Now, the Melanoma clinical register is already being tested, and the National Cancer Control Program 2017-2020 wants to establish, at least in the first stage, clinical registries for lung, colon, rectal, breast and prostate cancer.
Guidelines for setting up and maintaining registries
Head of the NIJZ Health Data Center, Metka Zaletel, highlighted several challenges that they face in the establishment and development of an organized collection and analysis system for data on groups of patients, those challenges existing also at European level. Patient registries are not always comparable and consistent, so data from different sources is poorly interconnected and unusable for secondary purposes. From 2012 to 2015, the National Institute of Public Health (NIJZ) led a joint European Parity Program (Patient Registries Initiative) to provide EU Member States with support in developing comparable and consistent patient registries in key areas such as chronic diseases, medical technology. In this process, guidelines and methodological recommendations for the efficient and rational management of patient registries were created. The head of the NIJZ data center pointed to the need for a national agreement on clinical registries, linking public health and clinical registries, clear definitions of the purpose of individual registry, and relevant regulatory bases that will allow comparability of patient registries in the national and European context.
In Slovenia are also good practices
Despite numerous challenges and inconsistencies in the field of clinical registries, we can also set up in Slovenia with individual good practices of clinical registries, which are primarily the result of the enthusiasm of groups of health professionals. A clinical register BioRx.si was established a decade ago at the Clinical Department of Rheumatology UKC Ljubljana. It is a register of patients with rheumatoid arthritis, ankylosing spondylitis and psoriatic arthritis treated with biological medicines. The BioRx.si register, in which data is entered by all Slovenian rheumatologists, enables the standardization of effective and safe treatment in everyday clinical practice and serves as a research tool. Head of the Clinical Department of Rheumatology UKC Ljubljana prof. dr. Matija Tomšič explained that while maintaining a registry, that they want to upgrade with other groups of patients who are treated with expensive biological medicines, they are faced with various legal issues in the field of personal data protection. Nevertheless, he is convinced that clinical registries are necessary because they provide data on the efficacy and safety of individual treatment protocols to rheumatologists and represent a good source for research work.
In the last few years, Clinical Department of Pediatric Surgery and Intensive Care UKC Ljubljana has moved from paper to fully electronic business, which also led to EMRAM 6 certificates. Digital transformation, according to the pediatrician mag. Gorazd Kalan, supports clinical decision-making, remote access, research and assessment of clinical efficacy, and provides staff, time and financial savings.
At the Clinical Department of Hematology, UKC Ljubljana, in 2012, the Slovenian Register of Hematological Neoplasms was established, in which data on some of the most common hematological neoplasms were collected. The data in the register, which is owned by the Association of Hematologists of Slovenia, are entered in general hospitals, as well as in UKC Maribor and UKC Ljubljana. The purpose of the data analysis is to assess the incidence and prevalence of more frequent blood diseases, which allows planning of treatment and staffing needs, reporting of adverse events, and assessment of the quality of clinical work and analysis of the course of treatment. The register is useful for a more detailed assessment of diagnostic criteria and criteria for starting treatment and assessment of disease prognosis for individual patients, explained the head of the Clinical Department of Hematology UKC Ljubljana prof. dr. Samo Zver. Since certain medicines require special approval from the Commission of the Clinical Department of Hematology UKC Ljubljana, the register is also useful as a platform for the transmission of the application and approval of treatment by the commission.
Doc. dr. Sabina Škrgat from the University Clinic for Pulmonary Diseases and Allergy Golnik presented the international connection that Klinika Golnik joined in order to treat patients with severe asthma as effective as possible. It is an international network established by several German clinical centers of German Asthma Net E. V. and is combining data on patients with severe asthma. Since the number of patients with this type of disease in small centers is small, from the point of view of optimizing the diagnostic evaluation and treatment of patients with severe asthma, the integration of data into the common database is very useful. In addition to Slovenia, Austria, Czech Republic and Switzerland joined the German international association, which aims to establish a clinical registry for patients with severe asthma.
“,”Rok Knafelj”,1543351500,1543351500,en,13739,306,13737,43,0,NULL,,”Klinični register – ključ za z dokazi podprto klinično prakso”,klinicni-register-kljuc-za-z-dokazi-podprto-klinicno-prakso,Post,”/sites/43/files/images/news/Stalisce o TZS/Foto-Terapevtske-skupine-zdravil.jpg”,1,1,1547474992,1551698760
531,13822,”Klinične raziskave za varen prehod v bolj zdravo prihodnost “,”Stroga regulacija področja kliničnih raziskav zagotavlja obveščenost, varnost in pravice prostovoljcev “,”
Klinične raziskave so raziskave, pri katerih raziskovalci s pomočjo prostovoljcev preučujejo učinkovitost in varnost novih načinov diagnostike in zdravljenja bolezni. Njihov pomen je izjemen, saj omogočajo uporabo najnovejših znanstvenih in tehnoloških odkritij pri oskrbi in zdravljenju bolnikov. Največ kliničnih raziskav poteka na področju zdravil, poznamo pa tudi klinične raziskave medicinskih pripomočkov in novih metod zdravljenja. Z njimi raziskovalci ugotavljajo in preverjajo, kako varno in učinkovito je novo zdravilo, s čimer se zagotovi tudi varen prenos zdravila v vsakodnevno klinično prakso.
Klinične raziskave delimo na intervencijske in neintervencijske. Slednje temeljijo na opazovanju raziskovalca, ki poskuša na podlagi protokola oceniti stanje pacienta, v okviru intervencijskih kliničnih raziskav pa se strategija zdravljenja, preiskave in spremljanje udeležencev razlikujejo od običajne klinične prakse, zato jih delimo na več faz. Vsaka faza je namenjena pridobivanju specifičnih informacij in vsaka nova faza gradi na izsledkih prejšnje faze.
Skozi celoten proces raziskave je poudarek na varnosti. V prvi fazi raziskovalci novo zdravilo ob skrbnem nadzoru odmerijo manjši skupini prostovoljcev, ki sodelujejo v raziskavi, določijo najboljši način prejemanja novega zdravila, odkrijejo najbolj pogoste in najbolj resne stranske učinke in določijo varen odmerek zdravila. V drugi fazi spremljajo učinkovitost zdravila, ki jo nato potrdijo ali ovržejo. V teh dveh fazah že manjše število prostovoljcev daje precej zanesljive rezultate, v tretji fazi pa je treba število v raziskavo vključenih bolnikov, če se je zdravilo izkazalo za varno in učinkovito, povečati.
Tretja faza je namreč namenjena primerjanju novega zdravila z že uveljavljenim zdravilom, raziskovanju vpliva novega zdravila na različne populacije, določanju odmerkov in različnim kombinacijam z drugimi zdravili. Podatki, ki jih raziskovalci zberejo v tretji fazi, pokažejo, ali se lahko novo zdravilo začne uporabljati za oskrbo bolnikov v vsakodnevni klinični praksi.
Seveda raziskovalci spremljajo tudi varnost zdravila po odobritvi za uporabo v klinični praksi, običajno s prej omenjenimi neintervencijskimi raziskavami, torej se zdravljenje, preiskave in spremljanje bolnikov ne razlikujejo od običajne klinične prakse.
Na splošno so klinične raziskave namenjene širjenju znanja o določeni bolezni, kar pomaga izboljšati samo zdravljenje, pa tudi postavljanju diagnoze, preprečevanju bolezni in bolezenskih stanj, ocenjevanju stopnje tveganja za določeno bolezen, izboljšanju življenjske kakovosti za ljudi s kronično boleznijo…
Največja prednost kliničnih raziskav je, da lahko bolnikom, ki so že izčrpali druge možnosti zdravljenja, ponudijo nove možnosti za potencialno učinkovito zdravljenje, in to še preden je novo zdravilo na trgu. Kdor sodeluje v takšni raziskavi, je deležen tudi večjega števila pregledov pri zdravniku in več preiskav, saj je treba potek bolezni in zdravljenja spremljati natančneje. To je za bolnika še ena od dobrodošlih prednosti, res pa je, da so pogostejše poti k zdravniku za močno bolne ljudi lahko tudi obremenjujoče.
Vsaka klinična raziskava ima specifične potrebe in raziskovalne cilje, k vplivajo na izbiro prostovoljcev. Tako raziskovalci včasih za raziskavo potrebujejo bolnike z določeno boleznijo, drugič pa zdrave ljudi brez simptomov. V vsakem primeru so v protokolu raziskave določene smernice za prostovoljce, ki vključujejo tudi kriterije, kot so starost, spol, vrsta in stadij bolezni, predhodno zdravljenje in drugi.
Pred vključitvijo v klinično raziskavo mora biti vsak bolnik ustno in pisno seznanjen z namenom, potekom, postopki in trajanjem raziskave, možnimi neželenimi učinki, tveganji in pričakovanimi koristmi ter s pravicami, ki mu pripadajo, in obveznostmi, ki jih prinese sodelovanje v raziskavi. Kdor se odloča za sodelovanje, ima na voljo gradivo o raziskavi in lahko raziskovalcem postavlja vprašanja, med katerimi prednjačijo tista, ki so vezana na morebitna tveganja, vse dokler nima dovolj podatkov, da sprejme odločitev za sodelovanje ali pa sodelovanje zavrne. Ob tem je pomembno vedeti, da je odločitev za ali proti popolnoma avtonomna.
Kdor se odloči za sodelovanje v raziskavi, mora podpisati posebno soglasje, ki se pri nas imenuje »obrazec o privolitvi po poučitvi«. Seveda prostovoljci tudi med raziskavo dobivajo vse potrebne informacije, na podlagi katerih se lahko odločajo, ali bodo v raziskavi sodelovali še naprej ali pa bodo iz raziskave izstopili. Sodelovanje lahko prostovoljci prekinejo kadarkoli, brez navajanja razlogov in brez posledic. Kdor sodelovanje zavrne ali prekine, je še vedno deležen vse potrebne zdravstvene oskrbe in obravnave v okviru rednega zdravljenja, ki ga je prejemal pred vključitvijo v raziskavo.
Pri uporabi zdravil v raziskavah obstaja določeno tveganje, ker se njihova varnost in učinkovitost še preučujeta. Prav tako obstaja tveganje, da se pojavijo neželeni stranski učniki zdravil, ki niso znani. Vedno obstaja tudi možnost, da zdravilo ne bo delovalo, zato je zelo pomembno, da prostovoljci dobijo vse potrebne informacije in se dobro izobrazijo.
Izvedba kliničnih raziskav je prav zaradi zagotavljanja varnosti in pravic bolnikov strogo in natančno regulirano področje. V Sloveniji se morajo klinične raziskave zdravila izvajati v skladu s protokolom, v katerem so natančno določeni cilji, nameni, metodologija, statistična obdelava in organizacija klinične raziskave. Vsaka klinična raziskava mora potekati tudi v skladu z mednarodnimi etičnimi načeli, znanstvenimi standardi in zakonodajo, pred začetkom izvajanja ga morata pregledati in odobriti Komisija Republike Slovenije za medicinsko etiko in Javna agencija Republike Slovenije za zdravila in medicinske pripomočke.
Klinične raziskave v Sloveniji se morajo izvajati v skladu z/s:
– Zakonom o zdravilih (Uradni list RS, št. 17/14)
– Pravilnikom o kliničnih preskušanjih zdravil (Uradni list RS, št. 54/06)
– Helsinško deklaracijo o biomedicinskih raziskavah na ljudeh
– ICH smernicami dobre klinične prakse
– Pravilnikom o pristojbinah in stroških postopkov na področju zdravil in medicinskih pripomočkov (Ur. l. RS, št. 3/07, 25/10 in 37/10)
Več o zakonodaji EU, ki se nanaša na klinične raziskave:
– Direktive in priporočila Evropske komisije: EudraLex – Volume 10 Clinical trials guidelines
– Uredba (EU) št. 536/2014 Evropskega parlamenta in Sveta, z dne 16. aprila 2014, o kliničnem preskušanju zdravil za uporabo v humani medicini in razveljavitvi Direktive 2001/20/ES
“,”Rok Knafelj”,1550811300,1550811300,sl,13822,306,13821,43,0,NULL,,”Klinične raziskave za varen prehod v bolj zdravo prihodnost “,klinicne-raziskave-za-varen-prehod-v-bolj-zdravo-prihodnost,Post,”/sites/43/files/images/news/Klinicene studije/Klinicne studije_img.jpg”,1,0,1551675569,1552385256
532,13824,”Klinične raziskave”,”Klinične raziskave imajo v medicini posebno mesto, so gonilo razvoja in napredka, saj medicini in farmaciji omogočajo polagati temelje za bolj zdravo družbo, za večjo kakovost življenja ter daljšo življenjsko dobo. “,”
Klinične raziskave imajo v medicini posebno mesto, so gonilo razvoja in napredka, saj medicini in farmaciji omogočajo polagati temelje za bolj zdravo družbo, za večjo kakovost življenja ter daljšo življenjsko dobo. Ker bolezen ne izbira, se lahko prav vsak znajde v položaju, ko verodostojne informacije o kliničnih raziskavah potrebuje, saj mora vedeti, kakšne so prednosti in tveganja, kaj je mit in kaj resnica. Pri tem so lahko v veliko pomoč resnične izkušnje vključenih v klinične raziskave in zanimive podatke o tem je zbrala Ameriška organizacija CISCRP (Center for Information and Study on Clinical Research Participation), ki si prizadeva osveščati o vseh vidikih kliničnih raziskav.
Leta 2017 so izvedli javnomnenjsko raziskavo, v kateri so želeli izvedeti, kako ljudje pred začetkom sodelovanja v klinični raziskavi doživljajo potencialne prednosti in tveganja kliničnih raziskav. Nato so zbrali še podatke o dejanskih izkušnjah ljudi, ki sodelujejo v kliničnih raziskavah, in izkazalo se je, da so predstave o sodelovanju v kliničnih raziskavah precej drugačne od dejanskih izkušenj, ki so v veliki meri bolj pozitivne, kot ljudje pričakujejo.
Dobra četrtina vprašanih v omenjeni raziskavi je menila, da je ključna prednost kliničnih raziskav to, da lahko znanosti pomagajo napredovati pri zdravljenju njihove bolezni. Enak delež ljudi je kot ključno prednost izpostavil, da lahko izsledki raziskave izboljšajo tudi življenje drugih ljudi z isto boleznijo. Da lahko klinična raziskava izboljša njihovo zdravje, je kot ključno prednost izpostavilo 15 odstotkov vprašanih; da klinična raziskava lahko predstavlja najboljšo možnost za zdravljenje, pa kot ključno prednost raziskav doživlja osem odstotkov ljudi. Štirje odstotki ljudi so kot najpomembnejšo prednost sodelovanja v klinični raziskavi izpostavili, da bodo tako deležni večje pozornosti zdravnikov in drugega medicinskega osebja.
Pred sodelovanjem v raziskavi je bilo okoli 40 odstotkov anketiranih najbolj strah možnih stranskih učinkov, tretjina pa se jih je najbolj bala, da bi raziskava predstavljala tveganje za njihovo zdravje. Zelo malo, le sedem odstotkov je strah, da bi namesto resničnega zdravila dobili placebo, enak odstotek ljudi pa se boji, da bi morali zaradi sodelovanja v raziskavi prenehati z zdravljenjem, ki so ga že deležni in jim koristi. Na zadnji dve mesti med tveganji so anketiranci umestili strah, da bi njihovi zasebni zdravstveni podatki postali javni, in bojazen, da bi zaradi sodelovanja v raziskavi preveč manjkali v službi.
Raziskovalci so o tem, kaj jim je bilo najbolj in najmanj všeč, ljudi povprašali tudi po sodelovanju v klinični raziskavi. Rezultati so zelo zanimivi in lahko razpršijo marsikateri dvom. Če se je pred začetkom sodelovanja v klinični raziskavi kar 40 odstotkov ljudi balo stranskih učinkov, je o njih kot najmanj prijetnem delu sodelovanja v klinični raziskavi poročalo le 11 odstotkov ljudi. Skoraj 40 odstotkov sodelujočih je povedalo, da sodelovanje v klinični raziskavi ni imelo nobenih elementov, ki jim ne bi bili všeč, za 24 odstotkov vprašanih je bil najpomembnejši negativni vidik sodelovanja možnost, da bi dobili placebo, za 23 odstotkov odročnost lokacije, kjer je potekala raziskava, za 11 odstotkov ljudi pa čas, ki so ga porabili za sodelovanje v raziskavi.
Če je pred sodelovanjem v klinični raziskavi 26 odstotkov vprašanih menilo, da je ključna prednost kliničnih raziskav to, da lahko znanosti pomagajo napredovati pri zdravljenju njihove bolezni, je to kot najbolj pozitiven vidik sodelovanja v klinični raziskavi izpostavilo kar 36 odstotkov anketiranih. Visoko na lestvico pozitivnih izkušenj so anketiranci postavili tudi občutek, da so s sodelovanjem v raziskavi pomagali tudi drugim s to boleznijo. Pred raziskavo so le štirje odstotki ljudi menili, da bo večja pozornost zdravstvenega osebja ena od ključnih prednosti sodelovanja v raziskavi, po sodelovanju pa jih je kar 20 odstotkov to izpostavilo kot najbolj pozitiven vidik, še 14 odstotkov ljudi pa je kot pozitivno izkušnjo izpostavilo odnos med njimi in raziskovalnim osebjem. Enak odstotek ljudi je kot najbolj pozitiven vidik sodelovanja v klinični raziskavi izpostavilo dostop do najsodobnejšega in najbolj naprednega zdravljenja, česar – zanimivo – anketiranci pred raziskavo sploh niso omenjali.
Kljub izjemnemu pomenu kliničnih raziskav o njih v splošni javnosti ni veliko znanega. In kjer ni pravih informacij, se hitro ustvarijo napačna prepričanja, zato tu navajamo nekaj odgovorov na pogosta vprašanja, ki si jih zastavljajo tisti, ki razmišljajo o sodelovanju v kliničnih raziskavah.
.
Zakaj raziskovalci zavrnejo nekatere prostovoljce, ki želijo sodelovati v raziskavi?
Vsaka klinična raziskava ima specifičen cilj ter zelo natančno določene postopke in pravila, ki ščitijo prostovoljce in raziskovalcem pomagajo razumeti, ali so učinki, ki jih vidijo, posledica preskušanih zdravil. Zato ljudje, ki ne ustrezajo tem okoliščinam, ne morejo sodelovati. Pravila so za vsako raziskavo drugačna in so vedno navedena v obrazcu o privolitvi po poučitvi.
.
Ali je sodelovanje v klinični raziskavi lahko boleče, neprijetno ali nevarno?
Raziskave so vedno zasnovane tako, da sta potencialna dobrobit in tveganje skrbno uravnotežena, vsaka raziskava pa je pred začetkom skrbno pregledana, da bi se izognili nepotrebnemu stresu in nelagodju. Področje kliničnih raziskav je strogo regulirano in vsako klinično raziskavo morata v Sloveniji pregledati in odobriti Komisija Republike Slovenije za medicinsko etiko in Javna agencija Republike Slovenije za zdravila in medicinske pripomočke. Prostovoljce, ki sodelujejo v klinični raziskavi, raziskovalci in zdravniki skrbno spremljajo, zdravila, ki jih jemljejo, pa so prestala stroge teste, še preden so jih začeli jemati. Aktivnosti v okviru raziskave so seveda različne, odvisne od posamezne raziskave. O njih se s prostovoljcem pogovori zdravnik, vse aktivnosti pa so vedno navedene tudi v obrazcu o privolitvi po poučitvi.
.
Mi bo za klinično raziskavo, ki bi mi lahko pomagala, povedal moj zdravnik?
Vaš zdravnik bo morda vedel za primerno klinično raziskavo, morda pa ne. Če ste pripravljeni sodelovati v klinični raziskavi, to povejte svojemu osebnemu zdravniku in specialistu, ki vas zdravi, informacije o kliničnih raziskavah pa lahko poiščete tudi sami na spletu ali se obrnete na ustrezno društvo bolnikov, kjer vam prav tako lahko pomagajo z informacijami in njihovim iskanjem.
.
Kako raziskovalci določijo, kdo bo dobil placebo in kdo pravo zdravilo?
Placebo niti ne škodi niti ne koristi. Odločitev o tem, ali bo v raziskavi uporabljen placebo, je odvisna od tega, kako resna je bolezen, ali že obstaja zdravilo zanjo, poleg tega pa so vključena še druga visoka etična merila. Pri raziskavah, kjer zdravilo za stanje ali bolezen že obstaja, ali pa gre za resno bolezen, se običajno vsem prostovoljcem dajejo prava zdravila. Pri drugih raziskavah ena skupina dobi pravo zdravilo, druga pa placebo, saj raziskovalci lahko le tako primerjajo novo zdravljenje in ne-zdravljenje v podobni skupini ljudi. Prostovoljci so v eno izmed obeh skupin običajno uvrščeni naključno s pomočjo računalniškega programa, zato raziskovalci nimajo vpliva na to, kdo bo dobil placebo in kdo pravo zdravilo.
.
Ali me bo moj zdravnik obravnaval drugače, če se pridružim raziskavi?
Oskrba, ki jo prejmejo prostovoljci v klinični raziskavi, je običajno odlična. Prostovoljci pogosto pripomnijo, da jih zdravnik raziskovalec skupaj z ostalim raziskovalci osebjem spremlja bolj skrbno kot njihov osebni zdravnik ali medicinska sestra. Klinične raziskave imajo namreč zelo natančno določene postopke, ki pogosto vključujejo dodatne preiskave in dodaten nadzor bolnika s pogostejšimi obiski pri zdravniku.
.
Ali sodelovanje v klinični raziskavi res pomaga prostovoljcu?
Sodelovanje v klinični raziskavi lahko izboljša zdravstveno stanje sodelujočega, ki je običajno upravičen do dodatnih preiskav, pregledov in dodatnega spremljanja njegovega zdravstvenega stanja, prav tako pa ima dostop do zdravila, ki ga sicer še ni na trgu. Prostovoljci v raziskavah imajo ključno vlogo v znanosti, saj pomagajo razvijati nove načine zdravljenja, zaradi katerih ljudje živijo boljše in dlje.
.
Ali podpis obrazca o privolitvi pomeni, da si prostovoljec ne sme premisliti in izstopiti iz raziskave?
Namen obrazca o privolitvi je zaščita pravic prostovoljcev, ki v obrazcu izvedo vse o raziskavi, tudi o aktivnostih, pregledih in potencialnih tveganjih ter o pozitivnih učinkih. Prostovoljec lahko brez razloga in pojasnila kadarkoli izstopi iz klinične raziskave, vendar mora o tem obvezno obvestiti raziskovalce, saj se nekaterih zdravil ne sme prenehati jemati brez zdravniškega nadzora.
.
Ali so prostovoljci v kliničnih raziskavah res poskusni zajčki?
To ne drži, saj so prostovoljci že pred sodelovanjem obveščeni o vseh korakih, postopkih, pregledih, aktivnostih, potencialnih pozitivnih učinkih in tveganjih klinične raziskave. Vse te informacije so vključene v tako imenovani obrazec o privolitvi po poučitvi, ki ga prostovoljec podpiše, ko se odloči za sodelovanje v klinični raziskavi. Seveda imajo prostovoljci vse informacije na voljo tudi med in po zaključenem sodelovanju v klinični raziskavi.
.
.
“,Admin,1551676020,1551676020,sl,13824,306,13823,43,0,NULL,,”Klinične raziskave “,klinicne-raziskave,Post,/sites/43/files/images/Fokus/Microskop.jpg,1,0,1551676145,1551697900
533,13826,”V Ljubljani začetek mednarodnega projekta za oskrbo bolnikov s hipertenzijo in sladkorno boleznijo”,”Zdravstveni dom (ZD) Ljubljana v okviru raziskovalnega programa Obzorja 2020 kot eden od petih partnerjev “,”
Ljubljana, 15. februarja (STA) – Zdravstveni dom (ZD) Ljubljana v okviru raziskovalnega programa Obzorja 2020 kot eden od petih partnerjev skupaj z Belgijo, Nizozemsko in Kambodžo začenja štiriletni projekt za oskrbo bolnikov s hipertenzijo in sladkorno boleznijo tipa 2 za ranljive ljudi. Pomen in prednosti projekta bodo predstavili danes v Ljubljani.
Mednarodni projekt z naslovom Povečanje obsega integriranega svežnja oskrbe za bolnike s sladkorno boleznijo in hipertenzijo za ranljive ljudi (SCUBY) je po navedbah sodelujočih edinstven, saj omogoča učenje iz najboljših praks in iskanje poti, pri čemer bosta primerjava med državami in vzajemno učenje vodilo za pripravo časovnih načrtov. Ti bodo v pomoč tudi odločevalcem v zdravstvu pri “uvajanju najboljših praks in izboljšanju standardne zdravstvene oskrbe za te bolnike”, so sporočili iz ZD Ljubljana.
“Jedro tega štiriletnega projekta je povečanje obsega integriranega svežnja oskrbe s petimi komponentami,” so pojasnili. Te so identifikacija ljudi s hipertenzijo in/ali sladkorno boleznijo tipa 2, obravnava na primarni ravni, zdravstvena vzgoja, podpora bolnikom in negovalcem pri samokontroli ter sodelovanje med negovalci. Posebna pozornost je posvečena ranljivim skupinam bolnikov in vključevanju njihovih oskrbovalcev. Prizadevajo si tudi za razširitev in povečanje nadzora nad sladkorno boleznijo in hipertenzijo v vseh državah.
Kot so pojasnili, se povezujejo z odločevalci na vseh ravneh, da bi lahko prepoznali možnosti in ovire pri vpeljevanju najboljših praks v večjem obsegu in podprli smiselno uporabo v vsaki državi. Ovrednotili bodo, kako svežnji oskrbe vplivajo na rezultate in učinkovitost nadgradnje oskrbe v vsaki vključeni državi. Njihove izkušnje in novo znanje bodo po navedbah partnerjev projekta koristile odločevalcem v državah s podobnimi okoliščinami.
Konzorcij projekta sestavlja pet izkušenih strokovnih in raziskovalnih partnerjev z znanjem o kroničnih nenalezljivih boleznih in nadgradnjo oskrbe. Poleg ZD Ljubljana pri projektu sodelujejo še Nacionalni inštitut za javno zdravje iz Kambodže, Univerza v Antwerpnu v Belgiji, Inštitut za tropsko medicino iz Antwerpna in Univerzitetni zdravstveni center Utrecht iz Nizozemske.
Današnje predstavitve in slavnostnega začetka raziskovalnega projekta SCUBY, ki ga v programu Obzorja 2020 financira EU, naj bi se udeležili minister za zdravje Samo Fakin, generalni direktor Zavoda za zdravstveno zavarovanje Slovenije Marjan Sušelj, ljubljanski župan Zoran Janković in znanstveni referent pri Evropski komisiji Miguel Lizaso.
“,STA,1550208660,1550208660,sl,13826,306,13825,43,0,NULL,,”V Ljubljani začetek mednarodnega projekta za oskrbo bolnikov s hipertenzijo in sladkorno boleznijo”,v-ljubljani-zacetek-mednarodnega-projekta-za-oskrbo-bolnikov-s-hipertenzijo-in-sladkorno-boleznijo,Post,,1,0,1551677581,1551677582
535,13832,”Naši ljudje”,”Naši ljudje”,”
“,Admin,1551878040,1551878040,sl,13832,306,13831,43,0,NULL,,Intervijuji,intervijuji,Post,,1,0,1551878225,1552400078
536,13837,”Inovativna zdravila in novi pristopi premikajo meje pri zdravljenju redkih bolezni “,”Upanje za prihodnost sta genetika in tarčno zdravljenje”,”

Zgovorna in sproščena Primorka dr. Anja Silič, mag.farm., vodi področje redkih bolezni za Adriatic regijo v ljubljanski podružnici farmacevtskega podjetja Pfizer. Rada potuje v daljne dežele, kljub temu, da veliko časa preživi na službeni poti. Razpeta je nekje na Balkanu, odvisno od trenutnih problemov, ki jih je potrebno rešiti, da bolniki pravočasno prejmejo ustrezno zdravilo. Nima dosti prostega časa in se rada pošali, da trenira tek na kratke proge po letališčih. Delo, ki ga opravlja, ji je pisano na kožo, saj se dobro znajde v komunikaciji in je kulturne razlike ne ovirajo.
Vodim marketing in prodajo zdravil za redke bolezni v regiji Adriatic, ki obsega območje nekdanje Jugoslavije in Albanijo. Naša naloga je poskrbeti, da imajo bolniki z redkimi boleznimi na teh trgih dostop do naših zdravil. Prizadevamo si, da zdravilo, ki je na voljo v Evropski uniji, ponudimo bolnikom v celotni regiji Adriatic, čeprav so pogoji za oskrbo z zdravili drugod bistveno slabši kot v Sloveniji, kar lahko pomeni veliko razliko v preživetju bolnikov. Ključni element našega dela pa je tudi izobraževanje bolnikov in zdravnikov. Na redke bolezni namreč lahko pomislimo, samo če o njih kaj vemo. Za njihovo odkrivanje morajo zdravniki imeti znanje o bolezni, vedeti morajo, da za bolezen obstaja zdravilo, saj je tako bistveno lažje pristopiti k diagnosticiranju. Zdravniki morajo vedeti tudi to, kako se z bolnikom pogovoriti in kaj ga vprašati, da bodo sploh prišli do pravih informacij. Zato z njimi tesno sodelujemo, pomemben partner so tudi društva bolnikov za redke bolezni, ki so zelo aktivna. Še posebno na Hrvaškem in v Srbiji je njihova vloga pri oskrbi z zdravili ključna. Skupaj s partnerji pripravljamo informativna gradiva o boleznih, naša terapevtska področja so endokrinologija in bolezni presnove (denimo pomanjkanje rastnega hormona, akromegalija, Gaucherjeva bolezen), hematologija (hemofilija A in B), amiloidoza in transplantacije. Naša naloga je predstavitev zdravil za ta področja, skupaj z vsemi prednostmi in slabostmi. Farmacija torej ni le prodaja zdravil, saj informiranje in izobraževanje v resnici predstavljata največji del tega, kar delamo.
Pri Pfizerju sem že 21 let, to je moja prva služba. Končala sem fakulteto za farmacijo, v podjetje pa sem prišla, ker sem za diplomo obravnavala farmakokinetiko Pfizerjevega zdravila. Takrat se je ravno odprlo predstavništvo v Sloveniji in potrebovali so farmacevte. Na začetku smo imeli pet zdravil in majhno ekipo, danes pa je trg zdravil bistveno večji in s tem tudi konkurenca. Kot strokovna sodelavka sem najprej pokrivala protivnetna zdravila, nato sem se usmerila v različne prodajne in marketinške vloge (kardiološko področje, diabetes, bolečino), pomagala sem pri registraciji in razvrščanju zdravil. Z zadnjo reorganizacijo sem pred petimi leti prevzela področje redkih bolezni, ki mi je po strokovni plati pisano na kožo, saj sem vmes naredila še doktorat na biomedicini.
Vsekakor imam občutek, da se trudimo za boljše in kakovostno zdravljenje bolnikov, kar pripomore k izboljšanju kakovosti življenja in k podaljšanju življenjske dobe. Običajno pa ni le eno zdravilo tisto, ki reši bolnika, ampak jih je več. Zadovoljna sem, ko redke bolezni postavimo v eno od prioritet, na katere se pomisli. Veseli me, če bolniki dobijo zdravljenje takrat, ko ga potrebujejo; če otrok zraste na ustrezno višino s pomočjo rastnega hormona; če so bolniki dobro in če kljub resni bolezni kakovostno živijo.
Moje poklicne želje so se spreminjale iz dekade v dekado. Kot punčka sem vedno rada pletla kitke in sem želela postati frizerka. Vedno pa sem govorila, da bom zdravnica. No, potem me je v srednji šoli pritegnila kemija, zdravila, eksperimenti, natančnost. Ko sem se odločala med medicino in farmacijo, sem izbrala slednjo. Vsi so bili zaskrbljeni, da kot farmacevtka ne bom dobila službe, saj takrat v Sloveniji še ni bilo toliko predstavništev in take potrebe po farmacevtih, ki so večinoma lahko delali le v lekarni. Potem se je odprlo predstavništvo Pfizerja in lahko sem se zaposlila tu. Pri svojem delu imam rada to znanstveno noto, da torej ne gre le za prodajo zdravil, ampak za odkrivanje novih možnosti zdravljenja.
Glavna motivacija pri delu so zadovoljen bolnik, dobra zdravila in inovacije. Prihajajo nove terapije, veliko vlagamo v razvoj, začenja se obdobje genske terapije, ko ne govorimo več le o možnostih zdravljenja, temveč o možnostih ozdravitve. Ti znanstveni preboji mi dajejo zagon, saj so bolezni, ki jih naš oddelek pokriva, zelo resne. Če niso pravočasno diagnosticirane, se običajno slabo končajo. Zato je naše delo pomembno, ker zdravnike in bolnike osveščamo, da sploh prepoznajo bolezenske znake, se oglasijo pri zdravniku oziroma bolezen dovolj zgodaj diagnosticirajo.
Motivira me tudi delo v mednarodnem okolju in prenos dobrih praks med državami. Včasih dejansko premikaš meje, ko, denimo, pomagaš neki državi, da sploh pride do določenega zdravila. Veliko zadovoljstvo je, ko pripomoreš k oskrbi bolnikov. Hvaležni so tudi zdravniki in ta hvaležnost je tem večja, čim južneje greš.
V osebnem življenju pa si želim nekoliko več ravnovesja v razmerju med delom in prostim časom, saj sem res veliko na poti. Rada grem sicer v gledališče in opero, tako skrbim za kulturno polnjenje baterij, za rekreacijo pa prakticiram tek na kratke proge ob prestopanjih na letališčih, ker letala pogosto zamujajo (se nasmeje, op. p.). Zelo rada hodim tudi v hribe, pozimi smučam in se poleti odklopim na jadrnici, a največja strast so potovanja. Vsaj enkrat na leto obiščem bolj oddaljene kraje; obožujem Afriko. To je drug svet. V stepi in savani pogled seže daleč in takrat občutiš svojo majhnost. Nazadnje sem bila v Kirgiziji, prihodnje leto se odpravljam v Korejo. Za potovanja izbiram predvsem destinacije, kjer mobilni telefon ne lovi, sicer me vedno kdo potrebuje. Službena potovanja pa so drugačna. Na njih vidim predvsem hotele in sejne sobe, tudi mobiteli lovijo (smeh, op. p). A si skušam tudi na teh destinacijah vzeti pol ure za sprehod, predvsem pa na teh potovanjih več spim kot doma (smeh, op. p.).
Želim si, da bi ljudje vedeli, da smo farmacevti in zdravniki partnerji in da oboji delamo le za en cilj – za bolnika, zato si delimo koristne informacije, zadnje novosti, razpravljamo o projektih. Tako pridemo tudi do dobrih idej. V stiku z drugimi državami si lahko izmenjujemo pozitivne izkušnje in dobre prakse. Tudi izobraževanja na kongresih so pomembna, saj so vir svetovnih novosti, ki jih potem lahko uvajamo doma. Zmotno je torej prepričanje, da delamo le za številke in prodajo. Finančna plat je del vsakega posla, konec koncev mora tudi medicina paziti na stroške in bilance, izgube niso nikomur v interesu. A to je samo ena plat naše zgodbe. Druga plat našega dela, še posebej na področju redkih bolezni, pa je odkrivanje in osveščanje javnosti o boleznih ter o novih načinih zdravljenja.
V naslednjih nekaj letih bo gensko zdravljenje naredilo preboj v obravnavi redkih bolezni, to bo povsem nov pristop k zdravljenju, ko bomo lahko popravili tisti gen, ki povzroči bolezen. Tako bomo bolezen lahko pozdravili, ne le zdravili. To morda še ni tako blizu, vendar tudi ne tako daleč, saj se za nekatere bolezni klinične študije že zaključujejo.
Težko napovedujem, saj nisem Nostradamus, upam pa, da bomo bolj zdravi in da bomo znali bolje sodelovati, biti bolj strpni. Težava naše družbe je komunikacija. Včasih individualne cilje postavljamo pred tiste cilje, ki bi pripomogli k izboljšanju stanja celotne družbe. Želim si, da bi država zagotovila ustrezno obravnavo, da se bo našel denar za nove terapije in da jih bomo lahko ponudili v Sloveniji in drugod po svetu. Vse več se dela na individualizaciji terapije, naše upanje za prihodnost pa sta genetika in tarčno zdravljenje, ki je že prisotno v onkologiji. Potrebnih pa je precej majhnih korakov, da narediš enega večjega.
“,Admin,1552396980,1552396980,sl,13837,306,13833,43,0,NULL,,”Anja Silič”,anja-silic,Post,/sites/43/files/images/Fokus/Human.jpg,1,0,1551878854,1552383003
537,13838,”Bolj izobražen zdravnik, bolj izobražen bolnik, boljši rezultat”,”Nismo le dobavitelji zdravil, temveč dobavitelji rešitev”,”

Piotr Czerkies je simpatični Poljak, ki ga je splet življenjskih okoliščin prinesel na mesto direktorja medicinskega oddelka na slovenskem predstavništvu inovativne farmacevtske družbe Novartis. Ko je začel delati v farmaciji, je bil prepričan, da je to le začasno, a ko je ugotovil, kako pomemben vpliv ima lahko njegovo delo na življenje ljudi, ni želel več oditi. Bil je del revolucije na področju presajanja organov, kar so omogočili učinkoviti zaviralci imunske odzivnosti,iz vsake njegove besede pa, poleg iskrivosti in humorja, sije nesporna predanost delu, ki ga opravlja.
Povedal sem vam, tole ne bo enostaven pogovor, in res – že pri prvem vprašanju imam težave podati preprost odgovor. Preden sem se pridružil farmacevtski družbi, sem bil kar uspešen raziskovalec in univerzitetni profesor, tako da si še vedno lahko pripisujem nekaj strokovnosti na nekaterih področjih biologije rib. V zadnjih dveh desetletjih pa sem postal pravi »insajder« farmacevtske industrije, saj sem si pridobil izkušnje na zelo različnih področjih, od trženja in prodaje do izobraževanja zdravnikov in kliničnih študij. Na podlagi lokalnih in regionalnih izkušenj sem postal strokovnjak za prenašanje rezultatov kliničnih študij v klinično prakso na različnih terapevtskih področjih, kot so kardiologija, imunologija in transplantacija organov.
Če sem iskren, tega nisem imel v načrtu. Kot univerzitetni profesor v času družbenih sprememb sem imel težave pri vzpostavljanju ravnovesja med delom in osebnim življenjem. Da bi pridobil več časa za družino in poskrbel za večjo finančno varnost, sem presedlal v farmacijo, vendar z mislijo, da bi to bila le začasna rešitev. Ko sem ugotovil, kako velik vpliv ima lahko moje delo na človeška življenja, sem se odločil opraviti izobraževanja, pridobiti znanje in izkušnje, da sem lahko prevzel funkcijo v medicinskem oddelku. To je bilo zahtevno, a mojo predanost in strast so v Novartisu opazili in me v teh prizadevanjih zelo podprli.
Zame je ta občutek, poleg moje družine, glavni vir energije in vztrajnosti. Srečo imam, da delam v eni najbolj inovativnih družb na svetu, v kateri razvijamo učinkovite rešitve za številne zdravstvene potrebe in bolezni. Na primer – bil sem priča dinamičnemu razvoju področja presajanja organov, kar so omogočili učinkoviti zaviralci imunske odzivnosti. Pravzaprav temu nisem bil le priča, bil sem del te revolucije, saj sem pomagal pri osveščanju ljudi, kar je vodilo k večjemu darovanju organov. Slovenskim bolnikom trenutno prinašamo tudi novo zdravljenje za srčne bolnike, ki pomembno zmanjšuje smrtnost in povečuje kakovost življenja. Naše sodelovanje z lokalno zdravstveno skupnostjo, ki temelji na izobraževanju in ni vezano le na posamezno zdravilo, neposredno vpliva na boljšo raven oskrbe in na boljše vodenje bolnikov. Da ima moje delo neposreden vpliv na izboljšanje življenja drugega človeka, je zame vir velikega zadovoljstva in ponosa. Po drugi plati zato čutim tudi odgovornost do tistih bolnikov, ki še čakajo na svojo priložnost, kar mi daje moč, da postanem ambasador njihovih potreb.
Mislite poleg gasilca, policista, astronavta, voznika dirkalnih avtomobilov, bojnega pilota in rok zvezdnika? Odgovor je – kirurg. V osnovni šoli sem imel zoprno nesrečo, zaradi katere sem pet dolgih mesecev preživel v postelji. Ko so me pripeljali na urgenco, so zdravniki že razmišljali o amputaciji noge, a mlad in predan kirurg se je odločil, da jo bo poskusil rešiti. Za to, da lahko hodim, tečem in celo (slabo, a z navdušenjem) plešem, mu bom večno hvaležen. Ta izkušnja je v veliki meri vplivala na moje življenje, saj sem med okrevanjem prebral skoraj vse knjige, ki so bile na voljo v knjižnici, in se odločil, da s svojim življenjem naredim nekaj, kar bo imelo pomen.
Kljub vsemu sem nato namesto medicine izbral biologijo, da bi prispeval k varovanju okolja za prihodnje generacije. A ta »kirurg« se je še vedno skrival nekje v ozadju in čakal na pravi trenutek. Ta je prišel, ko sem se pogovarjal s profesorjem Zbigniewom Religo, srčnim kirurgom, ki je izvedel prvo uspešno presaditev srca na Poljskem. Ta legendarni človek mi je pomagal spoznati, kako pomemben vpliv na življenja ljudi ima lahko moje delo v farmacevtski industriji.
Nimam, razen morda reka »Warto być przyzwoitym« (Vredno je bili dostojen, op.p.) Władysława Bartoszewskega, poljskega zgodovinarja in odpornika iz 2. svetovne vojne. V osebnem življenju me motivira sreča moje družine, pri delu pa je v središču bolnik. Dokler bodo obstajali bolniki, ki jim lahko moje delo pomaga, mi motivacije ne bo zmanjkalo. Zelo rad imam tudi sodelovanje z ljudmi, komunikacijo in interakcijo, zelo rad delam v ekipi. S tega stališča sem tu v Sloveniji zelo zadovoljen, saj imam priložnost sodelovati z res krasnimi ljudmi.
O farmacevtski industriji kroži kar nekaj mitov. Bodimo iskreni – to ni najbolj priljubljen posel na svetu. A »big pharma« ne pomeni le velikih prihodkov, temveč predvsem velikanska prizadevanja za razvoj zdravil. V neko okolje pridemo z veliko znanja in volje do sodelovanja pri reševanju obstoječih zdravstvenih potreb. Nismo dobavitelj zdravil, temveč dobavitelj rešitev. Naše izkušnje in znanje lahko zdravstvenemu sistemu pomagajo izboljšati njegovo učinkovitost in optimizirati razdelitev virov. A da to lahko dosežemo, nas mora družba videti kot resnega partnerja in ne kot prodajalca zdravil, ki ga zanima le dobiček.
Raje bi rekel, da sem zadržani optimist. Splošno gledano je medicina v zadnjih desetletjih izjemno napredovala, človeško telo razumemo mnogo bolje, naša nova zdravila pa so bolj specifična, bolj ciljna in bolj učinkovita. Za našo družbo sta bili zadnji dve leti izjemni, saj smo na trg prinesli prvo gensko terapijo na področju oftalmologije in prvo onkološko terapijo z gensko spremenjenimi imunskimi celicami bolnika. Vidimo lahko tudi veliko pozitivnih sprememb v osveščenosti o zdravju in zdravem načinu življenja, manj dejavnikov tveganja in napredek v zdravstveni oskrbi pa se odražata v daljši pričakovani življenjski dobi. Omeniti je treba tudi vedno večjo prisotnost tehnoloških in telekomunikacijskih podjetij na področju zdravja, prihajajo nove naprave za spremljanje osebne aktivnosti in življenjskih funkcij ter z njimi povezane aplikacije, rastejo tudi telezdravstvene storitve. A hkrati se soočamo z novimi izzivi, kot so dolgoživa družba, okoljska problematika ter naraščajoči družbeni pritiski zdravstvenih stroškov, katerih reševanja se bomo morali lotevati sistematično.
To, kar raziskujemo na osnovni ravni danes, nam bo dosegljivo čez dvajset let. Tisto, kar smo že odkrili in danes testiramo, pa nam bo na voljo čez deset let. Pričakujemo lahko, da bodo zdravljenja bolj prilagojena potrebam posameznika, kar nam bo omogočalo natančnejša posredovanja, ki bodo upoštevala klinični status bolnika in njegov genom. Telezdravstvena revolucija bo preoblikovala način vodenja bolnika in omogočala stalen nadzor, zdravstvena posvetovanja na daljavo in časovno ustreznejša posredovanja.
Naša izobraževanja že sedaj vključujejo nekaj elementov, ki zdravstvene delavce pripravljajo na prihajajoče sistemske spremembe v vodenju bolnikov in ki večajo osveščenost bolnikov, da bodo lažje sodelovali v tem procesu. Boljši rezultat zdravljenja lahko pričakujemo, ko se bolj izobražen bolnik sreča z bolj izobraženim zdravnikom – in to je tisto, za kar skrbim jaz.
“,Admin,1552397640,1552397640,sl,13838,306,13834,43,0,NULL,,”Piotr Czerkies”,piotr-czerkies,Post,/sites/43/files/images/Fokus/Human.jpg,1,0,1551880402,1552400179
538,13839,”Od igre z epruvetami do vodenja celotnih trgov “,”Telo mora podpirati duha, saj lahko le zdrav daješ družbi in ljudem”,”

Nesojeno veterinarko po izobrazbi je poklicna pot po končani fakulteti zanesla v farmacevtsko industrijo, kjer se je Ljiljana Žunjanin razvila v menedžerko, sposobno voditi trge v več različnih državah. Na videz je mladostna, pristopna in umirjena, deluje pa zelo zrelo in samozavestno, čemur najverjetneje botruje dejstvo, da si je z marljivim delom ter željo po znanju in napredovanju nabrala vse potrebne izkušnje. Čeprav ima družino, je zelo predana tudi svojemu poklicu, zato ga nikoli povsem ne izklopi iz glave. Njen službeni naziv je regijski vodja v podjetju Astellas Pharma, trženje in distribucija farmacevtskih izdelkov. Podjetje je del globalne farmacevtske družbe, ki ima sedež v Tokiu na Japonskem.
V okviru regije Adriatic-Baltic sem »country manager« za Adriatic, kar obsega Slovenijo, Hrvaško ter Bosno in Hercegovino. Sedež imamo v Ljubljani. V podružnici na Hrvaškem imamo devet zaposlenih, v BiH pa dva človeka. Moja funkcija vključuje vodenje zaposlenih v vseh treh državah, skupaj je to 23 ljudi. Pokrivamo marketing in prodajo, od predstavnikov na terenu in produktnih vodij do vodij predstavnikov. Predstavljamo zdravila za različna terapevtska področja, medtem ko razvoj zdravil poteka na globalni ravni. Terapevtska področja, ki jih pokrivamo, so onkologija, urologija, transplantacije, anti-infektiva. Kot menedžerka v multinacionalki pa moram seveda razumeti tudi finance.
Zaključila sem študij na veterinarski fakulteti, sem torej doktorica veterinarske medicine, a tega dela nisem nikoli opravljala. Po fakulteti v veterini nisem dobila zaposlitve, zato sem se pridružila farmacevtski industriji, kar se je kasneje izkazalo za zelo dobro odločitev, ki je ne obžalujem. Velikokrat me sprašujejo, če mi je žal, da nisem veterinarka, ali pa, kako to, da veterinarka dela v farmaciji. Ti dve področji nista tako nepovezani. Pri mojem delu v farmaciji mi je izobrazba veliko pomagala. Ko se pogovarjamo o zdravilu, je treba razumeti njegovo delovanje na organizem, indikacije, stranske učinke. Farmakokinetika, farmakodinamika ter distribucija zdravila v organe potekajo precej podobno tako v živalskem kot človeškem organizmu. Poleg tega se tudi veliko raziskav dela najprej na živalih, preden pridejo v klinično preizkušanje na človeku. V komunikaciji z zdravnikom zelo pomaga poznavanje delovanja organizma kot takega. To znanje sem dobila na fakulteti. Finančni del pa se je bilo treba priučiti, tega nam fakulteta ni dala. Na srečo sem imela dovolj dobre sodelavce in zdravo kmečko logiko, da sem se naučila samostojno narediti tudi finančni dokument in ga interpretirati.
Kariero v farmaciji sem začela kot prodajna predstavnica na terenu v podjetju Servier Pharma. Obiskovala sem zdravnike in predstavljala zdravila; to je bilo 15 let nazaj. Tam sem bila tudi produktni vodja. V podjetju Abbott sem bila potem vodja trženja, vodja poslovne enote in vodja za državo, še kasneje v podjetju Mylan pa vodja za več držav – Češko, Slovaško, Albanijo, Kosovo in Slovenijo. Takrat je bilo zelo veliko potovanj, ki so bila precej nezdružljiva z zasebnim življenjem – živela sem na letalu. In to je bil tudi eden od razlogov, zakaj sem prišla v družbo Astellas Pharma, kjer sem že četrto leto. Moje delo tukaj je bolj centralizirano. Še vedno potujem, vendar bistveno manj kot prej. Ponosna sem na to, da sem v karieri postopno napredovala in po korakih osvojila vsako delovno mesto. Imela sem torej čas razvijati se in spoznati vsako od funkcij, za katero sem sedaj odgovorna. Tudi osebnostno sem se z delom v farmaciji precej izpopolnila. Na začetku je bilo težko, potem pa mi je prav moje delo omogočilo razvoj novih kompetenc, kot so komunikacijske veščine, sposobnost hitrih odločitev, smisel za organizacijo ter gradnja odnosov s strankami in sodelavci. Vse to je kasneje botrovalo kariernim napredovanjem in je zelo uporabno tudi sicer v življenju.
Osebno sem imela to srečo, da sem vedno delala v podjetjih, kjer je bil bolnik na prvem mestu. Tudi interno, ko smo se pogovarjali, smo bili vedno osredotočeni na bolnika. Moja motivacija je ravno bolnik – bolje kot bom znala predstaviti prednosti zdravila, večjo korist od tega bo imel bolnik, saj bom tako pripomogla k temu, da bo dobil pravo zdravilo zase. Če mu to zdravilo izboljša potek bolezni in podaljša življenje, sem vedno vesela. Na ta način se vidim soodgovorno za bolnikovo zdravje. Seveda pa je zdravnik tisti, ki odloča, katero zdravilo bo bolnik dobil.
Kot otrok sem vedno vso svojo žepnino vložila v epruvete, petrijevke, lije. Znanost me je vedno zanimala. Hotela sem biti znanstvenica. Mislila sem, da bom delala v laboratoriju in da bom odkrivala nove molekule, da bom morda odkrila kakšno novo zdravilo. Vse svoje prihranke sem tako dajala na kupček za nakup malih laboratorijskih pripomočkov. Doma sem imela svoj igralni kotiček, ki se je imenoval laboratorij, in tam sem delala svoje male znanstvene poskuse ter pod mikroskopom opazovala žuželke in rastline. V knjižnici sem si na to temo izposojala veliko knjig, starši pa so me kar podpirali. Tako sem se odločila tudi za vpis na Bežigrajsko gimnazijo, ki je imela poudarek na naravoslovju, potem pa za fakulteto veterinarske znanosti. Nikoli nisem želela postati zdravnica. Veterina je bila moja prva izbira, saj sem imela rada živali, imeli smo jih tudi doma, celo med igro na ulici smo otroci s ceste pobirali potepuške mucke. Zdaj živali nimam, saj je zanje treba imeti čas, moj delovnik pa se pravzaprav nikoli ne konča. Sem pač tak tip, ki nikoli ne izklopi, stalno razmišljam, kaj bi še lahko naredila, kaj bi lahko naredila bolje in sem visoko motivirana.
Zasebno je moja največja motivacija moj sin, moj osebni moto pa je »Nikoli se ne predaj«. Vsakdanje življenje nam včasih nastavi pasti, težave nas kar posrkajo, vendar je treba včasih izstopiti iz te drame in se ne predati. To velja za vsa življenjska področja, tudi za prehranjevanje, šport, staranje. Telo mora vedno podpirati duha, saj boš le zdrav lahko kaj dal družbi in ljudem, ki jih imaš rad. Zame je to vse povezano, vse mora biti v ravnovesju, zato se precej ukvarjam s športom. Rekreativno veliko tečem, kar mi pomaga pri mentalnem razstrupljanju, pozimi hodim tudi v fitnes in vedno pazim, da sem v gibanju. Sem tip, ki bo raje izbral stopnice kot dvigalo, rada veliko stvari opravim peš in z rokami. V službi pa sem morala vedno v prvi vrsti verjeti v to, kar sem predstavljala. Vedno me je gnalo to, da bi bolnik lahko dobil najboljše zdravilo za svojo bolezen. To je naše poslanstvo in glavni motivator, da vztrajam na tej poti. Farmacevtska industrija mi je vedno omogočala, da sem lahko izražala svoje talente in speče potenciale. Pustila mi je tudi dovolj časa, da sem jih razvila. Vedno sem rada delala z ljudmi in to mi moje delo omogoča. Moja velika motivacija je tudi moja ekipa. Rada delam tam, kjer lahko pustim pečat na ljudeh. Tako dobiš zadoščenje, da si tudi ti nekaj dobrega naredil.
Kot mladostnica nisem bila komunikativna, bila sem sramežljiva in vedno malo v ozadju. Zato sem se namenoma vrgla v to branžo, ker sem imela vizijo, da sem bom med delom teh veščin priučila. Zato sem velikokrat hvaležna farmaciji, saj me je tega res naučila. Farmacevtske družbe namreč omogočajo veliko izobraževanj, ki sem se jih udeležila, nekatere kompetence pa mi je dala predvsem praksa. Vidim, da sem v primerjavi z nekoč v nekaterih situacijah bolj suverena in jih z lahkoto premagujem. Predvsem ljudje, ki me poznajo od mladosti, pravijo, da sem se zelo spremenila, da komuniciram in nastopam bolje in bolj samozavestno.
Zmota je, da nič ne naredimo za družbo, da smo zelo neetični, v resnici pa je to vroča tema v farmacevtski industriji. Imamo zelo oster samonadzor, zelo smo kritični sami do sebe in med sabo ter stremimo k visoki etičnosti in jo živimo. Napačno je tudi prepričanje, da vse gledamo skozi številke. Seveda nismo socialna ustanova, vendar pa se med nami večino časa pogovarjamo o bolniku, ne o zaslužkih. Tudi sami se med sabo vzgajamo tako, da naša motivacija temelji ravno na bolniku, zdravljenje njegove bolezni in kakovost njegovega življenja morata biti naš osrednji cilj. Meni je izjemno pomembno, da prodajam dobra zdravila, ki bodo rešila življenja, in farmacija naredi veliko dobrega. Tako lahko danes z nekaterimi kroničnimi boleznimi, kot sta visok krvni tlak ali aids, ljudje kakovostno živijo vrsto let, kar včasih ni bilo mogoče. Seveda pa zagovarjam tezo, da za svoje zdravje lahko največ naredimo sami, s preventivo, ki se začne z zdravim življenjskim slogom.
Ja, sem optimistična. Razvoj gre v preventivo, v preprečevanje določenih bolezni, zelo se razvija genetska medicina, s katero lahko določijo nagnjenost za razvoj določenih bolezni, ki se potem lahko razvijejo ali pa ne. Del medicine bo seveda še vedno tudi kurativa, pri čemer pa bomo morali na novo definirati starostnika. Če je bila ženska nekoč pri štiridesetih zrela ali celo že stara, se bo ta meja prav zaradi preventive močno pomaknila navzgor.
Verjamem, da bo v prihodnje poudarek tudi in predvsem na kakovosti bivanja bolnika v samem procesu zdravljenja. Zdravljenje na daljavo v bolniku prijaznem (domačem) okolju, kjer ga obdajajo pozitivni občutki, je vsekakor izziv za nove pristope. Seveda pa ne gre pozabiti na informacijsko tehnologijo, ki bolnika opolnomoči z znanjem, napravami in pripomočki ter ga postavi v aktivno vlogo v procesu zdravljenja. Uporaba umetne inteligence v procesih zdravljenja pa bo za naše otroke najverjetneje kar del zdravstvenega vsakdana.
V zdravstvu se stvari premikajo iz sekundarne ravni na primarno. Manj bo torej specialističnega obravnavanja in manj hospitalizacij, več pa dela na preventivi in dnevnih klinik. Če navedem primer: za kemoterapijo so bolniki nekoč morali ležati v bolnišnicah, zdaj pridejo v dnevno bolnico, kjer dobijo v žilo kemoterapevtik in gredo domov. Bolniki bodo vse bolj zdravstveno izobraženi, informacijsko podprti in samozavestni. Prevzemali bodo aktiven nadzor nad lastnim zdravjem in zdravljenjem ter bodo upravičeno čedalje zahtevnejši in bolj osveščeni uporabniki farmacevtskih in drugih zdravstvenih produktov.
Farmacija pa bo morala v prihodnje samozavestno, ponosno in iskreno vedno znova osveščati in dokazovati, da je naš cilj boljše zdravje v družbi. O tem in o mentaliteti ljudi, ki v tej industriji delamo, moramo govoriti več, saj si resnično in iskreno prizadevamo, da bi bil rezultat našega dela bolj zdrav in zadovoljen človek. Morda zveni klišejsko, a prepričana sem, da to še vedno premalo poudarjamo.
“,Admin,1552398840,1552398840,sl,13839,306,13835,43,0,NULL,,”Ljiljana Zunjanin”,ljiljana-zunjanin,Post,/sites/43/files/images/Fokus/Human.jpg,1,0,1551880696,1552460196
539,13840,”Ko se zgodba bolnika srečno izteče, je vse poplačano”,”Farmacevtska industrija je spremenila potek življenja za ljudi”,”

Naravoslovka po duši, simpatična, nasmejana in polna elana. Že v prvem trenutku je videti, da je našla svoje poslanstvo, da verjame v svoje delo in da ga opravlja s srcem. Kar precej delovnih ur preživlja v pisarni z razgledom na gore in veliko fotografijo jadrnice na steni. Spominja jo na morje in valove, pravi, med katerimi v prostem času tudi sama rada najde svoj mir. Rada ima stik z naravo, zato ji v pisarni dela družbo tudi mogočna zelena rastlina. Zanimajo jo novosti, nove tehnologije, napredek, raziskovanje. Ko govori o svojem delu, ji žarijo oči. Če v življenju delaš tisto, kar te veseli, se lahko zgodijo velike stvari, je prepričana. Pri svojem delu je vedno osredotočena na človeka, na bolnika, katerega kakovost življenja ali celo preživetje je odvisno od dela predanih ljudi v zdravstvu in farmacevtski industriji, prav takšnih, kot je Mojca Šelih, strokovni vodja medicinsko-regulatornega oddelka v podjetju Roche, farmacevtska družba. Podjetje je slovenska podružnica globalne farmacevtske skupine Roche. Družbo s sedežem v švicarskem Baslu je oktobra 1896 ustanovil Fritz Hoffmann-La Roche.
V našem oddelku skrbimo za registracije naših zdravil, opremljanje zdravil, ustrezno skladiščenje in sproščanje zdravil na trg. Neprestano spremljamo varnost naših zdravil, ko so že na trgu. Odgovorni smo tudi za medicinske informacije o naših zdravilih, za strokovna izobraževanja zdravstvenih delavcev in za izvajanje kliničnih raziskav. V našem oddelku imamo prav tako odgovorne osebe za kakovost na štirih področjih dobrih praks. Smo relativno majhen tim – nekaj več kot 40 nas je v celem podjetju, v mojem oddelku pa nas je 13.
V podjetju Roche sem že od leta 2001, 17 let. Svojo kariero sem začela kot strokovna svetovalka, kmalu pa sem se preusmerila v medicinski del, v izvajanje kliničnih raziskav. Klinične raziskave so me zanimale, saj si tukaj v okviru našega dela najbližje bolniku. Kasneje sem se usmerila na kakovost izvajanja kliničnih raziskav in izobraževanje. Za leto dni sem šla delat tudi na sedež našega podjetja, ki je v Baslu. Tam sem opravljala funkcijo regijske vodje kliničnih operacij za regijo. V okviru te funkcije smo se trudili v posameznih državah omogočiti pogoje, da bi se mednarodne klinične raziskave lahko izvajale v več državah. Po vrnitvi v Slovenijo sem kmalu prevzela lokalno vodenje medicinske skupine, kasneje medicinskega oddelka in nato medicinsko-regulatornega oddelka. V zadnjem letu se mi je torej zgodilo kar nekaj sprememb.
Ja, imam ta občutek. V to smo relativno hitro vpleteni že v okviru kliničnih raziskav, kjer zdravila spremljamo že od samega začetka. Zelo se trudimo, da bi raziskave pripeljali tudi v Slovenijo in da bi imeli tudi naši bolniki dostop do najnovejših zdravil. Vključitev vsakega bolnika v klinično raziskavo nam veliko pomeni, ker vemo, da bo imel v tistem trenutku najboljše klinične možnosti za zdravljenje. Velika paleta naših zdravil je za zdravljenje raka in bolezni, ki so ali življenjsko ogrožajoče ali pa zelo vplivajo na kakovost življenja. Pri svojem delu se tako vsak dan srečujemo z boleznimi, o katerih sicer neradi razmišljamo, zato znamo zdravje toliko bolj ceniti.
Kadar vidiš, da gre bolnikom v raziskavi in v klinični praksi dobro, pa je to prav poseben občutek. Počutiš se izpolnjeno. To je tisto, zaradi česar vsak dan prihajaš v službo. Pri našem delu je zelo veliko reguliranih zadev, vse postopke moramo imeti za vsak korak pisno dokumentirane, veliko je birokracije in ko se neka zgodba srečno izteče, je tudi vse to, kar delamo zraven, poplačano. Ravno danes šušti po hodniku – proslavljamo, ker smo uspeli bolniku s težkim primerom redke bolezni samo v 24 urah zagotoviti zdravilo iz tujine. Vsi v podjetju smo na dan, ko sicer nismo bili v pisarni, stopili skupaj in našli pot, da je bilo zdravilo v 24 urah že v bolnišnici pri bolniku, ki je tako dobil hitro pomoč
Želela sem si postati kemik. V osnovni šoli sem imela zelo dobro učiteljico kemije in prav ona me je navdušila za ta predmet. Kar nekaj iz razreda nas je hodilo na dodatni pouk kemije. Ko pa je postala kemija pri rednem pouku bolj komplicirana, sem pri dodatnem pouku ostala sama z učiteljico. Takrat sva malce pospešili tempo in se bolj poglobili v kemijo. Namesto na gimnazijo sem šla potem na srednjo kemijsko šolo, saj sem bila prepričana, da bom v tej smeri nadaljevala pot tudi na fakulteto. V srednji šoli smo se spoznali z različnimi vrstami kemije, ampak vse je bilo zelo vezano na proizvodnjo, kemija zaradi kemije pa se mi ni zdela tako aplikativna in pomembna, kot če se jo poveže s človekom. Želela sem si povezave s človekom, z zdravljenjem, da bi to znanje imelo širši pomen. Tako sem si pred izbiro fakultete premislila in se vpisala na fakulteto za farmacijo.
Farmacija je multidisciplinarna veda, ki ti da veliko širine in veliko možnosti, da se lahko usmeriš v različna področja dela, od lekarne do klinične farmacije, proizvodnje, raziskovanja. Diplomo sem delala iz področja biotehnologije. Raziskovalno delo v okviru diplome je bilo zelo zanimivo, vendar relativno daleč od bolnika. Želela pa sem, da bi bilo moje delo bližje bolniku. Zato sem si želela dela na koncu verige proizvodnje zdravil, v zaključnih kliničnih raziskavah ter uvajanju v klinično prakso. Zanimale so me inovacije in tako sem prišla v inovativno podjetje. V tistem času smo se v okviru biotehnologije o bioloških zdravilih učili samo iz knjig, Roche pa je bilo podjetje, ki je v klinično prakso uvedlo prvi biološki zdravili za zdravljenje solidnih in hematoloških tumorjev (med solidne sodi, denimo, rak dojke, med hematološke pa limfomi, op. p.), ki sta spremenili potek bolezni za te bolnike in še danes predstavljata pomemben mejnik zdravljenja. Ti zdravili sta predstavljali vrhunec biotehnologije tistega časa, kar smo na fakulteti študirali v knjigah. Čeprav nisem bila od samega začetka udeležena pri razvoju teh zdravil, pa sem kasneje postala vpletena v njihovo razvojno pot. Ko vidiš, kako so ta zdravila res spremenila prakso, si zelo ponosen na svoje delo.
Po duši sem naravoslovka in imam rada znanost. Verjamem v z dokazi podprto medicino. Verjamem, da je znanost tista, ki vodi v napredek. Tako zasebno kot pri delu me zanimajo novosti, nove tehnologije in tudi iznajdljivost posameznikov. Zdi pa se mi tudi pomembno, da v življenju delaš tisto, kar te veseli, ter da si lahko zvest samemu sebi. Če tako delaš, si lahko pri delu tudi uspešen in zgodijo se velike stvari. Delo je pomemben del našega življenja, je pa pomembno tudi to, da si znamo narediti prijetne trenutke, da smo drug do drugega prijazni, da si tudi pomagamo in da znamo živeti življenje. To pomeni, da imaš interese, svoje zasebno življenje in hobije, da loviš ravnotežje med poslovnim in zasebnim življenjem. Lepo je, če te stvari v službi toliko motivirajo, da niso samo delo, ampak o njih rad govoriš tudi zasebno, da so na ta način tudi bolj organsko del tebe. Zasebno imam rada morje, rada jadram. Jadranje pa ni samo hobi, je kar način življenja.
Želim si, da bi ljudje malo bolj poznali to, kar farmacevtska industrija počne. Najpogostejša zmota je verjetno to, da je cilj našega dela zgolj dobiček. Delamo na enem najbolj reguliranih področij, vsak korak razvoja, proizvodnje in preizkušanja je uzakonjen in poteka skladno z dobrimi praksami. Vse to pa je vedno pod budnim očesom zunanjih inštitucij, ki nas kontinuirano preverjajo. Zdravila, ki pridejo pod takimi pogoji na trg, so po vseh strogih etičnih standardih preizkušena in dokazano učinkovita z ugodnim razmerjem varnosti nasproti tveganju. Da, z zdravili seveda ustvarjamo tudi dobiček, tako kot vse druge industrije. Ponosna pa sem na to, da je naša industrija v vrhu po investicijah dobička nazaj v razvoj novih zdravil. Na področju zdravil so potrebni zelo visoki vložki zaradi vseh zahtev in standardov, ki pa se ne zaključijo, ko zdravilo pride na trg, ampak trajajo cel življenjski cikel zdravila. K temu nas za razliko od drugih industrij zavezujejo tudi etični standardi. Naša industrija je pravzaprav spremenila potek življenja za ljudi – naši pradedje so umirali precej prej, ker takrat še ni bilo zdravil, ki jih imamo danes. Danes imamo daljšo pričakovano življenjsko dobo, zaradi napredka zdravstva in zaradi zdravil, ki jih imamo na voljo.
Sem optimistična. Napredek znanosti in tehnologij je izjemen. Na voljo bomo imeli več tehnologij, ki bodo vplivale na to, kako živimo. Mislim, da se bo največ spremenilo na področjih zdravstva in ekologije. Nove tehnologije v zdravstvu že zdaj premikajo meje. Z genomskim profiliranjem tumorjev lahko že danes priporočamo zdravljenja na osnovi značilnosti posameznega tumorja, to zdravljenje je torej že zelo individualizirano. Medicinsko znanje eksponentno raste, izziv pa bo, kako to znanje obvladovati in kako temu slediti. Potrebovali bomo nove tehnologije, ki bodo znale to znanje sintetizirati v nek algoritem, da bomo lahko vse te informacije obvladovali. Nekatere nove tehnologije to že zmorejo. Vedno pa bo vprašanje, komu in kako bodo te tehnologije dostopne. Izziv bo tudi povezljivost vseh teh sistemov. Veliko podatkov imamo že zdaj v elektronski obliki, vendar še ne znamo vseh dobro povezovati.
Prihodnost bo zelo tehnološko obarvana, zdravstvo bo z novimi tehnologijami eksponentno napredovalo, s pomočjo tehnologij pa bo tudi dostop do zdravstva boljši. Z enim klikom bomo povezani z zdravnikom, farmacevtom in medicinsko sestro, ne bo več nujno iti v ambulanto. Že zdaj nosimo raznorazne merilnike, v prihodnosti pa bodo aplikacije, ki merijo parametre našega zdravja, povezane z zdravnikom, ki bo lahko preko njih nadzoroval naše stanje. Tako bo morda lahko videl, kakšen je srčni utrip bolnika, koliko se giblje, kako deluje zdravilo. Na voljo bodo nove tehnologije v diagnostiki, številne izvide bo lahko s pomočjo pametnih algoritmov odčitala umetna inteligenca, ne samo zdravnik. Računalnik so že naučili, kako lahko s pomočjo določenega algoritma zelo natančno loči sliko med melanomom in nemelanomom, podoben preboj je tudi na področju oftalmologije. Vendar pa tudi čez 30 let tehnologija ne bo nadomestila človeka, ampak bo zdravnik za diagnosticiranje in zdravljenje imel na voljo več možnosti. Na voljo bo imel izvide in pametne algoritme na osnovi podatkov iz kliničnih raziskav in prakse v elektronskem sistemu. Vse bo dostopno v realnem času na računalniku, kar mu bo omogočalo odločitev na osnovi znanja, algoritma in njegovega poglobljenega pogleda v podrobnosti, kako optimalno zdraviti neko bolezen. Vsi relevantni podatki za odločitev bodo nekoč dostopni na klik, in to bo tisto, kar je prihodnost medicine.
Poznali in odpravljali bomo tudi vzroke bolezni in ne le simptomov. Naša zdravila bodo oblikovana za določen tip bolezni, povezan z genetskimi in drugimi značilnostmi, saj bomo z novimi tehnologiji tudi vedno bolje lahko opredelili posamezne bolezni. To znamo že danes in to področje gre v čedalje večje detajle. S pomočjo širokega genomskega profiliranja bomo določili tip tumorja za vsakega bolnika. Izdelovali bomo cepiva za zdravljenje raka, ki bodo izdelana za vsakega posameznika. Zdravila bodo odpravljala tudi vzroke bolezni. Ta prihodnost je že zdaj v naših laboratorijih.
“,Admin,1551881100,1551881100,sl,13840,306,13836,43,0,NULL,,”Mojca Šelih”,mojca-selih,Post,/sites/43/files/images/Fokus/Human.jpg,1,0,1551881310,1552382539
540,13842,”Zdrav življenjski slog pripomore k nižji obolevnosti za rakom”,”Teden boja proti raku izpostavlja, da bi z zdravim življenjskim slogom lahko ogroženost z rakom zmanjšali za do 50 odstotkov.”,”
Ljubljana, 04. marca (STA) – Teden boja proti raku izpostavlja, da bi z zdravim življenjskim slogom lahko ogroženost z rakom zmanjšali za do 50 odstotkov. Da ne zbolimo za rakom, je treba opustiti kajenje, omejiti sončenje in pitje alkohola ter se redno udeleževati presejalnih programov. V četrtek bodo boj proti raku na lokalni ravni predstavljala društva.
Letošnji teden boja proti raku z geslom Evropski kodeks = manj raka izpostavlja nasvete evropskega kodeksa proti raku. Nasveti v evropskem kodeksu proti raku opozarjajo, da zdrava prehrana in gibanje nista dovolj. “Če bi upoštevali vseh 12 priporočil, bi lahko ogroženost z rakom zmanjšali za od 30 do 50 odstotkov,” je za STA pojasnila predsednica Zveze slovenskih društev za boj proti raku Maja Primic Žakelj.
Tako pa je pomembno tudi omejiti sončenje, zračiti prostore, se izogibati nevarnim snovem na delovnem mestu in v bivalnem okolju. Ženskam priporočajo, naj dojijo čim dlje in se izogibajo hormonskemu zdravljenju menopavznih težav. Starši pa naj poskrbijo, da bodo otroci cepljeni proti HBV ter HPV. Priporočajo tudi udeležbo v presejalnih programih Zora, Dora in Svit.
Teden boja proti raku in projekt približevanje kodeksa dijakom ter zaposlenim bodo podrobneje predstavili na današnji novinarski konferenci. V torek bo na Onkološkem inštitutu Ljubljana dan odprtih vrat, predstavili bodo obsevalni oddelek.
V sredo bodo na ministrstvu za zdravje na slavnostni seji podelili plakete in priznanja. Podarili bodo tudi sredstva iz novoletne akcije, letos bodo podarili ergonomski mikroskop za pregled celic iz brisa maternega vratu citološkemu laboratoriju bolnišnice Celje.
V četrtek se bodo v lokalnem okolju predstavila regijska društva. V Ljubljani bo zdravstvena šola predstavila samopregledovanje dojk in mod. Teden pa bodo v petek zaključili v Žirovnici, ko bodo zaključili tudi akcijo spodbujanja zdravega življenjskega sloga in nekajenja med osnovnošolci.
Vsako leto za rakom zboli več kot 14.000 Slovencev, kažejo podatki Registra raka RS iz leta 2015. Med njimi je okoli 8000 moških in 6000 žensk. Vsako leto umre več kot 6000 bolnikov. Smrtnost zaradi raka se manjša.
Najpogostejši so kožni rak, rak prostate, debelega črevesa in danke, dojke ter pljuč. Ti raki predstavljajo skoraj 60 odstotkov novih primerov. “Ponosni smo, da se zmanjšuje zbolevanje za pljučnim rakom med moškimi, ker se je tudi delež kadilcev v zadnjih 30-40 letih prepolovil,” je poudarila Primic Žakeljeva.
V otroštvu so pogostejši krvni raki. Pri mladih odraslih moških je najpogostejši rak mod, mlajše ženske pa najpogosteje zbolijo za rakom materničnega vratu. Pri 50 letih je pri ženskah najpogostejši rak dojke, pri moških pa rak debelega črevesa in danke, je naštela.
“,STA,1551702360,1551702360,sl,13842,306,13841,43,0,NULL,,”Zdrav življenjski slog pripomore k nižji obolevnosti za rakom”,zdrav-zivljenjski-slog-pripomore-k-nizji-obolevnosti-za-rakom,Post,,1,0,1551961629,1551961629
541,13844,”Mednarodni dan ozaveščanja o HPV tudi kot spodbuda k učinkoviti preventivi”,”Danes obeležujemo drugi mednarodni dan ozaveščanja o HPV, človeških papiloma virusih. “,”
Ljubljana, 04. marca (STA) – Danes obeležujemo drugi mednarodni dan ozaveščanja o HPV, človeških papiloma virusih. Okužbe s HPV so zelo pogoste, saj se vsaj enkrat v življenju okužimo skoraj vsi. Večina okužb poteka brez znakov bolezni, nevarnejši genotipi HPV pa lahko povzročajo predrakave spremembe in raka materničnega vratu. Pred okužbo se lahko zaščitimo s cepljenjem.
Okužba s HPV je po podatkih Nacionalnega inštituta za javno zdravje (NIJZ) ena izmed najpogostejših spolno prenosljivih okužb. Vsaj polovica ljudi, ki so spolno aktivni, se bo v življenju okužilo s HPV. Okužba s HPV je najpogostejša pri najstnikih in mlajših odraslih, starih od 15 do 25 let.
Okužba se prenaša s tesnimi stiki s kožo ali sluznico okužene osebe, na primer s spolnimi odnosi. Prenese se lahko tudi z matere na novorojenčka ob porodu, so pojasnili v Državnem programu zgodnjega odkrivanja predrakavih sprememb materničnega vratu Zora.
Poznamo več kot 200 genskih različic HPV, ki jih imenujemo genotipi. Okoli 45 genotipov HPV povzroča okužbe spolovil, rodil in predela okoli zadnjika. Večina okužb poteka brez znakov bolezni in okužena oseba sploh ne ve za okužbo. Tudi okužbe z nevarnejšimi genotipi HPV so najpogosteje prehodne in nikoli ne bodo povzročile bolezni. Nevarnejši HPV povzročajo predrakave spremembe in raka, manj nevarni pa genitalne bradavice.
Kot so poudarili v Zori, se pred okužbo s HPV lahko delno zaščitimo z varno spolnostjo. Pomembna je uporaba kondoma, ki pa prenosa okužbe s HPV ne prepreči popolnoma. Osebe, ki imajo v življenju več spolnih partnerjev, imajo večje tveganje okužbe s HPV.
Pred okužbo s HPV se je sicer možno dodatno zaščititi s cepljenjem. V Sloveniji je od leta 2009 cepljenje proti HPV vključeno v državni program cepljenja in se izvaja pri deklicah v 6. razredu osnovne šole. Prav tako že potekajo aktivnosti za vključitev dečkov v državni program cepljenja proti HPV. Cepljenje je najbolj smiselno do 26. leta starosti, pogojno pa tudi do 45. leta.
Cepljenje proti HPV je sicer najbolj učinkovito pred vstopom v spolno življenje, ko oseba še ni bila izpostavljena okužbi s HPV. Smiselno pa je tudi kasneje, saj cepivo zaščiti pred sevi HPV, s katerimi se oseba še ni okužila, so še poudarili na NIJZ.
“,STA,1551702480,1551702480,sl,13844,306,13843,43,0,NULL,,”Mednarodni dan ozaveščanja o HPV tudi kot spodbuda k učinkoviti preventivi”,mednarodni-dan-ozavescanja-o-hpv-tudi-kot-spodbuda-k-ucinkoviti-preventivi,Post,,1,0,1551961758,1551961758
542,13846,”V tednu boja proti raku pozivi k upoštevanju priporočil kodeksa proti raku”,”V slovenskem tednu boja proti raku strokovnjaki pozivajo k upoštevanju priporočil Evropskega kodeksa proti raku”,”
Ljubljana, 04. marca (STA) – V slovenskem tednu boja proti raku strokovnjaki pozivajo k upoštevanju priporočil Evropskega kodeksa proti raku in udeleževanju presejalnih programov. V Sloveniji na leto zboli okoli 14.000 oseb, umre pa jih okoli 6000. Najpogostejši raki pri nas so rak kože, prostate, debelega črevesa, pljuč in dojke. S staranjem družbe se tveganje za raka veča.
“V Zvezi slovenskih društev za boj proti raku si prizadevamo za družbo, v kateri ne bi nihče zbolel ali umrl za rakom”, je na novinarski konferenci Onkološkega inštituta Ljubljana in zveze izpostavila njena predsednica Maja Primic Žakelj. Za uspešno zmanjševanje bremena raka je po njenih besedah treba upoštevati prav vsa priporočila Evropskega kodeksa proti raku, ne samo tista, ki opozarjajo na zdrav življenjski slog.
V zadnjih letih za rakom v Sloveniji na leto zboli več kot 14.000 oseb, okoli 8000 moških in 6000 žensk, kažejo podatki registra raka. Zaradi raka jih umre več kot 6000. Med nami živi več kot 100.000 ljudi, ki so kadarkoli zboleli zaradi ene od rakavih bolezni. Od rojenih leta 2015 bosta do svojega 75. leta za rakom predvidoma zbolela eden od dveh moških in ena od treh žensk.
Grožnja raka se povečuje s podaljševanjem življenjske dobe. “V naslednjih desetletjih lahko zato pričakujemo vedno večje breme raka, tudi če se raven dejavnikov tveganja čisto nič ne spremeni,” je opozorila Primic Žakljeva. Zato je pomembno, da sami naredimo čim več za naše zdravje, saj bi po nekaterih ocenah z upoštevanjem priporočil ogroženost z rakom zmanjšali tudi do 50 odstotkov.
Prav tako se velja udeleževati presejalnih programov, saj lahko zbolimo tudi, če nimamo nobenega dejavnika tveganja. Tudi izidi zdravljenja so boljši, če bolezen odkrijemo čim prej. Po navedbah koordinatorja državnega programa za obvladovanje raka 2017-2022 Branka Zakotnika je bila umrljivost tistih, ki so udeležili presejalnih programov Dora, Zora in Svit kar štirikrat nižja kot pri tistih, ki se programov kljub povabilu niso udeležili. “Ti podatki jasno kažejo pomen udeležbe v programih, tako za znižanje obolevnosti, predvsem pa znižanje umrljivosti,” je poudaril Zakotnik.
Po podatkih registra raka v Sloveniji pozdravimo okoli 60 odstotkov bolnikov z rakom. Cilj državnega programa je, kot je pojasnil Zakotnik, tem ljudem omogočiti kolikor se le da normalno vrnitev v družbo. “Cilj ne more biti samo preživetje, ampak tudi kakovost življenja,” je dejal. Ob tem je opozoril na slabo razvitost paliativne oskrbe, ki jo je po njegovih besedah v vse bolj starajoči družbi treba detabuizirati.
“Breme raka je za vsako razvito družbo izjemno velik izziv in problem,” je poudaril tudi strokovni direktor onkološkega inštituta Viljem Kovač. Ob tem je v boju proti raku izpostavil pomembnost zgodnje diagnostike, dostopnost zdravstvenih storitev, novih tehnik zdravljenja in celosten pristop zdravljenja bolnikov.
Letošnji 36. slovenski teden boja proti raku, ki se je začel danes, poteka pod geslom Evropski kodeks = manj raka. Dijakinja srednje turistične šole Maša Sedej, ki je ena od 50 mladih ambasadorjev v okviru projekta Priporočila proti raku naj ne obvisijo v zraku, svojim vrstnikom, prijateljem, znancem in družini s pomočjo družbenih omrežij, predstavitev in deljenjem brošur skuša približati pomembnost upoštevanji priporočil. “Pomembno se mi zdi, da tudi mladi ozaveščamo starejše, predvsem tiste, ki menijo, da se jim to ne more zgoditi,” je še opisala svoje delo.
“,STA,1551702600,1551702600,sl,13846,306,13845,43,0,NULL,,”V tednu boja proti raku pozivi k upoštevanju priporočil kodeksa proti raku”,v-tednu-boja-proti-raku-pozivi-k-upostevanju-priporocil-kodeksa-proti-raku,Post,,1,0,1551961890,1551961890
543,13848,”Londonski bolnik drugi primer remisije po okužbi s hivom”,”Pri bolniku, ki je bil okužen z virusom hiv, po presaditvi matičnih celic ne zaznavajo več prisotnosti tega virusa”,”
London, 05. marca (STA) – Pri bolniku, ki je bil okužen z virusom hiv, po presaditvi matičnih celic ne zaznavajo več prisotnosti tega virusa, so sporočili zdravniki v znanstveni reviji Nature. Gre za drugi tovrsten primer. Londonski bolnik, kot ga označujejo zdravniki, je že 18 mesecev v remisiji, vendar je še prezgodaj reči, da je ozdravljen, so poudarili.
Bolniku so po poročanju tujih tiskovnih agencij presadili krvotvorne matične celice, ker ima eno od oblik raka limfnih žlez. Darovalec matičnih celic ima sicer zelo redko gensko mutacijo, zaradi katere je imun na določene oblike virusa hiv. To je koristilo tudi bolniku, ki je prejel matične celice. 16 mesecev po presaditvi je opustil zdravila, ki zavirajo širjenje virusa, več kot poldrugo leto zatem pa pri njem še niso zaznali virusa hiv.
Podobna metoda zdravljenja se je prvič izkazala za uspešno leta 2007 v Berlinu. Američan Timothy Brown, ki so mu zaradi levkemije presadili kostni mozeg, po tveganem posegu ni bil več okužen z virusom hiv. Tudi pri njem je imel darovalec gensko mutacijo, zaradi katere je imun na določene oblike virusa hiv.
“Z remisijo pri drugem bolniku po uporabi podobnega pristopa smo dokazali, da primer bolnika iz Berlina ni bil anomalija,” je poudaril eden od avtorjev članka v reviji Nature, profesor na univerzi v Cambridgeu Ravindra Gupta.
Ob tem so Gupta in njegovi kolegi opozorili, da presaditev kostnega mozga, ki je tvegana in boleča, ne more biti splošno razširjena oblika zdravljenja okuženih s hivom. Bodo pa lahko znanstveniki po dveh tovrstnih uspešnih primerih zožili nabor primernih strategij zdravljenja.
“Drugi primer krepi prepričanje, da je zdravljenje možno,” je za francosko tiskovno agencijo AFP dejala Sharon R Lewin, direktorica instituta za infekcije in imunologijo Peter Doherty na univerzi v Melbournu. “Lahko skušamo ugotoviti, kateri del transplantata je igral pomembno vlogo in po zaslugi katerega je bolnik lahko prenehal jemati antiretrovirusna zdravila,” je dodala.
Več milijonov bolnikov po svetu, okuženih z virusom hiv, bolezen nadzoruje z antiretrovirusno terapijo. Ta jim omogoča, da kljub okužbi normalno nadaljujejo življenje, a virus je pri njih še vedno prisoten.
Po svetu je okoli 37 milijonov okuženih z virusom hiv, med njimi jih antiretrovirusno terapijo prejema okoli 59 odstotkov. Vsako leto zaradi zapletov, povezanih z okužbo s hivom, po podatkih AFP umre skoraj milijon ljudi.
“,STA,1551789120,1551789120,sl,13848,306,13847,43,0,NULL,,”Londonski bolnik drugi primer remisije po okužbi s hivom”,londonski-bolnik-drugi-primer-remisije-po-okuzbi-s-hivom,Post,,1,0,1551961967,1551961968
544,13850,”Ameriški senat skuša prepričati Američane v cepljenje otrok”,”Odbor za zdravstvo, izobraževanje, delo in pokojnine ameriškega senata nadaljuje z javnimi zaslišanji glede krize javnega zdravja v delih ZDA”,”
Washington, 06. marca (STA) – Odbor za zdravstvo, izobraževanje, delo in pokojnine ameriškega senata nadaljuje z javnimi zaslišanji glede krize javnega zdravja v delih ZDA, ki jo povzročajo starši, ki zavračajo cepljenje svojih otrok. V torek je pričal najstnik iz Ohia, čigar mati bolj zaupa teorijam zarote kot znanosti in medicini.
Ethan Lindenberger je povedal, da ga mama ni dala cepiti, ker je prepričana, da gre pri tej zadevi za zaroto vlade skupaj s farmacevtsko industrijo. Poleg tega naj bi bilo cepljenje nevarno, ker pri otrocih povzroča avtizem.
To teorijo zarote je v preteklosti pomagal širiti tudi predsednik ZDA Donald Trump, ki v nasprotnikih cepljenja vidi pomemben del svoje volilne baze.
Najstnik iz Ohia je senatorjem povedal, da je mami kazal znanstvene študije in dejstva, vendar ni pomagalo. Nato je ugotovil, da ga v šoli obravnavajo kot grožnjo javnemu zdravju, in se je po dopolnjenem 18. letu starosti sam podal na cepljenja, ki mu jih mama ni dovolila. Lindenberger je Američanom sporočil, naj se skušajo naučiti ločiti zrnje od plevela oziroma znanstvena dejstva od neumnosti.
Republikanski senator iz Kentuckyja Rand Paul, ki je bil pred prestopom v politiko očesni zdravnik, je poleg Trumpa eden najbolj znanih zagovornikov svobodne volje staršev, kar zadeva cepljenje, in kljub končanemu študiju medicine trdi, da so cepiva nevarna.
Njegov nastop so kritizirali kolegi obeh strank, demokrati pa so ob tem opozorili, da je Trump še nevarnejši, ker je predsednik. “Na srečo njegov minister za zdravje ne deli podobno butastih stališč, Trump pa je zaradi drugih težav morda že pozabil idiotizme, ki jih je izrekel okrog cepljenj,” je dejal demokratski senator iz Connecticuta Chris Murphy.
V ZDA zadnje čase med otroki beležijo izbruhe okužb z ošpicami. Samo letos so jih v 11 državah našteli 200. V ZDA so smrtni primeri redki, je pa v svetu zaradi ošpic v letu 2017 umrlo 110.000 ljudi. Pogosti so tudi zapleti, kot sta pljučnica ali meningoencefalitis.
V ZDA okoli 90 odstotkov ljudi živi na območjih, kjer otroke cepijo, a 17 zveznih držav ima zakone, ki staršem dovoljujejo zavrnitev cepljenja otrok iz zasebnih, moralnih ali kakšnih drugih prepričanj.
Ameriška akademija za pediatrijo je v ponedeljek pozvala vodstva tehnoloških velikanov, kot so Facebook, Google, Pintrest in drugih, naj se učinkoviteje zoperstavijo kampanji dezinformacij okrog cepljenja.
“,STA,1551875580,1551875580,sl,13850,306,13849,43,0,NULL,,”Ameriški senat skuša prepričati Američane v cepljenje otrok”,ameriski-senat-skusa-prepricati-americane-v-cepljenje-otrok,Post,,1,0,1551962056,1551962057
549,13838,”Better educated physician, better educated patient, better outcome”,”We are not only suppliers of medicines, we supply solutions”,”

Piotr Czerkies is a likeable Pole who took on the position of Director of the medical department at the Slovenian office of the innovative pharmaceutical company Novartis. When he started working in pharmaceutics he was sure it was a temporary engagement, but when he saw the influence and impact his work could have on people’s lives, he no longer wanted to leave. He was part of the revolution in organ transplantation that was brought about by effective immunosuppressive medications and when he speaks his wit and sense of humor are outshined only by his unfaltering dedication to his work.
I told you this would not be a simple conversation. And here we are – I am already having trouble answering your first question. Before I joined the pharmaceutical company I was a rather successful researcher and university professor, so I can still claim some expertise in certain areas of fish biology. Over the past two decades I became a true pharmaceutical industry insider, gaining experience in a number of areas ranging from marketing and sales to physician training and clinical trials. Based on my local and regional experience I became an expert in transferring the outcomes of clinical trials into clinical practice in different therapeutic areas, including cardiology, immunology and organ transplantation.
To be honest this was not exactly planned. As a university professor in a time of social change I had trouble finding a balance between my work and my personal life. Deciding on making more time for family and finding greater financial security I transferred into pharmacy with the thought of it being a temporary solution. When I found out just how great an influence my work could have on people’s lives, I decided to pursue education and acquire knowledge and experience to be able to take on a position in the medical department. It was tough, but my dedication and passion did not go unnoticed at Novartis and they provided plenty of support in my efforts.
For me the feeling is, beside my family, my greatest source of energy and persistence. I am lucky to be able to work in one of the most innovative companies in the world that develops effective solutions for many medical needs and diseases. For example – I witnessed the dynamic evolution of organ transplantation that was enabled by effective suppressors of immune response. In fact I was more than a witness, I was part of the revolution as I helped raise awareness which directly contributed to increases in organ donation. Now we are bringing Slovenian patients a new treatment for heart disease that significantly reduces mortality and improves the quality of life. Our cooperation with the local medical community, based on education and not bound to any single medication, directly improves the level of care and management of patients. The fact that my work has a direct influence on improving the life of another person is a source of great pleasure and pride for me. On the other hand I also feel responsible for those patients that are still waiting for their opportunity and this gives me the strength to become an ambassador of their needs.
You mean, beside a fireman, policeman, astronaut, race car driver, fighter pilot and rock star? The answer is – a surgeon. In primary school I had a nasty accident that resulted in me being bedridden for five long months. When I was brought to the ER doctors even considered amputating my leg, but a young and dedicated surgeon decided to try and save it. I will be eternally grateful to him for the fact that I can walk, run and even (badly, but enthusiastically) dance. The experience had a profound influence on my life because I read just about every book in the local library during my bed rest and decided to do something meaningful with my life.
In spite of everything I then chose biology to help protect the environment for future generations. But my inner “surgeon” was still hiding somewhere in the background and biding his time. The moment came when I was talking to Professor Zbigniew Religa, cardiac surgeon that performed the first successful heart transplant in Poland. This legendary man helped me realize how important an influence on the lives of people my work in the pharmaceutical industry could have.
Not really, except perhaps for the saying »Warto być przyzwoitym« (It is worthy to be decent) by Polish historian and resistance member from the 2nd World War Władysław Bartoszewski. In my personal life I am motivated by the happiness of my family, but in my work the patient is the focus. As long as there patients that I can help with my work, I will not lack motivation. I also love collaborating with people, communicating and interacting. I really like working in a team. In this sense I am very happy in Slovenia because I have the opportunity to work with truly wonderful people.
There are quite a few myths regarding the pharmaceutical industry. Let’s be honest – it is not the most popular business in the world. But big pharma does not just mean big incomes. In fact it is much more about big efforts in developing medicines. We come into an environment with plenty of knowledge and will to cooperate in finding solutions for existing medical needs. We are not only suppliers of medicines, we supply solutions Our experience and knowledge can help the healthcare system improve its efficiency and optimize the distribution of resources. But in order for us to achieve this, society must see us as a serious partner and not as a medicine salesman interested only in profit.
I would rather say I am a reserved optimist. In general terms medicine has advanced greatly over the past decades. We have a much better understanding of the human body and our new medicines are more specific, more targeted and more effective. The past two years have been exceptional for our company as we brought the first gene therapy in ophthalmology to market, as well as the first oncology therapy using the patient’s own gene modified immunity cells. We can also see many positive changes in health and healthy living awareness while reduced risk factors and advances in patient care are bringing extended life expectancy. There is also the increased presence of technology and telecommunications companies in healthcare, the onset of new devices and applications for monitoring personal activity and life functions and telehealth services are on the rise too. But at the same time we are also facing new challenges, such as a long-living society, environmental issues and increasing social pressure of health costs and we will need to address all of them systematically.
What we are researching at a basic level today will be accessible in twenty years. What we have already discovered and are currently testing will be available in ten years. We can expect that treatments will be better adapted to the needs of the individual, allowing for more accurate interventions that consider the clinical status and genome of the patient. The telehealth revolution will transform patient management and enable permanent supervision, remote health consultations and faster responses.
Our education programs already include certain elements that prepare healthcare professionals for the coming systemic changes in patient management and improve patient awareness so that they will be better prepared to participate in the process. We can expect better results when a better educated patient meets with a better educated physician. This is what I am working on.
“,Admin,1552380420,1552380420,en,13838,306,13834,43,0,NULL,,”Piotr Czerkies”,piotr-czerkies,Post,/sites/43/files/images/Fokus/Human.jpg,1,0,1551880402,1552400179
550,13832,”Our people”,”Our people”,”
“,Admin,1552380900,1552380900,en,13832,306,13831,43,0,NULL,,Intervijuji,intervijuji,Post,,1,0,1551878225,1552400078
551,13837,”Innovative medicines and new approaches push new limits in the treatment of rare diseases”,”Our great hopes for the future are genetics and targeted treatments”,”

Talkative Dr. Anja Silič, mag. farm., heads the field of rare diseases for the Adriatic region at Pfizer’s Ljubljana office. She loves traveling to far away countries even though she spends much of her time traveling for work. She is usually found somewhere in the Balkans, her exact location depending on the current problems that need to be solved so that patients can receive the medicine they need in due time. Her free time is tight and she often jokes that she trains short course running in airports. The work she performs is perfect for her because she communicates very well and has no problems with cultural differences.
I manage marketing and sales of medicines for rare diseases in the Adriatic region, consisting of ex Yugoslavia and Albania. Our role is to assure that patients with rare diseases in these markets have access to our medicines. We strive to offer medicines available in the European Union to patients throughout the Adriatic region even though the conditions of medicinal product supply in other countries are much worse than in Slovenia, which can cause substantial differences in patient survival. A key element of our work is also the education of patients and physicians. We can only think about rare diseases if we know something about them. In order to discover them, physicians must be aware of the diseases and know there is a cure available. This makes diagnosing rare diseases much easier. Physicians must also know how to talk to the patient and what to ask to get the information they need. That is why we cooperate closely with doctors, as well as associations of patients with rare diseases which are very active. Especially in Croatia and Serbia their role in medicinal product supply is essential. Together with our partners we draft informational materials on diseases. Our main therapeutic areas are endocrinology and metabolic diseases (such as low growth hormone, acromegaly, Gaucher’s disease), haematology (hemophilia A and B), amiloidosis and transplantations. Our role is to present medicinal products for these areas with all of their benefits and weaknesses. Pharmacy is much more than just selling medicines, in fact most of what we do is informing and education.
I have been with Pfizer for 21 years. This is my first job. I finished the Faculty of Pharmacy and came to the company because my diploma thesis researched the pharmacokinetics of a Pfizer medicine. The Slovenian office just opened and needed pharmacists. In the beginning we had five medicines and a small team. Now the medicines market is much bigger and so is the competition. As an expert associate I initially covered antiinflamatory medicines and then worked in a number of sales and marketing roles (cardiology, diabetes, pain) and assisted in the registration and classification of medicines. With the last reorganisation five years ago I took on the field of rare diseases which is exactly my expertise as I also completed a Ph.D. in biomedicine during my work.
I definitely feel we are working for a better and higher quality treatment of patients which directly improves their quality of life and extends life expectancy. Usually it is not a single medicine that saves a patient but rather a combination of several medicines. I am satisfied when we successfully achieve the placement of rare diseases among the priorities that are considered. I am also happy when patients get treatment when they need it, when a child grows to their proper height with the help of growth hormone and when patients feel good and live quality lives in spite of their severe diseases.
My professional aspirations changed from decade to decade. As a little girl I loved braiding hair and wanted to be a hairdresser. But I always said I wanted to be a doctor. Well, in secondary school I was drawn to chemistry, medicines, experiments, accuracy. When I was deciding between medicine and pharmacy, I chose the latter. Everyone was worried that I would not be able to get a job as a pharmacist because at the time Slovenia did not have as many offices of international pharma companies and pharmacists could for the most part only find jobs in pharmacies. Then the Pfizer office opened and I was able to get a job here. I really like the scientific aspect of my work, so the fact that we are not just selling medicines but also discovering new treatment options.
My main motivation for work are satisfied patients, good medicines and innovations. New therapies are coming, we are investing a lot into development and the era of gene therapy is beginning. We are no longer talking just about treatment options, but also the potential for a full cure. These scientific breakthroughs give me strength because the diseases our department covers are very serious. If they are not diagnosed in time, they usually end badly. That is why our work is important. We raise awareness among physicians and patients and empower them to recognize signs of disease and consult a doctor or diagnose the condition as soon as possible.
I am also motivated by work in an international environment and transfer of good practices among countries. Sometimes our work actually moves borders, for example when we help a certain country access a certain medicine. It is a great pleasure to be able to contribute to patient care. Physicians are also thankful for our efforts and the gratitude is greater the further south you go.
In my personal life I wish for a better balance between work and free time because I really am on the road a lot. I do like to go to theater or the opera and charge my batteries through culture. As far as working out is concerned, I practice short sprints in airports because flights often get delayed (laughs). Mountaineering is another hobby of mine, skiing in winter and sailing in summer, but traveling remains my greatest passion. I visit more remote places at least once per year, I love Africa. It is a whole different world. The eyes see very far in steppes and savannas and one profoundly feels just how small we really are. My last trip was to Kirgizia and next year I am going to Korea. For my travels I usually choose destinations without cell phone coverage because there is usually always somebody that needs me. Traveling for work is a different thing altogether. Sights are usually limited to hotels and meeting halls and there is always cell reception (laughs). But I do try and take half an hour for a walk as well, and I usually sleep more during business trips than I do at home (laughs).
I wish people knew that pharmacists and physicians are partners and that we both work for a single objective – the patient. That is why we share useful information, news, discuss projects. That is also how we get good ideas. Contacts with other countries allow us to exchange positive experiences and best practices. Education at congresses is also important because that is where global new developments are presented that we can then introduce at home. It is wrong to say that we only work for numbers and sales. The financial side is part of every business. After all, medicine too needs to keep an eye on costs and balances. Losses benefit no one. But that is only one side of our story. The other side of our work, especially in the field of rare diseases, is the discovery and raising awareness in the public about diseases and new methods of treatment.
In the next few years gene treatment is set to make a breakthrough in the treatment of rare diseases. This will be a whole new approach to treatment where we will be able to repair the gene that causes the disease. Diseases will be cured and not only treated. Such solutions may still be quite a way off, but not that far into the future as clinical trials for certain diseases are already in their finishing phase.
It is hard to say, I am not Nostradamus, but I do hope we will be healthier and more able to cooperate, be more tolerant. Communication is the main problem of our society. Sometimes we put individual goals ahead of the goals that would benefit the entire society. I wish the state would assure appropriate treatment and find the funds for new treatments so that we can offer them in Slovenia and around the world. More and more work is being done in individualizing treatments and our main hopes for the future are genetics and targeted treatment which is already present in oncology. Of course, it takes plenty of small steps to make a bigger one.
“,Admin,1552382100,1552382100,en,13837,306,13833,43,0,NULL,,”Anja Silič”,anja-silic,Post,/sites/43/files/images/Fokus/Human.jpg,1,0,1551878854,1552383003
552,13839,”From playing with test tubes to leading markets”,”The body must support the spirit because we cannot give to society and others unless we are healthy”,”

A veterinarian by profession, Ljiljana’s career took an unexpected turn after graduation into the pharmaceutical industry, where Ljiljana Žunjanin developed into a manager capable of leading markets in several countries at once. Her appearance is youthful, accessible and calm and she acts with maturity and confidence, both attributable to the fact that she has gained all the necessary experience through hard work and he unyielding thirst for knowledge and development. Ljiljana is dedicated to her family, but her work is never far behind and never out of the picture. Her job tile is Regional Manager at Astellas Pharma, marketing and distribution of pharmaceutical products. The company is part of the global pharmaceutical company with headquarters in Tokyo, Japan.
I am the Country Manager for the Adriatic section of the Adriatic-Baltic region. My territory includes Slovenia, Croatia and Bosnia and Herzegovina. Our headquarters are in Ljubljana. The Croatian office employs nine and the Bosnian office a further two employees. My job is to manage and lead employees in all three countries, a total of 23 people. We cover marketing and sales, ranging from representatives in the field to project managers and managers of representatives. We represent medicines for different therapeutic areas while medicinal product development takes place at a global level. The therapeutic areas we cover are oncology, urology, transplantations and anti infection. As a manager in a multinational corporation I also need to understand finances.
I graduated at the Faculty of Veterinary Medicine so I am a veterinary doctor, but I never worked as one. After graduating I could not get a job, so I found my way in the pharmaceutical industry, which later proved to be a very good decision that I have never regretted. People often ask me if I am sorry that I never worked as a veterinarian, or how come a veterinarian works in pharmacy. The fields are not so different. My education was very helpful in my work in pharmacy. When we talk about a medicine it is important to understand its effects on the organism, indications, side effects. Pharmacokinetics, pharmacodinamics and distribution of the medicine in organs take place in much the same way in human and animal organisms. Plenty of research also takes place on animals before it reaches clinical testing on humans. Knowledge of the organism as such is very helpful in communication with physicians and it is what I learned at the faculty. I did have to learn the financial side of my job, there was none of that in my graduate program. Furtunately I had good colleagues and healthy common sense so that I could learn to draft and interpret financial documents independently.
I begun my career as a sales representative in the field with Servier Pharma. I visited doctors and presented medicines, this was 15 years ago. I also worked as a product manager at that company. At Abbott I worked as the head of marketing, head of business unit and national lead and than later at Mylan as leader for several countries; Czech Republic, Slovakia, Albania, Kosovo and Slovenia. There was a lot of traveling involved at the time and it was very much incompatible with a private life – I lived on airplanes. This was one of the reasons why I joined Astellas Pharma where I have been working for the fourth year now. My work here is more centralized. I still travel, but much less than before. I am proud that I advanced gradually in my career and conquered each position step by step. This gave me time to develop and get to know each of the functions that I am now responsible for. I have also developed as a person through my work in pharmacy. It was tough in the beginning, but my work enabled me to develop new competences, such as communication skills, ability to decide quickly, a sense for organization and building relationships with clients and colleagues. All of this helped me advance in my career and also proved very helpful in life in general.
I always worked in companies in which the patient came first. Even internally, when we discussed things, we always focused on the patient. Patients are also my greatest motivation. The better I can present the benefits of a medicine, the greater the benefit will be for the patient because I can do my part in making sure patients receive the medicine they need. If the medicine improves the course of a disease and extends life, I am always happy. In this way I see myself sharing responsibility for the patient’s health. Of course it is the physician that decides which treatment the patient receives.
As a child I always spent all of my pocket money for test tubes, petri dishes, funnels. I was always interested in science. I wanted to be a scientist. I thought I would be working in a lab, discovering new molecules and potentially discovering a new medicine. All my savings were put towards small laboratory equipment. At home I had a play area which was my laboratory and that is where I did my small science experiments and observed insects and plants under a microscope. I borrowed many books on the subject from the library and my parents kept supporting me. That is also why I decided to go to the Bežigrad secondary school which focused on natural sciences, and then on to the veterinary faculty. I never wanted to become a doctor. Veterinary medicine was my first choice because I loved animals. We had pets at home and as kids we would pick up stray cats from the street while we played. Now I do not have any animals, they take time and my working day pretty much never ends. I am just the type of person that never stops. I keep thinking what else I could do, what I could do better and I am highly motivated.
Personally my greatest motivation is my son and my personal motto is “never give up”. Daily life sometimes sets us traps and we get sucked in by trouble, but sometimes we need to find a way out of the drama and simply keep pushing forward. This applies to all areas of life, including food, sports, aging. The body must always support the spirit because you cannot give anything to society and the people you love unless you are healthy. For me it is all connected, everything must be balanced, so I do a lot of sports. Lots of running helps me detoxify mentally and in winter I visit a gym and always make sure I am in motion. I am the type of person that chooses stairs over elevators and I like doing things on foot and with my hands. At work I always had to first of all believe what I was representing. I was always driven by the potential of a patient receiving the best possible treatment for their disease. This is our mission and the main motivator for me to keep doing what I do. The pharmaceutical industry always allowed me to express my talents and dormant potentials. It also gave me enough time to develop them. I always liked working with people and my work allows me to do just that. Another major motivator for me is my team. I like working in places where I can leave a mark on people. This gives a person satisfaction in the knowledge that they did something good.
As a young woman I was not communicative. I was shy and always tried to blend in with the background. That is why I deliberately chose this industry because I had a vision of learning what I lacked through work. I am often thankful to pharmacy for teaching me just that. Pharmaceutical companies provide plenty of opportunities for education which I gladly took, but certain competences I learned just from practice. I can see that I am more confident in certain situations than I used to be and can deal with things much easier. People who I have known since I was young often tell me that I changed a lot and now communicate and present myself much better and more confidently.
It is a major misconception that we do nothing for society, that we are very unethical. In fact this is a major topic in the pharmaceutical industry. We have very strict self-control, are very critical to ourselves and among ourselves and strive for the highest ethical standards. It is also wrong to say that we see everything through numbers. Of course we are not a social establishment, but we spend the vast majority of our time talking about patients, not profits. We also educate ourselves so that our motivation arises from patients and the treatment of their illnesses and quality of their life remain our primary objective. For me personally it is very important that I sell good medicines that will save lives. Pharmacy does a lot of good. Nowadays people can live quality lives with certain chronic diseases such as hypertension or AIDS, which was simply not possible some years ago. Of course I firmly support the position that we can do the most for our health ourselves, by preventive action and a healthy lifestyle.
Yes, I am optimistic. Development is heading towards prevention of certain diseases. Genetic medicine is developing fast as well, which will determine the tendency towards certain diseases which can then develop or not. A part of medicine will of course remain focused on curing diseases, but it will need to redefine old age. If a women at forty was once considered mature or even old, the limit will shift up considerably due to prevention.
I believe that in the future medicine will focus on the quality of life of patients during the treatment process. Remote treatment in a patient friendly (home) environment filled with positive feelings is certainly a challenge for new approaches. We should not forget information technology which empowers patients with knowledge, devices and accessories and places them in an active role in the treatment process. The use of artificial intelligence in treatment processes will most likely be the new norm for our children.
Things in healthcare are moving from the secondary to the primary level. There will be less specialist treatment and hospitalisations and more work on prevention and day clinics. To state an example: chemotherapy used to require patients stay in hospitals. Now they come into a day clinic, receive their intravenous dose of chemoterapy medicine and go home. Patients will become increasingly scientifically educated, informed and confident. They will take active control of their health and treatment and will become justifiably more demanding and better informed users of pharmaceutical and other scientific products.
In the future pharmacy will need to confidently, proudly and sincerely raise awareness and prove that our goal is improved public health again and again. We need to talk more about this and the mentality of people working in the industry, because we truly and sincerely strive towards our goal of healthier and more satisfied people. It may sound like a cliché, but I do not think we emphasize this enough.
“,Admin,1552382340,1552382340,en,13839,306,13835,43,0,NULL,,”Ljiljana Zunjanin”,ljiljana-zunjanin,Post,/sites/43/files/images/Fokus/Human.jpg,1,0,1551880696,1552460196
553,13840,”When a patient’s story has a happy end, it is all worth it”,”The pharmaceutical industry has changed the course of human life”,”

Natural scientist at heart, personable, all smiles and full of life. It is immediately apparent that she has found her mission, that she believes in her work and does it with her heart and soul. She spends many of her working hours in an office with a view of the mountains and a large photo of a sailboat on the wall. It reminds her of the sea and waves, she says, a place where she likes to find her peace in her free time. She loves staying in touch with nature, so a massive green plant keeps her company in the office. She is interested in new developments, cutting edge technology, progress and research. When she speaks of her work her eyes light up. If you do what makes you happy in life, great things can happen, says Mojca. In her work she is always focuses on the person, the patient, whose quality of life or even survival depends on the work of dedicated people in healthcare and the pharmaceutical industry. People like Mojca Šelih, Technical Head of the Medical Regulation Department At Roche. The company is the Slovenian office of the Roche global pharmaceutical group. Roche is headquartered in Basel, Switzerland, was established by Fritz Hoffmann La Roche in October of 1896.
Our department cares for registration of our medicines, equipping medicines, appropriate storage and release of medicines into the market. We also continuously monitor the safety of our medicines when they are already on the market. Our department is also responsible for medical information about our medicines, professional education for healthcare workers and performance of clinical trials. The department includes responsible personsons for quality in four good practices areas. We are a relatively small team, the company has just over 40 employees with 13 in my department.
I have been working for Roche since 2001, 17 years. I started my career as a technical adviser but soon transferred to the medical side of things, to working in clinical trials. Clinical trials always intrigued me because that is the part of our work where we come closest to the patient. Later I focused on quality assurance in clinical trials and education. I also worked at our company headquarters in Basel for a year. While there I took on the position of regional head of clinical operations. As part of the function we worked towards creating conditions in separate countries that would allow clinical trials to be carried out in more countries. After returning to Slovenia I soon took over managing the medical team, later the medical department and now the medical-regulatory department. Many changes happened over the last year.
Yes, I do have that feeling. We become involved in it quite soon during the clinical trials phase where we monitor medicinal products since the very beginning. A lot of hard work is going into bringing trials to Slovenia and allowing our patients access to the newest medicines. Inclusion of each patient into a clinical trial means a lot to us because we know that that means access to the best clinical potential for treatment. Many of our medicines are intended for the treatment of cancer and other life threatening or debilitating diseases. In our work diseases that we do not normally like to think about are a daily occurrence, so we can appreciate health that much more.
When you see patients in a study or in clinical practice doing well, it is a very special feeling. You feel fulfilled. This is why we come to work each day. A great many aspects of our work are regulated and we need to document each step in writing. There is plenty of red tape to go through, but when a story has a happy end, everything we do is worth it. Today our hallway is buzzing – we are celebrating because we managed to provide a patient with a difficult case of a rare illness with medicines from abroad in just 24 hours. The entire company stepped up on our day off and found a way to get the medicine to the hospital for the patient in just 24 hours for rapid relief.
I wanted to be chemist. In primary school I had a very good chemistry teacher and she made me love the subject very much. Quite a few of us from the class happily went to additional chemistry lessons. When the subject matter became more complicated during regular lessons, I was the only one to stay with the teacher for additional lessons. We sped up the pace a bit and really got into chemistry. Instead of a general secondary school I decided to go to the Upper Secondary School of Chemistry as I was certain I would continue on the same path to university. In secondary school we got to know many different areas of chemistry, but the program was very much bound to production and I did not find chemistry for chemistry’s sake as useful and important as when it was applied to people. I sought more links to humans, to treatment, so that the knowledge would have a wider importance. I changed my mind before selecting a faculty and enrolled to the Faculty of Pharmacy.
Pharmacy is a multidisciplinary science that gives you plenty of wide knowledge and many opportunities to focus on different areas of work ranging from work in pharmacies to clinical pharmacy, manufacturing, research. I did my thesis in biotechnology. Research work for my thesis was very interesting but relatively far away from patients. I still wanted my work to be closer to patients. That is why I decided to focus on the end of the medicinal product production chain, to closing clinical trials and introduction into clinical practice. My interest in innovations brought me to an innovative company. At the time we learned about biological medicines as part of my biotechnology course only from books. Roche was the company that introduced the first biological medicines into clinical practice for the treatment of solid and hematological tumors (note: solid tumors include, for example, breast cancer, while hematological include lymphomas), which changed the course of the disease for these patients and continue to be an important treatment milestone. These medicines were the pinnacle of biotechnology at the time, they were what we were learning about at the faculty from books. Although I was not part of the development of these medicines since the beginning, I did become part of their developmental journey later. When you see how these medicines truly changed practice, you are very proud of your work.
I am a natural scientist at heart and I love science. I believe in evidence based medicine. I believe science is what drives progress. Both privately and in my work I am enthusiastic about new developments, new technologies and resourcefulness of individuals. I also believe that it is important to do what makes you happy in life and remain faithful to oneself. If you work like that, you can be successful and great things happen. Work is an important part of our life, but it is also important that we know how to make time for good moments, to be kind to each other, help each other and truly live life. This means to have interests, our private lives and hobbies and to keep a healthy balance between the business and private life. It is nice to be motivated by things at work to such an extent that they transcend mere work, that they become a subject of your off-work discussions and grow as an organic part of you. Privately I love the sea, I love to sail.Sailing is not just a hobby, it’s a way of life.
I wish people knew more about what the pharmaceutical industry is doing. I guess the most common misconception is that our work is only about profit. We are working in one of the most regulated fields of work, each step in development, manufacturing and testing is legislated and pursued in accordance with best practices. Everything is done under the watchful eye of outside institutions that constantly verify and audit our work. Medicines that come to market under such conditions are tested in accordance with strict ethical standards and proven to be effective with a favorable ratio of risk and safety. Yes, medicines of course also create profits, just like every other industry. But I am proud that our industry is at the very top in terms of investing profits back into development of new medicines. The field of medicine requires very high investments due to all the requirements and standards and they do not end when the medicine makes it to market. Investments continue throughout the entire life cycle of the medicine. Unlike other industries, we are also bound by ethical standards. Our industry has changed the course of human life – our great grandfathers died sooner because they did not have access to the medicines we now have. Today life expectancy is longer because of advances in healthcare and medicines at our disposal.
I am optimistic. The progress of science and technology is amazing. We will have more technologies available that will influence the way we live. I believe we will see the greatest changes in healthcare and ecology. New technologies are already breaking new ground in healthcare. Genetic profiling of tumor already allows us to recommend treatment based on the characteristics of each tumor, so this type of treatment is already highly individualised. Medical knowledge is growing exponentially and the next challenge will be to manage and follow this knowledge. We will need new technologies that will be able to bring this amassed knowledge into an algorithm that will enable us to manage it effectively. Some new technologies already can do that. But it will always be a question just who and how can access these technologies. Another challenge is the connectivity of these systems. We have plenty of information available in electronic form, but we are not yet good about linking it together.
The future will be very focused on technology. Healthcare will advance exponentially with new technologies, as will access to healthcare. A single click will bring us to our physician, pharmacist and nurse without ever needing to go to a clinic. We are already wearing different types of measuring devices and in the future applications measuring our health parameters will link directly to a physician that will use them to supervise our condition. They may be able to see the heart rate of each patient, their exercise regimes and the effects a medicine is having. New technologies will become available in diagnostics and many examination results will be interpreted by artificial intelligence using smart algorithms instead of a physician. A computer has already been taught how to separate melanoma from non-melanoma using a certain algorithm and we are seeing similar breakthroughs in the field of opthalmology. But even 30 years from now technology will never replace a human being. Physicians will simply have more options at their disposal for diagnosing and treating disease. They will have access to examination results and smart algorithms based on clinical research and practice in real time on a computer, allowing them to decide based on knowledge, algorithms and their in-depth analysis of how to optimally treat an illness. All relevant data required to make a decision will be available at the click of a button. This is the future of medicine.
We will also be able to know and address the causes of diseases, not only symptoms. Our medicines will be developed for a certain type of disease in relation to genetic and other characteristics as new technologies enable us to define separate diseases better. We can already do this today and the field is getting ever more detailed. With the help of wide spectrum gene profiling we will be able to determine the type of tumor for each patient. Cancer vaccines will be tailor made for each individual. Medicines will treat the causes of diseases. The future is already in our laboratories.
“,Admin,1552382520,1552382520,en,13840,306,13836,43,0,NULL,,”Mojca Šelih”,mojca-selih,Post,/sites/43/files/images/Fokus/Human.jpg,1,0,1551881310,1552382539
554,13822,”Clinical trials for a safe way towards a healthier future “,”Strict regulation in the field of clinical trials assures access to information, safety and rights of volunteers “,”
Clinical trials are studies in which researchers study the effectiveness and safety of new methods of diagnosing and treating diseases with the help of volunteers. Their importance is tremendous as they allow for the use of state of the art scientific and technological discoveries in the treatment of patients. Most clinical trials take place in the field of medicinal products, but we also know clinical trials in the field of medical devices and new methods of treatment. Trials are used by researchers to establish and verify the safety and effectiveness of new medicines, thereby assuring a safe transfer of medicines into daily clinical practice.
Clinical trials are divided into interventional and non-interventional. The latter are based on researchers’ observations and efforts to assess the state of the patient on the basis of a predetermined protocol. In interventional clinical trials the strategy of treatment, examinations and monitoring of participants differ from established clinical practice. Accordingly, they are divided into several phases. Each phase is aimed at gaining specific information and each new phase builds upon the results of the previous phase.
Safety is the primary concern throughout the research process. In the first phase researchers under strict supervision administer the new medicine to a smaller group of volunteers participating in the study, determine the best method of administering the new medicine, discover the most common and severe side effects and determine the safe dose of a medicinal product. The second phase monitors the efficiency of the medicinal product in order to confirm or disprove its effects. In these two phases a smaller number of volunteers provides quite reliable results. In the third phase the number of patients included in the trial must be increased, provided the medicine has been proven to be safe and effective.
The third phase is aimed at comparing the new medicine with established treatments, researching the influence of the new medicine on different populations, establishing dosing and combinations with other medicinal products. Data gathered by researchers in the third phase shows whether a new medicine can begin to be used to treat patients in daily clinical practice.
Of course researchers continue to monitor medicinal product safety after receiving authorization for use in clinical practice, normally through the aforementioned non-interventional trials where treatment, examinations and monitoring of patients is no different that regular clinical practice.
Generally clinical trials are intended to expand knowledge on a certain disease which helps improve treatment, but also diagnosing, prevention of diseases and conditions, assessment of risk rates for certain diseases, improvements of the quality of life of chronic patients …
The greatest benefit of clinical trials is to allow patients who have exhausted other treatment options access to new possibilities for potentially effective treatment before a new medicine reaches the market. Volunteers participating in such trials also receive a greater number of examinations by a physician and more tests as the progression of the disease and treatment must be monitored more closely. This is another welcome advantage for a patient, but it is also true that more frequent trips to the physician can be burdensome for seriously ill individuals.
Each clinical trial has specific needs and research goals that influence the selection of volunteers. Sometimes researchers require patients with specific diseases while at other times they need healthy persons without symptoms. In every case the trial protocol determines guidelines for volunteers that include criteria such as age, gender, type and stage of the disease, prior treatment and others.
Prior to being included in a trial, each patient must be informed of the purpose, course, procedures and duration of a trial, potential adverse effects, risks and expected benefits and associated rights and obligations inherent in participation, both verbally and in writing. Persons deciding on participation have access to materials on the trial and can pose questions to researchers, particularly in relation to potential risks, until they feel they have sufficient data to decide to participate or reject participation. It is important to note that the decision for or against participation is completely autonomous.
Persons who decide do participate must give their written consent by means of an informed consent form. Naturally volunteers are given all relevant information during the trial as well, on the basis of which they can decide on whether to keep participating in the trial or exit the trial. Participation can be terminated at any time, without stating any reason and without consequences. Persons who reject or terminate participation continue to receive all the necessary medical care and treatment within the scope of regular treatment, same as before their inclusion in a trial.
The use of medicinal products in trials carries a degree of risk since their safety and effectiveness are still being researched. There is also a risk of adverse effects that have not been seen before, as well as a risk that the medicine will not work. It is therefore very important that volunteers receive all necessary information and educate themselves thoroughly.
The performance of clinical trials is a strictly regulated area due to the necessity for assuring patient safety and rights. In Slovenia clinical trials must be performed in accordance with a protocol that accurately states the objectives, purposes, methodology, statistical processing and organization of each clinical trial. Each trial must also be organized in accordance with international ethical standards, scientific standards and legislation and must first be reviewed and approved by the National Medical Ethics Committee and the Public Agency for Medicinal Products and Medical Devices of the Republic of Slovenia.
Clinical trials in Slovenia must adhere to:
– The Medicinal Products Act (Official Gazette of RS no. 17/14)
– Rules on clinical testing of medicinal products (Official Gazette of the Republic of Slovenia, No 54/06)
– Helsinki declaration on Ethical Principles for Medical Research Involving Human Subjects
– ICH guidelines of good clinical practice
– Oviedo Convention
– Code of Medical Ethics
– Rules on fees and costs of procedures in the field of medicinal products (Official Gazette of RS, no. 3/07, 25/10 and 37/10)
More on EU legislation pertaining to clinical trials:
– Directives and recommendations of the European Commission: EudraLex – Volume 10 Clinical trials guidelines
– Regulation (EU) no. 536/2014 of the European Parliament and of the Council of 16 April 2014 on clinical trials on medicinal products for human use, and repealing Directive 2001/20/EC
“,”Rok Knafelj”,1550811300,1550811300,en,13822,306,13821,43,0,NULL,,”Klinične raziskave za varen prehod v bolj zdravo prihodnost “,klinicne-raziskave-za-varen-prehod-v-bolj-zdravo-prihodnost,Post,”/sites/43/files/images/news/Klinicene studije/Klinicne studije_img.jpg”,1,0,1551675569,1552385256
557,13865,”Svetovni dan ustnega zdravja letos s poudarkom na lastni skrbi za ustno zdravje”,”Danes obeležujemo svetovni dan ustnega zdravja, ki letos poteka pod sloganom Pamet v roke – za usta in zobe “,”
Ljubljana, 20. marca (STA) – Danes obeležujemo svetovni dan ustnega zdravja, ki letos poteka pod sloganom Pamet v roke – za usta in zobe in se osredotoča predvsem na pomen lastne skrbi za ustno zdravje. Ustno zdravje je neločljivo povezano s splošnim zdravjem in kakršnokoli obolenje na področju ust pomembno vpliva na kakovost življenja posameznika, so pojasnili na NIJZ.
Kot so sporočili z Nacionalnega inštituta za javno zdravje (NIJZ), sta dosledna skrb za ustno higieno in redni obiski pri zobozdravniku pomemben del zdravega življenjskega sloga. S tem lahko močno zmanjšamo verjetnost nastanka bolezni v ustni votlini in krepimo naše splošno zdravje.
V sodelovanju s stomatološko sekcijo Slovenskega zdravniškega društva so na NIJZ pripravili tudi krajšo brošuro. V brošuri so med drugim izpostavili pomen ustne higiene in zapisali tudi nekaj preprostih in najučinkovitejših ukrepov za ohranjanje in krepitev ustnega zdravja.
Ustno zdravje je namreč neločljivo povezano s splošnim zdravjem in obolenja na področju ust pa pomembno vplivajo na kakovost življenja posameznika, njegovo vsakodnevno delovanje in psihosocialno blagostanje.
Ključni dejavnik pri ohranjanju ustnega zdravja je primerna in zadostna ustna higiena, kar pomeni umivanje zob vsaj dvakrat dnevno. Raziskave kažejo, da je pogostost umivanja zob vsaj dvakrat dnevno v Sloveniji nekoliko višja med otroki in mladostniki v primerjavi z odraslimi, kjer je prisotna pri približno dveh tretjinah prebivalcev, je med drugim zapisano v brošuri.
Karies je najbolj razširjena kronična nenalezljiva bolezen. Njegov nastanek je tesno povezan s prisotnostjo bakterij v zobnih oblogah, ki presnavljajo sladkorje iz hrane v kisline in lahko se začne raztapljanje sklenine.
Po priporočilih Svetovne zdravstvene organizacije naj bi vnos prostih sladkorjev omejili na 10 odstotkov (50 g), še bolje pa na pet odstotkov (25 g) celotnega energijskega vnosa, piše v brošuri.
Druga zelo pogosta bolezen v ustni votlini je parodontalna bolezen, ki je tudi povezana z zobnimi oblogami. Bakterije v oblogah ob zobnem vratu povzročajo vnetje obzobnih tkiv, sčasoma pa tudi mineralizirajo (zobni kamen), kar še bolj oteži učinkovito odstranjevanje oblog in vodi v napredovanje bolezni. Nastanek parodontalne bolezni je povezan tudi s kajenjem, ki je skupaj z uživanjem alkohola pomemben dejavnik tveganja tudi za nastanek raka v ustni votlini.
Svetovni dan ustnega zdravja predstavlja projekt pod okriljem Svetovne zobozdravstvene organizacije. S sloganom Recite Aaa: Pomislite na usta, pomislite na zdravje želijo poudariti celostno in vseživljenjsko skrb za ustno zdravje, ki obsega zdravje zob, obzobnih tkiv in vseh drugih struktur v ustni votlini.
“,STA,1553086320,1553086320,sl,13865,306,13864,43,0,NULL,,”Svetovni dan ustnega zdravja letos s poudarkom na lastni skrbi za ustno zdravje”,svetovni-dan-ustnega-zdravja-letos-s-poudarkom-na-lastni-skrbi-za-ustno-zdravje,Post,,1,0,1553604781,1553604782
558,13867,”Že kratek sprehod le enkrat tedensko zmanjša tveganje za smrt”,”Že kratek sprehod le enkrat ali dvakrat tedensko je dovolj, da zmanjšamo tveganje za smrt zaradi srčnega infarkta”,”
London, 25. marca (STA) – Že kratek sprehod le enkrat ali dvakrat tedensko je dovolj, da zmanjšamo tveganje za smrt zaradi srčnega infarkta, kapi ali raka, kaže študija, ki so jo izvedli na statističnih podatkih o skoraj 90.000 ljudeh.
Pri ljudeh, ki so se vsak teden eno uro sprehajali ali vrtnarili, je bilo tveganje za smrt iz kateregakoli izmed naštetih razlogov za 18 odstotkov manjše kot pri tistih, ki se niso premaknili s kavča, kaže študija, ki so jo objavili prejšnji teden v publikaciji British Jorunal of Sports Medicine.
Dve uri in pol do pet ur zmerne fizične aktivnosti tedensko, ki po intervalih ni bila krajša od desetih minut, pa sta pomenili do 31 odstotkov nižje tveganje za smrt. Tisti, ki so vsak teden zmernemu gibanju posvetili najmanj 25 ur, pa so tveganje skoraj razpolovili, po poročanju francoske tiskovne agencije AFP dodaja študija.
Njeni avtorji so pri tem priznali, da vsak pač nima časa, da bi toliko časa posvetil gibanju. Zato so izpostavili “časovno učinkovitejše aktivnosti”, ki pospešijo bitje srca, kot so kolesarjenje, tek in tekmovalni športi. Navedli so tudi, da povečevanje aktivnosti s petih na 25 ur nima dodatnih koristi, ko gre za srčno-žilne bolezni.
Ekipa raziskovalcev pod vodstvom profesorja Bo Xija z oddelka za epidemiologijo na univerzi Shandong na severu Kitajske je v študiji preučila podatke, ki so jih v okviru raziskav o nacionalnem zdravju med letoma 1997 in 2008 letno zbirali med 88.140 ljudmi v ZDA. Podatke o gibanju so nato primerjali s podatki o smrtih v letu 2011.
Raziskovalci so sicer posvarili, da iz takšne, opazovalne študije ni mogoče potegniti trdnih zaključkov, pri čemer so kot šibko točko navedli tudi dejstvo, da so ljudje o svojih gibalnih navadah poročali sami. A obenem so menili, da že dejstvo, da je študija zajela tako veliko število ljudi, nadomešča njene metodološke pomanjkljivosti.
“,STA,1553518440,1553518440,sl,13867,306,13866,43,0,NULL,,”Že kratek sprehod le enkrat tedensko zmanjša tveganje za smrt”,ze-kratek-sprehod-le-enkrat-tedensko-zmanjsa-tveganje-za-smrt,Post,,1,0,1553604911,1553604912
561,13880,”Celjska bolnišnica s standardom medicinske rehabilitacije na sekundarni ravni”,”Zavod za zdravstveno zavarovanje Slovenije je celjski bolnišnici v splošnem dogovoru za leto 2019 podelil standard medicinske rehabilitacije na sekundarni ravni.”,”
Celje, 26. marca (STA) – Zavod za zdravstveno zavarovanje Slovenije je celjski bolnišnici v splošnem dogovoru za leto 2019 podelil standard medicinske rehabilitacije na sekundarni ravni. Kot so sporočili z bolnišnice, ga v resnici vsebinsko izvajajo že dolgo vrsto let. Zavod pa je bolnišnici doslej priznaval le primarno raven medicinske rehabilitacije bolnikov.
Kot navajajo v celjski bolnišnici, ves čas opravljajo zgodnjo in nadaljevalno medicinsko rehabilitacijo bolnikov z najtežjimi okvarami gibalnega sistema in vsemi ostalimi patologijami. S pridobljenim standardom medicinske rehabilitacije na sekundarni ravni pa bo imela bolnišnica tudi možnost za nadaljnji razvoj stroke na ustrezni ravni.
Predstojnica oddelka za medicinsko rehabilitacijo v celjski bolnišnici Lidija Plaskan je dejala, da so veseli priznanja za delo, ki so ga opravili, in možnosti, da naprej razvijajo stroko. Dodala je, da priznanje standarda medicinske rehabilitacije pomeni veliko dodano vrednost obravnavi njihovih bolnikov, ki bodo zdaj imeli možnost neposrednega nadaljevanja rehabilitacije po odpustu iz bolnišnice ali po ambulantni oskrbi.
V celjski bolnišnici so ob tem zapisali, da izvajajo med drugim tudi programe, ki so edinstveni v slovenskem prostoru. Leta 1989 je tako pričela z delom ambulanta za otroke s centralno motorično prizadetostjo, ki je še danes edina tovrstna bolnišnična specialistična ambulanta v Sloveniji.
Bolnišnica pa je leta 1990 kot prva v Sloveniji uvedla zgodnjo protetično rehabilitacijo po amputacijah na spodnjih udih s pomočjo pnevmatskega pripomočka za hojo oz. pnevmatske šolske proteze. Ta oblika rehabilitacije omogoča bolnikom ohranjanje centralne sheme hoje, hitrejše oblikovanje krna in boljšo fizično pripravljenost na dokončno protetično oskrbo.
Kot so zapisali, velik izziv predstavljajo tudi bolniki po politravmah in sklepnih ali prisklepnih zlomih, ki prav tako potrebujejo intenzivno, dolgotrajno rehabilitacijsko obravnavo, ki je ključna za dober končni funkcijski izid. Utečeni so programi po artroplastiki kolka, kolena in ramena ter po rekonstrukciji sprednje križne vezi in rotatorne manšete.
Oddelek za medicinsko rehabilitacijo, ki letos praznuje 70 let organizirane strokovne fizioterapije na kirurških oddelkih in 60 let ambulantne fizioterapije, ima tudi delovno terapijo, ki je nujen sestavni del obravnave bolnikov z resnejšimi poškodbami ali obolenji zgornjega uda, so še navedli v bolnišnici.
“,”Jaka Verbic Miklic”,1554188580,1554188580,sl,13880,306,13879,43,0,NULL,,”Celjska bolnišnica s standardom medicinske rehabilitacije na sekundarni ravni”,celjska-bolnisnica-s-standardom-medicinske-rehabilitacije-na-sekundarni-ravni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1554188689,1554188717
562,13882,”V ZDA za 80 odstotkov okužb s hivom krivi posamezniki, ki ne vedo, da so okuženi ali se ne zdravijo”,”Okoli 80 odstotkov novih okužb z virusom hiv v ZDA povzročijo posamezniki, ki ne vedo, da so seropozitivni “,”
Washington, 27. marca (STA) – Okoli 80 odstotkov novih okužb z virusom hiv v ZDA povzročijo posamezniki, ki ne vedo, da so seropozitivni ali tisti, ki to vedo, a se ne zdravijo, kaže nedavna raziskava ameriškega Centra za nadzor in preprečevanje bolezni (CDC).
Raziskava temelji na podatkih iz leta 2016, z njo pa so pristojne oblasti želele podkrepiti strategijo, ki jo je nedavno predstavil ameriški predsednik Donald Trump in katere cilj je končati epidemijo aidsa v prihodnjem desetletju. Ta strategija stremi k več in širšim pregledom ter boljšemu dostopu do zdravljenja okuženih vse od trenutka, ko ugotovijo, da so seropozitivni, povzema francoska tiskovna agencija AFP.
Raziskava je pokazala, da 38 odstotkov okužb s hivom povzročijo posamezniki, ki ne vedo, da so okuženi, 43 odstotkov pa tisti, ki vedo, da so okuženi, a ne jemljejo antiretrovirusnih zdravil. Preostale okužbe povzročijo tisti, ki se zdravijo, a pri katerih virus očitno še ni bil zatrt. Pol milijona ljudi v ZDA, ki so okuženi, a jemljejo zdravila in je virus pri njih zatrt, hiva ne širi oz. je stopnja širjenja ničelna, še izhaja iz raziskave.
CDC krivdo za to, da okuženi s hivom ne jemljejo zdravil, vidi predvsem v finančnih in socialnih razlogih – sploh glede na to, da so ta zdravila običajno v obliki tablet, ki se jemljejo dnevno, stranski učinki pa so minimalni.
Najvišje tveganje za okužbo s hivom imajo še vedno homoseksualni moški. Glede na raziskavo so namreč tri četrtine novih okužb povzročili moški, ki imajo spolne odnose z moškimi. Pet odstotkov okužb je posledica uživanja intravenoznih drog med homoseksualnimi moškimi, medtem ko jih je 10 odstotkov posledica uživanja tovrstnih mamil med preostalo populacijo.
Dvanajst odstotkov novih okužb so zabeležili med heteroseksualnimi, sicer pa je najvišja stopnja prenosa okužbe v starostni skupini med 13 in 24 let.
Trumpova administracija je napovedala, da bo v prihodnjem fiskalnem letu za bolj proti hivu oz. adisu namenila 291 milijonov dolarjev. Od leta 2013 letno zabeležijo 39.000 prenosov okužbe, cilj pa je to številko zmanjšati za 75 odstotkov v prihodnjih petih in za 90 odstotkov v prihodnjih desetih letih.
“,”Jaka Verbic Miklic”,1554188760,1554188760,sl,13882,306,13881,43,0,NULL,,”V ZDA za 80 odstotkov okužb s hivom krivi posamezniki, ki ne vedo, da so okuženi ali se ne zdravijo”,v-zda-za-80-odstotkov-okuzb-s-hivom-krivi-posamezniki-ki-ne-vedo-da-so-okuzeni-ali-se-ne-zdravijo,Post,,1,0,1554188849,1554188850
563,13884,”Obiski v UKC Ljubljana spet dovoljeni, zaradi gripe umrlo 62 ljudi “,”- V UKC Ljubljana so preklicali prepoved obiskov, ki so jo konec januarja uvedli zaradi gripe. “,”
Ljubljana, 27. marca (STA) – V UKC Ljubljana so preklicali prepoved obiskov, ki so jo konec januarja uvedli zaradi gripe. Obiski so dovoljeni v vseh oddelkih, omejeni so le še v porodnišnici. Še vedno velja, da morajo bolnike obiskovati zdrave osebe in v za to določenem času. Letos so obravnavali več kot 1100 bolnikov z gripo, zaradi nje pa je v UKC umrlo 62 ljudi.
Omejitev obiskov v porodnišnici še naprej velja zaradi pojavnosti respiratornega sincicijskega virusa (RSV), ki je povzročitelj obolenj dihal pri dojenčkih. Dovoljeni so obiski ene zdrave osebe – partnerja porodnice, so naknadno sporočili iz Univerzitetnega kliničnega centra (UKC) Ljubljana.
V primerjavi s preteklimi leti so letos v UKC zabeležili več primerov gripe kot pretekla leta. Poleg tega pa je bila tudi oblika gripe hujša, za gripo so hudo obolevali tudi mlajši in sicer zdravi ljudje.
Do 25. marca so obravnavali 1114 bolnikov z dokazano gripo, 559 bolnikov so zdravili v bolnišnici. Med 62 osebami, ki so umrle zaradi gripe, je bilo pet bolnikov brez znanih pridruženih kroničnih bolezni, najmlajši je bil star 41 let. Ostali so imeli pridružene bolezni.
Kot so spomnili v UKC, so za obdobje gripe in ostalih respiratornih obolenj 10. januarja odprli oddelek za epidemije v drugem nadstropju Bolnice dr. Petra Držaja UKC Ljubljana. V februarju so aktivirali pandemski načrt in zagotovili večje število postelj, in sicer 48 dodatnih postelj v Bolnici dr. Petra Držaja in po ostalih klinikah UKC, na ginekološki kliniki so organizirali tudi štiri dodatne postelje za potrebe intenzivne terapije.
Po besede vodje oddelka za intenzivno terapijo klinike za infekcijske bolezni in vročinska stanja Matjaža Jereba so v primerjavi s prejšnjimi leti v letošnji sezoni zdravili zahtevnejše bolnike in več jih je zaradi zapletov potrebovalo obravnavo na oddelkih za intenzivno zdravljenje. “Letošnji tip gripe je bil agresivnejši, enak kot leta 2009, ko so za gripo pogosteje zboleli tudi mlajši in popolnoma zdravi posamezniki. Gripa je pri številnih bolnikih potekala s hudo klinično sliko, z zapleti in tudi dihalno odpovedjo,” Jerebove besede navajajo v sporočilu za javnost.
V zadnjem tednu so se razmere zaradi gripe umirile in število novih primerov bolnikov z gripo upada. Še vedno pa zaznavajo porast okužb dihal z nekaterimi drugimi virusi, ki ogrožajo predvsem otroke in starostnike. Postelje v bolnišnici so zato še vedno zasedene, saj se je pri marsikateremu bolniku čas hospitalizacije in zdravljenja – zaradi hude bolezni in zapletov ob gripi – podaljšal.
“,”Jaka Verbic Miklic”,1554188880,1554188880,sl,13884,306,13883,43,0,NULL,,”Obiski v UKC Ljubljana spet dovoljeni, zaradi gripe umrlo 62 ljudi “,obiski-v-ukc-ljubljana-spet-dovoljeni-zaradi-gripe-umrlo-62-ljudi,Post,,1,0,1554188928,1554188928
564,13886,”S pomladnimi dnevi več nevarnosti za okužbe z boleznimi, ki jih prenašajo klopi”,”S toplejšim vremenom in aktivnostmi v naravi se poveča tudi verjetnost okužbe z boleznimi, ki jih prenašajo klopi in ki lahko resno ogrozijo naše zdravje. “,”
Ljubljana, 01. aprila (STA) – S toplejšim vremenom in aktivnostmi v naravi se poveča tudi verjetnost okužbe z boleznimi, ki jih prenašajo klopi in ki lahko resno ogrozijo naše zdravje. V Sloveniji sta najpogostejša lymska borelioza in klopni meningoencefalitis, proti kateremu se lahko zaščitimo s cepljenjem. Okužbam so izpostavljeni ljudje vseh starosti.
V Sloveniji je po podatkih Nacionalnega inštituta za javno zdravje (NIJZ) v letu 2017 zaradi lymske borelioze zbolelo 4534 oseb, zaradi klopnega menigoencefalitisa pa 102 osebi.
Slovenija sodi med endemska področja in se glede na pogostost klopnega meningoencefalitisa uvršča v sam vrh evropskih držav. Medtem ko so z borelijami okuženi klopi razširjeni po vsej Sloveniji, pa je klopov, okuženih s povzročiteljem klopnega menigoencefalitisa, največ na Gorenjskem, Koroškem in v ljubljanski regiji.
Cepiva proti lymski boreliozi pri ljudeh ni, zdravimo jo z antibiotiki. Zdravljenje je zelo uspešno in enostavno zgodaj v poteku bolezni, nekoliko bolj zapleteno pa pri zastaranih oblikah bolezni, ki so sicer redke. Bolezen se običajno začne z rdečino, ki se pojavi nekaj dni do enega meseca po vbodu klopa, se počasi širi, na sredini bledi in dobi obliko obroča. Kožne spremembe običajno izginejo po nekaj tednih. Kasneje, celo več let po okužbi se lahko pojavi prizadetost živčevja, sklepov ali srca.
Klopni meningoencefalitis je resno virusno vnetje osrednjega živčevja. Prva faza bolezni se prične približno teden do 14 dni po vbodu s slabim počutjem, bolečinami v mišicah, glavobolom in vročino. Pri večini bolnikov se po vmesnem izboljšanju pojavi druga faza bolezni z visoko telesno temperaturo, močnim glavobolom, slabostjo, bruhanjem, lahko se pojavi celo nezavest in smrt.
Bolezen lahko pusti trajne posledice, med katere sodijo glavoboli, vrtoglavice, motnje sluha, zmanjšana sposobnost koncentracije, depresija in motnje razpoloženja, motnje v delovanju avtonomnega živčevja in ohromitve. Bolezen v veliki večini primerov zahteva hospitalizacijo in lahko močno vpliva na kakovost življenja tudi po okrevanju.
Z virusom klopnega meningoencefalitisa se lahko okužijo tudi domače živali, na primer koze, ovce in krave. Te živali sicer niso naravni gostitelji virusa, lahko pa okužena žival izloča virus v svojem mleku. Tako se lahko z zaužitjem nepasteriziranega mleka in mlečnih izdelkov okužijo tudi ljudje. Leta 2012 je bil v Sloveniji dokazan prvi primer izbruha klopnega meningoencefalitisa po zaužitju surovega kozjega mleka.
Cepljenje proti klopnemu meningoencefalitisu strokovnjaki priporočajo vsem osebam od enega leta starosti naprej, ki se gibljejo ali živijo na območju, kjer je klopni meningoencefalitis endemičen. Priporočljivo je, da se cepljenje s prvima dvema odmerkoma opravi v zimskih mesecih še pred aktivnostjo klopov. Drugi odmerek osnovnega cepljenja sledi prvemu po enem mesecu, tretji odmerek pa čez 5 do 12 mesecev. Prvi poživitveni odmerek je potreben čez tri leta, kasneje pa na pet let, da se ohrani ustrezen nivo zaščite. Cepljenje se lahko opravi na območnih enotah NIJZ in pri izbranih zdravnikih.
Klopi se nahajajo predvsem v gozdni podrasti, v grmovju vlažnih mešanih gozdov, v travi in celo na vrtu. Takoj ko se temperatura tal poviša, postanejo aktivni. Na sprehodih in izletih v naravo se zato pred klopi zaščitimo z oblačili, pri katerih je čim več kože pokrite, uporabimo tudi repelent, svetujejo na NIJZ. Po vrnitvi iz narave natančno pregledamo telo, se stuširamo in umijemo glavo.
Če pri pregledu opazimo klopa, ga čim prej previdno odstranimo. “Klopa primemo s koničasto pinceto čim bližje koži in ga z enakomernim gibom izvlečemo. Če deli klopa ostanejo v koži, tudi te čim prej odstranimo. Za odstranjevanje klopov s kože ne uporabljamo olja, krem, petroleja ali drugih mazil,” poudarjajo na NIJZ.
“,”Jaka Verbic Miklic”,1554189000,1554189000,sl,13886,306,13885,43,0,NULL,,”S pomladnimi dnevi več nevarnosti za okužbe z boleznimi, ki jih prenašajo klopi”,s-pomladnimi-dnevi-vec-nevarnosti-za-okuzbe-z-boleznimi-ki-jih-prenasajo-klopi,Post,,1,0,1554189061,1554189062
565,13888,”Zveza NVO za avtizem: Družba lahko ponudi ustrezne odgovore z znanjem in razumevanjem”,”Zveza nevladnih organizacij za avtizem ob začetku aprila, ki je mesec zavedanja o avtizmu”,”
Ljubljana, 01. aprila (STA) – Zveza nevladnih organizacij za avtizem ob začetku aprila, ki je mesec zavedanja o avtizmu, in 2. aprilu, svetovnem dnevu avtizma, poziva k integraciji ljudi z avtizmom v družbo. Ta lahko z razumevanjem, znanjem in srčnostjo ponudi odgovore in omogoči njihovo aktivno vključevanje in vzpostavljanje socialne komunikacije, so pozvali v poslanici.
“Osebe z avtizmom nagovarjajo našo zmožnost za čuječnost,” je opozorila predsednica zveze Sandra Bohinec Gorjak. Družbo po njenih besedah spomnijo na temeljne človeške občutke in vrednote, kot so sočutje, požrtvovalnost, otroška igrivost pa tudi humor. “V njihovi družbi nam padajo maske lastne pomembnosti in socialnih okvirov, v katere se moderna družba velikokrat ujame,” je izpostavila.
Voditelji in odločevalci naj šole spodbujajo, da so sprejemajoče za drugačnost otrok, dijakov in študentov z avtizmom, da jim omogočijo uresničevanje njihove ustavne pravice do vključenosti v izobraževalni sistem in družbo, so pozvali v zvezi.
Javni uslužbenci, ponudniki storitev, skrbniki, družine in nestrokovnjaki naj se ustrezno usposobijo za podporo integraciji ljudem z avtizmom v družbo, saj lahko le tako spoznamo njihov pravi potencial. Javni uradi in podjetja pa naj si vzamejo čas, se poučijo o avtizmu in začnejo zaposlovati ljudi z avtizmom, so predlagali.
Ljudje z avtizmom imajo po opozorilih zveze zelo velik potencial. Veliko jih ima vizualne, umetniške ali akademske veščine. Za vzpostavitev vključujoče družbe je nujno prepoznati njihovo nadarjenost, pomanjkljivosti pa odpravljati z zgodnjimi obravnavami in uspešnimi sodobnimi terapevtskimi pristopi, so izpostavili.
Tudi Združeni narodi (ZN) pozivajo k prizadevanjem za polno vključenost vseh ljudi z avtizmom in k potrebni podpori. Tako bodo lahko uživali vse svoje človekove pravice in temeljne svoboščine, je zapisal generalni sekretar ZN Antonio Guterres.
Zveza nevladnih organizacij za avtizem Slovenije bo v torek priredila nacionalno konferenco zavedanja o avtizmu s sklopom o zdravstvu, izobraževanju ter delu in družini. Udeležence bo nagovoril varuh človekovih pravic Peter Svetina, v sklopu o izobraževanju pa tudi minister za izobraževanje, znanost in šport Jernej Pikalo. Pričakujejo več kot 400 udeležencev, med njimi strokovnjake, učitelje, zdravnike, terapevte, odločevalce in osebe z avtizmom, med njimi študente in tudi tiste, ki so že diplomirali in magistrirali.
Avtizem se v medicini obravnava kot kompleksna nevrološka razvojna motnja, pri kateri gre za neobičajen razvoj možganov. Ni bolezen, njegov spekter pa je zelo širok. V osnovi gre pri ljudeh z njim za težave pri verbalnem sporazumevanju, težko predvidijo stvari, izluščijo bistvo in razberejo pomen povedanega med vrsticami. Takšna oseba drugače razmišlja, razume in občuti svet okoli sebe, predvsem pa se mora prav vsega naučiti, tudi tistega, česar se drugi naučijo spontano. Nevrološke motnje se lahko v času otrokovega razvoja s pravilno obravnavo zmanjšajo.
Pojavnost spektroavtistične motnje v svetu strmo narašča. Po podatkih iz ZDA ima v generaciji, rojeni leta 2002, spektroavtistično motnjo eden od 68 otrok. V letu 2015 je bil v spektroavtistični motnji že eden od desetih dečkov in ena od 50 deklic. Če se bo takšen trend nadaljeval, bo leta 2025 že vsak drugi deček in vsaka deseta deklica v spektru avtističnih motenj.
V Sloveniji ni znano natančno število ljudi z avtizmom, ker te motne ne spremljajo sistematično, vendar pa so številke vsako leto višje.
Generalna skupščina ZN je leta 2008 2. april razglasila za svetovni dan zavedanja o avtizmu z namenom, da bi spodbujali k boljšemu razumevanju te motnje.
“,”Jaka Verbic Miklic”,1554189060,1554189060,sl,13888,306,13887,43,0,NULL,,”Zveza NVO za avtizem: Družba lahko ponudi ustrezne odgovore z znanjem in razumevanjem”,zveza-nvo-za-avtizem-druzba-lahko-ponudi-ustrezne-odgovore-z-znanjem-in-razumevanjem,Post,,1,0,1554189147,1554189148
568,13897,”Študija: Petina smrti na svetu povezana z neprimerno prehrano”,”Na svetu je ena od petih smrti povezana z neprimerno prehrano, so v danes objavljeni študiji ugotovili znanstveniki”,”
Washington, 04. aprila (STA) – Na svetu je ena od petih smrti povezana z neprimerno prehrano, so v danes objavljeni študiji ugotovili znanstveniki. Zaradi prekomernega uživanja sladkorja, soli in mesa vsako leto umre več milijonov ljudi.
Študija, objavljena v znanstveni reviji The Lancet, ugotavlja, da v skoraj vseh od 195 obravnavanih držav ljudje jedo preveč neprimerne hrane, medtem ko uživajo zaskrbljujoče malo zdrave hrane, navaja francoska tiskovna agencija AFP.
Na svetu tako v povprečju ljudje spijejo več kot desetkrat več sladkanih pijač od priporočene vrednosti in zaužijejo 86 odstotkov več soli, kot je varno. Obenem so posvarili, da ljudje jedo premalo polnozrnatih živil, sadja in oreščkov, da bi vzdrževali zdrav življenjski slog.
Od 11 milijonov smrti, povezanih z neprimernim prehranjevanjem, jih največ povzročijo srčno-žilne bolezni. Te pa najpogosteje povzroči ali poslabša debelost. “Ta študija potrjuje tisto, kar so mnogi mislili že več let, in sicer da je neprimerna prehrana kriva za več smrti kot katerikoli drug dejavnik tveganja,” je povedal avtor študije Christopher Murray z univerze v Washingtonu.
“Naša ocena kaže, da sta glavni tveganji, povezani s prehrano, uživanje velikih količin soli in uživanje premalo zdrave hrane,” je dodal.
Študija, ki temelji na spremljanju prehranjevalnih navad in bolezni med letoma 1990 in 2017, je pokazala še, da se države močno razlikujejo po številu smrti, povezanih s prehrano. V Uzbekistanu, kjer je največje tveganje za smrt, povezano z neprimerno prehrano, je teh desetkrat več kot v Izraelu, kjer je tveganje najmanjše.
Prehranjevanje z neprimerno prehrano je pogosto povezano z ekonomsko neenakostjo. V bogatih državah tako gospodinjstva porabijo zgolj dva odstotka prihodkov, da si lahko petkrat na dan privoščijo sadje in zelenjavo, v revnejših pa več kot polovico.
Profesorica na medicinski fakulteti v Warwicku Oyinlola Oyebode, ki ni sodelovala v raziskavi, je ob tem poudarila, da rezultati kažejo, na kaj se je treba usmeriti pri izboljševanju prehranjevalnih navad in s tem zdravja na nacionalni in globalni ravni.
“,STA,1554364380,1554364380,sl,13897,306,13896,43,0,NULL,,”Študija: Petina smrti na svetu povezana z neprimerno prehrano”,studija-petina-smrti-na-svetu-povezana-z-neprimerno-prehrano,Post,,1,0,1554969283,1554969284
569,13899,”V zadnjem obdobju več izbruhov noroviroz”,”Na Nacionalnem inštitutu za javno zdravje (NIJZ) so marca zaznali več izbruhov noroviroz”,”
Ljubljana, 09. aprila (STA) – Na Nacionalnem inštitutu za javno zdravje (NIJZ) so marca zaznali več izbruhov noroviroz, po zadnjih podatkih je zbolelo okrog 270 ljudi. Norovirus se je minuli teden razširil tudi med zaposlenimi v farmacevtskem podjetju Lek, kjer ocenjujejo, da jih je zbolelo okrog 200, potrjenih okužb pa je 50.
Na NIJZ so marca zaznali 11 izbruhov noroviroz, in sicer v osnovni šoli, srednji šoli, varstveno-delovnem centru, centru za izobraževanje, centru za izobraževanje in rehabilitacijo, bolnišnici, treh delovnih organizacijah in dveh gostinskih obratih. V teh izbruhih je skupaj zbolelo okrog 270 ljudi, nihče ni bil hospitaliziran, nihče ni umrl, so za STA pojasnili na NIJZ in dodali, da vsi podatki še niso dokončni in jih še zbirajo.
Norovirus je minuli teden izbruhnil tudi v farmacevtskem podjetju Lek, kjer ocenjujejo, da je zbolelo okrog 200 zaposlenih. Ob tem so v Leku poudarili, da niso vse odsotnosti potrjene z rezultati analize vzorcev blata.
Na NIJZ pa so potrdili, da so skupaj z Upravo za varno hrano, veterinarstvo in varstvo rastlin zaradi večje odsotnosti zaposlenih opravil epidemiološko poizvedovanje v Lekovih obratih v Ljubljani in Mengšu. Norovirus so potrdili pri 20 zaposlenih v Ljubljani in 30 v Mengšu.
Zaradi večjega števila obolelih so v Leku zaposlene obvestili o dogajanju ter sodelavcem predlagali delo od doma, kar je v petek veliko zaposlenih tudi upoštevalo, so še pojasnili.
Noroviroza je zelo nalezljiva črevesna bolezen, ki jo povzročajo norovirusi. Laično bolezen imenujemo tudi trebušna gripa, čeprav bolezen ni posledica okužbe z virusi gripe. Norovirusi so zelo kužni in se med ljudmi zlahka širijo. Virusi se izločajo z blatom okuženih ljudi in se prenašajo z rokami, živili, vodo, preko onesnaženih površin in kapljično pri bruhanju, kakor tudi z direktnim stikom, je zapisano na spletni strani NIJZ.
Inkubacijska doba je običajno 24 do 48 ur. Začetek bolezni je lahko nenaden ali pa se razvije postopno. Večina obolelih navaja slabost, bruhanje, drisko in trebušne krče, nekateri bolniki imajo tudi vročino, glavobol in bolečine v mišicah. Pri sicer zdravih osebah težave večinoma izzvenijo v do treh dneh. Okužba lahko poteka z resnimi simptomi pri manjših otrocih, starejših in hospitaliziranih osebah. Zdravniško oskrbo potrebuje deset odstotkov zbolelih, nekateri celo hospitalizacijo. Zdravljenje pa je simptomatsko.
Bolezen se zaradi tesnih stikov hitro širi v ustanovah, kot so bolnišnice in domovi za starejše občane, ter lahko prizadene veliko ljudi.
Pri preprečevanju širjenja norovirusov je pomembna skrb za osebno higieno. Najpomembnejši ukrep je umivanje rok s toplo vodo in milom, posebej po uporabi stranišča. Skrbeti moramo tudi za higieno in čiščenje toaletnih prostorov ter čiščenje površin, ki se jih dotikamo z rokami. Na NIJZ še opozarjajo, da bolna oseba lahko okuži hrano, ki jo pripravlja ali servira.
Da se omeji nadaljnje širjenje bolezni, na inštitutu svetujejo, naj bolnik ostane doma, v vrtec, šolo ali delovno mesto pa se lahko vrne 48 ur po prenehanju težav.
“,STA,1554796500,1554796500,sl,13899,306,13898,43,0,NULL,,”V zadnjem obdobju več izbruhov noroviroz”,v-zadnjem-obdobju-vec-izbruhov-noroviroz,Post,,1,0,1554969395,1554969395
570,13901,”Preventivni zdravstveni programi najbolje delujejo v lokalnem okolju”,”Preventivni programi in delo z ranljivi skupinami pomembno prispevajo k krepitvi zdravja”,”
Ljubljana, 09. aprila (STA) – Preventivni programi in delo z ranljivi skupinami pomembno prispevajo k krepitvi zdravja. Progami pa dajo dobre rezultate le, če se izvajajo v lokalnem okolju. Zdravje najbolje krepimo tam, kjer živimo in delamo, so poudarili sodelujoči na prvi konferenci Zdrava povezava. Predstavili so programe, ki dopolnjujejo javne službe na področju zdravja.
Ministrstvo za zdravje sofinancira delovanje 85 programov 75 organizacij, ki delujejo na področju varovanja in krepitve zdravja. Sredstva so namenjena tako za delovanje programov kot ustvarjanje novih delovnih mest, predvsem za mlade strokovnjake, je pojasnil minister za zdravje Aleš Šabeder. Izpostavil pa je tudi pomen sodelovanja z javnim sektorjem.
“Zdravstvo ima kar nekaj akutnih problemov, ki jih bomo skušali rešiti čim prej. Vendar ne smemo spregledati, da imamo na številnih področjih zdravja primerljive in ponekod celo boljše rezultate kot druge države po svetu,” je poudaril minister. To je po njegovih besedah skupen uspeh zdravstva ter društev, združenj in nevladnih organizacij.
Minister je izpostavil izkušnje, ki jih je z delovanjem nevladnih organizacij pridobil kot generalni direktor Univerzitetnega kliničnega centra (UKC) Ljubljana. “Razmišljam, da bi na ministrstvu vzpostavili skupino, podobno svetu pacientov, ki uspešno deluje v UKC Ljubljana,” je dejal in poudaril pomen takšnih programov. “Krepitev zdravja je ključna za vzdržnost zdravstvenega sistema in trajen razvoj naše družbe,” je dodal.
Erika Lenarčič Stojanovič z ministrstva za javno upravo pa je poudarila pomen prostovoljskega dela. Predstavila je strategijo razvoja nevladnih organizacij in prostovoljstva, ki bo vzpostavljala spodbudno okolje za nevladne organizaciji, dolgoročno financiranje in krepila sodelovanje pri snovanju politik ter sodelovanje z gospodarstvom.
V ta namen vzpostavljajo proračunski sklad, iz katerega bodo financirali profesionalizacijo nevladnih organizacij, mentorstvo v prostovoljskih organizacijah in povezovanje nevladnih organizacij. Subvencionirali bodo okoli 100 mest v nevladnih organizacijah in 20 v prostovoljskih organizacijah, je napovedala.
Dolgoročno financiranje nevladnih organizacij omogoča dolgoročno načrtovanje programov, je pojasnila vodja projekte pisarne Centra nevladnih organizacij Slovenije Veronika Vodlan. “Omogoča jim daljše programe, ki imajo na koncu tudi boljše rezultate in prinašajo večji učinek, ne samo za njih, ampak predvsem za življenja ljudi,” je povedala.
Monika Kosinska iz Svetovne zdravstvene organizacije pa je poudarila, da potrebe in izzive lokalne skupnosti najbolje razumejo tisti, ki živijo in delajo v tem okolju. Dobrih rezultatov po njenih besedah nikoli ne more doseči le javni sektor, ampak je za rezultate potrebno partnerstvo z civilnimi organizacijami in lokalno skupnostjo.
“,STA,1554796680,1554796680,sl,13901,306,13900,43,0,NULL,,”Preventivni zdravstveni programi najbolje delujejo v lokalnem okolju”,preventivni-zdravstveni-programi-najbolje-delujejo-v-lokalnem-okolju,Post,,1,0,1554969542,1554969543
571,13903,”Novinarski zajtrk pred svetovnim tednom cepljenja”,”Novinarski zajtrk pred svetovnim tednom cepljenja v organizaciji Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb GIZ”,”
“,STA,1555391460,1555391460,sl,13903,306,13902,43,0,NULL,,”Novinarski zajtrk pred svetovnim tednom cepljenja”,novinarski-zajtrk-pred-svetovnim-tednom-cepljenja,Post,,1,0,1555391380,1555397431
572,13907,”Cepljenje – Odgovornost vseh”,”Pred svetovnim tednom cepljenja”,”
Ljubljana, 16. april 2019 – Pred svetovnim tednom cepljenja, ki bo potekal od 24. do 30. aprila 2019, so strokovnjakinje s področij javnega zdravja in pediatrije na srečanju z novinarji poudarile, da je cepljenje eno največjih dosežkov medicine v zgodovini človeštva, ki je v zadnjih desetletjih preprečilo več smrti kot katerikoli drug zdravstveni ukrep. Čeprav so cepiva varna in učinkovita, se zaradi nasprotovanja cepljenju tudi v razvitem svetu ponovno pojavljajo hitro nalezljive bolezni, ki so že nekaj desetletij veljale za praktično izkoreninjene. Nedavni primer največjega izbruha ošpic po letu 1991 in razglasitev izrednih zdravstvenih razmer v New Yorku dokazuje, kako pomembno je zavedanje, da je cepljenje priložnost in odgovornost vsakega posameznika, družine in skupnosti, ki se ji zaradi kolektivnega varstva pred nalezljivimi boleznimi ne moremo in ne smemo odpovedati.
S cepljenji, ki vsako leto rešijo več kot tri milijone življenj po vsem svetu in s katerimi lahko preprečimo skoraj 30 bolezni, smo uspeli izkoreniniti marsikatero hudo nalezljivo bolezen, kot so črne koze, davica, otroška paraliza in druge. Izr. prof. dr. Nataša Bratina, dr. med., predsednica upravnega odbora Združenja za pediatrijo pri Slovenskem zdravniškem društvu je opozorila: »Starši bi se morali zavedati, da cepljenje za posameznika pomeni varnost pred boleznimi, ki jih trenutno skoraj ne poznamo več, kot so tetanus, poliomielitis, in le skupinsko cepljenje pomeni varnost za tiste posameznike, ki se cepiti ne morejo, ker imajo morda imunsko pomanjkljivost, progresivno nevrološko obolenje, ali so v aktivni fazi zdravljenja rakavega obolenja, oziroma imunosupresivno terapijo prejemajo iz drugih razlogov. Za te bi okužba lahko pomenila usodno klinično sliko, ki se lahko kljub pomoči moderne medicine konča smrtno.«
Program cepljenja v Sloveniji zagotavlja cepljenje proti številnim nalezljivim boleznim vsem otrokom in mladostnikom, pa tudi odraslim in starostnikom, za katere je zaradi različnih zdravstvenih okoliščin cepljenje še posebej priporočljivo. Cepljenje varuje zdravje v vseh življenjskih obdobjih, zato bi morala cepljenja proti gripi, klopnemu meningoencefalitisu, pnevmokoknim okužbam, hepatitisu A in hepatitisu B ter druga podobno kot redni zobozdravstveni in ginekološki pregledi ter udeležba v državnih presejalnih programih postati del vseživljenjske skrbi za zdravje posameznika in družbe. Ali, kot je pojasnila epidemiologinja prim. dr. Alenka Trop Skaza, dr. med., iz Območne enote Nacionalnega inštituta za javno zdravje v Celju: »Cepljenje ščiti pred nalezljivimi boleznimi. Nalezljive bolezni pa ne izbirajo glede na starost, spol, raso in veroizpoved, saj ne poznajo meja. Njihovo širjenje cepljenje zaustavi na najboljši možni način. Cepljenje si lahko zato predstavljamo kot velik dežnik, ki pred dežjem ne ščiti le enega posameznika, ampak tudi tiste, ki jih dežnik doseže.« Lažne novice o cepljenju kot nepotrebnem, celo škodljivem ukrepu v javnosti zbujajo dvom o učinkovitosti in varnosti cepiv. Posledica teh dezinformacij je nasprotovanje cepljenju, kar se odraža v manjšem deležu cepljenih, pomeni oviro pri uvedbi novih cepljenj in vodi v ponoven pojav nalezljivih bolezni. Kljub cilju, da bi ošpice do leta 2020 v Evropski uniji izkoreninili, so v EU le v prvi polovici leta 2018 zabeležili kar 10.000 primerov okužb in 31 smrti zaradi ošpic, posameznim primerom ošpic smo priča tudi v Sloveniji. Po besedah upokojene pediatrinje prim. Jasne Čuk Rupnik, dr. med., je širjenje lažnih in strašljivih vsebin prepričanih borcev proti cepljenju zelo neodgovorno ravnanje, saj zagotavljanje obveznih in priporočljivih cepljenj prinaša obsežno osebno in kolektivno zaščito pred številnimi boleznimi, zaradi katerih so v preteklosti otroci množično obolevali, trpeli trajne okvare in umirali. Te kužne bolezni danes izginjajo prav zaradi cepljenja, tega izjemno uspešnega in varnega posega: »Nekateri starši se poglabljajo v raziskovanje sicer možnih, a izjemno redkih negativnih učinkov cepljenj. Skrbijo jih sestavine cepiva, vpliv na možgane in imunski sistem, vročina, alergije in še in še. Ne poglobijo pa se v raziskovanje resnosti obolenj, proti katerim cepiva delujejo. Nekateri ostanejo ujeti v strahove, ki s cepljenjem nimajo nobene vzročne zveze in so le stvar njihovih umišljenih povezav. Informacije iščejo na spletnih forumih, ki pa so preplavljeni z lažnimi in strašljivimi vsebinami »prepričanih borcev proti cepljenju«. Takšno početje pa je zelo neodgovorno.«
Cepljenje, ne predstavlja le zaščite pred nalezljivimi boleznimi, temveč s cepljenjem, kot je denimo cepljenje proti HPV, preprečujemo tudi nekatere oblike raka. Cepljenje proti bakterijsko nalezljivim boleznim pa zaradi posledično manjše uporabe antibiotikov zmanjšuje bakterijsko odpornost slednje.
V ekonomskem smislu pa cepljenje dokazano zmanjšuje absentizem in povečuje produktivnost, ob tem pa, kot je izpostavila Urša Lakner iz Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, cepljenje ostaja nedvomno eden izmed stroškovno najučinkovitejših preventivnih javnozdravstvenih ukrepov: »Več kot 80 % cepiv proizvedejo vodilna inovativna farmacevtska podjetja v Evropski uniji, kajti proces izdelave cepiv je nepredstavljivo drag, dolgotrajen in negotov. Zato je za dobro preskrbo s cepivi izjemno pomembno, da zdravstvene oblasti dolgoročno načrtujejo nabavo cepiv. Cepiva so sicer v mnogih evropskih državah podcenjena, saj zanje porabijo manj kot 0,5 % zdravstvenega proračuna. Podatek iz januarja 2018, da v Sloveniji za cepiva porabimo 2,99 eura na prebivalca, pa naj govori sam zase.«
Za dobro delovanje zdravstvenega sistema in preventivnih programov, tudi cepljenja, je ključno zaupanje. Za verodostojne in znanstveno podprte informacije o cepljenju slovenski pediatri zato pripravljajo nov spletni portal, ki bo bralcem pomagal sprejemati informirane odločitve.
.
.
“,”Jaka Verbic Miklic”,1555440300,1555440300,sl,13907,306,13906,43,0,NULL,,”Cepljenje – Odgovornost vseh”,cepljenje-odgovornost-vseh,Post,”/sites/43/files/images/news/Cepljenje – Odgovornost vseh/Cepljenje_fiirdpc.jpg”,1,0,1555440580,1634559993
573,13907,”Vaccination – Our shared responsibility”,”Before the World Immunization Week, taking place from 24 to 30 April 2019″,”
Ljubljana, 16 April 2019 – Before the World Immunization Week, taking place from 24 to 30 April 2019, experts in the fields of public health and pediatric medicine met the press to emphasize the fact that immunization is one of the greatest healthcare achievements in the history of mankind and has prevented more deaths in recent decades than any other health intervention. Although vaccines are safe and effective, opposition to vaccinations, has caused the return of infectious diseases that were considered practically eradicated for decades, even in the developed world. The recent case of the greatest outbreak of measles after 1991 and declaration of a medical emergency in New York shows the importance of knowing that immunization is an opportunity and responsibility of every individual, family and community that should not be neglected due to the need for collective protection from infectious diseases.
Immunizations that save over three million lives around the world each year and can prevent almost 30 diseases have enabled us to eradicate many severe infectious diseases, including smallpox, diphteria, polio and others. Associate Professor dr. Nataša Bratina, M.D., President of the Management Board of the Association of Pediatric Medicine with the Slovenian Association of Physicians stated: “Parents should know that immunization means individual protection from diseases that we hardly see nowadays, including tetanus, polio, etc., but only group immunization brings protection to those individuals that cannot be vaccinated due to immune deficiency, progressive neurological conditions, are receiving active treatment for cancer or on immunosuppresive therapy for other reasons. For those persons an infection could prove fatal even with the assistance of modern medicine.”
The immunization program in Slovenia provides vaccination against many infectious diseases for all children and youths, as well as adults and the elderly who could benefit from additional vaccination due to different health circumstances. Immunization protects health in all stages of life, so vaccinations against influenza, tick-borne encephalitis, pneumococcal infections, hepatitis A and hepatitis B and other diseases should become just as much part of the life long care for the health of the individual and society as regular dental and gynecological examinations and participation in national screening programs.Or, as explained by epidemiologist prim. dr. Alenka Trop Skaza, M.D. from the Celje regional unit of the National Institute of Public Health: “Immunization protects against infectious diseases. Infectious diseases do not discriminate by age, gender, race or religion. They have no borders. Their spread canbe stopped in the best possible way by immunization.We can imagine immunization as a large umbrella that keeps not just a single individual out of the rain, but anybody that fits under it.”
Fake news describing vaccinations as an unnecessary, even harmful measure create doubt about the efficiency and safety of vaccines in the general public. The consequence of such disinformation is resistance against vaccination, showing in a smaller share of vaccinated individuals, causing difficulties in introducing new vaccines and leading to re-emergence of infectious diseases. In spite of the goal of eradicating measles in the EU by 2020, the EU recorded 10,000 cases of infection and 31 deaths due to measles just in 2018 and we have seen separate cases of measles in Slovenia as well. According to retired pediatrician prim. Jasna Čuk Rupnik, M.D., the spreading of false and fear mongering information by dedicated anti vaccination activists is a very irresponsible act since the assurance of mandatory and recommendable vaccinations brings extensive personal and collective protection against numerous diseases that wreaked havoc among children in the past, causing debilitating injury and death. These infectious diseases are now disappearing precisely because of immunization, a very safe and successful intervention: “Some parents focus on studying the potential but extremely rare negative effects of vaccination. They worry about the ingredients of vaccines, their influence on the brain and immune system, fever, allergies and on and on. But they do not consider the severity of diseases that vaccines target. Some then remain paralyzed by fears that have no causal relationship with vaccination and exist only in their made up connections. They seek information on Internet forums that are flooded with false and scary content published by “dedicated anti vaccination activists”. This is very irresponsible.”
Immunization does not provide protection only against infectious diseases. Vaccinating against certain agents such as HPV prevent some forms of cancer. Vaccinating against bacterial infectious diseases also reduces the consumption of antibiotics and thus reduces bacterial resistance against them.
In economic terms immunization has been proven to reduce absenteeism and increase productivity, while remaining, as put by mag. Urša Lakner from the Forum of International Research and Development Pharmaceutical Companies, one of the most cost effective preventative measures in public healthcare: “more than 80 % of all vaccines are produced by leading innovative pharmaceutical companies in the European Union as the process of producing vaccines is inconceivably expensive, time consuming and precarious. That is why it is very important for uninterrupted supply of vaccines that healthcare authorities plan their purchases in advance. Generally vaccines are undervalued in many European countries, accounting for less than 0.5 % of healthcare budgets. The January 2018 information that Slovenia spends 2.99 Euros per inhabitant on vaccines can speak for itself.”
Trust is a key factor in assuring good operation of the healthcare system and preventative programs, including immunization. That is why Slovenian pediatricians are preparing a new web portal with truthful and science backed information on vaccinations to help readers adopt informed decisions.
.

“,Jaka,1555563420,1555563420,en,13907,306,13906,43,0,NULL,,”Cepljenje – Odgovornost vseh”,cepljenje-odgovornost-vseh,Post,”/sites/43/files/images/news/Cepljenje – Odgovornost vseh/Cepljenje_fiirdpc.jpg”,1,0,1555440580,1634559993
575,13928,”Evropski in svetovni teden cepljenja v znamenju odgovornosti za zaščito skupnosti”,”Letošnji evropski in svetovni teden cepljenja, ki bo potekal od srede do konca aprila”,”
Ljubljana, 23. aprila (STA) – Letošnji evropski in svetovni teden cepljenja, ki bo potekal od srede do konca aprila, v ospredje postavlja odgovornost posameznika pri zaščiti skupnosti pred nalezljivimi boleznimi. Cepiva namreč ne ščitijo le posameznika, temveč lahko z velikim deležem cepljenih preprečimo prenos in širjenje bolezni, so izpostavili na tiskovni konferenci NIJZ.
V Sloveniji je precepljenost pred nalezljivimi boleznimi relativno visoka, trend upadanja precepljenosti pa se je v zadnjih letih ustavil. Bolezni, kot so otroška paraliza, davica in rdečke, nismo zabeležili že več desetletij, ošpice in mumps pa se pojavljajo kot posamični primerni, ki so prineseni iz tujine, je pojasnila Marta Grgič Vitek z Nacionalnega inštituta za javno zdravje (NIJZ). “Pomembno je, da vzdržujemo čim višjo precepljenost, da ne bi prišlo ponovno do izbruhov bolezni, ki smo jih že skoraj pozabili,” je pozvala.
Zaradi bolezni, ki bi jih lahko preprečili s cepljenjem, vsako leto namreč še vedno umre 1,5 milijona otrok, približno 20 milijonov otrok pa še vedno ni cepljenih, je ob tem opozoril izvršni direktor Unicef Slovenija Tomaž Bergoč. V preteklih desetletjih je bil sicer dosežen velik napredek pri reševanju otroških življenj: od leta 1988 je število primerov otroške paralize upadlo za več kot 99 odstotkov, na globalni ravni pa smo v zadnjih dveh desetletjih smrtnost zaradi ošpic uspeli zmanjšati za 80 odstotkov.
Pediater Denis Baš iz Zdravstvenega doma Kamnik opaža, da se v zadnjih letih zaradi pozitivnih kampanj o pomembnosti cepljenja starši več odločajo za cepljenje. Med razlogi nekaterih staršev, ki vztrajno odklanjajo cepljenje, pa so običajno strah pred neželenimi učinki, je pojasnil Baš. Želi si tudi, da bi pediatri pri pregledih imeli več časa za vsa vprašanja zaskrbljenih staršev.
Z informiranjem, izobraževanjem in razbijanjem mitov o cepljenju se ukvarjajo tudi študenti medicine v projektih Vakcinet in Imuno. To počnejo z obiski na šolah, predavanji in kongresi, prisotni pa so tudi na družbenih omrežjih, kjer želijo laični javnosti predstaviti preverjene in zanesljive informacije na razumljiv način, je pojasnil vodja projekt Imuno Vid Čeplak Mencin. Njihove izkušnje kažejo, da nasprotnikov cepljenja sicer ni veliko, so pa zelo glasni in dobro organizirani.
V projektu Vakcinet poseben poudarek dajejo tudi pomenu cepljenja med zdravstvenimi delavci, ki igrajo ključno vlogo pri preprečevanju širjenja nalezljivih bolezni, je pojasnila vodja projekta Ana Keršič. “Zdravstveni delavec nosi odgovornost do zdravja bolnika, s katerim dela,” je dejala. Po njenih izkušnjah ozaveščenost sicer narašča. Med študenti mariborske medicinske fakultete so z brezplačno akcijo cepljenja proti gripi na primer uspeli doseči 74-odstotno precepljenost.
Generalna direktorica direktorata za javno zdravje na ministrstvu za zdravje Mojca Gobec je poudarila, da imamo dober in učinkovit sistem javnega zdravstva, v katerem so cepiva otrokom dostopna. Tudi ona je poudarila pomembnost informiranja in komuniciranja z javnostjo. “Preprečevati bolezni je bolje, kot le zdraviti. Želimo, da bi več ljudi razumelo, da je cepljenje privilegij in da bi zaupali strokovnjakom,” je dejala. Ob tem je še opozorila, da Slovenija ni izolirana in da potovanja v tujino predstavljajo dejavnik tveganja za širjenje bolezni, pred katerimi se lahko učinkovito zaščitimo.
“,STA,1555995240,1555995240,sl,13928,306,13927,43,0,NULL,,”Evropski in svetovni teden cepljenja v znamenju odgovornosti za zaščito skupnosti”,evropski-in-svetovni-teden-cepljenja-v-znamenju-odgovornosti-za-zascito-skupnosti,Post,,1,0,1556168112,1556168113
576,13930,”Unicef opozarja na alarmanten porast ošpic v svetu”,”Unicef je ob današnjem začetku svetovnega in tudi evropskega tedna cepljenja opozoril na alarmanten porast ošpic po vsem svetu.”,”
Ljubljana, 24. aprila (STA) – Unicef je ob današnjem začetku svetovnega in tudi evropskega tedna cepljenja opozoril na alarmanten porast ošpic po vsem svetu. Kot so poudarili, približno 169 milijonov otrok med letoma 2010 in 2017 ni prejelo prvega odmerka cepiva proti ošpicam. To pomeni, da letno prvega odmerka cepiva ni prejelo več kot 21 milijonov otrok.
Naraščajoče število necepljenih otrok je olajšalo pot izbruhom ošpic, ki so v zadnjem času prizadeli več držav po svetu. “Temelji globalnega izbruha ošpic, ki smo mu priča danes, so bili ustvarjeni že pred leti,” je poudarila izvršna direktorica Unicefa Henrietta Fore.
Virus ošpic bo po njenih besedah vselej našel necepljene otroke. “Če želimo resnično preprečiti širjenje te nevarne, vendar preprečljive bolezni, moramo cepiti vsakega otroka, tako v razvitih državah kot tudi v državah v razvoju,” je še izpostavila, kot so sporočili iz Slovenske fundacije za Unicef.
V prvih treh mesecih letos je bilo po podatkih Unicefa v svetu prijavljenih več kot 110.000 primerov ošpic, kar je skoraj 300 odstotkov več kot v enakem obdobju lani. V letu 2017 je zaradi ošpic umrlo približno 110.000 ljudi, večinoma otrok, oz. 22 odstotkov več kot leto prej.
Za zaščito otrok pred ošpicami sta potrebna dva odmerka cepiva. Zaradi pomanjkanja dostopa do cepljenja, slabih zdravstvenih sistemov, pa tudi neupravičenega strahu in dvomov v cepiva je bila leta 2017 globalna precepljenost s prvim odmerkom cepiva proti ošpicam 85-odstotna in kljub rasti prebivalstva se v zadnjem desetletju ni bistveno spremenila.
Globalna precepljenost z drugim odmerkom cepiva je veliko nižja, in sicer 67 odstotkov. Svetovna zdravstvena organizacija priporoča prag 95-odstotne precepljenosti, da bi dosegli tako imenovano kolektivno zaščito, so spomnili pri Unicefu.
Po najnovejših podatkih je v državah z visokimi dohodki precepljenost s prvim odmerkom cepiva proti ošpicam 94-odstotna, z drugim odmerkom pa 91-odstotna. Čeprav so ZDA na vrhu seznama držav z visokim dohodkom, pa tam med letoma 2010 in 2017 največ otrok ni bilo cepljenih s prvim odmerkom cepiva, in sicer več kot 2,5 milijona. Sledita Francija z več kot 600.000 in Velika Britanija z več kot 500.000 necepljenih dojenčkov v enakem obdobju.
V državah z nizkimi in srednjimi dohodki so razmere kritične. V letu 2017 je imela na primer Nigerija največje število otrok, mlajših od leta dni, ki niso prejeli prvega odmerka cepiva, in sicer skoraj štiri milijone. Sledijo Indija (2,9 milijona otrok), Pakistan in Indonezija (1,2 milijona otrok) ter Etiopija (1,1 milijona otrok).
Še bolj zaskrbljujoča je globalna precepljenost z drugim odmerkom cepiva proti ošpicam. Med 20 državami z največjim številom necepljenih otrok v letu 2017 jih kar devet ni uvedlo drugega odmerka. V podsaharski Afriki dvajset držav ni uvedlo drugega odmerka v nacionalni program cepljenja, kar pomeni, da je več kot 17 milijonov dojenčkov letno izpostavljenih večjemu tveganju, da zbolijo za ošpicami v otroštvu.
Unicef skupaj s partnerji, kot sta Pobuda proti ošpicam in rdečkam ter Gavi, zavezništvo za cepljenje, pomaga pri reševanju globalnega izbruha ošpic, med drugim s pogajanji o cenah cepiva. Stroški cepiva proti ošpicam so zdaj na najnižji ravni, so ob tem navedli pri Unicefu.
Prav tako Unicef s partnerji državam pomaga pri prepoznavanju oddaljenih območij in marginaliziranih otrok, ki niso deležni cepljenja, pri dobavi cepiv in drugih pripomočkov za cepljenje, nudi podporo kampanjam dodatnega cepljenja za odpravo vrzeli v okviru nacionalnih programov cepljenja in spodbuja države pri vključitvi drugega odmerka cepiva proti ošpicam v nacionalni program cepljenja. Kot so zapisali, bodo Kamerun, Liberija in Nigerija to storile letos.
“,STA,1556081760,1556081760,sl,13930,306,13929,43,0,NULL,,”Unicef opozarja na alarmanten porast ošpic v svetu”,unicef-opozarja-na-alarmanten-porast-ospic-v-svetu,Post,,1,0,1556168216,1556168216
581,13965,”V ZDA našteli rekordnih 695 primerov ošpic”,”Ameriški Center za nadzor nad nalezljivimi boleznimi (CDC) je letos zabeležil že 695 primerov ošpic “,”
New York, 25. aprila (STA) – Ameriški Center za nadzor nad nalezljivimi boleznimi (CDC) je letos zabeležil že 695 primerov ošpic v 22 zveznih državah. To je največ od leta 2000, ko je bila ta izredno kužna bolezen v ZDA praktično izkoreninjena, so opozorili.
Največ primerov so zabeležili v zvezni državi New York, kjer je izbruh koncentriran v soseskah ultra ortodoksnih judovskih skupnostih v Brooklynu. Mestne oblasti so tam odredile obvezno cepljenje.
Naraščanje okužb z ošpicami je posledica naraščajočega globalnega gibanja proti cepljenju v bogatih državah, ki jo je Svetovna zdravstvena organizacija označila za največjo grožnjo globalnemu zdravju. Ljudje verjamejo lažnim novicam o tem, da cepivo povzroča različne bolezni, pri otrocih pa avtizem. CDC priporoča cepljenje vseh oseb, starejših od leta dni, razen tistih, ki so ošpice že preboleli, ker so imuni.
Cepivo za ošpice je v ZDA na voljo od leta 1960 in je varno in učinkovito, zaradi česar je bila bolezen leta 2000 praktično izkoreninjena, so poudarili. Nato pa so se začele med ljudmi širiti dezinformacije glede cepiva in leta 2014 so našteli 667 primerov bolezni.
Od leta 2000 so zaradi ošpic v ZDA umrle le tri osebe, kar je izključno posledica učinkovitosti cepiva. Leta 1958, ko cepljenja še ni bilo, so našteli 763.000 bolnih in 552 mrtvih. Letos smrtnega primera še ni bilo.
CDC sicer opozarja ljudi naj upoštevajo pozive k cepljenju, ne le proti ošpicam, ampak tudi proti drugim boleznim. V New Yorku, kjer je z ošpicami od oktobra lani zbolelo 390 ljudi, so oblasti določile kazen 1000 dolarjev za tiste v ogroženih predelih Brooklyna, ki se ne bodo cepili. Doslej so izrekli 12 kazni.
“,STA,1556166600,1556166600,sl,13965,306,13964,43,0,NULL,,”V ZDA našteli rekordnih 695 primerov ošpic”,v-zda-nasteli-rekordnih-695-primerov-ospic,Post,,1,0,1557808311,1557808522
582,13967,”Raziskava: Z vsakodnevno telovadbo nad sedeče del”,”Ljudje, ki več ur sedijo pred pisalno mizo ali gledajo televizijo, bi morali vsak dan telovaditi več kot 30 minut”,”
Sydney, 26. aprila (STA) – Ljudje, ki več ur sedijo pred pisalno mizo ali gledajo televizijo, bi morali vsak dan telovaditi več kot 30 minut, če želijo preprečiti zdravstvene težave, razkriva avstralska raziskava, ki so jo nedavno objavili v reviji The Journal of the American College of Cardiology, povzema nemška tiskovna agencija dpa.
Raziskava univerze v avstralskem Sydneyu je tako ugotovila, da ljudje, ki vsakodnevno presedijo šest ur in ne telovadijo, prej umirajo zaradi srčno-žilnih bolezni kot tisti, ki telovadijo uro na dan. V devetletni raziskavi je sodelovalo skoraj 150.000 ljudi, starejših od 45 let.
Odkrili so tudi povezavo med vsakodnevnim dolgotrajnim sedenjem, daljšim od šestih ur, z zdravstvenimi težavami, kot so prekomerna telesna teža, srčne bolezni, diabetes, rak in depresija. Večkratno vstajanje je zmanjšalo tveganje za srčno-žilne bolezni pri tistih, ki vsakodnevno sedijo štiri ure ali manj, ni pa imelo skoraj nobenega učinka pri tistih, ki sedijo dlje.
So pa tisti z dolgotrajnim sedenjem, ki so vsak dan bili od 20 do 40 minut zmerne telesno dejavni, npr. hoja ali hoja po stopnicah, lahko bistveno zmanjšali tveganja za zdravje.
“Na primer, ljudje, ki so bili telesno nedejavni in so dnevno sedeli več kot osem ur na dan, so imeli za 107 odstotkov večje tveganje za smrt zaradi srčno-žilnih bolezni od tistih, ki so bili vsak dan telesno aktivni vsaj uro in so sedeli manj kot štiri ure na dan,” je med drugim dejal vodilni avtor raziskave, profesor Emmanuel Stamatakis.
“Kakršnokoli gibanje je dobro, a zmerna do živahna telesna dejavnost, zaradi katere ljudje postanejo zadihani, je najučinkovitejša,” je priporočil Stamatakis.
“,STA,1556253120,1556253120,sl,13967,306,13966,43,0,NULL,,”Raziskava: Z vsakodnevno telovadbo nad sedeče del”,raziskava-z-vsakodnevno-telovadbo-nad-sedece-del,Post,,1,0,1557808497,1557808498
583,13969,”Preventiva najboljša zaščita pred klopnimi boleznimi”,”Obolevnost zaradi bolezni, ki jih prenašajo klopi, je v Sloveniji med najvišjimi v Evropi”,”
Ljubljana, 30. aprila (STA) – Obolevnost zaradi bolezni, ki jih prenašajo klopi, je v Sloveniji med najvišjimi v Evropi. Najpogostejši sta lymska borelioza in klopni meningoencefalitis, proti kateremu pa se lahko učinkovito zaščitimo s cepljenjem. S toplimi dnevi se poveča aktivnost klopov, zato strokovnjaki pozivajo na ustrezne ukrepe, s katerimi se zaščitimo pred okužbami.
Za lymsko boreliozo v Sloveniji letno zboli med 3000 do 7000 oseb vseh starosti, največ od 55 do 64 let. Po podatkih Nacionalnega inštituta za javno zdravje (NIJZ) je bilo lani prijavljenih okoli 7500 primerov borelioze, kar je po besedah Marte Vitek Grgič z NIJZ največ v zadnjem desetletju.
Bolezen se pojavlja sezonsko, od maja do oktobra, ko je aktivnost klopov največja. Razširjena je po vsej Sloveniji, najpogostejša je v novogoriški regiji. Cepiva proti tej bolezni ni, zato je pomembna zaščita pred vbodi klopa z ustreznimi oblačili in repelenti.
Lymska borelioza se običajno začne z rdečino, ki se pojavi od nekaj dni do enega meseca po vbodu klopa, se počasi širi, na sredini bledi in dobi obliko obroča. Te običajno izginejo po nekaj tednih, kasneje pa se lahko pojavi prizadetost živčevja, sklepov ali srca, je pojasnil Franc Strle iz Univerzitetnega kliničnega centra (UKC) Ljubljana. “Zaradi lymske boreioloze se ne umre, lahko pa zelo zagreni življenje,” je opozoril.
Druga najpogostejša klopna bolezen je klopni meningoencefalitis. V zadnjem desetletju na leto povprečno zboli okoli 170 oseb, lani je bilo prijavljenih 153 primerov. Tudi ta bolezen se pojavlja sezonsko, obolevnost pa je najvišja na Gorenjskem in Koroškem.
Kot je pojasnil Strle, se prva faza bolezni prične približno teden do 14 dni po vbodu s slabim počutjem. Pri večini bolnikov se po vmesnem izboljšanju pojavi druga faza bolezni z visoko telesno temperaturo, močnim glavobolom, slabostjo, bruhanjem. Bolezen v veliki večini primerov zahteva hospitalizacijo, zdravljenje pa je simptomatsko. Pusti trajne posledice, med katere sodijo glavoboli, vrtoglavice, motnje sluha, zmanjšana sposobnost koncentracije in ohromitve. Do teh pride v petih do 10 odstotkih primerov, odstotek bolnikov tudi umre, je pojasnil Strle.
Najbolj učinkovit način zaščite proti klopnemu meningoencefalitisu je cepljenje, ki ga priporočajo vsem, ki hodijo v naravo. Osnovno cepljenje zajema tri odmerke, nato pa na tri in kasneje na pet let sledijo poživitveni odmerki. A kot ugotavljajo na NIJZ, je v Sloveniji precepljenost nizka, redno se namreč cepi le med sedem do osem odstotkov prebivalcev.
Po letošnjem programu cepljenja bo cepljenje proti klopnemu meningoencefalitisu za otroke, ki bodo letos dopolnili tri leta, in odrasle, ki bodo letos dopolnili 49 let, financirano iz sredstev obveznega zdravstvenega zavarovanja. Ob tem je Grgič Vitkova opozorila, da se bo to cepljenje lahko začelo, ko bo na voljo t. i. zavarovalniško cepivo, predvidoma jeseni.
“Klopa primemo s pinceto čim bližje koži in ga počasi izvlečemo,” v primeru vboda svetuje Strle. Če smo pri tem preveč sunkoviti, lahko rilček namreč ostane v koži. Priporočljivo je, da klopa odstranimo čim prej.
Klopi prenašajo tudi humano granulocitno anaplazmozo, ki je vročinska bolezen z bolečinami v mišicah, glavobolom in slabim počutjem. Zdravi se z antibiotiki, s katerimi po Strletovih besedah vročina praviloma pade v 24 urah.
Klopne bolezni potrdijo z diagnostiko v mikrobioloških laboratorijih v nekaj urah, je pojasnila Tatjana Avšič Županc z inštituta za mikrobiologijo in imunologijo ljubljanske medicinske fakultete. Pri tem morajo biti zelo pozorni in natančni, da med bolniki, ki imajo zelo podobno klinično sliko, razlikujejo med povzročiteljema klopnega meningoencefalitisa in virusa zahodnega Nila, ki sta si genetsko zelo podobna.
“,STA,1556598900,1556598900,sl,13969,306,13968,43,0,NULL,,”Preventiva najboljša zaščita pred klopnimi boleznimi”,preventiva-najboljsa-zascita-pred-klopnimi-boleznimi,Post,,1,0,1557808623,1557808624
584,13971,”Na okrogli mizi STA poudarili pomen dobre precepljenosti”,”Na okrogli mizi o ključnih raziskovalnih korakih za varno in kakovostno precepljenost”,”
Ljubljana, 06. maja (STA) – Na okrogli mizi o ključnih raziskovalnih korakih za varno in kakovostno precepljenost, ki jo je Slovenska tiskovna agencija danes priredila v Ljubljani, so sodelujoči poudarili pomen dobre precepljenosti. Le tako bo mogoče preprečili, da se bolezni, ki smo jih v Sloveniji že izkoreninili, ne bodo vrnile, so opozorili.
Okrogla miza je sovpadla s prvim dnem kongresa Evropskega združenja za otroške nalezljive bolezni (ESPID), ki bo v Ljubljani potekal do nedelje.
Med vrhunskimi strokovnjaki na kongresu je bil tudi vodja medicinskega razvoja v podjetju GlaxoSmithKline Thomas Breuer. Ta se je na okrogli mizi med drugim dotaknil pomislekov v zvezi s cepljenjem in nasprotujočimi si informacijami, ki krožijo. Industrija je po njegovih besedah naredila velik napredek na področju cepiv v zadnjih letih. V podjetju GSK si prizadevajo, da bi povečali zaupanje v cepljenje tako med zdravstvenimi delavci kot tudi v širši javnosti, je dejal. Zdravstveni delavci pa morajo imeti točne informacije o prednostih in tveganjih posameznega cepiva, je poudaril.
Infektolog in pediater na kliniki za vročinska stanja in nalezljive bolezni Univerzitetnega kliničnega centra Ljubljana Marko Pokorn je dejal, da so razlogi, ki nas vodijo do posameznih odločitev pri skrbi za naše zdravje in zdravje naših bližnjih, včasih zelo iracionalni. “Najbolj radikalni nasprotniki cepljenja verjamejo v svoj prav in vernika težko spreobrneš,” je dejal. Preostali pa iščejo informacije na spletu, kjer pa je težko ločiti zrnje od plev, je opozoril.
Nasprotnikov cepljenja ni veliko, je dejala pediatrinja in podpredsednica sekcije za primarno pediatrijo pri združenju za pediatrijo Andreja Borinc Beden. Več je tistih, ki jih je strah cepiti otroka zaradi negativnih informacij o cepljenju. S temi starši moramo pediatri zelo veliko komunicirati, saj po raziskavah 85 odstotkov staršev v tej skupini na koncu zaupa pediatru. A za to je potreben čas, je opozorila.
Ljudje se po informacije pogosto zatekajo na splet, kjer je veliko negativnih in napačnih informacij o cepljenju. Zato so v projektu Vakcinet dejavni tudi na internetu, je dejala vodja projekta Vakcinet Ana Keršič.
Specialistka na področju javnega zdravja na Nacionalnem inštitutu za javno zdravje (NIJZ) Nadja Šinkovec je povedala, da NIJZ izvaja izobraževanja za izvajalce cepljenj, na svojih spletnih straneh pa objavlja tudi informacije za splošno javnost. Starši naj iščejo informacije na preverjenih straneh, do informacij na različnih forumih in nepreverjenih spletnih straneh pa naj bodo nezaupljivi, je pozvala.
Sicer pa je delež cepljenih otrok v Sloveniji dober, je dejal Pokorn. V Sloveniji tako po njegovih besedah denimo ni virusa ošpic. V vseh primerih ošpic v zadnjih desetih letih se je bolnik okužil v tujini, je spomnil.
Naša družba ni dovolj zrela, da bi ukinili obvezno cepljenje, je opozorila Borinc Bedenova. Tvegali bi namreč, da precepljenost močno pade, je posvarila.
Dostopnost cepljenja je eden od ključnih dejavnikov, da dosežemo visoko precepljenost, je dejala Borinc Bedenova. Hkrati pa mora biti zdravstveni delavec po njenem pozivu dovolj odgovoren, da se cepi, saj ima stik s številnimi ljudmi.
Na vprašanje, proti katerim boleznim se je priporočljivo cepiti, je Pokorn priporočil nosečnicam cepljenje proti oslovskemu kašlju, otrokom pa vsa cepiva, tudi proti noricam in rota virusom.
“,STA,1557117420,1557117420,sl,13971,306,13970,43,0,NULL,,”Na okrogli mizi STA poudarili pomen dobre precepljenosti”,na-okrogli-mizi-sta-poudarili-pomen-dobre-precepljenosti,Post,,1,0,1557808716,1557808717
585,13973,”Danes obeležujemo svetovni dan astme”,”Prvi torek v maju je svetovni dan astme, katerega pobudnica je Globalna iniciativa za astmo (Gina)”,”
Ljubljana, 07. maja (STA) – Prvi torek v maju je svetovni dan astme, katerega pobudnica je Globalna iniciativa za astmo (Gina). Astma je ena od najpogostejših kroničnih pljučnih bolezni, zaradi katere je po oceni Svetovne zdravstvene organizacije (WHO) v letu 2018 trpelo 235 milijonov ljudi. Letošnji dan poteka pod geslom STOP za astmo.
V izvirnem angleškem jeziku beseda STOP v geslu predstavlja kratico, ki pomeni: ovrednoti simptome (Symptom evaluation), testiraj odziv (Test response), opazuj in oceni (Observe and assess) ter nadaljuj s prilagajanjem zdravljenja (Proceed to adjust treatment).
Najmočnejši dejavniki tveganja za razvoj astme so izpostavljenost na alergene, kot so pršice v posteljnini in preprogah, onesnaževanje, cvetni prah, plesni in cigaretni dim.
Simptomi astme, ki so težko dihanje, kašelj, tiščanje v prsih in piskajoče dihanje, se lahko pri bolnikih pojavijo tudi večkrat na dan. Pri nekaterih bolnikih se simptomi lahko poslabšajo med telesno aktivnostjo ali ponoči. Nezdravljena astma lahko pri nekaterih ljudeh vodi v preoblikovanje dihalnih poti in trajno okvaro pljuč. Ob hudem poslabšanju astme lahko bolniki tudi umrejo, a je zaradi sodobnega zdravljenja z zdravili teh primerov bistveno manj kot v preteklosti.
Čeprav astme ni mogoče pozdraviti, se s pravilno diagnozo, zdravljenjem in izobraževanjem bolnika lahko zagotavlja dober nadzor in vodenje bolezni. Med pogostimi žrtvami te kronične bolezni so predvsem otroci. Ljudje, ki trpijo za astmo, lahko bolezen nadzorujejo s tem, da se naučijo izmikati sprožilcem astmatičnih napadov. Med bolj pogostimi so tobačni dim, plesen, onesnažen zrak, prehlad in gripa. Napade se lahko prepreči tudi z ustreznimi inhalacijskimi aparati.
Pojavlja se v vseh državah ne glede na stopnjo razvoja. Več kot 80 odstotkov smrtnih primerov astme je v slabše razvitih državah. Za učinkovit nadzor bolezni pa je nujno, da so zdravila dostopna in na voljo, še posebej družinam z nizkimi dohodki.
Svetovni dan astme se je prvič obeležilo leta 1998 v Španiji, odtlej pa to postal eden najpomembnejših svetovnih dogodkov ozaveščanja o tej bolezni.
“,STA,1557203940,1557203940,sl,13973,306,13972,43,0,NULL,,”Danes obeležujemo svetovni dan astme”,danes-obelezujemo-svetovni-dan-astme,Post,,1,0,1557808808,1557808808
586,13975,”Letno za rakom jajčnikov zboli 150 Slovenk”,”Rak jajčnikov, katerega svetovni dan obeležujemo danes, predstavlja tri odstotke vseh rakov”,”
Ljubljana, 08. maja (STA) – Rak jajčnikov, katerega svetovni dan obeležujemo danes, predstavlja tri odstotke vseh rakov, za katerimi zbolijo ženske, letno za to vrsto raka zboli 150 Slovenk. Ker ga največkrat odkrijejo, ko je že razširjen, ob obolenju preživi najmanj ljudi. Razkrivajo ga nejasni znaki.
Svetovni dan raka jajčnikov v Sloveniji od leta 2013 obeležujemo na pobudo organizacij, ki delujejo na področju ginekoloških rakov. Njihov glavni cilj je osveščanje svetovne javnosti o raku jajčnikov in simptomih bolezni.
Na torkovem pogovoru na temo rakov rodil, ki ga je pred svetovnim dnevom jajčnikov organiziralo Združenje Europa Donna Slovenija, je ginekolog z Onkološkega inštituta Ljubljana Sebastjan Merlo izpostavil pomen zgodnjega odkrivanja raka jajčnikov.
Kot je dejal, tega razkrivajo nejasni znaki, podobni znakom mnogih drugih bolezenskih stanj. Svetoval je, naj bodo ženske še posebej pozorne na nepojasnjeno utrujenost, nenadno in nepojasnjeno pridobivanje ali izgubo telesne teže, spremembe v prebavi, povečanje obsega trebuha in stalen občutek napihnjenosti, vztrajajočo bolečino v spodnjem delu trebuha, občutek hitre sitosti po hranjenju ter spremembe v pogostosti uriniranja. Dodal je, da je ključno, da so ženske pozorne na spremembe in da se ob dalj časa trajajočih težavah posvetujejo z izbranim ginekologom.
Sum na raka jajčnikov potrdi ultrazvočni pregled trebušne votline. Najpogosteje bolnico najprej operirajo, nato pa sledi kemoterapija, včasih tudi biološka zdravila. A če je bolezen bolj razširjena po trebušni votlini, se lahko zdravniki odločijo najprej za kemoterapijo, da zmanjšajo obseg raka, temu sledi operacija.
Sicer obstaja vsaj pet različnih tipov raka jajčnikov. Bolezen se pri večini tipov ne pojavi pri bolnicah, mlajših od 40 let, pri enem, gensko povezanem tipu pa se lahko pojavi v povprečju deset let prej.
“,STA,1557290400,1557290400,sl,13975,306,13974,43,0,NULL,,”Letno za rakom jajčnikov zboli 150 Slovenk”,letno-za-rakom-jajcnikov-zboli-150-slovenk,Post,,1,0,1557808881,1557808882
591,14000,”Za preprečevanje možganske kapi pomembno prepoznavanje znakov bolezni”,”Vsako leto drugi torek v maju obeležujemo evropski dan ozaveščanja o možganski kapi.”,”
Ljubljana, 14. maja (STA) – Vsako leto drugi torek v maju obeležujemo evropski dan ozaveščanja o možganski kapi. Možganska kap je najpogostejša nevrološka bolezen na svetu in samo v Sloveniji prizadene okoli 4000 ljudi letno. Za posledico ima visoko smrtnost in veliko invalidnost, zato sta pomembna preventiva in zgodnje prepoznavanje znakov bolezni.
Možganska kap je nenaden dogodek v osrednjem živčevju, pri katerem je zaradi nezadostne oskrbe možganov s krvjo njihovo delovanje moteno za več kot 24 ur.
Možganske celice za svoje delovanje potrebujejo nenehno oskrbo s kisikom, ki jim ga dovaja kri. Če je krvni obtok v možganih moten zaradi zamašitve, to povzroči smrt celic v tistem delu možganov, ki ga zamašena žila ne more več oskrbeti s kisikom. To vodi v nastanek značilnih simptomov in znakov, ki lahko trajajo nekaj tednov, mesecev ali so celo trajni.
Če simptomi minejo v nekaj dneh ali tednih, pravimo, da so bolniki preboleli manjšo možgansko kap. Pri okrog 20 odstotkih bolnikov je vzrok možganske kapi krvavitev v določenem delu možganov, o ishemični možganski kapi pa govorimo, ko prekinitev krvnega obtoka v delu možganov traja tako dolgo, da povzroči trajno možgansko okvaro.
Za prepoznavanje znakov možganske kapi si velja zapomniti besedo GROM. G pomeni, da je prizadet govor, R pomeni, da delno ali popolnoma ohromi roka, O pomeni, da se povesi ustni kot obraza, M pa pomeni, da se mudi in da šteje vsaka minuta ter da je treba poklicati pomoč. Glavni dejavnik, ki vpliva na učinkovitost zdravljenja, je prav čas, v katerem bolniki pridejo do nevrologa.
Najpomembnejša preventiva je zdrav način življenja – vsakodnevna hoja, zdrava prehrana, pri čemer je pomembno uživanje dovolj sadja in zelenjave ter omejitev vnosa soli, maščob in sladkorja, vzdrževanje ustrezne telesne teže ter izogibanje kajenju in alkoholu. Zelo pomembne so tudi redne meritve krvnega tlaka, krvnih maščob in sladkorja ter srčnega utripa.
V Sloveniji bodo ob evropskem dnevu ozaveščanja o možganski kapi potekale številne aktivnosti. Organiziran bo bolnikom po možganski kapi prilagojen simboličen pohod ob žici iz Tivolija do Prešernovega trga v Ljubljani, kjer bo osrednja prireditev in na kateri bodo ves dopoldan dejavnosti preventive in zgodnjega prepoznavanja znakov možganske kapi.
“,STA,1557834960,1557834960,sl,14000,306,13999,43,0,NULL,,”Za preprečevanje možganske kapi pomembno prepoznavanje znakov bolezni”,za-preprecevanje-mozganske-kapi-pomembno-prepoznavanje-znakov-bolezni,Post,,1,0,1559476694,1559476695
592,14002,”Porast mišje mrzlice v Sloveniji”,”Nacionalni inštitut za javno zdravje (NIJZ) je letos v Sloveniji zaznal porast primerov mišje mrzlice”,”
Ljubljana, 20. maja (STA) – Nacionalni inštitut za javno zdravje (NIJZ) je letos v Sloveniji zaznal porast primerov mišje mrzlice, in sicer so do sedaj obravnavali že 75 primerov. Na novinarski konferenci so opozorili, kako se izogniti tovrstnim okužbam s preprostimi ukrepi ter na kaj moramo biti pozorni, da bolezen pravočasno zaznamo.
Tatjana Frelih z NIJZ je na novinarski konferenci potrdila, da so do 15. maja letos zabeležili 75 že laboratorijsko potrjenih primerov mišje mrzlice oziroma hemoragične mrzlice z renalnim sindromom (HMRS), in sicer pri 59 moških in 16 ženskah. Razmerje gre v prid moških, kar je po besedah Frelihove običajno zaradi poklicne izpostavljenosti.
Število primerov okužb je letos preseglo število primerov iz preteklih let v istem obdobju. Povprečna starost bolnikov pri moških je 43 let, pri ženskah pa 41 let. Največ primerov mišje mrzlice je po podatkih NIJZ v Jugovzhodni Sloveniji, in sicer 38. Sledi 19 primerov iz Podravske regije, štirje iz Koroške, po tri iz Osrednjeslovenske, Posavske in Pomurske regije, dve iz Savinjske regije ter po en primer iz Gorenjske, Primorsko-notranjske in Zasavske regije. Vse bolnike so hospitalizirali, nihče pa ni za posledicami mišje mrzlice umrl, je dodala Frelihova.
Tatjana Avšič Županc z inštituta za mikrobiologijo in imunologijo ljubljanske medicinske fakultete je pojasnila, kaj mišja mrzlica sploh je in da se porast ciklično pojavlja na tri do pet let. Porastu po njenih besedah botruje več zunanjih dejavnikov, kot je bila na primer letos blaga zima. Tako je večina glodavcev, ki pozimi živijo pod zemljo, lahko preživela, njihova populacija se je povečala in s tem se je povečalo tudi število potencialnih virov okužbe. Porast je bil tudi v letu 2012, ko so zabeležili 185 primerov.
Kot je dejala Avšič Župančeva, Slovenija sodi med ene najvišjih endemskih območij za HMRS, saj imamo tri različne viruse, ki povzročajo to bolezen, in sicer virus puumala, virus dobrava in še različica virusa dobrava, ki se mu reče virus dobrava-kurkino.
Ko bolnike epidemiološko anketirajo, sprašujejo po dejavnikih tveganja, je dejala Frelihova in izpostavila, da se večina bolnikov okuži pri opravljanju del v gozdu, nekateri pa pri čiščenju in pospravljanju kleti ter okolice domačij.
Tatjana Lejko Zupanc z ljubljanske infekcijske klinike je dejala, da se klinična slika bolezni sklada z imenom bolezni. Pojasnila je, da gre za virusno okužbo, pri kateri ločimo štiri različne faze, in da je inkubacijska doba dva do štiri tedne, ampak zelo redko dlje od 21 dni. Običajno se začne s splošnimi znaki virusne okužbe, kot so vročina oziroma mrzlica, bolečine v mišicah, glavobol, najbolj značilna za to bolezen pa je motnja vida.
Smrtnost zaradi mišje mrzlice je v Sloveniji zelo nizka, v zadnjih 35 letih je pri nas zabeleženih 15 primerov smrti. V zadnjih nekaj letih smrtnega primera ni bilo, nekaj bolnikov je v času zdravljenja potrebovalo dializo, nihče pa v zadnjih letnih ni ostal kronično na dializi, je še povedala Lejko Zupančeva in dodala, da hospitalizacije običajno trajajo teden dni.
Na NIJZ so opozorili, da naj dalj časa zaprte prostore pred začetkom čiščenja temeljito prezračimo in da naj prostor razkužimo z raztopino klornega razkužila, kjer enoto razkužila zmešamo z 10 enotami vode, ki jo razpršimo po iztrebkih in pustimo delovati 10 do 30 minut. Pri čiščenju svetujejo uporabo zaščitne maske in rokavic.
“,STA,1558353540,1558353540,sl,14002,306,14001,43,0,NULL,,”Porast mišje mrzlice v Sloveniji”,porast-misje-mrzlice-v-sloveniji,Post,,1,0,1559476806,1559477358
593,14004,”Kakovost dela zdravnikov trpi tudi zaradi nasilja na delovnem mestu”,”- Nasilje v zdravstvenem sistemu tako s strani bolnikov in svojcev kot tudi nadrejenih in sodelavcev je resen problem”,”
Ljubljana, 21. maja (STA) – Nasilje v zdravstvenem sistemu tako s strani bolnikov in svojcev kot tudi nadrejenih in sodelavcev je resen problem, je pokazala anketa med člani Zdravniške zbornice Slovenije. Kot so opozorili na današnji novinarski konferenci, zdravniki in zobozdravniki, ki so žrtve nasilja, trpijo zaradi posledic, ki lahko vplivajo na kakovost njihovega dela.
Rezultati ankete po besedah predsednice zdravniške zbornice Zdenke Čebašek-Travnik kažejo, da nasilju na delovnem mestu nikoli ni bilo izpostavljenih le devet odstotkov zdravnikov, medtem ko je med zobozdravniki takih četrtina. Nasilja v zdravstvenem sistemu sicer niso deležni samo zdravniki, ampak tudi drugi zdravstveni delavci.
Največ nasilja so zdravniki in zobozdravniki deležni s strani bolnikov. Zabeležili pa so tudi nasilje s strani sodelavcev in vodstva ustanove, v kateri so zaposleni, na primer z dodatnimi obremenitvami ali omejitvami pri koriščenju ugodnosti.
Najpogostejši povod za izbruh nasilja nad zdravniki s strani bolnikov in svojcev je organizacija dela (naročanje in predolgo čakanje v čakalnici), sledijo psihični vzroki povzročitelja in neupravičena zahteva po napotitvi.
Dobrih 17 odstotkov anketiranih je že bilo žrtev fizičnega nasilja. A je veliko več verbalnega nasilja, kot so grožnje, poniževanje, pa tudi znašanja nad predmeti, na primer loputanje z vrati in tolčenje s pestjo po mizi, je opisala članica delovne skupine Ne dopuščajmo nasilja Mojca Zvezdana Dernovšek.
“Nasilje ni dopustno. Dobre prakse iz tujine kažejo, da se preprečevanje nasilja obnese,” je poudarila. Najenostavneje je to doseči z usposobljenimi zdravstvenimi delavci, da zgodaj zaznajo dejavnike tveganja za nasilno vedenje in hitro ukrepajo z umirjanjem okoliščin.
Tudi zato so na zdravniški zbornici v okviru delovne skupine izdelali priporočila za preprečevanje nasilnih incidentov in okvirne usmeritve za zaščito zdravništva na delovnem mestu. Med drugim svetujejo, da je z organizacijskimi ukrepi za oblikovanje varnega delovnega okolja treba začeti že v svojem zdravstvenem timu z dogovorjenimi znamenji za priklic pomoči in postavitvijo ambulante, ki omogoča umik.
Nasilju so sicer najbolj izpostavljeni zaposleni na urgenci ter psihiatriji in zdravniki pri samostojnem delu na terenu, je izpostavila vodja delovne skupine Nena Kopčavar Guček. Izkušnje še kažejo, da so nasilju bolj izpostavljeni mlajši zdravniki, ki še nimajo izkušenj z različnimi situacijami. Z različnimi izobraževanji bodo zato v okviru delovne skupine poskušali zaposlene v zdravstvu opolnomočiti za ravnanje v takih dogodkih.
“Samo zdravnik, ki se počuti varnega, lahko svoje delo opravi kakovostno, varno in strokovno,” je poudarila Kopčavar Gučkova. Zdravstveni delavci se po njenih besedah zavedajo, da so ljudje, ki vstopajo v zdravstveni sistem, bolni, prestrašeni in v stresni situaciji, a to ne opravičuje nasilja v njihovem delovnem okolju.
Na zbornici si ob tem želijo, da bi država, podobno kot sosednja Hrvaška, v kazenski zakonik dodala novo obliko kaznivega dejanja, to je nasilje proti zdravstvenim delavcem. “S tem bi dala jasen znak vsem, ki nasilje izvajajo, da jih bo doletel kazenski pregon, zdravstvenim delavcem pa, da je nasilne dogodke vredno prijavljati organom pregona,” je še izpostavila predsednica zbornice.
“,STA,1558440060,1558440060,sl,14004,306,14003,43,0,NULL,,”Kakovost dela zdravnikov trpi tudi zaradi nasilja na delovnem mestu”,kakovost-dela-zdravnikov-trpi-tudi-zaradi-nasilja-na-delovnem-mestu,Post,,1,0,1559476934,1559476935
594,14006,”Letos v Sloveniji 12 primerov ošpic”,”V Sloveniji smo letos zabeležili 12 primerov ošpic. Po podatkih NIJZ gre pri zadnjih treh primerih za vnesene ošpice. “,”
Ljubljana, 23. maja (STA) – V Sloveniji smo letos zabeležili 12 primerov ošpic. Po podatkih NIJZ gre pri zadnjih treh primerih za vnesene ošpice. Zboleli sta dve odrasli osebi in en otrok, pri čemer otrok ni bil cepljen, cepilni status odraslih oseb pa ni znan. V letu 2018 smo v državi zabeležili devet primerov ošpic, osem primerov v letu 2017 in en primer v letu 2016.
Ministrstvo za zdravje je v odgovoru na poslansko vprašanje Nade Brinovšek (SDS) pojasnilo, da je v Sloveniji večina primerov ošpic vnesenih ali povezanih z mednarodnimi potovanji. Zbolijo predvsem necepljene osebe, ki potem prenesejo okužbo na nezaščiteno osebo, kar ima lahko za posledico izbruh ošpic. Zadnjo smrt zaradi ošpic smo v državi zabeležili v večji epidemiji, ki je potekala med letoma 1994 in 1995.
Precepljenost predšolskih otrok v Sloveniji se je v preteklih letih zniževala, v letu 2017 pa je bilo vendarle zaznati rahel dvig precepljenosti. Delež cepljenih proti davici, tetanusu, oslovskemu kašlju, okužbam s Hib in otroški paralizi je tako znašal 94,2 odstotka (v letu 2016 94,1 odstotka), delež cepljenih proti ošpicam, mumpsu in rdečkam je bil 93,2 odstotka (v letu 2016 92,3 odstotka).
Po podatkih Nacionalnega inštituta za javno zdravje (NIJZ) je precepljenost proti ošpicam v Sloveniji še vedno relativno dobra. V letu 2018 je znašala 93,1 odstotka in v nobeni zdravstveni regiji ni padla pod 90 odstotkov. Za doseganje kolektivne imunost je potrebna 95-odstotna precepljenost. Glede na relativno dobro precepljenost skozi več desetletij je večje širjenje ošpic pri nas malo verjetno. Možni pa so omejeni izbruhi, še posebej v kolektivih, kjer je precepljenost izrazito nizka.
Z namenom povečanja deleža cepljenih v Sloveniji so na ministrstvu za zdravje ustanovili delovno skupino, ki jo poleg predstavnikov ministrstva in zdravstvenega inšpektorata sestavljajo tudi primarni pediatri, šolski zdravniki in drugi strokovnjaki javnega zdravja ter medicine dela. V okviru delovne skupine so oblikovali načrt ukrepov za povečanje deleža cepljenih, ki se glede na epidemiološko situacijo sproti posodablja.
Rezultat delovanja delovne skupine in boljše koordinacije je po navedbah ministrstva okrepljeno komuniciranje, tako v strokovni kot v laični javnosti. Izvedli so številne medijske aktivnosti, med njimi kampanjo promocije cepljenja proti gripi, kampanjo ob evropskem tednu cepljenja, aktivnosti med študenti medicine in veterine ter druge.
Tudi v prihodnje bodo na ministrstvu nadaljevali z začrtanimi ukrepi, ki so se do sedaj izkazali za učinkovite in še naprej dobro medsebojno sodelovali, predvsem z epidemiološko službo NIJZ, pediatri in šolskimi zdravniki ter drugimi zdravstvenimi delavci. Skupni cilj je povečati delež cepljenih v Sloveniji in okrepiti zaupanje v znanost in stroko.
Vzrok za porast števila obolelih z ošpicami v Evropi in svetu je torej predvsem prenizka precepljenost proti ošpicam, ki so ena najbolj nalezljivih bolezni, poleg tega pa k hitremu širjenju zagotovo prispeva tudi velika mobilnost prebivalstva in odklonilen odnos do cepljenja s strani nekaterih staršev, ki cepljenju, kot najbolj varni in učinkoviti zaščiti, ne zaupajo.
V mnogih predelih sveta so ošpice, kljub izvajanju programov za njihovo odpravo, še vedno pogosta bolezen. Razširjene so predvsem v Aziji, na Pacifiku, v Afriki pa tudi v Evropi. V prvih dveh mesecih leta 2019 so iz 42 držav evropske regije Svetovne zdravstvene organizacije (WHO) poročali o 34.300 primerih ošpic, vključno s 13 smrtnimi primeri iz Albanije, Romunije in Ukrajine.
Večina primerov je prav iz Ukrajine, kjer je bilo prijavljenih več kot 25.000 primerov. V Belgiji, Bosni in Hercegovini, Franciji, Gruziji, Nemčiji, Italiji, Romuniji, Rusiji, Srbiji in Ukrajini, so ošpice endemične.
V letu 2018 je evropska regija WHO poročala o skupno 82.596 primerih ošpic in 72 povezanih smrtnih primerih, kar predstavlja precejšen porast v primerjavi z letom 2017, ko je zbolelo 22.360 oseb in letom 2016, ko je bilo prijavljenih 5133 primerov bolezni. Največ obolelih je bilo v Italiji, Romuniji, Grčiji in Franciji.
“,STA,1558612980,1558612980,sl,14006,306,14005,43,0,NULL,,”Letos v Sloveniji 12 primerov ošpic”,letos-v-sloveniji-12-primerov-ospic,Post,,1,0,1559477061,1559477062
595,14008,”V okviru projekta Krepitev zdravja za vse številne preventivne aktivnost”,”V Ljubljani danes poteka delovno srečanje v okviru projekta Krepitev zdravja za vse.”,”
Ljubljana, 23. maja (STA) – V Ljubljani danes poteka delovno srečanje v okviru projekta Krepitev zdravja za vse. Tokrat so v ospredju preventivne aktivnosti in pristopi, ki jih za otroke, mladostnike, nosečnice ter mlade mamice in njihove novorojenčke razvijajo in nadgrajujejo v okviru projekta. Zdrav začetek je namreč neprecenljiva popotnica za dobro zdravje v odrasli dobi.
Slednje je v uvodnem delu današnjega dogodka poudarila generalna direktorica direktorata za javno zdravje na ministrstvu za zdravje Mojca Gobec. Po njenih besedah v okviru projekta uvajajo in testirajo nove pristope za krepitev zdravja in zmanjševanje neenakosti v zdravju med prebivalci vseh starostih skupin. Cilj pa je krepitev zdravja prebivalstva in opolnomočenje ljudi, da čim dlje ostanejo zdravi, nato pa na koncu uživajo tudi aktivno starost.
V okviru današnjega srečanja posebno pozornost namenjajo novostim, namenjenim otrokom in mladostnikom. Želijo jim pomagati, da razvijejo zdrave navade, ki zmanjšajo tveganja v odraslem življenju in starosti. Čeprav je po besedah Gobčeve blaginja otrok v Sloveniji primerljiva z blaginjo otrok na Norveškem in smo na tem področju v svetovnem vrhu, pa to ne pomeni, da ni treba razmišljati o uvajanju sprememb. V projektu pa se bo pokazalo, kaj deluje.
Načini, kako so v okoljih pristopili k spodbujanju prebivalcev za zdrave izbire, so navdušujoči že sedaj, je ugotavljala direktorica Nacionalnega inštituta za javno zdravje (NIJZ) Nina Pirnat. Inštitut namreč operativno vodi projekt, medtem ko ga sofinancirata ministrstvo za zdravje in EU.
Pirnatova je izrazila zadovoljstvo, da so se na današnjem srečanju zbrali v tako velikem številu. Med udeleženci pa so bili tako predstavniki ministrstva za zdravje, NIJZ, ministrstva za izobraževanje, znanost in šport, kot tudi sodelujoči v projektnih timih, predstavniki zdravstveni domov, šol in staršev.
Zbrane je uvodoma pozdravila tudi podpredsednica Zveze aktivov svetov staršev Lara Romih, ki je poudarila, da podpirajo projekte, ki so naravnani preventivno in v enaki meri ter enako kakovostno dosežejo vse otroke po državi. Po njenih besedah so za ohranitev koncepta organiziranih sistematskih pregledov, širše pa za preventivno zdravstveno varstvo v navezavi s šolo.
Prav vključevanje družine in konstruktiven dialog z vrtci, šolami in širšo skupnostjo je sicer usmeritev projekta. Za učinkovito preventivno zdravstveno varstvo otrok in mladostnikov je namreč zelo pomemben interdisciplinarni pristop, ki omogoča sodelovanje vseh zdravstvenih, vzgojno varstvenih, izobraževalnih in drugih struktur v skupnosti, ki pripomorejo k učinkoviti podpori k ohranjanju zdravja otrok in mladostnikov ter drugih ranljivih skupin.
Rade Pribaković Brinovec z NIJZ, ki vodi projekt Model skupnostnega pristopa za krepitev zdravja in zmanjševanje neenakosti v zdravju v lokalnih skupnostih, je poudaril, da so ponosni na multidisciplinarnost. Izpostavil je skupnostni pristop, program družinske obravnave in pristop k ranljivim skupinam, kjer je omenil izvedbo dodatnih preventivnih obiskov v družinah, ki so prepoznane kot ranljive.
Na današnjem srečanju so predstavili tudi nekatere konkretne izkušnje centrov za krepitev zdravja in na novo vpeljanih strokovnih skupin v zdravstvenih domovih in lokalnih skupnostih, ki nudijo podporo izvajanju programa. Direktor Zdravstvenega doma Slovenske Konjice Dejan Verhovšek je denimo pojasnil, da so pri njih analizirali razmere in kot ranljivo skupino prepoznali albanske žene in otroke ter jih aktivno vključili v preventivne programe s pomočjo medkulturnega mediatorja za albanski jezik. Prednost takšnega pristopa pa je po njihovih izkušnjah tudi izboljšanje komunikacije med različnimi izvajalci in strokovna podporo izvajalcem preventive.
Ob zagotavljanju enakosti v zdravstveni oskrbi ranljivih skupin so med novostmi in nadgradnjami danes omenili tudi dodatne preventivne aktivnosti patronažne službe, vključno s presejanjem na poporodno depresijo, nadgradnje pri preventivnih pregledih otrok in mladostnikov ter aktivnosti, namenjene mladim, ki ne zaključijo uspešno šolanja in niso zaposleni.
V projektu sicer sodeluje 25 zdravstvenih domov iz Slovenije, 16 iz vzhodne in devet iz zahodne kohezijske regije.
“,STA,1558613100,1558613100,sl,14008,306,14007,43,0,NULL,,”V okviru projekta Krepitev zdravja za vse številne preventivne aktivnost”,v-okviru-projekta-krepitev-zdravja-za-vse-stevilne-preventivne-aktivnost,Post,,1,0,1559477172,1559477173
596,14010,”WHO priznal izgorelost za bolezen”,”Svetovna zdravstvena organizacija (WHO) je uvrstila izgorelost v mednarodno klasifikacijo bolezni”,”
Ženeva, 27. maja (STA) – Svetovna zdravstvena organizacija (WHO) je uvrstila izgorelost v mednarodno klasifikacijo bolezni, s čimer bodo strokovnjakom olajšali prepoznavanje te bolezni, ki je povezana s stresom na delovnem mestu. Odločitev so sprejeli na letnem srečanju držav članic v Ženevi, ki ga bodo sklenili v torek, poroča francoska tiskovna agencija AFP.
V zadnji posodobitvi kataloga bolezni in poškodb je WHO prepoznal izgorelost kot “sindrom, ki se pojavi kot rezultat kroničnega stresa na delovnem mestu, ki se ga ni primerno obravnavalo”.
Sindrom se izraža na tri načine in sicer kot utrujenost in občutek pomanjkanja energije, povečan mentalni odpor do dela ali negativizem in cinizem do dela ter pomanjkanje profesionalne učinkovitosti.
“Izgorelost je povezana predvsem s službenim področjem in naj se ne bi uporabljala pri opisovanju izkušenj z drugih področij življenja,” še piše v klasifikaciji.
Osnutek posodobljene klasifikacije so oblikovali lani po preučitvi priporočil zdravstvenih strokovnjakov iz celega sveta. Posodobljeno klasifikacijo, ki se imenuje ICD-11, so potrdili v soboto.
To je prvič, da so v klasifikacijo vključili izgorelost, je dejal tiskovni predstavnik WHO Tarik Jašarević.
V ICD-11, ki bo stopil v veljavo januarja 2022, so med drugim uvrstili tudi kompulzivno spolno vedenje in zasvojenost z videoigrami.
“,”Jaka Verbic Miklic”,1558958880,1558958880,sl,14010,306,14009,43,0,NULL,,”WHO priznal izgorelost za bolezen”,who-priznal-izgorelost-za-bolezen,Post,,1,0,1559477344,1559477345
597,14012,Transparentnost,”Transparentnost je osnovni pogoj za sodelovanje z zdravstvenimi delavci ter organizacijami in obenem temelj za razvoj novih, inovativnih zdravil in metod zdravljenja v korist bolnikov. “,”
Transparentnost je osnovni pogoj za sodelovanje z zdravstvenimi delavci ter organizacijami in obenem temelj za razvoj novih, inovativnih zdravil in metod zdravljenja v korist bolnikov. Prav tu se poslanstvi farmacevtske industrije in zdravstvene stroke prepletata, zato si predstavniki inovativne farmacevtske industrije, združeni pod okriljem EFPIA – evropske zveze inovativnih farmacevtskih družb, prizadevamo za preglednost in razumevanje vzajemnosti našega, za razvoj novih in izboljšanih oblik zdravljenja, nujnega sodelovanja.
Pomemben korak pri zagotavljanju javnega vpogleda v interakcije z zdravstvenimi delavci in organizacijami so podjetja, članice Mednarodnega foruma znanstvenoraziskovalnih družb, naredila s samoregulacijo oziroma s sprejetjem Kodeksa transparentnosti. V okviru določil kodeksa, ki podrobno ureja in opredeljuje odnose družb članic z zdravstveno stroko, od leta 2016 članice in Forum javno objavljamo prenose vrednosti zdravstvenim delavcem in zdravstvenim organizacijam.
Kodeks, danes vitalni del vsakodnevnih praks sodelovanja z zdravstveno stroko, je bil pozitivno sprejet tako s strani zdravstvenih organizacij kot zdravstvenih delavcev. Še več, naša vloga pri zagotavljanju večje preglednosti je v mednarodnem prostoru postala primer dobre prakse.
Kodeks je v številnih evropskih državah prinesel pobudo za razvoj sistemskih rešitev, ki zagotavljajo transparentnost na nacionalnem nivoju. Od uvedbe kodeksa je namreč približno tretjina evropskih držav, iz katerih izhajajo družbe – podpisnice kodeksa, javno objavo prenosov vrednosti podprlo z ustrezno zakonodajo in pravilniki. V Sloveniji je pregled nad interakcijami z zdravstvenimi organizacijami in zdravstvenimi delavci še vedno del samoregulacije, zato bomo z aktivno vlogo pri zagotavljanju preglednosti teh interakcij nadaljevali – tudi v smeri zagotavljanja učinkovite lokalne zakonodaje.
Več o Kodeksu transparentnosti. Dodatne informacije najdete na spletni strani Efpie.
“,”Jaka Verbic Miklic”,1559479560,1559479560,sl,14012,306,14011,43,0,NULL,,”Transparency “,transparency,Post,/sites/43/files/images/Fokus/Magnify.jpg,0,0,1559479619,1559834547
598,14012,”Transparency “,”Transparency is a prerequisite for successful collaboration with healthcare professionals and organisations and a foundation for developing new innovative medicines and treatment methods to benefit patients. This is where the missions of the pharmaceutical industry and medical profession intertwine so representatives of innovative pharmaceutical industry organised within EFPIA – the European Federation of Pharmaceutical Industries and Associations – will continue to strive for transparency and understanding”,”
Transparency is a prerequisite for successful collaboration with healthcare professionals and organisations and a foundation for developing new innovative medicines and treatment methods to benefit patients. This is where the missions of the pharmaceutical industry and medical profession intertwine so representatives of innovative pharmaceutical industry organised within EFPIA – the European Federation of Pharmaceutical Industries and Associations – will continue to strive for transparency and understanding of the mutual nature of our essential collaboration towards new and improved forms of treatment.
Companies members of the Forum of International Research and Development Pharmaceutical Companies have made an important step in the assurance of public oversight over interactions with healthcare professionals and organisations with their self-regulatory adoption of the Disclosure Code. Under the auspices of the Code which regulates and determines relations of member companies with the medical profession members and the Forum have publicly disclosed their transfers of value to healthcare professionals and organisations since 2016.
The Code, today a vital part of daily practices of cooperating with the medical profession, was accepted positively by both healthcare organisations and professionals. Even more, our active role in the assurance of greater transparency has become an example of best practice in the international arena.
The Code has created an incentive in many European countries for the development of systemic solutions that assure transparency at a national level. Since the introduction of the Code about a third of European countries that are home to companies – signatories of the Code – have supported public disclosure of transfers of value by appropriate legislation and regulations. In Slovenia the oversight over interactions with healthcare professionals and organisations remains within the domain of self regulation so our active role in the assurance of transparency in these interactions will continue, as will our support for assuring effective local legislation.
More information about the Disclosure Code. Additional information is available at the official web page of EFPIA.
“,”Jaka Verbič Miklič”,1559479800,1559479800,en,14012,306,14011,43,0,NULL,,”Transparency “,transparency,Post,/sites/43/files/images/Fokus/Magnify.jpg,0,0,1559479619,1559834547
600,14025,”Javna objava prenosov vrednosti ZD in ZO 2018”,”Objava zajema podatke o prenosih vrednosti v preteklem koledarskem letu 2018. “,”
Skladno z določili Kodeksa transparentnosti članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ (v nadaljevanju Forum) tudi v letošnjem letu javno objavljajo prenose vrednosti zdravstvenim delavcem in zdravstvenim organizacijam. Kot določa Kodeks, bodo vse inovativne farmacevtske družbe, članice Foruma, podatke objavile do vključno 30. junija 2019.
Objava zajema podatke o prenosih vrednosti v preteklem koledarskem letu in na spletnih straneh posameznih članic ponuja vpogled v prenose v obdobju od 1. januarja do 31. decembra 2018. Po določilih zveze EFPIA se podatki javno objavljajo periodično, vsako leto, najkasneje do konca meseca junija, in sicer za preteklo koledarsko leto.
Javna objava prenosov vrednosti vključuje podatke o vrednostih vseh sredstev, ki so jih prejeli posamezni zdravstveni delavci in zdravstvene organizacije, s katerimi sodelujejo posamezne članice Foruma ali Forum – bodisi neposredno ali prek tretjih oseb, kot so agencije za organizacijo dogodkov. Javna objava vsebuje tudi informacije o vrsti dejavnosti ali tipu podpore:
Te prenose vsaka članica Foruma objavi v slovenskem jeziku na svoji lokalni, regijski ali mednarodni spletni strani.
Vsi prenosi zdravstvenim organizacijam, kamor se po Kodeksu transparentnosti uvrščajo javne zdravstvene institucije, zdravniška društva, združenja, zbornice in zasebna podjetja (d.o.o. in s.p.), so skladno z zakonodajo objavljeni individualno s polnim nazivom prejemnika.
Pri prenosih vrednosti posameznim zdravstvenim delavcem, fizičnim osebam, je objava v skladu z Zakonom o varstvu osebnih podatkov mogoča samo na podlagi predhodnega pisnega soglasja zdravstvenega delavca. V nasprotnem primeru se prenos objavi v skupinski obliki, pri čemer je v vsaki kategoriji navedeno število prejemnikov ter skupni znesek takim prejemnikom.
Podatki o plačilih na področju raziskav in razvoja zaradi varstva konkurence ter inovacij, ki jih razvijajo posamezne družbe, skladno z zakonodajo ne morejo biti objavljeni drugače kot v skupinski obliki.
Podatki, objavljeni v tem poročilu, so izraz naših prizadevanj za ravnanje skladno z zahtevami Kodeksa transparentnosti in zveze EFPIA (Disclosure Code). Če se kljub našim prizadevanjem za zagotovitev natančnih objav zgodi, da poročilo vsebuje nepopolne ali netočne podatke, bomo to raziskali in morebitne napačne podatke ustrezno popravili.
PODATKI O PRENOSU VREDNOSTI ZDRAVSTVENIM DELAVCEM IN ZDRAVSTVENIM ORGANIZACIJAM S STRANI MEDNARODNEGA FORUMA ZNANSTVENORAZISKOVALNIH FARMACEVTSKIH DRUŽB, GIZ, ZA LETO 2018
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ, je v koledarskem letu 2018 sodeloval z 8 različnimi organizacijami: eno organizacijo je podprl z donacijo oziroma prispevkom za izobraževanje, sponzorsko prispeval k izvedbi strokovnih srečanj in simpozijev trem zdravstvenim organizacijam, petim organizacijam pa je poravnal stroške, povezane z izvajanjem storitev in svetovanjem.
Skupna vrednost prenosov Foruma zdravstvenim organizacijam je v letu 2018 znašala 37.374,39 EUR. Prenosov na nivoju posameznih zdravstvenih delavcev ali na področju raziskav in razvoja v letu 2018 ni bilo.
Javno objavljeni podatki zajemajo prenose vrednosti, ki so bili v finančnem sistemu Foruma dejansko izvršeni v koledarskem letu 2018, to je od vključno 1. januarja 2018 do vključno 31. decembra 2018.
Prenosi posameznim zdravstvenim delavcem so navedeni kot bruto vrednosti tovrstnih pogodb.
Prenosi zdravstvenim organizacijam so navedeni kot neto zneski tovrstnih pogodb, ki ne vključujejo DDV.
Prenosi vrednosti, povezani s potnimi stroški, nastanitvami in stroški prijav, so objavljeni v podatkih za koledarsko leto, v katerem so dejavnosti potekale.
Opombe k tabeli “Podatki o prenosu vrednosti zdravstvenim delavcem in zdravstvenim organizacijam s strani Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ, za leto 2018”:
1 Področje opredeljuje Kodeks transparentnosti, člen 3.1.1.1
2 Področje opredeljuje Kodeks transparentnosti, člen 3.1.1.2 in 3.1.2.1
3 Področje opredeljuje Kodeks transparentnosti, člen 3.1.1.3 in člen 3.1.2.2
4 Področje opredeljuje Kodeks transparentnosti, člen 3.2
5 Področje opredeljuje Kodeks transparentnosti, člen 3.2
6 Področje opredeljuje Kodeks transparentnosti, člen 3.4
Oznaka “/” pomeni, da na tem področju ni bilo izvedenih prenosov vrednosti.
Vsi navedeni zneski predstavljajo skupne vrednosti za leto 2018.
Vse navedene transakcije so bile izvršene v koledarskem letu 2018, torej od vključno 1. januarja 2018 do vključno 31. decembra 2018.
Vrednosti prenosov sredstev zdravstvenim delavcem v letu 2018 so navedene v bruto zneskih.
Vrednosti prenosov sredstev zdravstvenim organizacijam so navedene v neto zneskih (brez DDV).
Zdravstvene organizacije (ZO) Kodeks transparentnosti opredeljuje kot vse samostojne podjetnike (s.p.) in pravne osebe, ki so zdravstvena, medicinska ali znanstvena združenja ali organizacije (ne glede na pravno ali organizacijsko obliko), kot so bolnišnice, klinike, fundacije, univerze ali druge izobraževalne ustanove ali akademska združenja (razen organizacij bolnikov v okviru Kodeksa sodelovanja z združenji bolnikov) ali preko katerih eden ali več zdravstvenih delavcev izvaja svoje storitve.
Zdravstvene delavce (ZD) Kodeks transparentnosti opredeljuje kot vse fizične osebe, ki so članice zdravstvene, zobozdravstvene, farmacevtske ali negovalne stroke ali vse druge osebe, ki lahko pri opravljanju svojih poklicnih dejavnosti predpišejo, kupijo, zagotovijo ali odmerijo zdravilo in katerih primarna praksa, naslov glavne poklicne dejavnosti ali sedež je v Republiki Sloveniji.
V izogib dvomom opredelitev ZD vključuje vse uradnike ali zaposlene v vladni agenciji ali drugi organizaciji (ne glede na to, ali je v zasebnem ali javnem sektorju), ki lahko predpišejo, kupijo, zagotovijo ali odmerijo zdravila, in vse zaposlene v Republiki Sloveniji, katerih glavna poklicna dejavnost je izvajanje zdravstvene dejavnosti, to pa ne vključuje vseh drugih zaposlenih v Republiki Sloveniji in prodajalcev na debelo ali distributerjev zdravil.
Kodeks transparentnosti je v celoti dostopen na:
http://www.farmaforum.si/sl/o-forumu/kodeksi/kodeks-transparentnosti
“,”Jaka Verbic Miklic”,1560227880,1560227880,sl,14025,306,14024,43,0,NULL,,”Javna objava prenosov vrednosti ZD in ZO 2018″,javna-objava-prenosov-vrednosti-zd-in-zo-2018,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1560227912,1560229593
601,14025,”Public disclosure of transfers of value”,”The publication includes data on transfers of value in the past calendar year and provides disclosure of transfer in the period from 1 January to 31 December 2018″,”
Pursuant to provisions from the Disclosure Code, members of The Forum of International Research and Development Pharmaceutical Companies, GIZ (hereinafter referred to as: Forum) are this year again publishing the values of transfers to healthcare professionals and healthcare organizations, respectively. As provided for under the Code, all innovative pharmaceutical companies that are members of the Forum will publish their data by up to 30 June 2019 inclusive.
The publication includes data on transfers of value in the past calendar year and provides disclosure of transfer in the period from 1 January to 31 December 2018 on the websites of individual members. According to EFPIA provisions, data is disclosed publicly periodically, on annual basis no later than the end of June, for the past calendar year.
Public disclosure of transfers of value includes data on the value of all funds received by individual healthcare professionals and healthcare organizations that collaborate with individual Forum members or the Forum itself, either directly or through third parties such as event organization agencies. Disclosure also includes information on the type of activity or support:
Each Forum member publishes these transfers in Slovenian at its local, regional or international website.
All transfers to healthcare organizations, which under the Disclosure Code include public healthcare institutions, physician associations and societies, chambers and private companies (d.o.o. and s.p.), are published individually, with the full name of the recipient.
Transfers of value to individual healthcare professionals who are natural persons are, pursuant to the Personal Data Protection Act, only possible on the basis of advance written consent of the healthcare professional. If such consent is withheld, transfers are published in a group or aggregate form, with the number of recipients and total amount listed separately for each category of such recipients.
Data on payments in the field of research and development cannot be published otherwise than in a group or aggregated form due to legislative protection of competition and innovations being developed by separate companies.
The data published in this report is an expression of our efforts towards observing the provisions of the EFPIA Disclosure Code. Should it be found that the report contains incomplete or inaccurate data in spite of our best efforts towards assuring accurate publications, we will research the situation and appropriately correct false data.
DATA ON TRANSFERS OF VALUE TO HEALTHCARE PROFESSIONALS AND HEALTHCARE ORGANISATIONS FROM THE FORUM OF INTERNATIONAL RESEARCH AND DEVELOPMENT PHARMACEUTICAL COMPANIES, EIG, FOR 2018
In calendar year 2018, the Forum of International Research and Development Pharmaceutical Companies, EIG, collaborated with 8 different organizations: one organization was supported in form of a donation/contribution for education, three healthcare organizations were granted contributions for the implementation of events, and five organizations received reimbursements, related to the provision of services and consulting.
The total value of the Forum’s transfers to healthcare organizations in the year 2018 amounted to 37,374.39 EUR. There were no transfers at the level of individual healthcare professionals or in the field of research and development in 2018.
Publicly disclosed data includes transfers of value actually executed in the financial system of the Forum in the 2018 calendar year, from 1 January 2018 to 31 December 2018.
Transfers to individual healthcare workers are listed as gross values of the relevant contracts.
Transfers to healthcare organizations are listed as net amounts of the relevant contracts without VAT.
Transfers of value pertaining to travel expenses, accommodation and registration fees are published in the calendar year in which activities actually took place.

Notes to the table ” Data on transfers of value to healthcare professionals and healthcare organizations from the Forum of international research and development pharmaceutical companies, EIG, for 2018″:
1 Field regulated by Disclosure Code, Article 3.1.1.1
2 Field regulated by Disclosure Code, Article 3.1.1.2 in 3.1.2.1
3 Field regulated by Disclosure Code, Article 3.1.1.3 and Article 3.1.2.2
4 Field regulated by Disclosure Code, Article 3.2
5 Field regulated by Disclosure Code, Article 3.2
6 Field regulated by Disclosure Code, Article 3.4
The “/” mark denotes no transfers of value were performed.
All listed amounts represent total values for 2018.
All listed transactions were performed in the 2018 calendar year, from and including 1 January 2018 to and including 31 December 2018.
Amounts of transfers of value to HCPs in 2018 are listed as gross amounts.
Amounts of transfers of value to HCOs in 2018 are listed as net amounts (not including VAT).
The Disclosure Code defines healthcare organizations (HCO) as all single entrepreneurs and any legal person that is a healthcare, medical or scientific association or organization (irrespective of the legal or organizational form) such as a hospital, clinic, foundation, university or other teaching institution or learned society (except for patient organizations within the scope of the EFPIA PO Code) or through which one or more HCPs provide services.
The Disclosure Code defines healthcare professionals (HCP) as any natural person that is a member of the medical, dental, pharmacy or nursing professions or any other person who, in the course of his or her professional activities, may prescribe, purchase, supply, recommend or administer a medicinal product and whose primary practice, principal professional address or place of incorporation is in the Republic of Slovenia.
For the avoidance of doubt, the definition of HCP includes any official or employee of a government agency or other organization (whether in the public or private sector) that may prescribe, purchase, supply or administer medicinal products and any person employed in the Republic of Slovenia whose primary occupation is that of a practicing HCP, but excludes all other persons employed in the Republic of Slovenia and a wholesaler or distributor of medicinal products.
The Disclosure Code is available in full at:
http://www.farmaforum.si/en/about-forum/codes/disclosure-code
“,”Jaka Verbič Miklič”,1560228000,1560228000,en,14025,306,14024,43,0,NULL,,”Javna objava prenosov vrednosti ZD in ZO 2018″,javna-objava-prenosov-vrednosti-zd-in-zo-2018,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1560227912,1560229593
608,14169,”Vabilo: Osma strateška konferenca Vrednost inovacij”,”Izziv zdravstva v naslednjem stoletju bo povečanje pogostosti kroničnih bolezni”,”
Eden izmed glavnih izzivov zdravstva v 21. stoletju bo povečanje pogostosti kroničnih bolezni kot posledica podvojitve deleža starejše populacije. Kronične bolezni namreč spadajo med vodilne vzroke smrti in prezgodnje umrljivosti. Hkrati zaradi dolgotrajnega poteka in pogosto hude prizadetosti povzročajo tudi veliko družbeno breme, s tem pa je povezana rast tako posrednih kot neposrednih stroškov.
Kako se bomo soočili s tovrstnimi izzivi? Kakšna je vloga različnih deležnikov v zdravstvu: vloga JAZMP, vloga in pogled plačnika na vrednotenje zdravstvenih tehnologij pri dostopnosti inovativnih terapij, vloga znanstvenoraziskovalnih farmacevtskih družb kot prinašalcev teh inovacij? Kakšna je vloga novih dostopnih digitalnih orodij pri sodobni obravnavi bolnika?
O teh vprašanjih bo tekla diskusija na osmi strateški konferenci Vrednost inovacij, ki bo
v Jakopičevi dvorani ZZZS (Miklošičeva 24., Ljubljana),
v torek, 19. novembra 2019, z začetkom ob 12. uri.
Več informacij in prijave: www.vrednostinovacij.si
“,”Rok Knafelj”,1572255600,1572255600,sl,14169,306,14166,43,0,NULL,,”Vabilo: osma strateška konferenca Vrednost inovacij”,vabilo-osma-strateska-konferenca-vrednost-inovacij,Post,/sites/43/files/images/news/VoI_2019a.png,0,1,1572252934,1580454759
611,14180,”Izzivi zdravja in razvoja v 21. stoletju”,”Čas za ambicije”,”
Ljubljana, 19. november 2019 – Čas je za ambicije, so se strinjali udeleženci 8. Strateške konference Vrednost inovacij: Izzivi zdravja in razvoja v 21. stoletju. Da bi zdravstveni sistem ustrezneje naslovil potrebe bolnikov po učinkovitem in dostopnem zdravstvenem varstvu in izzive, ki jih prinašajo demografske spremembe, porast kroničnih nenalezljivih bolezni, napredek znanosti in bolniku prilagojena medicina, potrebuje modernizacijo. Razvojno naravnan zdravstveni sistem in dobro dostopnost do inovacij je mogoče doseči zgolj z uvajanjem celostnega vrednotenja zdravstvenih tehnologij in novih zdravil, ki upošteva tako izdatke, kot tudi neposredne in posredne učinke, ki jih imajo za posledico znotraj in izven zdravstvenega sistema. Celostno vrednotenje inovacij plačniku zdravstvenih storitev zagotavlja pomoč pri odločanju o porabi sredstev ter potrebno transparentnost in odgovornost vseh deležnikov v zdravstvu. Sistemske ukrepe za modernizacijo zdravstvenega sistema naj v sodelovanju z vsemi deležniki v zdravstvu načrtuje in usmerja Ministrstvo za zdravje.

Predavatelji in razpravljavci 8. Strateške konference Vrednost inovacij: Izzivi zdravja in razvoja v 21. stoletju – čas za ambicije, ki je v organizaciji Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ, potekala na Zavodu za zdravstveno zavarovanje Slovenije, so poudarili pomen modernizacije zdravstvenega sistema. Staranje prebivalstva in porast kroničnih nenalezljivih bolezni, ki so odgovorne za prezgodnjo umrljivost in do 80 odstotkov vseh smrti, predstavljata za posameznike in družbo izziv, za zdravstvo pa veliko finančno breme. Generalna direktorica Direktorata za javno zdravje Ministrstva za zdravje Mojca Gobec je predstavila ukrepe za zmanjševanje bremena kroničnih nenalezljivih bolezni:
»V Sloveniji smo v zadnjih desetletjih dosegli pomembno podaljšanje življenjske dobe, zmanjšala se je umrljivost zaradi srčno – žilnih bolezni. S presejalnimi programi za zgodnje odkrivanje raka na materničnem vratu (ZORA), dojki (DORA) in debelem črevesu in danki (SVIT) se je zmanjšala incidenca teh rakov ter tudi podaljšalo preživetje. Sistem zdravstvenega varstva se prilagaja spremembam in potrebam hitro starajočega se prebivalstva in vse večjega števila ljudi s kroničnimi stanji. Vlaganja v programe krepitve zdravja in v preprečevanje bolezni ter ohranitev in okrepitev sistema primarnega zdravstvenega varstva ter uvajanje integrirane oskrbe so med pomembnimi ukrepi, s katerimi lahko obvladujemo breme kroničnih bolezni. Pomemben razvoj v zadnjih letih v Sloveniji je bila usmeritev zdravstvenega varstva tudi na področje krepitve zdravja in preprečevanja kroničnih bolezni. Aktivno odkrivamo osebe z dejavniki tveganja, ki so po potrebi napoteni v centre za krepitev zdravja, kjer dobijo ustrezno strokovno podporo za uvajanje sprememb, svetovanje in pomoč. Te storitve so namenjene in prilagojene tudi ranljivim skupinam prebivalstva, s ciljem zmanjševanja neenakosti v zdravju.«
Učinkovite in sodobne zdravstvene oskrbe in enakosti v zdravju si brez dobre dostopnosti do inovativnih zdravil ni mogoče predstavljati. Ta je v Sloveniji, zahvaljujoč tvornemu sodelovanju in nenehnim pogajanjem med farmacevtsko industrijo in Zavodom za zdravstveno zavarovanje Slovenije ter sodelovanju z drugimi deležniki v zdravstvu, zadovoljiva. Generalni direktor Zavoda za zdravstveno zavarovanje Slovenije Marjan Sušelj je zagotovil, da si bo zavod v okviru zmožnosti tudi v prihodnje prizadeval za dober dostop do novih zdravil:
»ZZZS si, kljub skromnim finančnim možnostim v letu 2020, ki nam jih odreja odlok Državnega zbora RS o najvišji dovoljeni porabi javne zdravstvene blagajne, še naprej prizadeva zadržati doseženo visoko raven dostopnosti do (novih) zdravil za slovenske zavarovance. Ob uspešni uvedbi novih mehanizmov za obvladovanje izdatkov za zdravila in sočasnem spodbujanju razvoja na področju diagnostike in zdravljenja lahko optimistično zremo v prihodnost. Pričakujemo pa tudi konstruktivno in razvojno usmerjeno sodelovanje farmacevtske industrije, kot so na primer dogovori za posamezna zdravila in sistemski dogovori ter režim sočutne uporabe pri novih zdravilih.«
Generalna sekretarka Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ, mag. Barbara Stegel ocenjuje, da so inovativna zdravila in nove tehnologije izjemnega pomena za izboljšanje kazalnikov zdravja in razvojno naravnanost zdravstvenega sistema:
»Prizadevamo si, da bi investicije v inovativna zdravila obravnavali celostno in jih presojali skupaj z njihovim družbenim vplivom ter prihranki, ki jih prinašajo znotraj zdravstvenega sistema in zunaj njega, saj je dobra dostopnost do zdravil eden ključnih pogojev uspešnega zdravstvenega sistema. Uvajanje novih zdravil je najbolj regulirano področje v zdravstvu, delež izdatkov za zdravila od leta 2010 dalje pa obsega zgolj okoli 15 odstotkov vseh izdatkov ZZZS. Tudi v prihodnje si bomo prizadevali za ustrezno mesto inovacij ter najmanj enak finančni obseg za zdravila v okviru proračuna ZZZS. Znano je namreč, da so bile skupnosti, ki so uporabljale razvitejše tehnologije vedno naprednejše. In družbe, ki uporabljajo nove tehnologije so v prednosti tudi v aktualnem času.«
Zagotavljanje kakovostnega zdravstvenega varstva bo zaradi staranja prebivalstva v prihodnosti še zahtevnejše, zato je uvedba posebnega orodja vrednotenja zdravstvenih tehnologij (HTA) predpogoj za vzdržen zdravstveni sistem. Razvoj HTA na evropski ravni je pojasnil dr. Andrej Janžič z Javne agencije za zdravila in medicinske pripomočke:
»Urejenost tega področja je v pristojnosti vsake države posebej, saj se s tem posega v sisteme zdravstvenega varstva oziroma odločitve o financiranju posameznih izdelkov in storitev, torej košarico pravic, ki jih lahko koristijo pacienti. Posledično so v tem pogledu znotraj EU velike razlike med državami, njihovo organiziranostjo in stopnjo razvitosti HTA-ja v povezavi s sistemom odločanja o financiranju, različne so kapacitete in kompetence ter s tem povezanega nivoja vrednotenja in ocenjevanja zdravstvenih tehnologij. V EU prostoru sicer trenutno potekajo diskusije o skupnem vrednotenju, ki pa je le delno in obsega klinični del, a že na tem nivoju so različni pogledi in države članice EU še niso našle skupnega jezika. Zaradi tega je prezgodaj napovedovati, kako se bo to področje uredilo na EU ravni, zagotovo pa bo en del in končna ocena ostala na nacionalni ravni, zato je tudi na posamezni državi, da sama definira in razvija svoj sistem HTA, ki bo v širšem kontekstu zdravstvenega varstva v tej državi.«
Napredek znanosti je silovit. Paradigma zdravstvene obravnave se spreminja, prehajamo v obdobje personalizirane medicine in digitalizacije, na kar v Sloveniji nismo ustrezno pripravljeni, ocenjuje izr. prof. dr. Petra Došenović Bonča z Ekonomske fakultete Univerze v Ljubljani:
»Ti trendi bodo prinesli zasuk od diagnoze in zdravljenja bolezni k prognozi bolezni in vseživljenjskem managementu pacienta, nove tipe izvajalcev, drugačne procese dela in specializacijo izvajalcev. Specializacija bo zaradi učinkovitosti, kakovosti in varnosti zahtevala tudi transnacionalno oblikovanje mrež izvajalcev. Okrepili se bodo izzivi zagotavljanja finančne vzdržnosti javnih zdravstvenih sistemov in ustvarile priložnosti za komercializacijo. Za ohranitev stabilnosti javnih zdravstvenih sistemov bo ključno ravno uveljavljanje ekonomskega vrednotenja zdravstvenih tehnologij, torej odločanje o razporejanju virov med različne programe na podlagi dokazov, dolgoročno načrtovanje človeških in materialnih zmogljivosti, novi modeli plačevanja izvajalcev, ki spodbujajo stroškovno učinkovitost ob ustreznem nadzoru kakovosti, ter organizacijske in ne zgolj tehnološke inovacije.«
Dr. Došenović Bonča je spregovorila tudi o razvojni usmerjenosti slovenskega zdravstvenega sistema:
»Pri odločitvah glede košarice mora ZZZS po eni strani upoštevati proračunsko omejitev, torej obseg sredstev, ki smo jih zbrali preko prispevkov. Po drugi strani pa bi moral o strukturi košarice odločati transparentno po načelih dobrega gospodarja. To pomeni, da mora omejene vire za zdravstvo razporediti med tiste programe, storitve, zdravila ali druge tehnologije, ki prinašajo glede na investicije vanje najboljše učinke. Tako stroške kot učinke pa mora presojati z vidika vseh relevantnih deležnikov, ki zdravstvo financiramo kolektivno ravno zato, da bi ZZZS namesto trga poskrbel za doseganje družbeno zaželene ravni zdravstvenih dobrin.«
Koncept zdravstvene oskrbe, ki poleg presoje neposrednih izdatkov vključuje tudi dolgoročno vrednost zdravstvene oskrbe za bolnike, družbo in zdravstveni sistem kot temelj učinkovitega in razvojno naravnanega upravljanja zdravstva je predstavil specialist za upravljanje in ekonomiko zdravstva, direktor za upravljanje
zdravstvenih tehnologij v Luz Saúde na Portugalskem Francisco Nuno Rocha-Goncalves:
»Prvi korak, ki bi ga svetoval zdravstvenemu sistemu na poti uveljavitve koncepta zdravstvenega sistema temelječega na dodani vrednosti (value based health care) je temeljita analiza kliničnih poti bolnika v posameznih bolnišnicah. Skupina strokovnjakov na podlagi analize zbranih podatkov iz klinične prakse ugotovi, kakšni so realni izidi in rezultati zdravljenja ter izdela načrt za potrebne spremembe znotraj posamezne bolnišnice. V naslednjem koraku sledijo simulacije, kakšni bi bili ti rezultati, če bi imeli na razpolago dodatne vire, druge načine financiranja, novejše tehnologije in podobno. To nam pomaga ustvariti okvir za uspešno, na osnovi dodane vrednosti temelječo obravnavo.«
Strokovnjak je izpostavil nujo, da so središče zdravstvene oskrbe bolnik in njegove potrebe (patient centricity), čemur mora slediti celotna organizacija sistema.
Slovenski bolniki in njihove družine, ki napredek znanosti najbolj potrebujejo in ga zase tudi najbolj legitimno terjajo, si zaslužijo modernizacijo zdravstvenega sistema, ki bo v partnerskem sodelovanju vseh deležnikov v zdravstvu uspešno naslavljal izzive zdravja in razvoja v 21. stoletju. Čas je za ambicije.
Več informacij je na voljo na elektronskem naslovu office@farmaforum.si in na spletni strani www.farmaforum.si
“,”Jaka Verbic Miklic”,1574252820,1574252820,sl,14180,306,14179,43,0,NULL,,”8. strateška konferenca”,8-strateska-konferenca,Post,,1,0,1574253453,1576566422
612,14194,”8. Strateška konferenca Vrednost inovacij”,”Izzivi zdravja in razvoja v 21-stoletju”,”
Ljubljana, 19. november 2019 – Čas je za ambicije, so se strinjali udeleženci 8. Strateške konference Vrednost inovacij: Izzivi zdravja in razvoja v 21. stoletju. Da bi zdravstveni sistem ustrezneje naslovil potrebe bolnikov po učinkovitem in dostopnem zdravstvenem varstvu in izzive, ki jih prinašajo demografske spremembe, porast kroničnih nenalezljivih bolezni, napredek znanosti in bolniku prilagojena medicina, potrebuje modernizacijo. Razvojno naravnan zdravstveni sistem in dobro dostopnost do inovacij je mogoče doseči zgolj z uvajanjem celostnega vrednotenja zdravstvenih tehnologij in novih zdravil, ki upošteva tako izdatke, kot tudi neposredne in posredne učinke, ki jih imajo za posledico znotraj in izven zdravstvenega sistema. Celostno vrednotenje inovacij plačniku zdravstvenih storitev zagotavlja pomoč pri odločanju o porabi sredstev ter potrebno transparentnost in odgovornost vseh deležnikov v zdravstvu. Sistemske ukrepe za modernizacijo zdravstvenega sistema naj v sodelovanju z vsemi deležniki v zdravstvu načrtuje in usmerja Ministrstvo za zdravje.
Predavatelji in razpravljavci 8. Strateške konference Vrednost inovacij: Izzivi zdravja in razvoja v 21. stoletju – čas za ambicije, ki je v organizaciji Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ, potekala na Zavodu za zdravstveno zavarovanje Slovenije, so poudarili pomen modernizacije zdravstvenega sistema. Staranje prebivalstva in porast kroničnih nenalezljivih bolezni, ki so odgovorne za prezgodnjo umrljivost in do 80 odstotkov vseh smrti, predstavljata za posameznike in družbo izziv, za zdravstvo pa veliko finančno breme. Generalna direktorica Direktorata za javno zdravje Ministrstva za zdravje Mojca Gobec je predstavila ukrepe za zmanjševanje bremena kroničnih nenalezljivih bolezni:
»V Sloveniji smo v zadnjih desetletjih dosegli pomembno podaljšanje življenjske dobe, zmanjšala se je umrljivost zaradi srčno – žilnih bolezni. S presejalnimi programi za zgodnje odkrivanje raka na materničnem vratu (ZORA), dojki (DORA) in debelem črevesu in danki (SVIT) se je zmanjšala incidenca teh rakov ter tudi podaljšalo preživetje. Sistem zdravstvenega varstva se prilagaja spremembam in potrebam hitro starajočega se prebivalstva in vse večjega števila ljudi s kroničnimi stanji. Vlaganja v programe krepitve zdravja in v preprečevanje bolezni ter ohranitev in okrepitev sistema primarnega zdravstvenega varstva ter uvajanje integrirane oskrbe so med pomembnimi ukrepi, s katerimi lahko obvladujemo breme kroničnih bolezni. Pomemben razvoj v zadnjih letih v Sloveniji je bila usmeritev zdravstvenega varstva tudi na področje krepitve zdravja in preprečevanja kroničnih bolezni. Aktivno odkrivamo osebe z dejavniki tveganja, ki so po potrebi napoteni v centre za krepitev zdravja, kjer dobijo ustrezno strokovno podporo za uvajanje sprememb, svetovanje in pomoč. Te storitve so namenjene in prilagojene tudi ranljivim skupinam prebivalstva, s ciljem zmanjševanja neenakosti v zdravju.«
Učinkovite in sodobne zdravstvene oskrbe in enakosti v zdravju si brez dobre dostopnosti do inovativnih zdravil ni mogoče predstavljati. Ta je v Sloveniji, zahvaljujoč tvornemu sodelovanju in nenehnim pogajanjem med farmacevtsko industrijo in Zavodom za zdravstveno zavarovanje Slovenije ter sodelovanju z drugimi deležniki v zdravstvu, zadovoljiva. Generalni direktor Zavoda za zdravstveno zavarovanje Slovenije Marjan Sušelj je zagotovil, da si bo zavod v okviru zmožnosti tudi v prihodnje prizadeval za dober dostop do novih zdravil:
»ZZZS si, kljub skromnim finančnim možnostim v letu 2020, ki nam jih odreja odlok Državnega zbora RS o najvišji dovoljeni porabi javne zdravstvene blagajne, še naprej prizadeva zadržati doseženo visoko raven dostopnosti do (novih) zdravil za slovenske zavarovance. Ob uspešni uvedbi novih mehanizmov za obvladovanje izdatkov za zdravila in sočasnem spodbujanju razvoja na področju diagnostike in zdravljenja lahko optimistično zremo v prihodnost. Pričakujemo pa tudi konstruktivno in razvojno usmerjeno sodelovanje farmacevtske industrije, kot so na primer dogovori za posamezna zdravila in sistemski dogovori ter režim sočutne uporabe pri novih zdravilih.«
Generalna sekretarka Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ, mag. Barbara Stegel ocenjuje, da so inovativna zdravila in nove tehnologije izjemnega pomena za izboljšanje kazalnikov zdravja in razvojno naravnanost zdravstvenega sistema:
»Prizadevamo si, da bi investicije v inovativna zdravila obravnavali celostno in jih presojali skupaj z njihovim družbenim vplivom ter prihranki, ki jih prinašajo znotraj zdravstvenega sistema in zunaj njega, saj je dobra dostopnost do zdravil eden ključnih pogojev uspešnega zdravstvenega sistema. Uvajanje novih zdravil je najbolj regulirano področje v zdravstvu, delež izdatkov za zdravila od leta 2010 dalje pa obsega zgolj okoli 15 odstotkov vseh izdatkov ZZZS. Tudi v prihodnje si bomo prizadevali za ustrezno mesto inovacij ter najmanj enak finančni obseg za zdravila v okviru proračuna ZZZS. Znano je namreč, da so bile skupnosti, ki so uporabljale razvitejše tehnologije vedno naprednejše. In družbe, ki uporabljajo nove tehnologije so v prednosti tudi v aktualnem času.«
Zagotavljanje kakovostnega zdravstvenega varstva bo zaradi staranja prebivalstva v prihodnosti še zahtevnejše, zato je uvedba posebnega orodja vrednotenja zdravstvenih tehnologij (HTA) predpogoj za vzdržen zdravstveni sistem. Razvoj HTA na evropski ravni je pojasnil dr. Andrej Janžič z Javne agencije za zdravila in medicinske pripomočke:
»Urejenost tega področja je v pristojnosti vsake države posebej, saj se s tem posega v sisteme zdravstvenega varstva oziroma odločitve o financiranju posameznih izdelkov in storitev, torej košarico pravic, ki jih lahko koristijo pacienti. Posledično so v tem pogledu znotraj EU velike razlike med državami, njihovo organiziranostjo in stopnjo razvitosti HTA-ja v povezavi s sistemom odločanja o financiranju, različne so kapacitete in kompetence ter s tem povezanega nivoja vrednotenja in ocenjevanja zdravstvenih tehnologij. V EU prostoru sicer trenutno potekajo diskusije o skupnem vrednotenju, ki pa je le delno in obsega klinični del, a že na tem nivoju so različni pogledi in države članice EU še niso našle skupnega jezika. Zaradi tega je prezgodaj napovedovati, kako se bo to področje uredilo na EU ravni, zagotovo pa bo en del in končna ocena ostala na nacionalni ravni, zato je tudi na posamezni državi, da sama definira in razvija svoj sistem HTA, ki bo v širšem kontekstu zdravstvenega varstva v tej državi.«
Napredek znanosti je silovit. Paradigma zdravstvene obravnave se spreminja, prehajamo v obdobje personalizirane medicine in digitalizacije, na kar v Sloveniji nismo ustrezno pripravljeni, ocenjuje izr. prof. dr. Petra Došenović Bonča z Ekonomske fakultete Univerze v Ljubljani:
»Ti trendi bodo prinesli zasuk od diagnoze in zdravljenja bolezni k prognozi bolezni in vseživljenjskem managementu pacienta, nove tipe izvajalcev, drugačne procese dela in specializacijo izvajalcev. Specializacija bo zaradi učinkovitosti, kakovosti in varnosti zahtevala tudi transnacionalno oblikovanje mrež izvajalcev. Okrepili se bodo izzivi zagotavljanja finančne vzdržnosti javnih zdravstvenih sistemov in ustvarile priložnosti za komercializacijo. Za ohranitev stabilnosti javnih zdravstvenih sistemov bo ključno ravno uveljavljanje ekonomskega vrednotenja zdravstvenih tehnologij, torej odločanje o razporejanju virov med različne programe na podlagi dokazov, dolgoročno načrtovanje človeških in materialnih zmogljivosti, novi modeli plačevanja izvajalcev, ki spodbujajo stroškovno učinkovitost ob ustreznem nadzoru kakovosti, ter organizacijske in ne zgolj tehnološke inovacije.«
Dr. Došenović Bonča je spregovorila tudi o razvojni usmerjenosti slovenskega zdravstvenega sistema:
»Pri odločitvah glede košarice mora ZZZS po eni strani upoštevati proračunsko omejitev, torej obseg sredstev, ki smo jih zbrali preko prispevkov. Po drugi strani pa bi moral o strukturi košarice odločati transparentno po načelih dobrega gospodarja. To pomeni, da mora omejene vire za zdravstvo razporediti med tiste programe, storitve, zdravila ali druge tehnologije, ki prinašajo glede na investicije vanje najboljše učinke. Tako stroške kot učinke pa mora presojati z vidika vseh relevantnih deležnikov, ki zdravstvo financiramo kolektivno ravno zato, da bi ZZZS namesto trga poskrbel za doseganje družbeno zaželene ravni zdravstvenih dobrin.«
Koncept zdravstvene oskrbe, ki poleg presoje neposrednih izdatkov vključuje tudi dolgoročno vrednost zdravstvene oskrbe za bolnike, družbo in zdravstveni sistem kot temelj učinkovitega in razvojno naravnanega upravljanja zdravstva je predstavil specialist za upravljanje in ekonomiko zdravstva, direktor za upravljanje
zdravstvenih tehnologij v Luz Saúde na Portugalskem Francisco Nuno Rocha-Goncalves:
»Prvi korak, ki bi ga svetoval zdravstvenemu sistemu na poti uveljavitve koncepta zdravstvenega sistema temelječega na dodani vrednosti (value based health care) je temeljita analiza kliničnih poti bolnika v posameznih bolnišnicah. Skupina strokovnjakov na podlagi analize zbranih podatkov iz klinične prakse ugotovi, kakšni so realni izidi in rezultati zdravljenja ter izdela načrt za potrebne spremembe znotraj posamezne bolnišnice. V naslednjem koraku sledijo simulacije, kakšni bi bili ti rezultati, če bi imeli na razpolago dodatne vire, druge načine financiranja, novejše tehnologije in podobno. To nam pomaga ustvariti okvir za uspešno, na osnovi dodane vrednosti temelječo obravnavo.«
Strokovnjak je izpostavil nujo, da so središče zdravstvene oskrbe bolnik in njegove potrebe (patient centricity), čemur mora slediti celotna organizacija sistema.
Slovenski bolniki in njihove družine, ki napredek znanosti najbolj potrebujejo in ga zase tudi najbolj legitimno terjajo, si zaslužijo modernizacijo zdravstvenega sistema, ki bo v partnerskem sodelovanju vseh deležnikov v zdravstvu uspešno naslavljal izzive zdravja in razvoja v 21. stoletju. Čas je za ambicije.
Več informacij je na voljo na elektronskem naslovu office@farmaforum.si in na spletni strani www.farmaforum.si
“,”Jaka Verbic Miklic”,1574415720,1574415720,sl,14194,306,14193,43,0,NULL,,”Strateška konferenca Vrednost inovacij: Izzivi zdravja in razvoja v 21. stoletju”,strateska-konferenca-vrednost-inovacij-izzivi-zdravja-in-razvoja-v-21-stoletju,Post,”/sites/43/files/images/news/8. strateska/OKROGLA MIZA VREDNOST INOVACIJ 2019 .JPG”,1,0,1574329474,1576408315
613,14194,”8th strategic Value of Innovation Conference”,”Development in the 21st century – Time for ambition”,”
Ljubljana, 19 November 2019 – It’s time for ambition, agreed the participants of the 8th Value of Innovation Strategic Conference: Challenges of health and Development in the 21st Century. Healthcare systems need modernization to appropriately address the needs of patients for effective and accessible healthcare and tackle challenges brought about by demographic changes, increases in chronic non-infectious diseases, advances in science and patient adapted medicine. A development oriented healthcare system and appropriate access to innovations can only be achieved by introducing integrated evaluation of healthcare technologies and new new medicines that takes into account the costs as well as the direct and indirect effects that occur within and outside the healthcare system. Integrated evaluation of innovations assists the healthcare service payer in deciding on spending and assuring the necessary transparency and responsibility of all stakeholders in healthcare. Systemic measures towards modernization of the healthcare system should be planned and directed by the Ministry of Health in cooperation with all stakeholders in healthcare.
Lecturers and guests at the 8th Value of Innovation Strategic Conference: Challenges of health and Development in the 21st Century – Time For Ambition, which was organized by the Forum of International Research and Development Pharmaceutical Companies, EIG, and took place at the Health Insurance Institute of Slovenia, emphasized the importance of modernization of the healthcare system. Aging of the population and increases in chronic non-infectious diseases that are responsible for premature mortality and up to 80 percent of all deaths, pose a great challenge for individuals and society and a great financial burden for healthcare. The Director General of the Public Health Directorate at the Ministry of Health Mojca Gobec presented measures to reduce the burden of chronic non infectious disease:
“Over the past decades Slovenia has achieved a substantial extension of life expectancy and reduction of mortality due to cardiovascular disease. Screening tests for early discovery of cervical cancer (ZORA), breast cancer (DORA) and colorectal cancer (SVIT) have reduced the incidence of these cancers and extended survival rates. The healthcare system is adapting to changes and needs of a rapidly aging population and increasing numbers of people with chronic conditions. Investments in health strengthening and disease prevention programs and the maintenance and strengthening of the primary healthcare system with the introduction of integrated care are among the most important measures we can use to manage the burden of chronic disease. Another important development in Slovenia in recent years has been the direction of healthcare towards strengthening health and preventing chronic diseases. We are actively discovering persons with risk factors and directing them as necessary towards health strengthening centers to receive necessary expert support in introducing changes, counseling and assistance. These services are intended and adapted to vulnerable population groups in order to reduce inequalities in healthcare.”
Effective and modern healthcare and equality in health cannot be imagined without good access to innovative medicines which is satisfactory in Slovenia due to constructive cooperation and constant negotiations between the pharmaceutical industry and the Health Insurance Institute of Slovenia and cooperation with other stakeholders in healthcare. General Director of the Health Insurance Institute of Slovenia Marjan Sušelj assured that the Institute will continue to strive for good access to new medicines within its capabilities:
“In spite of modest financial possibilities in 2020, determined by the Decree of the National Assembly of the Republic of Slovenia on maximum allowed public healthcare budget spending, the Health Insurance Institute of Slovenia will continue to strive to maintain the achieved high level of access to (new) medicines for insured Slovenians. With successful introduction of new mechanisms for managing expenditures for medicines and concurrent promotion of development in diagnostics and treatments we have reason to look towards the future with optimism. We also expect constructive and development focused cooperation of the pharmaceutical industry, such as agreements for individual medicines and systemic agreements and regimes of compassionate use in new medicines.”
Secretary General of the Forum of International Research and Development Pharmaceutical Companies, EIG, mag. Barbara Stegel believes innovative medicines and new technologies are essential for the improvement of health indicators and maintaining a focus on development in the healthcare system:
“We are seeking to assure that investments into innovative medicines are considered holistically and assessed together with their social impact and savings they bring both within and outside the healthcare system because good access to medicines is a key prerequisite for a successful healthcare system. The introduction of new medicines is the most regulated field in healthcare and the share of expenditures for medicines as of 2010 amounts to only 15 percent of all expenditures of the Health Insurance Institute of Slovenia. In the future we will continue to assure that innovations be given an appropriate place and at least an equal share of finances within the Insurance Institute budget. After all, it is a fact that societies that used more developed technologies always proved to be more advanced. And companies that use new technologies continue to have the edge on their competitors in modern times.”
Assurance of quality healthcare will become more demanding in the future due to population aging so the introduction of a special healthcare technology assessment tool (HTA) is a prerequisite for a sustainable healthcare system. The development of HTA at the European level was explained by Dr. Andrej Janžič from the Public Agency for Medicinal Products and Medical devices:
“Regulation in this field is within the competence of each individual state as it bears upon healthcare systems and decisions on financing certain products and services or the basket of rights patients are entitled to. Consequentially there are substantial differences between countries in the EU in their organization and development of HTA in connection with the decision making system for financing. There are differences in capacity and competence and the associated level of assessment and grading of healthcare technologies. The EU area is currently holding discussions on a common assessment program which is only partial and includes the clinical aspect. But there are different views already at this level and EU members have yet to find a common language. It is therefore too early to say how this field will be regulated at EU level. It is, however, quite certain that at least a part of the procedure and the final assessment will remain at a national level and it is up to each individual country to define and develop its HTA system within the wider context of its healthcare system.”
Advances in science are fierce. The paradigm of medical treatment is shifting and we are entering an era of personalized medicine and digitalization for which Slovenia is ill prepared, finds associate professor Dr. Petra Došenovič Bonča from the Faculty of Economics at the University of Ljubljana:
“These trends will bring a shift from diagnosing and treating disease to forecasting disease and life-long patient management, new types of service providers, different work processes and specialization of service providers. For the sake of efficiency, quality and safety specialization will also require a transnational development of service provider networks. Challenges in assuring financial sustainability of public healthcare systems will strengthen and new opportunities for commercialization will arise. In order to maintain stable public healthcare systems the introduction of economic assessment of healthcare technologies will play a major role in terms of evidence based allocation of resources among different programs, long term planning of human and material capacities, new models of paying service providers that promote cost efficiency while assuring quality and organizational innovations in addition to technological ones.”
Dr. Došenović Bonča also spoke about focus on development in the Slovenian healthcare system:
“When deciding on the basket the Health Insurance Institute of Slovenia must on the one hand observe its budgetary limitations in the form of funds collected through contributions. On the other hand the structure of the basket should be decided transparently and with due diligence. This means that the limited available to healthcare must be allocated to those programs, services, medicines and other technologies that provide the best effect in comparison to the investment. But both the costs and effects must be assessed from the viewpoints of all relevant stakeholders who collectively finance healthcare precisely so that the Health Insurance Institute of Slovenia would achieve a socially acceptable level of healthcare goods instead of the market just running its course.
The concept of healthcare that includes not only assessments of direct expenditures but also the long term value for patients, society and the healthcare system itself as a foundation for an effective and development focused healthcare management was presented by management and health economics specialist, Director of Health Technology Management at Luz Saúde in Portugal, Mr. Francisco Nuno Rocha-Goncalves:
“The first step I would advise to a healthcare system on its way to establishing value based health care is to pursue a thorough analysis of clinical pathways taken by patients in each separate hospital. On the basis of an analysis of data collected from clinical practice a group of experts can establish the actual outcomes and results of treatment and create a plan of necessary changes within each hospital. The next step is to carry out simulations of these outcomes with access to additional resources, other ways of financing, newer technologies and suchlike. This helps create a framework for successful value based treatment.”
The expert also emphasized the need to establish a patient centric approach that must be followed by the entire system organization.
Slovenian patients and their families who need and legitimately require progress in science the most deserve a modernization of the healthcare system that will successfully address the challenges of health and development in the 21st century with the partner cooperation of all stakeholders in healthcare. It is time for ambition.
For more information write to office@farmaforum.si or visit www.farmaforum.si
“,”Jaka Verbic Miklic”,1574423760,1574423760,en,14194,306,14193,43,0,NULL,,”Strateška konferenca Vrednost inovacij: Izzivi zdravja in razvoja v 21. stoletju”,strateska-konferenca-vrednost-inovacij-izzivi-zdravja-in-razvoja-v-21-stoletju,Post,”/sites/43/files/images/news/8. strateska/OKROGLA MIZA VREDNOST INOVACIJ 2019 .JPG”,1,0,1574329474,1576408315
614,14180,”8th strategic Value of Innovation Conference”,”Development in the 21st century – Time for ambition”,”
Ljubljana, 19 November 2019 – It’s time for ambition, agreed the participants of the 8th Value of Innovation Strategic Conference: Challenges of health and Development in the 21st Century. Healthcare systems need modernization to appropriately address the needs of patients for effective and accessible healthcare and tackle challenges brought about by demographic changes, increases in chronic non-infectious diseases, advances in science and patient adapted medicine. A development oriented healthcare system and appropriate access to innovations can only be achieved by introducing integrated evaluation of healthcare technologies and new new medicines that takes into account the costs as well as the direct and indirect effects that occur within and outside the healthcare system. Integrated evaluation of innovations assists the healthcare service payer in deciding on spending and assuring the necessary transparency and responsibility of all stakeholders in healthcare. Systemic measures towards modernization of the healthcare system should be planned and directed by the Ministry of Health in cooperation with all stakeholders in healthcare.
Lecturers and guests at the 8th Value of Innovation Strategic Conference: Challenges of health and Development in the 21st Century – Time For Ambition, which was organized by the Forum of International Research and Development Pharmaceutical Companies, EIG, and took place at the Health Insurance Institute of Slovenia, emphasized the importance of modernization of the healthcare system. Aging of the population and increases in chronic non-infectious diseases that are responsible for premature mortality and up to 80 percent of all deaths, pose a great challenge for individuals and society and a great financial burden for healthcare. The Director General of the Public Health Directorate at the Ministry of Health Mojca Gobec presented measures to reduce the burden of chronic non infectious disease:
“Over the past decades Slovenia has achieved a substantial extension of life expectancy and reduction of mortality due to cardiovascular disease. Screening tests for early discovery of cervical cancer (ZORA), breast cancer (DORA) and colorectal cancer (SVIT) have reduced the incidence of these cancers and extended survival rates. The healthcare system is adapting to changes and needs of a rapidly aging population and increasing numbers of people with chronic conditions. Investments in health strengthening and disease prevention programs and the maintenance and strengthening of the primary healthcare system with the introduction of integrated care are among the most important measures we can use to manage the burden of chronic disease. Another important development in Slovenia in recent years has been the direction of healthcare towards strengthening health and preventing chronic diseases. We are actively discovering persons with risk factors and directing them as necessary towards health strengthening centers to receive necessary expert support in introducing changes, counseling and assistance. These services are intended and adapted to vulnerable population groups in order to reduce inequalities in healthcare.”
Effective and modern healthcare and equality in health cannot be imagined without good access to innovative medicines which is satisfactory in Slovenia due to constructive cooperation and constant negotiations between the pharmaceutical industry and the Health Insurance Institute of Slovenia and cooperation with other stakeholders in healthcare. General Director of the Health Insurance Institute of Slovenia Marjan Sušelj assured that the Institute will continue to strive for good access to new medicines within its capabilities:
“In spite of modest financial possibilities in 2020, determined by the Decree of the National Assembly of the Republic of Slovenia on maximum allowed public healthcare budget spending, the Health Insurance Institute of Slovenia will continue to strive to maintain the achieved high level of access to (new) medicines for insured Slovenians. With successful introduction of new mechanisms for managing expenditures for medicines and concurrent promotion of development in diagnostics and treatments we have reason to look towards the future with optimism. We also expect constructive and development focused cooperation of the pharmaceutical industry, such as agreements for individual medicines and systemic agreements and regimes of compassionate use in new medicines.”
Secretary General of the Forum of International Research and Development Pharmaceutical Companies, EIG, mag. Barbara Stegel believes innovative medicines and new technologies are essential for the improvement of health indicators and maintaining a focus on development in the healthcare system:
“We are seeking to assure that investments into innovative medicines are considered holistically and assessed together with their social impact and savings they bring both within and outside the healthcare system because good access to medicines is a key prerequisite for a successful healthcare system. The introduction of new medicines is the most regulated field in healthcare and the share of expenditures for medicines as of 2010 amounts to only 15 percent of all expenditures of the Health Insurance Institute of Slovenia. In the future we will continue to assure that innovations be given an appropriate place and at least an equal share of finances within the Insurance Institute budget. After all, it is a fact that societies that used more developed technologies always proved to be more advanced. And companies that use new technologies continue to have the edge on their competitors in modern times.”
Assurance of quality healthcare will become more demanding in the future due to population aging so the introduction of a special healthcare technology assessment tool (HTA) is a prerequisite for a sustainable healthcare system. The development of HTA at the European level was explained by Dr. Andrej Janžič from the Public Agency for Medicinal Products and Medical devices:
“Regulation in this field is within the competence of each individual state as it bears upon healthcare systems and decisions on financing certain products and services or the basket of rights patients are entitled to. Consequentially there are substantial differences between countries in the EU in their organization and development of HTA in connection with the decision making system for financing. There are differences in capacity and competence and the associated level of assessment and grading of healthcare technologies. The EU area is currently holding discussions on a common assessment program which is only partial and includes the clinical aspect. But there are different views already at this level and EU members have yet to find a common language. It is therefore too early to say how this field will be regulated at EU level. It is, however, quite certain that at least a part of the procedure and the final assessment will remain at a national level and it is up to each individual country to define and develop its HTA system within the wider context of its healthcare system.”
Advances in science are fierce. The paradigm of medical treatment is shifting and we are entering an era of personalized medicine and digitalization for which Slovenia is ill prepared, finds associate professor Dr. Petra Došenovič Bonča from the Faculty of Economics at the University of Ljubljana:
“These trends will bring a shift from diagnosing and treating disease to forecasting disease and life-long patient management, new types of service providers, different work processes and specialization of service providers. For the sake of efficiency, quality and safety specialization will also require a transnational development of service provider networks. Challenges in assuring financial sustainability of public healthcare systems will strengthen and new opportunities for commercialization will arise. In order to maintain stable public healthcare systems the introduction of economic assessment of healthcare technologies will play a major role in terms of evidence based allocation of resources among different programs, long term planning of human and material capacities, new models of paying service providers that promote cost efficiency while assuring quality and organizational innovations in addition to technological ones.”
Dr. Došenović Bonča also spoke about focus on development in the Slovenian healthcare system:
“When deciding on the basket the Health Insurance Institute of Slovenia must on the one hand observe its budgetary limitations in the form of funds collected through contributions. On the other hand the structure of the basket should be decided transparently and with due diligence. This means that the limited available to healthcare must be allocated to those programs, services, medicines and other technologies that provide the best effect in comparison to the investment. But both the costs and effects must be assessed from the viewpoints of all relevant stakeholders who collectively finance healthcare precisely so that the Health Insurance Institute of Slovenia would achieve a socially acceptable level of healthcare goods instead of the market just running its course.
The concept of healthcare that includes not only assessments of direct expenditures but also the long term value for patients, society and the healthcare system itself as a foundation for an effective and development focused healthcare management was presented by management and health economics specialist, Director of Health Technology Management at Luz Saúde in Portugal, Mr. Francisco Nuno Rocha-Goncalves:
“The first step I would advise to a healthcare system on its way to establishing value based health care is to pursue a thorough analysis of clinical pathways taken by patients in each separate hospital. On the basis of an analysis of data collected from clinical practice a group of experts can establish the actual outcomes and results of treatment and create a plan of necessary changes within each hospital. The next step is to carry out simulations of these outcomes with access to additional resources, other ways of financing, newer technologies and suchlike. This helps create a framework for successful value based treatment.”
The expert also emphasized the need to establish a patient centric approach that must be followed by the entire system organization.
Slovenian patients and their families who need and legitimately require progress in science the most deserve a modernization of the healthcare system that will successfully address the challenges of health and development in the 21st century with the partner cooperation of all stakeholders in healthcare. It is time for ambition.
For more information write to office@farmaforum.si or visit www.farmaforum.si
“,,1574424660,1574424660,en,14180,306,14179,43,0,NULL,,”8. strateška konferenca”,8-strateska-konferenca,Post,,1,0,1574253453,1576566422
615,14213,”Sodelovanje na okrogli mizi Združenja slovenskih organizacij bolnikov z rakom”,”Bo država onkologijo sposobna ohranjati in razvijati na visoki ravni tudi v prihodnje?”,”
Ljubljana, 12. februar 2020 – Združenje slovenskih organizacij bolnikov z rakom Onko Net je skupaj s strokovnjaki s področij obvladovanja raka v Sloveniji opozorilo na naraščajoče breme raka v Sloveniji, silovit razvoj onkološkega zdravljenja, posledično vedno boljše možnosti za uspešno zdravljenje in daljše preživetje bolnikov z rakom, ki pa je hkrati pri najpogostejših rakih še vedno nekoliko slabše od evropskega povprečja. Združenje Onko Net je izpostavilo potrebo po hitrejši dostopnosti do diagnostike, ki je ključna za zgodnje odkrivanje, čimprejšnji začetek zdravljenja ter uspeh zdravljenja; sistemsko ureditev celostne obravnave bolnikov z rakom, ki vključuje pravočasno rehabilitacijo; zagotavljanju prostorskih in kadrovskih pogojev za varno zdravljenje bolnikov z rakom; ter pozvalo k čimprejšnji ureditvi človeka dostojne paliativne oskrbe. Pristojne so opozorili na pomen zagotavljanja kadrovskih, organizacijskih in finančnih virov za ohranitev doseženega standarda in nadaljnji razvoj celostne obravnave onkoloških bolnikov v Sloveniji.
Za rakom v Sloveniji vsako leto na novo zboli več kot 15.000 ljudi in pričakovati je, da bo zaradi staranja prebivalstva število obolelih še naraščalo. Zaradi učinkovitih državnih presejalnih programov in dostopnosti do najsodobnejšega onkološkega zdravljenja postaja rak v Sloveniji v mnogih primerih dobro obvladana kronična bolezen. Tako med nami živi že blizu 107.000 ljudi, ki so nekoč zboleli za rakom. Kljub temu, pa je petletno preživetje bolnikov z rakom v Sloveniji še vedno nekoliko slabše od evropskega povprečja, ali, kot je pojasnila izr. prof. dr. Vesna Zadnik, dr. med., vodja Epidemiologije in registra raka na Onkološkem inštitutu Ljubljana: »Preživetje slovenskih bolnikov z rakom se praktično pri vseh vrstah raka s časom povečuje; v zadnjih tridesetih letih se je podvojilo. Opažamo tudi manjšanje razlik med ženskami in moškimi, ki so v preteklosti preživljali bistveno slabše. Mednarodne primerjave preživetij onkoloških bolnikov so na voljo v raziskavi Concord. Primerjave so narejene le po posameznih najpogostejših vrstah raka. Slovenija se pri večini lokacij uvršča nekoliko pod evropsko povprečje.«.
V.d. strokovnega direktorja Onkološkega inštituta Ljubljana izr. prof. dr. Viljem Kovač, dr. med., je dodal, da so preživetja slovenskih bolnikov z redkimi raki hkrati nadpovprečna. Kot največjo težavo onkološke obravnave bolnikov je opredelil pomanjkanje kadrov in prostorsko stisko, kot največji dosežek pa: »Ponosni smo lahko, da državljanom Slovenije nudimo presejalne programe, ki so eni najuspešnejših v Evropi, bolnikom je dosegljiva praktično vsa sodobna klinična obravnava, vključno z najzahtevnejšim zdravljenjem. Onkološki inštitut je od svoje ustanovitve naprej težil tudi k celostni obravnavi in raziskovalnemu delu. Zato lahko bolnik prejme najrazličnejše oblike celostnega zdravljenja: ob kirurgiji, radioterapiji, še najrazličnejše sistemsko zdravljenje. Že omenjena kadrovska in prostorska stiska pa nas omejuje, da smo v nekaterih dejavnosti, ki jih tudi seveda izvajamo, manj intenzivni, kot bi želeli biti.«.
Če je zgodnje odkrivanje raka ciljnih skupin v državnih presejalnih programih zelo uspešno, pa je zgodnja diagnoza ob sumu onkološke bolezni pri ostalem prebivalstvu zaradi predolgih čakalnih dob na vseh ravneh zdravstvenega varstva v Sloveniji močno otežena. »Na področju raka prebavil, ginekoloških in uroloških rakov je ozko grlo v UKC Ljubljana slikovna diagnostika, predvsem CT. Temu prispeva tudi velik priliv bolnikov iz drugih slovenskih regij. Vseeno z velikimi napori praviloma uspemo zagotoviti pravočasno slikovno diagnostiko. Z dobavo novih CT aparatov in posodabljanjem drugih aparatur pričakujemo izboljšanje na tem področju. V sodelovanju z Onkološkim inštitutom za naše bolnike uporabljamo najsodobnejše onkološko zdravljenje (kirurško, sistemsko in radioterapevtsko). Izvajamo tudi robotske operacije raka prostate.«, je predstavila strokovna direktorica UKC Ljubljana prof. dr. Jadranka Buturović Ponikvar, dr. med.
ZZZS prepoznava bolnike z rakom kot eno najbolj ranljivih skupin prebivalcev, za slovensko družbo pa je naraščajoče breme raka vedno večji izziv, in sicer predvsem zaradi staranja prebivalstva, ki zahteva na eni strani učinkovito organizacijo in financiranje javne zdravstvene službe ter na drugi strani učinkovito promocijo zdravja, ki vključuje tudi skrb ljudi za zdrav življenjski slog ter skrb družbe za zdravo okolje in hrano je poudaril generalni direktor Zavoda za zdravstveno zavarovanje Slovenije Marjan Sušelj in pojasnil: »ZZZS zato vedno več vlaga v to področje, tako da že vrsto let plačuje diagnostiko in zdravljenje bolnikov z rakom količinsko neomejeno, glede na dejanske potrebe bolnikov. Zagotavljamo tudi zelo učinkovite presejalne programe za obvladovanje različnih vrst raka (DORA, ZORA, SVIT), uvajamo nova učinkovitejša zdravila ter najsodobnejše diagnostične postopke. 50% precepljenost deklic proti HPV je ena najboljših v Evropi in zaradi izjemne učinkovitosti pri preprečevanju raka materničnega vratu podpiramo uvedbo tovrstnega cepljenja tudi za dečke. Že lani smo uvedli najnovejše diagnostične pristope v hematologiji, letos poleti pa bomo uvedli financiranje novih genskih testov v molekularni genetski diagnostike v onkologiji. Po oceni ZZZS je ključno, da v bodoče na tem področju vzpostavimo nove učinkovite presejalne programe tudi za nekatere druge vrste raka, kot so rak pljuč in rak želodca, ter da zagotovimo zadostne zmogljivosti (kadri, prostor, zgradbe) in ustrezno organizacijo zdravstvene službe tudi z uvajanjem regijskih centrov za najpogostejše vrste raka. Za vse to pa bomo morali kot družba nameniti tudi več denarja za zdravstvo, morda tudi iz naslova trošarin na tobak in alkohol, ki nam povzročata precej škode.«.
Mojca Gobec, generalna direktorica Direktorata za javno zdravje Ministrstva za zdravje, je spomnila na pomen preventivne in sekundarne preventive ter celostne rehabilitacije pri obvladovanju raka, izpostavila uspešnost državnih presejalnih programov ter zaveze iz Državnega programa za obvladovanja raka in med drugim izrazila tudi potrebo po vzpostavitvi mreže bolnišnic za zdravljenje pogostih rakov: »Da tam s kliničnimi registri spremljamo kakovost izvajanja onkološke oskrbe. To so sprejele številne države in tudi naši podatki kažejo, da je tam, kjer je rak od prvega koraka zdravljen na strokoven in multidisciplinaren način, tudi preživetje bolnikov mnogo boljše kot tam, kjer se zatakne in se potem konča ali v UKC Ljubljana ali na Onkološkem inštitutu. Glede na večanje incidence raka pa je potrebno tudi načrtovanje kadrov v onkologiji« .
Kristina Modic, predsednica združenja Onko Net je pozdravila doseženo raven onkološkega zdravljenja in izrazila pričakovanje, da jo bo zdravstveni sistem zagotavljal in razvijal tudi v prihodnje ter poudarila: »Slovenske organizacije bolnikov z rakom trenutno raven onkološkega zdravljenja v Sloveniji pozdravljamo in jo ocenjujemo kot dobro. Hkrati pa ugotavljamo, da gre razvoj izjemno hitro naprej, zdravljenja se spreminjajo in so vedno bolj personalizirana, zato vsebinsko, organizacijsko in prostorsko veliko bolj zahtevna kot do sedaj in zato tudi obremenjujoča za izvajalce in zdravstveno blagajno. Če smo s trenutno ravnjo zdravljenja onkoloških bolezni zadovoljni, pa, žal, še vedno izstopajo tudi področja obravnave onkoloških bolnikov, ki jih je potrebno izboljšati, nadgraditi in tudi na tem področju ujeti najrazvitejše države Evrope. Zato želimo opozoriti na nekatera izjemno pomembna in odprta vprašanja na področju celostne obravnave onkoloških bolnikov, s katerim nismo in ne moremo biti zadovoljni: med drugim na zgodnje odkrivanje bolezni, pravočasno diagnostiko in čimprejšnji začetek zdravljenja; na pravočasen dostop do najnovejših metod zdravljenja, ki prihajajo; na pravico bolnikov z rakom, da se zdravijo v varnih prostorih; na dostop bolnikov do sistemsko urejene celostne rehabilitacije; na sistemsko dostopno celostno paliativno oskrbo; na pravico bolnikov do enakovredno kakovostne obravnave ne glede na kraj bivanja, k čemer bi zagotovo pomembno doprinesla tudi vzpostavitev kliničnih registrov in dostop do kliničnih raziskav.«. Kristina Modic je dodala še, da je precej področij, ki si zaslužijo več pozornosti in aktivacije v klinični praksi in na državni ravni ter opozorila: » Pomembno je, da Državni program obvladovanja raka dobi več podpore s strani odgovornih v državi, da bi se lahko njegovi cilji čim bolj uresničevali tudi v praksi, kar sedaj – z izjemo preventivnih programov – ne moremo reči.«
V Sloveniji je dostop do zdravil in novih tehnologij v onkologiji v splošnem dober. Izboljšave so možne v krajšem času razvrstitve nove terapije v Sloveniji po odobritvi evropske agencije za zdravila EMA. Povprečni čas za razvrstitev vseh novih zdravil v Sloveniji je po zadnjih podatkih namreč 417 dni, v onkologiji 496 dni. Izziv pri uvajanju novih zdravil je vmesno obdobje med odobritvijo novega zdravila s strani EMA in razvrstitvijo tega zdravila na listo. Pri bolnikih, kjer so izčrpane vse možnosti zdravljenja, ali teh sploh ni, lahko namreč bolnik prejme v EU še neodobreno zdravilo prek tako imenovanega instituta sočutne uporabe. Isti hip, ko je zdravilo v EU odobreno, sočutna uporaba praviloma ni več mogoče in se čaka na razvrščanje zdravila na listo. Vmesno obdobje je, posebej za onkološke bolnike, lahko predolgo. Zato se Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ, zavzema za postopek, ki ga uporabljajo v Nemčiji, da se zdravilo razvrsti takoj, ko ga EMA odobri in se potem začne proces dokazovanja stroškovne učinkovitosti zdravila. Mag. Barbara Stegel, generalna sekretarka omenjenega Mednarodnega foruma, je pojasnila še: »Prihodnost v onkologiji se dogaja že danes, praktično iz dneva v dan. Vseskozi potekajo raziskave in razvoj učinkovitejših, varnejših in bolniku prijaznejših zdravil ter diagnostičnih postopkov. Razvoj gre predvsem v smeri bolniku prilagojenega zdravljenja, po eni strani na področju imunološkega zdravljenja, po drugi pa na področju genskih terapij ter tarčnega zdravljenja. Pri teh novostih je ključnega pomena ustrezna, tudi genomska diagnostika. Pri tako hitrem znanstvenem razvoju je naša skupna želja, da bi se enako hitro prilagajali tudi regulatorni postopki, sistemi financiranja in organizacija v zdravstvu, s ciljem čim hitrejšega dostopa bolnikov do novih, učinkovitejših terapij.«.
Prof. dr. Samo Zver, dr. med. , predstojnik Kliničnega oddelka za hematologijo UKC Ljubljana, je predstavil prizadevanja za vzpostavitev zdravljenja z novo celično terapijo CAR-T, ki je za določene skupine bolnikov, pri katerih druge terapije niso bile uspešne, že dostopna v tujini, naši strokovnjaki pa si želijo, da bo vsem slovenskim bolnikom, ki jo potrebujejo, čim prej na voljo v Ljubljani. Opozoril je na težave pri implementaciji CAR-T zdravljenja v klinično prakso z vidika prostora, opreme in zakonodaje, kar poskušajo premostiti in zagotoviti vse pogoje za čim hitrejšo vpeljavo nove terapije v prakso tudi pri nas : »Mi smo majhni, ni nas 90 milijonov kot Nemcev, ampak imamo intelektualen potencial, treba pa se je povezati. In glede tega novega zdravljenja se nameravamo povezati z Medicinsko fakulteto, Zavodom za transfuzijsko medicino in drugimi strokami, da ugotovimo, kaj lahko vsak med nami prispeva. Imamo znanje, imamo voljo in imamo zagotovilo generalnega direktorja ZZZS tudi za sredstva, potrebna, da vzpostavimo »mašinerijo«, je pa pot dolga. Mislim, da bomo lastno CAR – T tehnologijo za zdravljenje vzpostavili nekje v dveh letih. Ovire so neskončne. Naj omenim le na primer Zakon o zdravilih. V delu, ki zadeva zdravila za napredno zdravljenje, trenutno veleva, če povem preprosto, da lahko razvijamo CAR – T celice za bolnika, ne smemo mu jih pa dati. Te nesmisle moramo premostiti.«.
Predsednica združenja Onko Net Kristina Modic je izpostavila tudi problematiko neustreznih prostorov, v katerih se zdravijo nekateri onkološki bolniki: »Izpostavila bi predvsem Kliniko za gastroenterologijo UKC Ljubljana, kjer na hodnikih kletnih prostorov bolniki prejemajo zdravljenja s kemoterapijo. Nekateri so tam celo več dni hospitalizirani. Ja, na hodniku. Tudi drugi prostori za obravnavo bolnikov na KOGE so dotrajani in za bolnike in zdravstveno osebje neprimerni. Sprašujem se, ali morda vse to tudi dodatno pripomore k slabšemu izidu zdravljenja? Druga kritična točka pa so življenjsko nevarni prostori hematoloških ambulant in dnevne bolnišnice na Polikliniki UKC Ljubljana. Tu so bolniki s krvnim rakom, ki so prejeli najtežja onkološka zdravljenja s PKMC in so kljub ozdravitvi imunsko zelo slabi, dejansko življenjsko ogroženi.«.
Združenje Onko Net je okroglo mizo zato zaokrožilo s pozivom odgovornim, naj nemudoma pristopijo k reševanju obeh kritičnih in življenjsko ogrožajočih mest za zdravljenje najtežje bolnih onkoloških bolnikov.
Združenje ONKO NET sestavljajo naslednje organizacije:
“,”Jaka Verbic Miklic”,1581625860,1581625860,sl,14213,306,14212,43,0,NULL,,”Forumovo sodelovanje na okrogli mizi”,forumovo-sodelovanje-na-okrogli-mizi,Post,”/sites/43/files/images/news/ONKO okrogla miza/ONKO-Net.jpg”,1,0,1581625776,1581924107
616,14213,”Forum at the panel discussion of the Association of Slovenian Cancer Patients Organisations”,”Will the state be able to continue to maintain and develop a high level of oncology in the future?”,”
Ljubljana, 12 February 2020 – The Association of Slovenian Cancer Patients Organisations Onko Net has joined forces with Slovenian cancer management experts to raise awareness of the increasing burden of cancer in Slovenia, rapid development of oncology treatments and associated improvements in treatment success and survival rates of cancer patients while rates of survival for the most common cancer types remain slightly below European average. The Onko Net association emphasized the need for faster access to diagnostics that are essential for early detection, early treatment and positive outcomes; the need for systemic regulation of comprehensive treatments for cancer patients that include timely rehabilitation; assurance of spatial and personnel conditions for safe treatment of cancer patients, and the need for rapid institution of appropriate palliative care. Members of the organisation called on those responsible to assure personnel, organisational and financial resources to maintain the current standard and ensure further development of comprehensive care for cancer patients in Slovenia.
As many as 15.000 persons are diagnosed with cancer each year in Slovenia and with population aging the number will likely continue to grow. Effective national screening programs and access to modern oncology treatments cancer in Slovenia is in many cases becoming a well managed chronic disease. Currently there are almost 107,000 people living among us who once had cancer. Despite the fact that the five year cancer survival rate in Slovenia remains slightly below the European average, or as izr. prof. dr. Vesna Zadnik, M. D., Head of Epidemiology and Cancer Register at Ljubljana’s Institute of Oncology explains: “Survival of Slovenian cancer patients is improving in practically all cancer types. It has doubled over the last thirty years. We are also seeing a reduction of differences between women and men who had much lower survival rates in the past. International comparisons of cancer survival rates are available as part of the Concord study. Comparisons were made only for the most common cancer types. In most locations Slovenia is placed slightly below the European average.”
Acting Medical Director of Ljubljana’s Institute of Oncology izr. prof. dr. Viljem Kovač, M. D., added that survival rates of Slovenian patients with rare cancer types are above average. He listed a lack of personnel and spatial constraints as the greatest problem of oncological treatment and described the greatest achievement as: “We can be proud to provide Slovenian citizens with screening programs that are among the most successful in Europe. Patients have access to practically all modern clinical treatments including the most demanding ones. The Institute of Oncology has since its inception strived for comprehensive treatment and research work. That is why patients can now receive various forms of comprehensive treatment: surgery, radiotherapy and many different systemic treatments. However, the aforementioned constraints of space and personnel limit us and prevent us from pursuing certain activities as intensively as we would like to, although we do engage in them.”
If early detection of cancer in target groups through national screening programs has been very successful, early diagnosis of suspected oncological diseases in the remaining population is very difficult in Slovenia due to excessive waiting periods at all levels of healthcare. “In the fields of cancer of the digestive tract, gynecological and urological cancers imaging diagnostics procedures in Ljubljana University Medical Centre are the limiting factor, especially CT. A contributing factor in this problem is also a great inflow of patients from other Slovenian regions. Through great efforts we are able to ensure timely imaging diagnostic procedures in most cases. We are expecting that the delivery of new CT devices and modernizations to other equipment will improve the situation. In cooperation with the Institute of Oncology we use state of the art procedures for our patients (surgical, radiotherapeutical and systemic). We also carry out robot supported surgical procedures for prostate cancer.«, reported Medical Director of the Ljubljana University Medical Centre prof. dr. Jadranka Buturović Ponikvar, M. D.
Director General of the Health Insurance Institute of Slovenia Marjan Sušelj said that the Health Insurance Institute of Slovenia recognized cancer patients as one of the most vulnerable population groups and that the increasing burden of cancer is becoming an increasing challenge for Slovenian society. Population aging requires effective organization and financing of public healthcare services on one hand and effective promotion of health on the other, with projects that include the promotion of healthy lifestyle and care for a healthy environment and food. Mr. Sušelj went on to say that “the Health Insurance Institute of Slovenia has therefore been increasing its investments in this field by paying for diagnostic and treatment procedures for cancer patients without limitations and in line with the actual needs of patients. We are also carrying out very effective screening programs for managing different types of cancer (DORA, ZORA, SVIT), introducing new, more effective medicines and state of the art diagnostic procedures. A 50 % vaccination rate of girls against HPV is among the best in Europe and we support the introduction of such vaccination for boys due to its exceptional success in preventing cervical cancer. Last year we introduced state of the art diagnostics procedures in hematology and this summer we will begin financing new gene testing in molecular genetic diagnostics for oncology. Studies of the Institute show that it is very important that we institute new effective screening programs for certain other cancer types such as lung and stomach cancer and to assure sufficient capacities (personnel, space, buildings) and appropriate organization of healthcare services by introducing regional centers for most common cancer types. All these measures will require us as a society to allocate much more money for healthcare, perhaps also by introducing excise duties on tobacco and alcohol that are causing us plenty of harm.”
Mojca Gobec, Director General of the Public Health Directorate at the Ministry of Health reminded of the importance of primary and secondary prevention efforts and comprehensive rehabilitation for cancer management, praised the effectiveness of national screening programs and undertakings from the National Cancer Management Plan and also expressed the need to institute a network of hospitals for treatment of common cancer types: “To enable clinical registries to better monitor the quality of oncological care. Such measures were taken by many countries and our data also shows that cases where cancer is treated with a professional and interdisciplinary approach from the very first step record much better survival rates than cases where things become derailed and end up either at the Ljubljana University Medical Centre or the Institute of Oncology. Increased incidence of cancer also requires planning of personnel in oncology”.
Kristina Modic, President of the Onko Net Association praised the achieved level of oncological treatment and expressed the expectation that the healthcare system will continue to ensure and develop it in the future. “Slovenian cancer patient organizations praise the current level of oncological treatment and assess it as good. We also find that development is progressing very fast, treatments are evolving and becoming increasingly personalized and therefore much more demanding in terms of content, organization and spatial requirements, which is placing greater demand on service providers and the healthcare budget. Although we are pleased with the current level of treatment of oncological diseases, there do remain certain areas of oncology that need to be improved and upgraded in order to catch the most developed countries in Europe. That is why we wish to emphasize certain very important and open issues in the field of comprehensive treatment of oncology patients which we cannot be satisfied with. These include early discovery of the disease, timely diagnostics and rapid commencement of treatment; timely access to state of the art and arising treatment methods; the right of cancer patients to receive treatment in safe premises; to patient access to systemic comprehensive rehabilitation; to systemic and accessible comprehensive paliative care; to the right of patients to equal quality of treatment regardless of their place of residence, which would certainly be better served with the introduction of clinical registers and access to clinical trials.” Kristina Modic added further that there were several areas deserving of greater attention and activation in clinical practice and state level and emphasized:”It is important that the National Cancer Management Plan receive greater support from those responsible in the country, so that its goals could be better achieved in practice. Currently – with the notable exception of screening programs – these goals remain unmet.”
Access to medicines and new technologies in oncology in Slovenia is generally good. Improvements are possible in short time after new therapies are classified in Slovenia once they receive approval from the European Medicines Agency. Recent data shows that the average time for classification of all new medicines in Slovenia is 417 days while oncology medicines take 496 days on average. The main challenge in the introduction of new medicines is the interim period between a new medicine being approved by the EMA and being classified on a list in Slovenia. Patients who have exhausted all treatment options or who do not have treatment options available at all may receive medicines not yet approved in the EU through the mechanism of the so called compassionate use. When a medicine is approved in the EU compassionate use is no longer possible and patients must wait for classification in Slovenia. The interim period may prove to be too long, especially for oncology patients. That is why the Forum of International Research and Development Pharmaceutical Companies, EIG, supports the introduction of the procedure used in Germany, where medicines are classified immediately after receiving EMA approval and the procedure of evidencing the cost efficiency of a medicine begins after classification. Mag. Barbara Stegel, Secretary General of the aforementioned Forum, also went on to say: ”In oncology the future is happening today, practically day to day. Studies, research and development of more effective, safer and more patient friendly medicines and diagnostic procedures never end. Development is focusing particularly on patient adapted treatment, firstly in the field of immunological treatment and secondly in the field of gene therapy and targeted treatment. In these new developments genetic diagnostics is a key component. With development moving as fast as it is, it is our common wish that regulatory procedures, financing systems and healthcare organization could adapt just as fast in order to provide patients with access to new and more effective therapies.”
Prof. dr. Samo Zver, M. D. , Head of the Clinical Department of Hematology at University Medical Centre Ljubljana, presented efforts to institute treatment using the new CAR-T cell therapy that is already available abroad to certain patient groups that had no success with other therapies and which our experts wish would be made available in Ljubljana for all Slovenian patients in need. He reported on problems during implementation of CAR-T treatment into clinical practice due to constraints of space, equipment and legislation, which the Department is trying to overcome and assure conditions for fast introduction of this new therapy into practice in Slovenia: “We are small, there isn’t 90 million of us like Germans, but we do have intellectual potential and we need to connect. And in the area of this new treatment we intend to connect with the Faculty of Medicine, the Blood transfusion center and other professions to find what each of us can contribute. We have the knowledge, the will and the assurance of the Director General of the Insurance Institute for the funding necessary to set up the “machinery”, but it is a long road. I believe we will be able to set up our own CAR-T treatment technology within two years. But the hurdles are endless. Let me just mention the Medicinal Products Act. In the section pertaining to advanced treatment medicines, the Act currently states, to put it simply, that we can develop CAR-T cells for a patient, but we must not administer them. Such absurdities must be changed.”
President of the Onko Net association Kristina Modic emphasized the issue of inappropriate premises where some oncology patients have been receiving treatment: “I wish to emphasize the Clinic of Gastroenterology at the Ljubljana University Medical Centre, where patients are receiving chemotherapy in the basement hallways. Some are even hospitalized there for several days. Yes, in the hallways. The other patient treatment facilities at the Gastroenterology Clinic are outdated and inappropriate for both patients and staff. I ask myself whether these factors contribute to poor treatment outcomes? The second critical point are the life threatening premises of hematology clinics and other specialist outpatient clinics of the Ljubljana University Medical Centre (Poliklinika). These host patients with blood cancers who have received the most demanding oncological treatments with HSCT and have greatly diminished immune systems in spite of having received treatment. Their lives are literally in danger.”
The Onko Net association concluded the panel discussion with a call to those responsible to immediately begin resolving both critical and life threatening places for treatment of patients with the most severe types of cancer.
The ONKO NET association includes the following organizations:
“,”Jaka Verbič Miklič”,1581702300,1581702300,en,14213,306,14212,43,0,NULL,,”Forumovo sodelovanje na okrogli mizi”,forumovo-sodelovanje-na-okrogli-mizi,Post,”/sites/43/files/images/news/ONKO okrogla miza/ONKO-Net.jpg”,1,0,1581625776,1581924107
617,14222,”Intelektualna lastnina”,”Vsako novo zdravilo se začne s prvo iskro zamisli.
To iskro je nato potrebno negovati skozi dolgotrajen in zapleten postopek razvoja zdravila, preden lahko začne spreminjati življenja bolnikov na boljše.”,”
Varovanje iskre lahko vključuje tudi zagotavljanje sredstev za zgodnjo fazo razvoja nove terapije, ustvarjanje pravega okolja za sodelovanje med partnerji v razvoju, nadgrajevanje regulatornega ogrodja v koraku s hitrim razvojem znanosti. Pomeni pa tudi izgradnjo trdnega in učinkovitega ogrodja za zaščito intelektualne lastnine.
Intelektualna lastnina je najpogosteje uporabljen izraz za opis sistema spodbud in nagrad, ki spodbuja in ščiti inovacije, pospešuje razvoj in usmerja investicije na področja neizpolnjenih zdravstvenih potreb. Iskro zamisli je potrebno varovati in ščititi do končnega razvoja v novo zdravilo. Farmacevtske spodbude in nagrade so omogočile dostop do današnjih zdravil in investicije v zdravila jutrišnjega dne za bolnike, ki jih potrebujejo že danes.
Sistem ukrepov, kot so patenti, varstveni certifikati in zaščita regulatornih podatkov so temelji, na katerih stoji inovacija. Družbam, ki raziskujejo in razvijajo nova zdravila daje določeno stopnjo varnosti in zagotovil, da bo zdravilo po vstopu na trg za določeno obdobje zaščiteno pred nepošteno konkurenco. Inovativne družbe takšno zaščito potrebujejo za investicije v dolgotrajen, zapleten in tvegan proces razvoja novih zdravil za bolnike, zdravstvene sisteme in družbo, ki nenazadnje tlakuje tudi pot uporabi nizkocenovnih generičnih zdravil v zdravstvenih sistemih.
Svet potrebuje celovit nabor spodbud, ki podpirajo razvoj rešitev za neizpolnjene potrebe bolnikov in razvoj odkritij osnovne znanosti v učinkovita zdravila. Prav takšne spodbude so v preteklosti omogočile razvoj zdravil, ki jih uporabljamo danes, in bodo podprle razvoj zdravil prihodnosti.
Več kot 7000 zdravil v razvoju dokazuje, da sistem deluje in omogoča razvojne postopke v tako velikem obsegu kljub visokemu tveganju neuspeha. Takšna nova zdravila bodo tudi v prihodnosti spreminjala življenja bolnikov; upočasnjevala napredovanje bolezni, omogočala izogibanje boleznim in zmanjševala skupne stroške zdravstvenih sistemov. Ta novi val inovacij v medicini in produkti, ki jih bo prinesel, preprosto ne bi obstajali brez farmacevtskih spodbud in nagrad.
Režim farmacevtskih spodbud je zapleten ekosistem, ki upošteva realnost biofarmacevtskega razvoja in potreb družbe. Kakršnakoli sprememba sistema farmacevtskih spodbud in nagrad prinaša tveganje spodkopavanja postopka inovacij, na katerega se zanašajo bolniki, zdravstveni sistemi in družba. Takšen primer je sprejem uredbe EU o odpovedi dodatnega varstvenega certifikata (SPC), ki v svet pošilja negativen signal, da Evropa slabi svoj sistem zaščite intelektualne lastnine. Evropa zato postaja manj zanimiva za investicije in izvajanje raziskav, takšni ukrepi pa vplivajo tudi na našo zmožnost za razvoj novih zdravil za bolnike.
Evropski oblikovalci politik morajo poiskati načine za vzpostavitev ravnovesja na področju inovacij in najti nove načine za zaščito iskre inovacij ter povrniti globalno zaupanje v Evropo kot destinacijo za raziskave, če naj Evropa razvije ves svoj potencial kot svetovna voditeljica na področju zdravstvenih raziskav in razvoja.
Več informacij je na voljo na naslovu:
https://www.efpia.eu/about-medicines/development-of-medicines/intellectual-propertv/
Patent ščiti inovacije, RDP ščiti podatke.
Za pridobitev dovoljenja za promet z zdravilom morajo farmacevtske družbe predložiti obsežne podatke v zvezi s predkliničnimi in kliničnimi preskušanji, da dokažejo kakovost, učinkovitost in varnost zdravila, ki ga je treba odobriti. Regulatorna zaščita podatkov (RDP) ščiti naložbe inovativnih podjetij v ustvarjanje te obsežne zbirke podatkov z omejenim obdobjem ekskluzivnosti podatkov, začenši z dovoljenjem za promet.
Po preteku RDP je proizvajalcem generikov dovoljeno, da se sklicujejo na podatke originalnega proizvajalca, da pridobijo odobritev za svoje izdelke. Takšna časovno omejena zaščita je ključnega pomena za spodbujanje znatnih naložb, potrebnih za dokazovanje varnosti in učinkovitosti novih zdravil, hkrati pa omogoča drugim podjetjem, da sčasoma registrirajo svoje izdelke na podlagi teh podatkov.
“,”Jaka Verbic Miklic”,1582782840,1582782840,sl,14222,306,14221,43,0,NULL,,”Intelektualna lastnina”,intelektualna-lastnina,Post,/sites/43/files/images/Fokus/Document-01.jpg,1,0,1582783315,1697368161
618,14222,”Intellectual Property “,”Every new treatment or cure starts with the spark of an idea. That spark has to be nurtured and cared for through the long and complex process of developing a medicine before it can begin to transform the lives of patients. “,”
Protecting that spark can involve ensuring funding for early stage development of a new therapy, it can be creating the right environment for collaboration between research partners, it can be evolving the regulatory framework to keep pace with rapidly advancing science and protecting the spark means having a strong and effective intellectual property framework.
Intellectual property (IP) is the most commonly used term to describe the framework of incentives and rewards that encourage and protect innovation, driving research and development investments to areas of unmet medical need. Protecting the spark of an idea until it becomes a new treatment or cure. Pharmaceutical incentives and rewards deliver access to today’s medicines and investment into the cures of tomorrow for patients who need them.
This framework of measures such as patents, supplementary protection certificates and regulatory data protection are the foundations on which innovation is built. They provide companies researching and developing new medicines the certainty that if a medicine makes it to the market, it will be protected from unfair competition for a limited period time. This is what they need to invest in the long, complex and risky process of delivering new medicines to patients, to healthcare systems and to society and what paves the way for low-cost generics to be used by healthcare systems.
A comprehensive suite of incentives is needed to foster the development of solutions to patients’ unmet needs and turn basic science into medicines. They have enabled the research and development of today’s medicines and will lead to tomorrow’s cures.
With over 7000 medicines in development, the system is working: it enables a pipeline of this scale despite the high risk of failure. These new treatments will continue to change patients’ lives; slowing disease progression, avoiding illness and reducing overall costs for healthcare systems. This exciting new wave of medical innovation and the products it will bring would simply not exist without pharmaceutical incentives and rewards.
The pharmaceutical incentives regime is a complex ecosystem that takes into account the realities of biopharmaceutical innovation and societal needs. Changing any part of the pharmaceutical incentives and rewards framework risks undermining the innovation process that patients, healthcare systems and society are relying on to address the challenges they face. The EU’s adoption of the SPC manufacturing waiver regulation is one such example, sending a negative signal that Europe is weakening its intellectual property framework, making Europe a less attractive place to invest, conduct research and impacting our ability to develop new treatments and cures for patients.
European policy makers need to find ways to redress the innovation balance, finding new ways to #ProtectTheSpark and restore global confidence in Europe as a research destination, if Europe is to realise its potential as a world leader in medical research and development.
More information please find below link:
https://www.efpia.eu/about-medicines/development-of-medicines/intellectual-propertv/
A patent protects inventions, RDP protects data.
In order to obtain a marketing authorisation, pharmaceutical companies need to submit extensive data relating to preclinical and clinical trials to demonstrate the quality, efficacy and safety of the medicine to be approved. Regulatory data protection (RDP) protects innovative companies’ investment in generating this extensive body of data through a limited period of exclusivity on the data, starting from marketing authorisation.
After the RDP period, generics are permitted to rely upon the originator’s data to obtain approval for their products through an “abbreviated” application. Such time limited protection is crucial to incentivize the significant investment necessary to demonstrate the safety and efficacy of new medicines, while nevertheless enabling other companies to eventually register their products on the basis of this data.
“,”Jaka Verbič Miklič”,1582783680,1582783680,en,14222,306,14221,43,0,NULL,,”Intelektualna lastnina”,intelektualna-lastnina,Post,/sites/43/files/images/Fokus/Document-01.jpg,1,0,1582783315,1697368161
619,14225,”#BrezPredaha: Dokler zdravila za redke bolezni ne postanejo manj redka”,”Inovativne farmacevtske družbe zato apelirajo na oblikovalce politik”,”
Inovativne farmacevtske družbe apelirajo na oblikovalce politik, naj podprejo robusten sistem spodbud za raziskave in razvoj na področju zdravil sirot in dajo upanje bolnikom, ki živijo z redkimi boleznimi.

Da bi prinesli upanje tridesetim milijonom Evropejcevi (vsakemu sedemnajstemu), ki živijo z redko boleznijo, morajo vsi partnerji v zdravstvu delati skupaj in zagotoviti, da bolniki lahko dostopajo do vseh trenutno razpoložljivih možnosti zdravljenja. Poleg tega moramo dodatno spodbuditi raziskave in razvoj novih možnosti zdravljenja za bolnike na področjih, kjer zdravila trenutno ne obstajajo. Noben od omenjenih dveh ciljev pa ne bo dosežen z ogrožanjem preverjene in učinkovite uredbe. Njuno doseganje zahteva drugačne pristope in rešitve.
Spodbujanje raziskav in razvoja zdravil sirot je dober primer načina, na katerega lahko industrijska strategija EU usmerja raziskovanje in inovacije v izpolnjevanje neizpolnjenih potreb bolnikov in hkrati tudi krepitev Evropskega gospodarstva. Morebitna vprašanja glede uspešnosti delovanja Uredbe o zdravilih sirotah pa je mogoče najbolje nasloviti v okviru Evropskega foruma za boljši dostop do zdravstvenih inovacij, ki bi združeval različne deležnike na tem področju.
V kontekstu aktualne presojeii učinkov uredbe o zdravilih sirotah EFPIA poziva evropske institucije, da zagotovijo stabilno in predvidljivo ogrodje predpisov in spodbud, s katerim bi še dodatno podprle nadaljnje raziskave in razvoj potrebnih novih zdravil za redke bolezni.
Redke bolezni so pogosto genetskega izvora. Pojavijo se večinoma v otroštvu in povzročajo hudo breme. Bolezni, kot so na primer amiotrofična lateralna skleroza (ALS), kronična limfocitna levkemija, duchennova mišična distrofija ali wilsonova bolezen, so zapletene, znanstveno zahtevne in raznolike bolezni, ki so sicer izjemno redke, toda skupno prizadenejo 30 milijonov Evropejceviii.
Evropska Unija je leta 2000 sprejela Uredbo o zdravilih sirotahiv, da bi poskrbela za potrebe Evropejcev, ki živijo z redko boleznijo. Pred uvedbo uredbe so bile raziskave na tem področju omejene in »zelo redke in niso privedle do bistvenega napredka v raziskavah«v. Glede na majhne populacije bolnikov s posamezno boleznijo, zapletenost in tveganje odkrivanja in razvoja zdravila, ki ima nato le majhno komercialno vrednost, so se pojavljale skrbi, da bi v odsotnosti posebnih spodbud za razvoj in inovacije razvili premalo ali nič novih specifičnih zdravil za te hude bolezni.
Uredba o zdravilih sirotah je spodbudila razvoj novih zdravil za bolnike z do sedaj neozdravljivimi boleznimi. Število odobrenih produktov za redke bolezni je od sprejema uredbe naraslo iz 8vi na današnjih 164vii.
Evropa je s sprejemom Uredbe o zdravilih sirotah in z njo povezanimi ciljno usmerjenimi spodbudami veliko pridobila. Uredba spodbuja raziskave in razvoj (npr. zmanjšanjem dajatev in pomočjo pri izvedbi protokolov) obetavnih metod zdravljenja in z 10-letno tržno ekskluzivnostjo nagrajuje tiste, ki prestanejo dolg in zapleten postopek razvoja nove metoda zdravljenja, postanejo novo zdravilo in prinesejo upanje bolnikom. Prednosti Uredbe o zdravilih sirotah so prinesle:
Poglobljeno razumevanje redkih bolezni, ki je bistveno za razvoj novih zdravil:
Spodbude so spremenile življenja bolnikov in njihovih družin, izboljšale izide zdravljenja in prispevale k rasti gospodarstva.
So ključnega pomena za širjenje znanj v medicini ter spodbujanje in ohranjanje raziskovalnega, inovativnega in investicijskega okolja v Evropi.
So ključnega pomena za širjenje znanj v medicini ter spodbujanje in ohranjanje raziskovalnega, inovativnega in investicijskega okolja v Evropi.
Kljub bistvenemu napredku 95%xi redkih bolezni še vedno ostaja brez možnosti zdravljenja. Nekateri izmed razlogov za takšno stanje so veliko število različic redkih bolezni po svetu (od 5000 do 8000), majhne in razpršene populacije bolnikov s posamezno boleznijo, pomanjkanje preverjenih bioloških označevalcev in končnih točk, slaba diagnostika in omejeno klinično znanje ter zapletenost in tveganja pri odkrivanju in razvoju zdravilxii.
Poleg naše skupne odgovornosti za iskanje novih možnosti zdravljenja za bolnike, ki živijo z redkimi boleznimi, lahko Uredba o zdravilih sirotah vlogo tudi v prihodnji gospodarski strategiji EU in pomaga promovirati trajnostne inovacije. V skladu s študijo gospodarskih in družbenih vplivov v biofarmacevtskih družbah, »(…) postopna odprava obstoječih spodbud v Evropi bi imela bistven negativen učinek na njihove operacije v Evropi, saj je več kot polovica [anketirancev] povedala, da bi takšen scenarij povzročil zmanjšanje njihovega razvojno raziskovalnega in komercialnega odtisa za več kot 25%. (…) Šibkejši režimi intelektualne lastnine zmanjšujejo pripravljenost družb za investicije v raziskave in razvoj [v Evropi].«
V skladu s potrebami po dostopu do novih zdravil sirot so raziskovalna farmacevtska podjetja zavezana sodelovanju z deležniki in iskanju novih modelov financiranja takšnih zdravil in s tem ohranjanju dostopa za bolnike in izboljševanju trajnosti zdravstvenih sistemov. Ponovno odpiranje uredbe, ki je namenjena podpori raziskav novih možnosti zdravljenja, ne bo izboljšala dostopa bolnikov – ne sedaj, ne v prihodnosti. Dostop lahko izboljša le iskanje novih skupnih pristopov v sodelovanju z vsemi vključenimi deležniki.
Nova zdravila in zgodnje odkrivanje pri otrocih in odraslih prinaša novo upanje. Uspeh in vrednost Uredbe pri spodbujanju razvoja novih zdravil je lahko v celoti dosežen le, če bolniki dobijo dostop do takšnih zdravil.
Pri dostopu do novih zdravil sirot pa obstajajo pomembne razlike med državami članicami, mestoma celo znotraj posamezne države članice. Kazalnik PATIENT W.A.I.T. za leto 2018 xiv ne kaže le, da so zdravila sirote manj dostopna. V več kot 80 odstotkih 26 analiziranih evropskih držav je tudi njihova pot do bolnikov po odobritvi dolgotrajnejša.
Zagotavljanje dostopa do novih zdravil sedanjosti in prihodnosti je skupni cilj in odgovornost, ki zahteva sodelovanje regulatorjev, partnerjev v zdravstvu, bolnikov, vlad in panoge. Deležniki morajo skupaj poiskati nove vire financiranja inovativnih zdravil, ki bodo zagotovili dostop za bolnike in trajnostno vzdržnost nacionalnih zdravstvenih sistemov. Dosežen je bil opazen napredek:
• Družbe že izvajajo inovativne ureditve, na primer upravljane vstopne pogodbe in sheme zgodnjega dostopa, s katerimi podpirajo dostop bolnikov do novih zdravil.
• Številne Evropske države so sprejele sheme HTA in povračil stroškov, da bi kar najbolje izkoristile vrednost, ki jo prinašajo novi produkti.
EFPIA verjame, da je prišel čas za novo vrsto pogovorov v Evropskih ustanovah o sprejemu predloga EU zdravstvene koalicije in vzpostavitvi foruma za boljši dostop do zdravstvenih inovacijxv, ki bi združil vse deležnike na zadevnem področju v iskanju rešitev za dostop do novih zdravil in tehnologij danes, zdravstvene inovacije za jutri in oblikovanje vzdržnih zdravstvenih sistemov v globalno konkurenčni Evropi. Le s takšnim dialogom je mogoče identificirati in oblikovati smiseln odziv na izzive, s katerimi se spopadajo zdravstveni sistemi.
i http://www.orpha.net/national/data/NO-NO/www/uploads/Orphanet_publication_pointprev_2019.pdf
ii https://www.who.int/medicines/areas/priority medicines/BP6 19Rare.pdf
iii https://ec.europa.eu/info/research-and-innovation/research-area/health/rare-diseases_en
iv https://ec.europa.eu/health/sites/health/files/files/eudralex/vol-1/reg_2000_141_cons-2009-07/reg_2000_141_cons-2009-07_en.pdf
v https://ec.europa.eu/health/sites/health/files/files/orphanmp/doc/orphan_inv_report_20160126.pdf
vi Mark L Flear, Anne-Maree Farrell, Tamara K Hervey and Therese Murphy (eds) (2013) European law and New Health Technologies. Oxford Studies in European Law.
vii https://www.ema.europa.eu/en/documents/other/orphan-medicines-figures-2000-2018 en.pdf
viii https://www.pugatch-consilium.com/reports/Benchmarking success.pdf
ix https://www.ema.europa.eu/en/documents/other/orphan-medicines-figures-2000-2018_en.pdf
x http://www.europlanproject.eu/NationalPlans?idMap=1
xi Global Genes, Rare diseases: Facts and Statistics, https:// globalgenes.org/rare-diseases-facts-statistics/
xii https://www.pugatch-consilium.com/reports/Benchmarking_success.pdf and https://www.who.int/medicines/areas/priority medicines/BP6_19Rare.pdf
xiii https://www.efpia.eu/media/412939/efpia-economic-societal-footprint-industry-final-report-250619.pdf
xiv https://www.efpia.eu/media/412747/efpia-patient-wait-indicator-study-2018-results-030419.pdf
xv https://www.euhealthcoalition.eu/recommendations/
Bolezen nikoli ne spi. Medtem, ko mi počivamo, je bolezen aktivna. Nikoli si ne vzame predaha. Morda se nam včasih zazdi, a bolezen le za hip zamiži, zajame sapo in nadaljuje s svojim, še odločnejšim pohodom. Bolezen nikoli ne spi, zato morajo inovacije v zdravstvu vedno teči korak pred njo, da nam pomagajo prebiti njene okope.
Zato bomo delali brez predaha, dokler svet ne postane bolj zdrav za vse.
V naslednjih petih letih bodo prodorne inovacije v zdravstvu spremenile življenja bolnikov po vsem svetu. Predstavljamo šest terapevtskih področij, kjer bo napredek najbolj očiten.
Delali bomo brez predaha, dokler terapije s celicami CAR-T ne postanejo učinkovito orožje v boju proti raku in dokler ne bodo morda celo povsem nadomestile agresivnega zdravljenja s kemoterapijo.
Genske terapije lahko spremenijo življenje bolnikom s hemofilijo B, zato za nas ne bo predaha, dokler takšnih redkih boleznih ne bomo znali olajšati ali celo ozdraviti.
Kombiniranje zdravil proti raku povečuje njihovo učinkovitost in pomaga ljudem živeti bolje. Brez predaha bomo raziskovali, dokler ne bomo znali nadzorovati ali celo ozdraviti ne-drobnoceličnega pljučnega karcinoma.
Alzheimerjeva bolezen je ena največjih javnozdravstvenih izzivov v Evropi, a mi si ne bomo vzeli predaha, dokler je z novimi zdravili ne bomo znali ustaviti.
Za nas ne bo predaha, dokler celična terapija ne bo nadomestila vseživljenjske insulinske terapije za bolnike s sladkorno boleznijo.
Brez predaha bomo oblikovali nove rešitve, dokler protibakterijska monoklonska protitelesa ne bodo upočasnila napredovanja odpornosti bakterij na antibiotike in se bodo lahko borila proti bakterijskim okužbam.
“,”Jaka Verbic Miklic”,1583060880,1583060880,sl,14225,306,14224,43,0,NULL,,”#BrezPredaha: Dokler zdravila za redke bolezni ne postanejo manj redka”,brezpredaha-dokler-zdravila-za-redke-bolezni-ne-postanejo-manj-redka,Post,”/sites/43/files/images/Fokus/WeWontRest/Until We Make Treatment for Rare Diseases Less Rare.jpg”,1,0,1583060993,1583260568
620,14225,”#WeWontRest Until We Make Treatment for Rare Diseases Less Rare”,”The innovative pharmaceutical industry urges policymakers to support robust incentives”,”
The innovative pharmaceutical industry urges policymakers to support robust incentives for research and development of orphan medicines to give hope to patients living with rare diseases

To give hope to the 30 millioni (1 in 17) Europeans living with a rare disease, all partners in healthcare need to work together to ensure that patients get access to currently available treatments. In addition, we need to further incentivise the research and development of new treatments for patients, where, currently, no treatment options exist. Neither of these two imperatives will be addressed by jeopardising a proven, effective Regulation – they require separate approaches and different solutions.
Incentivisation of research and development of orphan medicines is a good example of how an EU Industrial Strategy can channel research and innovation towards meeting patients’ unmet needs, and also strengthen the European economy. Meanwhile, any concerns on the good functioning of the Orphan Medicinal Products Regulation can be best addressed in the framework of an EU multi-stakeholder Forum for Better Access to Health Innovation.
In the context of the current evaluationii of the OMP Regulation, EFPIA calls on European institutions to ensure a stable and predictable regulatory and incentives’ framework. This will support further research and development into much needed new treatments for rare diseases.
The EU Orphan Regulation has brought hope to people living with rare diseases.
Rare diseases are often genetic in origin, mostly emerging in childhood and result in a severe burden of illness. Diseases such as amyotrophic lateral sclerosis (ALS), chronic lymphocytic leukaemia, Duchenne Muscular Dystrophy, or Wilson’s disease, to name a few, are complex, scientifically challenging and heterogenous diseases in nature, which despite being rare or very rare, collectively affect 30 million Europeansiii.
In 2000, the European Union adopted the Regulation on Orphan Medicinal Productsiv (“Orphan Regulation”) to address the needs of Europeans living with such a rare disease. Prior to its introduction, research in this area was limited and “too few and did not lead to significant progress in research”. Given the small patient populations associated with each rare condition, the complexity and risk associated with drug discovery and developments, and the corresponding limited commercial viability, there was mounting concern that without incentives to encourage research and innovation, no or too few new specific treatments would be developed for these serious conditionsv.
The Orphan Regulation has stimulated the development of new treatments for patients living with previously untreatable rare diseases – we have seen an increase from just 8vi authorised products for rare diseases before the entry into force of the Regulation, to 164 todayvii.
Europe has benefited greatly from the adoption of the Orphan Regulation and the targeted incentives it established. It stimulates R&D (e.g., via fee reduction and protocol assistance) into treatments showing great potential, and it rewards with 10-year market exclusivity those that ultimately make it through the long and complex development process, to become a new treatment and hope for patients. The benefits of the Orphan Regulation have led to:
Since the adoption of the Regulation, 23 European countries also adopted at least 1 national rare disease planx.
These incentives have transformed the lives of patients and their families, improving health outcomes and contributing to a thriving economy. They are central to developing treatment options for previously untreatable conditions, they advance medical knowledge more broadly, as well as foster a supportive research, innovation and investment environment in Europe.
We believe that no patient should be left behind. The Orphan Regulation is critical to foster further investment and innovation in Europe to deliver new treatments for these remaining rare diseases.
Despite these significant advances, 95%xi of rare conditions remain without a treatment option. This is due to the many distinct rare diseases that exist globally (estimated 5000 to 8000), small and scattered patient populations associated with each condition, lack of validated biomarkers and end-points, poor diagnostics and limited clinical expertise as well as the complexity and risk associated with drug discovery and developmentsxii.
In addition to our collective responsibility to find new treatment options for patients living with rare diseases, the Orphan Regulation can play a role in a future EU industrial strategy, helping to promote sustainable innovation. According to the Economic and Societal Footprint study among biopharmaceutical companiesxiii, “(…) phasing out current incentives in Europe would have a material negative effect on their European operations, with over half [of the respondents] indicating that this scenario would lead to a reduction in their R&D and commercial footprints of more than 25%. (…) Weaker intellectual property regimes limit the willingness of companies to invest in R&D [in Europe].”
In view of the needs regarding access to novel orphan treatments, the research-based pharmaceutical industry is committed to working together with stakeholders to find new pricing models to finance these, thus ensuring access for patients and improving sustainability for health systems. Re-opening the Regulation, designed to support research into new treatment options, will not improve patient access – now or in the future. Finding new and collaborative approaches involving all relevant stakeholders, will.
New hope comes from new treatments and early diagnosis both in child and adult patients. The success and value of the Regulation in stimulating the development of new treatments can only be fully realised if patients get access to them.
There are challenges regarding access to novel orphan treatments and considerable inequalities between, and sometimes even within, Member States. According to the 2018 PATIENT W.A.I.T. Indicatorxiv, not only are orphan medicines less available but they also take more time to reach patients following European Medicines Agency approval in over 80% of the 28 analysed European countries.
Ensuring patient access to the new treatments of today and tomorrow is a shared goal and responsibility. It requires regulators, health system partners, patients, governments and industry sitting together to find new ways to finance these innovative treatments and to ensure access for patients and sustainability for health systems at national level. There has been some progress:
EFPIA believes that is time for a different type of conversation calls on the European Institutions to implement the EU Health Coalition’s call to establish a multi-stakeholder Forum on Better Access to Health Innovationxv that brings all actors together to discuss how to ensure access to new treatments and technologies today, medical innovation for tomorrow and sustainable healthcare systems in a globally competitive Europe. Only through such a dialogue a meaningful response to the challenges of healthcare systems can be identified and implemented.
i http://www.orpha.net/national/data/NO-NO/www/uploads/Orphanet_publication_pointprev_2019.pdf
ii https://www.who.int/medicines/areas/priority_medicines/BP6_19Rare.pdf
iii https://ec.europa.eu/info/research-and-innovation/research-area/health/rare-diseases_en
iv https://ec.europa.eu/health/sites/health/files/files/eudralex/vol-1/reg_2000_141_cons-2009-07/reg_2000_141_cons-2009-07_en.pdf
v https://ec.europa.eu/health/sites/health/files/files/orphanmp/doc/orphan_inv_report_20160126.pdf
vi Mark L Flear, Anne-Maree Farrell, Tamara K Hervey and Therese Murphy (eds) (2013) European law and New Health Technologies. Oxford Studies in European Law.
vii https://www.ema.europa.eu/en/documents/other/orphan-medicines-figures-2000-2018_en.pdf
viii https://www.pugatch-consilium.com/reports/Benchmarking_success.pdf
ix https://www.ema.europa.eu/en/documents/other/orphan-medicines-figures-2000-2018_en.pdf
x http://www.europlanproject.eu/NationalPlans?idMap=1
xi Global Genes, Rare diseases: Facts and Statistics, https:// globalgenes.org/rare-diseases-facts-statistics/
xii https://www.pugatch-consilium.com/reports/Benchmarking_success.pdf and https://www.who.int/medicines/areas/priority_medicines/BP6_19Rare.pdf
xiii https://www.efpia.eu/media/412939/efpia-economic-societal-footprint-industry-final-report-250619.pdf
xiv https://www.efpia.eu/media/412747/efpia-patient-wait-indicator-study-2018-results-030419.pdf
xv https://www.euhealthcoalition.eu/recommendations/
“,”Jaka Verbic Miklic”,1583060880,1583060880,en,14225,306,14224,43,0,NULL,,”#BrezPredaha: Dokler zdravila za redke bolezni ne postanejo manj redka”,brezpredaha-dokler-zdravila-za-redke-bolezni-ne-postanejo-manj-redka,Post,”/sites/43/files/images/Fokus/WeWontRest/Until We Make Treatment for Rare Diseases Less Rare.jpg”,1,0,1583060993,1583260568
622,14235,”Pravilnik o spremembah Pravilnika o določanju cen zdravil za uporabo v humani medicini”,” “,”
579. Pravilnik o spremembah Pravilnika o določanju cen zdravil za uporabo v humani medicini
Na podlagi tretjega odstavka 158. člena Zakona o zdravilih (Uradni list RS, št. 17/14 in 66/19) minister za zdravje izdaja
P R A V I L N I K
o spremembah Pravilnika o določanju cen zdravil za uporabo v humani medicini
1. člen
V Pravilniku o določanju cen zdravil za uporabo v humani medicini (Uradni list RS, št. 32/15, 15/16, 19/18 in 11/19) se v 9. členu v drugem odstavku prvi stavek spremeni tako, da se glasi:
»Sestavni del vloge iz prejšnjega odstavka je izpolnjen obrazec B1 iz Priloge 1 tega pravilnika v fizični in elektronski obliki v xls formatu.«.
2. člen
11. člen se spremeni tako, da se glasi:
»11. člen
(1) Vrednost PEC se izračuna na podlagi primerjalne cene zdravil.
(2) Osnova za izračun primerjalne cene zdravil so cene zdravil, ki so financirana iz javnih sredstev v primerjalnih državah Avstriji, Franciji in Nemčiji (v nadaljnjem besedilu: primerjalne države).
(3) Za ugotavljanje vrednosti PEC se uporabljajo zadnje elektronske izdaje oziroma pripadajoči neposredni spletni viri ali izdajateljev licenčni vir:
– Avstrija: Erstattungskodex, izdajatelj Hauptverband der österreichischen Sozialversicherungsträger, za zdravila, ki jih Erstattungskodex ne navaja, se uporablja vir Warenverzeichnis, izdajatelj Österreichische Apotheker-Verlagsgesellschaft m.b.H., izračun iz cene zdravila na drobno brez davka na dodano vrednost;
– Francija: Vidal, izdajatelj Vidal France izračun iz cene zdravila na drobno, kadar cena zdravila na drobno ni podana, se uporablja cenovni standard UCD;
– Nemčija: Lauer-Taxe, izdajatelj Lauer-Fischer GmbH ali cenik ABDA Datenbank, izdajatelj Bundesvereinigung Deutscher Apothekerverbände, izračun iz cene zdravila na debelo z upoštevanjem najnižje cene zdravila na debelo.
(4) Predlagatelj na obrazcu B1 iz Priloge 1 tega pravilnika navede uporabljen vir in ceno iz prejšnjega odstavka ter datum zajema podatkov.
(5) Cene iz vira podatkov primerjalnih držav se za posamezno primerjalno državo preračunajo na naslednji način:
– za Nemčijo se cene preračunajo tako, da se uporabi Enačba 1, ki je v Prilogi 2, ki je sestavni del tega pravilnika;
– za Francijo se cene preračunajo tako, da se uporabita Enačba 2 in Tabela 1, ki sta v Prilogi 2 tega pravilnika;
– za Avstrijo se cene preračunajo tako, da se uporabi Tabela 2, ki je v Prilogi 2 tega pravilnika.
(6) Ne glede na prejšnji odstavek zavezanci kot primerjalne cene zdravil pri zdravilih, ki se v primerjalnih državah prodajajo izvajalcem zdravstvenih storitev neposredno mimo veletrgovcev, neposredno upoštevajo cene, navedene v viru primerjalne države.
(7) Zavezanci v primeru iz prejšnjega odstavka predložijo:
– izjavo o obstoju tega načina prodaje zdravil;
– preračun cene v skladu s tem pravilnikom z upoštevanjem dejanske prodajne cene na debelo in z obrazložitvijo za vsako od primerjalnih držav ter
– dokazilo o dejanski prodajni ceni na debelo, ki, če predstavlja plačilni dokument, ne sme biti starejše od treh mesecev.«.
3. člen
V 12. členu se v drugem odstavku četrta alineja spremeni tako, da se glasi:
»– če je generično zdravilo prisotno na trgu le v eni primerjalni državi in v nobeni primerjalni državi ni originalnega zdravila, je primerjalna cena zdravila povprečje najvišje in najnižje vrednosti preračunane cene v tej državi. Če je v tej državi prisotno le eno generično zdravilo, se upošteva njegova cena. Vrednost PEC generičnega zdravila lahko dosega največ 72 odstotkov primerjalne cene.«.
4. člen
15. člen se spremeni tako, da se glasi:
»15. člen
(1) Ne glede na določbo drugega odstavka 9. člena tega pravilnika vloga, če v primerjalnih državah ni niti generičnega niti originalnega zdravila, vsebuje naslednje sestavine:
– obrazložen predlog najvišje dovoljene cene zdravila na debelo;
– podatek o dosedanji veljavni ceni zdravila na debelo oziroma najvišji dovoljeni ceni zdravila in podatke o njeni strukturi (delež, namenjen pokritju stroškov izdelave, ki vključujejo tudi stroške, ki izhajajo iz zahtev pristojnih organov na podlagi predpisov, ki urejajo zdravila, cene zdravil, kritja zdravil iz zdravstvenega zavarovanja in stroškov trgovine na debelo), če so bile te cene določene;
– podatke o proizvajalčevih cenah in cenah istega zdravila na debelo brez davka na dodano vrednost CIP kupec v drugih državah članicah EU in državah podpisnicah Sporazuma o EGP, če v posamezni državi na trgu ni enakega pakiranja, se navaja po številu enot primerljivo pakiranje. Če zdravilo ni prisotno na trgu v drugih državah članicah EU oziroma državah podpisnicah Sporazuma o EGP, predlagatelj navede ustrezne podatke za druge evropske države, z navedbo vira in na obrazcu B3 iz Priloge 1 tega pravilnika v elektronski obliki v xls formatu;
– podatke o financiranju zdravila iz javnih sredstev v drugih državah članicah EU in državah podpisnicah Sporazuma o EGP, v katerih je po podatkih zavezanca to zdravilo prisotno na trgu;
– dokazila o podatkih iz vloge.
(2) JAZMP lahko cene zdravil v drugih državah članicah EU, državah podpisnicah Sporazuma o EGP in drugih evropskih državah preveri v javno dostopnih podatkovnih zbirkah oziroma v spletnih virih in te podatke uporabi pri izračunu vrednosti PEC.
(3) Vrednost PEC se ugotovi kot mediana proizvajalčevih cen iz tretje alineje prvega odstavka tega člena z upoštevanjem cen iz prejšnjega odstavka, v drugih državah članicah EU in državah podpisnicah Sporazuma o EGP, v katerih se zdravilo trži in je financirano iz javnih sredstev. Če zdravilo ni prisotno na trgu drugih držav članic EU in držav podpisnic Sporazuma o EGP, se vrednost PEC ugotovi kot mediana proizvajalčevih cen v drugih evropskih državah, v katerih je zdravilo prisotno na trgu. Če je zdravilo prisotno samo na trgu v Republiki Sloveniji, se vrednost PEC izračuna iz trenutno veljavne najvišje dovoljene cene tega zdravila.
(4) Najvišja dovoljena cena zdravila je enaka vrednosti PEC iz prejšnjega odstavka, povečana največ za dodani delež veletrgovine, na podlagi tabele iz Priloge 3, ki je sestavni del tega pravilnika.«.
5. člen
V 16. členu se v prvem odstavku prva alineja spremeni tako, da se glasi:
»– ima zdravilo določeno najvišjo dovoljeno ceno oziroma kadar najvišja dovoljena cena še ni določena, lahko zavezanec Stran 1756 / Št. 26 / 16. 3. 2020 Uradni list Republike Slovenije pri JAZMP istočasno vloži vlogo za določitev najvišje dovoljene cene in izredne višje dovoljene cene zdravila;«. V četrtem odstavku se v napovednem stavku za besedo »zdravila« črtata vejica in besedilo »ki niso uvrščena v seznam esencialnih ali nujno potrebnih zdravil iz 17. člena zakona,«., v drugi in tretji alineji pa se črta besedilo »pdf in«.
6. člen
V 19. členu se v prvem odstavku v 1. točki črta besedilo »ali več«.
7. člen
V 23. členu se tretji odstavek spremeni tako, da se glasi: »(3) V vlogi za uskladitev najvišjih dovoljenih cen zdravil se za vloge, vložene v prvi polovici leta, uporabljajo publikacije cen zdravil, izdane v februarju, za vloge, vložene v drugi polovici leta, pa publikacije cen zdravil, izdane v avgustu. Če je v posameznem mesecu več izdaj iste publikacije, se uporablja prva izdaja v predpisanem mesecu.«. V petem odstavku se v napovednem stavku črta besedilo »pdf in«.
8. člen
V Prilogi 2 se razdelek B nadomesti z novim razdelkom B, ki je kot Priloga sestavni del tega pravilnika.
PREHODNA IN KONČNA DOLOČBA
9. člen
Vloge za določitev najvišje dovoljene cene zdravila in vloge za določitev izredne višje dovoljene cene zdravila, ki so bile prejete do dneva uveljavitve tega pravilnika in o njih do tega dneva še ni bilo odločeno, se obravnavajo v skladu s tem pravilnikom.
10. člen
Ta pravilnik začne veljati naslednji dan po objavi v Uradnem listu Republike Slovenije. Št. 0070-4/2020 Ljubljana, dne 16. marca 2020 EVA 2020-2711-0002
Tomaž Gantar
minister za zdravje
“,”Jaka Verbic Miklic”,1584562980,1584562980,sl,14235,306,14234,43,0,NULL,,”Pravilnik o spremembah Pravilnika o določanju cen”,pravilnik-o-spremembah-pravilnika-o-dolocanju-cen,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,0,0,1584563054,1611174864
623,14235,”Rules amending the Rules determining the prices of medicinal products for human use”,” “,”
579. Rules amending the Rules determining the prices of medicinal products for human use
Pursuant to Paragraph 3 of Article 158 of the Medicinal Products Act (Official Gazette of the Republic of Slovenia no. 17/14 and 66/19), the Minister of Health hereby issues the following
R U L E S
amending the Rules determining the prices of medicinal products for human use
Article 1
In the Rules amending the Rules determining the prices of medicinal products for human use (Official Gazette of the Republic of Slovenia no. 32/15, 15/16, 19/18 and 11/19) the first sentence of the second paragraph of Article 9 shall be amended to read:
“A completed B1 form as per Appendix 1 hereto shall be enclosed with the application mentioned in the above paragraph in physical and electronic form in xls format.”
Article 2
Article 11 is hereby amended to read as follows:
“Article 11 (1)
The value of MEP shall be calculated on the basis of a comparative medicinal product price.
(2) The comparative medicinal product price shall be calculated on the basis of prices of medicinal products financed from public funds in comparative countries of Austria, France and Germany (hereinafter: comparative countries).
(3) The value of MEP shall be established using the latest electronic issues or accompanying direct web resources or licensed source of the issuer:
– Austria: Erstattungskodex, issued by der Österreichischen Sozialversicherungsträger. If medicines are not listed in the Erstattungskodex, calculations shall be based on those listed in the Warenverzeichnis, issued by Österreichische Apotheker-Verlagsgesellschaft m.b.H., calculation based on retail medicinal product price without value added tax;
– France: Vidal, issued by Vidal France, calculation of retail medicinal product price. When retail price is not listed, the UCD pricing standard shall be applied;
– Germany: Lauer-Taxe, issued by Lauer-Fischer GmbH, or the ABDA Datenbank pricelist, issued by Bundesvereinigung Deutscher Apothekerverbände, calculation from wholesale medicinal product price based on lowest wholesale price.
(4) The applicant shall list the applied resource and price referred to in the prior paragraph along with the data capture date on form B1 from Appendix 1 hereof.
(5) Prices from the source of data for comparative countries shall be calculated for each separate comparative country in the following manner:
– For Germany prices shall be calculated using Equation 1 stated in Appendix 2 which is a constituent part hereof;
– For France prices shall be calculated using Equation 2 and Table 1 stated in Appendix 2 hereto;
– For Austria prices shall be calculated using Table 2 stated in Appendix 2 hereto.
(6) Notwithstanding the previous paragraph applicants shall in the case of medicines sold to healthcare service providers in comparative countries directly without wholesalers use prices stipulated in the source of the comparative country as comparative prices.
(7) In the case referenced in the prior paragraph applicants shall submit:
– a statement of existence of this type of medicinal product sale;
– a calculation of price in accordance with these Rules, based on the actual wholesale price and with due substantiation of each of the comparative countries; and
– evidence of actual wholesale price which shall, if it is a document of payment, not be older than three months.
Article 3
Item four of paragraph two of Article 12 is hereby amended to read as follows:
“– if a generic medicinal product is present on the market in only one comparative country and the original medicinal product is not present in any of the comparative countries, the comparative price shall be the average of the highest and lowest calculated price in said country. If only one generic medicinal product is present in this country, its price shall be considered. The MEP value of a generic medicinal product may not exceed 72 percent of a comparative price.”.
Article 4
Article 15 is hereby amended to read as follows:
»Article 15 (1) Notwithstanding the provisions of paragraph two of Article 9 hereof applications shall in the absence of a generic or original medicinal product in any comparative country contain the following:
– substantiated proposal of the maximum allowed wholesale price of the relevant medicinal product;
– data on the currently valid wholesale price of the medicinal product or its maximum allowable price, including data on its makeup (share intended to cover manufacturing costs which include costs arising from requirements of competent bodies in the field of regulations pertaining to medicines, medicinal product pricing, coverage under mandatory health insurance and costs of wholesaling), if such prices were determined;
– data on manufacturer prices and wholesale prices of the same medicinal product CIP buyer without VAT in other EU member countries and EEA Agreement signatories; if the appropriate packaging is not available in an individual country, a comparable packaging by size shall be listed. If the medicinal product is not present on the market in other EU members or EEA Agreement signatories, the applicant shall list appropriate data for other European countries with a statement of source using the B3 form from Appendix 1 hereto in electronic xls format;
– data on financing of the medicinal product from public funds in other EU members and EEA Agreement signatories where the medicinal product is marketed according to the applicant;
– evidence supporting data on application.
(2) The Agency may verify prices in other EU member countries, EEA Agreement signatories and other European countries in publicly accessible databases or web resources and apply said data when calculating MEP value.
(3) MEP value shall be determined as the median of the manufacturer’s prices as per indent three of paragraph one of this Article by taking into account the prices listed in the prior paragraph, in other EU members and EEA Agreement signatories where the relevant medicinal product is being marketed and financed from public funds. If the medicinal product is not present on the markets of other EU members and EEA Agreement signatories, its MEP value shall be determined as the median of manufacturer’s prices in other European countries where the medicinal product is present on the market. If the medicinal product is marketed only in the Republic of Slovenia, its MEP value shall be calculated based on its currently applicable maximum allowable price.
(4) The maximum allowable price of a medicinal product shall be equal to the MEP value as per the above paragraph, increased by no more then the added wholesale share on the basis of the relevant table of Appendix 3, which is a constituent part of these Rules.”.
Article 5
Item one of the first paragraph of Article 16 is hereby amended to read as follows:
“– a medicinal product has a determined maximum allowable price. If a maximum allowable price is not yet determined, an applicant may concurrently file an application with the Agency for the determination of a maximum allowable price and exceptional higher allowed price;”.
In the introductory sentence of paragraph four the comma behind the word “medicinal products” and the text “not classified on the list of essential or indispensable medicinal products as per Article 17 of the Act,” shall be deleted. In indents two and three the text “pdf and” shall be deleted.
Article 6
In item one of paragraph one of Article 19 the text “or more” is hereby deleted.
Article 7
Paragraph three of Article 23 is hereby amended to read as follows:
“(3) In an application for harmonization of maximum allowed prices of medicinal products, submitted in the first half of the year, the publication of medicinal product prices issued in February shall be used, and for applications submitted in the second half of the year, the publication of medicinal product prices issued in August shall be used. If more than one issue of the same publication is published in a month, the first issue in the prescribed month shall be used.”.
The text “pdf and” is hereby deleted from the introductory sentence of the fifth paragraph.
Article 8
Section B of Appendix 2 shall be replaced by a new Section B which constitutes a component part hereof as the Appendix.
TRANSITIONAL AND FINAL PROVISION
Article 9
Applications for determination of the maximum allowed price and applications for determination of exceptional higher allowed price that were received by the date of enforcement of these Rules and have not yet been decided upon as of the said date shall be processed in accordance with these Rules.
Article 10
These Rules shall enter into force on the next day after publishing in the Official Gazette of the Republic of Slovenia.
No. 0070-4/2020
Ljubljana, 16 March 2020.
EVA 2020-2711-0002
Tomaž Gantar
Minister of Health
“,Jaka,1584563820,1584563820,en,14235,306,14234,43,0,NULL,,”Pravilnik o spremembah Pravilnika o določanju cen”,pravilnik-o-spremembah-pravilnika-o-dolocanju-cen,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,0,0,1584563054,1611174864
624,14237,”Polno sodelovanje pri zagotavljanju nemotene oskrbe z zdravili”,”V času epidemije COVID-19 je zagotavljanje nemotene dobave in zagotavljanje zadostnih rezerv še toliko bolj pomembno”,”
Mednarodni forum znanstveno raziskovalnih farmacevtskih družb, GIZ, kot krovni predstavnik inovativne farmacevtske industrije v Sloveniji, v imenu svojih članov, 23 farmacevtskih podjetij sporoča, da je ves njihov trud usmerjen v to, da dobava zdravil, cepiv in ostalih terapij ter oskrba z njimi poteka nemoteno.
V času epidemije COVID-19 je zagotavljanje nemotene dobave in zagotavljanje zadostnih rezerv še toliko bolj pomembno, zato so naši člani v nenehnem stiku tako s svojimi matičnimi družbami, kot z zdravstvenimi ustanovami, lekarnami in vele drogeristi glede potreb in zalog zdravil in cepiv. Ob tem vsem institucijam zagotavljamo tudi vso kooperativnost ter izmenjavo informacij, skupaj z dostopom do vseh podatkov, ki so potrebni za učinkovito podporo slovenskemu zdravstvenemu sistemu v času epidemije.
“,”Jaka Verbic Miklic”,1584609300,1584609300,sl,14237,306,14236,43,0,NULL,,”Polno sodelovanje pri zagotavljanju nemotene oskrbe z zdravili”,polno-sodelovanje-pri-zagotavljanju-nemotene-oskrbe-z-zdravili,Post,/sites/43/files/images/news/Covid-19/Pills.jpg,1,0,1584609450,1587022979
625,14237,”Working together to ensure smooth supply of medicines”,”During the COVID-19 epidemic, ensuring a smooth supply and providing sufficient reserves is even more important”,”
As the umbrella association of the innovative pharmaceutical industry in Slovenia, EIG Forum of International Research & Development Pharmaceutical Companies, on behalf of its members, 23 pharmaceutical companies announce that great effort of its members is invested in the smooth and running supply chain of medicines, vaccines and other therapies.
During the COVID-19 epidemic, ensuring a smooth supply and providing sufficient reserves is even more important, so our members are in constant contact with their principal companies together with medical institutions, pharmacies and distributors regarding the needs and supplies of medicines and vaccines. At the same time, we also provide maximum cooperation and information exchange to all institutions with access to all the information needed to effectively support the Slovenian healthcare system in times of the epidemic.
“,”Jaka Verbic Miklic”,1584609300,1584609300,en,14237,306,14236,43,0,NULL,,”Polno sodelovanje pri zagotavljanju nemotene oskrbe z zdravili”,polno-sodelovanje-pri-zagotavljanju-nemotene-oskrbe-z-zdravili,Post,/sites/43/files/images/news/Covid-19/Pills.jpg,1,0,1584609450,1587022979
626,14239,”Forumov kodeks ravnanja”,”Forumov Kodeks ravnanja predstavlja zbirko etičnih pravil”,”
sprejet na Skupščini Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ dne 20.3.2020
Forumov Kodeks ravnanja predstavlja zbirko etičnih pravil, ki so jih članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ (»Foruma«) sprejele glede promocije zdravil strokovni javnosti in sodelovanja z zdravstvenimi delavci, zdravstvenimi organizacijami in društvi bolnikov, z namenom zagotoviti, da se te dejavnosti izvajajo ob spoštovanju najstrožjih etičnih načel strokovnosti in odgovornosti.
Ta Kodeks velja za vse vrste komunikacije in sodelovanja, torej tako za klasični kot tudi za digitalni način.
KAZALO
DEFINICIJE
PREAMBULA
UVODNE NAVEDBE
PODROČJE UPORABE DOLOČIL KODEKSA
IZVAJANJE DOLOČIL KODEKSA
POGLAVJE 1 PROMOCIJA ZDRAVIL NA RECEPT ZDRAVSTVENIM DELAVCEM
Člen 1 – Dovoljenje za promet z zdravilom
Člen 2 – Obvezni podatki pri promociji
Člen 3 – Promocija in njena utemeljenost
Člen 4 – Uporaba citatov pri promociji
Člen 5 – Primernost promocije
Člen 6 – Distribucija promocijskega gradiva
Člen 7 – Transparentnost promocije
Člen 8 – Promocija med mednarodnimi dogodki
Člen 9 – Osebne zdravstvene zadeve
POGLAVJE 2 – SODELOVANJE Z ZD, ZO in DB
Člen 10 – Dogodki in gostoljubnost
Člen 11 – Prepoved dajanja daril
Člen 12 – Donacije in prispevki za izobraževanje za ZO in DB
Člen 13 – Prispevek za stroške v zvezi z dogodki in sponzorstva
Člen 14 – Financiranje s strani članic
Člen 15 – Pogodbeno izvajanje storitev
POGLAVJE 3 – POSEBNE ZAHTEVE ZA SODELOVANJE Z ZD in ZO
Člen 16 – Medicinsko izobraževanje
Člen 17 – Informativno in izobraževalno gradivo ter izdelki za medicinsko rabo
Člen 18 – Neintervencijska klinična preskušanja zdravil
Člen 19 – Vzorci zdravil
Člen 20 – Osebje in strokovni sodelavci
POGLAVJE 4 – POSEBNE ZAHTEVE ZA SODELOVANJE Z DB
Člen 21 – Sodelovanje z DB
POGLAVJE 5 – OBJAVA PRENOSOV VREDNOSTI
Člen 22 – Objava prenosov vrednosti ZD, ZO in DB
Člen 23 – Objava prenosov vrednosti ZD in ZO
Člen 24 – Objava podpore in storitev, zagotovljenih DB
POGLAVJE 6 – POSTOPKOVNE DOLOČBE
Člen 25 – Odgovornost in sankcije
Člen 26 – Nadzor
Člen 27 – Prijave kršitev
Člen 28 – Spremembe Kodeksa
Člen 29 – Uveljavitev Kodeksa
PRILOGA
Priloga A – Standardizirana predloga za objavo
DEFINICIJE
Definicije pojmov so vključene z namenom, da se zagotovi njihovo enovito razumevanje.
Članica: kot je določena v statutu in poslovniku Foruma.
Dogodki: Vsa strokovna, promocijska, znanstvena ali izobraževalna srečanja, kongresi, konference, simpoziji in drugi podobni dogodki (kar brez omejitev vključuje tudi srečanja svetovalnih odborov, obiske raziskovalnih ali proizvodnih obratov in sestanke za načrtovanje, usposabljanje ali srečanja za raziskovalce v povezavi s kliničnimi raziskavami in neintervencijskimi študijami), ki so organizirani ali sponzorirani s strani ali v imenu članice.
Donacije in prispevki za izobraževanje: pomenijo skupno zagotavljanje sredstev ali storitev, danih za namen podpore zdravstvenemu varstvu, znanstvenemu raziskovanju ali izobraževanju, brez posledične obveznosti prejemnika, da v zameno zagotovi blago ali storitve v korist donatorja.
Društvo bolnikov (DB): je nepridobitna pravna oseba/subjekt (vključno s krovno organizacijo, ki ji pripada), ki jo v glavnem sestavljajo bolniki in/ali negovalci in ki zastopa in/ali podpira potrebe bolnikov in/ali negovalcev ter katere poslovni naslov, kraj ustanovitve ali primarni kraj delovanja je v Evropi.
Evropa: vključuje tiste države, v katerih se uporabljajo nacionalni kodeksi združenj, ki so članice EFPIA.
Evropska zveza farmacevtske industrije in združenj (EFPIA): je reprezentativno telo farmacevtske industrije v Evropi.
Informativno ali izobraževalno gradivo: predstavlja gradivo manjše vrednosti, ki se neposredno nanaša na medicinsko ali farmacevtsko dejavnost in ima neposredno korist za oskrbo bolnikov.
Izdelki za medicinsko rabo: predstavljajo izdelke manjše vrednosti, ki so neposredno namenjeni izobraževanju ZD za izboljšanje zdravstvenih storitev in oskrbo bolnikov, ki pa ne krijejo rutinskih stroškov ZD.
Kodeks EFPIA: Kodeks ravnanja EFPIA, vključno s tistimi prilogami, ki so izrecno navedene kot zavezujoče in tvorijo del Kodeksa EFPIA.
Kraj: se nanaša na geografski kraj, kjer je organiziran dogodek (npr. mesto, kraj).
Lokacija: se nanaša na lokacijo, kjer je organiziran dogodek (t.j. hotel, kongresni center).
Medicinsko izobraževanje: vključuje izobraževanje, ki se nanaša na zdravje in bolezni ljudi in posebno nepromocijsko usposabljanje glede zdravil.
Nacionalni kodeks: pomeni kodeks, ki ga v posamezni državi sprejme lokalno združenje.
Nacionalno združenje: kot ga pojmuje statut EFPIA, pomeni organizacijo, ki zastopa farmacevtska podjetja na nacionalni ravni in katerega članstvo med drugim vključuje raziskovalna podjetja. Kodeks EFPIA zavezuje nacionalna združenja, če pa to zahteva kontekst, pa tudi njene ustanovne članice.
Načelo države gostiteljice: se nanaša na primarnost mejne denarne vrednosti za obrok (hrano in pijačo), ki ga posamezno nacionalno združenje določi v svojem nacionalnem kodeksu. Relevantna in prevladujoča je mejna denarna vrednost, kot je določena v državi, v kateri se odvija dogodek.
Neintervencijsko klinično preskušanje zdravil: je preskušanje, pri katerem je (so) zdravilo(-a) predpisano(-a) na običajen način v skladu s pogoji dovoljenja za promet z zdravilom. Uvedba določene terapevtske strategije pri bolniku ni vnaprej določena s poskusnimi protokoli temveč sledi običajni praksi, predpisovanje zdravila pa je jasno ločeno od odločitve o vključitvi bolnika v preskušanje. Za bolnike se ne uporabljajo nobeni dodatni diagnostični ali opazovalni postopki, za analizo zbranih podatkov pa se uporabljajo epidemiološke metode.
Obdobje poročanja: se nanaša na letni cikel objave in zajema celotno koledarsko leto.
Osebje članice: osebje, zaposleno pri članici, ali angažirano na podlagi pogodbe s tretjimi osebami, ki se ukvarja s promocijo zdravila, ki jo pokriva ta Kodeks.
Osebni zdravstveni podatki: pomenijo podatke, ki se nanašajo na telesno ali duševno zdravje posameznika ali na podedovane ali pridobljene genetske značilnosti določene ali določljive fizične osebe, vključno z zdravstvenimi storitvami, ki razkrivajo informacije o fiziologiji ali zdravstvenem stanju takšne osebe.
Predstavnik društva bolnikov: je oseba, ki je pooblaščena, da zastopa in izrazi kolektivne poglede DB glede določenega vprašanja ali področja bolezni.
Prejemnik: vsak ZD, ZO ali DB, katerih primarna praksa, glavni naslov izvajanja poklicne dejavnosti ali kraj ustanovitve je v Evropi.
Prenos vrednosti (PV): Neposredni in posredni PV, bodisi v denarju, v naravi ali kako drugače, izveden bodisi za promocijske namene ali za kaj drugega, v zvezi z razvojem in prodajo zdravil na recept izključno za uporabo v humani medicini. Neposredni PV so tisti, ki jih članica izvede neposredno v korist prejemnika. Posredni PV pa so tisti, ki so v imenu članice v korist prejemnika, ali tisti, ki so bili izvedeni prek tretje osebe in kadar članica ve ali lahko identificira prejemnika, ki bo imel koristi od prenosa vrednosti.
Prenosi vrednosti na področju raziskav in razvoja: Prenosi vrednosti ZD ali ZO, povezani z načrtovanjem ali izvajanjem (i) nekliničnih preskušanj (kot so opredeljena v načelih OECD o dobri laboratorijski praksi); (ii) kliničnih preskušanj (kot so opredeljena v Uredbi 536/2014 Evropskega parlamenta in Sveta z dne 16. aprila 2014 o kliničnem preskušanju zdravil za uporabo v humani medicini); ali (iii) neintervencijskih kliničnih preskušanj, ki so prospektivne narave in ki vključujejo zbiranje podatkov od ali v imenu posameznega ali skupin ZD izključno za preskušanje.
Prispevek za stroške v zvezi z dogodki: je podpora, ki zagotavlja ali krije stroške prehrane, potovanja, nastanitve in/ali pristojbin za registracijo, da se lahko posamezni ZD ali predstavnik DB udeleži dogodka, ki ga organizira ali pripravi članica in/ali tretja oseba.
Promocija: vključuje kakršno koli aktivnost, ki jo izvaja, organizira ali sponzorira članica, ali kdo drug po njenem naročilu, ki spodbuja predpisovanje, dobavo, prodajo, dajanje, priporočanje ali uporabo njenega zdravila oziroma zdravil.
Sponzorstvo: je podpora, ki jo, če je to dovoljeno v skladu z zakonom, zagotovi članica ali kdo v njenem imenu, kot prispevek k podpori dejavnosti (vključno z dogodki), ki jo izvaja, organizira ali pripravi ZO, DB ali tretja oseba.
Strokovni sodelavci farmacevtske družbe: osebje, zaposleno pri članici ali angažirano na podlagi pogodbe s tretjimi osebami, ki sodelujejo z ZD in ZO v zvezi s promocijo zdravil.
Tretja oseba: je pravna oseba/subjekt ali posameznik, ki zastopa članico ali komunicira z drugimi tretjimi osebami v imenu članice ali glede njenega zdravila, kot so distributerji, trgovci na debelo, svetovalci, pogodbene raziskovalne organizacije (CRO), profesionalni organizatorji kongresov, pogodbene angažirani prodajniki, podjetja za raziskave trga, oglaševalske agencije, ponudniki storitev, povezani z dogodki, odnosi z javnostmi in izvajanjem nekliničnih, neintervencijskih kliničnih preskušanj.
Veljavni kodeksi:
(a) (i) če se promocija zdravil ali sodelovanje izvaja, sponzorira ali organizira s strani ali v imenu članice, ki ima sedež v Evropi, velja nacionalni kodeks države, v kateri ima ta članica sedež, (ii) če pa se promocija zdravil ali sodelovanje izvaja, sponzorira ali organizira s strani ali v imenu članice, ki ima sedež izven Evrope, velja Kodeks EFPIA; in
(b) nacionalni kodeks države, v kateri se izvaja promocija zdravil ali poteka sodelovanje.
V primeru kolizije med določbami zgoraj navedenih veljavnih kodeksov, je potrebno uporabiti strožje določbe, razen pri odstavku 10.05. tega Kodeksa, kjer prevlada denarna mejna vrednost, določena v državi, v kateri se dogodek odvija (torej v “državi gostiteljici”).
V primeru mednarodnega dogodka, za katerega članica finančno podpre udeležbo ZD v skladu z določbami 13. člena tega Kodeksa, se za takšno podporo uporabljajo pravila nacionalnega kodeksa države, v kateri ZD opravlja svojo primarno dejavnost in ne države, v kateri poteka mednarodni dogodek.
Vzorec zdravil: ima pomen, določen v Direktivi 2001/83/ES Evropskega parlamenta in Sveta z dne 6. novembra 2001 o zakoniku Skupnosti o zdravilih za uporabo v humani medicini (v nadaljevanju: Direktiva 2001/83/ES), in sicer gre za brezplačen vzorec zdravila, posredovan osebam, pooblaščenim za predpisovanje ali izdajo zdravil, da se lahko seznanijo z novimi izdelki in pridobijo izkušnje pri ravnanju z njimi.
Zdravila na recept: je zdravilo, ki zahteva zdravniški recept, ki ga izda strokovna oseba, usposobljena za predpisovanje.
Zdravilo: ima pomen, določen v 1. členu Direktive 2001/83/ES, in sicer pomeni: (a) katerokoli snov ali kombinacijo snovi, ki so predstavljene kot lastnosti za zdravljenje ali preprečevanje bolezni pri ljudeh; ali (b) katerokoli snov ali kombinacijo snovi, ki se lahko uporablja ali daje ljudem za ponovno vzpostavitev, izboljšanje ali spreminjanje fizioloških funkcij prek farmakološkega, imunološkega ali presnovnega delovanja ali za postavitev medicinske diagnoze.
Zdravstvena organizacija (ZO): vsak samostojni podjetnik (s.p.) ali pravna oseba, (i) ki je zdravstveno, medicinsko ali znanstveno združenje oziroma organizacija (ne glede na pravno ali organizacijsko obliko), kot so bolnice, klinike, fundacije, univerze ali druge izobraževalne ustanove ali akademska združenja (razen društev bolnikov v okviru 21. člena tega Kodeksa) ali (ii) preko katere en ali več ZD izvaja storitve.
Zdravstveni delavec (ZD): vsaka fizična oseba, ki je članica zdravstvene, zobozdravstvene, farmacevtske ali negovalne stroke in vse druge osebe, ki lahko pri opravljanju svojih poklicnih dejavnosti predpišejo, kupijo, dobavijo, priporočajo ali odmerijo zdravilo in katerih primarna praksa, naslov glavne poklicne dejavnosti ali sedež je v Evropi. Za namen tega Kodeksa, definicija ZD vključuje: (i) uradnika ali zaposlenega v vladni agenciji ali drugi organizaciji (ne glede na to, ali je v zasebnem ali javnem sektorju), ki lahko predpiše, kupi, dobavi, priporoča ali odmeri zdravila in (ii) zaposleno osebo pri članici EFPIA-e ali Forumu, katere primarni poklic je zdravstveni poklic, vendar pa izključuje (x) ostale zaposlene pri članici EFPIA-e ali Forumu ter (y) prodajalce na debelo in distributerje zdravil.
PREAMBULA
Ta dokument nadomešča prej veljavne Forumove kodekse , in sicer:
a) Kodeks obveščanja in seznanjanja o zdravilih na recept in sodelovanja z zdravstvenimi delavci (Kodeks sodelovanja z zdravstvenimi delavci), sprejet na skupščini Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ dne 20. januarja 2012 in spremenjen dne 21. novembra 2013, 4. julija 2014, 27. maja 2016, 23. marca 2018 in 22. marca 2019;
b) Kodeks sodelovanja z združenji bolnikov, sprejet na skupščini Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ dne 20. januarja 2012 in spremenjen dne 7. decembra 2018 in
c) Kodeks o javni objavi prenosov vrednosti zdravstvenim delavcem in zdravstvenim organizacijam s strani farmacevtskih družb (Kodeks transparentnosti), sprejet na skupščini Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ dne 21. novembra 2013 in spremenjen dne 4. julija 2014, 5. decembra 2014 in 27. maja 2016.
ETIČNA NAČELA
Farmacevtska podjetja delujemo v sodelovanju z različnimi deležniki, vključno z ZD, ZO, DB in njihovi predstavniki, regulatornimi agencijami, vladnimi organi in javnostjo, z namenom izboljšanja zdravja in kakovosti življenja.
Nenehno vlagamo v raziskave in razvoj za zagotavljanje novih načinov zdravljenja in izboljšanje kakovosti zdravljenja.
Kot gospodarske družbe spodbujamo konkurenco in gospodarski razvoj za potrebne naložbe in spodbujanje inovativnosti.
Verjamemo v to, kar delamo in vemo, da je nekje bolnik, čigar zdravje in dobro počutje je neposredno ali posredno odvisno od našega dela.
Prizadevamo si ustvariti okolje, v katerem bodo deležniki in širša javnost farmacevtske družbe šteli za zaupanja vredne partnerje.
Poleg izpolnjevanja obsežnih zakonskih zahtev (t.j. zakonov in predpisov, ki se uporabljajo za našo industrijo, kot so farmacevtska, konkurenčna in protikorupcijska zakonodaja ter pravila o varstvu intelektualne lastnine in osebnih podatkov), se je farmacevtska industrija odločila, da bo spoštovala še dodatne standarde, dogovorjene v samoregulativnih kodeksih in skupnih stališčih.
Za Forum in njegove članice samoregulacija pomeni, da so odločno zavezane opredeliti, izvajati in uveljaviti najvišje etične standarde, preko združenja EFPIA, Foruma in nacionalnih kodeksov, ki kršitev ne tolerirajo.
Samoregulacija vključuje nenehen izziv za vse nas, da presežemo pričakovanja družbe in zagotovimo posluh za predloge drugih, kako lahko dodatno okrepimo zaupanje v našo industrijo in v naše ravnanje.
Deležniki, ki delijo vrednote in načela, zapisane v tem samoregulativnem Kodeksu, so povabljeni, da se nam pridružijo pri upoštevanju teh pravil in smernic.
To dokazuje našo zavezanost k naslednjim etičnim načelom:
V prvi vrsti velja, da so BOLNIKI V SREDIŠČU VSEGA, KAR POČNEMO. Prizadevamo si zagotoviti, da je vse, kar delamo, v korist bolnikov. Naš primarni prispevek družbi je, da izdelujemo visoko kakovostna zdravila in spodbujamo njihovo primerno in racionalno uporabo pri zdravljenju.
Delujemo z INTEGRITETO, komuniciramo odgovorno in želimo zagotoviti, da je naša komunikacija z vsemi deležniki točna, legitimna in uravnotežena. Odgovorni smo za naše odločitve, dejanja in sodelovanje, druge pa spodbujamo, da sledijo istim visokim etičnim standardom.
Z vsemi deležniki sodelujemo s SPOŠTOVANJEM. Zavezani smo, da k deležnikom pristopamo na odprt način, z odzivnim, konstruktivnim in kritičnim odnosom ter medsebojnim spoštovanjem. Cenimo pomembnost neodvisnega odločanja deležnikov, ki temelji na dokazih in je v interesu bolnikov. Prav tako želimo prisluhniti, kaj družba pričakuje od nas in temu prilagajamo način dela. Spoštujemo veljavne predpise o varstvu osebnih zdravstvenih podatkov in sprejemamo etične odločitve pri njihovi obdelavi.
Odločeni smo zagotoviti spoštovanje TRANSPARENTNOSTI. Odprti smo glede naših aktivnosti in sodelovanja, deležnike pa spodbujamo, da delujejo enako odprto.
UVODNE NAVEDBE
Forum in njegove članice se zavedajo pomembnosti (i) zagotavljanja točnih, poštenih in objektivnih informacij o zdravilih, tako da je mogoče sprejeti razumne odločitve o njihovi uporabi, (ii) zagotavljanja, da sodelovanje z ZD, ZO in DB, ki je ključno za izmenjavo znanja z namenom izboljšati kakovost oskrbe bolnikov, poteka na etični način in (iii) uvedbe večje transparentnosti glede sodelovanja farmacevtske industrije z ZD, ZO in DB.
Poglavja 1, 2 in 3 tega Kodeksa odražajo zahteve Direktive 2001/83/ES, kakor je bila spremenjena, v zvezi z zdravili, in spadajo v splošen okvir direktive, ki priznava vlogo prostovoljnega nadzora nad oglaševanjem zdravil s strani samoregulatornih organov in reševanja prijav kršitev, ko se te pojavijo.
Forum spodbuja konkurenco med farmacevtskimi družbami. Namen tega Kodeksa vsekakor ni omejevanje promocije zdravil ZD, niti omejevanje sodelovanja z ZD, ZO in DB na način, ki bi škodoval pošteni konkurenci. Nasprotno, namen Kodeksa je zagotoviti, da farmacevtske družbe promovirajo in z ZD sodelujejo na pošten način in se izogibajo zavajajočim praksam in morebitnim navzkrižjem interesov z deležniki ter v celoti delujejo v skladu z veljavnimi zakoni in predpisi.
Cilj Kodeksa je torej ustvariti okolje, v katerem splošna javnost zaupa, da so odločitve o izbiri zdravila sprejete na podlagi lastnosti posameznega zdravila in potreb posameznega bolnika.
ZD in ZO farmacevtski industriji zagotavljajo dragoceno, neodvisno in strokovno znanje, pridobljeno iz njihovih kliničnih in znanstvenih izkušenj. To strokovno znanje pomembno prispeva k prizadevanjem industrije za izboljšanje kakovosti oskrbe bolnikov s koristmi tako za posameznike kot tudi za družbo nasploh. Zato si ZD in ZO zaslužijo pravično nadomestilo za svoje strokovno znanje in storitve, ki jih zagotavljajo industriji.
Forum meni, da imajo interakcije med članicami in ZD globok in pozitiven vpliv na kakovost obravnave bolnikov in vrednost prihodnjih raziskav. Hkrati velja, da je integriteta pri predpisovanju zdravil eden izmed stebrov sistema zdravstvenega varstva. Forum se zaveda, da lahko interakcije med industrijo in ZD/ZO ustvarjajo možnost za navzkrižje interesov. Posledično so strokovna združenja in združenja industrije, kot so združenje EFPIA ter njene članice ter lokalna združenja, sprejela kodekse in smernice za zagotovitev, da te interakcije izpolnjujejo visoke standarde integritete, kot to pričakujejo bolniki, vladni organi in drugi deležniki.
Z namenom, da bo še naprej uspešna, mora samoregulacija odgovoriti na razvijajoče se potrebe družbe. Forum se še posebej zaveda, da vedno bolj raste pričakovanje, da se interakcije z družbo ne izvajajo samo z integriteto, temveč tudi na transparenten način.
Na enak način farmacevtska industrija sodeluje tudi z DB in se uči iz njihovega znanja in izkušenj stanja bolnikov, kar lahko zagotavlja pravo predstavo o tem, kako je živeti z določenim bolezenskim stanjem, kako se nudi zdravstvena oskrba, kako to vpliva na bolnike, njihove kariere in družine in kako lahko zdravila in druge oblike zdravljenja spremenijo kakovost njihovega življenja in zadovoljevanje njihovih potreb.
DB imajo ključno vlogo pri oblikovanju, razvoju in opredelitvi rešitev, ki najbolj pomagajo bolnikom. Članice v okviru teh interakcij objavljajo zneske, ki jih zagotavljajo DB.
Forum močno podpira javni nadzor in razumevanje teh odnosov, objava pa prispeva k zaupanju deležnikov v farmacevtsko industrijo.
Od uvedbe Kodeksa o javni objavi prenosov vrednosti, si je Forum močno prizadeval, da bi članice spodbudil, da si pri sodelovanju z ZD (in, kjer je to relevantno, z ZO) čimbolj prizadevajo pridobiti soglasje za objavo individualnih podatkov, nikakor pa članice ne bodo kritizirane, če bodo objavile še več podatkov, kot jih določa ta Kodeks.
PODROČJE UPORABE DOLOČIL KODEKSA
Ta Kodeks pokriva:
Članice odgovarjajo za obveznosti, naložene v skladu s katerimkoli veljavnim kodeksom, tudi če angažirajo tretjo osebo, da v njihovem imenu pripravi ali izvede aktivnosti, ki jih pokriva ta Kodeks. Poleg tega morajo članice sprejeti razumne ukrepe, s katerimi zagotovijo, da tudi vse druge osebe, ki jih angažirajo za pripravo ali izvedbo aktivnosti, ki jih pokriva ta Kodeks, vendar ne delujejo v njihovem imenu (npr. skupna podjetja, licencojemalci), ravnajo v skladu z veljavnimi kodeksi.
Določila tega Kodeksa veljajo za vse oblike promocije, kar brez omejitev vključuje ustne in pisne promocijske aktivnosti in komunikacijo, oglaševanje v revijah in z neposrednimi sporočili, aktivnosti strokovnih sodelavcev, uporabo digitalnih komunikacij in kanalov, kot so spletne strani in družbeni mediji, uporaba avdio-vizualnih sistemov, kot so filmi, video posnetki, storitve shranjevanja podatkov in podobno. Prav tako Kodeks zajema zagotavljanje informativnih ali izobraževalnih gradiv, izdelkov za medicinsko rabo, gostoljubnost v zvezi z dogodki in dajanje vzorcev zdravil.
Kodeks prav tako zajema tudi sodelovanje med članicami ter ZD in ZO, brez omejitev vključno s sodelovanjem v okviru raziskav ali pogodbenih dogovorov (vključno z nekaterimi vidiki kliničnih študij, neintervencijskih kliničnih preskušanj ter svetovanjem in sodelovanjem v posvetovalnih odborih). Kodeks pokriva tudi sodelovanje med članicami in DB.
Namen tega Kodeksa ni omejevati ali urejati aktivnosti, namenjenih splošni javnosti, ki se nanašajo izključno na zdravila, ki se izdajajo brez recepta.
Kodeks ne velja za:
a) ovojnino, povzetek glavnih značilnosti zdravila in navodila za uporabo zdravila ter druge dokumente, ki jih je odobril pristojni organ ob izdaji dovoljenja za promet z zdravilom ali kasneje, kot tudi ne druge splošne previdnostne ukrepe z namenom varnejše in učinkovitejše uporabe zdravila;
b) korespondenco in katerokoli drugo informativno gradivo, katerega namen je odgovoriti na specifična vprašanja o določenem zdravilu;
c) javne objave specifičnega in informativnega tipa, na primer glede nove ovojnine ali opozorila o morebitnih neželenih učinkih, ter kataloge izdelkov in cenike, pod pogojem, da ne vsebujejo nobenih informacij delovanju zdravila;
d) dejavnosti, ki zadevajo izključno zdravila, ki se izdajajo brez recepta; ali
e) nepromocijske splošne informacije o članicah (kot so informacije za vlagatelje ali sedanje/potencialne zaposlene), vključno s finančnimi podatki, opisi raziskovalnih in razvojnih programov ter obravnavo regulatornih sprememb, ki vplivajo na članico in njene izdelke.
IZVAJANJE DOLOČIL KODEKSA
Kodeks določa minimalne standarde, ki jih morajo upoštevati članice. Poleg tega morajo družbe članice Foruma spoštovati določbe veljavne slovenske zakonodaje na področju trženja, oglaševanja in obveščanja o zdravilih.
V okviru Foruma deluje Odbor za nadzor določil tega Kodeksa, katerega člani so neodvisni strokovnjaki s posameznih področij in ustreznim strokovnim znanjem ter predstavniki članov Foruma.
Odbor nadzoruje izvajanje tega Kodeksa ter po lastni presoji predlaga spremembe kodeksov ali postopkov, sprejetih za njihovo izvajanje.
Odbor je ustanovljen za presojo informacij o zdravilih, presojo primernosti sodelovanja članic z zdravstvenimi delavci, zdravstvenimi organizacijami in združenji bolnikov ter skladnosti javne objave prenosov vrednosti zdravstvenim delavcem in zdravstvenim organizacijam in društvom bolnikov s strani članic. Odbor deluje kot prostovoljni in samoregulatorni nadzorni organ za vse članice Foruma.
POGLAVJE 1 – PROMOCIJA ZDRAVIL NA RECEPT ZD
ČLEN 1 – DOVOLJENJE ZA PROMET Z ZDRAVILOM
1.01. Zdravila ni dovoljeno promovirati, dokler se ne pridobi dovoljenje za promet z zdravilom, ki dovoljuje njegovo prodajo in dobavo, prav tako ni dovoljena promocija izven odobrenih indikacij.
1.02. Vsi elementi promocije se morajo dosledno ujemati s podatki, navedenimi v povzetku glavnih značilnosti zdravila.
ČLEN 2 – OBVEZNI PODATKI PRI PROMOCIJI
2.01. Vsako promocijsko gradivo mora skladno z veljavno zakonodajo vsebovati naslednje informacije, podane na jasen in čitljiv način:
a. bistvene informacije, ki so skladne s povzetkom glavnih značilnosti izdelka (sestava zdravila, terapevtske indikacije, odmerjanje in način uporabe, povzetek neželenih učinkov, previdnostnih ukrepov in opozoril, kontraindikacij in interakcij, ime, znak in naslov imetnika dovoljenja za promet) in vsebujejo datum, ko so bile te bistvene informacije zbrane ali nazadnje spremenjene;
b. razvrstitev izdelka glede na način in režim izdaje zdravil; in
c. promocijsko gradivo, namenjeno strokovni javnosti, mora biti praviloma označeno z oznako »Samo za strokovno javnost.«.
ČLEN 3 – PROMOCIJA IN NJEGOVA UTEMELJENOST
3.01. Promocija mora biti točna, uravnotežena, pravična, objektivna in dovolj popolna, da lahko ZD oblikuje svoje mnenje o terapevtski vrednosti zadevnega zdravila. Temeljiti mora na posodobljeni oceni vseh relevantnih dokazov in takšne dokaze tudi jasno odražati. Ne sme zavajati z izkrivljanjem, pretiravanjem, nepotrebnim poudarjanjem, opuščanjem ali na kakršenkoli drug način.
3.02. Članice morajo biti sposobne utemeljiti promocijske navedbe kot odgovor na razumne zahteve ZD. Promocijske trditve o stranskih učinkih morajo še zlasti odražati razpoložljive dokaze in biti sposobne utemeljitve s kliničnimi izkušnjami. Utemeljitve pa ni potrebno zagotoviti v zvezi z veljavnostjo navedb, odobrenih v dovoljenju za promet z zdravilom.
3.03. Promocija mora spodbujati razumno uporabo zdravil, in sicer tako, da jih predstavi objektivno in brez pretiravanj v opisu njihovih lastnosti. Trditve ne smejo napeljevati k prepričanju, da ima zdravilo ali njegova učinkovina kakšno posebno lastnost, kakovost ali učinek, če tega ni mogoče utemeljiti.
3.04. Kadar se promocija sklicuje na objavljene raziskave, mora biti sklicevanje jasno opredeljeno.
3.05. Kakršnakoli primerjava med različnimi zdravili mora temeljiti na ustreznih in primerljivih vidikih zdravil. Primerjalno oglaševanje ne sme zavajati ali omalovaževati.
3.06. Slikovno gradivo, vključno z grafi, ilustracijami, fotografijami in tabelami, ki je bilo v promocijsko gradivo preneseno iz objavljenih raziskav, mora: (a) imeti jasno naveden(e) natančen(ne) vir(e) slikovnega gradiva; (b) mora biti dosledno reproducirano, razen v primerih, ko se zaradi uskladitve z veljavnim(i) kodeksom(-i) opravi prilagoditev ali sprememba, vendar pa je ob tem potrebno jasno navesti, da je bilo gradivo prilagojeno in/ali spremenjeno.
Še posebej je potrebno paziti, da slikovno gradivo, ki je vključeno v promocijo, ne zavaja glede narave zdravila (na primer ali je primerno za uporabo pri otrocih) ali glede trditev ali primerjav (na primer z uporabo nepopolnih ali statistično nepomembnih informacij ali neobičajnih kriterijev).
3.07. Besede “varno” se nikoli ne sme uporabiti za opis zdravila brez ustrezne obrazložitve.
3.08. Besede “novo” se ne sme uporabiti za opis kateregakoli zdravila ali prodajne oblike, ki je splošno dostopna, ali katerekoli terapevtske indikacije, za katero promocija poteka več kot eno leto od razpoložljivosti na slovenskem tržišču.
3.09. Ni dovoljeno trditi, da zdravilo nima stranskih učinkov in da ni tveganj za zastrupitev ali odvisnost.
ČLEN 4 – UPORABA CITATOV PRI PROMOCIJI
Citati iz medicinske in znanstvene literature ali iz osebnih komunikacij morajo biti natančno uporabljeni (razen ko se zaradi uskladitve z veljavnim(i) kodeksom(i) opravi prilagoditev ali sprememba, vendar pa je treba v tem primeru jasno navesti, da je bilo gradivo prilagojeno in/ali spremenjeno), viri pa natančno navedeni.
ČLEN 5 – PRIMERNOST PROMOCIJE
Članice morajo ves čas upoštevati visoke etične standarde. Promocija (a) ne sme nikoli ogrožati ugleda farmacevtske industrije ali slabiti zaupanja vanjo; (b) mora biti takšna, da upošteva specifično naravo zdravil in strokovni profil ciljne publike; in (c) ne sme biti žaljiva.
ČLEN 6 – DISTRIBUCIJA PROMOCIJSKEGA GRADIVA
6.01. Promocija mora biti usmerjena le na tiste ZD, za katere se lahko razumno domneva, da takšne informacije potrebujejo ali so v njihovem interesu.
6.02. Seznami naslovnikov (adreme) morajo biti posodobljeni. Zahteve za odstranitev s seznamov, morajo biti izpolnjene.
6.03. Ob upoštevanju veljavnih nacionalnih predpisov je za promocijo zdravil prepovedana uporaba faksov, e-pošte, avtomatiziranih klicnih sistemov, besedilnih sporočil in drugih digitalnih komunikacij, razen s predhodnim soglasjem ali na zahtevo tistih, ki jih prejmejo.
ČLEN 7 – TRANSPARENTNOST PROMOCIJE
7.01. Promocija ne sme biti prikrita.
7.02. Klinično spremljanje, postmarketinški programi in postavtorizacijske raziskave (vključno s tistimi, ki so po svoji naravi retrospektivne) ne smejo prikrito promovirati zdravila. Takšni programi in raziskave se morajo izvajati izključno z znanstvenim ali izobraževalnim namenom.
7.03. Kadar članica plača ali kako drugače zagotovi ali uredi objavo promocijskega gradiva v časopisih ali revijah, to promocijsko gradivo ne sme dajati videza neodvisnega uredniškega prispevka.
7.04. Gradivo z informacijami o zdravilih in njihovi uporabi, bodisi da je promocijske narave ali ne, ki ga podpre članica, mora vsebovati jasne navedbe, da ga je podprla konkretna članica.
ČLEN 8 – PROMOCIJA MED MEDNARODNIMI DOGODKI
Promocijsko gradivo, ki se pojavi na razstavnih prostorih ali se posreduje udeležencem na mednarodnih dogodkih, se lahko, razen če je prepovedano ali kako drugače urejeno z lokalnimi zakoni in predpisi, nanaša na zdravila (ali njihovo uporabo), ki niso odobrena v državi, v kateri se dogodek odvija ali so odobrena pod drugačnimi pogoji, pod pogojem: (i) da je vsakemu takšnemu promocijskemu gradivu priložena ustrezna izjava, ki navaja države, v katerih je zdravilo odobreno, in jasno določa, da zdravilo ali indikacija lokalno ni odobreno, in (ii) da ima vsako takšno promocijsko gradivo, ki se nanaša na informacije o predpisovanju (indikacije, opozorila itd.), ki veljajo v državi ali državah, v katerih je zdravilo odobreno, priloženo obrazložitveno izjavo, v kateri je navedeno, da se pogoji, pod katerimi je zdravilo odobreno, razlikujejo od države do države.
ČLEN 9 – OSEBNE ZDRAVSTVENE ZADEVE
Če posamezni predstavnik splošne javnosti prosi za nasvet glede osebnih zdravstvenih zadev, mu je potrebno svetovati, naj se posvetuje z zdravnikom.
POGLAVJE 2 – SODELOVANJE Z ZD, ZO in DB
ČLEN 10 – DOGODKI IN GOSTOLJUBNOST
10.01. Vsi dogodki, ki jih organizira ali sponzorira članica, morajo biti organizirani na “primernem kraju” in “primerni lokaciji”, ki ustreza glavnemu namenu dogodka, stroški pa se krijejo le, če je to primerno in v skladu z zakonsko omejenimi zneski ter določbami tega Kodeksa.
“Primeren” kraj v smislu te točke je kraj, ki je večini udeležencev najlažje dostopen in ima dostopne kapacitete za izvedbo dogodka.
“Primerna” lokacija v smislu te točke pomeni katero koli lokacija, ki se običajno uporablja za organizacijo podobnih dogodkov, z izjemo “razvedrilnih” ali “razkošnih” lokacij.
“Razvedrilna” lokacija v smislu te točke pomeni lokacijo, ki je znana zlasti po zagotavljanju posebnih vrst zabave (kar ni tipična kongresna dejavnost), kot sta na primer igralnica in igrišče za golf.
“Razkošna” lokacija v okviru te točke pomeni hotel s kategorizacijo 5* ali podoben objekt luksuzne kategorije, pri čemer se šteje, da je kategorizacija kongresnih kapacitet na posamezni lokaciji enaka kategorizaciji hotela ali objekta, v ali neposredno ob katerem se nahajajo.
10.02. Nobena članica ne sme organizirati ali sponzorirati dogodka, ki poteka zunaj njene države (mednarodni dogodek), razen če je:
10.03. Članice ne smejo nuditi prehrane ZD, razen v kolikor posamezni obroki (hrana in pijača) vrednostno ne presegajo 60 EUR (skupaj z DDV), če dogodek poteka v Sloveniji. Gostoljubnost mora biti na “razumni” ravni in strogo v okvirih glavnega namena dogodka. Na splošno velja, da izkazano gostoljubje ne sme preseči ravni, za katero se predvideva, da bi bili zanjo takšni posamezniki pripravljeni plačati tudi sami.
“Razumna” gostoljubnost v smislu tega člena pomeni gostoljubnost v okviru omejitev, ki bi jih zdravstvene ustanove običajno upoštevale pri organizaciji dogodkov za lastne potrebe, pri tem pa se je treba izogibati dogodkom, ki so namenjeni zlasti razvedrilu.
ZD se ne sme zagotoviti ali plačati nobenega samostojnega razvedrila ter drugih interesnih ali družabnih dejavnosti. Na srečanjih je dovoljeno zmerno (preprosto) razvedrilo, ki je drugotnega pomena v primerjavi z osvežilnimi napitki in/ali prehrano.
10.04. Kritje stroškov, povezano s promocijskimi, strokovnimi ali znanstvenimi dogodki, mora biti omejeno na prevoz, prehrano, namestitev in dejansko pristojbino za registracijo ter mora biti razumno in ustrezno dokumentirano.
Stroški poti, namestitve, pristojbine za registracijo in prehrane se ne štejejo med darila po Zakonu o javnih uslužbencih. Razumni stroški poti, namestitve in prehrane ter pristojbine za registracijo morajo biti prikazani na pregleden način.
10.05. Če dogodek poteka v tujini, se upoštevajo mejne vrednosti za gostoljubje, določene v kodeksu države, v kateri dogodek poteka ( »načelo države gostiteljice«).
10.06. Stroški se lahko krijejo le udeležencem dogodka, ne pa tudi spremljajočim osebam. V izjemnih primerih, če to upravičujejo dokazane zdravstvene potrebe (npr. invalidnosti ali poškodbe), se lahko potne stroške, prehrano, nastanitev in dejansko pristojbino za registracijo znotraj enakih kriterijev krije tudi spremljevalni osebi.
10.07. Gostoljubje ne sme vključevati sponzoriranja ali organizacije zabavnih (npr. športnih ali v prostem času) dogodkov.
ČLEN 11 – PREPOVED DAJANJA DARIL
11.01. Darila za osebno korist (kot so vstopnice za športne ali zabavne prireditve, družabna darila) ZD, članom ZO ali predstavnikom DB (dana bodisi neposredno bodisi posredno) so prepovedana.
Prepovedano je tudi zagotavljanje ali ponujanje gotovine, denarnih ustreznikov ali osebnih storitev. Za te namene so osebne storitve vse vrste storitev, ki niso povezane s poklicem in ki prejemniku zagotavljajo osebno korist.
11.02. Pripomoček za promocijo je izdelek zanemarljive denarne vrednosti, dan za promocijski namen (ki ne vključuje promocijskih gradiv, kot so opredeljena v poglavju 1). Njihovo deljenje ali ponujanje ZD, članom ZO ali predstavnikom DB v zvezi s promocijo zdravil na recept je prepovedano.
ČLEN 12 – DONACIJE IN PRISPEVKI ZA IZOBRAŽEVANJE ZA ZO IN DB
12.01. Donacije in prispevki za izobraževanje (v denarju, v naravi ali na drug način) ZO in DB so dovoljeni le pod pogojem, če: (i) so namenjeni podpori zdravstvene oskrbe, raziskavam ali izobraževanju; (ii) so dokumentirani in arhivirani v evidenci donatorja/podpornika; in (iii) ne predstavljajo spodbude za priporočanje in/ali predpisovanje, nakup, dobavo, prodajo ali dajanje določenega zdravila.
12.02. Dajanje donacij in prispevkov za izobraževanje posameznikom ni dovoljeno, je pa možno kriti stroške v zvezi z udeležbo na dogodkih skladno s 13. členom tega Kodeksa.
ČLEN 13 – PRISPEVEK ZA STROŠKE V ZVEZI Z DOGODKI IN SPONZORSTVA
13.01. Članice morajo izpolnjevati merila, ki urejajo izbiro in podporo ZD ali predstavnikov DB, da se udeležijo dogodkov, kot je določeno v ali v povezavi z vsemi veljavnimi kodeksi. Ne sme se ponuditi plačila samo za porabljen čas, ki ga ob udeležbi na dogodku prebije ZD ali predstavnik DB.
13.02. Če želi članica javno uporabiti logotip ZO ali DB in/ali njihov lastniški material, potrebuje za to dovoljenje te organizacije. Pri pridobivanju takšnega dovoljenja je treba jasno navesti namen in način, kako se bosta logotip in/ali lastniški material uporabljala.
13.03. Članice morajo zagotoviti, da je njihovo sponzorstvo ZO in DB vedno jasno izkazano in očitno že na prvi pogled.
ČLEN 14 – FINANCIRANJE S STRANI ČLANIC
Nobena članica ne sme zahtevati, da bo edini podpornik ali sponzor DB ali ZO ali katerega koli od njihovih programov.
Članice pozdravljajo široko financiranje in sponzoriranje DB in ZO iz več virov.
ČLEN 15 – POGODBENO IZVAJANJE STORITEV
15.01. Pogodbe med članicami in ZD, ZO, DB ali predstavniki DB, v skladu s katerimi ti zagotavljajo katerokoli vrsto storitev za članice (ki sicer niso zajete v Kodeksu), so dovoljene le, če so te storitve: (i) zagotovljene za namen podpiranja zdravstva, raziskav ali izobraževanja; in (ii) ne predstavljajo spodbude za priporočanje in/ali predpisovanje, nabavo, dobavo, prodajo ali dajanje določenih zdravil.
15.02. Dovoljeno je angažirati ZD in ali predstavnike DB kot svetovalce, posamično ali v skupinah, za storitve, kot so predavanja in vodenje sestankov, sodelovanje pri medicinskih /znanstvenih raziskavah, kliničnih raziskavah ali izobraževanju, sodelovanje na sestankih svetovalnega odbora in sodelovanje pri tržnih raziskavah, kjer takšno sodelovanje vključuje plačilo in/ali gostoljubje. Dogovori, ki se nanašajo na dejansko svetovanje ali druge storitve, morajo, v obsegu, ki ustreza posameznemu dogovoru, izpolnjevati naslednja merila:
a. pogodba ali dogovor v pisni obliki mora biti sklenjen pred začetkom izvajanja storitev, v njem pa je navedena narava storitev, ki bodo opravljene, in ob upoštevanju spodnje točke (g), podlaga za plačevanje teh storitev;
b. upravičena potreba po storitvah mora biti jasno opredeljena in dokumentirana že pred povpraševanjem za izvedbo storitev in pred sklenitvijo dogovora;
c. merila za izbiro svetovalcev se morajo nanašati neposredno na določeno potrebo, osebe, odgovorne za izbiro svetovalcev, pa morajo imeti ustrezno strokovno znanje za presojo ali posamezen zdravstveni strokovnjak izpolnjuje ta merila;
d. število najetih svetovalcev in obseg storitev ne sme biti večje, kot je razumno potrebno za izpolnjevanje določene potrebe;
e. članica, ki sklene pogodbo, mora hraniti dokumentacijo, ki se nanaša na storitve, ki jih ponujajo svetovalci, in mora takšne storitve tudi ustrezno uporabljati;
f. angažiranje svetovalcev za opravljanje določene storitve ne sme spodbujati priporočanja, predpisovanja, nakupa, dobave, prodaje ali dajanja določenega zdravila;
g. plačilo za storitve mora biti razumno in odražati pošteno tržno vrednost opravljenih storitev. V povezavi s tem se za opravičilo plačil ZD in predstavnikom DB ne sme uporabljati fiktivnih dogovorov o svetovanju.
15.03. Članice se močno spodbuja, da v pisne pogodbe s svetovalci vključijo določbe, ki se nanašajo na dolžnost svetovalca, da vedno, kadar za javnost piše ali govori o zadevi, ki je predmet pogodbe, ali o vprašanju, ki se nanaša na to članico, navede, da je svetovalec te članice.
Prav tako se močno spodbuja članice, ki za skrajšani delovni čas zaposlujejo zdravstvene delavce, ki še vedno opravljajo svojo prakso, da od takšnih oseb zahtevajo, da svoj status zaposlitve pri članici navedejo vedno, kadar za javnost pišejo ali govorijo o zadevah, ki so predmet zaposlitve, ali katerem koli drugem vprašanju, ki se nanaša na članice. Določbe, ki izhajajo iz tega člena 15.03, veljajo kljub temu, da ta Kodeks sicer ne pokriva nepromocijskih splošnih informacij o članicah (kot je določeno v poglavju »Področje uporabe Kodeksa«).
15.04. Omejene tržne raziskave, kot so enkratne telefonske ankete ali vprašalniki po pošti/e-pošti/internetu, ne sodijo v obseg 15. člena tega Kodeksa, če ZD, član ZO ali predstavnik DB ne zagotavlja svetovanja na redni osnovi (glede na splošno pogostost klicev ali klicev, ki se nanašajo na isto raziskavo) in nedenarno nadomestilo ne presega 42 EUR (skupaj z DDV) na anketo ali vprašalnik.
15.05. Če se ZD ali predstavnik DB udeleži dogodka (mednarodnega ali drugega) kot svetovalec, veljajo ustrezne določbe 10. člena tega Kodeksa.
POGLAVJE 3 – POSEBNE ZAHTEVE ZA SODELOVANJE Z ZD IN ZO
ČLEN 16 – MEDICINSKO IZOBRAŽEVANJE
Medicinsko izobraževanje je namenjeno pridobivanju dodatnega strokovnega znanja in usposobljenosti ZD z namenom izboljšanja medicinske prakse in rezultatov zdravljenja bolnikov.
Članice se lahko ukvarjajo z različnimi vrstami medicinskega izobraževanja, vendar takšne dejavnosti ne smejo predstavljati promocije.
Pri financiranju neodvisnega medicinskega izobraževanja ali organiziranju dejavnosti medicinskega izobraževanja neposredno ali v sodelovanju s tretjimi osebami morajo članice zagotoviti, da je njihova udeležba in vloga jasno razvidna in očitna že na prvi pogled. Pri organizaciji dejavnosti medicinskega izobraževanja, v katerem vsebinsko sodelujejo tudi članice, so članice odgovorne za to, kar se med takšno aktivnostjo sporoča. Takšna vsebina mora biti poštena, uravnotežena in objektivna ter zasnovana tako, da omogoča izražanje različnih teorij in priznanih mnenj.
ČLEN 17 – INFORMATIVNO IN IZOBRAŽEVALNO GRADIVO TER IZDELKI ZA MEDICINSKO RABO
17.01. Razdeljevanje informativnih in izobraževalnih gradiv je dovoljeno, če so: (i) “razumne vrednosti”, (ii) neposredno povezana z opravljanjem zdravstvene ali lekarniške dejavnosti, in (iii) neposredno koristna za oskrbo bolnikov.
17.02 Izdelki za medicinsko rabo, namenjeni neposredno izobraževanju ZD in oskrbi bolnikov, se lahko delijo pod pogojem, da so “razumne vrednosti” in ne krijejo rutinskih stroškov ZD.
17.03. Narava informativnih in izobraževalnih gradiv in izdelki za medicinsko rabo ne sme pomeniti izogibanja prepovedi dajanja daril, opredeljene v 11. členu tega Kodeksa. Dajanje takšnih gradiv prav tako ne sme predstavljati spodbude za priporočanje, predpisovanje, nakup, dobavo, prodajo ali dajanje zdravila.
17.04. Informativno in izobraževalno gradivo ter izdelki za medicinsko rabo lahko vključujejo ime članice, vendar ne sme biti vsebovati blagovne znamke izdelka, razen če je ime zdravila bistveno za pravilno uporabo materiala ali izdelka s strani bolnika.
ČLEN 18 – NEINTERVENCIJSKA KLINIČNA PRESKUŠANJA ZDRAVIL
18.01. Neintervencijska klinična preskušanja se morajo izvajati s primarnim znanstvenim namenom in ne smejo predstavljati prikrite promocije.
18.02. Neintervencijska klinična preskušanja, ki so po naravi prospektivna in vključujejo zbirko podatkov o bolnikih, namenjenih posebej za preskušanje in zbranih s strani ali na zahtevo posameznega zdravstvenega delavca ali skupine njih, morajo biti v skladu z naslednjimi merili:
a. obstajati mora pisni načrt preskušanja (opazovalni načrt/protokol);
b. v državah, kjer so komisije za medicinsko etiko pripravljene takšne študije pregledati, je treba načrt študije v pregled predložiti tudi komisiji za medicinsko etiko;
c. načrt preskušanja mora odobriti medicinski oddelek članice, prav tako pa mora medicinski oddelek nadzirati izvajanje preskušanja skladno s točko 20.01.a tega Kodeksa;
d. rezultati preskušanja morajo biti analizirani s strani ali v imenu članice, povzetek rezultatov pa mora biti v razumnem obdobju na voljo strokovni službi članice, ki je odgovorna za izvajanje kliničnih preskušanj (kot je opisano v točki 20.01.a tega Kodeksa), ki mora za razumno obdobje takšna poročila shraniti. Članica mora povzetek poročila posredovati vsem ZD, ki so sodelovali pri preskušanju, povzetek poročila pa mora, na njihovo zahtevo, dati na voljo tudi samoregulatornim organom industrije, ki so zadolženi za nadzor ali uveljavljanje veljavnih kodeksov. Če so rezultati preskušanja pomembni za ocenjevanje razmerja med koristmi in tveganji, je treba povzetek poročila nemudoma posredovati ustreznemu pristojnemu organu; in
e. strokovni sodelavci lahko sodelujejo le pri administrativnih opravilih, takšno sodelovanje pa mora biti pod nadzorom medicinskega oddelka članice, ki prav tako zagotovi, da so strokovni sodelavci ustrezno usposobljeni. Takšno sodelovanje ne sme biti povezano s promocijo zdravila.
18.03 Članice se v ustreznem obsegu spodbuja, da skladno s točko 18.02 tega Kodeksa delujejo pri vseh drugih vrstah neintervencijskih kliničnih preskušanj, vključno z epidemiološkimi študijami in registri ter drugimi študijami, ki so retrospektivne narave. V vsakem primeru za takšna preskušanja velja točka 15.01 tega Kodeksa.
ČLEN 19 – VZORCI ZDRAVIL
19.01. V skladu z veljavnim Pravilnikom o oglaševanju zdravil se osebam, pooblaščenim za predpisovanje zdravil, načeloma ne sme dajati brezplačnih vzorcev zdravil, razen izjemoma pod naslednjimi pogoji:
a) zdravilo ima dovoljenje za promet v skladu z zakonom;
b) za zdravilo niso določeni posebni pogoji shranjevanja, kot je hladna veriga;
c) od pridobitve dovoljenja za promet z zdravilom ali od odobritve spremembe dovoljenja za promet, ki zahteva novo vlogo, ni preteklo več kot dve leti;
d) vse vzorce se dostavi le na pisno prošnjo, ki jo predpisovalec podpiše in opremi z datumom;
e) prejemnik mora o prejetih vzorcih voditi evidenco in jih ne sme prodajati;
f) noben vzorec ne sme biti večji od najmanjšega pakiranja na trgu;
g) vsem vzorcem mora biti priložen izvod povzetka glavnih značilnosti zdravila;
h) vzorec ne sme vsebovati narkotičnih ali psihotropnih snovi.
Vzorcev zdravil se ne sme dajati z namenom spodbujanja, priporočanja, predpisovanja, nakupa, dobave, prodaje ali dajanja določenih zdravil, niti se jih ne sme dajati za namen samega zdravljenja bolnikov.
Vzorce zdravil se posreduje ZD, da lahko bolnike seznanijo z načinom uporabe novega zdravila, razen če to ni namenjeno za peroralno uporabo.
19.02. Članice morajo imeti ustrezne sisteme za evidentiranje, nadzor in odgovornost za vzorce, ki jih distribuirajo, in za vsa zdravila, s katerimi ravnajo njihovi strokovni sodelavci. Ti sistemi morajo jasno določati, da lahko ZD, na leto prejme le en vzorec posameznega zdravila v najmanjšem pakiranju, za katero je pridobljeno dovoljenje za promet in za katerega je imetnik dovoljenja za promet organ, pristojen za zdravila pisno obvestil o dejanskem začetku prometa.
Vsak vzorec mora biti označen z napisom “brezplačen vzorec – ni za prodajo”, ali besedilo v tem smislu in mora imeti priložen izvod povzetka glavnih značilnosti zdravila.
ČLEN 20 – OSEBJE IN STROKOVNI SODELAVCI ČLANIC
20.01. Osebje članic mora biti v celoti seznanjeno z določbami veljavnih kodeksov in veljavnega Pravilnika o oglaševanju zdravil.
a. Vse članice morajo imeti strokovno službo, ki se ukvarja z informacijami o njenih medicinskih izdelkih in odobrava ter nadzoruje neintervencijska klinična preskušanja zdravil. Članice lahko svobodno odločajo o tem, kako najbolje vzpostaviti takšne storitve v skladu s to točko 20.01 tega Kodeksa (t.j. ali bodo imele eno službo, pristojno za obe nalogi ali pa dve ločeni z jasno razmejenimi nalogami), glede na lastna sredstva in organizacijo. Taka strokovna služba mora imeti zdravnika ali, če je to primerno, farmacevta, ki je odgovoren za odobritev promocijskih gradiv pred objavo. Ta oseba mora s podpisom potrditi, da je pregledala končno različico promocijskega gradiva, da je to po njenem mnenju skladno z zahtevami veljavnega(-ih) kodeksa(-ov) ter veljavne zakonodaje in predpisov s področja promocije, da je promocijsko gradivo skladno s povzetkom glavnih značilnosti zdravila ter da so medicinska dejstva predstavljena pošteno in verodostojno. Poleg tega mora strokovna služba vključevati tudi zdravnika ali, če je to primerno, farmacevta, ki je odgovoren za nadzor neintervencijskih kliničnih preskušanj zdravil (vključno z nadzorom vseh zadolžitev v zvezi s takšnimi preskušanji, še posebej glede obveznosti, ki jih izpolnjujejo strokovni sodelavci). Ta oseba mora s podpisom potrditi, da je pregledala protokol neintervencijskega kliničnega preskušanja in je po njenem mnenju v skladu z zahtevami veljavnega(-ih) kodeksa(-ov) in veljavne zakonodaje.
b. Vsaka članica mora imenovati vsaj enega višje rangiranega zaposlenega, ki mora biti odgovoren za nadzor nad članico in njenimi hčerinskimi družbami, da se zagotovi, da so izpolnjeni standardi veljavnih kodeksov.
20.02. Vsaka članica mora zagotoviti, da so njeni strokovni sodelavci seznanjeni z ustreznimi zahtevami veljavnih kodeksov in vse veljavne zakonodaje ter so ustrezno usposobljeni in imajo dovolj strokovnega znanja, da lahko zagotovijo natančne in popolne informacije o zdravilih, ki jih promovirajo.
a. Strokovni sodelavci morajo izpolnjevati vse ustrezne zahteve veljavnih kodeksov in vse veljavne zakonodaje, članice pa so odgovorne za zagotavljanje skladnosti.
b. Strokovni sodelavci morajo svoje naloge opravljati odgovorno in etično.
c. Med vsakim obiskom in ob upoštevanju veljavnih zakonov morajo strokovni sodelavci dati obiskani osebi, ali imeti pri sebi na voljo, povzetek glavnih značilnosti zdravila za vsako zdravilo, ki ga predstavljajo.
d. Strokovni sodelavci morajo nemudoma posredovati strokovnih službam svojih podjetij vse informacije, ki jih prejmejo v zvezi z uporabo njihovih zdravil, zlasti pa poročila o neželenih učinkih.
e. Strokovni sodelavci morajo zagotoviti, da pogostost, časovna razporeditev in trajanje obiskov ZD, lekarn, bolnišnic ali drugih zdravstvenih ustanov, skupaj z načinom, na katerega so izvedeni, ne motijo njihovega rednega dela.
f. Strokovni sodelavci ne smejo uporabljati nobene spodbude ali pretveze, da bi si zagotovili obisk. Na obisku oziroma pri dogovarjanju za obisk morajo strokovni sodelavci od samega začetka sprejeti razumne ukrepe, s katerimi bodo zagotovili, da ne bo zavajali glede njihove identitete ali identitete članice, ki jo zastopajo.
POGLAVJE 4 – POSEBNE ZAHTEVE ZA SODELOVANJE Z DB
ČLEN 21 – SODELOVANJE Z DB
21.01. Članice morajo pri sodelovanje z DB upoštevati naslednja načela:
1. DB mora biti zagotovljena neodvisnost pri odločanju o politikah delovanja in njihovih aktivnostih.
2. Vsi odnosi med DB in članicami morajo temeljiti na medsebojnem spoštovanju, pri čemer so pogledi in odločitve obeh partnerjev enako pomembne.
3. Članice ne smejo zahtevati, DB pa ne smejo izvajati nobenega promocije določenega zdravila, ki se izdajajo na recept.
4. Cilji in obseg vseh odnosov morajo biti pregledni. Finančna in nefinančna pomoč, ki jo zagotovijo članice, mora biti vedno jasno razvidna in objavljena.
21.02. Zakonodaja EU ter nacionalna zakonodaja prepovedujeta oglaševanje zdravil na recept splošni javnosti.
21.03. Kadar članica DB zagotovi finančno pomoč, znatno posredno pomoč in/ali znatno nefinančno pomoč, mora imeti za to sklenjen pisni dogovor. V njem morata biti navedena znesek sredstev in namen (npr. nezavezujoča donacija, posebno srečanje ali publikacija). Prav tako mora dogovor vsebovati opis znatne posredne pomoči (npr. donacija časa agencije za odnose z javnostmi in naravo njene vključenosti) in znatne nefinančne pomoči.
21.04. Članice ne smejo vplivati na besedilo gradiva DB, ki ga sponzorirajo, na način, ki bi pozitivno vplival na njihove lastne komercialne interese. To ne preprečuje članicam, da bi ne smele popraviti netočnosti v dejanskih podatkih. Poleg tega lahko članice na zahtevo DB prispevajo k pripravi besedila, s poštene in uravnotežene znanstvene perspektive.
POGLAVJE 5 – OBJAVA PRENOSOV VREDNOSTI
ČLEN 22 – OBJAVA PRENOSOV VREDNOSTI ZD, ZO in DB
22.01. Čas objave
Članica mora podatke objaviti v 6 mesecih po koncu ustreznega obdobja poročanja, javno objavljene informacije pa morajo biti na voljo javnosti vsaj 3 leta od datuma prve objave, razen če v posameznem primeru (i) nacionalna zakonodaja predpisuje krajše obdobje ali (ii) če pravna podlaga za obdelavo osebnih podatkov (npr. legitimni interes, zakonska obveznost ) ne obstaja več.
Skupno obdobje za objavo poročil o prenosih vrednosti prejemnikom se določi najkasneje v časovnem intervalu med 20. in 30. junijem vsako leto.
ČLEN 23 – OBJAVA PRENOSOV VREDNOSTI ZD in ZO
23.01. Namen
Ta člen opredeljuje javno objavo drugih prenosov vrednosti ZD in ZO, bodisi neposredno ali posredno. Pri odločanju o načinu javne objave prenosa vrednosti se članice spodbuja, naj objavijo podatke na ravni posameznih ZD (ne ZO), če je to mogoče storiti z zadostno točnostjo, doslednostjo in skladno z veljavno zakonodajo.
23.02. Obveznost objave
Splošna obveznost. V skladu z določiti tega člena mora vsaka članica dokumentirati in objaviti plačila in druge prenose vrednosti, ki jih izvede neposredno ali posredno prejemniku ali v njegovo korist, kot je podrobno opisano v točki 23.05 tega Kodeksa.
Izključene objave. Brez omejitev, prenosi vrednosti, ki (i) se nanašajo izključno na zdravila, ki se prodajajo ali izdajajo brez recepta, (ii) ki niso navedeni v točki 23.05. tega Kodeksa, torej izdelki za medicinsko rabo (17. člen tega Kodeksa), prehrana in pijača na dogodkih (10. člen tega Kodeksa, zlasti točka 10.05.) ter vzorci zdravil (19. člen tega Kodeksa), oziroma (iii) so del običajnega postopka nabave in prodaje zdravil med članico in ZD (kot je na primer farmacevt) ali ZO, ne zapadejo v področje obvezne objave, opisane zgoraj v poglavju “Splošna obveznost”.
23.03. Oblika objave
Letni cikel objav. Podatki o plačilih in drugih prenosih vrednosti se objavijo enkrat letno, pri čemer vsako obdobje poročanja pokriva celotno koledarsko leto.
Predloga. Za namen večje doslednosti se objava v skladu s tem členom opravi na standardizirani predlogi, ki je določena v Prilogi A.
Mesto objav. Podatki se objavijo na spletni strani članice ali njenih povezanih oseb, pod pogojem, da dostop na spletno stran ni omejen.
Veljavni nacionalni kodeks. Podatki se objavijo v skladu z nacionalnim kodeksom države, v kateri ima prejemnik naslov opravljanja glavne poklicne dejavnosti ali registriran sedež. Če članica ni prisotna in nima podružnice ali povezane družbe v državi, kjer ima prejemnik naslov opravljanja glavne poklicne dejavnosti ali registriran sedež, članica tak prenos vrednosti objavi na način, ki je skladen s kodeksom, ki jo zavezuje v njeni matični državi.
Jezik objav. Objave se opravijo v slovenskem jeziku. Članice se spodbuja, naj poleg obvezne objave v slovenskem jeziku podatke objavijo tudi v angleščini.
Dokumentacija in hramba evidenc. Vsaka članica dokumentira vsa plačila in druge prenose vrednosti, ki jih je treba objaviti v skladu s točko 23.03 tega Kodeksa in hrani ustrezne evidence o objavah po tem Kodeksu vsaj 5 let po koncu ustreznega obdobja poročanja, razen če veljavnimi nacionalni zakoni ali predpisi ne zahtevajo krajšega obdobja.
23.05. Objava posamičnih in skupinskih podatkov
Objava posamičnih podatkov. Razen če ni v tem členu izrecno drugače določeno, se prenosi vrednosti objavijo individualno. Vsaka članica objavi podatke za vsakega posameznega jasno določljivega prejemnika, zneske prenosov vrednosti na takega prejemnika v vsakem obdobju poročanja, ki jih je mogoče razumno razvrstiti v eno od spodaj navedenih kategorij. Razumni stroški poti, namestitve in pristojbina za registracijo morajo biti prikazani na pregleden način, kot navedeno v nadaljevanju. Takšni prenosi vrednosti so lahko združeni po posameznih kategorijah, vendar pa je na zahtevo (i) prejemnika in/ali (ii) upravnega organa članice potrebno predložiti podatke po posameznih postavkah.
1. Za prenose vrednosti na ZO se objavi znesek, povezan s katero koli spodaj navedeno kategorijo:
a. Donacije in prispevki za izobraževanje. Donacije in prispevki ZO v podporo zdravstveni oskrbi, vključno z donacijami in prispevki za izobraževanje (v denarju ali v naravi), dane ustanovam, organizacijam ali združenjem, ki jih sestavljajo ZD in/ali nudijo zdravstvene storitve (kot to določa 12. člen tega Kodeksa).
b. Prispevek za kritje stroškov, povezanih z dogodki. Prispevek za kritje stroškov, povezanih z dogodki, preko ZO ali tretjih oseb, vključno s podporo ZD, da se udeležijo dogodkov, kot so:
i. Pristojbine za registracijo;
ii. Sponzorske pogodbe z ZO ali tretjimi osebami, ki jih imenuje ZO za organizacijo in vodenje dogodka; in
iii. Stroški za potovanje in namestitev (v obsegu kot to določa 10. člen tega Kodeksa).
c. Nadomestila za storitve in svetovanje. Prenosi vrednosti na podlagi pogodb med članicami in ZO, na podlagi katerih takšne ZO zagotavljajo kakršnekoli storitve članici ali druge oblike financiranja, ki niso opredeljene v prejšnjih kategorijah. Ločeno je potrebno javno objaviti nadomestila za storitve in svetovanje ter druge stroške, povezane s storitvami in svetovanjem (npr. potne stroške, druge materialni stroške,…)
2. Za prenose vrednosti na ZD:
a. Prispevek za kritje stroškov, povezanih z dogodki. Prispevek za kritje stroškov, povezanih z dogodki, kot so:
i. Pristojbine za registracijo; in
ii. Stroški za potovanje in namestitev (v obsegu kot to določa 10. člen tega Kodeksa).
b. Nadomestila za storitve in svetovanje. Prenosi vrednosti na podlagi pogodb med članicami in ZD, na podlagi katerih takšne ZD zagotavljajo kakršnekoli storitve članici ali druge oblike financiranja, ki niso opredeljene v prejšnjih kategorijah. Ločeno je potrebno javno objaviti nadomestila za storitve in svetovanje ter druge stroške, povezane s storitvami in svetovanjem (npr. potne stroške, drugi materialni stroški,…)
Objava skupinskih podatkov. Pri prenosih vrednosti, kjer nekaterih podatkov, ki jih je sicer možno razporediti v eno od kategorij, opredeljenih v točki 23.05 tega Kodeksa, zaradi pravnih razlogov ni mogoče javno objaviti posamično, članica javno objavi zneske takih prenosov vrednosti agregirano, za vsako obdobje poročanja. Takšna agregirana javna objava mora za vsako kategorijo navesti (i) število prejemnikov, ki jih vključuje, absolutno in kot odstotek vseh prejemnikov in (ii) skupni znesek prenosov vrednosti takšnim prejemnikom.
Brez podvajanja. Pri prenosih vrednosti, ki jih je treba javno objaviti v skladu s točko 23.05. tega Kodeksa, na posameznega ZD posredno prek ZO, je treba takšen prenos vrednosti javno objaviti le enkrat. Ta javna objava mora biti v čim večji možni meri izvedena po posameznem ZD, skladno s točko 23.05 tega Kodeksa.
Prenosi vrednosti na področju raziskav in razvoja. Vsaka članica javno objavi plačila na področju raziskav in razvoja na agregirani osnovi, za vsako obdobje poročanja. Stroški v zvezi z dogodki, ki so očitno povezani z aktivnostmi iz te točke, se lahko vključijo v skupinsko poročanje v kategorijo “Prenosi vrednosti na področju raziskav in razvoja”.
Metodologija. Vsaka članica mora objavi poročilo, v katerem povzame metodologije, ki jih je uporabila pri pripravi objav in identifikaciji prenosov vrednosti za vsako kategorijo, opisano v točki 23.05 tega Kodeksa. V poročilu je treba poleg splošnega povzetka in/ali specifik posameznih držav, opisati uporabljene metodologije, prav tako pa lahko vključuje obravnavo večletnih pogodb, DDV in druge davčne vidike, pojasnila, povezana z valutami, in druga vprašanja glede časa in zneska prenosa vrednosti za namene tega Kodeksa.
ČLEN 24 – OBJAVA PODPORE IN STORITEV, ZAGOTOVLJENIH DB
Vsaka članica mora objaviti seznam DB, ki jim zagotavlja finančno podporo, in/ali znatno posredno/nefinančno podporo ali s katerimi je sodelovala pri izvajanju pogodbenih storitev za to članico.
Pojem »znatna« pomoč iz prejšnjega odstavka pomeni katero koli pomoč ali storitev, ki ji je mogoče pripisati denarno vrednost, ki presega 150 EUR na transakcijo in 600 EUR na leto.
Objava mora vključevati opis narave podpore ali storitev, ki je dovolj popolna, da lahko povprečni bralec razume naravo podpore ali dogovora, ne da bi bilo potrebno razkriti zaupne informacije.
Poleg naziva DB, mora jo biti objavljeni še sledeči podatki:
a. Za podporo:
i. denarna vrednost finančne podpore in zaračunanih stroškov.
ii. nedenarna korist, ki jo prejme DB, ko nefinančni podpori ne mogoče pripisati smiselne denarne vrednosti.
b. Za pogodbene storitve: celotni znesek, plačan DB v obdobju poročanja.
Te informacije morajo biti objavljene na spletni strani članice bodisi na nacionalni ali evropski ravni na letni ravni, vsako obdobje poročanja pa zajema celotno koledarsko leto.
Metodologija. Vsaka članica mora objaviti metodologije, ki jih je uporabila pri pripravi objav ter za prepoznavanje podpore in zagotovljenih storitev.
POGLAVJE 6 – POSTOPKOVNE DOLOČBE
ČLEN 25 – ODGOVORNOST IN SANKCIJE
25.01. Odgovornost za farmacevtske informacije velja za informacije kot celoto: za obliko in vsebino.
25.02. Odgovornost za zagotavljanje skladnosti s Kodeksom nosijo vse članice Foruma. Prav tako so za spoštovanje tega Kodeksa odgovorni pooblaščeni predstavniki članic Foruma.
25.03. Če Forum v skladu z določili tega Kodeksa ugotovi kršitev, mora od družbe kršiteljice zahtevati, da nemudoma preneha s kršitvijo in podpiše izjavo, da je ne bo ponovila. Sankcije morajo biti sorazmerne z naravo kršitve, učinkovati svarilno in upoštevati ponavljajoče se kršitve enakega tipa ali vzorce različnih kršitev. Na splošno za najučinkovitejšo sankcijo velja kombinacija obvestitve vseh članic in denarne kazni za družbo kršiteljico, vendar pa lahko Forum izreče katerokoli drugo učinkovito sankcijo, da zagotovi izvajanje tega Kodeksa. Forum mora tudi preučiti vse veljavne pravne ali finančne zahteve, ki bi vplivale na naravo možnih sankcij.
ČLEN 26 – NADZOR
Odbor za nadzor določil Kodeksa ravnanja (»Odbor«) kot organ Foruma odloča v postopkih prijave kršitev tega Kodeksa ter presoja skladnost informacij o zdravilih kot tudi primernost sodelovanja članic z ZD, ZO in DB ter tudi daje smernice glede njih.
ČLEN 27 – PRIJAVA KRŠITEV
Pritožbe zaradi kršitve tega Kodeksa se pošljejo Odboru v roku 30 dni od kršitve.
ČLEN 28 – SPREMEMBE KODEKSA
28.01. Spremembe ali prilagoditve Kodeksa se lahko opravijo, če zanje na skupščini glasuje večina članic. Kodeks se lahko spremeni tudi:
a) ob spremembi Kodeksa EFPIA
b) na predlog ene ali več družb članic Foruma, podanega Upravi Foruma, ki ga po preučitvi predloži v sprejem Skupščini Foruma.
28.02.Za sprejetje sprememb(e) Kodeksa je treba potrebna večina glasov prisotnih članic na Skupščini Foruma.
ČLEN 29 – UVELJAVITEV KODEKSA
Ta Kodeks je Skupščina Foruma potrdila dne 20.03.2020, uporablja pa se od 1.1.2021.
PRILOGA A
Standardna predloga za objavo
Predloga za objavo
Različica: 27.06.2019
“,”Jaka Verbič Miklič”,1584737100,1584737100,sl,14239,306,14520,43,0,NULL,,”Forumov kodeks ravnanja”,forumov-kodeks-ravnanja,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1584743817,1605547512
627,14239,”Forum’s code of practice”,”The Forum Code of Practice constitutes the collection of ethical rules agreed by Forum”,”
adopted by the General Assembly of Forum of International Research and Development Pharmaceutical Companies, EIG on 20 March 2020
The Forum Code of Practice constitutes the collection of ethical rules agreed by Forum of International Research and Development Pharmaceutical Companies, EIG (“Forum”) members for the Promotion of Medicinal Products to HCPs and the interactions with HCPs, HCOs and POs, with the intent of guaranteeing that these activities are conducted while respecting the most stringent ethical principles of professionalism and responsibility.
This Code applies to all types of communication and interaction (traditional and digital).
TABLE OF CONTENTS
DEFINITIONS
PREAMBLE
INTRODUCTION
SCOPE OF THE CODE
APPLICABILITY OF THE CODE
CHAPTER 1 – PROMOTION OF POM TO HCPs
Article 1 – Marketing authorization
Article 2 – Information to be made available
Article 3 – Promotion and its substantiation
Article 4 – Use of quotations in Promotion
Article 5 – Acceptability of Promotion
Article 6 – Distribution of Promotion
Article 7 – Transparency of Promotion
Article 8 – Promotional information provided during international Events
Article 9 – Personal medical matters
CHAPTER 2 – INTERACTIONS WITH HCPs, HCOs AND POs
Article 10 – Events and hospitality
Article 11 – Prohibition of Gifts
Article 12 – Donations and Grants to HCOs and POs
Article 13 – Contribution to Cost of Events and Sponsorship
Article 14 – Member Company funding
Article 15 – Contracted services
CHAPTER 3 – SPECIFIC REQUIREMENTS FOR INTERACTIONS WITH HCPs AND HCOs
Article 16 – Medical education
Article 17 – Informational or Educational Materials and Items of Medical Utility
Article 18 – Non-Interventional Studies
Article 19 – Medical Samples
Article 20 – Member Company Staff
CHAPTER 4 – SPECIFIC REQUIREMENTS FOR INTERACTIONS WITH POs
Article 21 – Interactions with POs
CHAPTER 5 – DISCLOSURE OF TRANSFERS OF VALUE FROM MEMBER COMPANIES
Article 22 – Disclosure of ToVs to HCPs & HCOs and POs
Article 23 – Disclosure of ToVs to HCPs and HCOs
Article 24 – Disclosure of support and services provided to POs
CHAPTER 6 – PROCEDURAL PROVISIONS
Article 25 – Responsibility and Sanctions
Article 26 – Supervision
Article 27 – Complaints
Article 27 – Amendments of the Code
Article 28 – Enforcement of the Code
ANNEX
Annex A – Standardised Disclosure Template
DEFINITIONS
Definitions of capitalised terms are included to ensure their consistent understanding.
Member Company: as defined in the Forum’s Statute and Rules of Procedure.
Events: All professional, promotional, scientific, educational meetings, congresses, conferences, symposia, and other similar events (including, but not limited to, advisory board meetings, visits to research or manufacturing facilities, and planning, training or investigator meetings for clinical trials and non-interventional studies) organised or sponsored by or on behalf of a Member Company.
Donations and Grants: collectively, mean providing funds, assets or services freely given for the purpose of supporting healthcare, scientific research or education, with no consequent obligation on the recipient to provide goods or services to the benefit of the donor in return.
Patient Organisation (PO): not-for-profit legal person/entity (including the umbrella organisation to which it belongs), mainly composed of patients and/or caregivers, that represents and/or supports the needs of patients and/or caregivers and which business address, place of incorporation or primary place of operation is in Europe.
Europe: includes those countries in which the EFPIA Member Associations’ National Codes apply.
European Federation of Pharmaceutical Industries and Associations (EFPIA): is the representative body of the pharmaceutical industry in Europe.
Informational or Educational Material: constitutes inexpensive material directly relevant to the practice of medicine or pharmacy and directly beneficial to the care of patients.
Item of Medical Utility: constitutes inexpensive item aimed directly at the education of HCPs enhancing the provision of medical services and patient care and that do not offset routine business practices of the HCPs.
EFPIA Code: The EFPIA Code of Practice, including those Annexes which are expressly mentioned as binding and which form part of the EFPIA Code.
Location: refers to the geographic place where the Event is organized (e.g. the city, town).
Venue: refers to the logistic place where the Event is organized (i.e. the hotel, the congress center).
Medical Education: includes education related to human health and diseases and specific non-promotional training related to Medicinal Products.
National Code: the code of practice of a Member Association.
Member Association: as defined in the EFPIA Statute, means an organisation representing pharmaceutical manufacturers at national level whose members include, among others, research-based companies. Collectively, the national Member Associations or their constituent members, as the context may require, are bound by the EFPIA Code.
Host Country Principle: refers to the primacy of the monetary threshold for a meal (food and beverages) set by the relevant Member Association in its National Code. The monetary threshold set in the country where the Event takes place must prevail. Non-Interventional Study (NIS): is a study where the Medicinal Product(s) is (are) prescribed in the usual manner in accordance with the terms of the marketing authorization. The assignment of the patient to a particular therapeutic strategy is not decided in advance by a trial protocol but falls within current practice and the prescription of the Medicinal Product is clearly separated from the decision to include the patient in the study. No additional diagnostic or monitoring procedures must be applied to the patients and epidemiological methods must be used for the analysis of collected data.
Reporting Period: refers to the annual disclosure cycle and covers a full calendar year.
Member Company Staff: personnel employed by a Member Company or retained by way of contract with Third Parties, who are concerned with promotion of medicinal products covered by this Code.
Personal Health Data: is any information related to the physical, mental health or to the inherited or acquired genetic characteristics of an identified or identifiable natural person, including the provision of health care services, which reveal information about his or her physiology or health status.
Patient Organisation Representative: is a person who is mandated to represent and express the collective views of a PO on a specific issue or disease area.
Recipient: any HCP or HCO or PO as applicable, in each case, whose primary practice, principal professional address or place of incorporation is in Europe.
Transfers of Value (ToV): Direct and indirect ToV, whether in cash, in kind or otherwise, made, whether for promotional purposes or otherwise, in connection with the development and sale of POM exclusively for human use. Direct ToVs are those made directly by a Member Company for the benefit of a Recipient. Indirect ToVs are those made on behalf of a Member Company for the benefit of a Recipient, or those made through a Third Party and where the Member Company knows or can identify the Recipient that will benefit from the Transfer of Value.
Research and Development Transfers of Value: Transfers of Value to HCPs or HCOs related to the planning or conduct of (i) non-clinical studies (as defined in OECD Principles on Good Laboratory Practice); (ii) clinical trials (as defined in Regulation 536/2014 of the European Parliament and of the Council of 16 April 2014 on clinical trials on medicinal products for human use); or (iii) NIS that are prospective in nature and that involve the collection of patient data from or on behalf of individual, or groups of, HCPs specifically for the study.
Contribution to Costs related to Events: is a support providing or covering the costs of meals, travel, accommodation and/or registration fees to support the attendance of an individual HCP or PO Representative to an Event organised or created by a Member Company and/or a Third Party.
Promotion: includes any activity undertaken, organised or sponsored by a Member Company, or with its authority, which promotes the prescription, supply, sale, administration, recommendation or consumption of its Medicinal Product(s).
Sponsorship: is a support provided by or on behalf of a Member Company, when permitted by law, as a contribution to support an activity (including an Event) performed, organised or created by a HCO, a PO or a Third Party.
Medical Sales Representative: personnel employed by a Member Company or retained by way of contract with Third Parties, who interact with HCPs and HCOs, in connection with the Promotion of Medicinal Products.
Third Party: is a legal person/entity or individual that represents a Member Company or interacts with other Third Parties on behalf of a Member Company or relating to the Member Company’s Medicinal Product, such as distributors, wholesalers, consultants, contract research organisations (CRO), professional congress organisers, contracted sales forces, market research companies, advertising agencies, providers of services related to Events, public relations services, non-clinical, non-interventional studies management services.
Applicable Codes:
(a) (i) in the case of Promotion or interaction that is undertaken, sponsored or organised by or on behalf of, or with, a Member Company located within Europe, the Member Association National Code of the country in which such Member Company is located; or (ii) in the case of Promotion or interaction that is undertaken, sponsored or organised by or on behalf of, or with, a Member Company located outside of Europe, the EFPIA Code; and
(b) the Member Association’s National Code of the country in which the Promotion or the interaction takes place.
In the event of a conflict between the provisions of the Applicable Codes set forth above, the more restrictive of the conflicting provisions must apply, except for the application of Section 10.05 of this Code, where the monetary threshold set in the country where the event takes place (i.e. the “host country”) must prevail.
In case of international Event for which a Member Company sponsors the attendance of a HCP, if any funding is provided to such HCP in accordance with the provisions of Article 13, such funding is subject to the rules of the National Code where such HCP carries out his/her profession, as opposed to those in which the international Event takes place.
Medical Sample: has the meaning set forth in the Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to medicinal products for human use (hereinafter: Directive 2001/83/EC), namely sample of Medicinal Product free of charge to persons qualified to prescribe or supply them so that they can familiarize themselves with new products and acquire experience in dealing with them.
Prescription-Only Medicines (POM): is a Medicinal Product that requires a medical prescription issued by a professional person qualified to prescribe.
Medicinal Product: has the meaning set forth in Article 1 of the Directive 2001/83/EC, namely: (a) any substance or combination of substances presented as having properties for treating or preventing disease in human beings; or (b) any substance or combination of substances which may be used in or administered to human beings either with a view to restoring, correcting or modifying physiological functions by exerting a pharmacological, immunological or metabolic action, or to making a medical diagnosis.
Healthcare Organisation (HCO): any legal person/entity (i) that is a healthcare, medical or scientific association or organisation (irrespective of the legal or organisational form) such as a hospital, clinic, foundation, university or other teaching institution or learned society (except for POs within the scope of Article 21 of this Code) whose business address, place of incorporation or primary place of operation is in Europe or (ii) through which one or more HCPs provide services.
Healthcare Professional (HCP): any natural person that is a member of the medical, dental, pharmacy or nursing professions or any other person who, in the course of his/her professional activities, may prescribe, purchase, supply, recommend or administer a Medicinal Product and whose primary practice, principal professional address or place of incorporation is in Europe. For the purpose of this Code, the definition of HCPs includes: (i) any official or employee of a government, agency or other organisation (whether in the public or private sector) that may prescribe, purchase, supply, recommend or administer Medicinal Products and (ii) any employee of a Member Company or Forum whose primary occupation is that of a practising HCP, but excludes (x) all other employees of a Member Company or Forum and (y) a wholesaler or distributor of Medicinal Products.
PREAMBLE
This document replaces previous codes issued by Forum, namely:
a) Code on the Promotion of Prescription-Only Medicines to, and Interactions with, Healthcare Professionals (HCP Code), approved by the General Assembly of Forum of International Research and Development Pharmaceutical Companies, EIG on 20 January 2012, as amended on 21 November 2013, 4 July 2014, 27 May 2016, 23 March 2018 and 22 March 2019;
b) EFPIA Code of Practice on Relationships between the Pharmaceutical Industry and Patient Organisations, adopted by the General Assembly of Forum of International Research and Development Pharmaceutical Companies, EIG on 20 January 2012, as amended on 7 December 2018, and
c) Code on Disclosure of Transfers of Value from Pharmaceutical Companies to Healthcare Professionals and Healthcare Organisations (Transparency Code), adopted by the General Assembly of Forum of International Research and Development Pharmaceutical Companies, EIG on 21 November 2013, as amended on 4 July 2014, 5 December 2014 and 27 May 2016.
ETHICAL PRINCIPLES
As pharmaceutical companies, we work in collaboration with various stakeholders including HCPs, HCOs, POs and their Representatives, regulatory authorities, governments and the public to improve health and quality of life.
We continuously invest in research and development to deliver new treatments for medical needs and improving the quality of treatment.
As commercial organisations, we encourage competition and economic development to sustain investment and foster innovation.
We believe in what we do and know that there is somewhere a patient whose health and wellbeing is, directly or indirectly, dependent on our work.
We aim at creating an environment where our stakeholders and the general public, consider pharmaceutical companies as trusted partners.
In addition to complying with extensive legal requirements (i.e. laws and regulations applicable to our industry such as pharmaceutical, competition, intellectual property and data protection laws as well as anti-bribery and anti-corruption legislation), the pharmaceutical industry has agreed to comply with additional standards in its self-regulatory codes and joint positions.
For Forum and its members, self-regulation means being fully committed to define, implement, comply with and enforce the highest ethical standards through EFPIA, Forum and National Codes, where breaches are not tolerated.
Self-regulation includes the concept of continuous challenge for us to exceed society’s expectations and openness regarding suggestions from others on how we might further strengthen confidence in our industry and our behaviour.
Stakeholders who share the values and principles enshrined in this self-regulation are invited to adhere to these rules and guidance.
This demonstrates our commitment to the following ethical principles:
First and foremost, the PATIENTS ARE AT THE HEART OF WHAT WE DO. We aspire to ensure that everything we do will ultimately benefit patients. Our primary contribution to society is to make high quality Medicinal Products and to encourage their appropriate and rational use in the care pathway.
We act with INTEGRITY, interact in a responsible manner and aim to ensure that our communications with stakeholders are accurate, legitimate and balanced. We are accountable for our decisions, actions and interactions and we encourage others to follow the same high ethical standards.
We interact with all our stakeholders with RESPECT. We commit to approach our stakeholders in an open manner, with a responsive, constructive and learning attitude and mutual respect. We value the importance of independent decision-making by stakeholders, based on evidence and including patient interest. With respect to society, we listen to what is expected from us and adapt our way of working accordingly. We follow applicable laws and make ethical judgements when processing Personal Health Data.
We are committed to ensure that TRANSPARENCY is respected. We are open about our activities and interactions and encourage stakeholders to act with the same openness.
INTRODUCTION
Forum and its members are conscious of the importance of (i) providing accurate, fair and objective information about Medicinal Products so that rational decisions can be made as to their use, (ii) ensuring that interactions with HCPs, HCOs and POs, which are key to share knowledge aiming to improve the quality of patient care, take place in an ethical manner and (iii) introducing greater transparency around the pharmaceutical industry’s interactions with HCPs, HCOs and POs.
Chapters 1, 2 and 3 of this Code reflect the requirements of Directive 2001/83/EC, as amended, relating to Medicinal Products, and fit into the general framework established by the Directive, which recognises the role of voluntary control of advertising of Medicinal Products by self-regulatory bodies and recourse to such bodies when complaints arise.
Forum encourages competition among pharmaceutical companies. This Code is not intended to restrain the Promotion of Medicinal Products to HCPs, or limit interactions with HCPs, HCOs, and POs in a manner that is detrimental to fair competition. Instead, it seeks to ensure that pharmaceutical companies conduct such Promotion and interactions in a truthful manner, avoiding deceptive practices and potential conflicts of interest with stakeholders, and in compliance with applicable laws and regulations.
The Code thereby aims to foster an environment where the general public can be confident that the choices regarding their Medicinal Products are being made on the basis of the merits of each product and the healthcare needs of patients.
HCPs and HCOs provide the pharmaceutical industry with valuable, independent and expert knowledge derived from their clinical and scientific experience. This expertise makes an important contribution to the industry’s efforts to improve the quality of patient care, with benefits for individuals and society at large. HCPs and HCOs should be fairly remunerated for the legitimate expertise and services they provide to the industry.
Forum believes that interactions between Member Companies and HCPs have a profound and positive influence on the quality of patient treatment and the value of future research. At the same time, the integrity of the decision of a HCP to prescribe a Medicinal Product is one of the pillars of the healthcare system. Forum recognises that interactions between the industry and HCPs/HCOs can create the potential for conflicts of interest. Consequently, professional and industry associations, including EFPIA, its Members and Local Associations, have adopted codes and guidelines to ensure that these interactions meet the high standards of integrity that patients, governments and other stakeholders expect.
In order, to continue to be successful, self-regulation needs to respond to the evolving demands of society. In particular, Forum recognises the growing expectation that interactions with society are not only conducted with integrity but are also transparent.
In the same way, the pharmaceutical industry works with POs to learn from their knowledge and experience of patient’s condition that is able to provide a true picture of what it is like to live with a specific condition, how care is delivered, how that impacts on them, their careers and families and how medicines and other treatments can change their quality of life and meet their needs
POs have a key role in helping to shape, develop and define the outcomes that make the most difference to patients. Member Companies disclose the amounts provided to POs in the framework of these interactions.
Forum strongly supports public scrutiny and the understanding of these relationships and disclosure contributes to the confidence of stakeholders in the pharmaceutical industry.
In relation to working with HCPs and HCOs, since the introduction of the Disclosure Code, Forum has worked hard to encourage Member Companies to always look to disclose and to encourage HCPs (and HCOs where relevant) to agree to individual disclosure. Member Companies will not be criticized for over-disclosure.
SCOPE OF THE CODE
This Code covers:
Member Companies are responsible for the obligations imposed under any relevant Applicable Code even if they commission a Third Party to design, implement or engage in activities covered by the Applicable Code on their behalf. In addition, Member Companies must take reasonable steps to ensure that any other parties that they commission to design, implement or engage in activities covered by the Applicable Code but that do not act on behalf of the Member Company (e.g. joint ventures, licensees) comply with Applicable Codes.
This Code covers all methods of Promotion including, but not limited to, oral and written promotional activities and communications, journal and direct mail advertising, the activities of Medical Sales Representatives, the use of digital communications and channels, such as websites and social media, the use of audio-visual systems such as films, video recordings, data storage services and the like. It also covers the provision of Informational or Educational Materials, Items of Medical Utility, hospitality in relation to Events and Medical Samples.
This Code also covers interactions between Member Companies and HCPs and HCOs including, but not limited to, those in the context of research or contractual arrangements (including certain aspects of clinical trials, non-interventional studies as well as consultancy and advisory board). It also covers the interactions between Member Companies and POs.
This is not intended to restrain or regulate activities directed towards the general public which relate solely to non-prescription Medicinal Products.
This Code does not cover the following:
a) the labelling, summary of product characteristics, package leaflet and other documents, approved by the competent authority at granting of marketing authorisation or at any later time, as well as other general precautionary measures aimed at safer and more efficient consumption of the medicinal product;
b) correspondence, possibly accompanied by material of a non-promotional nature, needed to answer a specific question about a particular Medicinal Product;
c) factual, informative announcements and reference material relating, for example, to pack changes, adverse-reaction warnings as part of general precautions, trade catalogues and price lists, provided they include no product claims;
d) activities which relate solely to non-prescription Medicinal Products; or
e) non-promotional, general information about Member Companies (such as information directed to investors or to current/prospective employees), including financial data, descriptions of research and development programmes, and regulatory developments affecting a Member Company and its Medicinal Products.
APPLICABILITY OF THE CODE
This Code sets out the minimum standards which Member Companies shall respect. In addition, Member States of the Forum must respect the provisions of the applicable Slovenian legislation in the field of marketing, advertising and information on medicinal products.
Forum has established a committee for supervision of the provisions of this Code, which is composed of independent experts in various fields with appropriate expert knowledge and representatives of the Forum.
The Committee oversees the implementation of this Code and proposes amendments to codes or procedures adopted for their implementation.
The Committee has been established to assess information on medicinal products, assess the appropriateness of member cooperation with healthcare professionals, healthcare organizations and patient organisations and compliance of publishing transfers of funds from member companies to healthcare professionals and healthcare organisations and patients organizations. The Committee operates as a voluntary and self-regulating body for all Forum members.
CHAPTER 1 – PROMOTION OF POM TO HCPs
ARTICLE 1 – MARKETING AUTHORIZATION
Section 1.01. A Medicinal Product must not be promoted prior to the grant of the marketing authorization allowing its sale or supply or outside of its approved indications.
Section 1.02. Promotion must be consistent with the particulars listed in the summary of product characteristics of the relevant Medicinal Product.
ARTICLE 2 – INFORMATION TO BE MADE AVAILABLE
Section 2.01. Subject to applicable national laws and regulations, all promotional material must include the following information clearly and legibly:
a. essential information consistent with the summary of product characteristics (composition, therapeutic indications, dosage and method of administration, summary of adverse reactions, precautionary measures and warnings, contraindications and interactions, name, sign and address of the marketing authorisation holder) and shall include the date on which such essential information was generated or last revised;
b. classification of the Medicinal Product in terms of the manned and regime of dispensing the product; and
c. promotional materials, addressed to expert public, shall in principle be marked as “For expert public only”.
ARTICLE 3 – PROMOTION AND ITS SUBSTANTIATION
Section 3.01. Promotion must be accurate, balanced, fair, objective and sufficiently complete to enable the HCP to form his/her own opinion of the therapeutic value of the Medicinal Product concerned. It must be based on an up-to-date evaluation of all relevant evidence and reflect that evidence clearly. It must not mislead by distortion, exaggeration, undue emphasis, omission or in any other way.
Section 3.02. Promotion must be capable of substantiation which must be promptly provided in response to reasonable requests from HCPs. In particular, promotional claims about side-effects must reflect available evidence or be capable of substantiation by clinical experience. Substantiation need not be provided, however, in relation to the validity of elements approved in the marketing authorization.
Section 3.03. Promotion must encourage the rational use of Medicinal Products by presenting them objectively and without exaggerating their properties. Claims must not imply that a Medicinal Product, or an active ingredient, has some special merit, quality or property unless this can be substantiated.
Section 3.04. When Promotion refers to published studies, clear references must be given.
Section 3.05. Any comparison made between different Medicinal Products must be based on relevant and comparable aspects of the Medicinal Products. Comparative advertising must not be misleading or disparaging.
Section 3.06. All artwork, including graphs, illustrations, photographs and tables taken from published studies included in promotional material must: (a) clearly indicate the precise source(s) of the artwork; (b) be faithfully reproduced, except where adaptation or modification is required in order to comply with any Applicable Code(s), in which case it must be clearly stated that the artwork has been adapted and/or modified.
Particular care must be taken to ensure that artwork included in Promotion does not mislead about the nature of a Medicinal Product (for example, whether it is appropriate for use in children) or mislead about a claim or comparison (for example, by using incomplete or statistically irrelevant information or unusual scales).
Section 3.07. The word “safe” must never be used to describe a Medicinal Product without proper qualification.
Section 3.08. The word “new” must not be used to describe any Medicinal Product or presentation which has been generally available or any therapeutic indication which has been generally promoted, for more than one year.
Section 3.09. It must not be stated that a Medicinal Product has no side-effects, toxic hazards or risks of addiction or dependency.
ARTICLE 4 – USE OF QUOTATIONS IN PROMOTION
Quotations from medical and scientific literature or from personal communications must be faithfully reproduced (except where adaptation or modification is required in order to comply with any Applicable Code(s), in which case it must be clearly stated that the quotation has been adapted and/or modified) and the precise sources identified.
ARTICLE 5 – ACCEPTABILITY OF PROMOTION
Member Companies must maintain high ethical standards at all times. Promotion must: (a) never be such as to bring discredit upon, or reduce confidence in, the pharmaceutical industry; (b) be of a nature which recognises the special nature of Medicinal Products and the professional standing of the intended audience; and (c) not be likely to cause offence.
ARTICLE 6 – DISTRIBUTION OF PROMOTION
Section 6.01. Promotion must only be directed at those HCPs whose need for, or interest in, the particular information can reasonably be assumed.
Section 6.02. Mailing lists must be kept up-to-date. Requests to be removed from mailing lists must be complied with.
Section 6.03. Subject to applicable national laws and regulations, the use of faxes, e-mails, automated calling systems, text messages and other digital communications for Promotion is prohibited except with the prior consent, or upon the request, of those who receive it.
ARTICLE 7 – TRANSPARENCY OF PROMOTION
Section 7.01. Promotion must not be disguised.
Section 7.02. Clinical assessments, post-marketing surveillance and experience programmes and post-authorization studies (including those that are retrospective in nature) must not be disguised Promotion. Such assessments, programmes and studies must be conducted with a primarily scientific or educational purpose.
Section 7.03. Where a Member Company pays for or otherwise secures or arranges the publication of promotional material in journals, such promotional material must not resemble independent editorial matter.
Section 7.04. Material relating to Medicinal Products and their uses, whether promotional in nature or not, which is sponsored by a Member Company must clearly indicate that it has been sponsored by that Member Company.
ARTICLE 8 – PROMOTIONAL INFORMATION PROVIDED DURING INTERNATIONAL EVENTS
Promotional information which appears on exhibition stands or is communicated to participants at international Events may, unless prohibited or otherwise regulated by local laws and regulations, refer to Medicinal Products (or uses) which are not registered in the country where the Event takes place, or which are registered under different conditions, as long as: (i) any such promotional material is accompanied by a suitable statement indicating the countries in which the Medicinal Product is registered and makes clear that the Medicinal Product or indication is not registered locally, and (ii) any such promotional material which refers to the prescribing information (indications, warnings etc.) authorized in a country or countries where the Medicinal Product is registered must be accompanied by an explanatory statement indicating that registration conditions differ internationally.
ARTICLE 9 – PERSONAL MEDICAL MATTERS
In the case of requests from individual members of the general public for advice on personal medical matters, the enquirer must be advised to consult a HCP.
CHAPTER 2 – INTERACTIONS WITH HCPs, HCOs AND POs
ARTICLE 10 – EVENTS AND HOSPITALITY
Section 10.01. All Events, organised or sponsored by a Member Company must be held in “appropriate” Location and Venues that are conducive to the main purpose of the Event, whilst the costs may be borne only if appropriate and in accordance with the statutory amounts and the provisions of the Code.
For the purpose of this Article, an “appropriate” Location with the most convenient access for majority of participants and available capacities for organisation of the Event.
For the purpose of this Article, an “appropriate” Venue is a venue that is usually used for organisation of similar events and is not “renowned” or “extravagant”.
A “leisure” Venue in the sense hereof means a venue known predominantly for providing special types of entertainment (outside the scope of congress activity), such as a casino and golf course.
An “extravagant” venue in the sense hereof means a 5* hotel or similar venue of a higher luxury category, whereby the categorisation of the congressional capacity at each venue shall be deemed to be equal to the categorisation of the hotel or facility, in or directly at which they are located.
Section 10.02. No Member Company may organise or sponsor an Event that takes place outside its home country unless:
Section 10.03. Member Companies shall not provide any meal (food and beverages) to HCPs, unless the value of such individual meals (food and beverages) does not exceed 60 EUR (including VAT) if the event is set in Slovenia. All forms of hospitality offered shall be “reasonable” in level and strictly limited to the main purpose of the event. As a general rule, the hospitality provided must not exceed what recipients would normally be prepared to pay for themselves.
“Reasonable” hospitality in the sense of this Article shall mean hospitality within the limitations healthcare organisations would normally observe in the organisation of events for their own needs, whereby events aimed predominantly at leisure should be avoided.
HCPs must not be provided or have paid any individual leisure activities or other extra-curricular or social activities. Moderate (simple) entertainment at events is allowed but must be of secondary importance in comparison to refreshing beverages and/or food.
Section 10.04. Hospitality extended in connection with Events must be limited to travel, meals, accommodation and genuine registration fees and shall be reasonable and appropriately documented.
The costs of travel, accommodation, registration and food shall not be considered as gifts under the Civil Servants Act. Reasonable travel, accommodation, registration costs must be shown in a transparent manner.
Section 10.05. If the event is set abroad the monetary threshold set in the country where the event takes place (i.e. “host country” principle) shall prevail.
Section 10.06. Hospitality may only be extended to persons who qualify as participants in their own right. In exceptional cases of established health needs (e.g. disability or injury), the travel, meals, accommodation and genuine registration fee costs of an accompanying person can be reimbursed within the same parameters.
Section 10.07. Hospitality must not include sponsoring or organising entertainment events (e.g., sporting or leisure).
ARTICLE 11 – PROHIBITION OF GIFTS
Section 11.01. Gifts for the personal benefit (such as sporting or entertainment tickets, social courtesy gifts) of HCPs, HCOs’ members or POs’ Representatives (either directly or indirectly) are prohibited.
Providing or offering cash, cash equivalents or personal services is also prohibited. For these purposes, personal services are any type of service unrelated to the profession and that confer a personal benefit to the Recipient.
Section 11.02. A promotional aid is a non-monetary item given for a promotional purpose (which does not include promotional materials as defined in Chapter 1). Providing or offering them to HCPs, HCOs’ members or POs’ Representatives in relation to the promotion of POM is prohibited.
ARTICLE 12 – DONATIONS AND GRANTS TO HCOs AND POs
Section 12.01. Donations and Grants (in cash or in kind or otherwise) to HCOs and/or POs are only allowed if: (i) they are made for the purpose of supporting healthcare, research or education; (ii) they are documented and kept on record by the donor/grantor; and (iii) they do not constitute an inducement to recommend and/or prescribe, purchase, supply, sell or administer specific Medicinal Products.
Section 12.02. Donations and Grants to individuals are not permitted. The Contribution to Costs related to Events for HCPs to attend international Events is covered by Article 13 of this Code.
ARTICLE 13 – CONTRIBUTION TO COSTS RELATED TO EVENTS AND SPONSORSHIP
Section 13.01. Member Companies must comply with criteria governing the selection and support of HCPs or POs’ Representatives to attend Events as provided in, or in connection with, any Applicable Codes. No payment must be offered to compensate merely for the time spent by the HCP or PO’s Representative in attending Events.
Section 13.02. The public use of an HCO or PO´s logo and/or proprietary material by a Member Company requires written permission from that organisation. In seeking such permission, the specific purpose and the way the logo and/or proprietary material will be used must be clearly stated.
Section 13.03. Member Companies must ensure that their Sponsorship to HCOs and POs is always clearly acknowledged and apparent from the outset.
ARTICLE 14 – MEMBER COMPANY FUNDING
No Member Company may require that it be the sole funder or sponsor of a PO or HCO or any of its programmes.
Member Companies welcome broad funding and sponsorship of POs and HCOs from multiple sources.
ARTICLE 15 – CONTRACTED SERVICES
Section 15.01. Contracts between Member Companies and HCPs, HCOs, POs or POs’ Representatives under which those provide any type of services to Member Companies (not otherwise covered by the Code) are only allowed if such services: (i) are provided for the purpose of supporting healthcare, research or education; and (ii) do not constitute an inducement to recommend and/or prescribe, purchase, supply, sell or administer specific Medicinal Products.
Section 15.02. It is permitted to contract HCPs or POs’ Representatives as consultants, whether in groups or individually, for services such as speaking at and/or chairing meetings, involvement in medical/scientific studies, clinical trials or training services, participation at advisory board meetings, and participation in market research where such participation involves remuneration and/or hospitality. The arrangements that cover these genuine consultancy or other services must, to the extent relevant to the particular arrangement, fulfil all the following criteria:
a. a written contract is agreed in advance of the commencement of the services which specifies the nature of the services to be provided and, subject to clause (g) below, the basis for payment of those services;
b. a legitimate need for the services has been clearly identified and documented in advance of requesting the services and entering into arrangements;
c. the criteria for selecting consultants are directly related to the identified need and the persons responsible for selecting the consultants have the expertise necessary to evaluate whether the particular consultant meets those criteria;
d. the number of consultants retained and the extent of the service are not greater than reasonably necessary to achieve the identified need;
e. the contracting Member Company maintains documentation concerning, and makes appropriate use of, the services provided by consultants;
f. the engagement of the consultant to provide the relevant service is not an inducement to recommend and/or prescribe, purchase, supply, sell or administer a particular Medicinal Product;
g. the remuneration for the services is reasonable and reflects the fair market value of the services provided. In this regard, token consultancy arrangements must not be used to justify compensating the HCPs or PO Representatives.
Section 15.03. In their written contracts with consultants, Member Companies are strongly encouraged to include provisions regarding the obligation of the consultants to declare that they are consultants to the Member Company whenever they write or speak in public about a matter that is the subject of the agreement or any other matter relating to that Member Company.
Similarly, Member Companies that employ, on a part-time basis, HCPs that are still practising their profession are strongly encouraged to ensure that such persons have an obligation to declare their employment arrangements with the Member Company whenever they write or speak in public about a matter that is the subject of the employment or any other matter relating to that Member Company. The provisions of this Section 15.03 apply even though the EFPIA Code does not otherwise cover non-promotional, general information about Member Companies (as discussed in the “Scope of the EFPIA Code” section).
Section 15.04. Limited market research, such as one-off phone interviews or mail/e-mail/internet questionnaires are excluded from the scope of this Article 15 of this Code, provided that the HCP, HCO’s member or PO’s Representative is not consulted in a recurring manner (either with respect to the frequency of calls generally or of calls relating to the same research) and that the remuneration in kind does not exceed 42 EUR (inclusive of VAT) per survey or questionnaire.
Section 15.05. If an HCP or a PO’s Representative attends an Event (an international Event or otherwise) in a consultant capacity the relevant provisions of Article 10 of this Code must apply.
CHAPTER 3 – SPECIFIC REQUIREMENTS FOR INTERACTIONS WITH HCPs AND HCOs
ARTICLE – 16 MEDICAL EDUCATION
Medical Education is aimed at increasing the scientific knowledge and competence of HCPs to enhance medical practice and improve patient outcome.
Member Companies can be engaged in different types of Medical Education but such activities must not constitute Promotion.
When funding independent Medical Education or organizing Medical Education activities directly or in collaboration with Third Parties, Member Companies must ensure that their participation and role is clearly acknowledged and apparent from the outset. When organising Medical Education activities in which Member Companies have input in the content, they are responsible for what is communicated during the activities. Such content must be fair, balanced and objective, and designed to allow the expression of diverse theories and recognized opinions.
ARTICLE 17 – INFORMATIONAL OR EDUCATIONAL MATERIALS AND ITEMS OF MEDICAL UTILITY
Section 17.01. The provision of Informational or Educational Materials is permitted provided it is: (i) “inexpensive”; (ii) directly relevant to the practice of medicine or pharmacy; and (iii) directly beneficial to the care of patients.
Section 17.02. Items of Medical Utility aimed directly at the education of HCPs and patient care can be provided if they are “inexpensive” and do not offset routine business practices of those who receive them.
Section 17.03. The nature of Informational or Educational Materials and Items of Medical Utility considered may not constitute a circumvention of the prohibition on gifts defined under Article 11 of this Code. The transmission of such materials or items must not constitute an inducement to recommend, prescribe, purchase, supply, sell or administer a Medicinal Product.
Section 17.04. Informational or Educational Materials and Items of Medical Utility can include the Member Company name, but must not be product branded, unless the Medicinal Product’s name is essential for the correct use of the material or item by the patient.
ARTICLE 18 – NON-INTERVENTIONAL STUDIES
Section 18.01. Non-Interventional Studies must be conducted with a primarily scientific purpose and must not be disguised Promotion.
Section 18.02. Non-Interventional Studies that are prospective in nature and that involve the collection of patient data from or on behalf of individual, or groups of, HCPs specifically for the study must comply with all of the following criteria:
a. there is a written study plan (observational plan/protocol);
b. in countries where ethics commissions are prepared to review such studies, the study plan must be submitted to the ethics committee for review;
c. the study plan must be approved by the Member Company’s scientific service and the conduct of the study must be supervised by the Member Company’s scientific service as described in Section 20.01.a of this Code;
d. the study results must be analysed by or on behalf of the contracting Member Company and summaries thereof must be made available within a reasonable period of time to the Member Company’s scientific service (as described in Section 20.01.a of this Code), which service must maintain records of such reports for a reasonable period of time. The Member Company must send the summary report to all HCPs that participated in the study and must make the summary report available to industry self-regulatory bodies and/or committees that are in charge of supervising or enforcing Applicable Codes upon their request. If the study shows results that are important for the assessment of benefit-risk, the summary report must be immediately forwarded to the relevant competent authority; and
e. Medical Sales Representatives may only be involved in an administrative capacity and such involvement must be under the supervision of the Member Company’s scientific service that will also ensure that the Medical Sales Representatives are adequately trained. Such involvement must not be linked to the Promotion of any Medicinal Product.
Section 18.03. To the extent applicable, Member Companies are encouraged to comply with Section 18.02 of this Code for all other types of NIS, including epidemiological studies and registries and other studies that are retrospective in nature. In any case, such studies are subject to Section 15.01 of this Code.
ARTICLE 19 MEDICAL SAMPLES
Section 19.01. In accordance with the current Rules on advertising of medicinal products, in principle, no medical samples should be given to persons authorized to prescribe medicinal products, except exceptionally under the following conditions:
a) the medicinal product has due marketing authorisation;
b) the medicinal product does not require any special storage conditions, such as a cold chain;
c) no more than two years have elapsed from acquisition of the marketing authorisation or approval of a change of marketing authorisation that requires a new application;
d) samples may only be delivered upon a written request signed and dated by the prescriber;
e) the recipient must keep a record of received samples and must not resell them;
f) samples must be in the smallest packaging on the market;
g) samples must be accompanied by SmPC;
h) samples must not contain narcotic and psychotropic substances.
Medical Samples must not be given as an inducement to recommend, prescribe, purchase, supply, sell or administer specific Medicinal Products, and must not be given for the sole purpose of treating patients.
Medical Samples are provided to HCPs so that they may familiarise themselves with the Medicinal Product, unless such product is subject to peroral administration.
Section 19.02. Member Companies must have adequate systems of control and accountability for Medical Samples which they distribute and for all Medicinal Products handled by theirs Medical Sales Representatives. This system must also clearly establish, that each HCP may only receive on sample of each Medicinal Product, for which a marketing authorisation has been obtained and the marketing authorisation holder has informed the competent authority for medicinal products about the actual commencement of sales.
Each Medical Sample must be marked “free medical sample – not for sale” or words to that effect and must be accompanied by a copy of the summary of product characteristics.
ARTICLE 20 – MEMBER COMPANY STAFF
Section 20.01. All Member Company staff must be fully conversant with the relevant requirements of the Applicable Code(s) and Rules on advertising of medicinal products.
a. Each Member Company must establish a scientific service in charge of information about its Medicinal Products and the approval and supervision of NIS. Member Companies are free to decide how best to establish such service(s) in accordance with this Section 20.01 of this Code (i.e. whether there is one service in charge of both duties or separate services with clearly delineated duties), taking into account their own resources and organisation. The scientific service must include a medical doctor or, where appropriate, a pharmacist who will be responsible for approving any promotional material before release. Such person must certify that he or she has examined the final form of the promotional material and that in his or her belief it is in accordance with the requirements of the Applicable Code(s) and any relevant laws and regulations, is consistent with the summary of product characteristics and is a fair and truthful presentation of the facts about the Medicinal Product. In addition, the scientific service must include a medical doctor or, where appropriate, a pharmacist, who will be responsible for the oversight of any NIS (including the review of any responsibilities relating to such studies, particularly with respect to any responsibilities assumed by Medical Sales Representatives). Such person must certify that he or she has examined the protocol relating to the NIS and that in his or her belief it is in accordance with the requirements of the Applicable Code(s) and any relevant laws and regulations.
b. Each Member Company must appoint at least one senior employee who must be responsible for supervising the Member Company and its subsidiaries to ensure that the standards of the Applicable Code(s) are met.
Section 20.02. Each Member Company must ensure that its Medical Sales Representatives are familiar with the relevant requirements of the Applicable Code(s), and all applicable laws and regulations, and are adequately trained and have sufficient scientific knowledge to be able to provide precise and complete information about the Medicinal Products they promote.
a. Medical Sales Representatives must comply with all relevant requirements of the Applicable Code(s), and all applicable laws and regulations, and Member Companies are responsible for ensuring their compliance.
b. Medical Sales Representatives must approach their duties responsibly and ethically.
c. During each visit, and subject to applicable laws and regulations, Medical Sales Representatives must give the persons visited, or have available for them, a summary of the product characteristics for each Medicinal Product they present.
d. Medical Sales Representatives must transmit to the scientific service of their companies forthwith any information they receive in relation to the use of their company’s Medicinal Products, particularly reports of side effects.
e. Medical Sales Representatives must ensure that the frequency, timing and duration of visits to HCPs, pharmacies, hospitals or other healthcare facilities, together with the manner in which they are made, do not cause inconvenience.
f. Medical Sales Representatives must not use any inducement or subterfuge to gain an interview. In an interview, or when seeking an appointment for an interview, Medical Sales Representatives must, from the outset, take reasonable steps to ensure that they do not mislead as to their identity or that of the Member Company they represent.
CHAPTER 4 – SPECIFIC REQUIREMENTS FOR INTERACTIONS WITH POs
ARTICLE 21 – INTERACTIONS WITH POs
Section 21.01. For cooperation with POs Member Companies must comply with the following principles:
1. The independence of POs, in terms of their political judgement, policies and activities, must be assured.
2. All interactions between POs and Member Companies must be based on mutual respect, with the views and decisions of each partner having equal value.
3. Member Companies must not request, nor shall POs undertake, the Promotion of a particular POM.
4. The objectives and scope of any collaboration must be transparent. Financial and non-financial support provided by Member Companies must always be clearly acknowledged and disclosed.
Section 21.02. EU and national laws and regulations prohibit the advertising of POM to the general public.
Section 21.03. When Member Companies provide financial support, significant indirect support and/or significant non-financial support to POs, they must have in place a written agreement. This must state the amount of funding and also the purpose (e.g. unrestricted grant, specific meeting or publication, etc). It must also include a description of significant indirect support (e.g. the donation of public relations agency´s time and the nature of its involvement) and significant non-financial support.
Section 21.04. Member Companies must not influence the text of PO’s material they sponsor in a manner favourable to their own commercial interests. This does not preclude Member Companies from correcting factual inaccuracies. In addition, at the request of POs, Member Companies may contribute to the drafting of the text from a fair and balanced scientific perspective.
CHAPTER 5 – DISCLOSURE OF ToVs FROM MEMBER COMPANIES
ARTICLE 22 – DISCLOSURE OF ToVs TO HCPs, HCOs, AND POs
Section 22.01. Time of Disclosure
Disclosures must be made by each Member Company within 6 months after the end of the relevant Reporting Period and the information disclosed must be required to remain in the public domain for a minimum of 3 years after the time such information is first disclosed unless, in each case, (i) a shorter period is required under applicable national laws or regulations, or (ii) the relevant data protection legal basis (e.g. the legitimate interest grounds, a legal duty ) is no longer applicable.
The common reporting period for publication of ToVs to Recipients is set during the time interval from 20th to 30th June each year at the latest.
ARTICLE 23 – DISCLOSURE OF ToVs TO HCPs AND HCOs
Section 23.01. Rationale
The following Article provides for disclosures of ToVs to HCPs and HCOs, whether directly or indirectly. When deciding how a ToV must be disclosed, Member Companies should, wherever possible, identify and publish at the individual HCP (rather than HCO) level, as long as this can be achieved with accuracy, consistency and in compliance with applicable laws and regulations.
Section 23.02. Disclosure Obligation
General Obligation. Subject to the terms of this Article, each Member Company must document and disclose ToVs it makes, directly or indirectly, to or for the benefit of a Recipient, as described in more detail in Article 23.05 of this Code.
Excluded Disclosures. Without limitation, ToVs that (i) are solely related to over-the-counter medicines; (ii) are not listed in Section 23.05 of this Article, such as Items of Medical Utility (governed by Article 17 of this Code), meals (governed by Article 10 of this Code, especially Section 10.05), Medical Samples (governed by Article 19 of this Code); or (iii) are part of ordinary course purchases and sales of Medicinal Products by and between a Member Company and a HCP (such as a pharmacist) or a HCO do not fall within the scope of the disclosure obligation described above in “General Obligation”.
Section 23.03. Form of Disclosure
Annual Disclosure Cycle. Disclosures must be made on an annual basis and each Reporting Period must cover a full calendar year.
Template. For the sake of greater consistency, disclosures under this Article shall be made on a standardised template set out in Annex A.
Platform of Disclosure. Disclosures shall be made on websites Member Companies or their affiliates provided that they are unrestricted and publicly available.
Applicable National Code. Disclosures must be made pursuant to the National Code of the country where the Recipient has its professional address. If a Member Company is not resident or does not have a subsidiary or an affiliate in the country where the Recipient has its physical address, the Member Company must disclose such ToV in a manner consistent with the relevant National Code in its home country.
Language of Disclosure. Disclosures must be made in the Slovenian language. Member Companies are encouraged to make disclosures in English in addition to the mandatory disclosures in the local language.
Documentation and Retention of Records. Each Member Company must document all ToVs required to be disclosed pursuant to Section 23.03 of this Code and maintain the relevant records of the disclosures made under this Article for a minimum of 5 years after the end of the relevant Reporting Period, unless a shorter period is required under applicable national laws or regulations.
Section 23.05. Individual and Aggregate Disclosure
Individual Disclosure. Except as expressly provided by this Article, ToVs must be disclosed on an individual basis. Each Member Company must disclose, on an individual basis for each clearly identifiable Recipient, the amounts attributable to ToVs to such Recipient in each Reporting Period which can be reasonably allocated to one of the categories set out below. Reasonable travel, accommodation and registration costs must be shown in a transparent manner as referred to below. Such ToVs may be aggregated on a category-by-category basis, provided that itemised disclosure must be made available upon request to (i) the relevant Recipient, and/or (ii) the relevant authorities.
1. For ToVs to a HCO, an amount related to any of the categories set forth below:
a. Donations and Grants. Donations and Grants to HCOs that support healthcare, including donations and grants (either cash or benefits in kind) to institutions, organisations or associations that are comprised of HCPs and/or that provide healthcare (governed by Article 12 of this Code).
b. Contribution to costs related to Events. Contribution to costs related to Events, through HCOs or Third Parties, including support to HCPs to attend Events, such as:
i. Registration fees;
ii. Sponsorship agreements with HCOs or with Third Parties appointed by an HCO to manage an Event; and
iii. Travel and accommodation costs (to the extent governed by Article 10 of this Code).
c. Fees for Service and Consultancy. ToVs resulting from or related to contracts between Member Companies and HCOs under which such HCOs provide any type of services to a Member Company or any other type of funding not covered in the previous categories. Fees, on the one hand, and on the other hand ToVs relating to expenses agreed in the written agreement covering the activity (e.g. travel costs, other out of pocket expenses, …) will be disclosed as two separate amounts.
2. For ToVs to a HCP:
a. Contribution to costs related to Events. Contribution to costs related to Events, such as:
i. Registration fees; and
ii. Travel and accommodation costs (to the extent governed by Article 10 of this Code).
b. Fees for Service and Consultancy. ToVs resulting from or related to contracts between Member Companies and HCPs under which such HCPs provide any type of services to a Member Company or any other type of funding not covered in the previous categories. Fees, on the one hand, and on the other hand ToVs relating to expenses agreed in the written agreement covering the activity (e.g. travel costs, other out of pocket expenses, …) will be disclosed as two separate amounts.
Aggregate Disclosure. For ToVs where certain information, which can be otherwise reasonably allocated to one of the categories set forth in Section 23.05 of this Code, cannot be disclosed on an individual basis for legal reasons, a Member Company must disclose the amounts attributable to such ToVs in each Reporting Period on an aggregate basis. Such aggregate disclosure must identify, for each category, (i) the number of Recipients covered by such disclosure, on an absolute basis and as a percentage of all Recipients, and (ii) the aggregate amount attributable to ToVs to such Recipients.
Non duplication. Where a ToV required to be disclosed pursuant to Section 23.05 of this Code is made to an individual HCP indirectly via a HCO, such ToV must only be required to be disclosed once. To the extent possible, such disclosure must be made on an individual HCP named basis pursuant to Section 23.05 of this Code.
Research and Development ToV. Research and Development ToVs in each Reporting Period must be disclosed by each Member Company on an aggregate basis. Costs related to Events that are clearly related to activities covered in this section can be included in the aggregate amount under the “Research and Development Transfers of Value” category.
Methodology. Each Member Company must publish a note summarising the methodologies used by it in preparing the disclosures and identifying ToVs for each category described in Section 23.05 of this Code. The note, including a general summary and/or country specific considerations, must describe the recognition methodologies applied, and should include the treatment of multi-year contracts, VAT and other tax aspects, currency aspects and other issues related to the timing and amounts of ToVs for purposes of this Article, as applicable.
ARTICLE 24 – DISCLOSURE OF SUPPORT AND SERVICES PROVIDED TO POs
Each Member Company must disclose a list of POs to which it provides financial support and/or significant indirect/non-financial support or with whom it has engaged to provide contracted services for that Member Company.
The term “significant” support referred to in the preceding paragraph shall mean any support or service, with an attributable monetary value exceeding EUR 150 per transaction and EUR 600 per year.
This disclosure must include a description of the nature of the support or services provided that is sufficiently complete to enable the average reader to form an understanding of the nature of the support or the arrangement without the necessity to divulge confidential information.
In addition to the name of the PO, the following elements must be included:
a. For support:
i. the monetary value of financial support and of invoiced costs.
ii. the non-monetary benefit that the PO receives when the non-financial support cannot be assigned to a meaningful monetary value.
b. For contracted services: the total amount paid per PO over the Reporting Period.
This information must be disclosed on the Member Company website either on a national or European level on an annual basis and each Reporting Period shall cover a full calendar year.
Methodology. Each Member Company must publish the methodologies used by it in preparing the disclosures and identifying supports and services provided.
CHAPTER 6 – PROCEDURAL REQUIREMENTS
ARTICLE 25 – RESPONSABILITY AND SANCTIONS
25.01. Responsibility for pharmaceutical information shall apply to information as a whole: for form and content.
25.02. Responsibility for assuring compliance with the present Code is borne by all Forum members. Authorised representatives of Forum members are responsible also for compliance with this code.
25.03. If Forum finds out or is informed about a violation of this Code, it shall request the violating company to immediately cease the violation and sign a statement that it shall not repeat it. Sanctions must be proportionate to the nature of the violation, have a deterrent effect and take into account repeated violations of the same type or patterns of various violations. Generally, the most effective sanction is the combination of notifying all Members Companies and financial fine for the violating company, however, Forum may impose any other effective sanction to enforce the implementation of the Code. Forum must also consider all applicable legal or financial requirements that could influence the nature of sanctions.
ARTICLE 26 – SUPERVISION
The Committee for supervision of the provisions of the Code of Practice (hereinafter: “the Committee”) as a Forum body assesses compliance of information on medicinal products and appropriateness of cooperation of Member Companies with HCPs, HCOs and POs and also provides guidelines.
ARTCLE 27 – COMPLAINTS
Complaints regarding violations of the Code shall be submitted to the Committee within 30 days from the occurrence of violation.
ARTICLE 28 – AMENDMENTS OF THE CODE
28.01. Amendments or adjustments of the Code may be adopted on the basis of a majority vote of Member Companies at the General Assembly. The Code may also be amended:
a) upon amendment of the EFPIA Code of conduct.
b) upon a request submitted to the Forum Board by a one or more Member Companies, which shall, after review, be submitted for approval to the General Assembly.
28.02. Adoption shall require the majority of present votes at a General Assembly.
ARTICLE 29 – ENFORCEMENT OF THE CODE
This Code was adopted by the General Assembly of Forum on 20 March 2020 and shall be applicable as of 1 January 2021.
ANNEX A
Standardised disclosure template
Disclosure template
Version: 27 June 2019
“,”Jaka Verbič Miklič”,1584737100,1584737100,en,14239,306,14520,43,0,NULL,,”Forumov kodeks ravnanja”,forumov-kodeks-ravnanja,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1584743817,1605547512
629,14253,”Farmacevtska industrija skupaj z ostalimi deležniki v boju proti COVID-19″,”Koronavirus (COVID-19) se nezadržno širi po celem svetu in prizadevanja za njegovo zajezitev so vsak dan intenzivnejša.”,”
Koronavirus (COVID-19) se nezadržno širi po celem svetu in prizadevanja za njegovo zajezitev so vsak dan intenzivnejša. Prav tako tudi iskanje cepiva, k čemur je pristopila celotna farmacevtska stroka. Izziv pred katerega je danes postavljeno človeštvo je velik. Vsa vlaganja in napori farmacevtov imajo danes samo en cilj – poiskati cepivo zoper COVID-19.
K skupnemu iskanju cepiva so tako pristopile tudi družbe članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb GIZ kot tudi EFPIA, Evropska zveza farmacevtskih industrij in združenj, ki poziva k sodelovanju vseh pri takojšnjemu ukrepanju za zajezitev pandemije in iskanju rešitev za preprečitev le te v bodoče. EFPIA svoje napore usmerja predvsem v tri področja:
1. zagotavljanje ustrezne oskrbe bolnikov z zdravili, ki jih nujno potrebujejo;
2. podporo deležnikom v zdravstvu, državnim institucijam, zdravstvenim sistemom in organizacijam v boju proti COVID-19;
3. intenziven razvoj cepiv, diagnostike in zdravljenja v pomoč boju proti COVID-19.
Bolj kot kadarkoli prej, smo predstavniki farmacevtske industrije stopili skupaj z namenom, da v najkrajšem možnem času razvijemo in izdelamo učinkovito cepivo zoper COVID-19. Farmacevtska podjetja in raziskovalne institucije zato javno delimo svoje ugotovitve ter rezultate raziskav in testiranj, saj današnja situacija to od nas zahteva. Obenem se moramo zavedati, da se razvoj novega cepiva ne zgodi iz danes na jutri, temveč je proces, ki terja svoj čas.
Redno naprej sodelujemo z vsemi deležniki v zdravstvu, državnimi institucijami in zdravstvenimi institucijami, ki jih oskrbujemo s potrebnimi zdravili in medicinskimi pripomočki za blaženje učinkov koronavirusa. To bomo počeli dokler ne bomo razvili učinkovitega cepiva. Klinične raziskave novega cepiva so v polnem teku. In takoj, ko bo cepivo zoper COVID-19 odobreno, bomo poskrbeli, da bo na razpolago ter dostopno vsem.
To so naša prizadevanja, to so naše zaveze.
#BrezPredaha #WeWontRest
“,”Jaka Verbic Miklic”,1585906740,1585906740,sl,14253,306,14252,43,0,NULL,”Koronavirus (COVID-19) se nezadržno širi po celem svetu in priza”,”Farmacevtska industrija skupaj z ostalimi deležniki v boju proti COVID-19″,farmacevtska-industrija-skupaj-z-ostalimi-delezniki-v-boju-proti-covid-19,Post,/sites/43/files/images/slideshow/fidprc_004.jpg,1,0,1585906904,1587022829
630,14253,”Pharmaceutical industry working with other stakeholders against COVID-19″,”The novel coronavirus disease (COVID-19) is spreading inexorably around the world and efforts to stem the outbreak are growing more intense each day”,”
The novel coronavirus disease (COVID-19) is spreading inexorably around the world and efforts to stem the outbreak are growing more intense each day, as is the search for a vaccine which has become the common goal of the entire pharmaceutical industry. Humanity is facing a major challenge. All the efforts and work done by pharmaceutical professionals is now focused on a single goal – to find a vaccine against COVID-19.
Member companies of the Forum of International Research and Development Pharmaceutical Companies, EIG, and the European Federation of Pharmaceutical Industries and Associations (EFPIA) have joined the common efforts to find a vaccine and have issued a call for all stakeholders to step together and immediately adopt measures to help stem the pandemic and find solutions to prevent similar events in the future. The EFPIA has focused its efforts on three major areas:
1. Supplying necessary medicines to patients in need;
2. Supporting stakeholders in healthcare, national institutions, healthcare systems and organizations fighting against COVID-19;
3. Intensive development of vaccines, diagnostics and treatments to assist in the fight against COVID-19.
Representatives of the pharmaceutical industry have joined forces and bridged the divides more than ever before in order to develop and produce an effective vaccine against COVID-19 in the shortest possible time. Pharmaceutical companies and research institutions now publicly share our findings and results of studies and tests because that is what the current situation requires. But we also need to know that a new vaccine cannot be developed overnight. The process is complex and requires time.
We are continuing our regular cooperation with stakeholders in healthcare, national institutions and healthcare institutions and supplying the necessary medicines and medical devices to mitigate the effects of the coronavirus. We will keep doing so until we can develop an effective vaccine. Clinical research of the new vaccine is in full force. And as soon a vaccine against COVID-19 is approved, we will make sure it is made available to everybody.
This is our work, these are our commitments.
#WeWontRest
“,”Jaka Verbič Miklič”,1585906740,1585906740,en,14253,306,14252,43,0,NULL,”Koronavirus (COVID-19) se nezadržno širi po celem svetu in priza”,”Farmacevtska industrija skupaj z ostalimi deležniki v boju proti COVID-19″,farmacevtska-industrija-skupaj-z-ostalimi-delezniki-v-boju-proti-covid-19,Post,/sites/43/files/images/slideshow/fidprc_004.jpg,1,0,1585906904,1587022829
631,14256,”Farmacevtske družbe nad COVID-19″,”Vključili smo se v boj proti virusu COVID-19″,”
Mednarodni forum znanstveno raziskovalnih farmacevtskih družb, GIZ, se je skupaj z družbami članicami ter Evropsko federacijo inovativnih farmacevtskih družb in združenj, EFPIA, vključil v boj proti virusu COVID-19 na več ravneh. Družbe članice so svoje raziskave usmerile v iskanje učinkovitega zdravila in cepiva, hkrati pa nudijo sprotno pomoč zdravstvenim sistemom v lokalnih okoljih, in sicer v obliki blagovnih in finančnih donacij.
Družbe članice in Forum so v boju proti virusu COVID-19 v Sloveniji do sedaj prispevali okrog 853.000 eurov. Donacije so družbe članice in Forum prispevali tako v blagu – zdravila, zaščitna in medicinska oprema – kot v finančni obliki. Ob tem v Forumu poudarjamo, da se pomoč slovenskemu zdravstvu nadaljuje, saj je še kar precej prošenj, ki so jih prejele družbe članice Foruma, v postopkih potrjevanja.
»Družbe članice Mednarodnega foruma znanstveno raziskovalnih farmacevtskih družb, GIZ, so ob izbruhu pandemije nemudoma aktivirale svoje razpoložljive moči in usmerile svoja vlaganja v iskanje učinkovitega cepiva ter zdravil zoper koronavirus. Aktivno sodelujejo tudi v medpanožnih pobudah za pospešen razvoj zdravil in diagnostike pri COVID-19, kot so »Therapeutics Accelerator«, »Innovative Medicines Initiative -IMI« in druge. Ker razvoj zdravil in cepiv terja običajno dolgotrajne postopke, poskušamo v vmesnem času z donacijami vsaj delno pomagati blažiti posledice, ki jih za seboj pušča COVID-19,« poudarja generalna sekretarka Foruma, mag. Barbara Stegel.
Družbe članice Foruma, kot krovnega predstavnika inovativne farmacevtske industrije v Sloveniji, so prav tako izjemno aktivne pri vlaganjih v raziskave in razvoj ter iskanju zdravil in cepiva zoper COVID-19. Zadnji teden aprila obeležujemo tudi evropski in svetovni teden cepljenja, ki bo letos potekal pod geslom #VaccinesWork.
Cepljenje bistveno prispeva k zdravju tako posameznikov, kot celotne populacije, vzdržnosti zdravstvenih sistemov in dobrobiti družbe na sploh, saj preprečuje obolevanje in smrt. S cepivi lahko danes preprečimo že okoli 30 bolezni. Z njihovo pomočjo smo izkoreninili črne koze, prav tako se v Evropi otroška paraliza skorajda ne pojavlja več, tudi davica je postala redkost.
Da so cepiva ne samo življenjskega pomena in njihov nenehni razvoj nujno potreben, pa dokazuje tudi današnji čas, ko se celoten svet spopada z virusom COVID-19. A razvoj učinkovitega cepiva terja svoj čas, sredstva in strokovna znanja. Iskanje cepiva zoper koronavirus je v polnem teku, saj razvojno-raziskovalne farmacevtske družbe svoj fokus, čas, sredstva in znanja s pojačano močjo usmerjajo prav tja.
Več o letošnji obeležitvi svetovnega dneva cepljenja na tej povezavi.
“,”Jaka Verbic Miklic”,1587018600,1587018600,sl,14256,306,14258,43,0,NULL,,”Farmacevtske družbe nad COVID-19″,farmacevtske-druzbe-nad-covid-19,Post,/sites/43/files/images/news/Covid-19/Coronavirus_500-2.jpg,1,0,1587018770,1587030878
632,14256,”Pharmaceutical companies fight COVID-19″,”We joined the ranks against COVID-19″,”
Forum of International Research and Development Pharmaceutical Companies, EIG, its member companies and the European Federation of Pharmaceutical Industries and Associations have joined the fight against the COVID-19 virus on several fronts. Member companies have focused their research on finding an effective cure and vaccine while also providing assistance to healthcare systems in local environments in the form of donations of funding and equipment.
Member companies and the Forum have contributed about 853,000 Eur to the fight against COVID-19 in Slovenia to date. Forum members and Forum have donated goods – medicines, protective and medical equipment – and funds. And the aid to Slovenian healthcare is continuing as many requests received by Forum members are still being approved.
“At the onset of the pandemic member companies of the Forum of International Research and Development Pharmaceutical Companies, EIG, have immediately activated their available resources and directed their efforts towards finding an effective vaccine and treatment against the coronavirus. They are also actively participating in multidisciplinary incentives for accelerated development of medicines and diagnostics for COVID-19, including “Therapeutics Accelerator”, “Innovative Medicines Initiative -IMI” and others. Since the development of treatments and vaccines usually requires prolonged procedures, we have been trying to help mitigate the consequences left in the wake of COVID-19 through donations,” said Forum Secretary General mag. Barbara Stegel.
Members of the Forum as the leading representative of the innovative pharmaceutical industry in Slovenia are also actively investing sizable resources in research and development and the search for a treatment and vaccines against COVID-19. The last week of April is the European and also global immunization week which will this year be celebrated under the common slogan of #VaccinesWork.
Immunization has made a substantial contribution to the health of individuals and the entire population, sustainability of healthcare systems and the well being of society as a whole as it effectively prevents disease and death. Today vaccines can prevent around 30 diseases. The power of vaccines has helped us eradicate smallpox, nearly eradicate polio in Europe and greatly reduce the occurrence of diphtheria.
The fact that vaccines are an essential component of modern healthcare and their continuous development is a major priority is underlined by our current global battle against the COVID-19 virus. But the development of an effective vaccine requires time, funding and expert knowledge. The search for a coronavirus vaccine is in full force as global research and development pharmaceutical companies focus their time, assets and knowledge on this life saving project.
Find out more about this year’s World Immunization Week.
“,”Jaka Verbič Miklič”,1587022440,1587022440,en,14256,306,14258,43,0,NULL,,”Farmacevtske družbe nad COVID-19″,farmacevtske-druzbe-nad-covid-19,Post,/sites/43/files/images/news/Covid-19/Coronavirus_500-2.jpg,1,0,1587018770,1587030878
633,14265,”Evropski boj proti COVID-19″,”Podatki so ključ za dostop bolnikov do potrebnih zdravil”,”
08.05.2020
V tednu, v katerem je Evropska komisija prevzela vodilno vlogo v globalnem boju proti COVID-19 in so države sveta na pobudo EU zbrale 7.4 milijard evrov za globalni odziv na koronavirus, so komisarji v tedenskem telefonskem posvetu glede COVID-19 naslovili praktične izzive, ki jih je prinesla kriza, s pragmatičnimi rešitvami, ki na prvo mesto postavljajo potrebe bolnikov.
Tako komisarka Kyriakidesova kot generalna direktorica združenja EFPIA Nathalie Moll sta poudarili pomen ohranjanja bolnikov v središču evropskega odziva na koronavirus. Nathalie Moll je posebej izpostavila tudi javni dialog med združenjem EFPIA in evropskim forumom bolnikov ter zaveze evropske raziskovalne industrije k boju proti COVID-19.
Zagotavljanje dobave potrebnih zdravil bolnikom ostaja prva prioriteta združenja EFPIA/Foruma in njegovih članic. Dr. Susanne Fielder (MSD) je ponovno izpostavila pomen podatkov iz modelov Evropskega centra za preprečevanje in obvladovanje bolezni glede verjetnega napredovanja pandemije v posameznih državah in podatkov držav članic o številu bolnikov in hospitalizacij. Ti podatki bodo omogočili dobavo pravih zdravil v pravo bolnišnico v pravi državi v pravem času, v okviru priprav na morebitne prihodnje valove bolezni.
S sprejemom načrtov pripravljenosti na pandemijo v januarju 2020 so družbe članice EFPIA/Foruma povečale proizvodnjo, da bi zadostile potrebam bolnikov, toda podatki so ključni dejavnik za zagotavljanje, da zdravila iz povečane proizvodnje najdejo pot po Evropi do vsakega posameznega bolnika, ki jih potrebuje.
Poleg podatkov za napovedovanje in modeliranje poteka epidemije lahko podatki iz državnih zbirk v okviru Direktive o ponarejenih zdravilih v združeni obliki pokažejo, kako in kdaj se kritična zdravila dobavljajo v države in kako hitro se porabljajo. Če takšne podatke pravilno uporabimo, lahko postanejo pomembno orodje za pomoč pri načrtovanju učinkovitega razporejanja zdravil, ki bo zagotovilo, da bolniki prejmejo vse tisto kar potrebujejo.
Naši znanstveniki in raziskovalci še naprej delajo brez prestanka in razvijajo nove diagnostične postopke, zdravila in cepiva za boj proti COVID-19, mi pa bomo še naprej delali v tesnem partnerstvu z združenji bolnikov, partnerji v zdravstvu, ustanovami EU in državami članicami, da bi zmanjšali učinke
virusa ter skupaj gradili odpornost Evrope proti prihodnjim in sedanjim zdravstvenim izzivom.
“,”Jaka Verbic Miklic”,1589278140,1589278140,sl,14265,306,14264,43,0,NULL,,”Evropski boj proti COVID-19″,evropski-boj-proti-covid-19,Post,/sites/43/files/images/news/Covid-19/homepage-banner_500.jpg,1,0,1589278349,1589278972
634,14265,”Europe’s COVID-19 battle”,”Data holds the key to ensuring patients get the medicines they need”,”
08.05.2020
In a week that saw the European Commission take a lead role in the global fight against COVID-19, raising €7.4bn at the Coronavirus Global Response pledging event, the weekly call with the Commissioners dedicated to COVID-19 addressed the practical challenges caused by the crisis with pragmatic solutions that put the needs of patients first.
Both Commissioner Kyriakides and EFPIA Director General, Nathalie Moll underlined the importance of keeping the patients at the heart of Europe’s coronavirus response with Ms Moll highlighting the public dialogue between EFPIA and the European Patients Forum as well as the European researched-based industry’s commitments to fighting COVID-19.
Ensuring the supply of medicines to the patients who need them, remains a top priority for EFPIA/Forum and its members. Dr Susanne Fielder (MSD) reiterated the importance of modelling data from the European Centre for Disease Control about the likely progression of the pandemic in each country as well as patient level and hospital level data in the Member States. It is this data that will facilitate getting the right medicine to the right hospital in the right country at the right time as we prepare for any future waves of the disease.
Having instigated pandemic preparedness plans in January 2020, EFPIA/Forum member companies have been able to increase production to meet the needs of patients, however data holds the key to ensuring that this increased production can be allocated across Europe so that each patient gets the medicines she or he needs.
In addition to the forecasting data and modelling, data held in national repositories, set up in the context of the EU Falsified Medicines Directive can show, at aggregate level, how and when critical treatments are delivered to countries and how quickly they are being used. If utilised, this data can be another powerful tool in helping to plan and manage the allocation of medicines to ensure patients get the treatments they need.
While our scientists and researcher
“,”Jaka Verbic Miklic”,1589278140,1589278140,en,14265,306,14264,43,0,NULL,,”Evropski boj proti COVID-19″,evropski-boj-proti-covid-19,Post,/sites/43/files/images/news/Covid-19/homepage-banner_500.jpg,1,0,1589278349,1589278972
635,14267,”Donacije farmacevtskih podjetij presegle milijon evrov”,”Rešitev vidijo v odprti izmenjavi informacij”,”
Mednarodni forum znanstveno raziskovalnih farmacevtskih družb sporoča, da je skupni znesek donacij, ki so ga v boju proti COVID-19 v Sloveniji do sedaj prispevale družbe članice, presegel 1 milijon evrov. Farmacevtske družbe so donacije slovenskemu zdravstvu in zdravstvenim delavcem, za blaženje posledic epidemije, namenile tako v materialnih, kot finančnih sredstvih. Ob tem pa poudarjajo, da intenzivno nadaljujejo tudi z vlaganji v iskanje zdravil, terapij in cepiva ter vzpostavljanjem učinkovitega sistema izmenjave podatkov.
Družbe članice Foruma so s svojimi donacijami slovenskemu zdravstvenemu sistemu že presegle 1 milijon evrov, prav tako pa nadaljujejo z vlaganji v iskanje učinkovitega zdravila in cepiva zoper COVID-19. »Razvoj zdravil in cepiv za množično rabo terja svoj čas, testiranja in preverjanja, zato je težko pričakovati, da bo cepivo jutri že na voljo. Do takrat pa moramo biti vsi zavezani k iskanju poti za blaženje posledic epidemije. In temu so namenjene donacije slovenskemu zdravstvenemu sistemu naših družb članic v zadnjih dveh mesecih,« poudarja Barbara Stegel, generalna sekretarka Foruma.
Farmacevtska industrija je zelo aktivna tudi na evropski ravni, kjer EFPIA (Evropska zveza farmacevtske industrije in združenj) skupaj z Evropsko komisijo ter Komisarko za zdravje Stello Kyriakides iščejo skupne rešitve v boju proti COVID-19, ob tem pa so v Evropski komisiji že zbrali tudi 7,4 milijarde sredstev za boj proti epidemiji.
»Med prednostnimi nalogami je tudi vzpostavitev učinkovitega sistema izmenjave podatkov in informacij med državami članicami EU o zdravstveni sliki posamezne države, bolnikih, zdravilih in zalogah zdravil. S temi podatki se želi farmacevtska industrija ustrezno organizirati in pripraviti na morebitni drugi val epidemije,« še dodajajo v Forumu.
Farmacevtska industrija je ob izbruhu tudi že povečala svoje proizvodne kapacitete, da so lahko zadostili večjemu povpraševanju po zdravilih v času epidemije. V nadaljevanju pa bo, v primeru drugega vala epidemije, ključna učinkovita distribucija na celotnem evropskem ozemlju, zato je nujno doseči dogovor o sistemu nadzora in upravljanja z epidemijo na evropski ravni.
“,”Jaka Verbic Miklic”,1589543280,1589543280,sl,14267,306,14266,43,0,NULL,,”Donacije farmacevtskih podjetij”,donacije-farmacevtskih-podjetij,Post,/sites/43/files/images/news/Donacije/donacije.jpg,1,0,1589546667,1589546668
636,14267,”Donations made by pharmaceutical companies exceed one million euros”,”Solution seen in open exchange of information”,”
The Forum of International Research and Development Pharmaceutical Companies reports that the total amount of donations given by its member companies in the fight against COVID-19 in Slovenia has exceeded one million Euros. Pharmaceutical companies have contributed donations in kind and in funding to Slovenian healthcare and healthcare workers to help mitigate the consequences of the epidemic. Donors also emphasize that they are continuing to intensively pursue investments into the search for cures, therapies and vaccines and establishment of effective information exchange systems.
Forum member companies have exceeded 1 million Euros with their donations to the Slovenian healthcare system and are continuing their investments into the search for an effective cure and vaccine against COVID-19. “The development of medicines and vaccines for mass use takes time, testing and verification, so we cannot expect the vaccine to be available tomorrow. Until then we must all stay dedicated to finding a way to mitigate the consequences of the epidemic. This is what the donations our members made to the Slovenian healthcare system over the past two months are intended for,” noted Barbara Stegel, Secretary General of the Forum.
The pharmaceutical industry is also very active at the European level where the European Federation of Pharmaceutical Industries and Associations (EFPIA) is working together with the European Commission and the Commissioner for Health Stella Kyriakides to seek common solutions in the fight against COVID-19 while the European Commission has also raised 7.4 billion Euros to fight the epidemic.
“One of the priority tasks is the establishment of an effective system for exchanging information and data among EU member countries on the healthcare situation of each country, patients, medicines and medicinal product stocks. This information will allow the pharmaceutical industry to organize and prepare for a potential second wave of the epidemic,” added the Forum.
The pharmaceutical industry has also increased its production capacities in order to satisfy greater demand for medicines during the epidemic. If a second wave of the epidemic does occur, efficient distribution throughout the entire European territory will be essential, so it is very important that an agreement be reached on how to manage and control the epidemic at the European level.
“,”Jaka Verbic Miklic”,1589543280,1589543280,en,14267,306,14266,43,0,NULL,,”Donacije farmacevtskih podjetij”,donacije-farmacevtskih-podjetij,Post,/sites/43/files/images/news/Donacije/donacije.jpg,1,0,1589546667,1589546668
637,14269,”Pravilnik o spremembah in dopolnitvah Pravilnika o oglaševanju zdravil”,” “,”
P R A V I L N I K o spremembah in dopolnitvah Pravilnika o oglaševanju zdravil
1. člen
V Pravilniku o oglaševanju zdravil (Uradni list RS, št. 105/08) se 17. člen spremeni tako, da se glasi:
»17. člen
(oglaševanje v strokovnih publikacijah in z neposrednim obveščanjem)
(1) Imetniki dovoljenja za promet z zdravilom lahko oglašujejo zdravila, ki so pridobila dovoljenje za promet, strokovni javnosti v strokovnih knjigah, strokovnih revijah in drugih strokovnih publikacijah.
(2) Imetniki dovoljenja za promet z zdravilom lahko oglašujejo zdravila tudi z neposrednim obveščanjem oseb, ki so pooblaščene za predpisovanje in izdajanje zdravil.«.
2. člen
V 18. členu se naslov člena spremeni tako, da se glasi: »(podatki in informacije o zdravilih)«.
Prvi odstavek se črta.
V drugem odstavku, ki postane prvi odstavek, se napovedni stavek spremeni tako, da se glasi:
»(1) Vse informacije o zdravilih, namenjene strokovni javnosti in osebam, ki so pooblaščene za njihovo predpisovanje in izdajanje, morajo vsebovati zlasti naslednje podatke:«.
Dosedanji tretji do peti odstavek postanejo drugi do četrti odstavek.
3. člen
V 19. členu se za prvim odstavkom doda nov drugi odstavek, ki se glasi:
»(2) Oglaševanje zdravil z neposrednim obveščanjem oseb, ki so pooblaščene za predpisovanje in izdajanje zdravil in opravljajo zdravstveno dejavnost v okviru mreže javne zdravstvene službe, se lahko izvaja le v času strokovne priprave za delo, ki ni namenjen za neposredno delo s pacienti.«.
Dosedanji drugi in tretji odstavek postaneta tretji in četrti odstavek.
4. člen
V 22. členu se v prvem odstavku:
– napovedni stavek spremeni tako, da se glasi:
»(1) Izjemoma lahko proizvajalci zdravil ter pravne ali fizične osebe, ki nastopajo v imenu proizvajalcev, pooblaščenim osebam za predpisovanje zdravil posredujejo brezplačne vzorce zdravil, ki se sicer izdajajo na recept, kadar je potrebno pacienta poučiti o načinu uporabe novega zdravila, če to ni namenjeno za peroralno uporabo, in so izpolnjeni naslednji pogoji:«;
– tretja alinea spremeni tako, da se glasi:
»– pooblaščena oseba za predpisovanje zdravil lahko na leto prejme le en vzorec posameznega zdravila v najmanjšem pakiranju, za katero je pridobljeno dovoljenje za promet in za katerega je imetnik dovoljenja za promet organ, pristojen za zdravila pisno obvestil o dejanskem začetku prometa v skladu s 44. členom zakona.«;
– črta osma alinea, dosedanje deveta do enajsta alinea pa postanejo osma do deseta alinea.
5. člen
V 23. členu se v drugem odstavku za četrto alineo dodata nova peta in šesta alinea, ki se glasita:
»– voditi seznam strokovnih sodelavcev, ki oglašujejo zdravila z neposrednim obveščanjem oseb, ki so pooblaščene za predpisovanje in izdajanje zdravil, s podatkom o njihovi izobrazbi;
– seznam iz prejšnje alinee posredovati organu, pristojnemu za zdravila za namen izvajanja strokovnega nadzora, ki se izvaja v okviru farmacevtskega nadzorstva v skladu z zakonom;«.
Dosedanji peta in šesta alinea postaneta sedma in osma alinea.
Za drugim odstavkom se doda nov tretji odstavek, ki se glasi:
»(3) Spremembe podatkov iz pete alinee prejšnjega odstavka mora odgovorna oseba imetnika dovoljenja za promet z zdravilom sporočiti organu, pristojnemu za zdravila najpozneje v 15 dneh od njihove spremembe.«.
6. člen
V 24. členu se za drugim odstavkom dodata nova tretji in četrti odstavek, ki se glasita:
»(3) Zdravila, ki se uporabljajo pri programih cepljenja, se lahko oglašujejo širši javnosti le z mednarodnimi nelastniškimi imeni. Oglaševanje mora biti v skladu s 15. členom tega pravilnika in ne sme vsebovati elementov, ki bi zmanjševali objektivnost obveščanja o zdravilih, ki se uporabljajo pri programih cepljenja in cepljenju.
(4) Oglaševanje zdravil, ki se uporabljajo pri programih cepljenja, mora vsebovati informacije o vseh zdravilih z isto indikacijo, ki so prisotna na trgu v Republiki Sloveniji.«.
7. člen
V 27. členu se za prvim odstavkom doda nov drugi odstavek, ki se glasi:
»(2) Na podlagi podatkov iz seznama strokovnih sodelavcev iz pete alinee drugega odstavka 23. člena tega pravilnika organ, pristojen za zdravila v okviru strokovnega nadzora opravi splošno preverjanje izpolnjevanja pogojev za strokovne sodelavce, ki opravljajo delo pri imetnikih dovoljenj za promet z zdravilom.«.
8. člen
Imetniki dovoljenj za promet z zdravilom posredujejo organu, pristojnemu za zdravila, seznam strokovnih sodelavcev iz pete alinee drugega odstavka 23. člena pravilnika najpozneje v enem mesecu od uveljavitve tega pravilnika.
9. člen
Ta pravilnik začne veljati petnajsti dan po objavi v Uradnem listu Republike Slovenije.
Št. 0070-43/2010
Ljubljana, dne 14. decembra 2010
EVA 2010-2711-0038
Dorijan Marušič l.r. Minister za zdravje Soglašam! mag. Dejan Židan l.r. Minister za kmetijstvo, gozdarstvo in prehrano
“,”Jaka Verbic Miklic”,1589560200,1589560200,sl,14269,306,14268,43,0,NULL,,”Pravilnik o spremembah in dopolnitvah Pravilnika o oglaševanju zdravil”,pravilnik-o-spremembah-in-dopolnitvah-pravilnika-o-oglasevanju-zdravil,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,1,0,1589560316,1589561074
638,14269,”Rules amending the Rules on advertising of medicinal products”,” “,”
R U L E S amending the Rules on advertising of medicinal products
Article 1
Article 17 of the Rules on advertising of medicinal products (Official Gazette of the Republic of Slovenia no. 105/08) shall be amended to read:
“Article 17
(Advertising in expert publications and with direct informing)
(1) Marketing authorisation holders may advertise the medicinal products which acquired marketing authorisation to expert public in professional books, journals and other professional publications.
(2) Marketing authorisation holders may advertise medicinal products also by direct informing of persons authorised for prescribing and dispensing medicinal products.”
Article 2
The heading of Article 18 shall be amended to read: “(Data and information on medicinal products)”.
The first paragraph shall be deleted.
In the second paragraph, which becomes the first paragraph, the introductory sentence shall be amended to read:
“(1) Information on medicinal products intended for the expert public, which is designed for persons who are authorised for their prescribing and dispensing, has to include the following data in particular:”.
The previous third to fifth paragraphs shall become the second to fourth paragraphs, respectively.
Article 3
A new second paragraph shall be added after the first paragraph of Article 19, reading:
“(2) Advertising of medicinal products by means of direct advertising of persons authorised to prescribe and dispense medicinal products and perform the medical activity in the framework of public health service can only be carried out during the time of expert preparation for work not intended for direct work with the patients.”.
The previous second and third paragraphs shall become the third and fourth paragraphs, respectively.
Article 4
In the first paragraph of Article 22:
– The introductory sentence shall be amended to read:
“(1) Manufacturers of medicinal products and legal entities or natural persons, acting as representatives of manufacturers, may exceptionally submit free samples of prescription-only medicinal products to persons responsible for prescribing medicinal products, when the patient needs to be instructed on the method of use of the new medicinal product, if not intended for oral use and if the following conditions are met:”;
– The third indent shall be amended to read:
“- The person responsible for prescribing medicinal products may only receive one sample of each medicinal product in the smallest packaging for which marketing authorisation has been obtained and for which the marketing authorisation holder informed the body responsible for medicinal products in writing of the actual beginning of marketing pursuant to Article 44 of the Act.”;
– The eighth indent shall be deleted and the previous indents nine to eleven shall become indents eight to ten.
Article 5
After the third paragraph of Article 23, new fourth and fifth paragraphs shall be added, reading:
“- Keep the list of expert colleagues who advertise medicinal products by means of direct advertising to persons authorised to prescribe and dispense medicinal products, with data on their education;
– The list referred to in the previous indent shall be sent to the body competent for medicinal products with the aim of performing expert supervision in the scope of pharmaceutical control pursuant to the law;”.
The current fifth and sixth indents shall become the indents seven and eight, respectively.
After the second paragraph, a new third paragraph shall be added, reading:
“(3) The responsible person of the marketing authorisation holder must inform the body competent for medicinal products of any change of data from the fifth indent of the previous paragraph within 15 days of their occurrence.”.
Article 6
After the second paragraph of Article 24, new third and fourth paragraphs shall be added, reading:
“(3) Vaccination medicinal products may only be advertised to the broader public with international non-proprietary names. Advertising must be in line with Article 15 hereof and may not contain elements that would reduce the objectivity of informing on vaccination medicinal products and vaccination.
(4) Advertising of vaccination medicinal products must contain information on all medicinal products with the same indication present on the market of the Republic of Slovenia.”.
Article 7
A new second paragraph shall be added after the first paragraph of Article 27, reading:
“(2) Based on the data from the list of expert colleagues from the fifth indent of the second paragraph of Article 23 of these Rules, the body competent for medicinal products shall conduct expert supervision in the scope of which it shall check if the conditions for expert colleagues are met, in general, by those working for the marketing authorisation holders.
Article 8
Marketing authorisation holders shall submit to the body in charge of medicinal products a list of expert colleagues from the fifth indent of the second paragraph of Article 23 of the Rules no later than within one month of the enforcement hereof.
Article 9
These Rules shall enter into force on the fifteenth day after their publication in the Official Gazette of the Republic of Slovenia.
Number 0070-43/2010
Ljubljana, 14 December 2010
EVA 2010-2711-0038
Dorijan Marušič Minister of Health I hereby agree. Dejan Židan, MSc Minister of Agriculture, Forestry and Food
“,”Jaka Verbic Miklic”,1589560200,1589560200,en,14269,306,14268,43,0,NULL,,”Pravilnik o spremembah in dopolnitvah Pravilnika o oglaševanju zdravil”,pravilnik-o-spremembah-in-dopolnitvah-pravilnika-o-oglasevanju-zdravil,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,1,0,1589560316,1589561074
639,14271,”Oskrba bolnikov z rakom v času koronavirusa”,”Pandemija koronavirusa prinesla mnogo izzivov tudi v onkologiji”,”
V petek, 15. maja 2020 je STA klub, tudi ob podpori Mednarodnega foruma znanstveno raziskovalnih družb, GIZ, organiziral spletni pogovor s na temo “Oskrbe bolnikov z rakom v času koronavirusa”. Gostje pogovora so bili strokovnjaki s področja onkologije izr. prof. dr. Irena Oblak, strokovna direktorica Onkološkega inštituta, prof. dr. Tanja Čufer, svetovno priznana onkologinja, ki svoje znanje pa deli tudi Medicinski fakulteti Univerze v Ljubljani, Sašo Rebolj, družinski zdravnik in direktor zdravstvenega doma Kamnik ter Tanja Španič, predsednica Združenja Europa Donna Slovenija.
Sogovorniki so izpostavili, da je pandemija koronavirusa prinesla mnogo izzivov tudi v onkologiji, saj za bolnike z rakom obstaja velika nevarnost okužbe z virusom ter tveganje, da bo ob neustreznem zdravljenju njihova bolezen še dodatno napredovala. Med glavnimi težavami so izpostavili zastoje na primarni ravni, kjer se je število diagnosticiranih bolnikov v vseh starostnih skupinah zmanjšalo.
Rak je po besedah dr. Čuferjeve javnozdravstveni problem številka ena tako v Sloveniji kot v svetu in če rak ni zdravljen, pomeni 100 odstotno smrt. Vsako leto po svetu za rakom zboli okrog 18 milijonov ljudi, umre pa jih okrog 9,5 milijona.
Na zmanjšanje števila pregledov je posebej opozoril Sašo Rebolj in v zdravstvenem domu Kamnik so začeli prebivalce na preglede pozivati tudi preko lokalnih medijev. Upad števila napotitev so po besedah dr. Oblakove opazili tudi na Onkološkem inštitutu.
Vsi sogovorniki pa so opozorili, da mora onkologija kljub epidemiji COVID-19 teči naprej nemoteno, saj bi samo 1 odstotek višja umrljivost zaradi raka, v Sloveniji pomenilo dodatnih 30 smrti.
V Forumu se pridružujemo opozorilom in prav tako pozivamo vse, naj z diagnostičnimi pregledi ne čakajo oziroma jih odlašajo, saj sta pravočasna diagnoza in začetek zdravljenja ključna za uspešen boj s to boleznijo.
Celoten posnetek pogovora s strokovnjaki si lahko pogledate na: https://livestream.com/accounts/564247/events/7618799/videos/206073948/player
“,”Jaka Verbic Miklic”,1589884140,1589884140,sl,14271,306,14270,43,0,NULL,,”Oskrba bolnikov z rakov v času koronavirusa”,oskrba-bolnikov-z-rakov-v-casu-koronavirusa,Post,/sites/43/files/images/news/Covid-19/cancer-covid.jpg,1,0,1589884204,1590395466
640,14271,”Cancer patient care during the coronavirus epidemic”,”The coronavirus pandemic has brought many challenges to the field of oncology”,”
On Friday 15 May 2020 the Slovenian Press Agency Club organized an online panel discussion titled “Cancer patient care during the coronavirus epidemic” with the support of the Forum of International Research and Development Pharmaceutical Companies, EIG. Invited speakers at the discussion were experts in the field of oncology Associate Prof. Dr. Irena Oblak, Medical Director of the Institute of Oncology, Prof. Dr. Tanja Čufer, world renowned oncologist who shares her knowledge at the Faculty of Medicine of the University of Ljubljana, Sašo Rebolj, family physician and Director of community healthcare center Kamnik and Tanja Španič, President of Europa Donna Slovenia.
Speakers emphasized that the coronavirus pandemic has brought many challenges to the field of oncology as cancer patients are at high risk of infection with the virus while also risking advancing their disease due to improper treatment. Some of the main issues included delays at the primary level where the number of diagnosed patients has decreased across all age groups.
According to Dr. Čufar cancer is the number one threat to public health in Slovenia and around the world and has a 100 percent mortality rate if left untreated. Each year 18 million people around the world fall ill with cancer and around 9.5 million die.
The reduction in the number of examinations was particularly emphasized by Sašo Rebolj. Under his charge the Kamnik healthcare center has begun to call on people to schedule appointments through local mass media. According to Dr. Oblak the reduction in referrals was also detected at the Institute of Oncology.
All speakers agreed that oncology must maintain its activities in spite of the COVID-19 epidemic. A one percent increase in mortality due to cancer in Slovenia means an additional 30 deaths.
The Forum shares the concern of the speakers and hereby calls on everybody not to wait or put off diagnostic appointments because a timely diagnosis and commencement of treatment are essential for a successful treatment of this disease.
The entire discussion with the experts can be viewed at: https://livestream.com/accounts/564247/events/7618799/videos/206073948/player
“,”Jaka Verbic Miklic”,1589884140,1589884140,en,14271,306,14270,43,0,NULL,,”Oskrba bolnikov z rakov v času koronavirusa”,oskrba-bolnikov-z-rakov-v-casu-koronavirusa,Post,/sites/43/files/images/news/Covid-19/cancer-covid.jpg,1,0,1589884204,1590395466
641,14276,”Javna objava prenosov vrednosti ZD in ZO 2019″,”Objava zajema podatke o prenosih vrednosti v preteklem koledarskem letu 2019.”,”
JAVNA OBJAVA PRENOSOV VREDNOSTI ZDRAVSTVENIM DELAVCEM IN ZDRAVSTVENIM ORGANIZACIJAM S STRANI FARMACEVTSKIH DRUŽB
Skladno z določili Kodeksa transparentnosti članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ (v nadaljevanju Forum) tudi v letošnjem letu javno objavljajo prenose vrednosti zdravstvenim delavcem in zdravstvenim organizacijam. Kot določa Kodeks, bodo vse inovativne farmacevtske družbe, članice Foruma, podatke objavile do vključno 30. junija 2020.
Objava zajema podatke o prenosih vrednosti v preteklem koledarskem letu in na spletnih straneh posameznih članic ponuja vpogled v prenose v obdobju od 1. januarja do 31. decembra 2019. Po določilih zveze EFPIA se podatki javno objavljajo periodično, vsako leto, najkasneje do konca meseca junija, in sicer za preteklo koledarsko leto.
O javni objavi prenosov vrednosti
Javna objava prenosov vrednosti vključuje podatke o vrednostih vseh sredstev, ki so jih prejeli posamezni zdravstveni delavci in zdravstvene organizacije, s katerimi sodelujejo posamezne članice Foruma ali Forum – bodisi neposredno ali prek tretjih oseb, kot so agencije za organizacijo dogodkov. Javna objava vsebuje tudi informacije o vrsti dejavnosti ali tipu podpore:
Te prenose vsaka članica Foruma objavi v slovenskem jeziku na svoji lokalni, regijski ali mednarodni spletni strani.
Individualne in skupinske objave
Vsi prenosi zdravstvenim organizacijam, kamor se po Kodeksu transparentnosti uvrščajo javne zdravstvene institucije, zdravniška društva, združenja, zbornice in zasebna podjetja (d.o.o. in s.p.), so skladno z zakonodajo objavljeni individualno s polnim nazivom prejemnika.
Pri prenosih vrednosti posameznim zdravstvenim delavcem, fizičnim osebam, je objava v skladu z Zakonom o varstvu osebnih podatkov mogoča samo na podlagi predhodnega pisnega soglasja zdravstvenega delavca. V nasprotnem primeru se prenos objavi v skupinski obliki, pri čemer je v vsaki kategoriji navedeno število prejemnikov ter skupni znesek takim prejemnikom.
Podatki o plačilih na področju raziskav in razvoja zaradi varstva konkurence ter inovacij, ki jih razvijajo posamezne družbe, skladno z zakonodajo ne morejo biti objavljeni drugače kot v skupinski obliki.
Izjava o omejitvi odgovornosti
Podatki, objavljeni v tem poročilu, so izraz naših prizadevanj za ravnanje skladno z zahtevami Kodeksa transparentnosti in zveze EFPIA (Disclosure Code). Če se kljub našim prizadevanjem za zagotovitev natančnih objav zgodi, da poročilo vsebuje nepopolne ali netočne podatke, bomo to raziskali in morebitne napačne podatke ustrezno popravili.
PODATKI O PRENOSU VREDNOSTI ZDRAVSTVENIM DELAVCEM IN ZDRAVSTVENIM ORGANIZACIJAM S STRANI MEDNARODNEGA FORUMA ZNANSTVENORAZISKOVALNIH FARMACEVTSKIH DRUŽB, GIZ, ZA LETO 2019
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ, je v koledarskem letu 2019 sodeloval s 7 različnimi organizacijami: sponzorsko je prispeval k izvedbi strokovnih srečanj in simpozijev petim zdravstvenim organizacijam, dvema organizacijama pa je poravnal stroške, povezane z izvajanjem storitev in svetovanjem.
Skupna vrednost prenosov Foruma zdravstvenim organizacijam je v letu 2019 znašala 34.300,31 EUR. Vrednost prenosov zdravstvenim delavcem je v letu 2019 znašala 5.669,54 EUR. Vsi prenosi so objavljeni poimensko oziroma s polnim nazivom prejemnika.
Metodologija
Javno objavljeni podatki zajemajo prenose vrednosti, ki so bili v finančnem sistemu Foruma dejansko izvršeni v koledarskem letu 2019, to je od vključno 1. januarja 2019 do vključno 31. decembra 2019.
Prenosi posameznim zdravstvenim delavcem so navedeni kot bruto vrednosti tovrstnih pogodb.
Prenosi zdravstvenim organizacijam so navedeni kot neto zneski tovrstnih pogodb, ki ne vključujejo DDV.
Prenosi vrednosti, povezani s potnimi stroški, nastanitvami in stroški prijav, so objavljeni v podatkih za koledarsko leto, v katerem so dejavnosti potekale.
Opombe k tabeli “Podatki o prenosu vrednosti zdravstvenim delavcem in zdravstvenim organizacijam s strani Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ, za leto 2019”:
1 Področje opredeljuje Kodeks transparentnosti, člen 3.1.1.1
2 Področje opredeljuje Kodeks transparentnosti, člen 3.1.1.2 in 3.1.2.1
3 Področje opredeljuje Kodeks transparentnosti, člen 3.1.1.3 in člen 3.1.2.2
4 Področje opredeljuje Kodeks transparentnosti, člen 3.2
5 Področje opredeljuje Kodeks transparentnosti, člen 3.2
6 Področje opredeljuje Kodeks transparentnosti, člen 3.4
Oznaka “/” pomeni, da na tem področju ni bilo izvedenih prenosov vrednosti.
Vsi navedeni zneski predstavljajo skupne vrednosti za leto 2019.
Vse navedene transakcije so bile izvršene v koledarskem letu 2019, torej od vključno 1. januarja 2019 do vključno 31. decembra 2019.
Vrednosti prenosov sredstev zdravstvenim delavcem v letu 2019 so navedene v bruto zneskih.
Vrednosti prenosov sredstev zdravstvenim organizacijam so navedene v neto zneskih (brez DDV).
Zdravstvene organizacije (ZO) Kodeks transparentnosti opredeljuje kot vse samostojne podjetnike (s.p.) in pravne osebe, ki so zdravstvena, medicinska ali znanstvena združenja ali organizacije (ne glede na pravno ali organizacijsko obliko), kot so bolnišnice, klinike, fundacije, univerze ali druge izobraževalne ustanove ali akademska združenja (razen organizacij bolnikov v okviru Kodeksa sodelovanja z združenji bolnikov) ali preko katerih eden ali več zdravstvenih delavcev izvaja svoje storitve.
Zdravstvene delavce (ZD) Kodeks transparentnosti opredeljuje kot vse fizične osebe, ki so članice zdravstvene, zobozdravstvene, farmacevtske ali negovalne stroke ali vse druge osebe, ki lahko pri opravljanju svojih poklicnih dejavnosti predpišejo, kupijo, zagotovijo ali odmerijo zdravilo in katerih primarna praksa, naslov glavne poklicne dejavnosti ali sedež je v Republiki Sloveniji.
V izogib dvomom opredelitev ZD vključuje vse uradnike ali zaposlene v vladni agenciji ali drugi organizaciji (ne glede na to, ali je v zasebnem ali javnem sektorju), ki lahko predpišejo, kupijo, zagotovijo ali odmerijo zdravila, in vse zaposlene v Republiki Sloveniji, katerih glavna poklicna dejavnost je izvajanje zdravstvene dejavnosti, to pa ne vključuje vseh drugih zaposlenih v Republiki Sloveniji in prodajalcev na debelo ali distributerjev zdravil.
Kodeks transparentnosti je v celoti dostopen na:
http://www.farmaforum.si/sl/o-forumu/kodeksi/kodeks-transparentnosti
“,”Jaka Verbic Miklic”,1591673460,1591673460,sl,14276,306,14275,43,0,NULL,,”Javna objava prenosov vrednosti ZD in ZO 2019″,javna-objava-prenosov-vrednosti-zd-in-zo-2019,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1591677497,1591678939
642,14276,”Public disclosure of transfers in 2019″,”Public notice on transfers of value from pharmaceutical companies to healthcare professionals and healthcare organizations”,”
PUBLIC NOTICE ON TRANSFERS OF VALUE FROM PHARMACEUTICAL COMPANIES TO HEALTHCARE PROFESSIONALS AND HEALTHCARE ORGANIZATIONS
Pursuant to provisions from the Disclosure Code, members of The Forum of International Research and Development Pharmaceutical Companies, GIZ (hereinafter referred to as: Forum) are this year again publishing the values of transfers to healthcare professionals and healthcare organizations, respectively. As provided for under the Code, all innovative pharmaceutical companies that are members of the Forum will publish their data by up to 30 June 2020 inclusive.
The publication includes data on transfers of value in the past calendar year and provides disclosure of transfer in the period from 1 January to 31 December 2019 on the websites of individual members. According to EFPIA provisions, data is disclosed publicly periodically, on annual basis no later than the end of June, for the past calendar year.
About public disclosure of transfers of value
Public disclosure of transfers of value includes data on the value of all funds received by individual healthcare professionals and healthcare organizations that collaborate with individual Forum members or the Forum itself, either directly or through third parties such as event organization agencies. Disclosure also includes information on the type of activity or support:
Each Forum member publishes these transfers in Slovenian at its local, regional or international website.
Individual and group disclosures
All transfers to healthcare organizations, which under the Disclosure Code include public healthcare institutions, physician associations and societies, chambers and private companies (d.o.o. and s.p.), are published individually, with the full name of the recipient.
Transfers of value to individual healthcare professionals who are natural persons are, pursuant to the Personal Data Protection Act, only possible on the basis of advance written consent of the healthcare professional. If such consent is withheld, transfers are published in a group or aggregate form, with the number of recipients and total amount listed separately for each category of such recipients.
Data on payments in the field of research and development cannot be published otherwise than in a group or aggregated form due to legislative protection of competition and innovations being developed by separate companies.
Disclaimer
The data published in this report is an expression of our efforts towards observing the provisions of the EFPIA Disclosure Code. Should it be found that the report contains incomplete or inaccurate data in spite of our best efforts towards assuring accurate publications, we will research the situation and appropriately correct false data.
DATA ON TRANSFERS OF VALUE TO HEALTHCARE PROFESSIONALS AND HEALTHCARE ORGANISATIONS FROM THE FORUM OF INTERNATIONAL RESEARCH AND DEVELOPMENT PHARMACEUTICAL COMPANIES, EIG, FOR 2019
In calendar year 2019, the Forum of International Research and Development Pharmaceutical Companies, EIG, collaborated with 7 different organizations: five healthcare organizations were granted contributions for the implementation of events, and two organizations received reimbursements, related to the provision of services and consulting.
The total value of the Forum’s transfers to healthcare organizations in the year 2019 amounted to 34,300.31 EUR. Transfers of value to healthcare professionals amounted to 5,669.54 EUR in 2019. All transfers were disclosed with the full name of the recipient.
Methodology
Publicly disclosed data includes transfers of value actually executed in the financial system of the Forum in the 2019 calendar year, from 1 January 2019 to 31 December 2019.
Transfers to individual healthcare workers are listed as gross values of the relevant contracts.
Transfers to healthcare organizations are listed as net amounts of the relevant contracts without VAT.
Transfers of value pertaining to travel expenses, accommodation and registration fees are published in the calendar year in which activities actually took place.

Notes to the table ” Data on transfers of value to healthcare professionals and healthcare organizations from the Forum of international research and development pharmaceutical companies, EIG, for 2019″:
1 Field regulated by Disclosure Code, Article 3.1.1.1
2 Field regulated by Disclosure Code, Article 3.1.1.2 in 3.1.2.1
3 Field regulated by Disclosure Code, Article 3.1.1.3 and Article 3.1.2.2
4 Field regulated by Disclosure Code, Article 3.2
5 Field regulated by Disclosure Code, Article 3.2
6 Field regulated by Disclosure Code, Article 3.4
The “/” mark denotes no transfers of value were performed.
All listed amounts represent total values for 2019.
All listed transactions were performed in the 2019 calendar year, from and including 1 January 2019 to and including 31 December 2019.
Amounts of transfers of value to HCPs in 2019 are listed as gross amounts.
Amounts of transfers of value to HCOs in 2019 are listed as net amounts (not including VAT).
The Disclosure Code defines healthcare organizations (HCO) as all single entrepreneurs and any legal person that is a healthcare, medical or scientific association or organization (irrespective of the legal or organizational form) such as a hospital, clinic, foundation, university or other teaching institution or learned society (except for patient organizations within the scope of the EFPIA PO Code) or through which one or more HCPs provide services.
The Disclosure Code defines healthcare professionals (HCP) as any natural person that is a member of the medical, dental, pharmacy or nursing professions or any other person who, in the course of his or her professional activities, may prescribe, purchase, supply, recommend or administer a medicinal product and whose primary practice, principal professional address or place of incorporation is in the Republic of Slovenia.
For the avoidance of doubt, the definition of HCP includes any official or employee of a government agency or other organization (whether in the public or private sector) that may prescribe, purchase, supply or administer medicinal products and any person employed in the Republic of Slovenia whose primary occupation is that of a practicing HCP, but excludes all other persons employed in the Republic of Slovenia and a wholesaler or distributor of medicinal products.
The Disclosure Code is available in full at:
http://www.farmaforum.si/en/about-forum/codes/disclosure-code
“,”Jaka Verbic Miklic”,1591673460,1591673460,en,14276,306,14275,43,0,NULL,,”Javna objava prenosov vrednosti ZD in ZO 2019″,javna-objava-prenosov-vrednosti-zd-in-zo-2019,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1591677497,1591678939
643,14278,”Po podatkih NIJZ je v Sloveniji okoli 175.000 bolnikov s sladkorno boleznijo”,”Pogovor s strokovnjaki je tekel predvsem v smeri iskanja odgovorov, kako se je spremenila obravnava bolnikov s sladkorno boleznijo v času epidemije.”,”
Strokovnjaki izpostavili pomen tehnologije ter dostopa do zdravil in sodobnih medicinskih pripomočkov za boljšo obravnavo sladkornih bolnikov
STAklub je 16. junija 2020 v sklopu spletnih pogovorov organiziral pogovor o obravnavi bolnikov s sladkorno boleznijo med epidemijo COVID-19, ki smo ga v Mednarodnem forumu znanstvenoraziskovalnih farmacevtskih podjetij tudi podprli. Po podatkih NIJZ je v Sloveniji okoli 175.000 bolnikov s sladkorno boleznijo, pri čemer ima večina diabetikov sladkorno bolezen tipa 2. Gostje pogovora so bili prof. dr. Andrej Janež, dr. med., predstojnik klinike KO za endokrinologijo, diabetes in bolezni presnove, UKC Ljubljana, prof. dr. Tadej Battelino, dr. med. in predstojnik kliničnega oddelka za endokrinologijo, diabetes in presnovne bolezni na pediatrični kliniki v Ljubljani, Jana Komel, dr. med., vodja specialističnih ambulant za diabetike ZD Koper in Alojz Rudolf, podpredsednik Zveze društev diabetikov Slovenije.
Pogovor s strokovnjaki je tekel predvsem v smeri iskanja odgovorov, kako se je spremenila obravnava bolnikov s sladkorno boleznijo v času epidemije. V diabetoloških ambulantah so si pomagali s telefonskimi in video klici, ob tem pa so zdravniki izpostavili tudi pomen dostopa do zdravil in sodobnih medicinskih pripomočkov, ki bolnikom olajšajo spremljanje kronične bolezni. Za uspešno zdravljenje bolnikov s sladkorno boleznijo je torej ključnega pomena, da se vsem bolnikom omogoči enaka možnost dostopa do zdravil in modernih tehnologij ter dostopnost do diabetologa. Pri tem bo pomembno vlogo odigrala tudi stroka, vključno s farmacevtskimi družbami, ki nenehno vlaga in razvija tako nove načine zdravljenja, kot nova, bolj učinkovita zdravila zoper to bolezen.
Dotaknili pa so se tudi vprašanja kaj bi bilo potrebno nadgraditi v zdravstvenem sistemu, da bi se zagotovila nemotena obravnava oseb s sladkorno boleznijo. Dr. Battelino je pri tem izpostavil pomen in prednosti senzorja za kontinuirano merjenje glukoze, tako za bolnika, kot za zdravstveno blagajno, pozval pa je tudi k vzpostavitvi profesionalnih platform za obravnavno bolnikov na daljavo, s katerimi so v nekaterih ambulantah uspeli preprečiti prevelike zaostanke.
Dr. Komelova je opozorila, da bolniki povsod niso imeli enakega dostopa do zdravnika. Veliko diabetoloških ambulant je bilo zaprtih, ljudje pa so se zato obračali tudi na svoje osebne zdravnike. V pogovoru je bilo izpostavljen vpliv na število pregledov v času epidemije, ki je se v tem času zmanjšalo. Zato bi bilo smotrno nastali manko pregledov oseb sladkornih bolnikov nadoknaditi z dodatnimi ambulantami za boljšo urejenost sladkorne bolezni.
Pomoč in nasvete pa so bolniki po besedah Alojza Rudolfa iskali tudi pri različnih društvih. Ker so društva svoje prostore med epidemijo povečini morala zapreti, so s člani komunicirala prek telefonov, spletnih strani in družbenih omrežjih. Pri tem ne moremo mimo telemedicine, ki lahko v takšnih razmerah učinkovit in primeren pristop pri obravnavi bolnikov. Kljub napredku, ki ga je telemedicina doživela v zadnjih letih, pa z njo zaenkrat še ne moremo v celoti nadomestiti obiska pri zdravniku.
Urejen sistem obravnave in zdravljenja sladkorne bolezni torej prinaša dolgoročne koristi, v kolikor smo kot družba pripravljeni kratkoročno investirati v izboljšanje sistema obravnave ter večjo dostopnost do zdravil in novih tehnologij, s katerimi bosta obravnava in zdravljenje sladkorne bolezni učinkovitejša.
Povezava do celotnega spletnega pogovora: https://livestream.com/accounts/564247/events/7618799/videos/207530535/player
“,”Jaka Verbic Miklic”,1592890620,1592890620,sl,14278,306,14277,43,0,NULL,,”Po podatkih NIJZ je v Sloveniji okoli 175.000 bolnikov s sladkorno boleznijo”,po-podatkih-nijz-je-v-sloveniji-okoli-175-000-bolnikov-s-sladkorno-boleznijo,Post,/sites/43/files/images/news/Diabetes/multiplus-fami-lia-na-praia.jpg,1,0,1592890728,1592890728
644,14278,”Slovenia has approximately 175,000 patients with diabetes according to NIJZ”,”Discussions focused on finding answers on how the treatment of diabetic patients changed during the epidemic.”,”
Experts emphasize the importance of technology and access to medicines and modern medical devices to improve treatment of diabetics
On 16 June 2020 STAklub organized a discussion on the treatment of patients with diabetes during the COVID-19 epidemic, which the Forum of International Research and Development Pharmaceutical Companies gladly supported. According to data provided by the National Institute of Public Health Slovenia has approximately 175,000 patients with diabetes, most of whom have type 2 diabetes. Guests of the discussion included Prof. Dr. Andrej Janež, M.D., Head of the Clinical Department of Endocrinology, Diabetes and Metabolic Diseases at the University Medical Hospital Ljubljana, Jana Komel, M. D., Head of the Specialist Diabetic Clinics at the Koper healthcare centre and Alojz Rudolf, Vice-President of the Slovenian Diabetes Association.
Discussions focused on finding answers on how the treatment of diabetic patients changed during the epidemic. Diabetes clinics mainly took to telephone and video calls while physicians also emphasized the importance of access to medicines and modern medical devices that help patients monitor their chronic disease. A key prerequisite for successful treatment of patients with diabetes is the assurance of equal access to medicines and modern technologies and access to a diabetologist. An important role in these efforts is played by the pharmaceutical companies that constantly invest and develop new methods of treatment and new more effective medicines.
The guests also touched upon what should be upgraded in the healthcare system to assure uninterrupted treatment of diabetic patients. Dr. Battelino noted on the importance and benefits the sensor for continuous monitoring of glucose brings not only to the patient, but also the healthcare budget. He also called for the establishment of professional platforms for remote treatment of patients which were applied in several clinics with great success in preventing excessive delays.
Dr. Komel mentioned that patients did not have equal access to a physician in all areas. Many diabetes clinics were closed and people turned to their general practice physicians. Another factor emphasized during the discussion was the influence on the overall number of examinations which greatly reduced during the epidemic. It would therefore be prudent to make up for the deficiency in examinations through additional clinics to assure beater treatment of diabetes.
According to Mr. Alojz Rudolf patients sought assistance and advice with different associations. As associations were for the most part required to close their premises during the epidemic, communications with their members were transferred to telephone, web pages and social media. This brings us to the concept of telemedicine that provides an effective and appropriate approach to patient treatment in such circumstances. But in spite of the advances telemedicine has experienced in recent time, it still cannot fully replace a visit with a physician.
A well thought-out system of treatment of diabetes clearly brings long term benefits, provided we as a society are prepared to make short term investments in the system of treatment and greater accessibility of medicines and new technologies that make treatment more effective.
Link to full online discussion: https://livestream.com/accounts/564247/events/7618799/videos/207530535/player
“,”Jaka Verbic Miklic”,1592890620,1592890620,en,14278,306,14277,43,0,NULL,,”Po podatkih NIJZ je v Sloveniji okoli 175.000 bolnikov s sladkorno boleznijo”,po-podatkih-nijz-je-v-sloveniji-okoli-175-000-bolnikov-s-sladkorno-boleznijo,Post,/sites/43/files/images/news/Diabetes/multiplus-fami-lia-na-praia.jpg,1,0,1592890728,1592890728
645,14352,”Kakšen bo nov nacionalni načrt za redke bolezni?”,”V organizaciji revije Medicina danes je v potekal webinar na temo »Pogledi na oblikovanje novega nacionalnega načrta za obravnavo redkih bolezni”,”
Kakšen bo nov nacionalni načrt za redke bolezni?
V organizaciji revije Medicina danes je v četrtek, 18. junija 2020 potekal webinar na temo »Pogledi na oblikovanje novega nacionalnega načrta za obravnavo redkih bolezni, ki smo jo podprli tudi v Mednarodnem forumu znanstvenoraziskovalnih farmacevtskih družb. Medicina danes se s povezovanjem strokovnjakov in slovenskih zdravnikov zavzema za pozitiven premik zdravstvenega sistema na nacionalni ravni in za oblikovanje nacionalnega načrta za obravnavo redkih bolezni. Po ocenah naj bi v Sloveniji z redkimi boleznimi živelo okoli 120.000 bolnikov, pri tem naj bi svetovno gledano 80% redkih bolezni imelo genetski izvor in 75% bolnikov z redkimi boleznimi naj bi bili otroci.
Sogovorniki na webinarju so bili: prof. dr. Borut Peterlin iz Inštituta za genetiko UKC Ljubljana, doc. dr. Blaž Koritnik iz Nevrološke klinike UKC Ljubljana, dr. Urh Grošelj iz Pediatrične klinike UKC Ljubljana in dr. Tina Bregant, državna sekretarka na Ministrstvu za zdravje.
Pogovor s strokovnjaki je tekel v smeri iskanja dobrih praks, ki so se uresničile s starim nacionalnim načrtom redkih bolezni in iskanja novih izzivov, ki bodo del oblikovanja novega načrta. V letošnjem letu se namreč izteka rok 9-letnega nacionalnega načrta za redke bolezni. Na področju obravnave redkih bolezni je bilo veliko doseženega: vpeljali smo nove modele socialne oskrbe pacienta, vzpostavljena in financirana je bila informacijska točka za redke bolezni, izboljšali smo položaj dostopa informacij in diagnostike redkih bolezni ter dosegli obeležitev dneva redkih bolezni.
Prof. dr. Borut Peterlin iz Inštituta za genetiko vidi kot pomembne elemente prihodnjega načrta vzdrževanje in dvigovanje že sedaj visoke kvalitete zdravstvenih storitev. Pomembna bo kreativnost in inovativnost znotraj slovenskega zdravstvenega sistema. Sodobni zdravstveni sistemi bodo morali temeljiti na vrednotah, razviti pa bomo morali nove finančne modele, ki jih bomo morali prilagoditi slovenskim razmeram in naši majhnosti. Majhnost je po besedah dr. Peterlina nedvomno velika prednost.
Mnenju prof. Peterlina se pridružuje tudi dr. Koritnik iz Nevrološke klinike, izpostavlja pa problem enotnosti načrta. Pri obravnavi redkih bolezni se srečujemo z različnimi strokovnjaki, ki ne poznajo vseh področij medicine. Zato je pomembno zastaviti heterogenost obravnavanja načrtov, kjer se bodo različne stroke lahko bolj povezale. Tudi register, ki je v nastajanju mora služiti kot isto orodje za uporabo različnih bolezni. Prav tako je vpliv imela epidemija Covid-19, in sicer v smeri drugačnih načinov obravnav redkih bolezni. Tako smo med drugim vpeljali več obiskov na domu. Prakse so se izkazale kot zelo učinkovite.
Dr. Grošelj iz Pediatrične klinike se strinja s predhodniki, da je bilo na področju redkih bolezni veliko narejeno. Dodaja, da bi bilo potrebno zdravljenje z genskimi terapijami prestaviti v domače slovensko okolje, kljub uspešnim praksam v tujini. Dr. Grošelj izpostavlja problematiko nacionalne kontaktne točke, katere cilj je informiranje bolnikov in njihovih družinskih članov. Z njo naj bi postavili forum in možnost dvostranskega sodelovanja med bolnikom in zdravnikom. Število klicev na točko je začelo naraščati in odpirati preveč kompleksna vprašanja. Tukaj je nastala potreba po bolj strokovnem znanju. Nadgradnja bo potrebna v smeri celovite rešitve, saj s tem sistemom ne nudimo dovolj podpore pacientom. Premik smo naredili na področju registra redkih bolezni, kjer smo našli skupni imenovalec teh bolezni, razvili nabor skupnih podatkov kot zakonite lastnosti teh bolezni. Manjka nam še tehnična in sistemska rešitev.
Redke bolezni so ene izmed delovnih področij ministrstva. Tina Bregant, državna sekretarka na ministrstvu pravi, da trenutno področju redkih bolezni posvečajo občutno manj pozornosti, saj je v ospredju trenutna situacija korone, bolezen, ki je prejšnje leto sploh nismo poznali. Področje redkih
bolezni je multidisciplinarno, pri katerem je ključno, da je pacient v središču. Ko se bo situacija s korono umirila, bomo lahko spet več pozornosti namenili vzročnim zdravljenjem redkih bolezni.
Trenutni nacionalni načrt, ki se v letošnjem letu izteka, je prinesel na področju redkih bolezni veliko napredka, povečala se je ozaveščenost, razvili so se novi modeli socialne oskrbe, epidemija je prinesla nove načine razmišljanja in prinesla druge načine obravnave redkih bolezni. Za oblikovanje novega načrta bosta še posebej pomembna kreativnost in inovativnost ter iskanje novih finančnih modelov.
Povezava do celotnega spletnega webinarja: https://www.youtube.com/watch?v=0Vu6-xmnTeQ
“,”Jaka Verbic Miklic”,1592980260,1592980260,sl,14352,306,14351,43,0,NULL,,”Kakšen bo nov nacionalni načrt za redke bolezni?”,kaksen-bo-nov-nacionalni-nacrt-za-redke-bolezni,Post,/sites/43/files/images/slideshow/fidprc_001.jpg,1,0,1592980361,1592981731
646,14352,”What is the new national rare diseases plan?”,”Medicina Danes magazine organized a webinar titled “Views on the development of a new national plan for the management of rare diseases””,”
On Thursday, 18 June 2020 the Medicina Danes magazine organized a webinar titled “Views on the development of a new national plan for the management of rare diseases” which was also supported by the Forum of International Research and Development Pharmaceutical Companies. Medicina Danes is working to connect experts and Slovenian physicians to effect positive shifts in the healthcare system at the national level and develop a national plan for the management of rare diseases. Estimates show that Slovenia currently has 120,000 patients living with rare diseases. Globally 80 % of rare diseases have a genetic origin and 75 % of patients with rare diseases are children.
Speakers at the webinar were: Prof. Dr. Borut Peterlin from the Institute of Genetics at the Ljubljana University Medical Centre, Doc. Dr. Blaž Koritnik of the Division of Neurology at the Ljubljana University Medical Centre, Dr. Urh Grošelj from the Division of Pediatrics at the Ljubljana University Medical Centre and Dr. Tina Bregant, State Secretary at the Ministry of Health.
Discussions with the experts focused on finding best practices that were included in the old national plan of rare disease and seeking new challenges to inform the development of the new plan. This year marks the expiry of the 9-year national plan of rare diseases and at the end of its implementation we can say that it has achieved quite a lot. We have introduced new social care models for patients, established and financed an information point for rare diseases, improved access to information and diagnostics for rare diseases and achieved the marking of a national day of rare diseases.
Prof. Dr. Borut Peterlin from the Institute of Genetics sees the maintenance and further improvement of the already high degree of quality of healthcare services as an important elements of the future plan. Creativity and innovation will play a major role in the Slovenian healthcare system. Modern healthcare systems will need to be based on values and we will need to develop new financing models to correspond to Slovenian circumstances and our smallness. According to Dr. Peterlin smallness is a major advantage in this case.
The opinion of Prof. Peterlin is supported by Dr. Koritnik from the Division of Neurology who also emphasizes the issue of unity in the drafting of the plan. The management of rare diseases often includes different experts who are not fully familiar with all fields of medicine. That is why it is important to institute a certain degree of heterogeneity in the drafting of plans to allow better cohesion between different fields. The register currently under development must serve as a single tool for addressing several illnesses. The Covid-19 epidemic has left its mark as well, forging the path to different methods of managing rare diseases. One such method has been the increase of house visits. Practices have proven to be very effective.
Dr. Grošelj from the Department of Pediatrics agrees that much has been achieved in the field of rare diseases and adds that gene therapy treatments should be relocated to the home environment of Slovenia in spite of successful practices abroad. Dr. Grošelj also emphasizes the issue of a national contact point used to inform patients and their family members. Such a point would set up a forum and opportunity of mutual cooperation between the patient and physician. The number of calls to the contact point has begun to increase and open questions that are too complex, creating the need for further specialized knowledge. Upgrades will need to focus on creating a comprehensive solution as the current system does not provide sufficient support to patients. Advances have also been made in the register of rare diseases. We found the common denominator of these diseases and
developed a list of common data as a set of legal characteristics of such diseases. We are now lacking a technical and systemic solution.
Rare diseases are one of the fields of work at the Ministry. Tina Bregant, State Secretary at the Ministry, says that the field of rare diseases is currently not receiving much attention as the primary focus has shifted on the current situation caused by the coronavirus, a disease we knew nothing about in the past year. The field of rare diseases is multidisciplinary and must put the patient in the centre. When the coronavirus crisis recedes, we will be able to focus more attention on causal treatments of rare diseases.
The current national plan that is set to expire this year has brought about some major developments, increasing awareness and developing new modes of social care, while the current epidemic has brought new ways of thinking and other methods of managing rare diseases. Developing the new plan will require creativity, innovation and new financing models.
Link to full webinar: https://www.youtube.com/watch?v=0Vu6-xmnTeQ
“,”Jaka Verbic Miklic”,1592980260,1592980260,en,14352,306,14351,43,0,NULL,,”Kakšen bo nov nacionalni načrt za redke bolezni?”,kaksen-bo-nov-nacionalni-nacrt-za-redke-bolezni,Post,/sites/43/files/images/slideshow/fidprc_001.jpg,1,0,1592980361,1592981731
647,14363,”Kakšna bo prihodnost zdravljenja bolnikov z rakom v Sloveniji?”,”V Sloveniji letno več kot 15 tisoč ljudi zboli za rakavimi obolenji, 6 tisoč jih umre”,”
V Sloveniji letno več kot 15.000 ljudi zboli za rakavimi obolenji, 6000 jih umre. Rak je tako druga najbolj pogosta bolezen zaradi katere ljudje umirajo v Sloveniji, takoj za kardiovaskularnimi boleznimi. Vsako leto beležimo dva odstotka več onkoloških bolnikov kot leto prej.
Spletnemu pogovoru v organizaciji STAkluba, 1. julija 2020, so se pridružili dr. Tina Bregant, državna sekretarka na Ministrstvu za zdravje, Jure Mikolič z Oddelek za zdravila ZZZS, prof. dr. Tanja Čufer s Katedre za onkologijo na Medicinski fakulteti Univerze v Ljubljani in Iva Dimic, poslanka, članica odbora DZ za zdravstvo.
Osrednji temi pogovora s strokovnjaki sta bili sedanjost in prihodnost zdravljenja oseb z rakom, kjer sta se najbolj izpostavila zgodnja diagnostika in pomen dostopnosti do novejših zdravljenj in zdravil.
Po besedah onkologinje Tanje Čufer je dobra stran dostopnosti novih onkoloških zdravil pri nas, da so vsa zdravila bolnikom slej ko prej dostopna. Težava pa je v predolgem obdobju od registracije zdravila do takrat, ko je to zdravilo na razpolago tudi slovenskim bolnikom. V povprečju gre namreč za obdobje 400 dni. Opozorila je, da je mogoče do novih zdravil priti hitreje in sicer preko kliničnih raziskav, kar učinkovito dokazuje praksa zahodnjeevropskih držav, ki raka dobro obvladujejo.
Med težavami zdravljenja slovenskih bolnikov z rakom je Čuferjeva omenila tudi predolgo obdobje od prvih simptomov bolezni do postavitve diagnoze ter pri tem poudarila pomembnost zgodnjega odkrivanja. Prej ko je rak diagnosticiran bolj efektivno se ga lahko zdravi. Preživetju oziroma izboljšanju preživetja bolnikov namreč pripomoreta ravno zgodnja diagnostika ter kakovost zdravljena. Primer, ki to potrjuje je rak pljuč, ki je ozdravljiv v 70% procentih, pri pogoju da je le-ta odkrit pravočasno in bolnik dobi primerno zdravljenje.
Rak je zelo zahtevna bolezen, zato je nujen pogoj za hitro in učinkovito uvedbo novega zdravila ali načina zdravljenja visoka strokovnost in usposobljen kader, je tudi dodala Čuferjeva. Poudarila je prednosti, ki jih prinašajo klinični registri, kjer ima bolnik vpogled v kakovost obravnave in podatke o izhodih zdravljenja v posameznih ustanovah, kar je bolniku v pomoč pri izbiri zdravnika. Ob tem je opozorila tudi na pomembnost in uporabnosti skale klinične učinkovitosti zdravljenj, t.i. ESMO Magnitude of Clinical Benefit Scale, ki je bila razvita s strani Evropskega združenja za medicinsko onkologijo (ESMO) in Ameriškega združenja za klinično onkologijo (ASCO). Skala vrednoti v kolikšni meri se z nekim novim zdravilom, glede na drugo, podaljša bolnikova življenska doba in kakšna je njegova kvaliteta življenja. Višje ocenjena zdravljenja tako zagotavljajo daljše in bolj kvalitetno življenje, kar pa je želja vsakega bolnika, ki je soočen z zahtevno diagnozo, kot je diagnoza raka.
Tudi državna sekretarka Tina Bregant je izpostavila tako pomen primarne preventive pri zmanjšanju pojavnosti raka kot zgodnjega odkrivanja bolezni s pomočjo presejalnih programov. Na Ministrstvu se zavedajo potrebe po organizacijskih in kadrovskih izboljšavah na vseh treh ravneh zdravstva. Poudarila je, da je boj proti raku med prioritetami zdravstvene politike. Bregantova je opozorila na problem zagotavljanja dodatnih virov financiranja onkologije, še zlasti v času soočenja z epidemijo COVID-19. Pri tem je omenila, da je Ministrstvo namenilo dodatna sredstva za nadgradnjo registra raka s kliničnimi podatki. Novi viri financiranja za zdravljenje bolnikov z rakom, naj bi postali še večja prioriteta. Čufarjeva pa dodaja, da bo delež
financiranja v prihodnje potrebno povečati, saj je rak odgovoren za 25% smrti v Evropi. Raka bo vedno več, Slovenija pa bo morala svoj miselni tok usmeriti v znanje in energijo po obvladovanju raka.
Jure Mikolič je potrdil oceni Čuferjeve, da se Slovenija lahko pohvali z dobro dostopnostjo novih onkoloških zdravil. Kot problem, pa izpostavlja časovnico razvrščanja novega zdravila na listo. Veliko je potrebno prilagajanj s strani Zavoda in proizvajalci zdravil, da pripravijo vlogo. Potrebno je tudi uskladiti pogajanja o ceni zdravila.
Pozitivno izkušnjo zdravljenja raka ima Iva Dimic, poslanka in članica odbora DZ za zdravstvo. Diagnoza raka zanjo seveda ni bila prijetna novica. Zelo zadovoljna je z onkološkim zdravstvenim sistemom in izvrstnimi zdravniki ter kirurgi, ki so ji poleg strokovne oskrbe, dali tudi ponovno upanje za življenje. Po njenih besedah bi se morali politiki več ukvarjati s problematiko raka. Pri tem je spomnila, da je bila sama tudi pobudnica ustanovitve pododbora Odbora za zdravstvo za spremljanje rakavih obolenj v Sloveniji.
V živo je virtualno konferenco, upoštevajoč vse platforme, kjer smo imeli prenos, spremljalo praktično ves čas blizu 400 gledalcev. Upoštevajoč prav tako vse platforme, kjer je bil prenos predvajan, je posnetek pogovora doslej zabeležil že več kot 5300 ogledov, medtem, ko se bodo številke ogledov z dnevi še višale.
Celoten pogovor si lahko ogledate na povezavi: https://livestream.com/accounts/564247/events/7618799/videos/208152408/player
“,”Jaka Verbic Miklic”,1594195440,1594195440,sl,14363,306,14362,43,0,NULL,,”Kakšna bo prihodnost zdravljenja bolnikov z rakom v Sloveniji?”,kaksna-bo-prihodnost-zdravljenja-bolnikov-z-rakom-v-sloveniji,Post,”/sites/43/files/images/news/Cancer patients/cancer-cells-3.jpg”,1,0,1594195608,1594199773
648,14363,”What will be the future of treating cancer patients in Slovenia?”,”Over 15 thousand people develop cancer in Slovenia each year and 6 thousand die”,”
Over 15,000 people develop cancer in Slovenia each year and 6000 die. Cancer is the second commonest disease to cause death in Slovenia and closely follows cardiovascular diseases. The number of oncology patients increases by two percent each year.
The online panel discussion held by STAklub on 1 July 2020 was joined by Dr. Tina Bregant, State Secretary at the Ministry of Health, Jure Mikolič from the Department of Medicinal Products at the Health Insurance Institute of Slovenia, Prof. Dr. Tanja Čufer from the Oncology Department at the Faculty of Medicine, University of Ljubljana, and Iva Dimic, Member of the National Assembly and member of the National Assembly Healthcare Committee.
The central topic of discussion with the experts were the present and future of treatment of patients with cancer, focusing particularly on early diagnostics and the importance of access to new treatments and medicines.
According to oncologist Dr. Tanja Čufer the good side of access to new oncology medicines in Slovenia is the fact that all medicines become accessible sooner or later. The problem is the excessive time it takes from registration to the medicine actually being made available to Slovenian patients. On average this takes 400 days. Dr. Čufer noted that new medicines could be reached faster through clinical studies, which is a procedure western European countries practice to great effects in managing cancer.
Among the problems impacting treatment of oncology patients in Slovenia Dr. Čufer also mentioned the excessive time from the first symptoms to diagnosis and emphasised the importance of early discovery. The sooner cancer is diagnosed, the more effective the treatment can be. Cancer survival rates are greatly increased by early diagnostics and quality of treatment. A case in point is lung cancer which is treatable in 70% of all cases, provided it is discovered in time and the patient receives appropriate treatment.
Cancer is a very demanding disease so rapid and effective introduction of new medicines or treatment methods require extensively trained personnel, added Dr. Čufer. She emphasised the benefits brought by clinical registries that provide patients with access to data on treatment quality and outcomes in separate institutions that help in the selection of a physician. With that she also noted on the importance and usefulness of the ESMO Magnitude of Clinical Benefit Scale that was developed by the European Society for Medical Oncology (ESMO) and the American Society of Clinical Oncology (ASCO). The scale evaluates how much a new medication extends the life of a patient in comparison to another medication and how it impacts their quality of life. Higher scored treatments enable a longer, higher quality life which is the wish of every patient faced with a demanding diagnosis of cancer.
State Secretary Tina Bregant emphasised the importance of primary prevention for the reduction of cancer incidence and early discovery of the disease with the help of screening programs. The Ministry is aware of the need for organisational and personnel improvements at all three levels of healthcare. She emphasized that the fight against cancer is a priority of healthcare politics. Ms. Bregant noted on the issue of assuring additional resources for financing oncology, especially in the time of the COVID-19 epidemic. She mentioned that the Ministry did earmark additional funding for upgrading the cancer registry with clinical data. New sources of financing for the treatment of cancer patients are to receive higher priority. Ms. Čufar added that the share
of financing will need to be increased in the future because cancer causes 25% of all deaths in Europe. Cancer rates will continue to increase and Slovenia will need to focus its efforts on knowledge and energy to manage cancer.
Jure Mikolič confirmed Ms. Čufer’s assessment that Slovenia has quite good access to new oncology medications. He did note on the problem of the time line of classifying new medicines on a list. The drafting of an application requires a lot of adjustments on the part of the insurance institute and the medicinal product manufacturers. Another matter to coordinate is negotiations on price.
Iva Dimic, member of the National Assembly and member of the National Assembly Healthcare Committee shared her positive experience with cancer treatment. Her cancer diagnosis was not happy news for her. But she is very satisfied with the oncology healthcare system and exceptional doctors and surgeons who not only treated her disease, but also gave her hope for her future. In her words politicians should focus more on cancer related issues. She also noted that she initiated the founding of the subcommittee for the monitoring of cancer with the Healthcare Committee.
The live stream of the conference was watched on all platforms throughout its duration by about 400 viewers. Taking into account all the platforms where the discussion was published, the recording was viewed 5300 times so far and the view count will increase in the coming days.
The entire discussion can be viewed at: https://livestream.com/accounts/564247/events/7618799/videos/208152408/player
“,”Jaka Verbic Miklic”,1594195440,1594195440,en,14363,306,14362,43,0,NULL,,”Kakšna bo prihodnost zdravljenja bolnikov z rakom v Sloveniji?”,kaksna-bo-prihodnost-zdravljenja-bolnikov-z-rakom-v-sloveniji,Post,”/sites/43/files/images/news/Cancer patients/cancer-cells-3.jpg”,1,0,1594195608,1594199773
650,14387,”Ministrstvo za zdravje je pripravilo javni razpis za skrajševanje čakalnih vrst”,”Gantar je danes v izjavi medijem dejal, da bo razpis objavljen še ta mesec, razpisana sredstva pa so do konca prihodnjega leta.”,”
Ljubljana, 2. septembra – Ministrstvo za zdravje je pripravilo javni razpis za skrajševanje čakalnih vrst v zdravstvu, na katerega se bodo pod enakovrednimi pogoji prijavili tako javni kot zasebni izvajalci zdravstvenih storitev, je danes povedal minister za zdravje Tomaž Gantar. Skupna vrednost storitev bo 42 milijonov evrov, še letos bo na voljo okoli 14 milijonov evrov.
Gantar je danes v izjavi medijem dejal, da bo razpis objavljen še ta mesec, razpisana sredstva pa so do konca prihodnjega leta. Še letos nameravajo za skrajševanje čakalnih vrst nameniti okoli 14 milijonov evrov, kar je predvideno v predlogu zakona o izvrševanju proračuna, ostala manjkajoča sredstva do 42 milijonov evrov pa bodo delno črpali iz evropskih sredstev.
Razpisovali bodo tiste storitve, kjer so čakalne vrste najdaljše, po drugi strani pa najbolj vplivajo na zdravstveno stanje posameznika, med njimi so denimo ortopedske operacije hrbtenice.
Na razpis se bodo po Gantarjevih besedah lahko po enakimi pogoji prijavili tudi zasebni izvajalci zdravstvenih storitev, pri čemer bodo v razpisu tudi opredeljeni kriteriji in pogoji za spremljanje kakovosti dela.
Gantar je opozoril na slabe izkušnje iz preteklih let pri skrajševanju čakalnih vrst, ko se je v skrajševanje čakalnih vrst vlagal nov denar, po drugi strani pa se je število čakajočih prek dopustne čakalne dobe od konca leta 2013 do danes povečalo s 7000 na več kot 75.000. Kot je opozoril, so iz leta v leto slabši podatki o čakalnih dobah.
Po njegovih besedah so čakalne dobe danes na papirju še vedno krajše kot pred začetku krize, a je takšno stanje na račun tistih, ki še niso dobili nov datum za zdravstveno storitev.
Minister za zdravje v današnji izjavi tudi komentiral predlog rebalansa proračuna, ki ministrstvu namenja dodatnih dobrih 140 milijonov evrov. Po njegovih besedah gre za sredstva za ukrepe, dogovorjene v interventni protikoronski zakonodaji. Dodatno bodo v okviru zakona o izvrševanju proračuna letos dobili 50 milijonov evrov, ki bodo tudi namenjeni izvajalcem zdravstvenih storitev za vsebine, ki se nanašajo na epidemijo covida-19.
Gantar meni, da bi morala ta dodatna sredstva v letos zadostovati za Zavod za zdravstveno zavarovanje Slovenije (ZZZS), poleg tega tudi zadnji podatki ne kažejo, da se bodo projekcije Urada za makroekonomske analize in razvoj v celoti uresničile, kot so bile nakazane. Opozoril je, da ne pozna natančno ne prihodkovne ne odhodkovne strani ZZZS, a glede na to, da bodo izvajalci realizirali med 80 in 90 odstotkov programa, bo ZZZS prihranil nekaj sredstev na ta račun, poleg tega ima ZZZS prihranke iz preteklih let. To bi po Gantarjevem mnenju moralo zadostovati, da ZZZS ne bi zamikal plačil decembrskih avansov zdravstvenim izvajalcem v prihodnje leto.
Potrdil je tudi, da bo letos sprejet aneks k splošnemu dogovoru, sprejem je predviden v septembru.
Gantar se je dotaknil tudi predloga zakona o dolgotrajni oskrbi, ki ga je ministrstvo pred tedni vložilo v javno razpravo. V zakonu so se odprla nekatera vprašanja, tudi polemična razprava, a minister opozarja, da se ta zakon pričakuje že 20 let in bi moral vrniti dostojanstvo starejšim. Opozoril je na kakovost oskrbe v domovih za starejše, kar se je nenazadnje pokazalo tudi v epidemiji covida-19, saj da so ponekod razmere resnično slabe in je treba veliko spremeniti.
“Verjamem, da ta zakon vse to zaobjema in da bomo našli kompromis,” je povedal. Predlog financiranja bo po njegovih napovedih deležen še mnogo razprav, sami pa so predlagali solidarno financiranje.
Na vprašanje, kakšne so alternativne možnosti, če v koaliciji in vladi ne bodo podprli njihovega predloga po uvedbi dodatnega prispevka za dolgotrajno oskrbo, pa je dejal, da so bile v preteklosti ponujene različne rešitve – od prenosa plačila v dopolnilno zdravstveno zavarovanje, dodajanja proračunskih sredstev. Gantar si želi rešitve, ki bi vključevala razpršeno financiranje. Nazadnje pa se je odprla tudi široka možnost financiranja iz evropskih sredstev.
Po končani javni razpravi bodo predlog poslali v koalicijsko in nato še v medresorsko usklajevanje. Predlog zakona bi lahko bil na vladi še letos, je še napovedal Gantar.
“,”Jaka Verbic Miklic”,1599109860,1599109860,sl,14387,306,14386,43,0,NULL,,”Ministrstvo za zdravje je pripravilo javni razpis za skrajševanje čakalnih vrst”,ministrstvo-za-zdravje-je-pripravilo-javni-razpis-za-skrajsevanje-cakalnih-vrst,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1599110070,1599110070
651,14389,”V Zdravstvenem domu Dravograd odprli prostore pediatrije”,”V Zdravstvenem domu Dravograd so danes zjutraj odprli pediatrično ambulanto”,”
Dravograd, 1. septembra – V Zdravstvenem domu Dravograd so danes zjutraj odprli pediatrično ambulanto, ki je sam zdravstveni dom dolgo ni imel. Področje pediatrije je namreč doslej v Dravogradu pokrivala pediatrinja s koncesijo, ki bo svojo dejavnost opravljala še naprej. Na občini so širitve dejavnosti zdravstvenega doma in nove pediatrinje zelo veseli.
“S tem se v naši občini zaključuje prvi del kadrovske prenove primarnega zdravstva, s katerim smo pridobili tri mlade splošne zdravnike oz. zdravnico in pediatrinjo. Čez čas se jim pridruži še en zdravnik, naš štipendist. S tem bo krog kadrovske prenove Zdravstvenega doma Dravograd zaključen, kar pomeni, da bomo ena izmed redkih občin z ‘rešenim’ vprašanjem zdravstvene oskrbe na primarni ravni,” je na družbenem omrežju Facebook zapisal dravograjski podžupan Anton Preksavec.
Zdravstveni dom je prostore pediatrije uredil v nekdanjih prostorih rentgena, je za STA povedala dravograjska županja Marijana Cigala, ki je vseh pridobitev v primarnem zdravstvu v občini prav tako zelo vesela, potem ko je bil obstoj zdravstvenega doma pred nekaj leti zaradi kadrovske stiske celo ogrožen.
A s tem načrtov na področju zdravstva v dravograjski občini še ni konec. Občina namreč že nekaj časa načrtuje nov, večji zdravstveni dom. Sprva je občina načrtovala, da bo projekt, ki je že pripravljen, izvedla v okviru javno-zasebnega partnerstva, a se je medtem pokazala možnost, da bi lahko dom zgradila tudi s pomočjo sofinanciranja iz evropskih sredstev. V tem trenutku tako dokončne odločitve o načinu izvedbe nekaj milijonov evrov vrednega projekta še ni.
“,”Jaka Verbic Miklic”,1598937240,1598937240,sl,14389,306,14388,43,0,NULL,,”V Zdravstvenem domu Dravograd odprli prostore pediatrije”,v-zdravstvenem-domu-dravograd-odprli-prostore-pediatrije,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1599110241,1599110280
652,14391,”Necepljenih otrok po predlogu novega zakona ne bo mogoče vpisati v vrtec”,”Predlog zakona o nalezljivih boleznih določa, da necepljenih otrok ne bo mogoče vključiti v javno financiran vrtec ter nekatere srednje in visoke šole ter fakultete.”,”
Ljubljana, 21. avgusta – Predlog zakona o nalezljivih boleznih določa, da necepljenih otrok ne bo mogoče vključiti v javno financiran vrtec ter nekatere srednje in visoke šole ter fakultete. Po besedah državne sekretarke Tine Bregant želijo s tem preprečiti neupravičeno izogibanje cepljenju in zaščititi populacijo. Predlog bo v javni obravnavi do 30. septembra.
Državna sekretarka na ministrstvu za zdravje Bregantova je opozorila, da skušajo nekateri starši neupravičeno zavlačevati s cepljenjem otrok, včasih tudi tako dolgo, da otroci vmes že zrastejo, v tem času pa ogrožajo vse ostale. Posledica tega so bile po njenih besedah tudi nekatere okužbe z ošpicami.
Sistem po njenih besedah po novem ne bo dopuščal takšnega zavlačevanja. Otroci, ki ne bodo cepljeni v skladu s programom cepljenja, tako ne bodo mogli biti vključiti v javni vrtec ali v javno sofinanciran zasebni vrtec, prav tako jih ne bo mogoče vpisati “v programe srednjih in visokošolskih zavodov ter fakultet s področja zdravstva, vzgoje in izobraževanja in socialnega varstva”. Necepljeni otroci se tudi ne bodo mogli udeležiti organiziranih letovanj, ki so financirana iz sredstev obveznega zdravstvenega zavarovanja. Še vedno pa bo mogoče necepljenega otroka vpisati v šolo, saj je ta po zakonu obvezna.
Vse omenjene omejitve po besedah Bregantove ne bodo veljale za otroke, ki jih ni mogoče cepiti zaradi objektivnih razlogov. O (ne)obveznosti cepljenja bo v tem primeru odločala posebna komisija, po odločitvi slednje pa bo podatek, da za otroka ni obvezno cepljenje, v elektronski sistem vnesel njegov pediater.
Pri določbah glede cepljenja so po besedah Bregantove krmarili med zaščito populacije in pravicami posameznika. “Nismo želeli bili preveč restriktivni, smo pa želeli zaščititi populacijo,” je dejala.
S predlogom novega zakona po besedah državne sekretarke na novo urejajo tudi področje epidemiološkega spremljanja nalezljivih bolezni in okužb. Trenutni zakon o nalezljivih boleznih na tem področju ni slab, a ne odgovarja na vse izzive, ki jih je pred družbo postavil novi koronavirus, je opozorila.
Po novem bodo morali tako o prepoznanih povzročiteljih nalezljivih bolezni poročati vsi mikrobiološki laboratoriji, akreditirani s strani ministrstva, zdravniki pa le o določenem naboru nalezljivih bolezni, predvsem zato, da se jih razbremeni.
Predlog zakona določa tri vrste karantene za okužene – karanteno na domu po tesnem stiku z okuženo osebo, karanteno na domu po prihodu z območij z visokim tveganjem, ter karanteno, s katero se osebi deloma ali v celoti omeji svobodo gibanja, kar velja zlasti za težke nalezljive bolezni, kot so na primer kuga, ebola in podobno. Opredeljuje tudi institucije, ki odredijo karanteno, saj je bilo do zdaj na tem področju nekaj zagat, je dejala Bregantova.
S predlogom novega zakona vzpostavljajo še stabilnejši sistem spremljanja porabe protimikrobnih zdravil ter na novo določajo postopke obvladovanja okužb, povezanih z zdravstveno oskrbo.
Glede na to, da prihaja jesen, je Bregantova na koncu vse tudi pozvala, naj se cepijo proti gripi, starejši pa tudi proti pnevmokoku. “Če bomo namreč prebolevali gripo in še covid-19, tudi mlajši tega ne bomo preboleli na lahek način,” je dejala.
Sicer pa bo po njenih besedah v soboto v uradnem listu objavljen letni program cepljenja in zaščite z zdravili, ki bo v sezoni 2020/2022 omogočil brezplačno cepljenje proti gripi za otroke v starosti od šest do 23 mesecev.
“,”Jaka Verbic Miklic”,1597987080,1597987080,sl,14391,306,14390,43,0,NULL,,”Necepljenih otrok po predlogu novega zakona ne bo mogoče vpisati v vrtec”,necepljenih-otrok-po-predlogu-novega-zakona-ne-bo-mogoce-vpisati-v-vrtec,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1599110523,1599110524
653,14393,”Gantar od bolnišnic pričakuje podatke, koliko zdravstvenih storitev so sposobne opraviti za skrajšanje čakalnih dob”,”Minister za zdravje Tomaž Gantar se je danes z direktorji bolnišnic pogovarjal o pripravljenosti bolnišnic za obvladovanje epidemije covida-19, razpravljali pa so tudi o finančnih zagatah bolnišnic.”,”
Ljubljana, 18. avgusta – Minister za zdravje Tomaž Gantar se je danes z direktorji bolnišnic pogovarjal o pripravljenosti bolnišnic za obvladovanje epidemije covida-19, razpravljali pa so tudi o finančnih zagatah bolnišnic. Gantar je predstavil možne rešitve, od bolnišnic pa pričakuje podatke o tem, koliko storitev so dejansko sposobne opraviti.
Uprave slovenskih bolnišnic so v zadnjih tednih ob predstavitvi finančnih načrtov za letošnje leto opozarjale tudi na finančne težave. Te imajo nekatere skupne imenovalce, in sicer, da Zavod za zdravstveno zavarovanje Slovenije (ZZZS) v svoje cene za opravljene storitve ni vključil višjih stroškov delovne sile. Dogovor med vlado in sindikati javnega sektorja je namreč dvignil plače zaposlenih v zdravstvu. Izpad prihodkov imajo bolnišnice tudi zaradi tega, ker v času epidemije niso mogle opravljali zdravstvenih storitev, zaposlenim so pa vseeno morale izplačati plače. Epidemija je podaljšala tudi že tako boleče čakalne dobe v zdravstvu.
Poročila o delu v prvem polletju so predstavniki bolnišnic danes predstavili tudi ministru za zdravje. Gantar s sodelavci je predstavnikom bolnišnic predstavil predloge za reševanje tega področja v prihodnje, zavode pa zadolžil, da poročajo, koliko rednega in dodatnega programa so dejansko zmožni izvesti do konca leta.
Minister je direktorje bolnišnic danes tudi opozoril, da novi koronavirus ne sme biti razlog, da se bolnika ne obravnava. “Zdravstvenega sistema ne bomo zaustavljali tako kot v prvem valu epidemije, zato se morajo vsi zavodi prilagoditi in nadoknaditi zamujeno v času epidemije,” poudarjajo na ministrstvu.
Kot so še zapisali v sporočilu za javnost po srečanju, so minuli teden bolnišnice in zdravstvene domove pozvali, da pregledajo svoj način naročanja in odzivnost na klice ter se organizirajo tako, da bodo prebivalci deležni nemotene zdravstvene oskrbe na primarni in sekundarni ravni.
Minister pa je na današnjem srečanju predstavnike bolnišnic tudi opozoril, da sta za boljšo obravnavo vseh bolnikov, ne samo bolnikov z novim koronavirusom, ključni dobra organiziranost dela in usklajenost med javnimi zdravstvenimi zavodi.
O stanju v zdravstvu je danes razpravljal tudi upravni odbor ZZZS, ki je opozoril na slabšanje dostopnosti do zdravstvenih storitev in tudi finančnega poslovanja ZZZS zaradi epidemije covida-19.
Poleg že slišanih predlogov, naj se iz proračuna zagotovi kritje primanjkljaja javne zdravstvene blagajne, ki bi lahko ob koncu leta znašal 270 milijonov evrov, in nekaterih stroškov, ki jih zdaj krije ZZZS, so zažugali tudi zdravstvenim zavodom.
V Združenju zdravstvenih zavodov predloge ZZZS pozdravljajo, a ob tem opozarjajo, da vsi niso zadostni. Predsednik združenja Marjan Pintar je tako med drugim v izjavi za STA izpostavil, da je ZZZS kljub drugačnim zagotovilom ministra znižal avanse zdravstvenim zavodom za načrtovane programe. To po opozorilih Pintarja še poslabšuje likvidnost izvajalcev in posledično negativno vpliva na uresničljivost pričakovanj ZZZS, da bi izvajalci zdravstvenih storitev kljub epidemiji v celoti uresničili za letos dogovorjen obseg zdravstvenih storitev.
Pintar je opomnil, da ZZZS zdravstvenim zavodom za zdravstvene storitve plačuje nižje zneske, kot jih določa zakon, in tako ne krije celotnih stroškov dela, amortizacije in materialnih stroškov.
Znova je izpostavil podatke, da bi samo za izplačilo plač zdravstvenim delavcem po popravljeni plačni lestvici v zdravstvu potrebovali dodatnih 45 milijonov evrov letno, za izplačilo delovne uspešnosti zaposlenim, kot so jo dolžni izplačevati od 1. julija dalje, pa bi samo do konca leta potrebovali še 21 milijonov evrov.
Zato bi ZZZS, še preden ponuja dodatna sredstva za širitve posameznih zdravstvenih programov, moral izpolniti svoje z zakonom določene obveznosti do izvajalcev zdravstvenih storitev, je še pripomnil Pintar.
“,”Jaka Verbic Miklic”,1597728120,1597728120,sl,14393,306,14392,43,0,NULL,,”Gantar od bolnišnic pričakuje podatke, koliko zdravstvenih storitev so sposobne opraviti za skrajšanje čakalnih dob”,gantar-od-bolnisnic-pricakuje-podatke-koliko-zdravstvenih-storitev-so-sposobne-opraviti-za-skrajsanje-cakalnih-dob,Post,,1,0,1599110740,1599110740
654,14395,”Osnutek zakona o dolgotrajni oskrbi po napovedi Gantarja še ta teden v javno razpravo”,”Ministrstvo za zdravje bo še ta teden v javno razpravo poslalo osnutek zakona o dolgotrajni oskrbi”,”
Ljubljana, 17. avgusta – Ministrstvo za zdravje bo še ta teden v javno razpravo poslalo osnutek zakona o dolgotrajni oskrbi, je danes napovedal minister za zdravje Tomaž Gantar. Več podrobnosti, tudi tega, kako v zakonu predlagajo kritje manjkajočih 360 milijonov evrov sredstev za zagotavljanje dolgotrajne oskrbe, danes še ni želel razkriti.
Podrobno bodo rešitve v osnutku zakona predstavili, ko ga bodo poslali v javno obravnavo. Je pa Gantar danes na novinarski konferenci Zveze društev upokojencev Slovenije (Zdus), na kateri so sicer predstavili publikacijo z naslovom Organizirane oblike zagotavljanja kakovostne starosti ter spregovorili o aktualnih notranje političnih razmerah, pojasnil, da je bil cilj zakona, da bi bile vse osnovne storitve, vključno z zdravstvenimi, vsem dostopne brez dodatnega plačila.
Bo pa treba najti sredstva za “hotelski” del namestitve, gre za okoli 360 milijonov evrov. Kakšno rešitev v zakonu predlagajo za kritje teh sredstev, ni želel razkriti, je pa dejal da bo to verjetno še predmet razprave. “Predvsem pa bo odločitev družbe, ali je to pripravljena narediti in do katere mere je to sposobna izpeljati glede na razpoložljiva sredstva,” je dejal.
Predsednik Zdus Janez Sušnik pa je glede osnutka zakona dejal, da bodo nanj dali pripombe, ko ga bodo dobili. Nato pa bodo sodelovali z ministrstvom za zdravje, da bodo njihove pripombe tudi upoštevali.
Gantar je danes tudi pojasnil, da je pripravljen aneks k splošnemu dogovoru za letošnje leto, v katerem med drugim dvigujejo kadrovske normative za zdravstveno nego v domovih za starejše. Točnih številk, koliko bo ta ukrep vreden, ni znal pojasniti. Je pa opozoril, da je pri sprejemanju aneksa trenutno težava, ker morajo Zavodu za zdravstveno zavarovanje Slovenije, kjer se zbira denar, ki ga potem s splošnim dogovorom in pripadajočimi aneksi razporedijo, najprej zagotoviti dodatna sredstva.
Gantar je že pozval ministrstvo za finance, naj v letošnjem letu iz državnega proračuna za zdravstvo zagotovi vsaj 222,6 milijona evrov. Ali so že prejeli odgovor, pa ne ve, ker je bil v prejšnjem tednu odsoten.
Državni sekretar na ministrstvu za delo, družino, socialne zadeve in enake možnost Cveto Uršič opozoril, da bo v vsakem primeru težko najti dodatne kadre na trgu dela. Za to bo namenjenih 29 milijonov evrov, težava pa bo, kje najti ta kader. Pojasnil je, da bodo kader iskali tudi med upokojenci, študenti in prek javnih del. Poleg tega je težava financiranja osebne varovalne opreme v domovih, zlasti ker zdaj potrebujejo veliko tovrstne opreme in jo bodo težko zagotavljali iz lastnih sredstev. Tako z ministrstvom za zdravje iščejo rešitve, da bi nakup te opreme morda financirali iz evropskih sredstev.
V načrtu imajo tudi zgraditi nove domove za starejše, obstaja tudi možnost sofinanciranja prenove domov. Za hrastniški dom, kjer so v preteklih tednih imeli večji izbruh novega koronavirusa, pa je dejal, da je možnost tako obnove tega doma – gre namreč za prejšnji dijaški dom – kot tudi možnost novogradnje.
Gantar danes ni želel podati komentarja na poročanje Televizije Slovenija, da je Javna agencija za zdravila in medicinske pripomočke začasno prepovedala uporabo ventilatorjev Bellavista 1000, za katere je država odštela skoraj 1,7 milijona evrov. Dejal je, da se mora pred tem sestati z deležniki in pridobiti potrebne informacije.
“,”Jaka Verbic Miklic”,1597642080,1597642080,sl,14395,306,14394,43,0,NULL,,”Osnutek zakona o dolgotrajni oskrbi po napovedi Gantarja še ta teden v javno razpravo”,osnutek-zakona-o-dolgotrajni-oskrbi-po-napovedi-gantarja-se-ta-teden-v-javno-razpravo,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1599111187,1599111187
655,14397,”Rusija zavrača pomisleke glede svojega cepiva proti covidu-19″,”Rusija je danes zavrnila v tujini izražene zadržke in pomisleke glede svojega cepiva proti covidu-19 – prvega potrjenega na svetu.”,”
Moskva, 12. avgusta – Rusija je danes zavrnila v tujini izražene zadržke in pomisleke glede svojega cepiva proti covidu-19 – prvega potrjenega na svetu. “Kolegi iz tujine očitno poskušajo izraziti neko mnenje, ki je po našem prepričanju popolnoma neutemeljeno,” je danes dejal ruski minister za zdravstvo Mihail Muraško.
V Rusiji so v torek uradno registrirali in dovolili za uporabo svoje cepivo Sputnik V. Za ta korak so se odločili, še preden bi bili znani rezultati t. i. tretje faze kliničnega testiranja cepiva, kar je nasprotju z mednarodno uveljavljenim postopkom razvoja cepiva.
Cepivo je razvil državni inštitut za epidemiologijo in mikrobiologijo Gamaleja v Moskvi. Njegov direktor Aleksander Ginzburg je dejal, da bodo cepivo najprej ocenili ruski znanstveniki. Šele nato bodo objavili vse podatke. Dokončne rezultate raziskave bi lahko po njegovih besedah objavili v ruski znanstveni reviji, pa tudi v tujini.
Po Muraškovih besedah je prve pošiljke novega cepiva pričakovati v naslednjih dveh tednih. “Danes poteka nadzor kakovosti,” je dejal. Proizvodnja v Rusiji naj bi bila v prvi vrsti namenjena cepljenju lastnega prebivalstva. Bo pa Rusija tujini ponudila, da sami izdelujejo njihovo cepivo.
Rusija bo sicer vzporedno z izvedbo tretje faze testiranja že začela cepljenje zdravstvenega osebja in učiteljev, pri čemer bo cepljenje zanje prostovoljno, je še dejal Muraško. Po njegovih besedah ga priporočajo zlasti ljudem s predhodnimi obolenji, poroča nemška tiskovna agencija dpa.
“,”Jaka Verbic Miklic”,1597210260,1597210260,sl,14397,306,14396,43,0,NULL,,”Rusija zavrača pomisleke glede svojega cepiva proti covidu-19″,rusija-zavraca-pomisleke-glede-svojega-cepiva-proti-covidu-19,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1599111335,1599111336
656,14401,”Bolniki z rakom morajo biti kljub epidemiji covida-19 prioriteta”,”Bolniki z rakom ali sumom na raka morajo biti kljub epidemiji covida-19 prioriteta, so poudarili sodelujoči na današnji okrogli mizi.”,”
Ljubljana, 3. septembra – Bolniki z rakom ali sumom na raka morajo biti kljub epidemiji covida-19 prioriteta, so poudarili sodelujoči na današnji okrogli mizi. Kot zaskrbljujoče so izpostavili dejstvo, da je bilo aprila postavljenih 30 odstotkov manj diagnoz raka. Ob tem pa pozivajo vse bolnike, ki opažajo kakšne resne simptome, naj ne odlašajo z obiskom zdravnika.
Strokovna direktorica Onkološkega inštituta Ljubljana Irena Oblak je pojasnila, da so sicer imeli srečo, da so lahko opravljali svojo dejavnost ves čas epidemije, v nekaterih državah namreč tudi onkološki centri niso smeli delovati. “Posledice nediagnostike in nezdravljenja so lahko hujše kot posledice covida-19,” je opozorila. A so že v začetku marca in nato tudi aprila opazili, da so upadle napotitve bolnikov na onkološki inštitut in potrditve rakave bolezni, tudi za 30 odstotkov. Že v maju je bilo sicer teh napotitev več. Med epidemijo so zaustavili sledenje bolnikov po zaključenem zdravljenju in presejalni program Dora, katerega so znova začeli izvajati 25. maja. Pri Dori nameravajo nadoknaditi zamude do konca leta, medtem ko so kontrolne preglede uspeli nadoknaditi z delovnimi sobotami in podaljševanjem delovnega časa. A je predsednica Združenja slovenskih organizacij bolnikov z rakom ONKO NET, ki je organiziralo okroglo mizo, in izvršna direktorica Združenja L&L Kristina Modic ob tem opozorila, da se veliko ljudi na njih obrača, ker imajo sum na raka, a še vedno zelo težko ali celo ne morejo dostopati do družinskega zdravnika. “Veliko jih ne more priklicati zdravnika, so v kontaktu samo z medicinsko sestro. Drugi tarnajo, da ne dobijo odgovora na elektronsko pošto,” je izpostavila. Po njenih besedah je izrednega pomena, da na primarni zdravstveni ravni ne pride do zastojev pri obravnavi, saj je to vstopna točka tudi za nadaljnjo obravnavo. Tako je pozvala, naj se v prihodnje bolnikom omogoči normalen čas dostopa do zdravnika, saj ta ne sme biti podrejen le covidu-19. “Še veliko je drugih življenjsko ogroženih bolnikov,” je dejala. Ob tem je tudi pozvala javnosti, naj bodo pozorni na simptome in naj tudi v tem času poiščejo in zahtevajo pomoč. Tudi generalni direktor Zavoda za zdravstveno zavarovanje Slovenije (ZZZS) Marjan Sušelj pravi, da imajo pogoste pritožbe bolnikov, da ne morejo priti v kontakt z družinskim zdravnikom, saj so ves čas zasedeni telefoni. Ta dostop pa se utegne v jesensko-zimskem času, ko bodo poleg covida-19 prisotne tudi druge viroze, še poslabšati. Državna sekretarka na ministrstvu za zdravje Tina Bregant vidi delno rešitev za ta problem v informacijski tehnologiji, ki bi lahko razbremenila medicinske sestre, da ne bodo cel dan na telefonu. Zato je ministrstvo že stopilo v stik z ministrstvom za javno upravo, Nacionalnim inštitutom za javno zdravje in informatiki, in upa, da bodo za ta projekt tudi dobili evropska sredstva. “Epidemija zahteva butičen način dela, kar smo si zdravniki želeli. A sedaj, ko ga imamo, tega ne znamo obvladati,” je dejala. Po njenih besedah do težav prihaja predvsem tam, kjer imajo slabo organizacijo dela, za to pa so odgovorna vodstva zdravstvenih ustanov. Nedostopnost družinskega zdravnika je po njenih besedah nesprejemljiva tudi s strokovnega vidika. Tudi družinska zdravnica Danica Rotar – Pavlič vidi del rešitve v informacijski tehnologiji – naj se bolniki poslužijo elektronske pošte, če zdravnika ne dobijo prek telefona. Ob tem je pozvala bolnike, naj takoj, že v prvem stavku zdravnika opozorijo, če opazijo kakšen resen simptom. “Biti zdravnik v teh časih je prava umetnost, da bolnike pravilno selekcioniraš,” je dejala. Po njenem mnenju se je v času epidemije veliko ljudem poslabšalo duševno zdravje, shizofrenije, veliko poškodb obravnavajo, ker so ljudje živčni. Ob tem je opozorila, da so nekateri preprosto obupali nad zdravstvom, kar se med drugim pozna v več nenadnih srčnih smrti, saj kljub bolečinam v prsnem košu ne obiščejo zdravnika. In kot je opozoril predstojnik kliničnega oddelka za hematologijo Univerzitetnega kliničnega centra Ljubljana Samo Zver, covid-19 “ustavlja medicino na vseh ravneh, kar je dosti večja nevarnost, kot si predstavljamo”. Opozoril je, da je covid-19 “bolezen za zraven” in ne zahteva popolno pozornost v zdravstvu, čeprav jo je treba jemati z vso resnostjo. “Ob tem je treba tudi v prihodnje delati vse tisto, kar smo delali,” je poudaril.
“,”Jaka Verbic Miklic”,1599154080,1599154080,sl,14401,306,14400,43,0,NULL,,”Bolniki z rakom morajo biti kljub epidemiji covida-19 prioriteta”,bolniki-z-rakom-morajo-biti-kljub-epidemiji-covida-19-prioriteta,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1599499744,1599499744
657,14403,”ZPS: Označevanje alergenov v restavracijah s hitro hrano precej pomanjkljivo”,”Primerjalno ocenjevanje označevanja alergenov v restavracijah s hitro hrano je pokazalo, da se to v praksi ne izvaja v skladu z zakonodajo”,”
Ljubljana, 8. avgusta – Primerjalno ocenjevanje označevanja alergenov v restavracijah s hitro hrano je pokazalo, da se to v praksi ne izvaja v skladu z zakonodajo, ki določa, da morajo biti te informacije čitljive in objavljene na dobro vidnem mestu. Od 10 gostinskih obratov sta bila le dva ocenjena dobro, so navedli v Zveza potrošnikov Slovenije (ZPS).
Strokovnjaki Mednarodnega instituta za potrošniške raziskave so obiskali 10 restavracij s hitro hrano v petih slovenskih mestih. Zanimalo jih je, ali je označevanje alergenov na prodajnem mestu ustrezno in potrošniku prijazno ter kako dobro je z informacijami o alergenih v lastni ponudbi seznanjeno osebje restavracije. “Le dva gostinska obrata sta bila ocenjena dobro, vsi ostali pa slabše. Štirje so zaradi pomanjkljivih informacij na prodajnem mestu dobili skupno oceno pomanjkljivo, dva skupno oceno nezadovoljivo,” so navedli v ZPS. Kot so povzeli, v slabo ocenjenih primerih dostop do seznama alergenov ni bil preprost, prodajalca je bilo treba prositi zanj, seznam je bil težko berljiv, seznam je bil nepopoln ali pa ga celo niso imeli. Ljudem, ki imajo alergijo na hrano, ZPS tako svetuje, da obiskujejo le restavracije, ki imajo v ponudbi označene alergene. “Ne zaupajte zgolj priporočilom osebja, vedno zahtevajte pisno informacijo o alergenih,” so izpostavili. Tokratno primerjalno ocenjevanje je bilo izvedeno v sklopu ocenjevanj, ki jih Mednarodni institut za potrošniške raziskave izvaja v okviru državne koncesije za opravljanje javne službe izvajanja primerjalnih ocenjevanj blaga in storitev. Informacije in ugotovitve primerjalnih ocenjevanj so brezplačno dostopne na spletni strani potrošnikov zoom.
“,”Jaka Verbic Miklic”,1596907980,1596907980,sl,14403,306,14402,43,0,NULL,,”ZPS: Označevanje alergenov v restavracijah s hitro hrano precej pomanjkljivo”,zps-oznacevanje-alergenov-v-restavracijah-s-hitro-hrano-precej-pomanjkljivo,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1599500066,1599500111
658,14405,”Gantar predlaga, da se letos iz proračuna zagotovi 222,6 milijona evrov za zdravstvo”,”Minister za zdravje Tomaž Gantar meni, da so napovedi ZZZS, da bi v zdravstveni blagajni ob koncu leta lahko zmanjkalo okoli 270 milijonov evrov, pretirane.”,”
Ljubljana, 7. avgusta – Minister za zdravje Tomaž Gantar meni, da so napovedi ZZZS, da bi v zdravstveni blagajni ob koncu leta lahko zmanjkalo okoli 270 milijonov evrov, pretirane. Ne glede na to pa ministrstvo za finance poziva, naj v letošnjem letu iz državnega proračuna za zdravstvo zagotovi vsaj 222,6 milijona evrov. Odgovora finančnega ministrstva še ni prejel.
Na Zavodu za zdravstveno zavarovanje Slovenije (ZZZS) navajajo, da je primanjkljaj zdravstvene blagajne za letošnje leto zaradi izredno nestabilnih pogojev poslovanja težko predvideti. Ob upoštevanju junijske napovedi Urada za makroekonomske analize in razvoj pa bi ZZZS lahko imel do 200 milijonov evrov ali do šest odstotkov nižje prihodke iz prispevkov od načrtovanih v finančnem načrtu.
“Tako velik upad prispevkov in naraščajoči stroški na drugi strani – predvsem iz naslova preteklih dogovorov med vlado in sindikati glede plač v javnem sektorju, večji stroški povezani z epidemijo in nadomestila plač – vodijo v primanjkljaj okoli 270 milijonov evrov, ki ogroža finančno stabilnost javnega zdravstvenega sistema. Takšen znesek pa predstavlja enomesečno nakazilo izvajalcem zdravstvene dejavnosti, kar pomeni, da bi v decembru denarja za financiranje zdravstva preprosto zmanjkalo.
ZZZS je sicer imel okoli 120 milijonov evrov zalog iz plusa, ustvarjenega v preteklih letih. A ta denar so, kot so pojasnili za STA, že porabili.
Minister Gantar je v izjavi za STA dejal, da so določene ukrepe za finančno stabilizacijo zdravstva že predlagali ministrstvu za finance v dopisu 29. julija, pri čemer vsebine ni želel razkriti, saj da še čaka odgovor.
Je pa njegov predlog razviden v prilogi k odgovoru na poslansko vprašanje Francu Trčku (SD), in sicer Gantar predlaga, da državni proračun še letos krije 150 milijonov evrov za pokrivanje primanjkljaja ZZZS.
Od tega je, kot navaja v dopisu ministrstvu za finance, 43 milijonov evrov za odpravo zaostanka pri vkalkuliranih stroških dela, 14 milijonov evrov za varovalno opremo in brise za okužbo z novim koronavirusom od junija, 11 milijonov evrov za izplačila redne delovne uspešnosti, 22 milijonov evrov za nujne širitve in nove programe ter 58,6 milijona evrov za pokrivanje neporavnanih zapadlih obveznosti bolnišnic.
Poleg tega bi 14 milijonov evrov dali za financiranje sprejema učinkovitih ukrepov za skrajševanje čakalnih vrst, dodatno za ta namen v prihodnjem letu pa 28,2 milijona evrov.
Tako predlaga, da se v okviru sprejema interventne zakonodaje ali novele zakona, ki ureja izvrševanje proračunov, za letos in prihodnje leto zagotovijo proračunska sredstva za kritje predvidenega primanjkljaja ZZZS.
Ob tem je Gantar v dopisu opomnil, da se je maja s spremembo odloka povišal najvišji obseg izdatkov za državni proračun za 2,075 milijarde evrov, za občine 20 milijonov evrov in pokojninsko blagajno 85 milijonov evrov, le za zdravstveno blagajno je ostal obseg izdatkov za leto 2020 nespremenjen.
“Opozarjamo, da se lahko brez zagotovitve dodatnih proračunskih sredstev za zdravstvo v letu 2020 bistveno poslabša dostopnost prebivalcev Slovenije do zdravstvenih storitev v sistemu obveznega zdravstvenega zavarovanja ter njihova kakovost, prav tako pa brez zagotovitve dodatnih virov ni mogoče sprejeti ukrepov za skrajševanje čakalnih dob ter boljšo oskrbo zavarovanih oseb na primarni in sekundarni ravni,” je izpostavil v dopisu.
Brez zagotovitve virov za kritje primanjkljaja ZZZS v letu 2020 zavod ne bo mogel zagotavljati likvidnostih sredstev izvajalcem zdravstvenih storitev, kar bi lahko povzročilo izvajalcem težave pri izplačilu plač v decembru.
Če v letu 2021 ne bo mogoče zagotoviti proračunskih sredstev v višini 358,2 milijona evrov – od tega 330 milijonov evrov za kritje predvidenega primanjkljaja ZZZS ter 28,2 milijona evrov za sprejem učinkovitih ukrepov za skrajševanje čakalnih vrst – ter uveljaviti zakona o dolgotrajni oskrbi, pa velja razmisliti tudi o dvigu prispevne stopnje, je predlagal v dopisu.
Zaradi naraščajočih potreb, novih normativov dela v zdravstvu in novih oblik obravnav, pa bo treba tudi v prihodnje zagotoviti nove vire financiranja zdravstva, je dodal.
Gantar je v izjavi za STA dejal, da se zaveda, da bo težava zagotavljati dodatna sredstva za zdravstvo glede na stanje v proračunu, ampak druge poti za zagotavljanje finančne stabilnosti zdravstva ne vidi.
Žal pa mu je, da se v preteklih letih gospodarske rasti določene anomalije glede cen zdravstvenih storitev niso izravnale.
“,”Jaka Verbic Miklic”,1596822000,1596822000,sl,14405,306,14404,43,0,NULL,,”Gantar predlaga, da se letos iz proračuna zagotovi 222,6 milijona evrov za zdravstvo”,gantar-predlaga-da-se-letos-iz-proracuna-zagotovi-222-6-milijona-evrov-za-zdravstvo,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1599500481,1599500482
659,14407,”Vlada zaključila projekt sanacije bolnišnic”,”Vlada je na dopisni seji zaključila projekt za zagotavljanje poslovne in plačilne stabilnosti javnih zdravstvenih zavodov”,”
Ljubljana, 6. avgusta – Vlada je na dopisni seji zaključila projekt za zagotavljanje poslovne in plačilne stabilnosti javnih zdravstvenih zavodov. Ob tem je ugotovila, da je bila sanacija bolnišnic neuspešna pri 13 od 15 bolnišnic v sanaciji, so navedli na ministrstvu za zdravje. Z zaključkom sanacije preneha delovati sanacijski odbor in sanacijske uprave v zavodih.
Sanacija je bila v slovenskih bolnišnicah uvedena na podlagi zakona o interventnih ukrepih za zagotovitev finančne stabilnosti javnih zdravstvenih zavodov. Zakon je bil sprejet v mandatu Mira Cerarja, ministrstvo za zdravje je takrat vodila Milojka Kolar Celar. Petnajst bolnišnic je tako konec novembra 2017 prejelo skupaj skoraj 136 milijonov evrov za plačilo zapadlih neplačanih obveznosti do dobaviteljev in za plačilo posojil.
Edina bolnišnica, ki je zaključila sanacijo pred današnjo vladno odločitvijo, je bila jeseniška bolnišnica. Vlada je sklep o tem sprejela julija lani.
Danes pa je odločila, da se sanacija zaključi v onkološkem inštitutu, ljubljanskem in mariborskem univerzitetnem kliničnem centru, splošnih bolnišnicah Brežice, Celje, Murska Sobota, Novo mesto, Ptuj, Slovenj Gradec, Nova Gorica, Trbovlje in Izola ter v kranjski porodnišnici in Bolnišnici Topolšica. Kot so ob tem izpostavili na ministrstvu, je bila sanacija neuspešna pri 13 od 15 bolnišnic.
Zaposleni s sklenjenim delovnim razmerjem za delo na posebnem vladnem projektu sanacije bolnišnic opravljajo delo do konca leta. Do takrat morajo pripraviti končna poročila in podlage za prehod na redno spremljanje ukrepov za zagotavljanje dolgoročne finančne stabilnosti v okviru rednih nalog.
Vodstva javnih zdravstvenih zavodov medtem nadaljujejo z opravljanjem potrebnih ukrepov za zagotavljanje dolgoročne finančne stabilnosti v okviru rednih nalog. V skladu z zakonom o izvrševanju proračunov za leti 2020 in 2021 vodstvo zavoda polletnemu poročilu predloži sanacijski načrt, če iz ocene realizacije sprejetega finančnega načrta izhaja, da bo ob koncu tekočega leta javni zdravstveni zavod realiziral presežek odhodkov nad prihodki.
Funkcijo nadzora nad izvajanjem ukrepov izvaja svet zavoda, ki daje soglasje na program dela in finančni načrt ter sanacijski program, so še zapisali v sporočilu po današnji dopisni seji vlade.
“,”Jaka Verbic Miklic”,1596735720,1596735720,sl,14407,306,14406,43,0,NULL,,”Vlada zaključila projekt sanacije bolnišnic”,vlada-zakljucila-projekt-sanacije-bolnisnic,Post,,1,0,1599500617,1599500664
665,14423,”Obeležujemo svetovni dan varnosti pacientov”,”Obeležujemo svetovni dan varnosti pacientov, ki bo potekal v znamenju sporočil “Varni zdravstveni delavci, varni pacienti” in “Govorite o varnosti zdravstvenih delavcev”.”,”
Ljubljana, 17. septembra – Danes obeležujemo svetovni dan varnosti pacientov, ki bo potekal v znamenju sporočil “Varni zdravstveni delavci, varni pacienti” in “Govorite o varnosti zdravstvenih delavcev”. Letošnja slogana se osredotočata na medsebojno povezanost med varnostjo zdravstvenih delavcev in pacientov, je zapisano na spletni strani ljubljanskega kliničnega centra.
Svetovna zdravstvena organizacija (WHO) je lani 17. september prvič razglasila za Svetovni dan varnosti pacientov. WHO pa ob letošnjem dnevu predlaga tudi nujne in trajnostne ukrepe vseh zainteresiranih strani, da prepoznajo in investirajo v varnost zdravstvenih delavcev kot prednostno nalogo za varnost bolnikov.
Ob dnevu so na spletni strani Univerzitetnega kliničnega centra (UKC) Ljubljana še opozorili, da so se države članice WHO tudi zavezale, da bodo varnost pacientov priznale kot ključno zdravstveno prednostno nalogo in se strinjale, da bodo ukrepale za zmanjšanje varnostnih odklonov v zdravstvenih ustanovah.
Zdravstvena oskrba zaradi pandemije namreč doživlja največjo krizo na področju varnosti pacientov doslej in povzroča izjemni pritisk na zdravstvene sisteme po vsem svetu.
Zdravstveni sistemi lahko delujejo le z zdravimi zdravstvenimi delavci, za zagotavljanje varne oskrbe pa je ključna usposobljena in motivirana zdravstvena delovna sila, so še zapisali.
Pandemija je tako razkrila velike izzive, s katerimi se srečujejo zdravstveni delavci po vsem svetu. Delo v stresnem okolju pa poveča tudi tveganje za zdravje in varnost zdravstvenih delavcev, zaradi česar so še bolj nagnjeni k napakam, ki bi lahko povzročile škodo pacientu.
Svetovni dan varnosti pacientov bodo obeležili tudi na UKC Ljubljana, kjer bodo med drugim sodelovali številni strokovnjaki. Pred magistratom bodo postavili tudi stojnico z zdravstveno-vzgojnimi vsebinami in promovirali zaščito pred okužbami s predstavitvijo zaščitne opreme.
“,STA,1600327920,1600327920,sl,14423,306,14422,43,0,NULL,,”Obeležujemo svetovni dan varnosti pacientov”,obelezujemo-svetovni-dan-varnosti-pacientov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1600327866,1600327956
666,14425,”S cepljenjem proti HPV bi lahko v Sloveniji letno preprečili vsaj 50 smrti zaradi raka”,”Humani papiloma virusi (HPV), s katerimi se vsaj enkrat v življenju okuži 80 odstotkov spolno aktivnih oseb”,”
Ljubljana, 22. septembra – Humani papiloma virusi (HPV), s katerimi se vsaj enkrat v življenju okuži 80 odstotkov spolno aktivnih oseb, povzročajo genitalne bradavice in različna rakava obolenja. Najpogostejši je rak materničnega vratu, zaradi katerega v Sloveniji letno umre med 40 in 50 žensk. Najučinkovitejša zaščita pred okužbo s HPV je cepljenje, opozarjajo strokovnjaki.
Tako menita tudi ginekologinja Veronika Testen in pediater Denis Baš, ki se med drugim ukvarjata z ozaveščanjem o problematiki okužb z virusi HPV ter pomembnosti preventive in rednih pregledov pri zdravnikih.
Na današnji novinarski konferenci na temo so opozorili na pomen preventive in pregledov tudi v času novega koronavirusa. Zaradi epidemije so bili namreč preventivni programi in odvzemi brisov za nekaj časa ustavljeni, a od začetka maja ponovno potekajo. Kot je povedala Testenova, so ginekologe na državnem preventivnem programu za odkrivanje sprememb na materničnem vratu Zora pozvali, naj skušajo nadoknaditi vse, v dveh mesecih zamujene brise. “Konkretno v Zdravstvenem domu Novo Mesto delamo preko delovnega časa, da smo lahko ponudili dodatne termine, tako da popoldne po pet ur jemljemo brise,” je dejala.
Baš, ki starše šolajočih informira o učinkovitosti cepljenja, je povedal, da so maja ponovno uvedli šolsko zdravstveno sistematiko in od takrat večinoma nadoknadili vsa zamujena cepljenja. Preliminarni podatki za letošnje leto nakazujejo, da bo precepljenost deklic proti okužbi s HPV za minulo šolsko leto vsaj 60 odstotna, kakršna je bila tudi leto prej.
“V zadnjih letih se je odstotek precepljenosti proti HPV v Sloveniji povišal, a če želimo slediti trendom Svetovne zdravstvene organizacije (WHO), smo še kar daleč,” je povedal Baš. Po ciljih WHO bi namreč za izkoreninjenje raka materničnega vratu potrebovali 90-odstotno precepljenost deklic, je dodal. Poleg tega bi z visoko precepljenostjo lahko zmanjšali pojave genitalnih bradavic. V Avstraliji so uspeli precepiti 90 odstotkov deklic in s tem za okrog 80 odstotkov zmanjšati število pojavov genitalnih bradavic med deklicami in dečki, je v zvezi s tem povedala Testenova.
Cepljenje je trenutno v Sloveniji priporočeno za oba spola, a je brezplačno samo za deklice. Tudi zaradi tega prihaja do nesorazmerja med precepljenostjo enega in drugega spola, čeprav virus prenašata oba spola in ima lahko okužba z virusom za oba spola hude posledice. Testenova je povedala, da se zato strokovnjaki že dlje zavzemajo, da bi bilo cepljenje brezplačno tudi za fante.
Po Baševih navedbah je raziskav o posledicah okužbe s HPV pri moških sicer manj, a lahko tudi pri njih na stara leta povzroča raka, denimo na penisu, vratu in glavi. “Če je moški okužen, je večja verjetnost, da bo okužil žensko, kot obratno,” je še dodal Baš pri razlagi, zakaj je cepljenje za moške enako smiselno kot za ženske.
Poleg cepljenja je za zmanjševanje možnosti okužbe s HPV priporočljivo tudi upoštevanje načel varne spolnosti. A nošnja kondomov ne more stoodstotno preprečiti okužbe, saj je zanjo dovolj že tesen stik kože na kožo in stik s sluznico, pri čemer ne gre nujno za spolni odnos s penetracijo, je opozorila Testenova. Baš je dodal, da poleg okužbe tveganje za razvoj nadaljnjih bolezni povečujejo tudi kajenje, nezdrava prehrana in šibek imunski sistem.
Oba sta se strinjala, da je najboljša zaščita pred okužbo cepljenje. K zmanjšanju hudih posledic okužb z virusom pa lahko po njunem mnenju pripomorejo tudi osveščanje o HPV, destigmatizacije okužbe z njim in redni preventivni pregledi.
“,”Jaka Verbic Miklic”,1600755180,1600755180,sl,14425,306,14424,43,0,NULL,,”S cepljenjem proti HPV bi lahko v Sloveniji letno preprečili vsaj 50 smrti zaradi raka”,s-cepljenjem-proti-hpv-bi-lahko-v-sloveniji-letno-preprecili-vsaj-50-smrti-zaradi-raka,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1600928134,1600928298
667,14427,”Brezplačno cepljenje proti gripi letos tudi za majhne otroke”,”Cepljenje proti gripi se bo letos začelo v drugi polovici oktobra”,”
Ljubljana, 23. septembra – Cepljenje proti gripi se bo letos začelo v drugi polovici oktobra, letošnja novost pa je ta, da bodo do brezplačnega cepljenja poleg kroničnih bolnikov, starejših od 65 let, nosečnic in oseb z izrazito povečano telesno težo upravičeni tudi otroci, stari od pol leta do 23 mesecev, so za STA potrdili na NIJZ.
Tem skupinam ljudi bo torej cepljenje proti gripi krilo obvezno zdravstveno zavarovanje. Cepljenje proti gripi priporočajo tudi ostalim prebivalcem, vendar je zanje samoplačniško, so navedli na Nacionalnem inštitutu za javno zdravje (NIJZ).
Zaradi epidemije covida-19 letos zdravstvene oblasti pozivajo k obsežnejšemu cepljenju proti gripi, s čimer želijo preprečiti, da bi ob hkratnih zapletih zaradi gripe, zaradi katere se vsako zimo v bolnišnicah zdravi veliko ljudi, in ponovnem naraščanju števila obolenj za covidom-19 zaradi prezasedenosti odpovedal zdravstveni sistem.
NIJZ je za letošnjo sezono naročil 270.000 odmerkov cepiva proti gripi. Gre za enako cepivo kot v pretekli sezoni – štirivalentno cepivo francoskega proizvajalca.
Po preliminarnih podatkih se je v prejšnji sezoni v Sloveniji proti gripi cepilo 142.842 ljudi, od tega 51.030 kroničnih bolnikov, 716 nosečnic in 7595 zdravstvenih delavcev.
Cepljenje proti gripi za otroke, mlajše od dveh let, priporočajo zato, ker pri njih obstaja večje tveganje za zaplete in posledično bolnišnično zdravljenje. Zapleti vključujejo pljučnico, dehidracijo, encefalopatijo, vnetje srednjega ušesa, lahko pa gripa pri otroku privede tudi do poslabšanja že prej obstoječih kroničnih bolezni, kot so srčna obolenja in astma. Zaradi teh komplikacij se v sezoni gripe znatno poveča tudi poraba antibiotikov, so navedli na NIJZ.
Nosečnicam pa cepljenje proti gripi priporočajo, ker imajo povečano tveganje za hujše zaplete in sprejem v bolnišnico zaradi gripe. To pa zaradi tega, ker začasne spremembe imunskega sistema, srca in pljuč povečajo dovzetnost za hujše bolezni.
Gripa je lahko huda bolezen tudi za novorojenčke, saj njihov imunski sistem še ni popolnoma razvit in se tako težje borijo proti okužbi. Medtem pa če se nosečnica cepi proti gripi, prenesete svojo imunost na otroka in ga tako zaščiti za prvih šest mesecev življenja. Gripa med nosečnostjo pa lahko povzroči tudi prezgodnji porod ali nizko porodno težo novorojenčka.
Na NIJZ so za STA tudi pojasnili, da je bila sezona gripe letos na južni polobli izjemno neznačilna. Zaradi ukrepov za zajezitev novega koronavirusa v Avstraliji, na jugu Afrike in v Južni Ameriki virusa influence skoraj niso zaznali.
Posebno v Avstraliji so ugotavljali, da podatki iz različnih sistemov za spremljanje gripe ne predstavljajo natančnega odseva aktivnosti gripe. “Podatke je treba obravnavati previdno, zlasti kadar jih primerjamo s prejšnjimi sezonami gripe. Pri razlagi podatkov o gripi za sezono 2020 je treba upoštevati vpliv ukrepov socialnega distanciranja, spremembe v vedenju ljudi, ki so v primeru akutne respiratorne okužbe osredotočeni na testiranje na novi koronavirus,” so zapisali.
Ob tem pa so dodali, da upoštevanje trenutnih javnozdravstvenih ukrepov, povezanih s covidom-19, vpliva na prenos akutnih okužb dihal, vključno z gripo.
“,”Jaka Verbic Miklic”,1600841760,1600841760,sl,14427,306,14426,43,0,NULL,,”Brezplačno cepljenje proti gripi letos tudi za majhne otroke”,brezplacno-cepljenje-proti-gripi-letos-tudi-za-majhne-otroke,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1600928282,1600928282
668,14429,”Ob svetovnem dnevu družinske hiperholesterolemije opozorila o prepoznem iskanju pomoči ob zapletih v času pandemije”,”V društvu za zdravje srca in ožilja poudarjajo pomen pravočasnega odkrivanja in zdravljenja zapletov srčno-žilnih bolezni”,”
Ljubljana, 24. septembra – Ob današnjem svetovnem dnevu družinske hiperholesterolemije v društvu za zdravje srca in ožilja poudarjajo pomen pravočasnega odkrivanja in zdravljenja zapletov srčno-žilnih bolezni. Opozarjajo, da je v času pandemije covida-19 po vsem svetu opazno manj ljudi s srčnim infarktom, ki iščejo nujno medicinsko pomoč, pogosto pomoč iščejo tudi prepozno.
Družinska hiperholesterolemija je najpogostejša življenje ogrožujoča dedna motnja presnove, v Sloveniji jo ima ena oseba na 250 prebivalcev. V zadnjih letih v okviru presejalnega programa preiskave holesterola pri otrocih vsako leto odkrijejo vsaj 40 otrok s to motnjo, pri vsakem pa ima družinsko hiperholesterolemijo tudi eden od staršev in pa polovica sorojencev, so sporočili iz Društva za zdravje srca in ožilja Slovenije. Ob tem so opozorili, da je pri nezdravljeni motnji napredovanje ateroskleroze pospešeno tako, da je ogroženost takih oseb več kot 13-krat višja kot med zdravimi vrstniki.
V društvu so Teden družinske hiperholesterolemije, ki so ga začeli deset dni pred današnjim svetovnim dnevom, podaljšali v Mesec družinske hiperholesterolemije in pripravili akcijo, v kateri do 16. oktobra v posvetovalnici za srce na Dalmatinovi 10 v Ljubljani brezplačno opravljajo meritve holesterola v krvi ter svetovanje. Tako lahko posamezniki, ki se morajo na posvet in meritve vnaprej naročiti, ocenijo, kakšno je njihovo morebitno tveganje in tveganje v njihovi družini ter dobijo koristne nasvete, kako ohraniti zdravo srce.
Pomen pravočasnega odkrivanja in zdravljenja zapletov srčno-žilnih bolezni, ki zelo pogosto prizadenejo prav ljudi z družinsko hiperholesterolemijo, so v društvu izpostavili tudi v luči pandemije covida-19. Mnogi namreč tudi ob zapletih pomoč iščejo prepozno, kar povzroča veliko dodatnih smrti ali slabših izhodov zdravljenja, ki bi jih bilo mogoče preprečiti, so opozorili. Izpostavili so geslo vseevropske akcije: “Ko tvoje srce reče, pojdi! #JustGo.”.
Kot so pojasnili v društvu, je treba ob pojavu alarmnih znakov, na primer bolečine za prsnico, ki ne mine v 10-15 minutah oziroma po dveh odmerkih nitroglicerina, pomisliti na možni akutni srčni infarkt, nato pa nujno hitro ukrepati s klicem nujne medicinske pomoči. “Če preiskave potrdijo, da gre za srčni infarkt, bo le hitro zdravljenje preprečilo ali omililo škodo na srčni mišici in s tem povečalo možnost preživetja in dobrega okrevanja,” so navedli. Pozvali so, da pri nobeni od resnih zdravstvenih težav v času epidemije ne ostajajmo doma, ampak poiščimo zdravniško pomoč. Od vlade in zdravstvenih oblasti pa v društvu pričakujejo, da oblikujejo takšne ukrepe za obvladovanje covida-19, ki ne bodo še naprej odvračali akutnih bolnikov od iskanja nujne zdravniške pomoči.
Tudi predsednik društva Matija Cevc, sicer zdravnik na kliničnem oddelku za žilne bolezni Univerzitetnega kliničnega centra (UKC) Ljubljana, je na novinarski konferenci prejšnji teden pojasnil, da je bilo v času epidemije bistveno manj pregledov zaradi možganske kapi, prav tako pa tudi več amputacij nog zaradi žilnih zapletov, ker so ljudje z obiskom zdravnika odlašali, dokler ni bilo prepozno. Urh Grošelj s kliničnega oddelka za endokrinologijo, diabetes in presnovne bolezni na Pediatrični kliniki UKC Ljubljana je prepričan, da tu ne gre samo za nalogo oblasti, ampak se mora pomena pravočasnega obiska zdravnika zavedati vsak posameznik. Če začnejo bolezen zdraviti dovolj zgodaj, lahko po njegovih besedah ne le omogočijo posameznikom preživetje, ampak tudi preprečijo zaplete, ki jih lahko bolezen povzroča.
“,”Jaka Verbic Miklic”,1600955340,1600955340,sl,14429,306,14428,43,0,NULL,,”Ob svetovnem dnevu družinske hiperholesterolemije opozorila o prepoznem iskanju pomoči ob zapletih v času pandemije”,ob-svetovnem-dnevu-druzinske-hiperholesterolemije-opozorila-o-prepoznem-iskanju-pomoci-ob-zapletih-v-casu-pandemije,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1601387441,1601387994
669,14431,”ZN: Pandemija ogroža napredek na področju zdravja žensk in otrok”,”V minulem desetletju je bil dosežen izjemen napredek pri izboljšanju zdravja žensk, otrok in mladostnikov po svetu”,”
New York, 25. septembra – V minulem desetletju je bil dosežen izjemen napredek pri izboljšanju zdravja žensk, otrok in mladostnikov po svetu, ki pa ga ogrožajo pandemija covida-19, konflikti in podnebna kriza, v zadnjem poročilu opozarjajo Unicef, Svetovna zdravstvena organizacija (WHO) in Sklad ZN za prebivalstvo.
Umrljivost otrok, mlajših od pet let, je po podatkih Unicefa leta 2019 dosegla rekordno nizko raven, v zadnjem desetletju pa je bila cepljena več kot milijarda otrok. Globalna pokritost s cepljenjem, prisotnost babic ob porodu in dostop do pitne vode je dosegel več kot 80 odstotkov, so sporočili iz Unicefa.
Umrljivost mater se je od leta 2000 zmanjšala za 35 odstotkov. V zadnjem desetletju je bilo preprečenih tudi 25 milijonov otroških porok.
Vendar pa zlasti pandemija poglablja neenakost pri dostopu najranljivejših do osnovnih življenjskih storitev – motnje v ključnih zdravstvenih storitvah imajo najbolj uničujoč vpliv na najbolj ranljive ženske in otroke. Na vrhuncu pandemije so bile šole zaprte v 192 državah, kar je prizadelo učni proces 1,6 milijarde učencev. Povečalo se je nasilje v družini in zloraba deklet ter žensk. Prav tako naraščata revščina in podhranjenost, opozarja Unicef.
Že pred pandemijo covida-19 je vsakih šest sekund na svetu umrl otrok, mlajši od pet let, je opozorila izvršna direktorica Unicefa Henrietta Fore. Milijoni otrok, ki živijo na konfliktnih območjih in v nestabilnih okoljih, se v času pandemije srečujejo s še večjimi težavami.
Unicef opozarja, da je leta 2019 zaradi vzrokov, ki bi jih bilo mogoče preprečiti, umrlo 5,2 milijona otrok, mlajših od pet let, in milijon mladostnikov. Vsakih 13 sekund je umrl novorojenček. Vsako uro 33 žensk ni preživelo poroda in 33.000 deklic je bilo vsak dan prisiljenih v poroke, običajno z veliko starejšimi moškimi.
Brez okrepljenih prizadevanj v boju proti umrljivosti otrok zaradi vzrokov, ki jih je mogoče preprečiti, bi lahko med leti 2020 in 2030 umrlo 48 milijonov otrok, mlajših od pet let, skoraj polovica teh smrti bo med novorojenčki, opozarja Unicef.
“Nobenega dvoma ni, da je pandemija močno ohromila globalna prizadevanja za izboljšanje zdravja in blaginje žensk ter otrok, vendar bi to moralo le še okrepiti našo odločnost,” je opozoril generalni direktor WHO Tedros Adhanom Ghebreyesus.
“,”Jaka Verbic Miklic”,1601042220,1601042220,sl,14431,306,14430,43,0,NULL,,”ZN: Pandemija ogroža napredek na področju zdravja žensk in otrok”,zn-pandemija-ogroza-napredek-na-podrocju-zdravja-zensk-in-otrok,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1601387876,1601387983
670,14435,”Svetovni dan kontracepcije tudi kot opomnik za zdravo spolnost”,”Svetovni dan kontracepcije, ki je namenjen ozaveščanju o kontracepcijskih možnostih”,”
Ljubljana, 26. septembra – Danes obeležujemo svetovni dan kontracepcije, ki je namenjen ozaveščanju o kontracepcijskih možnostih, izboljšanju spolnega zdravja in oblikovanju sveta, v katerem je vsaka nosečnost zaželena. Letos je v ospredju pomen izbere varne in učinkovite kontracepcijske metode pri ženskah, ki imajo kronične nenalezljive in druge bolezni.
Na svetu je po ocenah letno 211 milijonov nosečnosti, od teh 40 odstotkov neželenih; polovica se konča s prekinitvijo nosečnosti. Vsako leto rodi 16 milijonov deklet med 15. in 19. letom ter milijon deklet, mlajših od 15 let. Predstavljajo veliko ranljivost in tveganje za usodne zaplete, so zapisali na spletni strani Nacionalnega inštituta za javno zdravje (NIJZ).
Še zlasti za mlade je pomembno, da so dobro informirani in lahko sprejemajo odločitve o svojem spolnem in reproduktivnem zdravju. “Zaželeno je, da se par skupaj odloča o primernem načinu zaščite in času za spočetje otroka. Posebej pa je pomembno, da ženske poznajo vse možnosti kontracepcije, si izberejo metodo, ki jim najbolj ustreza ter s tem prispevajo h kvalitetnemu, polnem in dostojanstvenem življenju. Zdrava in varna spolnost namreč pomembno vpliva na kakovost našega življenja,” so navedli.
Letošnje leto strokovna javnost poudarja pomen izbire primerne, varne in učinkovite kontracepcijske metode pri ženskah, ki imajo kronične nenalezljive in druge bolezni. Kontracepcije, ki vsebujejo estrogene, se morajo na primer izogibati ženske, ki so imele infarkt ali krvni strdek.
Kontracepcija je zelo pomembna za zdravo spolnost. Kot ocenjujejo na NIJZ, je zaskrbljujoče, da več kot četrtina spolno aktivnih parov pri nas ne uporablja nobene metode kontracepcije. Najbolj poznani in uporabljeni kontracepcijski metodi v Sloveniji sta sicer kondom in hormonske kontracepcijske tablete.
Okoli tri četrtine mladih se pri prvem spolnem odnosu zaščitijo s kondomom, kar je najbrž rezultat dolgoletne tradicije osveščanja in kampanj proti okužbi s hivom, ugotavljajo na NIJZ. “S ‘spolno kariero’ uporaba kondoma drastično pade, tudi z nastopom partnerstev. Zaradi spolno prenosljivih bolezni je to lahko problematično, saj opažamo fenomen zaporednih resnih zvez, tudi več v enem letu,” so zapisali.
Kot opozarja Svetovna zdravstvena organizacija, je oralna kontracepcija zelo zanesljiva metoda preprečevanja neželene nosečnosti, ne ščiti pa pred okužbami s spolno prenosnimi boleznimi. Zato še posebno mladim in zlasti vsem tistim, ki menjujejo spolne partnerje, poleg uporabe hormonske kontracepcije priporočajo t. i. dvojno zaščito s sočasno uporabo kondoma.
Po podatkih NIJZ 31 odstotkov parov v rodni dobi, ki ne načrtujejo nosečnosti, pri zadnjem spolnem odnosu ni uporabilo nobene metode kontracepcije. Na leto v Sloveniji zabeležimo okoli osem umetnih prekinitev nosečnosti na 1000 žensk v rodni dobi, najpogosteje pri ženskah, ki so predhodno že rodile, zato je zelo pomembno načrtovanje družine tudi po porodu, poziva NIJZ.
“,”Jaka Verbic Miklic”,1601103360,1601103360,sl,14435,306,14434,43,0,NULL,,”Svetovni dan kontracepcije tudi kot opomnik za zdravo spolnost”,svetovni-dan-kontracepcije-tudi-kot-opomnik-za-zdravo-spolnost,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1601881126,1601881127
672,14439,”Gantar: Za skrajševanje čakalnih dob iz proračuna letos 14 milijonov evrov”,”Za skrajševanje čakalnih dob je v letošnjem letu namenjenih 14 milijonov evrov”,”
Ljubljana, 28. septembra – Za skrajševanje čakalnih dob je v letošnjem letu namenjenih 14 milijonov evrov, v naslednjem letu pa 28 milijonov, je minister za zdravje Tomaž Gantar pojasnil v izjavi ob robu podelitve priznanj Moj zdravnik 2020. Kot je dejal, gre za proračunska sredstva, in ne sredstva iz zdravstvene blagajne Zavoda za zdravstveno zavarovanje Slovenije (ZZZS).
Poleg proračunskih sredstev so tu še sredstva iz zdravstvene blagajne, ki jih bodo z aneksom k splošnemu dogovoru v zdravstvu zagotovili za širitve programov. To je po Gantarjevi oceni bolj stimulativen način financiranja izvajalcev v specialističnih ambulantah.
Financiranje preko aneksa k splošnemu dogovoru je namenjeno tistim izvajalcem zdravstvenih storitev, ki imajo redne pogodbe z ZZZS. Za sredstva, ki bodo zagotovljena za skrajševanje čakalnih dob v okviru petega protikoronskega paketa, pa se bodo lahko potegovali tudi zasebniki, ki niso vključeni v javni zdravstveni sistem, je pojasnil minister.
Iz protikoronskega paketa bodo financirali posamične storitve, za katere so čakalne dobe najdaljše, a točne opredelitve še pripravljajo, je pristavil Gantar.
Na očitke, da bo to korak proti privatizaciji zdravstva, Gantar odgovarja, da največja privatizacija v tem smislu poteka že sedaj, ko ljudje plačujejo veliko denarja, da pridejo do zdravnika. Po novem pa bodo pri tistem zdravniku, tudi zasebniku, ki mu danes plačajo – če bo vključen v ta program -, imeli brezplačen pregled enako kot v javnem sistemu, je orisal Gantar.
Prepričan je, da gredo s tem na roko predvsem bolnikom. Ta ukrep bo po njegovih navedbah časovno omejen, in ne trajna rešitev.
Odgovarjal je tudi na vprašanje o morebitnih dodatnih pooblastilih zdravstvenih inšpektorjev in možnosti nadzorovanja zasebnih druženj. “Mislim, da je to v celoti nedorečeno, pogoji za nadzor nad zasebnimi prostori so z zakonom dokaj jasni in mislim, da to ne bo potekalo na tak način,” je ocenil.
“,”Jaka Verbic Miklic”,1601276580,1601276580,sl,14439,306,14438,43,0,NULL,,”Gantar: Za skrajševanje čakalnih dob iz proračuna letos 14 milijonov evrov”,gantar-za-skrajsevanje-cakalnih-dob-iz-proracuna-letos-14-milijonov-evrov,Post,,1,0,1601881482,1601881482
673,14441,”Demenca mora po opozorilu s strokovnega srečanja priti na dnevni red politike”,”Demenca zaradi staranja prebivalstva postaja vse večji problem”,”
Ljubljana, 28. septembra – Demenca, ki zaradi staranja prebivalstva postaja vse večji problem, mora priti na dnevni red politike, so med drugim pozvali na današnjem spletnem strokovnem srečanju o izzivih na področju Alzheimerjeve bolezni. Iskanje zdravila zanjo pa se zaradi težav, povezanih z epidemijo novega koronavirusa, po njihovem prepričanju ne sme ustaviti.
Diagnoza Alzheimerjeva bolezen ne pomeni konca življenja, je poudarila Mercedes Lovrečič z Nacionalnega inštituta za javno zdravje (NIJZ). Zdrav življenjski slog, ohranjanje socialnih stikov in obvladovanje stresa lahko pripomorejo k daljši produktivnosti in ohranjanju zadovoljstva v življenju, je dejala. Po ocenah naj bi bilo v Sloveniji leta 2030 med starimi 65 let ali več 37.500 ljudi z demenco, medtem ko jih je bilo leta 2018 28.100, je povedala na srečanju o izzivih na področju Alzheimerjeve bolezni v Sloveniji skozi prizmo problematike covida-19. Organizirali so jo NIJZ, Znanstvenoraziskovalni center Slovenske akademije znanosti in umetnosti in Spominčica – Alzheimer Slovenija.
Ministrstvo za zdravje pripravlja strategijo obvladovanja demence v Sloveniji 2020-2030, ki naj bi jo v javno razpravo poslali decembra. Dokument bo poudaril pomen zgodnje diagnoze, je pojasnila Nadja Čobal z ministrstva. Pripravljavci dokumenta imajo tokrat po njenih besedah sicer lažje delo kot pripravljavci prejšnje strategije, saj je predlog zakona o dolgotrajni oskrbi že v javni razpravi, resolucija o nacionalnem programu duševnega zdravja 2018-2028 pa je sprejeta.
Janja Romih z ministrstva za delo, družino, socialne zadeve in enake možnosti je dejala, da je področje demence med prioritetami razpisov na ministrstvu, kjer želijo denimo zagotoviti dovolj mest v institucionalnem varstvu. Med epidemijo so bili stanovalci z demenco v domovih v veliki stiski, ker niso vedeli, kaj se dogaja in zakaj ne morejo videti svojcev, je poudarila. Kot problem so se pokazali tudi prostorski pogoji in kadrovska stiska med negovalnim osebjem. Vlada je z interventnimi ukrepi že zagotovila 29 milijonov evrov za dodatne zaposlitve v prihodnjih dveh letih.
Na današnjem srečanju so sodelovali tudi evropski poslanci Irena Joveva (Renew/LMŠ), Milan Brglez (S&D/SD), Ljudmila Novak (EPP/NSi)in Romana Tomc (ELS/SDS), ki so izrazili podporo prizadevanjem za manj demence tako v Sloveniji kot EU. Organizacija Alzheimer Europe je po besedah Joveve pripravila predloge za zagotovitev enakega dostopa do potrebne oskrbe in za zmanjšanje birokracije.
Omenjena organizacija je prav tako pozvala države članice EU k zagotovitvi zadostnih sredstev za raziskave, ki bi privedle do zdravila za demenco in so zdaj ustavljene, je dejala Novakova. Tudi po mnenju Tomčeve raziskovanje za cepivo proti covidu-19 ne sme ohromiti raziskovanj za druga zdravila. Sicer pa bo denar tudi za področje demence na evropski ravni zagotovljen v okviru programa EU for health, prav tako pa je predviden v programu Obzorje 2020, je spomnila.
Brglez je izrazil upanje, da se bo zakon o dolgotrajni oskrbi v Sloveniji še spremenil, saj zdaj osebe z demenco vključuje le v delu, ki se nanaša na varovane oddelke. “To je premalo in če bo tako ostalo, zakon ne bo imel takšne legitimnosti, kot jo potrebuje,” je dejal.
“,”Jaka Verbic Miklic”,1601276700,1601276700,sl,14441,306,14440,43,0,NULL,,”Demenca mora po opozorilu s strokovnega srečanja priti na dnevni red politike”,demenca-mora-po-opozorilu-s-strokovnega-srecanja-priti-na-dnevni-red-politike,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1601881575,1601881575
674,14443,”Moja zdravnica 2020 je ginekologinja Hatije Ismaili”,”Letošnja dobitnica naziva Moja zdravnica je ginekologinja Hatije Ismaili”,”
Ljubljana, 28. septembra – Letošnja dobitnica naziva Moja zdravnica je ginekologinja Hatije Ismaili. Podelitev laskavih nazivov zdravnikom, ki jo tradicionalno prireja revija Viva, je potekala danes v ljubljanskem Cankarjevem domu. Govornik je bil minister za zdravje Tomaž Gantar, nagrajence pa je po podelitvi v predsedniški palači sprejel predsednik republike Borut Pahor.
Dobitnica naziva Moja zdravnica 2020 Ismailijeva se je v Slovenijo preselila pred 17 leti, po študiju medicine na hrvaški Reki. Kot ginekologinja se je zaposlila v novomeški splošni bolnišnici, kjer še vedno dela. Kot je dejala na današnji podelitvi, ji priznanje pomeni zelo veliko, jo pa hkrati tudi zavezuje, da svoje znanje nadgrajuje, da se posveti morebitnim napakam, jih odpravi in postane še boljša.
Ismailijeva je poudarila, da verjetno pacientke še bolj kot strokovno opravljena operacija, prisotnost in pomoč v porodnišnici prepriča njeno zanimanje za celotno zgodbo njihovega življenja. Dodala je, da se je svojih pacientk najbrž dotaknila prav z osebnim pristopom in iskreno željo po tem, da bi jim lahko celostno pomagala, ne le kot zdravnica, ampak kot človek.
Tokratni izbor Moj zdravnik je bil že 24. po vrsti. Bralci revije Viva so preko spleta ali po pošti skupaj oddali 2014 glasovnic zdravnikom različnih specialnosti, ki so jih organizatorji razvrstili v deset kategorij: družinski zdravnik, pediater, ginekolog, onkolog, zobozdravnik, urolog, kardiolog, nevrolog, oftalmolog in ortoped.
Bralci so Ismailijevo izbrali za Mojo ginekologinjo, ker pa je prejela največ glasov, je postala tudi Moja zdravnica leta 2020. Moja družinska zdravnica je postala Mirela Mićić Despotović, Moj zobozdravnik za leto 2020 je Rok Jurca, pediater je Denis Baš, onkolog Marko Hočevar, urolog Simon Hawlina, nevrologinja Lidija Žitnik, oftalmologinja Brigita Cvetko, naziv Moj kardiolog sta dobila dva: Igor Krajnc in Vojko Kanič, Moj ortoped 2020 pa je Gregor Kavčič.
Minister Gantar je sicer v govoru poudaril, da so dobitniki priznanj izjemni posamezniki, ki delujejo povezujoče, vlivajo optimizem in tudi zaupanje v zdravstvo. Prireditev Moj zdravnik po njegovih besedah vsako leto izpostavi posameznike, ki v zdravstvenem sistemu pomenijo ogromno. Opozoril je, da je epidemija covida-19 še dodatno izpostavila pomen sodelovanja in multidisciplinarnega pristopa bolniku.
Tudi predsednica komisije za podelitev priznanj Maja Kozlevčar Živec je v nagovoru poudarila ključni pomen dobrega sodelovanja zdravnikov in njihovih varovancev. Orkan virusa je po njenih besedah tudi v Sloveniji močno zamajal organizacijo zdravstva. “Zavedli smo se, da tudi zdravi s svojim odgovornim ravnanjem ščitimo ne le sebe, ampak tudi svojce, bolne in ogrožene, in kako pomembno je delovanje na preventivnem področju, da je nato zdravljenja čim manj,” je še dodala.
Predsednik Pahor je na sprejemu v predsedniški palači čestital nagrajenkam in nagrajencem ter organizatorjem akcije, s katero bolniki lahko z veseljem povedo, da imajo zdravnike radi. Navzočim zdravnicam in zdravnikom se je posebej zahvalil za pomembno družbeno poslanstvo, ki ga opravljajo, obenem pa je posebej opozoril tudi na vlogo politike pri zagotavljanju ustreznih pogojev za njihovo delo, so sporočili iz urada predsednika.
“Dozoreti mora spoznanje, da je sredi najtežjih okoliščin, ki smo jim sedaj priča, treba v političnem razredu ob veliki pomoči stroke razmišljati o strukturnih spremembah, potrebnih za to, da bo lahko ta sistem v času sedanje krize in zlasti po njej deloval tako, da ne bomo imeli neustreznih čakalnih dob in drugih strukturnih problemov, s katerimi se soočamo,” je pozval Pahor. Opozoril je, da bi bile prepozno uveljavljene spremembe v škodo bolnikov, čemur se moramo v celoti izogniti.
“,”Jaka Verbic Miklic”,1601276760,1601276760,sl,14443,306,14442,43,0,NULL,,”Moja zdravnica 2020 je ginekologinja Hatije Ismaili”,moja-zdravnica-2020-je-ginekologinja-hatije-ismaili,Post,,1,0,1601881668,1601881669
675,14445,”Ob svetovnem dnevu srca poziv k zdravemu življenjskemu slogu”,”Današnji svetovni dan srca pod geslom Prepreči”,”
Ljubljana, 29. septembra – Današnji svetovni dan srca pod geslom Prepreči spodbuja k zdravemu življenjskem slogu, ki zmanjšuje tveganje za nastanek srčno-žilnih bolezni. K temu spodbujajo tudi aktivnosti Društva za zdravje srca in ožilja Slovenije, sami pa moramo sprejeti odločitve in se odpraviti po poti do zdravja in zdravega srca.
Bolezni srca in ožilja so še vedno največje breme za sodobno človeštvo, pa čeprav se v zadnjem letu govori samo o covidu-19 in se bojimo predvsem novega virusa. Še več, srčnim bolnikom ta še dodatno povečuje tveganje, opozarjajo v društvu. “Nočemo omalovaževati tveganj, ki jih predstavlja novi virus, toda ne smemo pozabiti, da zaradi srčno-žilnih bolezni umre 10-krat več ljudi kot zaradi okužbe z novim koronavirusom, zato ne smemo nikoli zanemariti pozornosti do svojega srca in ožilja,” poudarjajo.
Bolezni srca in ožilja so najpogostejši povzročitelj smrti na svetu. Vsako leto zaradi teh bolezni, ki vključujejo tudi možgansko kap, umre okoli 18 milijonov ljudi po vsem svetu. Najpogostejši vzrok so nezdrav način življenja, kajenje, sladkorna bolezen in visok krvni tlak, opozarja predsednik društva Matija Cevc. Zato je najučinkovitejša in tudi najcenejša preventiva po njegovem prepričanju izogibanje nezdravim življenjskim navadam ter spodbujanje zdravega življenjskega sloga že pri naših najmlajših.
Kot izpostavljajo v društvu, ob tem dnevu ne smemo pozabiti tudi na sladkorno bolezen, ki je tesno povezana s srčno-žilnimi boleznimi in predstavlja enega od pomembnejših dejavnikov tveganja za zaplete. Kot vsi kronični bolniki, naj bi tudi sladkorni bolniki dosledno skrbeli za urejen krvni sladkor in redne obiske pri zdravniku tudi v času covida-19. “Vztrajanje pri skrbi zase lahko edino zares varuje osebo s sladkorno boleznijo pred zapleti malih in velikih žil,” še dodajajo v društvu.
Danes bodo v organizaciji društva po vsej državi potekale prireditve, osrednja pa bo tradicionalno na ljubljanskem Prešernovem trgu.
Na nujnost zagotavljanja ustreznih in strokovnih ukrepov obravnave srčno-žilnih bolnikov tudi v času epidemije, so v sporočilu za javnost opozorili tudi v Koronarnem klubu Ljubljana. Izpostavili so, da so srčno-žilne bolezni glavni razlog smrti v sodobni družbi, pri katerih hitro delovanje in zgodnje odkrivanje lahko pripomorejo k zmanjševanju smrtnosti in zapletov. Opozorili so tudi na pomen dolgoročne podpore osebam po srčno-žilnem dogodku in družbeni vpliv srčno-žilnih obolenj, ki poleg bolnikov močno zaznamujejo tudi svojce in okolico.
“Celovit program, ki ga izvajamo v klubu, vključuje različne metode rehabilitacijske vadbe, zdravstvene posvete s kardiologinjo in diplomirano medicinsko sestro ter psihoterapijo,” je v izjavi za javnost navedla predsednica kluba Petra Simpson Grom. Dodala je, da je sistemska podpora pri dolgoročnem delu s kroničnimi bolniki v Sloveniji slabo regulirana in prepuščena družbi, zato nevladne organizacije opravljajo pomembno delo. “Pomembno je, da naša država premisli o prioritetah in odgovorni porabi proračunskih sredstev, kot odziv na ‘duh časa’ in potrebe bolnikov,” so njeno izjavo še povzeli v sporočilu za javnost.
“,”Jaka Verbic Miklic”,1601363280,1601363280,sl,14445,306,14444,43,0,NULL,,”Ob svetovnem dnevu srca poziv k zdravemu življenjskemu slogu”,ob-svetovnem-dnevu-srca-poziv-k-zdravemu-zivljenjskemu-slogu,Post,,1,0,1601881773,1601881773
676,14447,”Precepljenost v državi naj bi bila v prihodnje večja”,”Precepljenost predšolskih otrok je padla že na 93 odstotkov, medtem ko meja za razvoj kolektivne imunosti znaša 95 odstotkov.”,”
Ljubljana, 30. septembra – Precepljenost v državi naj bi bila v prihodnje večja, saj bo le tako mogoče zagotavljati kolektivno zdravje. Precepljenost predšolskih otrok je padla že na 93 odstotkov, medtem ko meja za razvoj kolektivne imunosti znaša 95 odstotkov.
Z namenom, da bi precepljenost zvišali, je DZ v torek sprejel novelo zakona o nalezljivih boleznih, ki jo je v zakonodajni postopek vložila skupina poslancev iz SMC, SDS in DeSUS. Sprejeta je bila s 67 glasovi za in 12 proti.
Novela omejuje vključitev necepljenih otrok v javne in javno sofinancirane vrtce. Vključitev necepljenega otroka v tak vrtec se zavrne, če ni bil cepljen proti ošpicam, mumpsu in rdečkam, pa za to ni medicinskih razlogov. Lahko pa se vključi otrok, ki je v postopku pridobitve odločbe o opustitvi cepljenja.
Kandidati, ki se vpisujejo v programe srednjih in visokošolskih zavodov ter fakultet s področja zdravstva, vzgoje in izobraževanja ter socialnega varstva, morajo ob vpisu imeti opravljeno cepljenje v skladu s programom cepljenja, ki je v zakonu že opredeljen. Gre za program, ki ga določi minister, pristojen za zdravje, na predlog Nacionalnega inštituta za varovanje zdravja. Če kandidat ni opravil tega cepljenja, se mu vpis zavrne. Izjema so tisti, pri katerih za opustitev cepljenja obstajajo medicinski razlogi.
Novela določa tudi optimizacijo postopka za ugotavljanje razlogov za opustitev cepljenja, s čimer bi razbremenili delo komisije za cepljenje.
Odbor DZ za zdravstvo je v predlog vnesel nekaj dopolnil, s katerimi je tudi umaknil sprva predlagano določbo o obveznem cepljenju zdravstvenih delavcev denimo proti sezonski gripi. Vlada je zatrdila, da podpira prizadevanje za visoko precepljenost zaposlenih v javni zdravstveni mreži in socialno varstvenih zavodih. Ima pa zadržek do prepovedi dela z bolniki oziroma varovanci za zaposlene v javni zdravstveni mreži in socialnovarstvenih ustanovah, ki niso popolno cepljeni. Takšna prepoved bi lahko imela neželene učinke glede na kadrovsko podhranjenost v zdravstvu in socialnem varstvu, sploh glede na širjenje okužb z novim koronavirusom, je posvarila.
DZ je v skladu s to usmeritvijo v torek zavrnil dopolnilo LMŠ, da morajo biti zaposleni v javni zdravstveni mreži ali javnih socialno varstvenih zavodih za opravljanje svojega dela cepljeni proti ošpicam, mumpsu, rdečkam, oslovskemu kašlju in hepatitisu B, redno pa morajo opravljati tudi cepljenje proti sezonski gripi.
“,”Jaka Verbic Miklic”,1601450220,1601450220,sl,14447,306,14446,43,0,NULL,,”Precepljenost v državi naj bi bila v prihodnje večja”,precepljenost-v-drzavi-naj-bi-bila-v-prihodnje-vecja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1601882307,1601882308
677,14449,”Pred rožnatim oktobrom izpostavili pomen rednega samopregledovanja in zgodnjega odkrivanja raka dojk”,”V Združenju Europa Donna Slovenija izpostavili pomen rednega mesečnega samopregledovanja in zgodnjega odkrivanja raka.”,”
Ljubljana, 30. septembra – Pred rožnatim oktobrom, mesecem ozaveščanja o raku dojk, so v Združenju Europa Donna Slovenija izpostavili pomen rednega mesečnega samopregledovanja in zgodnjega odkrivanja raka. To je ključno za manj obremenjujoče zdravljenje, zato tudi med epidemijo covida-19 ne smemo pristati na slabši dostop do zdravstva in pravočasne diagnostike, so opozorili.
Združenje Europa Donna Slovenija, ki si že vrsto let prizadeva širšo slovensko javnost opozoriti na to, da smo za svoje zdravje v prvi vrsti odgovorni sami, bo letošnji rožnati mesec zaznamovalo s sloganom Dotik pove največ, ki opozarja na pomen rednega mesečnega samopregledovanja in zgodnjega odkrivanja raka dojk, so zapisali.
Ženske so zato pozvali, naj se tudi med epidemijo odzivajo na presejalni program za raka dojk Dora in naj bodo pozorne na morebitne zdravstvene težave. “Če odkrijemo sumljive spremembe, pa je treba vztrajati in priti do zdravnika, ki vas bo napotil na nadaljnje preiskave, če bo presodil, da je to potrebno,” so navedli v združenju Europa Donna.
Namestnica vodje programa Dora Kristijana Hertl je na današnji novinarski konferenci spomnila, da so bili ob razglasitvi epidemije sredi marca zaustavljeni tudi presejalni programi za raka. Program Dora so na Onkološkem inštitutu Ljubljana nato ponovno zagnali konec maja in v začetku junija v vseh ostalih presejalnih centrih. Podatki kažejo, da je udeležba žensk, število vabljenih žensk na dodatne obravnave in odkritih rakov v programu na ravni pred epidemijo.
Z odzivom žensk po skoraj štirih mesecih ponovnega delovanja programa so zadovoljni. Od ponovnega začetka slikanja žensk do konca avgusta so slikali 29.358 žensk, udeležba je bila 76-odstotna. Zaradi sumljivih sprememb na mamografskih slikah so jih 920 povabili na dodatne diagnostične obravnave. Pri okoli 90 ženskah, ki so opravile dodatne obravnave, so odkrili raka dojk. Številka še ni dokončna, saj obravnave še niso končane.
“Ženskam svetujemo, da zaradi strahu pred novim koronavirusom ne opustijo možnosti zgodnjega odkrivanja raka. Opuščanje udeležbe v presejalnih programih ima lahko resne posledice za zdravje,” so besede Hertlove povzeli v sporočilu za javnost. Priporoča jim redno udeleževanje mamografij v programu Dora, kjer so z ukrepi poskrbeli za varno obravnavo žensk. Med dvema mamografijama z normalnim izvidom naj si redno mesečno pregledujejo dojke. Če bi opazile kakršnekoli spremembe, naj se obrnejo na svojega osebnega zdravnika ali ginekologa, ki jih bo napotil v ambulanto za bolezni dojk.
“Letošnje leto je pokazalo, da dostop do zdravstva in pravočasne diagnostike ni samoumeven. Zato moramo biti še toliko bolj pozorni na svoje telo in morebitne spremembe,” je poudarila tudi predsednica Združenja Europa Donna Slovenija Tanja Španić. Kot je še dejala, naj strah pred koronavirusom ne vpliva na odločitev glede obiska zdravnika. Če bi pa naleteli na težave ali se znašli v stiski, pa v združenju ponujajo pomoč prek svetovalnih telefonov.
“,”Jaka Verbic Miklic”,1601451300,1601451300,sl,14449,306,14448,43,0,NULL,,”Pred rožnatim oktobrom izpostavili pomen rednega samopregledovanja in zgodnjega odkrivanja raka dojk”,pred-roznatim-oktobrom-izpostavili-pomen-rednega-samopregledovanja-in-zgodnjega-odkrivanja-raka-dojk,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1601883422,1601883422
678,14451,”Za uspešno zdravljenje astme pomembno sodelovanje bolnika in zdravnikov”,”Astma je ena od najpogostejših kroničnih pljučnih bolezni, za katero boleha približno 16 odstotkov Slovencev.”,”
Ljubljana, 30. septembra – Astma je ena od najpogostejših kroničnih pljučnih bolezni, za katero boleha približno 16 odstotkov Slovencev. Večina bolnikov, ob izpolnjevanju določenih pogojev, lahko živi dolgo in kvalitetno življenje. Po oceni strokovnjakov pa je pri tem pomembno tesno sodelovanje bolnika in zdravnikov. Predvsem pa je treba biti pozoren do simptomov bolezni.
Na novinarski konferenci, ki sta jo ob kampanji Življenje z astmo – Kaj sporočajo vaša pljuča, ki v teh dneh poteka v Sloveniji, pripravili Združenje pnevmologov Slovenije in Društvo pljučnih in alergijskih bolnikov Slovenije, je specialistka pulmologinja z Univerzitetne klinike za pljučne bolezni in alergijo Golnik Sabina Škrgat Kristan pojasnila, da je astma kronično vnetje malih in velikih dihalnih poti, stopnja njene težavnosti pa je v pomembni meri odvisna od stopnje vnetja na ravni dihalne poti.
To oži dihalne poti in ovira pretok zraka, kar bolniku otežuje dihanje. Astma ima lahko alergijsko ali nealergijsko ozadje. Simptomi astme pa so težko dihanje, kašelj, tiščanje v prsih in piskajoče dihanje.
Nezdravljena astma lahko pri nekaterih ljudeh vodi v preoblikovanje dihalnih poti in trajno okvaro pljuč. Ob hudem poslabšanju astme lahko bolniki tudi umrejo, a je zaradi sodobnega zdravljenja teh primerov bistveno manj kot v preteklosti, je poudarila. Pomembno je, kakšen podtip astme bolnik ima, saj se na podlagi tega pulmologi odločijo za najprimernejši način zdravljenja, je dodala.
Izpostavila je, da sodobni načini zdravljenja omogočajo boljše rešitve za bolnike z astmo. “Po uvedbi inhalacijskih glukokortikoidov, ki so sedaj temelj zdravljenja astme, je na globalni ravni prišlo do upada smrtnosti. Zgodila se je prava revolucija. Aplikacija zdravila z vdihovalnikom ima manj stranskih učinkov, saj zdravilo ostane v območju tarčnega organa, to je v našem primeru v dihalnih poteh, in ne obremenjuje drugih organov,” je pojasnila Škrgat Kristanova. Za bolnike z najtežjimi oblikami astme pa so na voljo t. i. biološka zdravila.
Za pomoč pri jemanju bioloških zdravil je sedaj na voljo tudi aplikacija. “Bolnike v ambulanti poučimo, kako aplicirati zdravilo, in jih nato spremljamo,” je povedala diplomirana medicinska sestra Mariana Paula Rezelj. Opažajo, da bolniki radi prihajajo v ambulanto, sami pravijo, kako se jim je na ta način izboljšala kvaliteta življenja, da se počutijo kot “novi”.
Za lajšanje življenje ljudem z astmo in alergijami od leta 1991 deluje tudi Društvo pljučnih in alergijskih bolnikov Slovenije. “Društvo ima 3600 do 3800 članov, združuje pa bolnike z boleznimi dihal in alergijskimi boleznimi, njihove svojce in zdravstvene delavce na območju celotne Slovenije,” je dejal predsednik društva Mirko Triller. Med dejavnostmi društva je tudi izobraževanje za astmatične bolnike, ki po njegovih besedah poteka dobro. A kot ugotavlja, je največ težav pri jemanju terapevtskih zdravil, posebej pri vdihovalnikih, ki jih bolniki predvsem na podeželju ne znajo uporabljati.
Tako prepričanje, da se mora astmatični bolnik podrejati bolezni in se odreči določenim življenjskim radostim, recimo svojemu najljubšemu športu, je zmotno, je opozorila Škrgat Kristanova. Meni pa, da bi številni bolniki lahko imeli bolj urejeno astmo, kot jo imajo ta hip, ker so do svojih simptomov premalo strogi in se z njimi nekako sprijaznijo.
Kampanja Življenje z astmo – Kaj sporočajo vaša pljuča poteka v sodelovanju združenja pnevmologov in društva pljučnih in alergijskih bolnikov s podporo podjetja AstraZeneca.
“,”Jaka Verbic Miklic”,1601451600,1601451600,sl,14451,306,14450,43,0,NULL,,”Za uspešno zdravljenje astme pomembno sodelovanje bolnika in zdravnikov”,za-uspesno-zdravljenje-astme-pomembno-sodelovanje-bolnika-in-zdravnikov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1601883704,1601883704
679,14453,”Letošnji rožnati oktober z geslom Dotik pove največ opozarja na pomen rednega samopregledovanja dojk”,”Letošnji rožnati oktober, mednarodni mesec ozaveščanja o raku dojk”,”
Ljubljana, 1. oktobra – Letošnji rožnati oktober, mednarodni mesec ozaveščanja o raku dojk, bo zaznamovalo geslo Dotik pove največ, ki opozarja na pomen rednega mesečnega samopregledovanja in zgodnjega odkrivanja raka dojk. V zbornici zdravstvene in babiške nege ob tem izpostavljajo izobraževanje za pridobitev dodatnih specialnih znanj zdravstvenih delavcev.
Rak dojk je najpogostejša oblika raka pri ženskah, zbolijo pa lahko tudi moški. Po podatkih registra raka je v letu 2017 v Sloveniji zbolelo 1399 žensk in deset moških. Istega leta je za rakom dojk umrlo 433 žensk in dva moška.
Zgodnje odkrivanje rakavih bolezni je pomembno za uspešno in manj obremenjujoče zdravljenje, manj poznih posledic in zmanjševanje umrljivosti. V Združenju Europa Donna Slovenija so zato opozorili, da v času epidemije covida-19 ne smemo pristati na slabši dostop do zdravstva in pravočasne diagnostike.
Ob tem so ženske pozvali, naj se tudi med epidemijo odzivajo na presejalni program za raka dojk Dora in naj bodo pozorne na morebitne zdravstvene težave. Če odkrijejo sumljive spremembe, pa je morajo vztrajati in priti do zdravnika, ki jih bo napotil na nadaljnje preiskave, če bo presodil, da je to potrebno.
Letošnje leto je namreč pokazalo, da dostop do zdravstva in pravočasne diagnostike ni samoumeven, je pred rožnatim oktobrom poudarila predsednica Združenja Europa Donna Slovenija Tanja Španić. Kot je še dejala, naj strah pred novim koronavirusom ne vpliva na odločitev glede obiska zdravnika.
V Europi Donni, slovenskem združenju za boj proti raku dojk, v rožnatem oktobru že tradicionalno pripravljajo številne aktivnosti, s katerimi želijo opozoriti na pomen preventive, zgodnjega odkrivanja in učinkovitega zdravljenja bolezni.
Zbornica zdravstvene in babiške nege Slovenije pa je ob začetku rožnatega oktobra izpostavila, da se je po zaslugi sodobnih metod zgodnjega odkrivanja in vse bolj učinkovitega zdravljenja v zadnjih desetletjih izjemno povečala stopnja preživetja bolnic z rakom dojk.
“Da bi zagotovile večjo kakovost oskrbe v smislu uspešnejše rehabilitacije žensk z rakom dojk, bi morale medicinske sestre pridobiti dodatna specialna znanja o učinkovitih in uspešnih postopkih za pogovore o spolnosti in normalizaciji težav, o najpogostejših potrebah po zaključenem zdravljenju, željah po pomoči in potencialnih ovirah,” so zapisali v sporočilu za javnost.
Kljub uspešnemu delu podpornih skupin, ki bolnikom z rakom prinašajo psihološko podporo, zmanjšujejo občutke osamljenosti, izoliranosti ali obsojanja, pa je po oceni zbornice na nacionalni ravni treba nujno zagotoviti tudi izvajanje rehabilitacijskih ukrepov od začetka zdravljenja do konca življenja.
“,”Jaka Verbic Miklic”,1601538120,1601538120,sl,14453,306,14452,43,0,NULL,,”Letošnji rožnati oktober z geslom Dotik pove največ opozarja na pomen rednega samopregledovanja dojk”,letosnji-roznati-oktober-z-geslom-dotik-pove-najvec-opozarja-na-pomen-rednega-samopregledovanja-dojk,Post,,1,0,1601883803,1601883803
680,14455,”Zdravniška zbornica poziva k preventivni skrbi za ustno higieno v vseh življenjskih obdobjih”,”Zdravniška zbornica Slovenije (ZZS) je ob predstavitvi akcije pozvala k preventivni skrbi za ustno higieno, saj ta ostane velikokrat pozabljena.”,”
Ljubljana, 1. oktobra – Zdravniška zbornica Slovenije (ZZS) je ob predstavitvi akcije pozvala k preventivni skrbi za ustno higieno, saj ta ostane velikokrat pozabljena. Vanjo spadajo redno ščetkanje zob, izogibanje sladkim pijačam in redni preventivni pregledi pri zobozdravniku. Za ustno zdravje pa je treba skrbeti v vseh življenjskih obdobjih, so še opozorili.
Specialist za otroško in preventivno zobozdravstvo Rok Kosem je ob predstavitvi med drugim opozoril, da sta že čas pred rojstvom in zgodnje obdobje otroštva ključna za ustvarjanje zobnemu in ustnemu zdravju prijaznih navad. Ob tem je poudaril pomen dojenja in pomoč staršev pri ščetkanju zob otrok. Izpostavil je tudi problematiko prekomernega uživanja sladkarij in sladkih pijač.
O pomembnosti vključevanja staršev v skrb za ustno zdravje otrok in problemu uživanja sladkih pijač je spregovorila tudi šolska zobozdravnica Vesna Banko s stomatološke sekcije Slovenskega zdravniškega društva. V času pandemije je po njenih besedah zaradi spremenjenega protokola v ambulantah v obravnavi namreč manj otrok, odpadlo pa je tudi tekmovanje za čiste zobe ob zdravi prehrani.
Ob tem je ponovila stališča in priporočila zdravnikov, da je treba zobe redno, pravilno in temeljito ščetkati. Zobno ščetko je treba menjavati na dva do tri mesece, pomembna pa je zobna pasta s primerno koncentracijo fluoridov in zobna nitka. Spomnila je tudi na pomembnost preventivnih pregledov.
Zobozdravnik Matej Praprotnik pa je opozoril na pasti zobozdravstvene oskrbe v tujini, ki jim podleže predvsem zrela generacija. Opomnil je na poplavo informacij, ob čemer težje izluščimo tisto, kar je dobro za nas. Praprotnik meni, da bi se moral vsak vprašati, “ali gre za informiranje ali oglaševanje in kdo je tisti, ki nam svetuje”. Javnost je pozval k zmernosti, sodelovanju in zaupanju v svojega zobozdravnika. Ljudi je pozval tudi h kritičnosti do senzacionalističnega oglaševanja in iskanja hitrih rešitev na račun lastnega zdravja.
“Splošno zdravje vsakega posameznika je neločljivo povezano z ustnim zdravjem in je temeljna človekova pravica,” pa je dejala Diana Terlević Dabić s stomatološke sekcije Slovenskega zdravniškega društva. Ob tem je opozorila na starejše, slepe in slabovidne, ki ustno higieno pogosto zanemarjajo.
Pri ranljivih skupinah po njenem prepričanju namreč prihaja do slabše ročne spretnosti, motnje vida pa pripeljejo do izgube veščin in motivacije za vzdrževanje ustne higiene. Zato je tudi njih treba spodbujati k samostojnemu čiščenju zob in obiskovanju rednih pregledov.
Krunoslav Pavlović z odbora za zobozdravstvo ZZS pa je ob predstavitvi akcije opozoril na pogosto izpuščanje zobozdravstvenega poklica pri odločitvah o zdravstvenih strategijah, kljub temu, da so s slabo ustno higieno povezane številne bolezni, ki resno prizadenejo tako zdravstvo kot ekonomijo. Pavlović je ob tem opomnil tudi na čakalne vrste v zobozdravstvu in dejal, da je pandemija samo še razgalila probleme dostopnosti zobozdravnikov.
ZZS se je projekta sicer lotila že v marcu, ob Svetovnem dnevu ustnega zdravja, v sodelovanju s stomatološko in pedantološko sekcijo Slovenskega zdravniškega društva, Nacionalnim inštitutom za javno zdravje in študenti dentalne medicine.
V sklopu projekta so pripravili šest zgibank, tri izobraževalne videe in spletno stran, dostopno preko strani zdravniške zbornice.
“,”Jaka Verbic Miklic”,1601538240,1601538240,sl,14455,306,14454,43,0,NULL,,”Zdravniška zbornica poziva k preventivni skrbi za ustno higieno v vseh življenjskih obdobjih”,zdravniska-zbornica-poziva-k-preventivni-skrbi-za-ustno-higieno-v-vseh-zivljenjskih-obdobjih,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1601883896,1601883896
681,14457,”Koprska občina z novim projektom do izboljšanja zdravja prebivalcev”,”Z dejavnostmi, ki jih bodo izvajali v okviru projekta, želijo izboljšati zdravje in blagostanje občanov”,”
Koper, 3. oktobra – Mestna občina Koper, ki je lani vstopila v slovensko mrežo zdravih mest, je letos začela izvajati program projekta Koper – zdravo mesto za obdobje 2020-2024. Z dejavnostmi, ki jih bodo izvajali v okviru projekta, želijo izboljšati zdravje in blagostanje občanov, hkrati pa zmanjšati neenakosti v zdravju.
Ključne ideje projekta, ki ga je potrdil tudi koprski občinski svet, so izboljšati zdravje in blagostanje prebivalstva, zmanjšati neenakosti v zdravju, okrepiti javno zdravje ter zagotoviti zdravstvene sisteme, ki so osredotočeni na ljudi in so univerzalni, sledijo načelom enakosti, so trajnostni in visoko kakovostni, so zapisali na mestni občini.
Cilji projekta so bili načrtovani na podlagi prioritetnih področij, ki so bila določena na konferenci v danskem Kopenhagnu, in sicer gre za investicijo v človeka, načrtovanje naselij za zdravje in dobro počutje, večjo participacijo in partnerstvo za zdravje ter boljšo kakovost življenja, dvig blaginje za vse občane, promocijo miru, v luči trajnosti pa tudi zaščito našega planeta.
Projektni svet, ki ga je imenoval župan Aleš Bržan, sestavljajo člani občinskega sveta ter predstavniki organizacij v občini in občinske uprave. Njihove naloge so učinkovito, hitro in široko uveljavljanje projekta v mestu, prenos temeljnih načel Zdravje 2020 v lokalno okolje, povezovanje in učinkovito komuniciranje med različnimi organizacijami za uspešno izvajanje akcij.
Hkrati bodo s promocijo projekta spodbujali stike s sorodnimi mesti, mednarodna sodelovanja in izobraževanja, oblikovali prednostne naloge s tega področja ter skrbeli, da bo projekt vsebinsko in finančno pripravljen tako, da bo vključeval potrebe iz okolja. Naloga sveta je bila tudi priprava programa s prednostnimi nalogami, ki vključujejo aktivnosti za obdobje med letoma 2020 in 2024, katerih namen je izboljšati pogoje za zdravo življenje v koprski občini in posledično izboljšati zdravstveno stanje prebivalcev.
Koprska občina tako želi skozi projekt Koper – zdravo mesto slediti viziji zdravega mesta. Prizadeva si ohranjati zdrave in čiste življenjske razmere, ob tem pa ozaveščati prebivalce in širšo družbeno skupnost, da prevzamejo večjo odgovornost za izboljšanje lastnega življenja, so v sporočilu za javnost še poudarili na koprski občini.
“,”Jaka Verbic Miklic”,1601711160,1601711160,sl,14457,306,14456,43,0,NULL,,”Koprska občina z novim projektom do izboljšanja zdravja prebivalcev”,koprska-obcina-z-novim-projektom-do-izboljsanja-zdravja-prebivalcev,Post,,1,0,1601884021,1601884022
685,14482,”9. strateška konferenca Vrednost inovacij: Čas za tehnologije jutrišnjega dne je danes”,”Zdravje in zdravstvo prihodnosti, ki jo organizira Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb in je letos prvič potekala virtualno.”,”
Ljubljana, 13. oktober 2020 – »Čas za tehnologije jutrišnjega dne je danes,« je bila ena izmed uvodnih misli na 9. strateški konferenci Vrednost inovacij: Zdravje in zdravstvo prihodnosti, ki jo organizira Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb in je letos prvič potekala virtualno. Vsi govorci konference so se strinjali, da je pandemija koronavirusa pospešila digitalizacijo zdravstva in vpeljavo inovacij, skupna naloga vseh deležnikov pa je, da nadaljujemo z vlaganji v razvoj in uvajanjem inovacij z namenom izboljšanja zdravstvenega sistema.
Pojav koronavirusa je v letošnjem letu popolnoma razgalil zdravstvene sisteme držav in ponovno odprl nekatera ključna vprašanja glede njihove odzivnosti in prilagodljivosti v času zaostrenih situacij, njihovega nadaljnjega razvoja, novih načinov organiziranja in vlaganj, s katerimi bo mogoče zagotoviti kakovostno zdravje celotne populacije tako v lokalnem kot globalnem okviru. To so bile nekatere tematike današnje strateške konference Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, ki je letos zaradi epidemioloških razmer v celoti potekala digitalno.
Nataša Jenčič, predsednica Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb je izpostavila, da smo v času pandemije izkusili številne zdravstvene inovacije, ki nam pomagajo uspešno premagovati pandemijo: »Digitalizacija, telemedicina, superračunalniki in umetna inteligenca so zgolj nekatera izmed orodji, ki so se izkazala v času pandemije. Zato je prav da se, ko se pogovarjamo o zdravstvu prihodnosti, pogovorimo tudi o tem, kako tehnologijo jutrišnjega dne pripeljati v zdravstvo že danes. Pospeška, ki nam ga je dal Covid-19 pri implementaciji novih tehnologij v zdravstvo, ne smemo izgubiti. Še naprej se moramo truditi, da bo naš zdravstveni sistem napredoval in ob tem poiskati mehanizme, ki bodo omogočali financiranje razvoja novih tehnologij in implementacijo teh tehnologij v zdravstvene sisteme in podsisteme.«
Peter Požun, državni svetnik za področje zdravstva, predsednik Komisije za socialno varstvo, delo, zdravstvo in invalide Državnega sveta RS meni, da je slovenski zdravstveni sistem še vedno kakovosten: »Pripravljen in zmožen je poskrbeti za vse, ki njegovo pomoč potrebujejo, ne glede na okoliščine. Le dovoliti mu moramo, da opravlja svojo funkcijo in ga zopet odpreti pacientom. Ne pozabimo namreč, da se je ob epidemiji covida-19 izkazalo, da so države, ki imajo močan in dobro delujoč javni zdravstveni sistem skozi epidemijo prišle mnogo lažje kot države, kjer je vse to prepuščeno zasebni iniciativi. Zato poskrbimo vsak na svojem področju, da bo v prihodnje zdravstveni sistem točno tak, kot si želimo – močan in sposoben nuditi vsakomur zdravstvene storitve, ko jih potrebuje.«
Francesca Colombo, vodja Oddelka za zdravje pri Organizaciji za gospodarsko sodelovanje in razvoj – OECD: »Menili smo, da imamo močne zdravstvene sisteme, posebej v razvitih državah, vendar smo spoznali, da to ne drži povsem.« Sedaj je ključno vprašanje, kako zdravstvene sisteme nadgraditi ter jih narediti bolj odporne na situacije, kot je pandemija. Francesca Colombo predlaga večja vlaganja v preventivo in odpravo neenakosti pri dostopu do zdravstva, kar bo okrepilo odpornost zdravstvenih sistemov. Naslovila je tudi njihovo rigidnost in uporabo digitalnih rešitev: »Kot smo se naučili iz krize, potrebujemo bolj fleksibilno infrastrukturo, ki bo lahko hitro dvignila svoje zmogljivosti, ko pride do nenadnega šoka. Kriza je bila priložnost za več in boljšo uporabo digitalnih podatkov, digitalnih rešitev in digitalne tehnologije. To moramo obdržati tudi v prihodnje.«
V podatkih o dostopnosti do najnovejših zdravil, ki jih je predstavil Thomas Allvin, izvršni direktor za strategijo in zdravstvene sisteme pri Evropski federaciji farmacevtske industrije in združenj – EFPIA, spada Slovenija v evropsko sredino. V združenju EFPIA podpirajo ustanovitev visokega posvetovalnega telesa pod okriljem Evropske komisije: »kjer bi sodelovale vse države članice EU, evropske institucije in vsi ostali ključni deležniki, med katerimi bi bili tudi predstavniki industrije in celotne zdravstvene verige s ciljem poiskati skupne rešitve v dobro bolnikov. Ne samo za zagotavljanje inovacij, ki naslavljajo ključne zdravstvene izzive, temveč tudi za enakovredno dostopnost do teh inovacij za vse bolnike v Evropi.”
Marko Grobelnik, raziskovalec v Laboratoriju za umetno inteligenco na Inštitutu Jožefa Stefana in digitalni glasnik Slovenije o novostih v razvoju umetne inteligence, je izpostavil, da je eden izmed glavnih naukov trenutne krize potreba po hitrejšem ukrepanju: »Pripravljamo digitalni dvojček države. Cilj je povezati podatkovne tokove iz zdravstva, farmacije, ekonomije, transporta, dobavnih verig, medijev, socialnih služb in statističnega urada v enovit analitski model, ki bo omogočal v realnem času kakovostno interpretacijo in napovedovanje trendov v državi. Če nam bo to uspelo, bo Slovenija prva država na svetu, ki bo imela učinkovit analitski model, ki bo podlaga za nadaljnje ukrepe in korake države.«
Marjan Sušelj, direktor Zavoda za zdravstveno zavarovanje Slovenije, je poudaril, da ima vsak bolnik pravico biti obravnavan kakovostno in pravočasno. To pravico je čas pandemije zaradi drugih prioritet nekoliko potisnil na stran. Po njegovem mnenju bo potrebno v bodoče tudi povečevati sredstva za zdravstvo. Pri tem se je dotaknil tudi vlaganj farmacevtskih podjetij v iskanje cepiva in zdravila za covid-19 ter dodal: »Vsi pa moramo imeti pred očmi predvsem dobrobit pacientov ter čim boljšo dostopnost, s čimer so povezana tudi zadostna finančna sredstva.«
Doroteja Novak Gosarič z Direktorata za zdravstveno varstvo na Ministrstvu za zdravje je povedala, da že nestrpno pričakujejo zdravilo in cepivo zoper koronavirus in opozorila: »Pri tem je izjemnega pomena sodelovanje ter solidarnost med vsemi državami na ravni EU, saj je to najboljša pot, da do zdravila in cepiva pridemo kar najhitreje.«
Udeleženci okrogle mize, ki jo je moderirala dr. Petra Došenović Bonča, izredna profesorica na Ekonomski fakulteti Univerze v Ljubljani, so se strinjali, da trenutne razmere narekujejo krepitev sodelovanja na nacionalni in meddržavni ravni. Izpostavili so, da je potrebno nadaljevati z vlaganji v raziskave in razvoj ter najti nove vire in oblike financiranja, ki bodo omogočili hitrejšo vpeljavo inovacij v zdravstvene sisteme ter povečali njihovo dostopnost v korist bolnikov.
“,”Jaka Verbic Miklic”,1603263300,1603263300,sl,14482,306,14471,43,0,NULL,,”9. strateska konferenca”,9-strateska-konferenca,Post,”/sites/43/files/images/news/9. strateska/Tehnoilogija danes.jpg”,1,0,1603263866,1605127712
686,14482,”9th value of innovation conference”,”The time for tomorrow’s technologies is today”,”
Ljubljana, 13 October 2020 – “The time for tomorrow’s technologies is today” was one of the introductory thoughts expressed at the 9th Value of Innovation Strategic Conference: Health and Healthcare of the Future, organized by the Forum of international research and development pharmaceutical companies and carried out in virtual form for the first time this year. All the speakers at the conference agreed that the coronavirus pandemic has accelerated the digitalization of healthcare and introduction of innovations and consolidated the role of all stakeholders in the effort to continue investing in development and introducing innovations to improve the healthcare system.
This year’s onset of the coronavirus has laid bare the issues facing healthcare systems across all countries and reopened certain key questions regarding their responsiveness and adaptability in times of increased needs, their further development and new methods of organization and investment that will allow the assurance of quality healthcare for the entire population at a local and global scale. These were some of the topics discussed at today’s strategic conference organized by the Forum of international research and development pharmaceutical companies that was carried out digitally due to the current epidemiological situation.
Nataša Jenčič, President of the Forum of international research and development pharmaceutical companies noted that the pandemic has brought about trials of many healthcare innovations that are now successfully being applied to help fight the pandemic: “Digitalization, telemedicine, supercomputers and artificial intelligence are just some of the tools that came to the forefront during the pandemic. It is therefore only right that any discussion of the future of healthcare touches on how to bring tomorrow’s technologies into healthcare today. We must not lose the momentum created by Covid-19 in the implementation of new technologies in healthcare. We must continue to work towards advancing out healthcare system and find mechanisms that enable financing for the development of new technologies and implementation of such technologies in healthcare systems and subsystems.”
Peter Požun, National Councillor for the field of healthcare, President of the Commission for Social Security, Labour, Healthcare and the Disabled of the National Council of the Republic of Slovenia believes that the Slovenian healthcare system has retained its high quality: “It is ready and able to take care of each and every one who needs its assistance, regardless of circumstances. We need only allow it to perform its function and reopen it for the patients. It should not be forgotten that the Covid-19 epidemic has shown that countries with a strong and well functioning healthcare system have been coping with the epidemic much better than countries where response has been given over to private initiatives. Every one of us should therefore make sure in our respective fields that the healthcare system becomes as we want it to bee – resilient and able to provide healthcare services to all persons when they need them.”
Francesca Colombo, Head of the Health Department with OECD: “We thought that we had strong healthcare systems, especially in developed countries, but now we have found that this is not completely true. The key question now is how to upgrade our healthcare systems and make them more resilient to situations such as this pandemic.” Francesca Colombo proposes increased investments in prevention and remedying inequality in access t healthcare which will strengthen the resilience of healthcare systems. She has also addressed their rigidity and the use of digital solutions: “As we learned from the crisis, we need more flexible infrastructure that will be able to rapidly increase its capacities when a sudden shock occurs. The crisis was an opportunity for increased and wider use of digital data, digital solution and digital technologies. We must maintain this in the future.”
Data on access to the newest medicines presented by Thomas Allvin, Executive Director of Strategy and Healthcare Systems with the European Federation of Pharmaceutical Industries and Associations – EFPIA, shows that Slovenia places midpack in Europe. EFPIA supports the establishment of a high level consulting body under the auspices of the European Commission: “A point of collaboration for all EU member countries, European institutions and all other key stakeholders, including representatives of the industry and the entire health chain, with the aim of seeking common solutions to benefit patients. Not only to assure innovations to tackle key heath challenges, but also to assure equal access to these innovations for all patients in Europe.”
Marko Grobelnik, researcher of the Artificial Intelligence Laboratory at the Jožef Štefan Institute and Slovenia’s digital spokesperson on new developments in artificial intelligence, emphasized that one of the main lessons learned in the current crisis is the need for faster action: “We are preparing a digital twin of the country. The aim is to connect data streams from healthcare, pharmacy, economy, transport, supply chains, media, social services and the statistical office into a unified analytical model that will enable real time and high quality interpretation and forecasting of trends in the country. If we are successful, Slovenia will be the first country in the world with an effective analytical model to support further measures and steps taken by the state.”
Marjan Sušelj, Director of the Health Insurance Institute of Slovenia, noted that every patient has the right to receive high quality and timely treatment. In the situation of a pandemic this right has been shifted aside somewhat by other priorities. In his opinion the healthcare budget will need to increase in the future. Mr. Sušelj also touched upon the investments made by pharmaceutical companies in the search of a vaccine and treatment for Covid-19 and added: “We must all focus primarily on the welfare of patients and assuring maximum accessibility, which does require sufficient funding.”
Doroteja Novak Gosarič from the Directorate of Health Protection at the Ministry of Health said that they eagerly awaiting a cure and vaccine against the coronavirus and added: “In this respect the co-operation and solidarity among all EU countries is essential as it is the best way to assure that we reach a cure and vaccine as fast as possible.”
Participants of the panel discussion led by dr. Petra Došenovič Bonča, associate professor at the Faculty of Economics of the University of Ljubljana, agreed that the current circumstances dictate stronger cooperation at a national and international level. Participants also agreed that investments into research and development must continue and that new sources and forms of financing should be found to enable faster introduction of innovations into health systems to increase their accessibility for the benefit of patients.
Download press release (.pdf) ENG
“,”Jaka Verbic Miklic”,1603264200,1603264200,en,14482,306,14471,43,0,NULL,,”9. strateska konferenca”,9-strateska-konferenca,Post,”/sites/43/files/images/news/9. strateska/Tehnoilogija danes.jpg”,1,0,1603263866,1605127712
689,14490,”Letošnja Nobelova nagrada za medicino za odkritje virusa hepatitisa C “,”Letošnjo Nobelovo nagrado za medicino prejmejo Američana Harvey J. Alter in Charles M. Rice ter Britanec Michael Houghton za odkritje virusa hepatitisa C (HCV), je danes sporočil švedski inštitut Karolinska.”,”
Stockholm, 5. oktobra – Letošnjo Nobelovo nagrado za medicino prejmejo Američana Harvey J. Alter in Charles M. Rice ter Britanec Michael Houghton za odkritje virusa hepatitisa C (HCV), je danes sporočil švedski inštitut Karolinska.
Američana in Britanec so nagrajeni za “odločilen prispevek k boju” proti hepatitisu C. “Ta bolezen je globalni zdravstveni problem, ki povzroča cirozo in raka jeter ljudem po vsem svetu,” so navedli na Nobelovem odboru.
Alter je dokazal, da je neznani virus skupen vzrok kroničnega hepatitisa. Houghton je uporabil nepreizkušeno metodologijo za izolacijo genoma novega virusa, ki so ga poimenovali virus hepatitisa C. Rice pa je dokazal, da ta virus edini povzroča hepatitis.
Virus hepatitisa C povzroča akutno ali kronično vnetje jeter, piše na spletni strani Nacionalnega inštituta za javno zdravje (NIJZ). Pri 20 odstotkih okuženih se pojavijo znaki akutnega virusnega hepatitisa, ostali pa kljub okužbi nimajo značilnih bolezenskih znakov.
Okužba najpogosteje izzveni spontano pri okuženih otrocih in tistih z izraženo klinično sliko (zlatenico). Pri tistih, ki nimajo simptomov, je verjetnost spontane odstranitve virusa bistveno manjša. Prisotnost virusnega genoma 6 mesecev po okužbi kaže na kronično okužbo.
Po nekaterih ocenah je na svetu od 130 do 150 milijonov ljudi okuženih s HCV, vsako leto pa umre od 350.000 do 500.000 oseb zaradi bolezni jeter, ki so posledica hepatitisa C, še navaja NIJZ.
“,”Jaka Verbic Miklic”,1601742300,1601742300,sl,14490,306,14489,43,0,NULL,,”Letošnja Nobelova nagrada za medicino za odkritje virusa hepatitisa C “,letosnja-nobelova-nagrada-za-medicino-za-odkritje-virusa-hepatitisa-c,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1603646771,1603646794
690,14492,”Življenje bolnikov z revmo je lahko ob zgodnji diagnozi, zdravljenju in zdravem življenjskem slogu kakovostno”,”K temu pripomore čim hitrejša diagnoza bolezni, zdravljenje in zdrav življenjski slog bolnikov, za kar pa je potrebna čim boljša informiranost.”,”
Ljubljana, 7. oktobra – Ob bližajočem dnevu revmatikov so v Društvu revmatikov Slovenije na današnji novinarski konferenci sporočali, da lahko bolniki z revmatskimi boleznimi živijo kakovostno in polno življenje. K temu pripomore čim hitrejša diagnoza bolezni, zdravljenje in zdrav življenjski slog bolnikov, za kar pa je potrebna čim boljša informiranost.
Mnogi oboleli namreč ob simptomih ne pomislijo, da bi šlo lahko za revmo, zato dolgo ne pridejo k zdravniku. V nasprotju s splošnim prepričanjem lahko namreč katera od več kot sto tipov revmatskih bolezni prizadene ljudi, ne glede na spol in starost. Simptomi teh bolezni so lahko zelo različni, od pogostejših bolečin v sklepih in hrbtenici, do povišane temperature, kožnih izpuščajev in nepojasnjenih splavov pri mladih ženskah, je povedal revmatolog Matija Tomšič.
Poudaril je pomen hitre diagnoze in zdravljenja. “Življenjska doba bolnikov z revmatitisom je bila nekoč 10 let krajša kot pri zdravi populaciji, zdaj pa živijo enako dolgo, če imajo umirjeno bolezen, kažejo raziskave. Umirjena bolezen pa je možna samo, če jemljejo zdravila,” je povedal Tomšič in ob tem pozval bolnike, naj poslušajo zdravnike in jemljejo zdravila. Ta so v Sloveniji dobro dostopna.
Tomšič je zdravnike pozval, naj bodo pozorni na ljudi, predvsem mlade, ki se vračajo k njim s hudimi bolečinami v križu, še posebej, če je prisotna tudi nočna bolečina. Dodal je, da po eni strani razume, zakaj zdravniki včasih ne posumijo na možnost, da gre za bolnika z revmo, še posebej ko gre za podtip ankilozirajoči spondilitis (AS). “Zdravniki imajo dnevno po 80 pacientov in na vsakega nekaj minut za pregled. Približno 20 odstotkov populacije v Sloveniji boli križ, 0,5 odstotka ima bolezen AS, polovici ljudi s to boleznijo pa se to v krvi ne kaže,” je opisal.
Na področju postavljanja diagnoze AS smo v Sloveniji veliko prepočasni, saj od pojavitve težav do diagnoze v povprečju traja kar 32 mesecev, je povedal Tomšič. Dodal je, da smo na drugi strani po hitrosti postavljanja diagnoz za nekatere druge revmatske bolezni med najboljšimi v Evropi. Pri revmatoidnem artritisu od napotnice do obiska revmatologa traja en dan, od začetka težav do diagnoze pa 12,7 tedna. Od začetka težav do diagnoze polimialgije pa traja samo šest tednov, je dodal. Poudaril je, da diagnosticiranje in pregledi glede revmatskih boleznih potekajo enako hitro kot pred covidom-19.
Poleg diagnoze in zdravljenja z zdravili sta za obvladovanje bolezni pomembna tudi gibanje in zdrava prehrana, je povedal revmatolog Anton Ambrožič. Nezdrav življenjski slog namreč pripomore k razvoju vnetne revmatske bolezni in razvoju drugih kroničnih bolezni, ki se lahko pridružijo revmi. Poleg tega so raziskave pokazale, da se bolniki z vnetno revmatsko boleznijo in nezdravim življenjskim slogom slabše odzivajo na zdravljenje.
Za bolezen je značilna pospešena izguba mišične mase, kar lahko vodi do nemobilnosti. Za preprečevanje izgube mišic je potreben zadosten vnos beljakovin in telesna vadba kljub bolečinam, ki ljudi pogosto demotivirajo od gibanja, je dejal Ambrožič. Pomen telesne vadbe je izpostavila tudi fizioterapevtka Anita Jaklič, ki fizioterapijo priporoča čim prej, lahko tudi pred postavljeno diagnozo, saj fizioterapevti ne zdravijo bolezni ampak lajšajo simptome. Razkrila je, da pripravljajo priročnik za bolnike z revmatskimi boleznimi, v katerem bodo fotografije in navodila za pravilno vadbo.
Svojo izkušnjo soočanja z bolečinami in svojo diagnozo je delilo tudi več oseb z boleznijo AS. Povedale so, da so potrebovali čas, da so sprejeli in se naučili živeti s svojo diagnozo, ostalim bolnikom pa sporočajo, da se da tudi z boleznijo živeti polno življenje.
“,”Jaka Verbic Miklic”,1602088080,1602088080,sl,14492,306,14491,43,0,NULL,,”Življenje bolnikov z revmo je lahko ob zgodnji diagnozi, zdravljenju in zdravem življenjskem slogu kakovostno”,zivljenje-bolnikov-z-revmo-je-lahko-ob-zgodnji-diagnozi-zdravljenju-in-zdravem-zivljenjskem-slogu-kakovostno,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1603646952,1603646952
691,14494,”Ulcerozni kolitis in Crohnova bolezen sta v družbi premalo poznani “,”Pomembno je dodatno izobraževanje o njiju, so se na današnji novinarski konferenci Društva za kronično vnetno črevesno bolezen strinjali sogovorniki.”,”
Ljubljana, 8. oktobra – Bolezni, kot sta ulcerozni kolitis in Crohnova bolezen, sta v družbi premalo poznani, zato je pomembno dodatno izobraževanje o njiju, so se na današnji novinarski konferenci Društva za kronično vnetno črevesno bolezen strinjali sogovorniki. Obenem so izpostavili pomembno vlogo družinskih zdravnikov in medicinskih sester pri njunem zdravljenju.
Po besedah specialistke interne medicine Nataše Smrekar sodi Crohnova bolezen v podskupino kronične vnetne črevesne bolezni, za katero je značilno kronično vnetje prebavil. Zajame lahko katerikoli del prebavne cevi, od ust do zadnjika. Zelo pogost simptom Crohnove bolezni je bolečina v trebuhu, medtem ko driska ni nujno prisotna. Bolezen se lahko sicer začne tudi z drugimi zapleti, kot so bolečina v sklepih in težave s kožo ali očmi. Gre za bolezen mladih odraslih, ki se ponavadi začne okoli 20. leta starosti.
Točni razlogi za nastanek Crohnove bolezni trenutno še niso znani. Kot pravi Smrekarjeva, menijo, da gre pri tem za dejavnike iz okolja, ki povzročijo določene spremembe v črevesju. Določen vpliv na pojav bolezni naj bi imela tudi genetika.
Med podvrste kronične vnetne bolezni sodi tudi ulcerozni kolitis. Za razliko od Crohnove bolezni bolečine v trebuhu skoraj vedno spremlja tudi driska, pogosto krvava, opozarja specialistka interne medicine Renata Šibli. Zaradi tega je diagnosticiranje ulceroznega kolitisa lažje in hitrejše kot pri Crohnovi bolezni. Bolezen praviloma prizadene samo debelo črevo in tako kot Crohnova pogosto prizadene mlade. Poteka lahko poteka v zelo hudi ali pa zelo blagi obliki, bolniki pa velikokrat potrebujejo zelo agresivno zdravljenje, je pojasnila Šiblijeva. Kot je še opozorila, sta si bolezni na začetku diagnoze sicer lahko zelo podobni.
Specialist družinske medicine Dušan Baraga pravi, da z vidika družinskih zdravnikov pri diagnosticiranju kronične vnetne črevesne bolezni precej pomaga, če zdravnik pozna bolnika in njegovo družino. Pomembno je tudi, da zna zdravnik bolnika poslušati in mu verjeti. Družinski zdravniki po mnenju Barage igrajo pomembno vlogo tudi po tistem, ko je diagnoza enkrat postavljena, saj se bolniki nanje pogosto obračajo z različnimi vprašanji glede zdravljenja in zdravil.
V Društvu za kronično vnetno črevesno bolezen so skupaj z družinskimi zdravniki pred leti opravili raziskavo, s katero so ugotovili, da je bilo takrat v Sloveniji okoli 7000 bolnikov. Po njihovih ocenah naj bi na leto na novo zbolelo med 250 do 300 ljudi. Približno 20 odstotkov bolnikov naj bi imelo težji potek bolezni, je navedel Baraga.
Da se lahko bolnika pri tej bolezni dobro obravnava, je potrebno tudi dobro izobraževanje, na tem področju pa je precej aktivno Društvo za kronično vnetno črevesno bolezen. Kot je opozorila predsednica društva Mateja Saje, je kronična vnetna črevesna bolezen še vedno premalo poznana v javnosti. Bolniki tako nemalokrat naletijo tudi na nerazumevanje okolice. V ta namen poleg strokovne javnosti pripravljajo izobraževanja za delodajalce in delovne organizacije, kjer v sklopu posebnih akcij opozarjajo na to, kako lahko delodajalci pomagajo bolnikom s to boleznijo.
Diplomirana medicinska sestra Tadeja Polanc je izpostavila tudi pomembno vlogo medicinskih sester pri tovrstnem izobraževanju. Medicinske sestre lahko bistveno prispevajo k temu, da je bolnik bolj pripravljen sodelovati, obenem pa ga lahko pomagajo usmerjati na pravilne klinične poti.
Pri zdravljenju kronične vnetne črevesne bolezni so se kot posebej učinkovita izkazala biološka zdravila, a kot je izpostavila Smrekarjeva, niso za vsakogar. Vedno je treba preveriti, kakšne dodatne bolezni še lahko ima bolnik, saj imajo tako kot vsako drugo zdravilo lahko kakšne dodatne učinke.
“,”Jaka Verbic Miklic”,1602174660,1602174660,sl,14494,306,14493,43,0,NULL,,”Ulcerozni kolitis in Crohnova bolezen sta v družbi premalo poznani “,ulcerozni-kolitis-in-crohnova-bolezen-sta-v-druzbi-premalo-poznani,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1603647211,1603647211
692,14496,”Predlog za brezplačno cepljenje proti gripi za vse prebivalce “,”Ministrstvo za zdravje predlaga, da bi bilo cepljenje proti gripi v tej sezoni brezplačno za vse prebivalce”,”
Ljubljana, 9. oktobra – Ministrstvo za zdravje predlaga, da bi bilo cepljenje proti gripi v tej sezoni brezplačno za vse prebivalce, je prek Twitterja sporočil minister za zdravje Tomaž Gantar. A cepiva za vse prebivalce zaenkrat ne bo na voljo, Nacionalni inštitut za javno zdravje (NIJZ) je namreč za letošnjo sezono naročil 270.000 odmerkov cepiva proti gripi.
Količine cepiv se namreč naročajo spomladi. Gre za enako cepivo kot v pretekli sezoni – štirivalentno cepivo francoskega proizvajalca.
V preteklosti se je sicer že zgodilo, da je NIJZ naknadno naročal dodatne odmerke cepiva, če ga je zmanjkalo in direktor NIJZ Milan Krek je za Dnevnik pojasnil, da bodo tako ravnali tudi letos, če bo treba. Ob bojazni, da cepiv ne bi bilo na voljo, saj so potrebe za tovrstno preventivo po svetu v epidemiji covida-19 večje, pa je Krek zagotovil, da so “proizvajalci povečano povpraševanje pričakovali in so se temu prilagodili”.
Po preliminarnih podatkih se je v prejšnji sezoni v Sloveniji proti gripi cepilo 142.842 ljudi, od tega 51.030 kroničnih bolnikov, 716 nosečnic in 7595 zdravstvenih delavcev.
Za letošnjo sezono je bilo sicer sprva predvideno, da bo cepljenje proti gripi brezplačno za kronične bolnike, starejše od 65 let, nosečnice, osebe z izrazito povečano telesno težo in tudi za otroke, stare od pol leta do 23 mesecev, so pred dvema tednoma pojasnjevali na NIJZ.
Zaradi epidemije novega koronavirusa pa letos zdravstvene oblasti pozivajo k obsežnejšemu cepljenju proti gripi, s čimer želijo preprečiti, da bi ob hkratnih zapletih zaradi gripe, zaradi katere se vsako zimo v bolnišnicah zdravi veliko ljudi, in ponovnem naraščanju števila bolnikov s covidom-19 zaradi prezasedenosti odpovedal zdravstveni sistem.
Tudi Gantar je v tvitu opozoril, da sočasna okužba pri okuženem s koronavirusom bistveno poveča tveganje za zaplete in smrt, zato je zlasti za starejše in druge ranljive skupine zaščita pred gripo zelo pomembna.
Pravno podlago za večji obseg brezplačnega cepljenja predvideva tudi peti protikoronski zakon. V 98. členu, ki opredeljuje neposredno financiranje ukrepov na področju vzgoje in izobraževanja ter znanosti, piše, da se iz sredstev državnega proračuna zagotavlja financiranje prostovoljnega cepljenja proti sezonski gripi.
Ker je zraven navedeno, da se to ne šteje za boniteto iz delovnega razmerja in ker se prvi odstavek člena, ki govori o financiranju zaščitnih sredstev, nanaša le na izvajalce storitev v vzgoji, izobraževanju in znanosti, bi lahko sklepali, da tudi del o cepljenju govori le o zaposlenih. A v obrazložitvi tega člena je navedeno, da se iz državnega proračuna zagotavlja “tudi financiranje prostovoljnega cepljenja proti sezonski gripi vseh”.
Sicer pa je bila sezona gripe letos na južni polobli izjemno neznačilna. Zaradi ukrepov za zajezitev novega koronavirusa v Avstraliji, na jugu Afrike in v Južni Ameriki virusa influence skoraj niso zaznali.
Posebno v Avstraliji so ugotavljali, da podatki iz različnih sistemov za spremljanje gripe ne predstavljajo natančnega odseva aktivnosti gripe. “Podatke je treba obravnavati previdno, zlasti kadar jih primerjamo s prejšnjimi sezonami gripe. Pri razlagi podatkov o gripi za sezono 2020 je treba upoštevati tudi vpliv ukrepov distanciranja in spremembe v vedenju ljudi, ki so v primeru akutne respiratorne okužbe osredotočeni na testiranje zgolj na novi koronavirus, so pred časom zapisali na NIJZ.
“,”Jaka Verbic Miklic”,1602262140,1602262140,sl,14496,306,14495,43,0,NULL,,”Predlog za brezplačno cepljenje proti gripi za vse prebivalce “,predlog-za-brezplacno-cepljenje-proti-gripi-za-vse-prebivalce,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1603648232,1603648233
693,14498,”Danes obeležujemo evropski dan darovanja organov in tkiv”,” V zavodu Slovenija-transplant opozarjajo, da epidemija covida-19 ni in ne sme zaustaviti darovanja in zdravljenja s presaditvijo organov.”,”
Ljubljana, 10. oktobra – Ob evropskem dnevu darovanja organov in tkiv, ki ga obeležujemo danes, v zavodu Slovenija-transplant opozarjajo, da epidemija covida-19 ni in ne sme zaustaviti darovanja in zdravljenja s presaditvijo organov. V zavodu so ob tem poudarili tudi pomembnost sodelovanja z mednarodno mrežo izmenjave organov Eurotransplant in pozvali ljudi k darovanju.
Po podatkih zavoda je bilo v ponedeljek na čakalnem seznamu 211 bolnikov, od tega 54 za srce, 117 za ledvico in 33 za presaditev jeter. Sedem bolnikov čaka nova pljuča, štirje pa trebušno slinavko. Povprečne čakalne dobe za srce sicer znašajo 247 dni, za urgentne presaditve pa 50 dni.
Ob tem so v zavodu zapisali, da gre pri darovanju in presaditvi sicer za zgleden primer v našem zdravstvu. Dejavnost so ob koronski krizi namreč ustrezno prilagodili in je niso prekinjali.
Po besedah direktorice zavoda Danice Avsec je letošnje leto minilo tudi v znamenju praznovanja 20-letnice sodelovanja z mednarodno mrežo izmenjave organov in tkiv Eurotransplant. “S tem smo zagotovili občutno boljše izide zdravljenja za naše bolnike in pa tudi strokovni razvoj,” je dejala Avsečeva. Če bi delovali le znotraj države, po njeni oceni namreč “marsikdo na čakalnem seznamu ne bi dočakal ustreznega oz. ujemajočega darovalca”.
V Sloveniji so po navedbah Slovenija-transplant med obdobjem epidemije opravili tudi več presaditev ledvic kot v enakem obdobju lani, 73 odstotkov organov za presaditev pa so prejeli iz držav članic Eurotransplanta.
Število umrlih iz programa darovalcev ni upadlo, visoka pa je ostala tudi stopnja soglasja svojcev za darovanje. Ob tem Andrej Gadžijev iz Slovenija-transplanta opozarja, da ljudje, umrli s covidom-19, sicer ne morejo postati darovalci, saj je škodovanje prejemniku previsoko.
So pa v zavodu opazili upad vpisa v nacionalni register opredeljenih oseb, ki bi želele darovati organe in tkiva. Letos se je namreč za to opredelilo 563 ljudi, kar je za tretjino manj kot lani. Ob tem na zavodu obžalujejo, da so se zaradi zajezitvenih ukrepov zmanjšale možnosti za osebni vpis na javnih dogodkih.
Tako poudarjajo, da se lahko ljudje za to odločijo po elektronski pošti preko portala e-uprava. Ob tem je Avsečeva poudarila, da morajo biti za to izpolnjeni tudi določeni pogoji, verjetnost dejanskega darovanja pa je nizka.
Letos so ob dnevu darovanja v zavodu zaradi slabe epidemiološke situacije namesto javnega dogodka pripravili informativne zgibanke, ki jih bodo razširili po zdravstvenih domovih in drugod po Sloveniji.
“,”Jaka Verbic Miklic”,1602348720,1602348720,sl,14498,306,14497,43,0,NULL,,”Danes obeležujemo evropski dan darovanja organov in tkiv “,danes-obelezujemo-evropski-dan-darovanja-organov-in-tkiv,Post,,1,0,1603648392,1603648392
694,14501,”Danes obeležujemo svetovni dan revmatikov”,”V Sloveniji z vnetno revmatično boleznijo živi med 40.000 in 60.000 ljudi.”,”
Ljubljana, 12. oktobra – Danes obeležujemo svetovni dan revmatikov. V Sloveniji z vnetno revmatično boleznijo živi med 40.000 in 60.000 ljudi. Bolnikov z revmatizmom pa je okrog 230.000. Za eno od vrst revmatskih bolezni lahko zbolijo ljudje ne glede na spol in starost. Četudi gre za kronične bolezni, ki trajajo vse življenje, lahko bolniki z njimi živijo kakovostno.
K temu pripomorejo zdrav življenjski slog, zdravljenje in čim hitrejša diagnoza. Revmatiki se soočajo s kronično bolečino, vnetji, okorelostjo in izgubo funkcije sklepov, prvi simptomi bolezni pa so lahko zelo raznoliki. Kot je na novinarski konferenci Društva revmatikov Slovenije pojasnil revmatolog Matija Tomšič, so lahko simptomi revmatske bolezni poleg pogostejših bolečin v sklepih in hrbtenici tudi povišana temperatura, kožni izpuščaji in nepojasnjeni splavi pri mladih ženskah.
“Življenjska doba bolnikov z revmatitisom je bila nekoč 10 let krajša kot pri zdravi populaciji, zdaj pa živijo enako dolgo, če imajo umirjeno bolezen, kažejo raziskave. Umirjena bolezen pa je možna samo, če jemljejo zdravila,” je povedal Tomšič. Ob tem je bolnike pozval, naj poslušajo zdravnike in jemljejo zdravila. Ta so v Sloveniji dobro dostopna.
Revmatolog Anton Ambrožič pa je poudaril, da lahko bolniki za obvladovanje bolezni veliko naredijo tudi z gibanjem in zdravo prehrano. Nezdrav življenjski slog lahko namreč pripomore k razvoju revme in priključitve še drugih kroničnih bolezni, poleg tega pa raziskave kažejo, da se bolniki z vnetno revmatsko boleznijo in nezdravim življenjskim slogom slabše odzivajo na zdravljenje.
Za revmatske bolezni je značilna pospešena izguba mišične mase, kar lahko vodi do nemobilnosti in odvisnosti od drugih. Izgubo mišične mase lahko bolniki upočasnijo z zadostnim vnosom beljakovin in gibanjem, je zato svetoval Ambrožič. Pomen telesne vadbe je izpostavila tudi fizioterapevtka Anita Jaklič, ki fizioterapijo priporoča čim prej, lahko tudi pred postavljeno diagnozo.
V društvu revmatikov so ob letošnjem dnevu bolnikov z revmatizmom še posebej opozorili na ankilozirajoči spondilitis, ki se pojavlja tudi pri mladih ljudeh in velja za enega zahrbtnejših tipov revmatskih bolezni. Diganoze so pogosto pozne, saj se ta bolezen pri polovici obolelih sploh ne kaže v krvi, kaže pa se v bolečinah v hrbtu, ki jih ima kar 20 odstotkov slovenske populacije, je dejal Tomšič.
Na področju postavljanja diagnoze ankilozirajoči spondilitis smo po njegovi oceni v Sloveniji “veliko prepočasni”, saj od pojavitve težav do diagnoze v povprečju traja 32 mesecev, medtem ko smo pri postavljanju diagnoz za nekatere druge revmatske bolezni med najboljšimi v Evropi. Tomšič je poudaril, da sicer diagnosticiranje in pregledi glede revmatskih boleznih v Sloveniji potekajo enako hitro kot pred covidom-19.
“,”Jaka Verbic Miklic”,1602521880,1602521880,sl,14501,306,14500,43,0,NULL,,”Danes obeležujemo svetovni dan revmatikov”,danes-obelezujemo-svetovni-dan-revmatikov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1603648778,1603648778
695,14503,”NIJZ prihodnji teden začenja cepljenje proti gripi”,”Kot opozarjajo, je letos toliko bolj pomembno, da se čim več ljudi tako zaščiti pred gripo, še posebej pa to velja za skupine, pri katerih gripa lahko poteka težje ali z zapleti.”,”
Ljubljana, 13. oktobra – Na Nacionalnem inštitutu za javno zdravje (NIJZ) v ponedeljek 19. oktobra začenjajo cepiti proti gripi v ambulantah območnih enot za sezono 2020/2021. Kot opozarjajo, je letos toliko bolj pomembno, da se čim več ljudi tako zaščiti pred gripo, še posebej pa to velja za skupine, pri katerih gripa lahko poteka težje ali z zapleti.
Kot poudarjajo na NIJZ, je cepljenje proti gripi priporočljivo zlasti za kronične bolnike, osebe stare 65 let in več, nosečnice, majhne otroke, stare med 6 do 23 mesecev, ter osebe z izjemno povečano telesno težo. Za te osebe cepljenje proti gripi v sezoni 2020/2021 v celoti krije Zavod za zdravstveno zavarovanje Slovenije iz obveznega zdravstvenega zavarovanja, so na svoji spletni strani navedli na NIJZ.
Cepljenje priporočajo tudi osebam, ki so pri svojem delu izpostavljene nevarnosti okužbe ali pri delu lahko prenesejo okužbo na druge osebe. To še posebej velja za zdravstvene delavce in sodelavce, zaposlene v domovih starejših občanov ter druge nujne službe, so izpostavili.
Kot zagotavljajo na NIJZ, je cepljenje proti gripi v času epidemije covida-19 varno. Za zagotavljanje najvišje stopnje varnosti in zaščite pred širjenjem okužb covid-19 bo potek dela na območnih enotah NIJZ organiziran nekoliko drugače kot doslej.
Za cepljenje se je treba predhodno naročiti po telefonu ali elektronski pošti, saj je vstop v čakalnico zaradi individualne obravnave omogočen le naročenim in v dogovorjenem terminu. Osebno naročanje v ambulanti ni mogoče, opozarjajo na NIJZ.
Na cepljenje lahko pridejo le zdrave osebe, ki v zadnjih 14 dneh niso imele znakov respiratorne okužbe, prav tako pa okužbe niso imele osebe, s katerimi živijo v istem gospodinjstvu. Obvezna je uporaba kirurške maske ter razkuževanje rok ob vstopu v prostore območne enote NIJZ.
Gripa je zelo nalezljiva bolezen in virus se z lahkoto širi med prebivalci. Kot zagotavljajo na NIJZ, je najučinkovitejša zaščita pred gripo vsakoletno cepljenje. Slednje je koristno, saj ščiti tako pred boleznijo kot tudi pred morebitnimi zapleti, ki gripo spremljajo.
Kontaktni podatki in termini za naročanje ter urnik dela ambulant so na voljo na povezavi https://www.nijz.si/sl/cepljenje-proti-gripi-v-sezoni-20202021.
“,”Jaka Verbic Miklic”,1602608460,1602608460,sl,14503,306,14502,43,0,NULL,,”NIJZ prihodnji teden začenja cepljenje proti gripi”,nijz-prihodnji-teden-zacenja-cepljenje-proti-gripi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1603648948,1603648949
696,14505,”Strokovnjaki pozvali k cepljenju proti gripi “,”Ker je vpliv novega koronavirusa na gripo še ne znan, strokovnjaki pozivajo k cepljenju tako ranljivih skupin kot tudi vseh ostalih.”,”
Ljubljana, 15. oktobra – Za gripo vsako leto zboli okoli 15 odstotkov populacije. Ker je vpliv novega koronavirusa na gripo še ne znan, strokovnjaki pozivajo k cepljenju tako ranljivih skupin kot tudi vseh ostalih. Cepljenje namreč ostaja eden najpomembnejših ukrepov proti okužbi, pripomore pa tudi k lažjemu poteku bolezni.
Cepljenje je najpomembnejši ukrep za preprečevanje gripe, je na današnji novinarski konferenci poudaril vodja Centra za geriatrično medicino v Univerzitetnem kliničnem centru (UKC) Ljubljana Gregor Veninšek. Gripe sicer ni mogoče popolnoma preprečiti, zmanjšati pa je mogoče tveganje za okužbo in omiliti potek bolezni. Imunost po cepljenju traja okoli štiri mesece, zato svetuje čim prejšnje cepljenje, saj bodo tako prebivalci imuni tudi ob koncu sezone gripe.
Zaščita, ki jo nudi cepljenje, je odvisna od seva gripe. Cepljeni bolniki, ki zbolijo, pa imajo lažji potek bolezni. Tako redkeje potrebujejo zdravljenje v bolnišnici, manj je kasnejših zapletov, nižja pa je tudi smrtnost, je povzela Mateja Logar iz klinike za infekcijske bolezni in vročinska stanja UKC Ljubljana.
K preprečevanju okužbe sicer pripomorejo tudi ukrepi, priporočeni v boju proti koronavirusu. Veninšek tako svetuje, naj se ljudje ne zadržujejo v slabo zračenih vlažnih prostorih, še posebej, če se tam nahaja več ljudi. Prav tako svetuje, naj ljudje držijo zadostno medsebojno razdaljo, si pogosto umivajo in razkužujejo roke ter se z rokami ne dotikajo oči, nos in ust. Sicer pa je pomemben tudi zdrav življenjski slog in redna zmerna telesna aktivnost, je še dodal.
Trenutno je cepljenje proti gripi brezplačno za ranljive skupine, med katere spadajo kronični bolniki, starejši od 65 let, osebe s povečano telesno težo, nosečnice in otroci, mlajši od dveh let. DZ sicer danes v okviru petega protikoronskega zakona obravnava predlog, po katerem bi bilo cepljenje za vse vključene v zdravstveno zavarovanje brezplačno.
V zadnji sezoni se je precepljenost povečala. Skupno se je lani cepilo okoli 142.000 oseb, kar predstavlja sedem odstotkov populacija, je pojasnila nacionalna koordinatorica programa cepljenja Marta Grgič Vitek. Precepljenost se je med starejšimi povečala s 13 na 19 odstotkov.
Tudi med otroci se je precepljenost povečala. Lani se je sicer cepilo 367 otrok, mlajših od dveh let. A je v generaciji približno 20.000 otrok, je opozoril vodja pediatrične ambulante Juventina clinic Ljubljana Denis Baš.
Cepljenje priporočajo tudi nosečnicam. Če se nosečnica cepi kasneje v nosečnosti, se bo zaščita bolje prenesla tudi na otroka, je pojasnil Baš.
Ob številnih zavajajočih informacijah so strokovnjaki poudarili, da je cepivo varno. “Ne gre za živo cepivo, tako, da tukaj ne moremo zboleti. To ni mogoče, ker cepivo ne vsebuje živega virusa,” je dejala Logarjeva. Možne so lažje težave, kot je bolečina ali rdečina na mestu vboda, težji zapleti se pojavijo redkeje.
Kakšen bo vpliv koronavirusa na gripo, strokovnjaki še ne znajo pojasniti. Kot je pojasnila Logarjeva, je bila letošnja sezona gripe na južni polobli zelo blaga, informacij o hkratni okužbi tako nimajo veliko. “Vemo pa iz drugih primerov, da če nekdo zboli za virusno okužbo dihal, je sluznica poškodovana in bolj dojemljiva, zaradi tega pa lažje pride do okužbe še z drugim virusom,” je dodala. Okužbi pa vplivata tudi na imunski sistem, kar pomeni, da je potek druge okužbe lahko bistveno težji.
“,”Jaka Verbic Miklic”,1602781560,1602781560,sl,14505,306,14504,43,0,NULL,,”Strokovnjaki pozvali k cepljenju proti gripi “,strokovnjaki-pozvali-k-cepljenju-proti-gripi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1603649218,1603649218
697,14507,”Pred možgansko kapjo nas najbolj ščiti zdrav način življenja”,”Zdrav način življenja od mladih nog naprej najboljša preventiva.”,”
Ljubljana, 15. oktobra – V Društvu za zdravje srca in ožilja Slovenije, kjer si prizadevajo za čim boljšo ozaveščenost o možganski kapi, poudarjajo, da je zdrav način življenja od mladih nog naprej najboljša preventiva. Na to so spomnili tudi na današnji virtualni novinarski konferenci pred svetovnim dnevom možganske kapi, 29. oktobrom.
Svetovni dan bo letos pod geslom Pridruži se gibanju, saj z zdravim načinom življenja lahko pomembno zmanjšamo tveganje za možgansko kap v odrasli dobi, je povedal predsednik društva Matija Cevc. Več kot tretjina vseh možganskih kapi se po njegovih besedah pojavi pri ljudeh, ki se ne gibljejo dovolj. Tveganje pa bo zmanjšalo že 20 do 30 minut zmerne telesne dejavnosti petkrat na teden.
V društvu svetujejo, da zaradi bolezni in nevarnosti širjenja novega koronavirusa ne opuščamo redne telesne dejavnosti. Le prilagodimo jo svojim možnostim in upoštevamo veljavne ukrepe proti širjenju virusa.
Najpomembnejši dejavnik tveganja za možgansko kap, na katerega lahko vplivamo, je sicer visok krvni tlak. Običajno ga sami ne čutimo, pač pa ga čutijo naše žile in srce. Glede na to so zelo pomembne redne kontrole in pa zdravljenje, če je tlak povišan. Poleg tega je pomemben dejavnik tveganja tudi nereden ritem srca oziroma atrijska fibrilacija. V takem primeru je treba k zdravniku.
Četrtina vseh možganskih kapi pa je povezana z nezdravim načinom prehranjevanja. Priporočljiva je prehrana z veliko svežega sadja in zelenjave, obroki pa naj bodo zdravi in pripravljeni doma, predlagajo v društvu.
Nastanek možganske kapi, ki je v razvitem svetu glavni vzrok za invalidnost in tretji vzrok smrtnosti, je v večini primerov mogoče preprečiti, je izpostavila Janja Pretnar Oblak z nevrološke klinike v Ljubljani. Pri tem je po njenih besedah ključno zdravljenje dejavnikov tveganja, kot so visok krvni tlak in povišane vrednosti holesterola, prav tako pa je zelo pomemben tudi zdrav življenjski slog.
Zdravniki ugotavljajo, da je med prvim valom epidemije prišlo v primerjavi z običajnimi obdobji precej manj bolnikov s šibkimi znaki kapi ali s prehodno kapjo, pri katerih je mogoče pojav velike kapi preprečiti. Toda možganska kap je po njenih besedah urgentno stanje tudi med epidemijo, klic na številko 112 pa je nujen.
Telesna dejavnost, ki je pomembna preventiva, je sicer nujna tudi po možganski kapi, je dejala Tatjana Erjavec z Univerzitetnega rehabilitacijskega inštituta Soča, ki je podpredsednica Združenja bolnikov s cerebrovaskularno boleznijo Slovenije. Z doslednim upoštevanjem t. i. sekundarne preventive, torej po prvi kapi, bi lahko zmanjšali pojavnost vnovične ishemične možganske kapi kar za 80 odstotkov, je pojasnila.
Kar tretjina bolnikov po njenih besedah doživi ponovno možgansko kap, pet odstotkov pa jih v prvem letu doživi še srčni infarkt. Slabi petini oseb z ohromelostjo po možganski kapi morajo amputirati nogo.
Društvo za zdravje srca in ožilja v torek vabi na Prešernov trg v Ljubljani na osrednjo prireditev, ki jo organizirajo skupaj z združenjem bolnikov s cerebrovaskularno boleznijo. Pridružila se jim bo tudi Zveza društev diabetikov Slovenije. Osebe s sladkorno boleznijo imajo namreč večjo možnost, da doživijo možgansko in srčno kap, večja je tudi možnost za kronično ledvično bolezni in zaplete, kot sta diabetična slepota in diabetično stopalo.
“,”Jaka Verbic Miklic”,1602781680,1602781680,sl,14507,306,14506,43,0,NULL,,”Pred možgansko kapjo nas najbolj ščiti zdrav način življenja”,pred-mozgansko-kapjo-nas-najbolj-sciti-zdrav-nacin-zivljenja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1603649369,1603649370
698,14516,”Med pandemijo v Sloveniji nemotena oskrba z zdravili”,”Na 9-ti strateški konferenci Vrednost inovacij: Zdravje in zdravstvo prihodnosti so strokovnjaki pohvalili dejstvo, da je preskrba z zdravili potekala nemoteno”,”
V času globalne pandemije v Sloveniji nismo imeli, nimamo in kot kaže tudi ne bomo imeli težav z oskrbo in dobavo zdravil. Čeprav do sedaj o tem nismo dosti govorili, smo vsi odgovorni, od Ministrstva za zdravje, ZZZS in farmacevtskih podjetij, vložili precej naporov, da so zagotovili nemoteno oskrbo z zdravili za vse paciente.
“Izpostaviti je potrebno tudi farmacevtska podjetja, ki so uspela zagotoviti in še vedno zagotavljajo nemoteno oskrbo z zdravili. V vsem tem času nismo v Sloveniji niti enkrat občutili pomanjkanja zdravil,” je na konferenci uvodoma povedala Nataša Jenčič, predsednica Mednarodnega foruma znanstveno raziskovalnih farmacevtskih družb, GIZ (Forum), ob tem pa je poudarila, da ravno v tem času mnogi raziskovalci neutrudno delajo na razvoju cepiva proti Covid-19. Da je bila dostopnost zdravil za bolnike nemotena, je potrdil tudi Marjan Sušelj, direktor Zavoda za zdravstveno zavarovanje Slovenije. Povedal je, da so bile investicije ZZZS v zdravila v prvega pol leta za približno 14 odstotkov višje kot v enakem obdobju lani. Na področju zahtevnejših inovativnih zdravil, ki se običajno uporabljajo na področju bolnišničnega zdravljenja, pa je glede na lansko leto rast še nekoliko višja. “To pomeni, da smo uspeli ohranjati dinamiko vključevanja novih zdravil v sistem,” je dodal Sušelj.
Učinkovit odziv slovenskega zdravstva
Po mnenju mag. Petra Požuna, državnega svetnika za področje zdravstva, predsednika Komisije za socialno varstvo, delo, zdravstvo in invalide Državnega sveta RS, je pandemija Evropo ujela nepripravljeno. Kljub temu meni, da se je v spomladanskem valu pandemije naš zdravstveni sistem odzval efektivno. “Na srečo smo bili priča pogumu in požrtvovalnosti mnogih zdravstvenih delavcev,” je poudaril mag. Požun in ob tem izpostavil tudi študente zdravstvene nege in medicine, ki so prostovoljno priskočili na pomoč, ko je bilo to najbolj potrebno. Ob dejstvu, da je stroka stopila skupaj, ko je bilo to najbolj potrebno, je mag. Požun optimističen glede prihodnosti: “Iz izkušenj lahko povem, da je slovenski zdravstveni sistem še vedno kakovosten, pripravljen in zmožen poskrbeti za vse, ki njegovo pomoč potrebujejo, bodisi s Covidom-19 ali brez. Le dovoliti mu moramo, da opravlja svojo funkcijo in ga zopet odpreti pacientom.”
Tudi Marjan Sušelj, direktor Zavoda za zdravstveno zavarovanje Slovenije, je povedal, da ima Slovenija dobro delujoč zdravstveni sistem: “Relativno hitro smo vzpostavili mrežo, ki je začela sprejemati bolnike okužene s Covid-19.” Kljub temu pa je opozoril na predolgo odlašanje glede investicij v zdravstvu in pomanjkanje bolnišničnih kapacitet ter kadrovskih virov, če bo v prihodnjih mesecih teh bolnikov več. Kot pozitivno je izpostavil še uvajanje digitalnih storitev v slovensko zdravstvo, tako na primarnem kot sekundarnem nivoju.
V splošnem so se govorci strinjali, da je izredno pomembno to, da bolniki niso utrpeli pomanjkanja zdravil, za kar je zaslužen celoten sistem, vključno s farmacevtsko industrijo.
“,”Jaka Verbic Miklic”,1605124500,1605124500,sl,14516,306,14515,43,0,NULL,,”Med pandemijo v Sloveniji nemotena oskrba z zdravili”,med-pandemijo-v-sloveniji-nemotena-oskrba-z-zdravili,Post,”/sites/43/files/images/news/9. strateska/nuovo-coronavirus-come-si-trasmette-e-quali-sono-i-sintomi.jpg”,1,0,1605124557,1605125662
699,14521,”Forumov kodeks ravnanja”,”Sprejet na Skupščini Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ”,”
Forumov Kodeks ravnanja predstavlja zbirko etičnih pravil, ki so jih članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ (»Foruma«) sprejele glede promocije zdravil strokovni javnosti in sodelovanja z zdravstvenimi delavci, zdravstvenimi organizacijami in društvi bolnikov, z namenom zagotoviti, da se te dejavnosti izvajajo ob spoštovanju najstrožjih etičnih načel strokovnosti in odgovornosti.
Ta Kodeks velja za vse vrste komunikacije in sodelovanja, torej tako za klasični kot tudi za digitalni način.
FORUMOV KODEKS RAVNANJA
sprejet na Skupščini Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ dne 20.3.2020 in dopolnjen 16.11.2020, 21.4.2021, 23.9.2022, 1.12.2023, 7.4.2025 in 4.7.2025
Forumov Kodeks ravnanja predstavlja zbirko etičnih pravil, ki so jih članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ (»Foruma«) sprejele glede promocije zdravil strokovni javnosti in sodelovanja z zdravstvenimi delavci, zdravstvenimi organizacijami in društvi bolnikov, z namenom zagotoviti, da se te dejavnosti izvajajo ob spoštovanju najstrožjih etičnih načel strokovnosti in odgovornosti.
Ta Kodeks velja za vse vrste komunikacije in sodelovanja, torej tako za klasični kot tudi za digitalni način.
KAZALO
DEFINICIJE
PREAMBULA
UVODNE NAVEDBE
PODROČJE UPORABE DOLOČIL KODEKSA
IZVAJANJE DOLOČIL KODEKSA
POGLAVJE 1 PROMOCIJA ZDRAVIL NA RECEPT ZDRAVSTVENIM DELAVCEM
Člen 1 – Dovoljenje za promet z zdravilom
Člen 2 – Obvezni podatki pri promociji
Člen 3 – Promocija in njena utemeljenost
Člen 4 – Uporaba citatov pri promociji
Člen 5 – Primernost promocije
Člen 6 – Distribucija promocijskega gradiva
Člen 7 – Transparentnost promocije
Člen 8 – Promocija med mednarodnimi dogodki
Člen 9 – Osebne zdravstvene zadeve
POGLAVJE 2 – SODELOVANJE Z ZD, ZO in DB
Člen 10 – Dogodki in gostoljubnost
Člen 11 – Prepoved dajanja daril
Člen 12 – Donacije in prispevki za izobraževanje za ZO in DB
Člen 13 – Prispevek za stroške v zvezi z dogodki in sponzorstva
Člen 14 – Financiranje s strani članic
Člen 15 – Pogodbeno izvajanje storitev
POGLAVJE 3 – POSEBNE ZAHTEVE ZA SODELOVANJE Z ZD in ZO
Člen 16 – Vseživljenjsko učenje o zdravstvu
Člen 17 – Informativno in izobraževalno gradivo ter izdelki za medicinsko rabo
Člen 18 – Neintervencijska klinična preskušanja zdravil
Člen 19 – Vzorci zdravil
Člen 20 – Osebje in strokovni sodelavci
POGLAVJE 4 – POSEBNE ZAHTEVE ZA SODELOVANJE Z DB
Člen 21 – Sodelovanje z DB
POGLAVJE 5 – OBJAVA PRENOSOV VREDNOSTI
Člen 22 – Objava prenosov vrednosti ZD, ZO in DB
Člen 23 – Objava prenosov vrednosti ZD in ZO
Člen 24 – Objava podpore in storitev, zagotovljenih DB
POGLAVJE 6 – POSTOPKOVNE DOLOČBE
Člen 25 – Odgovornost in sankcije
Člen 26 – Nadzor
Člen 27 – Prijave kršitev
Člen 28 – Spremembe Kodeksa
Člen 29 – Uveljavitev Kodeksa
PRILOGE
Priloga A – Standardizirana predloga za objavo prenosov vrednosti ZD in ZO
Priloga B – Standardizirana predloga za objavo prenosov vrednosti DB
Priloga C – Smernice glede objav podatkov o neintervencijskih študijah in razkritje posrednih prenosov vrednosti (PV) prek tretjih oseb
Priloga D – EFPIA e4ethics pravila in postopek
Priloga E – Smernice EFPIA glede Kakovostnega okvira
Načela vseživljenjskega učenja o zdravstvu
Priloga F – Načela za uporabo digitalnih kanalov
DEFINICIJE
Definicije pojmov so vključene z namenom, da se zagotovi njihovo enovito razumevanje.
Članica: kot je določena v statutu in poslovniku Foruma.
Dogodki: Vsa strokovna, promocijska, znanstvena ali izobraževalna srečanja, kongresi, konference, simpoziji in drugi podobni dogodki (kar brez omejitev vključuje tudi srečanja svetovalnih odborov, obiske raziskovalnih ali proizvodnih obratov in sestanke za načrtovanje, usposabljanje ali srečanja za raziskovalce v povezavi s kliničnimi raziskavami in neintervencijskimi študijami), ki so organizirani ali sponzorirani s strani ali v imenu članice.
Donacije in prispevki za izobraževanje: pomenijo skupno zagotavljanje sredstev ali storitev, danih za namen podpore zdravstvenemu varstvu, znanstvenemu raziskovanju ali izobraževanju, brez posledične obveznosti prejemnika, da v zameno zagotovi blago ali storitve v korist donatorja.
Društvo bolnikov (DB): je nepridobitna pravna oseba/subjekt (vključno s krovno organizacijo, ki ji pripada), ki jo v glavnem sestavljajo bolniki in/ali negovalci in ki zastopa in/ali podpira potrebe bolnikov in/ali negovalcev ter katere poslovni naslov, kraj ustanovitve ali primarni kraj delovanja je v Evropi.
Evropa: vključuje tiste države, v katerih se uporabljajo nacionalni kodeksi združenj, ki so članice EFPIA.
Evropska zveza farmacevtske industrije in združenj (EFPIA): je reprezentativno telo farmacevtske industrije v Evropi.
Informativno ali izobraževalno gradivo: predstavlja gradivo manjše vrednosti, ki se neposredno nanaša na medicinsko ali farmacevtsko dejavnost in ima neposredno korist za oskrbo bolnikov.
Izdelki za medicinsko rabo: predstavljajo izdelke manjše vrednosti, ki so neposredno namenjeni izobraževanju ZD za izboljšanje zdravstvenih storitev in oskrbo bolnikov, ki pa ne krijejo rutinskih stroškov ZD.
Kodeks EFPIA: Kodeks ravnanja EFPIA, vključno s tistimi prilogami, ki so izrecno navedene kot zavezujoče in tvorijo del Kodeksa EFPIA.
Kraj: se nanaša na geografski kraj, kjer je organiziran dogodek (npr. mesto, kraj).
Lokacija: se nanaša na lokacijo, kjer je organiziran dogodek (t.j. hotel, kongresni center).
Nacionalni kodeks: pomeni kodeks, ki ga v posamezni državi sprejme lokalno združenje.
Nacionalno združenje: kot ga pojmuje statut EFPIA, pomeni organizacijo, ki zastopa farmacevtska podjetja na nacionalni ravni in katerega članstvo med drugim vključuje raziskovalna podjetja. Kodeks EFPIA zavezuje nacionalna združenja, če pa to zahteva kontekst, pa tudi njene ustanovne članice.
Načelo države gostiteljice: se nanaša na primarnost mejne denarne vrednosti za obrok (hrano in pijačo), ki ga posamezno nacionalno združenje določi v svojem nacionalnem kodeksu. Relevantna in prevladujoča je mejna denarna vrednost, kot je določena v državi, v kateri se odvija dogodek.
Neintervencijsko klinično preskušanje zdravil: je preskušanje, pri katerem je (so) zdravilo(-a) predpisano(-a) na običajen način v skladu s pogoji dovoljenja za promet z zdravilom. Uvedba določene terapevtske strategije pri bolniku ni vnaprej določena s poskusnimi protokoli temveč sledi običajni praksi, predpisovanje zdravila pa je jasno ločeno od odločitve o vključitvi bolnika v preskušanje. Za bolnike se ne uporabljajo nobeni dodatni diagnostični ali opazovalni postopki, za analizo zbranih podatkov pa se uporabljajo epidemiološke metode.
Obdobje poročanja: se nanaša na letni cikel objave in zajema celotno koledarsko leto.
Osebje članice: osebje, zaposleno pri članici, ali angažirano na podlagi pogodbe s tretjimi osebami, ki se ukvarja s promocijo zdravila, ki jo pokriva ta Kodeks.
Osebni zdravstveni podatki: pomenijo podatke, ki se nanašajo na telesno ali duševno zdravje posameznika ali na podedovane ali pridobljene genetske značilnosti določene ali določljive fizične osebe, vključno z zdravstvenimi storitvami, ki razkrivajo informacije o fiziologiji ali zdravstvenem stanju takšne osebe.
Predstavnik društva bolnikov: je oseba, ki je pooblaščena, da zastopa in izrazi kolektivne poglede DB glede določenega vprašanja ali področja bolezni.
Prejemnik: vsak ZD, ZO ali DB, katerih primarna praksa, glavni naslov izvajanja poklicne dejavnosti ali kraj ustanovitve je v Evropi.
Prenos vrednosti (PV): Neposredni in posredni PV, bodisi v denarju, v naravi ali kako drugače, izveden bodisi za promocijske namene ali za kaj drugega, v zvezi z razvojem in prodajo zdravil na recept izključno za uporabo v humani medicini. Neposredni PV so tisti, ki jih članica izvede neposredno v korist prejemnika. Posredni PV pa so tisti, ki so izvedeni v imenu članice v korist prejemnika, ali tisti, ki so bili izvedeni prek tretje osebe in kadar članica ve ali lahko identificira Prejemnika, ki bo imel korist od prenosa vrednosti.
Prenosi vrednosti na področju raziskav in razvoja: Prenosi vrednosti ZD ali ZO, povezani z načrtovanjem ali izvajanjem (i) nekliničnih preskušanj (kot so opredeljena v načelih OECD o dobri laboratorijski praksi); (ii) kliničnih preskušanj (kot so opredeljena v Uredbi 536/2014); ali (iii) neintervencijskih kliničnih preskušanj, ki so prospektivne narave in ki vključujejo zbiranje podatkov od ali v imenu posameznega ali skupin ZD izključno za preskušanje.
Prispevek za stroške v zvezi z dogodki: je podpora, ki zagotavlja ali krije stroške prehrane, potovanja, nastanitve in/ali pristojbin za registracijo, da se lahko posamezni ZD ali predstavnik DB udeleži dogodka, ki ga organizira ali pripravi članica in/ali tretja oseba.
Promocija: vključuje kakršno koli aktivnost, ki jo izvaja, organizira ali sponzorira članica, ali kdo drug po njenem naročilu, ki spodbuja predpisovanje, dobavo, prodajo, dajanje, priporočanje ali uporabo njenega zdravila oziroma zdravil.
Sponzorstvo: je podpora, ki jo, če je to dovoljeno v skladu z zakonom, zagotovi članica ali kdo v njenem imenu, kot prispevek k podpori dejavnosti (vključno z dogodki), ki jo izvaja, organizira ali pripravi ZO, DB ali tretja oseba.
Strokovni sodelavci farmacevtske družbe: osebje, zaposleno pri članici ali angažirano na podlagi pogodbe s tretjimi osebami, ki sodelujejo z ZD in ZO v zvezi s promocijo zdravil.
Tretja oseba: je pravna oseba/subjekt ali posameznik, ki zastopa članico ali komunicira z drugimi tretjimi osebami v imenu članice ali glede njenega zdravila, kot so distributerji, trgovci na debelo, svetovalci, pogodbene raziskovalne organizacije (CRO), profesionalni organizatorji kongresov, pogodbene angažirani prodajniki, podjetja za raziskave trga, oglaševalske agencije, ponudniki storitev, povezani z dogodki, odnosi z javnostmi in izvajanjem nekliničnih, neintervencijskih kliničnih preskušanj.
Veljavni kodeksi:
(a) (i) če se promocija zdravil ali sodelovanje izvaja, sponzorira ali organizira s strani ali v imenu članice, ki ima sedež v Evropi, velja nacionalni kodeks države, v kateri ima ta članica sedež, (ii) če pa se promocija zdravil ali sodelovanje izvaja, sponzorira ali organizira s strani ali v imenu članice, ki ima sedež izven Evrope, velja Kodeks EFPIA; in
(b) nacionalni kodeks države, v kateri se izvaja promocija zdravil ali poteka sodelovanje.
V primeru kolizije med določbami zgoraj navedenih veljavnih kodeksov, je potrebno uporabiti strožje določbe, razen pri odstavku 10.05. tega Kodeksa, kjer prevlada denarna mejna vrednost, določena v državi, v kateri se dogodek odvija (torej v “državi gostiteljici”).
V primeru mednarodnega dogodka, za katerega članica finančno podpre udeležbo ZD v skladu z določbami 13. člena tega Kodeksa, se za takšno podporo uporabljajo pravila nacionalnega kodeksa države, v kateri ZD opravlja svojo primarno dejavnost in ne države, v kateri poteka mednarodni dogodek.
Vseživljenjsko učenje o zdravstvu: zajema nepromocijsko izobraževanje glede zdravja in bolezni ljudi.
Vzorec zdravil: ima pomen, določen v Direktivi 2001/83/ES Evropskega parlamenta in Sveta z dne 6. novembra 2001 o zakoniku Skupnosti o zdravilih za uporabo v humani medicini (v nadaljevanju: Direktiva 2001/83/ES), in sicer gre za brezplačen vzorec zdravila, posredovan osebam, pooblaščenim za predpisovanje ali izdajo zdravil, da se lahko seznanijo z novimi izdelki in pridobijo izkušnje pri ravnanju z njimi.
Zdravila na recept: je zdravilo, ki zahteva zdravniški recept, ki ga izda strokovna oseba, usposobljena za predpisovanje.
Zdravilo: ima pomen, določen v 1. členu Direktive 2001/83/ES, in sicer pomeni: (a) katerokoli snov ali kombinacijo snovi, ki so predstavljene kot lastnosti za zdravljenje ali preprečevanje bolezni pri ljudeh; ali (b) katerokoli snov ali kombinacijo snovi, ki se lahko uporablja ali daje ljudem za ponovno vzpostavitev, izboljšanje ali spreminjanje fizioloških funkcij prek farmakološkega, imunološkega ali presnovnega delovanja ali za postavitev medicinske diagnoze.
Zdravstvena organizacija (ZO): vsak samostojni podjetnik (s.p.) ali pravna oseba, (i) ki je zdravstveno, medicinsko ali znanstveno združenje oziroma organizacija (ne glede na pravno ali organizacijsko obliko), kot so bolnice, klinike, fundacije, univerze ali druge izobraževalne ustanove ali akademska združenja (razen društev bolnikov v okviru 21. člena tega Kodeksa) ali (ii) preko katere en ali več ZD izvaja storitve.
Zdravstveni delavec (ZD): vsaka fizična oseba, ki je članica zdravstvene, zobozdravstvene, farmacevtske ali negovalne stroke in vse druge osebe, ki lahko pri opravljanju svojih poklicnih dejavnosti predpišejo, kupijo, dobavijo, priporočajo ali dajejo zdravilo in katerih primarna praksa, naslov glavne poklicne dejavnosti ali sedež je v Evropi. Za namen tega Kodeksa, definicija ZD vključuje: (i) uradnika ali zaposlenega v vladni agenciji ali drugi organizaciji (ne glede na to, ali je v zasebnem ali javnem sektorju), ki lahko predpiše, kupi, dobavi, priporoča ali daje zdravila in (ii) zaposleno osebo pri članici EFPIA-e ali Forumu, katere primarni poklic je zdravstveni poklic, vendar pa izključuje (x) ostale zaposlene pri članici EFPIA-e ali Forumu ter (y) veleprodajalca in distributerja zdravil.
PREAMBULA
Ta dokument nadomešča prej veljavne Forumove kodekse , in sicer:
Kodeks obveščanja in seznanjanja o zdravilih na recept in sodelovanja z zdravstvenimi delavci (Kodeks sodelovanja z zdravstvenimi delavci), sprejet na skupščini Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ dne 20. januarja 2012 in spremenjen dne 21. novembra 2013, 4. julija 2014, 27. maja 2016, 23. marca 2018 in 22. marca 2019;
Kodeks sodelovanja z združenji bolnikov, sprejet na skupščini Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ dne 20. januarja 2012 in spremenjen dne 7. decembra 2018 in
Kodeks o javni objavi prenosov vrednosti zdravstvenim delavcem in zdravstvenim organizacijam s strani farmacevtskih družb (Kodeks transparentnosti), sprejet na skupščini Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ dne 21. novembra 2013 in spremenjen dne 4. julija 2014, 5. decembra 2014 in 27. maja 2016.
ETIČNA NAČELA
Farmacevtska podjetja delujemo v sodelovanju z različnimi deležniki, vključno z ZD, ZO, DB in njihovi predstavniki, regulatornimi agencijami, vladnimi organi in javnostjo, z namenom izboljšanja zdravja in kakovosti življenja.
Nenehno vlagamo v raziskave in razvoj za zagotavljanje novih načinov zdravljenja in izboljšanje kakovosti zdravljenja.
Kot gospodarske družbe spodbujamo konkurenco in gospodarski razvoj za potrebne naložbe in spodbujanje inovativnosti.
Verjamemo v to, kar delamo in vemo, da je nekje bolnik, čigar zdravje in dobro počutje je neposredno ali posredno odvisno od našega dela.
Prizadevamo si ustvariti okolje, v katerem bodo deležniki in širša javnost farmacevtske družbe šteli za zaupanja vredne partnerje.
Poleg izpolnjevanja obsežnih zakonskih zahtev (t.j. zakonov in predpisov, ki se uporabljajo za našo industrijo, kot so farmacevtska, konkurenčna in protikorupcijska zakonodaja ter pravila o varstvu intelektualne lastnine in osebnih podatkov), se je farmacevtska industrija odločila, da bo spoštovala še dodatne standarde, dogovorjene v samoregulativnih kodeksih in skupnih stališčih.
Za Forum in njegove članice samoregulacija pomeni, da so odločno zavezane opredeliti, izvajati in uveljaviti najvišje etične standarde, preko združenja EFPIA, Foruma in nacionalnih kodeksov, ki kršitev ne tolerirajo.
Samoregulacija vključuje nenehen izziv za vse nas, da presežemo pričakovanja družbe in zagotovimo posluh za predloge drugih, kako lahko dodatno okrepimo zaupanje v našo industrijo in v naše ravnanje.
Deležniki, ki delijo vrednote in načela, zapisane v tem samoregulativnem Kodeksu, so povabljeni, da se nam pridružijo pri upoštevanju teh pravil in smernic.
ETOS
Naš etos opisuje etična načela, na katerih temelji Kodeks in usmerja sodelovanje industrije s skupnostjo zdravstvenih delavcev, zdravstvenih organizacij in bolnikov.
UVODNE NAVEDBE
Forum in njegove članice se zavedajo pomembnosti (i) zagotavljanja točnih, poštenih in objektivnih informacij o zdravilih, tako da je mogoče sprejeti razumne odločitve o njihovi uporabi, (ii) zagotavljanja, da sodelovanje z ZD, ZO in DB, ki je ključno za izmenjavo znanja z namenom izboljšati kakovost oskrbe bolnikov, poteka na etični način in (iii) uvedbe večje transparentnosti glede sodelovanja farmacevtske industrije z ZD, ZO in DB.
Poglavja 1, 2 in 3 tega Kodeksa odražajo zahteve Direktive 2001/83/ES, kakor je bila spremenjena, v zvezi z zdravili, in spadajo v splošen okvir direktive, ki priznava vlogo prostovoljnega nadzora nad oglaševanjem zdravil s strani samoregulatornih organov in reševanja prijav kršitev, ko se te pojavijo.
Forum spodbuja konkurenco med farmacevtskimi družbami. Namen tega Kodeksa vsekakor ni omejevanje promocije zdravil ZD, niti omejevanje sodelovanja z ZD, ZO in DB na način, ki bi škodoval pošteni konkurenci. Nasprotno, namen Kodeksa je zagotoviti, da farmacevtske družbe promovirajo in z ZD sodelujejo na pošten način in se izogibajo zavajajočim praksam in morebitnim navzkrižjem interesov z deležniki ter v celoti delujejo v skladu z veljavnimi zakoni in predpisi.
Cilj Kodeksa je torej ustvariti okolje, v katerem splošna javnost zaupa, da so odločitve o izbiri zdravila sprejete na podlagi lastnosti posameznega zdravila in potreb posameznega bolnika.
ZD in ZO farmacevtski industriji zagotavljajo dragoceno, neodvisno in strokovno znanje, pridobljeno iz njihovih kliničnih in znanstvenih izkušenj. To strokovno znanje pomembno prispeva k prizadevanjem industrije za izboljšanje kakovosti oskrbe bolnikov s koristmi tako za posameznike kot tudi za družbo nasploh. Zato si ZD in ZO zaslužijo pravično nadomestilo za svoje strokovno znanje in storitve, ki jih zagotavljajo industriji.
Forum meni, da imajo interakcije med članicami in ZD globok in pozitiven vpliv na kakovost obravnave bolnikov in vrednost prihodnjih raziskav. Hkrati velja, da je integriteta pri predpisovanju zdravil eden izmed stebrov sistema zdravstvenega varstva. Forum se zaveda, da lahko interakcije med industrijo in ZD/ZO ustvarjajo možnost za navzkrižje interesov. Posledično so strokovna združenja in združenja industrije, kot so združenje EFPIA ter njene članice ter lokalna združenja, sprejela kodekse in smernice za zagotovitev, da te interakcije izpolnjujejo visoke standarde integritete, kot to pričakujejo bolniki, vladni organi in drugi deležniki.
Z namenom, da bo še naprej uspešna, mora samoregulacija odgovoriti na razvijajoče se potrebe družbe. Forum se še posebej zaveda, da vedno bolj raste pričakovanje, da se interakcije z družbo ne izvajajo samo z integriteto, temveč tudi na transparenten način.
Na enak način farmacevtska industrija sodeluje tudi z DB in se uči iz njihovega znanja in izkušenj stanja bolnikov, kar lahko zagotavlja pravo predstavo o tem, kako je živeti z določenim bolezenskim stanjem, kako se nudi zdravstvena oskrba, kako to vpliva na bolnike, njihove kariere in družine in kako lahko zdravila in druge oblike zdravljenja spremenijo kakovost njihovega življenja in zadovoljevanje njihovih potreb.
DB imajo ključno vlogo pri oblikovanju, razvoju in opredelitvi rešitev, ki najbolj pomagajo bolnikom. Članice v okviru teh interakcij objavljajo zneske, ki jih zagotavljajo DB.
Forum močno podpira javni nadzor in razumevanje teh odnosov, objava pa prispeva k zaupanju deležnikov v farmacevtsko industrijo.
Od uvedbe Kodeksa o javni objavi prenosov vrednosti, si je Forum močno prizadeval, da bi članice spodbudil, da si pri sodelovanju z ZD (in, kjer je to relevantno, z ZO) čimbolj prizadevajo pridobiti soglasje za objavo individualnih podatkov, nikakor pa članice ne bodo kritizirane, če bodo objavile še več podatkov, kot jih določa ta Kodeks.
PODROČJE UPORABE DOLOČIL KODEKSA
Ta Kodeks pokriva:
∙ promocijo zdravil na recept ZD,
∙ sodelovanje med članicami ter ZD, ZO in DB;
∙ objavo prenosov vrednosti, ki članice izvedejo ZD, ZO in DB; in
∙ postopkovne določbe.
Članice odgovarjajo za obveznosti, naložene v skladu s katerimkoli veljavnim kodeksom, tudi če angažirajo tretjo osebo, da v njihovem imenu pripravi ali izvede aktivnosti, ki jih pokriva ta Kodeks. Poleg tega morajo članice sprejeti razumne ukrepe, s katerimi zagotovijo, da tudi vse druge osebe, ki jih angažirajo za pripravo ali izvedbo aktivnosti, ki jih pokriva ta Kodeks, vendar ne delujejo v njihovem imenu (npr. skupna podjetja, licencojemalci), ravnajo v skladu z veljavnimi kodeksi.
Določila tega Kodeksa veljajo za vse oblike promocije, kar brez omejitev vključuje ustne in pisne promocijske aktivnosti in komunikacijo, oglaševanje v revijah in z neposrednimi sporočili, aktivnosti strokovnih sodelavcev, uporabo digitalnih komunikacij in kanalov, kot so spletne strani in družbeni mediji, uporaba avdio-vizualnih sistemov, kot so filmi, video posnetki, storitve shranjevanja podatkov in podobno. Prav tako Kodeks zajema zagotavljanje informativnih ali izobraževalnih gradiv, izdelkov za medicinsko rabo, gostoljubnost v zvezi z dogodki in dajanje vzorcev zdravil.
Kodeks prav tako zajema tudi sodelovanje med članicami ter ZD in ZO, brez omejitev vključno s sodelovanjem v okviru raziskav ali pogodbenih dogovorov (vključno z nekaterimi vidiki kliničnih študij, neintervencijskih kliničnih preskušanj ter svetovanjem in sodelovanjem v posvetovalnih odborih). Kodeks pokriva tudi sodelovanje med članicami in DB.
Namen tega Kodeksa ni omejevati ali urejati aktivnosti, namenjenih splošni javnosti, ki se nanašajo izključno na zdravila, ki se izdajajo brez recepta.
Kodeks ne velja za:
ovojnino, povzetek glavnih značilnosti zdravila in navodila za uporabo zdravila ter druge dokumente, ki jih je odobril pristojni organ ob izdaji dovoljenja za promet z zdravilom ali kasneje, kot tudi ne druge splošne previdnostne ukrepe z namenom varnejše in učinkovitejše uporabe zdravila;
korespondenco in katerokoli drugo informativno gradivo, katerega namen je odgovoriti na specifična vprašanja o določenem zdravilu;
javne objave specifičnega in informativnega tipa, na primer glede nove ovojnine ali opozorila o morebitnih neželenih učinkih, ter kataloge izdelkov in cenike, pod pogojem, da ne vsebujejo nobenih informacij delovanju zdravila;
dejavnosti, ki zadevajo izključno zdravila, ki se izdajajo brez recepta; ali
nepromocijske splošne informacije o članicah (kot so informacije za vlagatelje ali sedanje/potencialne zaposlene), vključno s finančnimi podatki, opisi raziskovalnih in razvojnih programov ter obravnavo regulatornih sprememb, ki vplivajo na članico in njene izdelke.
IZVAJANJE DOLOČIL KODEKSA
Kodeks določa minimalne standarde, ki jih morajo upoštevati članice. Poleg tega morajo družbe članice Foruma spoštovati določbe veljavne slovenske zakonodaje na področju trženja, oglaševanja in obveščanja o zdravilih.
V okviru Foruma deluje Odbor za nadzor določil tega Kodeksa, katerega člani so neodvisni strokovnjaki s posameznih področij in ustreznim strokovnim znanjem ter predstavniki članov Foruma.
Odbor nadzoruje izvajanje tega Kodeksa ter po lastni presoji predlaga spremembe kodeksov ali postopkov, sprejetih za njihovo izvajanje.
Odbor je ustanovljen za presojo informacij o zdravilih, presojo primernosti sodelovanja članic z zdravstvenimi delavci, zdravstvenimi organizacijami in združenji bolnikov ter skladnosti javne objave prenosov vrednosti zdravstvenim delavcem in zdravstvenim organizacijam in društvom bolnikov s strani članic. Odbor deluje kot prostovoljni in samoregulatorni nadzorni organ za vse članice Foruma.
POGLAVJE 1 – PROMOCIJA ZDRAVIL NA RECEPT ZD
ČLEN 1 – DOVOLJENJE ZA PROMET Z ZDRAVILOM
1.01. Zdravila ni dovoljeno promovirati, dokler se ne pridobi dovoljenje za promet z zdravilom, ki dovoljuje njegovo prodajo in dobavo, prav tako ni dovoljena promocija izven odobrenih indikacij.
1.02. Vsi elementi promocije se morajo dosledno ujemati s podatki, navedenimi v povzetku glavnih značilnosti zdravila.
ČLEN 2 – OBVEZNI PODATKI PRI PROMOCIJI
2.01. Vsako promocijsko gradivo mora skladno z veljavno zakonodajo vsebovati naslednje informacije, podane na jasen in čitljiv način:
a. bistvene informacije, ki so skladne s povzetkom glavnih značilnosti izdelka z navedbo datuma, ko so bile te bistvene informacije zbrane ali nazadnje posodobljene;
b. razvrstitev zdravila glede na izdajanje;
c. kadar je to primerno, prodajno ceno ali okvirno ceno okvirno ceno za različne oblike pakiranja in pogoje glede razvrstitve na listo zdravilih, kritih s strani organov socialnega varstva; in
d. promocijsko gradivo, namenjeno strokovni javnosti, mora biti praviloma označeno z oznako »Samo za strokovno javnost.«.
ČLEN 3 – PROMOCIJA IN NJEGOVA UTEMELJENOST
3.01. Promocija mora biti točna, uravnotežena, pravična, objektivna in dovolj popolna, da lahko ZD oblikuje svoje mnenje o terapevtski vrednosti zadevnega zdravila. Temeljiti mora na posodobljeni oceni vseh relevantnih dokazov in takšne dokaze tudi jasno odražati. Ne sme zavajati z izkrivljanjem, pretiravanjem, nepotrebnim poudarjanjem, opuščanjem ali na kakršenkoli drug način.
3.02. Članice morajo biti sposobne utemeljiti promocijske navedbe kot odgovor na razumne zahteve ZD. Promocijske trditve o stranskih učinkih morajo še zlasti odražati razpoložljive dokaze in biti sposobne utemeljitve s kliničnimi izkušnjami. Utemeljitve pa ni potrebno zagotoviti v zvezi z veljavnostjo navedb, odobrenih v dovoljenju za promet z zdravilom.
3.03. Promocija mora spodbujati razumno uporabo zdravil, in sicer tako, da jih predstavi objektivno in brez pretiravanj v opisu njihovih lastnosti. Trditve ne smejo napeljevati k prepričanju, da ima zdravilo ali njegova učinkovina kakšno posebno lastnost, kakovost ali učinek, če tega ni mogoče utemeljiti.
3.04. Kadar se promocija sklicuje na objavljene raziskave, mora biti sklicevanje jasno opredeljeno.
3.05. Kakršnakoli primerjava med različnimi zdravili mora temeljiti na ustreznih in primerljivih vidikih zdravil. Primerjalno oglaševanje ne sme zavajati ali omalovaževati.
3.06. Slikovno gradivo, vključno z grafi, ilustracijami, fotografijami in tabelami, ki je bilo v promocijsko gradivo preneseno iz objavljenih raziskav, mora: (a) imeti jasno naveden(e) natančen(ne) vir(e) slikovnega gradiva; (b) mora biti dosledno reproducirano, razen v primerih, ko se zaradi uskladitve z veljavnim(i) kodeksom(-i) opravi prilagoditev ali sprememba, vendar pa je ob tem potrebno jasno navesti, da je bilo gradivo prilagojeno in/ali spremenjeno.
Še posebej je potrebno paziti, da slikovno gradivo, ki je vključeno v promocijo, ne zavaja glede narave zdravila (na primer ali je primerno za uporabo pri otrocih) ali glede trditev ali primerjav (na primer z uporabo nepopolnih ali statistično nepomembnih informacij ali neobičajnih kriterijev).
3.07. Besede “varno” se nikoli ne sme uporabiti za opis zdravila brez ustrezne obrazložitve.
3.08. Besede “novo” se ne sme uporabiti za opis kateregakoli zdravila ali prodajne oblike, ki je splošno dostopna, ali katerekoli terapevtske indikacije, za katero promocija poteka več kot eno leto od razpoložljivosti na slovenskem tržišču.
3.09. Ni dovoljeno trditi, da zdravilo nima stranskih učinkov in da ni tveganj za zastrupitev ali odvisnost.
ČLEN 4 – UPORABA CITATOV PRI PROMOCIJI
Citati iz medicinske in znanstvene literature ali iz osebnih komunikacij morajo biti natančno uporabljeni (razen ko se zaradi uskladitve z veljavnim(i) kodeksom(i) opravi prilagoditev ali sprememba, vendar pa je treba v tem primeru jasno navesti, da je bilo gradivo prilagojeno in/ali spremenjeno), viri pa natančno navedeni.
ČLEN 5 – PRIMERNOST PROMOCIJE
Članice morajo ves čas upoštevati visoke etične standarde. Promocija (a) ne sme nikoli ogrožati ugleda farmacevtske industrije ali slabiti zaupanja vanjo; (b) mora biti takšna, da upošteva specifično naravo zdravil in strokovni profil ciljne publike; in (c) ne sme biti žaljiva.
ČLEN 6 – DISTRIBUCIJA PROMOCIJSKEGA GRADIVA
6.01. Promocija mora biti usmerjena le na tiste ZD, za katere se lahko razumno domneva, da takšne informacije potrebujejo ali so v njihovem interesu.
6.02. Seznami naslovnikov (adreme) morajo biti posodobljeni. Zahteve za odstranitev s seznamov, morajo biti izpolnjene.
6.03. Ob upoštevanju veljavnih nacionalnih predpisov je za promocijo zdravil prepovedana uporaba faksov, e-pošte, avtomatiziranih klicnih sistemov, besedilnih sporočil in drugih digitalnih komunikacij, razen s predhodno privolitvijo ali na zahtevo tistih, ki jih prejmejo.
ČLEN 7 – TRANSPARENTNOST PROMOCIJE
7.01. Promocija ne sme biti prikrita.
7.02. Klinično spremljanje, postmarketinški programi in postavtorizacijske raziskave (vključno s tistimi, ki so po svoji naravi retrospektivne) ne smejo prikrito promovirati zdravila. Takšni programi in raziskave se morajo izvajati izključno z znanstvenim ali izobraževalnim namenom.
7.03. Kadar članica plača ali kako drugače zagotovi ali uredi objavo promocijskega gradiva v časopisih ali revijah, to promocijsko gradivo ne sme dajati videza neodvisnega uredniškega prispevka.
7.04. Gradivo z informacijami o zdravilih in njihovi uporabi, bodisi da je promocijske narave ali ne, ki ga podpre članica, mora vsebovati jasne navedbe, da ga je podprla konkretna članica.
ČLEN 8 – PROMOCIJA MED MEDNARODNIMI DOGODKI
Promocijsko gradivo, ki se pojavi na razstavnih prostorih ali se posreduje udeležencem na mednarodnih dogodkih, se lahko, razen če je prepovedano ali kako drugače urejeno z lokalnimi zakoni in predpisi, nanaša na zdravila (ali njihovo uporabo), ki niso odobrena v državi, v kateri se dogodek odvija ali so odobrena pod drugačnimi pogoji, pod pogojem: (i) da je vsakemu takšnemu promocijskemu gradivu priložena ustrezna izjava, ki navaja države, v katerih je zdravilo odobreno, in jasno določa, da zdravilo ali indikacija lokalno ni odobreno, in (ii) da ima vsako takšno promocijsko gradivo, ki se nanaša na informacije o predpisovanju (indikacije, opozorila itd.), ki veljajo v državi ali državah, v katerih je zdravilo odobreno, priloženo obrazložitveno izjavo, v kateri je navedeno, da se pogoji, pod katerimi je zdravilo odobreno, razlikujejo od države do države.
ČLEN 9 – OSEBNE ZDRAVSTVENE ZADEVE
Če posamezni predstavnik splošne javnosti prosi za nasvet glede osebnih zdravstvenih zadev, mu je potrebno svetovati, naj se posvetuje z zdravnikom.
POGLAVJE 2 – SODELOVANJE Z ZD, ZO in DB
ČLEN 10 – DOGODKI IN GOSTOLJUBNOST
10.01. Vsi dogodki morajo biti izvedeni na »primernem« kraju in »primerni« lokaciji, ki ustreza glavnemu namenu dogodka, izogibati pa se je potrebno »razvedrilnim« lokacijam, ki so znane po zagotavljanju posebnih vrst zabave (ki ni skladna s kongresno dejavnostjo), kot so lokacije, ki imajo igralnico v okviru kompleksa, ali lokacije, ki ponujajo igrišče za golf kot njihovo glavno atrakcijo. Prav tako se je potrebno izogibati lokacijam, ki se štejejo za »razkošne« lokacije, kot je to npr. hotel s kategorizacijo 5* ali podoben objekt takšne luksuzne kategorije, razen če gre za hotel, ki je veljavno kategoriziran kot »F – kongresni hotel«. Šteje se, da je kategorizacija ločenih kongresnih kapacitet na posamezni lokaciji enaka kategorizaciji hotela ali objekta, v ali neposredno ob katerem se nahajajo.
10.02. Nobena članica ne sme organizirati ali sponzorirati dogodka, ki poteka zunaj njene države (mednarodni dogodek), razen če je:
∙ večina povabljenih iz drugih držav in je glede na državo, iz katere prihaja večina udeležencev, logistično bolj smotrno organizirati dogodek v drugi državi; ali
∙ glede na lokacijo pomembnega vira ali strokovnjaka, ki je predmet ali tema dogodka, logistično bolj smotrno organizirati prireditev v drugi državi.
10.03. Članice smejo nuditi gostoljubnost, če je ta »primerna« in se sklada z drugimi določili veljavnih kodeksov.
10.04. Kritje stroškov, povezano s promocijskimi, strokovnimi ali znanstvenimi dogodki, mora biti omejeno na prevoz, prehrano, namestitev in dejansko pristojbino za registracijo.
Stroški poti, namestitve, pristojbine za registracijo in prehrane se ne štejejo med darila po zakonu, ki ureja integriteto in preprečevanje korupcije. Razumni stroški poti, namestitve in prehrane ter pristojbine za registracijo morajo biti prikazani na pregleden način.
10.05. Članice ne smejo zagotoviti obrokov (hrana in pijača) ZD, zaposlenim v ZO ali predstavnikom DB, razen če vrednostno ne presega 80 EUR (skupaj z DDV) oz. se upoštevajo mejne vrednosti po »načelu države gostiteljice«).
10.06. Stroški se lahko krijejo le udeležencem dogodka, ne pa tudi spremljajočim osebam. V izjemnih primerih, če to upravičujejo dokazane zdravstvene potrebe (npr. invalidnosti ali poškodbe), se lahko potne stroške, prehrano, nastanitev in dejansko pristojbino za registracijo znotraj enakih kriterijev krije tudi spremljevalni osebi.
10.07. Gostoljubnost mora biti na “razumni” ravni in strogo v okvirih glavnega namena dogodka. Na splošno velja, da izkazano gostoljubje ne sme preseči ravni, za katero se predvideva, da bi bili zanjo takšni posamezniki pripravljeni plačati tudi sami.
10.08. Gostoljubje ne sme vključevati sponzoriranja ali organizacije zabavnih (npr. športnih ali v prostem času) dogodkov. Ne sme se zagotoviti ali plačati nobenega samostojnega razvedrila ter drugih interesnih ali družabnih dejavnosti. Na srečanjih je dovoljeno zmerno (preprosto) razvedrilo, ki je drugotnega pomena v primerjavi z osvežilnimi napitki in/ali prehrano.
ČLEN 11 – PREPOVED DAJANJA DARIL
11.01. Darila za osebno korist (kot so vstopnice za športne ali zabavne prireditve, družabna darila) ZD, zaposlenim ali članom ZO ali predstavnikom DB (dana bodisi neposredno bodisi posredno) so prepovedana.
Prepovedano je tudi zagotavljanje ali ponujanje gotovine, denarnih ustreznikov ali osebnih storitev. Za te namene so osebne storitve vse vrste storitev, ki niso povezane s poklicem in ki prejemniku zagotavljajo osebno korist.
11.02. Pripomoček za promocijo je izdelek zanemarljive denarne vrednosti, dan za promocijski namen (ki ne vključuje promocijskih gradiv, kot so opredeljena v poglavju 1). Njihovo deljenje ali ponujanje ZD, zaposlenim ali članom in ZO ali predstavnikom DB v zvezi s promocijo zdravil na recept je prepovedano.
ČLEN 12 – DONACIJE IN PRISPEVKI ZA IZOBRAŽEVANJE ZA ZO IN DB
12.01. Donacije in prispevki za izobraževanje (v denarju, v naravi ali na drug način) ZO in DB so dovoljeni le pod pogojem, če: (i) so namenjeni podpori zdravstvene oskrbe, raziskavam ali izobraževanju; (ii) so dokumentirani in arhivirani v evidenci donatorja/podpornika; in (iii) ne predstavljajo spodbude za priporočanje in/ali predpisovanje, nakup, dobavo, prodajo ali dajanje določenega zdravila.
12.02. Dajanje donacij in prispevkov za izobraževanje posameznikom ni dovoljeno, je pa možno kriti stroške v zvezi z udeležbo na dogodkih skladno s 13. členom tega Kodeksa.
ČLEN 13 – PRISPEVEK ZA STROŠKE V ZVEZI Z DOGODKI IN SPONZORSTVA
13.01. Članice morajo izpolnjevati merila, ki urejajo izbiro in podporo ZD ali predstavnikov DB, da se udeležijo dogodkov, kot je določeno v ali v povezavi z vsemi veljavnimi kodeksi. Ne sme se ponuditi plačila samo za porabljen čas, ki ga ob udeležbi na dogodku prebije ZD ali predstavnik DB.
13.02. Če želi članica javno uporabiti logotip ZO ali DB in/ali njihov lastniški material, potrebuje za to dovoljenje te organizacije. Pri pridobivanju takšnega dovoljenja je treba jasno navesti namen in način, kako se bosta logotip in/ali lastniški material uporabljala.
13.03. Članice morajo zagotoviti, da je njihovo sponzorstvo ZO in DB vedno jasno izkazano in očitno že na prvi pogled.
ČLEN 14 – FINANCIRANJE S STRANI ČLANIC
Nobena članica ne sme zahtevati, da bo edini podpornik ali sponzor DB ali ZO ali katerega koli od njihovih programov.
Članice pozdravljajo široko financiranje in sponzoriranje DB in ZO iz več virov.
ČLEN 15 – POGODBENO IZVAJANJE STORITEV
15.01. Pogodbe med članicami in ZD, ZO, DB ali predstavniki DB, v skladu s katerimi ti zagotavljajo katerokoli vrsto storitev za članice (ki sicer niso zajete v Kodeksu), so dovoljene le, če so te storitve: (i) zagotovljene za namen podpiranja zdravstva, raziskav ali izobraževanja; in (ii) ne predstavljajo spodbude za priporočanje in/ali predpisovanje, nabavo, dobavo, prodajo ali dajanje določenih zdravil.
15.02. Dovoljeno je angažirati ZD in ali predstavnike DB kot svetovalce, posamično ali v skupinah, za storitve, kot so predavanja in vodenje sestankov, sodelovanje pri medicinskih /znanstvenih raziskavah, kliničnih raziskavah ali izobraževanju, sodelovanje na sestankih svetovalnega odbora in sodelovanje pri tržnih raziskavah, kjer takšno sodelovanje vključuje plačilo in/ali gostoljubje. Dogovori, ki se nanašajo na dejansko svetovanje ali druge storitve, morajo, v obsegu, ki ustreza posameznemu dogovoru, izpolnjevati naslednja merila:
a. pogodba ali dogovor v pisni obliki mora biti sklenjen pred začetkom izvajanja storitev, v njem pa je navedena narava storitev, ki bodo opravljene, in ob upoštevanju spodnje točke (g), podlaga za plačevanje teh storitev;
b. upravičena potreba po storitvah mora biti jasno opredeljena in dokumentirana že pred povpraševanjem za izvedbo storitev in pred sklenitvijo dogovora;
c. merila za izbiro svetovalcev se morajo nanašati neposredno na določeno potrebo, osebe, odgovorne za izbiro svetovalcev, pa morajo imeti ustrezno strokovno znanje za presojo ali posamezen zdravstveni strokovnjak izpolnjuje ta merila;
d. število najetih svetovalcev in obseg storitev ne sme biti večje, kot je razumno potrebno za izpolnjevanje določene potrebe;
e. članica, ki sklene pogodbo, mora voditi evidenco, ki se nanaša na storitve, ki jih ponujajo svetovalci, in mora takšne storitve tudi ustrezno uporabljati;
f. angažiranje svetovalcev za opravljanje določene storitve ne sme spodbujati priporočanja, predpisovanja, nakupa, dobave, prodaje ali dajanja določenega zdravila;
g. plačilo za storitve mora biti razumno in odražati pošteno tržno vrednost opravljenih storitev. V povezavi s tem se za opravičilo plačil ZD in predstavnikom DB ne sme uporabljati fiktivnih dogovorov o svetovanju.
15.03. Članice se močno spodbuja, da v pisne pogodbe s svetovalci vključijo določbe, ki se nanašajo na dolžnost svetovalca, da vedno, kadar za javnost piše ali govori o zadevi, ki je predmet pogodbe, ali o vprašanju, ki se nanaša na to članico, navede, da je svetovalec te članice.
Prav tako se močno spodbuja članice, ki za skrajšani delovni čas zaposlujejo zdravstvene delavce, ki še vedno opravljajo svojo prakso, da od takšnih oseb zahtevajo, da svoj status zaposlitve pri članici navedejo vedno, kadar za javnost pišejo ali govorijo o zadevah, ki so predmet zaposlitve, ali katerem koli drugem vprašanju, ki se nanaša na članice. Določbe, ki izhajajo iz tega člena 15.03, veljajo kljub temu, da ta Kodeks sicer ne pokriva nepromocijskih splošnih informacij o članicah (kot je določeno v poglavju »Področje uporabe Kodeksa«).
15.04. Omejene tržne raziskave, kot so enkratne telefonske ankete ali vprašalniki po pošti/e-pošti/internetu, ne sodijo v obseg 15. člena tega Kodeksa, če ZD, član ZO ali predstavnik DB ne zagotavlja svetovanja na redni osnovi (glede na splošno pogostost klicev ali klicev, ki se nanašajo na isto raziskavo) in nedenarno nadomestilo ne presega 42 EUR (skupaj z DDV) na anketo ali vprašalnik.
15.05. Če se ZD ali predstavnik DB udeleži dogodka (mednarodnega ali drugega) kot svetovalec, veljajo ustrezne določbe 10. člena tega Kodeksa.
POGLAVJE 3 – POSEBNE ZAHTEVE ZA SODELOVANJE Z ZD IN ZO
ČLEN 16 – VSEŽIVLJENJSKO UČENJE O ZDRAVSTVU
16.01. Vseživljenjsko učenje o zdravstvu (VUZ) je namenjeno pridobivanju dodatnega strokovnega znanja in usposobljenosti ZD z namenom izboljšanja medicinske prakse in rezultatov zdravljenja bolnikov.
16.02. Članice lahko izvajajo ali podpirajo različne vrste izobraževalnih programov, vendar takšne aktivnosti ne smejo predstavljati promocije.
16.03. Te aktivnosti so lahko v eni od sledečih treh oblik 1) kot neodvisno medicinsko izobraževanje, torej izobraževanje, ki ga izvaja neodvisna organizacija in ga financira industrija; 2) kot programi, ki so zasnovani v sodelovanju z drugim deležnikom; ali 3) kot aktivnosti VUZ, ki jih izvaja farmacevtska industrija.
16.04. Pri financiranju neodvisnega medicinskega izobraževanja ali organiziranju aktivnosti VUZ neposredno ali v sodelovanju s tretjimi osebami, morajo članice zagotoviti, da je njihova udeležba in vloga jasno razvidna in očitna že na prvi pogled.
16.05. Vsebina VUZ mora biti poštena, uravnotežena in objektivna ter zasnovana tako, da omogoča izražanje različne, z dokazi podprte znanosti in izpolnjevanje neizpolnjenih izobraževalnih potreb v zdravstvu. Ta člen dopolnjujejo Smernice glede Kakovostnega okvira za VUZ (Priloga E).
ČLEN 17 – INFORMATIVNO IN IZOBRAŽEVALNO GRADIVO TER IZDELKI ZA MEDICINSKO RABO
17.01. Razdeljevanje informativnih in izobraževalnih gradiv je dovoljeno, če so: (i) “razumne vrednosti”, (ii) neposredno povezana z opravljanjem zdravstvene ali lekarniške dejavnosti, in (iii) neposredno koristna za oskrbo bolnikov.
17.02 Izdelki za medicinsko rabo, namenjeni neposredno izobraževanju ZD in oskrbi bolnikov, se lahko delijo pod pogojem, da so “razumne vrednosti” in ne krijejo rutinskih stroškov ZD.
17.03. Narava informativnih in izobraževalnih gradiv in izdelki za medicinsko rabo ne sme pomeniti izogibanja prepovedi dajanja daril, opredeljene v 11. členu tega Kodeksa. Dajanje takšnih gradiv prav tako ne sme predstavljati spodbude za priporočanje in/ali predpisovanje, nakup, dobavo, prodajo ali dajanje zdravila.
17.04. Informativno in izobraževalno gradivo ter izdelki za medicinsko rabo lahko vključujejo ime članice, vendar ne sme biti vsebovati blagovne znamke izdelka, razen če je ime zdravila bistveno za pravilno uporabo materiala ali izdelka s strani bolnika.
ČLEN 18 – NEINTERVENCIJSKA KLINIČNA PRESKUŠANJA ZDRAVIL
18.01. Neintervencijska klinična preskušanja se morajo izvajati s primarnim znanstvenim namenom in ne smejo predstavljati prikrite promocije.
18.02. Neintervencijska klinična preskušanja, ki so po naravi prospektivna in vključujejo zbirko podatkov o bolnikih, namenjenih posebej za preskušanje in zbranih s strani ali na zahtevo posameznega zdravstvenega delavca ali skupine njih, morajo biti v skladu z naslednjimi merili:
a. obstajati mora pisni načrt preskušanja (opazovalni načrt/protokol);
b. v državah, kjer so komisije za medicinsko etiko pripravljene takšne študije pregledati, je treba načrt študije v pregled predložiti tudi komisiji za medicinsko etiko;
c. načrt preskušanja mora odobriti medicinski oddelek članice, prav tako pa mora medicinski oddelek nadzirati izvajanje preskušanja skladno s točko 20.01.a tega Kodeksa;
d. rezultati preskušanja morajo biti analizirani s strani ali v imenu članice, povzetek rezultatov pa mora biti v razumnem obdobju na voljo strokovni službi članice, ki je odgovorna za izvajanje kliničnih preskušanj (kot je opisano v točki 20.01.a tega Kodeksa), ki mora za razumno obdobje takšna poročila shraniti. Članica mora povzetek poročila posredovati vsem ZD, ki so sodelovali pri preskušanju, povzetek poročila pa mora, na njihovo zahtevo, dati na voljo tudi samoregulatornim organom industrije, ki so zadolženi za nadzor ali uveljavljanje veljavnih kodeksov. Če so rezultati preskušanja pomembni za ocenjevanje razmerja med koristmi in tveganji, je treba povzetek poročila nemudoma posredovati ustreznemu pristojnemu organu; in
e. strokovni sodelavci lahko sodelujejo le pri administrativnih opravilih, takšno sodelovanje pa mora biti pod nadzorom medicinskega oddelka članice, ki prav tako zagotovi, da so strokovni sodelavci ustrezno usposobljeni. Takšno sodelovanje ne sme biti povezano s promocijo zdravila.
18.03 Članice se v ustreznem obsegu spodbuja, da skladno s točko 18.02 tega Kodeksa delujejo pri vseh drugih vrstah neintervencijskih kliničnih preskušanj, vključno z epidemiološkimi študijami in registri ter drugimi študijami, ki so retrospektivne narave. V vsakem primeru za takšna preskušanja velja točka 15.01 tega Kodeksa.
ČLEN 19 – VZORCI ZDRAVIL
19.01. V skladu z veljavnim Pravilnikom o oglaševanju zdravil se osebam, pooblaščenim za predpisovanje zdravil, načeloma ne sme dajati brezplačnih vzorcev zdravil, razen izjemoma kadar je potrebno pacienta poučiti o načinu uporabe novega zdravila, pod naslednjimi pogoji:
zdravilo ni namenjeno za peroralno uporabo;
zdravilo ima dovoljenje za promet v skladu z zakonom;
za zdravilo niso določeni posebni pogoji shranjevanja, kot je hladna veriga;
od pridobitve dovoljenja za promet z zdravilom ali od odobritve spremembe dovoljenja za promet, ki zahteva novo vlogo, ni preteklo več kot dve leti;
vse vzorce se dostavi le na pisno prošnjo, ki jo predpisovalec podpiše in opremi z datumom;
prejemnik mora o prejetih vzorcih voditi evidenco in jih ne sme prodajati;
noben vzorec ne sme biti večji od najmanjšega pakiranja na trgu;
vsem vzorcem mora biti priložen izvod povzetka glavnih značilnosti zdravila;
vzorec ne sme vsebovati narkotičnih ali psihotropnih snovi.
19.02. Vzorcev zdravil se ne sme dajati z namenom spodbujanja, priporočanja, predpisovanja, nakupa, dobave, prodaje ali dajanja določenih zdravil, niti se jih ne sme dajati za namen samega zdravljenja bolnikov.
19.03. Članice morajo imeti ustrezne sisteme za evidentiranje, nadzor in odgovornost za vzorce, ki jih distribuirajo, in za vsa zdravila, s katerimi ravnajo njihovi strokovni sodelavci. Ti sistemi morajo jasno določati, da lahko ZD, na leto prejme le en vzorec posameznega zdravila v najmanjšem pakiranju, za katero je pridobljeno dovoljenje za promet in za katerega je imetnik dovoljenja za promet organ, pristojen za zdravila pisno obvestil o dejanskem začetku prometa.
19.04. Vsak vzorec mora biti označen z napisom “brezplačen vzorec – ni za prodajo”, ali besedilom v tem smislu in mora imeti priložen izvod povzetka glavnih značilnosti zdravila.
ČLEN 20 – OSEBJE IN STROKOVNI SODELAVCI ČLANIC
20.01. Osebje članic mora biti v celoti seznanjeno z določbami veljavnih kodeksov, zakonov in predpisov.
a. Vse članice morajo imeti strokovno službo, ki se ukvarja z informacijami o njenih medicinskih izdelkih in odobrava ter nadzoruje neintervencijska klinična preskušanja zdravil. Članice lahko svobodno odločajo o tem, kako najbolje vzpostaviti takšne storitve v skladu s to točko 20.01 tega Kodeksa (t.j. ali bodo imele eno službo, pristojno za obe nalogi ali pa dve ločeni z jasno razmejenimi nalogami), glede na lastna sredstva in organizacijo. Taka strokovna služba mora imeti zdravnika ali, če je to primerno, farmacevta, ki je odgovoren za odobritev promocijskih gradiv pred objavo. Ta oseba mora s podpisom potrditi, da je pregledala končno različico promocijskega gradiva, da je to po njenem mnenju skladno z zahtevami veljavnega(-ih) kodeksa(-ov) ter veljavne zakonodaje in predpisov s področja promocije, da je promocijsko gradivo skladno s povzetkom glavnih značilnosti zdravila ter da so medicinska dejstva predstavljena pošteno in verodostojno. Poleg tega mora strokovna služba vključevati tudi zdravnika ali, če je to primerno, farmacevta, ki je odgovoren za nadzor neintervencijskih kliničnih preskušanj zdravil (vključno z nadzorom vseh zadolžitev v zvezi s takšnimi preskušanji, še posebej glede obveznosti, ki jih izpolnjujejo strokovni sodelavci). Ta oseba mora s podpisom potrditi, da je pregledala protokol neintervencijskega kliničnega preskušanja in je po njenem mnenju v skladu z zahtevami veljavnega(-ih) kodeksa(-ov) in veljavne zakonodaje.
b. Vsaka članica mora imenovati vsaj enega višje rangiranega zaposlenega, ki mora biti odgovoren za nadzor nad članico in njenimi hčerinskimi družbami, da se zagotovi, da so izpolnjeni standardi veljavnih kodeksov.
20.02. Vsaka članica mora zagotoviti, da so njeni strokovni sodelavci seznanjeni z ustreznimi zahtevami veljavnih kodeksov in vse veljavne zakonodaje ter so ustrezno usposobljeni in imajo dovolj strokovnega znanja, da lahko zagotovijo natančne in popolne informacije o zdravilih, ki jih promovirajo.
a. Strokovni sodelavci morajo izpolnjevati vse ustrezne zahteve veljavnih kodeksov in vse veljavne zakonodaje, članice pa so odgovorne za zagotavljanje skladnosti.
b. Strokovni sodelavci morajo svoje naloge opravljati odgovorno in etično.
c. Med vsakim obiskom in ob upoštevanju veljavnih zakonov morajo strokovni sodelavci dati obiskani osebi, ali imeti pri sebi na voljo, povzetek glavnih značilnosti zdravila za vsako zdravilo, ki ga predstavljajo.
d. Strokovni sodelavci morajo nemudoma posredovati strokovnih službam svojih podjetij vse informacije, ki jih prejmejo v zvezi z uporabo njihovih zdravil, zlasti pa poročila o neželenih učinkih.
e. Strokovni sodelavci morajo zagotoviti, da pogostost, časovna razporeditev in trajanje obiskov ZD, lekarn, bolnišnic ali drugih zdravstvenih ustanov, skupaj z načinom, na katerega so izvedeni, ne motijo njihovega rednega dela.
f. Strokovni sodelavci ne smejo uporabljati nobene spodbude ali pretveze, da bi si zagotovili obisk. Na obisku oziroma pri dogovarjanju za obisk morajo strokovni sodelavci od samega začetka sprejeti razumne ukrepe, s katerimi bodo zagotovili, da ne bo zavajali glede njihove identitete ali identitete članice, ki jo zastopajo.
POGLAVJE 4 – POSEBNE ZAHTEVE ZA SODELOVANJE Z DB
ČLEN 21 – SODELOVANJE Z DB
21.01. Članice morajo upoštevati naslednja načela, ki jih je sprejela EFPIA skupaj z vseevropskimi DB:
1. DB mora biti zagotovljena neodvisnost pri odločanju o politikah delovanja in njihovih aktivnostih.
2. Vsi odnosi med DB in članicami morajo temeljiti na medsebojnem spoštovanju, pri čemer so pogledi in odločitve obeh partnerjev enako pomembne.
3. Članice ne smejo zahtevati, DB pa ne smejo izvajati nobenega promocije določenega zdravila, ki se izdajajo na recept.
4. Cilji in obseg vseh odnosov morajo biti pregledni. Finančna in nefinančna pomoč, ki jo zagotovijo članice, mora biti vedno jasno razvidna.
5. Članice pozdravljajo široko financiranje DB z več virov.
21.02. Zakonodaja EU ter nacionalna zakonodaja prepovedujeta oglaševanje zdravil na recept splošni javnosti.
21.03. Kadar članica DB zagotovi finančno pomoč, znatno posredno pomoč in/ali znatno nefinančno pomoč, mora imeti za to sklenjen pisni dogovor. V njem morata biti navedena znesek sredstev in namen (npr. nezavezujoča donacija, posebno srečanje ali publikacija). Prav tako mora dogovor vsebovati opis znatne posredne pomoči (npr. donacija časa agencije za odnose z javnostmi in naravo njene vključenosti) in znatne nefinančne pomoči.
21.04. Članice ne smejo vplivati na besedilo gradiva DB, ki ga sponzorirajo, na način, ki bi pozitivno vplival na njihove lastne komercialne interese. To ne preprečuje članicam, da bi ne smele popraviti netočnosti v dejanskih podatkih. Poleg tega lahko članice na zahtevo DB prispevajo k pripravi besedila, s poštene in uravnotežene znanstvene perspektive.
POGLAVJE 5 – OBJAVA PRENOSOV VREDNOSTI
ČLEN 22 – OBJAVA PRENOSOV VREDNOSTI ZD, ZO in DB
22.01. Čas objave
Članica mora podatke objaviti v 6 mesecih po koncu ustreznega obdobja poročanja, javno objavljene informacije pa morajo biti na voljo javnosti vsaj 3 leta od datuma prve objave, razen če v posameznem primeru (i) nacionalna zakonodaja predpisuje krajše obdobje ali (ii) če pravna podlaga za obdelavo osebnih podatkov (npr. legitimni interes, zakonska obveznost ) ne obstaja več.
Skupno obdobje za objavo poročil o prenosih vrednosti prejemnikom se določi najkasneje v časovnem intervalu med 20. in 30. junijem vsako leto.
ČLEN 23 – OBJAVA PRENOSOV VREDNOSTI ZD in ZO
23.01. Namen
Ta člen opredeljuje javno objavo drugih prenosov vrednosti ZD in ZO, bodisi neposredno ali posredno. Pri odločanju o načinu javne objave prenosa vrednosti se članice spodbuja, naj objavijo podatke na ravni posameznih ZD (ne ZO), če je to mogoče storiti z zadostno točnostjo, doslednostjo in skladno z veljavno zakonodajo.
23.02. Obveznost objave
Splošna obveznost. V skladu z določiti tega člena mora vsaka članica dokumentirati in objaviti plačila in druge prenose vrednosti, ki jih izvede neposredno ali posredno prejemniku ali v njegovo korist, kot je podrobno opisano v točki 23.05 tega Kodeksa.
Izključene objave. Brez omejitev, prenosi vrednosti, ki (i) se nanašajo izključno na zdravila, ki se prodajajo ali izdajajo brez recepta, (ii) ki niso navedeni v točki 23.05 tega Kodeksa, torej izdelki za medicinsko rabo (17. člen tega Kodeksa), prehrana in pijača na dogodkih (10. člen tega Kodeksa, zlasti točka 10.05) ter vzorci zdravil (19. člen tega Kodeksa), oziroma (iii) so del običajnega postopka nabave in prodaje zdravil med članico in ZD (kot je na primer farmacevt) ali ZO, ne zapadejo v področje obvezne objave, opisane zgoraj v poglavju “Splošna obveznost”.
23.03. Oblika objave
Letni cikel objav. Podatki o plačilih in drugih prenosih vrednosti se objavijo enkrat letno, pri čemer vsako obdobje poročanja pokriva celotno koledarsko leto.
Predloga. Za namen večje doslednosti se objava v skladu s tem členom opravi na standardizirani predlogi, ki je določena v Prilogi A.
Mesto objav. Podatki se objavijo na spletni strani članice ali njenih povezanih oseb, pod pogojem, da dostop na spletno stran ni omejen.
Veljavni nacionalni kodeks. Podatki se objavijo v skladu z nacionalnim kodeksom države, v kateri ima prejemnik naslov opravljanja glavne poklicne dejavnosti ali registriran sedež. Če članica ni prisotna in nima podružnice ali povezane družbe v državi, kjer ima prejemnik naslov opravljanja glavne poklicne dejavnosti ali registriran sedež, članica tak prenos vrednosti objavi na način, ki je skladen s kodeksom, ki jo zavezuje v njeni matični državi.
Jezik objav. Objave se opravijo v slovenskem jeziku. Članice se spodbuja, naj poleg obvezne objave v slovenskem jeziku podatke objavijo tudi v angleščini.
Dokumentacija in hramba evidenc. Vsaka članica dokumentira vsa plačila in druge prenose vrednosti, ki jih je treba objaviti v skladu s točko 23.03 tega Kodeksa in hrani ustrezne evidence o objavah po tem Kodeksu vsaj 5 let po koncu ustreznega obdobja poročanja, razen če veljavnimi nacionalni zakoni ali predpisi ne zahtevajo krajšega obdobja.
23.05. Objava posamičnih in skupinskih podatkov
Objava posamičnih podatkov. Razen če ni v tem členu izrecno drugače določeno, se prenosi vrednosti objavijo individualno. Vsaka članica objavi podatke za vsakega posameznega jasno določljivega prejemnika, zneske prenosov vrednosti na takega prejemnika v vsakem obdobju poročanja, ki jih je mogoče razumno razvrstiti v eno od spodaj navedenih kategorij. Razumni stroški poti, namestitve in pristojbina za registracijo morajo biti prikazani na pregleden način, kot navedeno v nadaljevanju. Takšni prenosi vrednosti so lahko združeni po posameznih kategorijah, vendar pa je na zahtevo (i) prejemnika in/ali (ii) upravnega organa članice potrebno predložiti podatke po posameznih postavkah.
1. Za prenose vrednosti na ZO se objavi znesek, povezan s katero koli spodaj navedeno kategorijo:
a. Donacije in prispevki za izobraževanje. Donacije in prispevki ZO v podporo zdravstveni oskrbi, vključno z donacijami in prispevki za izobraževanje (v denarju ali v naravi), dane ustanovam, organizacijam ali združenjem, ki jih sestavljajo ZD in/ali nudijo zdravstvene storitve (kot to določa 12. člen tega Kodeksa).
b. Prispevek za kritje stroškov, povezanih z dogodki. Prispevek za kritje stroškov, povezanih z dogodki, preko ZO ali tretjih oseb, vključno s podporo ZD, da se udeležijo dogodkov, kot so:
i. Pristojbine za registracijo;
ii. Sponzorske pogodbe z ZO ali tretjimi osebami, ki jih imenuje ZO za organizacijo in vodenje dogodka; in
iii. Stroški za potovanje in namestitev (v obsegu kot to določa 10. člen tega Kodeksa).
c. Nadomestila za storitve in svetovanje. Prenosi vrednosti na podlagi pogodb med članicami in ZO, na podlagi katerih takšne ZO zagotavljajo kakršnekoli storitve članici ali druge oblike financiranja, ki niso opredeljene v prejšnjih kategorijah. Ločeno je potrebno javno objaviti nadomestila za storitve in svetovanje ter druge stroške, povezane s storitvami in svetovanjem (npr. potne stroške, druge materialni stroške,…)
2. Za prenose vrednosti na ZD:
a. Prispevek za kritje stroškov, povezanih z dogodki. Prispevek za kritje stroškov, povezanih z dogodki, kot so:
i. Pristojbine za registracijo; in
ii. Stroški za potovanje in namestitev (v obsegu kot to določa 10. člen tega Kodeksa).
b. Nadomestila za storitve in svetovanje. Prenosi vrednosti na podlagi pogodb med članicami in ZD, na podlagi katerih takšne ZD zagotavljajo kakršnekoli storitve članici ali druge oblike financiranja, ki niso opredeljene v prejšnjih kategorijah. Ločeno je potrebno javno objaviti nadomestila za storitve in svetovanje ter druge stroške, povezane s storitvami in svetovanjem (npr. potne stroške, drugi materialni stroški,…)
Objava skupinskih podatkov. Pri prenosih vrednosti, kjer nekaterih podatkov, ki jih je sicer možno razporediti v eno od kategorij, opredeljenih v točki 23.05 tega Kodeksa, zaradi pravnih razlogov ni mogoče javno objaviti posamično, članica javno objavi zneske takih prenosov vrednosti agregirano, za vsako obdobje poročanja. Takšna agregirana javna objava mora za vsako kategorijo navesti (i) število prejemnikov, ki jih vključuje, absolutno in kot odstotek vseh prejemnikov in (ii) skupni znesek prenosov vrednosti takšnim prejemnikom.
Brez podvajanja. Pri prenosih vrednosti, ki jih je treba javno objaviti v skladu s točko 23.05. tega Kodeksa, na posameznega ZD posredno prek ZO, je treba takšen prenos vrednosti javno objaviti le enkrat. Ta javna objava mora biti v čim večji možni meri izvedena po posameznem ZD, skladno s točko 23.05 tega Kodeksa.
Prenosi vrednosti na področju raziskav in razvoja.
Vsaka članica javno objavi plačila na področju raziskav in razvoja na agregirani osnovi, za vsako obdobje poročanja. Stroški v zvezi z dogodki, ki so očitno povezani z aktivnostmi iz te točke, se lahko vključijo v skupinsko poročanje v kategorijo “Prenosi vrednosti na področju raziskav in razvoja”.
Metodologija. Vsaka članica mora objavi poročilo, v katerem povzame metodologije, ki jih je uporabila pri pripravi objav in identifikaciji prenosov vrednosti za vsako kategorijo, opisano v točki 23.05 tega Kodeksa. V poročilu je treba poleg splošnega povzetka in/ali specifik posameznih držav, opisati uporabljene metodologije, prav tako pa lahko vključuje obravnavo večletnih pogodb, DDV in druge davčne vidike, pojasnila, povezana z valutami, in druga vprašanja glede časa in zneska prenosa vrednosti za namene tega Kodeksa.
ČLEN 24 – OBJAVA PODPORE IN STORITEV, ZAGOTOVLJENIH DB
Vsaka članica mora objaviti seznam DB, ki jim zagotavlja finančno podporo, in/ali znatno posredno/nefinančno podporo ali s katerimi je sodelovala pri izvajanju pogodbenih storitev za to članico.
Pojem »znatna« pomoč iz prejšnjega odstavka pomeni katero koli pomoč ali storitev, ki ji je mogoče pripisati denarno vrednost, ki presega 150 EUR na transakcijo in 600 EUR na leto.
Objava mora vključevati opis narave podpore ali storitev, ki je dovolj popolna, da lahko povprečni bralec razume naravo podpore ali dogovora, ne da bi bilo potrebno razkriti zaupne informacije. Poleg naziva DB, mora jo biti objavljeni še sledeči podatki:
a. Za podporo:
denarna vrednost finančne podpore in zaračunanih stroškov.
nedenarna korist, ki jo prejme DB, ko nefinančni podpori ne mogoče pripisati smiselne denarne vrednosti.
b. Za pogodbene storitve: celotni znesek, plačan DB v obdobju poročanja.
Te informacije morajo biti objavljene na spletni strani članice bodisi na nacionalni ali evropski ravni na letni ravni, vsako obdobje poročanja pa zajema celotno koledarsko leto.
Metodologija. Vsaka članica mora objaviti metodologije, ki jih je uporabila pri pripravi objav ter za prepoznavanje podpore in zagotovljenih storitev. Objava v skladu s tem členom se opravi na standardizirani predlogi, ki je določena v Prilogi B.
POGLAVJE 6 – POSTOPKOVNE DOLOČBE
ČLEN 25 – ODGOVORNOST IN SANKCIJE
25.01. Odgovornost za farmacevtske informacije velja za informacije kot celoto: za obliko in vsebino.
25.02. Odgovornost za zagotavljanje skladnosti s Kodeksom nosijo vse članice Foruma. Prav tako so za spoštovanje tega Kodeksa odgovorni pooblaščeni predstavniki članic Foruma.
25.03. Če Forum v skladu z določili tega Kodeksa ugotovi kršitev, mora od družbe kršiteljice zahtevati, da nemudoma preneha s kršitvijo in podpiše izjavo, da je ne bo ponovila. Sankcije morajo biti sorazmerne z naravo kršitve, učinkovati svarilno in upoštevati ponavljajoče se kršitve enakega tipa ali vzorce različnih kršitev. Na splošno za najučinkovitejšo sankcijo velja kombinacija obvestitve vseh članic in denarne kazni za družbo kršiteljico, vendar pa lahko Forum izreče katerokoli drugo učinkovito sankcijo, da zagotovi izvajanje tega Kodeksa. Forum mora tudi preučiti vse veljavne pravne ali finančne zahteve, ki bi vplivale na naravo možnih sankcij.
ČLEN 26 – NADZOR
Odbor za nadzor določil Kodeksa ravnanja (»Odbor«) kot organ Foruma odloča v postopkih prijave kršitev tega Kodeksa ter presoja skladnost informacij o zdravilih kot tudi primernost sodelovanja članic z ZD, ZO in DB ter tudi daje smernice glede njih.
ČLEN 27 – PRIJAVA KRŠITEV
Pritožbe zaradi kršitve tega Kodeksa se pošljejo Odboru v roku 30 dni od kršitve.
ČLEN 28 – SPREMEMBE KODEKSA
28.01. Spremembe ali prilagoditve Kodeksa se lahko opravijo, če zanje na skupščini glasuje večina članic. Kodeks se lahko spremeni tudi:
ob spremembi Kodeksa EFPIA
na predlog ene ali več družb članic Foruma, podanega Upravi Foruma, ki ga po preučitvi predloži v sprejem Skupščini Foruma.
28.02. Za sprejetje sprememb(e) Kodeksa je treba potrebna večina glasov prisotnih članic na Skupščini Foruma.
ČLEN 29 – UVELJAVITEV KODEKSA
Ta Kodeks je Skupščina Foruma potrdila dne 20.03.2020, uporablja pa se od 1.1.2021.
PRILOGA A
Standardna predloga za objavo prenosov vrednosti ZD in ZO
PRILOGA B
Standardna predloga za objavo prenosov vrednosti DB
SMERNICE GLEDE OBJAV PODATKOV O NEINTERVENCIJSKIH ŠTUDIJAH
Ozadje
Skladno s Forumovim kodeksom ravnanja je izjema od individualnega poročanja prenosov vrednosti v zvezi z neintervencijskimi študijami omejena na tiste, ki so prospektivne narave. Kodeks določa, da je treba retrospektivne neintervencijske študije poročati na podlagi individualnih imen, kot je to predvideno za ostale prenose vrednosti.
Članice so združenje EFPIA obvestile, da ni vedno mogoče razlikovati med prospektivnimi študijami (vključenimi v agregirano objavo prenosov vrednosti na področju raziskav in razvoja) in retrospektivnimi študijami (ki se objavijo individualno).
Odbor za etiko in skladnost (Ethics & Compliance Committee) je bil mnenja, da se lahko definicije v novi Uredbi EU o kliničnih preskušanjih 536/2014 uporabijo tudi za izvajanje obveznosti glede objave prenosov vrednosti, pri čimer se bodo upoštevale morebitne regulatorne spremembe, če bo do njih prišlo.
Dne 13. junija 2017 je uprava združenja EFPIA sprejela Smernice za individualno objavo vseh neintervencijskih študij, pri katerih razlikovanje med perspektivnimi in retrospektivnimi neintervencijske študijami ni mogoče.
Te smernice služijo kot podlaga za razločevanje med prospektivnimi in retrospektivnimi neintervencijskimi študijami in so namenjene zagotavljanju skladnosti pri objavi prenosov vrednosti z zvezi z neintervencijskimi študijami.
Relevantne določbe Forumovega kodeksa ravnanja
Definicije
Prenosi vrednosti na področju raziskav in razvoja: Prenosi vrednosti ZD ali ZO, povezani z načrtovanjem ali izvajanjem (i) nekliničnih preskušanj (kot so opredeljena v načelih OECD o dobri laboratorijski praksi); (ii) kliničnih preskušanj (kot so opredeljena v Uredbi EU 536/2014 Evropskega parlamenta in Sveta z dne 16. aprila 2014 o kliničnem preskušanju zdravil za uporabo v humani medicini); ali (iii) neintervencijskih kliničnih preskušanj, ki so prospektivne narave in ki vključujejo zbiranje podatkov od ali v imenu posameznega ali skupin ZD izključno za preskušanje.
Smernice
Prenose vrednosti v zvezi z neintervencijskimi študijami, ki v skladu s kodeksom ne spadajo pod definicijo Prenosov vrednosti na področju raziskav in razvoja, je treba poročati na individualni podlagi. S tem v zvezi se prospektivne študije od retrospektivnih razlikujejo skladno z razvrstitvijo v spodnji tabeli:
|
PROSPEKTIVNA PRESKUŠANJA |
RETROSPEKTIVNA PRESKUŠANJA |
|
Prospektivna kohortna preskušanja, v katerih je predpisovanje zdravila neodvisno od vključitve bolnika v študijo.
Retrospektivna študija, v katero se naknadno uvede prospektivni element.
Dolgoročna podaljšana (extension) preskušanja, pri katerem se spremljanje bolnika nadaljuje po času, določenem v protokolu za opazovanje in aktivno zbiranje dodatnih podatkov. |
Povsem opazovalni pregled baze podatkov in/ali raziskovanje.
Retrospektivni pregled zapisov, kjer so se že zgodili zasledovani dogodki že zgodili (npr. case-control, cross-sectional in povsem retrospektivne kohortne študije).
Preskušanja, v katerih predpisovalec kasneje postane raziskovalec, pri čemer je zdravilo že bilo predpisano (npr. retrospektivno zbiranje podatkov iz posameznih zdravstvenih kartotek pri raziskovalcu). |
Zaradi jasnosti se navede, da se aktivnosti, ki ne spadajo v definicijo Prenosov vrednosti na področju raziskav in razvoja opredelitev, vključno z ne-intervencijskimi študijami, ki se ne izvajajo za ohranitev dovoljenja za promet z zdravilom (v skladu z opredelitvami Uredbe o kliničnih preskušanjih” 536/2014), objavijo pod rubriko “nadomestila za storitve in svetovanje”. Članice se spodbuja, da če je to potrebno, pojasnilo o tem vključijo v metodološka pojasnila.
RAZKRITJE POSREDNIH PRENOSOV VREDNOSTI (PV) PREK TRETJIH OSEB
PODPORA / SPONZORSTVO DOGODKOV PREK PROFESIONALNIH ORGANIZATORJEV KONGRESOV (PCO)
Ozadje
Tretje osebe zagotavljajo podporo članicam v različnih oblikah, kar bolj ali manj vpliva na izvajanje dejavnosti, ki jih ureja kodeks. Takšne dejavnosti je potrebno po določbah kodeksa objaviti kot posredne prenose vrednosti (PV). Kadar članice zagotavljajo podporo/sponzorstvo profesionalnim organizatorjem kongresov, ki sodelujejo pri organizaciji strokovnih dogodkov, se razume, da je namen članic dejansko zagotoviti podporo ZD/ZO in ne PCO.
Posredni PV so tisti, ki so izvedeni v imenu članice v korist prejemnika, ali tisti, ki so bili izvedeni prek tretje osebe in kadar članica ve ali lahko identificira ZD/ZO, ki bo imel koristi od prenosa vrednosti.
Glede na številne načine, na katere se je mogoče dogovoriti za sodelovanje s tretjimi osebami, na prvi pogled lahko ni očitno, kako je potrebno uporabiti določila kodeksa. To ima lahko za posledico, da poročanje o PV preko tretjih oseb ne bo celovito, zato so spodnje smernice v pomoč za dosleden pristop k izboljšanemu poročanju, kadar je to mogoče v skladu z veljavno zakonodajo in predpisi.
Te smernice pojasnjujejo poročanje posrednih PV zdravstvenim organizacijam, preko profesionalnega organizatorja kongresov (PCOs).
V zvezi s pravnimi vprašanji, ki se lahko pojavijo pri poročanju PV prek distributerjev v imenu članice, poročanje takšnih PV ne spada v področje uporabe teh smernic. Kadar je to primerno, lahko EFPIA preuči nadaljnje smernice za to kategorijo PV (in druge kategorije vključenih tretjih oseb).
Relevantne določbe Forumovega kodeksa ravnanja
Člen 23.05.1.b
Prispevek za kritje stroškov, povezanih z dogodki. Prispevek za kritje stroškov, povezanih z dogodki, preko ZO ali tretjih oseb, vključno s podporo ZD, da se udeležijo dogodkov, se objavijo individualno z imenom prejemnika; takšni stroški se lahko nanašajo na:
Pristojbine za registracijo;
Sponzorske pogodbe z ZO ali tretjimi osebami, ki jih imenuje ZO za organizacijo in vodenje dogodka; in
iii. Stroški za potovanje in namestitev (v obsegu kot to določa 10. člen tega Kodeksa).
Definicije:
Posredni prenosi vrednosti so tisti, ki so v imenu članice izvedeni v korist prejemnika, ali tisti, ki so bili izvedeni prek tretje osebe in kadar članica ve ali lahko identificira ZD/ZO, ki bo imel koristi od prenosa vrednosti.
Smernice
Prispevke za dogodke, ki se zagotavljajo prek PCO – ki so torej prejemniki PV – je treba šteti za posredne PV.
Kadar članica podpre izvedbo dogodka preko PCO, se bodo za skladne z zahtevami poročanja šteli sledeči pristopi:
PV, ki jih prejme ZO (bodisi kot prejemnik bodisi kot upravičenec) se objavi v ustrezni kategoriji pod imenom te ZO
PV, ki so opravljeni preko PCO, se objavi
bodisi pod imenom ZO, ki podporo prejme, pri čemer se navede preko katerega PCO je bil PV prejet;
bodisi pod imenom PCO in se navede za katero ZO je bil PV prejet.
Ta navodila veljajo ne glede na to, ali PCO dogodek organizira na lastno pobudo ali na zahtevo ZO.
Kot dodatno pojasnilo so v spodnji tabeli so prikazani različni scenariji podpore/sponzorstev za dogodke preko PCO, kar lahko pomaga, pri pripravi objave v skladu s temi smernicami.
Ob tem je potrebno opozoriti, da je prispevek k stroškom, povezanih z udeležbo na dogodku, ki je prek tretje osebe plačan v korist posameznega ZD, ki ga članica lahko identificira kot končnega upravičenca, potrebno objaviti individualno pod imenom posameznega ZD kot posredni PV.
Dodatna priporočila
Nadalje se članicam priporoča, da podporo oziroma sponzorstvo dogodkov preko PCO natančno dogovorijo v pisnih pogodbah in se jih spodbuja, da v pogodbo vključijo tudi določbe v zvezi s podatki, ki jih morajo PCO sporočiti članici, da se ji omogoči ustrezno objavo PV s skladu s kodeksom.
Članice se prav tako spodbuja, da postopek zbiranja podatkov za objavo opišejo v svojih metodoloških pojasnilih, v katerih tudi pojasnijo, da PV morda ne odraža celotne koristi (v denarju ali v naravi), ki jo prejme ZO, saj lahko določen del kot plačilo za svoje storitve obdrži PCO.
Dodatne smernice, sprejete na lokalni ravni ali kot jih zahtevajo lokalni zakoni, lahko dopolnjujejo te smernice EFPIA-e.
Dodatne smernice za PV prek PCO
PODPORA / SPONZORSTVO DOGODKOV PREK PROFESIONALNIH ORGANIZATORJEV KONGRESOV (PCO)
Kot dodatno pojasnilo so v spodnji tabeli so prikazani različni scenariji podpore/sponzorstev za dogodke preko PCO, kar lahko pomaga, pri pripravi objave v skladu s temi smernicami.
Primeri možnih scenarijev pri podpori dogodkom
Ti primeri so na voljo kot pomoč članicam pri pripravi objav o razkritju z namenom optimalnega poročanja o dogodkih, ki jih sponzorirajo/podpirajo.
|
Prejemnik (PCO), ki prejme PV |
Upravičenec ZD/ZO, ki ima od tega korist |
Objava |
|
PCO v imenu / v sodelovanju z ZO |
kjer članica ve, kateri ZD/ZO je končni prejemnik |
Individualna objava skladno s temi navodili |
|
PCO v imenu / v sodelovanju z ZO |
kjer članica ne ve, kateri ZD/ZO je končni prejemnik |
če objava na individualni ravni ni mogoča, naj članica razmisli o objavi v imenu PCO skupaj z navedbo terapevtskega področja. |
|
PCO v sodelovanju s strokovnim odborom ZO |
kjer članica ve, kateri ZO pripada strokovni org. odbor |
Individualna objava skladno s temi navodili |
|
PCO v sodelovanju s strokovnim odborom ZD |
kjer članica ve, kateri ZD so člani strokovnega organizacijskega odbora |
Individualna objava skladno z določbami Kodeksa (potrebna pridobitev soglasja) |
|
PCO razvije / organizira dogodek na svojo pobudo (neodvisni dogodek) |
kjer članica ve, kateri ZD/ZO bo sodeloval na dogodku |
Individualna objava skladno s temi navodili |
|
PCO razvije / organizira dogodek na svojo pobudo (neodvisni dogodek) |
kjer članica ne ve, kateri ZD/ZO bo sodeloval na dogodku |
če objava na individualni ravni ni mogoča, naj članica razmisli o objavi v imenu PCO skupaj z navedbo terapevtskega področja. |
Za razkritja posameznih imen je potrebno ustrezno soglasje; če takega soglasja ni mogoče pridobiti, bodo takšni prenosi vrednosti objavljeni v agregirani obliki
PRILOGA D
EFPIA e4ethics pravila in postopek
1. Ozadje
Člen 10 Kodeksa EFPIA definira zahteve, ki se nanašajo na farmacevtske družbe, ko te organizirajo dogodke (strokovne, promocijske in znanstvene dogodke, izobraževalne sestanke, kongrese in konference) in/ali nudijo gostoljubnost tekom teh dogodkov (s plačilom stroškov za potovanje, obroke, nastanitev in dejanskih pristojbin za registracijo).
Leta 2011 je EFPIA koordinirala spremljanje dogodkov v Evropi, ki so jih organizirale tretje osebe, (katerih se je udeležilo več kot 500 zdravstvenih delavcev iz petih različnih držav in ki spadajo v področje uporabe Kodeksa EFPIA), tako da je vzpostavila spletno platformo za predhodno oceno dogodkov (imenovano e4ethics).
Z e4ethics EFPIA pomaga zagotoviti dosledno izvajanje določb Kodeksa EFPIA, veča skladnost ravnanja s Kodeksom in omogoča sodelovanje z našimi deležniki (npr. znanstvenimi združenji, organizatorji kongresov). Medtem ko je sicer članica EFPIA morala sama sprejeti svojo odločitev, ali bo sponzorirala, se udeležila ali sodelovala na dogodku, je e4ethics nudil neodvisno podporo, da bi lahko družba glede tega sprejela informirano odločitev.
2. Zavezujoče odločitve e4ethics in obvezno ocenjevanje
Na podlagi priporočila Odbora za Kodeks ravnanja EFPIA (CodCom) in Odbora za etiko in skladnost (E&CC) je Odbor EFPIA marca 2020 sprejel odločitev, da bo platforma e4ethics postala zavezujoča, kar pomeni, da bi sponzoriranje, udeležba ali sodelovanje na dogodku, ki s strani e4ethics ni bil odobren ali ga je e4ethics označil za neskladnega, štelo za potencialno kršitev Kodeksa EFPIA, ki bi jo lahko obravnavali pristojni nacionalni organi za nadzor spoštovanja kodeksov. Skratka, to pomeni, da so odločitve e4ethics zavezujoče za Družbe članice EFPIA in da morajo Družbe članice preveriti, ali je na voljo pozitivna ocena e4ethics.
3. Sodelovanje z MedTech Europe
MedTech Europe, Evropsko združenje za medicinske pripomočke, je leta 2012 ustanovilo Sistem za preverjanje dogodkov (Conference Vetting System, CVS) kot samostojno vodeni sistem, ki preverja skladnost izobraževalnih dogodkov tretjih oseb s Kodeksom etične poslovne prakse združenja MedTech Europe in Kodeksom poslovne prakse združenja Mecomed. Izid ocenjevanja določi, ali je primerno, da članice združenj MedTech Europe in Mecomed finančno podprejo dogodke. Odločitve, ki jih sprejme nadzornik za skladnost, so za članice združenj MedTech Europe in Mecomed zavezujoče. To pomeni, da te članice ne morejo podpreti dogodka, za katerega se ugotovi, da je neskladen.
Marca 2020 je Odbor EFPIA odobril sodelovanje z združenjem MedTech Europe na področju ocenjevanja kongresov. Posledično bodo ocene e4ethics vključene v CVS, četudi bodo ocene usmerjene na dve različni spletni strani: e4ethics in CVS. Na podlagi priporočila Odbora EFPIA bo uvedeno šestmesečno preizkusno obdobje, ki se bo začelo s 1. 1. 2021. V tem preizkusnem obdobju bosta veljala zavezujoči učinek odločitev in obvezna ava ocenjevanja.
A. KLJUČNI ELEMENTI
Vsaka platforma ohrani svojo identiteto in oznake , kar pomeni, da bo imela vsaka platforma svojo stran z ustreznimi informacijami, vključno s specifičnim uporabniku prijaznim usmerjanjem do obrazca za oddajo, kljub temu, da bosta obe strani gostovali na www.ethicalmedtech.eu. Na spletni strani združenja MedTech Europe bo dodan napis e4ethics, vendar bodo odločitve, ki jih sprejmejo CVS-ovi nadzorniki za skladnost, objavljene na tem, kar bo postalo skupni spletni koledar. V programski opremi CVS bo treba izvesti tehnične prilagoditve, da bi se omogočilo ločevanje profilov, ter da bi se lahko hkrati vodila deljena zgodovina znanja in optimizacija ravni storitve.
Skupni zaključek: vse zahteve za oceno bodo na koncu prejeli nadzorniki za skladnost združenja MedTech Europe, ki bodo postali tudi Nadzorniki za skladnost dogodkov farmacevtskih podjetij.
Obseg e4ethics bo ostal enak: obsegal bo evropske kongrese, ki jih organizirajo tretje osebe, v okviru določil Kodeksa EFPIA, z vsaj 500 zdravstvenimi delavci iz 5 različnih držav kot udeleženci. Virtualni kongresi ne pridejo v poštev.
B. USKLADITEV KRITERIJEV
Kriteriji, ki veljajo za e4ethics, bodo usklajeni s tistimi, ki veljajo za CVS:
Oddaja vloge za oceno dogodkov mora biti izvedena proaktivno in preko spleta, s strani družbe članice EFPIA, ali s strani organizatorja kongresa.
Prag, ki se je nanašal na organizacijo potovanja in obroke ter pijačo, ne bo več del meril za ocenjevanje. Tako posvetovanja z članicami združenja EFPIA glede tega ne bodo več potrebna.
Oddaja vloge na e4ethics bo obvezna, tj. članice EFPIA morajo preveriti, da je bil dogodek s stran e4ethics pozitivno ocenjen preden lahko zagotovijo kakršnokoli obliko podpore, in sicer od prvega dne pilotne faze dalje. Oddaja vloge za tako ocenjevanje lahko poda članica ali organizator kongresa (zdravstvena organizacija ali profesionalni organizator kongresov).
Vse odločitve, ki jih e4ethics sprejme v zvezi s člani EFPIA med pilotno fazo in po njej, so zavezujoče narave, kar pomeni, da dogodek, ki je bil ocenjen kot neskladen, ne more prejeti nobene oblike podpore članov EFPIA.
Pristop in interpretacija šestih kriterijev ocenjevanja sta med združenjem MedTech Europe in EFPIA popolnoma usklajena, kar pomeni, da ni razlike v tem, kako bodo ocenjevani dogodki farmacevtskih podjetij in dogodki združenja MedTech.
C. POMEMBNI POMISLEKI
Pomembni so naslednji pomisleki:
Odločitve se sprejemajo na podlagi dokumentov in informacij, ki se posredujejo CVS-ovemu nadzorniku za skladnost preko spletnega obrazca. CVS-ov nadzornik za skladnost ne preverja samostojno, ali so podatki ali dokumenti ažurni.
Odločbe ne upoštevajo niti ne nadomeščajo nacionalnih in lokalnih zakonov, predpisov ali strokovnih pravil ter pravil podjetij, ki lahko svojim članom, zdravstvenim delavcem, zdravstvenim organizacijami ali profesionalnim organizatorjem kongresov nalagajo strožje zahteve.
V okviru ocenjevanja se pregledata urnik in relevantnost sej strokovnega programa dogodka, ne pa tudi njihova vrednost in kakovost.
Edini namen sistema preverjanja je ta, da se članom pomaga pri oceni primernosti tega, da družbe članice nudijo podporo dogodku.
4. Postopek, ki velja za e4ethics
A. PRITOŽBA
Ocene za e4ethics bodo sledile postopku, ki velja za CVS: MedTech-ov odbor za skladnost bo vodil postopek glede pritožbe zoper oceno. Možna je pritožba zoper oceno CVS-ovega nadzornika za skladnost. Telo, pristojno za pregled tovrstnih pritožb, je Odbor za skladnost združenja MedTech Europe, saj je pomembno, da je za nadzor nad odločevalskimi postopki, ki se nanašajo na dogodke združenja MedTech in dogodke farmacevtske industrije, pristojen en sam organ.
Pritožbo lahko na Odbor za skladnost vloži družba članica ali organizator kongresa (ZO ali PCO), pri čemer je potrebno spoštovati naslednje pogoje:
pritožbe je potrebno vložiti v roku 10 dni za pridobitev predhodnega dovoljenja in vložitev redne vloge, potem ko je bila odločitev nadzornika za skladnost objavljena v skupnem spletnem koledarju.
uradna pritožba mora biti naslovljena na predsednika Odbora za skladnost in poslana na naslov cvs@ethicalmedtech.eu
Odbor za skladnost si bo prizadeval, da na pritožbo odgovori v roku 72 ur od njenega prejema.
B. PRITOŽBA V ZVEZI Z DOGODKOM
V primeru pritožbe v zvezi z evropskim kongresom (in ne v zvezi z oceno), se bo uporabil EFPIA SOP (Del A Priloge D Kodeksa EFPIA). EFPIA bo posredovala pritožbo pristojnemu nacionalnemu organu za nazdor spoštovanja kodeksa. Končna odločitev nacionalnega organa bo posredovana v vednost odboru za skladnost združenja MedTech.
A. PRITOŽBE, KI JIH PREJME EFPIA
3. poglavje “Pravil o izvajanju in postopkih” dalje določa, da bodo pritožbe, ki jih prejme EFPIA, obravnavane kot sledi:
EFPIA bo vse pritožbe, ki jih prejme (ne da bi odločala o njihovi upravičenosti ali podajala pripombe nanje), posredovala pristojnim lokalnim
združenjem.
EFPIA bo pritožniku poslala obvestilo o prejemu, v katerem bo navedla pristojno lokalno združenje, ki mu je pritožbo posredovala v obdelavo in presojo.
Poleg tega bo EFPIA, če prejme številne zunanje pritožbe (tj. številne pritožbe, ki so jih o istem ali podobnem vprašanju proti številnim odvisnim družbam enega samega podjetja vložili subjekti izven industrije), te pritožbe posredovala nacionalnemu združenju bodisi od matične družbe bodisi njeni odvisne družbe v EU, ki jo določi obvladujoče podjetje.
Postopkovni koraki
4. Ko EFPIA prejme pritožbo, jo EFPIA nadzornik za skladnost v roku 10 delovnih dni posreduje pristojnim lokalnim združenjem, da izvedejo dejanja, ki se skladno z njihovimi postopki zahtevajo za pritožbe, pri čemer bo pritožnik obveščen o tem, katera lokalna združenja so pristojna za obravnavo pritožbe;
5. Istočasno bo EFPIA nadzornik za skladnost pisno obvestil odgovornega višjega uslužbenca družb, v zvezi s katerimi je bila pritožba podana. Če se pritožba nanaša na več držav, bo EFPIA pritožbo posredovala lokalnemu združenju obvladujočega podjetja in relevantnim odvisnim družbam obvladujočega podjetja;
6. Lokalna združenja morajo potrditi prejem pritožbe s strani združenja EFPIA v roku 30 dni po obvestilu združenja EFPIA;
7. Lokalna združenja morajo obravnavati pritožbo po svojem običajnem postopku, upoštevajoč časovne omejitve, ki so za to določene. V času odločanja združenje EFPIA ne bo posegalo v postopek odločanja, prav tako ne bo odgovarjalo na vprašanja, ki jih postavil bodisi pritožnik bodisi članice, ki sodelujejo v postopku;
8. Ko lokalna združenja zaključijo obravnavo zadeve, morajo združenje EFPIA obvestiti o odločitvi, ki so jo sprejela njihova odločevalska telesa, vključno s podatkom o sankciji, ki je bila naložena, če je to primerno. Lokalna združenja morajo združenju EFPIA podati informacije o stanju zadeve najkasneje 6 mesecev po prejemu pritožbe in kasneje ob vsakem četrtletju do sprejema končne odločitve o pritožbi (ki mora biti sprejeta v razumnem času);
9. Povzetek odločitev v zadevah, ki so bile posredovane združenju EFPIA, bo objavljen v EFPIA Letnem poročilu o kodeksu – po tem, ko je obravnava pritožbe zaključena, lahko ugotovitve vodijo do nadaljnjih razprav Odbora za Kodeks ravnanja, tudi glede krepitve doslednega izvajanja kodeksov, če je to primerno.
Tekom pritožbenega postopka (od prejema pritožbe s strani združenja EFPIA do sprejema odločitve pristojnih odločevalskih teles), EFPIA ne bo komunicirala s strankami, ki so povezane s pritožbo, v skladu z omejitvami glede svoje vključenosti, ki so določene v Kodeksih EFPIA, upoštevajoč postopkovne korake, ki so opisani v tem SOP. V tem kontekstu bo komunikacija znotraj združenja EFPIA omejena na komunikacijo med vodjo pravne službe in EFPIA nadzornikom za skladnost; direktor bo vključen v obsegu, ki je upravičen glede na pritožbo.”
PRILOGA E
Smernice EFPIA glede Kakovostnega okvira – Načela vseživljenjskega učenja o zdravstvu
POVZETEK
Evropska komisija vseživljenjsko učenje opredeljuje kot ‘učne aktivnosti, ki se izvajajo skozi vse življenje z namenom izboljšanja znanja, veščin, sposobnosti z osebnega, državljanskega, družbenega in/ali zaposlitvenega vidika.’19 Farmacevtska industrija ima dolgoletno zavezanost k sodelovanju in odkrivanju novosti pri vseživljenjskem učenju o zdravstvu (VUZ). Te nezavezujoče smernice za družbe članice EFPIA zagotavljajo opredelitev in standarde za kakovost, preglednost in etičnost pri učenju s področja medicine. Upoštevanje načel v teh smernicah bo farmacevtski industriji pomagalo zagotoviti discipliniran pristop pri financiranju in organizaciji VUZ ter njenemu nadaljnjemu prispevku k izboljšanju zdravljenja bolnikov. Spoštovanje zakonov in predpisov ter organiziranje ažurnih, poštenih in uravnoteženih učnih programov ostajajo bistvenega pomena za razvoj kakovostnih izobraževalnih programov. Z uvedbo in/ali izvajanjem takšnega pristopa glede VUZ se farmacevtska industrija zavezuje, da bo formalno vključila izobraževalna načela VUZ, zagotovila preglednost in olajšala učinkovito delo z drugimi deležniki v zdravstvu.
Preambula
Namen tega dokumenta je zagotoviti smernice za izvajanje 16. člena Kodeksa EFPIA. Smernice je potrebno brati ob upoštevanju zahtev in v duhu Kodeksa ter v skladu z veljavnimi zakoni in predpisi, zlasti z Direktivo EU 2001/83/ES (Poglavji VIII in VIIIa o obveščanju in oglaševanju).
Namen teh smernic je zagotoviti, da se VUZ s strani farmacevtske industrije izvaja ob visokih etičnih standardih in trdnih izobraževalnih načelih s končnim skupnim ciljem, da koristi pacientom.
VUZ ne sme predstavljati promocije.
Za čim večjo preglednost, zagotavljanje kakovostnih, poštenih in uravnoteženih vsebin ter blažitev pristranskosti so potrebni visoki znanstveni standardi in proces zagotavljanja kakovosti za učne programe s področja medicine. Farmacevtska industrija si prizadeva spoštovati izobraževalna načela, ki temeljijo na osredotočenju na učečega za povečanje vrednosti in učinka učenja.
Vrednote farmacevtske industrije pri VUZ
Farmacevtska industrija ima poleg drugih deležnikov legitimno vlogo pri zagotavljanju dognanj, da so nova odkritja uporabljena varno in pri ustrezni populaciji pacientov.
Da bi sledili hitrosti in širini znanstvenega in medicinskega napredka, so potrebni različni ponudniki VUZ za hitro širjenje novih dognanj in inovacij v zdravstvu. Glede na to, da mora farmacevtska industrija zagotoviti, da se njena zdravila uporabljajo varno in v pravi populaciji, zagotavlja pomembno visoko kakovosten in dopolnilni kanal za VUZ.
Da bi omogočila robustno in praktično učno izkušnjo s pošteno in uravnoteženo predstavitvijo dognanj, farmacevtska industrija pogosto sodeluje z vodilnimi in priznanimi strokovnjaki.
Farmacevtska industrija je v nenehnem dialogu z zdravstvenimi delavci na globalni, regionalni in lokalni ravni ter zmore prepoznati in obravnavati učne potrebe, ki jih drugi ponudniki VUZ morda ne pokrivajo.
Farmacevtska industrija lahko s svojim velikim geografskim pokritjem ponudi priložnost za izobraževanje zdravstvenim delavcem v državah z omejenim dostopom do ponudb VUZ.
Z inovacijami na terapevtskih področjih je farmacevtska industrija pogosto v ospredju pri zagotavljanju VUZ za pomoč in pospešitev prenosa kliničnih raziskav in drugih napredkov v klinično prakso.
Uvod
Za opis učenja in stalnega strokovnega razvoja (SSR) se uporablja več izrazov. Ti se razlikujejo po regijah in državah in so lahko povezani s formalno akreditacijo ali pa tudi ne. V 16. členu Kodeksa EFPIA in v tem dokumentu se izraz vseživljenjsko učenje o zdravstvu (VUZ) uporablja za opis nepromocijskih izobraževalnih aktivnosti, ki jih vodi in/ali financira farmacevtska industrija in ki izpolnjujejo neizpolnjene izobraževalne potrebe v zdravstvu.
VUZ ne sme promovirati izdelkov, pripomočkov ali rešitev v zdravstvu farmacevtskega podjetja, temveč mora dognanja, pomembna za izboljšanje oskrbe pacientov, prenesti v ustrezne učne programe na posameznih terapevtskih področjih. Posebne izobraževalne aktivnosti, ki jih izvaja farmacevtsko podjetje za promocijo izdelkov, niso predmet tega dokumenta. Takšne aktivnosti morajo biti v skladu z zakoni in predpisi o oglaševanju zdravil.
V teh smernicah so zajete naslednje vrste izobraževalnih aktivnosti, ki imajo skupne cilje, vendar se razlikujejo glede na stopnjo vključenosti farmacevtske industrije, lastništva programov in financiranja:
1. Neodvisno medicinsko izobraževanje (NMI), z ali brez akreditacije za stalno medicinsko izobraževanje (SMI) ali stalni strokovni razvoj (SSR). NMI vodi neodvisna organizacija brez sodelovanja ali vpliva industrije, lahko pa ga farmacevtska industrija financira.
2. VUZ programi, zasnovani v sodelovanju ali partnerstvu z enim ali več farmacevtskimi podjetji, s strokovnimi društvi, zdravstvenimi organizacijami, ponudniki izobraževanja ali drugimi ključnimi deležniki. Sodelovanje/ partnerstvo vključuje zavezanost k opredelitvi medsebojnih odnosov in ciljev; skupno razvita struktura in skupna odgovornost; medsebojna pooblastila in odgovornost za uspeh.
3. Aktivnosti VUZ, ki jih izvaja farmacevtska industrija, ki lahko obravnavajo zdravje ljudi in specifične učne potrebe za določene bolezni. Te aktivnosti organizirajo posamezne farmacevtske družbe in lahko vključujejo znanstvene odbore in/ali neodvisne znanstvene in strokovne organizacije. Lastništvo, odgovornost in financiranje teh programov ostaja v lasti farmacevtske družbe.
Ne glede na vrsto VUZ je farmacevtska industrija zavezana k zagotavljanju in podpiranju visokokakovostnega učenja. Farmacevtska industrija pričakuje, da bodo tudi drugi zainteresirani deležniki, kot so ponudniki NMI, znanstveni odbori, znanstvene organizacije in strokovna združenja upoštevali naslednja načela, če bodo prejeli podporo/financiranje za VUZ s strani farmacevtske industrije.
Kakovostni okvir
Ta dokument opisuje sledeče 3 elemente:
1. Etično, transparentno in odgovorno sodelovanje;
2. Kakovostna vsebina: programi in aktivnosti ne smejo biti promocijski ne po vsebini, ne po namenu; in
3. Robustni procesi: ocena izobraževalnih potreb načrtovanje učenja in merjenje rezultatov.
Etično, transparentno in odgovorno sodelovanje je obvezno za vsako aktivnost VUZ. Kakovostne vsebine in robustni procesi so močno priporočeni za doseganje najvišjih učnih standardov in izobraževalnega učinka.
1. Obvezne zahteve: Etično, transparentno in odgovorno sodelovanje
Etično, transparentno in odgovorno sodelovanje je temeljno in osnovno načelo kakovostnega okvira in je obvezno. Podpirati ga morajo robustni izobraževalni procesi in kakovostne vsebine. Za zagotovitev znanstvene neoporečnosti je odgovorno farmacevtsko podjetje, ki aktivnost VUZ podpira.
Namen etičnega, transparentnega in odgovornega sodelovanja je obravnava sledečih glavni vidikov:
∙ Financiranje: Transparentnost v zvezi s poročanjem o financiranju in drugih vrednostih, zagotovljenih tistim, ki izvajajo ali prejemajo izobraževanje v skladu s poglavji 2 in 5 Kodeksa EFPIA
∙ Razkritje: Razkritje interesov in morebitnih nasprotij interesov za katerokoli vrsto aktivnosti VUZ s strani vseh vpletenih deležnikov
∙ Namen: Transparentnost glede namena, vključenosti, vlog in odgovornosti ter narave morebitnega sodelovanja z zunanjimi deležniki (klinični zdravniki, zdravniškimi združenji/organizacijami)
∙ Varstvo osebnih podatkov: spoštovanje predpisov (kot je GDPR)
∙ Skladnost s kodeksi ravnanja farmacevtske industrije [kot so IFPMA, EFPIA], EU ter lokalnimi veljavnimi zakoni in predpisi
2. Priporočene prakse
2.1 Kakovostna vsebina
Cilj VUZ je povečati strokovno znanje in usposobljenost zdravstvenih delavcev za izboljšanje zdravniške prakse in izboljšanje splošnega zdravljenja pacientov in zdravstvene oskrbe. Kakovostna vsebina je temelj VUZ.
Da bi zagotovili visokokakovostno vsebino VUZ programov, ki jih izvaja in/ali financira farmacevtska industrija, le-ti ne smejo biti promocijski niti po vsebini, niti po namenu. Ne smejo vključevati niti oznak izdelka (trgovskega imena, logotipa, barv, blagovne znamke itd.), niti podatkov o zdravilu.
2.2 Robustni postopki
Za zagotavljanje visokokakovostnega izobraževanja je zelo priporočljiv robusten in standardiziran postopek, ki vključuje:
∙ oceno učnih potreb
∙ načrtovanje učenja
∙ oceno rezultatov
Vsako farmacevtsko podjetje bo individualiziralo svoje izobraževalne postopke. Spodnji primeri so namenjeni pomoči podjetjem pri načrtovanju njihovih postopkov.
2.2.1. Ocena učnih potreb
Disciplinirana in natančna ocena učnih potreb udeležencev programa je priporočen začetni korak pri načrtovanju izobraževalnih aktivnosti in mora zagotoviti jasnost izbirnih meril. Izbor slušateljev mora temeljiti na učnih potrebah.
Potrebe je mogoče razdeliti na:
– zaznane potrebe; ki jih izrazijo in zaznajo slušatelji – npr. anketa med zdravstvenimi delavci, ki obiskujejo določeno aktivnost VUZ
– izražene potrebe; ki so izražene v vsakodnevni praksi – npr. klinični centri morajo razumeti nove smernice v klinični praksi
– normativne potrebe; ki jih navajajo strokovnjaki
– primerjalne potrebe; ki se izrazijo v skupinski primerjavi, npr. med kliničnimi ustanovami in njihovo klinično prakso.
Ocena učnih potreb mora vključevati prispevke več deležnikov v zdravstvu. Metode za ocenjevanje potreb slušateljev lahko vključujejo pregled literature, kvalitativne raziskovalne raziskave, ankete, prispevke strokovnjakov in drugih zainteresiranih deležnikov v zdravstvu, svetovalne odbore in številne druge metode zbiranja podatkov.
2.2.2. Načrtovanje učenja
Sedanji zdravstveni ekosistem doživlja veliko preobrazbo. To je posledica pristopa, ki se bolj osredotoča na pacienta in njegove koristi od zdravstva in obsežnih izboljšav v tehnologiji. Ta preobrazba zahteva, da za zagotavljanje visokih izobraževalnih standardov, vsi deležniki v zdravstvenem ekosistemu sodelujejo pri postopkih VUZ.
Okvir zagotavljanja kakovosti20 lahko vključuje standardiziran proces za načrtovanje učenja in mora biti del razvite strategije na višji ravni, katere cilj je povečati znanstveno znanje in usposobljenost zdravstvenih delavcev za izboljšanje medicinske prakse ter izboljšanje zdravljenja in oskrbe pacientov.
Takšni procesi lahko vključujejo pristop načrtovanja, ki temelji na rezultatih in bi morali sporočati, kaj želi VUZ doseči. V izobraževanju se lahko uporabijo naslednji koraki:
1. Identifikacija načrtovanih rezultatov na podlagi učnih potreb (glejte oceno potreb)
2. Dogovor o sprejemljivih dokazih npr. razprava o programu in predavateljih z znanstvenim odborom na podlagi ugotovljenih učnih rezultatov
3. Načrtovanje učne izkušnje
2.2.3. Ocena rezultatov
Za zagotavljanje nenehnega izboljševanja VUZ, je potrebno uporabiti različne pristope za merjenje rezultatov, le-te pa uporabiti za izboljšanje prihodnjih programov. Merijo se lahko različne učne ali poučevalne platforme in kanali, po katerih se prenaša učna vsebina. Čeprav imajo objektivna merila prednost, se subjektivna merila lahko uporabljajo tam, kjer se išče mnenje slušateljev (npr. ‘zadovoljstvo’ ali ‘ustreznost’).
Priporočena literatura
PRILOGA F
Načela za uporabo digitalnih kanalov
1. Načela, ki veljajo za vse vrste komunikacije
SKLADNOST Z ZAKONI, PREDPISI IN KODEKSI RAVNANJA
Digitalni kanal je le platforma za komuniciranje. Zakoni in predpisi, ki veljajo za druge platforme in medije, veljajo tudi za digitalne medije. Vsebina, ciljna skupina in uporaba platforme so ključni elementi za določitev veljavnih pravil, ne pa medij kot tak.
Zato se za digitalno komunikacijo uporabljajo določbe Direktive 2001/83/ES v zvezi z oglaševanjem zdravil, EFPIA Kodeks in ta Kodeks.
Obdelava osebnih podatkov mora biti v skladu z veljavnimi predpisi o varstvu osebnih podatkov.
ODGOVORNOST
Članice so odgovorne za vse vsebine, ki se razširjajo preko digitalnega kanala, ki je zasnovan, brandiran ali sponzoriran s strani članic ali tretje osebe, ki deluje v njihovem imenu, vključno z oglaševanjem zdravil.
Članica, ki ima v lasti spletni stran ali spletno mesto socialnega medija, je odgovorna za njegovo vsebino. Npr. kakršnakoli omemba zdravila na recept se bo verjetno štela kot oglaševanje tega zdravila v splošni javnosti in bo prepovedana. Drug primer bi lahko bila uporaba socialnih omrežij namenjenih splošni javnosti, da bi zdravstvene delavce opozorili na objavo študije o zdravilu, kar se bo prav tako lahko štelo kot oglaševanje tega zdravila in bo zato prepovedano.
Članice so lahko odgovorne tudi pri interakciji na digitalnih kanalih v lasti drugih podjetij ali organizacij.
Članice so prav tako odgovorne za informacije, ki jih razširjajo njeni zaposleni, ki to počnejo prek svojih zasebnih kanalov socialnih omrežij, predvsem a) kadar je mogoče razumno razumeti kot da predstavljajo članico ali b) kadar jim to naroči, odobri ali omogoči članica. Članica mora imeti vzpostavljene interne smernice o tem, kako naj se njeno osebje obnaša na digitalnih kanalih, vključno z aktivnostmi na zasebnih računih.
Za digitalne kanale v lasti članice je treba vzpostaviti postopke za spremljanje, moderiranje in/ali pravočasno brisanje neprimernih komentarjev v obsegu, kot to dovoljujejo predpisi o varstvu osebnih podatkov ter veljavni zakoni in kodeksi. Članice bodo morda morale imeti podobne postopke pri uporabi digitalnih kanalov v lasti drugih podjetij ali organizacij.
FARMAKOVIGILANCA
Članice morajo razmisliti o izdelavi posebnih smernic za digitalne kanale in stopiti v stik s svojimi strokovnjaki za farmakovigilanco za posebne projekte, da bodo izpolnile svoje odgovornosti glede farmakovigilance, vključno z obveznostjo beleženja in poročanja o kakršnihkoli škodljivih učinkih, o katerih se razpravlja v zvezi z njihovimi zdravili.
TRANSPARENTNOST
Člen 7.04 tega Kodeksa ravnanja zahteva, da članice jasno navedejo, kdaj sponzorirajo določeno komunikacijo. Kadarkoli članica ali posameznik oziroma oseba, ki deluje v imenu članice, posreduje informacije po digitalnem kanalu, mora jasno navesti vpletenost članice, med drugim vključno z opredelitvijo ali je bila vsebina financiranja delno ali v celoti.
Poleg tega je treba poročati o prenosih vrednosti zdravstvenim delavcem, zdravstvenim organizacijam in društvom bolnikov v skladu z obveznostmi razkritja prenosov vrednosti, kot so opisane v tem Kodeksu (5. poglavje).
Kadar je mogoče mora biti ciljna publika kanala jasno opredeljena (npr. zdravstveni delavci, splošna javnost ali kombinacija obojega).
2. Kako prepoznati dovoljene informacije za različne digitalne kanale
Pomembno je, da članica razume, katere vsebine so primerne za različne digitalne kanale in ustrezno publiko. Pri tem je treba upoštevati vse zakone in predpise enako kot pri drugih medijih.
Informacije na digitalnem kanalu je treba redno posodabljati in za vsako stran in/ali element, če je primerno, jasno prikazati zadnji datum, ko so bile te informacije posodobljene.
Naslednja vprašanja so lahko koristna za ocenjevanje tveganj, povezanih z digitalnim komuniciranjem, ter ustreznostjo vsebine, dostopa, vzpostavitvijo in vzdrževanjem digitalnega kanala:
p Kakšen je cilj komunikacije (spodbujanje, obveščanje, izmenjava)?
p Kakšna vsebina bo na voljo na digitalnem kanalu?
Ali je vsebina povezana s farmacevtskimi izdelki?
Ali je vsebina promocijska ali ne promocijska?
Ali je vsebina povezana z ozaveščanjem o boleznih?
Ali je vsebina povezana z informacijami o zdravstveni oskrbi, npr. v zvezi z diagnozo, izobraževanjem o zdravljenju, podporo pri prehrani?
Ali je vloga članice, ki zagotavlja/razvija vsebino, jasna?
Kdo je ciljna publika? Splošna javnost, ZD ali vsi
Ali je potrebno preverjanje publike?
Če je odgovor pritrdilen, kako?
Kakšna je osnovna nastavitev kanala?
Ali je digitalni kanal odprt za odzive publike, kot so deljenje, komentiranje, izmenjava?
Kako se informacije posredujejo po digitalnih kanalih?
Ali je digitalni kanal odprta platforma ali je namenjen zaprti publiki?
Ali obstajajo omejitve glede obsega vsebine? npr. Twitter
Ali veljajo kakšne smernice skupnosti? npr. Facebook, YouTube
Kako se vsebine pregledujejo, odobravajo in vzdržujejo, vključno s strani podjetja člana?
Kako se vsebine pregledujejo, odobravajo in vzdržujejo, vključno s strani podjetja člana?
3. Navodila EFPIA-e članicam za različne digitalne kanale
V nadaljevanju sledi kratek opis splošne uporabe različnih vrst digitalnih kanalov. Pri odločanju o tem, kateri digitalni kanal uporabiti in kako ga razviti, je treba upoštevati zgoraj navedena načela.
Vsebina, ki jo članica objavi na vsakem kanalu, mora biti primerna in usklajena z ustreznimi predpisi, zakoni in kodeksi, vključno s Kodeksom EFPIA in tem Kodeksom.
SPLETNE STRANI
Spletne strani so razvrščene kot kanal, ki doseže javnost, razen če je za dostop do spletne strani potrebno preverjanje (npr. pojavno okno za identifikacijo ali geslo), npr. za ZD. Nekatere spletne strani lahko vključujejo forume, na katerih si javnost lahko izmenjuje informacije ali razpravlja o temah.
Ker je veliko obiskov spletnih strani posledica uporabe iskalnika, je optimizacija ključnih besed postala pomembno orodje. Članice lahko z ustrezno optimizacijo iskanja zagotovijo, da so njihove spletne strani prikazane visoko na seznamu rezultatov iskanja za ustrezne ključne besede. Vendar pa morajo članice zagotoviti, da je uporaba optimizacije ključnih besed primerna za ciljno publiko. Na primer, optimizirano iskanje z uporabo ključnih besed, usmerjenih na spletne strani z informacijami o terapijah za splošno javnost ali na spletne strani, namenjene zdravstvenim delavcem, kjer lahko do takšnih spletnih strani dostopajo samo pooblaščeni posamezniki.
Članice lahko sponzorirajo gradiva za spletno stran, ki jo izdela tretja oseba, vendar mora biti vloga članice v tem primeru jasno opredeljena. Če članica i) da pobudo za vsebino ali njen koncept; ii) če kakorkoli vpliva na vsebino gradiva; iii) izbira ali neposredno plačuje avtorje; je zelo verjetno, da bo članica odgovorna za vsebino spletne strani. Če pa velja obratno in obstaja strogo neodvisen dogovor, po katerem članica zagotovi zgolj donacijo, potem članica ne bo odgovorna.
Članice morajo biti prepričane o izbiri povezav do spletnih strani in da te ne oglašujejo zdravil na recept splošni javnosti. Če članica vključi naslove spletnih strani v oglaševanje zdravil na recept, namenjeno zdravstvenim delavcem, potem veljajo temeljna načela za zagotavljanje ustreznosti vsebine teh spletnih strani.
SOCIALNA OMREŽJA
Na splošno so socialna omrežja kanali, za katere velja, da so namenjeni splošni javnosti. Socialna omrežja so spletna mesta ali aplikacije, na katerih lahko ljudje komunicirajo v družbenih omrežjih (npr. Facebook, X (nekdanji Twitter), Snapchat, LinkedIn, YouTube, Instagram). V večini primerov se socialna omrežja uporabljajo za doseganje ali interakcijo z javnostjo. Platforma socialnega medija je lahko odprt kanal za javnost ali zaprt kanal za ciljno publiko, kjer je pred zagotavljanjem dostopa potrebna verifikacija.
BLOGI
Razlika med besedilom na spletni strani in na blogu je v tem, da je blog običajno v lasti in posodabljan s strani osebe ali skupine oseb, ki na njem redno objavlja.
Blog je lahko v lasti članice ali pa članica za pisanje na blogu angažira (prek sponzorstva ali honorarja za svetovanje) lastnika (kot so “družbeni vplivneži”). V obeh primerih mora biti vključenost članice na blogu jasno navedena.
Glede na to, da je blog po svoji naravi namenjen avtorjem, da svobodno in spontano izražajo svoja osebna stališča o določeni temi, članice ne smejo sponzorirati blogov, ki so namenjeni ali za katere se lahko upravičeno pričakuje, da promovirajo zdravila na recept in njihovo uporabo.
PODKASTI
Članica ima lahko svoj podkast, ki mora upoštevati enaka pravila kot veljajo za spletne strani.
Podkast si je mogoče prenesti s kateregakoli distributerja podkastov. Veljajo osnovna načela, da je prejemnik dobro opredeljen in ciljno usmerjen ter da je vsebina primerna. Npr. podkast, ki oglašuje zdravila na recept, lahko uporabljajo le ZD.
APPLIKACIJE (APPS)
Aplikacijo, običajno imenovano “app”, je mogoče prenesti na elektronsko napravo (npr. pametni telefon, računalnik ali tablični računalnik).
Članica lahko razvije aplikacije za uporabo zunanjih deležnikov (npr. ZD, ZO, pacientov, zdravstvene zavarovalnice), če upoštevajo enaka pravila, kot veljajo za spletne strani. Prav tako morajo upoštevati morebitne zakonske zahteve, če aplikacija izpolnjuje zahteve za medicinski pripomoček. Pri tem veljajo temeljna načela, vključno z zagotavljanjem, da je publika dobro opredeljena in ciljno določena.
Aplikacijo je mogoče razviti tudi za izboljšanje upoštevanja metode zdravljenja. Če je aplikacija namenjena določeni skupini (npr. ZD, pacientom, oskrbovalcem), je pomembno, da je dostop do vsebine aplikacije omogočen samo tej skupini.
WEBINARJI (SPLETNI SEMINARJI)
Webinar ali spletni seminar je spletni dogodek, ki se izvaja prek interneta in se lahko izvede kot prenos v živo ali kot storitev na zahtevo.
Članica je lahko neposredni organizator spletnega seminarja in/ali za izvedbo dogodka najame tretjo osebo. Članica je odgovorna za takšne spletne seminarje, vključno z vsebino in zagotavljanjem, da je publika dobro opredeljena in ciljno določena. Podobna ureditev velja za spletne seminarje tretjih oseb, ki jih članice sponzorirajo.
Takšni spletni seminarji so lahko namenjeni komunikaciji z zunanjimi zainteresiranimi deležniki (npr. ZD, ZO, pacienti, zdravstvena zavarovalnica), če upoštevajo enaka pravila kot veljajo za spletne strani.
NEPOSREDNI KANALI
To so kanali ena-na-ena ali ena-na-več oseb, ki so usmerjeni na izbrane prejemnike; ti so najpogosteje zasebni in niso vidni neizbranim prejemnikom; lahko so to tudi odgovori posamezniku na socialnih omrežjih.
Članice morajo zagotoviti, da imajo soglasje prejemnikov za stike z njimi, prejemniki pa morajo imeti možnost, da enostavno prenehajo prejemati sporočila. Upoštevati je treba tudi primernost pogostosti kontaktiranja.
RAZPRAVNI FORUMI
Če članica omogoči razpravni forum na platformi tretje osebe ali gosti forum na svoji platformi, mora biti prepričana, da lahko spletno stran moderira tako, da je vsebina v skladu z ustreznimi predpisi, zakoni in kodeksi, vključno s Kodeksom EFPIA in tem Kodeksom. Opredeliti je treba ciljno publiko, da so izpolnjene ustrezne zahteve. Če se razpravni forumi uporabljajo za tržne raziskave, morajo članice zagotoviti, da so te skladne z ustreznimi pravnimi in etičnimi smernicami.
“,,1605546300,1605546300,sl,14521,306,14238,43,0,NULL,,”Forumov kodeks ravnanja”,forumov-kodeks-ravnanja,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1605546477,1753006384
700,14521,”Forum’s code of practice”,”Adopted by the General Assembly of Forum of International Research and Development Pharmaceutical Companies, EIG”,”
FORUM’S CODE OF PRACTICE
adopted by the General Assembly of Forum of International Research and Development Pharmaceutical Companies, EIG on 20 March 2020 as amended on 16 November 2020, 21 April 2021, 23 September 2022, 1 December 2023, 7 April 2025 and 4 July 2025
The Forum Code of Practice constitutes the collection of ethical rules agreed by Forum of International Research and Development Pharmaceutical Companies, EIG (“Forum”) members for the Promotion of Medicinal Products to HCPs and the interactions with HCPs, HCOs and POs, with the intent of guaranteeing that these activities are conducted while respecting the most stringent ethical principles of professionalism and responsibility.
This Code applies to all types of communication and interaction (traditional and digital).
TABLE OF CONTENTS
DEFINITIONS
PREAMBLE
INTRODUCTION
SCOPE OF THE CODE
APPLICABILITY OF THE CODE
CHAPTER 1 – PROMOTION OF POM TO HCPs
Article 1 – Marketing authorization
Article 2 – Information to be made available
Article 3 – Promotion and its substantiation
Article 4 – Use of quotations in Promotion
Article 5 – Acceptability of Promotion
Article 6 – Distribution of Promotion
Article 7 – Transparency of Promotion
Article 8 – Promotional information provided during international Events
Article 9 – Personal medical matters
CHAPTER 2 – INTERACTIONS WITH HCPs, HCOs AND POs
Article 10 – Events and hospitality
Article 11 – Prohibition of Gifts
Article 12 – Donations and Grants to HCOs and POs
Article 13 – Contribution to Cost of Events and Sponsorship
Article 14 – Member Company funding
Article 15 – Contracted services
CHAPTER 3 – SPECIFIC REQUIREMENTS FOR INTERACTIONS WITH HCPs AND HCOs
Article 16 – Lifelong learning in healthcare
Article 17 – Informational or Educational Materials and Items of Medical Utility
Article 18 – Non-Interventional Studies
Article 19 – Medical Samples
Article 20 – Member Company Staff
CHAPTER 4 – SPECIFIC REQUIREMENTS FOR INTERACTIONS WITH POs
Article 21 – Interactions with POs
CHAPTER 5 – DISCLOSURE OF TRANSFERS OF VALUE FROM MEMBER COMPANIES
Article 22 – Disclosure of ToVs to HCPs & HCOs and POs
Article 23 – Disclosure of ToVs to HCPs and HCOs
Article 24 – Disclosure of support and services provided to POs
CHAPTER 6 – PROCEDURAL PROVISIONS
Article 25 – Responsibility and Sanctions
Article 26 – Supervision
Article 27 – Complaints
Article 27 – Amendments of the Code
Article 28 – Enforcement of the Code
ANNEXES
Annex A – Standardised Disclosure Template for HCP and HCO
Annex B – Standardised Disclosure Template for PO
Annex C – Guidance on Disclosure of Non-Interventional Studies and Disclosure of Indirect Transfers of Values (Tovs) Through Third Parties
Annex D – EFPIA e4ethics rules and procedure
Annex E – EFPIA Guideline on a Quality Framework
Principles in Lifelong Learning in Healthcare
Annex F – Principles for the use of digital channels
DEFINITIONS
Definitions of capitalised terms are included to ensure their consistent understanding.
Member Company: as defined in the Forum’s Statute and Rules of Procedure.
Events: All professional, promotional, scientific, educational meetings, congresses, conferences, symposia, and other similar events (including, but not limited to, advisory board meetings, visits to research or manufacturing facilities, and planning, training or investigator meetings for clinical trials and non-interventional studies) organised or sponsored by or on behalf of a Member Company.
Donations and Grants: collectively, mean providing funds, assets or services freely given for the purpose of supporting healthcare, scientific research or education, with no consequent obligation on the recipient to provide goods or services to the benefit of the donor in return.
Patient Organisation (PO): not-for-profit legal person/entity (including the umbrella organisation to which it belongs), mainly composed of patients and/or caregivers, that represents and/or supports the needs of patients and/or caregivers and which business address, place of incorporation or primary place of operation is in Europe.
Europe: includes those countries in which the EFPIA Member Associations’ National Codes apply.
European Federation of Pharmaceutical Industries and Associations (EFPIA): is the representative body of the pharmaceutical industry in Europe.
Informational or Educational Material: constitutes inexpensive material directly relevant to the practice of medicine or pharmacy and directly beneficial to the care of patients.
Item of Medical Utility: constitutes inexpensive item aimed directly at the education of HCPs enhancing the provision of medical services and patient care and that do not offset routine business practices of the HCPs.
EFPIA Code: The EFPIA Code of Practice, including those Annexes which are expressly mentioned as binding and which form part of the EFPIA Code.
Location: refers to the geographic place where the Event is organized (e.g. the city, town).
Venue: refers to the logistic place where the Event is organized (i.e. the hotel, the congress center).
National Code: the code of practice of a Member Association.
Member Association: as defined in the EFPIA Statutes, means an organisation representing pharmaceutical manufacturers at national level whose members include, among others, research-based companies. Collectively, the national Member Associations or their constituent members, as the context may require, are bound by the EFPIA Code.
Host Country Principle: refers to the primacy of the monetary threshold for a meal (food and beverages) set by the relevant Member Association in its National Code. The monetary threshold set in the country where the Event takes place must prevail.
Non-Interventional Study (NIS): is a study where the Medicinal Product(s) is (are) prescribed in the usual manner in accordance with the terms of the marketing authorization. The assignment of the patient to a particular therapeutic strategy is not decided in advance by a trial protocol but falls within current practice and the prescription of the Medicinal Product is clearly separated from the decision to include the patient in the study. No additional diagnostic or monitoring procedures must be applied to the patients and epidemiological methods must be used for the analysis of collected data.
Reporting Period: refers to the annual disclosure cycle and covers a full calendar year.
Member Company Staff: personnel employed by a Member Company or retained by way of contract with Third Parties, who are concerned with promotion of medicinal products covered by this Code.
Personal Health Data: is any information related to the physical, mental health or to the inherited or acquired genetic characteristics of an identified or identifiable natural person, including the provision of health care services, which reveal information about his or her physiology or health status.
Patient Organisation Representative: is a person who is mandated to represent and express the collective views of a PO on a specific issue or disease area.
Recipient: any HCP or HCO or PO as applicable, in each case, whose primary practice, principal professional address or place of incorporation is in Europe.
Transfers of Value (ToV): Direct and indirect ToV, whether in cash, in kind or otherwise, made, whether for promotional purposes or otherwise, in connection with the development and sale of POM exclusively for human use. Direct ToVs are those made directly by a Member Company for the benefit of a Recipient. Indirect ToVs are those made on behalf of a Member Company for the benefit of a Recipient, or those made through a Third Party and where the Member Company knows or can identify the Recipient that will benefit from the Transfer of Value.
Research and Development Transfers of Value: Transfers of Value to HCPs or HCOs related to the planning or conduct of (i) non-clinical studies (as defined in OECD Principles on Good Laboratory Practice); (ii) clinical trials (as defined in Regulation 536/2014); or (iii) NIS that are prospective in nature and that involve the collection of patient data from or on behalf of individual, or groups of, HCPs specifically for the study.
Contribution to Costs related to Events: is a support providing or covering the costs of meals, travel, accommodation and/or registration fees to support the attendance of an individual HCP or PO Representative to an Event organised or created by a Member Company and/or a Third Party.
Promotion: includes any activity undertaken, organised or sponsored by a Member Company, or with its authority, which promotes the prescription, supply, sale, administration, recommendation or consumption of its Medicinal Product(s).
Sponsorship: is a support provided by or on behalf of a Member Company, when permitted by law, as a contribution to support an activity (including an Event) performed, organised or created by a HCO, a PO or a Third Party.
Medical Sales Representative: personnel employed by a Member Company or retained by way of contract with Third Parties, who interact with HCPs and HCOs, in connection with the Promotion of Medicinal Products.
Third Party: is a legal person/entity or individual that represents a Member Company or interacts with other Third Parties on behalf of a Member Company or relating to the Member Company’s Medicinal Product, such as distributors, wholesalers, consultants, contract research organisations (CRO), professional congress organisers, contracted sales forces, market research companies, advertising agencies, providers of services related to Events, public relations services, non-clinical, non-interventional studies management services.
Applicable Codes:
(a) (i) in the case of Promotion or interaction that is undertaken, sponsored or organised by or on behalf of, or with, a Member Company located within Europe, the Member Association National Code of the country in which such Member Company is located; or (ii) in the case of Promotion or interaction that is undertaken, sponsored or organised by or on behalf of, or with, a Member Company located outside of Europe, the EFPIA Code; and
(b) the Member Association’s National Code of the country in which the Promotion or the interaction takes place.
In the event of a conflict between the provisions of the Applicable Codes set forth above, the more restrictive of the conflicting provisions must apply, except for the application of Section 10.05 of this Code, where the monetary threshold set in the country where the event takes place (i.e. the “host country”) must prevail.
In case of international Event for which a Member Company sponsors the attendance of a HCP, if any funding is provided to such HCP in accordance with the provisions of Article 13, such funding is subject to the rules of the National Code where such HCP carries out his/her profession, as opposed to those in which the international Event takes place.
Lifelong learning in healthcare: constitutes non-promotional education related to human health and disease.
Medical Sample: has the meaning set forth in the Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to medicinal products for human use (hereinafter: Directive 2001/83/EC), namely sample of Medicinal Product free of charge to persons qualified to prescribe or supply them so that they can familiarize themselves with new products and acquire experience in dealing with them.
Prescription-Only Medicines (POM): is a Medicinal Product that requires a medical prescription issued by a professional person qualified to prescribe.
Medicinal Product: has the meaning set forth in Article 1 of the Directive 2001/83/EC, namely: (a) any substance or combination of substances presented as having properties for treating or preventing disease in human beings; or (b) any substance or combination of substances which may be used in or administered to human beings either with a view to restoring, correcting or modifying physiological functions by exerting a pharmacological, immunological or metabolic action, or to making a medical diagnosis.
Healthcare Organisation (HCO): any sole entrepreneur or legal person/entity (i) that is a healthcare, medical or scientific association or organisation (irrespective of the legal or organisational form) such as a hospital, clinic, foundation, university or other teaching institution or learned society (except for POs within the scope of Article 21 of this Code) whose business address, place of incorporation or primary place of operation is in Europe or (ii) through which one or more HCPs provide services.
Healthcare Professional (HCP): any natural person that is a member of the medical, dental, pharmacy or nursing professions or any other person who, in the course of his/her professional activities, may prescribe, purchase, supply, recommend or administer a Medicinal Product and whose primary practice, principal professional address or place of incorporation is in Europe. For the purpose of this Code, the definition of HCPs includes: (i) any official or employee of a government, agency or other organisation (whether in the public or private sector) that may prescribe, purchase, supply, recommend or administer Medicinal Products and (ii) any employee of a Member Company or Forum whose primary occupation is that of a practising HCP, but excludes (x) all other employees of a Member Company or Forum and (y) a wholesaler or distributor of Medicinal Products.
PREAMBLE
This document replaces previous codes issued by Forum, namely:
Code on the Promotion of Prescription-Only Medicines to, and Interactions with, Healthcare Professionals (HCP Code), approved by the General Assembly of Forum of International Research and Development Pharmaceutical Companies, EIG on 20 January 2012, as amended on 21 November 2013, 4 July 2014, 27 May 2016, 23 March 2018 and 22 March 2019;
EFPIA Code of Practice on Relationships between the Pharmaceutical Industry and Patient Organisations, adopted by the General Assembly of Forum of International Research and Development Pharmaceutical Companies, EIG on 20 January 2012, as amended on 7 December 2018, and
Code on Disclosure of Transfers of Value from Pharmaceutical Companies to Healthcare Professionals and Healthcare Organisations (Transparency Code), adopted by the General Assembly of Forum of International Research and Development Pharmaceutical Companies, EIG on 21 November 2013, as amended on 4 July 2014, 5 December 2014 and 27 May 2016.
ETHICAL PRINCIPLES
As pharmaceutical companies, we work in collaboration with various stakeholders including HCPs, HCOs, POs and their Representatives, regulatory authorities, governments and the public to improve health and quality of life.
We continuously invest in research and development to deliver new treatments for medical needs and improving the quality of treatment.
As commercial organisations, we encourage competition and economic development to sustain investment and foster innovation.
We believe in what we do and know that there is somewhere a patient whose health and wellbeing is, directly or indirectly, dependent on our work.
We aim at creating an environment where our stakeholders and the general public, consider pharmaceutical companies as trusted partners.
In addition to complying with extensive legal requirements (i.e. laws and regulations applicable to our industry such as pharmaceutical, competition, intellectual property and data protection laws as well as anti-bribery and anti-corruption legislation), the pharmaceutical industry has agreed to comply with additional standards in its self-regulatory codes and joint positions.
For Forum and its members, self-regulation means being fully committed to define, implement, comply with and enforce the highest ethical standards through EFPIA, Forum and National Codes, where breaches are not tolerated.
Self-regulation includes the concept of continuous challenge for us to exceed society’s expectations and openness regarding suggestions from others on how we might further strengthen confidence in our industry and our behaviour.
Stakeholders who share the values and principles enshrined in this self-regulation are invited to adhere to these rules and guidance.
ETHOS
Our Ethos outlines the ethical principles that underpin the Code and guide the industry’s interactions with the healthcare and patient community.
INTRODUCTION
Forum and its members are conscious of the importance of (i) providing accurate, fair and objective information about Medicinal Products so that rational decisions can be made as to their use, (ii) ensuring that interactions with HCPs, HCOs and POs, which are key to share knowledge aiming to improve the quality of patient care, take place in an ethical manner and (iii) introducing greater transparency around the pharmaceutical industry’s interactions with HCPs, HCOs and POs.
Chapters 1, 2 and 3 of this Code reflect the requirements of Directive 2001/83/EC, as amended, relating to Medicinal Products, and fit into the general framework established by the Directive, which recognises the role of voluntary control of advertising of Medicinal Products by self-regulatory bodies and recourse to such bodies when complaints arise.
Forum encourages competition among pharmaceutical companies. This Code is not intended to restrain the Promotion of Medicinal Products to HCPs, or limit interactions with HCPs, HCOs, and POs in a manner that is detrimental to fair competition. Instead, it seeks to ensure that pharmaceutical companies conduct such Promotion and interactions in a truthful manner, avoiding deceptive practices and potential conflicts of interest with stakeholders, and in compliance with applicable laws and regulations.
The Code thereby aims to foster an environment where the general public can be confident that the choices regarding their Medicinal Products are being made on the basis of the merits of each product and the healthcare needs of patients.
HCPs and HCOs provide the pharmaceutical industry with valuable, independent and expert knowledge derived from their clinical and scientific experience. This expertise makes an important contribution to the industry’s efforts to improve the quality of patient care, with benefits for individuals and society at large. HCPs and HCOs should be fairly remunerated for the legitimate expertise and services they provide to the industry.
Forum believes that interactions between Member Companies and HCPs have a profound and positive influence on the quality of patient treatment and the value of future research. At the same time, the integrity of the decision of a HCP to prescribe a Medicinal Product is one of the pillars of the healthcare system. Forum recognises that interactions between the industry and HCPs/HCOs can create the potential for conflicts of interest. Consequently, professional and industry associations, including EFPIA, its Members and Local Associations, have adopted codes and guidelines to ensure that these interactions meet the high standards of integrity that patients, governments and other stakeholders expect.
In order, to continue to be successful, self-regulation needs to respond to the evolving demands of society. In particular, Forum recognises the growing expectation that interactions with society are not only conducted with integrity but are also transparent.
In the same way, the pharmaceutical industry works with POs to learn from their knowledge and experience of patient’s condition that is able to provide a true picture of what it is like to live with a specific condition, how care is delivered, how that impacts on them, their careers and families and how medicines and other treatments can change their quality of life and meet their needs.
POs have a key role in helping to shape, develop and define the outcomes that make the most difference to patients. Member Companies disclose the amounts provided to POs in the framework of these interactions.
Forum strongly supports public scrutiny and the understanding of these relationships and disclosure contributes to the confidence of stakeholders in the pharmaceutical industry.
In relation to working with HCPs and HCOs, since the introduction of the Disclosure Code, Forum has worked hard to encourage Member Companies to always look to disclose and to encourage HCPs (and HCOs where relevant) to agree to individual disclosure. Member Companies will not be criticized for over-disclosure.
SCOPE OF THE CODE
This Code covers:
∙ promotion of POMs to HCPs,
∙ interactions between Member Companies and HCPs, HCOs and POs;
∙ disclosure of ToVs from Member Companies to HCPs, HCOs and POs; and
∙ procedural provisions of the Code.
Member Companies are responsible for the obligations imposed under any relevant Applicable Code even if they commission a Third Party to design, implement or engage in activities covered by the Applicable Code on their behalf. In addition, Member Companies must take reasonable steps to ensure that any other parties that they commission to design, implement or engage in activities covered by the Applicable Code but that do not act on behalf of the Member Company (e.g. joint ventures, licensees) comply with Applicable Codes.
This Code covers all methods of Promotion including, but not limited to, oral and written promotional activities and communications, journal and direct mail advertising, the activities of Medical Sales Representatives, the use of digital communications and channels, such as websites and social media, the use of audio-visual systems such as films, video recordings, data storage services and the like. It also covers the provision of Informational or Educational Materials, Items of Medical Utility, hospitality in relation to Events and Medical Samples.
This Code also covers interactions between Member Companies and HCPs and HCOs including, but not limited to, those in the context of research or contractual arrangements (including certain aspects of clinical trials, non-interventional studies as well as consultancy and advisory board). It also covers the interactions between Member Companies and POs.
This is not intended to restrain or regulate activities directed towards the general public which relate solely to non-prescription Medicinal Products.
This Code does not cover the following:
the labelling, summary of product characteristics, package leaflet and other documents, approved by the competent authority at granting of marketing authorisation or at any later time, as well as other general precautionary measures aimed at safer and more efficient consumption of the medicinal product;
correspondence, possibly accompanied by material of a non-promotional nature, needed to answer a specific question about a particular Medicinal Product;
factual, informative announcements and reference material relating, for example, to pack changes, adverse-reaction warnings as part of general precautions, trade catalogues and price lists, provided they include no product claims;
activities which relate solely to non-prescription Medicinal Products; or
non-promotional, general information about Member Companies (such as information directed to investors or to current/prospective employees), including financial data, descriptions of research and development programmes, and regulatory developments affecting a Member Company and its Medicinal Products.
APPLICABILITY OF THE CODE
This Code sets out the minimum standards which Member Companies shall respect. In addition, Member States of the Forum must respect the provisions of the applicable Slovenian legislation in the field of marketing, advertising and information on medicinal products.
Forum has established a committee for supervision of the provisions of this Code, which is composed of independent experts in various fields with appropriate expert knowledge and representatives of the Forum.
The Committee oversees the implementation of this Code and proposes amendments to codes or procedures adopted for their implementation.
The Committee has been established to assess information on medicinal products, assess the appropriateness of member cooperation with healthcare professionals, healthcare organizations and patient organisations and compliance of publishing transfers of funds from member companies to healthcare professionals and healthcare organisations and patients organizations. The Committee operates as a voluntary and self-regulating body for all Forum members.
CHAPTER 1 – PROMOTION OF POM TO HCPs
ARTICLE 1 – MARKETING AUTHORIZATION
Section 1.01. A Medicinal Product must not be promoted prior to the grant of the marketing authorization allowing its sale or supply or outside of its approved indications.
Section 1.02. Promotion must be consistent with the particulars listed in the summary of product characteristics of the relevant Medicinal Product.
ARTICLE 2 – INFORMATION TO BE MADE AVAILABLE
Section 2.01. Subject to applicable national laws and regulations, all promotional material must include the following information clearly and legibly:
a. essential information consistent with the summary of product characteristics,) specifying the date on which such essential information was generated or last revised;
b. the supply classification of the Medicinal Product;
c. when appropriate, the selling price or indicative price of the various presentations and the conditions for reimbursement by social security bodies; and
d. promotional materials, addressed to expert public, shall in principle be marked as “For expert public only”.
ARTICLE 3 – PROMOTION AND ITS SUBSTANTIATION
Section 3.01. Promotion must be accurate, balanced, fair, objective and sufficiently complete to enable the HCP to form his/her own opinion of the therapeutic value of the Medicinal Product concerned. It must be based on an up-to-date evaluation of all relevant evidence and reflect that evidence clearly. It must not mislead by distortion, exaggeration, undue emphasis, omission or in any other way.
Section 3.02. Promotion must be capable of substantiation which must be promptly provided in response to reasonable requests from HCPs. In particular, promotional claims about side-effects must reflect available evidence or be capable of substantiation by clinical experience. Substantiation need not be provided, however, in relation to the validity of elements approved in the marketing authorization.
Section 3.03. Promotion must encourage the rational use of Medicinal Products by presenting them objectively and without exaggerating their properties. Claims must not imply that a Medicinal Product, or an active ingredient, has some special merit, quality or property unless this can be substantiated.
Section 3.04. When Promotion refers to published studies, clear references must be given.
Section 3.05. Any comparison made between different Medicinal Products must be based on relevant and comparable aspects of the Medicinal Products. Comparative advertising must not be misleading or disparaging.
Section 3.06. All artwork, including graphs, illustrations, photographs and tables taken from published studies included in promotional material must: (a) clearly indicate the precise source(s) of the artwork; (b) be faithfully reproduced, except where adaptation or modification is required in order to comply with any Applicable Code(s), in which case it must be clearly stated that the artwork has been adapted and/or modified.
Particular care must be taken to ensure that artwork included in Promotion does not mislead about the nature of a Medicinal Product (for example, whether it is appropriate for use in children) or mislead about a claim or comparison (for example, by using incomplete or statistically irrelevant information or unusual scales).
Section 3.07. The word “safe” must never be used to describe a Medicinal Product without proper qualification.
Section 3.08. The word “new” must not be used to describe any Medicinal Product or presentation which has been generally available or any therapeutic indication which has been generally promoted, for more than one year.
Section 3.09. It must not be stated that a Medicinal Product has no side-effects, toxic hazards or risks of addiction or dependency.
ARTICLE 4 – USE OF QUOTATIONS IN PROMOTION
Quotations from medical and scientific literature or from personal communications must be faithfully reproduced (except where adaptation or modification is required in order to comply with any Applicable Code(s), in which case it must be clearly stated that the quotation has been adapted and/or modified) and the precise sources identified.
ARTICLE 5 – ACCEPTABILITY OF PROMOTION
Member Companies must maintain high ethical standards at all times. Promotion must: (a) never be such as to bring discredit upon, or reduce confidence in, the pharmaceutical industry; (b) be of a nature which recognises the special nature of Medicinal Products and the professional standing of the intended audience; and (c) not be likely to cause offence.
ARTICLE 6 – DISTRIBUTION OF PROMOTION
Section 6.01. Promotion must only be directed at those HCPs whose need for, or interest in, the particular information can reasonably be assumed.
Section 6.02. Mailing lists must be kept up-to-date. Requests to be removed from mailing lists must be complied with.
Section 6.03. Subject to applicable national laws and regulations, the use of faxes, e-mails, automated calling systems, text messages and other digital communications for Promotion is prohibited except with the prior permission, or upon the request, of those who receive it.
ARTICLE 7 – TRANSPARENCY OF PROMOTION
Section 7.01. Promotion must not be disguised.
Section 7.02. Clinical assessments, post-marketing surveillance and experience programmes and post-authorization studies (including those that are retrospective in nature) must not be disguised Promotion. Such assessments, programmes and studies must be conducted with a primarily scientific or educational purpose.
Section 7.03. Where a Member Company pays for or otherwise secures or arranges the publication of promotional material in journals, such promotional material must not resemble independent editorial matter.
Section 7.04. Material relating to Medicinal Products and their uses, whether promotional in nature or not, which is sponsored by a Member Company must clearly indicate that it has been sponsored by that Member Company.
ARTICLE 8 – PROMOTIONAL INFORMATION PROVIDED DURING INTERNATIONAL EVENTS
Promotional information which appears on exhibition stands or is communicated to participants at international Events may, unless prohibited or otherwise regulated by local laws and regulations, refer to Medicinal Products (or uses) which are not registered in the country where the Event takes place, or which are registered under different conditions, as long as: (i) any such promotional material is accompanied by a suitable statement indicating the countries in which the Medicinal Product is registered and makes clear that the Medicinal Product or indication is not registered locally, and (ii) any such promotional material which refers to the prescribing information (indications, warnings etc.) authorized in a country or countries where the Medicinal Product is registered must be accompanied by an explanatory statement indicating that registration conditions differ internationally.
ARTICLE 9 – PERSONAL MEDICAL MATTERS
In the case of requests from individual members of the general public for advice on personal medical matters, the enquirer must be advised to consult a HCP.
CHAPTER 2 – INTERACTIONS WITH HCPs, HCOs AND POs
ARTICLE 10 – EVENTS AND HOSPITALITY
Section 10.01. All Events must be held in “appropriate” Location and Venues that are conducive to the main purpose of the Event, avoiding those that are “renowned” for their entertainment facilities (not compatible with congress activity) such as venues with on-site casino or venues which offer golf course as their main attraction. Similarly, venues which are considered “extravagant”, such as, for example, a 5* hotel or similar venue of such luxury category, unless such venue holds a valid categorisation as “F – congress hotel”, shall also be avoided. Categorisation of separate congressional facilities at each venue shall be deemed to be equal to the categorisation of the hotel or facility, in or directly at which they are located.
Section 10.02. No Member Company may organise or sponsor an Event that takes place outside its home country unless:
∙ most of the invitees are from outside of its home country and, given the countries of origin of most of the invitees, it makes greater logistical sense to hold the Event in another country; or
∙ given the location of the relevant resource or expertise that is the object or subject matter of the Event, it makes greater logistical sense to hold the Event in another country.
Section 10.03. Member Companies may only offer hospitality when such hospitality is “appropriate” and otherwise complies with the provisions of any Applicable Code(s).
Section 10.04. Hospitality extended in connection with Events must be limited to travel, meals, accommodation and genuine registration fees.
The costs of travel, accommodation, registration and food shall not be considered as gifts under the Act, which regulates integrity and anti-corruption. Reasonable travel, accommodation, registration costs must be shown in a transparent manner.
Section 10.05. Member Companies must not provide or offer any meal (food and beverages) to HCPs, HCOs’ members or POs’ Representatives, unless, in each case, the value of such meal does not exceed the monetary threshold of 80 EUR (including VAT) if the event is set in Slovenia or follow “Host country principle”).”).
Section 10.06. Hospitality may only be extended to persons who qualify as participants in their own right. In exceptional cases of established health needs (e.g. disability or injury), the travel, meals, accommodation and genuine registration fee costs of an accompanying person can be reimbursed within the same parameters.
Section 10.07. All forms of hospitality offered must be “reasonable” in level and strictly limited to the main purpose of the event. As a general rule, the hospitality provided must not exceed what recipients would normally be prepared to pay for themselves.
Section 10.08. Hospitality must not include sponsoring or organising entertainment events (e.g., sporting or leisure). No individual leisure activities or other extra-curricular or social activities is allowed. Moderate (simple) entertainment at events is allowed but must be of secondary importance in comparison to refreshing beverages and/or food.
ARTICLE 11 – PROHIBITION OF GIFTS
Section 11.01. Gifts for the personal benefit (such as sporting or entertainment tickets, social courtesy gifts) of HCPs, HCOs’ members or POs’ Representatives (either directly or indirectly) are prohibited.
Providing or offering cash, cash equivalents or personal services is also prohibited. For these purposes, personal services are any type of service unrelated to the profession and that confer a personal benefit to the Recipient.
Section 11.02. A promotional aid is a non-monetary item given for a promotional purpose (which does not include promotional materials as defined in Chapter 1). Providing or offering them to HCPs, HCOs’ members or POs’ Representatives in relation to the promotion of POM is prohibited.
ARTICLE 12 – DONATIONS AND GRANTS TO HCOs AND POs
Section 12.01. Donations and Grants (in cash or in kind or otherwise) to HCOs and/or POs are only allowed if: (i) they are made for the purpose of supporting healthcare, research or education; (ii) they are documented and kept on record by the donor/grantor; and (iii) they do not constitute an inducement to recommend and/or prescribe, purchase, supply, sell or administer specific Medicinal Products.
Section 12.02. Donations and Grants to individuals are not permitted. The Contribution to Costs related to Events for HCPs to attend international Events is covered by Article 13 of this Code.
ARTICLE 13 – CONTRIBUTION TO COSTS RELATED TO EVENTS AND SPONSORSHIP
Section 13.01. Member Companies must comply with criteria governing the selection and support of HCPs or POs’ Representatives to attend Events as provided in, or in connection with, any Applicable Code(s). No payment must be offered to compensate merely for the time spent by the HCP or PO’s Representative in attending Events.
Section 13.02. The public use of an HCO or PO´s logo and/or proprietary material by a Member Company requires written permission from that organisation. In seeking such permission, the specific purpose and the way the logo and/or proprietary material will be used must be clearly stated.
Section 13.03. Member Companies must ensure that their Sponsorship to HCOs and POs is always clearly acknowledged and apparent from the outset.
ARTICLE 14 – MEMBER COMPANY FUNDING
No Member Company may require that it be the sole funder or sponsor of a PO or HCO or any of its programmes.
Member Companies welcome broad funding and sponsorship of POs and HCOs from multiple sources.
ARTICLE 15 – CONTRACTED SERVICES
Section 15.01. Contracts between Member Companies and HCPs, HCOs, POs or POs’ Representatives under which those provide any type of services to Member Companies (not otherwise covered by the Code) are only allowed if such services: (i) are provided for the purpose of supporting healthcare, research or education; and (ii) do not constitute an inducement to recommend and/or prescribe, purchase, supply, sell or administer specific Medicinal Products.
Section 15.02. It is permitted to contract HCPs or POs’ Representatives as consultants, whether in groups or individually, for services such as speaking at and/or chairing meetings, involvement in medical/scientific studies, clinical trials or training services, participation at advisory board meetings, and participation in market research where such participation involves remuneration and/or hospitality. The arrangements that cover these genuine consultancy or other services must, to the extent relevant to the particular arrangement, fulfil all the following criteria:
a. a written contract is agreed in advance of the commencement of the services which specifies the nature of the services to be provided and, subject to clause (g) below, the basis for payment of those services;
b. a legitimate need for the services has been clearly identified and documented in advance of requesting the services and entering into arrangements;
c. the criteria for selecting consultants are directly related to the identified need and the persons responsible for selecting the consultants have the expertise necessary to evaluate whether the particular consultant meets those criteria;
d. the number of consultants retained and the extent of the service are not greater than reasonably necessary to achieve the identified need;
e. the contracting Member Company maintains records concerning, and makes appropriate use of, the services provided by consultants;
f. the engagement of the consultant to provide the relevant service is not an inducement to recommend and/or prescribe, purchase, supply, sell or administer a particular Medicinal Product;
g. the remuneration for the services is reasonable and reflects the fair market value of the services provided. In this regard, token consultancy arrangements must not be used to justify compensating the HCPs or PO Representatives.
Section 15.03. In their written contracts with consultants, Member Companies are strongly encouraged to include provisions regarding the obligation of the consultants to declare that they are consultants to the Member Company whenever they write or speak in public about a matter that is the subject of the agreement or any other matter relating to that Member Company.
Similarly, Member Companies that employ, on a part-time basis, HCPs that are still practising their profession are strongly encouraged to ensure that such persons have an obligation to declare their employment arrangements with the Member Company whenever they write or speak in public about a matter that is the subject of the employment or any other matter relating to that Member Company. The provisions of this Section 15.03 apply even though the EFPIA Code does not otherwise cover non-promotional, general information about Member Companies (as discussed in the “Scope of the EFPIA Code” section).
Section 15.04. Limited market research, such as one-off phone interviews or mail/e-mail/internet questionnaires are excluded from the scope of this Article 15 of this Code, provided that the HCP, HCO’s member or PO’s Representative is not consulted in a recurring manner (either with respect to the frequency of calls generally or of calls relating to the same research) and that the remuneration in kind does not exceed 42 EUR (inclusive of VAT) per survey or questionnaire.
Section 15.05. If an HCP or a PO’s Representative attends an Event (an international Event or otherwise) in a consultant capacity the relevant provisions of Article 10 of this Code must apply.
CHAPTER 3 – SPECIFIC REQUIREMENTS FOR INTERACTIONS WITH HCPs AND HCOs
ARTICLE 16 – LIFELONG LEARNING IN HEALTHCARE
16.01. Lifelong learning in healthcare (LLH) is aimed at increasing the scientific knowledge and competence of HCPs to enhance medical practice and improve patient outcome.
16.02. Member Companies can be engaged in or support different types of educational programs but such activities must not constitute Promotion.
16.03. These activities can be one of three types: 1) Independent Medical Education i.e. conducted by an independent organisation and funded by the industry; 2) programs that are developed in collaboration with another stakeholder; or 3) pharmaceutical industry led LLH activities.
16.04. When funding Independent Medical Education or organizing LLH activities directly or in collaboration with third parties, Member Companies must ensure that their participation and role is clearly acknowledged and apparent from the outset.
16.05. LLH activities must have content fair, balanced and objective, designed to allow the expression of diverse evidence-based science and fulfil unmet educational needs in healthcare. This Article is complemented by a Guideline on a Quality Framework for LLH (Annex E).
ARTICLE 17 – INFORMATIONAL OR EDUCATIONAL MATERIALS AND ITEMS OF MEDICAL UTILITY
Section 17.01. The provision of Informational or Educational Materials is permitted provided it is: (i) “inexpensive”; (ii) directly relevant to the practice of medicine or pharmacy; and (iii) directly beneficial to the care of patients.
Section 17.02. Items of Medical Utility aimed directly at the education of HCPs and patient care can be provided if they are “inexpensive” and do not offset routine business practices of those who receive them.
Section 17.03. The nature of Informational or Educational Materials and Items of Medical Utility considered may not constitute a circumvention of the prohibition on gifts defined under Article 11 of this Code. The transmission of such materials or items must not constitute an inducement to recommend and/or prescribe, purchase, supply, sell or administer a Medicinal Product.
Section 17.04. Informational or Educational Materials and Items of Medical Utility can include the Member Company name, but must not be product branded, unless the Medicinal Product’s name is essential for the correct use of the material or item by the patient.
ARTICLE 18 – NON-INTERVENTIONAL STUDIES
Section 18.01. Non-Interventional Studies must be conducted with a primarily scientific purpose and must not be disguised Promotion.
Section 18.02. Non-Interventional Studies that are prospective in nature and that involve the collection of patient data from or on behalf of individual, or groups of, HCPs specifically for the study must comply with all of the following criteria:
a. There is a written study plan (observational plan/protocol);
b. In countries where ethics commissions are prepared to review such studies, the study plan must be submitted to the ethics committee for review;
c. The study plan must be approved by the Member Company’s scientific service and the conduct of the study must be supervised by the Member Company’s scientific service as described in Section 20.01.a of this Code;
d. The study results must be analysed by or on behalf of the contracting Member Company and summaries thereof must be made available within a reasonable period of time to the Member Company’s scientific service (as described in Section 20.01.a of this Code), which service must maintain records of such reports for a reasonable period of time. The Member Company must send the summary report to all HCPs that participated in the study and must make the summary report available to industry self-regulatory bodies and/or committees that are in charge of supervising or enforcing Applicable Codes upon their request. If the study shows results that are important for the assessment of benefit-risk, the summary report must be immediately forwarded to the relevant competent authority; and
e. Medical Sales Representatives may only be involved in an administrative capacity and such involvement must be under the supervision of the Member Company’s scientific service that will also ensure that the Medical Sales Representatives are adequately trained. Such involvement must not be linked to the Promotion of any Medicinal Product.
Section 18.03. To the extent applicable, Member Companies are encouraged to comply with Section 18.02 of this Code for all other types of NIS, including epidemiological studies and registries and other studies that are retrospective in nature. In any case, such studies are subject to Section 15.01 of this Code.
ARTICLE 19 MEDICAL SAMPLES
Section 19.01. In accordance with the current Rules on advertising of medicinal products, in principle, no medical samples should be given to persons authorized to prescribe medicinal products, except exceptionally when they need to educate the patient how to use a new medicine, under the following conditions:
the medicinal product is not intended for peroral use;
the medicinal product has due marketing authorisation;
the medicinal product does not require any special storage conditions, such as a cold chain;
no more than two years have elapsed from acquisition of the marketing authorisation or approval of a change of marketing authorisation that requires a new application;
samples may only be delivered upon a written request signed and dated by the prescriber;
the recipient must keep a record of received samples and must not resell them;
samples must be in the smallest packaging on the market;
samples must be accompanied by SmPC;
samples must not contain narcotic and psychotropic substances.
Section 19.02. Medical Samples must not be given as an inducement to recommend, prescribe, purchase, supply, sell or administer specific Medicinal Products, and must not be given for the sole purpose of treating patients.
Section 19.03. Member Companies must have adequate systems of control and accountability for Medical Samples which they distribute and for all Medicinal Products handled by theirs Medical Sales Representatives. This system must also clearly establish, that each HCP may only receive one sample of each Medicinal Product, for which a marketing authorisation has been obtained and the marketing authorisation holder has informed the competent authority for medicinal products about the actual commencement of sales.
Section 19.04. Each Medical Sample must be marked “free medical sample – not for sale” or words to that effect and must be accompanied by a copy of the summary of product characteristics.
ARTICLE 20 – MEMBER COMPANY STAFF
Section 20.01. All Member Company staff must be fully conversant with the relevant requirements of the Applicable Code(s) and laws and regulations.
a. Each Member Company must establish a scientific service in charge of information about its Medicinal Products and the approval and supervision of NIS. Member Companies are free to decide how best to establish such service(s) in accordance with this Section 20.01 of this Code (i.e. whether there is one service in charge of both duties or separate services with clearly delineated duties), taking into account their own resources and organisation. The scientific service must include a medical doctor or, where appropriate, a pharmacist who will be responsible for approving any promotional material before release. Such person must certify that he or she has examined the final form of the promotional material and that in his or her belief it is in accordance with the requirements of the Applicable Code(s) and any relevant laws and regulations, is consistent with the summary of product characteristics and is a fair and truthful presentation of the facts about the Medicinal Product. In addition, the scientific service must include a medical doctor or, where appropriate, a pharmacist, who will be responsible for the oversight of any NIS (including the review of any responsibilities relating to such studies, particularly with respect to any responsibilities assumed by Medical Sales Representatives). Such person must certify that he or she has examined the protocol relating to the NIS and that in his or her belief it is in accordance with the requirements of the Applicable Code(s) and any relevant laws and regulations.
b. Each Member Company must appoint at least one senior employee who must be responsible for supervising the Member Company and its subsidiaries to ensure that the standards of the Applicable Code(s) are met.
Section 20.02. Each Member Company must ensure that its Medical Sales Representatives are familiar with the relevant requirements of the Applicable Code(s), and all applicable laws and regulations, and are adequately trained and have sufficient scientific knowledge to be able to provide precise and complete information about the Medicinal Products they promote.
a. Medical Sales Representatives must comply with all relevant requirements of the Applicable Code(s), and all applicable laws and regulations, and Member Companies are responsible for ensuring their compliance.
b. Medical Sales Representatives must approach their duties responsibly and ethically.
c. During each visit, and subject to applicable laws and regulations, Medical Sales Representatives must give the persons visited, or have available for them, a summary of the product characteristics for each Medicinal Product they present.
d. Medical Sales Representatives must transmit to the scientific service of their companies forthwith any information they receive in relation to the use of their company’s Medicinal Products, particularly reports of side effects.
e. Medical Sales Representatives must ensure that the frequency, timing and duration of visits to HCPs, pharmacies, hospitals or other healthcare facilities, together with the manner in which they are made, do not cause inconvenience.
f. Medical Sales Representatives must not use any inducement or subterfuge to gain an interview. In an interview, or when seeking an appointment for an interview, Medical Sales Representatives must, from the outset, take reasonable steps to ensure that they do not mislead as to their identity or that of the Member Company they represent.
CHAPTER 4 – SPECIFIC REQUIREMENTS FOR INTERACTIONS WITH POs
ARTICLE 21 – INTERACTIONS WITH POs
Section 21.01. Member Companies must comply with the following principles that EFPIA, together with pan-European POs, have subscribed to:
1. The independence of POs, in terms of their political judgement, policies and activities, must be assured.
2. All interactions between POs and Member Companies must be based on mutual respect, with the views and decisions of each partner having equal value.
3. Member Companies must not request, nor shall POs undertake, the Promotion of a particular POM.
4. The objectives and scope of any collaboration must be transparent. Financial and non-financial support provided by Member Companies must always be clearly acknowledged.
5. Member Companies welcome broad funding of POs from multiple sources.
Section 21.02. EU and national laws and regulations prohibit the advertising of POM to the general public.
Section 21.03. When Member Companies provide financial support, significant indirect support and/or significant non-financial support to POs, they must have in place a written agreement. This must state the amount of funding and also the purpose (e.g. unrestricted grant, specific meeting or publication, etc). It must also include a description of significant indirect support (e.g. the donation of public relations agency´s time and the nature of its involvement) and significant non-financial support.
Section 21.04. Member Companies must not influence the text of PO’s material they sponsor in a manner favourable to their own commercial interests. This does not preclude Member Companies from correcting factual inaccuracies. In addition, at the request of POs, Member Companies may contribute to the drafting of the text from a fair and balanced scientific perspective.
CHAPTER 5 – DISCLOSURE OF ToVs FROM MEMBER COMPANIES
ARTICLE 22 – DISCLOSURE OF ToVs TO HCPs, HCOs, AND POs
Section 22.01. Time of Disclosure
Disclosures must be made by each Member Company within 6 months after the end of the relevant Reporting Period and the information disclosed must be required to remain in the public domain for a minimum of 3 years after the time such information is first disclosed unless, in each case, (i) a shorter period is required under applicable national laws or regulations, or (ii) the relevant data protection legal basis (e.g. the legitimate interest grounds, a legal duty ) is no longer applicable.
The common reporting period for publication of ToVs to Recipients is set during the time interval from 20th to 30th June each year at the latest.
ARTICLE 23 – DISCLOSURE OF ToVs TO HCPs AND HCOs
Section 23.01. Rationale
The following Article provides for disclosures of ToVs to HCPs and HCOs, whether directly or indirectly. When deciding how a ToV must be disclosed, Member Companies should, wherever possible, identify and publish at the individual HCP (rather than HCO) level, as long as this can be achieved with accuracy, consistency and in compliance with applicable laws and regulations.
Section 23.02. Disclosure Obligation
General Obligation. Subject to the terms of this Article, each Member Company must document and disclose ToVs it makes, directly or indirectly, to or for the benefit of a Recipient, as described in more detail in Article 23.05 of this Code.
Excluded Disclosures. Without limitation, ToVs that (i) are solely related to over-the-counter medicines; (ii) are not listed in Section 23.05 of this Article, such as Items of Medical Utility (governed by Article 17 of this Code), meals (governed by Article 10 of this Code, especially Section 10.05), Medical Samples (governed by Article 19 of this Code); or (iii) are part of ordinary course purchases and sales of Medicinal Products by and between a Member Company and a HCP (such as a pharmacist) or a HCO do not fall within the scope of the disclosure obligation described above in “General Obligation”.
Section 23.03. Form of Disclosure
Annual Disclosure Cycle. Disclosures must be made on an annual basis and each Reporting Period must cover a full calendar year.
Template. For the sake of greater consistency, disclosures under this Article shall be made on a standardised template set out in Annex A.
Platform of Disclosure. Disclosures shall be made on websites Member Companies or their affiliates provided that they are unrestricted and publicly available.
Applicable National Code. Disclosures must be made pursuant to the National Code of the country where the Recipient has its professional address. If a Member Company is not resident or does not have a subsidiary or an affiliate in the country where the Recipient has its physical address, the Member Company must disclose such ToV in a manner consistent with the relevant National Code in its home country.
Language of Disclosure. Disclosures must be made in the Slovenian language. Member Companies are encouraged to make disclosures in English in addition to the mandatory disclosures in the local language.
Documentation and Retention of Records. Each Member Company must document all ToVs required to be disclosed pursuant to Section 23.03 of this Code and maintain the relevant records of the disclosures made under this Article for a minimum of 5 years after the end of the relevant Reporting Period, unless a shorter period is required under applicable national laws or regulations.
Section 23.05. Individual and Aggregate Disclosure
Individual Disclosure. Except as expressly provided by this Article, ToVs must be disclosed on an individual basis. Each Member Company must disclose, on an individual basis for each clearly identifiable Recipient, the amounts attributable to ToVs to such Recipient in each Reporting Period which can be reasonably allocated to one of the categories set out below. Reasonable travel, accommodation and registration costs must be shown in a transparent manner as referred to below. Such ToVs may be aggregated on a category-by-category basis, provided that itemised disclosure must be made available upon request to (i) the relevant Recipient, and/or (ii) the relevant authorities.
1. For ToVs to a HCO, an amount related to any of the categories set forth below:
a. Donations and Grants. Donations and Grants to HCOs that support healthcare, including donations and grants (either cash or benefits in kind) to institutions, organisations or associations that are comprised of HCPs and/or that provide healthcare (governed by Article 12 of this Code).
b. Contribution to costs related to Events. Contribution to costs related to Events, through HCOs or Third Parties, including support to HCPs to attend Events, such as:
i. Registration fees;
ii. Sponsorship agreements with HCOs or with Third Parties appointed by an HCO to manage an Event; and
iii. Travel and accommodation costs (to the extent governed by Article 10 of this Code).
c. Fees for Service and Consultancy. ToVs resulting from or related to contracts between Member Companies and HCOs under which such HCOs provide any type of services to a Member Company or any other type of funding not covered in the previous categories. Fees, on the one hand, and on the other hand ToVs relating to expenses agreed in the written agreement covering the activity (e.g. travel costs, other out of pocket expenses, …) will be disclosed as two separate amounts.
2. For ToVs to a HCP:
a. Contribution to costs related to Events. Contribution to costs related to Events, such as:
i. Registration fees; and
ii. Travel and accommodation costs (to the extent governed by Article 10 of this Code).
b. Fees for Service and Consultancy. ToVs resulting from or related to contracts between Member Companies and HCPs under which such HCPs provide any type of services to a Member Company or any other type of funding not covered in the previous categories. Fees, on the one hand, and on the other hand ToVs relating to expenses agreed in the written agreement covering the activity (e.g. travel costs, other out of pocket expenses, …) will be disclosed as two separate amounts.
Aggregate Disclosure. For ToVs where certain information, which can be otherwise reasonably allocated to one of the categories set forth in Section 23.05 of this Code, cannot be disclosed on an individual basis for legal reasons, a Member Company must disclose the amounts attributable to such ToVs in each Reporting Period on an aggregate basis. Such aggregate disclosure must identify, for each category, (i) the number of Recipients covered by such disclosure, on an absolute basis and as a percentage of all Recipients, and (ii) the aggregate amount attributable to ToVs to such Recipients.
Non duplication. Where a ToV required to be disclosed pursuant to Section 23.05 of this Code is made to an individual HCP indirectly via a HCO, such ToV must only be required to be disclosed once. To the extent possible, such disclosure must be made on an individual HCP named basis pursuant to Section 23.05 of this Code.
Research and Development ToV. Research and Development ToVs in each Reporting Period must be disclosed by each Member Company on an aggregate basis. Costs related to Events that are clearly related to activities covered in this section can be included in the aggregate amount under the “Research and Development Transfers of Value” category.
Methodology. Each Member Company must publish a note summarising the methodologies used by it in preparing the disclosures and identifying ToVs for each category described in Section 23.05 of this Code. The note, including a general summary and/or country specific considerations, must describe the recognition methodologies applied, and should include the treatment of multi-year contracts, VAT and other tax aspects, currency aspects and other issues related to the timing and amounts of ToVs for purposes of this Article, as applicable.
ARTICLE 24 – DISCLOSURE OF SUPPORT AND SERVICES PROVIDED TO POs
Each Member Company must disclose a list of POs to which it provides financial support and/or significant indirect/non-financial support or with whom it has engaged to provide contracted services for that Member Company.
The term “significant” support referred to in the preceding paragraph shall mean any support or service, with an attributable monetary value exceeding EUR 150 per transaction and EUR 600 per year.
This disclosure must include a description of the nature of the support or services provided that is sufficiently complete to enable the average reader to form an understanding of the nature of the support or the arrangement without the necessity to divulge confidential information. In addition to the name of the PO, the following elements must be included:
a. For support:
the monetary value of financial support and of invoiced costs.
the non-monetary benefit that the PO receives when the non-financial support cannot be assigned to a meaningful monetary value.
b. For contracted services: the total amount paid per PO over the Reporting Period.
This information must be disclosed on the Member Company website either on a national or European level on an annual basis and each Reporting Period shall cover a full calendar year.
Methodology. Each Member Company must publish the methodologies used by it in preparing the disclosures and identifying supports and services provided. Disclosures under this Article shall be made on a standardised template set out in Annex B.
CHAPTER 6 – PROCEDURAL REQUIREMENTS
ARTICLE 25 – RESPONSIBILITY AND SANCTIONS
25.01. Responsibility for pharmaceutical information shall apply to information as a whole: for form and content.
25.02. Responsibility for assuring compliance with the present Code is borne by all Forum members. Authorised representatives of Forum members are responsible also for compliance with this code.
25.03. If Forum finds out or is informed about a violation of this Code, it shall request the violating company to immediately cease the violation and sign a statement that it shall not repeat it. Sanctions must be proportionate to the nature of the violation, have a deterrent effect and take into account repeated violations of the same type or patterns of various violations. Generally, the most effective sanction is the combination of notifying all Members Companies and financial fine for the violating company, however, Forum may impose any other effective sanction to enforce the implementation of the Code. Forum must also consider all applicable legal or financial requirements that could influence the nature of sanctions.
ARTICLE 26 – SUPERVISIONS
The Committee for supervision of the provisions of the Code of Practice (hereinafter: “the Committee”) as a Forum body assesses compliance of information on medicinal products and appropriateness of cooperation of Member Companies with HCPs, HCOs and POs and also provides guidelines.
ARTCLE 27 – COMPLAINTS
Complaints regarding violations of the Code shall be submitted to the Committee within 30 days from the occurrence of violation.
ARTICLE 28 – AMENDMENTS OF THE CODE
28.01. Amendments or adjustments of the Code may be adopted on the basis of a majority vote of Member Companies at the General Assembly. The Code may also be amended:
upon amendment of the EFPIA Code of conduct.
upon a request submitted to the Forum Board by a one or more Member Companies, which shall, after review, be submitted for approval to the General Assembly.
28.02. Adoption shall require the majority of present votes at a General Assembly.
ARTICLE 29 – ENFORCEMENT OF THE CODE
This Code was adopted by the General Assembly of Forum on 20 March 2020 and shall be applicable as of 1 January 2021.
ANNEX A
Standardised disclosure template for HCP and HCO
ANNEX B
Standardised disclosure template for PO
ANNEX C
GUIDANCE ON DISCLOSURE OF NON-INTERVENTIONAL STUDIES AND DISCLOSURE OF INDIRECT TRANSFERS OF VALUES (ToVs) THROUGH THIRD PARTIES
GUIDANCE ON DISCLOSURE OF NON-INTERVENTIONAL STUDIES
Background
In application of the Forums’ Code of Practice to exemption on individual reporting of ToVs relating to non-interventional studies (NIS) is limited to NIS that are prospective in nature. The Code prescribes that retrospective NIS must be reported on an individual names basis, in line with applicable codes.
Member Companies informed EFPIA that it was not always possible to distinguish ToVs relating to prospective (included in the aggregated reporting of R&D ToVs) and retrospective (to be reported on an individual basis) NIS.
The Ethics & Compliance Committee (E&CC) had considered that definitions in the new EU Clinical Trials Regulation 536/2014 could be used for reference when implementing the Disclosure requirements, thus anticipating and align with the regulatory change that will eventually take place.
On 13th June 2017, EFPIA Board approved the Guidance on disclosure of all NIS on an individual basis in case ToVs relating prospective and retrospective non-interventional studies cannot be distinguished.
This Guidance provides a basis for distinguishing between prospective versus retrospective NIS and aims at ensuring consistency in reporting of ToVs relating to NIS.
Relevant Forum Code of Practice provision
Definition of Terms
Research and Development Transfers of Value – Transfers of Value to HCPs or HCOs related to the planning or conduct of (i) non-clinical studies (as defined in OECD Principles on Good Laboratory Practice); (ii) clinical trials (as defined in Regulation N° 536/2014); or (iii) non-interventional studies that are prospective in nature and that involve the collection of patient data from or on behalf of individual, or groups of, HCPs specifically for the study.
Guidance
Transfers of Value relating to non-interventional studies (NIS) that are not within the definition of R&D ToVs under the Code must be reported on an individually named basis. In this regard, prospective versus retrospective NIS will be considered following classification in the table below:
|
RETROSPECTIVE STUDIES |
|
|
Prospective cohort studies in which the prescription of the medicine is independent from the inclusion of the patient in the study
A retrospective study to which a prospective element is subsequently introduced
Long-term extension studies with patient follow up beyond trial protocol specified time for observation and active collection of additional data |
Purely observational database review and/or research
Retrospective review of records where all the events of interest have already happened – e.g. case-control, cross-sectional, and purely retrospective cohort studies
Studies in which the prescriber later becomes an Investigator, but prescribing has already occurred – e.g. retrospective data collection from individual medical records at the site of the investigator |
For sake of clarity, activities not falling within the definition of R&D ToVs, including NIS that are not conducted to maintain a marketing authorisation (in application and following definitions of the “Clinical Trials” Regulation 536/2014), will be disclosed under “consultancy/fee-for-services”. Member Companies are encouraged to include a comment in the Methodological Note, where appropriate.
DISCLOSURE OF INDIRECT TRANSFERS OF VALUES (ToVs) THROUGH THIRD PARTIES
SUPPORT TO / SPONSORSHIP TO EVENTS THROUGH PROFESSIONAL CONFERENCE ORGANISERS (PCOS)
Background
Third parties provide support to Member Companies in a variety of capacities, impacting more or less on the conduct of activities regulated by the Code. Such activities would be reported as indirect Transfers of Values (ToVs) following provisions of the EFPIA Disclosure Code. When Member Companies provide support/sponsorship to PCOs involved in the organisation of scientific Events, it is understood that the Member Companies’ intention is to provide support to HCPs/HCOs and not to PCO.
Indirect ToVs are those made on behalf of a Member Company for the benefit of a Recipient, or ToVs through an intermediate and where the Member Company knows or can identify the HCP/ HCO that will benefit from the ToV.
In consideration of the multiple ways collaboration with third parties can be contracted, it may not be straightforward to report in application of the Code in full. As this may lead to underreporting of ToVs through third parties, further Guidance aims at providing a consistent approach towards improved reporting wherever possible in compliance with applicable law and regulations.
This Guidance clarifies reporting of Indirect ToVs to HCOs made through Professional Congress Organiser (PCOs).
In consideration of legal issues that may arise in the reporting of ToVs through Distributors on behalf of a Member Company, reporting of such ToVs are not within scope of this Guidance. Where appropriate, EFPIA may consider further Guidance for this category of (and other categories of third parties involved in) ToVs.
Relevant Forum Code of Practice provision
Section 23.05.1.b
Contribution to costs related to Events, through HCOs or third parties, including sponsorship to HCPs to attend Events, must be disclosed individually under the name of the Recipient; such costs may relate to:
Registration fees;
Sponsorship agreements with HCOs or with third parties appointed by an HCO to manage an Event; and
Travel and accommodation (to the extent governed by Article 10 of the Code).
Schedule 1: Definitions
Indirect transfers of value are those made on behalf of a Member Company for the benefit of a Recipient, or transfers of value made through an intermediate and where the Member Company knows or can identify the HCP/HCO that will benefit from the Transfer of Value.
Guidance
Contributions provided to Events through PCOs – that would therefore be the Recipient of the ToVs – must be considered as indirect ToVs.
When a Member Company contributes to the costs related to Events through PCOs, the following reporting approaches are considered compliant with reporting requirements:
All ToVs to an HCO (either as Recipient or as Beneficiary) are reported in the relevant category under the name of the HCO
ToVs through PCOs are reported:
either in the name of benefitting HCO (through include the name of Recipient PCO), if not included in direct ToVs to the HCO;
or in the name of Recipient PCO (to the benefit of include the name of benefitting HCO)
This Guidance applies whether PCOs organise Events on their own initiative, or at the request of an HCO.
For further clarification, the attached table reviews scenarios of support / sponsorship to Events through PCOs that may help in preparation of reporting according to this Guidance.
For good order, it is reminded that contribution to costs related to Events paid through third parties to the benefit of individual HCPs that the Member Company knows, must be reported on an individually named basis, as Indirect ToVs to HCPs.
Further recommendation
It is further recommended that Member Companies confirm support / sponsorship to Events through PCOs in written agreements, and encourage them to include provisions relating to information that the PCOs must communicate to the Member Company to allow appropriate reporting of ToVs following the Code.
The Member Companies are encouraged to describe the process followed to collect the information in their Methodological Note, where it must also be stated that the full value ToVs to the PCO will not constitute a benefit (in cash or in kind) to the HCO as the PCO may retain a “service fee”.
Additional Guidance adopted at national level or requested by national legal requirements may complement this EFPIA Guidance.
Additional Guidance on ToVs through PCOs
SUPPORT TO / SPONSORSHIP TO EVENTS THROUGH PROFESSIONAL CONFERENCE ORGANISERS (PCOS)
For further clarification, the table below reviews scenarios of support / sponsorship to Events through PCOs, which may help in preparation of reporting according to this EFPIA Guidance.
Examples of possible scenarios in support of Events
These examples are offered to help Member Companies when preparing their disclosure reports in the perspective of optimal reporting of Events which they sponsor / support
|
Recipient PCO receiving the ToVs |
Beneficiary HCP/HCO benefitting |
Disclosure |
|
PCO on behalf of / in collaboration with a HCO |
where the Member Company knows the HCP/HCO benefitting |
Individual disclosure following guidance |
|
PCO on behalf of / in collaboration with HCO |
where the Member Company does not know the HCP/HCO benefitting |
Whilst disclosure on an individual HCP/HCO named basis, the Member Company may consider disclosing under the PCOs name with indication of the specialty area |
|
PCO with HCO Scientific Committee |
HCO(s) is (are) known to the Member Company |
Individual disclosure following guidance |
|
PCO with HCP Scientific Committee |
HCP(s) is (are) known to the Member Company |
Individual disclosure following relevant provisions of the Code (consent by the individual required) |
|
PCO developing / organising an Event at its own initiative (independent event) |
where the Member Company knows the HCP/HCO participating in the Event |
Individual disclosure following guidance |
|
PCO developing / organising an Event at its own initiative (independent event) |
where the Member Company does not know the HCP/HCO participating in the Event |
Whilst disclosure on an individual HCP/HCO named basis, the Member Company may consider disclosing under the PCOs name with indication of the specialty area |
Disclosures on an individual names basis are subject to appropriate consent; where such consent cannot be secured, related ToVs will be disclosure in aggregate.
ANNEX D
EFPIA e4ethics rules and procedure
1. Background
Article 10 of the EFPIA Code defines the requirements applicable to pharmaceutical companies when organising events (professional, promotional, scientific, educational meetings, congresses, conferences) and/or providing hospitality during these events (paying for travel, meals, accommodation and genuine registration fees).
In 2011, EFPIA coordinated the monitoring of European third-party organised events (with more than 500 HCPs coming from 5 different countries in the scope of the EFPIA Code) by setting up an on-line platform to pre-assess events (named e4ethics).
Through e4ethics, EFPIA helps ensure a consistent implementation of the EFPIA Code provisions, enhances compliance with the Code and allows collaboration with our stakeholders (e.g. learned societies, congress organisers). While an EFPIA member company needed to take its individual decision to sponsor, participate or collaborate to an event, e4ethics provided an independent reference to inform such a decision.
2. e4ethics decisions binding and mandatory assessments
Based on a recommendation of the EFPIA Codes Committee (CodCom) and Ethics & Compliance Committee (E&CC), the EFPIA Board decided, in March 2020, to make the e4ethics platform binding, meaning that sponsoring, participation or collaboration in an event that has not been approved or has been qualified as non-compliant by e4ethics is considered as a potential breach to the EFPIA Code which could be enforced by the competent national Code authorities. In summary, this means that e4ethics decisions are binding for EFPIA Member Companies and that Member Companies must verify that an e4ethics positive assessment is available.
3. Collaboration with MedTech Europe
In 2012, MedTech Europe, the European Association for Medical Devices, set up the Conference Vetting System (CVS) as an independently managed system that checks the compliance of third-party educational events with MedTech Europe’s Code of Ethical Business Practice and Mecomed’s Code of Business Practice. The outcome of the assessment determines the appropriateness for MedTech Europe and Mecomed member companies to provide financial support to the events. The decisions rendered by the Compliance Officer are binding on MedTech Europe and Mecomed members. This means that these members cannot provide support to an event which is found to be non-compliant.
In March 2020, the EFPIA Board approved the collaboration with MedTech Europe in the field of congresses’ assessments. Therefore, e4ethics assessments will be integrated in CVS even if the assessments will be directed to two different websites: e4ethics and CVS. Based on the EFPIA Board recommendation, a testing period of 6 months will be implemented and will start on 1st January 2021. During this testing period, the binding effect of decisions and the mandatory nature of assessments will be in force.
A. KEY ELEMENTS
Each platform keeps its identity and branding, meaning that each one would have its own page with relevant information, including specific user-friendly routing to the submission form, but both pages will be hosted on www.ethicalmedtech.eu. An e4ethics banner will be added on MedTech Europe website but decisions rendered by CVS Compliance Officers shall
be posted on what will become the joint online calendar. Technical adjustment will have to be made within the CVS software to allow profile separation, while keeping a shared history of knowledge and an optimisation of service level.
Common back end: In the back end, all assessment requests will be received by MedTech Europe Compliance Officers, which will become the Compliance Officers also for Pharma Events.
The scope of e4ethics will remain the same: European congresses, organised by a third party, with 5 different countries in the scope of the EFPIA Code and more than 500 HCPs. Virtual congresses are out-of-scope.
B. ALIGNMENT OF CRITERIA
The criteria applying to e4ethics will be aligned to those of CVS:
The submission for events assessment must be done proactively and online by the EFPIA member companies or the congress organisers.
The travel arrangements and meals & drinks threshold will no longer be part of the criteria assessed. Therefore, the EFPIA Member Associations will not be consulted.
Submission in e4ethics will be mandatory, i.e. EFPIA Member Companies need to verify that an e4ethics positive assessment is available for the Event prior to being able to provide any kind of support, from the first day of the pilot phase. The submission for such assessment can be made by the Member Company or the Congress Organiser (HCO/PCO).
Binding nature of all decisions rendered by e4ethics on the EFPIA members during and after the pilot phase, meaning that an Event assessed as non-compliant cannot receive any form of support from EFPIA members.
Full MedTech Europe/EFPIA alignment on the approach and interpretation of the six assessment criteria, which means that there will not be a difference on how Pharma and MedTech Events will be assessed.
C. IMPORTANT CONSIDERATIONS
The following considerations are important:
Decisions are rendered on the basis of the documents and information provided to the CVS Compliance Officer via the online submission form. The CVS Compliance Officer does not independently verify whether the information or documents are up to date.
Decisions do not consider, nor supplant national and local laws, regulations or professional and company codes that may impose more stringent requirements upon members, HCPs, HCOs or PCOs.
The schedule and relevance of scientific programme sessions of an Event are reviewed, but not their value or quality.
The sole purpose of the vetting system is to assist corporate members in determining the appropriateness for member companies to provide support to an Event.
4. Procedure applicable to e4ethics
A. APPEAL
The assessments for e4ethics will follow the CVS process: the MedTech compliance panel will be in charge of the appeal procedure for the assessments. An appeal of the CVS Compliance Officer’s assessment is possible. The body responsible for reviewing such appeals is the MedTech Europe Compliance Panel, given the value of having one single authority overseeing the decision processes respectively pertaining to MedTech and Pharma Events.
An appeal may be filed by the Member Company or the Congress Organiser (HCO/PCO) with the Compliance Panel provided that the following requirements are respected:
Appeals must be filed within a deadline of 10 days for Pre-Clearance and Regular Submissions after the Compliance Officer’s assessment decision has been published on the joint online calendar.
A formal appeal needs to be addressed to the Chair of the Compliance Panel at cvs@ethicalmedtech.eu
The Compliance Panel will endeavour to respond to appeals within 72 hours of receipt.
B. COMPLAINT RELATED TO AN EVENT
In case of a complaint related to a European congress (and not related to an assessment), the EFPIA SOP is applicable (Annex D part A of the EFPIA Code). EFPIA will forward the complaint to the relevant national Code authority. The final decision of the national Code authority will be shared with the MedTech compliance panel for information.
A. COMPLAINTS RECEIVED BY EFPIA
Section 3 of the “Implementation & Procedural Rules” further provides that complaints received by EFPIA shall be processed as follows:
EFPIA will forward any complaints it receives (without considering their admissibility or commenting upon them) to the relevant member association(s).
EFPIA will send an acknowledgement of receipt to the complainant, indicating the¸relevant national association(s) to which the complaint has been sent for processing and decision.
iii. In addition, upon receipt by EFPIA of multiple external complaints (i.e. several complaints on the same or similar subjects lodged from outside the industry against several subsidiaries of a single company), EFPIA will communicate these complaints to the national association either of the parent company or of the EU subsidiary designated by the parent company.
Procedural Steps
4. When a complaint is received by EFPIA, the EFPIA Compliance Officer forwards it, within 10 working days, to the relevant Member Association(s) for action under the Member Association(s)’s procedure for dealing with complaints, and the complainant will be
informed of which Member Association(s) are responsible for dealing with the complaint;
5. Simultaneously, the EFPIA Compliance Officer will inform, in writing, the responsible senior employee of the company(ies) against which the complaint is made. If the complaint involves a number of countries, EFPIA will forward the complaint to the Member Association of the parent company and to the relevant company’s subsidiary(ies);
6. The Member Association(s) must acknowledge receipt of the complaint from EFPIA within 30 days following EFPIA’s communication;
7. The Member Association(s) should consider the complaint under its usual procedure, including timelines. During the adjudication period, EFPIA will not intervene, neither will it answer questions neither from the complainant nor from the Member Company(ies) involved in the case;
8. When the Member Association(s) has(ve) completed its(their) consideration of the matter, EFPIA must be so informed of the decision(s) made by the adjudication bodies, including, where appropriate, the sanction imposed. The Member Association(s) should provide updates to EFPIA as the matter proceeds no later than 6 months after it receipt of the complaint, and subsequently within each following quarter until a final decision is made on the compliant (within a reasonable timeframe);
9. A summary of decisions made on cases submitted to EFPIA will be published in EFPIA’s Codes Activity Report – once the complaint has been concluded, the learnings might lead to further discussion by the Codes Committee including enhancing code consistent implementation, where relevant.
Throughout the complaint procedure (from receipt of the complaint at EFPIA to decision of the competent adjudication bodies), EFPIA will not communicate with parties involved in the complaint within the limits of its involvement set out in the EFPIA Codes and following the procedural steps described in this SOP. In this context, communications within EFPIA will be limited to General Counsel and EFPIA Compliance Officer; the Director General will be involved to the extent justified by the complaint.”
ANNEX E
EFPIA Guideline on a Quality Framework
Principles in Lifelong Learning in Healthcare
EXECUTIVE SUMMARY
Lifelong Learning is defined by the European Commission as ‘all learning activity undertaken throughout life, with the aim of improving knowledge, skills, competences within a personal, civic, social and/or employment related perspective.’ The pharmaceutical industry has a longstanding commitment to engaging and innovating in Lifelong Learning in Healthcare (LLH). This non-binding guideline for EFPIA Members Companies provides definition and standards for quality, transparency and ethics in medical learning. Adhering to the principles in this guideline, will assist the pharmaceutical industry to ensure a disciplined approach to the funding and organisation of LLH and its continued contribution to improved patient outcomes. Adherence to laws and regulations, and organizing up-to-date, fair and balanced learning programmes remains essential to the development of quality educational programmes. By implementing and/or maintaining this approach to LLH, the pharmaceutical industry agrees to formally incorporate educational principles of LLH, provide transparency and facilitate working effectively with other stakeholders in healthcare.
Preamble
The purpose of this document is to provide a guideline for the implementation of EFPIA Code Article 16. The guideline must be read with the requirements and spirit of the Code in mind and in accordance with applicable laws and regulations, in particular, the EU Directive 2001/83/EC Titles VIII and VIIIa on information and advertising.
The intention of this guideline is to ensure that LLH by the pharmaceutical industry adheres to high ethical standards and robust educational principles with the ultimate common goal to benefit patients.
LLH must not constitute promotion.
High scientific standards and the process of quality assurance for medical learning programmes are required to maximize transparency, ensure quality, fair and balanced content, and mitigate bias. The pharmaceutical industry strives to use educational principles which are based on, learner-centric engagement to advance the value and impact of learning.
The Value of the Pharmaceutical Industry in LLH
The pharmaceutical industry has a legitimate role among other stakeholders in providing evidence to ensure innovations are used safely and in the appropriate patient populations.
To keep up with the speed and breadth of scientific and medical progress, different LLH providers are needed for rapid diffusion of new evidence and innovations in healthcare. Given that the pharmaceutical industry must ensure its medicines are used safely and in the right populations, it provides important high quality and a complementary channel for LLH.
To facilitate a robust and practical learning experience with a fair and balanced presentation of evidence, the pharmaceutical industry often partners with leading and recognised experts.
The pharmaceutical industry is in constant dialogue with healthcare professionals at the global, regional and local levels and may be in a position to identify and address learning needs that may not be covered by other providers of LLH.
With its large geographic footprint, the pharmaceutical industry can provide opportunities for education to HCPs in countries with limited access to LLH offerings.
With innovation in therapeutic areas, the pharmaceutical industry is frequently at the forefront of the provision of LLH to assist and accelerate the translation of clinical research and other advancements into clinical practice.
Introduction
Multiple terms are used to describe learning and Continuous Professional Development (CPD). These vary across regions and countries and may or may not be associated with formal accreditation. In the EFPIA Code Article 16 as well as in this document the term Lifelong Learning in Healthcare (LLH) is used to describe non promotional educational activities led and/or funded by the pharmaceutical industry and that fulfil unmet educational needs in healthcare.
LLH must not be to promote company products, devices or healthcare solutions, but to translate evidence relevant for enhancing patient care into respective learning interventions in disease areas. Company-driven, product only specific educational activities which promote medicinal products are out of scope for this document. Such activities must comply with laws and regulations for the promotion of medicines.
The following types of educational activities are covered by this guideline and have common objectives, but differ as to the level of pharmaceutical industry involvement, ownership and funding:
1. Independent Medical Education (IME), with or without Continuous Medical Education (CME) or Continuous Professional Development (CPD) accreditation. IME is conducted by an independent organisation without industry involvement or influence and can be funded by the pharmaceutical industry.
2. LLH programmes developed through collaboration or partnership of one or more pharmaceutical company(ies) with professional societies, healthcare organizations, education providers, or other key stakeholders. The collaboration/partnership includes a commitment to a definition of mutual relationships and goals; a jointly developed structure and shared responsibility; mutual authority and accountability for success.
3. Pharmaceutical industry led LLH activities, which may address human health, and diseases -specific learning needs. These activities are organized by individual pharmaceutical companies and may involve scientific committees, and/or independent scientific and professional organisations. Ownership, accountability and funding for these programmes remains that of the pharmaceutical company.
Whatever the type of LLH, the pharmaceutical industry is committed to delivering and supporting high-quality learning. The pharmaceutical industry expects other stakeholders, such as IME providers, scientific committees, scientific organizations or professional associations to adhere to the following principles when receiving pharmaceutical industry support/funding for LLH.
Quality Framework
This document describes the following 3 elements:
1. Ethical, transparent and responsible engagement;
2. Quality content: programmes and activities must not be promotional, either in content or intent; and
3. Robust processes: educational needs assessment, learning design and outcomes measurement.
Ethical, transparent and responsible engagement is mandatory for any LLH activity. Quality content and robust processes are strongly recommended to meet the highest quality learning standards and educational impact.
1. Mandatory requirements: Ethical, transparent, and responsible engagement
Ethical, transparent and responsible engagement is the overarching and basic principle of the quality framework and is mandatory. It is supported by robust educational processes and quality content. It is the responsibility of the funding pharmaceutical company to ensure the scientific integrity of LLH activity.
The purpose of ethical, transparent and responsible engagement is to address the following major considerations:
∙ Funding: Transparency regarding the reporting of funding and other value provided to those delivering or receiving the education as per EFPIA Code Chapter 2 and 5
∙ Disclosure: Disclosure of interests and potential conflicts of interest for any activity type of LLH by all party(ies) involved
∙ Intent: Transparency regarding intent, involvement, roles and responsibilities and nature of potential collaboration with external stakeholders (clinicians, medical associations/organizations)
∙ Data privacy: respect regulations (such as per GDPR)
∙ Compliance with pharmaceutical industry codes of practice [such as IFPMA, EFPIA], EU regulations and local applicable laws and regulations
2. Recommended practices
2.1 Quality content
The objective of LLH is to increase the scientific knowledge and competence of HCPs to enhance medical practice and improve the overall patient and healthcare outcomes. Quality content is the foundation of LLH.
To ensure high quality content is provided by pharmaceutical industry led and/or funded LLH activities, the programmes must not be promotional, either in content or intent. They must not include product branding (trade name, logo, brand colours etc.), nor product claims.
2.2 Robust processes
To ensure high educational quality; a robust and standardized process is strongly recommended, including:
∙ Educational needs assessment
∙ Learning design
∙ Outcomes assessment
Each pharmaceutical company will individualise their own educational processes. Examples below are intended to assist companies in the design of their processes
2.2.1. Educational needs assessment
A disciplined and accurate assessment of programme participants´ learning needs is a recommended initial step in planning educational activities and should ensure clarity on the selection criteria. Selection of delegates should be based on educational needs.
Needs can be classified as:
– Perceived needs; expressed and perceived by learners– e.g. a survey among HCPs attending a specific LLH activity
– Expressed needs; expressed in action – e.g. a clinical centre’s need to understand new guidelines in clinical practice
– Normative needs; stated by experts
– Comparative needs; expressed in group comparison for instance between clinical institutions and their clinical practice.
An educational needs assessment should include input from multiple stakeholders in healthcare. Methods for assessing learner´s needs can include reviewing literature, qualitative exploratory research, surveys, input from experts and other stakeholders in healthcare, advisory boards and multiple other data collection methods.
2.2.2. Learning design
The current healthcare ecosystem is undergoing a major transformation. This is driven by a more patient centric approach towards healthcare and vast improvements in technology. This transformation requires all stakeholders in the healthcare ecosystem to collaborate for LLH processes to meet high educational standards.
A quality assurance framework may include a standardized process for learning design and should be part of a developed higher-level strategy that aims at increasing the scientific knowledge and competence of HCPs to enhance medical practice and improve patient and healthcare outcomes.
Such processes could include an outcomes-based planning approach and should communicate what LLH should achieve. The following steps may be used in education:
1. Identify the intended outcomes based on educational needs (see needs assessment)
2. Agree on acceptable evidence e.g. discuss programme and faculty with scientific committee based on identified learning outcomes
3. Plan the learning experience
2.2.3. Outcomes measurement
To ensure continuous improvement in LLH, different approaches for measurement should be used and outcomes used to improve future programmes. Measurements may apply to different learning or instructional design and delivery channels. Although objective measures are preferred, subjective measures are used where the opinion of learners is sought, (e.g. ‘satisfaction’ or ‘relevance’).
Recommended bibliography
ANNEX F
Principles for the use of digital channels
1. Principles applicable to all types of communication
COMPLIANCE WITH LAWS, REGULATIONS AND CODES OF PRACTICE
A digital channel is only a platform for communicating. Laws and regulations applicable to other platforms and media also apply to digital media. The content, target group and use of the platform are relevant factors to determine applicable rules, not the media as such.
Therefore, the provisions of the Directive 2001/83/EC related to the Medicinal Products’ advertising, of the EFPIA Code and of this Code apply to digital communication.
The processing of personal data must comply with applicable data protection regulations.
RESPONSIBILITY
Member Companies are responsible for all material disseminated via any digital channel that is initiated, branded and/or sponsored by Member Companies, or any Third Party acting on their behalf, including promotion of Medicinal Products.
A Member Company owning the social media page or site is responsible for the content. E.g. any mention of a Prescription-Only Medicine is likely to be considered promotion of that medicine to the public and prohibited. Another example might be the use of social media directed to the public to alert HCPs about the publication of a study on a Medicinal Product which is also likely to be considered promotion of that Medicinal Product and therefore prohibited.
Member Companies may also have responsibilities when interacting on digital channels owned by other companies or organisations.
Member Companies are also responsible for information disseminated by Member Company staff who do so via their private social media channel including, a) when they can reasonably be perceived as representing the Member Company, or b) if they are instructed, approved or facilitated by the Member Company to do so. The Member Company should have internal guidelines in place on how its staff should behave on digital channels including their own personal account activities.
For digital channels owned by the Member Company, processes should be established to monitor, moderate and/or delete any inappropriate comments in a timely manner to the extent permitted by the data protection regulations and applicable laws and codes. Member Companies may need to have similar processes when using digital channels owned by other companies or organisations.
PHARMACOVIG I LANCE
Member Companies should consider developing specific guidance for digital channels and contacting their pharmacovigilance experts for specific projects in order to meet their pharmacovigilance responsibilities including the obligation to record and report any adverse effects that are discussed about their Medicinal Products.
TRANSPARENCY
Section 7.04 of this Code requires Member Companies to clearly indicate when they have sponsored a communication. Whenever a Member Company or an individual or entity acting on behalf of a Member Company provides information on a digital channel, it should clearly state the involvement of the Member Company, including but not limited to defining content, funding in part or in totality.
In addition, the transfers of values to HCPs, HCOs and POs are reportable under the disclosure obligations as described in the Code (Chapter 5).
When possible, the target audience of the channel should be clearly identified (e.g., HCPs and the public, or a combination thereof).
2. How to identify the allowed information for the different digital channels
It is important that the Member Company understands what content is appropriate for the different digital channels and the respective audience. All laws and regulations in this regard must be complied with in the same way as for other media.
Information included on a digital channel should be regularly updated and should clearly display, for each page and/or item, as applicable, the most recent date as of which such information was updated.
The following questions can be useful to assess risks associated with digital communication and appropriateness of digital channel content, access, set-up and maintenance:
What is the objective of the communication (promote, inform, exchange)?
What content will be made available on the digital channel?
Is the content related to Medicinal Products?
Is the content promotional or non-promotional?
Is the content related to disease awareness?
Is the content related to healthcare information e.g. in connection with diagnosis, treatment education, dietary support
Is the role of the Member Company providing/developing the content clear?
Who is the intended audience? e.g. public, HCPs or both
Is verification of audience required?
If yes, how?
What is the channel standard set-up?
Is the digital channel open to audience reaction such as sharing, commenting, exchanging?
How is the information cascaded across the digital channels?
Is the digital channel an open platform or for a closed audience?
Are there limitations in content size? e.g. Twitter
Are there any community guidelines applicable? e.g. Facebook, YouTube
How is the information about the channel audience processed?
How is the content reviewed, approved and maintained including by the Member Company?
3. EFPIA guidance for members for various digital channels
Below is a short description of the general use of different types of digital channels. When deciding which digital channel to use and how to develop it, the principles set out above should be taken into account.
The content published by a Member Company on each channel must be appropriate and aligned with relevant regulations, laws and codes including the EFPIA Code and this Code.
WEBSITES
Websites are classified as a channel that reaches the public, unless verification (e.g. pop-up for identification, or password) is required to access the website e.g. to HCPs. Some websites may include forums where the public can exchange or discuss topics.
Since many website visits are a result of using a search engine, keyword optimization has become an important tool. Member Companies can use appropriate search optimization to ensure that their websites are displayed high on the list of search results for relevant key words. However, Member Companies need to ensure that the use of keyword optimization is appropriate for the intended audience. For example, optimized search through use of key words directed to websites with therapy-oriented information for the public or websites aimed at HCPs, where such websites can only be accessed by the authorized individuals.
Member Companies may sponsor website material to be produced by a Third Party in which the role of the Member Company must be made clear. If the Member Company i) is initiating the material, or the concept for it; ii) is influencing the content of the material in any way; iii) is selecting or directly paying the authors; then the Member Company is very likely to be liable for the contents of the website. If the reverse is true, and there is a strictly arm’s length arrangement with the Member Company just providing a grant, then the Member Company may not be liable.
Member Companies should be confident about the choice of linked websites and that these do not promote Prescription-Only Medicines to the public. If a Member Company includes website addresses in an advertisement of a Prescription-Only Medicines to HCPs, the core principles apply, of ensuring the content of those websites is appropriate.
SOCIAL MEDIA
In general, social media are digital channels that are considered to be aimed at the public. Social media are websites or applications on which people can interact in social networks (e.g. Facebook, X (ex Twitter), Snapchat, LinkedIn, YouTube, Instagram). In most cases social media are used to reach or interact with the public. A social media platform can be an open channel for the public or a closed channel for a targeted audience where verification of the audience is required before providing access.
BLOGS
The difference between a text on a website and on a blog is that a blog is usually owned and updated by a person or a group of people who posts on the blog regularly.
A blog can be owned by the Member Company or the Member Company may engage (either through sponsorship or consultancy fees) the owner to write on a blog (such as “social influencers”). In both cases, the blog should clearly state the involvement of the Member Company.
Given that, by its very nature, a blog is for contributors to freely and spontaneously express their personal views on a subject, Member Companies should not sponsor such blogs if they were intended, or could reasonably be expected, to promote Prescription-Only Medicines and their uses.
PODCASTS
A Member Company can have its own podcast which should follow the same rules as for websites.
A podcast can be downloaded from any podcast distributor. Core principles apply, of ensuring the recipient is well defined and targeted and that content is appropriate. E.g. a podcast promoting Prescription-Only Medicines should only be accessed by HCPs.
APPLICATIONS (APPS)
An application, usually referred to as an “app”, is to be downloaded on an electronic device (e.g. smartphone, computer or tablet).
A Member Company can develop apps for the use of external stakeholders (e.g. HCPs, HCOs, patients, payers), provided that they follow the same rules as for websites. Also, they should consider potential regulatory requirements if the app fulfils the requirements for a medical device. Core principles apply, including ensuring the audience is well defined and targeted.
An app can also be developed to improve compliance with a treatment method. If an app targets a specific group (e.g. HCPs, patients, caregivers), it is important that only this group is offered access to the app content.
WEBINARS
A webinar is an on-line event conducted via the internet and it can be either performed as a live streaming event or as an on-demand service.
A Member Company can be the direct organiser of a webinar and/or use a Third Party facilitator to run the event. The Member Company is responsible for these webinars including the content and ensuring that the audience is well defined and targeted. Similar arrangements apply to Third Party webinars sponsored by Member Companies.
Such webinars can be for the communication with external stakeholders (e.g. HCPs, HCOs, patients, payers) provided, that they follow the same rules as for websites.
DIRECT CHANNELS
These are one-to-one or one-to-many channels, which are targeting selected recipients; these are most commonly private, not visible to non-selected recipients; they could be replies on social media channels to an individual.
Member Companies should ensure they have the consent of the recipients to be in contact with them, and the recipients should be able to stop receiving messages easily. Appropriateness of the frequency of contact should be borne in mind.
DISCUSSION FORUMS
If a Member Company facilitates a discussion forum on either a Third Party platform, or hosts a forum on its own platform, the Member Company must be confident that they can moderate the site such that the content complies with relevant regulations, laws and codes including the EFPIA Code and this Code. The intended audience should be identified so that relevant requirements are complied with. If discussion forums are used for market research, Member Companies should ensure these are compliant with relevant legal and ethical guidelines.
“,”Jaka Verbič Miklič”,1745005500,1745005500,en,14521,306,14238,43,0,NULL,,”Forumov kodeks ravnanja”,forumov-kodeks-ravnanja,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1605546477,1753006384
701,14531,”Inovativnost potrebuje regulatorno podporo”,”Na področju zdravstva potreben napredek na področju inovacij, digitalizacije in hitrejšega pretoka informacij”,”
Na 9. strateški konferenci Vrednost inovacij: Čas za tehnologije jutrišnjega dne je danes so govorci spregovorili tudi o tem, da je lahko kriza, s katero se je v letošnjem letu soočil svet, dobro izhodišče za premislek o obstoječih (zdravstvenih) sistemih in predvsem iskanju rešitev za težave, ki jih je pandemija poudarila. Tako, kot je na področju inovacij še mnogo prostora za izboljšave, je za to, da bodo nove terapije dosegle bolnike, ki jih nujno potrebujejo, prostor za izboljšave tudi na področju regulativnih procesov.
Mag. Francesca Colombo, vodja oddelka za zdravje pri Organizaciji za gospodarsko sodelovanje in razvoj (OECD) je poudarila, da je pandemija novega koronavirusa pokazala, da je na področju zdravstva mnogo prostora za inovacije. Omenila je razvoj hitrejših in bolj zanesljivih diagnostičnih kapacitet in orodij, ki bi pomagala pri obvladovanju trenutne pandemije in potencialnih prihodnjih. Izpostavila je tudi drugo področje inovacij, kjer smo v pandemiji dosegali dobre rezultate: “Prišlo je do izredno hitrega napredka pri uporabi digitalnih podatkov, tehnologij in rešitev, ter celo umetne inteligence (UI) in telemedicine. Na tem področju smo prešli nekatere finančne in institucionalne ovire, ki so prej zavirale napredek.” Kljub temu je potrebno nagovoriti še marsikatero področje, pri UI na primer vnos podatkov še ni dovolj kvaliteten oziroma celosten. Zadnje področje inovacij, o katerem je govorila mag. Colombo, se tiče raziskav in razvoja (ang. Research and Development oz. R&D), kjer je prišlo do zelo velikih investicij tudi s strani vlad in filantropskih organizacij predvsem za razvoj cepiva proti Covid-19.
O napredku zdravstvenih inovacij je govoril tudi Thomas Allvin, izvršni direktor za strategijo in zdravstvene sisteme pri Evropski federaciji farmacevtske industrije in združenj (EFPIA), ki je povedal, da od leta 2015 opažamo konstanten trend rasti kliničnih preizkusov za inovativne terapije, predvsem na petih največjih področjih, ki so onkologija, nalezljive bolezni, nevrologija, hematologija in respiratorno področje. Trend se nadaljuje tudi v letu 2020, kljub svetovni pandemiji. Na področju zdravstva lahko torej govorimo o visoki stopnji inovativnosti, težava pa se pojavi pri dostopu zdravil, ki je v državah Evropske unije zelo različen; povprečna zakasnitev med izdanim dovoljenjem za promet in dostopom pacientov do terapij je v Severni in Zahodni Evropi tudi do šestkrat manjša kot v Južni in Vzhodni Evropi, zato je Allvin izrazil utemeljeno skrb, da bo pandemija Covida-19 dostop do zdravil še poslabšala. “Za nova zdravila mora obstajati podporna infrastruktura, da lahko terapije pridejo do bolnikov. Na kar nekaj področjih bi bilo potrebno poiskati politične rešitve, s katerimi bomo pospešili regulatorne procese,” je poudaril.
Umetna inteligenca lahko pomaga pri obvladovanju kriznih situacij
Potencialna rešitev, ki lahko pomaga predvsem na področju odločanja (tudi) v kriznih situacijah, pa je umetna inteligenca, o kateri je več povedal dr. Marko Grobelnik, raziskovalec v laboratoriju za umetno inteligenco na Inštitutu Jožefa Stefana in digitalni glasnik Slovenije o novostih v razvoju umetne inteligence, ki je poudaril kar nekaj lekcij pandemije: “Hitrost pri odločanju se je povišala, vendar organizacije in sistemi niso bili pripravljeni na hitro reagiranje. Prilagajanje novim situacijam je postalo nuja, so pa procesi za prilagajanje prepočasni. Znamo reševati izolirane probleme, ampak brez dobrega razumevanja posledic izoliranih ukrepov, ki se sprejemajo, bodisi na nivoju države bodisi na nivoju podjetij. Podatke za pomoč pri odločanju imamo, so na razpolago, ampak največkrat niso integrirani in so pogosto nedosegljivi. Tehnologija je prav tako na razpolago, ampak je na kritičnih mestih ne uporabljamo. Kot zadnje – javno mnenje je pomembno, ampak se na drugi strani ne znamo boriti z dezinformacijami, ki maličijo prostor.” Kot priložnost, ki lahko pomaga v takšnih situacijah, vidi splošno umetno inteligenco, ki lahko odgovori na težave v zelo zahtevnih celovitih situacijah – pri tovrstnih nalogah bo v prihodnosti človek namreč le stežka tekmoval z avtomatiziranimi sistemi, poudarja dr. Grobelnik.
Farmacevtska ter IT podjetja, raziskovalci in drugi deležniki torej že omogočajo dobre inovativne rešitve, bo pa za resničen napredek, ki bo za paciente predstavljal dodaten korak naprej, potrebno spremeniti procese odločanja, predvsem v smeri hitrejših in enostavnejših postopkov.
“,”Jaka Verbic Miklic”,1605770820,1605770820,sl,14531,306,14530,43,0,NULL,,”Inovativnost potrebuje regulatorno podporo”,inovativnost-potrebuje-regulatorno-podporo,Post,”/sites/43/files/images/news/Inovativnost potrebuje regulatorno podporo/Farmaforum_ Inovativnost potrebuje regulatorno podporo.jpg”,1,0,1605770946,1605770947
703,14558,”Ali resnično poznamo potrebe ljudi z redkimi boleznimi?”,”Objavljamo prvi del članka o virtualni okrogli mizi na temo Nacionalnega načrta za obravnavo redkih bolezni 2020-2030 “,”
S koncem letošnjega leta se izteče 8-letni nacionalni Načrt dela na področju redkih bolezni (Načrt), zato potekajo intenzivne aktivnosti na področju priprave novega načrta za prihodnje desetletje. Medicina danes je zato, tudi ob podpori Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, organizirala virtualno okroglo mizo, kjer so svoja mnenja predstavili tako člani komisije za pripravo novega Načrta dela na področju redkih bolezni (Komisija) kot tudi predstavniki nekaterih društev bolnikov z redkimi boleznimi.
Na okrogli mizi so sodelovali prof. dr. Borut Peterlin iz Inštituta za genetiko UKC Ljubljana, doc. dr. Blaž Koritnik iz Nevrološke klinike UKC Ljubljana in dr. Urh Grošelj iz Pediatrične klinike UKC Ljubljana, vsi člani Komisije, ter predstavniki društev bolnikov; Kristina Modic, predsednica Slovenskega združenja bolnikov z limfomom in levkemijo, Davor Duboka iz Evropskega združenja za redke bolezni EURORDIS in Mateja Toman iz Društva distrofikov Slovenije. Sogovorci so predstavili pozitivne prakse, izpostavili pa so tudi področja, ki bi jih bilo potrebno še izboljšati.
Moderatorka je uvodoma prebrala pismo mame bolnice z redko boleznijo, ki je izpostavila težave, s katerimi se bolniki z redkimi boleznimi spopadajo vsakodnevno. Omenila je, da se soočajo z mnogimi birokratskimi težavami, kot primer je navedla dejstvo, da hčerkina bolezen ni v registru, posledično pa ji ne pripada nadomestilo za nego. Ker deklice zaradi starosti ni mogoče vključiti v noben program terapij, morajo za le-te plačevati iz lastnega žepa. Kot odgovor je doc. dr. Urh Grošelj uvodoma izpostavil, da je pri redkih boleznih pogosto težava to, da bolniki nimajo postavljenih diagnoz, posledično pa je seveda težko zdraviti, saj ne vemo, proti čemu se je treba boriti. Kot zelo pomembno je izpostavil podporno terapijo, tako za bolnike, ki imajo diagnozo, kot za tiste, ki je nimajo.
Izkoristiti je potrebno obstoječo infrastrukturo
Moderatorka okrogle mize je tekom dogodka prebrala še eno pismo, in sicer bolnice z redko obliko raka ki je zapisala, da zdravniki po njenem mnenju niso dovolj ozaveščeni o redkih boleznih in da je na tem področju premalo aktivnosti. “V Sloveniji nimamo dobro delujočega združenja za redke bolezni, ki bi lahko pomagalo bolnikom. Tudi Nacionalna točka za redke bolezni včasih razočara s presplošnimi odgovori, več bi bilo potrebno narediti za bolj strokovno podporo,” je zapisala.
Doc. dr. Blaž Koritnik je glede načrtovanja sistemskih rešitev za obravnavo redkih bolezni povedal, da se mu zdi smiselno “da se tega lotevamo od spodaj navzgor, torej v čim večji meri izkoristiti že obstoječo infrastrukturo in jo nadgrajevati. Vsak mora imeti dostop do strokovnjaka, ki se z boleznijo ukvarja. Težko je pričakovati, da vsak družinski zdravnik pozna vse redke bolezni, mora pa kljub temu bolnik imeti nekoga, ki bolezen pozna in ga lahko obravnava ter mu nudi pomoč,” je povedal kot odgovor bolnici z rakom.
Predsednica Slovenskega združenja bolnikov z limfomom in levkemijo (Združenje L&L) Kristina Modic je izpostavila, da mnogi bolniki z redkimi boleznimi nimajo možnosti članstva v društvu, če tovrstna organizacija ne obstaja: “Zanje je zagotovo najtežje, zato jim je potrebno pomagati. Tu ima pomembno vlogo Nacionalna kontaktna točka in Združenje za redke bolezni. Pomembno je, da bi Nacionalna kontaktna točka dobila podporo za delovanje in tako čim prej zaživela v pravem pomenu besede ter bila s kakovostnimi informacijami dostopna bolnikom in svojcem. Tudi strokovnjaki, ki delujejo na področju redkih bolezni, bi morali dobiti podporo države. Nacionalni Načrt za redke bolezni potrebujemo čim prej, pa tudi v prakso bi ga bilo potrebno implementirati v čim večjem obsegu.”
Želimo, da bo Slovenija vzor drugim
Sodelujoči zdravniki so se strinjali, da je potrebno določena področja še urediti. Glede prihajajočega Načrta, ki ga v okviru Ministrstva za zdravje aktivno soustvarjajo tudi vsi trije specialisti, ki so sodelovali na okrogli mizi, pa je prof. dr. Borut Peterlin povedal: “S predlaganimi ukrepi moramo nagovoriti takojšnje težave bolnikov, stroke in drugih deležnikov, po drugi strani pa mora imeti Načrt vizijo in odprt prostor, da se ga bo dalo nadgrajevati. Želimo pripraviti takšen Načrt, da bo Slovenija vzor drugim državam, tako na evropskem kot globalnem nivoju,” je poudaril. V prejšnjem Načrtu je po njegovem mnenju manjkal reprezentativen glas bolnikov in njihovih potreb v Sloveniji. Z ustanovitvijo krovnega Združenja za redke bolezni pa je bil narejen pomemben korak naprej.
Vlogo slednjega je natančneje pojasnila Mateja Toman iz Društva distrofikov Slovenije, ki opaža, da je namen Združenja v javnosti včasih napačno razumljen: “Gre za združenje organizacij – pravnih oseb, ki obravnava skupne cilje, vprašanja in prizadevanja organizacij. Vloga Združenja je v oblikovanju in zagovarjanju skupnih interesov in ciljev v dialogu s pristojnimi institucijami, s svetovanjem pa pomaga tudi organizacijam bolnikov pri njihovem ustanavljanju in organiziranju delovanja,” je povedala in dodala, da na Združenju za redke bolezni ni zaposlenih zdravnikov, ki bi lahko odgovarjali na konkretne težave bolnikov.
Tako strokovnjaki kot bolniki z redkimi boleznimi imajo kopico dobrih predlogov, kako bi lahko prihajajoči desetletni nacionalni Načrt za obravnavo redkih bolezni 2020-2030 izboljšal diagnostiko in potek zdravljenja za bolnike. V prihodnjih dneh bomo objavili še drugi del zapisa o pogovoru na virtualni okrogli mizi, to pa si lahko v celoti ogledate tudi spodaj.
“,”Jaka Verbic Miklic”,1606200480,1606200480,sl,14558,306,14557,43,0,NULL,,”Redke bolezni”,redke-bolezni,Post,”/sites/43/files/images/O nas/Povezave/Povezave.jpg”,1,0,1606200584,1606380725
705,14567,”Evropska komisija predstavila farmacevtsko strategijo”,”Na pripravo strategije je vplivalo tudi soočanje s svetovno pandemijo, ki je pokazala kar nekaj možnosti za regulativne izboljšave na področju zdravstva”,”
Lekcije pandemije covida-19 so pomembne za nadaljnji razvoj in usmeritve evropske farmacevtske strategije in so bile vzete v obzir ob nastajanju Farmacevtske strategije EU (Strategije), ki jo je predstavila Evropska komisija (EK). Strategija vsebuje številne predloge, s ciljem izboljšanja evropske konkurenčnosti in vzpostavitve Evropske unije (EU) kot vodilne na področju zdravstvenih inovacij.
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb (Forum) in Evropska zveza farmacevtske industrije in združenj (EFPIA) se strinjata, da je Strategija ključnega pomena za spodbujanje raziskav na področju nezadovoljenih zdravstvenih potreb in tudi širše za naslavljanje izzivov, s katerimi se soočajo zdravstveni sistemi evropskih držav. Še posebej so pomembni ukrepi na področju protimikrobne odpornosti, učinkovite uporabe podatkov pri raziskavah in upravljanju zdravstvenega sistema, v diagnostiki, na področju terapij in tudi pri razvoju cepiv. Strategija vključuje nove pobude, ki so ključne za podporo učinkoviti uporabi zdravstvenih podatkov. Še posebej je pomembna vzpostavitev enotnega evropskega podatkovnega prostora za zdravstvo in ustvarjanje interoperabilne infrastrukture za dostop do podatkov, ki bo olajšala analizo podatkov po Evropi.
Farmacevtska podjetja so v ospredju boja proti koronavirusu, saj zagotavljajo oskrbo bolnikov z zdravili (v Sloveniji je v času pandemije oskrba z zdravili ves čas nemotena), podpirajo zdravstvene sisteme z raziskavami in diagnostiko, še posebej pa je potrebno poudariti hiter razvoj učinkovitih in varnih cepiv proti covidu-19. Na vseh teh področjih lahko govorimo o izjemno hitrem napredku ter številnih spoznanjih s področja reguliranja raziskav, razvoja, proizvodnje in dobave novih diagnostik, zdravljenj in cepiv. Strategija vključuje veliko regulativnih predlogov, ki se skladajo s predlogi Foruma in EFPIA. Za izboljšave evropskega regulativnega sistema bo potrebno sodelovanje vseh ključnih deležnikov, posebej je treba izpostaviti izboljšave na področjih znanstvenega dialoga, dinamične regulativne ocene in odločanja na osnovi podatkov, da bi lahko dosegli izboljšanje regulacije za zdravila in pripomočke ter spodbudili inovativne modele preskušanj.
Za Slovenijo je še posebej pomembno to, da namerava Strategija nagovoriti razlike v dostopu do zdravil. V tem okviru predvideva nekatere ukrepe, ki jih EFPIA in Forum ocenjujeta kot napačne.
Nathalie Moll, generalna direktorica EFPIA, je komentirala: “Pri reševanju vprašanja antimikrobne odpornosti Strategija priznava pomen spodbud pri usmerjanju raziskav v nezadovoljene zdravstvene potrebe. Vendar pa hkrati kot način reševanja težav dostopa do zdravil predlaga destabilizacijo in oslabitev spodbud, namenjenih podpori inovacijam na več področjih, vključno z zdravili za redke bolezni in otroke. Poleg tega, da bi bilo to neučinkovito, hkrati predstavlja tveganje, da bi se s tem spodkopalo splošne cilje Strategije z ustvarjanjem negotovosti in posledičnim usmerjanjem investicij v ZDA, Združeno kraljestvo in na Kitajsko. Verjamemo, da se lahko s sprejetjem pravega pristopa, s sodelovanjem vseh pomembnih deležnikov in z izbiro pravih političnih možnosti za reševanje vprašanj dostopa do zdravil izognemo negativnim posledicam in ustvarimo hitrejši, pravičnejši in trajnejši dostop za bolnike po vsej Evropi, hkrati pa podpiramo inovacije.”
EFPIA in Forum skupaj s številnimi zdravstvenimi organi pozivata Komisijo, naj pri iskanju rešitev vprašanj dostopa do zdravstvenih inovacij sodeluje z vsemi deležniki preko vzpostavitve posvetovalnega telesa – Zdravstvenega foruma EK, kjer bi lahko sodelovali relevantni deležniki, vključno s farmacevtskimi podjetji, ki odkrivajo, razvijajo in ponujajo farmacevtske inovacije. Izkušnje, pridobljene tekom pandemije koronavirusa, so namreč pokazale, da je s skupnimi močmi mogoče identificirati večstranske rešitve za vpeljavo novih tehnologij, ki lahko razširijo dostop, zmanjšajo zamude in ublažijo vpliv pomanjkanja terapij.
Svetovna pandemija je regulatornim, raziskovalnim in znanstvenim skupnostim ponudila enoten cilj iskanja rešitev za zdravstvene sisteme, ki kar najbolje nagovarjajo potrebe bolnikov. V tem času smo našli rešitve in poti pri iskanju novih diagnostik, skeniranju baz podatkov o izdelkih za iskanje možnih zdravil in cepiv, za sodelovanje pri raziskavah, razvoju, izdelavi, inovacijah in dostavi.
Evropa ima še vedno močan in stabilen raziskovalni ekosistem, prvovrstna raziskovalna središča, velika in majhna raziskovalna farmacevtska podjetja, predvidljive iniciative, ki pomirjajo vlagatelje in regulatorno fleksibilnost, preizkušeno v obdobju pandemije koronavirusa, ki zagotavlja varnost in učinkovitost. Strategija pozitivno prispeva k izboljšanju evropskega ekosistema za raziskave, proizvodnjo in biološko pripravljenost. Z izbiro optimalnih političnih rešitev za vprašanja dostopa in cen se lahko izognemo ogrožanju evropske konkurenčnosti, zagotovimo boljše pogoje in rezultate za bolnike ter hkrati spodbudimo gospodarsko okrevanje.
“,”Jaka Verbic Miklic”,1606482840,1606482840,sl,14567,306,14566,43,0,NULL,,”Evropska komisija predstavila farmacevtsko strategijo”,evropska-komisija-predstavila-farmacevtsko-strategijo,Post,”/sites/43/files/images/news/Farmacevtska strategija/Evropska komisija predstavila farmacevtsko strategijo.jpg”,1,0,1606483011,1606483012
706,14571,”Povezovanje ljudi z redkimi boleznimi je ključnega pomena”,”Objavljamo drugi del članka o virtualni okrogli mizi na temo nacionalnega Načrta za obravnavo redkih bolezni 2020-2030″,”
Medicina danes je ob podpori Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb organizirala virtualno okroglo mizo na temo prihajajočega Načrta za obravnavo redkih bolezni (Načrt). S koncem letošnjega leta se namreč izteče 8-letni nacionalni Načrt za obravnavo redkih bolezni, zato je v nastajanju nov plan. Prvi del povzetka okrogle mize lahko preberete tu.
Vsi govorci, ki so sodelovali na okrogli mizi, se strinjajo, da je ključnega pomena povezovanje tako bolnikov v društva, kot s specialisti in dalje specialistov v mreže strokovnjakov. Doc. dr. Urh Grošelj pozdravlja povezovanje bolnikov v društva, saj lahko skupaj dosežejo več in svetuje, da so bolniki z redkimi boleznimi proaktivni pri obravnavi svoje bolezni. Pozitivno se mu zdi tudi povezovanje s tujimi društvi in mrežami, na primer EURORDIS-om, saj opaža, da bolniki na takšen način pogosto pridobijo uporabne informacije. “Včasih prinesejo koristne podatke, ki nam lahko pomagajo pri naslavljanju njihovih bolezni,” je povedal.
Z njim se je strinjal koordinator EURORDIS-a, Davor Duboka: “EURORDIS svojim članom omogoča, da izkoristijo priporočila o različnih temah, vključno z nacionalnimi načrti, ki so obravnavani na srečanjih. Drugo pomembno sredstvo za člane EURORDIS-a je Svet nacionalnih zvez (ang. Council of National Alliances oz. CNA), ki vključuje evropske nacionalne zveze za redke bolezni in je priložnost za izmenjavo znanja in izkušenj. Nazadnje je pa EURORDIS partner in pobudnik številnih projektov na evropski ravni, med katerimi je najpomembnejši Rare 2030, katerega cilj je podati pogled za prihodnjih 10 let in na podlagi teh ugotovitev razviti politična priporočila.”
Društva bolnikov z roko v roki s stroko
Tudi Mateja Toman iz Društva distrofikov Slovenije vidi prednosti v sodelovanju, sami se povezujejo tudi s strokovnimi institucijami: s Kliničnim inštitutom za klinično nevrofiziologijo pri UKC Ljubljana in z Univerzitetnim rehabilitacijskim inštitutom RS – Soča. “Povezujemo se tudi z drugimi organizacijami, s katerimi si skupaj prizadevamo za cilje, ki nas vsebinsko povezujejo.” Med njimi so invalidske organizacije, povezane v Nacionalni svet invalidskih organizacij Slovenije, na evropski ravni pa sodelujejo v Evropskem združenju društev distrofikov EAMDA, preko katerega se vključujejo v EURORDIS. “Namen je v obeh primerih enak: sodelovanje, skupno oblikovanje predlogov in učinkovitejše zagovarjanje naših skupnih interesov. Rešitve oblikovane na evropski ravni so lahko koristne in uporabne tudi pri urejanju istih področij na nacionalni ravni,” je povedala Mateja Toman.
Kristina Modic, predsednica Slovenskega združenja bolnikov z limfomom in levkemijo, je povedala, da so potrebe bolnikov s krvnim rakom zelo podobne potrebam vseh onkoloških bolnikov, zato so se povezali v krovno organizacijo društev bolnikov, Združenje ONKO NET, kjer skupaj z ostalimi zagovorniki bolnikov s področja onkologije uresničujejo skupne interese in se zavzemajo za skupne cilje. Posebej je izpostavila močno podporo in odlično sodelovanje z zdravstvenimi strokovnjaki, ki prav tako pomagajo razvijati in nadgrajevati njihove programe za bolnike in svojce.
Slovenija povezana z mrežami v tujini
Prof. dr. Borut Peterlin je kot pomembno dejstvo izpostavil, da v Sloveniji že leta zagotavljamo evropsko primerljiv standard obravnave redkih bolezni in da smo se priključili praktično vsem evropskim mrežam za redke bolezni, ki pogosto delujejo kot povezovalni člen. “Če v Sloveniji na primer ne bi mogli ponuditi evropskega standarda obravnave bolezni, obstaja inštrument evropskih mrež, da lahko bolnika usmerimo na najboljšo trenutno možno obravnavo v Evropi,” je poudaril.
S pomembnostjo referenčnih mrež se je strinjal tudi doc. dr. Urh Grošelj, ki je povedal, da tovrstne mreže in formalno povezovanje pogosto olajšata delo, zato je to potrebno aktivno spodbujati. Pozitiven vidik tovrstnih centrov je namreč to, da se z njimi poveča število bolnikov, ki jih specialisti obravnavajo, več podobnih bolnikov pa pomeni več izkušenj in diagnostičnih orodij. Kljub temu pa meni, da imamo v Sloveniji vrhunsko medicino na področju redkih bolezni in da domača stroka naredi veliko za bolnike. “Organizirati obravnavo takšnih bolnikov pogosto zahteva dodatno delo, nekaj improvizacije, predvsem pa je potreben interdisciplinaren pristop, redke bolezni so namreč pogosto multi-organske. Zato na pediatrični kliniki razmišljamo o vpeljavi vsaj delne centralizacije obravnave, na primer ustanovitve centra za redke bolezni, idealno bi namreč bilo, da bi bil bolnik v centru in da različni specialisti prihajajo k njemu. Je pa to dražja medicina, ki zahteva bolj “velikodušne” standarde za obravnavo. Država mora prepoznati, da obstaja skupina bolnikov, ki ima posebne in pogosto dodatne potrebe in prilagoditi rešitve,” je poudaril.
Doc. dr. Blaž Koritnik se je strinjal s predhodnikoma in podpira pobudo ustanovitve centra za redke bolezni, je pa hkrati pojasnil, da je tovrstno povezovanje na Pediatrični kliniki lažje, ker imajo na enem mestu različne strokovnjake, težje pa je to za bolnike v odrasli dobi: “Strokovnjaki se razlikujemo. Najboljši način se mi zdi ta, da se bolezni na nek način grupirajo po podsistemih.” Bolnika, ki ima na primer primarno nevrološko redko bolezen, bi vodil specialist s tega področja, priključeval pa bi specialiste drugih smeri, ki so potrebni za primerno obravnavo bolnika. Poudaril je tudi to, da se je potrebno zavedati, da se redke bolezni med seboj izrazito razlikujejo in je zato težko razviti enoten pristop k obravnavi in zdravljenju. “Smiselno je, da v okviru krovnega Načrta oblikujemo principe, kako naj sistem deluje, nadalje pa je zelo pomembno, da znamo prisluhniti specifičnim potrebam bolnikov, da slišimo njihov glas in primerno prilagodimo obravnavo. Potrebno se je prilagoditi specifiki vsake posamezne bolezni,” je povedal.
Sodelujoči na okrogli mizi so se strinjali, da je povezovanje vseh deležnikov, tako strokovnjakov, kot društev bolnikov in nenazadnje regulatornih organov, ključnega pomena pri obravnavi bolnikov z redkimi boleznimi. Zaradi specifike področja morajo biti vsi nekoliko bolj prilagodljivi in odprti za sodelovanje.
Povezava do celotnega spletnega webinarja:
“,”Jaka Verbic Miklic”,1606746780,1606746780,sl,14571,306,14570,43,0,NULL,,”Povezovanje ljudi z redkimi boleznimi je ključnega pomena”,povezovanje-ljudi-z-redkimi-boleznimi-je-kljucnega-pomena,Post,/sites/43/files/images/news/ali-resnicno-poznamo-potrebe-ljudi-z-redkimi-boleznimi.jpg,1,0,1606746914,1606747014
707,14573,”Osteoporoza je nevidna bolezen, ki ne prizadene zgolj žensk”,”Osteoporoza je tiha in nevidna bolezen, zaradi katere lahko pride do zlomov kosti”,”
Ljubljana, 20. oktobra – Osteoporoza je tiha in nevidna bolezen, zaradi katere lahko pride do zlomov kosti, ki lahko vodijo v omejitve gibanja ali celo invalidnost, so povedali na novinarski konferenci zveze društev bolnikov z osteoporozo. Med drugim so poudarili potrebo po čim hitrejši mobilizaciji bolnikov, opozorili pa so tudi, da osteoporoza ni zgolj ženska bolezen.
Osteoporoza je zelo pogosta bolezen, zaradi katere imajo bolniki krhke kosti. To najpogosteje vodi v zlome kolkov, hrbteničnih vretenc in zapestij, je pojasnil endokrinolog Tomaž Kocjan iz Univerzitetnega kliničnega centra (UKC) Ljubljana. Bolezen najpogosteje prizadene starejše, med dejavnike tveganja pa poleg starosti sodijo tudi genetski dejavniki, menopavza, pomanjkanje kostne mase in testosterona pri moških, nezdrav življenjski slog ter premalo kalcija in vitamina D. Dejavniki tveganja so lahko tudi različne spremljajoče bolezni.
Zlomi zaradi osteoporoze lahko vodijo v izgubo samostojnosti ali celo invalidnost bolnikov. Kot sta opozorili družinska zdravnica Jana Govc Eržen in Elizabeta Stepanović s kliničnega oddelka za endokrinologijo, diabetes in presnovne bolezni UKC Ljubljana, to lahko predstavlja velik šok tako za bolnika, kot tudi za njegove najbližje.
Kot so povedali na novinarski konferenci, v roku enega leta umre skoraj četrtina bolnikov, ki utrpi tak zlom. Po besedah travmatologa Matevža Tomaževiča z ljubljanskega kliničnega centra, razlog za to pogostokrat tiči v pridruženih boleznih bolnikov. Stres, ki sledi takšnemu zlomu, lahko takšne bolezni namreč še poslabša.
Ravno to je razlog, zakaj je cilj zdravnikov takšnim bolnikom čim hitreje vrniti mobilnost, za kar pa je potrebno izobraževanje, operacije in protibolečinske terapije, je dejal Tomaževič. Izobraževanje bolnikov je pomembno tudi za to, ker je pri osteoporozi ključnega pomena hitra diagnoza in preventivno ravnanje. Po mnenju Stepanovićeve so dobro ozaveščeni bolniki, ki so seznanjeni s svojimi dejavniki tveganja, zelo dobrodošli.
Osteoporoza sicer precej bolj prizadene ženske kot moške, kar je posledica višjih starosti, ki jih dosegajo ženske, gostejše kostne mase moških ter odsotnost menopavze pri slednjih. Leta 2019 je v Sloveniji za osteoporozo trpelo okoli 100.000 žensk ter 25.000 moških. Po ocenah sogovornikov je nezdravljenih 60 odstotkov primerov osteoporoze, kar pa je sicer pod evropskih povprečjem, ki znaša 80 odstotkov.
A kot so opozorili sogovorniki, je osteoporoza zaradi tega v današnji družbi še vedno prevečkrat obravnavana kot bolezen žensk. Opažajo, da tudi zdravniki pri diagnosticiranju moških premalokrat pomislijo na to bolezen. Kocjan je ob tem posebej poudaril, da so tukaj predvsem izpostavljeni moški, ki se zdravijo zaradi raka na prostati. Zdravila, ki se jih uporablja pri tem zdravljenju, namreč zavirajo proizvajanje testosterona.
Situacija na tem področju se izboljšuje, pa je optimistična predsednica Zveze društev bolnikov z osteoporozo Slovenije Duša Hlade Zore. Kot pravi so v dvajsetih letih delovanja v zvezi zaznali porast moških članov, opazili pa so tudi večje zanimanje moških za dogodke povezane z osteoporozo.
Za izboljšanje situacije na področju osteoporoze pa so pomembno prispevali tudi napredki na področju medicine. Tako je po podatkih Tomaževiča še 20 let nazaj za posledicami osteoporoze umrla ena tretjina bolnikov, medtem ko je zdaj ta številka padla na eno petino. Uveden je bil tudi poseben program za zgodno odkrivanje osteoporoze in čimprejšnjo mobilizacijo bolnikov. V Sloveniji so bolnikom na voljo vsa zdravila, ki so odobrena s strani Evropske agencija za zdravila, pa je še izpostavil Kocjan.
Novinarsko konferenco je Zveza društev bolnikov z osteoporozo Slovenije pripravila ob današnjem svetovnem dnevu osteoporoze, ki ga obeležujemo od leta 1996.
“,”Jaka Verbic Miklic”,1603172100,1603172100,sl,14573,306,14572,43,0,NULL,,”Osteoporoza je nevidna bolezen, ki ne prizadene zgolj žensk”,osteoporoza-je-nevidna-bolezen-ki-ne-prizadene-zgolj-zensk,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1606891109,1606891145
708,14575,”Na cepljenje proti gripi tudi k osebnim zdravnikom ali v najbližji zdravstveni dom”,”NIJZ prebivalce poziva, da se za cepljenje proti gripi naročijo pri osebnih zdravnikih ali v najbližjem zdravstvenem domu.”,”
Ljubljana, 24. oktobra – NIJZ prebivalce poziva, da se za cepljenje proti gripi naročijo pri osebnih zdravnikih ali v najbližjem zdravstvenem domu. Večina ambulant NIJZ ima namreč termine zasedene vsaj do konca novembra, z vidika zaščite pa je pomembno, da se cepljenje opravi čim prej. NIJZ bo zato del cepiva za cepljenje v svojih ambulantah odstopil drugim izvajalcem.
Cepljenje proti gripi se je začelo minuli ponedeljek. Kot kaže, je letos zanimanje za cepljenje precejšnje, saj ima večina ambulant na devetih območnih enotah Nacionalnega inštituta za javno zdravje (NIJZ) zapolnjene termine cepljenja vsaj do konca meseca novembra, posamezne pa tudi že v mesecu decembru. K temu so najbrž pripomogle tako epidemiološke razmere zaradi širjenja novega koronavirusa kot tudi brezplačno cepljenje za vse zavarovanje osebe, ki ga je nedavno potrdil državni zbor.
NIJZ zato vse, ki bi se želeli cepiti proti sezonski gripi, poziva, da se za cepljenje naročijo pri izbranih osebnih zdravnikih ali v najbližjem zdravstvenem domu. “Z vidika zaščite proti gripi je namreč pomembno, da se cepljenje opravi čim prej, da se čim prej vzpostavi tudi zaščita pred sezonsko gripo,” so zapisali na spletni strani.
Zato bo tudi NIJZ del cepiva, ki so ga načrtovali za izvajanje cepljenja v ambulantah NIJZ, odstopil drugim izvajalcem, ki bodo lahko hitreje izvedli cepljenje proti gripi. Večji del cepljenja namreč opravijo v zdravstvenih domovih.
Zdravstveni domovi morajo, glede na priporočila ministrstva za zdravje, zagotoviti cepljenje svojih bolnikov. Ministrstvu se zdi smiselna organizacija posebnih cepilnih ambulant tudi zunaj ordinacijskega časa, da lahko cepljenje poteka hitreje.
NIJZ pri proizvajalcih tudi preverja možnost naročila dodatnih odmerkov, a kot pojasnjujejo, se cepivo proti sezonski gripi naroča pol leta pred začetkom cepljenja. Takrat je Slovenija naročila 270.000 odmerkov cepiva, kar je skoraj 100.000 odmerkov več kot leto prej. Zanimanje za dodatne odmerke cepiv proti gripi je letos večje tudi v drugih državah.
Za osebe z zmanjšano pokretnostjo, ki zaradi zdravstvenega stanja ali drugih ovir ne morejo priti v ambulanto izbranega osebnega zdravnika ali cepilno ambulanto, pa je na voljo cepljenje proti gripi na domu. Cepljenje izvede medicinska sestra v patronažnem varstvu po nalogu izbranega osebnega zdravnika pacienta.
Osebe, ki so upravičene do cepljenja proti gripi na domu, in njihovi svojci, se lahko za dodatne informacije povežejo z ambulanto svojega izbranega osebnega zdravnika ali patronažno službo zdravstvenega doma, na območju katerega imajo stalno ali začasno bivališče.
Po preliminarnih podatkih se je v prejšnji sezoni v Sloveniji proti gripi cepilo 142.842 ljudi, od tega 51.030 kroničnih bolnikov, 716 nosečnic in 7595 zdravstvenih delavcev.
“,”Jaka Verbic Miklic”,1603518240,1603518240,sl,14575,306,14574,43,0,NULL,,”Na cepljenje proti gripi tudi k osebnim zdravnikom ali v najbližji zdravstveni dom”,na-cepljenje-proti-gripi-tudi-k-osebnim-zdravnikom-ali-v-najblizji-zdravstveni-dom,Post,,1,0,1606891558,1606891559
709,14577,”Na okrogli mizi tudi o odgovornosti bolnikov za njihovo zdravje”,”V Sloveniji bolnik, ko zboli, dobi vse možnosti zdravljenja.”,”
Ljubljana, 22. oktobra – V Sloveniji bolnik, ko zboli, dobi vse možnosti zdravljenja. Tak sistem dolgoročno ne bo vzdržen, zato se je treba pogovarjati o optimizacijah, je na današnji okrogli mizi o inovacijah v zdravstvu opozorila Maja Južnič Sotlar iz društva Europacolon. Del odgovornosti morajo po njenih besedah prevzeti tudi bolniki sami.
Udeleženci današnje okrogle mize o inovacijah v zdravstvu, ki je potekala na konferenci HealthDay.si, so se strinjali, da je način plačevanja zdravstvenih storitev v Sloveniji zelo za časom, ne odraža kakovosti opravljene storitve, da pa je tudi zelo težko določiti, katera naj bodo merila kakovosti opravljene zdravstvene storitve, saj sploh ko gre za bolnike s hudimi boleznimi ali umirajoče, je ocenjevanje kakovosti storitve še težje.
Direktor Bolnišnice Topolšica Jurij Šorli je kot slabo izpostavil to, da Zavoda za zdravstveno zavarovanje Slovenije (ZZZS) plača izvedbo storitve, ne pa njenega rezultata. Da je kakovost neke storitve težko primerjati tudi med izvajalci, je ponazoril na primeru bolnikov s pljučnico: če neka ustanova zdravi predvsem starejše bolnike, bo imela bistveno slabše rezultate zdravljenj kot ustanova, ki zdravi mlajše.
A po njegovem prepričanju je treba v Sloveniji spremeniti celoten sistem plačevanja. V cenah ZZZS je po njegovih opozorilih malo manevrskega prostora za izboljšave, saj plačilo ZZZS komaj pokrije stroške kadra.
Predstavnica ZZZS Anka Bolka je priznala, da javni zdravstveni sistem nima enotnih meril niti za posamezno specialistično dejavnost, da bi lahko na to vezali model plačevanja. “Če hočeš plačevati po izidih zdravljenja, moraš znati oceniti, kaj je pozitiven izid zdravljenja. Vse to je treba zelo modro ovrednotiti, da bi lahko vgradili v modele plačevanja. Prevesti izide zdravljena v evre je zahtevna stvar. Ne smemo ničesar podreti ali narediti stvari še slabše,” je opozorila.
Šorli je izpostavil tudi vprašanje odgovornosti bolnika. Če ta ne upošteva priporočil zdravnika o zdravi prehrani, kajenju, gibanju, njegove bolezni ni mogoče urediti. Južnič Sotlarjeva je k temu dodala še pomen preventive še pred nastankom bolezni in sodelovanja v preventivnih programih. Kot je dejala, “naj še tako kritiziramo slovenski zdravstveni sistem, pri nas bolnik, ko zboli, lahko dobi vse, kar je na svetu znanega in registriranega. Tak sistem dolgo ne bo vzdržen”.
Po besedah Bolke pa je treba zavarovanca “zavezati, da če nekaj dobi, mora tudi kaj prispevati”. Odgovornost bolnika bi po njenem prepričanju lahko dosegli z nekimi bonusi, kar pa je po njenem mnenju resen izziv.
Predsednica Zdravniške zbornice Slovenije Zdenka Čebašek-Travnik pa je opozorila, da so v preteklosti že bili poskusi uvajanja merjenja kakovosti opravljenih storitev v zdravstvu, a so se vsi klavrno končali, ali zaradi pomanjkanja sredstev, ker kriteriji niso bili pravilno zbrani, ali pa zato, ker njihovo uvajanje ni bilo v interesu ne izvajalcem ne regulatorjem. “Čaka nas veliko dela na informatiki in na iskanju pravih kazalcev, kako bomo merili. V Sloveniji capljamo daleč zadaj. Lahko bi naredili več,” je ocenila.
“,”Jaka Verbic Miklic”,1603345740,1603345740,sl,14577,306,14576,43,0,NULL,,”Na okrogli mizi tudi o odgovornosti bolnikov za njihovo zdravje”,na-okrogli-mizi-tudi-o-odgovornosti-bolnikov-za-njihovo-zdravje,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1606891814,1606891815
711,14583,”Facebook bo prepovedal oglase in objave, ki odvračajo od cepljenja”,”Družbeno omrežje Facebook je na svoji spletni platformi zagnalo novo osveščevalno kampanjo”,”
Ljubljana, 29. oktobra – Družbeno omrežje Facebook je na svoji spletni platformi zagnalo novo osveščevalno kampanjo promocije cepljenja proti gripi. Uporabniki bodo tako lahko videli objave, ki bodo podajale splošne informacije o cepivu in lokacije najbližjih ustanov, kjer se je mogoče cepiti. Prepovedali pa bodo oglase in objave, ki odvračajo od cepljenja.
Pandemija covida-19 je pokazala pomembnost preventivnih zdravstvenih ukrepov, med katere sodi tudi sezonsko cepljenje proti gripi in zato so pri Facebooku zagnali to kampanjo, so v imenu podjetja zapisali v družbi za komuniciranje. Facebook bo v sklopu kampanje med drugim zagotovil tudi deljenje opomnikov za cepljenje proti gripi in vire zdravstvenih ustanov na zidu in v “središču z informacijami covid-19”. V mnogih delih sveta bo Facebook sodeloval tudi pri kampanjah WHO in UNICEF za zviševanje stopnje imunosti. Facebook bo obenem predstavil novo globalno politiko, ki prepoveduje oglase in objave, ki ljudi odvračajo od cepljenja. Gre za nadaljevanje kampanje, ki že zdaj prepoveduje oglase s prevarami in dezinformacijami o cepljenju, ki so bile kot take javno identificirane s strani vodilnih globalnih zdravstvenih organizacij. Oglas, ki bo eksplicitno odvračal ljudi od cepljenja, bo s strani Facebooka odstranjen, so zapisali. Kampanja bo aktivna od sobote, 31. oktobra.
“,”Jaka Verbic Miklic”,1603969800,1603969800,sl,14583,306,14582,43,0,NULL,,”Facebook bo prepovedal oglase in objave, ki odvračajo od cepljenja”,facebook-bo-prepovedal-oglase-in-objave-ki-odvracajo-od-cepljenja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1607685109,1607685110
712,14585,”Rak prostate ogroža številna življenja tudi v teh časih”,”V Sloveniji letno odkrijejo okoli 1600 novih primerov raka prostate, ki je najpogostejši rak moških.”,”
Maribor, 30. oktobra – V Sloveniji letno odkrijejo okoli 1600 novih primerov raka prostate, ki je najpogostejši rak moških. Tudi pri tej bolezni je ključno pravočasno odkritje in zdravljenje, zato je nujno, da v časih soočanja z novim koronavirusom ne ostane na stranskem tiru, opozarjajo Društvo uroloških bolnikov Slovenije, gibanje Movember in UKC Maribor.
“Zaradi raka prostate umre v Sloveniji več kot 400 moških letno. To umiranje je zelo boleče, ker se običajno rak razširi na kosti,” je na današnji novinarski konferenci v Mariboru opozoril predsednik Društva uroloških bolnikov Slovenije Franc Hočevar.
November je že vrsto let proglašen kot mesec Movember in namenjen osveščanju o zdravju moških, predvsem opozarjanju o raku mod in prostate. Letos bodo tradicionalni dogodki tega mednarodnega gibanja odpadli oziroma bodo pretvorjeni v dejavnosti na spletu, pobudniki pa vztrajajo, da ta problematika kljub vsemu terja ustrezno pozornost.
V Društvu uroloških bolnikov Slovenije namreč opažajo, da se dostopnost do diagnostike in posegov na področju urologije zaradi ukrepov, uvedenih zaradi novega koronavirusa, poslabšuje. “Nihče ne zanika, da je covid-19 resna grožnja. A treba je poskrbeti tudi za ostale paciente, ki prav tako zbolevajo in je lahko ogroženo njihovo življenje, če se jih ne zdravi pravočasno,” je izpostavil Hočevar.
Zdravstvenih storitev se po njegovih besedah ne sme krčiti na vseh področjih, ampak je treba to delati selektivno glede na nujnost zdravljenja. “Vsaka stroka naj opredeli storitve, ki morajo biti tudi v obstoječih pogojih nujno izvedene, in ta seznam nato natančno predstavi javnosti,” je dejal.
Trenutno se po besedah predstojnika oddelka za urologijo Univerzitetnega kliničnega centra (UKC) Maribor Nika Kavčiča zdravi zaradi raka prostate okoli 14.000 Slovencev. Vse moške je pozval, naj če imajo težave, kot so bula na modih, nepojasnjene bolečine v trebuhu ali kri v urinu, tudi v teh časih ne čakajo doma, ampak naj takoj vzpostavijo stik z osebnim zdravnikom, ki bo presodil, če potrebujejo nadaljnjo urološko obravnavo.
Urološka ambulanta UKC Maribor zaenkrat deluje po sistemu, da so tisti, ki so napoteni vanjo s stopnjo nujno ali zelo hitro, obravnavani na določen datum obravnave. Ostale pa pred določenim terminom pokliče zdravnik po telefonu in doreče nadaljnje postopanje. “Trudimo se, da bi bilo čim manj zamujenega. Prosimo pa gospode, da so pozorni na svoje težave in pravočasno ukrepajo,” je pozval Kavčič.
Kirurška dejavnost teče s polovično močjo, saj je bilo nekaj kadra prerazporejenega na druga delovišča v okviru kliničnega centra. “Trenutno čaka 27 bolnikov z rakom prostate na operacijo v naši ustanovi, zato upamo, da se v prihodnjih dneh ne bo kirurški program še dodatno zmanjševal,” je dodal.
Točnih podatkov nima, a tudi Kavčič ocenjuje, da je letos manj napotitev bolnikov v urološko ambulanto, zaradi česar se odkrije manj bolezni. “A to ne pomeni, da je obolenj manj, ampak da gospodje čakajo doma s težavami,” je dejal.
Društvo uroloških bolnikov Slovenije je ob tej priložnosti podarilo oddelku za urologijo UKC Maribor fleksibilni citoskop, ki se uporablja predvsem pri diagnostiki raka sečnega mehurja. Po besedah Kavčiča letno opravijo več kot tisoč tovrstnih raziskav, zato bo ta pripomoček na njihovem oddelku zelo dobrodošel.
“,”Jaka Verbic Miklic”,1604056440,1604056440,sl,14585,306,14584,43,0,NULL,,”Rak prostate ogroža številna življenja tudi v teh časih”,rak-prostate-ogroza-stevilna-zivljenja-tudi-v-teh-casih,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1607685380,1607685380
713,14587,”Vitamina D jeseni in pozimi primanjkuje kar približno 80 odstotkom prebivalcev Slovenije”,”Kar približno 80 odstotkov odraslih prebivalcev Slovenje v jesensko-zimskem obdobju ni dovolj preskrbljenih z vitaminom D”,”
Ljubljana, 2. novembra – Kar približno 80 odstotkov odraslih prebivalcev Slovenje v jesensko-zimskem obdobju ni dovolj preskrbljenih z vitaminom D, čeprav ima ta zelo pomembno vlogo pri delovanju imunskega sistema. Tega se je treba zavedati še zlasti v času epidemije covida-19, so ob svetovnem dnevu vitamina D, 2. novembru, poudarili na Inštitutu za nutricionistiko.
Vitamin D je ključen za normalno delovanje človeškega telesa. V človeški koži nastaja, kadar je ta dovolj časa izpostavljena sončni svetlobi. Potrebe poleti pokrijemo že s krajšo zmerno izpostavljenostjo soncu, v jesensko-zimskem obdobju pa zaradi slabše moči sončnih žarkov vitamin D v koži skoraj ne nastaja, zato ga je treba vnesti s hrano. To so različna živila živalskega izvora, denimo ribe in jajca. Rastlinska živila pa ga vsebujejo predvsem, če so obogatena, je navedel Igor Pravst z inštituta.
Na to področje se je v Sloveniji pred nedavnim osredotočila nacionalna raziskava Nutrihealth, raziskave pa se nadaljujejo v okviru raziskovalnega projekta Izzivi doseganja ustrezne preskrbljenosti z vitaminom D, ki ga vodijo na inštitutu.
Po predhodnih rezultatih teh raziskav Slovenci v povprečju dnevno zaužijemo približno tri do štiri mikrograme vitamina D, medtem ko ga zdravi odrasli potrebujejo vsaj 20 mikrogramov. Zaradi te razlike ga imajo številni premalo jeseni in pozimi, ko telo ne more tvoriti vitamina D samo.
Glede na predhodne rezultate je preskrbljenost z vitaminom D v letošnjem letu morda tudi zaradi spremenjenega življenjskega sloga po izbruhu novega koronavirusa še slabša kot lani. Pri posameznikih, ki so bili poleti morda tudi zaradi protikoronskih ukrepov manj na soncu in so pridobili še manj zaloge vitamina D kot lani, bo jeseni do pomanjkanja lahko prišlo hitreje oz. v večjem obsegu kot prejšnja leta, pa je izpostavila Katja Žmitek z inštituta.
Zaradi pomanjkanja tega vitamina je naša naravna odpornost proti akutnim okužbam dihal slabša. Po besedah endokrinologinje Marije Pfeifer pa se je treba v času epidemije zavedati, da lahko vitamin D v zadostnih količinah umiri pretirano vnetno dogajanje v pljučih, ublaži potek bolezni covid-19 in morda prepreči smrt.
Zaradi vse več podatkov o ugodnih učinkih vitamina D so po njenih besedah sestavili priporočila za nadomeščanje vitamina D v času epidemije. V njih svetujejo nadomeščanje vitamina D3 v preventivne namene z odmerki od 20 do 50 mikrogramov na dan, pri čezmerno prehranjenih in tistih z debelostjo pa približno dvakrat večje odmerke.
Ob ugotovljeni okužbi s koronavirusom svetujejo večje odmerke, da se hitreje zapolnijo zaloge vitamina D in da dosežemo optimalne ravni za podporo imunskemu sistemu, nato pa vzdrževalne odmerke 50 mikrogramov na dan, je navedla Pfeiferjeva, ki je tudi predsednica Združenja endokrinologov Slovenije pri Slovenskem zdravniškem društvu. Priporočila bodo od danes naprej dostopna na spletni strani Združenja endokrinologov Slovenije.
V Sloveniji so na nacionalni ravni konec lanskega leta vzpostavili strokovno skupino za pripravo nacionalnih smernic za preskrbo z vitaminom D, ki jo vodi. Načrtujejo, da bodo celostne nacionalne smernice lahko predstavili prihodnje leto.
“,”Jaka Verbic Miklic”,1604317140,1604317140,sl,14587,306,14586,43,0,NULL,,”Vitamina D jeseni in pozimi primanjkuje kar približno 80 odstotkom prebivalcev Slovenije”,vitamina-d-jeseni-in-pozimi-primanjkuje-kar-priblizno-80-odstotkom-prebivalcev-slovenije,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1607686841,1607686890
714,14589,”Društvo OnkoMan v letošnjem novembru z opozorili o vplivu epidemije na onkološke bolnike”,”OnkoMan v letošnjem tradicionalno moškem mesecu novembru izpostavlja problematiko pljučnega raka in stisko obolelih”,”
Ljubljana, 4. novembra – Slovensko onkološko društvo za moške OnkoMan v letošnjem tradicionalno moškem mesecu novembru izpostavlja problematiko pljučnega raka in stisko obolelih, ki je v luči trenutnih epidemioloških razmer še večja. Pri zdravljenju sta namreč ključna zgodnje odkrivanje bolezni in pravočasen obisk zdravnika, ki pa je v danem položaju otežen, opozarjajo.
V Društvu OnkoMan letos opozarjajo na tihega ubijalca, saj pljučni rak sodi med tiste z najslabšo prognozo in zajema skoraj 10-odstotni delež vseh rakov, po obolevnosti in umrljivosti pa prednjačijo moški, ki pogosto do zadnjega trenutka čakajo na obisk zdravnika, so besede predsednika društva Gregorja Pirca povzeli v sporočilu za javnost. Pirc je opozoril tudi na dejstvo, da je do zdaj precej manj odkritih rakov kot prejšnja leta. “To ne pomeni, da jih ni, le diagnosticirani niso, ker ljudje ne pridejo do svojega zdravnika,” je opozoril. Mirjana Rajer z Onkološkega inštituta Ljubljana je zato vse pozvala k obisku zdravnika ob prvih simptomih pljučnega raka, pri čemer je potrebna vztrajnost, saj je prvi obisk izjemno pomemben ne glede na trenutne razmere. Po njenih besedah zdravljenje onkoloških bolnikov zaenkrat poteka nemoteno, saj se vsi izjemno trudijo, da ga ne bi bilo treba prilagajati ali prekinjati, kar bi lahko pripeljalo do slabših rezultatov. Zaostankov pri pljučnem raku, ko pravi, zaenkrat še ni, za oceno, kako bo z odkrivanjem bolnikov v bolj napredovalih stadijih, pa je trenutno še prezgodaj. Leta 2017 je za pljučnim rakom zbolelo 1422 ljudi, in sicer 927 moških in 495 žensk, umrlo pa je 1187 ljudi, od tega 798 moških in 389 žensk. “Čas je ključnega pomena, saj se znaki bolezni velikokrat pojavijo šele takrat, ko je razširjena že na druge dele telesa,” je opomnil Pirc.
“,”Jaka Verbic Miklic”,1604516220,1604516220,sl,14589,306,14588,43,0,NULL,,”Društvo OnkoMan v letošnjem novembru z opozorili o vplivu epidemije na onkološke bolnike”,drustvo-onkoman-v-letosnjem-novembru-z-opozorili-o-vplivu-epidemije-na-onkoloske-bolnike,Post,,1,0,1607713108,1609237134
715,14591,”Unicef in WHO pozivata k nujnim ukrepom za preprečitev epidemije ošpic in otroške paralize”,”Sklad ZN za otroke in Svetovna zdravstvena organizacija sta danes objavila nujen poziv k ukrepanju”,”
Ljubljana/Ženeva, 6. novembra – Sklad ZN za otroke in Svetovna zdravstvena organizacija sta danes objavila nujen poziv k ukrepanju za preprečitev epidemije ošpic in otroške paralize. Opozarjata, da pandemija covida-19 ovira rutinsko cepljenje po vsem svetu, to pa povečuje tveganje, da milijoni ranljivih otrok zbolijo za nevarnimi otroškimi boleznimi, ki jih je mogoče preprečiti.
Sklad ZN za otroke (Unicef) in Svetovna zdravstvena organizacija (WHO) ocenjujeta, da je za odpravo nevarnih vrzeli v cepljenju v državah s srednjimi dohodki potrebnih 655 milijonov ameriških dolarjev, od tega 400 milijonov za otroško paralizo in 255 milijonov za ošpice, so sporočili iz Slovenska fundacija za Unicef.
Generalni direktor WHO Tedros Adhanom Ghebreyesus je opozoril, da ima pandemija novega koronavirusa uničujoč vpliv na zdravstvene storitve, še posebej na kampanje cepljenja po vsem svetu. “Z razliko od covida-19 imamo za preprečevanje bolezni, kot sta otroška paraliza in ošpice, na voljo cepiva in znanje. Potrebujemo finančna sredstva in zaveze za njihovo udejanjanje, da bi rešili otroška življenja,” je poudaril.
Izvršna direktorica Unicefa Henrietta Fore je izpostavila, da ne smemo dovoliti, da boj proti eni smrtonosni bolezni povzroči nazadovanje v boju proti drugim nevarnim boleznim.
“Obvladovanje globalne pandemije covida-19 je ključnega pomena, vendar tudi druge smrtonosne bolezni ogrožajo življenja milijonov otrok v najrevnejših predelih sveta. Zato danes voditelje držav, darovalce in partnerje pozivamo k nujnemu globalnemu ukrepanju. Potrebujemo dodatna finančna sredstva za nadaljevanje kampanj množičnega cepljenja, ki so nujne za zaščito otrok in preprečevanje drugih epidemij poleg covida-19,” je poudarila.
V zadnjih letih so se v vseh delih sveta znova pojavljali izbruhi ošpic. Vrzeli v precepljenosti so se letos zaradi pandemije covida-19 še poglobile. Lani so bile ošpice na prvem mestu glede novih okužb v več kot dveh desetletjih. Letni podatki o umrljivosti zaradi ošpic za leto 2019, ki bodo objavljeni prihodnji teden, pa bodo potrdili negativne posledice trajnih izbruhov v številnih državah sveta, so dodali.
Hkrati naj bi se prenos poliovirusa povečal v Pakistanu in Afganistanu ter na številnih območjih Afrike. Če zdaj ne bomo izkoreninili otroške paralize, se bo bolezen znova pojavljala po vsem svetu, kar bi v prihodnjih desetih letih povzročilo kar 200.000 novih primerov okužbe letno, še opozarjata Unicef in WHO.
Iz Slovenske fundacije za Unicef so ob tem še spomnili, da s projektom Unicefove punčke iz cunj zbirajo sredstva za cepljenje otrok v državah v razvoju proti šestim nalezljivim otroškim boleznim – ošpicam, otroški paralizi, davici, tetanusu, oslovskemu kašlju in tuberkulozi. “Vsaka punčka iz cunj predstavlja otroka iz države v razvoju, ki potrebuje našo pomoč. Posameznik si lahko v spletni trgovini na www.punckeizcunj.si izbere punčko, z donacijo 20 evrov pa reši eno otroško življenje,” so poudarili.
“,”Jaka Verbic Miklic”,1604689500,1604689500,sl,14591,306,14590,43,0,NULL,,”Unicef in WHO pozivata k nujnim ukrepom za preprečitev epidemije ošpic in otroške paralize”,unicef-in-who-pozivata-k-nujnim-ukrepom-za-preprecitev-epidemije-ospic-in-otroske-paralize,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1607713535,1607713535
716,14593,”Združenju Europi Donna Slovenija ob rožnatem oktobru več donacij podjetij”,”Ob mednarodnem mesecu osveščanja o raku dojk, rožnatem oktobru”,”
Ljubljana, 10. novembra – Ob mednarodnem mesecu osveščanja o raku dojk, rožnatem oktobru, so pri podjetjih Lidl Slovenija, Žito, Hofer in Telekom Slovenija s prodajo določenih izdelkov zbrali skupaj 23.152 evrov, ki so jih predali Združenju Europa Donna Slovenija, so sporočili iz podjetij.
V Lidlu Slovenija in Žitu so s prodajo dobrodelnega Kruha roza oktober, ki je bil v okviru pekovske premiere meseca tekom rožnatega oktobra naprodaj v vseh njihovih trgovinah, zbrali 5000 evrov za združenje.
Donacija je namenjena njihovemu programu Roza, ki ponuja psihosocialno podporo bolnicam, njihovim otrokom ter drugim svojcem obolelih za rakom dojk in rodil. Podjetji sta namreč od vsakega prodanega hlebčka kruha skupaj donirali 0,5 evra za program. Predajo donacije so zaradi trenutnih razmer izvedli prek spleta.
Tudi v podjetju Hofer so ob rožnatem oktobru znova opominjali na pomembnost preventive. Tudi tokrat so s prodajo t. i. dobrodelnih šampinjonov v roza embalaži s pomočjo kupcev za združenje zbrali 8152 evrov. V petih letih so boju proti raku dojk namenili že več kot 35.000 evrov, so navedli v podjetju.
Iz Združenja Europa Donna pa so sporočili, da se zahvaljujejo kupcem mobitelov Pink Ribbon, saj so z nakupom prispevali k nadaljnjemu boju proti raku dojk. Telekom Slovenije je namreč skupaj s Samsungom tudi letos podprl rožnati oktober s prodajo dveh rožnatih mobitelov. Ob zaključku oktobrske akcije Modri Fon so združenju od prodanih mobitelov predali donacijo v višini 10.000 evrov.
“,”Jaka Verbic Miklic”,1605035460,1605035460,sl,14593,306,14592,43,0,NULL,,”Združenju Europi Donna Slovenija ob rožnatem oktobru več donacij podjetij”,zdruzenju-europi-donna-slovenija-ob-roznatem-oktobru-vec-donacij-podjetij,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1607713982,1607713982
717,14597,”Za kakovost življenja bolnikov s krvnim rakom pomembne prehrana, aktivnost in psihična podpora”,”Predvsem pa je pomembno, da zdravnik bolnika obravnava celostno in ustvari zaupanje med njim in bolnikom, so poudarili v spletnem pogovoru STAkluba.”,”
Ljubljana, 8. decembra – Za ohranjanje kakovosti življenja in pozitivne naravnanosti med in po zdravljenju krvnega raka so po mnenju zdravstvene stroke zelo pomembne primerna prehrana, telesna aktivnost in psihična podpora. Predvsem pa je pomembno, da zdravnik bolnika obravnava celostno in ustvari zaupanje med njim in bolnikom, so poudarili v spletnem pogovoru STAkluba.
Predstojnik Kliničnega oddelka za hematologijo Univerzitetnega kliničnega centra (UKC) Ljubljana Samo Zver je na današnjem pogovoru, ki ga je STAklub pripravil v sodelovanju Slovenskim združenjem bolnikov z limfomom in levkemijo (L&L), izpostavil, da pri zdravljenju bolnikov, posebej v času covida-19, izjemno pomemben tesen stik oz. zaupanje med zdravniki in zdravstvenim osebjem ter med bolnikom in zdravnikom. “Bolnik je za nas še večji od carja, ima vedno prav,” je dejal.
Svojim bolnikom se Zver ves čas oglaša z aktualnimi sporočili, da so uspeli zavarovati oddelek pred covidom-19. “Če posekaš en stik, fizični, moraš ponuditi nekaj drugega, ali je to telefon, internet, pomembno je, da ima človek, ki je bolan in v stiski, občutek varnosti,” je pojasnil. Opozoril je, da so edina klinika, ki še ni imela prenosa koronavirusa na bolnika s strani osebja. “Na to smo ponosni in delamo naprej, je dodal.
Da je zaupanje med bolnikom in zdravnikom še kako pomembno, je menila tudi članica Tima za zdravljenje limfomov na Onkološkem inštitutu Ljubljana Jana Pahole. Zelo pomembno se ji zdi, da nikoli ne gledajo na človeka, kot da hodi k zdravniku na neke vrste servis, ampak ga gledajo celostno kot živo bitje, ki se sooča tudi s strahovi. “A ko imaš v ambulanti čez 30 bolnikov in imaš za vsakega imaš na voljo osemminutni slot, se na koncu počutiš, kot da delaš kot po tekočem traku, kajti časa za pogovor o njegovem počutju ni,” je dejala.
Ob tem je opozorila, da je pri njih precej napeto, ker je oddelek za limfome zaprt. Tako so bolniki razseljeni po celem Onkološkem inštitutu, delo je izjemno naporno s fizičnega stališča. Zelo zaskrbljujoče je, da je letos več kot 80 odstotkov bolnikov s Hodgkinovimi limfomi prišlo v 4. stadiju, kar pomeni, da se je bolezen popolnoma razširila. Običajno večina teh bolnikov k zdravniku pride v 2. stadiju. Zdravljenje načeloma poteka nemoteno, tudi kontrolni pregledi se izvajajo, s predhodno najavo preko telefona in to ostaja še naprej, je še navedla.
Vodja programa celostne rehabilitacije Skupaj na poti do zdravja Irena Preložnik Zupan je spregovorila o različnih oblikah zdravljenja akutne in kronične levkemije ter izpostavila, da je za krvni rak eno najbolj uspešnih zdravljenj oz. je dobro ozdravljiv, zlasti po letu 2000 z uvedbo tarčnih zdravil.
V procesu zdravljenja in rehabilitacije bolnikov s krvnim rakom je po besedah vodje Enote za klinično prehrano na Onkološkem inštitutu Ljubljana Nada Rotovnik Kozjek ustrezna prehrana in telesna aktivnost. Poleg tega pa je nepogrešljiva psihološka podpora, je izpostavila specialistka klinične psihologije Vesna Radonjič Miholič. To je pomembno še zlasti v sedanjem času, ko se bolniki soočajo z negotovostjo, nezaupanjem, strahom in omejevalnimi ukrepi, je dejala in spomnila razne oblike psihološke pomoči, med drugim jo brezplačno zagotavlja tudi Nacionalni inštitut za javno zdravje.
Izvršna direktorica združenja L&L Kristina Modic je med drugim povedala, da želijo biti bolnikom v tem času čim bolj v oporo. Zato nadaljujejo rehabilitacijske programe, ki jih izvajajo preko spleta. Pod naslovom Rehabilitacija on line je na voljo veliko podpornih vsebin, ki pomagajo prebroditi to negotovo obdobje, je dodala.
“,”Jaka Verbic Miklic”,1607422500,1607422500,sl,14597,306,14596,43,0,NULL,,”Za kakovost življenja bolnikov s krvnim rakom pomembne prehrana, aktivnost in psihična podpora”,za-kakovost-zivljenja-bolnikov-s-krvnim-rakom-pomembne-prehrana-aktivnost-in-psihicna-podpora,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1609236965,1609237022
718,14599,”Kajenju lahko pripišemo osem primerov pljučnega raka od desetih”,”Včasih je veljal za neozdravljivega, a danes odkritje v zgodnjih stadijih močno poveča verjetnost za preživetje.”,”
Ljubljana, 10. novembra – Pljučni rak je najpogostejši rak v svetovnem merilu in eden od petih najpogostejših rakov v Sloveniji. Včasih je veljal za neozdravljivega, a danes odkritje v zgodnjih stadijih močno poveča verjetnost za preživetje. Najpomembnejši dejavnik za nastanek pljučnega raka je kajenje, so opozorili sodelujoči v današnjem spletnem pogovoru STAkluba.
Rak pljuč je eden od rakov z najslabšo prognozo, saj je petletno preživetje bolnikov le 20-odsotno. Glede umrljivosti je pljučni rak na prvem mestu med vsemi raki, pripišemo mu lahko petino vseh smrti zaradi rakov, je povedala specialistka radioterapije in onkologije na Onkološkem inštitutu Ljubljana Martina Vrankar.
Pljučni rak je velik javnozdravstveni problem tudi v Sloveniji, kjer je po pojavnosti rakov na tretjem mestu tako med moškimi kot med ženskami. A medtem ko se je pojavnost tega raka med moškimi že ustalila, pri ženskah še narašča. Leta 2017 je več žensk umrlo za pljučnim rakom kot za rakom dojk.
V zgodnji fazi ima bolezen le malo simptomov. Ko se ti pojavijo, je bolezen običajno napredovala. Diagnozo pljučnega raka po besedah Vrankarjeve povečini postavijo pri bolnikih v napredovani fazi, ko ni več možnosti ozdravitve. Ob tem je poudarila, da so se v zadnjih letih možnosti zdravljenja precej povečale in lahko tudi take bolnike zdravijo tudi po nekaj let. “Tistih, ki imajo možnost ozdravitve, ki jih lahko operiramo, je le okoli 20 odstotkov. Zato je pomembno, da smo pozorni na simptome in hitro poiščemo zdravniško pomoč,” je pozvala.
A glede na rezultate raziskave iz leta 2017 40 odstotkov Slovencev ne zna našteti nobenega od simptomov pljučnega raka. Zato Društvo pljučnih in alergijskih bolnikov Slovenije v novembru, mesecu ozaveščanja o pljučnem raku, predstavlja projekt Izkašljaj se, s katerim javnost seznanjajo raku pljuč in njegovih simptomih, je povedal pojasnil predsednik društva Mirko Triller.
Kot je pojasnila Vrankarjeva, je glavni simptom, ki ga povezujemo s pljučnim rakom, kašelj. A ta je zelo nespecifičen bolezenski znak, prisoten je tudi pri drugih obolenjih, lahko je tudi neželen učinek nekaterih zdravil, pri kadilcih je celo kronično prisoten. Pozoren je treba postati, če se kadilski kašelj morda spremeni. Med znaki raka pljuč so še težko dihanje, hripavost, hujšanje, bolečina v prsnem košu. “Če simptomi trajajo več kot tri tedne ali se celo stopnjujejo, je absolutno potreben obisk zdravnika, da se ugotovi vzrok težav,” je poudarila.
Da se raku pljuč lahko izognemo, lahko veliko naredimo sami, je bila jasna specialistka internistične onkologije Mojca Unk z onkološkega inštituta. Večina, 80 odstotkov bolnikov s pljučnim rakom, je namreč kadilcev oz. bivših kadilcev. Pri kadilcih je tveganje za nastanek raka pljuč 25-krat večje kot pri nekadilcih. Poleg tega kajenje škoduje ljudem v okolici, saj je tveganje za raka pri pasivnih kadilcih kar 20-krat kot pri nekadilcih. “Nehajte kaditi, dokler je še čas,” je ob tem pozval Triller.
Na nastanek pljučnega raka vpliva tudi prisotnost radona v okolju in neugodne mikroklimatske razmere, na primer na delovnem mestu. Po njenih besedah je tudi pomembno, da kot družba vladamo v zdravo, čisto okolje, ki je dobra popotnica tudi za naslednje generacije.
“,”Jaka Verbic Miklic”,1605003720,1605003720,sl,14599,306,14598,43,0,NULL,,”Kajenju lahko pripišemo osem primerov pljučnega raka od desetih”,kajenju-lahko-pripisemo-osem-primerov-pljucnega-raka-od-desetih,Post,,1,0,1609237411,1609237755
719,14601,”Na nacionalni konferenci opozorila o slabši dostopnosti sladkornih bolnikov do preventive in zdravljenja”,”Razpravljavci so tako opozorili, da je epidemija bolnikom otežila dostop tako do preventive kot zdravljenja.”,”
Ljubljana, 12. novembra – Letošnjo nacionalno konferenco obvladovanja sladkorne bolezni, ki je danes potekala na daljavo, so zaznamovale posledice epidemije covida-19. Razpravljavci so tako opozorili, da je epidemija bolnikom otežila dostop tako do preventive kot zdravljenja. Znova so tudi poudarili, da sladkorna bolezen predstavlja veliko breme za javno zdravstvo.
Ivan Eržen z Nacionalnega inštituta za javno zdravje (NIJZ) je pojasnil, da je bilo leta 2007 v Sloveniji prepoznanih 111.000 bolnikov s sladkorno boleznijo, v letu 2019 pa jih je bilo že 132.300. Kot posebej zgovoren podatek je navedel, da se je med leti 2008 in 2019 število prejemnikov zdravil za zniževanje krvnega sladkorja povečalo za skoraj 40 odstotkov.
Kako veliko breme predstavlja sladkorna bolezen za javno zdravstvo, kažejo tudi preliminarni rezultati nacionalne raziskave Odkrijmo sladkorno, ki so jih tokrat prvič predstavili širši javnosti. Po besedah Darje Lavtar z NIJZ je v Sloveniji 79.000 bolnikov s sladkorno boleznijo, pri katerih bolezni še ni prepoznana. Sicer bo število sladkornih bolnikov v prihodnje še naraščalo.
Eržen je opozoril, da so med slovenskimi statističnimi regijami pomembne razlike v stopnji pojavnosti sladkorne bolezni, največja pa je Posavju in Zasavju. Pri tem je izrazil zaskrbljenost zaradi “nedopustno velikih” razlike glede preskrbljenosti s timi za diabetologijo v posameznih delih države. Tako je npr. preskrbljenost s timi na koprskem območju 2,7-krat boljša kot pa na celjskem.
Vodja urada Svetovne zdravstvene organizacije (WHO) v Sloveniji Aiga Rurane je že v uvodu današnje konference z več kot 140 udeleženci poudarila, da je epidemija covida-19 povsod po svetu, še posebej pa v manj razvitih državah, kroničnim bolnikom, med katerimi so tudi sladkorni bolniki, otežila dostop tako do preventive kot zdravljenja. Negativne posledice se kažejo tudi pri odkrivanju bolezni.
Poleg tega kronični bolniki v primeru okužbe z novim koronavirusom sodijo med ogrožene skupine prebivalstva. Sicer po besedah razpravljavcev tudi v Sloveniji zaradi epidemije sladkorni bolniki težje pridejo do družinskega zdravnika ali diabetologa. Temu je pritrdila tudi anketa, ki jo je ob prvem valu izvedla Zveze društev diabetikov Slovenije. Bolniki so tako pogrešali osebni stik z zdravnikom.
Predsednik zveze Robert Gratton je dejal, da je bilo več težav z dostopnostjo do družinskih zdravnikov kot pa do diabetologov. Pogoste so kritike zaradi slabe dosegljivosti zdravnika po telefonu. Pokazale so se tudi razlike v dostopnosti med posameznimi občinami in regijami, še najbolj zadovoljni so bili bolniki na Koroškem. Na težave pri oskrbi bolnikov pa so opozorili tudi zdravstveni delavci.
Na primarni ravni so po besedah Barbare Jemec Zalar z ljubljanske katedre za družinsko medicino iskali izhod v telefonski komunikaciji med zdravnikom in bolnikom. Težava pa je bila tudi v tem, da si bolniki, čeprav bi njihovo akutno stanje to terjalo, zaradi nevarnosti okužbe pogosto niso upali iti do zdravnika. Tudi v bolnišnicah so se zatekli k obravnavi preko telefona, e-pošte in video povezave.
Na ljubljanski pediatrični kliniki so za mlade bolnike s sladkorno boleznijo takoj ob nastopu epidemije vzpostavili video tele-ambulanto. Po besedah Tadeja Battelina je bil odziv mladostnikov izjemno dober, saj se jih je kar 96 odstotkov odzvalo na povabilo. Poseben izziv za zdravstveno stroko pa je tudi spremljanje nosečnostne sladkorne bolezni v času epidemije.
Draženka Pongrac Barlovič s katedre za interno medicino na ljubljanski medicinski fakulteti je opozorila, da ima spremljanje zdravstvenega stanja nosečnic s pomočjo telemedicine tudi slabe plati, kot je povečanje bremena bolezni in več administriranja. Dobra plat telemedicine pa je po njenih besedah dostopnost in jo bo mogoče v večji meri uporabljati tudi po koncu epidemije.
V. d. generalne direktorice direktorata za javno zdravje Vesna Kerstin Petrič pa je spomnila na nastajanje nacionalnega plana za obvladovanje sladkorne bolezni za obdobje 2020-2030. Predlog plana so po njenih besedah ravno v sredo predstavili zdravstvenemu svetu, ki mu je le ob nekaj pripombah izrekel enotno podporo. Javna obravnava dokumenta se bo končala 21. novembra.
“,”Jaka Verbic Miklic”,1605176820,1605176820,sl,14601,306,14600,43,0,NULL,,”Na nacionalni konferenci opozorila o slabši dostopnosti sladkornih bolnikov do preventive in zdravljenja”,na-nacionalni-konferenci-opozorila-o-slabsi-dostopnosti-sladkornih-bolnikov-do-preventive-in-zdravljenja,Post,,1,0,1609237722,1609237722
720,14603,”Slovenija se pridružuje globalni akciji za odpravo raka materničnega vratu”,”Države bodo zavezanost akciji izrazile z osvetlitvijo vsaj ene svoje kulturne znamenitosti s turkizno barvo, ki simbolizira to bolezen.”,”
Ljubljana, 17. novembra – Slovenija se bo danes pridružila akciji Svetovne zdravstvene organizacije (WHO) za odpravo raka materničnega vratu. Države bodo zavezanost akciji izrazile z osvetlitvijo vsaj ene svoje kulturne znamenitosti s turkizno barvo, ki simbolizira to bolezen. Pri nas bosta zvečer turkizno osvetljena Blejski grad in Mesarski most v Ljubljani.
Da bi dosegli odpravo raka materničnega vratu, je WHO pozvala vse države sveta, naj v naslednjem desetletju dosežejo 90-odstotno precepljenost proti humanim papilomavirusom (HPV) in 70-odstotno pregledanost žensk v presejalnem programu, ki jo je Slovenija s programom Zora že dosegla, so zapisali na Nacionalnem inštitutu za javno zdravje (NIJZ).
Cilj akcije pod okriljem WHO je tudi, da bi bilo 90 odstotkov žensk s predrakavimi in rakavimi spremembami materničnega vratu deležnih ustreznega zdravljenja, kar je naša država prav tako že dosegla. Zaradi teh izjemnih rezultatov bi lahko po navedbah NIJZ Slovenija postala ena prvih evropskih držav, ki bi ji uspelo odpraviti rak materničnega vratu.
Nacionalni presejalni program Zora poteka od leta 2003. “V preteklosti je bilo breme raka materničnega vratu v Sloveniji med največjimi v Evropi, v zadnjih letih pa se Slovenija z incidenčno stopnjo okoli sedem na 100.000 žensk in umrljivostjo dve na 100.000 žensk uvršča med države z najmanjšim bremenom tega raka,” so poudarili na NIJZ.
Pri ženskah, ki redno hodijo na presejalne preglede, je kar od 70 do 90 odstotkov manjša verjetnost, da bodo kadarkoli zbolele za rakom materničnega vratu, so pojasnili na NIJZ. Enako velja za ženske, ki so bile cepljene proti HPV še pred prvo okužbo.
Okužba s HPV je sicer največkrat prehodna in mine brez večjih posledic, v nekaterih primerih pa je dolgotrajna in lahko povzroči nastanek genitalnih bradavic, predrakavih in rakavih sprememb materničnega vratu, zunanjega spolovila in zadnjika ter ustno-žrelnega prostora pri obeh spolih.
Učinkovita zaščita pred boleznimi zaradi okužbe s HPV je cepljenje tako deklic kot dečkov, najbolje pred začetkom spolne aktivnosti. Za dekleta v šestem razredu osnovne šole je cepljenje priporočeno in brezplačno v okviru nacionalnega programa cepljenja.
Dekleta, ki so cepljenje proti HPV v šestem razredu zamudila in so rojena leta 1998 ali kasneje, se lahko brezplačno cepijo pri osebnem zdravniku. Cepljenje priporočajo tudi fantom, moškim, starejšim dekletom in ženskam, a je zanje to samoplačniško. Cepljenje se priporoča predvsem ženskam, ki so že imele predrakave spremembe ali raka zaradi okužbe s HPV.
Na Onkološkem inštitutu Ljubljana bo danes virtualno potekal tudi tradicionalni, že deseti izobraževalni dan presejalnega programa Zora. Od uvedbe tega programa Slovenija beleži kar 50-odstotni upad števila novih primerov bolnic z rakom materničnega vratu in se tako uvršča med evropske države z nizko pojavnostjo tega raka.
“,”Jaka Verbic Miklic”,1605609360,1605609360,sl,14603,306,14602,43,0,NULL,,”Slovenija se pridružuje globalni akciji za odpravo raka materničnega vratu”,slovenija-se-pridruzuje-globalni-akciji-za-odpravo-raka-maternicnega-vratu,Post,,1,0,1609238260,1609238261
721,14605,”Evropski dan antibiotikov priložnost za pogovor o odgovorni rabi teh zdravil”,”Pri njihovi uporabi moramo zato biti kljub izjemnemu pomenu, ki ga imajo v medicini, previdni.”,”
Ljubljana, 18. novembra – Namen evropskega dneva antibiotikov, ki ga zaznamujemo danes, je ozaveščanje, da antibiotiki ob neprimerni uporabi izgubljajo učinkovitost v boju proti bakterijam. Pri njihovi uporabi moramo zato biti kljub izjemnemu pomenu, ki ga imajo v medicini, previdni.
Odpornost proti antibiotikom je sposobnost bakterij, da se borijo proti delovanju enega ali več antibiotikov. Proti antibiotikom ne postanejo odporni ljudje in živali, temveč bakterije, ki se nahajajo v njih, pojasnjujejo na Nacionalnem inštitut za javno zdravje (NIJZ).
Breme okužb z bakterijami, odpornimi proti antibiotikom, je primerljivo tistemu, ki ga povzročajo gripa, tuberkuloza in HIV/aids skupaj. Vsako leto zaradi okužbe z bakterijami, odpornimi proti antibiotikom, umre 33.000 ljudi.
V Evropi je 75 odstotkov zdravstvenega bremena zaradi bakterij, odpornih na antibiotike, posledica okužb, povezanih z zdravstveno oskrbo. To bi bilo mogoče zmanjšati z ustreznimi ukrepi za preprečevanje in obvladovanje okužb, pa tudi z usmerjeno rabo antibiotikov v zdravstvenih ustanovah.
Pred odkritjem antibiotikov je po navedbah Evropskega centra za preprečevanje in obvladovanje bolezni (ECDC) na tisoče ljudi umrlo zaradi bakterijskih bolezni, kot sta pljučnica ali okužba po operaciji. Odkar so odkrili in uporabili antibiotike, je vse več bakterij, ki so bile prvotno dovzetne, postale odporne in razvile številna različne mehanizme za boj proti antibiotikom. Ker se odpornost povečuje in je bilo v zadnjih letih odkritih malo novih antibiotikov, je odpornost na antibiotike ena glavnih groženj javnemu zdravju.
Brez antibiotikov bi se lahko vrnili v obdobje pred odkritjem antibiotikov, ko presaditev organov, kemoterapija raka, intenzivna nega in drugi medicinski postopki ne bi bili več mogoči. Bakterijske bolezni bi se širile in jih ne bi bilo več mogoče zdraviti, opozarja ECDC.
Zdravstvena stroka zato poziva, da antibiotike uporabljamo preudarno in samo takrat, ko se res nujno potrebni. Odgovorno jemanje antibiotikov pomeni, da se pred njihovim jemanjem vedno posvetujemo z zdravnikom. Pomembno je, da antibiotikov ne jemljemo v napačen namen ali nepravilno. Antibiotike jemljemo le takrat, kadar nam jih predpiše zdravnik in upoštevamo navodila zdravnika o načinu njihove uporabe, tako da bodo učinkovali tudi v prihodnje. Ostankov antibiotikov ne hranimo in če dobimo več odmerkov, kot nam jih je bilo predpisanih, se o odstranjevanju ostankov zdravil posvetujemo s farmacevtom.
Slovenija je v zadnjih letih pri ambulantnem predpisovanju zmanjšala porabo antibiotikov, pri bolnišničnem predpisovanju pa ne dovolj in še odstopa od zastavljenih ciljev, je ob tednu ob svetovnem tednu ozaveščanja o smotrni rabi antibiotikov, ki se začenja danes, izpostavil član Komisije za smiselno porabo protimikrobnih zdravil v Sloveniji Milan Čižman. Predpisovanje antibiotikov bi lahko zmanjšali predvsem pri zdravljenju zgornjih dihal in bronhitisa pri otrocih ter s postavljanjem natančnih diagnoz bolezni.
Sicer Slovenija sodi v boljšo tretjino med EU državami glede predpisovanja antibiotikov. Najmanj antibiotikov predpisujejo na Nizozemskem, največ pa v Grčiji.
Prvi in še danes najbolj uporabljen antibiotik penicilin je odkril škotski raziskovalec in zdravnik Alexander Fleming, in sicer po naključju. Za odkritje in njegovo izolacijo ter produkcijo je skupaj z dvema drugima znanstvenikoma prejel tudi Nobelovo nagrado.
“,”Jaka Verbic Miklic”,1605695940,1605695940,sl,14605,306,14604,43,0,NULL,,”Evropski dan antibiotikov priložnost za pogovor o odgovorni rabi teh zdravil”,evropski-dan-antibiotikov-priloznost-za-pogovor-o-odgovorni-rabi-teh-zdravil,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1609238446,1609238447
722,14607,”NIJZ prejel in razdelil dodatnih 20.000 odmerkov cepiva proti gripi”,”Ocenili so, da bo to cepivo večinoma namenjeno rizičnim skupinam.”,”
Ljubljana, 21. novembra – Nacionalni inštitut za javno zdravje (NIJZ) je že prejel in razdelil dodatnih 20.000 odmerkov cepiva proti gripi, so na inštitutu pojasnili za STA. Ocenili so, da bo to cepivo večinoma namenjeno rizičnim skupinam. A naročila za to skupino so lahko izpolnili le delno, saj so bile razpoložljive količine bistveno manjše od povpraševanja.
Ministrstvo za zdravje je v začetku novembra pozvalo izvajalce cepljenja na primarni ravni, da cepivo, ki ga bodo prejeli naknadno, porabijo za cepljenje najranljivejših skupin, so spomnili.
Ocenili so, da bodo izvajalci cepivo porabili za rizične bolnike, ki so že bili naročeni na cepljenje.
Njihove ambulante imajo sicer zasedene termine do konca novembra, ponekod tudi v decembru. Ker je pomembno, da se cepljenje opravi čim prej, so del cepiva, ki je bilo namenjeno za cepljenje v ambulantah NIJZ, že odstopili drugim izvajalcem, ki bodo cepljenje izvedli hitreje, so zapisali.
Podatkov o tem, kje se je še mogoče naročiti na cepljenje, na NIJZ nimajo.
Za cepljenje svojih opredeljenih pacientov v prvi vrsti skrbijo izbrani osebni zdravniki. V ambulantah NIJZ cepijo le okoli 15 odstotkov oseb, ki se odločijo za cepljenje.
Akutnih obolenj dihal je bilo sicer v minulem tednu manj kot v enakem obdobju lani, izhaja iz spletne strani NIJZ. A je treba upoštevati, da lahko spremenjen način delovanja ambulant zaradi epidemije covida-19 vpliva na poročanje o teh obolenjih.
Čeprav se je sezona gripe že začela, incidenca ostaja na medsezonski ravni. O gripi poročajo le iz Azerbajdžana, Srbije in Slovaške. Tudi v Združenih državah Amerike ne zaznavajo povečane incidence gripe.
“,”Jaka Verbic Miklic”,1605955620,1605955620,sl,14607,306,14606,43,0,NULL,,”NIJZ prejel in razdelil dodatnih 20.000 odmerkov cepiva proti gripi”,nijz-prejel-in-razdelil-dodatnih-20-000-odmerkov-cepiva-proti-gripi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1609238889,1609238897
723,14609,”Obeležujemo mednarodni dan pomanjkanja železa v krvi”,”Pomanjkanje železa v krvi je problem tretjine svetovnega prebivalstva, ki lahko zelo vpliva na kakovost življenja, zdravje in dobro počutje, pa tudi na odpornost, ki je v boju z epidemijo posebej pomembna. “,”
Ljubljana, 26. novembra – Pomanjkanje železa v krvi je problem tretjine svetovnega prebivalstva, ki lahko zelo vpliva na kakovost življenja, zdravje in dobro počutje, pa tudi na odpornost, ki je v boju z epidemijo posebej pomembna. Ozaveščanju o skrbi za zadostno količino železa v krvi je namenjen današnji mednarodni dan pomanjkanja železa v krvi.
Železo ima ključno vlogo pri tvorjenju rdečih krvnih celic, delovanju srca in skeletnih mišic, odzivu na okužbe, ohranjanju energije in normalnemu delovanju možganov. Ustrezna raven železa v krvi je posebej pomembna tudi, ko se ženska odloča za zanositev, tekom nosečnosti in po porodu.
Pomanjkanje železa se lahko med drugim kaže v slabem počutju, utrujenosti, omotici, težki sapi, krhkih nohtih, izpadanju las, razdražljivosti in glavobolih. Povezano je tudi z zmanjšano kognitivno funkcijo, zlasti koncentracijo in kratkoročnim spominom, piše na spletni strani www.anemija.si, ki je namenjena izobraževanju o anemiji oz. slabokrvnosti.
To stanje lahko prizadene vse ljudi, je pa pogostejše pri ženskah, posebej pred menopavzo, v nosečnosti in po porodu, pa tudi pri otrocih do 5. leta starosti, pogosteje se pojavi tudi pri ljudeh s povečano telesno težo. Potreba po železu se poveča tudi ob večjih fizičnih obremenitvah.
Pomanjkanje železa pred zanositvijo lahko vpliva na otrokovo rast, poveča verjetnost za prezgodnji porod in tveganje za majhno porodno težo. Med nosečnostjo je potreba po železu večja zaradi rasti posteljice, povečanja števila krvnih celic in razvoj ter pravilno rast otroka. Tudi po rojstvu je zadostna raven železa v krvi pomembna za zdrav razvoj.
Posledica slabokrvnosti je, da je v krvi manj hemoglobina – krvnega barvila v rdečih krvničkah, piše na spletni strani Društva bolnikov s krvnimi boleznimi Slovenije. Enostavno jo je mogoče diagnosticirati s testom krvi in tudi uspešno zdraviti.
K zadostni količini železa v krvi lahko pripomoremo tudi z ustrezno prehrano. V telo ga je mogoče vnesti na primer z uživanjem mesa, rib, morskih sadežev, semen, žit, oreščkov in zelene listnate zelenjave. Hkratno uživanje vitamina C oz. živil, ki so z njim bogata, poveča absorpcijo železa v telo, na drugi strani pa jo zmanjšuje uživanje kave in pravega čaja.
S pravilno izbiro prehrane lahko preprečimo pomanjkanje železa v telesu zaradi prehranskih vzrokov in zmanjšamo pomanjkanje železa ob drugih vzrokih (povečane potrebe pri otrocih in ženskah v rodni dobi). Pri hudem pomanjkanju železa v telesu – ob že razviti anemiji zaradi pomanjkanja železa – s hrano ne moremo ustrezno nadomestiti zdravljenja s pripravki železa.
V podjetju Lek so za ozaveščanje o pomenu železa ob današnjem dnevu pripravili akcijo Vzemite železo resno, v sklopu katere so pripravili zloženko in na spletni strani www.anemija.si zbrali različne informacije o železu, prepoznavanju simptomov pomanjkanja železa in ustreznem ukrepanju ob tem.
“,”Jaka Verbic Miklic”,1606387920,1606387920,sl,14609,306,14608,43,0,NULL,,”Obeležujemo mednarodni dan pomanjkanja železa v krvi”,obelezujemo-mednarodni-dan-pomanjkanja-zeleza-v-krvi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1609239213,1609239213
724,14611,”WHO: Boj proti malariji ogrožata pomanjkanje sredstev in pandemija”,”Pomanjkanje sredstev in pandemija covida-19 spodkopavata prizadevanja za zajezitev malarije, zlasti v Afriki.”,”
Ženeva, 30. novembra – Svetovna zdravstvena organizacija (WHO) je danes opozorila, da pomanjkanje sredstev in pandemija covida-19 spodkopavata prizadevanja za zajezitev malarije, zlasti v Afriki.
WHO v poročilu navaja, da je bilo leta 2019 v svetu zabeleženih 229 milijonov primerov malarije in ta številka zadnja štiri leta ostaja praktično nespremenjena.
Za to boleznijo je lani umrlo okoli 409.000 ljudi, leta 2018 pa 411.000, večina v Afriki, kjer zabeležijo več kot 90 odstotkov vseh primerov malarije na svetu.
V WHO menijo, da bi z zadostnimi sredstvi lahko premagali to bolezen, ki jo mogoče preprečiti in ozdraviti.
Afriški voditelji so leta 2000 podpisali obljubo, da bodo v desetih letih prepolovili število smrti zaradi malarije, čemur sta sledila izjemno povečanje sredstev v ta namen in uspešen boj proti tej bolezni. Od leta 2000 se je število smrtnih primerov malarije na črni celini zmanjšalo za 44 odstotkov, in sicer z okoli 680.000 primerov na 384.000 na leto.
Toda ko se je financiranje zmanjšalo, se je ustavilo tudi zmanjševanje števila primerov in smrti, opozarjajo v WHO.
Dodaten izziv predstavlja pandemija covida-19, ki je poslabšala situacijo. Deset odstotkov manjši dostop do zdravil proti malariji bi pomenil dodatnih 19.000 smrtnih primerov v podsaharski Afriki, 50 odstotkov pa dodatnih 100.000, v poročilu še dodaja WHO.
“,”Jaka Verbic Miklic”,1606733880,1606733880,sl,14611,306,14610,43,0,NULL,,”WHO: Boj proti malariji ogrožata pomanjkanje sredstev in pandemija”,who-boj-proti-malariji-ogrozata-pomanjkanje-sredstev-in-pandemija,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1609239570,1609239571
725,14613,”Rdečo pentljo ob letošnjem dnevu boja proti aidsu pripenjamo na daljavo”,”Letos jo zaradi epidemioloških razmer, ki so tudi okrnile dostop do preventivnih programov, pripenjamo na daljavo.”,”
Ljubljana, 1. decembra – Na prvi decembrski dan obeležujemo svetovni dan boja proti aidsu, ki ga simbolizira rdeča pentlja. Letos jo zaradi epidemioloških razmer, ki so tudi okrnile dostop do preventivnih programov, pripenjamo na daljavo. Navkljub zgodbi o uspehu okužba s HIV še vedno ostaja pomembna javnozdravstvena težava, opozarjajo na NIJZ.
Mednarodni dan boja proti aidsu, ki ga obeležujemo 1. decembra, je leta 1988 razglasila Svetovna zdravstvena organizacija. Na svetu živi približno 38 milijonov oseb, ki so okužene s HIV, letno pa jih zaradi HIV oz. aidsa umre okrog 690.000.
Prvi primeri tedaj še neznane bolezni so zdravniki opazili leta 1981 v Los Angelesu, kmalu pa so o podobnih ugotovitvah poročali še iz drugih delov ZDA in zahodne Evrope. Med obolelimi so izstopali predvsem moški, ki so imeli spolne odnose z moškimi, in uživalci trdih drog. Bolezen se je pojavila tudi med bolniki s hemofilijo in heteroseksualnimi osebami, pri čemer je postalo jasno, da se neznana bolezen prenaša preko telesnih tekočin. Povzročitelja skrivnostne bolezni, virus HIV, je francoskih znanstvenikom uspelo identificirati leta 1983.
V Sloveniji so letos vključno 20. novembra zabeležili 28 novih diagnoz okužbe s HIV, kar je šest manj kot v celem letu 2019 in manj kot v kateremkoli letu v obdobju zadnjih desetih let, so sporočili z Nacionalnega inštituta za javno zdravje (NIJZ). Šest okužb je bilo med ženskami in 22 med moškimi. Pri slednjih jih je bilo 12 med moškimi, ki imajo spolne odnose z moškimi, kar je najmanj v zadnjih desetih letih.
“Relativno nizko število novih diagnoz in poznih diagnoz okužbe s HIV med moškimi, ki imajo spolne odnose z moškimi, je predvidoma posledica uspehov kombinirane preventive, predvsem dostopnosti testiranja in spremenjene kulture testiranj ter takojšnjega zdravljenja po diagnozi okužbe. Zgodnje zdravljenje je uspešnejše, izboljša kakovost in pričakovano trajanje življenja ter preprečuje prenos okužbe s HIV,” ocenjuje Irena Klavs z NIJZ.
Glede na prijavljene primere novih diagnoz okužbe s HIV v začetku leta 2020 je v Sloveniji živelo 704 oseb s prepoznano okužbo s HIV. Med njimi je po podatkih Klinike za infekcijske bolezni in vročinska stanja Univerzitetnega kliničnega centra Ljubljana 649 oz. 92 odstotkov oseb prejemalo protiretrovirusna zdravila. Med temi večina, 96 odstotkov, zaradi uspešnega zdravljenja ne morejo okužiti drugih.
Aids so letos diagnosticirali pri petih osebah. Pri vseh petih je bila tudi okužba s HIV prepoznana v istem letu. Umrla je ena oseba s HIV, a ne a zaradi aidsa.
Prijavljen je bil tudi en primer okužbe s HIV pri sedemletnem otroku. Okužba je bila prenesena z matere na otroka, pred, med ali po porodu v letu 2013. “Da bi v prihodnosti preprečili rojstva s HIV okuženih otrok, moramo v Sloveniji čim prej uvesti presejanje nosečnic na okužbo s HIV,” pozivajo na NIJZ.
Na svetu 12 milijonov ljudi s HIV čaka na zdravljenje, 1,7 milijona ljudi pa se je v lanskem letu na novo okužilo, ker niso imeli dostopa do ključnih servisov. Na področje preventive, testiranja, zdravljenja in servisov za okužene in bolne po vsem svetu je v preteklih mesecih močno vplivala tudi epidemija covida-19, pa opozarjajo pri Združenih narodih.
Zgodnejše odkrivanje in zdravljenje lahko pomembno vplivata na boljše izide zdravljenja ter omejujeta prenos okužbe naprej. Ključna dejavnika pri zajezitvi svetovne pandemije pa ostajata varna spolnost in redna uporaba kondomov.
Tudi letos bodo ob 1. decembru potekale akcije za ozaveščanje o tej bolezni, zaradi katere so okuženi še vedno pogosto stigmatizirani. Med drugim že tradicionalno akcijo z različnimi aktivnostmi na spletni pripravljajo študenti medicine iz Projekta Virus, zvečer pa Zavod SCCA-Ljubljana pripravlja spletno VR razstavo Adijo stigma in pogovor o življenju z virusom HIV.
“,”Jaka Verbic Miklic”,1606820460,1606820460,sl,14613,306,14612,43,0,NULL,,”Rdečo pentljo ob letošnjem dnevu boja proti aidsu pripenjamo na daljavo”,rdeco-pentljo-ob-letosnjem-dnevu-boja-proti-aidsu-pripenjamo-na-daljavo,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1609239706,1609239714
726,14615,”Ob svetovnem dnevu boja proti aidsa opozorila na težave, s katerimi se srečujejo okuženi s HIV”,”Slovenija po kriterijih Svetovne zdravstvene organizacije (WHO) sodi med države z zelo nizkim deležem oseb z virusom HIV”,”
Ljubljana, 1. decembra – Slovenija po kriterijih Svetovne zdravstvene organizacije (WHO) sodi med države z zelo nizkim deležem oseb z virusom HIV, so ob današnjem svetovnem dnevu boja proti aidsu zapisali pri ministrstvu za zdravje. Nekatere organizacije pa so ob tem opozorile na težave, s katerimi se okuženi s HIV srečujejo tako doma kot po svetu.
Kot navajajo na ministrstvu za zdravje, je po podatkih Nacionalnega inštituta za javno zdravje (NIJZ) v zadnjih štirih letih zelo upadlo skupno število novih odkritih okužb s HIV.
V društvu Legebitra izpostavljajo, da je ta upad števila okužb posledica uspehov kombinirane preventive, h kateri pomemben del prispeva društvo s svojimi programi, ki jih sofinancirata ministrstvo za zdravje in Mestna občina Ljubljana, še posebej pa s testiranjem na HIV in druge spolno prenosljive okužbe v skupnosti, ki ga izvajajo od leta 2009.
Kljub tem uspehom pa tako na nacionalnem nivoju kot med moškimi, ki imajo spolne odnose z moškimi, ostaja problem prevelik delež pozno odkritih okužb pri osebah, ki so že imele hudo oslabljen imunski sistem, opozarjajo pri Legebitri.
Letošnji svetovni dan boja proti aidsu poteka tudi v luči pandemije koronavirusa. Pri Legebitri ob tem posebej poudarjajo, da je potrebno najti načine, kako vnaprej zagotoviti varnost in stabilnost zdravstva in ostalih preventivnih storitev, brez tega, da se okrnijo in zaustavijo različne preventivne storitve, ki so dolgoročno izjemnega pomena za javno zdravje, kamor tudi spadajo aktivnosti preventive, ki se izvajajo na področju HIV in ostalih spolno prenosljivih okužb.
Pri zagovorniku načela enakosti pa so ob tem opozorili, da imajo ljudje, ki živijo s HIV, še vedno težave pri sklepanju zavarovanj, kar je pokazala nedavna raziskava zagovornika.
Ugotovitve raziskave med drugim kažejo, da se zavarovalnice, ki delujejo na območju Slovenije, dosledno sklicujejo samo na področno zakonodajo, ne upoštevajo pa tudi zakona o varstvu pred diskriminacijo. Pri ponujanju storitev so pozorne na splošna pravila in temeljna načela zavarovalne oziroma aktuarske stroke, pri čemer se sklicujejo tudi na pravila pozavarovalnic, pri katerih se za rizike, ki jih sprejmejo, zavarujejo same, so v sporočilu za javnost pojasnili pri zagovorniku.
Posledica takšnega neprožnega delovanja zavarovalnic je, da se osebe, ki živijo s HIV, praviloma ne morejo zavarovati za primer težke bolezni, življenjska zavarovanja pa lahko sklenejo le ob prilagojenih pogojih, so zapisali. Pri zagovorniku ugotavljajo tudi, da zavarovalnice osebam s HIV takšnih omejitev ali dodatnih zahtev ne postavljajo pri sklepanju nezgodnih zavarovanj.
V Slovenski karitas pa so opozorili, da letošnja pandemija ogroža napredek, ki ga je svet dosegel v zvezi z bojem proti virusu HIV, saj je bilo zaradi zaprtja držav v določenih obdobjih testiranje za HIV in zdravljenje bolnikov težje.
Kot so zapisali v sporočilu za javnost, HIV še vedno najbolj ogroža prebivalce ekonomsko revnejših država sveta, predvsem podsaharske Afrike. Po zadnjih podatkih je z virusom okuženih 38 milijonov ljudi po svetu, od tega skoraj dva milijona otrok. V letu 2019 je bilo 1,7 milijona novih okužb, 690.000 ljudi je izgubilo življenje.
V Slovenski karitas zato pozivajo, da so v državah, kjer je stopnja ogroženosti visoka, nujno potrebne preventivne dejavnosti, kot je spodbujanje k zakonski zvestobi in podpora razvojnim projektom, ki revnim omogočajo dostop do primernega zdravljenja za vse okužene s HIV.
“,”Jaka Verbic Miklic”,1606820580,1606820580,sl,14615,306,14614,43,0,NULL,,”Ob svetovnem dnevu boja proti aidsa opozorila na težave, s katerimi se srečujejo okuženi s HIV”,ob-svetovnem-dnevu-boja-proti-aidsa-opozorila-na-tezave-s-katerimi-se-srecujejo-okuzeni-s-hiv,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1609239836,1609239836
727,14617,”S projektom Krepitev zdravja za vse nadgradili preventivne programe za celotno populacijo”,”V projektu je sodelovalo 25 zdravstvenih domov in pripadajočih lokalnih skupnosti.”,”
Ljubljana, 9. decembra – V projektu Krepitev zdravja za vse so nadgradili dosedanje preventivne programe za celotno populacijo, tako na področju skrbi za otroke in mladostnike kot tudi za odrasle ranljive skupine, so ob zaključnem delovnem srečanju zapisali na ministrstvu za zdravje. V projektu je sodelovalo 25 zdravstvenih domov in pripadajočih lokalnih skupnosti.
Projekt Krepitev zdravja za vse je trajal od februarja 2018 do konca decembra 2019, z njim pa so nadgradili vseživljenjsko preventivno obravnavo celotne populacije. Po besedah državne sekretarke na ministrstvu Marije Magajne je bil namen projekta, da z zagotavljanjem dostopnosti in povezovanjem izvajalcev zdravstvenih storitev omogočijo uspešno preventivno obravnavo vsem, ki jo potrebujejo. Primarno zdravstveno varstvo so želeli usmeriti v skupnost in po njeni oceni so bili v tej smeri storjeni zelo pomembni koraki.
Centri za krepitev zdravja, v katerih je sodelovalo 559 strokovnjakov, so se s svojimi aktivnostmi približali ljudem tam, kjer ti živijo in delajo. V letu 2019 so izvedli več kot 5000 zdravstvenovzgojnih delavnic in individualnih svetovanj ter v lokalnih skupnostih izvedli 2282 aktivnosti za krepitev zdravja, je naštela državna sekretarka.
Od začetka projekta so v centrih za krepitev zdravja obravnavali približno 44.000 uporabnikov. Aktivnosti v lokalnih okoljih so zajele več kot 80.000 prebivalcev v 94 občinah, pa je izpostavil vodja Centra za upravljanje programov preventive in krepitve zdravja na Nacionalnem inštitutu za javno zdravje (NIJZ) Rade Pribaković Brinovec.
“V projektnih okoljih smo vzpostavili delovne skupine in multidisciplinarne time, ki so uspešno implementirali nadgrajene preventivne programe za otroke in mladostnike, nosečnice in mlade starše, aktivne odrasle in starejše. Raziskali smo značilnosti ranljivih posameznikov in pripravili ukrepe za njihovo boljše vključevanje v programe krepitve zdravja in preventivo. Dosegli smo cilje in prispevali k večji socialni vključenosti in zmanjšanju neenakosti v zdravju,” so njegove besede še povzeli na spletnih straneh ministrstva.
V pilotnem testiranju so nadgradili preventivne pregledi otrok in mladostnikov ter družinska obravnava za zdrav življenjski slog. V dodatne preventivne obravnave v patronažnem varstvu oo vključili 281 medicinskih sester, ki so izvedle 12.813 projektnih aktivnosti ter 32.970 posvetov z različnimi izvajalci. Vzpostavili so 30 lokalnih skupin za krepitev zdravja za podporo in opolnomočenje ljudi za ohranjanje zdravja in obvladovanje kroničnih nenalezljivih bolezni, so še zapisali.
Projekt sofinancirata država in EU iz Evropskega socialnega sklada.
“,”Jaka Verbic Miklic”,1607512020,1607512020,sl,14617,306,14616,43,0,NULL,,”S projektom Krepitev zdravja za vse nadgradili preventivne programe za celotno populacijo”,s-projektom-krepitev-zdravja-za-vse-nadgradili-preventivne-programe-za-celotno-populacijo,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1609240104,1609240569
728,14619,”V programu Dora letos preventivno mamografijo opravilo skoraj 100.000 žensk”,”Z dodatnimi termini so slikali 99.671 žensk, kar je primerljivo z lanskim obsegom, so sporočili z onkološkega inštituta.”,”
Ljubljana, 24. decembra – V državnem presejalnem programu za raka dojk Dora so uspeli nadoknaditi skoraj vse odpovedi slikanj zaradi spomladanske dva meseca in pol dolge prekinitve izvajanja presejalnih programov zaradi prvega vala epidemije covida-19. Z dodatnimi termini so slikali 99.671 žensk, kar je primerljivo z lanskim obsegom, so sporočili z onkološkega inštituta.
Kot so zapisali, so zaradi odkritih sprememb na mamografskih slikah na dodatne obravnave – dodatno slikanje, ultrazvok, magnetno resonanco in v manjši meri tudi punkcijo – povabili 3116 žensk, pri 575 ženskah so odkrili raka dojk.
Izvajanje presejalnega programa je bilo ustavljeno med 16. marcem in 1. junijem. Ker na mamografijo v programu Dora vabijo približno tri tedne pred terminom, so ob ponovnem zagonu najprej povabili vse tiste ženske, ki so jim že poslali vabilo, a so jim termin zaradi prekinitve odpovedali.
Ob ponovnem začetku slikanja so uvedli dodatne ukrepe za varno obravnavo žensk in delo vseh sodelavcev. Odziv žensk je bil zelo dober, saj je v prvih dveh mesecih po ponovnem zagonu na mamografijo prišlo 75 odstotkov vseh povabljenih, kar je na ravni pred epidemijo.
Trend se je nadaljeval tudi v naslednjih mesecih in je na letni ravni znašal 74 odstotkov. Število odkritih rakov dojk je prav tako na ravni lanskega leta oz. pred epidemijo, vendar še ni dokončno, saj so nekatere ženske še v obravnavi.
Kot je navedla vodja programa Kristijana Hertl, ki je novembra po upokojitvi nadomestila dolgoletnega vodjo Maksimiljana Kadivca, jih dobri rezultati navdajajo z optimizmom, ženskam, ki so jim zaupale in se v skrbi za svoje zdravje odzvale vabilom, pa se je zahvalila.
“Kljub zaostrenim epidemiološkim pogojem nam je uspelo z organizacijo dela in sodelovanjem vseh sodelavcev po presejalnih centrih v Sloveniji nadoknaditi večino odpovedanih slikanj žensk med začasno spomladansko zaustavitvijo programa,” je ocenila Hertlova.
Kot je poudarila, program Dora tako kot druga dva presejalna programa za raka Zora in Svit deluje ob upoštevanju strogih ukrepov za zagotavljanje varnosti žensk v času drugega vala epidemije, saj je pomembno, da ljudje ne opustijo možnosti zgodnjega odkrivanja raka.
“Če je rak dojk odkrit na začetni stopnji, je zdravljenje lahko zelo uspešno. Zato svetujemo, da se ženske redno udeležijo mamografije, kjer smo z zaščitnimi ukrepi poskrbeli za varno obravnavo,” je še dodala Hertlova.
Glavni namen programa je odkrivanje majhnih rakov, ko je verjetnost ozdravitve lahko bistveno večja. Tudi zdravljenje je manj obsežno, kar vpliva na boljšo kakovost življenja bolnic. Redna udeležba v organiziranem programu zgodnjega odkrivanja raka dojk dokazano v ciljni populaciji žensk zmanjšuje umrljivost za rakom dojk in povečuje preživetje bolnic. Dolgoročni cilj programa Dora je za tretjino zmanjšati število smrti žensk zaradi raka dojk.
“,”Jaka Verbic Miklic”,1608812040,1608812040,sl,14619,306,14618,43,0,NULL,,”V programu Dora letos preventivno mamografijo opravilo skoraj 100.000 žensk”,v-programu-dora-letos-preventivno-mamografijo-opravilo-skoraj-100-000-zensk,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1609244116,1609244116
730,14628,”Pravilnik o razvrščanju, predpisovanju in izdajanju zdravil za uporabo v humani medicini”,” “,”
Opozorilo: Neuradno prečiščeno besedilo predpisa predstavlja zgolj informativni delovni pripomoček, glede katerega organ ne jamči odškodninsko ali kako drugače.
Neuradno prečiščeno besedilo Pravilnika o razvrščanju, predpisovanju in izdajanju zdravil za uporabo v humani medicini obsega:
– Pravilnik o razvrščanju, predpisovanju in izdajanju zdravil za uporabo v humani medicini (Uradni list RS, št. 86/08 z dne 5. 9. 2008),
– Pravilnik o spremembah in dopolnitvah Pravilnika o razvrščanju, predpisovanju in izdajanju zdravil za uporabo v humani medicini (Uradni list RS, št. 45/10 z dne 4. 6. 2010),
– Pravilnik o spremembah in dopolnitvah Pravilnika o razvrščanju, predpisovanju in izdajanju zdravil za uporabo v humani medicini (Uradni list RS, št. 38/12 z dne 25. 5. 2012).
PRAVILNIK O RAZVRŠČANJU, PREDPISOVANJU IN IZDAJANJU ZDRAVIL ZA UPORABO V HUMANI MEDICINI
(neuradno prečiščeno besedilo št. 2)
I. SPLOŠNE DOLOČBE
1. člen
(področje urejanja)
Ta pravilnik v skladu z Direktivo 2001/83/ES Evropskega parlamenta in Sveta z dne 6. novembra 2001 o zakoniku Skupnosti o zdravilih za uporabo v humani medicini (UL L št. 311 z dne 28. 11. 2001, str. 67), zadnjič spremenjeno z Direktivo 2008/29/ES Evropskega parlamenta in Sveta z dne 11. marca 2008 o spremembi Direktive 2001/83/ES o zakoniku Skupnosti o zdravilih za uporabo v humani medicini, glede Komisiji podeljenih izvedbenih pooblastil (UL L št. 81 z dne 20. 3. 2008, str. 51), natančneje predpisuje opredelitev, način razvrščanja glede na predpisovanje in izdajo zdravil, način predpisovanja in način izdaje zdravil za uporabo v humani medicini.
2. člen
(pomen izrazov)
Poleg definicij in izrazov, ki so opredeljeni v 5. in 6. členu Zakona o zdravilih (Uradni list RS, št. 31/06 in 45/08; v nadaljnjem besedilu: zakon) izrazi, uporabljeni v tem pravilniku, pomenijo:
1. Zdravniški recept je javna listina, s katero strokovnjak, usposobljen in pooblaščen za predpisovanje zdravil, predpiše zdravilo, ki ga v lekarni izda pooblaščena oseba. Zdravniški recept je recept ali naročilnica.
2. Recept je vrsta zdravniškega recepta na uradno veljavnem receptnem obrazcu v papirni ali elektronski obliki, na katerega strokovnjak, usposobljen in pooblaščen za predpisovanje zdravil, predpiše zdravilo za posameznega uporabnika, ki ga v lekarni izda pooblaščena oseba.
3. Uradno veljavni receptni obrazec je obrazec, ki ga izda pooblaščena institucija v Republiki Sloveniji. Kot uradno veljavni receptni obrazec se šteje tudi oblika zdravniškega recepta, določena z veljavnimi splošnimi predpisi druge države.
4. Naročilnica za zdravila je vrsta zdravniškega recepta, na katerega strokovnjak, usposobljen in pooblaščen za predpisovanje zdravil, v javnem zdravstvenem zavodu ali pri pravni ali fizični osebi, ki opravlja zdravstveno dejavnost, predpiše zdravila za opravljanje svoje dejavnosti in jih v lekarni izda pooblaščena oseba.
5. Dobavnica za zdravila je listina, ki jo ob izdaji zdravil na naročilnico v lekarni izda pooblaščena oseba.
6. Neobnovljivi recept je tisti, na katerega se zdravilo sme izdati le enkrat.
7. Obnovljivi recept je tisti, na katerega se sme zdravilo izdati večkrat.
8. Poseben zdravniški recept je posebni recept ali posebna naročilnica.
9. Posebni recept je recept v dveh istovetnih izvodih, pri čemer mora biti na drugem izvodu označba “kopija“. Na obeh izvodih posebnega recepta mora biti navedena zaporedna številka iz uradno pečatene knjige evidenc o izdanih zdravniških receptih, ki jo vodijo predpisovalci receptov, in zaporedna številka iz uradno pečatene knjige evidenc o izdanih zdravilih, ki jo vodijo lekarne.
10. Posebna naročilnica za zdravila je naročilnica v dveh istovetnih izvodih, pri čemer mora biti na drugem izvodu označba “kopija“. Na obeh izvodih posebne naročilnice mora biti vsako zdravilo vpisano z zaporedno številko iz uradno pečatene knjige evidenc o izdanih zdravniških receptih, ki jo vodijo predpisovalci receptov, in z zaporedno številko iz uradno pečatene knjige evidenc o izdanih zdravilih, ki jo vodijo lekarne.
11. Posebna dobavnica za zdravila je dobavnica v dveh istovetnih izvodih, pri čemer mora biti na drugem izvodu označba “kopija“. Na posebni dobavnici mora biti vsako zdravilo vpisano z zaporedno številko iz uradno pečatene knjige evidenc o izdanih zdravniških receptih, ki jo vodijo predpisovalci receptov, in z zaporedno številko iz uradno pečatene knjige evidenc o izdanih zdravilih, ki jo vodijo lekarne.
12. Zdravilo s posebnim režimom predpisovanja in izdaje je zdravilo na zdravniški recept, ki je namenjeno izključno za uporabo na določenih specializiranih področjih.
13. Lekarna je lekarniška enota javnega zdravstvenega zavoda, lekarne, lekarniške podružnice lekarnarjev in bolnišnične lekarne, v skladu s predpisi, ki urejajo lekarniško dejavnost.
14. Seznam medsebojno zamenljivih zdravil je seznam zdravil, ki jih organ, pristojen za zdravila, opredeli in objavi v Uradnem listu Republike Slovenije kot primerna za medsebojno zamenjavo.
3. člen
(pooblaščene institucije)
(1) Pooblaščena institucija v Republiki Sloveniji za izdajo uradno veljavnih receptnih obrazcev, na katere se predpisujejo zdravila, katerih stroški se delno ali v celoti krijejo iz obveznega zdravstvenega zavarovanja, je Zavod za zdravstveno zavarovanje Slovenije.
(2) Pooblaščena institucija v Republiki Sloveniji za izdajo uradno veljavnih receptnih obrazcev, na katere se predpisujejo zdravila, katerih stroški se ne krijejo iz obveznega zdravstvenega zavarovanja, je Inštitut za varovanje zdravja Republike Slovenije.
(3) Pooblaščena institucija za uradno pečatenje knjig evidenc je organ, pristojen za zdravila.
4. člen
(varovanje osebnih podatkov)
Osebe, pooblaščene za predpisovanje in izdajanje zdravil ter druge osebe, ki imajo dostop do podatkov iz zdravniškega recepta oziroma podatkov o uporabniku zdravila, so dolžne varovati podatke o uporabnikih zdravil v skladu s predpisi, ki urejajo varstvo osebnih podatkov.
II. OPREDELITEV IN NAČIN RAZVRŠČANJA ZDRAVIL
5. člen
(razvrščanje zdravil)
(1) Zdravila se glede na predpisovanje opredeljujejo in razvrščajo v:
– zdravila, za katera je potreben zdravniški recept;
– zdravila, za katera zdravniški recept ni potreben.
(2) Zdravila, za katera je potreben zdravniški recept, se glede na mesto izdaje izdajajo samo v lekarnah.
(3) Zdravila, za katera zdravniški recept ni potreben, se glede na mesto izdaje razvrščajo v:
– zdravila brez recepta, ki se izdajajo samo v lekarnah;
– zdravila brez recepta, ki se izdajajo v lekarnah in specializiranih prodajalnah.
6. člen
(merila za razvrščanje zdravil na zdravniški recept)
Med zdravila, za katera je potreben zdravniški recept, se razvrstijo zdravila, ki izpolnjujejo najmanj eno od naslednjih meril:
1. zanje obstaja verjetnost, da tudi ob pravilni uporabi predstavljajo posredno ali neposredno nevarnost za uporabnika, če se uporabljajo brez zdravniškega nadzora;
2. se pogosto in v veliki meri uporabljajo nepravilno, zato obstaja velika verjetnost, da bodo posredno ali neposredno ogrozila uporabnikovo zdravje;
3. vsebujejo učinkovine ali pripravke učinkovin, katerih učinki ali neželeni učinki zahtevajo nadaljnje raziskovanje;
4. so v farmacevtskih oblikah za parenteralno uporabo.
7. člen
(podskupine zdravil na zdravniški recept)
Zdravila, za katera je potreben zdravniški recept, se lahko razvrščajo tudi v podskupine, in sicer:
– zdravila, ki se predpisujejo in izdajajo na obnovljivi ali neobnovljivi recept;
– zdravila, ki se predpisujejo in izdajajo na poseben zdravniški recept;
– zdravila s posebnim režimom predpisovanja in izdaje.
8. člen
(obnovljivi recept)
Med zdravila, ki se predpisujejo in izdajajo na obnovljivi recept se razvrščajo zdravila, ki se uporabljajo za dolgotrajno jemanje ali za zdravljenje kroničnih ali ponavljajočih motenj ali bolezni, razen:
– zdravil iz 9. člena tega pravilnika,
– zdravil z režimom izdaje H in ZZ iz 10. člena tega pravilnika in
– zdravil, ki vsebujejo psihotropne snovi iz skupine IIIb Zakona o proizvodnji in prometu s prepovedanimi drogami (Uradni list RS, št. 108/99, 44/00, 2/04 – ZZdrl-A in 47/04 – ZdZPZ).
9. člen
(poseben zdravniški recept)
(1) Med zdravila, ki se predpisujejo in izdajajo na poseben zdravniški recept, se razvrstijo zdravila, ki vsebujejo narkotične in psihotropne snovi iz skupine II, IIIa in IIIc Zakona o proizvodnji in prometu s prepovedanimi drogami.
(2) Med zdravila, ki se izdajajo na poseben zdravniški recept, se razvrstijo tudi zdravila, ki vsebujejo snov ali učinkovino, ki je nova ali ima posebne lastnosti, zaradi katerih uvrstitev v to podskupino pomeni previdnostni ukrep.
10. člen
(zdravniški recept za zdravila s posebnim režimom)
(1) Zdravila s posebnim režimom predpisovanja in izdaje se razvrščajo v naslednje podskupine:
– H: zdravilo je zaradi svojih lastnosti, svoje relativne novosti ali zaradi varovanja javnega zdravja namenjeno izključno za zdravljenje, ki ga je mogoče spremljati samo v bolnišnici;
– H/Rp: zdravilo se uporablja za zdravljenje bolezni, za katero se mora postaviti diagnoza v bolnišnici ali v ustanovi, ki ima ustrezno diagnostično opremo, čeprav jemanje zdravila ali spremljanje zdravljenja lahko potekata tudi izven bolnišnice;
– Rp/Spec.: zdravilo se uporablja za zdravljenje ambulantnih bolnikov, vendar lahko njegova uporaba vodi do resnih neželenih učinkov, kar zahteva izdajo recepta zdravnika specialista ustreznega področja medicine ali njegovo pooblastilo drugemu zdravniku in poseben nadzor ves čas zdravljenja;
– ZZ: zdravilo se zaradi načina uporabe zdravila, ki zahteva dajanje ali nadzor zdravstvenega delavca, uporablja samo v javnih zdravstvenih zavodih ter pri pravnih in fizičnih osebah, ki opravljajo zdravstveno dejavnost.
(2) Za zdravila, za katera je potreben zdravniški recept, ki se ne predpisujejo in izdajajo s posebnim režimom iz prejšnjega odstavka, se uporablja okrajšava Rp.
11. člen
(zdravila brez recepta)
(1) Med zdravila, za katera ni potreben zdravniški recept, se razvrstijo zdravila, ki ne izpolnjujejo meril iz 6., 7., 8., 9., in 10. člena tega pravilnika. Podrobnejša merila za razvrstitev med zdravila, za katera ni potreben zdravniški recept, so določena v 12. do 17. členu tega pravilnika.
(2) Za zdravila, za katera ni potreben zdravniški recept, se uporablja okrajšava BRp.
12. člen
(neposredna nevarnost za uporabnika)
(1) Med zdravila, za katera ni potreben zdravniški recept, se razvrstijo tista, ki glede neposredne nevarnosti izpolnjujejo naslednja merila:
– morajo imeti majhno splošno toksičnost in ne smejo imeti pomembnega vpliva na sposobnost razmnoževanja, genotoksičnih ali kancerogenih lastnosti;
– morajo predstavljati majhno tveganje za resne neželene učinke;
– morajo predstavljati zelo majhno tveganje za nepričakovane resne neželene učinke;
– ne smejo imeti interakcij s splošno uporabljanimi zdravili, zaradi katerih bi lahko prišlo do resnih neželenih učinkov.
(2) Kontraindikacije, interakcije, opozorila in previdnostni ukrepi, ki jih ima zdravilo, za katero ni potreben zdravniški recept, morajo biti uporabniku razumljivi.
(3) Pri razvrstitvi med zdravila, za katera ni potreben zdravniški recept, je tveganje za resne neželene učinke sprejemljivo le, če je možno preventivno, brez zdravniškega nadzora, izključiti rizične skupine ljudi.
13. člen
(posredna nevarnost za uporabnika)
(1) Med zdravila, za katera ni potreben zdravniški recept, se razvrstijo tista, ki glede posredne nevarnosti izpolnjujejo naslednja merila:
– namenjena so za samozdravljenje, ki je omejeno na preprečevanje, lajšanje in odpravljanje simptomov in zdravstvenih težav, ki so praviloma takšne, da ne zahtevajo posvetovanja z zdravnikom in jih uporabnik lahko sam pravilno oceni. Ob tem mora biti verjetnost nepravilnega prepoznavanja bolezni in nepravočasnega zdravljenja zmanjšana na najmanjšo možno mero. Zato so zdravila, ki se izdajajo brez recepta, namenjena predvsem za krajša obdobja samozdravljenja;
– ne smejo biti namenjena odpravljanju simptomov, ki so lahko značilni za različne bolezni, tako da uporabnik ne more razločevati med temi boleznimi.
(2) Zdravila, za katera ni potreben zdravniški recept, morajo imeti taka navodila za uporabo in morajo biti tako označena, da omogočajo varno samozdravljenje. Navodila za uporabo morajo vsebovati dovolj podatkov in morajo biti dovolj jasna za uporabnika, da so lahko nadomestilo za posvet z zdravnikom.
14. člen
(nepravilna uporaba zdravila)
(1) Pri zdravilih, za katera ni potreben zdravniški recept, mora biti nevarnost za zdravje majhna, tudi:
– če se uporabljajo, kadar niso indicirana,
– če se uporabljajo daljše obdobje, kot je priporočeno,
– če se priporočeni odmerki prekoračijo ali
– če se pri uporabi ne upošteva opozoril in kontraindikacij.
(2) Med zdravila, za katera ni potreben zdravniški recept, se ne sme razvrstiti zdravil, pri katerih obstaja tveganje za nastanek odvisnosti.
(3) Zdravila, za katera ni potreben zdravniški recept, ne smejo zaradi možnosti preširoke uporabe predstavljati tveganja za razvoj rezistence na zdravilo.
15. člen
(nezadostne izkušnje z zdravilom)
(1) Zdravilo, ki je na trgu krajši čas, ali se manj uporablja in za katerega ni dovolj izkušenj, se ne sme razvrstiti med zdravila, za katera ni potreben zdravniški recept.
(2) Za zdravila, za katera ni potreben zdravniški recept, mora obstajati dovolj podatkov o varni uporabi tega zdravila na splošni populaciji, pri čemer določene skupine uporabnikov ne smejo biti izključene, razen če so zanje navedena posebna opozorila.
16. člen
(spremembe oziroma razširitev dovoljenja za promet)
Če se za zdravilo, za katero ni potreben zdravniški recept, predlagajo nove jakosti, nov način uporabe, nove indikacije, uporaba pri novih starostnih skupinah, nove kombinacije učinkovin, je za vse spremembe potrebna ponovna ocena razmerja med varnostjo in tveganjem, da se ugotovi, če je predlagana sprememba ustrezna za zdravilo, za katero ni potreben zdravniški recept.
17. člen
(drugi pogoji za zdravila brez recepta)
(1) Če zdravilo ustreza kateremukoli merilu iz 6. člena tega pravilnika za razvrstitev med zdravila, za katera je potreben zdravniški recept, se sme razvrstiti med zdravila, za katera ni potreben zdravniški recept, samo pod pogojem, da največji enkratni odmerek, največji dnevni odmerek, jakost, farmacevtska oblika, pakiranje ali druge okoliščine ustrezajo merilom za uvrstitev med zdravila, ki se izdajajo brez recepta samo v lekarnah.
(2) Pri tem mora biti zdravilo, za katero ni potreben zdravniški recept, pakirano v ustrezno majhnem pakiranju in v ustreznem vsebniku. Ob znižanju odmerkov mora biti dokazano, da je ustrezna učinkovitost zdravila ohranjena.
18. člen
(zdravila brez recepta, ki se izdajajo samo v lekarnah)
Zdravila, ki se izdajajo brez recepta samo v lekarnah, vsebujejo zdravilne učinkovine sinteznega, polsinteznega, biosinteznega ali naravnega izvora ter anorganske zdravilne učinkovine, za katere organ, pristojen za zdravila, ugotovi, da je za varno samozdravljenje potreben nadzor in svetovanje v lekarnah. Pri tem upošteva zlasti kontraindikacije, potrebna opozorila in previdnostne ukrepe, možnost medsebojnega delovanja z drugimi zdravili, možnost nastanka neželenih učinkov, možnost nepravilnega prepoznavanja bolezni in morebitne posledice zaradi nepravočasnega zdravljenja, možnost prevelikega odmerjanja in zlorabe zdravila ter možnost nastanka rezistence mikroorganizmov na zdravila.
19. člen
(zdravila brez recepta, ki se izdajajo v lekarnah in specializiranih prodajalnah)
(1) Zdravila, ki se izdajajo brez recepta v lekarnah in specializiranih prodajalnah, vsebujejo zdravilne učinkovine predvsem naravnega izvora ter anorganske zdravilne učinkovine, redkeje pa tudi sinteznega, polsinteznega ali biosinteznega izvora.
(2) Zdravila, ki se izdajajo brez recepta v lekarnah in specializiranih prodajalnah, imajo zmerno jakost farmakodinamičnega učinka. Uporabljajo se za odpravljanje blažjih simptomov in zdravstvenih težav. Zanje je značilna relativna neškodljivost, ki jo ugotovi organ, pristojen za zdravila.
20. člen
(področja uporabe zdravil brez recepta, ki se izdajajo v lekarnah in specializiranih prodajalnah)
Zdravila, ki se izdajajo brez recepta v lekarnah in specializiranih prodajalnah, so lahko zdravila za:
1. ublažitev bolečin v farmacevtskih oblikah za zunanjo uporabo;
2. ublažitev revmatičnih težav v farmacevtskih oblikah za zunanjo uporabo;
3. olajševanje izkašljevanja;
4. ublažitev kašlja;
5. dezinfekcijo ustne votline, kože in sluznic;
6. lajšanje težav zaradi nahoda in prehlada;
7. izboljšanje vitalnosti in odpornosti organizma;
8. lajšanje težav pri vnetju sečnih poti;
9. urejanje in izboljšanje prebave;
10. ublažitev vnetij na koži in sluznicah (tudi antihemoroidaliae);
11. ublažitev težav v menstruacijskem ciklusu ali v menopavzalnem obdobju;
12. ublažitev težav zaradi motenj v perifernem krvnem obtoku;
13. ublažitev želodčnih težav in motenj;
14. zdravljenje in preprečevanje zdravju škodljivih navad;
15. pomoč pri zmanjšanju telesne mase;
16. druge indikacije, ki jih določi organ, pristojen za zdravila.
21. člen
(merila za razvrščanje izdelkov med zdravila)
(1) Če izdelek po definiciji in ob upoštevanju vseh njegovih značilnosti lahko hkrati sodi v opredelitev zdravila in v opredelitev izdelka, ki je predmet drugih predpisov, se v primeru dvoma uporabijo določbe zakona.
(2) O opredelitvi izdelkov odloča organ, pristojen za zdravila, in pri tem upošteva zlasti:
– kakovostno in količinsko sestavo izdelka;
– ali ima izdelek oziroma njegove sestavine farmakološke učinke;
– ali se izdelku pripisujejo neposredni ali posredni zdravilni učinki;
– predstavitev izdelka in vtis, ki ga izdelek naredi na potrošnika;
– možne neželene učinke in povezana tveganja zaradi daljše uporabe izdelka;
– poznavanja izdelka s strani potrošnikov;
– najnovejša znanstvena spoznanja.
III. PREDPISOVANJE ZDRAVIL
22. člen
(predpisovanje zdravil)
(1) Pooblaščene osebe za predpisovanje zdravil na zdravniški recept za uporabo v humani medicini so zdravniki z licenco na podlagi zakona, ki ureja zdravniško službo, in sicer lahko predpisujejo samo tista zdravila, ki se dajejo v promet na podlagi zakona.
(2) Zdravila iz prejšnjega odstavka se predpisujejo z zdravniškim receptom.
(3) Pri predpisovanju zdravniških receptov v elektronski obliki je treba upoštevati določbe tega pravilnika in predpisov o elektronskem poslovanju.
23. člen
(sestava recepta)
(1) Recept je sestavljen iz administrativnega in strokovnega dela.
(2) Administrativni del recepta vsebuje podatke o uporabniku zdravila, o zdravniku, o plačniku zdravila in druge potrebne podatke.
(3) Strokovni del recepta vsebuje naročilo zdravnika pooblaščeni osebi, katero zdravilo naj izda in kakšno je odmerjanje ter način uporabe tega zdravila za navedenega uporabnika.
(4) Pooblastilo pooblaščene osebe za predpisovanje zdravil za uporabo v humani medicini zajema izpolnitev administrativnega in strokovnega dela recepta.
(5) Recept mora biti napisan ali računalniško izpisan čitljivo in neizbrisljivo.
(6) Z enim receptom se sme predpisati samo eno zdravilo in samo za eno osebo.
24. člen
(podatki na receptu)
Recept mora vsebovati najmanj naslednje podatke:
1. lastniško ali splošno ime zdravila;
2. farmacevtsko obliko in jakost zdravila;
3. količino zdravila, ki je praviloma izražena s številom originalnih pakiranj z navedenim številom enot, izjemoma pa je lahko izražena tudi samo s številom odmernih enot ali s številom dni zdravljenja;
4. odmerjanje in način uporabe zdravila;
5. osebna številka zdravnika;
6. lastnoročni podpis z osebnim žigom zdravnika in telefonsko številko zdravnika. Pri zdravniških receptih v elektronski obliki se lastnoročni podpis nadomesti z varnim elektronskim podpisom zdravnika, overjenim s kvalificiranim potrdilom v skladu z zakonom, ki ureja elektronsko poslovanje in elektronski podpis;
7. žig z imenom in naslovom javnega zdravstvenega zavoda oziroma pravne ali fizične osebe, ki opravlja zdravstveno dejavnost, kjer je bil recept predpisan, razen v primeru receptnih obrazcev iz 210. člena Pravil obveznega zdravstvenega zavarovanja (Uradni list RS, št. 30/03 – prečiščeno besedilo, 35/03 – popr., 78/03, 84/04, 44/05, 86/06, 90/06 – popr., 64/07 in 33/08) in receptnih obrazcev, na katera se predpisujejo zdravila, katerih stroški se ne krijejo iz zdravstvenega zavarovanja;
8. datum predpisa recepta;
9. ime, priimek in naslov uporabnika zdravila;
10. mesec in leto rojstva ter spol uporabnika zdravila in
11. druge podatke, ki jih zahtevajo drugi ustrezni predpisi.
25. člen
(dodatne sestavine recepta)
Nosilec obveznega zdravstvenega zavarovanja lahko skladno s predpisi in s svojimi pravili določi obliko in dodatne sestavine receptnega obrazca, poleg predpisanih s tem pravilnikom, in sicer za zdravila na recept, ki se predpisujejo v breme obveznega zdravstvenega zavarovanja.
26. člen
(imena zdravil na receptu)
(1) Lastniška in splošna imena zdravil ter imena sestavin zdravil se ne smejo krajšati.
(2) Imena sestavin magistralnega zdravila se pišejo praviloma v latinskem jeziku in sicer po imenih iz veljavnih farmakopej ali drugih uradnih in strokovnih predpisov.
27. člen
(navodilo zdravnika za uporabo zdravila)
(1) Zdravnik mora uporabnika o predpisanem zdravilu ustrezno informirati, vključno z možnostjo zamenjave v okviru seznama medsebojno zamenljivih zdravil in potrebnih doplačil.
(2) Na receptu mora jasno in popolno navesti navodilo o odmerjanju in načinu uporabe zdravila. Ne zadostuje, če napiše samo besede “po navodilu“ ipd., razen v primerih sklica na pisno navodilo, ki ga da uporabniku.
(3) Kadar zdravilo predpiše le za občasno uporabo (po potrebi), mora navesti največji dnevni odmerek zdravila za zadevnega uporabnika.
(4) Navodilo na receptu za zdravila, za katera je določeno, da jih daje (aplicira) zdravstveni delavec, mora imeti označbo “v roke zdravniku“ ( ad manum medici).
28. člen
(navedba merskih enot na receptu)
(1) Če se mora pri pripravi zdravila meriti njegova masa, mora zdravnik to na receptu označiti z ustrezno mersko enoto po mednarodnem sistemu enot (SI) z arabskimi številkami, vsaj na eno decimalko natančno.
(2) Ne glede na določbo prejšnjega odstavka merske enote ni treba zapisati, če se masa zdravila meri v gramih (g).
(3) Če je treba pri pripravi zdravila meriti kapljice, mora zdravnik njihovo število označiti z rimskimi številkami in jih v oklepaju izpisati z besedo.
29. člen
(navedba količine zdravila na receptu)
(1) Število pakiranj mora zdravnik označiti z rimskimi številkami. Njihovo število mora označiti tudi z besedami v oklepaju.
(2) Če se količina zdravila izrazi s številom dni zdravljenja, mora biti število teh dni izpisano tudi z besedo.
30. člen
(navedba drugačnega odmerjanja zdravila)
Če zdravnik predpiše prekoračen največji odmerek zdravila, ali če predpiše drugačno odmerjanje, kot ga določa dovoljenje za promet z zdravilom in drugi predpisi, mora številke izpisati tudi z besedami in poleg te označbe dodati klicaj (!) ter se poleg njega podpisati.
31. člen
(nujna izdaja zdravila)
Če je treba zaradi narave bolezni zdravilo izdati takoj, mora zdravnik to na receptu označiti z besedami: “nujno“, “ cito“, “ statim“ ali “ periculum in mora“.
32. člen
(prepoved zamenjave predpisanega zdravila)
Če zdravnik ne želi, da se na recept, na katerega je predpisal zdravilo, izda drugo ustrezno zdravilo s seznama medsebojno zamenljivih zdravil, mora to označiti z besedami “Ne zamenjuj!“ in se poleg oznake podpisati. Pri receptu v elektronski obliki z varnim elektronskim podpisom, overjenim s kvalificiranim potrdilom, poleg oznake »Ne zamenjuj!« ni potreben še en podpis zdravnika. Zdravnik sme tako prepovedati zamenjavo le, kadar bi zamenjava lahko ogrozila uporabnikovo zdravje ali varnost.
33. člen
(obnovljivi recept)
(1) Na obnovljivi recept se smejo predpisati samo zdravila za dolgotrajno jemanje ali za zdravljenje kroničnih ali ponavljajočih motenj ali bolezni, ki nimajo posebnega režima predpisovanja in izdaje ter zdravila, ki ne vsebujejo narkotičnih in psihotropnih snovi iz skupine II in III Zakona o proizvodnji in prometu s prepovedanimi drogami.
(2) Zdravnik mora na obnovljivem receptu označiti “ repetatur“ ali “ponovi“, če želi, da se predpisano zdravilo na ta recept ponovno izda. Hkrati mora s številko in besedo označiti število želenih ponovitev.
(3) Obnovljivi recept velja za število predpisanih ponovitev oziroma največ leto dni od datuma predpisa.
(4) Če zdravnik poleg oznake “ repetatur“ ali “ponovi“ ne navede števila ponovitev, se izdaja zdravila lahko ponovi le enkrat.
(5) V breme obveznega zdravstvenega zavarovanja se smejo zdravila na obnovljivi recept predpisovati v skladu s tem pravilnikom in v skladu s predpisi nosilca obveznega zdravstvenega zavarovanja.
34. člen
(popravki na zdravniškem receptu)
Kakršenkoli popravek na strokovnem delu zdravniškega recepta sme narediti le zdravnik, ki je recept predpisal. Napačno navedbo mora prečrtati, tako da je še mogoče razbrati prvotno navedbo. Popravek mora potrditi z lastnoročnim podpisom ob zapisani spremembi. Popravki receptov v elektronski obliki niso mogoči. Nepravilen recept v elektronski obliki zdravnik prekliče in predpiše nov recept.
35. člen
(veljavnost recepta)
Recept velja 30 dni od datuma izdaje, kolikor ni v tem pravilniku, v dovoljenju za promet z zdravilom ali v drugih predpisih s področja zdravil drugače določeno. Rok začne teči naslednji dan po predpisu.
36. člen
(predpisovanje zdravil z narkotičnimi in psihotropnimi snovmi)
Zdravila, ki vsebujejo narkotične in psihotropne snovi, se smejo predpisovati samo, če je njihova uporaba nujna in je z Zakonom o proizvodnji in prometu s prepovedanimi drogami določeno, da smejo v promet za medicinske namene. Predpisovati se smejo v skladu s sprejetimi nacionalnimi usmeritvami za zdravljenje bolečine pri bolnikih z rakom ter za zdravljenje kronične bolečine, ki ni posledica rakave bolezni.
37. člen
(zdravila z narkotičnimi in psihotropnimi snovmi)
(1) Zdravila iz prejšnjega člena so zdravila, ki vsebujejo eno ali več narkotičnih in psihotropnih snovi iz skupine II in III Zakona o proizvodnji in prometu s prepovedanimi drogami.
(2) Določba prejšnjega odstavka se ne nanaša na zdravila, ki v svoji sestavi vsebujejo:
– manj kot 100 mg folkodina v posameznem odmerku oziroma manj kot 2,5% v nedeljeni obliki zdravila ali
– manj kot 30 mg kodeina v kombinaciji z drugimi zdravilnimi učinkovinami v posameznem odmerku oziroma manj kot 2,5% v nedeljeni obliki zdravila, preračunano na kodein (bazo).
38. člen
(omejitve predpisovanja zdravil z narkotičnimi in psihotropnimi snovmi)
(1) Za enkratno izdajo sme zdravnik predpisati zdravilo za enega uporabnika v količinah za zdravljenje do 30 dni, in sicer:
– največ 800 mg buprenorfina;
– največ 7500 mg dihidrokodeina;
– največ 500 mg dronabinola;
– največ 2500 mg fenetilina;
– največ 700 mg fentanila;
– največ 1200 mg hidrokodona;
– največ 3200 mg hidromorfona;
– največ 7500 mg kodeina;
– največ 3000 mg racemnega metadona;
– največ 1500 mg levometadona;
– največ 20000 mg morfina;
– največ 12000 mg modafinila;
– največ 600 mg nalbufina;
– največ 40000 mg tinkture opija;
– največ 13000 mg oksikodona;
– največ 15000 mg pentazocina;
– največ 10000 mg petidina;
– največ 6000 mg piritramida.
Navedene količine se nanašajo na količino zdravila v farmacevtski obliki.
(2) Za en dan zdravljenja sme zdravnik za posameznega bolnika predpisati največ desetino količin iz prejšnjega odstavka, ob tem pa celotna predpisana količina zdravila na receptu ne sme biti večja, kot je določeno v prejšnjem odstavku.
(3) Ne glede na prvi in drugi odstavek tega člena sme zobozdravnik predpisati samo tista zdravila iz prvega in drugega odstavka tega člena, ki se uporabljajo v dentalni medicini, in sicer za enkratno izdajo za enega uporabnika največ do ene tretjine količine teh zdravil.
(4) Količine iz prvega odstavka tega člena ne veljajo za zdravljenje odvisnosti in če so predpisane na posebno naročilnico za uporabo v javnih zdravstvenih zavodih ter pri pravnih in fizičnih osebah, ki opravljajo zdravstveno dejavnost.
(5) Z receptom se ne smejo predpisati in ne nanj izdajati kokain (vse kokainijeve soli in proste baze) ter zdravila, ki ga vsebujejo.
39. člen
(predpisovanje zdravil na poseben zdravniški recept)
(1) Zdravila, ki vsebujejo narkotične in psihotropne snovi iz skupine II, IIIa in IIIc Zakona o proizvodnji in prometu s prepovedanimi drogami, se morajo predpisati na posebni recept ali na posebno naročilnico. Predpisovati jih smejo samo zdravniki, ki so registrirani v Republiki Sloveniji. Ta zdravila se ne smejo predpisovati na receptne obrazce iz 210. člena Pravil obveznega zdravstvenega zavarovanja.
(2) Na obeh izvodih posebnega recepta in posebne naročilnice mora biti vpisana zaporedna številka iz uradno pečatene knjige evidenc o izdanih zdravniških receptih, na drugem izvodu mora biti označba »kopija«. Na posebnih receptih v elektronski obliki mora biti vpisana zaporedna številka iz uradno pečatene knjige evidenc o izdanih zdravniških receptih.
(3) Posebni recept in posebna naročilnica veljata pet dni od datuma predpisa, pri čemer rok začne teči naslednji dan po predpisu.
40. člen
(uradno pečatene knjige evidenc o predpisovanju zdravil)
(1) O predpisovanju zdravil, ki vsebujejo narkotične in psihotropne snovi iz skupine II, IIIa in IIIc Zakona o proizvodnji in prometu s prepovedanimi drogami, morajo zdravniki voditi uradno pečateno knjigo evidenc. Knjiga evidenc mora biti oštevilčena od prve do zadnje strani in označena z žigom javnega zdravstvenega zavoda oziroma pravne in fizične osebe, ki opravlja zdravstveno dejavnost, ter imenom(i), priimkom(i) in osebno(imi) številko(ami) zdravnika(ov). Glede na organiziranost javnega zdravstvenega zavoda oziroma pravne in fizične osebe, ki opravlja zdravstveno dejavnost, lahko isto knjigo evidenc uporablja več zdravnikov. Zdravniki morajo v knjigi voditi evidenco naslednjih podatkov:
1. zaporedna številka;
2. datum, kdaj je bilo zdravilo predpisano;
3. predpisano lastniško ali splošno ime zdravila, farmacevtska oblika, jakost in pakiranje zdravila ter količina predpisanega zdravila in odmerjanje;
4. ime, priimek in naslov uporabnika zdravila;
5. podpis, ime in priimek ter osebna številka zdravnika, ki je predpisal recept. V sami evidenci je ob predpisanem zdravilu lahko le podpis zdravnika, če so ime, priimek, osebna številka zdravnika in njegov podpis razvidni iz uvodnega dela predmetne knjige evidenc.
(2) Zdravniki oziroma določene odgovorne osebe v javnih zdravstvenih zavodih ali pri pravnih in fizičnih osebah, ki opravljajo zdravstveno dejavnost, morajo voditi tudi uradno pečatene knjige evidenc o nabavi, porabi in zalogi zdravil, ki vsebujejo narkotične in psihotropne snovi iz skupine II, IIIa in IIIc Zakona o proizvodnji in prometu s prepovedanimi drogami, in sicer za zdravila, ki se uporabljajo pri opravljanju zdravstvene dejavnosti za neposredno aplikacijo uporabnikom. Knjige evidenc je treba voditi na način, ki omogoča sledljivost.
(3) Knjige evidenc iz tega člena morajo biti varovane pred morebitnimi zlorabami ali uničenjem.
(4) Knjige evidenc iz tega člena morajo zdravniki shranjevati vsaj pet let po datumu zadnjega vpisa o zdravilu, ki vsebuje narkotične in psihotropne snovi, v skladu s predpisi, ki urejajo varovanje arhiviranega gradiva.
41. člen
(predpisovanje zdravil z režimom izdaje H in ZZ)
(1) Zdravila na zdravniški recept z režimom predpisovanja in izdaje H se predpisujejo samo na naročilnico.
(2) Zdravila na zdravniški recept z režimom predpisovanja in izdaje ZZ, se praviloma predpisujejo na naročilnico. Na recept se smejo predpisati le izjemoma, če se zagotovi prenos zdravila od lekarne do javnega zdravstvenega zavoda oziroma pravne in fizične osebe, ki opravlja zdravstveno dejavnost, v ustreznih temperaturnih in drugih pogojih shranjevanja.
42. člen
(podatki na naročilnici)
(1) Naročilnica mora vsebovati najmanj naslednje podatke:
1. lastniško ali splošno ime zdravila;
2. farmacevtsko obliko in jakost zdravila;
3. količino zdravila;
4. lastnoročni podpis in osebni žig zdravnika, zaželena tudi telefonska številka;
5. datum izdaje naročilnice;
6. odtisnjeno ali natiskano ime in naslov javnega zdravstvenega zavoda ali pravne ali fizične osebe, ki opravlja zdravstveno dejavnost in
7. druge podatke, ki jih zahtevajo drugi ustrezni predpisi.
(2) Na naročilnico se sme predpisati tudi več zdravil hkrati.
(3) Za zdravila, ki vsebujejo narkotične in psihotropne snovi iz skupine II, IIIa in IIIc Zakona o proizvodnji in prometu s prepovedanimi drogami, morajo zdravniki oziroma določene odgovorne osebe v javnih zdravstvenih zavodih ali pravnih in fizičnih osebah, ki opravljajo zdravstveno dejavnost, voditi uradno pečateno knjigo evidenc o izdanih posebnih naročilnicah in prejetih posebnih dobavnicah, na način, ki omogoča sledljivost.
(4) Knjige evidenc iz prejšnjega odstavka morajo biti varovane pred morebitnimi zlorabami ali uničenjem.
(5) Knjige evidenc iz tretjega odstavka tega člena morajo zdravniki shranjevati vsaj pet let po datumu zadnjega vpisa o zdravilu, ki vsebuje narkotične in psihotropne snovi, v skladu s predpisi, ki urejajo varovanje arhiviranega gradiva.
IV. IZDAJANJE ZDRAVIL
43. člen
(pooblaščene osebe za izdajo zdravil)
(1) Zdravila sme izdajati le pooblaščena oseba.
(2) Pooblaščena oseba za izdajo zdravil, ki se izdajajo na posebni recept in na posebno naročilnico, je magister farmacije z opravljenim strokovnim izpitom.
(3) Pooblaščena oseba za izdajo zdravil, ki se izdajajo na obnovljivi recept, je magister farmacije z opravljenim strokovnim izpitom.
(4) Pooblaščena oseba za izdajo zdravil, ki se izdajajo na zdravniški recept, je magister farmacije in inženir farmacije z opravljenim strokovnim izpitom.
(5) Pooblaščena oseba za izdajo zdravil, ki se izdajajo brez recepta samo v lekarnah, je magister farmacije in inženir farmacije z opravljenim strokovnim izpitom ter farmacevtski tehnik z opravljenim strokovnim izpitom, pod nadzorom magistra farmacije.
(6) Pooblaščena oseba za izdajo zdravil brez recepta v specializiranih prodajalnah je poleg pooblaščenih oseb iz prejšnjega odstavka tudi farmacevtski tehnik z opravljenim strokovnim izpitom.
44. člen
(izdajanje zdravil)
(1) Pooblaščena oseba v lekarni mora izdati zdravilo v skladu s tem pravilnikom.
(2) Vsa zdravila, predpisana na zdravniški recept, se smejo izdati le v lekarni.
(3) Ob izdaji zdravila se zdravniški recept v izvirniku zadrži v lekarni, razen če je v drugih predpisih določeno, da se mora zdravniški recept priložiti zahtevku za povračilo sredstev za zdravilo. Lekarna mora voditi evidenco zdravniških receptov, ki niso bili zadržani v lekarni. Elektronski recepti se hranijo centralno v elektronskem arhivu v skladu s 64. členom tega pravilnika.
45. člen
(izdaja zdravila v izvirnem pakiranju)
Zdravila za individualno uporabo se smejo izdajati samo v izvirnem pakiranju.
46. člen
(preverjanje podatkov ob izdaji zdravil)
(1) Ob izdaji zdravila lahko pooblaščena oseba zaradi preverjanja podatkov zahteva osebni dokument uporabnika zdravila. V nasprotnem primeru lahko izdajo zdravila zavrne.
(2) Pooblaščena oseba lahko v skladu s predpisi nosilca obveznega zdravstvenega zavarovanja popravi podatke na administrativnem delu recepta.
47. člen
(izdaja zdravil v dežurni službi)
Med dežurno službo mora pooblaščena oseba izdati zdravilo na recept, ki je predpisan istega dne ali če je označen kot nujen.
48. člen
(izdaja medsebojno zamenljivega zdravila, predpisanega z lastniškim imenom)
(1) Pooblaščena oseba za izdajo zdravil praviloma izda tisto zdravilo z lastniškim imenom, ki ga je predpisal zdravnik.
(2) Zdravilo, ki je na seznamu medsebojno zamenljivih zdravil, je mogoče brez poprejšnjega sporazuma z zdravnikom zamenjati z ustreznim zdravilom s tega seznama, če zdravnik na receptu z besedami “Ne zamenjuj!“ ni ustrezno označil, da zamenjava ni dovoljena, v naslednjih primerih:
– če je za predpisano zdravilo potrebno doplačilo, uporabnik oziroma prevzemnik pa zanj ni pripravljen plačati doplačila oziroma ne izkaže drugega ustreznega kritja, se predpisano zdravilo lahko zamenja z ustreznim cenejšim zdravilom s tega seznama;
– če pri veletrgovcih z zdravili predpisanega zdravila ni mogoče dobiti.
V teh primerih mora pooblaščena oseba uporabnika oziroma prevzemnika seznaniti s predpisanim zdravilom in ustreznimi zdravili s seznama medsebojno zamenljivih zdravil.
(3) Pooblaščena oseba za izdajo zdravil mora zamenjavo označiti na receptu. Pri izdaji zdravila, predpisanega na recept v elektronski obliki, pooblaščena oseba za izdajo zdravil zamenjavo označi v elektronski obliki in se podpiše z varnim elektronskim podpisom, overjenim s kvalificiranim potrdilom.
49. člen
(izdaja zdravila, predpisanega s splošnim imenom)
(1) Kadar je zdravilo predpisano s splošnim imenom, mora pooblaščena oseba, ki zdravilo izda, uporabnika oziroma prevzemnika zdravila obvestiti o vseh razpoložljivih zdravilih in morebitnem doplačilu. Ustrezno zdravilo pooblaščena oseba izda sporazumno z uporabnikom oziroma prevzemnikom zdravila.
(2) Pooblaščena oseba za izdajo zdravil v lekarni mora izdano zdravilo označiti na receptu. Pri izdaji zdravila, predpisanega na recept v elektronski obliki, pooblaščena oseba za izdajo zdravil podatke o izdanem zdravilu označi v elektronski obliki in se podpiše z varnim elektronskim podpisom, overjenim s kvalificiranim potrdilom.
50. člen
(preprečevanje zapletov zaradi zamenjave zdravila)
Pooblaščena oseba mora pri zamenjavi zdravila, ki ga je uporabnik že prejemal, dati uporabniku oziroma prevzemniku zdravila tudi točna pisna navodila za preprečitev morebitnih zapletov zaradi zamenjave.
51. člen
(prepoved zamenjave zdravila)
Pooblaščena oseba ne sme brez poprejšnjega sporazuma z zdravnikom, ki je predpisal zdravilo, izdati namesto predpisanega zdravila:
– podobnega zdravila, ki nima enake kakovostne in količinske sestave učinkovine v enaki farmacevtski obliki;
– zdravila, ki ni na seznamu medsebojno zamenljivih zdravil.
52. člen
(izdaja zdravil ob neustrezno predpisanem odmerjanju)
(1) Če je na receptu predpisano odmerjanje na neustrezen način (npr. po navodilu, po potrebi), pooblaščena oseba za izdajo pa se o tem ne more ustrezno dogovoriti z zdravnikom, sme izdati le eno najmanjše pakiranje zdravila.
(2) Podatke o izdaji zdravila pooblaščena oseba označi na receptu. Pri izdaji zdravila, predpisanega na recept v elektronski obliki, pooblaščena oseba za izdajo zdravil podatke o izdanem zdravilu označi v elektronski obliki in se podpiše z varnim elektronskim podpisom, overjenim s kvalificiranim potrdilom.
53. člen
(izdaja zdravila ob neustrezno predpisani jakosti in količini zdravila)
(1) Če zdravnik pri predpisovanju lastniškega zdravila, ki je v prometu v različnih jakostih ali pakiranjih, ne navede jakosti ali pakiranja oziroma števila dni zdravljenja, izda pooblaščena oseba predpisano zdravilo v najmanjši učinkoviti jakosti in v najmanjšem pakiranju.
(2) Če je količina zdravila izražena s številom dni zdravljenja, pooblaščena oseba izda najmanjšo količino izvirnega pakiranja, ki zadošča za predpisano število dni zdravljenja.
(3) Podatke o izdanem zdravilu pooblaščena oseba označi na receptu. Pri izdaji zdravila, predpisanega na recept v elektronski obliki, pooblaščena oseba za izdajo zdravil podatke o izdanem zdravilu označi v elektronski obliki in se podpiše z varnim elektronskim podpisom, overjenim s kvalificiranim potrdilom.
54. člen
(ravnanje ob neustrezno predpisanem receptu)
(1) Pooblaščena oseba ne sme izdati zdravila na zdravniški recept, katerega strokovni del ni skladen s tem pravilnikom.
(2) Če recept ni skladen s tem pravilnikom, mora pooblaščena oseba opozoriti zdravnika, ki je tak recept predpisal, na ugotovljeno pomanjkljivost, in sicer na tak način, da pri tistem, ki mu je zdravilo predpisano, ohrani zaupanje v pravilnost zdravnikovega in svojega dela. Če se pri tem ne more sporazumeti z zdravnikom, pooblaščena oseba na primeren način vrne recept zdravniku oziroma uporabniku s potrebnim pojasnilom.
(3) Če zdravnik, ki je recept predpisal, ni dosegljiv, ravna pooblaščena oseba na naslednji način:
– če je na receptu predpisano zdravilo, pri katerem so prekoračeni največji odmerki, zdravnik pa ni napisal predpisanih označb, izda zdravilo v srednjem priporočenem odmerku;
– če je zdravilo v več farmacevtskih oblikah, zdravnik pa je ni navedel, izda tako farmacevtsko obliko zdravila, ki nedvoumno ustreza navodilu za njegovo uporabo;
– o svojem ravnanju čim prej obvesti zdravnika, ki je izdal recept;
– svoje ukrepe označi na receptu. Pri izdaji zdravila, predpisanega na recept v elektronski obliki, pooblaščena oseba za izdajo zdravil podatke o ukrepih in izdanem zdravilu označi v elektronski obliki in se podpiše z varnim elektronskim podpisom, overjenim s kvalificiranim potrdilom.
(4) Če gre za dvoumne primere, pooblaščena oseba na primeren način vrne recept zdravniku, ki je tak recept predpisal, oziroma uporabniku s potrebnim pojasnilom.
55. člen
(izdaja zdravila na obnovljivi recept)
(1) Pri vsaki izdaji zdravila na obnovljivi recept mora pooblaščena oseba recept zavesti v evidenco obnovljivih receptov in vanjo vpisati podatke iz 1., 2., 9. in 10. točke 24. člena tega pravilnika ter ime in priimek zdravnika, ki je zdravilo predpisal. Številko zavedbe iz evidence obnovljivih receptov mora vpisati na recept. Na recept mora vpisati tudi datum in izdano količino zdravila. Evidence morajo biti varovane pred morebitnimi zlorabami ali uničenjem.
(2) Ne glede na prejšnji odstavek lahko pooblaščena oseba, če po delnih izdajah zdravila recept zadrži v lekarni, vodi številko zavedbe, datum in izdano količino s pomočjo računalniškega sistema. Vpis podatkov iz prejšnjega odstavka na recept v tem primeru ni potreben.
(3) Ob zadnji izdaji zdravila se obnovljivi recept zadrži v lekarni, razen če je v drugih predpisih določeno, da se mora zdravniški recept priložiti zahtevku za povračilo sredstev za zdravila. Lekarna mora voditi evidenco zdravniških receptov, ki niso bili zadržani v lekarni.
(4) Zdravila na obnovljivi recept, ki so predpisana v breme zdravstvenega zavarovanja, se smejo izdajati v skladu s tem pravilnikom in predpisi nosilca obveznega zdravstvenega zavarovanja.
56. člen
(izdaja zdravil z narkotičnimi in psihotropnimi snovmi)
(1) Zdravila, ki vsebujejo narkotične in psihotropne snovi iz skupine II, IIIa in IIIc Zakona o proizvodnji in prometu s prepovedanimi drogami, se smejo izdajati le polnoletnim osebam. Ob izdaji teh zdravil se mora oseba, ki je prevzemnik zdravila, izkazati z veljavnim osebnim dokumentom.
(2) O izdaji zdravil iz prejšnjega odstavka morajo lekarne voditi uradno pečateno knjigo evidenc. Pooblaščena oseba mora ob izdaji zdravila na posebni recept in na posebno naročilnico vpisati zaporedno številko iz knjige evidenc, pod katero je izdaja tega zdravila zavedena. Tudi na posebne recepte v elektronski obliki mora biti vpisana zaporedna številka iz uradno pečatene knjige evidenc, pod katero je zavedena izdaja zdravila.
(3) Pooblaščena oseba mora v uradno pečateno knjigo evidenc zavesti tudi količine izdanih snovi iz skupine II, IIIa in IIIc Zakona o proizvodnji in prometu s prepovedanimi drogami, ki so bile uporabljene pri izdelavi magistralnega zdravila.
(4) Knjiga evidenc iz drugega in tretjega odstavka tega člena mora biti oštevilčena od prve do zadnje strani in označena z imenom in naslovom lekarne. Pooblaščene osebe za izdaje zdravil morajo v njej voditi evidenco naslednjih podatkov:
1. zaporedna številka;
2. datum izdaje zdravila;
3. ime, priimek in naslov uporabnika zdravila;
4. ime, priimek in naslov prevzemnika zdravila;
5. lastniško ime zdravila, farmacevtska oblika, jakost in pakiranje ter količina izdanega zdravila;
6. ime in priimek zdravnika, ki je predpisal recept ter naslov javnega zdravstvenega zavoda ali pravne ali fizične osebe, ki opravlja zdravstveno dejavnost, kjer je zdravnik zaposlen, ter zaporedna številka iz uradno pečatene knjige evidenc, ki jo vodijo predpisovalci teh zdravil in
7. podpis oziroma parafa pooblaščene osebe, ki je izdala zdravilo.
(5) Lekarne morajo voditi tudi uradno pečatene knjige evidenc o nabavi oziroma dobavi in zalogi narkotičnih in psihotropnih snovi iz skupine II., IIIa in IIIc Zakona o proizvodnji in prometu s prepovedanimi drogami.
(6) Knjige evidenc iz tega člena morajo biti varovane pred morebitnimi zlorabami ali uničenjem.
57. člen
(označevanje receptov ob izdaji)
Ob vsaki izdaji zdravila pooblaščena oseba na recept napiše svojo uradno parafo. Izdajo zdravila na elektronski recept pooblaščena oseba za izdajo zdravil podpiše z varnim elektronskim podpisom, overjenim s kvalificiranim potrdilom. Recept mora na neizbrisljiv način opremiti z imenom lekarne in datumom izdaje.
58. člen
(opremljanje zdravil s signaturo)
(1) Pooblaščena oseba mora zdravilo, ki ga izda na recept, opremiti s signaturo, na kateri morata biti natiskana ali odtisnjena ime in kraj lekarne. Signatura mora biti na za to predvidenem prostoru, ki je določen v skladu s predpisom, ki ureja označevanje zdravil.
(2) Pooblaščena oseba mora na signaturi čitljivo napisati navodilo za odmerjanje in način uporabe zdravila, označiti datum izdaje zdravila ter dodati svojo uradno parafo. Če je poleg kratkega navodila na signaturi potrebno še širše navodilo za uporabo zdravila, mora napisati to navodilo na posebnem listu ter ga overiti z žigom in svojim podpisom.
(3) Če je potrebno, mora pooblaščena oseba zdravilo opremiti tudi z drugimi ustreznimi opozorili.
59. člen
(obveznost svetovanja)
Ob vsaki izdaji zdravila na recept ali brez recepta mora pooblaščena oseba uporabniku oziroma prevzemniku svetovati in ga seznaniti s pravilno in varno uporabo zdravila.
60. člen
(omejitve izdaje zdravil brez recepta)
(1) Izdana količina zdravila, za katerega ni potreben zdravniški recept in katerega izdaja ni dovoljena na podlagi samopostrežne izbire, je za enega uporabnika največ tri pakiranja z najmanjšim številom enot oziroma eno pakiranje z večjim številom enot.
(2) Organ, pristojen za zdravila, lahko pri posameznem zdravilu v dovoljenju za promet z zdravilom dodatno omeji število pakiranj in število enot zdravila za enkratno izdajo brez recepta posameznemu uporabniku.
(3) Če pooblaščena oseba sumi, da gre za zlorabo, lahko zavrne izdajo zdravila, za katero ni potreben zdravniški recept.
61. člen
(dobavnica ob izdaji zdravil)
Ob izdaji zdravila na naročilnico mora pooblaščena oseba uporabniku oziroma prevzemniku izdati dobavnico, ki mora vsebovati najmanj naslednje podatke:
1. lastniško ime zdravila;
2. farmacevtsko obliko in jakost zdravila;
3. količino zdravila;
4. lastnoročni podpis in čitljivo izpisano ime in priimek farmacevta, ki je zdravilo izdal;
5. odtisnjeno ali natiskano ime in naslov lekarne, v kateri je bilo zdravilo izdano;
6. datum izdaje zdravila;
7. druge podatke, ki so vezani na naročilnico oziroma dobavnico ali ki jih zahtevajo drugi predpisi s področja zdravil.
62. člen
(posebna dobavnica ob izdaji zdravil)
(1) Ob izdaji zdravil na posebno naročilnico mora pooblaščena oseba uporabniku oziroma prevzemniku izdati posebno dobavnico.
(2) Lekarne morajo voditi evidence o prejetih posebnih naročilnicah ter dobavnicah na način, ki omogoča sledljivost.
(3) Evidence iz prejšnjega odstavka morajo biti varovane pred morebitnimi zlorabami ali uničenjem.
63. člen
(evidence izdaje zdravil)
Lekarne morajo s pomočjo računalniškega sistema voditi ustrezno evidenco, iz katere so razvidni podatki o vseh izdanih zdravilih in pri zdravilih, ki so predmet zdravniškega recepta, tudi o vključenih uporabnikih.
64. člen
(shranjevanje zdravniških receptov, evidenc in uradno pečatenih knjig)
(1) Zdravniške recepte morajo lekarne shranjevati vsaj tri leta od datuma izdaje zadevnega zdravila.
(2) Ne glede na določbo prejšnjega odstavka morajo lekarne shranjevati posebne zdravniške recepte in posebne dobavnice vsaj pet let od datuma izdaje zadevnega zdravila.
(3) Recepti v elektronski obliki se hranijo v elektronskem arhivu. Posebne recepte v elektronski obliki je treba shranjevati vsaj pet let, druge pa vsaj tri leta od datuma izdaje zadevnega zdravila.
(4) Uradno pečatene knjige evidenc o zdravilih, ki vsebuje narkotične in psihotropne snovi, morajo lekarne shranjevati vsaj pet let po datumu zadnjega vpisa o zdravilu.
(5) Računalniški sistemi morajo omogočati vpogled v evidence iz prejšnjega člena vsaj tri leta.
(6) Evidence iz 55. člena tega pravilnika morajo lekarne shranjevati vsaj tri leta od datuma zadnjega vnosa.
(7) Vso dokumentacijo iz tega člena je treba shranjevati v skladu s predpisi, ki urejajo varovanje arhiviranega gradiva.
Pravilnik o razvrščanju, predpisovanju in izdajanju zdravil v humani medicini (Uradni list RS, št. 86/08) vsebuje naslednji končni določbi:
»V. KONČNI DOLOČBI
65. člen
(prenehanje veljavnosti)
Z dnem uveljavitve tega pravilnika prenehata veljati Pravilnik o razvrščanju, predpisovanju in izdajanju zdravil za uporabo v humani medicini (Uradni list RS, št. 59/03 in 114/03) ter Odredba o določitvi zdravil, ki se izdajajo na recept ali brez recepta le v lekarnah (Uradni list RS, št. 110/99).
66. člen
(uveljavitev pravilnika)
Ta pravilnik začne veljati petnajsti dan po objavi v Uradnem listu Republike Slovenije.«.
Pravilnik o spremembah in dopolnitvah Pravilnika o razvrščanju, predpisovanju in izdajanju zdravil v humani medicini (Uradni list RS, št. 45/10) vsebuje naslednjo končno določbo:
»KONČNA DOLOČBA
15. člen
Ta pravilnik začne veljati petnajsti dan po objavi v Uradnem listu Republike Slovenije.«.
Pravilnik o spremembah in dopolnitvah Pravilnika o razvrščanju, predpisovanju in izdajanju zdravil v humani medicini (Uradni list RS, št. 38/12) vsebuje naslednjo končno določbo:
»3. člen
Ta pravilnik začne veljati petnajsti dan po objavi v Uradnem listu Republike Slovenije.«.
“,”Jaka Verbic Miklic”,1712260560,1712260560,sl,14628,306,14627,43,0,NULL,,”Pravilnik o razvrščanju, predpisovanju in izdajanju zdravil za uporabo v humani medicini”,pravilnik-o-razvrscanju-predpisovanju-in-izdajanju-zdravil-za-uporabo-v-humani-medicini,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,1,0,1611176242,1712245882
731,14630,”Izjava EFPIA/Foruma o distribuciji cepiv proti COVID-19 “,” “,”
Čeprav podrobnosti predloga Komisije o mehanizmu za zagotavljanje transparentnosti izvoza cepiv proti COVID-19, proizvedenih v EU, ostajajo nejasne, je zelo pomembno, da ukrepi, ki jih bo predlagala Komisija, ne omejijo in nimajo drugih negativnih vplivov na izvoz cepiv ali uvoz ključnih surovin za izdelavo cepiv. To je pomembno predvsem z vidika globalnih verig za dobavo cepiv državljanom Evrope in drugih držav po svetu.
Razumemo nejevoljo, ki jo je vzbudilo nedavno poročanje glede zmanjšanja količine cepiv proti COVID-19, ki se dobavljajo v Evropsko unijo. COVID-19 vpliva na vse nas in tako kot marsikje drugod po Evropi še vedno preštevamo uničujočo človeško in gospodarsko ceno te pandemije. Vsi skupaj si želimo v najkrajšem možnem času dobaviti varna in učinkovita cepiva kar največ ljudem.
Priča smo, kako milijoni Evropejcev dobivajo cepiva le 12 mesecev po prvem odkritju COVID-19, kar je neverjeten skupni znanstveni, proizvodni in logistični dosežek, ki vključuje institucije EU, vlade, zdravstvene sisteme, regulatorje in farmacevtsko industrijo, ki temelji na raziskavah. V EU je bilo dobavljenih več kot 7 milijonov odmerkov cepiva od prve odobritve cepiva proti COVID-19 pri Evropski agenciji za zdravila pred dobrim mesecem.
Proizvodnja milijard odmerkov za državljane v Evropi in po svetu je izziv brez primere, ki vključuje številne partnerje, ki brez prestanka delajo, ne da bi kadarkoli ogrozili kakovost ali varnost cepiv. Nihanja v oskrbi z odmerki, pa čeprav moteča, so posledica proizvodnje zapletenih bioloških produktov. Farmacevtski strokovnjaki in znanstveniki delajo dan in noč, da bi rešili te izzive, povečali zmogljivost proizvodnih obratov in optimizirali procese za povečanje dobave. Delamo brez predaha, dokler cepiva proti COVID-19 ne dobavimo vsem, ki ga potrebujejo, in te pandemije dokončno ne ustavimo.
“,”Jaka Verbic Miklic”,1611908520,1611908520,sl,14630,306,14629,43,0,NULL,,”Izjava EFPIA/Foruma o distribuciji cepiv proti COVID-19 “,izjava-efpia-foruma-o-distribuciji-cepiv-proti-covid-19,Post,/sites/43/files/images/news/Covid-19/homepage-banner_500.jpg,1,0,1612167835,1612180245
733,14638,”Bolniki z redkimi boleznimi potrebujejo celostno podporo”,”Objavljamo prvi del članka o virtualni okrogli mizi na temo redkih bolezni”,”
Revija Medicina danes je, ob podpori Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, organizirala virtualno okroglo mizo na temo redkih bolezni, kjer so svoje izkušnje in poglede predstavili tako strokovnjaki, kot predstavniki (dobro) organiziranih društev bolnikov in posamezniki z redkimi boleznimi.
Na okrogli mizi so sodelovali prof. dr. Jože Faganel (Združenje za redke bolezni Slovenije), Tea Černigoj Pušnjak (Društvo distrofikov Slovenije), Kristina Modic (Slovensko združenje bolnikov z limfomom in levkemijo), dr. Irena Žnidar (Društvo bolnikov z Gaucherjevo boleznijo Slovenije), Polona Valentinčič (mamica otroka z redko boleznijo), Simon Petrovčič (bolnik z redko boleznijo), doc. dr. Blaž Koritnik (Nevrološka klinika, UKC Ljubljana), doc. dr. Urh Grošelj (Pediatrična klinika, UKC Ljubljana), prof. dr. Borut Peterlin (Klinični inštitut za genetiko, UKC Ljubljana), moderatorka je bila Vesna Tomaževič (urednica revije Medicina danes).
Bolniki z redkimi boleznimi se pogosto soočajo z dolgotrajnim diagnosticiranjem svoje bolezni, pri g. Petrovčiču, ki ima Marfanov sindrom, je to trajalo kar sedem let. Po postavitvi diagnoze se je dlje časa trudil ustanoviti društvo, vendar je ugotovil, da je ob tako malem številu bolnikov to praktično nemogoče. Tudi če bi uspeli ustanoviti društvo, pa s tako malim številom bolnikov, ne bi zmogli uresničiti zastavljenih ciljev. Gospod Petrovčič o svoji bolezni govori javno in v sodelovanju s strokovnjaki. “Nujno potrebno je, da bolniki sodelujemo z zdravniki,” je še povedal. Ob tem je izpostavil pomen koordinacije na državni ravni, ki je po njegovem mnenju pomanjkljiva: “Info točka bi morala biti odskočna deska za informacije o redkih boleznih.”
S tem se je strinjala tudi Polona Valentinčič, mamica otroka z izredno redko boleznijo. Tudi pri njem je trajalo več let, da je dobil diagnozo. Njegova bolezen sploh nima imena, kaj šele društva. V Sloveniji je namreč edini bolnik s to diagnozo, celo na celem svetu najdemo le nekaj takih bolnikov. Zato je tudi informacij o tej bolezni pri domačih strokovnjakih zelo malo. Sama se trudi pridobiti čim več informacij tudi iz tujine. “Potrebujemo ne samo info točko, ampak še kaj več. Nekoga, ki bi bil na razpolago in bi nas znal usmeriti. Brala sem o praksah na inštitutih za redke bolezni v tujini, kjer imajo tako bolniki kot njihove družine podporo strokovnjakov, kar pri nas manjka. Kar resnično potrebujemo, je podpora,” je poudarila.
Potrebne so spremembe v zdravstvenem sistemu
Doc. dr. Urh Grošelj je pojasnil, da trenutni zdravstveni sistemi tako doma kot v tujini niso zasnovani za obravnavo redkih in zelo redkih ter kompliciranih bolezni. Zadostne podpore nimajo ne bolniki in njihove družine, ne zdravniki. Info točka je po njegovem mnenju površinska zadeva, potrebovali bi strokovni panel v obliki centra za redke bolezni, da bi se lahko strokovnjaki zbrali okoli enega bolnika in ga celovito obravnavali. “Glede nacionalne info točke oz. nacionalne točke za redke bolezni moramo imeti realne predstave, kaj to sploh je. Gre za internetno stran, stičišče bolnikov, društev bolnikov in zdravstvenih delavcev ter organizacij, ki se s tem ukvarjajo. Namen je podati pregled tega, kaj se lahko na tem področju ponudi. Za kontaktno točko ni na voljo strokovnjakov, zelo malo je sploh zanimanja za delo na tem področju, hkrati pa na vprašanja težko odgovarja nekdo, ki ni subspecialist,” je poudaril in hkrati pohvalil prizadevanja svoje sodelavke doc. dr. Mojce Žerjav Tanšek, ki je gonilna sila in zaslužna, da ta točka sploh obstaja. “Potrebna je državna regulacija, brez tega ne gre. Ne moremo pričakovati, da bo sistem delal na podlagi dobre volje zdravnikov, ki se trudimo pomagati in tudi v prostem času raziskujemo ter iščemo odgovore. Menim pa, da se stvari konkretno premikajo na bolje. 10 let nazaj je bilo bistveno manj informacij, danes pa imamo pri nas modele uspešnih pristopov. V dveh, treh letih smo prišli iz podpovprečne situacije v svetovno špico,” je še povedal.
Tudi doc. dr. Blaž Koritnik se je strinjal, da je potrebna celovita obravnava bolnika in poudaril, da se takšen način dela trudijo organizirati tudi pri odraslih: “Za bolezni, kjer nam je vsaj začetna obravnava uspela na takšen način, se je izkazalo kot zelo uspešno. Pomembno je, da bi imeli model centralne koordinacije obravnave bolnikov. Vsak bolnik z redko boleznijo bi moral imeti svojega koordinatorja zdravnika ali medicinsko sestro, ki bi priskočil na pomoč pri različnih težavah in ga znal pravilno usmeriti.” Povedal je še, da zdravstveni sistem ni organiziran za time strokovnjakov, ki so potrebni za obravnavo bolnika z redko boleznijo, ki ima težave z različnih področij: “Se pa trudimo takšen način dela- vzpostaviti.”
V prihodnjih dneh bomo objavili še drugi del zapisa o pogovoru na virtualni okrogli mizi, slednjega pa si lahko v celoti ogledate tudi na povezavi: https://www.youtube.com/watch?v=qRwOsg-U4ME&feature=emb_title
“,”Jaka Verbic Miklic”,1613971800,1613971800,sl,14638,306,14637,43,0,NULL,,”Bolniki z redkimi boleznimi potrebujejo celostno podporo”,bolniki-z-redkimi-boleznimi-potrebujejo-celostno-podporo,Post,/sites/43/files/images/news/ali-resnicno-poznamo-potrebe-ljudi-z-redkimi-boleznimi.jpg,1,0,1613971906,1613971961
734,14640,”Dejstva o cepljenju: Cepljenje proti covidu-19 priporočljivo onkološkim bolnikom, ki niso na aktivnem zdravljenju”,”Cepljenje proti covid-19 se zagotovo priporoča onkološkim bolnikom, ki niso na aktivnem onkološkem zdravljenju”,”
Ljubljana, 5. januarja – Na Onkološkem inštitutu Ljubljana so za STA navedli, da se cepljenje proti covid-19 zagotovo priporoča onkološkim bolnikom, ki niso na aktivnem onkološkem zdravljenju. Pri tisti, ki se aktivno zdravijo, zlasti s kemoterapijo ali imunoterapijo, pa je potrebna individualna presoja, zato naj se posvetujejo z osebnim zdravnikom in lečečim onkologom.
Na Onkološkem inštitutu Ljubljana so za STA pojasnili, da je glede na razpoložljivo literaturo mRNK cepivo, na tej tehnologiji temelji za zdaj edino registrirano cepivo v EU proti covidu-19, to je cepivo Pfizerja in BioNTecha, učinkovito in varno, cepljenje proti covidu-19 se tako priporoča za onkološke bolnike. “Zagotovo cepljenje priporočamo pri onkoloških bolnikih, ki niso na aktivnem onkološkem zdravljenju. Pri njih v raziskavah niso zaznali nobenih posebnih zapletov,” navajajo. Glede onkoloških bolnikov, ki so na aktivnem onkološkem zdravljenju, na sistemskem zdravljenju ali obsevanju, nimajo dostopnih podatkov, saj v raziskave niso bili vključeni. Vendar pa glede na empirično znanje ne predvidevajo drugačne učinkovitosti ali varnosti cepiva pri onkoloških bolnikih na hormonskem zdravljenju ali obsevanju v primerjavi z drugimi kroničnimi bolniki. Zato se tem bolnikom cepljenje načeloma priporoča, so dodali. Pri bolnikih, ki prejemajo kemoterapijo ali imunoterapijo, pa obstaja predvsem vprašanje učinkovitosti in tudi varnosti cepiva. “Pri teh bolnikih je potrebna skrbna individualna presoja o smiselnosti cepljenja, upoštevajoč vrsto kemoterapije ali imunoterapije, kot tudi splošno stanje bolnika, zato tem bolnikom svetujemo, da se posvetujejo z osebnim zdravnikom in lečečim onkologom,” so še dodali.
p>
“,”Jaka Verbic Miklic”,1609825380,1609825380,sl,14640,306,14639,43,0,NULL,,”Dejstva o cepljenju: Cepljenje proti covidu-19 priporočljivo onkološkim bolnikom, ki niso na aktivnem zdravljenju”,dejstva-o-cepljenju-cepljenje-proti-covidu-19-priporocljivo-onkoloskim-bolnikom-ki-niso-na-aktivnem-zdravljenju,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1613972684,1613973971
735,14643,”Zdravniška stroka prebivalcem priporočila cepljenje proti koronavirusu”,”Le enotni in solidarni bomo kolikor mogoče hitro obvladali epidemijo in spet omogočili življenje brez epidemijskih omejitev”,”
Ljubljana, 13. januarja – Zdravniške organizacije, medicinski fakulteti in komisija za medicinsko etiko prebivalcem priporočajo, da se odločijo za cepljenje proti covidu-19, če jim zdravstveno stanje to dopušča. “Le enotni in solidarni bomo kolikor mogoče hitro obvladali epidemijo in spet omogočili življenje brez epidemijskih omejitev,” so zapisali.
Poudarili so, da do sedaj opravljenih cepljenj niso spremljali pomembni stranski učinki. To kaže, da je korist cepljenja večja od morebitnih tveganj. Cepiva so pripravljena na podlagi izjemnega napredka biomedicine in biotehnologije, so zapisali v izjavi za javnost.
“Nesmiselno in nepotrebno je, da bi se v epidemiji, ki traja že toliko časa, odrekali cepljenju, ki je učinkovit način preprečevanja bolezni,” so zapisali. Spomnili so, da se je v preteklosti s cepljenji, ki sodijo med največje dosežke medicine, obvladalo epidemije nalezljivih bolezni, ki so pred tem, tudi po naših krajih, množično morile otroke in odrasle.
“S cepljenjem lahko zaščitimo pred boleznijo sebe in tiste, ki jih epidemija najbolj ogroža, zmanjšamo število umrlih in omogočimo povratek življenja, kakršnega smo bili vajeni,” so zapisali.
Poudarili so, da je odločitev za cepljenje osebna pravica vsakogar. “A več kot nas bo cepljenih, manjša bo moč covida-19 in ko bo cepljenih dovolj, bo epidemija zaustavljena. Lepo in prav je, da se s cepljenjem v svoje dobro in dobro drugih poenotimo v prizadevanjih za njeno obvladanje in da vsak od nas k temu prispeva svoj delež,” so sporočili.
Izjavo so podpisali v Zdravniški zbornici Slovenije, Slovenskem zdravniškem društvu, Slovenski medicinski akademiji, na medicinskih fakultetah v Ljubljani in Mariboru ter v komisiji za medicinsko etiko.
“,”Jaka Verbic Miklic”,1610517300,1610517300,sl,14643,306,14642,43,0,NULL,,”Zdravniška stroka prebivalcem priporočila cepljenje proti koronavirusu”,zdravniska-stroka-prebivalcem-priporocila-cepljenje-proti-koronavirusu,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1613973399,1613973959
736,14645,”Pod vodstvom slovenskih raziskovalcev odkrili molekule za pomoč pri zdravljenju okužb s super odpornimi bakterijami”,”Odkritje bo v pomoč tudi pri razvoju učinkovitejših zdravil.”,”
Ljubljana, 19. januarja – Mednarodna skupina raziskovalcev, ki sta jo vodila Marko Anderluh z ljubljanske fakultete za farmacijo in Nikola Minovski s Kemijskega inštituta, je sintetizirala molekule, ki pomenijo preboj pri zdravljenju okužb s super odpornimi bakterijami, so sporočilu s fakultete. Odkritje bo v pomoč tudi pri razvoju učinkovitejših zdravil.
Skupina je hkrati prvič dokazala mehanizem delovanja teh novih molekul. Kot so navedli v sporočilu za javnost, je odpornost mikrobov na zdravila eden glavnih globalnih problemov 21. stoletja, ki ga Svetovna zdravstvena organizacija umešča med deset največjih groženj javnemu zdravju. Pojav in širjenje patogenov, odpornih na zdravila, namreč ogroža sposobnost zdravljenja pogostih okužb. Novo odkritje bo pomagalo pri razvoju učinkovitejših protimikrobnih zdravil.
“Glavni dosežek raziskovalcev je razvoj novih bakterijskih zaviralcev topoizomeraze tipa II (NBTI) z inovativnim delom molekule. Dobljene molekule, ki so jih patentno zaščitili, imajo izjemno močno protibakterijsko delovanje, saj še učinkoviteje zavirajo deljenje bakterijskih celic,” so zapisali v sporočilu.
Dodali so, da lahko nove molekule k uspešnejšemu zdravljenju bakterijskih okužb pripomorejo tudi zato, ker delujejo tudi na odporne bakterijske seve, ki jih z obstoječimi protibakterijskimi učinkovinami težko zdravimo.
Dodana vrednost odkritja je dokaz obstoja posebnih halogenskih vezi v biološkem okolju, kakršni so bili po navedbah vodje raziskave Marka Anderluha doslej dokazani le na kristalnih modelih majhnih molekul, ne pa tudi v bioloških makromolekulah.
V raziskavi, ki je trajala štiri leta, so sodelovali štirje znanstveniki iz Slovenije in šest iz Združenega kraljestva. Raziskovalni članek na to temo je bil 8. januarja objavljen v ugledni reviji Nature Communications.
“,”Jaka Verbic Miklic”,1611036180,1611036180,sl,14645,306,14644,43,0,NULL,,”Pod vodstvom slovenskih raziskovalcev odkrili molekule za pomoč pri zdravljenju okužb s super odpornimi bakterijami”,pod-vodstvom-slovenskih-raziskovalcev-odkrili-molekule-za-pomoc-pri-zdravljenju-okuzb-s-super-odpornimi-bakterijami,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1613973909,1613973945
737,14647,”Zdravstveni dom za študente v Ljubljani poziva k cepljenju proti virusu HPV”,”Gre za najpogostejšo spolno prenosljivo okužbo in v želji po boljši zaščiti mladih bodo v zdravstvenem domu za študente organizirali sedmi cepilni dan”,”
Ljubljana, 23. januarja – Zdravstveni dom za študente ljubljanske univerze poziva mlade k cepljenju proti humanim papilomavirusom (HPV). Gre za najpogostejšo spolno prenosljivo okužbo in v želji po boljši zaščiti mladih bodo v zdravstvenem domu za študente organizirali sedmi cepilni dan, ki bo potekal v sredo, 3. februarja, so sporočili iz zdravstvenega doma.
Okužba z virusom HPV je najpogostejša spolno prenosljiva okužba, s katero se večina spolno aktivnih ljudi okuži vsaj enkrat v življenju. Najpogostejša je pri mladostnikih in mladih odraslih, starih od 15 do 25 let.
Okužba je največkrat prehodna in mine brez večjih posledic, v nekaterih primerih pa je dolgotrajna in lahko povzroči nastanek genitalnih bradavic, predrakavih in rakavih sprememb materničnega vratu, zunanjega spolovila in zadnjika ter ustno-žrelnega prostora pri obeh spolih.
Na brezplačno cepljenje zato v zdravstvenem domu vabijo študentke zamudnice, torej rojene 1998 in mlajše, ki še niso bile cepljene, ter samoplačniško vse ostale ženske in moške, ki se želijo zaščititi pred okužbo s HPV. Cepljenje bo 3. februarja od 10. do 19. ure potekalo v Zdravstvenem domu za študente na Aškerčevi 4 v Ljubljani. Študenti se morajo za cepljenje obvezno predhodno naročiti do 2. februarja spletni strani zdravstvenega doma.
Cepilni dan je namenjen vsem, ki se še nikoli niso cepili in bi se proti okužbi z virusom HPV radi cepili prvič, pa tudi tistim, ki so že prejeli katerega izmed odmerkov ter želijo opraviti cepljenje z drugim oziroma tretjim odmerkom. Za dosego dolgoročne zaščite proti virusu HPV je namreč treba izvršiti celotno predpisano shemo cepljenja.
Učinkovita zaščita pred boleznimi zaradi okužbe s HPV je cepljenje tako deklic kot dečkov, najbolje pred začetkom spolne aktivnosti. Za dekleta v 6. razredu osnovne šole je cepljenje proti HPV priporočeno in brezplačno v okviru nacionalnega programa cepljenja. Tista dekleta, ki so cepljenje v 6. razredu zamudila in so rojena 1998 ali pozneje, se lahko brezplačno cepijo pri svojem izbranem zdravniku.
Cepljenje proti HPV je priporočljivo tudi za fante in moške ter starejša dekleta in ženske, vendar pa je zanje samoplačniško. Cepljenje se zlasti priporoča ženskam, ki so že imele predrakave spremembe ali raka zaradi okužbe s HPV, so še zapisali v zdravstvenem domu.
“,”Jaka Verbic Miklic”,1611382080,1611382080,sl,14647,306,14646,43,0,NULL,,”Zdravstveni dom za študente v Ljubljani poziva k cepljenju proti virusu HPV”,zdravstveni-dom-za-studente-v-ljubljani-poziva-k-cepljenju-proti-virusu-hpv,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1613974192,1613974192
738,14649,”Danes obeležujemo dan brez cigarete”,”Razširjenost kajenja se po podatkih v Sloveniji sicer zmanjšuje, vseeno pa Nacionalni inštitut za javno zdravje (NIJZ) kadilce spodbuja k opustitvi kajenja”,”
Ljubljana, 31. januarja – Danes je dan brez cigarete, ki je priložnost in spodbuda za opustitev kajenja. Razširjenost kajenja se po podatkih v Sloveniji sicer zmanjšuje, vseeno pa Nacionalni inštitut za javno zdravje (NIJZ) kadilce spodbuja k opustitvi kajenja, saj ta prinese številne koristi za zdravje v vseh starostnih obdobjih, sploh pa v času epidemije covida-19.
Kajenje tobaka škoduje tako rekoč vsem organom v telesu in škodljivo vpliva na zdravje skozi celotno življenje. Povzroča številne vrste raka, bolezni dihal, bolezni srca in ožilja ter vpliva na številne druge bolezni, denimo na sladkorno bolezen in revmatoidni artritis.
Še posebej problematično je kajenje nosečnic, saj je povezano z nizko porodno težo otroka, prezgodnjim porodom, zmanjšanjem pljučnih funkcij pri otroku in razcepljeno ustnico in/ali nebom ter nenadno smrtjo dojenčka, opozarjajo pri Zbornici zdravstvene in babiške nege Slovenije – Zveza strokovnih društev medicinskih sester, babic in zdravstvenih tehnikov Slovenije (Zbornica – Zveza).
“Čimprejšnja opustitev kajenja pomembno izboljša zdravje in podaljša življenjsko dobo. Gre za težek proces, vendar je opustitev kajenja koristna za zdravje v kateremkoli starostnem obdobju. Pozitivni učinki opustitve se poznajo že kmalu po zadnji cigareti,” je dejala predsednica Sekcije medicinskih sester in zdravstvenih tehnikov v pulmologiji pri Zbornici – Zvezi Maruša Ahačič.
Opuščanje kajenja je še posebej pomembno v času epidemije covida-19. “Kajenje je dejavnik tveganja za okužbe na splošno, še posebej za okužbe dihal. Kadilci imajo pogosteje težji potek bolezni covid-19, še posebej so ogroženi bolniki s kronično obstruktivno pljučno boleznijo, ki je posledica kajenja. Zmanjšanje stopnje kajenja lahko vpliva tudi na zmanjšano obremenitev zdravstvenega sistema zaradi drugih stanj, povezanih s kajenjem, ki zahtevajo zdravstveno obravnavo in hospitalizacijo,” sta povedali Mihaela Zidarn in Saša Kadivec iz Univerzitetne klinike za pljučne bolezni in alergijo Golnik.
Mnogi posamezniki težko prenehajo s kajenjem, še posebej, če poskušajo nehati sami, brez pomoči. Vsem kadilcem, ki želijo opustiti kajenje, priporočajo, da se vključijo v programe za opuščanje kajenja, ki so v Sloveniji brezplačno na voljo. Na brezplačnem svetovalnem telefonu za opuščanje kajenja 080 27 77 lahko vsakdo pridobi potrebne informacije oziroma se dogovori za pomoč. Telefon deluje vsak dan, tudi med vikendi in prazniki, med 7. in 10. uro ter med 17. in 20. uro, so sporočili z NIJZ.
K brezplačnemu vodenemu skupinskemu opuščanju kajenja ob tej priliki vabi tudi Slovenska zveza za javno zdravje, okolje in tobačno kontrolo (SZOTK). “V facebook kampanji “OPUSTI IN ZMAGAJ” bodo vsi udeleženci na isti dan pričeli z vodenim opuščanjem kajenja. Kampanjo bo v zaprti skupini koordiniral moderator, v njen pa bodo sodelovali tudi strokovnjaki s področja opuščanja kajenja in zdravstveni delavci,” je povedala Neža Polh, strokovna sodelavka SZOTK.
Na NIJZ ugotavljajo, da narašča uporaba različnih novejših izdelkov z nikotinom. “Različni izdelki z nikotinom, kot so elektronske cigarete ali novi tobačni izdelki, v katerih se tobak segreva, niso pripomočki za opuščanje kajenja. Zato jih ne priporočamo oziroma jih povsem odsvetujemo, saj vzdržujejo zasvojenost z nikotinom in imajo škodljive učinke na zdravje,” je povedal Tomaž Čakš iz NIJZ.
Naj dan brez kajenja postane življenje brez kajenja, še dodajajo v NIJZ.
“,”Jaka Verbic Miklic”,1612073760,1612073760,sl,14649,306,14648,43,0,NULL,,”Danes obeležujemo dan brez cigarete”,danes-obelezujemo-dan-brez-cigarete,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1613974660,1613974660
739,14651,”Z akcijo 50 milijonov korakov za epilepsijo do ozaveščanja o tej nevrološki motnji”,”Pred mednarodnim dnevom epilepsije, ki ga obeležujemo 8. februarja”,”
Ljubljana, 4. februarja – Pred mednarodnim dnevom epilepsije, ki ga obeležujemo 8. februarja, se je danes začela mednarodna akcija 50 milijonov korakov za epilepsijo. Ta je namenjena ozaveščanju o epilepsiji in pridobivanju sredstev za organizacije, ki se ukvarjajo s to nevrološko motnjo.
Kot so zapisali na spletnih straneh društva Liga proti epilepsiji Slovenije, bodo vsi sodelujoči v akciji prispevali k ozaveščanju in pridobivanju sredstev, ki jih organizacije za ljudi z epilepsijo potrebujejo. V akciji je mogoče sodelovati tako, da posamezniki prehodijo kar največ korakov, ki jih nato vpišejo na spleti strani Mednarodnega urada za epilepsijo. Cilj akcije je zbrati 50 milijonov korakov, kolikor je po svetu ljudi z epilepsijo.
Akcija traja od danes do 8. februarja, ko obeležujemo mednarodni dan epilepsije.
Epilepsija je motnja v delovanju možganov, za katero je značilna stalna nagnjenost k ponavljajočim se epileptičnim napadom. Je ena najpogostejših nevroloških bolezni. V Sloveniji naj bi bilo okoli 15.000 bolnikov z epilepsijo, vsako leto pa na novo zboli približno 1000 ljudi.
Najpogostejša je v otroški in mladostniški dobi ter v starosti, v to obdobje sodi približno četrtina vseh na novo odkritih epilepsij. Pri starejših ljudeh je epilepsija tretja najpogostejša nevrološka bolezen, za demenco in možgansko kapjo. Zaradi trenda staranja prebivalstva se bo delež starostnikov z epilepsijo v prihodnje še povečeval, opozarjajo v Ligi za epilepsijo Slovenije.
“,”Jaka Verbic Miklic”,1612419600,1612419600,sl,14651,306,14650,43,0,NULL,,”Z akcijo 50 milijonov korakov za epilepsijo do ozaveščanja o tej nevrološki motnji”,z-akcijo-50-milijonov-korakov-za-epilepsijo-do-ozavescanja-o-tej-nevroloski-motnji,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1613974889,1613974889
740,14653,”Slovenski raziskovalec s člankom v prestižni reviji Science Translational Medicine”,”Ugledna znanstvena revija Science Translational Medicine je objavila članek slovenskega biologa Simona Sedeja o uspehu mednarodne raziskovalne skupine pod njegovim vodstvom”,”
Ljubljana, 12. februarja – Ugledna znanstvena revija Science Translational Medicine je objavila članek slovenskega biologa Simona Sedeja o uspehu mednarodne raziskovalne skupine pod njegovim vodstvom, ki je dokazala, da naravna sestavina nikotinamid ščiti pred najpogostejšo starostno obliko srčnega popuščanja.
Mednarodna raziskovalna skupina 44 raziskovalk in raziskovalcev iz 21 univerz in inštitutov iz šestih evropskih držav pod vodstvom Sedeja s Kliničnega oddelka za kardiologijo medicinske univerze v Gradcu je na treh različnih živalskih modelih pokazala pozitivne učinke nikotinamida na srčno popuščanje z ohranjeno krčljivostjo srčne mišice, ki je najpogostejši vzrok za sprejem starejših ljudi v bolnišnico.
Kot so v skupnem sporočilu za javnost zapisali na Medicinski fakulteti Univerze v Mariboru in Medicinski Univerzi v Gradcu, kjer je Sedej trenutno izredni profesor fiziologije srca, tako imenovano diastolično srčno popuščanje zmanjšuje kakovost življenja in v kombinaciji z zvišanim arterijskim tlakom in debelostjo predstavlja enega najpogostejših vzrokov umrljivosti starajočega se prebivalstva v zahodnem svetu.
Raziskovalna skupina pa je pri starajočih se miših in podganah s povišanim arterijskim tlakom ali metabolnim sindromom dokazala, da je dodajanje nikotinamida pitni vodi zvečalo raztegljivost srca in diastolično relaksacijo, medtem ko se je zadebelitev sten zmanjšala.
To pomeni, da se lahko srce med posameznimi utripi boljše sprosti in ponovno napolni s krvjo. Pri podganah, ki so imele zaradi metabolnega sindroma zvišan arterijski tlak, se je ta ob dodajanju nikotinamida znižal.
Skupina je uspela pokazati tudi, da ljudje, ki uživajo veliko z niacinom bogate hrane, kot so pšenični kalčki, gobe, grah in ostale stročnice, sojin fižol, tuna in med drugim oreščki, redkeje umirajo zaradi bolezni srca in imajo nižji arterijski tlak.
“,”Jaka Verbic Miklic”,1613111340,1613111340,sl,14653,306,14652,43,0,NULL,,”Slovenski raziskovalec s člankom v prestižni reviji Science Translational Medicine”,slovenski-raziskovalec-s-clankom-v-prestizni-reviji-science-translational-medicine,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1613975437,1613975437
741,14655,”V Mariboru na znanstveni konferenci o naprednih znanjih v zdravstveni negi”,”Udeleženci konference so ocenili, da medicinske sestre z naprednimi znanji z dopolnitvijo ali razširitvijo kompetenc lahko nudijo strokovno in kakovostno obravnavo bolnikov.”,”
Maribor, 18. februarja – Mariborska fakulteta za zdravstvene vede je danes pripravila spletno mednarodno znanstveno konferenco o naprednih znanjih v zdravstveni negi. Udeleženci konference so ocenili, da medicinske sestre z naprednimi znanji z dopolnitvijo ali razširitvijo kompetenc lahko nudijo strokovno in kakovostno obravnavo bolnikov.
Prav tako medicinske sestre s takšnimi znanji prispevajo k boljši učinkovitosti, zmanjševanju stroškov, zadovoljstvu bolnikov, zmanjšanju hospitalizacij in smrtnosti, so sporočili z Univerze v Mariboru.
Mariborska fakulteta za zdravstvene vede je pripravila prvi model za izobraževanje medicinskih sester za pridobivanje naprednih znanj v zdravstveni negi, na magistrskem študijskem programu druge stopnje zdravstvena nega. Prvi v Sloveniji so tako pripravili tri študijske smeri: Integrirana obravnava kroničnih bolnikov v napredni zdravstveni negi, Integrirana obravnava starejših v napredni zdravstveni negi in Mentalno zdravje v napredni praksi zdravstvene nege. Prvo od študijskih smeri, to je Integrirana obravnava kroničnih bolnikov v napredni zdravstveni negi, pa so že pričeli izvajati v tem akademskem letu.
Državni sekretar na ministrstvu za izobraževanje, znanost in šport Mitja Slavinec je na konferenci pohvalil omenjeno fakulteto za pripravo novih študijskih smeri z večjim številom ur praktičnega -kliničnega izobraževanja. Dejal je, da bo tovrstno izobraževanje zagotovilo nujno potreben profil za slovensko zdravstvo, saj se je podobno izkazalo v zahodnoevropskih državah, Veliki Britaniji in ZDA.
“Nove študijske smeri bodo izjemno pomembne tudi za postcovidno stanje v Sloveniji in svetu. Novi profil medicinskih sester bo zahteval medresorsko usklajevanje ministrstva za zdravje in ministrstva za izobraževanje, znanost in šport, saj bo potrebna umestitev poklica v praksi oz. plačnem sistemu,” je še izpostavil Slavinec.
Izvršna direktorica zbornice zdravstvene in babiške nege Anita Prelec se je strinjala s Slavincem in dodala, da bo treba veliko narediti za promocijo novega profila medicinskih sester, predvsem pri bolnikih in zdravnikih. Njihove kompetence bo treba jasno opredeliti, pravi Prelčeva.
Po besedah generalne direktorice direktorata za javno zdravje na ministrstvu za zdravje Vesne Kerstin Petrič ima Slovenija dolgo tradicijo močnega lika medicinske sestre, zdravstvena nega v Sloveniji pa je bila vedno predstavljena kot primer dobre prakse. “Današnja konferenca, okrogla miza in delo fakultete za zdravstvene vede je uvod v nekaj novega in dobrega za slovensko zdravstvo in bolnike,” je ocenila.
Za dekanico Fakultete za zdravstvene vede Maribor Majdo Pajnkihar novi profil izobraženih medicinskih sester na magistrski stopnji izobraževanja prinaša velike spremembe v vlogah in razširjenih kompetencah medicinskih sester pri obravnavi bolnikov v zdravstvu. Verjetno bo najtežje po njenem mnenju razumeti in sprejeti nove profile medicinskih sester ter medicinskim sestram podati potrebno veljavo in priznanje, v našem še nekako tradicionalnem modelu zdravstva.
“Medicinske sestre so pomemben član širšega zdravstvenega in multidisciplinarnega tima pri celostni obravnavi bolnikov za zdravje in njihovo dobro počutje,” je še dejala Pajnkiharjeva.
Namen konference pa je bil približati izobraževanje medicinskih sester z naprednimi znanji ter predvsem napredno prakso zdravstvene nege akademskemu in kliničnemu okolju ter odločevalcem v vladnih in drugih poklicnih skupinah v Sloveniji.
“,,1613630280,1613630280,sl,14655,306,14654,43,0,NULL,”V Mariboru na znanstveni konferenci o naprednih znanjih v zdravs”,”V Mariboru na znanstveni konferenci o naprednih znanjih v zdravstveni negi”,v-mariboru-na-znanstveni-konferenci-o-naprednih-znanjih-v-zdravstveni-negi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1613975840,1613975905
742,14657,”Društva so lahko bolnikom z redkimi boleznimi v veliko pomoč”,”Objavljamo drugi del članka o virtualni okrogli mizi na temo redkih bolezni”,”
Bolniki z redkimi boleznimi se pogosto povezujejo v društva, da si medsebojno pomagajo in svetujejo, hkrati pa se kot društva povezujejo s strokovnjaki. Nenazadnje so bolniki, ki so povezani in organizirani, glasnejši in tako lažje pridobijo pozornost odgovornih institucij, da skupaj najdejo rešitve in odgovore na težave, ki pestijo posameznike. Prvi del povzetka okrogle mize na temo redkih bolezni lahko preberete na tej povezavi.
Dr. Irena Žnidar iz Društva bolnikov z Gaucherjevo boleznijo Slovenije je poudarila, da imajo društva pomembno vlogo, saj so bolniki lahko drug drugemu v oporo: “Naš glavni namen je povezati bolnike in jim biti v pomoč pri morebitnih težavah. Spremljamo novosti na področju, o njih obveščamo bolnike in zdravnike, srečanja so priložnost za spoznavanje in izmenjavo izkušenj tako med bolniki kot tudi s stroko,” je poudarila. Pomembna funkcija društev je tudi opozarjanje pristojnih državnih institucij na morebitne težave. Trenutno se soočajo z ukinitvijo terapije na domu zaradi ukrepov, povezanih s covidom-19 in se dogovarjajo za sestanek z odgovornimi, da bi našli skupno rešitev.
Da je pri tovrstnih nalogah pomembna tudi velikost društva, sta se strinjali tako dr. Žnidar kot Kristina Modic iz Slovenskega združenje bolnikov z limfomom in levkemijo, ki šteje preko 600 članov: “Bolniki smo skupaj precej močnejši in glasnejši. Naše društvo ima 13-letno zgodovino in v tem času smo uspeli za bolnike ob močni podpori stroke narediti veliko: “Nimamo izkušenj, da bi ostali pred zaprtimi vrati, da ne bi prišli do sestankov s predstavniki državnih institucij,” je povedala Modiceva. Tudi ona je poudarila, potrebo po nacionalni info točki, centru za redke bolezni, ki bi bilo stičišče za bolnike z redkimi boleznimi, ki nimajo svojih društev. “Mislim, da bi bolnikom in svojcem zelo pomagalo, da bi imeli info točko, ki bi nudila psihosocialno in pravno pomoč, usmeritev, kam se obrniti po informacije. Celovita podpora v smislu takšne točke bi morala biti organizirana in financirana s strani države. Verjetno bi to moral biti tim strokovnjakov, ki bi jim bila to primarna služba,” je poudarila.
Na drugi strani pa si prof. dr. Jože Faganel iz Združenje za redke bolezni Slovenije ne predstavlja splošne info točke ali centra za redke bolezni, ker različne bolezni potrebujejo različne strokovnjake. “CSD je točka za pomoč glede pridobivanja finančnih pomoči,” je povedal, hkrati pa vse bolnike z redkimi bolniki spodbudil, da se vključijo v društva ali pa jih ustanovijo. “Center za vse bolezni ni mogoč. Centri so specifični in bolj kot so specifični, lažje pomagajo. Pomembno je, da pediater ali osebni zdravnik ve, kam bolnika usmeriti,” je poudaril.
Tea Černigoj Pušnjak iz Društva distrofikov Slovenije pravi, da lahko društva predvsem svetujejo svojim članom. “V našem društvu so bolniki s približno 20 različnimi redkimi obolenji, vsi posamezniki, ki imajo katerokoli izmed živčno-mišičnih obolenj, spadajo pod naše društvo. Moj predlog je, da se bolniki s podobnimi značilnostmi združijo in si pomagajo med seboj. Si nudijo podporo, ki je zelo pomembna, enako tudi izmenjava mnenj in dobrih praks. Se medsebojno opolnomočimo,” je še poudarila.
Nacionalni načrt za redke bolezni
Nazadnje je spregovoril še prof. dr. Borut Peterlin, ki v okviru Ministrstva za zdravje aktivno sodeluje pri snovanju novega desetletnega nacionalnega načrta dela na področju redkih bolezni (Načrt). Povedal je, da imajo podobne izzive vsi bolniki z redkimi boleznimi, ne samo v majhni državi, kot je Slovenija, ampak tudi v velikih državah. “Politika se zaveda težav bolnikov z redkimi boleznimi.
Evropska skupnost je pred desetimi leti naložila državam članicam, da morajo pripraviti načrte za bolnike z redkimi boleznimi, ker se zavedajo, da obstaja primanjkljaj na področju zdravstvene in socialne oskrbe. V tem času smo razvili kar nekaj mehanizmov, med drugim mehanizem evropskih referenčnih mrež, ki se posvečajo temu področju. Slovenija direktno ali indirektno preko vozlišča, tu sodeluje.”
Prof. Peterlin je poudaril pomen izobraževanja zdravstvenih delavcev s področja redkih bolezni, ki ga predvideva tudi prihajajoči Načrt: “V Sloveniji moramo oblikovati sistemske rešitve za redke bolezni. Info točka je že po naravi “personalizirana”, konkretnemu bolniku ali svojcu skuša pomagati kam se obrniti, ne more pa rešiti težav, če sistemsko ni poskrbljeno za odgovor.” Poudaril je tudi pomen društev bolnikov “Niso strokovnjaki medicine tisti, ki bodo reševali politike na področju sociale. Pomembno je, da se še bolj sliši glas bolnikov in njihovih potreb. Pomembno je najti sredstva, da se Načrt uresniči. Ureditev ne more temeljiti na prostovoljnem delu, potrebne so sistemske rešitve,” je zaključil.
Ob zaključku je gospa Vesna Tomaževič poudarila potrebo po nadaljnjih pogovorih in izrazila upanje, da so v novem Načrtu, ki je v pripravi, ustrezno naslovljene tudi potrebe bolnikov.
“,”Jaka Verbic Miklic”,1614328260,1614328260,sl,14657,306,14656,43,0,NULL,,”Društva so lahko bolnikom z redkimi boleznimi v veliko pomoč”,drustva-so-lahko-bolnikom-z-redkimi-boleznimi-v-veliko-pomoc,Post,/sites/43/files/images/news/ali-resnicno-poznamo-potrebe-ljudi-z-redkimi-boleznimi.jpg,1,0,1614328429,1634560003
743,14659,”Za napredek je potrebna zaščita in promocija intelektualne lastnine”,”Povzetek konference o digitalizaciji in intelektualni lastnini “,”
V okviru portugalskega predsedovanja Svetu EU je potekala konferenca na temo pomena intelektualne lastnine – “High Level Conference on Intellectual Property”, kjer so govorci razpravljali o prihodnosti (digitalnih) inovacij in s tem povezanimi vprašanji o intelektualni lastnini (IP oz. Intellectual Property).
Pospeševanje in spodbujanje digitalnega razvoja preko sistema intelektualne lastnine je edinstvena priložnost ne le za spodbujanje gospodarstva, temveč tudi za ustvarjanje ugodnejšega ozračja za močnejšo in učinkovitejšo inovacijsko sfero, tudi na področju farmacevtske panoge. Evolucijski tehnološki in inovacijski proces vodi do tega, da mora intelektualna lastnina ustvariti pogoje tako za sam razvoj, kot za lansiranje izdelkov na trg. Dogodek je organiziral Portugalski inštitut za industrijsko lastnino (Portuguese Institute of Industrial Property, INPI), s podporo Evropske komisije, Urada Evropske unije za intelektualno lastnino (EUIPO), Evropske patentne organizacije (EPO) in Svetovne organizacije za intelektualno lastnino (WIPO).
V uvodnem nagovoru na konferenci je predsednik EPO poudaril, da imajo inovacije in intelektualna lastnina osrednjo vlogo v boju proti pandemiji in evropskemu gospodarskemu okrevanju. Poudaril je potrebo po podpori izumiteljem in podjetjem, ki jim bodo pomagali pri uvajanju novih tehnologij na trg in sicer tako, da bodo prejemali visokokakovostne pravočasne patente in da bodo opremljeni z znanjem in orodji za učinkovito uporabo patentov in intelektualne lastnine.
Poudaril je tudi pomen napredka pri enotnem evropskem patentu, katerega cilj je zagotoviti stroškovno učinkovito patentno zaščito in večjo pravno varnost v državah članicah EU. To je še posebej pomembno za zaščito evropskih inovativnih podjetij.
Predsednica INPI, Ana Bandeira, je poudarila, da mora digitalna preobrazba, ki bo ključno gonilo gospodarskega okrevanja, imeti enak tempo sprememb in prilagajanja kot tehnološka in komercialna revolucija. “V tem primeru vrednost neopredmetenih sredstev presega vrednost opredmetenih sredstev,” je dejala.
Cilj konference je bil ozaveščanje o koristih zaščite pravic industrijske lastnine in promocija inovativnih rešitev s posebnim poudarkom na zelenih tehnologijah in umetni inteligenci.
“,”Jaka Verbic Miklic”,1614583860,1614583860,sl,14659,306,14658,43,0,NULL,,”Za napredek je potrebna zaščita in promocija intelektualne lastnine”,za-napredek-je-potrebna-zascita-in-promocija-intelektualne-lastnine,Post,”/sites/43/files/images/news/Klinicene studije/Klinicne studije_img.jpg”,1,0,1614583928,1614584005
744,14663,”Spletni pogovor “Evropa in Slovenija v boju proti raku””,”STA je pripravila spletni pogovor z naslovom “Evropa in Slovenija v boju proti raku.””,”
Evropska komisija je v želji po skupnem pristopu k obvladovanju raka, ki predstavlja drugi najpogostejši vzrok smrti v državah EU, februarja predstavila Evropski načrt za boj proti raku, ki rešitvam za trajnostno obvladovanje raka namenja štiri milijarde evrov. Načrt začrtuje nov in celosten pristop k preprečevanju, zdravljenju in oskrbi raka, v izhodišče pa postavlja nove tehnologije, raziskave in inovacije. Pogovor je tekel o tem, kako bomo ta načrt implementirali v Sloveniji, katere sistemske spremembe moramo v Sloveniji najprej nasloviti, da bomo lahko uvajali nove, tudi digitalne zdravstvene rešitve, kakšno je meddržavno sodelovanje med onkologi.
“,”Jaka Verbic Miklic”,1614846840,1614846840,sl,14663,306,14662,43,0,NULL,,”Spletni pogovor “Evropa in Slovenija v boju proti raku””,spletni-pogovor-evropa-in-slovenija-v-boju-proti-raku,Post,”/sites/43/files/images/news/Cancer patients/cancer-cells-3.jpg”,1,0,1614846923,1614847068
745,14665,”Evropska industrija je preplet tradicije in inovacij “,”Povzetek konference Evropski dnevi industrije 2021″,”
Evropski dnevi industrije so vodilni letni evropski dogodek, ki služi kot glavna platforma za razpravo o industrijskih izzivih in sooblikovanju priložnosti ter političnih odzivov v vključujočem dialogu s številnimi partnerji. Dogodek prav tako pomaga zagotoviti, da industrijska politika na evropski, nacionalni, regionalni in lokalni ravni sodeluje v smeri zagotovitve rasti delovnih mest in inovacij širom celotne Evrope.
Evropski dnevi industrije 2021 so potekali od 23. do 26. februarja v popolnoma digitalni obliki. V uvodnem nagovoru je predsednica Evropske komisije, Ursula von der Leyen, izpostavila pomembnost evropske industrije in poudarila, da je le-ta “svet starih tradicij in nenehnih inovacij. Je tisto, zaradi česar je Evropa vodilna v svetu na različnih področjih. Od avtomobilizma do agroživilstva in od farmacije do mode. Po vsem svetu izraz „made in Europe“ pomeni vrhunsko kakovost.” Poudarila je tudi, da je Evropa vodilna na svetu pri zelenih inovacijah.
Pandemija covida-19 je pretresla celoten svet in hkrati izpostavila pomen konkurenčnosti evropske industrije, pri kateri so ključen element zelene tehnologije, kot je poudarila tudi predsednica Evropske komisije. Razvoj in integracija zelenih rešitev v industriji bo Evropi omogočila, da postane izhodišče za zeleni prehod po vsem svetu, hkrati pa bo zagotovila, da bodo zaveze usklajene tudi s konkurenčnostjo.
Pogovori na letošnjih evropskih dneh industrije so bili usmerjeni v prihodnost in priložnosti. Med hitro spreminjajočo se svetovno konkurenčno krajino evropska industrijska strategija ustvarja prostor za zeleno preobrazbo in zagotavlja orodja za podporo industrijskim ekosistemom ter posledično krepitvi globalne konkurenčnosti in zagotavljanju delovnih mest. Ključno je, da Evropa izkoristi lastne vire in znanja, hkrati pa ohranja trdna partnerstva z drugimi velesilami.
“,”Jaka Verbic Miklic”,1615186680,1615186680,sl,14665,306,14664,43,0,NULL,,”Evropska industrija je preplet tradicije in inovacij “,evropska-industrija-je-preplet-tradicije-in-inovacij,Post,”/sites/43/files/images/news/Inovativnost potrebuje regulatorno podporo/Farmaforum_ Inovativnost potrebuje regulatorno podporo.jpg”,1,0,1615186752,1615186752
747,14671,”Na Vrhniki znova mobilna enota programa Dora”,”Na Vrhniko se je ta teden po dveh letih vrnila mobilna enota presejalnega programa za raka dojk Dora.”,”
Ljubljana, 19. februarja – Na Vrhniko se je ta teden po dveh letih vrnila mobilna enota presejalnega programa za raka dojk Dora. Na preventivno mamografijo bodo povabili okoli 6000 žensk med 50. in 69. letom iz občin Vrhnika, Borovnica, Dobrova-Polhov Gradec, Horjul, Log-Dragomer in Logatec. Slikanje bo potekalo vse do konca poletja, so sporočili iz programa Dora.
Vabilo ženske prejmejo dva do tri tedne pred terminom presejalne mamografije. V programu Dora jih pozivajo, naj se mamografije udeležijo, če so zdrave in nimajo znakov prehladnih obolenj oziroma okužbe z novim koronavirusom. Če vabila niso prejele, pa se lahko na mamografijo naročijo tudi same.
Mobilna enota programa Dora, ki bo delovala na parkirišču za Cankarjevim domom ob Tržaški cesti, se je na Vrhniko vrnila že petič. Pred dvema letoma, ko je bila tam nazadnje, se je preventivne mamografije udeležilo več kot 4500 žensk oziroma 78 odstotkov vseh povabljenih. Pri 105 so na mamografskih slikah ugotovili spremembe, zaradi katerih so jih povabili na dodatne obravnave v presejalno-diagnostični center programa Dora na Onkološkem inštitutu Ljubljana, ter pri 13 odkrili raka dojk.
Kot so navedli v sporočilu za javnost, je po besedah vodje programa Dora Kristijane Hertl odziv žensk, ki prihajajo na slikanje v mobilno enoto na Vrhniko, eden najvišjih v Sloveniji. “Če raka dojk odkrijemo dovolj zgodaj, ko je še majhen in omejen na dojko, je zdravljenje lahko zelo uspešno in manj obsežno, kar vpliva na višjo kakovost življenja bolnic. Pri zgodaj odkritih rakih dojk je večje tudi preživetje,” pri tem opozarja Hertlova.
“,”Jaka Verbic Miklic”,1613731080,1613731080,sl,14671,306,14670,43,0,NULL,,”Na Vrhniki znova mobilna enota programa Dora”,na-vrhniki-znova-mobilna-enota-programa-dora,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1616150370,1616150767
750,14677,”Salvador postal prva srednjeameriška država brez malarije”,”Salvador je postal prva država v Srednji Ameriki brez malarije, so v četrtek sporočili iz Svetovne zdravstvene organizacije (WHO). “,”
Ženeva, 26. februarja – Salvador je postal prva država v Srednji Ameriki brez malarije, so v četrtek sporočili iz Svetovne zdravstvene organizacije (WHO). V državi že najmanj tri leta niso imeli lokalnega prenosa te tropske bolezni, poroča nemška tiskovna agencija dpa.
“Malarija že tisočletja otežuje življenja, ampak države kot so Salvador so živi dokaz in navdih za vse države, da lahko sanjamo o državi brez malarije,” je povedal generalni direktor WHO Tedros Adhanom Ghebreyesus.
Glavni prenašalci malarije so komarji. Bolezen povzroča vročino, anemijo in nevrološke težave. Letno poročajo o več kot 200 milijonov okuženih in okoli 40.000 mrtvih, od tega okoli dve tretjini otrok, ki so mlajši od pet let.
Salvador se je desetletja boril proti malariji in je za Paragvajem in Argentino tretja ameriška država od leta 2018, ki jo je WHO sedaj označil za državo brez malarije.
“,”Jaka Verbic Miklic”,1614334320,1614334320,sl,14677,306,14676,43,0,NULL,,”Salvador postal prva srednjeameriška država brez malarije”,salvador-postal-prva-srednjeameriska-drzava-brez-malarije,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1616321638,1616321638
751,14679,”Obeležujemo svetovni dan redkih bolezni”,”Danes obeležujemo svetovni dan redkih bolezni, ki so opredeljene kot bolezni, ki prizadenejo največ pet oseb na 10.000 prebivalcev.”,”
Ljubljana, 28. februarja – Danes obeležujemo svetovni dan redkih bolezni, ki so opredeljene kot bolezni, ki prizadenejo največ pet oseb na 10.000 prebivalcev. Gre namreč za raznoliko skupino bolezenskih stanj, ki imajo pogosto skupne značilnosti kroničnega, napredujočega, degenerativnega in včasih življenjsko ogrožajočega poteka, so zapisali na ministrstvu za zdravje.
Poznamo med 6000 in 8000 redkih bolezni, med katerimi za 95 odstotkov bolezni ni zdravila ali zdravljenja. 75 odstotkov redkih bolezni prizadene otroke, 30 odstotkov jih umre pred starostjo pet let. 80 odstotkov bolezni je genskega izvora, ostale pa so posledica bakterijskih ali virusnih okužb, alergij in vplivov iz okolja. Bolniki se soočajo s hudimi bolečinami, za njihove družine pa je bolezen psihosocialno zelo obremenjujoča. V Sloveniji po ocenah živi 120.000 oseb z redko boleznijo, kar predstavlja od šest do osem odstotkov prebivalstva, je objavljeno na spletni strani Nacionalne kontaktne točke za redke bolezni.
Ministrstvo za zdravje v sodelovanju z Združenjem za redke bolezni Slovenije v torek organizira Nacionalno konferenco ob dnevu redkih bolezni, ki je namenjena ključnim deležnikom v zdravstvu, obolelim z redkimi boleznimi in njihovim svojcem. Zaradi trenutnih razmer bo letos organizirana kot spletni dogodek.
Kot so zapisali v vabilu na nacionalno konferenco, se zavedajo, da so med skupnimi značilnostmi tovrstnih bolezni tudi globok psihosocialni vpliv na bolnike in njihove svojce ter včasih zahtevna zdravstvena obravnava. Ministrstvo je bilo tudi lani kljub pandemiji covida-19 aktivni na področju redkih bolezni.
Svetovni dan redkih bolezni obeležujemo 29. februarja, ki je redek dan, zato ga, kadar leto ni prestopno, obeležujemo 28. februarja. Razglasila ga je Evropska organizacija za redke bolezni Eurordis z namenom večanja zavesti o redkih boleznih in njihovi problematiki.
“,”Jaka Verbic Miklic”,1614507960,1614507960,sl,14679,306,14678,43,0,NULL,,” Obeležujemo svetovni dan redkih bolezni”,obelezujemo-svetovni-dan-redkih-bolezni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1616322470,1616322470
752,14681,”V ospredju letošnjega tedna boja proti raku obvladovanje raka s cepljenjem”,”V ospredju letošnjega slovenskega tedna boja proti raku, ki se začne v ponedeljek, bo obvladovanje raka s cepljenjem.”,”
Ljubljana, 28. februarja – V ospredju letošnjega slovenskega tedna boja proti raku, ki se začne v ponedeljek, bo obvladovanje raka s cepljenjem. V Zvezi slovenskih društev za boj proti raku poudarjajo, da v času pandemije covida-19 ne smemo dopustiti, da se negotovost prikrade na področja, ki jih znamo in zmoremo obvladovati. Med te pa zagotovo sodi tudi preventiva raka.
V zvezi spodbujajo posameznike k upoštevanju vseh 12 nasvetov Evropskega kodeksa proti raku, še posebej enajstega, ki svetuje cepljenje otrok proti hepatitisu B in virusu HPV.
Kot so pojasnili, lahko okužbam pripišemo približno 15 odstotkov vseh rakov v svetu, v razvitih predelih sveta pa okoli sedem odstotkov. “To spoznanje nam daje povsem nove možnosti preprečevanja raka s cepljenjem,” so zapisali na spletni strani zveze.
Po podatkih zveze je precepljenost proti hepatitisu B v Sloveniji okoli 80 odstotkov in se zmanjšuje, precepljenost proti HPV pa je okoli 60 odstotkov in se veča.
“Spodbujamo vse deležnike za podporo Sloveniji na poti k eliminaciji raka materničnega vratu in k doseganju ciljev Svetovne zdravstvene organizacije do leta 2030: vsaj 90-odstotna precepljenost deklic proti HPV, vsaj 70-odstotna udeležba žensk na presejalnem programu Zora in vsaj 90 odstotkov žensk s predrakavimi spremembami materničnega vratu ustrezno zdravljenih,” so zapisali.
Zadnja dva cilja že dosegamo, tudi prvi je dosegljiv, so poudarili. Po oceni zveze je povsem mogoče, da bo Slovenija med prvimi evropskimi državami, ki bo dosegla eliminacijo raka materničnega vratu.
Mednarodna agencija za raziskovanje raka pri Svetovni zdravstveni organizaciji sicer ocenjuje, da lahko z upoštevanjem 12 enostavnih priporočil Evropskega kodeksa proti raku preprečimo okoli 40 odstotkov vseh smrti zaradi raka, so izpostavili v zvezi.
Zveza slovenskih društev za boj proti raku bo v sodelovanju z Onkološkim inštitutom Ljubljana v prihodnjem tednu pripravila več dogodkov. Med drugim bodo na novinarski konferenci spregovorili o obvladovanju raka s cepljenjem, pripravljajo tudi dan odprtih vrat onkološkega inštituta s spletnim seminarjem za dijake.
V ponedeljek pa se začenja tudi mednarodni mesec ozaveščanja o rakih prebavil, skupino rakov, za katerimi vsako leto zboli okoli 2700, umre pa okoli 1900 ljudi. Zato v mednarodnem mesecu ozaveščanja o teh rakih v Združenju EuropaColon Slovenija spodbujajo k čim zgodnejšemu odkrivanju bolezni, saj prav zgodnje odkrivanje bistveno pripomore k daljšemu preživetju ter krajšemu in lažjemu zdravljenju, s tem pa tudi kakovostnejšemu življenju.
Med rake prebavil uvrščamo rake požiralnika, želodca, jeter, žolčnika in žolčevodov, trebušne slinavke ter debelega črevesa in danke. Pri odkrivanju raka debelega črevesa in danke ima zelo pomembno vlogo presejalni program Svit, poudarjajo v združenju. Zato tudi pozivajo vse državljane in državljanke, stare med 50 in 74 let, da se presejanja udeležujejo redno na dve leti.
Za druge rake prebavil za zdaj v Sloveniji še ni presejalnih programov, zato v združenju priporočajo samoopazovanje in takojšnjega obiska pri zdravniku, če pri sebi zaznamo znake kot je nepojasnjeno izgubljanje telesne teže, črno ali zelo svetlo in krvavo blato.
“,”Jaka Verbic Miklic”,1614508140,1614508140,sl,14681,306,14680,43,0,NULL,,”V ospredju letošnjega tedna boja proti raku obvladovanje raka s cepljenjem”,v-ospredju-letosnjega-tedna-boja-proti-raku-obvladovanje-raka-s-cepljenjem,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1616322635,1616322636
753,14683,”Začenja se teden boja proti raku in mesec ozaveščanja o rakih prebavil”,”Danes se začenja slovenski teden boja proti raku, ki bo letos potekal pod geslom Obvladovanje raka s cepljenjem.”,”
Ljubljana, 1. marca – Danes se začenja slovenski teden boja proti raku, ki bo letos potekal pod geslom Obvladovanje raka s cepljenjem. O tej temi bo danes tekla beseda na novinarski konferenci, ki jo pripravljata Zveza slovenskih društev za boj proti raku in Onkološki inštitut Ljubljana. Z današnjim dnem pa se začenja tudi mednarodni mesec ozaveščanja o rakih prebavil.
V zvezi društev za boj proti raku spodbujajo posameznike k upoštevanju vseh 12 nasvetov Evropskega kodeksa proti raku, še posebej enajstega, ki svetuje cepljenje otrok proti hepatitisu B in virusu HPV. Kot so pojasnili, lahko okužbam pripišemo približno 15 odstotkov vseh rakov v svetu, v razvitih predelih sveta pa okoli sedem odstotkov. “To spoznanje nam daje povsem nove možnosti preprečevanja raka s cepljenjem,” so zapisali na spletni strani zveze.
Virtualna novinarska konferenca se bo začela ob 11. uri na njej pa bodo sodelovali predsednica Zveze slovenskih društev za boj proti raku Urška Ivanuš, v. d. generalne direktorica Onkološkega inštituta Andreja Uštar, koordinator Državnega progama obvladovanja raka (DPOR) Branko Zakotnik, pediatrinja Andreja Borinc Beden, strokovna direktorica Onkološkega inštituta Irena Oblak in Katja Jarm iz vzgojno izobraževalne komisije Zveze slovenskih društev za boj proti raku.
V torek se bo ob 11. uri začel dan odprtih vrat Onkološkega inštituta Ljubljana za dijake, ki bo prav tako potekal v virtualni obliki. V sklopu dneva odprtih vrat bo preko platforme Zoom potekal seminar Imam moč – lahko preprečim raka. Strokovnjaki bodo na seminarju mladim predstavili to bolezen ter kako jo lahko preprečijo.
Zveza bo v sredo na slavnostni seji podelila priznanja in plakete zaslužnim sodelavcem. Obenem bodo podelili donacijo Ginekološki kliniki UKC Ljubljana v višini 15.000 evrov iz sredstev, zbranih v okviru dobrodelne novoletne akcije z namenom spodbujanja eliminacije raka materničnega vratu v Sloveniji. Sredstva bodo namenjena za nakup opreme sodobne video-kolposkopske ambulante za zgodnje odkrivanje pred/rakavih sprememb materničnega vratu.
V četrtek bodo regijska društva predstavila svoje delo v okoljih kjer delujejo, v petek pa bodo potekale različne aktivnosti po osnovnih in srednjih šolah, je zapisano na spletni strani zveze.
Danes pa se začenja tudi mednarodni mesec ozaveščanja o rakih prebavil, skupino rakov, za katerimi po podatkih Združenja EuropaColon Slovenija vsako leto zboli okoli 2700, umre pa okoli 1900 ljudi. Zato v tem mesecu v združenju spodbujajo k čim zgodnejšemu odkrivanju bolezni, saj prav to bistveno pripomore k daljšemu preživetju ter krajšemu in lažjemu zdravljenju, s tem pa tudi kakovostnejšemu življenju, so sporočili iz združenja.
V združenju tudi spodbujajo vse Slovenke in Slovence starejše od 50 let, da se redno udeležujejo presejalnega programa Svit. Ta ima namreč zelo pomembno vlogo pri odkrivanju raka debelega črevesa in danke, najpogostejšega med raki prebavil, so še zapisali.
“,”Jaka Verbic Miklic”,1614594900,1614594900,sl,14683,306,14682,43,0,NULL,,”Začenja se teden boja proti raku in mesec ozaveščanja o rakih prebavil”,zacenja-se-teden-boja-proti-raku-in-mesec-ozavescanja-o-rakih-prebavil,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1616322981,1616323229
754,14685,”Varuh opozarja na težave, s katerimi se v zdravstvenem sistemu soočajo bolniki z rakom in drugimi težkimi boleznimi”,”Boleča resničnost, ki jo bolniki z rakom in drugimi težkimi boleznimi izkušajo iz dneva v dan, zahteva celovito zdravstveno reformo”,”
Ljubljana, 3. marca – Boleča resničnost, ki jo bolniki z rakom in drugimi težkimi boleznimi izkušajo iz dneva v dan, zahteva celovito zdravstveno reformo, ki bo zagotovila dostopne, kakovostne in varne programe preprečevanja bolezni, zdravljenja in rehabilitacije, je ob slovenskem tednu boja proti raku izpostavil varuh človekovih pravic Peter Svetina.
Kot so zapisali pri varuhu, je Svetina danes nagovoril udeležence na spletni slavnostni seji zveze in regijskih društev za boj proti raku. Poudaril je, da si je težko predstavljati, s kakšnimi sistemskimi ovirami se sreča človek, ki resno zboli. “Kot da že diagnoza težke in nepredvidljive bolezni za njih ne bi bila dovolj stresna, se morajo soočati še z dolgimi čakalnimi vrstami, pomanjkanjem zdravnikov in neenakopravnim dostopom do zdravstvenih storitev,” je dejal varuh.
Pandemija koronavirusne bolezni je po njegovih besedah še bolj razgalila številne težave slovenskega zdravstva, “ki smo jih do zdaj ponekod bolj, drugod manj uspešno obvladovali”. Spomnil je, da pri varuhu pogosto poudarjajo, da imamo v Sloveniji kakovosten in izobražen zdravstveni kader, a žal ne tako dobro urejen zdravstveni sistem.
Ob tem je varuh izpostavil, da se nanj obračajo tudi onkološki bolniki in njihovi svojci. Obravnavali so primer bolnika z rakom, ki je po pošti dobil obvestilo, da je ostal brez osebnega zdravnika, ker se je njegov zdravnik upokojil. Poskušal je najti novega, vendar v njegovem zdravstvenem domu nihče ni sprejemal novih bolnikov. Kot opozarja varuh, gre za bolnika s težko boleznijo, ki zdravnika v takih razmerah še bolj potrebuje za potrebe spremljanja diagnoze, izdaje receptov za zdravila, napotovanja na preglede, itd.
“Obrnili smo se na ministrstvo za zdravje in predlagali, da čim prej poišče začasne oziroma premostitvene rešitve, saj taki bolniki ne morejo čakati več let, da bo število zdravnikov družinske medicine skladno s potrebami,” je pojasnil varuh. Se pa po njegovih besedah zavedajo, da težava oziroma okoliščine pomanjkanja zdravnikov družinske medicine niso nastale čez noč in da obstoječega problema ni možno rešiti v kratkem času.
Varuh tako poudarja, da predvsem potrebujemo spremembe v smeri, da bo zagotovljeno dostopno zdravstveno varstvo vsem skupinam prebivalstva. Napoveduje, da bo institucija varuha človekovih pravic še naprej bdela nad tem.
“,”Jaka Verbic Miklic”,1614768180,1614768180,sl,14685,306,14684,43,0,NULL,,”Varuh opozarja na težave, s katerimi se v zdravstvenem sistemu soočajo bolniki z rakom in drugimi težkimi boleznimi”,varuh-opozarja-na-tezave-s-katerimi-se-v-zdravstvenem-sistemu-soocajo-bolniki-z-rakom-in-drugimi-tezkimi-boleznimi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1616323447,1616323448
755,14687,”Svetovni dan ledvic v znamenju ozaveščanja o pomenu in preprečevanju ledvičnih bolezni”,”Cilj letošnje teme Dobro živeti z ledvično boleznijo je povečati znanja in ozaveščenost bolnikov o učinkovitem zdravljenju in obvladovanju simptomov”,”
Ljubljana, 11. marca – Danes obeležujemo svetovni dan ledvic. Cilj letošnje teme Dobro živeti z ledvično boleznijo je povečati znanja in ozaveščenost bolnikov o učinkovitem zdravljenju in obvladovanju simptomov, predvsem pa opolnomočiti bolnike, da bi lažje dosegali cilje, ki so jim pomembni, so sporočili iz Slovenskega nefrološkega društva.
Kronična ledvična bolezen večinoma nastane zaradi nezdravega načina življenja. Z zgodnjim odkrivanjem se lahko upočasni ali zaustavi napredovanje bolezni in prepreči nastanek ledvične odpovedi, hkrati pa se tudi ohrani zdravo srce. Ocenjujejo, da je v Sloveniji več kot 150.000 odraslih ljudi, ki se spopadajo s to boleznijo.
Cilj obvladovanja in zdravljenja ledvičnih bolezni ni samo podaljšati življenjsko dobo z ohranjanjem ali nadomeščanjem delovanja ledvic in zmanjševanjem težav zaradi napredovanja ledvične bolezni. Bolniki si predvsem želijo, da bi lahko živeli dobro, ohranili svojo vlogo in vključenost v družbo, hkrati pa imeli občutek nadzora nad svojim zdravjem in počutjem.
Dobro poznavanje svoje bolezni in sodelovanje pri zdravljenju za doseganje želenih ciljev oz. opolnomočenje bolnikov je zato po mnenju društva pomembno tako za bolnike kot za njihove svojce.
“Tega se dobro zavedamo tudi v Sloveniji, kjer je edukacija ledvičnih bolnikov že dolgo prepoznana kot pomembna in ključni del obravnave, ki omogoča večjo kakovost bivanja, boljši izid bolezni in ustrezno izbiro nadomestnega zdravljenja, če pride do odpovedi ledvic,” so zapisali.
Podpora bolnikov z ledvično boleznijo, tudi tistih, ki so odvisni od dialize ali po presaditvi ledvice, in njihovih svojcev, je po navedbah društva izjemnega pomena. Vendar morajo bolniki postati partnerji tudi pri razvoju, izvajanju in vrednotenju zdravstvene politike, ki jim bo omogočala dobro življenje.
Za vpeljavo takšnega sistema obravnave je potreben vsestranski razvojno utemeljeni načrt, ki ga podpirajo zdravstveni delavci, strokovna združenja, raziskovalci, predvsem pa odločevalci zdravstvene politike, so še dodali v društvu.
Svetovni dan ledvic je globalna pobuda, v kateri od začetka leta 2006 sodeluje tudi Slovenija.
“,”Jaka Verbic Miklic”,1615461720,1615461720,sl,14687,306,14686,43,0,NULL,,”Svetovni dan ledvic v znamenju ozaveščanja o pomenu in preprečevanju ledvičnih bolezni”,svetovni-dan-ledvic-v-znamenju-ozavescanja-o-pomenu-in-preprecevanju-ledvicnih-bolezni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1616326675,1616326676
756,14689,”S pomočjo donatorjev do nakupa naprave za celično terapijo za hematološke bolnike”,”Slovensko združenje bolnikov z limfomom in levkemijo je s pomočjo donatorjev, posameznikov in podjetij v dobrem mesecu uspelo zbrati dovolj sredstev za nakup naprave za CAR-T”,”
Ljubljana, 11. marca – Slovensko združenje bolnikov z limfomom in levkemijo je s pomočjo donatorjev, posameznikov in podjetij v dobrem mesecu uspelo zbrati dovolj sredstev za nakup naprave za CAR-T celično terapijo na kliničnem oddelku za hematologijo UKC Ljubljana. Prve bolnike z najtežjimi oblikami krvnih rakov bi lahko s to napravo začeli zdraviti konec leta.
Kot je na današnji novinarski konferenci povedala predsednica združenja Kristina Modic, je odziv javnosti presegel vsa pričakovanja. Z donacijami so od 6. februarja do 11. marca uspeli zbrati skoraj okoli 700.000 evrov, cilj so presegli v sredo, ko je anonimni donator prispeval 100.000 evrov.
Prav tako se je javil donator, ki bo kupil še eno celotno napravo s pripadajočo opremo.
Edini proizvajalec naprave je v sredo zagotovil tudi nižjo ceno od prvotno predvidene. Za napravo s pripadajočo tehnično opremo bo združenje tako odštelo nekaj manj kot 534.000 evrov, namesto sprva predvidenih 613.000 evrov. S presežkom zbranih sredstev, ki trenutno znaša okoli 165.000 evrov, in donacijami, ki jih prek donatorski pogodb še pričakujejo, bodo poskušali zagotoviti še dodaten instrument, ki bo osrednji napravi omogočil izdelavo pripravkov za dve osebi hkrati.
Posebni transakcijski račun združenja, na katerem zbirajo donacijska sredstva, tako v prihodnjih dneh ostaja odprt, prav tako so še vedno mogoče donacije prek sms-sporočil.
Zbiranju sredstev se bodo z dražbo malih črnih oblek pridružili tudi na katedri za oblikovanje tekstilij in oblačil ljubljanske naravoslovnotehnične fakultete. Dražba bo na Facebook strani katedre potekala od 18. do 25. marca. Izkupiček bodo nakazali na račun združenja.
Združenje bo napravo pri zastopniku proizvajalca naročilo v petek in jo skladno s ponudbo prejelo v 12 do 14 tednih. Kot je napovedal predstojnik oddelka za hematologijo v Univerzitetnem kliničnem centru (UKC) Ljubljana Samo Zver, bodo prve bolnike s pomočjo te naprave začeli zdraviti konec leta, na leto bi lahko obravnavali med 20 do 30 bolnikov.
Na pomoč pri urejanju zadev za nakup naprave so jim priskočili tudi pri agenciji za zdravila in medicinske pripomočke, prav tako so po Zverovih besedah že začeli z urejanjem primernih prostorov za postavitev naprav. Ministrstvo za zdravje je zagotovilo kritje stroškov za postavitev naprav v prostor.
CAR-T celična terapija predstavlja nov način imunskega zdravljenja raka. Tako bolniku vzamejo imunske celice, ki jih s pomočjo virusov gensko spremenijo na način, da dobijo nove senzorje za vrsto raka, ki ga ima bolnik. Celice nato v aparatu namnožijo, nato pa jih aplicirajo v bolnika.
Novi senzorji imunskim celicam omogočijo, da prepoznajo raka, ki ga ima bolnik, poleg tega pa so imunske celice opremljene z mehanizmi, s katerimi limfociti potem bolj učinkovito najdejo in uničijo raka.
“,”Jaka Verbic Miklic”,1615462920,1615462920,sl,14689,306,14688,43,0,NULL,,”S pomočjo donatorjev do nakupa naprave za celično terapijo za hematološke bolnike”,s-pomocjo-donatorjev-do-nakupa-naprave-za-celicno-terapijo-za-hematoloske-bolnike,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1616327082,1616327082
757,14691,”Programi Zora, Dora in Svit tudi v epidemiji, pozivajo k udeležbi na presejalnih pregledih”,”S presejalnimi programi lahko odkrijejo raka ali predrakave spremembe, še preden se pojavijo simptomi ali znaki bolezni.”,”
Ljubljana, 11. marca – S presejalnimi programi lahko odkrijejo raka ali predrakave spremembe, še preden se pojavijo simptomi ali znaki bolezni. Zato je pomembno, da se na vabilo na pregled v teh programih odzovemo, kar velja tudi v času epidemije covida-19. Ta je sicer na začetku zavrla tudi izvajanje teh programov, a so v kasnejših mesecih zamude nadoknadili.
V Sloveniji delujejo trije presejalni programi za zgodnje odkrivanje raka: Zora (zgodnje odkrivanje predrakavih sprememb materničnega vratu), Dora (zgodnje odkrivanje raka dojk) in Svit (zgodnje odkrivanje predrakavih sprememb in zgodnejših oblik raka na debelem črevesu in danki). O njihovem pomenu pa so spregovorili na današnjem spletnem posvetu v organizaciji Triglav Laba.
Kot je dejala vodja programa Zora Urška Ivanuš, s presejalni programi, ki potekajo v asimptomatski, zdravi populaciji, lahko odkrijejo predrakave ali zgodnje rakave spremembe ter na ta način zmanjšajo število novih primerov raka, kot tudi umrljivost.
“O raku materničnega vratu vemo dovolj, da lahko preprečimo skoraj vsak nov primer tega raka. Ženske, ki hodijo na presejalne preglede, imajo kar 70 do 90 odstotkov manjšo verjetnost, da bodo kadarkoli zbolele za rakom materničnega vratu, prav tako ženske, ki so bile cepljene proti HPV še pred prvo okužbo. Ženske, ki so cepljene in se redno udeležujejo presejalnih pregledov, bodo izjemno, izjemno redko zbolevale,” je poudarila.
Cilj v vseh presejalnih programih je, da v določenem časovnem intervalu pregledajo vsaj 70 odstotkov vse ciljne skupine. Po besedah Ivanuševe je v programu Zora zaradi epidemije covida-19 prvič v 15 letih pregledanost v zadnji triletki padla tik pod 70 odstotkov, vendar se je konec leta že spet nekako dvignila na 70 odstotkov. “Nismo pa še na 72 odstotkih, kot smo bili, seveda pa si želimo še več,” je dejala. Ob tem pa je ženske pozvala, naj tudi v času epidemije ne zanemarijo skrbi za zdravje in se odzovejo vabilu na presejalni pregled.
V programu Dora je bila po besedah vodje programa Kristijane Hertl v lanskem letu, ki ga je zaznamoval covid-19, količina opravljenih mamografij minimalno manjša kot leto prej. In tudi število odkritih rakov je bilo le minimalno drugačno. Kot je pojasnila, so lani spomladi delo prekinili za dva meseca in pol. A so to zamudo zelo intenzivno poskušali nadoknadili v poletnih mesecih. “Lani praktično nismo imeli dopusta,” je dejala Hertlova in dodala, da so s tem nekako uspeli doseči normalno stanje.
Hertlova je pojasnila, da je v programu Dora sicer udeležba v povprečju 74-odstotna, na kar so zelo ponosni. Dora deluje 13 let, od leta 2018 po celi Sloveniji, v tem času pa so naredili skoraj 600.000 mamografij in odkrili precej preko 3000 rakov. “Če je rak odkrit v začetni fazi, ko je omejen samo na dojko, je potrebno zdravljenje manj obsežno, v največ primerih odstranitev cele dojke ni potrebna, manj obsežno je tudi sistemsko zdravljenje. Posledično je veliko hitrejše okrevanje, boljše preživetje in zmanjšanje umrljivosti,” je izpostavila.
Predstojnik kliničnega oddelka za gastroenterologijo v Univerzitetnem kliničnem centru Ljubljana Borut Štabuc, ki je predstavil Program Svit, je podobno poudaril, da sodelovanje v programu zmanjšuje zbolevnost za rakom debelega črevesa in danke, pa tudi umrljivost. Izboljšuje tudi kakovost življenja bolnikov, saj približno 40 odstotkov vseh rakov odkrijejo v zgodnji fazi, ko je mogoče le endoskopsko zdravljenje.
Po njegovih besedah je bil rak debelega črevesa in danke leta 2010 na drugem mestu po pojavnosti, leta 2017 že na petem mestu. Pomembno pa se je zmanjšalo tudi finančno breme zdravljenja raka debelega črevesa in danke.
Epidemije je v začetku vplivala tudi na njihovo delo. Med marcem in majem je bilo ustavljeno pošiljanje testnih kompletov, v začetku aprila 14 dni niso izvajali kolonoskopije in nanjo naročali. V nekaterih centrih so nato kolonoskopijo predvsem zaradi pomanjkanja zaščitne opreme izvajali v omejenem obsegu, a so od julija do novembra vse te kolonoskopije opravili in v decembru glede na epidemijo ni bilo čakalne dobe.
“,,1615463220,1615463160,sl,14691,306,14690,43,0,NULL,,”Programi Zora, Dora in Svit tudi v epidemiji, pozivajo k udeležbi na presejalnih pregledih”,programi-zora-dora-in-svit-tudi-v-epidemiji-pozivajo-k-udelezbi-na-presejalnih-pregledih,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1616327213,1616327267
758,14693,”Društvo za zdravje srca in ožilja ob dnevu žil poziva k zdravemu življenjskemu slogu”,”V Društvu za zdravje srca in ožilja Slovenije so ob današnjem evropskem dnevu žil pozvali k zdravemu življenjskemu slogu”,”
Ljubljana, 16. marca – V Društvu za zdravje srca in ožilja Slovenije so ob današnjem evropskem dnevu žil pozvali k zdravemu življenjskemu slogu, ki lahko bistveno zmanjša tveganja za nastanek srčno-žilnih bolezni. Prav tako so na današnji tiskovni konferenci pozvali, naj se ob težavah in simptomih kljub epidemiji ne odlaša z obiskom zdravnika.
Če je bil covid-19 pred dobrim letom “še na pol eksotična pljučnica”, smo to bolezen po besedah predstojnika kliničnega oddelka za žilne bolezni Univerzitetnega kliničnega centra (UKC) Ljubljana Aleša Blinca v tem času že dodobra spoznali. Novi koronavirus, ki povzroča covidno bolezen, v telo vstopi skozi dihala, od koder pa se zelo hitro razširi tudi v žile. Kot je pojasnil Blinc, ima notranji žilni sloj veliko receptorjev za virusne bodice in s tem vstopnih mest za virus. Pri hudih oblikah covida-19 ne gre samo za pljučnico, ampak tudi za vnetje žil.
Poleg tega izkušnje kažejo, da imajo covidni bolniki več tveganja za koronarne bolezni, možgansko kap in arterijske zaplete. “Deloma zato, ker so strdki pri covidu-19 večji in jih je težje raztopiti, deloma pa zato, ker je organizem splošno prizadet zaradi težkega poteka bolezni,” je naštel. Poleg tega imajo osebe, ki so covidno bolezen prebolele, povečano tveganje za nastanek žilnih bolezni.
Najpogosteje krvni strdki pri covidu-19 nastanejo na nožnih žilah, srcu in glavi, in sicer v nekaj primerih na 1000 bolnikov. Ob tem je Blinc komentiral tudi zaplete s strjevanjem krvi, ki so časovno sovpadali s cepljenjem proti covidu-19. Kot je dejal, je pojavnost tega zapleta nekaj primerov na milijon. Treba je narediti analizo posameznih primerov, a osebno bi ga presenetilo, če bi cepivo samo po sebi povzročalo krvne strdke, je dejal in dodal, da je cepljenje ključno, če se hočemo izviti iz primeža epidemije.
Rok Perme z oddelka za žilne bolezni UKC Ljubljana in Združenja za žilne bolezni pa je opozoril na periferno arterijsko bolezen, ki zaradi oblaganja in mašenja arterij prizadene predvsem spodnje okončine. Leta 2010 je bilo na svetu več kot 200 milijonov ljudi s to boleznijo in po ocenah prizadene od tri do deset odstotkov populacije. Glavni dejavniki tveganja za nastanek te bolezni so kajenje, sladkorna bolezen, povišan holesterol in starost, je naštel.
Bolezen se kaže z bolečinami v mišicah nog, predvsem v mečih. Pojavijo se po določeni prehojeni razdalji in po kratkem počitku povsem izzvenijo. V primeru, da so zamašitve arterij nog zelo obsežne, pa lahko pride do tako hudo okrnjene prekrvavitve, da se pojavijo rane na prstih in stopalih oz. se razvije gangrena, je opozoril Perme. Velik delež bolnikov s periferno arterijsko boleznijo je brez simptomov, a ne glede na to imajo zelo veliko tveganje za smrt zaradi srčno-žilnih vzrokov.
Bolezen se, kot je dejal Perme, k sreči diagnosticira enostavno in hitro v ambulanti družinskega zdravnika z določitvijo t.i. gleženjskega indeksa, ki je razmerje med vrednostjo krvnega tlaka v gležnju in na nadlakti. Prvi ukrep po postavitvi diagnoze je sprememba življenjskega sloga s prenehanjem kajenja, znižanjem telesnem mase, redno telesno aktivnostjo in uravnoteženo prehrano ter zmanjševanjem srčno-žilnega tveganja z zdravili. V hujših primerih pa prekrvavitev izboljšajo tudi z različnimi posegi.
Matija Cevc z oddelka za žilne bolezni in predsednik Društva za zdravje srca in ožilja Slovenije je ob tem opozoril, da kajenje, ki je pomemben nastanek tveganja za koronarno bolezen, še bistveno bolj škoduje pri periferni arterijski bolezni, prav tako sladkorna bolezen, starost in povišan krvni tlak. Z izjemo starosti je značilno, da nanje vpliva življenjski slog, zato Cevc poziva k redni aerobni telesni dejavnost in uživanju mediteranske prehrane.
Ko nefarmakološki ukrepi ne zadoščajo, je potrebno tudi redno jemanje zdravil. Ob tem je izpostavil, da se na področju zdravljenja holesterola LDL v bližnji prihodnosti obeta novo zdravilo, ki se ga bo bo dajalo le vsakih šest mesecev in bi za 50 odstotkov znižalo raven holesterola LDL.
“,”Jaka Verbic Miklic”,1615895760,1615895760,sl,14693,306,14692,43,0,NULL,,”Društvo za zdravje srca in ožilja ob dnevu žil poziva k zdravemu življenjskemu slogu”,drustvo-za-zdravje-srca-in-ozilja-ob-dnevu-zil-poziva-k-zdravemu-zivljenjskemu-slogu,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1616327984,1616327985
759,14695,”Strokovnjaki o razvoju, nadzoru in neželenih učinkih cepiva proti covidu-19″,”Spletni pogovor z naslovom »Cepiva proti covidu-19 kot velik znanstveni dosežek«”,”
Ljubljana, 31. marca – Hiter razvoj cepiv proti covidu-19 temelji na večletnih raziskavah in poznavanju drugih podobnih virusov, pripomoglo je tudi obsežno financiranje področja, so danes pojasnili strokovnjaki v spletnem pogovoru STAkluba. Med drugim pričakujejo, da bodo do konca leta dovoljenje za uporabo dobila še tri cepiva, večajo se tudi proizvodne kapacitete.
Na številna vprašanja so odgovarjali priznani strokovnjaki:
– izr. prof. dr. Tomaž Bratkovič, predstojnik katedre za farmacevtsko biologijo na fakulteti za farmacijo,
– prof. dr. Roman Jerala, vodja odseka za sintezno biologijo in imunologijo na Kemijskem inštitutu,
– prof. dr. Alojz Ihan, dr. med., vodja Laboratorija za celično imunologijo (CEL) in oddelka za imunologijo ter predstojnik Katedre za mikrobiologijo in imunologijo na Inštitutu za mikrobiologijo in imunologijo Medicinske fakultete Univerze v Ljubljani.
– izr. prof. dr. Dragan Kesič, profesor za področje mednarodnega poslovanja na UP FM in strokovnjak za svetovno farmacevtsko industrijo.
V pogovoru smo med drugim izvedeli kako poteka razvoj cepiv, kakšne so razlike med cepivi, kako je mogoče, da je bilo cepivo proti covid-19 izdelano v manj kot letu dni, kako poteka odobritev cepiva v EU. Sogovorniki so podali še veliko drugih pomembnih in zanimivih informacij.
Pri razvoju cepiva proti covidu-19 so raziskovalci imeli že nekaj izkušenj s sarsom in mersom, ki sta podobna novemu koronavirusu, zato so hitro vedeli, kaj je tarča, na katero se s cepivom želijo osredotočiti, je uvodoma dejal vodja odseka za sintezno biologijo in imunologijo na Kemijskem inštitutu Roman Jerala.
K temu je pripomoglo tudi obsežno financiranje s strani vlad in organizacij, ki so finančno podprli razvoj cepiva, je ocenil predstojnik katedre za farmacevtsko biologijo na ljubljanski fakulteti za farmacijo Tomaž Bratkovič.
Da so cepiva tako hitro na trgu, je tudi posledica tega, da so farmacevtska podjetja prilagodila tempo testiranja, nekatere faze so na primer potekale deloma vzporedno. Še pred formalno odobritvijo so nekatera podjetja na lastno tveganje že vnaprej vzpostavila proizvodne procese, je opisal Bratkovič.
V EU imajo trenutno pogojno dovoljenje za promet štiri cepiva. To pomeni, da nobeno cepivo ni šlo skozi redne faze registracije in da imajo dovoljenje za uporabo samo za čas oklicane pandemije, je pojasnil profesor za področje mednarodnega poslovanja na primorski fakulteti za management in strokovnjak za svetovno farmacevtsko industrijo Dragan Kesič.
Pričakuje, da bodo do konca leta pogojno dovoljenje za promet dobila še tri cepiva. Najbližje postopku vložitve dokumentacije sta po po Kesičevih besedah proizvajalca cepiv Novavax in CureVac.
Bratkovič je izpostavil, da so farmacevtska podjetja še vedno zavezana k nadaljevanju spremljanja podatkov, npr. koliko časa po cepljenju traja imunost, ali je mogoče cepiti otroško populacijo in nosečnice.
V dokumentaciji, ki jo proizvajalci cepiv predložijo regulatorju, so navedeni pričakovani neželeni učinki, najpogostejši so glavobol, vročina in bolečina na mestu cepljenja, ki so posledica imunskega odziva, je pojasnil vodja laboratorija za celično imunologijo in oddelka za imunologijo Alojz Ihan.
Drugi neželeni učinki so tisti, ki v dokumentaciji niso navedeni kot pričakovani. Bili so tako redki, da se izognejo registracijski študiji, ki po pojasnilih Ihana ne more zaznati tistih, ki so manj pogosti kot eden na 50.000 ali 100.000, zlasti takih, ki so v populaciji razmeroma pogosti.
Kot je poudaril, neželeni učinki vedno vzbudijo pozornost, če se pojavijo v nekem časovnem oknu po cepljenju, sploh če za zelo resno obliko zapletov zbolijo mlajše osebe. “Vsekakor je to umestno čim prej raziskati, potem pa se seveda vsaka država po svoje odločil, ali je več škode, če se zaustavi cepljenje vsaj določenih populacij ali je več škode, če bi se cepljenje nadaljevalo,” je dejal.
Odločitve za prekinitev cepljenja s cepivom AstraZenece po oceni Ihana niso “neke zelo statistično utemeljene odločitve”, ampak so delno posledica javnega mnenja, v določeni meri gre po njegovem mnenju tudi za politično odločanje.
Jerala pa je poudaril, naj ljudje ne razmišljajo o “covid ruleti” oz. načrtni okužbi, saj je bolezen še vedno nevarna. Poleg tega so že na voljo cepiva in po njegovi oceni je realna verjetno, da vsi ogroženi cepivo dobijo v treh mesecih. Proizvodne kapacitete se povečujejo, zdržimo še nekaj mesecev, je pozval. “Prepričan sem, da bomo jeseni lahko bolj normalno zaživeli,” je še dodal.
Celoten posnetek pogovora si lahko ogledate na tej povezavi.
“,”Jaka Verbic Miklic”,1617220200,1617220200,sl,14695,306,14694,43,0,NULL,,”Strokovnjaki o razvoju, nadzoru in neželenih učinkih cepiva proti covidu-19″,strokovnjaki-o-razvoju-nadzoru-in-nezelenih-ucinkih-cepiva-proti-covidu-19,Post,/sites/43/files/images/news/Covid-19/homepage-banner_500.jpg,1,0,1617220465,1617892093
760,14701,”Pravičnejši in bolj zdrav svet “,”Na današnji dan obeležujemo svetovni dan zdravja”,”
Letošnji svetovni dan zdravja poteka pod geslom »Gradimo pravičnejši, bolj zdrav svet«, tudi na področju dostopa do zdravstvenih storitev, zdravil, cepiv in medicinskih pripomočkov je namreč v svetu veliko neenakosti.
Svetovna zdravstvena organizacija opozarja na neenakosti v zdravstvu po celem svetu, neenak pa je v razviti Evropski uniji tudi dostop bolnikov do novih zdravil, cepiv, medicinskih pripomočkov in oskrbe. Zato je ob svetovnem dnevu zdravju pomembno, da naslovimo tudi ta zdravstveni problem. Na področju EU je največja stopnja razpoložljivosti zdravil v državah Severne in Zahodne Evrope, najnižja pa v državah Južne in Vzhodne Evrope.
Zelo zaskrbljujoč je podatek, da se povprečna zakasnitev med dovoljenjem za promet in dostopom bolnikov do posameznega zdravila v Evropi lahko razlikuje za več kot šestkrat, pri čemer bolniki v Severni in Zahodni Evropi do novih zdravil dostopajo 100-350 dni po izdanem dovoljenju za promet, bolniki v Južni in Vzhodni Evropi pa med 600 in 850 dnevi po izdanem dovoljenju za promet.
Če pogledamo povprečen čas razpoložljivosti zdravil po izdanem dovoljenju za promet na primeru Slovenije in Nemčije, ponovno vidimo neenakosti. Leta 2018 je v Sloveniji po izdanem dovoljenju za promet do dostopa zdravila na trgu v povprečju preteklo 417 dni, leta 2019 pa kar 445 dni. Medtem pa je bil v Nemčiji povprečen čas skoraj štirikrat krajši, 119 dni v letu 2018 in 127 dni v letu 2019. Zato članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb (Forum) skupaj z Evropsko zvezo farmacevtske industrije in združenj (EFPIA) iščemo rešitve, ki bi pripomogle k odpravljanju teh neenakosti.
Posledice pandemije covida-19 na ljudi ter gospodarstvo so bolj kot kadarkoli prej poudarile pomen odkrivanja, razvoja in zagotavljanja dostopa do novih diagnostik, terapij in cepiv, da se lahko odzovemo na globalne zdravstvene izzive in izboljšamo dostopnost tako do zdravstvenih storitev, kot dostopnost do novih zdravil, cepiv, medicinskih pripomočkov v Sloveniji, EU in svetu.
“,”Jaka Verbic Miklic”,1617794880,1617794880,sl,14701,306,14700,43,0,NULL,,”Svetovni dan zdravja 2021 “,svetovni-dan-zdravja-2021,Post,”/sites/43/files/images/news/Farmacevtska strategija/Evropska komisija predstavila farmacevtsko strategijo.jpg”,1,0,1617881385,1617892163
761,14705,”Digitalizacija je pomembna”,”Za razvoj zdravstvenih sistemov je izredno pomembna njihova digitalizacija.”,”
Pandemija novega koronavirusa je v zadnjem letu le še poglobila zavedanje, da je digitalizacija eno izmed ključnih razvojnih področij tudi v zdravstvu. Odpira namreč potencial za večjo učinkovitost procesov, izboljšanje kakovosti storitev ter varnost bolnikov in je ob tem tudi stroškovno učinkovita.
Digitalizacija lahko v zdravstvene sisteme prinese mnogo prednosti in izboljšav, na primer hitrejši dostop do storitev za bolnike; zgodnejšo diagnostiko, zaznavo in preventivo bolezni; večjo vključenost bolnikov v postopke zdravljenja in zmanjšanje stroškov zdravljenja. Na področju zdravstvenih storitev govorijo strokovnjaki o “bolnišnici 4.0”, ki vključuje tri ključne komponente: digitalno zdravje, uporaba masovnih podatkov (ang. big data) in tehnologija 3D tiskanja.
Digitalno zdravje
Digitalno zdravje se nanaša na povezovanje medicinskega znanja z računalniškimi aplikacijami ali tehnologijami, namen pa je predvsem izboljšanje zdravstvene oskrbe in pregled nad stanjem bolnikov. Preko pametnega telefona je na primer omogočen uvid v različne informacije, kot so ali bolnik jemlje predpisana zdravila, spremljanje ključnih podatkov (pulz, krvni tlak, nasičenost s kisikom), prav tako pa je mogoče s telesno temperaturo in gibalnimi vzorci določiti, če je bolnik morebiti doma padel in se poškodoval. Za starejše osebe lahko to na primer pomeni, da dlje časa bivajo v lastnem domu, zmanjšuje potrebo po nepotrebnih sprejemih v bolnišnico in spodbuja preventivo.
Masovni podatki
Strukturirano upravljanje z masovnimi podatki omogoča pridobivanje informacij, ki so pomembne za sprejemanje odločitev. To lahko nato v najkrajšem možnem času ustvari ciljno usmerjeno znanje, ki ga lahko uporabimo za bolj informirano odločanje in reševanje težav. Uporaba tovrstnih podatkov v zdravstvu lahko izboljša natančnost diagnostike, skrajša čas med postavljeno diagnozo in začetkom zdravljenja ter omogoči bolj informirano terapevtsko odločanje – vse to pa je za bolnike ključnega pomena. Prednosti uporabe podatkov se že kažejo predvsem na področju diagnostike in zdravljenja tumorjev, odpirajo pa tudi veliko možnosti na področju bolnikom prilagojene obravnave, ki je lahko brez uporabe le-teh zgolj delno izkoriščena.
3D tiskanje
3D tiskalnik je naprava za ustvarjanje tridimenzionalnih izdelkov (modelov, teles, organov). Gre za računalniško voden proces izdelave iz tekočih ali trdnih materialov (sintetični materiali, sintetične smole, keramika, kovine). 3D tehnologija omogoča razvoj zapletenih oblik, tovrstni modeli pa so v medicini posebej uporabni za natančno razumevanje anatomskih posebnosti posameznega bolnika z namenom priprave na zapletene operacije. Izdelava modela (npr. srca, kolka, arterije) poteka na podlagi MRT (magnetna resonančna tomografija) in CT (računalniška tomografija) podatkov, ki se s pomočjo posebne programske opreme pretvorijo v 3D model in nato izdelajo s 3D tiskalnikom. To na primer omogoča izdelavo po meri narejenih in individualiziranih srčnih zaklopk, čeljusti, kolčnih vsadkov itn.
Bolnišnica 4.0 poleg naštetega omogoča tudi izmenjavo kliničnih in administrativnih podatkov v realnem času, olajša nadzor, nabavo in logistiko ter nenazadnje izboljšave na področju finančnega poslovanja, zato je razvoj v to smer zagotovo pomemben za prihodnost zdravstvenih sistemov.
Povzeto po članku The Future is Digital v HealthManagement.org The Journal, 2020
“,”Jaka Verbic Miklic”,1618397100,1618397100,sl,14705,306,14704,43,0,NULL,,”Digitalizacija je pomembna”,digitalizacija-je-pomembna,Post,”/sites/43/files/images/news/Inovativnost potrebuje regulatorno podporo/Farmaforum_ Inovativnost potrebuje regulatorno podporo.jpg”,1,0,1618742790,1618742898
762,14707,”Pravilnik o spremembah Pravilnika o oblikovnaju cen za uporabo v humani medicini 21/03/2021″,” “,”
P R A V I L N I K
o spremembah in dopolnitvah Pravilnika o določanju cen zdravil za uporabo v humani medicini
1. člen
V Pravilniku o določanju cen zdravil za uporabo v humani medicini (Uradni list RS, št. 32/15, 15/16, 19/18, 11/19 in 26/20) se v 2. členu:
‒ v napovednem stavku v oklepaju za besedilom »17/14« doda besedilo »in 66/19«;
‒ v 1. točki druga, tretja in četrta alineja spremenijo tako, da se glasijo:
»– imetnik dovoljenja za vnos oziroma uvoz zdravil za zdravilo, ki nima dovoljenja za promet in je razvrščeno v seznam esencialnih ali nujno potrebnih zdravil na podlagi zakona;
– imetnik začasnega dovoljenja za promet z zdravilom, ki nima dovoljenja za promet;
– imetnik dovoljenja za promet s paralelno uvoženim zdravilom;«.
V 13. točki se za besedilom »v koledarskem letu,« doda besedilo »ki jih imetnik iz 1. točke proda drugi pravni osebi in je«.
V 14. točki se v prvi alineji besedilo »Direktivo 2012/26/EU Evropskega parlamenta in Sveta z dne 25. oktobra 2012 o spremembi Direktive 2001/83/ES, kar zadeva farmakovigilanco (UL L št. 299 z dne 27. 10. 2012, str. 1)« nadomesti z besedilom »Uredbo (EU) 2019/1243 Evropskega parlamenta in Sveta z dne 20. junija 2019 o prilagoditvi več zakonodajnih aktov, v katerih je določena uporaba regulativnega postopka s pregledom, členoma 290 in 291 Pogodbe o delovanju Evropske unije (UL L št. 198 z dne 25. 7. 2019, str. 241)«, druga alineja pa se črta.
2. člen
Besedilo 3. člena se spremeni tako, da se glasi:
»(1) Izrazi, uporabljeni v tem pravilniku, pomenijo:
1. Generično zdravilo je zdravilo, ki je ne glede na vrsto postopka pridobilo dovoljenje za promet v skladu s:
– prvim odstavkom 45. člena zakona oziroma prvim odstavkom 10. člena Direktive 2001/83/ES,
– 52. členom zakona oziroma 16.a členom Direktive 2001/83/ES,
– šestim odstavkom 45. člena zakona oziroma tretjim odstavkom 10. člena Direktive 2001/83/ES,
– 47. členom zakona oziroma 10.a členom Direktive 2001/83/ES ali
– 50. členom zakona oziroma 10.c členom Direktive 2001/83/ES po izteku podatkovne zaščite originalnega zdravila pri čemer zavezanec ne izkazuje dokazil o originalnem izvoru zdravila.
2. Podobno biološko zdravilo je zdravilo, ki je pridobilo dovoljenje za promet v skladu s sedmim odstavkom 45. člena zakona oziroma četrtim odstavkom 10. člena Direktive 2001/83/ES in ustreza opredelitvi izraza iz 58. točke 6. člena zakona.
(2) Izrazi iz prejšnjega odstavka se smiselno uporabljajo tudi za zdravila, ki so financirana iz javnih sredstev oziroma so namenjena za financiranje iz javnih sredstev in v Republiki Sloveniji nimajo dovoljenja za promet, imajo pa:
Uradni list Republike Slovenije Št. 51 / 2. 4. 2021 / Stran 2981
– začasno dovoljenje za promet z zdravilom ali dovoljenje za vnos oziroma uvoz zdravil za zdravilo, ki nima dovoljenja za promet in je razvrščeno v seznam esencialnih ali nujno potrebnih zdravil na podlagi zakona,
– dovoljenje za promet s paralelno uvoženim zdravilom ali
– potrdilo o prejemu obvestila o paralelni distribuciji zdravil na podlagi 118. člena zakona.«.
3. člen
V 11. členu se v petem odstavku druga alineja spremeni tako, da se glasi:
»– za Francijo se cene preračunajo tako, da se uporabljata Enačba 2 in Tabela 1, ki sta v Prilogi 2 tega pravilnika, razen v primeru uporabe cenovnega standarda UCD, ki predstavlja neposredno primerjalno ceno;«.
4. člen
V 12. členu se tretji odstavek spremeni tako, da se glasi:
»(3) Vrednost PEC podobnega biološkega zdravila se ugotovi na podlagi cen vseh podobnih bioloških zdravil v primerjalnih državah na naslednji način:
– če so podobna biološka zdravila prisotna na trgih primerjalnih držav, je primerjalna cena zdravila najnižja preračunana cena podobnega biološkega zdravila v katerikoli od primerjalnih držav. Če je podobno biološko zdravilo prisotno na trgu le v eni ali dveh primerjalnih državah, se upoštevajo preračunane cene v teh državah. Vrednost PEC podobnega biološkega zdravila lahko dosega največ 100 odstotkov primerjalne cene zdravila;
– če podobnih bioloških zdravil ni na trgih primerjalnih držav, se primerjalna cena tega zdravila ugotovi kot primerjalna cena referenčnega biološkega zdravila, ki mu je zadevno biološko zdravilo podobno. Vrednost PEC podobnega biološkega zdravila lahko dosega največ 68 odstotkov primerjalne cene originalnega biološkega zdravila iz prvega odstavka tega člena. Če obstajajo razlike v učinkovitosti zdravila, se dodatno upoštevajo tudi podatki o razliki v učinkovitosti zdravila, navedeni v Evropskem poročilu o oceni zdravila (EPAR) oziroma v dokumentih organov, pristojnih za vrednotenje zdravstvenih tehnologij v državah članicah EU, ki se izračuna z enačbo:
PEC (BPZ) = PEC (RBZ)*0,68*
(delež učinkovitosti BPZ po EPAR),
kjer pomenijo:
PEC (BPZ) – PEC biološko podobnega zdravila
PEC (RBZ) – PEC referenčnega biološkega zdravila.«.
5. člen
V 15. členu se v prvem odstavku napovedni stavek spremeni tako, da se glasi:
»(1) Ne glede na določbo drugega odstavka 9. člena tega pravilnika vloga, če v primerjalnih državah ni niti originalnega niti generičnega ali podobnega biološkega zdravila, vsebuje naslednje sestavine:«.
Za tretjim odstavkom se doda nov četrti odstavek, ki se glasi:
»(4) Če zdravilo ni na voljo v drugih državah članicah EU, državah podpisnicah Sporazuma o EGP ali v drugih evropskih državah in mediane iz prejšnjega odstavka ni mogoče določiti, se vrednost PEC določi glede na strokovno utemeljenost obrazložitve iz prve alineje prvega odstavka tega člena.«.
V dosedanjem četrtem odstavku, ki postane peti odstavek, se besedilo »prejšnjega odstavka« nadomesti z besedilom »tretjega ali četrtega odstavka tega člena«.
6. člen
V 16. členu se četrti odstavek spremeni tako, da se glasi:
»(4) Vloga za določitev izredne višje dovoljene cene za zdravila vsebuje:
1. spremni dopis z navedbo razlogov in utemeljitvijo, zakaj najvišja dovoljena cena ne omogoča preskrbe trga v Republiki Sloveniji;
2. administrativni del (del A Priloge 4, ki je sestavni del tega pravilnika):
– A.1: osnovne informacije o zdravilu, za katerega zavezanec vlaga vlogo za določitev izredne višje dovoljene cene;
– A.2: podatki o skupnem letnem prometu zdravila na ravni proizvajalca v vrednosti po posameznem zdravilu, opredeljenem z nacionalnim identifikatorjem, za vse farmacevtske oblike, jakosti in pakiranja zdravila, za zadnja tri koledarska leta in predvideni skupni letni promet zdravila v naslednjem koledarskem letu;
– A.3: predlog najvišje dovoljene cene oziroma predlog izredne višje dovoljene cene zdravila. Če je cena zdravila v prometu nižja od najvišje dovoljene cene oziroma izredne višje dovoljene cene, je potrebna obrazložitev dogovora, sklenjenega na podlagi 159. člena zakona.
3. klinični del (del B Priloge 4 tega pravilnika):
– B.1: navedba terapevtskih indikacij zdravila;
– B.2: navedba zdravil, ki so v prometu v Republiki Sloveniji in se uporabljajo na istem indikacijskem področju;
– B.3: primerjava učinkovitosti in varnosti oziroma opredelitev relativne terapevtske vrednosti zdravila, ki pomeni dodatno učinkovitost z izboljšanjem zdravstvenih izidov v primerjavi z zdravili, navedenimi pod točko B.2;
– B.4: ocena javnozdravstvenega tveganja, ki bi nastalo zaradi nerazpoložljivosti, nedostopnosti ali motene preskrbe zadevnega zdravila;
4. ekonomski del (del C Priloge 4 tega pravilnika) za zdravilo z dovoljenjem za promet, z dovoljenjem za promet s paralelno uvoženim zdravilom ali s potrdilom o prejemu obvestila o paralelni distribuciji:
– C.1: analiza vpliva na javna sredstva ob odobritvi izredne višje dovoljene cene, z navedbo tržnega deleža in oceno števila celotne populacije zdravljenih oseb;
– C.2: primerjava cen zdravil za posameznega pacienta za mesečno terapijo v primeru kroničnega zdravljenja oziroma za celotno obdobje zdravljenja v primeru akutnega zdravljenja z drugimi zdravili, navedenimi pod točko B.2;
– C.3: podatki o proizvajalčevih cenah in cenah na debelo istega zdravila v enakem ali primerljivem pakiranju (za vsako posamezno pakiranje) v drugih državah članicah EU oziroma državah podpisnicah Sporazuma o EGP in drugih evropskih državah na obrazcu B3 iz Priloge 1 tega pravilnika v formatu xls;
5. stroškovni del (del D Priloge 4 tega pravilnika) za zdravilo z začasnim dovoljenjem za promet ali dovoljenjem za vnos oziroma uvoz, ki je razvrščeno na seznam esencialnih ali nujno potrebnih zdravil na podlagi zakona:
– D.1: navedba nabavne cene zdravila z upoštevanimi popusti in rabati ter dokazilo o nabavni ceni, kar predstavlja račun za že dobavljena zdravila oziroma, če gre za prvo dobavo, predračun ali ponudba;
– D.2: izračun in dokazila o stroških prevoza zdravila iz izvorne države v Republiko Slovenijo;
– D.3: izračun in dokazila o stroških skladiščenja zdravila in s tem povezanih storitev;
– D.4: izračun in dokazila stroškov morebitnega dodatnega opremljanja zdravila;
– D.5: navedba administrativnih stroškov, ki nastanejo pri vnosu oziroma uvozu zdravila;
– D.6: navedba plačanih pristojbin in drugih dajatev, ki nastanejo pri vnosu oziroma uvozu zdravila.«.
Peti odstavek se spremeni tako, da se glasi:
»(5) Za zdravila z dovoljenjem za promet, dovoljenjem za promet s paralelno uvoženim zdravilom ali s potrdilom o prejemu obvestila o paralelni distribuciji, katerih skupni letni promet zdravila na ravni proizvajalca v vrednosti ne presega 30.000 eurov, kar v vlogi izkaže zavezanec, ni treba predložiti podatkov iz točke B.3 dela B Priloge 4 tega pravilnika in iz točk C.1 in C.2 dela C Priloge 4 tega pravilnika.«.
Stran 2982 / Št. 51 / 2. 4. 2021 Uradni list Republike Slovenije
Šesti odstavek se spremeni tako, da se glasi:
»(6) Za zdravila z začasnim dovoljenjem za promet ali dovoljenjem za vnos oziroma uvoz zdravil, ki so uvrščena na seznam esencialnih oziroma nujno potrebnih zdravil na podlagi zakona, katerih skupni letni promet zdravila na ravni proizvajalca v vrednosti ne presega 30.000 eurov, kar v vlogi izkaže zavezanec, in za katera predlog izredne višje dovoljene cene v vlogi ne presega 120 % nabavne cene zdravila iz točke D.1 dela D Priloge 4 tega pravilnika, ni treba predložiti podatkov iz točk B.3 dela B in točk D.2, D.3, D.4, D.5 in D.6 dela D Priloge 4 tega pravilnika.«.
7. člen
V 18. členu se tretji odstavek spremeni tako, da se glasi:
»(3) Ne glede na prvi in drugi odstavek tega člena, se komisija pri vlogah, skladnih s petim ali šestim odstavkom 16. člena tega pravilnika, opredeli do ekonomskih oziroma stroškovnih vidikov in javnozdravstvenega tveganja, ki bi nastalo zaradi nerazpoložljivosti, nedostopnosti ali motene preskrbe z zdravilom.«.
8. člen
V 19. členu se v prvem odstavku 1. točka spremeni tako, da se glasi:
»1. s pozitivnim mnenjem predlaga izredno višjo dovoljeno ceno zdravila, kot je bila predlagana v vlogi,«.
9. člen
V Prilogi 1 se Obrazec B3 nadomesti z novim Obrazcem B3, ki je kot Priloga 1 sestavni del tega pravilnika.
10. člen
V Prilogi 2 se razdelek B nadomesti z novim razdelkom B, ki je kot Priloga 2 sestavni del tega pravilnika.
11. člen
Za Prilogo 3 se doda nova, Priloga 4, ki je kot Priloga 3 sestavni del tega pravilnika.
PREHODNA IN KONČNA DOLOČBA
12. člen
Vloge za določitev najvišje dovoljene cene zdravila in vloge za določitev izredne višje dovoljene cene zdravila, ki so bile prejete do dneva uveljavitve tega pravilnika in o njih do tega dneva še ni bilo odločeno, se obravnavajo v skladu tem pravilnikom.
13. člen
Ta pravilnik začne veljati naslednji dan po objavi v Uradnem listu Republike Slovenije.
Št. 0070-30/2021
Ljubljana, dne 29. marca 2021
EVA 2021-2711-0024
Janez Poklukar
minister
za zdravje
“,”Jaka Verbic Miklic”,1618744140,1618744140,sl,14707,306,14706,43,0,NULL,,”Pravilnik o spremembah Pravilnika o oblikovnaju cen za uporabo v humani medicini 21/03/2021″,pravilnik-o-spremembah-pravilnika-o-oblikovnaju-cen-za-uporabo-v-humani-medicini-21-03-2021,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,1,0,1618744237,1621760468
763,14707,”R U L E S Amending the Rules Determining the Prices of Medicinal Products For Human Use”,” “,”
982. Rules Amending the Rules Determining the Prices of Medicinal Products For Human Use
Pursuant to Paragraph three of Article 158 of the Medicinal Products Act (Official Gazette of RS, no. 17/14 and 66/19), the Minister of Health hereby issues the following
R U L E S
Amending the Rules Determining the Prices of Medicinal Products For Human Use
Article 1
The Rules Determining the Prices of Medicinal Products For Human Use (Official Gazette of the Republic of Slovenia, No. 32/15, 15/16, 19/18, 11/19 and 26/20) shall be amended in Article 2 as follows:
– The initial sentence shall be amended in the brackets following the text “17/14” by adding “and 66/19”;
– The second, third and fourth indent of Item 1 is hereby amended to read as follows:
“- The holder of authorisation for entry or import of a medicinal product that is without marketing authorisation and is classified into the list of essential or indispensable medicinal products pursuant to the Act;
– The holder of temporary marketing authorisation for a medicinal product that is not authorised for marketing;
– The holder of marketing authorisation for parallel imported medicinal product;”.
In Item 13 the text “in a calendar year” shall be supplemented by “which is sold by the Holder listed under Item 1 to another legal person and is”.
In indent one of Item 14 the text “Directive 2012/26/EU of the European Parliament and of the Council of 25 October 2012 amending Directive 2001/83/EC as regards pharmacovigilance (OJ L 299 of 27 October 2012, p. 1)” shall be substituted by the text “Regulation (EU) 2019/1243 of the European Parliament and of the Council of 20 June 2019 adapting a number of legal acts providing for the use of the regulatory procedure with scrutiny to Articles 290 and 291 of the Treaty on the Functioning of the European Union (OJ L no. 198 of 25 July 2019, p. 241)”, and the second indent shall be deleted.
Article 2
The text of Article 3 is hereby amended to read as follows:
“(1) The expressions used herein shall have the following meaning:
1. A generic medicinal product is a medicinal product that has, regardless of the type of procedure, acquired marketing authorisation pursuant to:
– Paragraph one of Article 45 of the Act or paragraph one of Article 10 of Directive 2001/83/EC;
– Article 52 of the Act or Article 16a of Directive 2001/83/EC;
– Paragraph six of Article 45 of the Act or Paragraph three of Article 10 of Directive 2001/83/EC;
– Article 47 of the Act or Article 10a of Directive 2001/83/EC; or
– Article 50 of the Act or Article 10c of Directive 2001/83/EC after expiry of data protection of the original medicinal product, whereby the subject does not possess evidence on the primary origin of the medicinal product.
2. A similar biological medicinal product is a medicinal product that has acquired marketing authorisation pursuant to paragraph 7 of Article 45 of the Act or paragraph four of Article 10 of Directive 2001/83/EC and corresponds to the definition under item 58 of Article 6 of the Act.
(2) Terms set out in the above paragraph shall apply mutatis mutandis to medicinal product that are financed by public funds or are intended to be financed by public funds and do not have marketing authorisation in the Republic of Slovenia, but do have:
– Temporary marketing authorisation or authorisation for entry or import of a medicinal product that is without marketing authorisation and is classified into the list of essential or indispensable medicinal products pursuant to the Act;
– Marketing authorisation for parallel imported medicinal product; or
– Certificate of received notification on parallel distribution of medicinal product based on the provisions of Article 118 of the Act.”.
Article 3Indent two of paragraph five of Article 11 shall be amended to read as follows: “- Prices for France shall be recalculated using Equation 2 and Table 1 which are enclosed in Appendix 2 hereof, except in case of applying the UCD pricing standard which is a directly comparable price;”.
Article 3
Indent two of paragraph five of Article 11 shall be amended to read as follows: “- Prices for France shall be recalculated using Equation 2 and Table 1 which are enclosed in Appendix 2 hereof, except in case of applying the UCD pricing standard which is a directly comparable price;”.
Article 4
Paragraph three of Article 12 is hereby amended to read as follows:
“(3) PEP value of biosimilar medicinal products shall be determined on the basis of all biosimilar medicinal products in comparative countries in the following manner:
– if biosimilar medicinal products are present on markets of comparative countries, the comparative price of a medicinal product shall be the lowest recalculated price of the biosimilar medicinal product in any of the comparative countries. If the biosimilar medicinal product is marketed in only one or two comparative countries, recalculated prices from such countries shall be considered. The PEP value of a biosimilar medicinal product shall not exceed 100 percent of the comparative price.
– If biosimilars are not marketed in comparative countries, the comparative price of such a medicinal product shall be established as the comparative price of the reference biological medicinal product the medicinal product in question is similar to. The PEP value of a biosimilar medicinal product shall not exceed 68 percent of the comparative price of the original biological medicinal product stated in paragraph 1 of this Article. If there are differences in the effectiveness of the medicinal product, data on differences in medicinal product effectiveness listed in the European public assessment reports (EPAR) or documents of bodies competent for assessment of healthcare technologies in EU member states shall also be considered and calculated using the following equation:
PEP (BSM) = PEP (RBM)*0,68* (share of BSM efficiency according to EPAR),
whereby the following elements shall have the following meanings: PEP (BSM) – PEP of similar biological medicinal product PEP (RBM) – PEP of reference biological medicinal product”.
Article 5
In paragraph one of Article 15 the initial sentence shall be amended to read as follows:
“(1) Notwithstanding the provision of the second paragraph of Article 9 hereof, the application, in case there is no original or generic or biosimilar medicinal product in the comparative country, shall contain the following components:”.
A new fourth paragraph is hereby added after the third paragraph to read as follows:
“(4) If a medicinal product is not available in other EU member countries, EEA signatories or other European countries and the above referenced median cannot be determined, the PEP shall be determined with regard to the expert substantiation as per indent one of paragraph one of this Article.”.
In the current fourth paragraph that shall become the fifth paragraph, the text “previous paragraph” shall be substituted to read “third or fourth paragraph of this Article”.
Article 6
Paragraph four of Article 16 is hereby amended to read as follows:
“(4) The application for determining the extraordinary allowed higher price of a medicinal product must contain:
1. Cover letter with a listing of reasons and substantiation of why the maximum allowed price does not allow market supply in the Republic of Slovenia;
2. Administrative section (Section A of Appendix 4 which is an integral part hereof):
– A.1: Basic information about the medicinal product for which the subject is filing an application for the determination of an exceptional higher allowed price;
– A.2: Data on overall annual turnover of the medicinal product at manufacturer level by individual medicinal product furnished with a national identifier, for all pharmaceutical forms, strengths and packaging variants, for the last three calendar years and anticipated volume of sales in the following calendar year;
– A.3: Proposed maximum allowed price or proposed exceptional higher allowed price of a medicinal product. If the market price of the medicinal product is lower than the maximum allowed price or exceptional higher allowed price, the agreement concluded based on Article 159 of the Act requires substantiation.
3. Clinical section (Section B of Appendix 4 hereof):
– B.1: Listing of therapeutic indications
– B.2: Listing of medicinal products marketed in the Republic of Slovenia and used in the same therapeutic area;
– B.3: Comparison of efficiency and safety or determination of relative therapeutic value of medicinal product that constitutes additional efficiency by improving health outcomes in comparison to medicines listed under B.2;
– B.4: Assessment of risk to public health that may arise from unavailability or impaired supply of the relevant medicinal product;
4. Economic section (Section C of Appendix 4 hereof) for medicinal products with marketing authorisation, marketing authorisation for a parallel imported medicinal product or certificate of notification of parallel distribution:
– C.1: Analysis of impact on public funds after approval of exceptional higher allowed price, with listing of market share and assessment of entire population of treated individuals;
– C.2: Comparison of medicinal product prices for individual patients for monthly therapy in case of chronic treatment or for the entire duration of treatment in case of acute treatment with other medicinal products listed under item B.2;
– C.3: Data on manufacturer prices and wholesale prices for a medicinal product in equal or comparable packaging (per packaging unit) in other EU member countries or signatories of the EEA Agreement and other European countries on form B3 from Appendix 1 hereto in xls format;
5. Cost section (Section D of Appendix 4 hereof) for medicinal products with temporary marketing authorisation or authorisation for entry or import of a medicinal product that is classified onto the list of essential or indispensable medicinal products pursuant to the Act;
– D.1: Statement of medicinal product purchase price with included discounts and rebates and evidence of purchase price in the form of an invoice for previously delivered products or, in case of first delivery, a pro-forma invoice or offer;
– D.2: Calculation and evidence of costs of transporting the medicinal product from the source country to the Republic of Slovenia;
– D.3: Calculation and evidence of the costs of medicinal product storage and associated services;
– D.4: Calculation and evidence of costs of potential additional packaging or labeling of the medicinal product;
– D.5: Statement of administrative costs incurred upon entry or import of the medicinal product;
– D.6: Statement of paid fees and other dues incurred upon entry or import of the medicinal product.”.
Paragraph five is hereby amended to read as follows:
“(5) Medicinal products with marketing authorisation, marketing authorisation for a parallel imported medicinal product or certificate of notification of parallel distribution, the annual turnover of which at manufacturer level does not exceed the value of EUR 30,000 as evidenced by the applicant in the application, do not require the submission of data under section B, part B.3 and section C, parts C.1 and C.2 of Appendix 4 hereto.”.
Paragraph six is hereby amended to read as follows:
“(6) Medicinal products with temporary marketing authorisation or authorisation for entry or import of medicinal products classified on the list of essential or indispensable medicinal products in accordance with the Act, the annual turnover of which at manufacturer level does not exceed the value of EUR 30,000 as evidenced by the applicant in the application, and the proposed exceptionally allowed higher price of which does not exceed 120 % of the purchase price of the medicinal product under section D, part D.1 of Appendix 4 hereto, do not require the submission of data under section B, part B.3 of Appendix 2 and section D, parts D.2, D.3, D.4, D.5 and D.6 of Appendix 4 hereto.”.
Article 7
Paragraph three of Article 18 is hereby amended to read as follows:
“(3) Notwithstanding paragraphs one and two of this Article, the Commission shall in applications consistent with paragraphs five and six of Article 16 hereof issue an opinion on the economic or costs related aspects and potential risk to public health that may arise from unavailability or impaired supply of the relevant medicinal product.”.
Article 8
Item 1 of paragraph one of Article 19 is hereby amended to read as follows:
“1. By a positive opinion the Committee proposes the exceptionally allowed higher price of medicinal product as proposed in the application,”.
Article 9
Form B3 of Appendix 1 shall be substituted by a new form B3 that shall constitute an integral part hereof.
Article 10
Heading B in Appendix 2 shall be substituted by a new heading B, which constitutes an integral part hereof as Appendix 2.
Article 11
A new Appendix 4 shall be added after Appendix 3 hereof that shall constitute a constituent part hereof.
TRANSITIONAL AND FINAL PROVISION
Article 12
Applications for determining the maximum allowed price and extraordinary allowed higher price of medicinal products, received up to the day of enforcement hereof, for which no price had been determined before that date, shall be subject to the provisions hereof.
Article 13
These Rules shall enter into force on the next day after their publication in the Official Gazette of the Republic of Slovenia.
No. 0070-30/2021
Ljubljana, 29 March 2021
EVA 2021-2711-0024
Janez Poklukar
Minister of Health

“,,1618343100,1618343100,en,14707,306,14706,43,0,NULL,,”Pravilnik o spremembah Pravilnika o oblikovnaju cen za uporabo v humani medicini 21/03/2021″,pravilnik-o-spremembah-pravilnika-o-oblikovnaju-cen-za-uporabo-v-humani-medicini-21-03-2021,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,1,0,1618744237,1621760468
764,14709,”Svetovni dan tuberkuloze kot opomnik k izpolnitvi zavez za izkoreninjenje te bolezni”,”Letošnji svetovni dan tuberkuloze zaznamuje slogan Ura tiktaka”,”
Ljubljana, 24. marca – Letošnji svetovni dan tuberkuloze zaznamuje slogan Ura tiktaka, ki izpostavlja, da svetu zmanjkuje časa za ukrepanje in izpolnjevanje zavez za izkoreninjenje tuberkuloze. To je še posebej pomembno v času pandemije, ki je ogrozila napredek na področju odprave tuberkuloze in onemogočila dostop do oskrbe tuberkuloze v skladu s prizadevanji WHO.
Tuberkuloza, poznana tudi kot jetika ali sušica, je nalezljiva bolezen pljuč, ki primarno prizadene pljuča in pogosto poteka kronično, s številnimi zapleti, lahko vodi tudi v smrt. Bolezen se lahko pojavi v katerikoli življenjski dobi človeka, navaja spletna stran Nacionalnega inštituta za javno zdravje.
Zaradi tuberkuloze vsak dan življenje izgubi skoraj 4000 ljudi in dnevno zboli približno 28.000 ljudi, so ob današnjem dnevu tuberkuloze sporočili iz zbornice zdravstvene in babiške nege. Svetovna prizadevanja za boj proti tuberkulozi, ki jo je mogoče preprečiti in zdraviti, so od leta 2000 rešila približno 63 milijonov življenj. Danes je z bacili tuberkuloze, ki se prenašajo kapljično po zraku, po navedbah Lekarniške zbornice Slovenije okuženih približno 1,7 milijarde ljudi. Na leto jih umre od dva do tri milijone, predvsem v državah v razvoju.
Poznamo izvenpljučno in pljučno tuberkulozo. Znaki bolj pogoste, pljučne oblike, so lahko kašelj, bolečina v prsnem košu, malo povišana telesna temperatura, ki traja več kot tri tedne, lahko tudi izkašljevanje krvi. Tem težavam je lahko pridruženo znojenje, otečene bezgavke, utrujenost, izguba telesne teže. Znaki izvenpljučne tuberkuloze pa so odvisni od prizadetega organa, so v lekarniški zbornici povzeli pojasnila vodje lekarne Klinike Golnik Janeza Tonija.
Bolezni se ubranimo in izognemo z zdravim življenjskim slogom, raznovrstno prehrano, ustrezno osebno higieno, redno telesno dejavnostjo, dovolj kakovostnega spanca in dodatno pazljivost, če potujemo v države, kjer je aktivna tuberkuloza pogosta. To se države Latinske Amerike, Afrike in nekaterih delov Azije.
“Slovenija na srečo spada med države z zelo nizkim število bolnikov, v zadnjih letih je število iz leta v leto manjše. To je tudi posledica izjemno dobrega nadzora nad boleznijo in odlične dostopnosti do zdravljenja,” je še izpostavil Toni. V zbornici zdravstvene nege ob tem ugotavljajo, da pri nas za to boleznijo zbolevajo bolniki iz rizičnih skupin, kot so starostniki, alkoholiki, odvisniki od prepovedanih substanc ter begunci in migranti.
“Tuberkuloza še vedno predstavlja določeno stigmo, tudi med zdravstvenimi delavci, ki bi se morali bolj zavedati svoje izredno pomembne vloge pri obravnavi in zdravljenju te bolezni, so v zbornici povzeli besede predsednice sekcije medicinskih sester in zdravstvenih tehnikov v pulmologiji Maruše Ahačič.
Svetovni dan tuberkuloze je namenjen ozaveščanju javnosti o uničujočih zdravstvenih, socialnih in gospodarskih posledicah tuberkuloze ter krepitvi prizadevanj za odpravo svetovne epidemije tuberkuloze. Na ta dan leta 1882 je Robert Koch sporočil, da je odkril bakterijo, ki povzroča tuberkulozo, kar je odprlo pot k diagnosticiranju in zdravljenju te bolezni.
“,”Jaka Verbic Miklic”,1616592360,1616592360,sl,14709,306,14708,43,0,NULL,,”Svetovni dan tuberkuloze kot opomnik k izpolnitvi zavez za izkoreninjenje te bolezni”,svetovni-dan-tuberkuloze-kot-opomnik-k-izpolnitvi-zavez-za-izkoreninjenje-te-bolezni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1618748802,1618749758
765,14711,”Z donacijami tudi do nakupa dodatnega inštrumenta za povečanje zmogljivosti naprave za celično terapijo”,”Slovensko združenje bolnikov z limfomom in levkemijo je zbralo dovolj donacij”,”
Ljubljana, 25. marca – Slovensko združenje bolnikov z limfomom in levkemijo je zbralo dovolj donacij, da je poleg naprave naprave za CAR-T celično terapijo za hematološke bolnikov naročilo še dodaten inštrument za povečanje zmogljivosti osrednje naprave. Ta bo omogočil izdelavo CAR-T celičnih pripravkov za dva bolnika hkrati. V kampanji so zbrali skoraj 776.500 evrov.
S tem so zaključili sedemtedensko kampanjo, v kateri je sodelovalo več kot 4000 donatorjev, med katerimi je bilo 250 podjetij. Prav tako se je javil donator, ki bo kupil še eno celotno napravo s pripadajočo opremo. Pomoč s proračunskimi sredstvi je projektu obljubilo tudi ministrstvo za zdravje.
Združenje je osrednjo napravo naročilo 15. marca, to sredo pa še dodatni inštrument. Napravi bosta v Slovenijo prispeli najkasneje v 14 tednih.
Po nakupu naprav je na posebnem CAR-T transakcijskem računu ostalo okoli 37.000 evrov, ki bodo v celoti porabljeni za vzpostavitev CAR-T celične terapije na kliničnem oddelku za hematologijo Univerzitetnega kliničnega centra Ljubljana, je na današnji novinarski konferenci napovedala predsednica združenja Kristina Modic.
A z nakupom naprave dela še ni konec. Da bi prvim bolnikom z najtežjimi oblikami krvnih rakov najsodobnejše zdravljenje lahko nudili že konec leta, pristojne čakajo še številne priprave, med drugim tudi ustrezno izobraževanje kadra, je izpostavil Alojz Ihan z ljubljanskega Inštituta za mikrobiologijo in imunologijo.
CAR-T celična terapija predstavlja nov način imunskega zdravljenja raka. Tako bolniku vzamejo imunske celice, ki jih s pomočjo virusov gensko spremenijo na način, da dobijo nove senzorje za vrsto raka, ki ga ima bolnik. Celice nato v aparatu namnožijo, nato pa jih aplicirajo v bolnika.
Novi senzorji imunskim celicam omogočijo, da prepoznajo raka, ki ga ima bolnik, poleg tega pa so imunske celice opremljene z mehanizmi, s katerimi limfociti potem bolj učinkovito najdejo in uničijo raka.
“,”Jaka Verbic Miklic”,1616678880,1616678880,sl,14711,306,14710,43,0,NULL,,”Z donacijami tudi do nakupa dodatnega inštrumenta za povečanje zmogljivosti naprave za celično terapijo”,z-donacijami-tudi-do-nakupa-dodatnega-instrumenta-za-povecanje-zmogljivosti-naprave-za-celicno-terapijo,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1618749007,1618749745
766,14713,”Svetovni dan zavedanja o avtizmu bodo letos zaznamovali z dokumentarcem Zakaj skačem”,”Film je posnet po knjižni uspešnici negovorečega avtističnega dečka.”,”
Ljubljana, 1. aprila – Pred svetovnim dnevom zavedanja o avtizmu bodo bodo danes na spletnem Kinodvoru ob 19. uri premierno prikazali dokumentarni film Zakaj skačem. Film je posnet po knjižni uspešnici negovorečega avtističnega dečka. Odpre nam oči in zruši vse predstave o avtizmu, so sporočili iz Kinodvora.
Premiernemu predvajanju lani posnetega filma z izvirnim naslovom The Reason I Jump, bo sledil pogovor. Povezovala ga bo Irena Matko Lukan, ki bo gostila Apolonijo Klančar, prevajalko knjige Zakaj skačem: glas dečka iz tišine avtizma, in profesorico specialne in rehabilitacijske pedagogike Barbaro Žnidarko. Diskusiji se bo pridružila tudi odrasla oseba z avtizmom iz Društva za pomoč mladostnikom in odraslim s spektroavtistično motnjo (ASPI). Film bo na spletu na ogled do 28. aprila, so še sporočili.
Avtizem je razvojna motnja z največjim primanjkljajem na področju socialne komunikacije in interakcije ter z izrazito stereotipnostjo in nefleksibilnostjo na področju dejavnosti in interesov. Pogostnost avtizma je v zadnjih dveh desetletjih narasla za več 10-krat, kar jo danes uvršča med najhitreje naraščajočo razvojno motnjo. V Sloveniji je glede na te podatke 20.000 oseb z motnjo avtističnega spektra (MAS), je objavljeno na spletni strani Zveze za avtizem Slovenije.
“,”Jaka Verbic Miklic”,1617280800,1617280800,sl,14713,306,14712,43,0,NULL,,”Svetovni dan zavedanja o avtizmu bodo letos zaznamovali z dokumentarcem Zakaj skačem”,svetovni-dan-zavedanja-o-avtizmu-bodo-letos-zaznamovali-z-dokumentarcem-zakaj-skacem,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1618749728,1618749728
767,14715,”Svetovni dan zdravja za bolj pravičen in zdrav svet”,”Danes je svetovni dan zdravja”,”
Ljubljana/New York/Ženeva, 7. aprila – Danes je svetovni dan zdravja. Tokrat je posvečen trenutno najbolj aktualni javnozdravstveni temi – kako svet po pandemiji covida-19 vrniti v sprejemljive tirnice življenja, da bo bolj pravičen za vse in da bodo vsi ljudje in vse družbe uživali več zdravja in blaginje, so pojasnili na Nacionalnem inštitutu za javno zdravje (NIJZ).
Letošnji svetovni dan je vstopna točka v proces, v katerem bo več pozornosti namenjene tematikam o neenakosti v zdravju in socialnih neenakostih, so navedli na NIJZ. Prizadevajo si, da bodo znali argumentirati potrebne ukrepe za izboljšanje stanja z različnih vidikov, denimo ekonomskega in socialnega. Želijo si, da bi njihove ugotovitve čim bolj upoštevali tudi politični odločevalci v vseh sektorjih, ki na različnih ravneh vplivajo na zdravje in blaginjo pri posameznih skupinah prebivalcev.
Pri varovanju in ohranjanju zdravja imajo pomembno vlogo izvajalci zdravstvene in babiške nege, ki so odločilni pri krepitvi zdravstvenega sistema, pa je poudarila zbornica zdravstvene in babiške nege – zveza strokovnih društev medicinskih sester, babic in zdravstvenih tehnikov.
Po besedah predsednice zbornice – zveze Monike Ažman podpirajo prizadevanja Svetovne zdravstvene organizacije (WHO) za pravico do zdravja in zdravstvenega varstva za vse. A da bodo izvajalci zdravstvene in babiške nege lahko še naprej zagotavljali kakovostno in varno zdravstveno obravnavo vsem, potrebujejo ustrezne delovne pogoje in zadostno število kadra, je poudarila.
Na celjski območni enoti NIJZ pa so se osredotočili na zdravstveno stanje v savinjski regiji. Število umrlih na 100.000 prebivalcev upada, a je še vedno nad slovenskim povprečjem. Nad državnim povprečjem je tudi umrljivost zaradi bolezni srca in ožilja. Poleg tega je regija med tremi z najvišjo stopnjo bolnikov s sladkorno boleznijo, ki imajo predpisana zdravila.
Mestna občina Velenje pa je svetovni dan izkoristila za povabilo občanom, da se kljub epidemiji individualno ukvarjajo s športnimi dejavnostmi. Telesna aktivnost namreč pomembno vpliva na odpornost, zmanjševanje stresa in kakovost življenja.
Ob svetovnem dnevu so se oglasili tudi v Združenih narodih (ZN). Generalni sekretar ZN Antonio Guterres meni, da bo treba med okrevanjem po pandemiji izvajati takšne politike in razporediti sredstva tako, da bodo vsi imeli enak dostop do zdravstvenih storitev. To pomeni doseganje trajnostnih razvojnih ciljev iz Agende 2030, je spomnil. Na tokratni svetovni dan se zavežimo, da bomo sodelovali na poti do zdravega in pravičnega sveta, je povabil.
WHO pa poziva voditelje po svetu k zagotavljanju boljših življenjskih in delovnih pogojev za vse. Med pandemijo covida-19 je po njihovih besedah postalo še bolj očitno, v kako različnih pogojih živimo. Nekatere skupine prebivalstva po svetu komaj pridejo skozi mesec, nimajo denimo dostopa do čiste pitne vode in do zdravstvenih storitev, zaradi česar po nepotrebnem trpijo, obolevajo za boleznimi, ki jih je mogoče preprečiti, in prezgodaj umrejo.
Organizacija poziva, naj voditelji zagotovijo, da bodo imeli vsi prebivalci na voljo kakovostne zdravstvene storitve, ko jih potrebujejo. Pandemija je zelo prizadela vse države, vendar so jo najbolj občutili tam, kjer so že sicer bolj ranljivi in izpostavljeni boleznim ter imajo slabši dostop do kakovostnih zdravstvenih storitev, je spomnila WHO.
Pri naslavljanju problemov je treba po njenem nasvetu tesno sodelovati s skupnostmi, da bi odpravili vzroke za težave. Vlaganja v primarno zdravstvo naj se povečajo, saj je to ključno za zagotavljanje zdravja vsem. Poleg tega je treba voditi evidence članov skupnosti denimo po spolu, dohodku in izobrazbi, uporabljati pa je treba najnovejše in zanesljive podatke. Poleg tega naj države sodelujejo med seboj, priporočajo.
Svetovni dan zdravja je 7. aprila, ker je bila na ta dan leta 1948 ustanovljena WHO.
“,,1617801180,1617801180,sl,14715,306,14714,43,0,NULL,,”Svetovni dan zdravja za bolj pravičen in zdrav svet”,svetovni-dan-zdravja-za-bolj-pravicen-in-zdrav-svet,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1618751504,1618751642
768,14717,”K zmanjševanju neenakosti v zdravju pripomorejo tudi preventivni programi”,”Letošnji svetovni dan zdravja v središče postavlja neenak dostop do zdravja, ki ga je razkrila pandemija covida-19.”,”
Ljubljana, 7. aprila – Letošnji svetovni dan zdravja v središče postavlja neenak dostop do zdravja, ki ga je razkrila pandemija covida-19. V Rdečem križu Slovenije za zmanjševanje neenakosti v zdravju prebivalce spodbujajo k udeležbi na preventivnih zdravstvenih programih. Dostopnost povečujejo predvsem s postopnim uvajanjem programa Zdravo staranje.
Program Zdravo staranje je v sodelovanju s Svetovno zdravstveno organizacijo (WHO) pripravila skupina strokovnjakov iz Mednarodne federacije Rdečega križa in Rdečega polmeseca, so zapisali v sporočilu za javnost.
Program je usmerjen v preprečevanje današnjih temeljnih nenalezljivih kroničnih bolezni, kot so sladkorna bolezen, srčno-žilne bolezni, kronične respiratorne bolezni in različne vrste raka. Temelji na celostnem in vseživljenjskem pristopu, teoriji vedenjskih sprememb ter praksi, v okviru katere so za zdravje odgovorni vsi sektorji družbe, vključno z nevladnimi, humanitarnimi organizacijami.
Program so v Rdečem križu Slovenije poenostavili in priredili na osnovi lastnih izkušenj in spoznanj ter za slovenske razmere. Lansko leto pa so program dopolnili z izkušnjo življenja v samoizolaciji, so sporočili.
Svetovni dan zdravja na 7. april obeležujemo od leta 1950. Vsako leto je izpostavljena določena javnozdravstvena tema. Letos je posvečen vprašanju, kako svet po pandemiji covida-19 vrniti v sprejemljive tirnice življenja, da bo bolj pravičen za vse in da bodo vsi ljudje in vse družbe uživali več zdravja in blaginje.
“,”Jaka Verbic Miklic”,1617801300,1617801300,sl,14717,306,14716,43,0,NULL,,”K zmanjševanju neenakosti v zdravju pripomorejo tudi preventivni programi”,k-zmanjsevanju-neenakosti-v-zdravju-pripomorejo-tudi-preventivni-programi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1618751781,1618751781
769,14719,”Kakovostna sestava živil pomembno vpliva na zdravje potrošnikov”,”Gospodarska zbornica Slovenije je ob letošnjem svetovnem dnevu zdravja izpostavila pomen kakovostne sestave živil.”,”
Ljubljana, 7. aprila – Gospodarska zbornica Slovenije je ob letošnjem svetovnem dnevu zdravja izpostavila pomen kakovostne sestave živil. Živilska podjetja so se prostovoljno zavezala k izboljšanju sestave živil, s tem pa prispevajo k pozitivnim spremembam prehranjevalnih navad potrošnikov in bolj zdravemu življenjskemu slogu, so sporočili.
Zbornica kmetijskih in živilskih podjetij pri gospodarski zbornici že od leta 2015 živilska podjetja spodbuja k uresničevanju strateških ciljev prehranske strategije, predvsem na področju izboljšanja sestave živilskih izdelkov in spodbujanja zdravega življenjskega sloga.
Neuravnotežena prehrana in pomanjkanje telesne dejavnosti namreč lahko prispevata k razvoju prekomerne telesne mase in debelosti ter k razvoju kronično nenalezljivih bolezni, kot so diabetes tipa dva, srčno-žilne bolezni in bolezni dihal. Z manjšo uporabo sladkorja in soli v živilih, spodbujanjem porabe polnozrnatih sestavin, dodatnim informiranjem potrošnika ter drugimi ukrepi želijo podjetja prispevati k zmanjševanju teh kroničnih bolezni, so sporočili.
Pod okriljem zbornice poteka projekt Zaveza odgovornosti, v okviru katerega podjetja iz sektorja brezalkoholnih pijač, mlekarskega in pekarskega sektorja širijo ponudbo živil izboljšane hranilne sestave.
Potrošnikom so tako danes dostopne številne manj sladke pijače, brezalkoholne pijače z nizko ali brez energijske različice. Prav tako je bolj pestra ponudba mlečnih izdelkov z manj dodanega sladkorja. Povprečen energijski iznos brezalkoholne pijače je v štirih letih padel za eno kilokalorijo na 100 mililitrov, povprečna vsebnost dodanega sladkorja v mlečnih izdelkih pa se je v dveh letih znižala za 0,4 grama na 100 gramov oz. 100 mililitrov. Pada tudi trend slanosti kruha, razširja pa se ponudba polnozrnatih izdelkov.
Ponudba izdelkov izboljšane sestave se je v segmentu brezalkoholnih pijač v štirih letih povečala za 48 odstotkov, v segmentu mlečnih izdelkov pa v dveh letih za 27 odstotkov. Na trgu je večina takšnih izdelkov tudi dodatno označenih z informacijami o njihovi energijski oz. hranilni sestavi že na prednji strani embalaže.
Zbornica kmetijskih in živilskih podjetij pri gospodarski zbornici je izdala tudi katalog živil izboljšane sestave. Skupaj z ministrstvom za zdravje je zbornica začela s kampanjo Odloči se za, ki spodbuja potrošnike k uporabi živil izboljšane hranilne sestave. Na socialnih omrežjih potrošnike tako seznanjajo o izboljšanju hranilnih sestav živil.
“,”Jaka Verbic Miklic”,1617801420,1617801420,sl,14719,306,14718,43,0,NULL,,”Kakovostna sestava živil pomembno vpliva na zdravje potrošnikov”,kakovostna-sestava-zivil-pomembno-vpliva-na-zdravje-potrosnikov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1618751885,1618751885
770,14721,”Danes je svetovni dan Parkinsonove bolezni”,”Letošnji svetovni dan Parkinsonove bolezni zaznamujeta epidemija covid-19 in tudi 31-letnica delovanja društva Trepetlika”,”
Ljubljana, 11. aprila – Letošnji svetovni dan Parkinsonove bolezni zaznamujeta epidemija covid-19 in tudi 31-letnica delovanja društva Trepetlika. Je edino slovensko društvo bolnikov s parkinsonizmom in drugimi ekstrapiramidnimi motnjami. Ima več kot 1200 članov, med katerimi so oboleli in njihovi svojci.
V društvo je vključenih tudi nekaj bolnikov z distonijami in Huntingtonovo boleznijo. Poleg združevanja ljudi s podobnimi zdravstvenimi težavami je glavni namen društva predvsem izobraževanje obolelih in njihovih svojcev o novostih s področja zdravljenja ter seznanjanje z načini lajšanja življenja obolelih. Društvo tesno sodeluje s strokovnjaki s področja zdravljenja in obravnave Parkinsonove bolezni, predvsem z vidika organiziranja pogostih poljudno-strokovnih srečanj in delavnic. Izdajajo tudi svoje glasilo Trepetlika, aprila lani pa so na Televiziji Slovenija predvajali njihov dokumentarni film z istoimenskim naslovom, so zapisali.
Uspeh jim priznavajo tudi slovenski nevrologi, ki potrjujejo, da se z aktivno udeležbo na društvenih dogodkih pri obolelih podaljša dobro začetno obdobje, v katerem zdravila do določene mere upočasnjujejo bolezen in lajšajo simptome. Slovenski oboleli s Parkinsonovo boleznijo po mnenju nekaterih strokovnjakov spadajo med ene najbolj podučenih o tej bolezni v Evropi, za kar ima veliko zaslugo društvo, so dodali.
Letos bodo tako kot lani zaradi epidemiološke situacije svetovni dan Parkinsonove bolezni spet obeležili preko spleta. Objavili bodo 12 zgodb bolnikov, ki govorijo o svojih motnjah spanja, v načrtu pa imajo tudi različne delavnice. Med drugim bodo pokazali video z navodili, kako izdelati tulipan iz papirja, ki je simbol Parkinsonove bolezni. Prav tako so skupaj z obolelimi pripravili besedni oblak na temo te bolezni, so pojasnili.
Z obolelimi se zaradi epidemije še vedno ne morejo srečevati v živo. Morali so prekiniti načrtno izobraževanje, ki poteka že mnogo let. Okrnjeni so bili tudi programi in terapije v zdraviliščih, ki so jih pred epidemijo izvajali po Sloveniji. V drugem valu so zato uvedli srečanja preko spleta, kjer obolelim nudijo vrsto delavnic, psihološko pomoč in telesno vadbo, so poudarili. “Zavedamo se, da se odpadlih srečanj ne da nadomestiti in da spletna oblika doseže precej manj obolelih kot različica v živo, vendar se kljub temu trudimo čim bolj pomagati. Veseli nas, da je interes za delavnice preko spleta vedno večji, odziv pa zelo pozitiven,” so pojasnili. Dodali so, da so predsednica društva Cvetka Pavlina Likar, regijski vodje in njihova zaposlena ves čas dosegljivi na telefonih ter preko elektronske pošte za psihosocialno pomoč.
Kljub temu so v društvu zelo zaskrbljeni glede psihofizičnega stanja bolnikov med epidemijo. “Ni dovolj fizioterapij, pregledi odpadajo in se prestavljajo, ni reda. Ne srečujejo sebi podobnih, zato ni stikov in izmenjave mnenj, zaradi katerih je bilo potrebno tudi manjkrat v bolnišnico. Ljudje so obupani, potolčeni. Veliko jih bo zaradi nepopravljive škode obležalo nepokretnih na postelji,” so zapisali.
Poudarili so, da država s svojimi predpisi ne zagotavlja sredstev, s katerimi bi obolele spravili nazaj v stanje, kakršno je bilo v normalnih razmerah, in izrazili zaskrbljenost glede trenutne situacije. Po besedah društva namreč odločevalci stiske obolelih slabo prepoznavajo. Opozorili so, da ima to dolgoročne posledice, med drugim tudi povečanje izdatkov zdravstvene in pokojninske blagajne. Prav tako jih skrbi cepljenje. “Mnogi oboleli se zaradi čudne situacije s cepivi v naši državi nočejo cepiti, čeprav so jim to priporočili nevrologi,” so pojasnili.
Društvo si že več let aktivno prizadeva tudi za uveljavitev pravice do redne obnovitvene rehabilitacije za obolele s Parkinsonovo boleznijo. Skupaj s strokovnjaki so pripravili poseben program osnovnega izobraževanja, s katerim želijo obolele in njihove svojce podučiti o osnovah bolezni. Da bi ta cilj dosegli, jim preprečujejo dolgi postopki. “Zadnja štiri leta je vloga pri zdravstvenem svetu na ministrstvu za zdravje. Obravnava vloge se je izredno zavlekla. Vedno, ko se zamenja minister, razpade tudi zdravstveni svet. Nato se z novim ministrom formira nazaj, čez nekaj časa prične delovati, nato pa se minister zopet zamenja in začarani krog se nadaljuje. Smo ujetniki menjav na ministrstvu za zdravje,” so opozorili.
Vse pa imajo pripravljeno za projekt Šola za obolele in njihove svojce. “Zaznavamo res veliko potrebo s terena po osnovni izobrazbi o bolezni. Šola bo potekala enkrat mesečno dve šolski uri, vanjo pa bodo povabljeni vsi, ki bodo prvič dobili to diagnozo in njihovi svojci. V njej bodo s strani strokovnjaka za Parkinsonovo bolezen dobili osnovne podatke o bolezni in kako naprej. Začutili bodo, da niso sami,” so zaključili.
“,”Jaka Verbic Miklic”,1618147440,1618147440,sl,14721,306,14720,43,0,NULL,,”Danes je svetovni dan Parkinsonove bolezni”,danes-je-svetovni-dan-parkinsonove-bolezni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1618752359,1618752359
771,14723,”Tisoč naključno izbranih oseb prejelo klobčiče rdeče volne”,”Gre za vseslovensko akcijo Društva Hemofilikov Slovenije Ljubljana in Krvnih bratov”,”
Ljubljana, 13. aprila – V zadnjem tednu je 1000 naključno izbranih oseb po Sloveniji na svoj naslov prejelo klobčič rdeče volne. Gre za vseslovensko akcijo Društva Hemofilikov Slovenije Ljubljana in Krvnih bratov – Društva bolnikov z motnjo strjevanja krvi Slovenije, s katero ob svetovnem dnevu hemofilije, ki bo v soboto, ozaveščajo o tej neozdravljivi dedni bolezni.
Hemofilija se namreč pojavi pri enemu od 10.000 ljudi (hemofilija A) in pri enemu od 50.000 ljudi (hemofilija B). V Sloveniji je po uradnih podatkih oseb s hemofilijo A 205, oseb s hemofilijo B pa 24. Je redka, a dedna bolezen z motnjo strjevanja krvi, pri kateri osebe ne krvavijo močneje in hitreje, ampak dlje.
Po svetu živi s hudo obliko bolezni 418.000 oseb, skupno je okrog 1.125.000 oseb s hemofilijo. Dobijo jo z dedovanjem, v 30 odstotkov pa se pojavi s spontano mutacijo in brez predhodne okvare gena za strjevanje krvi pri starših.
Mnogo let je veljalo, da lahko zbolijo le moški, ženske pa so prenašalke. Danes je znano, da lahko zbolijo tudi slednje, če imajo premajhno raven enega od strjevalnih faktorjev v krvni plazmi. Za osebe s hemofilijo so problematične notranje krvavitve v mišicah in sklepih, ki povzročajo kronične bolečine in omejeno gibljivost.
Najpogosteje se notranje krvavitve dogajajo v gležnju, kolenih, komolcih, v mečih, stegnu in nadlakti. Manj pogoste, a zato veliko bolj nevarne pa so krvavitve v glavo, vrat oz. žrelo in prebavila.
V okviru akcije sta društvi namreč v začetku aprila na 1000 naslovov naključno izbranih oseb poslali klobčič rdeče volne s priloženimi navodili, da se klobčič podari naprej in izbrancu s simbolno gesto obljubi pomoč, ko jo bo ta potreboval.
Fotografije klobčičev prejemniki objavljajo tudi na Facebooku in jih označujejo s ključnikom #dajnaprej. Društvi objave zbirata na Facebook strani @Dajnaprej, kjer iz povezanih niti nastaja mreža ljudi po Sloveniji, ki jim ni vseeno za soljudi.
“,”Jaka Verbic Miklic”,1618320720,1618320720,sl,14723,306,14722,43,0,NULL,,”Tisoč naključno izbranih oseb prejelo klobčiče rdeče volne”,tisoc-nakljucno-izbranih-oseb-prejelo-klobcice-rdece-volne,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1618752834,1618752834
772,14725,”Z akcijskim načrtom za izboljšanje prehranskih in gibalnih navad prebivalcev”,”V njem med drugim sledijo usmeritvam Svetovne zdravstvene organizacije, EU in OECD, so navedli na ministrstvu za zdravje.”,”
Ljubljana, 17. aprila – Vlada je v akcijskem načrtu za izvajanje resolucije o nacionalnem programu o prehrani in telesni dejavnosti za zdravje 2015-2025 do leta 2022 posodobila usmeritve za izboljšanje prehranskih in gibalnih navad prebivalcev. V njem med drugim sledijo usmeritvam Svetovne zdravstvene organizacije, EU in OECD, so navedli na ministrstvu za zdravje.
Akcijski načrt, ki ga je sprejela vlada, je nadaljevanje in nadgradnja preteklega načrta za obdobje 2015-2018. Na ministrstvu so ob tem poudarili, da si bodo še naprej prizadevali za zagotavljanje zdravih subvencioniranih obrokov v vzgojno-izobraževalnem sistemu, ki so skladni s smernicami zdravega prehranjevanja. Menijo, da je pomembno nadaljevati krepitev zdravih prehranjevalnih navad s spodbujanjem uživanja kakovostne, sveže in lokalno pridelane hrane.
Še bolj nameravajo spodbujati trgovino, nacionalno živilskopredelovalno industrijo in gostinstvo z namenom, da bi izboljšali sestavo živilskih izdelkov. Prebivalce želijo tudi spodbujati k nakupu izdelkov z ugodnejšo hranilno sestavo. To nameravajo doseči z nacionalno shemo za lažjo prepoznavnost živil. Prav tako bodo še naprej delali na omejevanju trženja nezdravih živil, alkohola in tobaka otrokom. Večjo pozornost bodo namenili tudi kakovosti živil, ki z javnimi naročili prihajajo v javne sisteme.
Tako so na primer za šolsko shemo, ki med drugim vključuje tudi razdeljevanje sadja in zelenjave ter mleka in mlečnih izdelkov učencem, za obdobje 2021-2022 namenili 2,98 milijona evrov. Za zagotavljanje pogojev in povečevanje spodbud za ekološko pridelavo pa so pripravili 24 milijonov evrov. Med drugim bodo 4,15 milijona evrov brez DDV vložili tudi v vključevanje živil z ugodno prehransko sestavo v pakete pomoči, saj so v načrtu med drugim poudarili tudi skrb za kakovostnejšo prehrano socialno ogroženega prebivalstva.
Ocenili so, da predhodno sistematično delo na tem področju že kaže dobre rezultate. Kot glavne dosežke so omenili zaustavitev trenda naraščanja otroške debelosti, pogostejše zajtrkovanje med populacijo in bolj zdravo prehranjevanje nasploh.
“Akcijski načrt 2019-2022 se dopolnjuje tudi s cilji Strategije razvoja Slovenije 2030, ki si prizadeva za uresničevanje uravnoteženega gospodarskega, družbenega in okoljskega razvoja, upošteva omejitve in zmožnosti planeta ter ustvarja pogoje in priložnosti tudi za prihodnje generacije, kjer bo imela družba dobre priložnosti za delo, izobraževanje in ustvarjanje v dostojnem, varnem, čistem in zdravem okolju,” so še dodali.
“,”Jaka Verbic Miklic”,1618666860,1618666860,sl,14725,306,14724,43,0,NULL,,”Z akcijskim načrtom za izboljšanje prehranskih in gibalnih navad prebivalcev”,z-akcijskim-nacrtom-za-izboljsanje-prehranskih-in-gibalnih-navad-prebivalcev,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1618753375,1618753375
776,14733,”Cepiva so ključnega pomena za posameznika in družbo”,” “,”
22. aprila je potekal spletni pogovor na katerem so strokovnjaki razpravljali o pomenu cepiv za posameznika in družbo ter odgovarjali na vprašanja poslušalcev.
V pogovoru so sodelovali:
– Denis Baš, dr. med., specialist pediater,
– doc. dr. Tatjana Lejko Zupanc, predstojnica Klinike za infekcijske bolezni in vročinska stanja v UKC Ljubljana,
– Mojca Gobec, vodja Sektorja za preprečevanje bolezni in poškodb na Ministrstvu za zdravje Republike Slovenije.
– Zoran Simonovič – epidemiolog in predstojnik območne enote NIJZ Maribor
Celoten posnetek pogovora si lahko ogledate tu.
“,”Jaka Verbic Miklic”,1619167080,1619167080,sl,14733,306,14732,43,0,NULL,,”Cepiva so ključnega pomena za posameznika in družbo”,cepiva-so-kljucnega-pomena-za-posameznika-in-druzbo,Post,/sites/43/files/images/news/Covid-19/homepage-banner_500.jpg,1,0,1619944865,1619944944
777,14737,”Začenja se svetovni teden cepljenja”,”Letos posebej izpostavlja pomembnost cepljenja pri preprečevanju bolezni in zaščiti življenj.”,”
Ljubljana, 24. aprila – Z današnjim dnem se začenja svetovni teden cepljenja, ki letos posebej izpostavlja pomembnost cepljenja pri preprečevanju bolezni in zaščiti življenj, so sporočili iz Nacionalnega inštituta za javno zdravje. S ponedeljkom pa se začenja še evropski teden cepljenja, ki letos v ospredje postavlja solidarnost in zaupanje v cepljenje kot javno dobrino.
Svetovni teden cepljenja letos poteka od 24. aprila do 2. maja. Tokrat je poudarek na pomembnosti cepljenja pri preprečevanju bolezni in zaščiti življenj. “Cepljenje je eden izmed najučinkovitejših zdravstvenih ukrepov, predstavlja temelj univerzalnega zdravstvenega varstva in je bistveno za doseganje optimalnega zdravja za vse in povsod. Cepljenje je torej pomembna naložba v dobro zdravje in dobro počutje skozi vse življenje,” so v inštitutu navedli na spletni strani.
Pomen cepljenja kot učinkovite in varne zaščite pred nalezljivimi boleznimi se izrazito kaže tudi v situaciji aktualne pandemije covida-19. Kot so poudarili, je cepljenje proti covidu-19 najpomembnejši način za obvladovanje pandemije, saj lahko tako zmanjšamo število zbolelih, preprečimo težke zaplete, hospitalizacije in smrti ter pripomoremo k razbremenitvi zdravstvenega sistema, so pojasnili na NIJZ.
Cepljenje proti covidu-19 se je v Sloveniji začelo 27. decembra lani. Do 21. aprila je bilo s prvim odmerkom cepiva proti covidu-19 cepljenih nekaj več kot 380.000 oseb, z drugim odmerkom pa nekaj več kot 147.500 oseb. Precepljenost proti covidu-19 je v Sloveniji tako za zdaj sedemodstotna.
S ponedeljkom se sicer začenja še obeleževanje evropskega tedna cepljenja. Letošnji poudarek daje solidarnosti in zaupanju v cepljenje kot javni dobrini, ki podpira našo družbo, rešuje življenja in ščiti zdravje. Evropski teden cepljenja je leta 2005 prvič izvedlo nekaj držav, da bi povečalo obseg cepljenja z ozaveščanjem o potrebi in pravici vsakega otroka do zaščite pred boleznimi.
V Sloveniji je precepljenost za bolezni, proti katerim je cepljenje obvezno, relativno visoka. V šolskem letu 2019/2020 so s programom cepljenja med šolskimi otroki in mladino dosegli 90-odstotno precepljenost proti davici, tetanusu in oslovskemu kašlju, 91-odstotno precepljenost proti ošpicam, mumpsu in rdečkam ter 79,9-odstotno precepljenost proti hepatitisu B. Vzdrževanje čim višje precepljenosti je pomembno, saj tako preprečimo ponovne izbruhe bolezni, sčasoma pa bi lahko nekatere nalezljive bolezni tako popolnoma izkoreninili.
“,”Jaka Verbic Miklic”,1619265300,1619265300,sl,14737,306,14736,43,0,NULL,,”Začenja se svetovni teden cepljenja”,zacenja-se-svetovni-teden-cepljenja,Post,,1,0,1619956623,1619956623
779,14741,”Opustitev patentov bo boj proti koronavirusu še dodatno otežila”,” “,”
Bruselj, 6. maj, 2021, Generalna direktorica združenja EFPIA Nathalie Moll je komentirala predlog vlade ZDA o opustitvi patentov za cepiva proti COVID-19: »Ta kratkovidna in neučinkovita odločitev Bidenove administracije ogroža težko doseženi napredek v boju s to grozno boleznijo. V celoti podpiramo cilj varovanja ljudi po vsem svetu s cepivi, toda opustitev patentov bo boj proti koronavirusu še dodatno otežila.«
Povedala je še: »Povečevanje proizvodnih kapacitet za dobavo odmerkov ljudem po vsem svetu zahteva tehnična in specialistična znanja razvijalca cepiv, ki lahko sodeluje s partnerskimi proizvodnimi organizacijami. Takšne širitve kapacitet preprosto ni mogoče doseči z opustitvijo patentov in upanjem, da bodo do sedaj še neznane tovarne po svetu poskušale z zapletenim postopkom proizvodnje cepiv. Opustitev patentne zaščite lahko povzroči preusmerjanje surovin in materialov stran od uveljavljenih in učinkovitih dobavnih verig k manj učinkovitim proizvodnim obratom, v katerih sta produktivnost in kakovost lahko problematični. S takšnim dejanjem odpiramo vrata vstopu ponarejenih cepiv v globalno dobavno verigo. Širjenje kapacitet lahko dosežemo le s prostovoljnimi partnerstvi med inovatorji, ki razvijajo cepiva, in strokovnjaki za proizvodnjo. Osredotočati se moramo na odstranjevanje ovir za sodelovanje, zagotavljanje prostega pretoka materialov po svetu in nadaljevanje raziskovanja.«
Evropa je od samega začetka krize motor raziskav, razvoja in inovacij na področju COVID-19, od novih diagnostičnih postopkov do tehnologije mRNA v prvem odobrenem cepivu. Takšen odziv na podlagi raziskav in stabilnega okvira za varstvo intelektualne lastnine, ki spodbuja inovatorje k raziskovanju novih tehnologij, nam je prinesel orodja za boj proti pandemiji. Evropski parlament je prepoznal pomen teh ključnih orodij in je 29. aprila 2021 glasoval proti opustitvi patentov, Evropska komisija pa dosledno podpira inovacije kot ključni element boja proti pandemiji.
Če bo opustitev potrdila še Svetovna trgovinska organizacija, bodo odstranjene vse spodbude za nadaljnje raziskave novih sevov, novih diagnostičnih postopkov, zdravil in cepiv proti koronavirusu. Hkrati pa to ne bo povečalo globalnih kapacitet za izdelavo cepiv proti COVID-19. Poleg tega bi opustitev patentov za cepiva proti COVID-19 vnaprej ohromila tudi inovativne odzive na prihodnje pandemije.
Nathalie Moll je za konec dodala: »Zelo je pomembno, da Evropa s svojim nasprotovanjem opustitvi patentov še naprej podpira inovacije v medicini kot edino trajno pot iz koronavirusne krize. Smo globalni center proizvodnje cepiv, zato moramo ostati osredotočeni na oblikovanje partnerstev in investicije v proizvodne obrate, s katerimi bomo povečali kapacitete in izpolnili potrebe ljudi po vsej Evropi in po svetu.«
“,”Jaka Verbic Miklic”,1621320360,1621320360,sl,14741,306,14740,43,0,NULL,,”Opustitev patentov bo boj proti koronavirusu še dodatno otežila”,opustitev-patentov-bo-boj-proti-koronavirusu-se-dodatno-otezila,Post,/sites/43/files/images/news/Covid-19/homepage-banner_500.jpg,1,0,1621320499,1621320578
780,14741,”Waiving patents will make winning the fight against the coronavirus even harder.”,” “,”
Brussels 06 May 2021, Speaking about the US administration’s decision to support a proposal to waive patents on COVID-19 vaccines, EFPIA Director General Nathalie Moll said. “This short-sighted and ineffectual decision by the Biden administration puts the hard-won progress in fighting this terrible disease in jeopardy. While we wholeheartedly agree with the goal of protecting citizens around the world through vaccines, waiving patents will make winning the fight against the coronavirus even harder.”
She went on to say. “Increasing capacity to deliver doses to citizens around the world requires the skills and technical know-how of the vaccine developer to bring on-board partner manufacturing organizations. You simply cannot achieve this kind of capacity expansion by waiving patents and hoping that hitherto unknown factories around the world will turn their hand to the complex process of vaccine manufacture. A waiver risks diverting raw materials and supplies away from well established, effective supply chains to less efficient manufacturing sites where productivity and quality may be an issue. It opens the door to counterfeit vaccines entering the supply chain around the world. Capacity expansion is only achievable through voluntary, collaborative partnerships between the innovators behind each vaccine and expert manufacturing partners. All our focus should be on removing barriers to collaboration, ensuring the free flow of materials around the world, and continuing the research effort.”
Since the very beginning of the crisis, Europe has been an engine room of COVID-19, research, development, and innovation; from new diagnostics to mRNA technology used in the first approved vaccine. This research-based response has given us the tools to fight the pandemic. A response built on an IP framework that incentivised innovators to explore these new technologies. Recognising the genesis of these vital tools, the European Parliament voted against the waiver on 29 April 2021 and the European Commission has remained consistent in their support for innovation as key to fighting the pandemic.
If approved by the WTO, the waiver would remove any incentive for companies to continue research into new variants, new diagnostics, treatments, and vaccines to tackle the coronavirus. And at the same time, it would fail to increase the global capacity to manufacture COVID-19 vaccines. In addition, removing patents on COVID-19 vaccines would also negate any innovation-based response to future pandemics.
Nathalie Moll concluded by saying. “It is vital that Europe continues to champion medical innovation as the only permanent route out from under the shadow of the coronavirus, through its opposition to the waiver. As a global hub for vaccine manufacture, our focus should remain on creating the partnerships and investing in facilities to increase capacity to meet the needs to citizens across Europe around the world.”
“,,-2147483648,-2147483648,en,14741,306,14740,43,0,NULL,,”Opustitev patentov bo boj proti koronavirusu še dodatno otežila”,opustitev-patentov-bo-boj-proti-koronavirusu-se-dodatno-otezila,Post,/sites/43/files/images/news/Covid-19/homepage-banner_500.jpg,1,0,1621320499,1621320578
781,14743,”Pet korakov za nujno zagotavljanje enakopravnosti pri cepljenju proti COVID-19 “,”Inovativni proizvajalci cepiv in biotehnološka podjetja so v ospredju globalnega dela na področju razvoja in proizvodnje cepiv proti COVID-19. “,”
19. maj 2021 07h00 CET- Inovativni proizvajalci cepiv in biotehnološka podjetja so v ospredju globalnega dela na področju razvoja in proizvodnje cepiv proti COVID-19. Ta izjemno zahteven globalni projekt že dosega uspehe. Po več kot 200 kliničnih študijah in skoraj 300 partnerstvih in sodelovanju proizvajalcev po vsem svetu, se je proizvodnja v le nekaj mesecih povečala z nič na 2,2 milijarde odmerkov cepiva proti COVID-19 ob koncu maja, ocene pa napovedujejo izjemnih 11 milijard odmerkov do konca 2021 (podatki Airfinity so na voljo v na tej povezavi). To pomeni, da bo cepiva dovolj za celotno odraslo populacijo sveta.
Zaskrbljujoče je, da prednostne skupine prebivalstva po svetu nimajo enake dostopnosti do cepiv proti COVID-19
Proizvajalci, vlade in nevladne organizacije morajo skupaj nujno sprejeti vse potrebne ukrepe, da se ta neenakost zmanjša. Takojšnje ukrepanje mora biti osredotočeno na odgovorno delitev odmerkov in povečanje proizvodnje brez ogrožanja kakovosti ali varnosti.
Da bi to dosegli, so se inovativni proizvajalci cepiv in biotehnološka podjetja zavezali:
IZBOLJŠATI DELITEV ODMERKOV:
NADALJEVATI Z OPTIMIZACIJO PROIZVODNJE:
IDENTIFICIRATI TRGOVINSKE OVIRE, KI JIH JE POTREBNO ODPRAVITI:
PODPRETI PRIPRAVLJENOST DRŽAV:
SPODBUJANJE NADALJNJIH INOVACIJ:
Kontakti za medije
ABPI: Elaine Towell ETowell@abpi.org.uk
BIO: Jacy Gomez jgomez@bio.org
EFPIA: Andrew Powrie-Smith andy.powrie-smith@efpia.eu
IFPMA: Abigail Jones a.jones@ifpma.org
PhRMA: Megan Van Etten MVanetten@phrma.org
Informacije o združenjih
Združenje ABPI želi Veliko Britanijo razviti v najboljši kraj na svetu za raziskave, razvoj in uporabo novih zdravil. Zastopamo podjetja vseh velikosti, ki investirajo v odkrivanje zdravil prihodnosti. Naši člani dobavljajo revolucionarna zdravila, ki izboljšujejo in rešujejo življenja milijonov ljudi. Delujemo v partnerstvu z vlado in NHS in omogočamo, da bolniki hitreje dostopajo do novih zdravil, NHS pa lahko načrtuje svoje izdatke za zdravila. Vsak dan sodelujemo z organizacijami v skupnosti znanosti o življenju in izven nje in spreminjamo življenja po vsej Veliki Britaniji.
Organizacija za inovacije v biotehnologiji (Biotechnology Innovation Organization – BIO) je največja svetovna organizacija, ki zastopa biotehnološka podjetja, akademske ustanove, državne biotehnološke centre in povezane organizacije v Združenih državah Amerike in več kot 30 drugih državah.
Evropska zveza farmacevtskih industrij in združenj (EFPIA) zastopa farmacevtsko industrijo, ki deluje v Evropi. Z neposrednim članstvom 36 nacionalnih organizacij, 39 vodilnih farmacevtskih družb in vse večjim številom majhnih in srednje velikih podjetij želi EFPIA ustvariti sodelovalno okolje, ki članom omogoča inovacije, odkrivanje, razvoj in dobavo novih terapij in cepiv za ljudi po vsej Evropi in hkrati prispeva k evropskemu gospodarstvu.
Mednarodni svet biotehnoloških združenj (International Council of Biotechnology Associations – ICBA) je koalicija neprofitnih, nacionalnih biotehnoloških trgovinskih združenj, ustanovljena za promocijo javnega razumevanja in zagovorništva za javne politike, ki podpirajo rast inovativnih biotehnoloških industrij. ICBA je globalni glas industrije na mednarodnih forumih s ciljem promocije trajnih inovacij na področju zdravja ljudi, kmetijstva ter industrijskih in okoljskih sektorjev.
Mednarodna federacija farmacevtskih proizvajalcev in združenj (IFPMA) zastopa raziskovalne farmacevtske družbe in združenja iz vsega sveta.
Dva milijona delavcev v raziskovalni farmacevtski industriji raziskuje, razvija in dobavlja zdravila in cepiva, ki izboljšujejo življenja bolnikov po svetu. IFPMA s sedežem v Ženevi ima uradne odnose z Združenimi narodi in prispeva znanje industrije za pomoč svetovni zdravstveni skupnosti pri iskanju rešitev za globalno zdravje.
Združenje Pharmaceutical Research and Manufacturers of America (PhRMA) zastopa vodilna raziskovalna biofarmacevtska podjetja v ZDA, ki odkrivajo in razvijajo zdravila, s katerimi bolniki
živijo dlje bolj zdravo in bolj produktivno.. Od leta 2000 so družbe članice PhRMA investirale skoraj en trilijon dolarjev v iskanje novih zdravil, od tega približno 83 milijard le v letu 2019.
Združenje Vaccines Europe je bilo ustanovljeno leta 1991 kot zagovornik industrije cepiv v Evropi. Skupina zastopa proizvajalce cepiv vseh velikosti, ki delujejo v Evropi, in trenutno vključuje vsa pomembna globalna inovativna in raziskovalna podjetja na področju cepiv, vključno z majhnimi in srednje velikimi podjetji.
“,”Jaka Verbic Miklic”,1621575120,1621575120,sl,14743,306,14742,43,0,NULL,,”Pet korakov”,pet-korakov,Post,/sites/43/files/images/news/Covid-19/homepage-banner_500.jpg,1,0,1621575260,1621761051
782,14745,”Evropski teden boja proti raku”,”Pomembna sta ozaveščanje in preventiva – Evropski teden boja proti raku poudarja pomen ozaveščanja, dostopa do zdravljenja in podpori bolnikom. “,”
Vsako leto med 23. in 31. majem poteka kampanja “Evropski teden boja proti raku”, ki pod vodstvom Združenja evropskih zvez za boj proti raku (Association of European Cancer Leagues) opozarja na breme te bolezni. Letošnje leto se kampanja osredotoča na sooblikovanje izvajanja Evropskega načrta za boj proti raku (#EUCancerPlan), ki je ena izmed temeljnih prednostnih nalog Evropske komisije v zakonodajnem obdobju 2019–2024.
Diagnoza raka je zelo pereč problem za celotno Evropo, v kateri živi desetina svetovnega prebivalstva, hkrati pa je tu kar četrtina vseh primerov rakavih obolenj na svetu. V Evropski uniji je bil leta 2020 rak diagnosticiran pri 2,7 milijona ljudeh, umrlo pa je 1,3 milijona ljudi1. V Sloveniji za rakom vsako leto zboli več kot 15.000 ljudi, približno 6.000 pa jih umre, predstavlja pa drugi najpogostejši vzrok smrti v Sloveniji, prvi so bolezni srca in ožilja.
Rak je diagnoza, ki ne vpliva zgolj na bolnika, ampak tudi na njegove bližnje. Evropski načrt boja proti raku predvideva, da se bo brez odločnega ukrepanja število smrti zaradi rakavih obolenj do leta 2035 povečalo za več kot 24 %2, zaradi česar bi rak postal glavni vzrok smrti v EU. Po ocenah naj bi skupni gospodarski učinek raka v Evropi presegal 100 milijard EUR na leto. V zadnjem letu veliko težav na tem področju predstavlja pandemija covida-19, ki močno vpliva na oskrbo rakavih bolnikov, povzroča motnje v preprečevanju in zdravljenju raka ter zaostanke v diagnostiki in pri cepljenju, ponekod po Evropi pa vpliva tudi na dostop do zdravil (v Sloveniji temu ni tako, kot smo že pisali). Od začetka pandemije se je v nekaterih državah število diagnosticiranih primerov rakavih obolenj zmanjšalo, kar nakazuje povečanje števila primerov v prihodnosti.
Evropa nujno potrebuje obnovljeno zavezo preprečevanju, zdravljenju in oskrbi raka. Potreben je širok pristop, usmerjen k bolniku, ki bo hkrati povečal potencial novih tehnologij in dognanj. Prav tako je nujno potrebno sodelovanje različnih deležnikov – vse od odločevalcev, do bolnikov in njihovih združenj, stroke, farmacevtske industrije in drugih, ki bomo skupaj naslovili neenakosti pri dostopu do znanja o raku ter preprečevanja, diagnosticiranja in oskrbe raka, kar bo za bolnike pomenilo boljši izid zdravljenja.
Namen Evropskega načrta za boj proti raku (ang. Europe’s Beating Cancer Plan) je zajeti celotno pot obravnave bolezni, temelji pa na štirih ključnih področjih ukrepanja, na katerih lahko EU prispeva največjo dodano vrednost:
V prihodnjih letih bo načrt usmerjen v raziskave in inovacije, izkoriščal bo možnosti, ki jih zagotavljajo digitalizacija in nove tehnologije, za podporo državam članicam pa bo uporabil finančne instrumente.
V Sloveniji letos poteče Nacionalni program za boj proti raku 2017−2021 in v pripravi je nov desetletni načrt.
1 Vir: Najnovejše ocene evropskega informacijskega sistema o raku (ECIS) za države EU-27. Nove diagnoze zajemajo vse vrste rakov, razen nemelanomskega kožnega raka.
2 Vir: https://gco.iarc.fr/tomorrow/en/
“,”Jaka Verbic Miklic”,1621576920,1621576920,sl,14745,306,14744,43,0,NULL,,”Evropski teden boja proti raku”,evropski-teden-boja-proti-raku,Post,”/sites/43/files/images/news/Cancer patients/cancer-cells-3.jpg”,1,0,1621576978,1621872767
783,14747,”Obeležujemo svetovni dan astme”,”Po besedah Bojana Madjara iz Lekarniške zbornice Slovenije sodi astma med najpogostejše kronične pljučne bolezni”,”
Ljubljana, 4. maja – Svetovni dan astme obeležujemo vsak prvi torek v maju. Po besedah Bojana Madjara iz Lekarniške zbornice Slovenije sodi astma med najpogostejše kronične pljučne bolezni, za njo pa po svetu trpi več kot 300 milijonov oseb. Poleg tega so astmatiki v skupini tistih, za katere okužba z novim koronavirusom pomeni večje tveganje.
Astma je neozdravljiva bolezen, ki pa jo je mogoče uspešno zdraviti in nadzorovati, da bi bolnik lahko čim bolj normalno živel. Kljub temu po nekaterih ocenah več kot polovica ljudi z astmo nima dovolj dobrega nadzora nad boleznijo.
Globalna iniciativa za astmo (Gina), ki je pobudnica svetovnega dneva, je na svoji spletni strani zapisala, da letošnji dan astme poteka pod geslom “Odkrivanje zmot o astmi”. Dodali so, da tema poziva k odpravljanju mitov in napačnih predstav o astmi. Med razjasnjenimi miti so tako tudi, da astma ni nalezljiva, lahko pa virusne okužbe dihal povzročajo napade astme. Pojavi se lahko v kateri koli starosti, astmatiki pa so lahko tudi vrhunski ali rekreativni športniki, če astmo dobro nadzorujejo.
Med ključna simptoma astme štejemo sopenje zaradi motenosti dihalnih poti in suh ali moker kašelj. Večinoma težave sprožijo določeni alergeni ali iritatorji, lahko pa se pojavi tudi ob telesni dejavnosti. “Na astmo lahko opozarjajo tudi sopenje, hlastanje za zrakom, daljše izdihovanje, pretirano napihovanje prsnega koša in drugi znaki. Redko se napadi astme kažejo brez znakov,” je ključne znanilce astme pojasnil Madjar.
Astma predstavlja pomembno breme zaradi slabše kakovosti življenja in ni samo javnozdravstveni problem za razvite države, ampak se pojavlja v vseh državah, ne glede na stopnjo razvoja. Za mnoge bolnike ima astma velik negativni vpliv na vsakdanje življenje, zato je v ospredje obravnave postavljena urejenost astme, je zapisano na spletni strani Nacionalnega inštituta za javno zdravje.
“,”Jaka Verbic Miklic”,1620130320,1620130320,sl,14747,306,14746,43,0,NULL,,”Obeležujemo svetovni dan astme”,obelezujemo-svetovni-dan-astme,Post,,1,0,1621772003,1621772029
784,14749,”Ob sumu na možgansko kap bistveno hitro ukrepanje”,”Pomembnost zdravega življenjskega sloga”,”
Ljubljana, 6. maja – Ob prihajajočem evropskem dnevu ozaveščanja o možganski kapi so na virtualni novinarski konferenci v organizaciji Društva za zdravje srca in ožilja Slovenije strokovnjaki poudarili pomembnost zdravega življenjskega sloga. Poudarili so tudi umanjkanje ozaveščenosti ljudi o hitrem ukrepanju ob sumu na možgansko kap skladno z geslom GROM.
Ljudje se po oceni predsednika društva in zdravnika, ki dela na kliničnem oddelku za žilne bolezni na Univerzitetnem kliničnem centru (UKC) Ljubljana, Matije Cevca premalo zavedajo preventivnega preprečevanja nastanka možganske kapi, kar lahko dosežemo z gibanjem in zdravo prehrano.
Ob tem je dodal, da je odgovornost vseh, da so pozorni na opozorilne znake možganske kapi, ki si jih je lažje zapomniti pod geslom GROM. Slednje narekuje, da je treba pri neustreznem, zatikajočem in slabo razumljivem govoru, šibki roki ali nogi in povešenem ustnem kotu hitro poiskati pomoč, pri tem pa so izredno pomembne tudi minute, ki lahko rešijo marsikatero invalidnost kot posledico možganske kapi. Kot je še dejal Cevc, je v Sloveniji ozaveščenost ljudi na žalost premajhna.
Na neozaveščenost in čakanje ljudi na spontano izboljšanje stanja je opozoril tudi Štefan Mally iz nujne medicinske pomoči mariborskega zdravstvenega doma Adolfa Drolca. Po njegovih navedbah v Sloveniji vsak dan za možgansko kapjo zboli deset ljudi, pravočasne urgentne prevoze z reševalnimi vozili pa izvedejo manj kot v polovici primerov. Pri tem je zato pozdravil in predstavil vzpostavitev dispečerske službe zdravstva, ki prevzema nujne zdravstvene klice v več regijah, s čimer so pridobili dodatno možnost hitre aktivacije ekip.
Tudi specialistka interne medicine iz Splošne bolnišnice Jesenice Mateja Verdinek je ob predstavitvi poteka obravnave možganske kapi opozorila, da je ob sumu nanjo treba nujno čim prej poklicati medicinsko pomoč, zelo pomemben izvor podatkov pa so tudi poročanja očividcev in svojcev. Ob tem je še opozorila, da lahko zaradi nezdravega načina življenja kap prizadene tudi mlajše ljudi, kot so recimo 30-letniki.
Verdinkova je še dodala, da se v bolnišnici zavedajo, da je bila obravnava bolnikov zaradi ukrepov preprečevanja okužbe s koronavirusom nekoliko daljša, a so se kljub temu trudili, da do tega ne bi prihajalo in so možgansko kap obravnavali prioritetno. Ob tem je izpostavila tudi pomanjkanje nevrologov na območju celotne države.
Trenutno namreč ostalim bolnišnicam po državi pri obravnavi možganske kapi preko centra mreže TeleKap na pomoč priskočijo na nevrološki kliniki UKC Ljubljana. Kot je dodal nevrolog Matija Zupan, v pandemičnih razmerah zagotavljajo nemoteno oskrbo tudi najbolj zahtevnim bolnikom z možgansko kapjo. Je pa zaradi upoštevanja zaščitnih ukrepov tudi pri njih, predvsem v drugem valu, prihajalo do podaljšanega časa obravnave, delo pa je bilo precej stresno.
Zupan je med drugim komentiral tudi domnevne povezave med cepljenjem proti covidu-19 in trombozo ter dejal, da tovrstnega primera zaenkrat na nevrološki kliniki ne pomni.
Nika Goljar iz Univerzitetnega rehabilitacijskega inštituta (URI) Soča pa je opozorila na nezadostno zmogljivost znotraj služb, kjer potekajo rehabilitacijski postopki. Po njenih besedah so bili številni bolniki po preboleli možganski kapi tako že pred pandemijo deležni pomanjkljive oskrbe, v zadnjem letu pa se je stanje še poslabšalo. Čakalne dobe so se podaljšale, s tem pa so se povečale tudi obremenitve svojcev. Kljub temu se po besedah Goljarjeve v URI Soča trudijo storitve kar se da nemoteno izvajati, postopno pa uvajajo tudi pogoje za telerehabilitacijske storitve.
V evropski organizaciji za možgansko kap (ESO) in Zavezništvu za možgansko kap za Evropo (SAFE) medtem pozivajo ministrstva za zdravje po vsej Evropi, naj podpišejo izjavo v zvezi z akcijskim načrtom za ukrepanje ob možganski kapi za Evropo. Ministra za zdravje Janeza Poklukarja prosijo, naj to pobudo podpre in skupaj z drugimi evropskimi državami pokaže svojo zavezanost k izboljšanju preprečevanja in zdravljenja možganske kapi ter oskrbe in podpore po možganski kapi vsem državljanom Slovenije. S tem naj minister doda svoj glas v boju proti možganski kapi v Evropi, je v imenu omenjenih organizacij sporočila nevrologinja Bojana Žvan.
“,”Jaka Verbic Miklic”,1620303360,1620303360,sl,14749,306,14748,43,0,NULL,,”Ob sumu na možgansko kap bistveno hitro ukrepanje”,ob-sumu-na-mozgansko-kap-bistveno-hitro-ukrepanje,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1621772272,1621772586
785,14751,”Za povišanim krvnim tlakom trpi tretjina odraslih”,” Približno ena tretjina odraslih ima arterijsko hipertenzijo oziroma povišan krvni tlak”,”
Ljubljana, 17. maja – Danes je svetovni dan hipertenzije. Približno ena tretjina odraslih ima arterijsko hipertenzijo oziroma povišan krvni tlak. To je resno zdravstveno stanje, ki močno poveča tveganje za srčno-žilne dogodke, možgansko kap in ledvično bolezen, so sporočili iz Zbornice zdravstvene in babiške nege Slovenije.
V zadnjem obdobju veliko časa posvečamo okužbam s koronavirusom in pozabljamo na kronične bolezni, med katere sodi tudi arterijska hipertenzija. Zaradi nje in njenih posledic na svetu umre veliko ljudi, so v Zbornici – Zvezi povzeli izjavo predsednice Sekcije medicinskih sester in zdravstvenih tehnikov v kardiologiji in angiologiji Irene Trampuš.
Poudarila je tudi pomembno vlogo medicinskih sester, saj s pravilno izvedenimi meritvami ter ozaveščanjem in motiviranjem prebivalstva pomagajo pri temu, da je diagnoza stanja pravilno diagnosticirana in zdravljena.
Svetovna liga za hipertenzijo od leta 2005 obeležuje svetovni dan hipertenzije. Zdravstveni delavci s ciljem ozaveščanja o nevarnosti te bolezni izvajajo meritve arterijskega krvnega tlaka vsem, ki to želijo, in svetujejo ter opozarjajo na pomen urejenega krvnega tlaka in njegovih vrednosti.
Kljub omejenim možnostim zaradi epidemioloških razmer se bo tudi letos v zdravstvenih domovih po Sloveniji maja odvijala akcija meritev arterijskega krvnega tlaka, ki poteka pod sloganom Mesec meritev maj 2021 (MMM21), so dodali v Zbornici zdravstvene in babiške nege Slovenije – Zvezi strokovnih društev medicinskih sester, babic in zdravstvenih tehnikov Slovenije (Zbornica – Zveza).
“,”Jaka Verbic Miklic”,1621255320,1621255320,sl,14751,306,14750,43,0,NULL,,”Za povišanim krvnim tlakom trpi tretjina odraslih”,za-povisanim-krvnim-tlakom-trpi-tretjina-odraslih,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1621773817,1621773817
786,14753,”Danes obeležujemo svetovni dan kronične vnetne črevesne bolezni”,”Posvečen je ljudem z ulceroznim kolitisom in Chronovo boleznijo”,”
Ljubljana, 19. maja – Danes obeležujemo svetovni dan kronične vnetne črevesne bolezni, ki je posvečen ljudem z ulceroznim kolitisom in Chronovo boleznijo. Nastanek te bolezni, katere simptomi bolnike spremljajo praviloma vse življenje, je odločilno povezan predvsem z genetsko predispozicijo, so ob dnevu spomnili v Društvu za kronično vnetno črevesno bolezen.
Kot so zapisali na spletni strani društva, je vzrok možno pripisati tudi nenormalnim imunskim odzivom obrambnega sistema, zaradi česa pride do prekomernega vnetja v sluznici črevesja.
Kronično vnetno črevesno bolezen sicer delimo na dve skupini, in sicer ulcerozni kolitis in Crohnovo bolezen, v desetih do 15 odstotkih pa je zdravniki ne morejo uvrstiti v nobeno od navedenih.
Ulcerozni kolitis praviloma prizadene samo debelo črevo, vnetje je omejeno na sluznico in podsluznico, vnetni proces pa poteka neprekinjeno in brez vmesnih neprizadetih predelov sluznice.
Pri Crohnovi bolezni pa lahko vnetni proces zajame katerikoli del prebavil od ust do zadnjične odprtine, prizadene vse sloje črevesne stene, značilno pa je tudi menjavanje vnetih in zdravih segmentov črevesne stene.
Značilni bolezenski znaki pri tej bolezni so bolečine v trebuhu, mehkejše, vodenasto ali krvavo blato ter hujšanje ali nenapredovanje teže. Kot je še razbrati s spletne strani društva, bolezen spremljata tudi zaostanek v rasti in pubertetnem razvoju, redkeje pa tudi bolečine v sklepih in kosteh, slab apetit, kožne spremembe in otekline sklepov.
Bolezen zdravijo z zdravili, kot so kortikosteroidi, aminosalicilati in imunosupresivi, ter biološkimi zdravili. Pri zdravljenju pa je pomembna tudi enetralna prehrana, ki omogoča vzpostavitev začasnega izboljšanja zdravstvenega stanja in pomaga nadomestiti izgubljeno telesno težo. V primeru, da bolezni ne bi zdravili, bi lahko slednja huje napredovala ter vodila v resne zaplete ali celo smrt.
Ob dnevu kronične vnetne črevesne bolezni društvo pripravlja novinarsko konferenco, na kateri bodo strokovnjaki spregovorili predvsem o duševnih stiskah ljudi, ki se z njo spopadajo.
“,”Jaka Verbic Miklic”,1621428480,1621428480,sl,14753,306,14752,43,0,NULL,,”Danes obeležujemo svetovni dan kronične vnetne črevesne bolezni”,danes-obelezujemo-svetovni-dan-kronicne-vnetne-crevesne-bolezni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1621774212,1621774213
788,14759,”Javna objava prenosov vrednosti ZD, ZO in DB 2020″,” “,”
Po enotnem Kodeksu ravnanja (v nadaljevanju Kodeks), ki je veljaven do 1.1.2021 in združuje prejšnje tri Kodekse (Kodeks Transparentnosti, Kodeks sodelovanja z zdravstvenimi delavci in Kodeks sodelovanja z društvi bolnikov), bodo članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ (v nadaljevanju Forum) tudi v letošnjem letu javno objavile prenose vrednosti zdravstvenim delavcem, zdravstvenim organizacijam in društvom bolnikov. Kot določa enotni Kodeks, bodo podatke objavile do vključno 30. junija 2021.
Objava zajema podatke o prenosih vrednosti v preteklem koledarskem letu in na spletnih straneh posameznih članic ponuja vpogled v prenose v obdobju od 1. januarja do 31. decembra 2020. Po določilih zveze EFPIA se podatki javno objavljajo periodično, vsako leto, najkasneje do konca meseca junija, in sicer za preteklo koledarsko leto.
Javna objava prenosov vrednosti vključuje podatke o vrednostih vseh sredstev, ki so jih prejeli posamezni zdravstveni delavci, zdravstvene organizacije in društva bolnikov s katerimi sodelujejo posamezne članice Foruma ali Forum – bodisi neposredno ali prek tretjih oseb, kot so agencije za organizacijo dogodkov. Javna objava vsebuje tudi informacije o vrsti dejavnosti ali tipu podpore:
Te prenose vsaka članica Foruma objavi v slovenskem jeziku na svoji lokalni, regijski ali mednarodni spletni strani.
Vsi prenosi zdravstvenim organizacijam, kamor se po Kodeksu ravnanja uvrščajo javne zdravstvene institucije, zdravniška društva, združenja, zbornice in zasebna podjetja (d. o. o. in s. p.), so skladno z zakonodajo objavljeni individualno s polnim nazivom prejemnika.
Pri prenosih vrednosti posameznim zdravstvenim delavcem, fizičnim osebam, je objava v skladu z Zakonom o varstvu osebnih podatkov mogoča samo na podlagi predhodnega pisnega soglasja zdravstvenega delavca. V nasprotnem primeru se prenos objavi v skupinski obliki, pri čemer je v vsaki kategoriji navedeno število prejemnikov ter skupni znesek takim prejemnikom.
Podatki o plačilih na področju raziskav in razvoja zaradi varstva konkurence ter inovacij, ki jih razvijajo posamezne družbe, skladno z zakonodajo ne morejo biti objavljeni drugače kot v skupinski obliki.
Podatki, objavljeni v tem poročilu, so izraz naših prizadevanj za ravnanje skladno z zahtevami Kodeksa ravnanja in zveze EFPIA (Code of Conduct). Če se kljub našim prizadevanjem za zagotovitev natančnih objav zgodi, da poročilo vsebuje nepopolne ali netočne podatke, bomo to raziskali in morebitne napačne podatke ustrezno popravili.
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ, je v koledarskem letu 2020 sodeloval z različnimi organizacijami: sponzorsko je podprl aktivnosti Slovenskega zdravniškega društva, šestim organizacijam je poravnal stroške povezane z izvajanjem storitev in svetovanjem, izplačani sta bili dve donaciji.
Skupna vrednost prenosov Foruma zdravstvenim organizacijam je v letu 2020 znašala 68.380 EUR. V letu 2020 ni bil izveden noben prenos na zdravstvene delavce. Vrednost prenosov društvom bolnikov je znašala 7.000 EUR.
Javno objavljeni podatki zajemajo prenose vrednosti, ki so bili v finančnem sistemu Foruma dejansko izvršeni v koledarskem letu 2020, to je od vključno 1. januarja 2020 do vključno 31. decembra 2020.
Prenosi zdravstvenim organizacijam in društvom bolnikov so navedeni kot neto zneski tovrstnih pogodb, ki ne vključujejo DDV.
Vsi navedeni zneski predstavljajo skupne vrednosti za leto 2020.
Vse navedene transakcije so bile izvršene v koledarskem letu 2020, torej od vključno 1. januarja 2020 do vključno 31. decembra 2020.
Vrednosti prenosov sredstev zdravstvenim organizacijam in društvom bolnikov so navedene v neto zneskih (brez DDV).
Skladno s Kodeksom ravnanja je zdravstvena organizacija (ZO) opredeljena kot:
Zdravstvene delavce (ZD) Kodeks ravnanja opredeljuje kot:
Za namen tega Kodeksa, definicija ZD vključuje:
Skladno s Kodeksom ravnanja je društvo bolnikov (DB) opredeljeno kot:
Kodeks ravnanja je v celoti dostopen na tej povezavi.
Priloga A
Priloga B
“,”Jaka Verbic Miklic”,1623393720,1623393720,sl,14759,306,14758,43,0,NULL,,”Javna objava prenosov vrednosti ZD, ZO in DB 2020″,javna-objava-prenosov-vrednosti-zd-zo-in-db-2020,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,0,0,1623393878,1717345595
789,14761,”Medicina danes: Okrogla miza o redkih boleznih “,”Medicina danes je ob podpori Mednarodnega foruma znanstvenoraziskovalnih družb, organizirala virtualno okroglo mizo”,”
Psihosocialna podpora ključna za bolnike z redkimi boleznimi
Medicina danes je ob podpori Mednarodnega foruma znanstvenoraziskovalnih družb, organizirala virtualno okroglo mizo na temo »Kaj potrebujejo osebe z redkimi boleznimi«. Gre za pomembno tematiko, saj so – kot so opozorili sogovorniki na okrogli mizi – bolniki z redkimi boleznimi v zdravstvenem sistemu pogosto spregledani, da so diagnosticirani, pa morajo pogosto vložiti tudi veliko svojega časa in denarja. Specifičnega znanja, resursov in pomoči namreč s strani svojih zdravnikov specialistov pogosto ne dobijo.
Na okrogli mizi so sodelovali prof. Jože Faganel iz Združenja za redke bolezni Slovenije, Sara Brajlo, predsednica Hrvaškega združenja za redke bolezni, Erika Stariha, mag. farm. spec. klin. farm iz Iniciative za povezovanje staršev otrok z nediagnosticiranimi redkimi boleznimi in ustanoviteljica Evropske fundacije SATB2, Gabi Bezjak, bolnica z visoko malignim endometrijskim stromalnim sarkomom ter Kristina Modic iz Slovenskega združenja bolnikov z limfomom in levkemijo. Sogovorci so se strinjali, da je situacija za bolnike z redkimi boleznimi pri nas in v tujini slaba ter predstavili rešitve za izboljšavo.
Kot je v svoji zgodbi opisala Erika Stariha, ima njen sin redko genetsko bolezen SATB2. A na diagnozo je čakal skoraj sedem let – vse od svojega rojstva. V tem času sta z možem tavala v temi, saj sta bila razpeta med dvema možnima scenarijema – od tega da njun sin ne bo preživel, do tega da bo vse v redu. »V sedmih letih brez diagnoze sva pogrešala predvsem psihološko podporo, saj nisva vedela, kaj mu je – ali gre za gensko bolezen, ga lahko cepimo, lahko poskusimo z drugačnim zdravljenjem? Bilo je veliko dilem, kaj nas čaka v prihodnosti in ob vsem tem psihološkem bremenu nisva našla nikogar, da bi nama pomagal,« je povedala Stariha.
Da je tudi sama tavala v temi in da brez samoiniciative verjetno danes še vedno ne bi vedela, kakšno bolezen ima, je povedala tudi Gabi Bezjak, ki trpi za zelo redko obliko raka – visoko malignim endmetrijskim stromalnim sarkomom. Sama je iskala pomoč doma in v tujini, vse skupaj pa jo je stalo veliko časa – ki bi ga sicer lahko preživela z družino – predvsem pa veliko denarja. Sama je v tujini našla enega največjih strokovnjakov za sarkome, ki ji je povedal za različna tarčna zdravila. Kot je povedala, v Evropi obstaja mreža strokovnjakov za sarkome, tudi mednarodni konzilij, a se jih domači strokovnjaki ne udeležujejo, bolnike s to boleznijo pa prepuščajo same sebi.
Tudi Kristina Modic iz Slovenskega združenja bolnikov z limofmom in levkemijo pravi, da v združenju opažajo pomanjkanje psihosocialne podpore ter usmerjanje bolnikov po diagnozi.
Podobno tudi na Hrvaškem
Na Hrvaškem je situacija boljša, a še vedno ni dobra, je povedala Sara Brajlo. Njihovo združenje za redke bolezni je z namenom boljše obravnave bolnikov z redkimi boleznimi ustvarilo projekt Baza redkih bolezni, ki vsebuje kvantitativne podatke o redkih boleznih. Te so dobili na vzorcu 860 oseb, prikazujejo pa sociodemografske značilnosti bolnikov z redkimi boleznimi, njihov zdravstveni in socialni profil ter nabor potreb hrvaških bolnikov z redkimi boleznimi. Kot so ugotovili, je pot bolnikov do diagnoze zelo dolga in – podobno kot v Sloveniji – so v tem času prepuščeni samim sebi.
Samo 12 % njihovih članov je denimo zdravstvena inštitucija ob diagnozi napotila k uveljavljanju svojih pravic, ostali niso prejeli nobenih podatkov, kako naprej. Medtem ko jih ima kar 70 % redne mesečne stroške za terapije oz. zdravljenje.
Prav tako starši otrok z redkimi boleznimi, zaradi potrebne 24-urne oskrbe otroka, ne zmorejo obdržati redne službe, zato imajo pogosto le minimalne prihodke, zdravljena pa so finančno zelo obremenjujoča.
So kakšne možnosti za izboljšanje sistema?
Stariha ob tem poudarja, da je na tem področju veliko prostora za izboljšave. Prva je že ta, da se v sistemu ustvari register tistih, ki so še brez diagnoze. Pa tudi, da se preiskave, kot je na primer sekvenciranje celotnega eksoma, ob klinični obravnavi ne postavijo na zadnje mesto. Prav tako bi se po njenem morali domači specialisti vključiti v evropske strokovne mreže in si s tujimi strokovnjaki redno izmenjevati informacije. Bezjakova pa dodaja, da bi potrebovali tudi drugačen sistem plačevanja storitev za diagnosticiranje, saj te največkrat niso vključene v zdravstveno zavarovanje – še posebej če se bolniki odločijo, da bodo odgovore iskali v tujini.
S tem se strinja tudi prof. Jože Faganel iz Združenja za redke bolezni Slovenije, ki pravi, da bi moralo za redke in rakave bolezni celotne stroške zdravljenja kriti zdravstveno zavarovanje.
Svetla prihodnost za SATB2
Stariha je sicer pobudnica in tudi ena od ustanoviteljic Evropske fundacije SATB2, s katero želijo preko ene mreže povezati vse tiste, ki trpijo za to boleznijo. Njihova vizija je izboljšanje kvalitete življenja, od odkritja bolezni do zdravljenja ter oskrbe znotraj evropskega zdravstvenega sistema.
Vsi sodelujoči na okrogli mizi so mnenja, da se zdravljenje bolnikov z redkimi boleznimi izboljšuje, a da je ta proces prepočasen. Zato pozivajo stroko in pristojne, da tudi z zakonom uredi področje diagnosticiranja in zdravljenja redkih bolezni.
Celoten pogovor lahko pogledate na tej povezavi.
“,”Jaka Verbic Miklic”,1624701900,1624701900,sl,14761,306,14760,43,0,NULL,,”Medicina danes: Okrogla miza o redkih boleznih “,medicina-danes-okrogla-miza-o-redkih-boleznih,Post,/sites/43/files/images/news/ali-resnicno-poznamo-potrebe-ljudi-z-redkimi-boleznimi.jpg,1,0,1624701993,1624702052
790,14763,”Na Alzheimer Cafeju o soočanju z demenco v EU in Sloveniji”,”Na pogovoru v organizaciji Spominčice – Alzheimer Slovenija so danes z evropsko poslanko Romano Tomc (EPP) spregovorili o težavah oseb z demenco”,”
Ljubljana/Bruselj, 20. maja – Na pogovoru v organizaciji Spominčice – Alzheimer Slovenija so danes z evropsko poslanko Romano Tomc (EPP) spregovorili o težavah oseb z demenco in njihovih svojcev v času covida-19 ter potrebnih sistemskih ureditvah. Tomčeva je poudarila pomen zakona o dolgotrajni oskrbi, ki sega tudi na področje demence, in izrazila upanje, da bo čim prej sprejet
Osrednja tema tokratnega spletnega pogovora s slovenskimi poslanci v Evropskem parlamentu je obravnava področja demence na ravni EU in v Sloveniji. Predsednica društva Spominčica Štefanija L. Zlobec je povedala, da Tomčeva, ki je tudi članica Alzheimer’s Alliance, podpira razpravo o demenci v Evropskem parlamentu, kar je izrazila tudi s podpisom pobude, da demenca postane ena prednostnih nalog javnega zdravstva. Zato je Zlobčevo zanimalo, kaj konkretnega so v tem letu naredili.
“To leto je bilo zaradi dela na daljavo specifično za Evropski parlament in za naše delo. Kljub temu so naša prizadevanja, pogovori, sestanki in dokumenti, ki smo jih sprejemali, potekali nemoteno naprej. V skladu s podpisano pobudo vedno znova opozarjam na pomen demence pri prepoznavanju bolezni kot ene izmed prioritet ne samo v EU, tudi doma,” je povedala. Pri tem je omenila poročilo o demografiji, o katerem bo prihodnji teden glasoval evropski odbor za zaposlovanje in socialo.
Sama je v tem poročilu poleg drugih stvari izpostavila potrebo po večji prepoznavnosti oz. interesu za ukvarjanje z demenco in njenimi posledicami. Vesela je, da so te pobude skoraj vedno zelo pozitivno sprejete, saj so kolegi poslanci po njenih navedbah naklonjeni temu, da se v takšnih dokumentih, ki jih sprejemajo v Evropskem parlamentu, demenca uvršča na zelo visoko mesto.
V nadaljevanju je Tomčeva izpostavila pomen strategije obvladovanja demence, ki se je iztekla lani, v pripravi pa je nova do leta 2030. Prav se ji zdi, da so strateške usmeritve na tem področju, a še bolj pomembno je, da te strategije, kot pravi, “dejansko pridejo v življenje”. Za to pa je zadolžena politika, ki mora vzpostaviti primerno okolje, da se določene težave in izzivi lahko rešujejo, je poudarila.
Pri tem je omenila dolgo in težko pričakovani zakon o dolgotrajni oskrbi, ki v veliki meri posega na področje demence in za katerega upa, da bo kmalu sprejet. Zakon, pri katerem je Tomčeva sodelovala, bo na vladi predvidoma junija. “Zakon v Sloveniji zelo zelo nujno potrebujemo,” zatrjuje Tomčeva, ki je prepričana, da so v njem dobre rešitve za vsa področja. Našli so tudi rešitev glede financiranje dolgotrajne oskrbe.
Novega prispevka vsaj v tem začetnem obdobju ne bo. Kot je pojasnila, je vlada našla finančne vire v državnem proračunu in v evropskih projektih, kar bo omogočilo plačevanje oskrbnikov in družinskih pomočnikov, ki bodo pomagali osebam z demenco.
“,”Jaka Verbic Miklic”,1621489680,1621489680,sl,14763,306,14762,43,0,NULL,,”Na Alzheimer Cafeju o soočanju z demenco v EU in Sloveniji”,na-alzheimer-cafeju-o-soocanju-z-demenco-v-eu-in-sloveniji,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1624859416,1624859472
791,14765,”Ob letošnjem evropskem tednu boja proti raku izpostavljajo pomen cepljenja proti HPV”,”Ob letošnjem evropskem tednu boja proti raku izpostavljajo pomen cepljenja proti HPV”,”
Ljubljana, 25. maja – Pod okriljem Zveze evropskih društev proti raku poteka od danes do konca maja tradicionalni Evropski teden boja proti raku. Letos opozarjajo na pomen cepljenja proti HPV pri obvladovanju raka, so sporočili z Onkološkega inštituta Ljubljana. V prihodnjem šolskem letu bodo lahko prvič po programu cepljenja proti HPV cepljeni tudi dečki.
Okužba s HPV povzroča različne rake in druge bolezni, tako pri ženskah kot pri moških. Raki, ki jih povzročajo okužbe s HPV, pa so najbolj preprečljivi med vsemi raki, navajajo na onkološkem inštitutu in dodajajo, da bo Slovenija s cepljenjem dečkov dosegla pomemben mejnik v obvladovanju rakov in drugih bolezni, ki jih povzročajo okužbe s HPV.
“Cepljenje dečkov je pomembno iz dveh razlogov. Prvi je, da bodo sedaj tudi slovenski dečki zaščiteni pred boleznimi, ki jih povzročajo okužbe s HPV. Drugi je, da bo cepljenje dečkov doprineslo k vzpostavitvi kolektivne imunosti in s tem tudi k eliminaciji raka materničnega vratu ter k boljšemu obvladovanju drugih rakov in bolezni, ki jih okužbe s HPV povzročajo,” je pojasnila predsednica Zveze slovenskih društev za boj proti raku in vodja Državnega programa ZORA Urška Ivanuš.
Svetovna zdravstvena organizacija je nedavno prepoznala Slovenijo kot državo, ki bo morda med prvimi uspela eliminirati raka materničnega vratu, saj že dosegamo dva od treh ciljev Svetovne zdravstvene organizacije za eliminacijo raka materničnega vratu, to sta več kot 70-odstotna udeležba žensk v programu ZORA in več kot 90 odstotkov odkritih predrakavih sprememb materničnega vratu učinkovito zdravljenih.
Ivanuševa ob tem poudarja, da Slovenijo čaka še tretji cilj, to je doseči 90-odstotno precepljenost deklic proti HPV. S tako precepljenostjo bi ustvarili tudi kolektivno imunost in s tem pred boleznimi, ki jih povzroča HPV, zaščitili tudi tiste, ki se ne morejo cepiti. Na Koroškem to precepljenost skoraj že dosegajo, zato Ivanuševa ne vidi razloga, da je ne bi v prihodnje tudi v drugih slovenskih regijah.
Vodja sektorja za preprečevanje bolezni in poškodb na ministrstvu za zdravje Mojca Gobec pa je izpostavila pomen usklajenega delovanja in sodelovanja stroke, civilne družbe in ministrstva. Glede cepljenja dečkov v prihodnjem šolskem letu pa je pojasnila, da bodo prvič v 6. razredu osnovne šole brezplačno cepili ne le deklice, temveč tudi dečki po vsej Sloveniji.
S tem se bo Slovenija pridružila številnim državam po svetu in v Evropi, ki v okviru nacionalnega progama cepljenja proti HPV poleg deklic cepijo tudi dečke. “Cepivo je varno in učinkovito preprečuje s HPV povezane rake in druge bolezni. Ministrstvo bo še naprej podpiralo aktivnosti za boljšo ozaveščenost ter podpiralo nevladne organizacije, ki delujejo na tem področju,” je poudarila.
“,”Jaka Verbic Miklic”,1621921860,1621921860,sl,14765,306,14764,43,0,NULL,,”Ob letošnjem evropskem tednu boja proti raku izpostavljajo pomen cepljenja proti HPV”,ob-letosnjem-evropskem-tednu-boja-proti-raku-izpostavljajo-pomen-cepljenja-proti-hpv,Post,,1,0,1624859531,1624859531
793,14769,”Združenje multiple skleroze poudarja pomen celostne obravnave bolnikov”,”V združenju multiple skleroze so z današnjo novinarsko konferenco izpostavili pomen celostne in multidisciplinarne obravnave bolnikov”,”
Ljubljana, 27. maja – V združenju multiple skleroze so z današnjo novinarsko konferenco izpostavili pomen celostne in multidisciplinarne obravnave bolnikov s to neozdravljivo avtoimunsko vnetno boleznijo, ki prizadene osrednji živčni sistem. Poudarili so tudi pomen podporne mreže različnih strok in institucij, ki bolnikom pomagajo pri vključevanju v vsakdanje življenje.
Multipla skleroza se pojavlja kronično ali v presledkih in odločilno vpliva na bolnikovo življenje. Najpogosteje se pojavi med 20. in 40. letom, med obolelimi pa je dve tretjini žensk in tretjina moških, je pojasnil vodja centra za multiplo sklerozo na ljubljanski nevrološki kliniki Gregor Brecl Jakob. V Sloveniji je registriranih okoli 2500 bolnikov s to boleznijo, na svetu jih je okoli tri milijone.
Natančno število bolnikov z multiplo sklerozo v Sloveniji ni znano, po oceni stroke pa jih je med 3100 in 3500. Po besedah Brecl Jakoba so simptomi bolezni raznoliki: zamegljenost vida na eno oko, dvojni vid, mravljinčenje in odrevenelost, oslabelost udov, motnje ravnotežja in utrudljivost. Bolnik ima lahko tudi motnje koncentracije, motnje mokrenja in spolne motnje.
Brecl Jakob je poudaril pomen zgodnjega diagnosticiranja in zdravljenja multiple skleroze, kar pa je v primeru atipičnih simptomov oteženo. Obstajata dve vrsti zdravljenja. Najpomembnejša so zdravila, ki na dolgi rok vplivajo na potek bolezni in lahko zavrejo dolgoročno nevrološko prizadetost. Druga skupina zdravil pa blaži simptome, zlasti v obdobju zagona oziroma poslabšanja bolezni.
Ana Ožura Brečko iz službe za nevrorehabilitacijo na ljubljanski nevrološki kliniki je opozorila, da se bolniki z multiplo sklerozo zelo težko soočijo z boleznijo in jo sprejmejo, kar pa vpliva tako na potek bolezni kot njeno zdravljenje. Pogosto jih mučijo depresija, anksioznost, motnje spanja, stres in utrudljivost, zato v okviru podpornih terapij potrebujejo tudi psihološko in psihiatrično pomoč.
Zaradi pomena celostne in multidisciplinarne obravnave bolnikov z multiplo sklerozo je Brecl Jakob izrazil potrebo po boljši dostopnosti različnih strokovnjakov, izboljšati pa bi se morala tudi dostopnost ambulantne obravnave. Opozoril je, da so omejitve zaradi epidemije covida-19 povzročile manj optimalno zdravljenje, nekatere podporne terapije so tudi obstale. Negotovost zaradi epidemije je poslabšala tudi duševno zdravje bolnikov.
Združenje multiple skleroze, ki ima okoli 2100 članov, bolnikom nudi tudi psihosocialno pomoč. Predsednik združenja Pavel Kranjc je posebej opozoril na potrebo bolnikov po druženju v okviru skupin za samopomoč, kjer skozi pogovor izmenjujejo svoje izkušnje z boleznijo. Kako pomembno je druženje, se je izrazito pokazalo v času dolgotrajne epidemije, ko zaradi zaščitnih ukrepov to ni bilo mogoče.
Sicer je tema letošnjega svetovnega dneva multiple skleroze, ki bo 30. maja, povezovanje za boljšo zdravstveno oskrbo in povezovanje celotne skupnosti za podporo bolnikom, pa tudi povezovanje bolnika s samim seboj pri sprejemanju bolezni. Že drugo leto zapored je globalni slogan svetovnega dne #MSPovezujemo, ki poziva tudi k zagotovitvi podporno mrežo za bolnike.
“,”Jaka Verbic Miklic”,1622093040,1622093040,sl,14769,306,14768,43,0,NULL,,”Združenje multiple skleroze poudarja pomen celostne obravnave bolnikov”,zdruzenje-multiple-skleroze-poudarja-pomen-celostne-obravnave-bolnikov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1625549164,1625549164
794,14771,”Svetovni dan brez tobaka v znamenju opuščanja kajenja”,”Letošnja tema je bila izbrana v podporo 780 milijonom ljudem po vsem svetu, ki želijo opustiti kajenje.”,”
Ljubljana, 31. maja – Zadnji dan v maju obeležujemo svetovni dan brez tobaka, ki je letos posvečen opuščanju kajenja in poteka pod geslom Odločeni! Opuščamo kajenje. Po podatkih se razširjenost kajenja v Sloveniji zmanjšuje, vse, ki kadijo, pa se spodbuja k opustitvi kajenja. NIJZ jim svetuje, da se vključijo v številne brezplačne programe za opuščanje kajenja.
Po mnenju predstavnice in vodje urada Svetovne zdravstvene organizacije (WHO) v Sloveniji Aige Rurane je treba v vseh državah okrepiti politike in zmogljivosti za opustitev rabe tobaka. Prepričana je, da bo letošnja kampanja pomagala ustvariti bolj zdrava okolja, ki spodbujajo opuščanje kajenja z učinkovitimi politikami in ozaveščanjem o taktiki tobačne industrije.
V Sloveniji smo s prejetimi ukrepi v zadnjih štirih letih po oceni ministra za zdravje Janeza Poklukarja okrepili nadzor nad tobakom tako na področju prepovedi oglaševanja kot ozaveščanja ljudi s slikovno besedilnimi zdravstvenimi opozorili. Direktor Nacionalnega inštituta za javno zdravje (NIJZ) Milan Krek je prepričan, da bomo s strategijo za zmanjševanje posledic rabe tobaka, ki je trenutno v obravnavi, “Slovenijo popeljali po poti brez tobaka, kot si želimo, do leta 2040”.
Še vedno pa pri nas kadi vsak peti prebivalec, star 25 do 74 let, večina redno vsak dan, zaradi tobaka pa jih vsak teden umre 60. Ob tem Helena Koprivnikar z NIJZ opozarja, da med 15-letniki beležijo višanje deleža uporabnikov elektronskih cigaret, vodnih pip in brezdimnih tobačnih izdelkov, med odraslimi pa višanje odstotka uporabnikov elektronskih cigaret.
Opustitev kajenja prinese številne koristi za zdravje v vsakem starostnem obdobju. Prej ko posameznik preneha s kajenjem in uporabo drugih tobačnih izdelkov, večje so koristi za njegovo zdravje. Največje so, če kajenje opusti pred 40. letom, izpostavljajo na ministrstvu za zdravje in NIJZ.
Kajenje je dejavnik tveganja za razvoj bolezni srca in ožilja, dihal, raka pljuč in številnih drugih rakov. Povečuje smrtnost zaradi bolezni srca in ožilja ter dihal, okužb, sladkorne bolezni in številnih drugih bolezni.
Za uspešno odvajanje od kajenja je po mnenju Saše Kadivec z Univerzitetne klinike za pljučne bolezni in alergijo Golnik ključna kombinacija vedenjske terapije, farmakološkega zdravljenja in terapevtskega pristopa. Da je opustitev kajenja daleč najboljša investicija v prihodnost vsakega kadilca, pritrjuje tudi Nina Rogelj Peloza iz Mladinske zveze Brez izgovora Slovenija. Prepričana je, da še posebej v pandemičnih časih predstavlja odvajanje od kajenja pametno izbiro, saj so kadilci veliko bolj dovzetni za okužbo z novim koronavirusom in poznejše zaplete.
V Sloveniji je tudi v času epidemije na voljo več vrst pomoči pri opuščanju kajenja, številne so brezplačne. Tomaž Čakš z NIJZ vsem, ki želijo opustiti kajenje, priporoča preizkušene, varne in klinično testirane pripomočke, s strani Agencije za zdravila odobrene nikotinske nadomestke ter zdravila na recept. Elektronske cigarete ali novi tobačni izdelki, v katerih se tobak segreva, niso pripomočki za opuščanje kajenja, zato jih odsvetujejo.
Slovenska zveza za javno zdravje, okolje in tobačno kontrolo danes vabi k prijavi v kampanjo na Facebooku za spodbujanje in pomoč k opuščanju kajenja.
Letošnja tema je bila izbrana v podporo 780 milijonom ljudem po vsem svetu, ki želijo opustiti kajenje.
“,”Jaka Verbic Miklic”,1622438940,1622438940,sl,14771,306,14770,43,0,NULL,,”Svetovni dan brez tobaka v znamenju opuščanja kajenja”,svetovni-dan-brez-tobaka-v-znamenju-opuscanja-kajenja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1625549443,1625549886
795,14773,”Ob svetovnem dnevu krvodajalstva tudi pričetek iniciative Daruj energijo za življenje”,”Ob današnjem svetovnem dnevu krvodajalstva bo že enajsto leto zapored stekla iniciativa Daruj energijo za življenje”,”
Ljubljana, 4. junija – Ob današnjem svetovnem dnevu krvodajalstva bo že enajsto leto zapored stekla iniciativa Daruj energijo za življenje, ki širi sporočilo o solidarnosti, empatiji in velikem pomenu krvodajalstva za nemoteno delovanje zdravstva. Na pomen krvodajalstva je v svoji poslanici spomnil tudi letošnji pokrovitelj dneva predsednik republike Borut Pahor.
“Krvodajalstvo je najbolj množična in plemenita oblika solidarnosti in ima v Sloveniji zares dolgoletno in ugledno tradicijo,” je ob dnevu dejal Pahor. “Med nami je postalo vrednota, ki se prenaša med generacijami in ni se še zgodilo, da bi kdo, ki bi kri potreboval, ostal brez nje,” je dodal.
Ob tem je spomnil, da kri kljub napredku medicine ostaja nenadomestljivo zdravilo in najdragocenejše darilo, ki ga lahko človek podari sočloveku. Predsednik se je tudi zahvalil vsem krvodajalcem in izrazil željo, da bi darovalo še več ljudi.
K darovanju krvi si prizadevajo tudi v Zavodu za transfuzijsko medicino, kjer znotraj iniciative Daruj energijo za življenje, ki poteka pod sloganom Velika družina srčnih ljudi, predstavljajo krvodajalske družine, v katerih kri daruje več generacij.
V Sloveniji sicer dnevno za bolnike potrebujemo v povprečju od 300 do 350 krvodajalcev na dan. Kot so v zavodu še zapisali na svoji spletni strani, se Slovenija s številom krvodajalcev uvršča v evropsko povprečje, na področju preskrbe s krvjo pa smo samozadostni. Ob tem so izpostavili tudi dobro zgrajen sistem krvodajalstva in visoko pripravljenost ljudi za darovanje krvi. Od leta 2011 so tako skupaj s partnerstvom Rdečega križa Slovenije in Petrola zabeležili skoraj 95.000 novih krvodajalcev.
Krvodajalske akcije bodo potekale tudi danes. Kri je tako možno darovati v Ljubljani, in sicer na naslovu zavoda, ter v osnovni šoli Korena v Dupleku. Ob svetovnem dnevu bo ob obisku zavoda kri daroval tudi minister za zdravje Janez Poklukar.
“,”Jaka Verbic Miklic”,1622784960,1622784960,sl,14773,306,14772,43,0,NULL,,”Ob svetovnem dnevu krvodajalstva tudi pričetek iniciative Daruj energijo za življenje”,ob-svetovnem-dnevu-krvodajalstva-tudi-pricetek-iniciative-daruj-energijo-za-zivljenje,Post,,1,0,1625549856,1625549856
796,14775,”V Sloveniji odslej na voljo zdravilo za napredovalega raka dojk”,”Bolnikom v Sloveniji je odslej na voljo prvo in edino tarčno zdravilo za napredovalega raka dojk”,”
Ljubljana, 8. junija – Bolnikom v Sloveniji je odslej na voljo prvo in edino tarčno zdravilo za napredovalega raka dojk. Kot so sporočili iz Novartisa, je zdravilo z učinkovino alpelizib novo upanje za bolnike z napredovalim rakom dojk z mutacijo PIK3CA, ki imajo navadno slabšo splošno prognozo.
Alpelizib je prvo in edino zdravilo, posebej odobreno za ljudi z napredovalim rakom dojk, katerih tumorji vsebujejo mutacijo PIK3CA, ki spodbuja rast tumorja in je povezana s slabim odzivom na zdravljenje. Kot so sporočili iz Novartisa, poznavanje statusa PIK3CA omogoča zdravnikom, da bolje pripravijo osebni načrt zdravljenja za bolnike. Bolniki z napredovalim rakom dojk so lahko izbrani za zdravljenje z alpelizibom na podlagi prisotnosti mutacije PIK3CA v vzorcih tumorjev.
V Sloveniji vsako leto za napredovalim rakom dojk zboli okrog 3501 ljudi, po vsem svetu pa 334.000 ljudi. Od tega ima približno 40 odstotkov tistih s podtipom HR+/HER2- mutacijo PIK3CA, kar je povezano s slabo prognozo.
Evropska komisija je alpelizib odobrila julija 2020. Ta odobritev je sledila pozitivnemu mnenju, ki ga je maja 2020 podal Odbor za zdravila za uporabo v humani medicini pri Evropski agenciji za zdravila (EMA). Učinkovino za to zdravilo proizvajajo v Novartisovih Tehničnih dejavnostih v Mengšu.
Slovenija je po poročanju Radia Slovenija ena redkih držav, kjer je to zdravilo dostopno. Na Onkološkem inštitutu so že zdravili bolnice v programu sočutne uporabe, še preden je bilo zdravilo registrirano. V okviru programa, ko proizvajalec daje na voljo zdravila brezplačno, na OI zdravijo 25 bolnic. Gre sicer za drago zdravilo, saj mesečno zdravljenje stane med 3000 in 4000 evrov, povprečni čas jemanja pa je leto dni.
“,”Jaka Verbic Miklic”,1623130740,1623130740,sl,14775,306,14774,43,0,NULL,,”V Sloveniji odslej na voljo zdravilo za napredovalega raka dojk”,v-sloveniji-odslej-na-voljo-zdravilo-za-napredovalega-raka-dojk,Post,,1,0,1625550066,1625550066
797,14777,”Združenje Spominčica pozdravlja odobritev novega zdravila za Alzheimerjevo bolezen”,”Ameriška Uprava za hrano in zdravila (FDA) je v ponedeljek prvič po skoraj 20 letih odobrila novo zdravilo za Alzheimerjevo bolezen”,”
Ljubljana, 9. junija – Ameriška Uprava za hrano in zdravila (FDA) je v ponedeljek prvič po skoraj 20 letih odobrila novo zdravilo za Alzheimerjevo bolezen. Slovensko združenje za pomoč pri demenci Spominčica pozdravlja odkritje zdravila, ki po besedah društva predstavlja velik napredek pri zdravljenju bolezni, so danes sporočili iz združenja.
“Na Spominčici se zavedamo, da je pravočasna diagnoza ključnega pomena za uspešnost zdravljenja bolezni. Odobritev te nove terapije še posebej izpostavlja pomen pravočasne diagnoze! Posameznikom je treba zagotoviti čim večjo korist v najkrajšem možnem času ter jih tudi vključiti v terapije in intervencije,” so v izjavi za javnost zapisali v društvu. “Srčno upamo, da je uvedba tega zdravila, prvega po letu 2003, korak k zagonu tudi drugih raziskav za pomoč in zdravljenje bolezni, ki povzročajo demenco,” so navedli.
Prav tako so izpostavili, da novo zdravilo za marsikoga predstavljala možnost ozdravitve, vendar pa še zdaleč ni edini pomemben dejavnik zdravljenja in oskrbe oseb z demenco. V društvu si prizadevajo za partnerstvo z zdravstvenimi sistemi in zdravniki za zagotovitev pravočasne in natančne diagnoze ter dostop do zdravljenja, vodenja in načrtovanja nege.
Alzheimerjeva bolezen povzroča več kot 60 odstotkov vseh primerov demenc, za katero vsako leto po vsem svetu zboli več kot deset milijonov oseb. V Sloveniji je po ocenah v letu 2018 živelo 34.137 oseb z demenco, to število pa narašča. Ocenjujejo, da bi lahko osebe z demenco v letu 2050 predstavljale kar 3,4 odstotka celotnega prebivalstva Slovenije.
FDA je sklenila, da lahko zdravilo aducanumab, ki ga bodo tržili pod imenom aduhelm, pomaga bolnikom in je edino sredstvo, ki lahko zdravi bolezen, ne pa le odpravlja simptome. Odbor neodvisnih strokovnjakov je sicer ugotovil nezadostne dokaze o koristi zdravila, ki sta ga skupaj razvila ameriški Biogen in japonski Eisai, ter odsvetoval njegovo odobritev.
“,”Jaka Verbic Miklic”,1623217320,1623217320,sl,14777,306,14776,43,0,NULL,,”Združenje Spominčica pozdravlja odobritev novega zdravila za Alzheimerjevo bolezen”,zdruzenje-spomincica-pozdravlja-odobritev-novega-zdravila-za-alzheimerjevo-bolezen,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1625550261,1625550261
798,14779,”Onkološki inštitut: Preživetje bolnikov z rakom se je v zadnjih 20 letih povečalo za 11 odstotkov”,”Starost in stadij raka ob diagnozi sta še vedno ključna za preživetje bolnikov, so še poudarili.”,”
Ljubljana, 10. junija – Preživetje slovenskih bolnikov z rakom se je v zadnjih 20 letih povečalo za 11 odstotkov, so na današnji spletni okrogli mizi, ki je potekala ob predstavitvi rezultatov publikacije o preživetju bolnikov z rakom, izpostavili na onkološkem inštitutu. Starost in stadij raka ob diagnozi sta še vedno ključna za preživetje bolnikov, so še poudarili.
Čeprav se preživetje slovenskih bolnikov z rakom s časom povečuje, pa je le to za nekaj odstotnih točk nižje kot v najuspešnejših evropskih državah. Zato so strokovnjaki na današnji okrogli mizi razpravljali o tem, kaj lahko Slovenija na področju organizacije in kakovosti zdravljenja bolnikov z rakom, v skladu z nastajajočim tretjim državnim programom obvladovanja raka, še izboljša, so v sporočilu za javnost zapisali organizatorji današnje okrogle mize na Onkološkem inštitutu Ljubljana.
“Rak je epidemija 21. stoletja, zato me iskreno veselijo danes predstavljeni podatki, da se preživetje slovenskih bolnikov z rakom s časom izboljšuje. Za obvladovanje bremena raka je potreben celovit pristop in v Sloveniji smo lahko ponosni, da imamo že 10 let državni progam obvladovanja raka, ki z jasno smerjo in cilji celovito povezuje vse dele enega najkompleksnejših sistemov v zdravstvu,” je ob tem poudaril minister za zdravje Janez Poklukar.
Rezultati predstavljene analize so pokazali, da se je v zadnjih 20 letih povečalo predvsem preživetje bolnikov s kožnim melanomom, rakom debelega črevesa in danke ter pljučnim rakom. Za deset odstotnih točk se je povečal tudi delež preživelih žensk, ki zbolijo za rakom dojk. Delež preživelih moških, ki zbolijo za rakom prostate pa se je povečal za več kot 20 odstotnih točk.
V skupino rakov, kjer napredka s časom ni opaziti ali pri katerih preživetje še vedno ostaja majhno, pa sodijo rak trebušne slinavke, rak požiralnika, rak jeter, rak žolčnika in žolčevodov ter možganski tumorji.
“Rak se je v zadnjih desetletjih iz bolezni, ki večinoma jemlje življenja, spremenil v bolezen, ki jo je mogoče z zgodnjim odkrivanjem in dobrim zdravljenjem obvladovati bistveno bolje,” je na okrogli mizi še poudarila strokovna direktorica Onkološkega inštituta Ljubljana Irena Oblak.
Kot je izpostavil koordinator državnega programa obvladovanja raka Branko Zakotnik, je za nadaljnje obvladovanje rakavih obolenj v Sloveniji nujno upoštevati vse z dokazi podprte programe preventive ter izvajati zdravljenje v strokovno sprejemljivih časovnih okvirih.
“,”Jaka Verbic Miklic”,1623303900,1623303900,sl,14779,306,14778,43,0,NULL,,”Onkološki inštitut: Preživetje bolnikov z rakom se je v zadnjih 20 letih povečalo za 11 odstotkov”,onkoloski-institut-prezivetje-bolnikov-z-rakom-se-je-v-zadnjih-20-letih-povecalo-za-11-odstotkov,Post,,1,0,1625550446,1625550446
799,14784,”Slovenjgraška bolnišnica z najsodobnejšim angiografom v širšem prostoru”,”Najsodobnejši angiograf, ki je po navedbah bolnišnice edini tovrstni v jugovzhodni Evropi”,”
Slovenj Gradec, 11. junija – Splošna bolnišnica Slovenj Gradec ima nov, najsodobnejši angiograf, ki je po navedbah bolnišnice edini tovrstni v jugovzhodni Evropi. Celotna naložba, ki so jo uradno odprli danes, je vredna dva milijona evrov. Gre za veliko pridobitev v slovenskem prostoru, je ob odprtju poudarila državna sekretarka Alenka Forte in pohvalila delo bolnišnice.
“Slovenjgraška bolnišnica je bila vedno vodilna, vedno je kazala smer,” je dejala državna sekretarka na ministrstvu za zdravje Alenka Forte in ob tem omenila področje urologije in prve laparoskopske operacije ter tudi bariatrične operacije pri prekomerni debelosti. Tudi ta naložba v sodobno radiološko napravo bo omogočala zelo napredne posege in bo v veliko korist koroški regiji in širšemu slovenskemu zdravstvu ter tudi širše, je dejala Fortejeva.
Novi angiograf v slovenjgraški bolnišnici je zamenjal dobro desetletje starega in iztrošenega, hkrati pa so v bolnišnici na novo uredili tudi prostore, kamor so umestili nov angiograf in v katerih bodo lahko potekali tudi nujni kirurški posegi, je v izjavi medijem povedal direktor Splošne bolnišnice Slovenj Gradec Janez Lavre. Kot pomembno tako za bolnike kot za zaposlene pa je izpostavil, da je z novim aparatom sevalna obremenitev bistveno nižja.
To je največja letošnja naložba koroške bolnišnice in velika pridobitev zanjo, je še dejal Lavre. Bolnišnica bo znesek naložbe poravnala iz lastnih amortizacijskih sredstev v naslednjih petih letih. S starim angiografom so v slovenjgraški bolnišnici pregledali od 20 do 30 bolnikov na mesec, z novim načrtujejo, da bodo mesečno pregledali od 200 do 250 bolnikov, odvisno od potreb in zmožnosti zdravnikov, je povedal Lavre.
V. d. predstojnika bolnišničnega oddelka za diagnostično in intervencijsko radiologijo Miran Jeromel pa je med drugim dejal, da bodo z novim aparatom posege lahko izvajali bistveno bolj varno in uspešneje.
“,”Jaka Verbic Miklic”,1623386940,1623386940,sl,14784,306,14783,43,0,NULL,,”Slovenjgraška bolnišnica z najsodobnejšim angiografom v širšem prostoru”,slovenjgraska-bolnisnica-z-najsodobnejsim-angiografom-v-sirsem-prostoru,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1627966241,1627966263
800,14786,”Začetek kampanje ob svetovnem dnevu krvodajalstva”,”Darujte kri in svet naj bije!”,”
Ljubljana, 14. junija – Ob svetovnem dnevu krvodajalstva, ki ga obeležujemo danes, se začenja letošnja kampanja ob dnevu krvodajalstva, ki bo potekala pod sloganom “Darujte kri in svet naj bije!”. Kampanja poudarja prispevek krvodajalcev k ohranjanju ‘utripa sveta’ z reševanjem življenj in izboljšanjem zdravja.
“Varna in zadostna preskrba s krvjo je eden izmed pomembnih stebrov zdravstvene oskrbe in s tem tudi javnega zdravja,” ob svetovnem dnevu krvodajalcev, ki ga obeležujemo danes, sporoča Zbornica zdravstvene in babiške nege Slovenije.
Letošnja svetovna kampanja ob dnevu krvodajalcev, ki ga praznujemo že vse od leta 2005, posebej izpostavlja mlade in njihovo vlogo pri zagotavljanju varne oskrbe s krvjo. Ti so v mnogih državah v ospredju dejavnosti in pobud, katerih cilj je doseči varno oskrbo s krvjo.
“Pandemija covida-19 je postavila sistem preskrbe s krvjo na preizkušnjo. Kljub temu, da se je svet malce upočasnil in da so se potrebe po krvi zato nekoliko zmanjšale, je bilo treba zagotoviti zdravljenje s krvjo za nujne primere in hudo bolne, pri katerih transfuzije ni mogoče odložiti,” je dejal predsednik Sekcije medicinskih sester in zdravstvenih tehnikov v anesteziologiji, Anton Justin.
Cilji svetovnega dneva krvodajalcev so osveščanje širše javnosti o potrebi po rednem, neplačanem darovanju krvi, zahvala krvodajalcem po svetu ter spodbujanje skupnostne vrednote krvodajalstva.
Slovenija se s številom krvodajalcev uvršča v evropsko povprečje, na področju preskrbe s krvjo pa smo samozadostni, so na svoji spletni strani zapisali na Zavodu za transfuzijsko medicino.
Specialistka transfuzijske medicine z oddelka za preskrbo s krvjo Polonca Mali je v izjavi novinarjem dejala, da v Sloveniji dnevno potrebujemo med 350 in 400 krvodajalcev. Vsaj enkrat letno daruje kri 62.000 Slovencev, nekateri med njimi tudi do štirikrat na leto.
“Veseli nas, da v vseh teh letih v slovenskem zdravstvu nikoli ni zmanjkalo krvi. Leta 1953 je Rdeči križ prevzel organizacijo, motivacijo in promocijo krvodajalcev, da sploh pridejo, se odzivajo, da organizirajo odvzeme na terenskih krvodajalskih akcijah vsak dan v določenem kraju Slovenije. Res smo veseli. To nas uvršča v sam svetovni vrh in lahko smo ponosni na tradicijo,” je povedala Malijeva.
“,”Jaka Verbic Miklic”,1623646320,1623646320,sl,14786,306,14785,43,0,NULL,,”Začetek kampanje ob svetovnem dnevu krvodajalstva”,zacetek-kampanje-ob-svetovnem-dnevu-krvodajalstva,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1627966417,1627966418
801,14788,”Zveza društev diabetikov in stroka s pozivom k ustreznemu vodenju sladkorne bolezni”,”Napovedi o porastu števila oseb s sladkorno boleznijo so zaskrbljujoče”,”
Ljubljana, 16. junija – Napovedi o porastu števila oseb s sladkorno boleznijo so zaskrbljujoče, poleg tega je epidemija covida-19 še posebej razkrila, kako pomembno je, da osebe s sladkorno boleznijo dosledno upoštevajo navodila zdravnika in ustrezno vodijo sladkorno bolezen, spodbujajo medicinska stroka in zveza društev diabetikov. To bolezen ima vsak deseti Slovenec.
V Zvezi društev diabetikov Slovenije si prizadevajo spodbuditi in aktivirati slovensko javnost, saj je v populaciji Slovencev, starejših od 18 let, 8,1 odstotka ali 132.000 ljudi s potrjeno sladkorno boleznijo. Poleg njih je v Sloveniji še dodatnih 79.000 ljudi s sladkorno boleznijo, pri katerih ta še ni bila odkrita, kaže raziskava Nacionalnega inštituta za javno zdravje.
Raziskava Mednarodne zveze diabetikov v Evropi je sicer potrdila, da je zdravstveni sistem v Sloveniji ustrezno organiziran, saj je bil v času epidemije dostop do zdravil dobro urejen. V primerjavi z Norveško, kjer je skoraj tretjina oseb s sladkorno boleznijo poročala o oteženem dostopu do zdravil, jih je v Sloveniji takšne težave imelo pol manj. Dostop do zdravstvenega osebja v času epidemije je bil sicer otežen in deloma nadomeščen z virtualnimi konzultacijami, več kot 80 odstotkov oseb s sladkorno boleznijo pa želi nadaljevati posvete v živo, ne na daljavo.
“Ukrepa, kot sta omejitev gibanja in spremenjen življenjski slog sta še posebej negativno vplivala na zdravstveno stanje. 57 odstotkov bolnikov je bilo manj aktivnih, ena tretjina pa je poročala o večjem nihanju krvnega sladkorja,” so v ugotovitve predsednika slovenske zveze društev diabetikov Roberta Grattona povzeli v sporočilu za javnost.
Ob tem predsednica združenja zdravnikov družinske medicine Danica Rotar Pavlič opaža preveliko zadovoljstvo s previsokim sladkorjem. “Osebe s sladkorno boleznijo se morajo zavedati, da je njihovo življenje v njihovih rokah, zato naj vsaj svojega izbranega zdravnika povprašajo, če že ne gredo k specialistu diabetologu. Ne smemo čakati toliko časa, da bi tvegali operacijo ali odstranitev prsta ali da bi se pojavil slab vid,” je pozvala.
Kot opažajo zdravniki, so bolniki predvsem v obdobju epidemije preveč opuščali obiske pri izbranem zdravniku. “V zadnjem mesecu je prišlo kar nekaj oseb s sladkorno boleznijo z visoko vrednostjo sladkorja, ki jih nisem videla celo leto, čeprav je naša ambulanta delovala. Prišle so tudi osebe, ki so imeli doslej urejeno sladkorno bolezen pa so med epidemijo popustili in nismo dosegali ciljnih vrednosti krvnega sladkorja,” je opisala situacijo.
V zvezi društev diabetikov zato ponovno poudarjajo, da lahko z ustrezno vodeno boleznijo ljudje upočasnijo bolezen ter pomembno pripomorejo k zmanjšanju zapletov, ki se tekom sladkorne bolezni skoraj vedno pojavijo. Sočasno so lahko namreč prizadeti tudi ostali organi v telesu, zaradi česar se med drugim razvijejo bolezni srca, ledvic, težave z vidom in prizadetost okončin. Brez ustreznega nadzora sladkorne bolezni lahko ti zapleti vodijo celo v amputacije okončin, slepoto in prezgodnjo smrt, so še opozorili.
“,”Jaka Verbic Miklic”,1623819600,1623819600,sl,14788,306,14787,43,0,NULL,,”Zveza društev diabetikov in stroka s pozivom k ustreznemu vodenju sladkorne bolezni”,zveza-drustev-diabetikov-in-stroka-s-pozivom-k-ustreznemu-vodenju-sladkorne-bolezni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1627966853,1627966853
802,14790,”Na zdravstvenem forumu o potrebnih spremembah zdravstvenega sistema”,”Stabilnost in vzdržnost zdravstvenih sistemov sta v času zdravstvene krize odločilni”,”
Portorož, 17. junija – Stabilnost in vzdržnost zdravstvenih sistemov sta v času zdravstvene krize odločilni, je ob odprtju zdravstvenega razvojnega foruma v Portorožu poudaril minister za zdravje Janez Poklukar. Kot svoj dolgoročni cilj je izpostavil opolnomočenje zdravstvenega sistema. Predsednik republike Borut Pahor pa je naglasil potrebo po strukturnih ukrepih.
Med konkretnimi sistemski rešitvami je Poklukar, ki se je na uvodu v portoroški forum v organizaciji Planeta GV oglasil prek video povezave, izpostavil predlog zakona o zagotavljanju investicij v slovensko zdravstvo, po katerem naj bi v prihodnjih desetih letih v zdravstvo vložili 1,9 milijarde evrov.
V zakonu so posebno pozornost namenili tudi krepitvi človeških virov, je navedel minister. Zakon tako predvideva prek 200 milijonov evrov investicij v izobraževanje in raziskovalne dejavnosti. Med drugim želijo na ministrstvu povečati Medicinsko fakulteto Univerze v Ljubljani in s tem povečati vpis študentov medicine, prav tako želijo povečati vpis na mariborski medicinski fakulteti.
Poklukar se je dotaknil tudi prioritet slovenskega predsedovanja Svetu EU in med temi naštel krepitev evropske zdravstvene unije, povečanje dostopnosti do zdravil in obvladovanje raka.
Predsednik republike Borut Pahor pa je poudaril, da “reformo javnega zdravstvenega sistema štejem za najbolj nujen strukturni ukrep sedanjega časa”. Pri tem je opozoril, da nekatera vprašanja s področja zdravstva čakajo na odgovore že dvajset in več let.
Pahor je sicer ocenil, da je zdravstveni sistem v času krize nudil dobro možnost, da so lahko zdravniki in zdravstveno osebje reševali življenje, vendar “se ne smemo zanašati na moralni kapital zdravstvenega osebja”.
Obstoječe težave po predsednikovih besedah niso nepremagljive, bodo pa terjale politični dialog in sodelovanje tako koalicije kot opozicije.
Vodja svetovalne skupine za cepljenje pri NIJZ in predsednica Zdravniške zbornice Slovenije Bojana Beović je v analizi epidemije v Sloveniji ocenila, da so se v prvem valu soočali z izrazitim pomanjkanjem opreme na primarni ravni in težavami z zagotavljanjem ločene obravnave covidnih bolnikov.
Kot je sklenila Beovićeva, je bilo zdravstveno varstvo v času epidemije zelo dobro organizirano, kar je rezultiralo v nizki smrtnosti glede na okužbe. Kot slabost pa je izpostavila nezmnožnost socialno varstvenih zavodov, da bi zamejili epidemijo, ter šibko strukturo službe javnega zdravstva. Prav zato je zdaj po njenem priložnost za okrepitev zdravstvenega sistema in skrbi za starejše.
“,”Jaka Verbic Miklic”,1623906120,1623906120,sl,14790,306,14789,43,0,NULL,,”Na zdravstvenem forumu o potrebnih spremembah zdravstvenega sistema”,na-zdravstvenem-forumu-o-potrebnih-spremembah-zdravstvenega-sistema,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1627966996,1627966996
803,14798,”Predavanje Društva distrofikov Slovenije ob svetovnemu dnevu ALS”,”Društvo distrofikov Slovenije bo ob današnjem svetovnem dnevu Amiotrofično lateralne skleroze (ALS) organiziralo spletno predavanjem”,”
Ljubljana, 21. junija – Društvo distrofikov Slovenije bo ob današnjem svetovnem dnevu Amiotrofično lateralne skleroze (ALS) organiziralo spletno predavanjem z naslovom Novosti glede zdravljenja ALS, v katerem bodo skupaj s povabljenimi predavatelji predstavili nova odkritja s področja zdravljenja in lajšanja bolezni.
ALS je hitro napredujoča in za zdaj tudi neozdravljiva nevrološka bolezen, ki jo je javnost pred leti bolj podrobno spoznala ob izzivu polivanja z vedrom ledene vode. Najbolj tipično se bolezen najprej pokaže z oslabitvijo skupine mišic na enem od udov, nato oslabitev postopno zajame sosednje mišice, mišice na drugi strani telesa in mišice za dihanje, govor, požiranje. Vzroki za nastanek ALS niso znani. Zdravila, ki bi zaustavilo ali spremenilo potek bolezni, ni.
V Sloveniji trenutno živi okoli 150 obolelih. Pojavnost je tudi pri nas, tako kot po svetu, od šest do osem primerov na 100.000 prebivalcev. Bolezen se najpogosteje pojavi med 40. in 60. letom starosti in je bolj pogosta pri moških kot pri ženskah.
V Društvo distrofikov Slovenije je vključenih okoli 45 bolnikov z ALS. Društvo obolelim in njihovim svojcem prek posebnih socialnih programov omogoča pomoč na več področjih življenja, na katera vpliva bolezen.
“,”Jaka Verbic Miklic”,1624272060,1624272060,sl,14798,306,14797,43,0,NULL,,”Predavanje Društva distrofikov Slovenije ob svetovnemu dnevu ALS”,predavanje-drustva-distrofikov-slovenije-ob-svetovnemu-dnevu-als,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1630233791,1630233866
804,14800,”V središču dneva boja proti zlorabi drog pomen točnih podatkov za sprejemanje učinkovitih ukrepov in politik”,”Mednarodni dan boja proti zlorabi drog in nezakonitemu trgovanju z drogami”,”
Ljubljana, 26. junija – Mednarodni dan boja proti zlorabi drog in nezakonitemu trgovanju z drogami, ki ga obeležujemo danes, poteka pod geslom Seznani se z dejstvi – rešuj življenja! Združeni narodi želijo s tem opozoriti, da so točni podatki in resnična dejstva na področju uporabe drog ključni za sprejemanje učinkovitih ukrepov in politik.
Tudi Nacionalni inštitut za javno zdravje (NIJZ) redno spremlja področje prepovedanih drog, saj vsako leto zbira vrsto različnih podatkov in informacij, ki jih objavi v Nacionalnem poročilu o stanju na področju drog. Kot kažejo podatki zadnjega poročila, število zastrupitev in smrti, povezanih s prepovedanimi drogami, v splošnem narašča.
Konoplja je tista droga, s katero je povezanih največ zastrupitev, heroin in kokain pa drogi, s katerimi je povezanih največ smrti zaradi drog. Podatki kažejo tudi, da v zdravljenje uporabniki vstopajo predvsem zaradi težav z opioidi, kokainom in konopljo, so ob današnjem dnevu boja proti zlorabi drog zapisali na spletni strani.
Kot je poudarila Mateja Jandl z NIJZ, imamo v Sloveniji dobro razvito mrežo programov zdravljenja, v katere lahko vstopajo posamezniki, ki potrebujejo različne oblike pomoči zaradi težav z uporabo drog. Razveseljivo je tudi, da narašča število kakovostnih preventivnih programov, ki temeljijo na znanstvenih dokazih.
NIJZ spremlja tudi razširjenost uporabe prepovedanih drog z različnimi raziskavami, ki jih izvaja med splošnim prebivalstvom, mladostniki, uporabniki drog in zaporniki. Po navedbah Andreje Drev z NIJZ, podatki zadnje nacionalne raziskave o razširjenosti uporabe drog med splošnim prebivalstvom kažejo, da je vsak peti prebivalec Slovenije v starosti od 15 do 64 let že kdaj v življenju uporabil katero izmed prepovedanih drog.
Konoplja je še vedno najbolj razširjena prepovedana droga med prebivalci Slovenije, sledijo ekstazi, kokain, amfetamin, LSD in drugi halucinogeni ter heroin. Primerjava podatkov iz prve in druge nacionalne raziskave o uporabi drog pa kaže, da se je med letoma 2012 in 2018 zvišal odstotek prebivalcev, ki so že kdaj v življenju uporabili katero izmed prepovedanih drog.
Ada Hočevar Grom z NIJZ pa je opozorila na problem zlorabe zdravil. Po podatkih zadnje nacionalne raziskave o uporabi drog med splošnim prebivalstvom je namreč dva odstotka prebivalcev vsaj enkrat v zadnjih 12 mesecih uporabilo psihoaktivna zdravila v nemedicinske namene.
“V najvišjem odstotku so prebivalci neustrezno uporabili močna protibolečinska zdravila in pomirjevala. Bolečina je bila najpogostejši razlog, zaradi katerega so prebivalci Slovenije zlorabili zdravila, sledita nespečnost in obvladovanje stresa. Zdravila, ki so jih prebivalci zlorabili, pa so v največji meri dobili na recept pri svojem zdravniku,” je še izpostavila Ada Hočevar Grom. Večjo pozornost je zato treba nameniti tako predpisovanju zdravil s psihoaktivnimi učinki kot tudi boljšemu informiranju ljudi o pomembnosti jemanja zdravil na način, kot je bil predpisan.
Letno poročilo Združenih narodov, ki so ga objavili v četrtek, kaže, da je v lanskem letu okoli 275 milijonov ljudi uporabljalo droge, več kot 36 milijonov ljudi pa je trpelo za motnjami zaradi uživanja drog. Poročilo kaže, da se je uporaba konoplje v nekaterih delih sveta povečala za štirikrat. Na to kaže tudi podatek, da 40 odstotkov manj mladostnikov dojema konopljo kot škodljivo, kljub temu da njeno uživanje lahko vpliva na kakovost zdravja.
Čeprav se je trg drog na temnem spletu pojavil šele pred desetletjem, je letna vrednost nekaterih trgov 315 milijonov ameriških dolarjev. Od leta 2011 do sredine leta 2017 in od sredine leta 2017 do leta 2020 je trg na spletu zrasel za štirikrat, kljub temu da spletna prodaja drog predstavlja le en del trga.
Tehnološke inovacije in vse večja tehnološka razgledanost uporabnikov bo verjetno pripeljala tudi do globaliziranega trga, ki bo dostopnost drog še povečala, kar bi lahko vplivalo tudi na način uporabe drog in na javno zdravje, so še zapisali.
“,”Jaka Verbic Miklic”,1624704480,1624704480,sl,14800,306,14799,43,0,NULL,,”V središču dneva boja proti zlorabi drog pomen točnih podatkov za sprejemanje učinkovitih ukrepov in politik”,v-srediscu-dneva-boja-proti-zlorabi-drog-pomen-tocnih-podatkov-za-sprejemanje-ucinkovitih-ukrepov-in-politik,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1630234178,1630234178
805,14802,”Po opozorilih strokovnjakov varno izpostavljanje soncu ne obstaja”,”Strokovnjaki so na novinarski konferenci kliničnega inštituta za medicino dela, prometa in športa UKC Ljubljana v sodelovanju z Združenjem slovenskih dermatovenerologov poudarili pomen ustrezne zaščite pred soncem.”,”
Ljubljana, 6. julija – Strokovnjaki so na novinarski konferenci kliničnega inštituta za medicino dela, prometa in športa UKC Ljubljana v sodelovanju z Združenjem slovenskih dermatovenerologov poudarili pomen ustrezne zaščite pred soncem. Posvarili so pred izpostavljanjem UV žarkom, ki ne povzročajo zgolj opeklin, ampak lahko vodijo tudi v bolezni, kot je kožni rak.
Nevarnih ultravioličnih (UV) žarkov ne čutimo, so pa prisotni ves čas, ko je sonce na nebu, je povedala dermatovenerologinja Ana Benedičič. Posebej nevarno je opeklinsko, kratkotročno UV sevanje, ki seže do zemlje. To sevanje lahko povzroči hitro nastale oz. nekaj ur odložene učinke, kot so sončne opekline, po daljšem času pa sončno zagorelost.
“Povzroča tudi odložene učinke, kot je fotostaranje. Še resnejša sprememba so predrakava bolezenska stanja, ki nastanejo zaradi sprememb, ki se kopičijo več let. Tako lahko pride tudi do kožnega raka različnih vrst, med njimi je najbolj znan kožni melanom, ki se ga boji tudi največ ljudi,” opozorila. Tveganje za nevarne spremembe pa predstavlja tudi večje število pigmentnih kožnih znamenj.
Benedičičeva je opozorila tudi na napačne informacije glede sonca in tvorbe vitamina D. “Vitamin D nastaja med majem in septembrom, ravno takrat, ko je prisotno opeklinsko UV sevanje. Če je oseba svetle polti, za tvorbo vitamina D potrebuje zgolj trikrat na teden od deset do petnajst minut na soncu. Če smo na soncu več kot uro in pol, se zgodi, da aktivne oblike nastalega vitamina D preidejo v neaktivne, zato postane telo v bistvu bolj dovzetno ravno za pomanjkanje tega vitamina,” je poudarila.
Glede na podatke ankete dermatovenerološke klinike Univerzitetnega kliničnega centra (UKC) Ljubljana iz 2011 je 88 odstotkov od 553 anketiranih Slovencev vedelo, da lahko UV sevanje povzroči kožnega raka. Leta 2019 je od 550 anketirancev to vedelo 62 odstotkov. Leta 2011 so zgolj štirje odstotki anketiranih odgovorili, da imajo v službenem času možnost zaščite pred soncem, leta 2019 pa je pritrdilno odgovorilo 16 odstotkov.
Obe anketi sta pokazali, da moški večinoma uporabljajo kreme z nižjim zaščitnim faktorjem, medtem ko ženske višjega, je pojasnila predstavnica dermatovenerološke klinike UKC Ljubljana Tanja Planinšek Ručigaj. Opozorila je tudi na nujnost dobrih in zdravih praks, predvsem za delavce na gradbiščih. “Vsekakor bi morali tisti, ki so prisiljeni delati na prostem, imeti boljše pogoje za zaščito pred soncem,” je poudarila.
Blaž Valič z Inštituta za neionizirna sevanja pa je pojasnil, da tekstilne zaščite, kot so različne majice in kape ter ostali kosi oblačil in dodatkov nudijo do petdesetkratno zaščito, kar pomeni, da se čas izpostavljenosti lahko podaljša za petdesetkrat. To je primerljivo s kremo z zaščitnim faktorjem 50. Visoko oz. popolno zaščito nudijo tudi zaščitna očala, korekcijska očala z dioptrijo pa prav tako prepuščajo zelo majhen oz. zanemarljiv del UV sevanja.
“,”Jaka Verbic Miklic”,1625568840,1625568840,sl,14802,306,14801,43,0,NULL,,”Po opozorilih strokovnjakov varno izpostavljanje soncu ne obstaja”,po-opozorilih-strokovnjakov-varno-izpostavljanje-soncu-ne-obstaja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1630234567,1630234568
806,14804,”Raziskava: Alkohol povezan z enim od 25 rakavih obolenj”,”Uživanje alkohola je bilo lani povezano z več kot štirimi odstotki vseh novih primerov rakavih obolenj v svetu”,”
Pariz, 14. julija – Uživanje alkohola je bilo lani povezano z več kot štirimi odstotki vseh novih primerov rakavih obolenj v svetu, razkriva danes objavljena raziskava. Več kot tri četrtine teh primerov so zabeležili pri moških. Večinoma je šlo za posledice občutno prekomernega pitja, sedmina primerov pa je bila povezana z zgolj zmernim pitjem.
Raziskava, objavljena v znanstveni reviji Lancet Oncology, temelji po eni strani na podatkih glede lani odkritih rakavih obolenj, še posebej takih, ki so dokazano pogosto povezana z uživanjem alkohola, ter po drugi strani na podatkih o prodaji, proizvodnji in porabi alkoholnih pijač. S pomočjo slednjih so izračunali, koliko alkohola so ljudje v različnih državah po svetu v povprečju popili leta 2010 – torej pred desetletjem, kolikor je načeloma potrebno, da se pokažejo posledice uživanja alkohola v obliki rakavih obolenj.
Po njihovih ocenah je bilo dobrih štiri odstotkov oziroma 741.300 na novo odkritih primerov raka v svetu lani povezanih z alkoholom, od tega 77 odstotkov oziroma 568.700 pri moških.
Ugotovili so še, da se to število v različnih delih sveta zelo razlikuje – najvišje je na vzhodu Azije ter v srednji in vzhodni Evropi, najnižje pa na severu Afrike in zahodu Azije. Med posameznimi državami je najvišji delež z alkoholom povezanih rakavih obolenj v Mongoliji, na Kitajskem, v Moldaviji in Romuniji, najnižji pa v Kuvajtu, Libiji in Savdski Arabiji. Med ženskami so medtem najvišji deleži med drugim v Belorusiji, Romuniji in Rusiji, Avstraliji in Novi Zelandiji ter na zahodu Evrope.
Največkrat je z alkoholom povezan rak na požiralniku, jetrih in dojkah.
“,”Jaka Verbic Miklic”,1626260460,1626260460,sl,14804,306,14803,43,0,NULL,,”Raziskava: Alkohol povezan z enim od 25 rakavih obolenj”,raziskava-alkohol-povezan-z-enim-od-25-rakavih-obolenj,Post,,1,0,1630234961,1630234962
807,14806,”Več milijonov otrok zaradi pandemije ni prejelo osnovnih cepiv”,”Lani okoli 23 milijonov otrok ni prejelo osnovnih cepiv v okviru rutinskih storitev imunizacije”,”
Ženeva, 15. julija – Lani okoli 23 milijonov otrok ni prejelo osnovnih cepiv v okviru rutinskih storitev imunizacije, kar je 3,7 milijona več otrok kot leta 2019, so danes sporočili iz Unicefa in Svetovne zdravstvene organizacije (WHO). Zaradi pandemije covida-19 je namreč prišlo do prekinitve programov cepljenja v večini držav.
Lani do 17 milijonov otrok ni prejelo niti enega cepiva, s čimer se še povečuje ogromna neenakost glede dostopa do cepiv. Večina teh otrok namreč živi na območjih z omejenim dostopom do osnovnih zdravstvenih in ključnih socialnih storitev. Najhuje sta prizadeti regiji WHO jugovzhodne Azije in vzhodnega Sredozemlja.
“Države si na vse načine prizadevajo dobiti cepivo proti covidu-19, obenem pa nazadujemo na področju drugih cepiv, zaradi česar otroke ogrožajo hude bolezni, ki pa jih je mogoče preprečiti, kot denimo ošpice, otroška paraliza ali meningitis,” je dejal generalni direktor WHO Tedros Adhanom Ghebreyesus.
Zaradi okrnjenega dostopa do zdravstvenih storitev in imunizacije med pandemijo covid-19 se je število otrok, ki niso prejeli niti prvega odmerka cepiv, povečalo v vseh regijah. V primerjavi z letom 2019 je 3,5 milijona več otrok zamudilo prvi odmerek cepiva proti davici, tetanusu in oslovskem kašlju, tri milijone več otrok pa ni prejelo prvega odmerka cepiva proti ošpicam.
“To bi moralo biti dovolj jasno opozorilo, da zaradi pandemije in z njo povezanih motenj izgubljamo dragoceno prednost na tem področju, česar si ne moremo privoščiti, posledice pa bodo izgubljena življenja in dobrobit najbolj ranljivih članov naših skupnosti,” pa je opozorila izvršna direktorica Unicefa Henrietta Fore.
Unicef in WHO še opozarjata, da državam grozi ponoven pojav ošpic in drugih bolezni, ki bi jih bilo mogoče preprečiti s cepljenjem. S tem je tudi ogrožen napredek na področju rutinske imunizacije, so prepričani. Zato pozivajo k nujni obuditvi rutinske imunizacije in vlaganju v to področje.
“,”Jaka Verbic Miklic”,1626347040,1626347040,sl,14806,306,14805,43,0,NULL,,”Več milijonov otrok zaradi pandemije ni prejelo osnovnih cepiv”,vec-milijonov-otrok-zaradi-pandemije-ni-prejelo-osnovnih-cepiv,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1630235142,1630235142
808,14808,”Slovenski raziskovalci s člankom o črevesni mikrobioti na naslovnico revije Metabolites”,”Njihovo odkritje prinaša priložnosti za razvoj novih terapij v personalizirani medicini”,”
Ljubljana, 23. julija – Skupina slovenskih raziskovalcev je z izvirnim znanstvenim člankom o črevesni mikrobioti prišla na naslovnico znanstvene revije Metabolites. Njihovo odkritje prinaša priložnosti za razvoj novih terapij v personalizirani medicini, so sporočili z Biotehniške fakultete Univerze v Ljubljani.
Avtorji članka so Boštjan Murovec s Fakultete za elektrotehniko, Leon Deutsch z Biotehniške fakultete in Blaž Stres z Biotehniške fakultete, Fakultete za gradbeništvo in geodezijo in Inštituta Jožef Stefan, sam članek pa je dosegljiv na povezavi https://www.mdpi.com/2218-1989/11/6/336.
Omenjena slovenska raziskovalna skupina je preučevala črevesno mikrobioto in njen vpliv na zdravje posameznika. “Črevesna mikrobiota je sestavljena iz ogromnega števila različnih bakterij, arhej, gliv in praživali, poleg virusov in različnih mobilnih elementov. Vsi ti mikrobi ustvarjajo ogromno raznolikost kemičnih spojin, ki igrajo ključno vlogo pri razvoju, počutju in staranju gostiteljev”, je povedal glavni avtor članka Blaž Stres s Katedre za mikrobiologijo in mikrobno biotehnologijo na Oddelku za zootehniko.
“V okviru raziskave smo za napovedovanje metagenomskih funkcionalnih genov, encimskih reakcij in presnovne poti iz amplikonskih podatkov razvili program General Unified Microbiome Profiling Pipeline (GUMPP). S pomočjo programa lahko iz obsežnih podatkov za ponovljivo in standardizirano analizo bakterijskih 16S rRNA izdelamo podatkovne nize, ki na koncu prepoznajo biokemične poti, značilne za patologijo posamezne bolezni,” je še pojasnil.
Program GUMPP omogoča obsežne študije mikrobioma in s tem ustvarja podlago za razumevanje odzivanja teh skupnosti na njihove zapletene okoljske dražljaje. Tekom raziskovanja so slovenski strokovnjaki prišli do podatkov, ki vedno bolj kažejo na to, da mikrobiom vpliva na zdravstveno stanje gostitelja in napredovanje različnih kroničnih bolezni. Poleg tega je mikrobiom vključen v vrsto presnovnih motenj, od presnovnega sindroma in debelosti do avtoimunskih bolezni, psiholoških motenj in raznih okužb.
Odkritje tako predstavlja priložnosti za razvoj novih terapij v personalizirani medicini, zato je uredništvo revije Metabolites presodilo, da ta zaradi svoje aktualnosti sodi na naslovnico, so še dodali na Biotehniški fakulteti.
“,”Jaka Verbic Miklic”,1627038720,1627038720,sl,14808,306,14807,43,0,NULL,,”Slovenski raziskovalci s člankom o črevesni mikrobioti na naslovnico revije Metabolites”,slovenski-raziskovalci-s-clankom-o-crevesni-mikrobioti-na-naslovnico-revije-metabolites,Post,,1,0,1630235588,1630235588
809,14810,”Pred svetovnim dnevom hepatitisa brezplačno testiranje na hepatitis C”,”Akcija bo potekala danes in v sredo med 14h in 19h na Poljanskem nasipu 58, brez naročanja in brez napotnice.”,”
Ljubljana, 27. julija – Pred svetovnim dnevom hepatitisa, 28. julijem, bo potekalo anonimno in brezplačno testiranje na okužbo z virusom hepatitisa C. Akcija bo potekala danes in v sredo med 14. in 19. uro na Poljanskem nasipu 58, brez naročanja in brez napotnice. Na voljo za pogovor pa bo tudi zdravnik, so sporočili iz Univerzitetnega kliničnega centra (UKC) Ljubljana.
Akcijo kot vsako leto organizira Klinika za infekcijske bolezni in vročinska stanja UKC Ljubljana v sodelovanju z Inštitutom za mikrobiologijo in imunologijo Medicinske fakultete Univerze v Ljubljani, Slovenskim društvom bolnikov, obolelih za virusnim hepatitisom SLOVENIJA HEP, in študenti medicine iz Projektov Imuno in Virus pri Društvu študentov medicine Slovenije.
Svetovni dan hepatitisa bo letos potekal pod sloganom “Virusni hepatitis ne more čakati!”. Pod okriljem Svetovne zdravstvene organizacije (WHO) ga letos obeležujejo petnajstič. Preprečevanje okužbe z virusoma hepatitisa B (HBV) in C (HCV) oziroma njeno zgodnje odkrivanje in zdravljenje preprečujeta nastanek raka na jetrih in odpoved delovanja jeter.
Pred dnevom hepatitisa je Svetovna zdravstvena organizacija objavila poročilo o aktualnem bremenu okužbe z virusoma HBV in HCV ter realizaciji globalne strategije za njuno odpravo. Poročilo kaže, da je bilo v petih letih po postavitvi strategije WHO zaznati največ napredka na področjih cepljenja proti hepatitisu B in zdravljenja hepatitisa C z novimi zdravili, ki vodijo v popolno ozdravitev.
Med letoma 2015 in 2019 se je v svetu delež zdravljenih za hepatitis C povečal za desetkrat. Vendar pa je leta 2019 v svetu zaradi posledic hepatitisa B ali C umrlo 1,2 milijona ljudi, trije milijoni pa so se na novo okužili.
Najbolj pereč problem je še vedno odkrivanje okuženih, ki se okužbe ne zavedajo in dostikrat pomoč poiščejo šele, ko pride do nenadne odpovedi delovanja jeter ali nastanka raka na jetrih, ki je dokazano povezan z okužbo s HBV ali HCV.
Tudi pandemija covida-19 je posegla na področje virusnih hepatitisov, saj bo v naslednjih letih močno povečala njihovo breme v svetu. Najnovejše statistične projekcije so pokazale, da bo zgolj enoletna zakasnitev v odkrivanju in zdravljenju hepatitisa C v naslednjem desetletju povzročila 44800 novih primerov raka na jetrih in 72 300 smrti zaradi posledic hepatitisa C.
V Sloveniji hepatitis C zelo dobro obvladujejo, saj so z aktivnim pristopom prvi v svetu povsem odstranili okužbo v določenih skupinah bolnikov, kot so hemofiliki, dializirani bolniki in okuženi s HIV. S strategijo ‘odkrivaj in zdravi’ so do leta 2020 odkrili že več kot tri četrtine okuženih in jih nad polovico tudi pozdravili, so še sporočili iz UKC Ljubljana.
“,”Jaka Verbic Miklic”,1627384560,1627384560,sl,14810,306,14809,43,0,NULL,,”Pred svetovnim dnevom hepatitisa brezplačno testiranje na hepatitis C”,pred-svetovnim-dnevom-hepatitisa-brezplacno-testiranje-na-hepatitis-c,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1630235818,1630235850
810,14812,”Svetovni teden dojenja poudarja velik pomen dojenja tako za otroka kot za mamico”,”Obeležujejo ga nekatere države zunaj Evrope, medtem ko v Evropi in z njo v Sloveniji poteka prvi teden v oktobru.”,”
Ljubljana, 1. avgusta – Svetovni teden dojenja, ki bo potekal od danes do 7. avgusta, poudarja velik pomen dojenja tako za otroka kot za mamico. Obeležujejo ga nekatere države zunaj Evrope, medtem ko v Evropi in z njo v Sloveniji poteka prvi teden v oktobru.
Namen prizadevanj ob tej priložnosti, ki jih koordinira Svetovna zveza za podporo dojenju (World Alliance for Breastfeeding Action – WABA), je izboljšati zdravje mater in otrok ter vsem otrokom zagotoviti zdrav in enak začetek življenja. Prav tako želijo, da bi povsod po svetu s pomočjo dojenja preprečevali podhranjenost otrok.
Podpora dojenju je pomembna tako na individualni kot na družbeni ravni, kjer je treba dojenje obravnavati kot javnozdravstveno vprašanje, ki zahteva vlaganja na vseh ravneh od zdravstvenega sistema in področja delovnih mest naprej. Po prepričanju svetovne zveze bo le z ustrezno podporo mogoče ustvariti okolje, naklonjeno dojenju.
WABA želi z dogodki ob svetovnem tednu osvestiti družbo o pomenu dojenja. Otrok dobi z materinim mlekom optimalna hranila, kar dobro vpliva na njegove možnosti za preživetje in zdravje. Prav tako je dojenje koristno za matere, saj imajo manj poporodnih krvavitev, osteoporoze ter raka dojk in jajčnikov.
V Sloveniji je v porodnišnicah visok delež dojenja, saj je v povprečju ob odpustu dojenih več kot 90 odstotkov novorojenčkov. Vendar se pogostnost dojenja po tem obdobju zelo hitro zmanjšuje. Šestmesečne dojenčke tako doji le še približno polovica mamic, od tega jih je le približno pet odstotkov izključno dojenih. Dvanajstmesečne otroke pa doji le še četrtina mamic.
“,”Jaka Verbic Miklic”,1627816740,1627816740,sl,14812,306,14811,43,0,NULL,,”Svetovni teden dojenja poudarja velik pomen dojenja tako za otroka kot za mamico”,svetovni-teden-dojenja-poudarja-velik-pomen-dojenja-tako-za-otroka-kot-za-mamico,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1630236051,1630236051
811,14814,”Ob alergiji na sonce treba kožo ohladiti in pomiriti”,”Poleti se morajo močnim sončnim žarkom izogibati posebej tisti, ki imajo alergijo na sonce.”,”
Ljubljana, 4. avgusta – Poleti se morajo močnim sončnim žarkom izogibati posebej tisti, ki imajo alergijo na sonce. Ob pojavu alergije moramo kožo ohladiti in namazati s kremo ali gelom, ki reakcijo blaži. Najučinkovitejša preventivna zaščita je izogibanje soncu ter nošenje svetlih in zračnih oblačil. Odveč ni niti jemanje zdravil, antihistaminikov.
Po besedah farmacevtke in predsednice Lekarniške zbornice Slovenije Darje Potočnik Benčič prave alergije na sonce niso zelo pogoste, vseeno pa ima veliko oseb težave s kožo, ki so posledica izpostavljanja sončnim žarkom. “Velikokrat gre za preobčutljivostne reakcije, ki so posledica kombinacije sonca, morske vode in krem za zaščito pred soncem z neprimernimi podlagami. Reakcije so lahko tudi kombinacija uporabe zdravil in sončnih žarkov,” je povedala za STA.
Posledice vpliva sončnih žarkov na kožo se lahko pojavijo takoj ali pa z zamikom. Do učinkov ultravijoličnega sevanja pride pri vseh ljudeh, ki so dovolj dolgo izpostavljeni soncu. Najprej nastopi akutno vnetje z rdečino, ki je v bistvu sončna opeklina, sledi porjavelost, zadebelitev zgornje plasti kože ter druge spremembe. Škodljiva učinka, ki lahko nastaneta zaradi čezmernega izpostavljanja sončni svetlobi, sta prezgodnje staranje kože ter rak kože.
Prava alergija na sonce nastane hitro po izpostavljenosti soncu. “Najpogosteje prizadene svetlopolte mlajše ženske v prvih desetletjih življenja,” izpostavlja farmacevtka Venceslava Bavčar. Kožne spremembe se najpogosteje pojavijo na izpostavljenih mestih dekolteja, ramen in nadlahti. “Zaradi obsevanja v koži nastajajo prosti radikali. Ti celice poškodujejo in sproži se reakcija, v kateri pride do sproščanja histamina, ki je krivec za simptome oziroma znake alergije,” je pojasnila Darja Potočnik Benčič.
Tipična alergija se pokaže kot koprivnica. Izpostavljeni deli kože so posuti z drobnimi, rdečkasto obarvanimi mehurčki. Lahko se pojavijo tudi večja območja otečene kože in zatrdline. Značilna je tudi srbečica.
Po besedah Venceslave Bavčar so pri alergijah na sonce spremembam na koži lahko pridruženi tudi glavobol, vročina ali mrzlica in slabost. “Težave z alergijo lahko vztrajajo celo življenje, vendar se sčasoma pojavljajo v blažji obliki ali popolnoma izzvenijo zaradi razvoja tolerance,” pravi.
Ko se pri posamezniku pojavi alergija ali preobčutljivostna reakcija kože, je najučinkovitejši ukrep izogibanje soncu. Kožo je prav tako treba hladiti – lahko s hladno ali mlačno vodo. Za umiritev srbečice pomagajo hladilni geli, ki vsebujejo zdravilo antihistaminik. Dodatno lahko kožo negujemo in hladimo z geli, ki vsebujejo alojo ali pantenol. Slednji učinkovito pomaga tudi pri regeneraciji poškodovane kože.
Predsednica Lekarniške zbornice Slovenije svetuje, da se alergiki pred soncem zaščitijo z lahkimi, svetlimi in zračnimi oblačili na način, da so prekriti vsi deli kože. “To pomeni, dolgi rokavi, dolge hlače ali krilo in pokrivalo. Pomembna je tudi zaščita oči s sončnimi očali,” navaja.
Vedno se soncu ne moremo izogniti. V tem primeru pomaga uporaba zdravil, antihistaminikov. Priporočljivo je njihovo jemanje še pred predvidenim izpostavljanjem soncu, torej nekaj dni pred odhodom na morje, bazen ali v hribe.
Če se pri osebi pojavi hujša oblika alergične reakcije, ki jo spremlja močno srbenje, če je velik del kože prizadet in če pripravki, ki so priporočljivi pri samozdravljenju, ne pomagajo, pa je potreben obisk zdravnika.
“,”Jaka Verbic Miklic”,1628076120,1628076120,sl,14814,306,14813,43,0,NULL,,”Ob alergiji na sonce treba kožo ohladiti in pomiriti”,ob-alergiji-na-sonce-treba-kozo-ohladiti-in-pomiriti,Post,,1,0,1630236215,1630236215
812,14816,”Med opravljenimi skoraj 1,7 milijona cepljenj proti covidu-19 doslej 155 prijav resnih neželenih učinkov”,”Za večino se je ugotovilo, da povezava s cepljenjem ni verjetna oziroma so še v fazi preiskave.”,”
Ljubljana, 4. avgusta – Iz novega poročila o spremljanju neželenih učinkov po cepljenju proti covidu-19, ki ga je danes objavil NIJZ, izhaja, da so doslej prejeli 155 prijav resnih neželenih učinkov po cepljenju, medtem ko je bilo opravljenih okoli 1,7 milijona cepljenj. Za večino se je ugotovilo, da povezava s cepljenjem ni verjetna oz. so še v fazi preiskave.
Nacionalni inštitut za javno zdravje (NIJZ) v novem poročilu navaja, da je bilo s cepivom proizvajalca Pfizer in BioNTech do začetka avgusta opravljenih 1.095.748 cepljenj, od tega je 3950 oseb poročalo o neželenih učinkih. Ti so bili večinoma splošne težave in spremembe na mestu aplikacije.
V register cepljenja so prejeli 87 prijav o resnih neželenih učinkih. Med njimi je 18 oseb s kroničnimi obolenji umrlo, komisija pri ministrstvu za zdravje pa je v osmih primerih zaključila, da povezava s cepljenjem ni verjetna. Ostali primeri so še v fazi preiskav. Obravnavanih je bilo tudi 13 prijav resnih neželenih dogodkov, kjer je bila potrebna hospitalizacija. V 12 primerih je komisija ugotovila, da povezava s cepljenjem ni bila verjetna. V enem primeru pa je bila povezava ocenjena kot možna, šlo je za manjšo možgansko kap, ki bi lahko bila posledica bolezni žilja ali bolezni srca ali cepljenja, navaja NIJZ v poročilu.
Po cepljenju s cepivom Moderne – doslej je bilo s tem cepivom v Sloveniji opravljenih vsaj 176.000 cepljenj – je o neželenih učinkih poročalo 444 oseb. V registru cepljenja so prejeli tudi 14 prijav z resnimi neželenimi učinki, pri treh starejših osebah s kroničnimi obolenji je prišlo do smrti. Pri prvi osebi povezava s cepljenjem ni verjetna, je ugotovila komisija, ki je preiskovala primer, ostala dva primera sta še v fazi preiskave. Prav tako je po cepljenju z Moderno v enem primeru prišlo do kolapsa, povezava s cepljenjem je možna. Ostali primeri so še v preiskavi.
S cepivom AstraZenece je bilo doslej po podatkih NIJZ v Sloveniji opravljenih več kot 316.500 cepljenj, prejeli so poročila o stranskih učinkih 3039 oseb. Prejeli so tudi 51 prijav z resnimi neželenimi dogodki. Pri sedmih osebah s kroničnimi obolenji je prišlo do smrti v dneh po cepljenju, pri prvi povezava s cepljenjem ni verjetna, ostali primeri so še v fazi preiskav.
Obravnavanih je bilo tudi 10 prijav resnih neželenih dogodkov po cepljenju, kjer je bila potrebna hospitalizacija. V šestih primerih povezava s cepljenjem ni bila verjetna, v enem primeru je prišlo do alergične reakcije, pri čemer je komisija ugotovila, da je povezava s cepljenjem verjetna. Povezava s cepljenjem je možna tudi v primerih parestezije in izgube moči v okončinah in pri dveh globokih venskih trombozah. Ostali primeri so še v fazi zbiranja podatkov.
S cepivom Johnson & Johnson je bilo doslej izvedenih najmanj 71.000 cepljenj, prejeli so poročila o neželenih učinkih od skupno 331 oseb. Med njimi so bile tri prijave z resnimi neželenimi učinki, pri eni osebi je prišlo do smrti zaradi tromboze v povezavi z nizko vrednostjo trombocitov. Komisija je ocenila, da je povezava s cepljenjem gotova.
Poleg tega so prejeli še dve prijavi neželenih dogodkov, zaradi katerih je bila potrebna hospitalizacija, šlo je za možgansko kap in vensko trombozo, a sta še v fazi zbiranja podatkov.
“,”Jaka Verbic Miklic”,1628076240,1628076240,sl,14816,306,14815,43,0,NULL,,”Med opravljenimi skoraj 1,7 milijona cepljenj proti covidu-19 doslej 155 prijav resnih neželenih učinkov”,med-opravljenimi-skoraj-1-7-milijona-cepljenj-proti-covidu-19-doslej-155-prijav-resnih-nezelenih-ucinkov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1630236343,1630236343
814,14830,”10. strateška konferenca Vrednost inovacij”,”Z digitalno preobrazbo v informirano odločanje v zdravstvu”,”
V četrtek, 7. oktobra 2021, bo od 12. do 15. ure potekala
10. strateška konferenca Vrednost inovacij: Z digitalno preobrazbo v informirano odločanje v zdravstvu.

Vrhunski domači in tuji strokovnjaki bodo razpravljali o digitalizaciji zdravstvenega sistema, primerih dobrih praks zbiranja in uporabe podatkov ter načinih, kako te podatke čim bolje izkoristiti pri načrtovanju zdravstvenih politik in kako bolnikom omogočiti najboljše personalizirano zdravljenje.
Častni pokrovitelj konference je predsednik Republike Slovenije Borut Pahor.
Govorci bodo predstavniki organizacij, ki se ukvarjajo z digitalizacijo zdravstva, odločevalskih organov, predstavniki združenj bolnikov in inovativne farmacevtske industrije.
Program si lahko ogledate TU.
Konference bo potekala v Ljubljani, v Cankarjevem domu v Klubu CD (če bodo ukrepi proti covidu-19 to dovoljevali). Konference se lahko udeležite tudi virtualno. PRIJAVA
“,”Jaka Verbic Miklic”,1632560280,1632560280,sl,14830,306,14829,43,0,NULL,,”10. strateška konferenca Vrednost inovacij”,10-strateska-konferenca-vrednost-inovacij,Post,”/sites/43/files/images/news/10. strateska/10-konferenca-vrednost inovacij-500.JPG”,1,0,1632560442,1634719428
815,14830,”10th Strategic Conference Value of Innovation”,”Digital transformation for informed decision-making in healthcare”,”
On Thursday, October 7th 2021, from 12 a.m. to 3 p.m., we will host
10th Strategic Conference Value of Innovation: Digital transformation for informed decision-making in healthcare.

Top domestic and foreign experts will discuss the digitalization of healthcare system, best practices in data collecting and usage, ways to make the most of this data in healthcare policy planning and how to provide best personalized treatment for patients.
Honorary patron of the conference is the President of the Republic of Slovenia Borut Pahor.
Speakers will be representatives from organizations involved in the digitization of healthcare, data collection and usage, decision-makers, representatives of patient associations and the innovative pharmaceutical industry.
More about the program: https://en.vrednostinovacij.si/
If you want to join us at the conference, you can REGISTER HERE.
“,”Jaka Verbic Miklic”,1632560280,1632560280,en,14830,306,14829,43,0,NULL,,”10. strateška konferenca Vrednost inovacij”,10-strateska-konferenca-vrednost-inovacij,Post,”/sites/43/files/images/news/10. strateska/10-konferenca-vrednost inovacij-500.JPG”,1,0,1632560442,1634719428
816,14832,”Za digitalno zdravstveno preobrazbo načrtovanih 83 milijonov evrov”,”Ta bo osredotočena na štiri glavna področja – uporabnike in izvajalce zdravstvenih storitev, odločevalce in načrtovalce zdravstvenega sistema ter plačnike storitev.”,”
Ljubljana, 30. avgusta – Slovenija bo po napovedih državnega sekretarja na ministrstvu za zdravje Roberta Cuglja namenila 83 milijonov evrov za doseganje ciljev v digitalni zdravstveni preobrazbi. Ta bo osredotočena na štiri glavna področja – uporabnike in izvajalce zdravstvenih storitev, odločevalce in načrtovalce zdravstvenega sistema ter plačnike storitev.
Sredstva bodo namenjena za vključitev novih digitalnih storitev v zdravstvo, vključno s telemedicino, digitalizacijo zdravstvenih kartotek, vzpostavitev osrednjega skladišča slik, uvedbo varnejše izdaje zdravil z uporabo robotov v večini bolnišnic, certificirane IT rešitve in nadgradnjo sistema eImenovanja. Cilj je, da bi zagotovili večjo preglednost čakalnih dob in omogočili dobro politiko in odločanje z zagotavljanjem kakovosti, je na današnji konferenci z naslovom Dnevi eZdravja povedal Cugelj.
Na konferenci so med drugim razpravljali tudi o zbiranju in uporabi zdravstvenih podatkov posameznika. Tiste, ki so ustvarjeni v zdravstvenem sistemu, denimo zdravstvene izvide, recepte, napotnice itd. hranijo v okviru centralnega registra podatkov o bolniku (CRPP).
A zdravstvenih podatkov posameznik ne zbere le v okviru obravnav v zdravstvenem sistemu, pač pa vsak dan, denimo prek svoji pametnih IT naprav. Ti podatki so tudi lahko pomembni in uporabni za izboljšanje zdravstva, a morajo biti po opozorilih nemškega strokovnjaka za področje podatkov Thorstena Dittmarja kakovostni. Da bi bili zbrani podatki kakovostni, pa morajo posamezniki zaupati zbiralcem podatkov, sicer bi lahko začeli potvarjati podatke ali pa jih celo ne bi posredovali. V tem primeru bi namreč “vsa leta umetna inteligenca ustvarjala neumnosti”.
Dittmar vidi glavno težavo uporabe teh podatkov trenutno v tem, da se zberejo na strežniku in se tam obdelujejo, kar stane ogromno denarja in energije, poleg tega daje priložnost hekerjem, saj se na istem mestu centralizira ogromno zdravstvenih informacij. Zato se mu zdi boljša možnost, da bi omenjeni podatki zbirali pri posamezniku, torej na njegovih pametnih napravah, kjer bi ostali, bi pa obstajali algoritmi za dostop do teh podatkov.
Ob tem se je odprla tudi razprava, kdo bi moral biti lastnik zdravstvenih podatkov posameznika. Po mnenju odvetnice, specialistke za področje prava varstva osebnih podatkov in dostopa do javnih informacij, Nataše Pirc Musar bi morali lastništvo zdravstvenih podatkov ostati regulirano kot je sedaj, v rokah upravljavca podatkov. Vsekakor pa po njenem mnenju ne bi bilo smotrno zaupati teh podatkov zgolj posamezniku, mora pa ta imeti dostop do svojih podatkov.
“,”Jaka Verbic Miklic”,1630318560,1630318560,sl,14832,306,14831,43,0,NULL,,”Za digitalno zdravstveno preobrazbo načrtovanih 83 milijonov evrov”,za-digitalno-zdravstveno-preobrazbo-nacrtovanih-83-milijonov-evrov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1632565032,1632565102
817,14834,”WHO: Svet pozablja na ljudi z demenco “,”Pojavnost demence, ki ljudi oropa njihovih “spominov, neodvisnosti in dostojnosti””,”
Ženeva, 2. septembra – Pojavnost demence, ki ljudi oropa njihovih “spominov, neodvisnosti in dostojnosti”, se po svetu povečuje, a le redke države so opremljene za boj z njo, kaže poročilo, ki ga je danes objavila Svetovna zdravstvena organizacija (WHO). Po njihovih podatkih ima demenco več kot 55 milijonov ljudi in je tako “globalna grožnja javnemu zdravstvu”.
S tem ko se prebivalstvo stara, se bo število ljudi z demenco po navedbah WHO zvišalo na 78 milijonov do leta 2030 in 139 milijonov do leta 2050.
A le četrtina držav na svetu ima nacionalno strategijo za podporo osebam z demenco in njihovim družinam. Polovica teh držav je v Evropi. “Pa tudi v Evropi se številni načrti iztekajo ali pa so že potekli, kar pomeni, da bi morale vlade obnoviti zaveze,” so po navedbah francoske tiskovne agencije AFP poudarili v WHO.
Med temi državami je Slovenija, ki je leta 2016 sprejela strategijo soočanja z demenco, a je bila veljavna do leta 2020. Je pa v poročilu izpostavljena po izobraževalnih in osveščevalnih programih. Opravljenih je bilo več kot 350 predavanj, ki se jih je udeležilo več kot 10.000 ljudi, piše v poročilu.
Generalni direktor WHO Tedros Adhanom Ghebreyesus je poudaril, da “demenca ropa milijone ljudi njihovih spominov, neodvisnosti in dostojnosti, hkrati pa oropa nas ostale za ljudi, ki jih poznamo in imamo radi”. “Svet pozablja na ljudi z demenco in zaradi tega bomo prizadeti vsi,” je dodal.
Demenca večinoma prizadene starejše od 65 let, lahko pa jo imajo tudi mlajši. Ni je mogoče pozdraviti, raziskave pa kažejo, da bi se okoli 40 odstotkom primerov lahko izognili ali jih prestavili na kasnejši čas s primernim življenjskim slogom.
Predstavnica WHO Katrin Seeher je novinarjem pojasnila, da je več kot 60 odstotkov ljudi z demenco v državah z nizkimi ali srednje visokimi prihodki. “Predvsem je treba zmanjšati vrzel med bogatejšimi in revnejšimi državami, med urbanimi in ruralnimi predeli,” je dejala.
Po njenih besedah je treba okrepiti socialne programe in storitve za pomoč ljudem z demenco, da bi tako razbremenili njihove svojce in jim omogočili strokovno pomoč.
Kot še kaže poročilo WHO, so bili svetovni stroški demence leta 2019 ocenjeni na 1,3 bilijona ameriških dolarjev. “Ti stroški se bodo do leta 2030 zvišali na 1,7 bilijona ali celo 2,8 bilijona dolarjev, če upoštevamo zvišanje stroškov oskrbe,” piše.
“,”Jaka Verbic Miklic”,1630578000,1630578000,sl,14834,306,14833,43,0,NULL,,”WHO: Svet pozablja na ljudi z demenco “,who-svet-pozablja-na-ljudi-z-demenco,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1632565344,1632565345
818,14836,”V letošnjem šolskem letu bodo proti HPV prvič lahko cepljeni tudi dečki “,”Z novim šolskim letom bodo pri nas proti virusu HPV po deklicah začeli cepiti tudi dečke.”,”
Ljubljana, 3. septembra – Z novim šolskim letom bodo pri nas proti virusu HPV po deklicah začeli cepiti tudi dečke. Zveza slovenskih društev za boj proti raku, Onkološki inštitut Ljubljana in Nacionalni inštitut za javno zdravje so na današnji novinarski konferenci pozvali starše k odločitvi za cepljenje otrok, saj je to ključno za zmanjšanje raka na materničnem vratu.
Državni sekretar na ministrstvu za zdravje Franc Vindišar je povedal, da je cepljenje dečkov proti HPV pomembno, saj je zelo učinkovito pri preprečevanju raka. Po njegovem zatrjevanju s cepljenjem lahko preprečimo “skoraj 100 odstotkov raka materničnega vratu, med 45 in 90 odstotkov ostalih rakov anogenitalnega področja obeh spolov in 26 odstotkov rakov ustnega dela žrela”.
Zaradi tega po njegovem mnenju cepljeni “pomembno manj zbolevajo in umirajo za raki”.
Dodal je še, da je cepljenje proti HPV med prioritetami evropskega načrta za boj proti raku, prav tako pa ima pomembno mesto tudi v okviru državnega programa za obvladovanje raka, zato bi s cepljenjem in presejalnim programom Zora lahko eliminirali to vrsto raka pri nas.
Po podatkih Svetovne zdravstvene organizacije je cilj cepiti vsaj 90 odstotkov deklic. Trenutno jih je v Sloveniji precepljenih okoli 60 odstotkov. Po zatrjevanju vodje programa Zora Urške Ivanuš se rezultati cepljenja pri nas že poznajo. Po podatkih Nacionalnega inštituta za javno zdravje (NIJZ) iz leta 2016 pri nas na 100.000 prebivalcev namreč zboli okoli 11 žensk, v Romuniji, kjer je precepljenost manjša, pa 23 žensk.
Ob začetku novega šolskega leta si Stanka Preskar z zavoda za šolstvo želi, da bi otroke in njihove starše informirali in ozavestili o pomembnosti cepljenja proti virusu HPV. “Kot strokovna inštitucija, ki svetuje vzgojno-izobraževalnim inštitucijam po celotni vertikali, se zavedamo, da je le pravočasna in korektna informacija, ki doseže tako delavce vzgojno-izobraževalnih ustanov kakor tudi starše, ki se vsakodnevno srečujejo s temi delavci, tista, ki bo dala možnost, da se na osnovi relevantne informacije odločijo o tem, da bodo svojega otroka dali cepiti,” je povedala.
Direktor NIJZ Milan Krek je spomnil na viruse in bolezni, za katerimi so zbolevali otroci v preteklosti. Ker teh bolezni danes praktično ni več, je pozval k cepljenju tudi proti virusu HPV. Ob pozivih je še poudaril, da so cepiva v mnogih državah plačljiva, pri nas pa brezplačna.
Generalna direktorica Onkološkega inštituta Ljubljana Andreja Uštar je povedala, da njihov inštitut kot osrednja ustanova za onkologijo “usmerja program celostne obravnave rakavih bolezni” na področju preventive. Ob tem je povedala, da je preventivno delovanje ključnega pomena za celostno obravnavo raka.
Izrazila je tudi zadovoljstvo in ponos zaradi usklajenega sodelovanja s strokovnjaki s področij “zdravstva, šolstva, civilne družbe in političnih odločevalcev v podporo cepljenju proti HPV”.
“Le z zaupanjem v znanost in medicino lahko premagujemo bolezni, na kar nas danes opominja tudi epidemija covida-19. Eno najmočnejših sredstev za boj proti covidu-19 in posledicam, ki jih nosi ta bolezen, zagotovo predstavlja cepljenje in s cepljenjem lahko preprečimo tudi raka,” je povedala.
Da bo cepljenje tako deklic kot dečkov pripomoglo k zmanjšanju raka na materničnem vratu, je povedala tudi strokovna direktorica Onkološkega inštituta Ljubljana Irena Oblak.
NIJZ je idejo za cepljenje dečkov v obravnavo sicer podal leta 2019, cepljenje deklic pa so začeli v šolskem letu 2009/2010.
“,”Jaka Verbic Miklic”,1630664580,1630664580,sl,14836,306,14835,43,0,NULL,,”V letošnjem šolskem letu bodo proti HPV prvič lahko cepljeni tudi dečki “,v-letosnjem-solskem-letu-bodo-proti-hpv-prvic-lahko-cepljeni-tudi-decki,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1632565480,1632565481
819,14838,”V zadnjih dveh letih diagnosticirali polovico manj krvnih rakov “,”Ob mesecu krvnih bolezni so na okrogli mizi, ki jo je pripravila družba Aetas, ozaveščali o pomembnosti pravočasne prepoznave krvnih bolezni. “,”
Ljubljana, 7. septembra – Ob mesecu krvnih bolezni so na okrogli mizi, ki jo je pripravila družba Aetas, ozaveščali o pomembnosti pravočasne prepoznave krvnih bolezni. Ker je bil v preteklih dveh letih omejen dostop do osebnih zdravnikov, so diagnosticirali polovico manj krvnih rakov kot pred epidemijo covida-19, kljub temu pa zdravljenje bolnikov ostaja uspešno.
Podpredsednica Društva bolnikov s krvnimi boleznimi Slovenije Anica Kralj Štimec je povedala, da znake in simptome rakavih krvnih bolezni podcenjujemo, saj jih je težko prepoznati. Najpomembnejša za prepoznavanje krvnih bolezni, sploh v začetni fazi, je krvna slika. Krvne bolezni imajo sicer po zatrjevanju strokovnjakov zelo splošne znake, kot so utrujenost, potenje in bolečina v kosteh, zato je obisk osebnega zdravnika toliko pomembnejši. Zaradi okvare imunskega sistema so pogostejše tudi okužbe, krvavitve in zatrdline na telesu.
Med epidemijo je bil otežen dostop do osebnih zdravnikov, zato so prepoznali za polovico manj krvnih rakavih bolnikov kot v preteklih letih. Kljub temu pa so po zatrjevanju strokovnjakov bolniki poudarili, da je zdravljenje na sekundarni ravni, ko je bolezen že prepoznana, potekalo še bolje in hitreje kot prej.
Dobro dostopnost med epidemijo je izpostavila tudi izvršna direktorica Slovenskega združenja bolnikov z limfomom in levkemijo Kristina Modic, ob tem pa dodala probleme, ki so jih imeli tisti, ki so šele vstopali v zdravljenje. Poudarila je, da posameznik z diagnozo raka ne sme čakati, saj je čas ključnega pomena za uspešno zdravljenje.
Čas epidemije covida-19 je pomenil in še vedno pomeni hudo grožnjo za rakave bolnike. Ker jih ne ogroža le novi koronavirus temveč tudi njihova primarna bolezen, mora biti po mnenju Modičeve njihova obravnava nemotena.
Hematologinja Irena Preložnik Zupan je pojasnila, da so hematološki bolniki dolgotrajno utrujeni in nimajo volje do vsakodnevnega dela. Če takšno počutje traja dlje časa, poziva k obisku osebnega zdravnika.
Krvne bolezni sicer niso breme le posameznika temveč celotne družbe. V letu 2019 je v Evropi za njimi umrlo 154.000 ljudi, osem odstotkov vseh rakov v Evropi je krvnih.
Ker je diagnosticiranje krvnega raka izjemnega pomena, študente medicine začenjajo vse bolj poglobljeno poučevati o krvnih boleznih, je povedal predstojnik kliničnega oddelka za hematologijo interne klinike UKC Ljubljana Samo Zver.
Strokovnjaki so opozorili, da je pomembno tudi ozaveščanje in poučevanje bolnikov. Po besedah hematologinje Irene Preložnik Zupan bolniki lahko optimistično gledajo v prihodnost, saj dandanes poznamo veliko zdravil, ki omilijo znake in jih ozdravijo.
Bolniku po mnenju Kralj Štimčeve najlažje pomaga in svetuje preboleli bolnik. V Društvu bolnikov s krvnimi boleznimi imajo zato bolniki in njihovi svojci z akcijo bolnik bolniku možnost pogovora s strokovnjaki in prebolevniki. Ob tem poudarja, da tak pogovor bolnikom pomaga in lajša preživljanje bolezni.
Letošnji mesec ozaveščanja bodo med drugim posvetili predstavitvam redkih krvnih bolezni z organizacijo dogodkov v septembru.
“,”Jaka Verbic Miklic”,1631010360,1631010360,sl,14838,306,14837,43,0,NULL,,”V zadnjih dveh letih diagnosticirali polovico manj krvnih rakov “,v-zadnjih-dveh-letih-diagnosticirali-polovico-manj-krvnih-rakov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1632565658,1632565658
820,14840,”10. strateška konferenca”,”Če hočemo kakovosten, hitro odziven in vzdržen zdravstveni sistem, je ena izmed ključnih rešitev jasna: sistematična digitalizacija”,”
Ljubljana, 7. oktober 2021 – Epidemija covida-19 je po svetu, a tudi v Sloveniji, razgalila problem nesistematičnega pristopa pri digitalizaciji v zdravstvenem sistemu. Če hočemo kakovosten, hitro odziven in vzdržen zdravstveni sistem, je ena izmed ključnih rešitev jasna: sistematična digitalizacija s poenotenjem beleženja podatkov ter njihova kakovostna obdelava. O tem so ugledni tuji in domači strokovnjaki razpravljali na strateški konferenci Vrednost inovacij, ki jo je že deseto leto zapored organiziral Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb (Forum).
Da se zdravstvena tehnologija razvija nezadržno hitro in da nanjo vse bolj vpliva tudi umetna inteligenca, je poudaril Michael Strübin, direktor digitalnega zdravja pri Medtech Europe. Dokaz za to so naprave, ki jih nosimo na telesu za spremljanje gibanja in zaznavanje padcev, merjenje aktivnosti srca in napovedovanje njegove odpovedi ter naprave za merjenje fizičnih aktivnosti. Po njegovih besedah lahko umetna inteligenca in medicinske tehnologije ohranijo 40 tisoč življenj na leto, kar letno predstavlja 200 milijard evrov prihrankov oziroma 12 odstotkov vseh izdatkov za zdravstvo v EU. »Umetna inteligenca nam prihrani 1,8 milijard ur letno. To je enako kot 500 tisoč dodatno zaposlenih zdravstvenih delavcev. Zato tukaj ne govorimo o nadomeščanju medicinskih tehnologij ampak o tem, da so te na voljo za interakcije s pacienti kjer človek ostaja boljši od stroja,« je še dodal Strübin.
Ob tem pa so tudi ovire, predvsem pravne, regulativne in finančne. A z dobro organizacijo, lahko vsako zdravstvo postane bolj dostopno in personalizirano, je ocenila vodilna strokovna sodelavka za zdravstvene podatke v finski fundaciji za inovacije Sitra, dr. Minna Hendolin. Finska je kljub svoji majhnosti na področju digitalizacije zdravstvenih storitev na samem vrhu v Evropi. Leta 2014 so na finskem sprejeli široko strategijo zdravstvenega varstva, ki je preživela tri različne vlade. Cilj strategije je bil, da postane Finska mednarodno priznana v sektorju raziskav, inovacij in razvoja, pa tudi v naložbah v zdravstveni sektor. Poudarili so pomen uporabe podatkov v sekundarne namene za raziskave, razvoj, inovacije in oblikovanje politik. A za tako uspešno zgodbo so morali najprej urediti zakonodajo, kar je bil težji del. Dr. Hendolin je opisala nacionalno službo KANTA, ki so jo razvili z namenom, da postane hrbtenica za podatke in zdravstveni ekosistem: »To je repozitorij podatkov o pacientih, socialnih in zdravstvenih podatkov, podatkov o receptih in neke vrste podatkovna banka. Do podatkov lahko dostopajo zdravstveni delavci in tam hranijo zdravstvene kartoteke in recepte. Dostop imajo tudi državljani. Ob vsem tem je to tudi storitvena platforma, ki je pomemben del infrastrukture zdravstvenega varstva na finskem,« je poudarila Minna Hendolin.
Da v Sloveniji premalo vlagamo v digitalizacijo zdravstva in skupne baze podatkov, so si bili enotni vsi domači govorci na konferenci. Bogdan Tušar, generalni direktor Direktorata za razvoj zdravstvenega sistema na Ministrstvu za zdravje, je dejal, da gre le en odstotek vseh sredstev namenjenih za zdravstvo, za področje digitalizacije. V tujini je ta odstotek 4-krat višji. Na drugi strani pa že izvajamo tekoče ukrepe in prve korake proti bolj inovativnemu zdravstvu – na ministrstvu so denimo oblikovali nov direktorat, ki se bo ukvarjal z razvojnimi vsebinami: od področja zakonodaje, varstva v zdravstvu, dolgotrajne oskrbe in področja digitalizacije. Tudi Metka Zaletel, predstojnica Zdravstveno podatkovnega centra Nacionalnega inštituta za javno zdravje Slovenije, in Anka Bolka, vodja Direktorata za razvoj in analizo Zavoda za zdravstveno zavarovanje Slovenije, sta poudarili, da Slovenija že zbira podatke in jih ureja v koristne baze.
Eden izmed najbolj perečih problemov v slovenskem zdravstvu, kot ga je izpostavil tudi Gregor Cuzak, soustvarjalec in soorganizator HealthDay.si, je tudi to, da deset let ali več vlagamo v zdravstveni kader, ki potem odide v tujino. Kadrovske težave bi delno lahko rešili tudi z umetno inteligenco. Na konferenci je bil predstavljena Frida – komercialni model humanoidnega robota. Dr. Izidor Mlakar iz Fakultete za elektrotehniko, računalništvo in informatiko Univerze v Mariboru in UKC Maribor, je poudaril da z robotom sledijo viziji zasnove odprte in celovite platforme, kjer bi lahko različne aspekte umetne inteligence umestili v klinično oskrbo. Frida bi tako lahko med drugim pri opravilih pomagala zdravstvenemu osebju, predvsem medicinskim sestram.
Panoga zdravstva v Evropi je »težka« 140 milijard evrov, na stari celini pa zaposluje 760.000 ljudi. Večina njih, kar 95 odstotkov, dela v malih in srednje velikih podjetjih, povezanih z zdravstvenim sektorjem. Nathalie Moll, generalna direktorica Evropske zveze farmacevtskih industrij in združenj (EFPIA) tako vidi digitalizacijo kot hrbtenico sodobnega zdravljenja. Po njenem bodo digitalne zdravstvene rešitve in podatki, krojili razvoj znanosti o življenju in tudi zdravstvo.
»Epidemija nas je opozorila, kako pomembno je preučevati bolezni na širšem področju in ne le na ravni posamezne države. Države morajo povezati zdravstvene podatke, poskrbeti za tako imenovano federativno arhitekturo, in se lotiti analiz masovnih podatkov,« je poudaril prof. dr. Dipak Kalra, predsednik Evropskega inštituta za inovacije skozi zdravstvene podatke. Prav zdravstveni podatki so namreč tisti, ki spodbujajo inovacije v zdravstvu. Zavedati se moramo neenakosti na področju zdravstva v različnih državah, a če želimo uresničiti enakopraven dostop do zdravstvenih storitev, moramo postaviti ustrezne podatkovne temelje, je še poudaril prof. dr. Kalra in izpostavil pomembnost podatkov – ti so izjemno koristni za boljšo kakovost oskrbe, pa tudi za to, da sploh ugotovimo, na katerih področjih so nujne izboljšave.
Sicer pa so bili na konferenci predstavljeni tudi primeri prebojnih terapij in tehnologij, ki bodo bistveno spremenile način obravnave bolnikov. Prof. dr. Roman Jerala je predstavil pomen in poslanstvo kemijskega inštituta pri širjenju znanja ter povezovanju z različnimi deležniki z namenom prenosa inovacij v prakso, med katerimi velja omeniti razvoj novih protivirusnih terapij. Prof. dr. Borut Štrukelj je predstavil prihodnost tehnologije RNA in možnosti razvoja novih zdravil z omenjeno tehnologijo.
Digitalizacija zdravstva in skupna, evropska baza zdravstvenih podatkov je tisto, za kar bi si morala Evropa kot celota prizadevati, so si bili enotni strokovnjaki iz področja zdravstva in farmacije. Če želimo imeti kakovosten in vzdržen zdravstveni sistem, je prava pot sistematična digitalizacija, saj celovitejša zdravstvena oskrba, tudi tista, ki se izvaja na daljavo, na dolgi rok prinaša prihranke in pripomore k večji odpornosti zdravstvenega sistema.
“,”Jaka Verbic Miklic”,1633850640,1633850640,sl,14840,306,14839,43,0,NULL,,”10 strateska konferenca forum”,10-strateska-konferenca-forum,Post,”/sites/43/files/images/10-konferenca-vrednost inovacij-500.JPG”,1,0,1633850766,1635099158
821,14847,”Redke bolezni – kakšna je prihodnost? “,”Kakšno je stanje na področju redkih bolezni v Sloveniji, kateri so največji izzivi na tem področju ter kaj nas čaka v prihodnosti.”,”
V ponedeljek 4.10. je v organizaciji STA potekala virtualna okrogla miza z naslovom »Redke bolezni – kakšna je prihodnost.« Kakšno je stanje na področju redkih bolezni v Sloveniji, kateri so največji izzivi na tem področju ter kaj nas čaka v prihodnosti. O tem so spregovorili eminentni domači strokovnjaki:
Prof. dr. Tadej Battelino, predstojnik kliničnega oddelka za endokrinologijo, diabetes in presnovne bolezni na Pediatrični kliniki v Ljubljani
Prof. dr. Samo Zver, predstojnik kliničnega oddelka za hematologijo v UKC Ljubljana
Prof. dr. Damjan Osredkar, predstojnik kliničnega oddelka za otroško, mladostniško in razvojno nevrologijo na Pediatrični kliniki v Ljubljani.
Posnetek je na voljo tu: https://www.youtube.com/watch?v=ojIBnsp7Sb4
“,”Jaka Verbic Miklic”,1634466060,1634466060,sl,14847,306,14846,43,0,NULL,,”Redke bolezni – kakšna je prihodnost? “,redke-bolezni-kaksna-je-prihodnost,Post,”/sites/43/files/images/news/Rare desises/Mic2.jpg”,1,0,1634552579,1634806666
822,14840,”10th Value of Innovation strategic conference”,”Digital transformation for informed decision-making in healthcare”,”
Ljubljana, 7 October 2021 – The covid-19 epidemic has exposed the issue of non-systematic approaches to digitalization in healthcare systems around the world, and Slovenia is no exception. If we want a high quality, responsive and sustainable healthcare system, one of the key solutions is clear: systematic digitalization with unified logging quality processing of data. This was the topic of debate for eminent foreign and Slovenian experts at the Value of Innovation Strategic Conference, organized for the tenth year running by the Forum of international research and development pharmaceutical companies (Forum).
The fact that health technology is developing ever faster and is being increasingly influenced by artificial intelligence was emphasized by Michael Strübin, director of digital health with Medtech Europe. The devices we wear on our bodies today to monitor movement and detect falls, measure physical activity, heart activity and even forecast its failure are proof of this rapid development. Mr. Strübin noted that artificial intelligence and medical technologies could save 40 thousand lives per year, making up for 200 billion Euros or worth of savings each year which corresponds to 12 percent of all health expenditures in the EU. “Artificial intelligence saves us 1.8 billion hours per year. This equates to five hundred thousand additionally employed healthcare professionals. We are not talking about replacing medical technologies but rather making them available for interacting with patients in areas where a human is better than a machine,” added Strübin.
Of course there are certain obstacles, particularly legal, regulatory and financial, but with good organization any healthcare system can become more accessible and personalized, noted leading health data expert from the Finnish innovation foundation Sitra, dr. Minna Hendolin. In spite of its small size, Finland is at the top of the European countries in terms of digitalization of healthcare services. In 2014, Finland adopted a comprehensive healthcare strategy that has so far survived three different governments. The aim of the strategy was to transform Finland into an internationally recognized powerhouse in the field of research, innovation and development, as well as investments into the health sector. The strategy emphasized the importance of using data for secondary purposes of research, development, innovation and policy development, but the success story could not start without a profound renovation of legislation, which proved to be the difficult part. Dr. Hendolin described the national service KANTA that was established to become the backbone of the data and healthcare ecosystem: “It is a repository of patient data, social and health data, data on prescriptions and a type of data bank. Stored data is accessible to healthcare professionals that use the service to store health records and prescriptions, but citizens can access the data as well. KANTA also provides a service platform that is a very important part of Finland’s healthcare infrastructure,” emphasized Minna Hendolin.
The opinion that Slovenia is investing much too little in the digitalization of healthcare and building a common database was echoed by all Slovenian speakers at the conference. Bogdan Tušar, Director General of the Healthcare System Development Directorate at the Ministry of Health, reported that only a single percent of all funds earmarked for healthcare is allocated to digitalization. The percentage abroad is four times as high. But we are already carrying out measures and taking first steps towards more innovative healthcare. The Ministry has formed a new directorate to focus on development issues ranging from legislation, health protection, long term care and digitalization. Metka Zaletel, head of the Health Data Center at the National Institute of Public Health and Anka Bolka, head of the Directorate for Development and Analysis at the Health Insurance Institute of Slovenia, both reported that Slovenia is already collecting data and classifying it into useful databases.
One of the most challenging issues in Slovenian healthcare, as emphasized by Gregor Cuzak, co-creator and co-organizer of HealthDay.si, is also the fact that we invest into healthcare personnel for ten years or more, only to have professionals leave the country. Personnel issues could partly also be addressed by using artificial intelligence. The Conference saw a presentation of Frida – a commercial model of a humanoid robot. Dr. Izidor Mlakar from the Faculty of Electrotecnics, Computer Science and Informatics of the University of Maribor and University Medical Centre Maribor reported that the robot follows the vision of an open and comprehensive platform that could integrate various aspects of artificial intelligence into clinical care. Frida could be used to assist healthcare staff in various tasks, particularly in nursing care.
The healthcare sector in Europe has a turnover of 140 billion Euros and employs 760,000 people. Most of them, as many as 95 percent, work in small and mid-sized companies linked with the healthcare sector. Nathalie Moll, Director General of the European Federation of Pharmaceutical Industries and Associations (EFPIA) sees digitalization as the backbone of modern healthcare. She believes that digital health solutions and data will steer the development of life sciences and healthcare in the future.
“The epidemic has shown us how important it is to study diseases in a wider area, not only in individual countries. Countries must share their health data, establish a so-called federative architecture and begin analyzing mass data,” noted Dipak Kalra, President of the European Institute for Innovation through Health Data. It is health data that promotes innovation in healthcare. We must be aware of inequalities in the field of healthcare in different countries, but if we want to establish equitable access to health services, we must first establish appropriate data foundations, noted Dr. Kalra and emphasized the importance of data, that is essential for improving the quality of care and even finding out which areas require improvements.
The Conference also saw presentations of breakthrough therapies and technologies that will fundamentally change the way patients are treated. Prof. dr. Roman Jerala presented the importance and mission of the National Institute of Chemistry in the expansion of knowledge and linking with various stakeholders to transfer innovations into practice, including the development of new antiviral therapies. Prof. dr. Borut Štrukelj presented the future of RNA technology and the potential for developing new medicines using the technology.
Experts in the fields of healthcare and pharmacy agreed that digitalization of healthcare and a common European health database should be at the forefront of Europe’s efforts. If we want to have a high quality and sustainable healthcare system, a systematic digitalization is essential because a better integrated healthcare, remote or in person, brings long term savings and contributes decisively to greater resilience of healthcare systems.
“,”Jaka Verbic Miklic”,1634467260,1634467260,en,14840,306,14839,43,0,NULL,,”10 strateska konferenca forum”,10-strateska-konferenca-forum,Post,”/sites/43/files/images/10-konferenca-vrednost inovacij-500.JPG”,1,0,1633850766,1635099158
824,14852,”Ministri za zdravje držav članic EU v Sloveniji”,”Dnevni red sestanka bo, med drugim, zajemal tudi teme dostopnosti in razpoložljivosti zdravil”,”
12. oktobra 2021 se bodo ministri za zdravje držav članic EU srečali na neformalnem sestanku v Sloveniji, na katerem bo prisotna tudi Stella Kyriakides, komisarka za zdravje in varnost hrane. Dnevni red sestanka bo, med drugim, zajemal tudi teme dostopnosti in razpoložljivosti zdravil, odziva in pripravljenosti na čezmejne grožnje zdravju ter odpornost zdravstvenih sistemov.
Združenje EFPIA pozdravlja predloge Slovenskega predsedstva Svetu EU za krepitev Evropske zdravstvene unije, ki so predstavljeni v osnutkih sklepov Sveta.
Pozdravljamo osnutek sklepa sveta, ki države članice in Komisijo poziva k ustreznemu osredotočanju na iskanje možnosti za izboljševanje dostopnosti in razpoložljivosti zdravil, predvsem protimikrobnih. Na področju boja proti protimikrobni odpornosti je potrebno sprejeti celovit sklop politik, ki bodo zagotovile boljšo ozaveščenost, upravljanje in programe nadzora. Nujno moramo nasloviti tudi neuspehe aktualnega ekonomskega ogrodja za protimikrobna sredstva na področju spodbujanja trajnih investicij v raziskave in razvoj na tem zares kritičnem področju. Za doseganje tega cilja pozivamo k razvoju nove spodbude na Evropskem nivoju v obliki prenosljivega podaljšanja ekskluzivnosti (transferable exclusivity extension – TEE), ki n spoštuje preudarno uporabo tako, da finančno nagrado loči od obsega receptov. Za premagovanje komercialnih izzivov, povezanih z ustrezno uporabo protimikrobnih sredstev, je treba nagraditi uspešne inovacije na nivoju, ki omogoča povečanje sredstev za raziskave in razvoj protimikrobnih zdravil, obenem pa zagotoviti trajnosten nabor inovativnih protimikrobnih zdravil za spopadanje s prihodnjimi grožnjami AMR in dostop bolnikov do teh zdravil, ko jih potrebujejo..
Glede vključitve uporabe obstoječih zdravil za nove indikacije v osnutek sklepa Sveta in verjetno temo pogovorov na jutrišnjem sestanku želi EFPIA poudariti, da je združenje hkrati z drugimi trgovinskimi organizacijami, združenji bolnikov in regulatorji iz evropskih držav sodelovalo z Evropsko komisijo pri pripravi pilotnega projekta rabe obstoječih zdravil za nove indikacije s strokovno skupino Evropske komisije za varen in pravočasen dostop do zdravil za bolnike (STAMP)2. Rezultati pilotnega projekta bodo najverjetneje predstavljeni ob koncu tega meseca in bodo lahko pomagali pri sprejemanju nadaljnjih političnih odločitev. V komentarju na besedilo osnutka je generalna direktorica združenja EFPIA Nathalie Moll povedala: »Kot smo videli v primeru multiplega mieloma, je uporaba obstoječih zdravil s patentno zaščito ali brez za nove indikacije lahko učinkovit način za izpolnjevanje potreb po zdravilih sirotah ali pediatričnih zdravilih. Vsekakor pa je za takšno novo uporabo pomembno soglasje imetnika dovoljenja za promet. Verjamemo, da bi morala nova inovativna zdravila in že znana zdravila, ki se pričnejo uporabljati za zdravljenje redke bolezni, prejeti enake spodbude, saj je pomembno, da se zmanjšajo ovire, povezane z regulativo, dostopnostjo zdravil, oblikovanjem cen in umeščanjem zdravil v sistem javnega financiranja.«
“,”Jaka Verbic Miklic”,1634038080,1634038080,sl,14852,306,14851,43,0,NULL,,”Ministri na obisku”,ministri-na-obisku,Post,/sites/43/files/images/ljubljana.jpeg,1,0,1634556543,1634560559
826,14852,”EFPIA statement on tomorrow’s meeting of EU Health Ministers”,”EFPIA welcomes the proposals from the the Slovenian Presidency of the Council of the EU presented in the draft Council Conclusions to strengthen a European Health Union.”,”
Tomorrow (12 October 2021), EU Health Ministers will gather for an informal meeting in Slovenia, which will also be attended by Stella Kyriakides, Commissioner for Health and Food Safety. The agenda will focus on the following topics, amongst others: availability and accessibility of medicines, the response and preparedness to cross-border health threats, and resilient health systems.
EFPIA welcomes the proposals from the the Slovenian Presidency of the Council of the EU presented in the draft Council Conclusions to strengthen a European Health Union.
We welcome the draft Council Conclusion’s invitation to Member States and the Commission to pay due attention to finding ways to improve the accessibility and the availability of medicinal products, notably of antimicrobials. In regard to the fight against Anti-Microbial Resistance (AMR), a comprehensive set of policies is required including better awareness, stewardship and surveillance programmes. We also need to urgently address the failure of the current economic framework for anti-microbials to drive sustained research and development (R&D) investments in this critical field. To achieve this objective, we call for the development of a new incentive at the European level in the form of a transferable exclusivity extension (TEE) which is pro-stewardship and respects prudent use by delinking financial reward from the volume of prescriptions. Rewarding successful innovation at a level sufficient to increase anti-microbial R&D is required to overcome the commercial challenges associated with appropriate use of anti-microbials, whilst ensuring a sustainable pipeline of innovative antimicrobial medicines to meet future AMR threats as well as patient access to these medicines when needed.
In light of the inclusion of repurposing in the draft Council Conclusions and likely discussion at tomorrow’s meeting, EFPIA wishes to highlight that together with other trade associations, patient groups and regulators from around Europe, we have been working with the European Commission on a repurposing pilot project with the Commission’s Expert Group on Safe and Timely Access to Medicines for Patients (STAMP)1. Results of the pilot are likely to be launched later this month and should inform further policy decisions. Commenting on the draft Council Conclusions, EFPIA Director General, Nathalie Moll said, “As seen in the case of multiple myeloma, repurposing existing on-patent or off-patent products can also be an effective means of addressing orphan and paediatric health needs. However, the consent of the Marketing Authorisation Holder(s) for such repurposing is important. To regard repurposing as one viable way to address unmet needs in rare disease, we have to acknowledge the merits of incentives.”
1The STAMP expert group is set up to provide advice and expertise to the Commission services in relation to the implementation of the EU Pharmaceutical legislation, as well as programmes and policies in this field.
“,,1634042040,1634042040,en,14852,306,14851,43,0,NULL,,”Ministri na obisku”,ministri-na-obisku,Post,/sites/43/files/images/ljubljana.jpeg,1,0,1634556543,1634560559
827,14857,”10. strateška konferenca”,”Če hočemo kakovosten, hitro odziven in vzdržen zdravstveni sistem, je ena izmed ključnih rešitev jasna: sistematična digitalizacija”,”
Ljubljana, 7. oktober 2021 – Epidemija covida-19 je po svetu, a tudi v Sloveniji, razgalila problem nesistematičnega pristopa pri digitalizaciji v zdravstvenem sistemu. Če hočemo kakovosten, hitro odziven in vzdržen zdravstveni sistem, je ena izmed ključnih rešitev jasna: sistematična digitalizacija s poenotenjem beleženja podatkov ter njihova kakovostna obdelava. O tem so ugledni tuji in domači strokovnjaki razpravljali na strateški konferenci Vrednost inovacij, ki jo je že deseto leto zapored organiziral Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb (Forum).
Da se zdravstvena tehnologija razvija nezadržno hitro in da nanjo vse bolj vpliva tudi umetna inteligenca, je poudaril Michael Strübin, direktor digitalnega zdravja pri Medtech Europe. Dokaz za to so naprave, ki jih nosimo na telesu za spremljanje gibanja in zaznavanje padcev, merjenje aktivnosti srca in napovedovanje njegove odpovedi ter naprave za merjenje fizičnih aktivnosti. Po njegovih besedah lahko umetna inteligenca in medicinske tehnologije ohranijo 40 tisoč življenj na leto, kar letno predstavlja 200 milijard evrov prihrankov oziroma 12 odstotkov vseh izdatkov za zdravstvo v EU. »Umetna inteligenca nam prihrani 1,8 milijard ur letno. To je enako kot 500 tisoč dodatno zaposlenih zdravstvenih delavcev. Zato tukaj ne govorimo o nadomeščanju medicinskih tehnologij ampak o tem, da so te na voljo za interakcije s pacienti kjer človek ostaja boljši od stroja,« je še dodal Strübin.
Ob tem pa so tudi ovire, predvsem pravne, regulativne in finančne. A z dobro organizacijo, lahko vsako zdravstvo postane bolj dostopno in personalizirano, je ocenila vodilna strokovna sodelavka za zdravstvene podatke v finski fundaciji za inovacije Sitra, dr. Minna Hendolin. Finska je kljub svoji majhnosti na področju digitalizacije zdravstvenih storitev na samem vrhu v Evropi. Leta 2014 so na finskem sprejeli široko strategijo zdravstvenega varstva, ki je preživela tri različne vlade. Cilj strategije je bil, da postane Finska mednarodno priznana v sektorju raziskav, inovacij in razvoja, pa tudi v naložbah v zdravstveni sektor. Poudarili so pomen uporabe podatkov v sekundarne namene za raziskave, razvoj, inovacije in oblikovanje politik. A za tako uspešno zgodbo so morali najprej urediti zakonodajo, kar je bil težji del. Dr. Hendolin je opisala nacionalno službo KANTA, ki so jo razvili z namenom, da postane hrbtenica za podatke in zdravstveni ekosistem: »To je repozitorij podatkov o pacientih, socialnih in zdravstvenih podatkov, podatkov o receptih in neke vrste podatkovna banka. Do podatkov lahko dostopajo zdravstveni delavci in tam hranijo zdravstvene kartoteke in recepte. Dostop imajo tudi državljani. Ob vsem tem je to tudi storitvena platforma, ki je pomemben del infrastrukture zdravstvenega varstva na finskem,« je poudarila Minna Hendolin.
Da v Sloveniji premalo vlagamo v digitalizacijo zdravstva in skupne baze podatkov, so si bili enotni vsi domači govorci na konferenci. Bogdan Tušar, generalni direktor Direktorata za razvoj zdravstvenega sistema na Ministrstvu za zdravje, je dejal, da gre le en odstotek vseh sredstev namenjenih za zdravstvo, za področje digitalizacije. V tujini je ta odstotek 4-krat višji. Na drugi strani pa že izvajamo tekoče ukrepe in prve korake proti bolj inovativnemu zdravstvu – na ministrstvu so denimo oblikovali nov direktorat, ki se bo ukvarjal z razvojnimi vsebinami: od področja zakonodaje, varstva v zdravstvu, dolgotrajne oskrbe in področja digitalizacije. Tudi Metka Zaletel, predstojnica Zdravstveno podatkovnega centra Nacionalnega inštituta za javno zdravje Slovenije, in Anka Bolka, vodja Direktorata za razvoj in analizo Zavoda za zdravstveno zavarovanje Slovenije, sta poudarili, da Slovenija že zbira podatke in jih ureja v koristne baze.
Eden izmed najbolj perečih problemov v slovenskem zdravstvu, kot ga je izpostavil tudi Gregor Cuzak, soustvarjalec in soorganizator HealthDay.si, je tudi to, da deset let ali več vlagamo v zdravstveni kader, ki potem odide v tujino. Kadrovske težave bi delno lahko rešili tudi z umetno inteligenco. Na konferenci je bil predstavljena Frida – komercialni model humanoidnega robota. Dr. Izidor Mlakar iz Fakultete za elektrotehniko, računalništvo in informatiko Univerze v Mariboru in UKC Maribor, je poudaril da z robotom sledijo viziji zasnove odprte in celovite platforme, kjer bi lahko različne aspekte umetne inteligence umestili v klinično oskrbo. Frida bi tako lahko med drugim pri opravilih pomagala zdravstvenemu osebju, predvsem medicinskim sestram.
Panoga zdravstva v Evropi je »težka« 140 milijard evrov, na stari celini pa zaposluje 760.000 ljudi. Večina njih, kar 95 odstotkov, dela v malih in srednje velikih podjetjih, povezanih z zdravstvenim sektorjem. Nathalie Moll, generalna direktorica Evropske zveze farmacevtskih industrij in združenj (EFPIA) tako vidi digitalizacijo kot hrbtenico sodobnega zdravljenja. Po njenem bodo digitalne zdravstvene rešitve in podatki, krojili razvoj znanosti o življenju in tudi zdravstvo.
»Epidemija nas je opozorila, kako pomembno je preučevati bolezni na širšem področju in ne le na ravni posamezne države. Države morajo povezati zdravstvene podatke, poskrbeti za tako imenovano federativno arhitekturo, in se lotiti analiz masovnih podatkov,« je poudaril prof. dr. Dipak Kalra, predsednik Evropskega inštituta za inovacije skozi zdravstvene podatke. Prav zdravstveni podatki so namreč tisti, ki spodbujajo inovacije v zdravstvu. Zavedati se moramo neenakosti na področju zdravstva v različnih državah, a če želimo uresničiti enakopraven dostop do zdravstvenih storitev, moramo postaviti ustrezne podatkovne temelje, je še poudaril prof. dr. Kalra in izpostavil pomembnost podatkov – ti so izjemno koristni za boljšo kakovost oskrbe, pa tudi za to, da sploh ugotovimo, na katerih področjih so nujne izboljšave.
Sicer pa so bili na konferenci predstavljeni tudi primeri prebojnih terapij in tehnologij, ki bodo bistveno spremenile način obravnave bolnikov. Prof. dr. Roman Jerala je predstavil pomen in poslanstvo kemijskega inštituta pri širjenju znanja ter povezovanju z različnimi deležniki z namenom prenosa inovacij v prakso, med katerimi velja omeniti razvoj novih protivirusnih terapij. Prof. dr. Borut Štrukelj je predstavil prihodnost tehnologije RNA in možnosti razvoja novih zdravil z omenjeno tehnologijo.
Digitalizacija zdravstva in skupna, evropska baza zdravstvenih podatkov je tisto, za kar bi si morala Evropa kot celota prizadevati, so si bili enotni strokovnjaki iz področja zdravstva in farmacije. Če želimo imeti kakovosten in vzdržen zdravstveni sistem, je prava pot sistematična digitalizacija, saj celovitejša zdravstvena oskrba, tudi tista, ki se izvaja na daljavo, na dolgi rok prinaša prihranke in pripomore k večji odpornosti zdravstvenega sistema.
“,”Jaka Verbic Miklic”,1633855440,1633855440,sl,14857,306,14853,43,0,NULL,,”10 strateska konferenca forum”,10-strateska-konferenca-forum,Post,”/sites/43/files/images/10-konferenca-vrednost inovacij-500.JPG”,1,0,1634719553,1635098604
828,14857,”10th Value of Innovation strategic conference”,”Digital transformation for informed decision-making in healthcare”,”
Ljubljana, 7 October 2021 – The covid-19 epidemic has exposed the issue of non-systematic approaches to digitalization in healthcare systems around the world, and Slovenia is no exception. If we want a high quality, responsive and sustainable healthcare system, one of the key solutions is clear: systematic digitalization with unified logging quality processing of data. This was the topic of debate for eminent foreign and Slovenian experts at the Value of Innovation Strategic Conference, organized for the tenth year running by the Forum of international research and development pharmaceutical companies (Forum).
The fact that health technology is developing ever faster and is being increasingly influenced by artificial intelligence was emphasized by Michael Strübin, director of digital health with Medtech Europe. The devices we wear on our bodies today to monitor movement and detect falls, measure physical activity, heart activity and even forecast its failure are proof of this rapid development. Mr. Strübin noted that artificial intelligence and medical technologies could save 40 thousand lives per year, making up for 200 billion Euros or worth of savings each year which corresponds to 12 percent of all health expenditures in the EU. “Artificial intelligence saves us 1.8 billion hours per year. This equates to five hundred thousand additionally employed healthcare professionals. We are not talking about replacing medical technologies but rather making them available for interacting with patients in areas where a human is better than a machine,” added Strübin.
Of course there are certain obstacles, particularly legal, regulatory and financial, but with good organization any healthcare system can become more accessible and personalized, noted leading health data expert from the Finnish innovation foundation Sitra, dr. Minna Hendolin. In spite of its small size, Finland is at the top of the European countries in terms of digitalization of healthcare services. In 2014, Finland adopted a comprehensive healthcare strategy that has so far survived three different governments. The aim of the strategy was to transform Finland into an internationally recognized powerhouse in the field of research, innovation and development, as well as investments into the health sector. The strategy emphasized the importance of using data for secondary purposes of research, development, innovation and policy development, but the success story could not start without a profound renovation of legislation, which proved to be the difficult part. Dr. Hendolin described the national service KANTA that was established to become the backbone of the data and healthcare ecosystem: “It is a repository of patient data, social and health data, data on prescriptions and a type of data bank. Stored data is accessible to healthcare professionals that use the service to store health records and prescriptions, but citizens can access the data as well. KANTA also provides a service platform that is a very important part of Finland’s healthcare infrastructure,” emphasized Minna Hendolin.
The opinion that Slovenia is investing much too little in the digitalization of healthcare and building a common database was echoed by all Slovenian speakers at the conference. Bogdan Tušar, Director General of the Healthcare System Development Directorate at the Ministry of Health, reported that only a single percent of all funds earmarked for healthcare is allocated to digitalization. The percentage abroad is four times as high. But we are already carrying out measures and taking first steps towards more innovative healthcare. The Ministry has formed a new directorate to focus on development issues ranging from legislation, health protection, long term care and digitalization. Metka Zaletel, head of the Health Data Center at the National Institute of Public Health and Anka Bolka, head of the Directorate for Development and Analysis at the Health Insurance Institute of Slovenia, both reported that Slovenia is already collecting data and classifying it into useful databases.
One of the most challenging issues in Slovenian healthcare, as emphasized by Gregor Cuzak, co-creator and co-organizer of HealthDay.si, is also the fact that we invest into healthcare personnel for ten years or more, only to have professionals leave the country. Personnel issues could partly also be addressed by using artificial intelligence. The Conference saw a presentation of Frida – a commercial model of a humanoid robot. Dr. Izidor Mlakar from the Faculty of Electrotecnics, Computer Science and Informatics of the University of Maribor and University Medical Centre Maribor reported that the robot follows the vision of an open and comprehensive platform that could integrate various aspects of artificial intelligence into clinical care. Frida could be used to assist healthcare staff in various tasks, particularly in nursing care.
The healthcare sector in Europe has a turnover of 140 billion Euros and employs 760,000 people. Most of them, as many as 95 percent, work in small and mid-sized companies linked with the healthcare sector. Nathalie Moll, Director General of the European Federation of Pharmaceutical Industries and Associations (EFPIA) sees digitalization as the backbone of modern healthcare. She believes that digital health solutions and data will steer the development of life sciences and healthcare in the future.
“The epidemic has shown us how important it is to study diseases in a wider area, not only in individual countries. Countries must share their health data, establish a so-called federative architecture and begin analyzing mass data,” noted Dipak Kalra, President of the European Institute for Innovation through Health Data. It is health data that promotes innovation in healthcare. We must be aware of inequalities in the field of healthcare in different countries, but if we want to establish equitable access to health services, we must first establish appropriate data foundations, noted Dr. Kalra and emphasized the importance of data, that is essential for improving the quality of care and even finding out which areas require improvements.
The Conference also saw presentations of breakthrough therapies and technologies that will fundamentally change the way patients are treated. Prof. dr. Roman Jerala presented the importance and mission of the National Institute of Chemistry in the expansion of knowledge and linking with various stakeholders to transfer innovations into practice, including the development of new antiviral therapies. Prof. dr. Borut Štrukelj presented the future of RNA technology and the potential for developing new medicines using the technology.
Experts in the fields of healthcare and pharmacy agreed that digitalization of healthcare and a common European health database should be at the forefront of Europe’s efforts. If we want to have a high quality and sustainable healthcare system, a systematic digitalization is essential because a better integrated healthcare, remote or in person, brings long term savings and contributes decisively to greater resilience of healthcare systems.
“,,1633855560,1633855560,en,14857,306,14853,43,0,NULL,,”10 strateska konferenca forum”,10-strateska-konferenca-forum,Post,”/sites/43/files/images/10-konferenca-vrednost inovacij-500.JPG”,1,0,1634719553,1635098604
829,14859,”10th Value of Innovation strategic conference”,”Digital transformation for informed decision-making in healthcare”,”
Ljubljana, 7 October 2021 – The covid-19 epidemic has exposed the issue of non-systematic approaches to digitalization in healthcare systems around the world, and Slovenia is no exception. If we want a high quality, responsive and sustainable healthcare system, one of the key solutions is clear: systematic digitalization with unified logging quality processing of data. This was the topic of debate for eminent foreign and Slovenian experts at the Value of Innovation Strategic Conference, organized for the tenth year running by the Forum of international research and development pharmaceutical companies (Forum).
The fact that health technology is developing ever faster and is being increasingly influenced by artificial intelligence was emphasized by Michael Strübin, director of digital health with Medtech Europe. The devices we wear on our bodies today to monitor movement and detect falls, measure physical activity, heart activity and even forecast its failure are proof of this rapid development. Mr. Strübin noted that artificial intelligence and medical technologies could save 40 thousand lives per year, making up for 200 billion Euros or worth of savings each year which corresponds to 12 percent of all health expenditures in the EU. “Artificial intelligence saves us 1.8 billion hours per year. This equates to five hundred thousand additionally employed healthcare professionals. We are not talking about replacing medical technologies but rather making them available for interacting with patients in areas where a human is better than a machine,” added Strübin.
Of course there are certain obstacles, particularly legal, regulatory and financial, but with good organization any healthcare system can become more accessible and personalized, noted leading health data expert from the Finnish innovation foundation Sitra, dr. Minna Hendolin. In spite of its small size, Finland is at the top of the European countries in terms of digitalization of healthcare services. In 2014, Finland adopted a comprehensive healthcare strategy that has so far survived three different governments. The aim of the strategy was to transform Finland into an internationally recognized powerhouse in the field of research, innovation and development, as well as investments into the health sector. The strategy emphasized the importance of using data for secondary purposes of research, development, innovation and policy development, but the success story could not start without a profound renovation of legislation, which proved to be the difficult part. Dr. Hendolin described the national service KANTA that was established to become the backbone of the data and healthcare ecosystem: “It is a repository of patient data, social and health data, data on prescriptions and a type of data bank. Stored data is accessible to healthcare professionals that use the service to store health records and prescriptions, but citizens can access the data as well. KANTA also provides a service platform that is a very important part of Finland’s healthcare infrastructure,” emphasized Minna Hendolin.
The opinion that Slovenia is investing much too little in the digitalization of healthcare and building a common database was echoed by all Slovenian speakers at the conference. Bogdan Tušar, Director General of the Healthcare System Development Directorate at the Ministry of Health, reported that only a single percent of all funds earmarked for healthcare is allocated to digitalization. The percentage abroad is four times as high. But we are already carrying out measures and taking first steps towards more innovative healthcare. The Ministry has formed a new directorate to focus on development issues ranging from legislation, health protection, long term care and digitalization. Metka Zaletel, head of the Health Data Center at the National Institute of Public Health and Anka Bolka, head of the Directorate for Development and Analysis at the Health Insurance Institute of Slovenia, both reported that Slovenia is already collecting data and classifying it into useful databases.
One of the most challenging issues in Slovenian healthcare, as emphasized by Gregor Cuzak, co-creator and co-organizer of HealthDay.si, is also the fact that we invest into healthcare personnel for ten years or more, only to have professionals leave the country. Personnel issues could partly also be addressed by using artificial intelligence. The Conference saw a presentation of Frida – a commercial model of a humanoid robot. Dr. Izidor Mlakar from the Faculty of Electrotecnics, Computer Science and Informatics of the University of Maribor and University Medical Centre Maribor reported that the robot follows the vision of an open and comprehensive platform that could integrate various aspects of artificial intelligence into clinical care. Frida could be used to assist healthcare staff in various tasks, particularly in nursing care.
The healthcare sector in Europe has a turnover of 140 billion Euros and employs 760,000 people. Most of them, as many as 95 percent, work in small and mid-sized companies linked with the healthcare sector. Nathalie Moll, Director General of the European Federation of Pharmaceutical Industries and Associations (EFPIA) sees digitalization as the backbone of modern healthcare. She believes that digital health solutions and data will steer the development of life sciences and healthcare in the future.
“The epidemic has shown us how important it is to study diseases in a wider area, not only in individual countries. Countries must share their health data, establish a so-called federative architecture and begin analyzing mass data,” noted Dipak Kalra, President of the European Institute for Innovation through Health Data. It is health data that promotes innovation in healthcare. We must be aware of inequalities in the field of healthcare in different countries, but if we want to establish equitable access to health services, we must first establish appropriate data foundations, noted Dr. Kalra and emphasized the importance of data, that is essential for improving the quality of care and even finding out which areas require improvements.
The Conference also saw presentations of breakthrough therapies and technologies that will fundamentally change the way patients are treated. Prof. dr. Roman Jerala presented the importance and mission of the National Institute of Chemistry in the expansion of knowledge and linking with various stakeholders to transfer innovations into practice, including the development of new antiviral therapies. Prof. dr. Borut Štrukelj presented the future of RNA technology and the potential for developing new medicines using the technology.
Experts in the fields of healthcare and pharmacy agreed that digitalization of healthcare and a common European health database should be at the forefront of Europe’s efforts. If we want to have a high quality and sustainable healthcare system, a systematic digitalization is essential because a better integrated healthcare, remote or in person, brings long term savings and contributes decisively to greater resilience of healthcare systems.
“,”Jaka Verbic Miklic”,1633855860,1633855860,en,14859,306,14858,43,0,NULL,,”10 strateska konferenca forum”,10-strateska-konferenca-forum,Post,”/sites/43/files/images/10-konferenca-vrednost inovacij-500.JPG”,1,0,1634719927,1635099413
830,14859,”10. strateška konferenca”,”Če hočemo kakovosten, hitro odziven in vzdržen zdravstveni sistem, je ena izmed ključnih rešitev jasna: sistematična digitalizacija”,”
Ljubljana, 7. oktober 2021 – Epidemija covida-19 je po svetu, a tudi v Sloveniji, razgalila problem nesistematičnega pristopa pri digitalizaciji v zdravstvenem sistemu. Če hočemo kakovosten, hitro odziven in vzdržen zdravstveni sistem, je ena izmed ključnih rešitev jasna: sistematična digitalizacija s poenotenjem beleženja podatkov ter njihova kakovostna obdelava. O tem so ugledni tuji in domači strokovnjaki razpravljali na strateški konferenci Vrednost inovacij, ki jo je že deseto leto zapored organiziral Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb (Forum).
Da se zdravstvena tehnologija razvija nezadržno hitro in da nanjo vse bolj vpliva tudi umetna inteligenca, je poudaril Michael Strübin, direktor digitalnega zdravja pri Medtech Europe. Dokaz za to so naprave, ki jih nosimo na telesu za spremljanje gibanja in zaznavanje padcev, merjenje aktivnosti srca in napovedovanje njegove odpovedi ter naprave za merjenje fizičnih aktivnosti. Po njegovih besedah lahko umetna inteligenca in medicinske tehnologije ohranijo 40 tisoč življenj na leto, kar letno predstavlja 200 milijard evrov prihrankov oziroma 12 odstotkov vseh izdatkov za zdravstvo v EU. »Umetna inteligenca nam prihrani 1,8 milijard ur letno. To je enako kot 500 tisoč dodatno zaposlenih zdravstvenih delavcev. Zato tukaj ne govorimo o nadomeščanju medicinskih tehnologij ampak o tem, da so te na voljo za interakcije s pacienti kjer človek ostaja boljši od stroja,« je še dodal Strübin.
Ob tem pa so tudi ovire, predvsem pravne, regulativne in finančne. A z dobro organizacijo, lahko vsako zdravstvo postane bolj dostopno in personalizirano, je ocenila vodilna strokovna sodelavka za zdravstvene podatke v finski fundaciji za inovacije Sitra, dr. Minna Hendolin. Finska je kljub svoji majhnosti na področju digitalizacije zdravstvenih storitev na samem vrhu v Evropi. Leta 2014 so na finskem sprejeli široko strategijo zdravstvenega varstva, ki je preživela tri različne vlade. Cilj strategije je bil, da postane Finska mednarodno priznana v sektorju raziskav, inovacij in razvoja, pa tudi v naložbah v zdravstveni sektor. Poudarili so pomen uporabe podatkov v sekundarne namene za raziskave, razvoj, inovacije in oblikovanje politik. A za tako uspešno zgodbo so morali najprej urediti zakonodajo, kar je bil težji del. Dr. Hendolin je opisala nacionalno službo KANTA, ki so jo razvili z namenom, da postane hrbtenica za podatke in zdravstveni ekosistem: »To je repozitorij podatkov o pacientih, socialnih in zdravstvenih podatkov, podatkov o receptih in neke vrste podatkovna banka. Do podatkov lahko dostopajo zdravstveni delavci in tam hranijo zdravstvene kartoteke in recepte. Dostop imajo tudi državljani. Ob vsem tem je to tudi storitvena platforma, ki je pomemben del infrastrukture zdravstvenega varstva na finskem,« je poudarila Minna Hendolin.
Da v Sloveniji premalo vlagamo v digitalizacijo zdravstva in skupne baze podatkov, so si bili enotni vsi domači govorci na konferenci. Bogdan Tušar, generalni direktor Direktorata za razvoj zdravstvenega sistema na Ministrstvu za zdravje, je dejal, da gre le en odstotek vseh sredstev namenjenih za zdravstvo, za področje digitalizacije. V tujini je ta odstotek 4-krat višji. Na drugi strani pa že izvajamo tekoče ukrepe in prve korake proti bolj inovativnemu zdravstvu – na ministrstvu so denimo oblikovali nov direktorat, ki se bo ukvarjal z razvojnimi vsebinami: od področja zakonodaje, varstva v zdravstvu, dolgotrajne oskrbe in področja digitalizacije. Tudi Metka Zaletel, predstojnica Zdravstveno podatkovnega centra Nacionalnega inštituta za javno zdravje Slovenije, in Anka Bolka, vodja Direktorata za razvoj in analizo Zavoda za zdravstveno zavarovanje Slovenije, sta poudarili, da Slovenija že zbira podatke in jih ureja v koristne baze.
Eden izmed najbolj perečih problemov v slovenskem zdravstvu, kot ga je izpostavil tudi Gregor Cuzak, soustvarjalec in soorganizator HealthDay.si, je tudi to, da deset let ali več vlagamo v zdravstveni kader, ki potem odide v tujino. Kadrovske težave bi delno lahko rešili tudi z umetno inteligenco. Na konferenci je bil predstavljena Frida – komercialni model humanoidnega robota. Dr. Izidor Mlakar iz Fakultete za elektrotehniko, računalništvo in informatiko Univerze v Mariboru in UKC Maribor, je poudaril da z robotom sledijo viziji zasnove odprte in celovite platforme, kjer bi lahko različne aspekte umetne inteligence umestili v klinično oskrbo. Frida bi tako lahko med drugim pri opravilih pomagala zdravstvenemu osebju, predvsem medicinskim sestram.
Panoga zdravstva v Evropi je »težka« 140 milijard evrov, na stari celini pa zaposluje 760.000 ljudi. Večina njih, kar 95 odstotkov, dela v malih in srednje velikih podjetjih, povezanih z zdravstvenim sektorjem. Nathalie Moll, generalna direktorica Evropske zveze farmacevtskih industrij in združenj (EFPIA) tako vidi digitalizacijo kot hrbtenico sodobnega zdravljenja. Po njenem bodo digitalne zdravstvene rešitve in podatki, krojili razvoj znanosti o življenju in tudi zdravstvo.
»Epidemija nas je opozorila, kako pomembno je preučevati bolezni na širšem področju in ne le na ravni posamezne države. Države morajo povezati zdravstvene podatke, poskrbeti za tako imenovano federativno arhitekturo, in se lotiti analiz masovnih podatkov,« je poudaril prof. dr. Dipak Kalra, predsednik Evropskega inštituta za inovacije skozi zdravstvene podatke. Prav zdravstveni podatki so namreč tisti, ki spodbujajo inovacije v zdravstvu. Zavedati se moramo neenakosti na področju zdravstva v različnih državah, a če želimo uresničiti enakopraven dostop do zdravstvenih storitev, moramo postaviti ustrezne podatkovne temelje, je še poudaril prof. dr. Kalra in izpostavil pomembnost podatkov – ti so izjemno koristni za boljšo kakovost oskrbe, pa tudi za to, da sploh ugotovimo, na katerih področjih so nujne izboljšave.
Sicer pa so bili na konferenci predstavljeni tudi primeri prebojnih terapij in tehnologij, ki bodo bistveno spremenile način obravnave bolnikov. Prof. dr. Roman Jerala je predstavil pomen in poslanstvo kemijskega inštituta pri širjenju znanja ter povezovanju z različnimi deležniki z namenom prenosa inovacij v prakso, med katerimi velja omeniti razvoj novih protivirusnih terapij. Prof. dr. Borut Štrukelj je predstavil prihodnost tehnologije RNA in možnosti razvoja novih zdravil z omenjeno tehnologijo.
Digitalizacija zdravstva in skupna, evropska baza zdravstvenih podatkov je tisto, za kar bi si morala Evropa kot celota prizadevati, so si bili enotni strokovnjaki iz področja zdravstva in farmacije. Če želimo imeti kakovosten in vzdržen zdravstveni sistem, je prava pot sistematična digitalizacija, saj celovitejša zdravstvena oskrba, tudi tista, ki se izvaja na daljavo, na dolgi rok prinaša prihranke in pripomore k večji odpornosti zdravstvenega sistema.
“,,1633855980,1633855980,sl,14859,306,14858,43,0,NULL,,”10 strateska konferenca forum”,10-strateska-konferenca-forum,Post,”/sites/43/files/images/10-konferenca-vrednost inovacij-500.JPG”,1,0,1634719927,1635099413
831,14861,”Demenca, tiha epidemija sodobnega časa”,”Mesec september je že vse od leta 2011 svetovni mesec Alzheimerjeve bolezni, ki je v več kot šestdesetih odstotkih vzrok demence”,”
Mesec september je že vse od leta 2011 svetovni mesec Alzheimerjeve bolezni, ki je v več kot šestdesetih odstotkih vzrok demence, bolezni, ki velja za eno hujših bolezni sodobne družbe in v svetovnem merilu dosega razsežnosti pandemije. Na svetu živi več kot 47,5 milijonov ljudi z demenco, zaradi daljše pričakovane življenjske dobe je pričakovati, da bo število oseb z demenco še naraščalo.
Na spletnem pogovoru STAkluba o aktualni problematiki demence in Alzheimerjeve bolezni so sodelovali vodja Centra za kognitivne motnje na Nevrološki kliniki UKC Ljubljana doc. dr. Milica Gregorič Kramberger, vodja Enote za gerontopsihiatrijo na Univerzitetni psihiatrični kliniki Ljubljana dr. Polona Rus Prelog, predsednica Združenja Spominčica – Alzheimer Slovenija Štefanija L. Zlobec ter sekretarka v sektorju za preprečevanje bolezni in poškodb na direktoratu za javno zdravje na Ministrstvu za zdravje mag. Nadja Čobal.
Pomembnost zgodnje diagnoze
Letošnja tema meseca Alzheimerjeve bolezni je bila pravočasna diagnoza, saj prav pravočasno prepoznavanje znakov demence, diagnoza, ustrezno zdravljenje in način življenja pripomorejo k večji kakovosti življenja oseb z demenco in njihovih svojcev. »Alzheimerjeva bolezen je napredujoča bolezen možganov, rečemo ji tudi nevrodegenerativna bolezen, ki se v možganih začne že vrsto let, preden se pri bolniku znaki bolezni pokažejo,« uvodoma pojasni doc. dr. Milica Gregorič Kramberger. »Kaže se značilno z motnjami spomina in orientacije. Na začetku so težave blage narave, bolnik opaža, da mu iz glave uidejo podatki istega ali prejšnjega dne, kakšne obveznosti ne uspe urediti, pojavijo se težave z iskanjem besed in pri vožnji, posebno pri razvrščanju v prometu.« Obstajajo številni dejavniki tveganja, zato je pred postavitvijo diagnoze treba opraviti natančen pregled, pa tudi pogovor z nekom, ki bolnika pozna. »Pomemben je tudi pregled krvi in slikanje glave, da ugotovimo, da ne gre za kakšno drugo stanje, ki zahteva drugačno zdravljenje.«
Da je diagnoza ključna za nadaljnje zdravljenje, se strinja tudi dr. Polona Rus Prelog. »Veliko ljudi pride k nam, ko postanejo simptomi bolj boleči za okolico, ko se pridružijo vedenjske spremembe in ne toliko zaradi tistih manj bolečih sprememb, kot je denimo motnja spomina.« Še manj jih je njihovo pomoč prvič poiskalo v času epidemije, opozori doc. dr. Gregorič Krambergerjeva. »Opažamo, da veliko ljudi ni prišlo na pregled, čeprav bi lahko pod določeni pogoji tudi prišli. Odkar so vzpostavljene možnosti za preglede, pa imamo vtis, da ljudje prihajajo z bolj napredovalnimi težavami in da v času epidemije niso iskali pomoči. Na eni strani zaradi tega, da se ne bi okužili, na drugi pa zaradi občutka, ki ga daje stigma pri nas, da se za to bolezen ne išče pomoči v času pandemije. Mi želimo ljudem sporočiti, da je ta bolezen enakovredna drugim in da je prav, da poiščejo pomoč.«
Osebe z demenco težko razumejo ukrepe
Številne raziskave kažejo, da je pandemija novega koronavirusa povečala stiske ljudi, tako pri otrocih kot pri starejših. »Ko je bila proglašena prepoved obiskov v domovih, smo prejeli veliko klicev, saj so svojci težko sprejeli nove omejitve. Presenečeni so bili oboji, tako svojci kot starostniki v domovih, ki so bili vajeni obiskov. V združenju, ki deluje po celi Sloveniji, smo takoj odreagirali. Podaljšali smo delovanje naše svetovalne telefonske linije, tudi ob vikendih, vključili še specialiste, tudi dr. Rus in doc. dr. Kramberger, da so svojci lahko poklicali, dobili odgovore in podporo. Pripravili smo 12 različnih letakov z desetimi pravili za svojce, da bi lažje razumeli nastalo situacijo, jih pošiljali demenci prijaznim točkam, domovom, članom, medijem, na Rdeči križ…. Pandemijo so v isti ali še večji meri doživeli svojci in osebe z demenco doma, teh je več kot 80 odstotkov. Tisti, ki živijo sami in morda še nimajo znakov demence, niso niti razumeli ukrepov.« Tudi pri Združenju Spominčica – Alzheimer Slovenija so prešli na digitalne kanale in ponujali podporo preko spleta. »Prijetno smo bili presenečeni, da so se novi pristopi tako dobro prijeli. Presenetil jih je dober odziv na delavnice, Alzheimer cafeje, usposabljanja in izobraževanja… Na delavnicah in na izobraževanjih je bila udeležba večja kot v živo, ker so se tudi svojci prilagodili novonastali situaciji. Seveda pa nihče ne more nadoknaditi srečanja v živo.
Ob pogovoru o pandemiji in osebah z demenco vodja enote za geriatrično psihiatrijo Univerzitetne psihiatrične klinike v Ljubljani dr. Polona Rus Prelog pojasnjuje, da je pri bolnikih z demenco več povezav med potekom bolezni in dovzetnostjo za okužbo. »Bolniki težje sledijo navodilom in težko razumejo ukrepe. Starost je velik dejavnik za hud potek koronavirusne bolezni in tudi za smrtnost. Ugotovljeno je bilo, da je nad starostjo 59 let petkrat višja verjetnost za smrt po pojavu simptomov kot pri mlajši populaciji. Druga skrb je, da bolniki z demenco premalo skrbijo zase in tretja, da jih velik odstotek živi v domovih starejših občanov, kjer je širjenje virusa hitrejše.« Raziskave kažejo, da je večja smrtnost tudi pri bolnikih z apolipoproteinom E (krajše APOE), genom, ki je povezan z Alzheimerjevo boleznijo. Poleg tega nekatera zdravila za zdravljenje okužbe s covid-19 poslabšujejo stanje demence in ugotovili so kar nekaj interakcij med zdravili. Bolniki so pogosto tudi podhranjenih, dodaja dr. Rus Prelogova, kar je lahko povezano z dolžino hospitalizacije in potekom bolezni.
V stiski doma in v DSO
Osebe z demenco, ki so v času pandemije prebivali v DSO-jih, so imeli možnost pomoči negovalnega osebja in strokovnjakov, ki poznajo demenco. Vendar, kot spomni doc. dr. Gregorič Krambergerjeva, se v praktično vseh domovih soočajo s pomanjkanjem kadra, v času pandemije pa so bili še pod dodatnim stresom. Z več znanja o demenci bi bila obravnava v splošnem bolj kakovostna. »Če v DSO nimajo dovolj dodatnega znanja o demenci ali če imajo neustrezen odnos do demence, da na primer menijo, da za osebo z demenco, ki je v začetni fazi, ni treba, da je deležen enako intenzivne nege kot nekdo drug, potem je lahko človek z demenco v domu v še slabšem položaju.« Zlobčeva ob tem opozori, da je še vedno največ oseb z demenco doma in da so bili ti v času pandemije še bolj osamljeni, v še večjih stiskah, dostopnost do zdravnikov je bila skoraj onemogočena. »Zato smo v našo telefonsko linijo vključili še specialiste, tudi dr. Rus Prelog in doc. dr. Gregorič Kramberger, da so lahko svojci poklicali, dobili odgovore in podporo.« Tudi vse demenci prijazne točke so bile v lanskem letu mnogim v nenadomestljivo oporo, kamor so lahko prišli po informacije ali kakšno koli pomoč.
Sistemska rešitev za manj stigme
Tekom epidemije so se težave, ki so sicer obstajale že prej, tako na lokalni kot državni ravni, še dodatno okrepile. »Izkazalo se je, da so tako domovi kot psihiatrične in druge bolnišnice nekako bolj ranljive v situaciji epidemije, medtem ko so bili centri za duševno zdravje, ki se vzpostavljajo na podlagi Resolucije o nacionalnem programu o duševnem zdravju, dovolj aktivni in to je že eden od možnih odgovorov države,« na vprašanje o tem, kaj lahko spremenimo, odgovarja sekretarka v sektorju za preprečevanje bolezni in poškodb na direktoratu za javno zdravje na ministrstvu za zdravje mag. Nadja Čobal. Pomembno je reševanje na nacionalni ravni in zato se za področje demence na Ministrstvu za zdravje pripravlja nova strategija obvladovanja demence za obdobje do leta 2030, s katero bo ministrstvo nadaljevalo oziroma nadgradilo ukrepe prve Strategije obvladovanja demence v Sloveniji do leta 2020. Strategija posebno pozornost namenja ustvarjanju pogojev za demenci prijazna okolja, da bodo osebe z demenco lahko ostale v domačem okolju čim dlje in zato je potrebno organizirati ustrezno pomoč in podporo tudi za svojce oziroma skrbnike oseb z demenco. Klub velikim napredkom je stigma obolelih z demenco in Alzheimerjevo boleznijo v Sloveniji še danes močno prisotna. Predsodke je treba vedno znova naslavljati in upati, da bodo v nekaj letih izzveneli. »Ministrstvo za zdravje zato pripravlja javni razpis, s katerim bomo spodbudili projekte za ozaveščanje in izobraževanje ter nove modelne pristope k obravnavi dementnih,« pristavi Čobalova.
Stigma je po besedah Zlobčeve tudi razlog, da pridejo bolniki (pre)pozno do zdravnika: »Le vsak četrti z demenco ima diagnozo. Tri četrtine ali več jih je doma brez diagnoze.« Opozarja, da demenca ni le zdravstveni problem, temveč v veliki meri socialni problem. »Osebe z demenco živijo dolgo, v povprečju 10 do 15 let, včasih tudi dlje. Ob tem so svojci izpostavljeni velikim obremenitvam in izgorevanju. Prav zaradi tega je pomembna podpora in izobraževanje za svojce, da se lažje soočajo s predvidenimi in nepredvidenimi težavami pri tej bolezni. Glavna naloga Spominčice je podpora svojcem. Na nivoju države bi moralo biti to področje sistemsko urejeno.« Ob tem spomni, da smo ena redkih držav, ki še nima zakona o dolgotrajni oskrbi, ki bi bil v veliko pomoč in podporo zlasti osebam z demenco, ki živijo doma in teh je največ. »Pomembna je pravočasna diagnoza in po-diagnostična podpora svojcem, da dobijo čim več informacij takoj po diagnozi in da vedo kam po pomoč. Spominčica deluje po celi Sloveniji, zato se vedno lahko obrnejo na nas ali na našo spletno stran in Facebook. Poleg prepoznavanja prvih znakov je pomembno tudi, da vemo, da mora biti komunikacija z njimi prijazna, nekonfliktna, potrpežljiva in ljubeča. Dobro razumejo stisk roke in objem. Ker se oni zaradi bolezni ne morejo več približati nam, se moramo mi njim,« pravi Štefanija L. Zlobec. »Osebe z demenco čutijo do konca. Pomembno je, da se trudimo ohraniti njihovo dostojanstvo.« Na težave svojcev, ki skrbijo za osebo z demenco, spomni tudi doc. dr. Gregorič Krambergerjeva. »Pomembno je, da si svojci odpočijejo in da imajo nekoga, ki jim je lahko v pomoč. Po dolgih obdobjih te bolezni je nujno, da svojec razume, da ni narobe, če prosi za pomoč.« Podobnega mnenja je tudi dr. Rus Prelogova, ki se vsakodnevno srečuje s stiskami svojcev, ki so zaradi pandemije še večje. »Pri primarnih negovalcih so izjemno pogoste depresija, izgorelost in telesne težave. Pojavi se lahko tudi žalovanje, izgubljanje nekoga, ki se pred vašimi očmi psihično in fizično spreminja.« Demenca lahko postajane velik socialni problem, zato ni pomembno le, da osebe pridejo dovolj zgodaj do diagnoze, temveč tudi da se o bolezni dobro podučijo njihovi svojci in znajo poiskati pomoč. Za osebo z demenco je najboljše poiskati pomoč v lokalnem okolju, kjer poznajo tiste, ki mu lahko pomagajo. Tisti, ki lahko pomagajo, pa morajo boljše sodelovati, meni doc. dr. Gregorič Krambergerjeva. »Za vse to je potrebna podpora s strani države in družbe v celoti.«
“,”Jaka Verbic Miklic”,1635093660,1635093660,sl,14861,306,14860,43,0,NULL,,”Demenca, tiha epidemija sodobnega časa”,demenca-tiha-epidemija-sodobnega-casa,Post,/sites/43/files/images/news/ali-resnicno-poznamo-potrebe-ljudi-z-redkimi-boleznimi.jpg,1,0,1635093713,1635093946
832,14863,”Konferenca o celostni rehabilitaciji onkoloških bolnikov “,”Na prvi mednarodni konferenci o celostni rehabilitaciji onkoloških bolnikov so domači in tuji govorci poudarili pomen skupne politične rešitve znotraj prostora EU”,”
LJUBLJANA, oktober – V Sloveniji imamo zelo dobro onkološko oskrbo in če že zbolimo za rakom, je Slovenija dober prostor za to. Seveda pa obstajajo področja, ki jih moramo še izboljšati in eno od njih je celostna rehabilitacija bolnikov z rakom, je bilo eno ključnih sporočil, ki so jih javnosti želeli sporočiti udeleženci prve mednarodne konference o celostni rehabilitaciji onkoloških bolnikov “Življenje z rakom po raku”, ki je bila 20. oktobra na zoomu. Potekala je v soorganizaciji Foruma znanstvenoraziskovalnih farmacevtskih družb, Slovenskega združenja organizacij bolnikov z rakom ONKO NET, Zdravniške zbornice Slovenije ter Zavoda Simpozija.
Gre za prvo konferenco, ki smo jo pripravili v Sloveniji o eni najbolj aktualnih in obenem do sedaj zelo spregledanih tem v celostni obravnavi onkoloških bolnikov – življenju z rakom po raku. Zakaj? Časi, ko je bil eden in edini cilj zdravljenja raka samo čim bolj podaljšati preživetje, se iztekajo. Učinkoviti presejalni programi, vse boljša diagnostika, podprta z molekularno znanostjo, vedno večja izbira zdravljenja, ki postaja vse bolj prilagojeno bolniku, različne kampanje in aktivnosti ozaveščanja organizacij bolnikov so korenito spremenile statistiko preživetja bolnikov. Danes je posledično vse več rakov na zemljevidu dobro obvladljivih kroničnih bolezni. Vse to je odličen napredek, ki pa obenem odpira številna nova vprašanja, predvsem o čim bolj kakovostnem življenju po zaključenem zdravljenju.
“Pred 20 leti si nismo niti upali pomisliti, da bomo kdaj imeli konferenco o življenju po raku in rehabilitaciji ozdravljenih bolnikov. Današnja konferenca je tako dokaz o tem, kako velik napredek smo v onkologiji zabeležili v zadnjem desetletju. Naj ilustriram samo z enim primerom. Še pred samo desetimi leti je pet let po diagnozi doživelo le pet odstotkov bolnikov z malignim melanomom; danes je takih kar 50 odstotkov, torej desetkrat več! To je tudi rezultat razvoja številnih inovativnih zdravil, ki so skupaj z molekularnim testiranjem osnova vse bolj posameznemu bolniku prilagojenega zdravljenja. Gre za izjemen napredek, ki se odraža in je prepoznan tudi v vsebini evropskega programa obvladovanja raka; v njem je namreč velik poudarek prav na življenju po raku in rehabilitaciji bolnikov,” je v svojem nagovoru poudaril Alexander Roediger, vodja onkološke platforme pri Evropskem forumu farmacevtskih družb EFPIA.
V bodoče bo med nami živelo vedno več ljudi, ki bodo potrebovali celostno rehabilitacijo, nekateri tudi dolga leta. Celostna obravnava raka se ne zaključi z medicinskim zdravljenjem, saj bolniki potrebujejo tudi pomoč pri drugih vidikih življenja, ko je zdravljenje zaključeno. Različni vidiki celostne obravnave so pri nas že na voljo, vendar razdrobljeno in niso vključeni v klinično pot, zato bolniki zanje ne vedo, pa bi morali. Zato razveseljuje dejstvo, da smo v Sloveniji prepoznali pomen celostne rehabilitacije onkoloških bolnikov že ob uvedbi Državnega programa obvladovanja raka (DPOR). Ta letos zaključuje drugi krog, v pripravi pa je že tretji in kot je povedal nacionalni koordinator tega programa, prof. dr. Branko Zakotnik, dr. med., spec. internistične onkologije, je v novem DPOR velik poudarek prav na celostni rehabilitaciji bolnikov. Že četrto leto pa teče od uvedbe pilotnega projekta celostne rehabilitacije bolnic z rakom dojk OREH, ki na Onkološkem inštitutu teče pod okriljem Ministrstva za zdravje. Vodja programa, doc. dr. Lorna Zadravec Zaletel, dr. med., radioterapevtka z Onkološkega inštituta Ljubljana, je povedala, da so se zanj odločili, ker so ves čas opažali, koliko težav imajo bolnice po zdravljenju tako zaradi neželenih učinkov in poznih posledic zdravljenja kot tudi povsem vsakdanjih pri vračanju na delo, skrbi za družino, psiholoških stisk … Želja vseh, ki sodelujejo v tej multidisciplinarni skupini, je, da bi celostna rehabilitacija prišla v redno obravnavo ne le bolnic z rakom dojk, temveč vseh bolnikov, ki se zdravijo na Onkološkem inštitutu in tudi v drugih ustanovah v Sloveniji.
Kot je povedala Bettina Ryll, Misija za raka pri EU, predsednica Evropske zveze bolnikov z melanomom, je “potrebno vsem bolnikom zagotoviti najprej čim bolj njim prilagojeno zdravljenje, po njem pa jim omogočiti, da se čim prej vrnejo nazaj v kar se da kakovostno življenje. Da bo to možno, pa je treba razmišljati o celostni rehabilitaciji in jo tudi ustrezno načrtovati že od samega začetka, ko človek zboli in ne šele takrat, ko se je zdravljenje zaključilo.”
Eden glavnih razlogov za vse daljše preživetje in s tem tudi vedno večje število ozdravljenih ali dolgotrajno zazdravljenih bolnikov je skokovit razvoj inovativnih zdravil, ki v kombinaciji z molekularnim testiranjem omogočajo vedno bolj bolniku prilagojeno, personalizirano zdravljenje in obravnavo. O (ne)enakosti v dostopnosti do tovrstnega zdravljenja in obravnave je govoril Panos Kanavos z London School of Economics, ki se je zavzel za oblikovanje priporočil na nivoju EU, s katerimi bi uredili in pripravili skupno strategijo za personalizirano zdravljenje in njegovo dostopnost ter postavili skupne temeljnje cilje in usklajeno delovanje. Za to nujno potrebujemo tudi ustrezne podatke, dognanja, ki jih bomo z njimi dobili, pa vključiti v vse zdravstvene in ekonomske politike. Zavzel se je tudi za to, da bi tovrstno znanje vključili v učne načrte na vseh ravneh izobraževanja ter poudaril pomen ozaveščenosti in edukacije ne le strokovne, temveč tudi splošne javnosti, zlasti pa organizacij bolnikov.
Med najbolj perečimi temami, ki so jih govorci omenili na konferenci, so bile vračanje na delovno mesto in težave z zaposlovanjem, finančne stiske zlasti tistih, ki so delno ali popolno invalidsko upokojeni, težave pri najemanju posojil in različnih življenjskih zavarovanj, socialna vključenost oziroma izključenost, strah pred ponovitvijo bolezni, vprašanje potomstva, pozne posledice raka, rak pri mladih, zlasti ko gre za dedne oblike, zelo izpostavljeno pa je bilo tudi vprašanje tako imenovane pravice do pozabe. Najpreprostejša definicija slednje je, da imajo ljudje po prebolelem raku pravico pozabiti na svojo preteklost in jim ni več treba nikomur in nikjer navajati, da so nekoč preboleli raka. Po definiciji SZO je nekdo ozdravljen, ko je popolnoma okreval, nima več tveganja za ponovitev bolezni in je obnovil vse bistvene življenjske funkcije. “V EU so to pravico uzakonile štiri države (Benelux in Francija). Kaj to za ozdravljenega bolnika pomeni v praksi? Če želi skleniti življenjsko zavarovanje, ob najemu posojila ali daljšem potovanju, denimo, mora izpolniti vprašalnik in ob vprašanju, ali ste imeli raka, obkroži DA tudi po več letih ali celo desetletjih, zaradi česar ne more dobiti zavarovanja ali pa mora zanj plačati bistveno več. Za prebolevnike je to zelo težko, je pa tudi neenakopravno glede na ostale, zato je pravica do pozabe zelo pomebna,” je povedala Joke Verbaan iz nizozemske pozavarovalniške družbe De Hoop.
Problem raka je skupen celotnemu prostoru EU. Bolniki imajo zelo podobne težave pred diagnozo, med zdravljenjem in po njem, zato so potrebne skupne in usklajene politične poteze, s katerimi bi izboljšali trenutni položaj. To je še zlasti pomembno, ker projekcije zelo jasno kažejo, da bo število bolnikov samo še naraščalo. Omenjene problematike se zavedajo tudi v slovenskem parlamentu, v katerem že dve leti znotraj odbora za zdravstvo deluje pododbor za raka, ki ga je ustanovila poslanka Iva Dimic, tudi udeleženka konference. Napovedala je, da bo pododbor v kratkem imel sejo prav na temo celostne rehabilitacije onkoloških bolnikov s poudarkom na urejanju zakonske podlage za uveljavitev instituta pravice do pozabe.
Vsak od nas lahko zboli za rakom, zato bi to vprašanje kot družba morali postaviti za prioriteto in o njem educirati in ozavestiti vse plasti družbe. Ljudje med boleznijo in po prebolelem raku lahko povsem enakovredno doprinesejo družbi in vanjo želijo biti vključeni. Pri tem potrebujejo pomoč, a tudi spremembo nekaterih povsem zastarelih zakonov in miselnih vzorcev ter vpeljati nekatere nove.
“Rak je bil včasih binarna bolezen, kar pomeni, da so ga bolniki bodisi uspeli premagati, ker so jim ga odkrili dovolj zgodaj, ali pa se je končala s skorajšnjo smrtjo, predvsem pri tistih bolnikih, ki so jim raka odkrili pozno. Še pred zgolj nekaj leti je bilo tudi zelo veliko rakov, pri katerih so bili bolniki že ob diagnozi obsojeni na slab izid. Danes je položaj bolj pisan in imamo več kategorij bolnikov: ozdravljene, take, ki jim raka odkrijemo pozno, a jih znamo obvladati in spremeniti v kronično bolezen, o čemer se pred leti nismo niti spraševali, ker ni bilo nobene možnosti za kaj takega, in potem je tu še skrb za tiste, ki potrebujejo podporno zdravljenje in oskrbo, ki jim mora zagotoviti polno dostojanstvo. Prav je, da vemo, da ni vse samo v preživetju, čeprav je to sicer najpomembnejši cilj in smo nanj najbolj ponosni. Enako pomembno je, da poskrbimo, da bo vsem bolnikom dobro tudi naprej. Skrb za celostno rehabilitacijo je potrebno izpostaviti kot samostojen in prepleten del celovite obravnave raka od diagnoze dalje. Ni naloga klinikov, da rešujejo socialna vprašanja bolnikov, je pa naloga družbe, da omogoči enake možnosti za vse bolnike, da bodo ostali polnopravni člani te družbe in bodo izpolnjene vse potrebe, ki jih imajo. To se v sodobni družbi tudi edino spodobi,” je na konferenci sklenil doc. dr. Tit Albreht z NIJZ ter vodja Joint Action iPAAC ter obenem vsebinski vodja konference Življenje z rakom po raku.
“,”Jaka Verbic Miklic”,1635095340,1635095340,sl,14863,306,14862,43,0,NULL,,”Konferenca o celostni rehabilitaciji onkoloških bolnikov “,konferenca-o-celostni-rehabilitaciji-onkoloskih-bolnikov,Post,”/sites/43/files/images/Objave za medije/rehabilitaciji onkoloških bolnikov/Konferenca or Raku po raku_smernice-06.jpg”,1,0,1635095489,1635925645
833,14911,”Slovenski raziskovalci razvili novo celično zdravilo za raka prostate”,”Kot so zapisali, se s tem odpira možnost, da bi se nova tehnologija uporabila “tudi za zdravljenje drugih oblik solidnih tumorjev”.”,”
Ljubljana, 8. septembra – Raziskovalci ljubljanske medicinske fakultete, UKC Ljubljana, biomedicinskega centra Celica in Zavoda za transfuzijsko medicino so razvili napredno celično zdravilo za zdravljenje raka, so sporočili s fakultete. Kot so zapisali, se s tem odpira možnost, da bi se nova tehnologija uporabila “tudi za zdravljenje drugih oblik solidnih tumorjev”.
V sporočilu za javnost so na Medicinski fakulteti Univerze v Ljubljani zapisali, da so raziskovalci “razvili in klinično preskusili napredno avtologno celično zdravilo nove generacije za zdravljenje raka prostate”.
Po njihovih navedbah naj bi bilo preživetje bolnikov s karcinomom prostate, zdravljenih z avtolognimi imunohibridomi, pripravljenimi s fuzijo dendritičnih in tumorskih celic, povezano z zmanjšanjem populacije celic ubijalk v periferni krvi.
Rezultati so bili objavljeni v reviji Clinical and Translational Medicine in kažejo, da pri bolnikih niso zaznali resnih neželenih učinkov, kar je pri celičnih zdravilih lahko sicer težava.
Da bi zmanjšali neželene učinke, je raziskovalno-klinična skupina v Sloveniji razvila povsem avtologno celično cepivo tako, da je iz bolnikovih levkocitov pripravila dendritične celice, ki so specializirane za predstavljanje antigenov, in jih z elektrofuzijo združila z bolnikovimi lastnimi (avtolognimi) rakavimi celicami v imunohibridom (aHyC), ki ga je bolnik prejel intradermalno.
“Na tak, povsem personaliziran način, potem v telesu steče proces predstavljanja vseh, tudi neznanih antigenov rakave celice bolnikovemu imunskemu sistemu, saj ima rakava bolezen v vsakem bolniku individualen razvoj mutacij,” so zapisali.
Ob tem so poudarili, da zakonodaja na področju naprednih zdravil omogoča zdravljenje po bolnišnični izjemi za personalizirana zdravila, ki se pripravijo za vsakega bolnika posebej, saj je po pripravi imunohibridomov le nekaj ur časa za aplikacijo zdravila aHyC. “Zato mora biti laboratorij, ki pripravlja tako celično vakcino, blizu bolnišnice oziroma ambulante, kjer se aplicira.”
“,”Jaka Verbic Miklic”,1631081700,1631081700,sl,14911,306,14910,43,0,NULL,,”Slovenski raziskovalci razvili novo celično zdravilo za raka prostate”,slovenski-raziskovalci-razvili-novo-celicno-zdravilo-za-raka-prostate,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1636960624,1636960624
834,14913,”Društvo pljučnih in alergijskih bolnikov Slovenije začelo kampanjo Čik pavza”,”Digitalna kampanja bo potekala do 4. oktobra.”,”
Ljubljana, 9. septembra – Društvo pljučnih in alergijskih bolnikov Slovenije je v ponedeljek začelo digitalno kampanjo Čik pavza, v kateri ljudi ozaveščajo o pomenu zgodnjega odkrivanja pljučnega raka in o možnosti brezplačnega spletnega anonimnega posveta z zdravnikom. Digitalna kampanja bo potekala do 4. oktobra.
Kampanja je nadgradnja projekta Izkašljaj se, s katerim javnost seznanjajo z informacijami o raku pljuč, njegovih simptomih in pomenu zgodnjega odkrivanja, so sporočili iz Društva pljučnih in alergijskih bolnikov Slovenije.
Kot izpostavljajo, je pljučni rak eden od najpogostejših rakov v svetovnem merilu in je glavni vzrok smrti med bolniki z rakom. V Sloveniji je rak pljuč po pogostosti na četrtem mestu, še vedno pa je vodilni vzrok smrti med vsemi rakavimi obolenji pri obeh spolih. Čeprav je včasih veljal za neozdravljivega, danes odkritje v zgodnjih stadijih močno poveča verjetnost za ozdravitev.
Najpomembnejši dejavnik za nastanek pljučnega raka je še vedno kajenje, ki mu pripisujejo kar osem od deset primerov. Kadilci imajo celo 25-krat večje tveganje za nastanek bolezni kot nekadilci. Več kot polovica bolnikov ima ob prvem obisku zdravnika že razširjeno bolezen, kar pomeni, da je rak v že napredovani fazi, in veliko manj možnostmi za preživetje kot sicer.
Po oceni zdravnikov, ki se ukvarjajo z odkrivanjem in zdravljenjem pljučnega raka, je številka na novo odkritih bolnikov trenutno precej manjša kot v letih pred pandemijo covida-19. V društvu si zato prizadevajo spodbuditi bolj ogrožene skupine ljudi, kot so aktivni in bivši kadilci, da ob prvih simptomih ne odlašajo, saj se možnosti ozdravitve in uspešnega zdravljenja s tem le poslabšajo.
Z video prispevkom, v katerem nastopa slovenski gledališki igralec Bojan Emeršič, digitalnimi oglasi in z objavami na družbenih omrežjih Društvo pljučnih in alergijskih bolnikov Slovenije želi spodbuditi osebe, ki kadijo ali pa jih skrbi zdravje pljuč, da se preko spletne platforme prijavijo na brezplačni in anonimni posvet z zdravnikom.
“,”Jaka Verbic Miklic”,1631168280,1631168280,sl,14913,306,14912,43,0,NULL,,”Društvo pljučnih in alergijskih bolnikov Slovenije začelo kampanjo Čik pavza”,drustvo-pljucnih-in-alergijskih-bolnikov-slovenije-zacelo-kampanjo-cik-pavza,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1636960774,1636960774
835,14915,”Pri družinski hiperholesterolemiji opozorili na pomen zgodnejšega odkrivanja in zdravljenja”,”V Društvu za zdravje srca in ožilja Slovenije pred svetovnim dnevom družinske hiperholesterolemije, ki bo 24. septembra, opozarjajo, da ta dedna motnja presnove najpogosteje ogroža življenje.”,”
Ljubljana, 16. septembra – V Društvu za zdravje srca in ožilja Slovenije pred svetovnim dnevom družinske hiperholesterolemije, ki bo 24. septembra, opozarjajo, da ta dedna motnja presnove najpogosteje ogroža življenje. Zato je pomembno, da to bolezen, ki jo ima ena oseba na 250 prebivalcev, odkrijemo čim bolj zgodaj v življenju in primerno ukrepamo.
Na današnji spletni novinarski konferenci so govorili o družinski hiperholesterolemiji kot najpogostejši življenju ogrožajoči dedni motnji presnove, ki je tesno povezana s srčno-žilnimi zapleti. Nevarnost za te zaplete pa se lahko po besedah predsednika društva Matije Cevca, sicer zdravnika na kliničnem oddelku za žilne bolezni Univerzitetnega kliničnega centra (UKC) Ljubljana, zmanjša, če pri osebah znižajo holesterol, pri čemer velja, da dlje kot ima nekdo povišano raven holesterola, bolj je ogrožen.
Zato je nujno potrebno zgodnejše odkrivanje te bolezni in večja uporaba intenzivne terapije za zniževanje lipidov, vključno s kombiniranim zdravljenjem, da se dosežejo cilji najnovejših smernic, je dodal.
Da je edini učinkovit način primarne preventive zgodnja prepoznava bolezni in zdravljenje že v otroštvu, je izpostavil tudi Urh Grošelj s kliničnega oddelka za endokrinologijo, diabetes in presnovne bolezni na Pediatrični kliniki UKC Ljubljana. Poudaril je, da je Slovenija še vedno edina država na svetu, kjer v sklopu rednega sistematskega pregleda petletnikov že od leta 1995 poteka populacijsko presejanje otrok za hiperholesterolemijo.
V zadnjih letih odkrijejo vsaj 40 otrok s to motnjo, pri vsakem pa ima bolezen tudi eden od staršev in pa polovica sorojencev. Pri nezdravljeni motnji je napredovanje ateroskleroze pospešeno tako, da je ogroženost teh oseb več kot desetkrat višja, kot med zdravimi vrstniki, je dejal.
Če začnejo bolezen zdraviti dovolj zgodaj, lahko po njegovih besedah ne le omogočijo posameznikom preživetje, ampak tudi preprečijo zaplete, ki jih lahko bolezen povzroča, oziroma tveganje za zaplete pri teh osebah izenačijo s preostalo populacijo.
Omenil je, da je Svetovno združenje za srce letos ta presejalni program uvrstilo kot modelni program za populacijsko presejanje družinske hiperholesterolemije, kar je po njegovem mnenju veliko priznanje in dokaz, da so pri tem na pravi poti.
Grošelj je predstavil tudi najnovejše podatke študije, pred nekaj dnevi objavljene v eni najpomembnejših strokovnih revij The Lancet, kjer sta med soavtorji sodelovala oba sogovornika, in predstavlja prve rezultate iz svetovnega registra oseb z družinsko hiperholesterolemijo. “Ugotavljajo, da je globalno ta motnja slabo diagnosticirana in da tudi tisti, ki pridejo do diagnoze, potrebujejo več časa oz. ko pride do nekega zapleta. To je izgubljena priložnost, zato je jasno sporočilo študije, da obstaja velika potreba po sistematičnem in bolj zgodnejšem odkrivanju te motnje že v otroški dobi,” je povzel Grošelj.
“,”Jaka Verbic Miklic”,1631773320,1631773320,sl,14915,306,14914,43,0,NULL,,”Pri družinski hiperholesterolemiji opozorili na pomen zgodnejšega odkrivanja in zdravljenja”,pri-druzinski-hiperholesterolemiji-opozorili-na-pomen-zgodnejsega-odkrivanja-in-zdravljenja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1636961417,1636961436
836,14917,”WHO: Z višjimi trošarinami na alkohol bi v Evropi letno preprečili 5000 rakavih obolenj”,”S podvojitvijo trošarin na alkohol lahko letno preprečili okoli 5000 primerov smrti in skoraj 11.000 primerom rakavih obolenj”,”
Koebenhavn, 20. septembra – Rezultati nove študije Svetovne zdravstvene organizacije (WHO) so pokazali, da bi v Evropi s podvojitvijo trošarin na alkohol lahko letno preprečili okoli 5000 primerov smrti in skoraj 11.000 primerom rakavih obolenj, ki so povezana z alkoholom. Z alkoholom je namreč povezanih kar sedem različnih vrst rakavih obolenj, opozarjajo v WHO.
Študija z naslovom Modeliranje vpliva povečane obdavčitve alkohola na rak, ki ga povzroči alkohol v evropski regiji WHO, je bila objavljene v znanstveni reviji The Lancet Regional Health Europe.
Avtorji študije so ustvarili model za tri scenarije, v katerih so se sedanje trošarine na alkoholne pijače zvišale za 20 odstotkov, 50 odstotkov ali 100 odstotkov. Podatki o raku iz leta 2019 so bili zbrani v 50 državah v evropski regiji WHO. Ta regija sicer zajema skupaj 53 držav.
“Stopnja raka v regiji je najvišja na svetu, k temu pa prispeva visoka stopnja uživanja alkohola. Alkohol je povezan s sedmimi različnimi vrstami raka. Dobra novica je, da bi v Evropi lahko preprečili do 40 odstotkov rakavih obolenj in imamo v bližnji prihodnosti veliko možnosti za premagovanje raka kot življenjsko nevarne bolezni,” je dejala direktorica programa za nenalezljive bolezni pri WHO Evropa Carina Ferreira-Borges, ki je tudi ena izmed avtorjev nove študije.
Opozorila je, da bi podvojitev sedanjih trošarin na alkohol v Evropski regiji WHO preprečila približno šest odstotkov novih primerov raka in z njimi povezanih smrti. Leta 2020 je v regiji za rakom zbolelo skoraj 5 milijonov ljudi, je še dodala.
Rezultati študije kažejo, da bi podvojitev trošarin preprečila največ primerov bolezni in smrti zaradi rakavih obolenj v Veliki Britaniji, Rusiji in Nemčiji. Na Norveškem, v Armeniji in Islandiji pa bi se najbolj drastično zmanjšal relativni delež novih primerov raka in smrti zaradi alkohola.
Mednarodna agencija za raziskave raka alkohol uvršča med rakotvorne snovi prve kategorije. Vzročno je povezan z rakom ustne votline, žrela, požiralnika, debelega črevesa, jeter, grla in dojk. Ob podvojitvi sedanjih trošarin na alkohol so znanstveniki največji upad primerov ocenili pri ženskem raku dojk in raku črevesja.
“,”Jaka Verbic Miklic”,1632119640,1632119640,sl,14917,306,14916,43,0,NULL,,”WHO: Z višjimi trošarinami na alkohol bi v Evropi letno preprečili 5000 rakavih obolenj”,who-z-visjimi-trosarinami-na-alkohol-bi-v-evropi-letno-preprecili-5000-rakavih-obolenj,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1636961741,1636961741
837,14919,”Za zdravje srca in ožilja lahko veliko naredimo z zdravim življenjskim slogom”,”V času epidemije je obravnava srčno-žilnih bolnikov strmo padla, med glavnimi dejavniki obolenja pa sta holesterol in debelost, so opozorili na novinarski konferenci.”,”
Ljubljana, 23. septembra – Ob svetovnem dnevu srca, ki bo prihodnjo sredo, v Društvu za zdravje srca in ožilja opozarjajo, da za težave srca in ožilja lahko veliko naredimo z zdravo prehrano in rekreacijo. V času epidemije je obravnava srčno-žilnih bolnikov strmo padla, med glavnimi dejavniki obolenja pa sta holesterol in debelost, so opozorili na novinarski konferenci.
Možne zdravstvene težave, povezane z boleznimi srca in ožilja, še posebej v času covida-19, so možganska kap, srčni infarkt, srčno popuščanje, angina pektoris, arterijska hipertenzija in sladkorna bolezen.
Po besedah predsednika Društva za zdravje srca in ožilja Matije Cevca so vzrok za srčno-žilne bolezni dejavniki tveganja, kot je holesterol. Ob tem opaža, da je pojavnost holesterola višja med manj izobraženimi ljudmi, kar pripisuje slabši informiranosti.
Velika težava za nastanek srčno-žilnih bolezni je tudi debelost. Po besedah Cevca se ta v zadnjih letih ne zmanjšuje, temveč povečuje. K temu je dodatno pripomogla tudi epidemija, saj smo več časa preživeli doma.
Število smrti zaradi bolezni srca in ožilja se je po podatkih Cevca v zadnjih letih zmanjšalo za skoraj 50 odstotkov. “Če smo že zmanjšali umrljivost, žal zbolevnosti nismo,” je povedal.
Nada Rotovnik Kozjek z Onkološkega inštituta Ljubljana je poudarila, da za zdravje veliko lahko naredimo sami z zdravo prehrano in rekreacijo. Ob tem je poudarila, da določene diete na naše telo lahko delujejo negativno, saj da se “lahko nekoliko razlikujejo od splošnih priporočil za zdravo prehrano, zato je za zdravstvene učinke telesne dejavnosti potrebno razumeti tudi izhodišča športne prehrane”.
Med epidemijo so na oddelku internistične prve pomoči Univerzitetnega kliničnega centra (UKC) Ljubljana zaznali upad prihoda bolnikov s srčnimi boleznimi. Trend pa ni bil značilen samo za Slovenijo, zaznali so ga tudi drugod po Evropi.
“To stanje je na srečo trajalo samo tri do štiri tedne. Potem se je normaliziralo in smo v naslednjih mesecih imeli veliko več dela, kajti prihajali so ljudje, ki niso mogli do svojih zdravnikov,” je povedal vodja internistične prve pomoči na UKC Ljubljana Hugon Možina.
Izpostavil je, da morajo bolniki ob nastalem težkem dihanju ali bolečini v prsnem košu poklicati pomoč, ne da bi čakali, da se stanje izboljša samo od sebe.
Letošnji svetovni dan srca bo potekal pod geslom Povezujmo se s srcem. Na spletni strani Društva za zdravje srca in ožilja Slovenije so zapisali, da to “bolj kot kadarkoli združuje, vodi in navdušuje za spremembe v načinu življenja, ki pomenijo učinkovito preventivo pred srčno-žilnimi boleznimi”. Poudarili so, da je zavedanje “prvi korak na poti do zdravja” in ohranjanja zdravja ter dodali, da je ključno iskanje pravih informacij.
Za člane društva bodo v petek ob 30. obletnici društva organizirali ogled Arboretuma Volčji potok, v soboto pa bodo ob svetovnem dnevu organizirali osrednjo prireditev na Prešernovem trgu v Ljubljani.
“,”Jaka Verbic Miklic”,1632379020,1632379020,sl,14919,306,14918,43,0,NULL,,”Za zdravje srca in ožilja lahko veliko naredimo z zdravim življenjskim slogom”,za-zdravje-srca-in-ozilja-lahko-veliko-naredimo-z-zdravim-zivljenjskim-slogom,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1636961929,1637501935
838,14921,”Začenja se mednarodni športni dogodek Race for the cure za osveščanje o raku dojk”,”Slovensko združenje za boj proti raku dojk Europa Donna Slovenija se pridružuje mednarodnemu dogodku Race for the cure”,”
Ljubljana, 26. septembra – Slovensko združenje za boj proti raku dojk Europa Donna Slovenija se pridružuje mednarodnemu dogodku Race for the cure pri hoji na tri in teku na pet kilometrov, ki se začenja danes. S tem ozdravljenke raka dojk praznujejo svojo zmago, ostali udeleženci pa podpirajo svoje najbližje. Dogodek bo do 10. oktobra tako kot lani potekal preko spleta.
Vabijo tako posameznike kot skupine in organizacije, da se jim pridružijo pri teku in hoji. “Lahko hodite ali tečete po vaši soseski, po vasi ali mestu. Lahko greste, kamor vas odnesejo noge, dokler spoštujete ukrepe za preprečevanje širjenja koronavirusa, ki so v veljavi,” so zapisali v sporočilu na spletišču Europa Donne.
Race for the cure sicer v organizaciji opisujejo kot največji evropski športni dogodek za osveščanje o zdravju žensk. Z njim pomagajo organizacijam in ustanovam pri zbiranju sredstev za osveščanje o raku dojk.
“Vsako leto je v Evropi na novo diagnosticiranih 500.000 primerov raka dojk in zaradi te diagnoze 130.000 ljudi umre, zato so ta sredstva ključnega pomena. Danes še bolj kot kadarkoli prej,” so dodali.
Organizacija se je mednarodnemu dogodku prvič pridružila lani, ko se ga je udeležilo 40.935 udeležencev, 4416 ekip in 5188 podpornikov ekip, ob čemer so v 32 državah zbrali 532.012 evrov. V Sloveniji se je dogodku v preteklem letu pridružilo 344 udeležencev, zbrali so 4770 evrov.
Europa Donna Slovenija je sicer neprofitna organizacija, ki združuje 3000 članov. Povezuje tako zdrave ženske kot bolnice z rakom dojk, pa tudi strokovne institucije, ki delujejo na področju raka dojk in rakov rodil.
“,”Jaka Verbic Miklic”,1632660540,1632660540,sl,14921,306,14920,43,0,NULL,,”Začenja se mednarodni športni dogodek Race for the cure za osveščanje o raku dojk”,zacenja-se-mednarodni-sportni-dogodek-race-for-the-cure-za-osvescanje-o-raku-dojk,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637502603,1637503085
839,14923,”Europa Donna Slovenija poziva ženske k skrbi za zdravje tudi med epidemijo”,”Združenje Europa Donna Slovenija ob začetku rožnatega oktobra, mednarodnega meseca ozaveščanja o raku dojk, poziva ženske k skrbi za zdravje.”,”
Ljubljana, 30. septembra – Združenje Europa Donna Slovenija ob začetku rožnatega oktobra, mednarodnega meseca ozaveščanja o raku dojk, poziva ženske k skrbi za zdravje. V času epidemije covida-19 ne smemo pristati na slabši dostop do zdravstva in pravočasne diagnostike, vabilom presejalnih programov pa se moramo odzivati, so poudarili.
V ospredje rožnatega oktobra so postavili pomen odgovornosti za svoje zdravje, ki je v času epidemije še toliko bolj pomembno. Po podatkih Registra raka je bilo v prvem valu diagnosticiranih tretjino manj onkoloških obolenj, medtem ko sta drugi in tretji val epidemije nekoliko manj vplivala na število novo odkritih primerov raka, je na današnji novinarski konferenci združenja poudarila vodja registra in klicnega centra programa Dora na Onkološkem inštitutu Ljubljana Katja Jarm.
Manjše število postavljenih diagnoz je po njenih navedbah zaskrbljujoče. To namreč pomeni, da bodo raki odkriti v kasnejših stadijih, s slabšo prognozo, bolj zahtevnim zdravljenjem in z več poznimi posledicami zdravljenja.
Vsi trije presejalni programi na področju raka so bili spomladi lani prekinjeni, a so vsaj pri Dori zamudo nadoknadili, je dejala.
Ženskam svetuje, da se odpovejo nezdravim razvadam, kot sta alkohol in kajenje. Zelo pomembno je tudi samopregledovanje dojk, ki pa ne more nadomestiti udeležbe na presejalnem programu. “Nimamo samo epidemije covida-19, ampak tudi epidemijo raka,” je opomnila.
Ženske so se vsaj v začetku epidemije bale vstopiti v zdravstvene ustanove, da se ne bi okužile z novim koronavirusom, je povedala predsednica združenja Tanja Španić. Sama sicer ohranja optimizem. V Sloveniji namreč pri onkoloških programih med epidemijo ni nastala taka zamuda kot v nekaterih drugih evropskih državah, tudi v naši okolici.
Letošnji dogodki in aktivnosti v rožnatem oktobru bodo potekali pod sloganom Bodi in ostani zdrava!. Z njimi želijo po besedah Španićeve poudariti, da lahko sami veliko naredimo za svoje zdravje s preprostimi odločitvami za zdrav življenjski slog. Z dogodki skušajo pokriti celotno državo. Z njimi želijo priti ženskam čim bolj naproti in jih doseči povsod.
Pridružili so se tudi evropskemu dogodku Race for the cure za ozaveščanje o raku dojk. Dogodek od 26. septembra do 10. oktobra poteka virtualno.
Rak dojk je najpogostejši rak pri ženskah v razvitem svetu. V Sloveniji je po podatkih onkološkega inštituta med letoma 2014 in 2018 povprečno letno za rakom dojk zbolelo 1396 žensk, umrlo pa jih je 420.
Za rakom dojk je v letu 2018 zbolelo 1527 oseb, od tega 1516 žensk in 11 moških, umrlo pa je 473 žensk in pet moških. Ob koncu leta 2018 je med nami živelo 18.571 bolnic, ki jim je bila kdaj v življenju postavljena diagnoza raka dojk. Najpogosteje za rakom dojk zbolevajo ženske od 50. do 65. leta.
Rak dojk sicer spada med bolezni z dobrim preživetjem. Petletno čisto preživetje bolnic v Sloveniji, ki so zbolele med letoma 2013 in 2017, je bilo 88-odstotno.
“,”Jaka Verbic Miklic”,1633006320,1633006320,sl,14923,306,14922,43,0,NULL,,”Europa Donna Slovenija poziva ženske k skrbi za zdravje tudi med epidemijo”,europa-donna-slovenija-poziva-zenske-k-skrbi-za-zdravje-tudi-med-epidemijo,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637502808,1637503484
840,14925,”Na ljubljanski pediatrični kliniki odprli center za otroško psihiatrijo”,”Z odprtjem centra otrokom in mladostnikom zagotavljamo prijetnejšo zdravstveno obravnavo, so sporočili z ministrstva za zdravje.”,”
Ljubljana, 1. oktobra – Na pediatrični kliniki Univerzitetnega kliničnega centra (UKC) Ljubljana so v četrtek odprli center za otroško psihiatrijo. Z odprtjem centra otrokom in mladostnikom zagotavljamo prijetnejšo zdravstveno obravnavo, so sporočili z ministrstva za zdravje.
Center lahko v trenutnem obsegu sprejme od šest do osem otrok, kar v veliki meri razbremenjuje oddelek službe za otroško psihiatrijo pediatrične klinike, ki zagotavlja prostor otrokom v primerih nujnih hospitalizacij, so pojasnili na ministrstvu.
Iz ministrstva so sporočili, da sta bila službi za otroško psihiatrijo dodeljena dva dodatna tima, zato je lahko pediatrična klinika poskrbela za temelje dnevnega centra. Zdravstveno osebje v mirnem okolju prenovljenih prostorov že sprejema prve otroke, so navedli.
V službi za otroško psihiatrijo pediatrične klinike se po pojasnilih ministrstva še posebno v času epidemije in po njej soočajo s porastom otrok in mladostnikov, ki potrebujejo psihiatrično zdravstveno obravnavo in oskrbo. “Ministrstvo se problematike težav v duševnem zdravju otrok in mladostnikov zaveda, zato s potrebnimi ukrepi sledi in podpira reševanje akutne problematike,” poudarja ministrstvo.
Ministrstvo je zagotovilo sredstva za vzpostavitev novih centrov za duševno zdravje otrok in mladostnikov. Ob zavedanju pomanjkanja ustreznega strokovnega kadra so v zakonu o nujnih ukrepih na področju zdravstva zagotovili plačilo specializacije 30 kliničnim psihologom. V nadaljevanju pa iščejo tudi sistemsko rešitev za to specializacijo.
“,”Jaka Verbic Miklic”,1633092960,1633092960,sl,14925,306,14924,43,0,NULL,,”Na ljubljanski pediatrični kliniki odprli center za otroško psihiatrijo”,na-ljubljanski-pediatricni-kliniki-odprli-center-za-otrosko-psihiatrijo,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637503028,1637503454
841,14927,”Letošnja Nobelova nagrada za medicino za odkritje receptorjev za temperaturo in dotik”,”65-letni David Julius z Univerze Kalifornija v San Franciscu je uporabil kapsaicin, aktivno sestavino čilijev, ki povzroča pekoč občutek, za identifikacijo senzorja v živčnih končičih kože, ki se odziva na toploto.”,”
Stockholm, 4. oktobra – Letošnja Nobelova nagrada za fiziologijo ali medicino gre v roke ameriškemu fiziologu Davidu Juliusu in armensko-ameriškemu molekularnemu biologu, rojenemu v Libanonu, Ardemu Patapoutianu za odkritje receptorjev za temperaturo in dotik, je danes sporočil švedski inštitut Karolinska.
Kot je ob razglasitvi nagrajencev utemeljila žirija za Nobelove nagrade, gre za “prelomno odkritje “. Letošnja dobitnika Nobelove nagrade sta omogočila razumeti, kako lahko toplota, mraz in mehanska sila sprožijo živčne impulze, ki omogočajo zaznavanje in prilagajanje svetu, so med drugim utemeljili.
Dodali so, da sta raziskovalca s celicami, občutljivimi na pritisk, odkrila nov razred senzorjev, ki se odzivajo na mehanske dražljaje v koži in notranjih organih.
65-letni David Julius z Univerze Kalifornija v San Franciscu je uporabil kapsaicin, aktivno sestavino čilijev, ki povzroča pekoč občutek, za identifikacijo senzorja v živčnih končičih kože, ki se odziva na toploto.
Ardem Patapoutian je s pomočjo celic, občutljivih na pritisk, odkril nov razred senzorjev, ki se odzivajo na mehanske dražljaje v koži in notranjih organih.
Patapoutiab se je rodil v Bejrutu leta 1967 in kot najstnik prišel v Los Angeles. Trenutno raziskuje v raziskovalnem medicinskem inštitutu Scripps Research v kalifornijski La Jolli.
Najpomembnejšo nagrado s področja medicine spremlja denarna nagrada v vrednosti deset milijonov švedskih kron (okoli 980.000 evrov), ki si jo bosta tokrat razdelila dva nagrajenca.
Lani so Nobelovo nagrado za medicino prejeli trije virologi, Američana Harvey J. Alter in Charles M. Rice ter Michael Houghton iz Velike Britanije za odkritje virusa hepatitisa C.
Od leta 1901 je po poročanju nemške tiskovne agencije dpa Nobelovo nagrado za medicino prejelo 222 posameznikov, od tega 12 žensk. Prvo Nobelovo nagrado za medicino je prejel nemški bakteriolog Emil Adolf von Behring za odkritje terapije proti davici.
Z objavo letošnjega dobitnika Nobelove nagrade za medicino se je začel teden objave letošnjih Nobelovih nagrajencev. V torek sledi objava letošnjega Nobelovega nagrajenca za fiziko, v dnevih kasneje sledijo kemija, književnost in mir. V ponedeljek sledi še razglasitev Nobelove nagrade za ekonomijo.
Nobelove nagrade bodo tradicionalno podelili 10. decembra, na obletnico smrti ustanovitelja denarnega sklada Alfreda Nobela. Nagrajenci znanstvenih kategorij ter književnosti bodo predvidoma zaradi pandemije covida-19 nagrade tudo letos prejeli v svojih domovinah, namesto v švedski prestolnici Stockholm. Nobelovo nagrado za mir običajno podelijo v norveški prestolnici Oslo.
“,”Jaka Verbic Miklic”,1633352400,1633352400,sl,14927,306,14926,43,0,NULL,,”Letošnja Nobelova nagrada za medicino za odkritje receptorjev za temperaturo in dotik”,letosnja-nobelova-nagrada-za-medicino-za-odkritje-receptorjev-za-temperaturo-in-dotik,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637503326,1637503411
842,14929,”Cepljenje proti gripi tudi letos brezplačno za vse prebivalce”,”Cepljenje proti gripi bo tudi v letošnji sezoni brezplačno za vse prebivalce”,”
Ljubljana, 6. oktobra – Cepljenje proti gripi bo tudi v letošnji sezoni brezplačno za vse prebivalce, so za STA pojasnili na ministrstvu za zdravje. Nacionalni inštitut za javno zdravje (NIJZ) je sicer za letošnjo sezono naročil 360.000 odmerkov cepiva proti gripi.
Cepljenje proti gripi se ponavadi začne v drugi polovici oktobra. NIJZ je letos naročil večjo količino cepiva proti gripi kot lani, ko so naročili 270.000 odmerkov, dodatno so jih prejeli še 20.000, a je cepivo zaradi velikega zanimanja za cepljenje v nekaj tednih pošlo.
Lani so zdravstvene oblasti pozivale k obsežnejšemu cepljenju proti gripi, saj so želeli preprečiti, da bi ob hkratnih zapletih zaradi gripe, zaradi katere vsako zimo v bolnišnicah zdravijo veliko ljudi, in ponovnem naraščanju števila obolenj za covidom-19 zaradi prezasedenosti odpovedal zdravstveni sistem.
Tako so sprva odločili, da bo obvezno zdravstveno zavarovanje krilo cepljenje proti gripi (tako kot leto pred tem) za kronične bolnike, starejše od 65 let, nosečnice in oseb z izrazito povečano telesno težo, pa tudi za otroke, stare od pol leta do 23 mesecev.
Nato pa so v peti protikoronski zakon vnesli določbo, da je cepljenje proti gripi v sezoni 2020/2021 brezplačno za vse zavarovane osebe. Na ministrstvu za zdravje so za STA navedli, da jim podlago za brezplačno cepljenje vsem prebivalcem daje prav omenjena zakonodaja, saj ukrep, ki se nanaša na cepljenje proti gripi, velja do konca letošnjega leta.
Lanskoletna sezona gripe je bila sicer bistveno drugačna kot sicer. Na koncu niso potrdili niti enega primera gripe v Sloveniji, tudi v ostalih državah je bilo gripe izjemno malo. Vzrok za to je v tem, da so bile vzgojno-varstvene in šolske institucije zaprte precej časa, ljudje so se zaradi epidemije covida-19 manj družili in upoštevali tudi ostale ukrepe, ki zmanjšujejo pojavnost novega koronavirusa in hkrati delujejo tudi v smeri zmanjševanja prenosa respiratornih virusov, vključno z gripo.
Letošnja sezona virusnih okužb utegne biti drugačna, predvsem med otroki že nekaj časa, bistveno prej kot ponavadi, krožijo respiratorne virusne okužbe. V nekaterih bolnišnicah so otroški oddelki polni, prevladujejo zlasti okužbe z respiratornim sincicijskim virusom (RSV). Ponekod v Evropi pa se že pojavlja gripa.
“,”Jaka Verbic Miklic”,1633525560,1633525560,sl,14929,306,14928,43,0,NULL,,”Cepljenje proti gripi tudi letos brezplačno za vse prebivalce”,cepljenje-proti-gripi-tudi-letos-brezplacno-za-vse-prebivalce,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637503630,1637503631
843,14931,”WHO odobrila prvo cepivo proti malariji”,”Svetovna zdravstvena organizacija (WHO) odobrila prvo cepivo proti malariji”,”
Ženeva, 7. oktobra – Boj proti malariji je dobil v sredo pomembno spodbudo, saj je Svetovna zdravstvena organizacija (WHO) odobrila prvo cepivo proti tej bolezni in ga priporočila za široko uporabo, poročajo tuje tiskovne agencije.
Cepivo – znano kot RTS,S/AS01, ki ga je že leta 1987 prvič razvilo britansko farmacevtsko podjetje GlaxoSmithKline – bo zdaj priporočeno za množično uporabo pri otrocih, ki živijo južno od Sahare, ter v vseh drugih regijah, kjer je malarija razširjena. Do drugega leta starosti naj bi otroci prejeli štiri odmerke cepiva.
“To je zgodovinski trenutek. Dolgo pričakovano cepivo proti malariji za otroke predstavlja preboj za znanost, zdravje otrok in nadzor nad malarijo,” je ocenil prvi mož WHO Tedros Adhanom Ghebreyesus. Kot je še izpostavil, bi lahko cepivo skupaj s preventivnim sistemom, ki se že izvaja, rešil na desettisoče življenj letno.
Priporočilo WHO sicer sledi izvedbi pilotnega projekta, ki je od leta 2019 zajel okoli 800.000 otrok v Gani, Keniji in Malaviju. Stopnja smrtnosti zaradi malarije se je med tistimi, ki so jih cepili, zmanjšala za 30 odstotkov, poudarjajo v WHO. Tedros je zatrdil, da je cepivo varno.
Novih okužb z malarijo je približno 200 milijonov letno, večinoma v Afriki. Nekateri ljudje se okužijo večkrat v enem letu. Bolezen terja okoli 400.000 življenj vsako leto, večinoma otrok, starih pet let ali manj. 94 odstotkov smrti zaradi malarije zabeležijo v Afriki, več kot polovico v šestih podsaharskih državah in skoraj četrtino samo v Nigeriji.
Malarijo povzročajo paraziti plazmodiji, ki jih s pikom na človeka prenašajo okuženi komarji. Med simptomi so visoka vročina, mrzlica in potenje, pa tudi bolečine v mišicah in sklepih, glavobol in prebavne težave, težave z dihanjem in kašelj.
Omenjeno cepivo deluje proti najnevarnejšemu povzročitelju, parazitu Plasmodium falciparum, ki je najbolj razširjen in odgovoren za večino smrtnih primerov okužb.
“,”Jaka Verbic Miklic”,1633612020,1633612020,sl,14931,306,14930,43,0,NULL,,”WHO odobrila prvo cepivo proti malariji”,who-odobrila-prvo-cepivo-proti-malariji,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637503728,1637503728
844,14933,”Ob svetovnem dnevu boja proti bolečini poudarjajo pomen obvladovanja bolečine”,”V povprečju vsak posameznik vsako leto občuti deset vrst bolečine”,”
Ljubljana, 11. oktobra – Svetovni dan boja proti bolečini, ki ga obeležujemo danes, želi ozaveščati ljudi o pomenu obvladovanja bolečine. V povprečju vsak posameznik vsako leto občuti deset vrst bolečine. Najpogostejša je bolečina v križu, ki jo doživlja dobra polovica ljudi, vsaj enkrat v življenju pa skoraj vsak. Leto 2021 je tudi svetovno leto bolečine v križu.
Po ocenah za leto 2017 je to bolečino imelo 7,5 odstotka svetovne populacije, kar predstavlja 577 milijonov ljudi, izpostavlja predsednica Slovenskega združenja za zdravljenje bolečine Barbara Kosmina Štefančič.
V Sloveniji ima glede na raziskavo iz leta 2019 po njenih besedah kronično bolečino 22 odstotkov odraslih, daleč najpogostejša kronična bolečina pa je ravno bolečina v križu in hrbtenici, ki se pojavlja pri 63 odstotkih bolnikov s kronično bolečino. Bolečina v križu je tudi eden od glavnih razlogov za bolniški stalež, ki je pogosto dolgotrajen in tudi eden od glavnih razlogov za prezgodnjo invalidsko upokojitev.
Čeprav je bolečina v križu zelo pogosta, zdravniki velikokrat ne najdejo natančnega vzroka zanjo, zaradi česar jo kar v 85 do 95 odstotkih označijo kot nespecifično. Takrat je osnovni cilj lajšanje in zdravljenje simptomov, navajajo v združenju.
Bolečina v križu večinoma ne pomeni nevarnosti za zdravje. Pri 90 odstotkih ljudi mine v dveh do treh tednih. Pomembno pa je, da akutno stanje ustrezno lajšamo, saj s tem zmanjšamo možnost za vnovično bolečino in za razvoj kronične bolečine v križu, poudarja Gorazd Požlep iz Univerzitetnega kliničnega centra v Ljubljani. Ker se ob akutni bolečini v križu pogosto pojavi tudi vnetje, takšna bolečinska stanja bolj uspešno lajšajo z nesteroidnimi protivnetnimi zdravili in ne z zdravili, kot je paracetamol, ki nima protivnetnega učinka. Pomagajo tudi topli ali mrzli obkladki ter počitek, ki pa naj ne traja več kot dan ali dva. Takoj ko je mogoče, naj bolniki po njegovem nasvetu nadaljujejo vsakodnevne aktivnosti in izvajajo vaje za krepitev hrbtnih mišic. Dolgotrajen počitek namreč lahko bolečino samo še poslabša, je dodal.
Lahko se zgodi, da bolečina ni omejena na hrbtenico, ampak se širi v zadnjico in nogo. V tem primeru gre za t. i. nevropatsko bolečino, ki jo bolniki občutijo kot mravljinčenje ali kot elektrizirajočo oziroma pekočo bolečino. Ti simptomi se pogosto pojavljajo ali stopnjujejo konec dneva in ponoči, kar zelo moti spanec. Bolniki lahko občutijo tudi oslabelost mišic ali doživijo celo hude motorične težave.
Nevropatsko bolečino povzroči neposredna poškodba ali bolezen živca oziroma živčevja. Ti znaki po Požlepovih navedbah kažejo, da je lahko prizadeto živčevje. Če simptomi v dveh do treh tednih ne izginejo ali pa se celo stopnjujejo, je potreben obisk pri zdravniku.
Združenje ob svetovnem dnevu organizira aktivnosti, s katerimi želi prispevati k boljšemu razumevanju in obravnavi kronične bolečine v križu predvsem pri delovno aktivnih. Ob tej priložnosti poudarjajo, da je pomembno povečati možnosti za sočasno obravnavo bolnika pri strokovnjakih, ki se bolečine lotevajo z različnih zornih kotov.
“,”Jaka Verbic Miklic”,1633957800,1633957800,sl,14933,306,14932,43,0,NULL,,”Ob svetovnem dnevu boja proti bolečini poudarjajo pomen obvladovanja bolečine”,ob-svetovnem-dnevu-boja-proti-bolecini-poudarjajo-pomen-obvladovanja-bolecine,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637503886,1637503886
845,14935,”Cepljenje proti gripi je lahko opravljeno hkrati s cepljenjem proti covidu-19″,”je na današnji novinarski konferenci o cepljenju proti gripi povedal predstojnik mariborske enote NIJZ Zoran Simonović.v”,”
Ljubljana, 14. oktobra – Ta teden poteka razdeljevanje cepiv proti gripi med izvajalce cepljenja, ambulante NIJZ pa bodo cepljenje proti gripi začele v ponedeljek. Cepljenje proti gripi je lahko opravljeno hkrati s cepljenjem proti covidu-19, je na današnji novinarski konferenci o cepljenju proti gripi povedal predstojnik mariborske enote NIJZ Zoran Simonović.
Čeprav v lanskoletni sezoni pri nas ni bilo uradno zabeleženega nobenega primera gripe v Sloveniji, je cepljenje proti gripi pomembno in smiselno tudi letos. Stroka cepljenje priporoča vsem prebivalcem, zlasti skupinam z večjim tveganjem za težji potek bolezni.
Vsako leto za gripo zboli od pet do deset odstotkov ljudi, pri otrocih je delež lahko še nekoliko višji. A lani to ni bilo tako, saj smo po besedah specialista javnega zdravja Zorana Simonovića z mariborske območne enote Nacionalnega inštituta za javno zdravje (NIJZ) prvič doživeli popolni izostanek sezonskega pojavljanja gripe. Pojavili so se samo posamični primeri, tako da je stroka govorila le o medsezonskem pojavljanju gripe.
Podobno je bilo tudi v ostalih delih sveta, glavni razlog pa so najverjetneje vsi preventivni ukrepi za obvladovanje epidemije novega koronavirusa. “Ker v letošnji sezoni ne pričakujemo vseh teh ukrepov omejevanja socialnega življenja, lahko predvidevamo, da zna biti letošnja sezona gripe spet drugačna kot lani,” je povedal Simonović. Gripa je pričakovana tudi pri nas, nenazadnje se virus pojavlja v drugih evropskih državah, med drugim so na Hrvaškem laboratorijsko potrdili več kot sto primerov gripe.
Lani, ko je bilo pri nas na voljo okoli 270.000 odmerkov cepiva proti gripi, ga je razmeroma hitro zmanjkalo, zato je letos naročenega več cepiva, skupno 360.000 odmerkov. Cepivo med izvajalce cepljenja razdeljujejo v tem tednu. S cepljenjem lahko začnejo takoj, ko cepivo pridobijo, je povedal Simonović. Ambulante NIJZ bodo cepljenje proti gripi začele v ponedeljek, cepljenje pa je tudi letos povsod brezplačno za vse z urejenim obveznim zdravstvenim zavarovanjem.
Glede sočasnosti cepljenj proti covidu-19 in proti gripi je Simonović povedal, da je doslej ves čas izvajanja cepljenja proti covidu-19 veljalo, da je potreben oz. priporočen dvotedenski razmik med cepljenjem proti covidu-19 in katerimkoli drugim cepljenjem.
Pri cepljenju proti gripi pa gre za izjemo in je tudi strokovno potrjeno, da je možno opraviti cepljenje proti gripi in proti covid-19 na isti dan, lahko pa tudi s časovnim razmikom. To je po Simonovićevih besedah pomembno zato, da ne zamikamo izvedbe cepljenj proti gripi ali proti covidu-19, to velja tudi za tretji, poživitveni odmerek cepiva proti covidu-19.
Po cepljenju proti gripi se zaščita razvije v roku 10 do 14 dni in vsako zamikanje izvedbe cepljenja proti gripi, če bo prišlo do zgodnjega pojava sezone gripe, bi bilo nezaželeno, je še dejal Simonović.
Med rizične skupine z večjim tveganjem za težek potek bolezni spadajo starejši od 65 let in kronični bolniki, zato jim cepljenje priporočajo, prav tako med rizične skupine spadajo nosečnice. V zvezi s temi je ginekolog in porodničar Miha Lučovnik povedal, da je v sezoni 2014/2015 bilo pri nas proti gripi cepljenih manj kot sto nosečnic, v sezoni 2019/2020, za katero še ima podatke, jih je bilo že več kot 700. Cepljenje je po njegovih besedah učinkovito in varno tudi v prvem trimesečju nosečnosti.
Rizična skupina za težji potek gripe so tudi otroci, predvsem tisti, mlajši od dveh let. Pediater Denis Baš je opozoril, da lahko obolenje pri otrocih spremljajo tudi vročinski krči in bakterijske okužbe. V sezoni 2019/2020 je bilo pri nas proti gripi cepljenih skupaj 367 otrok, mlajših od dveh let, eno sezono prej je bila številka za polovico manjša.
Infektologinja Daša Stupica z infekcijske klinike pa je med drugim povedala, da je podatkov o tem, kaj bi pomenila hkratna okužba z novim koronavirusom in gripo, malo, je pa sicer glede respiratornih virusov znano, da se praviloma ne pojavljajo sočasno in da se vrhovi okužb praviloma ne prekrivajo.
“,”Jaka Verbic Miklic”,1634217180,1634217180,sl,14935,306,14934,43,0,NULL,,”Cepljenje proti gripi je lahko opravljeno hkrati s cepljenjem proti covidu-19″,cepljenje-proti-gripi-je-lahko-opravljeno-hkrati-s-cepljenjem-proti-covidu-19,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637504079,1637504079
846,14937,”Pri možganski kapi lahko minute rešijo življenja”,”Poleg očitnih znakov za možgansko kap so opozorili tudi na pomen zdravljenja drugih kroničnih nenalezljivih bolezni.”,”
Ljubljana, 18. oktobra – Pri možganski kapi lahko minute rešijo življenja, pomemben je predvsem čas, kdaj na opozorilne znake reagiramo, so na novinarski konferenci ob svetovnem dnevu možganske kapi, ki bo 29. oktobra, izpostavili govorci. Poleg očitnih znakov za možgansko kap so opozorili tudi na pomen zdravljenja drugih kroničnih nenalezljivih bolezni.
Možganska kap je ena najpogostejših srčno-žilnih bolezni. Ena oseba od štirih odraslih po svetu utrpi možgansko kap. Približno 30 odstotkov jo doživi v aktivnem delovnem obdobju. Možganska kap je med vodilnimi vzroki smrti in invalidnosti po vsem svetu, vendar bi skoraj vse možganske kapi lahko preprečili, so zapisali v Društvu za zdravje srca in ožilja Slovenije.
Predsednik Društva za zdravje srca in ožilja Slovenije in zdravnik Matija Cevc je na današnji novinarski konferenci poleg očitnih znakov za možgansko kap – to so slabo razumljiv govor, šibka roka ali noga in na obrazu povešen ustni kot – poudaril pomen zdravljenja drugih kroničnih nenalezljivih bolezni. “Neurejen krvni tlak, slabo urejena sladkorna bolezen, motnje v presnovi maščob in neredno utripanje srca. To so vse stanja, ki pomenijo dodatno ogroženost, nevarnost, da bo prišlo do možganske kapi,” je opozoril Cevc.
“Vsa ta stanja, vključno z možgansko kapjo, znamo zelo dobro zdraviti,” je poudaril Cevc, a dodal, da raziskave kažejo, da polovica bolnikov po šestih mesecih redne terapije opusti jemanje zdravil, ki so namenjena zdravljenju teh kroničnih nenalezljivih bolezni. “To je resna zadeva in skrajno neresno je, če ustreznih zdravil ljudje ne jemljejo,” je še dejal Cevc.
Zdravnica Janja Pretnar Oblak z nevrološke klinike pa je opozorila, da lahko možganska kap nastopi tudi neopaženo, “rečemo, da ima bolnik bolezen malih žil”. Bolnik sam kapi ne opazi, te mikro kapi pa povzročijo kognitivni upad, bolniki lahko težje hodijo, postanejo tudi depresivni. Dejavniki tveganja za nastanek tihe možganske kapi so visok krvni tlak, sladkorna bolezen in slaba presnova maščob, “vse kar lahko naredimo je skrben nadzor dejavnikov tveganja na dolgi rok,” je poudarila Pretnar Oblakova.
Podpredsednica Združenja bolnikov s cerebrovaskularno boleznijo Slovenije in zdravnica Tatjana Erjavec je dejala, da so v času zaprtja države zaradi epidemije novega koronavirusa poskušali ostati v stiku z okoli 20.000 bolniki, ki živijo s posledicami možganske kapi. V prvem valu so uporabljali predvsem telefonske pogovore, sms sporočila in elektronsko pošto.
V času drugega vala pa so se preselili na splet, a ugotovili, da odziv bolnikov ni bil velik. V te programe so se vključevali predvsem mlajši, manj funkcionalno prizadeti in tisti, ki so že prej uporabljali splet. Velika skupina bolnikov, ki kot glavni medij, ki ga spremlja, navaja televizijo, pa spletnih srečanj ni bila deležna. Erjavčeva je dodala, da si zato želijo “v okviru rednih programov dobiti nekomercialne minute za učenje, podporo bolnikom in svojcev ter osveščanje ljudi o življenju po možganski kapi”.
“Z zdravim življenjskim slogom lahko marsikatero od nenalezljivih kroničnih bolezni skoraj odstranimo. Velik delež sladkornih bolezni, motenj v presnovi maščob pa tudi povišanega krvnega tlaka, je povezan s prekomerno prehrano, z debelostjo. Ljudje, ki shujšajo, imajo bistveno bolj urejen, včasih celo spet normalen krvni sladkor, izboljša se jim povišan krvni tlak, kar je koristno tudi v okviru preprečevanja možganske kapi,” je še poudaril Matija Cevc.
Društvo za zdravje srca in ožilja v torek vabi na Prešernov trg v Ljubljani, kjer bo med 10. in 13. uro osrednja prireditev ob svetovnem dnevu možganske kapi.
“,”Jaka Verbic Miklic”,1634562960,1634562960,sl,14937,306,14936,43,0,NULL,,”Pri možganski kapi lahko minute rešijo življenja”,pri-mozganski-kapi-lahko-minute-resijo-zivljenja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637504231,1637504231
847,14939,”Preventiva pred luskavico sta vzdrževanje zdrave telesne teže in redna fizična aktivnost”,”so na današnji novinarski konferenci pred svetovnim dnevom psoriaze poudarili dermatovenerologi in predstavnik Društva psoriatikov Slovenije, ki združuje bolnike z luskavico”,”
Ljubljana, 21. oktobra – Vzdrževanje zdrave telesne teže in redna telesna aktivnost sta pomembna dejavnika preprečevanja in lajšanja luskavice oz. psoriaze, so na današnji novinarski konferenci pred svetovnim dnevom psoriaze, ki ga obeležujemo 29. oktobra, poudarili dermatovenerologi in predstavnik Društva psoriatikov Slovenije, ki združuje bolnike z luskavico.
Letošnje globalno sporočilo Združeni v razumevanju psoriaze želi opozoriti na pomen obravnave in razumevanje bolezni.
Luskavica je kronična imunsko pogojena vnetna bolezen, ki po podatkih Društva psoriatikov Slovenije prizadene od dva do tri odstotke svetovne populacije. Obenem je ena najpogostejših kožnih bolezni. V Sloveniji je okoli 40.000 bolnikov z luskavico, od tega jih ima 20-30 odstotkov hudo obliko.
Bolezen se na koži odraža z žarišči zadebeljene, rdeče, luščeče se kože, ki se najpogosteje pojavljajo na delih telesa, kot so komolci, kolena, lasišče, dlani, stopala, nohti in trup. Po besedah specialista dermatovenerologije Tomaža Lundra ima pri nastanku luskavice pomembno vlogo genetska nagnjenost, obenem pa vplivanje dejavnikov okolja, med drugim stres, premalo telesne aktivnosti in nezdrava prehrana. “Vzdrževanje zdrave telesne teže in redno gibanje sta zato pomembna dejavnika preprečevanja oz. lajšanja bolezni,” je povedal.
Kot je še dodal, luskavica ni omejena samo na kožo, saj jo lahko spremljajo pridružene bolezni. Pri tretjini obolelih se lahko bolezen razvije tudi v vnetno sklepno bolezen psoriatični artritis. Revmatolog Žiga Rotar je ob tem poudaril, da so k njemu najbolj nagnjeni tisti oboleli, ki imajo v bližnjem sorodstvu bolnika s psoriatičnim artritisom, imajo obsežno luskavico tudi v lasišču ali očitne znake na prstih na rokah.
Luskavico zdravijo lokalno z različnimi mazili, ki blažijo vnetne izbruhe. Zdravnik pa lahko predvsem pri težjih oblikah predpiše tudi foto terapijo, kjer se obolel del kože izpostavi umetni ultravijolični svetlobi. Sistemsko zdravljenje pa predpiše dermatolog, je pojasnil Lundra.
Dodal je, da so v zadnjih 15 letih do revolucije pri zdravljenju luskavice privedla predvsem biološka zdravila, ki so pridobljena z biološkimi procesi v živih organizmih in namenjena bolnikom s težjo obliko luskavice.
Bolezen lahko negativno vpliva tudi na duševno zdravje bolnika. “Zaradi zunanjih znakov, oboleli pogosto občutijo sram, imajo nizko samopodobo in se počutijo izločene iz družbe,” je povedala psihiatrinja Anja Plemenitaš. Posledično lahko zapadejo tudi v depresijo.
Zaradi slabega poznavanja bolezni je luskavica v javnosti še vedno stigmatizirana, toda po besedah predsednika društva Jana Korena v dosti manjši meri kot v preteklosti. “K temu je pripomoglo naše prizadevanje za boljše poznavanje, razumevanje in sprejemanje bolezni ter izboljšanje kakovosti življenja bolnikov z luskavico,” je izpostavil.
V društvu jim v ta namen ponujajo program psihoterapije preko telefona. Bolnike pa lahko napotijo tudi na obnovitveno rehabilitacijo, zdravljenje v tujini, družinsko rehabilitacijo, organizirajo pa tudi druženja, predavanja, izobraževanja in izlete.
“,”Jaka Verbic Miklic”,1634822280,1634822280,sl,14939,306,14938,43,0,NULL,,”Preventiva pred luskavico sta vzdrževanje zdrave telesne teže in redna fizična aktivnost”,preventiva-pred-luskavico-sta-vzdrzevanje-zdrave-telesne-teze-in-redna-fizicna-aktivnost,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637504414,1637504414
848,14941,”S slovenskim znanjem na poti do novega genskega zdravila za zdravljenje raka”,”Onkološki inštitut Ljubljana je postal prvi nosilec dovoljenja za izvajanje klinične študije novega genskega zdravila za zdravljenje raka v Sloveniji”,”
Ljubljana, 27. oktobra – Onkološki inštitut Ljubljana je postal prvi nosilec dovoljenja za izvajanje klinične študije novega genskega zdravila za zdravljenje raka v Sloveniji. Zdravilo, postopek priprave in celotno proizvodno okolje so plod slovenskega znanja in izkušenj strokovnjakov, ki so več kot tri leta sodelovali v projektu SmartGene.si.
Kot so danes sporočili iz Onkološkega inštituta Ljubljana, je Javna agencija za zdravila in medicinske pripomočke (JAZMP) izdala odločbo, s katero je konzorciju SmartGene.si odobrila klinično preizkušanje zdravljenja kožnih tumorjev glave in vratu z gensko terapijo, onkološki inštitut pa je tako postal prvi nosilec dovoljenja za izvajanje klinične študije tega novega genskega zdravila v Sloveniji.
Vodja oddelka za eksperimentalno onkologijo na Onkološkem inštitutu Ljubljana Gregor Serša pojasnjuje, da je vzpostavljena platforma za pripravo genskih terapij in da se začenja klinična študija faze I, v katero bodo vključili že prvega bolnika.
“Bolnike bomo zdravili z gensko terapijo, tako da jim bomo najprej vbrizgali genski zapis za interleukin-12, ki ga bomo vnesli v celice tumorja z elektroprenosom. Celice bodo same proizvajale interleukin-12, ki ima sposobnost spodbujanja imunskega sistema in s tem deluje tudi protitumorsko,” je razložil.
Začetek kliničnih študij je prvi korak k uporabi terapije in partnerji projekta so že v fazi pridobivanja sredstev za nadaljnja klinična testiranja, so še sporočili z onkološkega inštituta. Vzpostavljena platforma za proizvodnjo genskega zdravila je okolje, ki omogoča razvoj novih genskih zdravil ali cepiv na osnovi DNK- ali RNK-tehnologij ter omogoča izvedbo razvoja procesa, proizvodnje, predkliničnega testiranja ter tudi izvedbo kliničnih študij za domači ali svetovni trg.
Projekt SmartGene.si se je zaključil letos septembra, poleg Onkološkega inštituta Ljubljana, ki je prijavitelj projekta, pa so sodelovali še center odličnosti Cobik, družbi Iskra PIO in Jafral ter Fakulteta za elektrotehniko Univerze v Ljubljani. Soizvajalca projekta sta tudi Veterinarska fakulteta Univerze v Ljubljani ter Klinika za otorinolaringologijo in cervikofacialno kirurgijo Univerzitetnega kliničnega centra Ljubljana.
Projekt je bil delno financiran iz sredstev države in Evropskega sklada za regionalni razvoj. “Ocenjujemo, da gre verjetno za najuspešnejši javno sofinanciran projekt na področju medicine in biotehnologije v Sloveniji, saj smo inovativno terapijo dejansko pripeljali do ljudi, tako da smo razvili tehnologije in okolje, ki omogočajo proizvodnjo zdravila in tudi izvedbo terapije,” pojasnjuje direktor Centra odličnosti za biosenzoriko, instrumentacijo in procesno kontrolo (Cobik) Matjaž Peterka.
Kot so še navedli v inštitutu, predstavlja gensko zdravilo za zdravljenje raka, razvito in proizvedeno izključno na podlagi domačega znanja, velik dosežek na razvojnem ter tudi na znanstvenem področju, zato bo 23. novembra v soorganizaciji Slovenske akademije znanosti in umetnosti ter konzorcija SmartGene.si potekal tudi simpozij o razvoju in izzivih genske terapije v Sloveniji.
“,”Jaka Verbic Miklic”,1635341580,1635341580,sl,14941,306,14940,43,0,NULL,,”S slovenskim znanjem na poti do novega genskega zdravila za zdravljenje raka”,s-slovenskim-znanjem-na-poti-do-novega-genskega-zdravila-za-zdravljenje-raka,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637505292,1637505293
849,14943,”Obeležujemo svetovni dan možganske kapi”,”Možganska kap v Sloveniji vsak dan prizadene deset ljudi, oziroma 4000 ljudi na leto”,”
Ljubljana, 29. oktobra – Danes obeležujemo svetovni dan možganske kapi, ene najpogostejših srčno-žilnih bolezni. Možganska kap v Sloveniji vsak dan prizadene deset ljudi, oziroma 4000 ljudi na leto. Je med vodilnimi vzroki smrti in invalidnosti po vsem svetu, vendar bi skoraj vse možganske kapi lahko preprečili, so zapisali v Društvu za zdravje srca in ožilja Slovenije.
Možganska kap se v večini primerov pojavlja pri ljudeh, ki so starejši od 65 let. V prvih treh tednih po možganski kapi umre okoli 30 odstotkov bolnikov, 30 odstotkov jih po kapi dobro okreva in nimajo večjih težav, okoli 40 odstotkov pa jih ostane bolj ali manj prizadetih, so navedli v društvu.
Najpogostejši simptomi in znaki, ki se pojavijo po možganski kapi, so delna ali popolna ohromelost polovice telesa, motnje občutka po polovici telesa, motnje govora, branja in pisanja, motnje vida, nesposobnost zadrževanja urina in blata ter motnje požiranja. Možganska kap lahko vpliva tudi na duševne sposobnosti, spomin, mišljenje, dojemanje, čustvovanje, prepoznavanje sebe in okolja.
V društvu opozarjajo, da je okrevanje po možganski kapi dolgotrajno. Najhitreje poteka v prvih mesecih, vendar pa lahko skupaj traja nekaj let. Odvisno je predvsem od mesta in velikosti možganske okvare. Na funkcionalno okrevanje vplivajo tudi bolnikova motivacija, sposobnost učenja, podpora družine ter kakovost in intenzivnost rehabilitacijske obravnave.
Zgodnja rehabilitacija se začne v prvih dneh zdravljenja v bolnišnici, njen namen pa je predvsem preprečevanje zapletov. Razgibavanje v postelji, posedanje, vstajanje in hoja ob opori zmanjšujejo tveganje za dodatne zaplete.
Bolniki, ki po zaključku zdravljenja v bolnišnici ali po zgodnjem obdobju bolezni potrebujejo le manjšo pomoč v dnevnih opravilih in pri gibanju, so lahko vključeni v ambulantno terapijo v zdravstvenem domu, zdravilišču in v domovih za starejše občane ali v terapijo na domu. Bolniki, ki imajo znatne nevrološke izpade ali prizadetosti na vsaj dveh različnih področjih funkcioniranja, pa so vključeni v program celovite obravnave v rehabilitacijski ustanovi.
Z delom rehabilitacijskih programov je treba nadaljevati tudi v domačem okolju in bolnika spodbujati k čim večji samostojnosti. S časom lahko pri bolnikih po možganski kapi pride do upada funkcijskih sposobnosti, kar lahko preprečijo z rednim izvajanjem vaj, s poudarkom na vsakodnevnem raztezanju, vajah za ravnotežje in koordinacijo ter aerobni vadbi. Za preprečevanje ponovne možganske kapi pa je pomembno dobro uravnavati krvni tlak, raven holesterola v krvi in raven krvnega sladkorja.
“,”Jaka Verbic Miklic”,1635514500,1635514500,sl,14943,306,14942,43,0,NULL,,”Obeležujemo svetovni dan možganske kapi”,obelezujemo-svetovni-dan-mozganske-kapi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637505395,1637505523
850,14945,”Movember – mesec ozaveščanja o zdravju moških”,”Za rakom letno po svetu zboli več kot 12 milijonov ljudi, pri čemer je rak prostate najpogosteje diagnosticirana oblika raka pri moških”,”
Ljubljana, 1. novembra – Mesec november, ki je bil razglašen za movember, je namenjen zdravju moških, predvsem opozarjanju na raka prostate in mod. Za rakom letno po svetu zboli več kot 12 milijonov ljudi, pri čemer je rak prostate najpogosteje diagnosticirana oblika raka pri moških, kažejo podatki Nacionalnega inštituta za javno zdravje (NIJZ).
Movember je mednarodno gibanje, katerega namen je javnost ozaveščati o zdravju in boleznih, ki prizadenejo moško populacijo. Gibanje se je leta 2003 začelo v Avstraliji in preraslo v globalno gibanje, ki združuje več kot pet milijonov ljudi. Člani svojo podporo gibanju izražajo z nošenjem brk v mesecu novembru, od koder tudi ime.
Rak prostate je pogost zlasti pri starejših moških. Več kot dve tretjini bolnikov je namreč starejših od 65 let. Na leto ga v Sloveniji diagnosticirajo pri okoli 1500 moških, za posledicami te bolezni pa jih umre okoli 400, piše na spletni strani NIJZ.
Po poročilu bolnišničnega registra raka Onkološkega inštituta Ljubljana so v letu 2019 raka potrdili pri 682 moških, ki so bili prvič sprejeti na Onkološki inštitut Ljubljana. V Društvu onkoloških bolnikov Slovenije pa poudarjajo, da bo zaradi v prihodnje pričakovanega staranja prebivalstva tudi obolevnost za rakom prostate najbrž še naraščala.
Poleg starosti med dejavnike tveganja spada tudi družinska obremenjenost. To pomeni, da ima moški, katerega oče ali brat sta zbolela za rakom prostate, povečano tveganje, da bo tudi sam zbolel. Obenem ima velik pomen v sklopu zgodnjega odkrivanja bolezni odkrivanje genskih mutacij.
Simptomi, ki so najpogosteje povezani z zgodnjim rakom prostate, so pogosto uriniranje, slaboten ali prekinjen tok urina, bolečina ali pekoč občutek med uriniranjem in krvav seč. V primeru, da se je rak razširil iz prostate na druge organe, pa se omenjenim simptomom lahko pridružijo še bolečine v presredku, motnje pri odvajanju blata in motnje ejakulacije, bolečine v kosteh ter splošna oslabelost z izgubo telesne teže, opozarjajo v društvu.
Število primerov se iz leta v leto veča tudi zaradi strogega upoštevanja izvida testa, ki pokaže mejne ravni za prostato specifičnega antigena (test PSA). V dobri tretjini primerov tako postavljene diagnoze rak namreč nikoli ne napreduje in ne povzroči pomembnejših kliničnih težav, bolezni tako sploh ne bi odkrili, če je ne bi iskali. pojasnjujejo na NIJZ.
Na društvu izpostavljajo, da je preventiva za preprečevanje smrtnosti zaradi raka prostate zdrav življenjski slog, torej zdrava prehrana in zadostna telesna aktivnost. Najpomembnejši dejavnik pa je zgodnje odkrivanje in učinkovito zdravljenje.
“,”Jaka Verbic Miklic”,1635777600,1635777600,sl,14945,306,14944,43,0,NULL,,”Movember – mesec ozaveščanja o zdravju moških”,movember-mesec-ozavescanja-o-zdravju-moskih,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637505648,1637505649
851,14947,”Ob mesecu zdravja moških opozorilo, da je v Sloveniji premalo urologov”,”V državi premalo urologov, čakanje na urološke preglede pa je nedopustno dolgo”,”
Novo mesto, 3. novembra – V Splošni bolnišnici Novo mesto so predstavniki te ustanove, Društva uroloških bolnikov Slovenije in mednarodnega gibanja Movember v Sloveniji ob mesecu zdravja moških danes opozorili, da je v državi premalo urologov, čakanje na urološke preglede pa je nedopustno dolgo. Hkrati so poudarili pomen ozaveščanja o raku na prostati.
Kot je opozoril specialist urologije in tajnik Združenja urologov Slovenije Boris Košuta, imajo v Nemčiji enega urologa na 13.000 prebivalcev, v Sloveniji pa le enega na 33.300 prebivalcev. Poleg pomanjkanja urologov in spremljevalnega kadra v državi primanjkujejo tudi operativne zmogljivosti. Na prvi pregled pri urologu in na posege je treba nerazumno dolgo čakati.
Navedel je še stališče razširjenega strokovnega kolegija za urologijo, ki ga imajo zadnji dve leti tudi v Sloveniji, po katerem ambulantne in operativne zmogljivosti niso dovolj velike za pravočasno in učinkovito obravnavo uroloških bolnikov. Primanjkuje tudi operativnih dvoran, posteljnih mest in kadra zdravstvene nege, sester, inštrumentark in anastezijskih ekip, je dejal.
Košuta je še povzel, da se razmere sicer počasi popravljajo. V državi je 60 urologov, 26 specializantov urologije in 20 upokojenih urologov.
Predsednik Društva uroloških bolnikov Slovenije Franc Hočevar je povedal, da rak prostate ogroža predvsem moške po 50. letu starosti, zaradi te bolezni pa v Sloveniji letno umre več kot 400 bolnikov, medtem ko jo letno na novo odkrijejo pri 1600 moških.
Kot najboljšo preventivo pri moških, ki se bližajo starosti 60 let, je navedel ustrezne zdravniške preglede in pravočasno odkrivanje te bolezni, pri čemer pa ni mogel mimo dolgega čakanja. Gre za “nespodobno predolgo čakalno dobo”, je ocenil. Ta se po njegovih podatkih zadnja leta ne krajša, temveč še podaljšuje, pri čemer je svoje dodala epidemija covida-19.
Čakanje na pregled s stopnjo zelo hitro presega 45 dni, na hitri pregled je treba čakati 125 dni, na redni pregled pa v povprečju 225 dni. Gre za podatke Nacionalnega inštituta za javno zdravje (NIJZ). Tudi Hočevarja je opozoril, na pomanjkanje urologov. Glede na število prebivalcev bi jih morali imeti v Sloveniji vsaj 120, je navedel.
Dolgoletni specialist urologije v novomeški bolnišnici Boris Pogačar je pristavil, da bi radi o raku prostate opozorili tako moške kot njihove partnerice in družine. Ta bolezen sicer kaže “rahlo tendenco naraščanja”, kot edino možno in ključno preventivo pa je poudaril pravočasno odkrivanje. Glede števila zaposlenih urologov je ocenil, “da se stanje izboljšuje, ni pa še dobro”.
Društvo uroloških bolnikov Slovenije in gibanje Movember v Sloveniji sta urološkemu oddelku novomeške bolnišnice ob današnji izjavi izročila donacijo v znesku 5000 evrov.
Mesec november, ki je bil razglašen za movember, je namenjen zdravju moških, predvsem opozarjanju na raka prostate in mod. Za rakom letno po svetu zboli več kot 12 milijonov ljudi, pri čemer je rak prostate najpogosteje diagnosticirana oblika raka pri moških, kažejo podatki NIJZ.
Movember je mednarodno gibanje, katerega namen je ozaveščati o zdravju in boleznih, ki prizadenejo moške. Leta 2003 se je začelo v Avstraliji in preraslo v globalno gibanje, ki združuje več kot pet milijonov ljudi. Člani podporo gibanju izražajo z nošenjem brk v novembru oz. t. i. movembru.
“,”Jaka Verbic Miklic”,1635950520,1635950520,sl,14947,306,14946,43,0,NULL,,”Ob mesecu zdravja moških opozorilo, da je v Sloveniji premalo urologov”,ob-mesecu-zdravja-moskih-opozorilo-da-je-v-sloveniji-premalo-urologov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637505816,1637505817
852,14949,”V Sloveniji narašča število sladkornih bolnikov in umrlih zaradi te bolezni”,”S konferenco je prvič zaživel tudi državni program za obvladovanje sladkorne bolezni 2020-2030.”,”
Ljubljana, 9. novembra – Na nacionalni konferenci obvladovanja sladkorne bolezni so danes opozorili, da pri nas narašča število sladkornih bolnikov in umrlih zaradi te bolezni kot osnovnega vzroka smrti. Osrednja tema je bila dostopnost presejanja za sladkorno bolezen tipa 2. S konferenco je prvič zaživel tudi državni program za obvladovanje sladkorne bolezni 2020-2030.
Na področju sladkorne bolezni tipa 2 je stanje zaskrbljujoče. Raziskava Nacionalnega inštituta za javno zdravje (NIJZ), ki so jo predstavili na nacionalni konferenci, je pokazala, da ima v Sloveniji od 59.000 do 127.000 ljudi sladkorno bolezen, ne da bi vedeli zanjo. Še posebej veliko jih je v vzhodni Sloveniji, med starejšimi od 60 let in med tistimi, ki imajo debelost.
Ivan Eržen z NIJZ je na dogodku, ki je potekal prek spleta, povedal, da so lani 2020 zabeležili 2-odstotno rast števila prejemnikov zdravil za sladkorno bolezen, so še sporočili z NIJZ. Še vedno so velike razlike med regijami. V zasavski je ljudi, ki prejemajo ta zdravila, največ, in sicer kar dve tretjini več kot npr. v goriški regiji.
Lani je bilo v Sloveniji približno 9500 novih bolnikov, ki prejemajo antihiperglikemična zdravila za sladkorno bolezen, hospitalizacij zaradi zapletov s sladkorno boleznijo pa razmeroma malo, 1861 bolnikov s sladkorno boleznijo oziroma 104,3 hospitalizacije na 100.000 prebivalcev.
Narašča število umrlih zaradi sladkorne bolezni kot osnovnega vzroka smrti. Lani je tako pri nas umrlo 443 ljudi, leta 2019 je bilo umrlih 380, leta 2018 pa 282. Sladkorne bolnike zelo ogroža tudi covid-19. Kot je povedal Eržen, so se mlajši bolniki s sladkorno boleznijo hitreje cepili kot ostali. Zaradi zapore družbe je bilo veliko težav pri kontaktih s podporno primarno službo, odpadlo je veliko preventivnih pregledov, kar se odraža tudi v številkah.
Državna sekretarka na Ministrstvu za zdravje Alenka Forte je dejala, da se kljub trenutnim razmeram na tem področju dela dobro, so sporočili z NIJZ. “Slovenija si prizadeva slediti izvajanju učinkovite politike po vzoru evropskih držav, ki vključuje zakonodajne ukrepe za omejevanje dostopnosti in promocije škodljivih izdelkov in navad. Ključni so kompleksni pristopi, ki jih izvajamo v zdravstvu v sodelovanju s šolstvom, socialnim varstvom, nevladnimi organizacijami in drugimi deležniki v lokalnem okolju,” je povedala državna sekretarka.
Konference se je udeležila tudi predstavnica Regionalnega urada Svetovne zdravstvene organizacije (WHO) za Evropo Jill Farrington, ki je povedala, da državni program za obvladovanje sladkorne bolezni 2020-2030, ki ga je vlada potrdila junija, podpira tudi WHO.
Udeležencem so se predstavili člani nove koordinativne skupine državnega programa na ministrstvu za zdravje. Predstavnik Zveze društev Diabetikov Slovenije Robert Gratton je ob tem poudaril pomen povratnih informacij, ali program uspešno deluje, in kaj je potrebno storiti za njegovo uspešno delovanje.
Predstavnica Regionalnega urada WHO za Evropo Sue Cohen je predstavila dobre prakse pravilnega izvajanja presejalnih programov in predlagala začetno pilotno uvedbo izvajanja presejalnih programov na terenu.
Na konferenci so posebej poudarili tudi pomen preventivnih pregledov v ambulantah družinske medicine, so še sporočili z NIJZ.
“,”Jaka Verbic Miklic”,1636469220,1636469220,sl,14949,306,14948,43,0,NULL,,” V Sloveniji narašča število sladkornih bolnikov in umrlih zaradi te bolezni”,v-sloveniji-narasca-stevilo-sladkornih-bolnikov-in-umrlih-zaradi-te-bolezni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637506114,1637506114
853,14951,”Pozivi k večjemu vnosu prehranskih vlaknin”,”Inštitut za nutricionistiko ob današnjem mednarodnem dnevu ozaveščanja o polnozrnatih žitih poziva k večjemu zaužitju polnozrnatih izdelkov”,”
Ljubljana, 16. novembra – Inštitut za nutricionistiko ob današnjem mednarodnem dnevu ozaveščanja o polnozrnatih žitih poziva k večjemu zaužitju polnozrnatih izdelkov, saj njihovo redno vključevanje v vsakodnevno prehrano močno prispeva k prehranskemu vnosu vlaknin. Te imajo številne dokazano ugodne vplive na zdravje, a jih Slovenci zaužijemo znatno premalo, kaže raziskava.
Rezultati raziskave, ki so bili objavljeni tudi v znanstveni reviji Nutrients, so pokazali, da 90 odstotkov prebivalcev Slovenije dnevno zaužije manj od priporočenih 30 gramov prehranske vlaknine. Povprečni vnosi vlaknin so znašali okrog 20 gramov, so sporočili z Inštituta za nutricionistiko.
Raziskava je temeljila na podatkih nacionalno reprezentativne prehranske raziskave Si.Menu, izvedli so jo raziskovalci z Inštituta za nutricionistiko v sodelovanju z Institutom Jožef Stefan, Nacionalnim inštitutom za javno zdravje in biotehniško fakulteto, sofinancirali pa so jo ministrstvo za zdravje, agencija za raziskovalno dejavnost ter Evropska agencija za varnost hrane.
Vanjo je bilo vključenih 1248 oseb, starih med 10 in 74 let, iz vseh slovenskih regij. “Gre za prvo tako obsežno raziskavo, ki je zelo pomembna tudi za politične odločevalce, s katerimi si prizadevamo izboljšati prehranske navade prebivalcev. Rezultati so pokazali, da nas na tem področju čakajo hudi izzivi, saj je vnos prehranske vlaknine nezadosten kar pri 90 odstotkih mladostnikov in odraslih ter pri 84 odstotkih starejših odraslih,” je dejal Igor Pravst z Inštituta za nutricionistiko.
Ustrezen vnos prehranske vlaknine ima dokazano ugoden vpliv na prebavo, hkrati pa se na ta način zmanjša tveganje za nastanek srčno-žilnih bolezni in sladkorne bolezni tipa 2. Ključni viri prehranske vlaknine v prehrani so zelenjava in stročnice, sadje ter polnozrnati žitni izdelki.
Nacionalni program o prehrani in telesni dejavnosti za zdravje, Dober tek Slovenija 2015-2025, izpostavlja, da je treba odstotek prebivalcev, ki uživa polnozrnata živila, občutno povečati. “Že v času sprejemanja programa so podatki pokazali, da kruh iz polnozrnate moke občasno uživa le 27 odstotkov prebivalcev, kar 31 odstotkov pa sploh nikoli. Prav zato je bil cilj nacionalnega programa tudi povečati ponudbo prehransko ustreznejših in preoblikovanih živilskih izdelkov, kamor sodi tudi vključevanje prehranske vlaknine,” je povedala Katja Povhe Jemec z ministrstva za zdravje.
Inštitut je ob mednarodnem dnevu ozaveščanja o polnozrnatih žitih podal nekaj primerov obrokov, bogatih s prehransko vlaknino. Med njimi so ovseni kosmiči z lanenimi semeni, mandlji in suhimi slivami, polnozrnat kruh z namazom iz čičerike, ješprenjeva rižota z grahom in zelenjavo, polnozrnate testenine z zelenjavno omako ter mešanica različnih oreškov in semen kot prigrizek.
Za priporočen vnos prehranske vlaknin se sicer priporoča pestra in uravnotežena prehrano, ki naj vključuje pretežno nepredelana in s tem polnovredna rastlinska živila.
Uživanje polnozrnatih žit pa ima pomembno vlogo tudi v okviru tako imenovanega trajnostnega načina prehranjevanja, ki na eni strani poudarja pomen prehrane pri ohranjanju človekovega zdravja z zmanjševanjem tveganj, povezanih z razvojem kronični nenalezljivih bolezni, na drugi strani pa ohranjanje okolja z zmanjševanjem količin odpadne hrane in posledično ohranjanjem vodnih virov ter kmetijskih zemljišč, so še zapisali na inštitutu.
“,”Jaka Verbic Miklic”,1637074380,1637074380,sl,14951,306,14950,43,0,NULL,,”Pozivi k večjemu vnosu prehranskih vlaknin”,pozivi-k-vecjemu-vnosu-prehranskih-vlaknin,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1637506489,1637506489
854,14953,”Odziv na srečanje Evropskega Sveta za zaposlovanje, socialno politiko, zdravje in varstvo potrošnikov (EPSCO)”,”Svet ESPCO je na današnjem sestanku podal informativno poročilo o napredku številnih z zdravjem ter zdravstvom povezanih zadev in sprejel sklepe Sveta Slovenskega predsedstva o krepitvi Evropske zdravstvene unije.”,”
Svet ESPCO je na današnjem sestanku podal informativno poročilo o napredku številnih z zdravjem ter zdravstvom povezanih zadev in sprejel sklepe Sveta Slovenskega predsedstva o krepitvi Evropske zdravstvene unije. Pogovori so bili med drugim osredotočeni na odziv EU na pandemijo, pripravo evropske Farmacevtske strategije in na evropski načrt za boj proti raku.
Pandemija covida-19 je razkrila številne šibkosti evropskih kapacitet za odziv na tako obsežno krizo javnega zdravja in zagotavljanje ustrezne koordinacije ter odločanja na podlagi dokazov na vseh nivojih, potrebnih za učinkovit boj proti pandemiji in njenim posledicam. Ad-hoc rešitve so bile oblikovane uspešno: vzpostavitev Evropskega organa za pripravljenost in odzivanje na izredne zdravstvene razmere – HERA, Uredba Sveta o izrednih okvirih za zdravstvene protiukrepe in Uredba o oblikovanju Evropske zdravstvene unije so pomembni koraki, ki bodo Evropo opremili za učinkovit odziv na globalne grožnje zdravju.
EFPIA in FarmaForum razumeta zaskrbljenost, ki jo je povzročil pojav različic covida-19, zato smo zavezani sodelovanju in delitvi znanja ter izkušenj z znanstveno skupnostjo, regulatornimi in javnozdravstvenimi organi po svetu. Zato pozivamo institucije EU, da zagotovijo ohranitev spodbud na globalnem in EU nivoju za podjetja, ki bodo nadaljevala z raziskovanjem novih različic, diagnostičnih postopkov, zdravil in cepiv za boj proti covidu-19.
EFPIA in FarmaForum pozdravljata Sklepe Sveta o krepitvi Evropske zdravstvene unije. Delimo si skupni cilj razvoja in zagotavljanja dostopnosti do novih zdravil za vse bolnike v EU. Pri tem poudarjamo, da sta optimizacija regulatornih poti za urejanje novih indikacij za obstoječa zdravila in ustrezne spodbude pomembna cilja.
Obstoječi evropski regulatorni okvir se mora prilagoditi novim okoliščinam, hkrati pa sta njegova stabilnost in predvidljivost industriji omogočila investiranje v raziskave in razvoj, dobavo novih zdravil bolnikom, zdravstvenim sistemom in celotni družbi. EFPIA in FarmaForum ostajata zaskrbljena zaradi pomanjkanja političnih reform za naslavljanje tržnih nepravilnosti na področju protimikrobnih zdravil in pozivata k razvoju novih spodbud na evropskem nivoju v obliki prenosljivega podaljšanja ekskluzivnosti (transferable exclusivity extension – TEE).
Veseli nas pozornost, ki jo zaključki Sveta posvečajo promociji cepljenja, zgodnjega zaznavanja in presejalnih programov. Pozdravljamo tudi priporočila, ki jih je sprejela zaključna konferenca o skupnih ukrepih Inovativnega partnerstva proti raku (iPAAC) in integracijo priporočil za prihajajoče izvajanje evropskega načrta za boj proti raku.
EFPIA in FarmaForum se zahvaljujeta slovenskemu predsedstvu za delo na področju zdravja in zdravstva v Evropi in se veselita sodelovanja z vsemi deležniki v prihajajočem francoskem predsedstvu, z namenom izvajanja evropske Farmacevtske strategije in oblikovanja boljše, bolj zdrave in varnejše prihodnosti za Evropo.
Z zavedanjem, da gre za multidisciplinarne in dolgoročne zdravstvene teme, kjer je potrebno sodelovanje različnih ministerstev, direktoratov Evropske komisije ter številnih socialnih in političnih partnerjev se veselimo nadaljnjega vključevanja pri iskanju kar najboljših rešitev.
“,”Jaka Verbic Miklic”,1638890940,1638890940,sl,14953,306,14952,43,0,NULL,,”Izjava za javnost EFPIA in FarmaForum “,izjava-za-javnost-efpia-in-farmaforum,Post,”/sites/43/files/images/news/Inovativnost potrebuje regulatorno podporo/Farmaforum_ Inovativnost potrebuje regulatorno podporo.jpg”,1,0,1638891202,1638892947
855,14953,”EFPIA and FarmaForum Press Release “,”Today’s ESPCO Council meeting provided an informative update on the progress of numerous health-related files and saw the adoption of the Slovenian Presidency Council Conclusions on ’Strengthening the European Health Union’. “,”
Today’s ESPCO Council meeting provided an informative update on the progress of numerous health-related files and saw the adoption of the Slovenian Presidency Council Conclusions on ’Strengthening the European Health Union’. The discussions focused, among others, on the EU response to the pandemic and the Pharmaceutical Strategy for Europe, as well as Europe’s Beating Cancer Plan.
The Covid-19 pandemic revealed several weaknesses in Europe’s capacity to respond to a public health crisis of this magnitude and to ensure sufficient coordination and evidence-based decision-making at all levels to effectively combat the pandemic and its consequences. While ad-hoc solutions were eventually found, HERA, the Council Regulation on the emergency framework regarding medical countermeasures, and Health Union Regulations are important steps to putting Europe on the front foot in addressing global health threats.
EFPIA and FarmaForum understand the concern caused by the emergence of Covid-19 variants and we are committed to working with the scientific community, and public health and regulatory bodies around the world, to continue to bring together our experience and expertise. In this respect, we call on the EU institutions to ensure that incentives for companies to continue research into new variants, new diagnostics, treatments, and vaccines to tackle Covid-19 are maintained, at the EU as well as the global level.
EFPIA and FarmaForum welcome the Council Conclusions on Strengthening the European Health Union. We share the goal of making new treatments available and accessible to all patients in the EU that need them and emphasise that streamlining the regulatory pathway and for repurposing of older medicines and appropriately incentivising it, are important goals. While the existing European regulatory framework needs to evolve, the stability and predictability of it has enabled industry to invest in R&D and to deliver new medicines to patients, healthcare systems and society. EFPIA and FarmaForum remain concerned around the lack of policy reforms to address market failures in antimicrobials and calls for the development of a new pull incentive at the European level in the form of a transferable exclusivity extension (TEE). We are encouraged by the attention placed in the Council Conclusions on promoting vaccination, early detection, and screening, and look forward to the recommendations from The Innovative Partnership for Action Against Cancer (iPAAC) Joint Action final conference, and the integration of recommendations into the forthcoming implementation of the Europe’s Beating Cancer Plan.
EFPIA and FarmaForum thank the Slovenian Presidency for its commitment to advancing the EU healthcare debate and looks forward to working with all stakeholders under the upcoming French Presidency towards the implementation of the EU’s Pharmaceutical Strategy and a better, healthier, and safer future for Europe.
“,”Jaka Verbic Miklic”,1638890940,1638890940,en,14953,306,14952,43,0,NULL,,”Izjava za javnost EFPIA in FarmaForum “,izjava-za-javnost-efpia-in-farmaforum,Post,”/sites/43/files/images/news/Inovativnost potrebuje regulatorno podporo/Farmaforum_ Inovativnost potrebuje regulatorno podporo.jpg”,1,0,1638891202,1638892947
856,14959,”Program Zora obeležuje prvo obletnico začetka globalne strategije za eliminacijo raka materničnega vratu”,”Cilj je doseči 90-odstotno precepljenost deklic proti HPV.”,”
Ljubljana, 17. novembra – Presejalni program za zgodnje odkrivanje predrakavih in rakavih obolenj Zora danes obeležuje prvo obletnico začetka globalne strategije WHO za eliminacijo raka materničnega vratu. Cilj je doseči 90-odstotno precepljenost deklic proti HPV. Ta cilj še ni dosežen, so pa prvi rezultati glede populacijskega učinka cepljenja v Sloveniji spodbudni.
Slovenija bi lahko na podlagi odličnih rezultatov, ki jih dosega s presejalnim programom Zora, postala celo ena prvih evropskih držav, ki bi ji to uspelo. Dva od treh ciljev za eliminacijo raka materničnega vratu globalne strategije Svetovne zdravstvene organizacije (WHO) namreč že izpolnjuje, to sta več kot 70-odstotna udeležba žensk v programu Zora in ustrezno zdravljenih več kot 90 odstotkov odkritih predrakavih sprememb materničnega vratu, so zapisali na spletni strani Onkološkega inštituta Ljubljana.
Tretji cilj, 90-odstotna precepljenost deklic, še ni dosežen, so pa prvi rezultati glede populacijskega učinka cepljenja spodbudni in o njih so razpravljali tudi na današnjem 11. izobraževalnem dnevu programa Zora, imenovanem Zorin dan, v organizaciji onkološkega inštituta in ministrstva za zdravje.
Vodja programa Zora Urška Ivanuš je v izjavi za javnost po posvetu povedala, da analiza zbranih podatkov registra Zora kaže, da imajo dekleta, ki so se med prvimi cepile proti HPV, za polovico manjšo verjetnost, da jim v brisu materničnega vratu odkrijejo predrakave spremembe visoke stopnje kot enako stara dekleta v preteklosti, ki možnosti cepljenja še niso imele.
Pomemben korak k temu, da otroci v odrasli dobi ne bodo zbolevali za raki in drugimi boleznimi je letošnja uvedba brezplačnega cepljenja proti HPV tudi za dečke, je poudarila.
Opozorila je, da jih skrbijo ženske stare med 30 in 39 let, kjer so lani zaznali za 10 odstotkov manjšo udeležbo na presejalnih pregledih kot pred pandemijo covida-19 in odkrili in zdravili kar za 14 odstotkov manj predrakavih sprememb visoke stopnje.
Triletna pregledanost žensk v programu Zora tako tudi v času pandemije ostaja nad ciljno vrednostjo 70 odstotkov. “Prav zaradi velike udeležbe žensk v programu Zora in visoke kakovosti storitev v programu vsako leto v Sloveniji pravočasno odkrijemo in zdravimo okrog 1600 predrakavih sprememb, s tem pa lahko preprečimo, da bi te ženske zbolele za rakom materničnega vratu,” še pravi Ivanuševa.
“Pomembno je, da se ženske v vseh starostnih obdobjih redno udeležujejo ginekoloških pregledov, tudi v času epidemije, saj lahko le na tak način pravočasno odkrijejo morebitne okužbe in preprečijo nadaljnjo širjenje in resnejše zaplete,” je povedala Nina Gaspari, sicer ambasadorka gibanja Gud Vajb.
V okviru Zorinega dneva je Ljubljanski grad osvetljen s turkizno barvo, ki je simbolična barva raka materničnega vratu.
“,”Jaka Verbic Miklic”,1637159520,1637159520,sl,14959,306,14958,43,0,NULL,,”Program Zora obeležuje prvo obletnico začetka globalne strategije za eliminacijo raka materničnega vratu”,program-zora-obelezuje-prvo-obletnico-zacetka-globalne-strategije-za-eliminacijo-raka-maternicnega-vratu,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1642516431,1642516486
857,14961,”Začenja se evropski teden testiranja na okužbo s HIV ter hepatitisa B in C”,”Letošnja kampanja poteka pod geslom Testiraj se. Zdravi. Prepreči.”,”
Ljubljana, 22. novembra – Danes se začenja Evropski teden testiranja na okužbe z virusi HIV, hepatitisa B in C ter na spolno prenosljive okužbe. Letošnja kampanja poteka pod geslom Testiraj se. Zdravi. Prepreči., so sporočili z ministrstva za zdravje.
Komisija za aids pri ministrstvu za zdravje v času zaostrenih epidemioloških razmer poziva tudi k cepljenju proti covidu-19. To namreč lahko omeji širjenje okužb, kar je pogoj za zagotavljanje dostopa do ostalih zdravstvenih storitev.
Predsednica Komisije za aids Mojca Gobec z ministrstva za zdravje je poudarila, da epidemijo covida-19 lahko obvladali z bolj učinkovitim cepljenjem. “Precepljenost prebivalstva je ključna tudi za nemoten dostop do ostalih zdravstvenih storitev, lažje odkrivanje in zdravljenje ostalih bolezni in okužb,” je poudarila.
Okužba z virusom HIV se v Sloveniji prenaša predvsem z nezaščitenimi spolnimi odnosi z okuženimi osebami, ki niso zdravljene. Tveganje je večje predvsem pri moških, ki imajo spolne odnose z moškimi, pri osebah, ki si injicirajo droge, pri osebah s spolno prenosljivimi okužbami ter pri osebah, ki imajo številne spolne partnerje. Najpomembnejša preventiva je varno spolno vedenje, so besede Irene Klavs z Nacionalnega Inštituta za javno zdravje (NIJZ) povzeli v sporočilu za javnost.
Kot je dejal infektolog Janez Tomažič z ljubljanske infekcijske klinike, pravočasno testiranje na okužbo s HIV omogoča tudi bolj uspešno zdravljenje, obenem pa je ključno za preprečevanje nadaljnjih okužb. Osebe, ki se učinkovito zdravijo, ne morejo prenašati okužbe naprej na druge. Nezaznavnost virusa v krvi pomeni, da se virus ne more prenašati na druge osebe, kar velja v javnem življenju kot tudi v zdravstvu.
Okužba z virusom hepatitisa C, ki lahko povzroči odpoved delovanja jeter ali raka na jetrih, pa se prenaša predvsem z okuženo krvjo in krvnimi pripravki. Pogosto se prenaša z menjavo pribora za injiciranje med uživalci drog, pri neprofesionalno izvedenem tetoviranju ali prebadanju kože ali sluznic, lahko tudi pri nezaščitenih spolnih odnosih.
V Sloveniji testiranje na tovrstno okužbo svetujejo vsem, ki so prejeli kri ali krvne pripravke pred letom 1993. Cepiva proti hepatitisu C ni na voljo, obstaja pa učinkovito zdravljenje, ki omogoči odstranitev virusa hepatitisa C iz telesa. V Sloveniji so najbolj tvegana skupina za okužbo injicirajoči uživalci drog, v zadnjih letih pa se pojavljajo izbruhi okužbe tudi med moškimi, ki imajo spolne odnose z moškimi, je povedala infektologinja Mojca Matičič.
Virus hepatitisa B se v razvitem svetu najpogosteje prenaša pri nezaščitenih spolnih odnosih z okuženo osebo ali s souporabo okuženih igel in brizg pri injiciranju drog, lahko pa tudi pri neprofesionalno izvedenem tetoviranju. Možen je tudi prenos z okužene matere na plod oziroma novorojenca. V Sloveniji je od leta 1998 cepljenje proti hepatitisu B vključeno v nacionalni program cepljenja otrok, ki se je sprva izvajalo pred vstopom v šolo, od leta 2020 dalje pa se je priključilo ostalim obveznim cepljenjem v prvem letu starosti. Cepivo daje dolgotrajno zaščito, ki je najverjetneje doživljenjska.
Matičičeva je še spomnila, da so tudi spolno prenosljive okužbe še vedno v porastu povsod po svetu, tudi v Sloveniji, in predstavljajo pomemben zdravstveni problem. Pogosto lahko potekajo brez značilnih bolezenskih znakov, zato okuženi ne poiščejo zdravniške pomoči in okužbe ne zdravijo pravočasno, kar lahko privede do hudih, celo življenje ogrožajočih zapletov.
Vse, ki so se kadarkoli izpostavili tveganju za omenjene okužbe, komisija za aids poziva, da se testirajo. Testiranje na okužbo s HIV ali z virusoma hepatitisa B in C je na voljo tudi pri izbranem zdravniku.
Anonimno brezplačno testiranje na okužbo z virusi HIV ter hepatitisi B in C je dostopno na infekcijski kliniki. Samoplačniško testiranje na okužbo z omenjenimi virusi ter na sifilis poteka na zavodu za transfuzijsko medicino.
Za moške, ki imajo spolne odnose z moškimi, Društvo Legebitra v sodelovanju z Inštitutom za mikrobiologijo in imunologijo Medicinske fakultete Univerze v Ljubljani izvaja testiranje na HIV, virusa hepatitisa B in C ter testiranje na sifilis in gonorejo. Testiranja potekajo v Ljubljani in v desetih drugih krajih po Sloveniji.
“,”Jaka Verbic Miklic”,1637591880,1637591880,sl,14961,306,14960,43,0,NULL,,”Začenja se evropski teden testiranja na okužbo s HIV ter hepatitisa B in C”,zacenja-se-evropski-teden-testiranja-na-okuzbo-s-hiv-ter-hepatitisa-b-in-c,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1642516772,1642516822
858,14963,”Za spinalno mišično atrofijo lahko zbolijo tudi odrasli”,”Spinalna mišična atrofija je genetska progresivna in pogosto terminalna bolezen, ki jo sicer pogosteje povezujemo z otroki, vendar prizadene tudi odrasle.”,”
Ljubljana, 24. novembra – Za spinalno mišično atrofijo lahko zbolijo tudi odrasli. Gre za živčno-mišično bolezen oz. vnetje mišic ali živcev. Prvi simptomi bolezni se kažejo pri hoji, težave so tudi z uporabo rok, možne so tudi težave z dihanjem, je v današnjem spletnem pogovoru v organizaciji STAkluba povedal nevrolog iz ljubljanskega kliničnega centra Blaž Koritnik.
Kot je še dejal Koritnik, predstojnik centra za živčno-mišične bolezni v ljubljanskem kliničnem centru, lahko osebni zdravnik prepozna simptome spinalne mišične atrofije in bolnika napoti k nevrologu.
Večina ljudi sicer za omenjeno boleznijo zboli že v otroštvu. Po Koritnikovih besedah je spinalno mišično atrofijo možno odkriti z genetsko preiskavo vzorca krvi. Genetika je v zadnjih 10 letih odigrala veliko vlogo pri odkrivanju in zdravljenju bolezni, je dejal.
Na vprašanje o tem, kakšna je prihodnost bolnikov s spinalno mišično atrofijo, je Koritnik odgovoril, da so zdravila na voljo in da bo pot do učinkovitega zdravljena krajša, zdravljenje pa ni poceni. Meni tudi, da je treba podpirati raziskovalno delo.
Predsednica Društva distrofikov Slovenije Mateja Toman, ki se prav tako sooča z eno od oblik mišičnih obolenj, je povedala, da imajo starejši bolniki na začetku bolezni težave z opravljanjem dela. Čeprav se ga trudijo opraviti, pa učinki dela padajo. Na društvo se bolniki obračajo z vprašanjem, kako ravnati v odnosu do delodajalcev oz. kako jim pojasniti, zakaj niso več učinkoviti pri delu.
Tomanova je tudi dejala, da društvo svojim članom pomaga z osebno asistenco, svetovanjem in prevozi. Društvo je tudi zaposlovalec, saj se veliko njihovih strokovnih sodelavcev sooča s spinalno mišično atrofijo. Imajo tudi dve invalidski podjetji.
Socialna organizatorka omenjenega društva Tea Černigoj Pušnjak pa je orisala svoj potek bolezni, s katero živi od rojstva. Največ težav ima z dihanjem, kot otrok je prebolela veliko pljučnic, ukrivila se ji je tudi hrbtenica. Zato je potrebovala pomoč staršev, svojcev, med šolanjem pa tudi sošolcev. Naučila se je prilagajati stvari sebi primerno, je poudarila.
Pri zaposlovanju Černigoj Pušnjakova ni imela večjih težav. Kot je dejala, je z informacijsko tehnologijo možno delati od doma in si delo časovno prilagoditi.
Spinalna mišična atrofija je genetska progresivna in pogosto terminalna bolezen, ki jo sicer pogosteje povezujemo z otroki, vendar prizadene tudi odrasle. Poznamo štiri tipe te atrofije. Najpogosteje je diagnosticirana že v zgodnjem otroštvu – to velja za prve tri tipe – pri tipu štiri, ki je redkejši, pa se simptomi začnejo pojavljati v odrasli dobi. Poleg tega da je ta oblika atrofije redka, je tudi napredovanje bolezni počasnejše.
“,”Jaka Verbic Miklic”,1637764920,1637764920,sl,14963,306,14962,43,0,NULL,,”Za spinalno mišično atrofijo lahko zbolijo tudi odrasli”,za-spinalno-misicno-atrofijo-lahko-zbolijo-tudi-odrasli,Post,,1,0,1642517097,1642517778
859,14965,”Na strokovnem srečanju izpostavili pomen zdravstvene pismenosti”,”Predstavili so izsledke raziskave o zdravstveni pismenosti, ki je pokazala, da je skoraj polovica odraslih pri nas omejeno zdravstveno pismenih.”,”
Ljubljana, 25. novembra – Nizka zdravstvena pismenost je močno povezana z višjo zbolevnostjo, umrljivostjo, pogostejšo rabo zdravstvenih storitev in višjimi stroški zdravljenja, je bilo slišati na današnjem strokovnem posvetu. Predstavili so tudi izsledke raziskave o zdravstveni pismenosti, ki je pokazala, da je skoraj polovica odraslih pri nas omejeno zdravstveno pismenih.
Vodja sektorja za preprečevanje bolezni in poškodb na ministrstvu za zdravje Mojca Gobec je v uvodnem nagovoru poudarila, da se je v času negotovosti, povezanih s pandemijo covida-19, še bolj izpostavila potreba po učinkovitem izboljšanju zdravstvene pismenosti ljudi.
“Poznavanje zdravstvenega sistema in razumevanje zdravstvenih informacij je postalo pomembnejše kot kadarkoli prej. Poenotenje informiranja o zdravju in skrbi zanj, je nujno na vseh ravneh političnega in zdravstvenega sistema v državi,” so njene besede povzeli v sporočilu za javnost.
Iskanje zdravstvenih informacij, njihovo razumevanje, ovrednotenje in uporaba pri naših odločitvah, sprejemanje odgovornosti za te odločitve in zaupanje v možnost izboljšanja zdravja ter vedenje o tem, kam, na koga se obrniti v zdravstvenem sistemu, so ključne veščine zdravstvene pismenosti, pa je izpostavil vodja centra za upravljanje programov preventive in krepitve zdravja na Nacionalnem inštitutu za javno zdravje (NIJZ) Rade Pribaković Brinovec.
“Nizka zdravstvena pismenost je močno povezana z višjo zbolevnostjo, umrljivostjo, pogostejšo rabo zdravstvenih storitev in višjimi stroški zdravljenja”, je še opozoril.
Nacionalna raziskava o zdravstveni pismenosti v Sloveniji je pokazala, da je 48 odstotkov odraslih prebivalcev Slovenije omejeno zdravstveno pismenih, in da ima kar 60 odstotkov prebivalcev omejeno navigacijsko zdravstveno pismenost. “Raziskava je prva te vrste pri nas, in predstavlja enega izmed korakov k ukrepom in k nacionalni strategiji za dvig zdravstvene pismenosti,” so izpostavili na ministrstvu.
Rezultati nacionalne raziskave digitalne zdravstvene pismenosti slovenskih študentov pa kažejo, da je raven digitalne zdravstvene pismenosti med slovenskimi študenti precej visoka. Četrtina jih ima težave pri iskanju informacij, ki jih zanimajo, nekoliko višji odstotek, nekaj manj kot 30 odstotkov, jih težko izbira med vsemi informacije, ki jih najdejo. Kar polovica pa jih ima težave pri oceni zanesljivosti informacij. Glede uporabe pridobljenih informacij se po navedbah ministrstva kaže visoka stopnja digitalne zdravstvene pismenosti.
Strokovno srečanje, ki se ga danes prek spleta udeležuje več kot 100 strokovnjakov iz 44 različnih institucij, organizira ministrstvo za zdravje v sodelovanju z NIJZ.
“,”Jaka Verbic Miklic”,1637852040,1637852040,sl,14965,306,14964,43,0,NULL,,”Na strokovnem srečanju izpostavili pomen zdravstvene pismenosti”,na-strokovnem-srecanju-izpostavili-pomen-zdravstvene-pismenosti,Post,,1,0,1642517751,1642517751
860,14967,”Na okrogli mizi poudarili pomen primarnega zdravstva in posvarili pred privatizacijo zdravstva”,”Ambulante družinske medicine so srce zdravstva, saj bolnika poznajo in vodijo skozi daljši čas, je bilo slišati na okrogli mizi o zdravstvenem sistemu po pandemiji covida-19″,”
Ljubljana, 29. novembra – Ambulante družinske medicine so srce zdravstva, saj bolnika poznajo in vodijo skozi daljši čas, je bilo slišati na okrogli mizi o zdravstvenem sistemu po pandemiji covida-19, ki ga je organizirala pisarna evropske poslanke Irene Joveve. Poudarili so pomena primarnega zdravstva in posvarili pred privatizacijo zdravstvenega sistema.
Direktor Zdravstvenega doma (ZD) Kamnik Sašo Rebolj je poudaril, da je prednost javnega zdravstvenega sistema v tem, da je dostopen za vse. Javni zdravstveni sistem ni vezan na izvajanje le komercialno zanimivejših programov, kar je po Reboljevi oceni za posamezne zdravstvene zavode lahko slabo, a hkrati dobro za bolnike. Ob tem je izpostavil skrb, da bi lahko v primeru privatizacije zdravstvenega sistema javni zdravstveni zavodi izvajali zamudne in slabo donosne zdravstvene storitve, zasebni pa storitve, ki so donosnejše.
Po Reboljevi oceni bi morali v primarnem zdravstvenem varstvu prevetriti pričakovanja do posameznih ekip. “Odhodi v zdravstvu niso vezani izključno na plače ampak tudi na delovne pogoje,” je izpostavil Rebolj. Dodal je, da storitve v zdravstvu “niso delo po tekočem traku”. Po Reboljevem mnenju bi bil potreben razmislek in načrtovanje glede vrste in števila kadrov, ki bodo v zdravstvu potrebni v prihodnosti.
V času pandemije se je javni zdravstveni sistem izkazal kot najbolj učinkovit, je ocenila epidemiologinja Nina Pirnat, ki je ob tem izpostavila, da bi bilo treba spremeniti način financiranja zdravstvenih storitev.
Po njenih besedah bi se bilo v primarnem zdravstvenem varstvu treba lotiti organizacije. Opomnila je, da so v zadnjih letih v ambulantah družinske medicine določene kompetence zdravnikov prevzele t. i. referenčne medicinske sestre, a se je ta sprememba ponekod prijela, drugje pa še ne.
Pirnatova ocenjuje tudi, da bi bilo treba pogledati na razmerja med posameznimi zdravniki in se pogovoriti o prilagajanju plačnega sistema v zdravstvu.
Po besedah vodje centra za krepitev zdravja ZD Maribor Nataše Vidnar si medicinske sestre želijo vidnega mesta pri odločanju. Izpostavila je cepljenje proti covidu-19, kjer medicinske sestre naročajo cepiva, vabijo bolnike, organizirajo cepilna mesta in na koncu bolnike tudi cepijo. “Pa je vseeno naša vloga samo izvedbena,” je povedala Vidnarjeva.
Evropska poslanka Irena Joveva (LMŠ/Renew) je opomnila, da je privatizacija pomembna tema, ki razdvaja družbo. Zdravstveni sistemi držav članic Evropske unije se sicer razlikujejo in se delijo na tiste, ki so osnovani na shemah zaposlitvenega zavarovanja, in tiste, ki so financirani s splošno obdavčitvijo. Ne eden ne drugi nista imuna na politične in lobistične pritiske, je poudarila Joveva.
Po njenih besedah se v politični skupini Renew zavzemajo za “odmik od privatizacije” in upe polagajo v Evropsko zdravstveno unijo, za katero upajo, da se bo sčasoma preoblikovala v enoten model zdravstva za vse države članice. Doslej je imela vsaka država članica EU namreč možnost sama oblikovati svoj zdravstveni sistem. Zaradi dogajanja v povezavi s pandemijo covida-19 pa je Joveva izrazila upanje, da se bodo sistemi držav sčasoma poenotili.
“,”Jaka Verbic Miklic”,1638198000,1638198000,sl,14967,306,14966,43,0,NULL,,”Na okrogli mizi poudarili pomen primarnega zdravstva in posvarili pred privatizacijo zdravstva”,na-okrogli-mizi-poudarili-pomen-primarnega-zdravstva-in-posvarili-pred-privatizacijo-zdravstva,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1642518030,1642518626
861,14969,”Raziskovalna skupina s slovenskimi raziskovalci odkrila nove gene, ki povzročajo ALS”,”S temi odkritji se odpirajo nove možnosti iskanja zdravil, ki bi bila usmerjena v raziskavi razkrite biološke procese, so sporočili z IJS.”,”
Ljubljana, 8. decembra – Skupina mednarodnih raziskovalcev, v kateri so sodelovali tudi slovenski znanstveniki, je odkrila nove gene, katerih patološke variante povečajo tveganje za nastanek amiotrofične lateralne skleroze (ALS). S temi odkritji se odpirajo nove možnosti iskanja zdravil, ki bi bila usmerjena v raziskavi razkrite biološke procese, so sporočili z IJS.
Raziskovalci mednarodnega konzorcija Projekta MinE že osem let raziskujejo genetske vzroke ALS. Leta 2016 so poročali o novem genu C21orf2, ki povečuje tveganje za nastanek te bolezni. Te dni pa je skupina raziskovalcev iz 22 držav ponovno odkrila nove gene, katerih patološke variante povečajo tveganje za ALS, so v sporočilu za javnost zapisali na Institutu Jožef Stefan (IJS). Skupno število poznanih genov, ki povečajo tveganje za to bolezen, je zdaj 15.
Rezultati raziskave, v katero je bilo vključenih 29.612 bolnikov z ALS in 122.656 zdravih ljudi v kontrolni skupini, nakazujejo na okvaro pri avtofagiji, ki odstranjuje poškodovane in odvečne proteine, ter na bolezenske poškodbe v transportu, ki ga posredujejo vezikli. Raziskava vzpostavlja tudi vzročno povezavo bolezni z višjim nivojem holesterola.
S temi odkritji se odpirajo nove možnosti iskanja zdravil, ki bi bila usmerjena v raziskavi razkrite biološke procese, so poudarili na IJS.
Raziskavo sta vodila Jan Veldink in Leonard van den Berg z Univerzitetnega kliničnega centra Utrecht na Nizozemskem, kot soavtorji študije pa so sodelovali Boris Rogelj z IJS in Fakultete za kemijo in kemijsko tehnologijo Univerze v Ljubljani, Metka Ravnik-Glavač in Damjan Glavač z Medicinske fakultete Univerze v Ljubljani ter Blaž Koritnik in Janez Zidar z Inštituta za klinično nevrofiziologijo UKC Ljubljana.
ALS oziroma bolezen motoričnega nevrona je hitro napredujoča smrtna nevrodegenerativna bolezen, ki prizadene enega od 350 ljudi. Vzroki za ALS še niso dovolj podrobno znani, kar onemogoča razvoj učinkovitega zdravljenja. Bolniki z ALS so leta 2013 z množičnim financiranjem sprožili veliko akcijo Projekt MinE, da bi raziskovalcem pomagali odkriti genetske vzroke ALS.
Izsledke so raziskovalci predstavili v članku, objavljenem v znanstveni reviji Nature Genetics, ki je dostopen na https://www.nature.com/articles/s41588-021-00973-1.
“,”Jaka Verbic Miklic”,1638976080,1638976080,sl,14969,306,14968,43,0,NULL,,”Raziskovalna skupina s slovenskimi raziskovalci odkrila nove gene, ki povzročajo ALS”,raziskovalna-skupina-s-slovenskimi-raziskovalci-odkrila-nove-gene-ki-povzrocajo-als,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1642518572,1642518572
862,14971,”EU zagnala mrežo centrov za boj proti raku”,”Mreža bo dokončno vzpostavljena do leta 2025, njen cilj pa je do leta 2030 zagotoviti dostop do centrov EU 90 odstotkom upravičenih pacientov.”,”
Bruselj, 13. decembra – Evropska komisija je danes zagnala mrežo centrov EU za boj proti raku, ki je eden od vodilnih ukrepov evropskega načrta za boj proti raku. Mreža bo dokončno vzpostavljena do leta 2025, njen cilj pa je do leta 2030 zagotoviti dostop do centrov EU 90 odstotkom upravičenih pacientov.
Z združevanjem nacionalnih celovitih centrov za boj proti raku in mrež iz vse EU bo zgoraj omenjena mreža EU izboljšala dostop do zagotovljene kakovosti diagnostike in zdravljenja, hkrati pa bo podpirala ukrepe za izboljšano usposabljanje, raziskave in klinična preskušanja po vsej EU, so ob tem sporočili v Bruslju.
“Z evropskim načrtom za boj proti raku smo se zavezali, da bomo izboljšali dostop do visokokakovostne diagnostike, inovativnih zdravljenj in prilagojene oskrbe pacientov po vsej EU,” je ob tem dejala evropska komisarka za zdravje in varnost hrane Stella Kiriakides. Dodala je, da je mreža celovitih centrov za raka v EU del zaveze Evropske komisije za zmanjšanje neenakosti med državami članicami in pomaga spodbujati sodelovanje po vsej EU.
Evropski načrt za boj proti raku je politična zaveza za preobrat v boju proti raku, podlaga za močno evropsko zdravstveno unijo ter varnejšo, bolje pripravljeno in odpornejšo EU, poudarjajo v Bruslju.
V EU so lani raka odkrili pri 2,7 milijona ljudeh. 1,3 milijona jih je zaradi raka umrlo, med njimi več kot 2000 mladih. Ocenjujejo, da se bo v primeru, če ne bo takojšnega odločnega ukrepanju, število rakavih obolenj do leta 2035 povečalo za 24 odstotkov, kar pomeni, da bi rak lahko postal glavni vzrok smrti v EU.
Evropski načrt za boj proti raku bo prejel štiri milijarde evrov sredstev, vključno z 1,25 milijarde evrov iz prihodnjega programa EU za zdravje (EU4Health).
“,”Jaka Verbic Miklic”,1639410180,1639410180,sl,14971,306,14970,43,0,NULL,,”EU zagnala mrežo centrov za boj proti raku”,eu-zagnala-mrezo-centrov-za-boj-proti-raku,Post,,1,0,1642607057,1642607057
863,14973,”Spodbudni rezultati tarčnega zdravljenja kronične limfocitne levkemije”,”Kronična limfocitna levkemija je kronična neozdravljiva bolezen, ki pa poteka zelo različno. Če je potek bolezni pri nekaterih bolnikih zelo hiter in ti niso odzivni na terapijo, pa zato približno tretjina pacientov ne potrebuje zdravljenja in živi normalno.”,”
Ljubljana, 15. decembra – Za diagnosticiranje kronične limfocitne levkemije danes zadošča že analiza krvi, pri zdravljenju pa poleg kemoimunoterapije pride v poštev tudi tarčno zdravljenje, ki se kaže kot čedalje bolj uspešno, je na spletnem izobraževalnem dogodku STAkluba in Slovenskega združenja bolnikov z limfomom in levkemijo (L&L) ocenil zdravnik Matevž Škerget.
Kronična limfocitna levkemija je kronična neozdravljiva bolezen, ki pa poteka zelo različno. Če je potek bolezni pri nekaterih bolnikih zelo hiter in ti niso odzivni na terapijo, pa zato približno tretjina pacientov ne potrebuje zdravljenja in živi normalno, je navedel specialist interne medicine z UKC Maribor Andrej Soršak.
Obstaja sicer neizrazita genetska dovzetnost, k pojavu bolezni prispevajo tudi okoljski dejavniki. V Sloveniji na leto odkrijejo dobrih 100 novih bolnikov, povečini pa gre za bolezen starejših, saj so bolniki ob postavitvi diagnoze v povprečju stari 72 let, je še navedel Soršak.
Bolezenski znaki so povečane, a praviloma neboleče bezgavke, povečana vranica, nepojasnjena in dalj trajajoča vročina, hujšanje in nočno potenje. Bolniki tožijo tudi za utrujenostjo in so bolj dovzetni za različne okužbe.
Po besedah specialista interne medicine in hematologije na UKC Ljubljana Matevža Škergeta bolezen dandanes odkrijejo tudi že povsem naključno že na podlagi analize krvi. Bolnike z diagnozo redno spremljajo, ker pa bolezen napreduje le postopoma ali včasih sploh ne, zgodnje zdravljenje ni smiselno, kar je včasih težko razložiti pacientom.
Za zdravljenje se odločijo v primeru večjih težav, kot so nenormalno hujšanje, izrazito potenje ali poslabšanje krvne slike. Ob poslabšanju bolezni z dodatnimi preiskavami poskušajo ugotoviti, ali gre za bolj prijazno ali pa za manj ugodno obliko. V prvem primeru zdravljenje lahko poteka s kemomunoterapijo, v drugem primeru pa se odločijo za tarčno zdravljenje. Pri slednjemu je treba biti posebej pozoren na sopojave tovrstnega zdravljenja, je opozoril.
Škerget je ob tem izpostavil visoko uspešnost tarčnih zdravil, ki jih uporabljajo šele zadnja leta in katerih učinkovitost šele zdaj dobro ugotavljajo. Tudi pri najbolj neugodnih oblikah bolezni so bolniki, k jih spremljajo, po šestih letih še tu in se zdravijo z istimi zdravili. Če so podatki o preživetju spodbudni, pa se je po njegovih besedah treba tudi zavedati, da bodo pacienti tarčna zdravila jemali dosmrtno.
Soršak je opozoril tudi na pomen zdravega življenjskega sloga in podpornih terapij.
Združenje L&L bolnikom preko podpornega programa Skupaj na poti do zdravja nudi psihološko in drugo podporo, preko spletne platforme Posvetuj.se pa ponujajo tudi individualno svetovanje.
Spregovorila je tudi članica L&L Darinka Vazovec, ki so ji kronično limfocitno levkemijo ugotovili povsem naključno ob sistematskem pregledu pred dvema letoma. Sicer ji bolezen ne povzroča težav, tako da hodi v službo in živi normalno življenje brez omejitev. Kot je dodala, je ne glede na bolezen “na življenje treba gledati pozitivno in živeti normalno življenje, dokler se le da”.
“,”Jaka Verbic Miklic”,1639583220,1639583220,sl,14973,306,14972,43,0,NULL,,”Spodbudni rezultati tarčnega zdravljenja kronične limfocitne levkemije”,spodbudni-rezultati-tarcnega-zdravljenja-kronicne-limfocitne-levkemije,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1642607340,1642607363
864,14975,”Vlada sprejela Državni program obvladovanja raka do leta 2026″,”Trije ključni cilji so upočasniti povečevanje števila novih bolnikov z rakom v državi, povečati preživetje bolnikov z rakom in izboljšati kakovost življenja bolnikov z rakom s krepitvijo celostne rehabilitacije in paliativne oskrbe,”,”
Ljubljana, 23. decembra – Vlada je danes na seji sprejela Državni program obvladovanja raka 2022-2026. Trije ključni cilji so upočasniti povečevanje števila novih bolnikov z rakom v državi, povečati preživetje bolnikov z rakom in izboljšati kakovost življenja bolnikov z rakom s krepitvijo celostne rehabilitacije in paliativne oskrbe, so objavili na spletnih straneh vlade.
Program je usmerjen predvsem v izboljševanje kakovosti obravnave ter izboljševanje kakovosti življenja bolnikov z rakom. Prvi korak za izboljšanje tega področja je oblikovanje smernic diagnostike in zdravljenja, ki morajo biti redno posodobljene in vpeljane v prakso v vseh ustanovah, kjer obravnavajo bolnike z določeno vrsto raka.
Naslednji korak je vzpostavljanje t. i. kliničnih registrov za najpogostejših pet vrst raka (rak dojk, debelega črevesa in danke, prostate, pljučni rak, maligni melanom), kar je bilo sicer zastavljeno že za predhodni program, so zapisali na spletni strani vlade.
Cilj je tudi, da se celostna rehabilitacija in paliativna oskrba vključujeta v obravnavo bolnika že takoj po postavitvi diagnoze. Tako rehabilitacijske kot paliativne storitve potrebujejo boljše povezovanje med različnimi izvajalci v mreži zdravstvene dejavnosti, nekatere kadrovske okrepitve. Cilj pa je predvsem, da je več bolnikov deležnih tovrstne podpore.
Minister za zdravje Janez Poklukar je ob tem povedal, da rak ostaja epidemija sodobnega časa, zato ga veseli, da so kljub izrednim razmeram v zdravstvu in državi uspeli oblikovati program. “V Sloveniji smo lahko ponosni, da imamo že več kot 10 let Državni progam obvladovanja raka, ki z jasno smerjo in cilji celovito povezuje vse dele enega najkompleksnejših sistemov v zdravstvu, ki pa se pomembno povezujejo tudi z razmerami v drugih sektorjih,” je po navedbah v sporočilu dejal na seji.
Tudi skupna področja delovanja ostajajo podobna kot do sedaj. To so primarna in sekundarna preventiva, diagnostika, zdravljenje, celostna rehabilitacija, paliativna oskrba, izobraževanje, raziskovanje in spremljanje bremena raka.
Koordinator programa 2017-2021 Branko Zakotnik je povedal, da so od leta 2010, ko je bil sprejet prvi državni program, uspeli “obrniti trend naraščanja novih primerov raka pri moških, pri ženskah pa smo ga nekoliko umirili, pri čemer imajo veliko zaslugo presejalni programi za raka, ki delujejo na visokem nivoju kakovosti in so med uporabniki dobro sprejeti”. Dejal je, da se izboljšuje tudi preživetje bolnikov z rakom.
S 1. januarjem 2022 upravljanje Državnega programa obvladovanja raka od ministrstva za zdravje prevzema Onkološki inštitut Ljubljana, so še zapisali.
“,”Jaka Verbic Miklic”,1640275140,1640275140,sl,14975,306,14974,43,0,NULL,,”Vlada sprejela Državni program obvladovanja raka do leta 2026″,vlada-sprejela-drzavni-program-obvladovanja-raka-do-leta-2026,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1642608047,1642608048
865,14981,”Na pogovoru STAkluba tokrat o pomenu kliničnih registrov v Sloveniji”,”Zdravstvena stroka in predstavniki zdravstvene zavarovalnice so na današnjem spletnem pogovoru STAkluba govorili o poteh do vzpostavitve kliničnih registrov v Sloveniji in njihovi dodani vrednosti.”,”
Ljubljana, 26. januarja – Številne razvite države imajo za spremljanje zdravstvenega stanja in prikaz osnovnih zdravstvenih kazalnikov vzpostavljen sistem zbiranja podatkov. Zdravstvena stroka in predstavniki zdravstvene zavarovalnice so na današnjem spletnem pogovoru STAkluba govorili o poteh do vzpostavitve kliničnih registrov v Sloveniji in njihovi dodani vrednosti.
Za spremljanje zdravstvenega stanja in prikaz osnovnih zdravstvenih kazalnikov imajo številne razvite države vzpostavljen sistem zbiranja podatkov. V registrih se zbirajo podatki, ki omogočajo spremljanje populacijskih kazalnikov bremena neke bolezni in tudi izidi zdravljenja posameznih bolnikov. Kje je Slovenija na področju takšnih registrov, kakšni so največji izzivi na poti njihove vzpostavitve ter kje stroka vidi njihovo dodano vrednost, so nekatera vprašanja, na katera so sogovorniki iskali odgovore. Na pogovoru so sodelovali:
– prof. dr. Vesna Zadnik, Vodja Epidemiologije in registra raka na Onkološkem inštitutu
– prof dr. Matija Tomšič, predstojnik kliničnega oddelka za revmatologijo, UKC
– prof. dr. Mitja Košnik, Univerzitetna klinika za pljučne bolezni in alergijo Golnik
– Karmen Janša, ZZZS
Zdravstvena stroka v registrih zbira podatke, ki omogočajo spremljanje populacijskih kazalnikov bremena neke bolezni in tudi izidov zdravljenja posameznih bolnikov. Eden takih je državni register Onkološkega inštituta Ljubljana, v katerem zbirajo klinične registre za vse slovenske bolnike z rakom pljuč, dojk, debelega črevesa in danke, prostate, kožnega melanoma in vseh oblike otroških rakavih obolenj.
Kot je povedala vodja registra Vesna Zadnik, gre za enega najstarejših in najbolj kakovostnih zdravstvenih registrov v Sloveniji, saj na onkološkem inštitutu deluje že vse od leta 1950 v njem beležijo podatke o vseh zbolelih za rakom v slovenski populaciji. Bistven namen tega je po njenih besedah razpolaganje s kakovostnimi in ažurnimi podatki o bremenu določene bolezni, z uvajanjem kliničnih registrov zadnja leta pa lahko spremljajo tudi kakovost obravnave onkoloških bolnikov.
“Slednje v onkologiji pripenjamo populacijskim registrom, pri čemer širimo nabor podatkov, zlasti o diagnostiki in zdravljenju bolnikov. V splošnem registru so namreč ti podatki relativno skopi in malo vemo o tem, kako smo diagnosticirali kakšnega raka, kako smo pacienta zdravili. Ti podatki so čedalje bolj pomembni, da vemo, kje lahko kaj izboljšamo,” je pojasnila Zadnikova.
Na kliničnem oddelku za revmatologijo Univerzitetnega kliničnega centra Ljubljana so se po besedah Matije Tomšiča takega zbiranja podatkov lotili veliko pozneje, leta 2006, med glavnimi razlogi pa je bilo pomanjkanje prepričljivih evropskih priporočil o zdravljenju določenih bolezni. Vsaka država in celo vsaka bolnišnica se je načina zdravljenj lotevala po svoje, s prihodom bioloških zdravil pa se je pokazala priložnost za poenotenje zdravljenja bolnikov z isto boleznijo.
“Naša želja je bila, da bi vsem bolnikom ponudili enake preiskave pred začetkom zdravljenja in po uvedbi zdravila izvedli standardiziran način zdravljena,” je pojasnil Tomšič. Dodal je, da morajo zato zdaj revmatologi vpisovati zahtevane podatke v informacijski sistem. Že po šestih mesecih od uvedbe se je izkazalo, da lahko s pomočjo tega registra ugotavljajo učinkovitost razmeroma dragih bioloških zdravil ali morebitni zamenjavi zdravljenja.
V kliniki za pljučne bolezni Golnik so po besedah Mitje Košnika prvi register uredili že pred leti in je bil namenjen bolnikom s tuberkulozo. Pozneje so se lotili še organizacije bolj enostavnih registrov za nekatere redke bolezni, ki so pomembni predvsem v raziskovalne namene. Za slednje so sicer začeli nastajati tudi nacionalni in celo mednarodni registri.
“Na ta način lahko na najbolj optimalen način poenotimo kakovost obravnave bolnikov, hkrati pa gre tudi za bolj racionalno porabo denarja, saj lahko hitro pridemo od prvih podatkov do rezultata in tako hitro optimiziramo način strokovnega dela,” je prednosti uvajanja registrov poudaril Košnik.
Vendar gre v teh primerih po besedah Zadnikove v glavnem za akademske registre, medtem ko tisti na področju onkologije veljajo za sistemske. Za morebitno oblikovanje takega registra so potrebni tudi primerni zakonski temelji, a je trenutni zakon o zbirkah po njenem precej zastarel. Njegova dobra stran je vseeno, da v registre z omenjeno zakonsko osnovo lahko zbirajo podatke o bolnikih ne glede na njihovo morebitno soglasje, saj le tako lahko zagotovijo primerno kakovost podatkov.
Vrednost registrov je prepoznal tudi Zavod za zdravstveno zavarovanje Slovenije. Karmen Janša s področja za analitiko in razvoj na zavarovalnici je poudarila, da so podatki v njih dragoceni, tudi s stroškovnega vidika pa je za njih pomembno, da je ponavadi najbolj optimalna obravnava bolnika tudi najbolj učinkovita ter nenazadnje najcenejša.
“Še posebej, ker so registri ponavadi namenjeni redkim in zahtevnim boleznim, za katere so zdravila običajno izredno draga in je njihova racionalna uporaba še toliko bolj pomembna,” je dodala Janša. Meni tudi, da imamo v Sloveniji tudi zato veliko možnosti, da razmeroma hitro pridemo do najnovejših razpoložljivih zdravil.
Zdravstvena zavarovalnica sicer prispeva nekaj sredstev za vzpostavitev in vzdrževanje registrov v terciarni dejavnosti, a Janša meni, da bi moralo to pokrivati z denarjem iz državnega proračuna, prav tako pa bi registri morali biti bolje centralno in sistemsko urejeni.
“,”Jaka Verbic Miklic”,1643181180,1643181180,sl,14981,306,14980,43,0,NULL,,”Na pogovoru STAkluba tokrat o pomenu kliničnih registrov v Sloveniji”,na-pogovoru-stakluba-tokrat-o-pomenu-klinicnih-registrov-v-sloveniji,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1645082028,1648384107
866,14983,”Na pogovoru STAkluba tokrat o pomenu kliničnih registrov v Sloveniji”,”Zdravstvena stroka in predstavniki zdravstvene zavarovalnice so na današnjem spletnem pogovoru STAkluba govorili o poteh do vzpostavitve kliničnih registrov v Sloveniji in njihovi dodani vrednosti.”,”
Ljubljana, 26. januarja – Številne razvite države imajo za spremljanje zdravstvenega stanja in prikaz osnovnih zdravstvenih kazalnikov vzpostavljen sistem zbiranja podatkov. Zdravstvena stroka in predstavniki zdravstvene zavarovalnice so na današnjem spletnem pogovoru STAkluba govorili o poteh do vzpostavitve kliničnih registrov v Sloveniji in njihovi dodani vrednosti.
Za spremljanje zdravstvenega stanja in prikaz osnovnih zdravstvenih kazalnikov imajo številne razvite države vzpostavljen sistem zbiranja podatkov. V registrih se zbirajo podatki, ki omogočajo spremljanje populacijskih kazalnikov bremena neke bolezni in tudi izidi zdravljenja posameznih bolnikov. Kje je Slovenija na področju takšnih registrov, kakšni so največji izzivi na poti njihove vzpostavitve ter kje stroka vidi njihovo dodano vrednost, so nekatera vprašanja, na katera so sogovorniki iskali odgovore. Na pogovoru so sodelovali:
– prof. dr. Vesna Zadnik, Vodja Epidemiologije in registra raka na Onkološkem inštitutu
– prof dr. Matija Tomšič, predstojnik kliničnega oddelka za revmatologijo, UKC
– prof. dr. Mitja Košnik, Univerzitetna klinika za pljučne bolezni in alergijo Golnik
– Karmen Janša, ZZZS
Zdravstvena stroka v registrih zbira podatke, ki omogočajo spremljanje populacijskih kazalnikov bremena neke bolezni in tudi izidov zdravljenja posameznih bolnikov. Eden takih je državni register Onkološkega inštituta Ljubljana, v katerem zbirajo klinične registre za vse slovenske bolnike z rakom pljuč, dojk, debelega črevesa in danke, prostate, kožnega melanoma in vseh oblike otroških rakavih obolenj.
Kot je povedala vodja registra Vesna Zadnik, gre za enega najstarejših in najbolj kakovostnih zdravstvenih registrov v Sloveniji, saj na onkološkem inštitutu deluje že vse od leta 1950 v njem beležijo podatke o vseh zbolelih za rakom v slovenski populaciji. Bistven namen tega je po njenih besedah razpolaganje s kakovostnimi in ažurnimi podatki o bremenu določene bolezni, z uvajanjem kliničnih registrov zadnja leta pa lahko spremljajo tudi kakovost obravnave onkoloških bolnikov.
“Slednje v onkologiji pripenjamo populacijskim registrom, pri čemer širimo nabor podatkov, zlasti o diagnostiki in zdravljenju bolnikov. V splošnem registru so namreč ti podatki relativno skopi in malo vemo o tem, kako smo diagnosticirali kakšnega raka, kako smo pacienta zdravili. Ti podatki so čedalje bolj pomembni, da vemo, kje lahko kaj izboljšamo,” je pojasnila Zadnikova.
Na kliničnem oddelku za revmatologijo Univerzitetnega kliničnega centra Ljubljana so se po besedah Matije Tomšiča takega zbiranja podatkov lotili veliko pozneje, leta 2006, med glavnimi razlogi pa je bilo pomanjkanje prepričljivih evropskih priporočil o zdravljenju določenih bolezni. Vsaka država in celo vsaka bolnišnica se je načina zdravljenj lotevala po svoje, s prihodom bioloških zdravil pa se je pokazala priložnost za poenotenje zdravljenja bolnikov z isto boleznijo.
“Naša želja je bila, da bi vsem bolnikom ponudili enake preiskave pred začetkom zdravljenja in po uvedbi zdravila izvedli standardiziran način zdravljena,” je pojasnil Tomšič. Dodal je, da morajo zato zdaj revmatologi vpisovati zahtevane podatke v informacijski sistem. Že po šestih mesecih od uvedbe se je izkazalo, da lahko s pomočjo tega registra ugotavljajo učinkovitost razmeroma dragih bioloških zdravil ali morebitni zamenjavi zdravljenja.
V kliniki za pljučne bolezni Golnik so po besedah Mitje Košnika prvi register uredili že pred leti in je bil namenjen bolnikom s tuberkulozo. Pozneje so se lotili še organizacije bolj enostavnih registrov za nekatere redke bolezni, ki so pomembni predvsem v raziskovalne namene. Za slednje so sicer začeli nastajati tudi nacionalni in celo mednarodni registri.
“Na ta način lahko na najbolj optimalen način poenotimo kakovost obravnave bolnikov, hkrati pa gre tudi za bolj racionalno porabo denarja, saj lahko hitro pridemo od prvih podatkov do rezultata in tako hitro optimiziramo način strokovnega dela,” je prednosti uvajanja registrov poudaril Košnik.
Vendar gre v teh primerih po besedah Zadnikove v glavnem za akademske registre, medtem ko tisti na področju onkologije veljajo za sistemske. Za morebitno oblikovanje takega registra so potrebni tudi primerni zakonski temelji, a je trenutni zakon o zbirkah po njenem precej zastarel. Njegova dobra stran je vseeno, da v registre z omenjeno zakonsko osnovo lahko zbirajo podatke o bolnikih ne glede na njihovo morebitno soglasje, saj le tako lahko zagotovijo primerno kakovost podatkov.
Vrednost registrov je prepoznal tudi Zavod za zdravstveno zavarovanje Slovenije. Karmen Janša s področja za analitiko in razvoj na zavarovalnici je poudarila, da so podatki v njih dragoceni, tudi s stroškovnega vidika pa je za njih pomembno, da je ponavadi najbolj optimalna obravnava bolnika tudi najbolj učinkovita ter nenazadnje najcenejša.
“Še posebej, ker so registri ponavadi namenjeni redkim in zahtevnim boleznim, za katere so zdravila običajno izredno draga in je njihova racionalna uporaba še toliko bolj pomembna,” je dodala Janša. Meni tudi, da imamo v Sloveniji tudi zato veliko možnosti, da razmeroma hitro pridemo do najnovejših razpoložljivih zdravil.
Zdravstvena zavarovalnica sicer prispeva nekaj sredstev za vzpostavitev in vzdrževanje registrov v terciarni dejavnosti, a Janša meni, da bi moralo to pokrivati z denarjem iz državnega proračuna, prav tako pa bi registri morali biti bolje centralno in sistemsko urejeni.
“,”Jaka Verbic Miklic”,1643180820,1643180820,sl,14983,306,14982,43,0,NULL,,”Na pogovoru STAkluba tokrat o pomenu kliničnih registrov v Sloveniji”,na-pogovoru-stakluba-tokrat-o-pomenu-klinicnih-registrov-v-sloveniji,Post,”/sites/43/files/images/news/Rare desises/Mic2.jpg”,1,0,1645427281,1645427306
867,14985,”Pot do celostnega zdravljenja tudi v naših rokah”,”V organizaciji STA potekal spletni pogovor”,”
15.2. 2022 je v organizaciji STA potekal spletni pogovor z naslovom: Pot do celostnega zdravljenja tudi v naših rokah. Na dogodku so sodelovali predstavniki društev bolnikov:
Prof. Jože Faganel iz Društva hemofilikov Slovenije
Kristina Modic iz Slovenskega združenja bolnikov z levkemijo in limfomom
Tea Černigoj Pušnjak iz društva distrofikov Slovenije
Ter predstojnik centra za diagnostiko in zdravljenje Fabryeve bolezni v SB Slovenj Gradec, primarij Bojan Vujkovac
“,”Jaka Verbic Miklic”,1644908940,1644908940,sl,14985,306,14984,43,0,NULL,,”Pot do celostnega zdravljenja tudi v naših rokah.”,pot-do-celostnega-zdravljenja-tudi-v-nasih-rokah,Post,”/sites/43/files/images/news/Rare desises/Mic2.jpg”,1,0,1645427765,1645427785
868,15023,”V ZDA pred presaditvijo prašičjega srca v človeka uspešno presadili tudi prašičjo ledvico”,”Dobre obete za prihodnje presaditve predelanih prašičjih organov v človeka pa napoveduje tudi uspešna presaditev prašičje ledvice.”,”
New York, 29. januarja – 57-letnemu Davidu Bennettu, ki so mu kot prvemu uspešno presadili genetsko predelano prašičje srce, gre dobro in je že na fizioterapiji, je sporočila zdravstvena ekipa univerze Baltimore. Dobre obete za prihodnje presaditve predelanih prašičjih organov v človeka pa napoveduje tudi uspešna presaditev prašičje ledvice.
Revija American Journal of Transplantation je objavila članek o presaditvi prašičje ledvice v telo možgansko mrtvega 57-letnega Jima Parsonsa, ki se je ponesrečil z motorjem. Operacija je bila opravljena že lani septembra. Ledvica je brez težav delovala tri dni, nato so Parsonsa odklopili od naprav, ki so ga umetno ohranjale pri življenju.
Zdravnica Jayme Locke z univerze Alabama v Birminghamu je novinarjem povedala, da je šlo za prvega v vrsti tovrstnih eksperimentov s prašičjimi ledvicami.
V ZDA sicer vlada veliko pomanjkanje organov za presaditev. Na presaditev čaka okrog 110.000 ljudi, na leto pa jih med čakanjem umre okrog 6000.
Oktobra lani pa so na newyorški univerzi začasno priključili genetsko predelano prašičjo ledvico na ožilje možgansko mrtvega pacienta in tudi v tem primeru je ledvica delovala.
Vse omenjene organe je genetsko predelalo podjetje iz Virginije Revivicor. Prašičji organi naj bi bili za tovrstne presaditve od vseh živalskih najbolj ustrezni, ker so najbolj podobni človeškim.
Lockejeva je dejala, da je njihova operacija pokazala, da so možgansko mrtva telesa lahko dober model za tovrstne eksperimente, ter dokazala, da lahko krvne žile v prašičji ledvici prenesejo veliko močnejši človeški krvni tlak. V telesu niso odkrili nobenih sledi prašičjih virusov ali celic.
Medtem pa David Bennett iz Baltimora, ki so mu presadili prašičje srce, po besedah zdravnika Muhammada Mohiuddina okreva celo bolje, kot so pričakovali. Tudi dva tedna po operaciji ni nobenih znamenj zavračanja prašičjega srca.
Kirurg Bartley Griffith pa je sporočil, da je že začel fizioterapijo, saj želijo, da bi si dovolj okrepil noge, da bi lahko spet hodil. Za zdaj tega še ne zmore.
Zdravniki so vmes tudi priznali, da je bil pri presajenem srcu uporabljen tudi kokain. Organi včasih med odvzemom iz telesa in pred presaditvijo v drugo telo odpovedo. Prašičje srce so zato namočili v posebno raztopino, v kateri je bil poleg adrenalina tudi kokain, da se ga ohrani pri življenju.
Po svetu so pred omenjenimi primeri opravili že nekaj poskusnih presaditev živalskih organov v človeško telo, vendar pa nobena ni bila uspešna, saj je človeško telo te organe takoj zavrnilo. Genetsko predelani organi prašičev pa veliko obetajo.
V ZDA so lani opravili 3800 presaditev človeškega srca. Ker organov primanjkuje, so poskusi s presajanjem živalskih organov oziroma ksenotransplantacije v polnem teku.
“,”Jaka Verbic Miklic”,1643463120,1643463120,sl,15023,306,15022,43,0,NULL,,”V ZDA pred presaditvijo prašičjega srca v človeka”,v-zda-pred-presaditvijo-prasicjega-srca-v-cloveka,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1648384356,1648384356
869,15025,”Danes zaznamujemo dan brez cigarete”,”Razširjenost kajenja se po podatkih v Sloveniji sicer zmanjšuje, a še vedno kadi vsak četrti odrasli prebivalec.”,”
Ljubljana, 31. januarja – Danes je dan brez cigarete, ki je posvečen opuščanju kajenja. Razširjenost kajenja se po podatkih v Sloveniji sicer zmanjšuje, a še vedno kadi vsak četrti odrasli prebivalec. Kljub temu NIJZ kadilce spodbuja k opustitvi kajenja, saj ta prinese številne koristi za zdravje v vseh starostnih obdobjih, sploh pa v času epidemije covida-19.
Kajenje tobaka škoduje tako rekoč vsem organom v telesu in škodljivo vpliva na zdravje skozi celotno življenje. Predvsem pa je eden od glavnih dejavnikov bolezni dihal, ki vključujejo kronično obstruktivno pljučno bolezen (KOPB) in pljučnega raka, so v sporočilu za javnost zapisali na Nacionalnem inštitutu za javno zdravje (NIJZ).
Kadilci so bolj dovzetni za okužbo z novim koronavirusom in imajo zvišano tveganje za težji potek covida-19. “Aktivni kadilci s covidom-19 imajo tudi večjo verjetnost, da bodo imeli hude zaplete v primerjavi z nekadilci. Povečano tveganje za smrt zaradi covida-19 v bolnišnici so ugotovili tudi pri nekdanjih kadilcih v primerjavi s tistimi, ki niso nikoli kadili,” pa poudarjajo na Univerzitetni kliniki za pljučne bolezni in alergijo Golnik.
Opustitev kajenja prinese številne koristi za zdravje v vsakem starostnem obdobju, v času covida-19 pa pomeni pomembne dodatne koristi za zdravje. Mnogi posamezniki težko prenehajo s kajenjem, še posebej, če poskušajo kajenje opustiti sami, brez pomoči. Vsem kadilcem, ki želijo opustiti kajenje, NIJZ svetuje, da se vključijo v številne brezplačne programe za opuščanje kajenja v Sloveniji.
Na brezplačnem svetovalnem telefonu za opuščanje kajenja 080 27 77 lahko vsakdo pridobi potrebne informacije oziroma se dogovori za pomoč. Telefon deluje vsak dan, tudi med vikendi in prazniki, med 7. in 10. uro ter med 17. in 20. uro.
Svetovanje za opuščanje kajenja je dostopno tudi na forumu Med.Over.Net, na voljo sta brošuri Izzivi opuščanja kajenja in Ne bom več kadil, ne bom več kadila, več informacij lahko kadilci najdejo tudi na spletni strani Skupaj za zdravje.
V lekarnah so na voljo različne oblike nikotinskega nadomestnega zdravljenja (žvečilke, obliži in inhalatorji), ki lahko olajšajo odtegnitvene simptome. Druga zdravila pa lahko na recept predpiše osebni zdravnik.
K brezplačnemu vodenemu skupinskemu opuščanju kajenja ob tej priliki vabi tudi Slovenska zveza za javno zdravje, okolje in tobačno kontrolo.
V Splošni bolnišnici Jesenice bodo danes na stojnici v avli v pritličju stavbe skupaj s študenti Fakultete za zdravstvo Angele Boškin mimoidoče spodbujali k opustitvi kajenja.
“,”Jaka Verbic Miklic”,1643635980,1643635980,sl,15025,306,15024,43,0,NULL,,”Danes zaznamujemo dan brez cigarete”,danes-zaznamujemo-dan-brez-cigarete,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1648384465,1648384933
870,15027,”Pred dnevom boja proti raku o pomenu celovitega obvladovanja bolezni”,”Onkološki inštitut in ministrstvo za zdravje izpostavljata, da je sistematično in dolgoročno zmanjševanje bremena raka mogoče le s celovitim obvladovanjem”,”
Ljubljana, 3. februarja – V petek bomo obeležili svetovni dan boja proti raku. Onkološki inštitut in ministrstvo za zdravje izpostavljata, da je sistematično in dolgoročno zmanjševanje bremena raka mogoče le s celovitim obvladovanjem, ki ga uresničujemo z državnim programom obvladovanja raka. Danes mineva tudi leto dni od predstavitve evropskega načrta s tega področja.
Decembra je vlada sprejela nov državni program obvladovanja raka za obdobje 2022-2026, katerega namen je vsem državljanom zagotavljati enakost v dostopu do kakovostnih zdravstvenih storitev na področju raka na vseh ravneh zdravstvenega sistema. Dokument zavezuje k okrepljeni primarni preventivi, k čim bolj enakim možnostim za zdrave izbire posameznika, s katerimi preprečujemo nastanek raka, k izvajanju dokazano učinkovitih presejalnih programov za raka, k čim zgodnejši diagnostiki raka ter dolgoročno čim boljšim izidom pri celoviti obravnavi raka, vključno s celostno rehabilitacijo in paliativno oskrbo, so v skupni izjavi navedli na Onkološkem inštitutu Ljubljana in ministrstvu za zdravje.
Vsako leto po svetu za rakom na novo zboli 17 milijonov ljudi, 10 milijonov jih umre. V Sloveniji zboli vsako leto 15.000 ljudi. Trenutno je rak v Sloveniji najpogostejši vzrok smrti pri moških in drugi najpogostejši pri ženskah. Več kot tretjino primerov raka je mogoče preprečiti. Drugo tretjino je ob zgodnjem odkritju mogoče pozdraviti.
Minister za zdravje Janez Poklukar je ob tem priznal, da je epidemija covida-19 pustila posledice: “Podatki registra raka kažejo, da smo med epidemijo odkrivali manj novih primerov raka kot pred epidemijo, celoten vpliv pa bomo realno lahko ocenili šele v prihodnjih letih.”
Prav zato je Poklukar izpostavil pomen strateških usmeritev na tem področju. Državni program po njegovih besedah zavezuje k nadaljnji krepitvi primarne preventive. Tako bodo nadaljevali z izvajanjem obstoječih presejalnih programov, nove pa bodo uvajali na podlagi znanstvenih dokazov o njihovi učinkovitosti in smotrnosti.
Prav tako vzpostavljajo klinične registre najpogostejših rakov, ki bodo omogočali spremljanje kakovosti obravnave. Rezultati spremljanja kakovosti bodo podlaga za pripravo predlogov sistemskih sprememb za zagotavljanje najvišje možne kakovostne ravni obravnave bolnikov, z zagotavljanjem celostne rehabilitacije in paliativne oskrbe pa bodo po ministrovih napovedih izboljšali kakovost življenja bolnikov z rakom.
Namestnica koordinatorja državnega programa Sonja Tomšič pa je dodala, da bodo preko državnega programa več pozornosti namenili zlasti nadaljevanju vzpostavljanja oz. krepitvi mreže izvajalcev za področje onkologije v državi, spremljanju in zagotavljanju visoke kakovosti obravnave za vse bolnike ter nadgradnji aktivnosti za boljšo kakovost življenja bolnikov.
Nov državni program dodatno opredeljuje prenovljen in bolj operativen način vodenja programa, ki bo omogočal bolj pregledno, kompetentno in strokovno usmerjanje enega najkompleksnejših področij našega zdravstvenega sistema. Kot je navedla generalna direktorica Onkološkega inštituta Andreja Uštar, v tem trenutku potekajo aktivnosti za prenos koordinacije in upravljanja programa z ministrstva za zdravje na Onkološki inštitut, kjer naj bi se v kratkem začela s tem profesionalno ukvarjati manjša ekipa zaposlenih.
Ob svetovnem dnevu bo društvo Ko-RAK, kjer prav tako izpostavljajo pomen državnega programa in posameznih presejalnih programov, pripravilo konferenco za medije na temo eliminacije raka materničnega vrata in cepljenja proti HPV.
“,”Jaka Verbic Miklic”,1643895360,1643895360,sl,15027,306,15026,43,0,NULL,,”Pred dnevom boja proti raku o pomenu celovitega obvladovanja bolezni”,pred-dnevom-boja-proti-raku-o-pomenu-celovitega-obvladovanja-bolezni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1648384638,1648384881
871,15029,”Lani presadili 105 organov”,”Darovalci so lani darovali 125 organov, v Centru za transplantacijsko dejavnost v UKC Ljubljana pa so presadili 105 organov”,”
Ljubljana, 13. februarja – Darovalci so lani darovali 125 organov, v Centru za transplantacijsko dejavnost v UKC Ljubljana pa so presadili 105 organov, so sporočili iz javnega zavoda za presaditve organov in tkiv Slovenia Transplant. Z 18,5 dejanskega darovalca na milijon prebivalcev se je Slovenija med osmimi državami v regiji Eurotransplant uvrstila na četrto mesto.
Kot kažejo letni podatki o darovanju organov in transplantacijah za leto 2021, so darovalci podarili 60 ledvic, 32 jeter, 18 pljuč, 13 src in dve trebušni slinavki. Lani je umrlo 41 darovalcev, njihova povprečna starost je bila 54 let. V centru za transplantacijsko dejavnost v UKC Ljubljana pa so lani presadili 52 ledvic, 21 jeter, 17 src in 15 pljuč.
V zavodu Slovenija Transplant so zapisali, da je bilo število umrlih darovalcev in transplantacij organov lani nižje kot leto poprej, ocenjujejo pa, da je to dober rezultat glede na ekstremne delovne razmere in preobremenjenost osebja v enotah intenzivne medicine. Zadovoljni so tudi z visokim deležem soglasij svojcev za darovanje, kar kaže, da se zaupanje v sistem darovanja organov ni zamajalo. Zavod je lani opravil 55 pogovorov s svojci umrlih glede darovanja organov, med njimi jih je soglasje za darovanje podalo 84 odstotkov.
Direktor Slovenije Transplant Andrej Gadžijev je poudaril, da bo morala Slovenija v korak s časom tudi na področju posmrtnega darovanja, saj so se na mednarodni ravni v zadnjih 15 letih odvili koreniti premiki. Gadžijev med prioritete svojega mandata med drugim uvršča vpeljavo sistemskih novosti, optimizacijo postopkov odločanja, okrepitev zdravniške ekipe in razširitev donorskega programa. Eden od njegovih ciljev je tudi, da bi z ukrepi in novostmi dosegli stabilen dvig števila umrlih darovalcev.
“Vse to so tudi koraki k povečanju samozadostnosti, saj bi se lahko ob podobnih izrednih dogodkih, kot je epidemija, zgodilo, da bi se meje držav za dalj časa zaprle in bi bilo preživetje bolnikov odvisno izključno od našega lastnega donorskega programa,” je povedal Gadžijev.
V začetku januarja je na presaditev organov čakalo 180 pacientov, od tega 99 za presaditev ledvice, 57 za presaditev srca, 21 za presaditev jeter, šest za presaditev pljuč in štirje za presaditev trebušne slinavke. Na presaditev ledvic se povprečno čaka 300 dni, na presaditev srca 247 dni. Čakalna doba za presaditev jeter je 155 dni in 100 dni za presaditev pljuča.
V nacionalni register opredeljenih oseb glede posmrtnega darovanja se je lani vpisalo 225 več ljudi kot v letu 2020.
“,”Jaka Verbic Miklic”,1644759960,1644759960,sl,15029,306,15028,43,0,NULL,,”Lani presadili 105 organov”,lani-presadili-105-organov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1648385244,1648385244
872,15031,”Začetek sezone alergij na cvetni prah”,”V nižinah je namreč glavna sezona cvetnega prahu leske in jelše, na Primorskem pa lokalno cvetijo ciprese, obremenitev se bo s padavinami znižala, vendar bo v suhem vremenu ponovno visoka.”,”
Ljubljana, 19. februarja – Občutljivi na cvetni prah že občutijo začetek sezone alergij, ki jih ta povzroča. V nižinah je namreč glavna sezona cvetnega prahu leske in jelše, na Primorskem pa lokalno cvetijo ciprese, obremenitev se bo s padavinami znižala, vendar bo v suhem vremenu ponovno visoka.
Alergeni, ki prizadenejo dihala, vstopajo v telo z vdihanim zrakom. Nekateri so prisotni v zraku celo leto, drugi le občasno, takšen je na primer cvetni prah, so pojasnili na Nacionalnem inštitutu za javno zdravje (NIJZ). Bolniki imajo največkrat težave z zgornjimi dihali zaradi alergijskega rinitisa, to je alergijsko vnetje nosne sluznice, ki se mu pogosto pridruži še alergijsko vnetje očesnih veznic in obnosnih sinusov, so še zapisali.
Po napovedi Nacionalnega laboratorija za zdravje, okolje in hrano (NLZOH) lahko zaradi sprememb vremena pričakujemo obremenitev zraka s cvetnim prahom.
Iz koledarja cvetnega prahu NLZOH je razvidno, da smo po nižinah vstopili v drugi del sezone cvetnega prahu leske, obremenitve bodo ob suhem vremenu velike. Sezona jelše je šele v svoji prvi tretjini, obremenitve so zlasti na severozahodu države zelo velike. Cvetenje napreduje tudi v hribovite predele. Cvetni prah sproščajo topoli (trepetlike) in nizko alergene tise, obremenitev bo nizka do srednje visoka.
Kot je za STA pojasnila vodja laboratorija za aerobiologijo pri NLZOH Andreja Kofol Seliger trenutno največ cvetnega prahu v zraku prispevata leska in jelša. Ta cvetni prah vsebuje sorodne alergene brezi, zato lahko imajo tisti, ko so zelo občutljivi že sedaj simptome alergijske bolezni, je opozorila.
Na obalnih območjih so obremenitve jelše in leske odvisne od transporta vetra s celine in lahko občasno dosežejo visoke vrednosti. Sicer pa je sezona cvetnega prahu jelše po besedah Kofol Seligerjeve letos zelo težka. “Ko smo v prejšnjem tednu imeli že prvi maksimum obremenjenosti zraka, in sicer v Prekmurju, v Lendavi, ga je večinoma prispevala jelša. Bilo ga je sedemkrat več kot v lanskem letu,” je dejala.
Leska medtem letos cveti zmerno, v Primorju pa je v zraku prisoten tudi svetni prah cipresovk. Tako se povečuje tudi obremenitev cvetnega prahu arizonske ciprese in lahko občasno doseže zmerne do visoke vrednosti, so tudi napovedali na NLZOH.
V marcu pa lahko po podatkih NLZOH pričakujemo srednjo obremenitev s cvetnim prahom cipresovke in jeseni, visoko z gabrom in zelo visoko z brezo.
“,”Jaka Verbic Miklic”,1645278600,1645278600,sl,15031,306,15030,43,0,NULL,,”Začetek sezone alergij na cvetni prah”,zacetek-sezone-alergij-na-cvetni-prah,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1648385513,1648385513
873,15039,”Z zgodnjim odkrivanjem do manj novih primerov raka debelega črevesa in danke “,”Marec je mednarodni mesec boja proti raku debelega črevesa in danke”,”
Ljubljana, 1. marca – Marec je mednarodni mesec boja proti raku debelega črevesa in danke, namenjen tudi opozarjanju na pomen zgodnjega odkrivanja bolezni. Med novo odkritimi raki v Sloveniji se je od 2007 do 2018 rak debelega črevesa in danke po pogostosti pomaknil z drugega na peto mesto, k čemur pomembno prispeva odkrivanje predrakavih sprememb v programu Svit.
Program Svit je državni program presejanja in zgodnjega odkrivanja predrakavih sprememb in raka na debelem črevesu in danki. Kot so v sporočilu za javnost napisali na Nacionalnem inštitutu za javno zdravje (NIJZ), je cilj programa med navidezno zdravimi osebami odkriti tiste, pri katerih je velika verjetnost, da bi se iz sprememb na steni debelega črevesa ali danke razvil rak, ali že imajo začetno obliko raka, in te spremembe odstraniti.
“Zgodaj odkrito bolezen lahko uspešno zdravimo, z odkritjem predrakavih sprememb pa lahko bolezen celo preprečimo,” so poudarili.
Od leta 2011 v Registru raka RS beležijo občuten padec novih primerov raka debelega črevesa in danke. Podatki za obdobje 2020-2021 kažejo, da je epidemija covida-19 zmanjšala število novih primerov raka in število napotitev na onkološko obravnavo. V programu Svit pa so v letu 2021 zabeležili tudi padec odzivnosti. V tem letu je bila odzivnost 63,35-odstotna, kar je nekoliko manj kot leto prej, ko je bila odzivnost 64,37-odstotna.
“Nižjo odzivnost pripisujemo raznovrstnim vplivom pandemije, kot je pandemična izčrpanost, ki je pričakovan in naraven odziv ljudi na dolgotrajno javnozdravstveno krizo, ki bistveno posega v vsakdan posameznika,” je pojasnila vodja programa Dominika Novak Mlakar.
Aktivnosti programa so v lanskem letu potekale po vnaprej zastavljenem načrtu, in sicer je 314.306 oseb med 50. in 74. letom starosti s centralne enote programa Svit na dom prejelo vabilo, ki vključuje izjavo o prostovoljnem sodelovanju v programu. Če se je oseba odločila za sodelovanje in ni imela izključitvenih kriterijev, je na dom prejela komplet testerjev za odvzem vzorcev blata. “Kljub epidemiji covida-19 je program zagotavljal izvajanje presejanja za ciljno populacijo na najvarnejši možen način,” je ob tem dodala Dominika Novak Mlakar.
Kot so navedli na NIJZ, je bilo v lanskem letu po preliminarnih podatkih med osebami z opravljeno kolonoskopijo odkritih 188 primerov raka debelega črevesa in danke, 2011 oseb je imelo predrakavo spremembo, kar predstavlja večje tveganje za nastanek raka.
V programu Svit je med odkritimi raki sicer do 60 odstotkov rakov odkritih dovolj zgodaj, da onkološkega zdravljenja pacienti ne potrebujejo. Na NIJZ pa so opozorili, da se kljub izjemnim uspehom Programa Svit vabilu v program še vedno vsaka tretja oseba v ciljni starosti ne odzove. “Če se v program odzovemo redno vsaki dve leti, zelo povečamo možnost, da morebitno bolezen pravočasno zaznamo in jo uspešno odstranimo,” so dodali.
“,”Jaka Verbic Miklic”,1646126400,1646126400,sl,15039,306,15038,43,0,NULL,,”Z zgodnjim odkrivanjem do manj novih primerov raka debelega črevesa in danke “,z-zgodnjim-odkrivanjem-do-manj-novih-primerov-raka-debelega-crevesa-in-danke,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1649924540,1649924605
874,15041,”Strokovnjaki: Družba debelosti pogosto ne prepoznava kot bolezen”,”Družba debelosti pogosto ne prepoznava kot bolezen, pač pa kot napačno izbiro življenjskega sloga, so v okviru okrogle mize Debelost je bolezen STAkluba izpostavili strokovnjaki.”,”
Ljubljana, 1. marca – Družba debelosti pogosto ne prepoznava kot bolezen, pač pa kot napačno izbiro življenjskega sloga, so v okviru okrogle mize Debelost je bolezen STAkluba izpostavili strokovnjaki. Poudarili so pomen preventive in celostne obravnave posameznika s prekomerno telesno težo. Posvarili so pred hitrimi metodami hujšanja, ki na dolgi rok niso učinkovite.
Strokovnjaki so opozorili, da lahko debelost, s katero se sooča več okoli 800 milijonov odraslih in otrok po vsem svetu, življenje posameznika skrajša za 10 let in več.
Po besedah endokrinologinje v Univerzitetnem kliničnem centru Ljubljana Mojce Jensterle Sever je bila debelost kot bolezen opredeljena že leta 1997. Kljub temu jo številni bolniki, pa tudi družba ne dojemajo kot bolezen, pač pa kot estetsko motnjo in rezultat življenjskega sloga, je dodala družinska zdravnica v Zdravstvenem domu (ZD) Ljubljana Nena Kopčavar Guček. Številni bolniki zato potrebujejo čas, da se soočijo s postavljeno diagnozo.
Debelost je kronična bolezen, saj je ni mogoče zdraviti v okviru enkratne zdravstvene obravnave, je pojasnila. Prav tako debelost spremljajo številne druge zdravstvene težave, med njimi bolezni kože, okostja in rak. Predsednik Društva za zdravje srca in ožilja Slovenije in zdravnik Matija Cevc je ob tem omenil še sladkorno bolezen in povišan krvni tlak. “Z debelostjo so povezane praktično vse nenalezljive kronične bolezni,” je pojasnil.
Jensterle Severjeva je dodala, da je debelost kronična bolezen, ker se razvija počasi in ker traja do konca življenja. Po njenih besedah lahko zgolj ob presežku 11 kalorij dnevno vsako leto pridobimo pol kilograma telesne teže, kar v 10 letih skupaj pomeni dodatnih pet kilogramov teže.
Poudarila je, da nekateri posamezniki podedujejo nagnjenost k debelosti: “Če jo razvijejo, pa je odvisno od dejavnikov tveganja.” Zato je s preventivo potrebno pričeti že pri otrocih, še posebno pri tistih z večjimi tveganji, katerih starši se soočajo s prekomerno telesno težo.
Cevc je izpostavil različne stopnje debelosti. Stopnje debelosti na enostaven način opredeljuje indeks telesne mase (ITM), je dejala Jensterle Severjeva. Dodatno pa debelost opredeljujejo še z drugimi kazalniki, med njimi z merjenjem obsega pasu.
Kopčavar Gučkova je povedala, da se obravnava bolnika z debelostjo začne na osnovnem nivoju zdravstva, torej v zdravstvenih domovih. Preventivna dejavnost, ki so jo tudi na področju debelosti izvajale medicinske sestre v referenčnih ambulantah, je zaradi prerazporejanja kadra na točke za odvzem brisov na koronavirus, v cepilne centre in covidne ambulante med epidemijo covida-19 zastala. V ZD Ljubljana so preventivno dejavnost po njenih besedah sicer ponovno vzpostavili.
Izpostavila je tudi pomen družinskih zdravnikov, ki imajo pogosto priložnost spoznati več članov iste družine. Tako se velikokrat zgodi, da v procesu hujšanja posameznika sodeluje tudi njegova družina.
Debelost je treba obravnavati multidisciplinarno, je opomnila. Tako bi bilo po njeni oceni v proces hujšanja posameznika smiselno vključiti tudi fizioterapevte in psihologe, saj so posamezniki s prekomerno telesno težo v družbi pogosto še vedno stigmatizirani in se soočajo s slabo samopodobo, depresivnostjo in slabo motivacijo, pa tudi demenco. Spomnila je tudi, da debelost vpliva na težji potek covida-19.
Kot ključno v procesu hujšanja je Cevc izpostavil stalno motivacijo in spodbujanje posameznika, brez strašenja. Opozoril je na reklamiranje sladkih pijač in na nevarnosti reklam, ki obljubljajo hitro izgubo telesne teže. “Shujšati ni problem, problem je vzdrževati telesno težo,” je dodala Kopčavar Gučkova.
Okroglo mizo z naslovom Debelost je bolezen sta v sodelovanju z STA pripravila Slovensko združenje za kronične nenalezljive bolezni in Društvo za zdravje srca in ožilja.
“,”Jaka Verbic Miklic”,1646126640,1646126640,sl,15041,306,15040,43,0,NULL,,”Strokovnjaki: Družba debelosti pogosto ne prepoznava kot bolezen”,strokovnjaki-druzba-debelosti-pogosto-ne-prepoznava-kot-bolezen,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1649924718,1649924718
875,15043,”Ob prihajajočem tednu glavkoma v ospredju ozaveščanje o očesnih boleznih”,”Glavkom je očesna bolezen, ki je zaradi počasnega poteka brez težav za bolnika dobil ime tudi tihi uničevalec vida.”,”
Ljubljana, 3. marca – Letos bomo od 6. do 12. marca obeležili svetovni teden glavkoma. Glavkom je očesna bolezen, ki je zaradi počasnega poteka brez težav za bolnika dobil ime tudi tihi uničevalec vida. Če ga ne odkrijemo dovolj zgodaj, lahko napreduje in povzroči nepovratne okvare na vidnem živcu, kar je brez ustreznega zdravljenja tudi pogost vzrok za slepoto.
Oftalmologinja Barbara Cvenkel iz Univerzitetnega kliničnega centra (UKC) Ljubljana je na današnji novinarski konferenci sekcije za glavkom Združenja oftalmologov Slovenije pojasnila, da je glavkom počasi napredujoča bolezen vidnega živca, ki povzroča odmiranje živčnih vlaken. Zaradi tega se pri osebah z glavkomom pojavijo izpadi v vidnem polju oziroma zamegljen vid, privede pa lahko tudi do slepote. Bolezen ostane pogosto neodkrita bodisi zaradi poteka bolezni brez simptomov bodisi ker je slabši vid zaradi starosti bolnika pripisan drugim boleznim.
Po njenih besedah je najpomembnejši dejavnik tveganja za pojav bolezni povišan očesni tlak, med drugimi pa tudi staranje in dednost glavkoma, lahko pa se ta pojavi tudi pri osebah s statistično normalnim očesnim tlakom. Z znižanjem očesnega tlaka z različnimi načini zdravljenja pa se lahko potek bolezni upočasni ali ustavi.
Po navedbi oftalmologa Tomaža Gračnerja iz UKC Maribor je glavkom v razvitem svetu drugi najpogostejši vzrok za nastanek slepote, s starostjo pa verjetnost za njegov razvoj raste. Bolezen zmanjšuje kakovost življenja bolnikov, ker ti ne vidijo dobro, so občutljivi na svetlobo, imajo težave pri globinskem vidu, pri prehajanju s svetlega na temno in obratno, podaljša se jim čas adaptacije na sprejemanje slike, s tem pa vpliva bolezen tudi na sposobnost vožnje.
Kot je pojasnil Gračner, so bolniki lahko omejeni tudi pri izvajanju poklica, velikokrat pa je poslabšan vid zaradi glavkoma vzrok za invalidsko upokojitev. Ker je zgodnja diagnoza ključna za preprečitev napredovanja bolezni, je priporočen očesni pregled pri slabovidnih okoli 35 leta, pri normalno vidnih pa okoli 40 leta starosti, je povedala Cvenkelova. Po njenih besedah se v primeru prirojenega glavkoma ta lahko pojavi tudi pri otrocih.
Priporoča temeljit pregled vida, saj po njenih besedah samo meritev očesnega tlaka ne zadošča. “Visok očesni tlak je sicer eden od pomembnih dejavnikov tveganja za razvoj glavkoma, ni pa diagnostični kriterij. Poleg meritve očesnega tlaka in mikroskopskega pregleda potrebujemo še dober pregled očesnega ozadja, in če je kaj sumljivega na izgledu živca, tudi preiskavo vidnega polja.”
Cvenkelova je zagotovila, da imamo v Sloveniji dostopne vse najsodobnejše terapije za zdravljenje tudi najbolj zahtevnih oblik glavkoma. Gračner pa je pojasnil, da je zdravljenje mogoče z zdravili, s kapljicami, z lasersko ali kirurško terapijo, hkrati pa je za uspeh potrebno tudi bolnikovo sodelovanje in razumevanje zdravljenja.
“Ker približno 50 odstotkov bolnikov sploh ne ve, da imajo glavkom, ne vemo točno, koliko jih je v Sloveniji. Ocenjujemo, da tudi pri nas približno polovica primerov ostane neodkrita. Na podlagi različnih študij ocenjujemo, da ima v populaciji od 40 do 80 let glavkom približno od 2,5 do 3 odstotke ljudi. Po 80. letu pa se pogostost bolezni zelo poveča, ocenjujemo, da jih je med 8 in 12 odstotkov,” je povedal Gračner.
Po podatkih Svetovnega združenja za glavkom je danes na svetovni ravni okoli 80 milijonov ljudi z glavkomom, zaradi staranja prebivalstva pa naj bi do leta 2030 glavkom imelo več kot 95 milijonov ljudi po vsem svetu.
“,”Jaka Verbic Miklic”,1646299560,1646299560,sl,15043,306,15042,43,0,NULL,,”Ob prihajajočem tednu glavkoma v ospredju ozaveščanje o očesnih boleznih”,ob-prihajajocem-tednu-glavkoma-v-ospredju-ozavescanje-o-ocesnih-boleznih,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1649924858,1649924859
876,15045,”Svetovni dan ledvic letos s sloganom Spoznaj svoje ledvice “,”Cilj letošnje akcije Spoznaj svoje ledvice je aktivno iskanje ledvičnih bolnikov, so sporočili iz slovenjgraške bolnišnice.”,”
Ljubljana, 10. marca – Danes praznujemo svetovni dan ledvic. Cilj letošnje akcije Spoznaj svoje ledvice je aktivno iskanje ledvičnih bolnikov, so sporočili iz slovenjgraške bolnišnice. V Slovenskem nefrološkem društvu ocenjujejo, da ima približno deset odstotkov odraslih kronično ledvično bolezen, 90 odstotkov bolnikov pa niti ne ve, da imajo težave z ledvicami.
Pri kronični ledvični bolezni gre za postopno poslabševanje ledvičnega delovanja in običajno imajo bolniki vrsto let zelo malo vidnih težav, so zapisali na spletni strani svetovnega dneva ledvic. “Največkrat se težave kot so slabše počutje in utrujenost, težave s spanjem, redno nočno odvajanje urina ali otekanje, pojavijo šele zelo pozno, včasih šele tik pred popolno odpovedjo ledvic,” so navedli na spletu.
Tako se v večini primerov zgodi, da je bolezen diagnosticirana pozno, vse prevečkrat tudi prepozno, so še dodali. Zato v Slovenskem nefrološkem društvu opominjajo na pomen preiskav za preverjanje stanja ledvic, še posebej pri osebah, ki imajo povečano tveganje za ledvične bolezni.
Kot navaja spletna stran svetovnega dneva ledvic, je glavni problem bolnikov s kronično ledvično boleznijo pospešeno staranje telesa, ki pogosto privede do prezgodnje smrti ali hudih težav zaradi okvar srca, možganov in drugih organov.
“Na voljo je vedno več zdravil in zdravljenj, ki uspešno upočasnjujejo odpovedovanje ledvic. Daljše delovanje ledvic pa pomeni tudi daljše in bolj kakovostno življenje,” so dodali.
Kot so organizatorji ozaveščevalne akcije še pojasnili na spletu, je poglavitni vzrok za nastanek bolezni nezdrav življenjski slog, kar pomeni, da lahko z zdravim življenjskim slogom v veliki meri preprečimo in preložimo nastanek razvoja ledvičnih bolezni, bolniki pa upočasnijo napredovanje bolezni.
Zato Slovensko nefrološko društvo priporoča redno telesno aktivnost, izogibanje slani hrani in živilom z veliko sladkorja, redno merjenje krvnega tlaka ter obdobno merjenje krvnega sladkorja. Odraslim osebam s sladkorno boleznijo, povišanim krvnim tlakom, srčno-žilnimi boleznimi in debelostjo ter osebam, ki imajo bližnjega sorodnika z ledvično boleznijo, pa svetuje tudi opravljanje laboratorijskih preiskav za preverjanje stanja ledvic.
Svetovni dan ledvic je globalna pobuda, v kateri od začetka leta 2006 sodeluje tudi Slovenija. Kot so zapisali na slovenski spletni strani svetovnega dneva ledvic, že 17. ozaveščevalno akcijo organizirajo Slovensko nefrološko društvo, Zveza društev ledvičnih bolnikov in Sekcija medicinskih sester in zdravstvenih tehnikov v nefrologiji, dializi in transplantaciji. Zaradi epidemije covida-19 pa tudi letos ne bodo organizirali informacijski točk ter izvajali meritev krvnega tlaka in preiskav seča, so še zapisali.
“,”Jaka Verbic Miklic”,1646904540,1646904540,sl,15045,306,15044,43,0,NULL,,”Svetovni dan ledvic letos s sloganom Spoznaj svoje ledvice “,svetovni-dan-ledvic-letos-s-sloganom-spoznaj-svoje-ledvice,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1649925083,1649925083
877,15047,”Ustno zdravje je skrb vsakega posameznika “,”Rezultati nacionalne raziskave o ustnem zdravju prebivalcev Slovenije iz leta 2019 kažejo, da si vsaj dvakrat dnevno čisti zobe le okoli 60 odstotkov otrok, starih do pet let oz. jim pri tem pomagajo starši.”,”
Ljubljana, 18. marca – Pred svetovnim dnem ustnega zdravja so strokovnjaki na novinarski konferenci opozorili, da je ustna higiena skrb vsakega posameznika. Rezultati nacionalne raziskave o ustnem zdravju prebivalcev Slovenije iz leta 2019 kažejo, da si vsaj dvakrat dnevno čisti zobe le okoli 60 odstotkov otrok, starih do pet let oz. jim pri tem pomagajo starši.
Nacionalna raziskava je pokazala tudi, da si 20 odstotkov otrok in mladostnikov, starih med šest in 17 let, zobe čisti največkrat enkrat dnevno ali ne vsak dan. In le 70 odstotkov odraslih (med 18 in 74 let) si zobe ščetka redno, torej vsaj dvakrat na dan, je povedal v. d. predsednika Stomatološke sekcije Slovenskega zdravniškega društva (SZD) Matej Leskošek.
“Žal je pandemija malce obrnila stvari na glavo. Tekmovanje za čiste zobe ob zdravi prehrani, ki pod okriljem Stomatološke sekcije SZD poteka že 36 let na praktično vseh osnovnih šolah in šolah za otroke s posebnimi potrebami, je bilo v času epidemije zaustavljeno. Šolski zobozdravniki zato opažamo padec v ustni higieni naših šolarjev,” je opozoril Leskošek. Poudaril je še, da če bomo našim najmlajšim že od malih nog vcepili redno, pravilno skrb za ustno zdravje, nas v prihodnosti ne rabi pretirano skrbeti za naše oralno zdravje.
Specialistka otroškega in preventivnega zobozdravstva iz Zobne poliklinike Kranj Andreja Krašovec Jeraša je opozorila, da je karies zgodnjega otroštva ena najpogostejših kroničnih bolezni otrok. Karies je pri številnih otrocih prisoten v obliki nesaniranih karioznih lezij, ki imajo velik vpliv na otrokovo življenje.
“Pri veliki večini otrok je karies bolezen, ki jo je ob primerni preventivi mogoče preprečiti,” je poudarila. Otrokom je zato treba ščetkati zobe vsaj dvakrat dnevno, in paziti na prehrano otrok. Svetujejo, da otroci do drugega leta starosti sploh ne bi uživali prostih sladkorjev, torej sladkih pijač in sladkarij.
Vodja delovne skupine Ustno zdravje pri Zdravniški zbornici Slovenije Matej Praprotnik je na novinarski konferenci poudaril, da je dobra ustna higiena tista, ki je prilagojena vsakemu posamezniku, prilagojena našim navadam, razvadam, starosti in bolezenskim stanjem. Opozoril je na pasti dentalnega turizma, sploh večjih posegov v ustih. Posamezniki naj se pred posegom posvetujejo s strokovnjakom, svetuje.
Diana Terlević Dabić iz Stomatološke sekcije SZD je dejala, da v njihovih ambulantah opaža vse več starejših. Starejši, slepi in slabovidni spadajo v skupino ljudi z večjim tveganjem za bolezni zob in ustne votline. Razlogi za to so slabše ročne spretnosti, motnje vida, kar vodi v slabo ustno higieno, nezdrave prehranske navade, pridružene bolezni in uporaba veliko zdravil, katerih stranski učinek so suha usta, in neredno obiskovanje zobozdravnika. “Starejše je treba motivirati za čiščenje zob in tudi protetičnih nadomestkov,” je povedala.
“,,1647596160,1647596160,sl,15047,306,15046,43,0,NULL,,”Ustno zdravje je skrb vsakega posameznika “,ustno-zdravje-je-skrb-vsakega-posameznika,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1649925277,1649925381
878,15049,”S projektom Slovenski genom do zagona personalizirane medicine v Sloveniji “,”Redke bolezni prizadenejo vsakega 2000. prebivalca Slovenije, bolniki pa imajo poleg bolezenskih še vrsto težav z dolgotrajno potjo do pravilne klinične diagnoze.”,”
Ljubljana, 21. marca – Redke bolezni prizadenejo vsakega 2000. prebivalca Slovenije, bolniki pa imajo poleg bolezenskih še vrsto težav z dolgotrajno potjo do pravilne klinične diagnoze. To pot bi lahko občutno skrajšal projekt Slovenski genom, ki bo olajšal genomsko diagnostiko v Sloveniji, saj bo v bazo združil podatke o genetski variabilnosti prebivalcev Slovenije.
Pri bolnikih z redkimi boleznimi od prvih simptomov do končne diagnoze pogosto poteče več kot osem let. V tem času so bolniki pogosto deležni napačnih diagnoz in posledično napačnih zdravljenj, kar še dodatno znižuje kakovost življenja, je na današnji novinarski konferenci o projektu Slovenski genom povedal minister za zdravje Janez Poklukar. Načrt dela za zdravljenje redkih bolezni zato po njegovih besedah vključuje tudi “čimprejšnjo diagnostiko s personalizirano medicino.”
Za hitro genomsko diagnostiko je treba določiti normalne variacije človeškega genoma na področju Slovenije. “Slovenski genom bo izredno olajšal genomsko diagnostiko v Sloveniji, saj bo v skupno evropsko bazo združil podatke o genetski variabilnosti reprezentativnega vzorca zdravih prebivalk in prebivalcev Slovenije. Prav tako pa bo z vključevanjem v evropske genomske mreže dodatno razširil genomsko informacijo, ki bo seveda na voljo tako slovenskim kot evropskim raziskovalcem in diagnostikom oziroma zdravnikom s tega področja,” je ob tem dejal Poklukar.
Vsakdo od nas se od drugega človeka, s katerim ni v sorodstvenem razmerju, gensko razlikuje za tri milijone baz, je ob tem povedala Damjana Rozman z Inštituta za biokemijo in molekularno genetiko. “In znotraj teh treh milijonov baz so verjetno neke takšne spremembe, ki so pogostejše v slovenski populaciji in so čisto normalne. Če mi to enkrat poznamo, potem bomo lažje videli, katere spremembe so tiste, ki pa dejansko predisponirajo za neko redko bolezen,” je pojasnila.
Predstojnik kliničnega oddelka za endokrinologijo, diabetes in presnovne bolezni Pediatrične klinike Univerzitetnega kliničnega centra (UKC) Ljubljana Tadej Battelino, ki je vodilni slovenski strokovnjak na tem področju, je ob tem poudaril, da se je medicina, ko pridemo do genetike, močno razvila. “Danes zdravnik sam ne more storiti ničesar. Zdravnik potrebuje inženirje kemije, inženirje biologije, inženirje računalniške tehnologije, matematike, da pravzaprav lahko pridobi ključne podatke za to, da lahko obravnava bolne ljudi. In če želimo skrajšati pot do diagnoze potrebujemo slovenski genom zdravih ljudi,” je pojasnil.
Ob tem je Battelino povabil vse prebivalce Slovenije, ki so zdravi in nimajo redke genetske bolezni, da se pridružijo projektu. Darovanje genomske informacije pomaga pri postavljanju diagnoze za tiste bolnike, ki so podedovali eno izmed redkih bolezni. “Gre za neko humanistično noto tega projekta. Tisti, ki imamo več sreče, s tem, da damo na razpolago v povsem anonimni obliki podatke o svojem genomu, pomagamo tistim, ki imajo nekaj manj sreče,” je dodal.
“Že v nekaj letih bomo marsikatero bolezen, ki je še danes neozdravljiva, lahko pozdravili. Zato mislim, da je zelo dobro, da imamo podatke o normalnem genomu,” pa je povedal strokovni direktor Pediatrične klinike UKC Ljubljana Marko Pokorn. “Tudi sam sem zavihal rokav in dal svoj vzorec, ker je dobro, da imamo za lokalno populacijo nek normalen genom,” je dodal.
Za darovanje genomske informacije se je mogoče prijaviti na elektronskem naslovu redke.bolezni@kclj.si. Izbrani kandidati morajo najprej podpisati pisno soglasje, nato jim odvzamejo manjšo količino krvi, vzorec pa pošljejo v laboratorij na sekvenciranje. “To soglasje omogoča, da ima tudi tisti, ki je dal svoj genom, nekaj od tega. Če namreč kadarkoli hudo zboli, lahko njegovi sorodniki zahtevajo pristop do tega genoma in se izvede postopek za personalizirano medicino,” je ob tem še pojasnil Battelino, ki poudarja, da je vsaka genomska informacija strogo anonimizirana.
“,”Jaka Verbic Miklic”,1647855420,1647855420,sl,15049,306,15048,43,0,NULL,,”S projektom Slovenski genom do zagona personalizirane medicine v Sloveniji “,s-projektom-slovenski-genom-do-zagona-personalizirane-medicine-v-sloveniji,Post,,1,0,1649925519,1649925519
879,15055,”Dolgo življenje za vse”,”Okrogla miza”,”
19.4. 2022 je STA klub organiziral okroglo mizo z naslovom: “Dolgo življenje za vse”. To je tudi slogan letošnjega svetovnega tedna imunizacije, ki bo potekla od 24.-30. aprila in je namenjen spodbujanju uporabe cepiv za zaščito ljudi vseh starosti pred različnimi boleznimi.
Kako na zaščito celotne populacije vpliva nižanje precepljenosti, vedno številčnejše migracije in kako poteka osveščanje o pomenu cepljenja, so spregovorili:
– Miroslava Cajnkar Kac, dr. med, specialistka šolske medicine, ZD Slovenj Gradec
– Prim. doc. dr. Alenka Trop Skaza, Nacionalni inštitut za javno zdravje
– doc. dr. Marko Pokorn, strokovni direktor Pediatrične klinike, UKC Ljubljana
– Denis Baš, dr. med., specialist pediater, ZD Kamnik
Posnetek je na voljo tukaj: https://youtu.be/rDWDxLfaYGE
“,”Jaka Verbic Miklic”,1650811620,1650811620,sl,15055,306,15054,43,0,NULL,,”Dolgo življenje za vse”,dolgo-zivljenje-za-vse,Post,”/sites/43/files/images/news/Rare desises/Mic2.jpg”,1,0,1650811693,1650811805
880,15059,”Z dobrodelnim tekom Hop na Grad do naprave za lažje zaznavanje duševnih težav otrok “,”Ljubljanska pediatrična klinika bo s pomočjo donacij v okviru dobrodelnega teka Hop na Grad bogatejša za napravo biofeedback”,”
Ljubljana, 23. marca – Ljubljanska pediatrična klinika bo s pomočjo donacij v okviru dobrodelnega teka Hop na Grad bogatejša za napravo biofeedback, ki bo v pomoč pri zdravljenju otrok z duševnimi težavami. S pomočjo te naprave bodo namreč njihove težave lažje in prej zaznali, zato bo zdravljenje uspešnejše, so povedali na današnji predstavitvi teka, ki bo 10. aprila.
Epidemija covida-19 in potem še vojna v Ukrajini sta pustili posledice na duševnem zdravju premnogih otrok. Njihove stiske so velike. Tokratni četrti dobrodelni tek Hop na Grad bo zato namenjen zbiranju denarja za nakup naprave biofeedback, ki je v pomoč pri zdravljenju otrok z duševnimi težavami. Naprava namreč nudi nove možnosti, kako izboljšati zaznavo lastnega telesa in nadzor nad njim ter s tem boljše obvladovanje telesnih simptomov in lastnega počutja.
S tem bodo na Pediatrični kliniki Univerzitetnega kliničnega centra Ljubljana lahko pomagali otrokom, ki imajo težave na področju duševna zdravja, ki so v času epidemije v porastu. S tem bo tudi zdravljenje uspešnejše, so ob predstavitvi izpostavili pobudniki akcije pediatri Damjan Osredkar, Nina Battelino in David Gosar.
“Z dobrodelnim tekom tudi spodbujamo zdrav način življenja in povezujemo ljudi, ki želijo vračati v skupnost, iz katere izhajajo,” je poudaril predstojnik kliničnega oddelka za otroško, mladostniško in razvojno nevrologijo Osredkar. Tek po njegovih besedah s pomočjo športnikov in donatorjev organizirajo tekaški zanesenjaki, ki so zaposleni na kliniki. Leta 2019 je teklo že 200 tekačev vseh starosti, na četrtem Hop na Grad pa jih bo teklo še več, je prepričan.
Tek je sicer organiziran tako, da Timing Ljubljana meri čas na dveh daljših tekih (dva in šest kilometrov), podarjeni bodo tudi pokali za prva tri mesta v vsaki kategoriji. Za mlajše otroke pa so organizirali teke na 200, 400 in 600 metrov.
Gosar z oddelka za otroško, mladostniško in razvojno nevrologijo je izpostavil, da so težave na področju duševnega zdravja v času epidemije pri otrocih v porastu, še posebej tesnoba in depresija. Glede otrok iz Ukrajine je povedal, da so odprti za otroke, ki bodo potrebovali zdravniško pomoč, stroške zdravljenja bo prevzela država.
Nina Battelino z oddelka za nefrologijo je spomnila, da so z dosedanjimi dobrodelnimi teki Hop na Grad zbrali denar za nakup dveh naprav za kontinuirano spremljanje srčno-dihalne funkcije pri dojenčkih, napravo za merjenje zgradbe telesa za nefrološki oddelek in sondo za ultrazvočni aparat in otroški endoskop.
“,”Jaka Verbic Miklic”,1648056000,1648056000,sl,15059,306,15058,43,0,NULL,,”Z dobrodelnim tekom Hop na Grad do naprave za lažje zaznavanje duševnih težav otrok “,z-dobrodelnim-tekom-hop-na-grad-do-naprave-za-lazje-zaznavanje-dusevnih-tezav-otrok,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1651681311,1651681311
881,15063,”Strokovnjaki: Za preprečevanje ateroskleroze ključna preventiva “,”Srčno-žilne bolezni, med katere spada tudi ateroskleroza, v Sloveniji vsako leto povzročijo kar 38 odstotkov vseh smrti”,”
Ljubljana, 30. marca – Srčno-žilne bolezni, med katere spada tudi ateroskleroza, v Sloveniji vsako leto povzročijo kar 38 odstotkov vseh smrti. V primeru ateroskleroze je ključnega pomena diagnostika in preventiva, za katero je v veliki meri odgovoren bolnik sam, so na novinarski konferenci v Ljubljani izpostavili strokovnjaki.
Strokovnjaki so opozorili, da je osnovni vzrok bolezni srca in ožilja prav ateroskleroza, ki povzroča postopno oženje arterij. Osnova ateroskleroze je okvara notranje plasti žile, ki ji sledi kopičenje maščobnih celic, razraščanje veziva in druge spremembe v žilni steni, ki privedejo do zoženja arterije, kar lahko privede do tromboze, možganske kapi in srčne kapi.
Velja za resno bolezen, ki pa običajno v začetnih oblikah ne kaže simptomov. V enem od šestih primerov pride do nenadne smrti, ne da bi bili prej prisotni bolezenski znaki. Dejavniki tveganja so med drugimi nezdrave ravni holesterola v krvi, visok krvni tlak, kajenje, nezdrava prehrana, pomanjkanje telesne aktivnosti in drugi, na katere težje vplivamo, kot je starost, so še pojasnili strokovnjaki.
Po besedah strokovnega direktorja Interne klinike UKC Ljubljana in predsednika Združenja kardiologov Slovenije Zlatka Frasa je razlog, da so srčno žilne bolezni v Sloveniji še vedno vodilni vzrok smrtnosti dejstvo, da je za obvladovanje bolezni in zmanjšanje tveganja pogosto potreben popoln zasuk v življenjskem slogu, kar je precej težko doseči. V Sloveniji smo se tega lotili sistematično in s tem v letu 2009 dosegli, da srčno žilne bolezni za moške niso več glavni vzrok smrti, je pojasnil.
Strokovnjaki so pri tem poudarili pomen primarne preventive, ki je usmerjena v preprečevanje napredovanja in pojava zapletov ateroskleroze pri bolnikih brez težav in sekundarne preventive, ki vključuje vseživljenjsko rehabilitacijo za bolnike z že znanimi težavami, povezanimi z boleznijo. Za spremembo svojega življenjskega sloga, ki ga zahtevata tako primarna kot tudi sekundarna preventiva, pa je predvsem odgovoren bolnik sam, so še poudarili.
Vodja posvetovalnice za srce pri Društvu za zdravje srca in ožilja Slovenije Jasna J. Petrovčič je poudarila pomen posvetovalnice, kjer velik poudarek dajejo zdravstveni vzgoji in redni telesni aktivnosti. Prav tako je pomembna zadostna hidracija, zdrava prehrana, ustrezna telesna teža in obseg pasu, zdravo uživanje alkohola, spanje, poznavanje lastnega zdravstvenega stanja, je še poudarila. Z vsemi temi ukrepi se lahko namreč tveganje za slabšanje ali razvoj bolezni občutno zmanjša.
V primarni in sekundarni preventivi je ključno, da s človekom stopimo v stik in se odzovemo s sočutjem in ne s kritiko, je še izpostavila. Predsednik Zveze koronarnih društev in klubov Slovenije Janez Poles je povedal, da se je bolniku treba približati, mu prisluhniti, da bo stopil na pot zdravja. Pomembno je na preprost način informirati tudi splošno populacijo in o bolezni ozavestiti mlade družine, da bodo z vzgojo na pravo pot usmerile svoje otroke, je še izpostavil.
“,”Jaka Verbic Miklic”,1648657500,1648657500,sl,15063,306,15062,43,0,NULL,,”Strokovnjaki: Za preprečevanje ateroskleroze ključna preventiva “,strokovnjaki-za-preprecevanje-ateroskleroze-kljucna-preventiva,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1651681601,1651681601
882,15065,”Odličji zdravniške zbornice za življenjsko delo Igorju Švabu in Dušanu Grošlju “,”Zdravniška zbornica Slovenije bo zvečer podelila zbornična odličja za leto 2020 in 2021.”,”
Ljubljana, 30. marca – Zdravniška zbornica Slovenije bo zvečer podelila zbornična odličja za leto 2020 in 2021. Hipokratovi priznanji, odličji za življenjsko delo bosta prejela Igor Švab in Dušan Grošelj. Častni član bo med drugimi postal direktor NIJZ Milan Krek. Osrednji govornik bo minister za zdravje Janez Poklukar.
Odličja, zahvale in častne nazive zdravniške zbornice za leto 2020 in 2021 bo prejelo 16 zdravnikov in zobozdravnikov. Med njimi bosta podeljeni dve Hipokratovi priznanji, najvišji odličji za življenjsko delo.
Švab je med nagrajenci za leto 2020. Odličje za življenjsko delo bo prejel za “izjemno strokovno, organizacijsko in stanovsko delo na področju uveljavitve družinske medicine v Sloveniji in tujini ter bistven prispevek k ugledu slovenskega zdravništva”. Je namreč eden vodilnih svetovnih strokovnjakov na področju družinske medicine, ustanovitelj katedre za družinsko medicino Univerze v Ljubljani ter član Evropske akademije znanosti in umetnosti.
Je predstojnik katedre za družinsko medicino na medicinski fakulteti Ljubljana in dekan omenjene fakultete. “V zadnjem desetletju je s svojim strokovnim, pedagoško-znanstvenim in ekspertnim delom izjemno prispeval k promociji in prepoznavnosti slovenske medicine in Slovenije v Evropi in svetu,” je zapisano v obrazložitvi.
Grošelj je med nagrajenci za leto 2021. Odličje za življenjsko delo bo prejel “za izjemen prispevek k ugledu in razvoju slovenskega zdravništva in zobozdravništva ter predano mentorsko delo”. Po uspešno končanem študiju se je zaposlil v Zdravstvenem domu Bežigrad, nato pa deloval kot klinični zobozdravnik v Centru za zobne bolezni stomatološke klinike univerzitetno-kliničnega centra. Pozneje je je deloval kot asistent za predmet Ustne bolezni in parodontologija na odseku za stomatologijo medicinske fakultete v Ljubljani in doktoriral leta 1991.
Je aktiven član številnih slovenskih in mednarodnih organizacij in društev. Sodeloval je v več raziskovalnih projektih in bil mentor nekaterim specializantom s področja zobnih, ustnih bolezni in parodontologije.
Na slovesnosti bodo podelili tudi nekaj nazivov častni člani zbornice. Med drugimi bo častni član postal direktor Nacionalnega inštituta za javno zdravje (NIJZ) Krek. Naziv bo prejel “za izjemno javnozdravstveno delovanje, dosežke na področju organizacije zdravstva in obravnave rabe nedovoljenih drog ter še posebej za delovanje v času pandemije covida-19”, je zapisano v obrazložitvi.
“,”Jaka Verbic Miklic”,1648657620,1648657620,sl,15065,306,15064,43,0,NULL,,”Odličji zdravniške zbornice za življenjsko delo Igorju Švabu in Dušanu Grošlju “,odlicji-zdravniske-zbornice-za-zivljenjsko-delo-igorju-svabu-in-dusanu-groslju,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1651681701,1651681701
883,15067,”Danes obeležujemo svetovni dan zavedanja o avtizmu “,”Ob tem Zveza nevladnih organizacij za avtizem Slovenije v poslanici izpostavlja področja, ki jih je treba urediti.”,”
Ljubljana, 2. aprila – Danes zaznamujemo svetovni dan zavedanja o avtizmu. Ob tem Zveza nevladnih organizacij za avtizem Slovenije v poslanici izpostavlja področja, ki jih je treba urediti. Med drugim je treba osebam z avtizmom zagotoviti redne terapije. Varuh Peter Svetina pa je opozoril na pomanjkanje sistemskih rešitev in potrebo po multidisciplinarnosti.
V zvezi so v poslanici med drugim navedli razloge, zakaj še vedno potrebujemo dan zavedanja o avtizmu. “Znašli smo se v obdobju, ko nič več ni kot je bilo, ali skoraj nič več ni kot je bilo. A avtizem in z njim povezani izzivi so še vedno med nami,” so navedli. Če je bila preteklo leto pozornost odločevalcev usmerjena v epidemijo, pa je zdaj usmerjena v bližajoče se volitve in v vojno v naši bližini.
Ob teh na videz tako pomembnih temah odločevalci brez osebne izkušnje z avtizmom po navedbah zveze prepogosto pozabijo na vse izzive, ki jih avtizem prinese v življenja oseb z avtizmom in njihovih družin, pa tudi v vrtce in šole, kamor so otroci in mladostniki vključeni.
Varuh človekovih pravic Peter Svetina pa je opozoril na pomanjkanje sistemskih rešitev za osebe z avtizmom. Pristojne je pozval, naj prepočasne korake pri skrbi za osebe s spektroavtistično motnjo (SAM) pospešijo in se skrbi zanje že končno lotijo sistemsko ter multidisciplinarno.
Kot je dejal, bi s tem namreč omogočili povečanje števila strokovnjakov za delo z avtisti in uredili dostopnost rednih obravnav in potrebnih terapij. Po njegovem mnenju je nujna tudi vzpostavitev celostne timske obravnave posameznika ter pomoči družini.
Ob dnevu zavedanja o avtizmu so v zvezi pripravili več akcij. Med drugim bodo v sodelovanju z lokalnimi skupnostmi nekatere zgradbe osvetljene v modro. V sklopu projekta Avtizem SAM bodo popoldne izvedli spletno tržnico, na kateri bodo starše, družine in odrasle z avtizmom ter laično javnosti seznanili o projektu in drugih aktivnostih zveze, družinam in strokovnim delavcem pa bodo predstavili možnosti obravnave osebe z avtizmom.
Avtizem je razvojna motnja z največjim primanjkljajem na področju socialne komunikacije in interakcije ter z izrazito stereotipnostjo in nefleksibilnostjo na področju dejavnosti in interesov. Pogostnost avtizma je v zadnjih dveh desetletjih narasla za več desetkrat, kar jo uvršča med najhitreje naraščajočo razvojno motnjo. Zajema že več kot en odstotek populacije, v Sloveniji pa je glede na te podatke 20.000 oseb z motnjo avtističnega spektra (MAS).
Generalna skupščina ZN je leta 2008 2. april razglasila za svetovni dan zavedanja o avtizmu z namenom spodbujanja k boljšemu razumevanju te motnje.
“,”Jaka Verbic Miklic”,1648916940,1648916940,sl,15067,306,15066,43,0,NULL,,”Danes obeležujemo svetovni dan zavedanja o avtizmu “,danes-obelezujemo-svetovni-dan-zavedanja-o-avtizmu,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1651681860,1651681860
884,15069,”Ob svetovnem dnevu zdravja pozivi k skrbi za lastno zdravje “,” V četrtek obeležujemo svetovni dan zdravja, ki bo letos potekal pod geslom Naš planet, naše zdravje.”,”
Ljubljana/Nova Gorica/Jesenice/Velenje, 5. aprila – V četrtek obeležujemo svetovni dan zdravja, ki bo letos potekal pod geslom Naš planet, naše zdravje. Ob tem različne zdravstvene organizacije ljudem svetujejo preventivno skrb za lastno zdravje, pa tudi skrb za zdravje planeta, saj lahko onesnaženost planeta vpliva tudi na slabšo kakovost zdravja ljudi.
Svetovna zdravstvena organizacija (WHO) po navedbah Zbornice zdravstvene in babiške nege Slovenije ob pandemiji covida-19, vse večji onesnaženosti planeta in vse pogostejših boleznih, kot so rak, astma in bolezni srca, opozarja na nujne ukrepe za ohranjanje zdravja ljudi in planeta in spodbuja gibanja za oblikovanje družb, osredotočenih na blaginjo vseh.
Prizadevanja WHO podpirajo tudi v zbornici. Kot so zapisali v sporočilu za javnost, imajo medicinske sestre ključno vlogo pri sooblikovanju in izvajanju rešitev na področju zdravja planeta.
“Vključiti nas je treba v politiko načrtovanja in odločanja o ekološki preobrazbi delovnih mest in procesov v zdravstvu ter digitalizacijo zdravstvenega sistema, katere cilj je tudi brezpapirnata zdravstvena nega,” je po navedbah zbornice ob tem poudarila predsednica zbornice Monika Ažman.
Po podatkih WHO zaradi okoljskih vzrokov letno umre več kot 13 milijonov ljudi, več kot 90 odstotkov svetovnega prebivalstva diha onesnažen zrak, na zdravje pa vplivajo tudi ekstremni vremenski pojavi, ki ljudi silijo k selitvam.
Rdeči križ z brezplačnimi meritvami krvnega tlaka ter sladkorja in holesterola v krvi
Na Rdečem križu Slovenije ob dnevu zdravja opozarjajo na povečano umrljivost, ki jo že nekaj let beležimo v Sloveniji in drugje v razvitem svetu, in je posledica srčno-žilnih bolezni.
Med najpogostejšimi dejavniki tveganja za nastanek bolezni srca in ožilja navajajo zvišan krvni tlak, zvišan holesterol in zvišan krvni sladkor, zato pri Rdečem križu ob letošnjem dnevu zdravja v tem tednu pripravljajo akcijo meritev krvnega tlaka ter sladkorja in holesterola v krvi.
Brezplačne meritve bodo skupaj z območnimi združenji in krajevnimi organizacijami Rdečega križa izvajali na več kot 40 lokacijah po Sloveniji.
Ob tem poudarjajo, da povišan holesterol v krvi predstavlja tveganje za zdravje in je glavni vzrok za nastanek ateroskleroze, ki povečuje tveganje za nastanek koronarne srčne bolezni, možganske kapi in srčnega infarkta.
Sprememba v krvnem tlaku pomeni spremembo v pretoku krvi, ki je bistven za normalno preskrbo organov s kisikom in hranilnimi snovmi. Skrbno nadzorovanje vrednosti krvnega sladkorja pa lahko upočasni razvoj in napredovanje sladkorne bolezni.
K preventivi pozivajo tudi v lekarnah
V Lekarniški zbornici Slovenije ugotavljajo, da ljudje vse bolj razmišljajo o ohranjanju zdravja in preventivnih ukrepih. Svetovni dan zdravja je priložnost, da izpostavimo, da je preprečevanje bolezni lažje kot zdravljenje, so zapisali v sporočilu za javnost.
Ljudem ob tem svetujejo, naj si v svoji lekarni izmerijo krvni tlak, krvni sladkor, se stehtajo in s farmacevtom pogovorijo, kako preprečiti morebitne zdravstvene težave. “Veliko pa lahko za zdravje naredite sami, in sicer z redno telesno dejavnostjo, izogibanjem daljšemu sedenju ter skrbjo za ustrezno telesno težo,” so poudarili in pozvali tudi k pravilni uporabi zdravil. Kot so pojasnili, moramo biti previdni, da ne uporabljamo zdravil, ki jim je pretekel rok uporabe.
V raziskavi večina ocenila, da epidemija covida-19 ni vplivala na njihovo duševno zdravje
Po podatkih lanskoletne raziskave Statističnega urada RS (Surs) 53 odstotkov vprašanih meni, da epidemija covida-19 v letu 2021 ni imela nobenega vpliva na njihovo duševno zdravje. 43 odstotkov jih je odgovorilo, da je nanje vplivala negativno, štirje odstotki vprašanih pa so odgovorili, da je imela pozitiven vpliv na njihovo duševno zdravje.
Da je epidemija negativno vplivala na njihovo duševno zdravje, so po navedbah Sursa večinoma navajale ženske. Negativno oceno so najpogosteje podale osebe v starostni skupini 16-24 let.
Ob dnevu zdravja številne aktivnosti v lokalnih okoljih
V Novi Gorici v tem tednu na različnih lokacijah potekajo aktivnosti Festivala Zdravje 2022. Festival bodo sklenili v petek na pasaži med Trgovsko hišo in spomenikom Edvarda Rusjana, kjer bodo predstavili vzgojno-izobraževalne vsebine in svetovanja, ki so lahko v pomoč pri skrbi za lastno zdravje, so sporočili z Nacionalnega inštituta za javno zdravje.
V Splošni bolnišnici Jesenice bodo v četrtek skupaj s študenti Fakultete za zdravstvo Angele Boškin in dijaki Srednje šole Jesenice na stojnico pred bolnišnico med 10. in 12. uro ozaveščali o pomenu skrbi za zdravje s poudarkom na preventivi.
V Velenju bodo v četrtek med 9. in 14. uro na Titovem trgu organizirali prireditev Mesto zdravja, v okviru katere se bodo predstavile različne zdravstvene organizacije. V okviru prireditev bo potekala skupinska vadba, aktivne delavnice za osnovnošolce ter strokovni posvet Hoji prijazno mesto za zdravje ljudi in planeta.
“,”Jaka Verbic Miklic”,1649176260,1649176260,sl,15069,306,15068,43,0,NULL,,”Ob svetovnem dnevu zdravja pozivi k skrbi za lastno zdravje “,ob-svetovnem-dnevu-zdravja-pozivi-k-skrbi-za-lastno-zdravje,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1651682022,1651682048
885,15071,”Na okrogli mizi poudarili pomen zgodnje obravnave Parkinsonove bolezni “,”Pred svetovnim dnevom Parkinsonove bolezni, ki ga bomo obeležili 11. aprila, so sogovorniki na okrogli mizi izpostavili pomen zgodnjega odkrivanja in zdravljenja te bolezni.”,”
Ljubljana, 8. aprila – Pred svetovnim dnevom Parkinsonove bolezni, ki ga bomo obeležili 11. aprila, so sogovorniki na okrogli mizi izpostavili pomen zgodnjega odkrivanja in zdravljenja te bolezni. Kot so pojasnili, na Nevrološki kliniki UKC Ljubljana bolnike obravnavajo različni strokovnjaki z različnih področij, kar bolnikom nudi celovito in kakovostnejšo obravnavo.
Nevrologinja Nina Zupančič Križnar z Nevrološke klinike Univerzitetnega kliničnega centra (UKC) Ljubljana je pojasnila, da je Parkinsonova bolezen napredujoča degenerativna nevrološka bolezen, ki ni ozdravljiva. Izraža se v motoričnih simptomih, kot so tresenje, pa tudi v nemotoričnih simptomih. Izmed slednjih je naštela psihološke težave, bolečine v križu, rokah in ramenih ter omotico. Razlog za težave je v pomanjkanju hormona dopamina v možganih zaradi propadanja celic.
Bolniki so v povprečju stari 60 let, bolezen pa se lahko pojavi tudi prej ali kasneje, je pojasnil nevrolog Dejan Georgiev z ljubljanske nevrološke klinike. Ocenil je, da je v Sloveniji okoli 9000 bolnikov z omenjeno boleznijo, nekateri pa najverjetneje še niso diagnosticirani. Po njegovih besedah nekateri strokovnjaki tveganje za razvoj bolezni povezujejo s stikom s pesticidi, vplivajo pa tudi genetski dejavniki.
Slovenija ima po besedah predstojnika katedre za nevrologijo na ljubljanski medicinski fakulteti in nevrologa na ljubljanski nevrološki kliniki Zvezdana Pirtoška v UKC Ljubljana enega redkih centrov v Evropi, kjer bolnike obravnavajo različni strokovnjaki in jim predvsem v pozni fazi bolezni nudijo še dodatno pomoč.
V multidisciplinarno ekipo so med drugim vključeni nevrologi, fizioterapevti, logopedi, psihiatri, dietetiki, pa tudi specializirane medicinske sestre za Parkinsonovo bolezen.
Specializirana medicinska sestra Lidija Ocepek je poudarila, da bolezen ne prizadene le bolnika, pač pa tudi njegovo družino. Po njenih besedah so pogosto še posebej prizadeti mlajši odrasli, kjer lahko hitro pride do napredovanja bolezni.
Zato je izpostavila pomen pogovora z bolnikom in njegovimi bližnjimi. Na ljubljanski nevrološki kliniki po njenih besedah zaradi obremenjenosti nevrologov dodatne informacije o bolezni, zdravljenju in stranskih učinkih bolnikom nudi specializirana medicinska sestra.
Pomembno je, da bolnik čim prej sprejme diagnozo in zdravljenje, saj se s potekom bolezni “oži terapevtsko okno”, je opomnila Zupančič Križnarjeva. Kot je dejala, zdravljenje Parkinsonove bolezni poteka individualno in je prilagojeno posamezniku, zato je pomembno, da zdravnik nevrolog posameznega bolnika spremlja ves potek njegovega zdravljenja.
Predsednica Društva bolnikov s parkinsonizmom in drugimi ekstrapiramidnimi motnjami Trepetlika Cvetka Pavlina Likar je pojasnila, da je namen društva ozaveščati o Parkinsonovi bolezni. Kot je dejala, se nekateri bolniki s to boleznijo v začetku ne želijo vključiti v društvo, saj njihove težave še niso velike. Številni se pridružijo kasneje. V društvu jim nudijo predavanja, ob vključitvi v društvo pa tudi štiridnevni tabor, kjer jim strokovnjaki pojasnijo značilnosti bolezni in zdravljenja.
Spregovoril je tudi bolnik s Parkinsonovo boleznijo Jože Šprohar, ki je pojasnil, da je sam sprva opazil počasnejše gibanje in zatem tresenje rok. Simptome so sicer prvi opazili drugi, in ne on sam. Izpostavil je terapevtski pomen namiznega tenisa, kar so potrdili tudi drugi govorci na okrogli mizi v organizaciji družbe Aetas in poudarili, da ima terapevtski učinek na bolnike tudi ples in nordijska hoja.
“,”Jaka Verbic Miklic”,1649435820,1649435820,sl,15071,306,15070,43,0,NULL,,”Na okrogli mizi poudarili pomen zgodnje obravnave Parkinsonove bolezni “,na-okrogli-mizi-poudarili-pomen-zgodnje-obravnave-parkinsonove-bolezni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1651682285,1651682286
886,15073,”Obeležujemo dan Parkinsonove bolezni, v Sloveniji se z njo sooča okoli 9000 bolnikov “,”Danes obeležujemo svetovni dan Parkinsonove bolezni, s katero v Sloveniji živi približno 9000 posameznikov.”,”
Ljubljana, 11. aprila – Danes obeležujemo svetovni dan Parkinsonove bolezni, s katero v Sloveniji živi približno 9000 posameznikov. Gre za počasi napredujočo degenerativno nevrološko bolezen, ki ni ozdravljiva. Najpogosteje prizadene starejše, moške pogosteje kot ženske. Strokovnjaki ob tem poudarjajo pomen zgodnjega odkrivanja in zdravljenja te bolezni.
Zdravljenje Parkinsonove bolezni poteka z blaženjem simptomov s kombinacijo zdravil, terapij in kirurškim zdravljenjem. Bolezen je napredujoča, prav tako ni znan natančen vzrok za njen nastanek.
Nevrologinja Nina Zupančič Križnar z Nevrološke klinike Univerzitetnega kliničnega centra (UKC) Ljubljana je na petkovi okrogli mizi z naslovom Aktivno v življenje s Parkinsonovo boleznijo pojasnila, da se bolezen izraža v motoričnih simptomih, kot so tresenje, pa tudi v nemotoričnih simptomih. Izmed slednjih je naštela psihološke težave, bolečine v križu, rokah in ramenih ter omotico. Razlog za težave je v pomanjkanju hormona dopamina v možganih zaradi propadanja celic.
Nevrolog Dejan Georgiev z ljubljanske nevrološke klinike je ocenil, da je v Sloveniji okoli 9000 bolnikov z omenjeno boleznijo, nekateri pa najverjetneje še niso diagnosticirani. Po njegovih besedah nekateri strokovnjaki tveganje za razvoj bolezni povezujejo s stikom s pesticidi, vplivajo pa tudi genetski dejavniki.
Slovenija ima po besedah predstojnika katedre za nevrologijo na ljubljanski medicinski fakulteti in nevrologa na ljubljanski nevrološki kliniki Zvezdana Pirtoška v UKC Ljubljana enega redkih centrov v Evropi, kjer bolnike obravnavajo različni strokovnjaki in jim predvsem v pozni fazi bolezni nudijo še dodatno pomoč.
V multidisciplinarno ekipo so med drugim vključeni nevrologi, fizioterapevti, logopedi, psihiatri, dietetiki, pa tudi specializirane medicinske sestre za Parkinsonovo bolezen.
Specializirana medicinska sestra Lidija Ocepek je poudarila, da bolezen ne prizadene le bolnika, pač pa tudi njegovo družino. Po njenih besedah so pogosto še posebej prizadeti mlajši odrasli, kjer lahko hitro pride do napredovanja bolezni.
Zato je izpostavila pomen pogovora z bolnikom in njegovimi bližnjimi. Na ljubljanski nevrološki kliniki po njenih besedah zaradi obremenjenosti nevrologov dodatne informacije o bolezni, zdravljenju in stranskih učinkih bolnikom nudi specializirana medicinska sestra.
Spregovoril je tudi bolnik s Parkinsonovo boleznijo Jože Šprohar, ki je pojasnil, da je sam sprva opazil počasnejše gibanje in zatem tresenje rok. Simptome so sicer prvi opazili drugi, in ne on sam. Izpostavil je terapevtski pomen namiznega tenisa.
“,”Jaka Verbic Miklic”,1649695140,1649695140,sl,15073,306,15072,43,0,NULL,,”Obeležujemo dan Parkinsonove bolezni, v Sloveniji se z njo sooča okoli 9000 bolnikov “,obelezujemo-dan-parkinsonove-bolezni-v-sloveniji-se-z-njo-sooca-okoli-9000-bolnikov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1651682414,1651682414
887,15075,”Slovenija v zdravljenju hemofilije v svetovnem vrhu “,” Slovenija spada med 20 odstotkov držav na svetu, kjer vse bolnike s težko obliko hemofilije zdravijo z redno profilakso”,”
Ljubljana, 13. aprila – Slovenija spada med 20 odstotkov držav na svetu, kjer vse bolnike s težko obliko hemofilije zdravijo z redno profilakso, je na današnji okrogli mizi Mejniki zdravljenja hemofilije skozi čas izpostavila zdravnica s Kliničnega oddelka za hematologijo Univerzitetnega kliničnega centra (UKC) Ljubljana Irena Preložnik Zupan.
Hemofilija je nekoč veljala za hudo redko bolezen, danes pa imajo bolniki po zaslugi profilakse – preprečevanja bolezni s preventivnimi zdravljenji, dokaj normalno življenje. Gre za dedno bolezen, pri kateri bolnikom v krvi primanjkuje faktor strjevanja krvi, zaradi česar imajo daljše krvavitve. Letno se v Sloveniji lahko rodi en, največ dva bolnika s to boleznijo, včasih pa tudi nihče. Za to boleznijo večinoma zbolevajo moški, ženske pa so prenašalke.
Bolniki si pri novem zdravljenju v žilo vbrizgajo koncentrat manjkajočega strjevalnega faktorja, s čimer preprečijo bolečine in invalidnosti, krvavitve pa nastopijo le še pri hujših poškodbah. Do invalidnosti lahko pride zaradi ponavljajočih krvavitev v sklepe, saj kri povzroči počasno okvaro hrustanca, ki z leti izgine, in vpliva na kostnino, kjer se razvijejo ciste in nepovratno uničenje sklepa.
Kot je na okrogli mizi povedala Barbara Faganel Kotnik z oddelka za otroško hematologijo in onkologijo UKC Ljubljana, na pediatrično kliniko vstopajo osebe s hemofilijo od rojstva do 18 leta starosti. Osebam, ki se rodijo v družini z že znano boleznijo, lahko diagnozo postavijo že v uri ali dveh po rojstvu, če bolezen v družini ni znana, pa je to odvisno od stopnje bolezni. “Ključno je zgodnje odkrivanje bolezni zlasti pri teži obliki, starši lahko hemofilijo pri otrocih prepoznajo, ko gredo na odvzem krvi iz prsta in se jim krvavitev ne ustavi tudi po nekaj dneh,” je dodala.
Na okrogli mizi je sodeloval tudi predsednik društva Krvni bratje Dominik Zver, ki je spregovoril o težavah hemofilikov v preteklosti. Včasih je bilo težje priti do zdravljenja, pa tudi do faktorjev, ki so danes dostopni v vsaki lekarni, nadomestno zdravljenje pa jim je omogočilo normalno in bolj svobodno življenje. Bolečine so si lajšali z ledenimi obkladki in mirovanjem, uporabljali so tudi opornice, včasih pa jim je pomagal tudi placebo efekt. Predsednik Društva hemofilikov Slovenije Janez Dolinšek je dodal, da so v preteklosti z boleznijo živeli bolj odkrito, danes pa imajo mladi bolniki manj težav in je tudi javnost o tem manj ozaveščena.
Faganel Kotnikova je kot največjo težavo hemofilikov izpostavila spontane krvavitve v sklepe, ki lahko nastanejo že po manjšem nerodnem gibu. Ogroža pa jih tudi nastanek protiteles proti vbrizganemu faktorju, kar povzroči, da je zdravljenje neučinkovito. Ob vsakem pomembnejšem padcu ali poškodbi je treba ukrepati v dveh, najkasneje pa v šestih urah, saj lahko tako preprečijo nastanek življenjsko ogrožajoče krvavitve.
Kot ključen napredek pri zdravljenju je Preložnik Zupanova izpostavila premik v razmišljanju, da škode ne popravljaš, ko se je že zgodila, ampak jo preprečiš. “Spremembe v sklepih zaradi krvavitev se kopičijo, pri vseh bolnikih starejših od 30 oziroma 35 let opažajo hude kronične okvare sklepov, bolniki mlajši od 25 let, ki so preventivno profilaktično zdravljenje imeli že od 1. leta starosti, pa nimajo okvar sklepov in živijo normalno življenje,” je še povedala.
V Sloveniji so z redno profilakso začeli leta 1996, najprej so z njo zdravili mlajše, ko je ta postala dostopnejša, pa tudi starejše bolnike. Preložnik Zupanova si želi, da bi tudi tisti s srednjo in lažjo obliko prejemali tovrstno zdravljenje. Redna profilaksa namreč vzgaja imunski sistem, da ne začne razvijati protiteles na faktor, skrbi tudi za zdravje sklepov in zmanjšuje pojav hujših krvavitev. V zadnjih letih se poleg nadomestnih zdravljenj pojavljajo tudi nova zdravljenja z monokleonskimi protitelesi ali drugimi protitelesi.
Za zdravljenje hemofilije pa razvijajo tudi gensko terapijo. Faganel Kotnikova je povedala, da z genskim zdravljenjem ne samo obvladujejo bolezen, ampak jo lahko trajno pozdravijo. Ker gre za redko bolezen, še ne poznajo vseh dolgoročnih stranskih učinkov zdravljenja. Dodala je še, da takšno zdravljenje ne bo dostopno za vse, predvideno je, da ga bodo najprej prejeli starejši bolniki, za otroke pa razvijajo poseben način genske terapije, ki na bolj usmerjen način popravi okvaro gena.
Okrogla miza je potekala pred prihajajočim svetovnim dnevom hemofilije, ki ga obeležujemo 17. aprila. V sodelovanju z Društvom hemofilikov Slovenije in društvom Krvni bratje jo je pripravil STAklub.
“,”Jaka Verbic Miklic”,1649868240,1649868240,sl,15075,306,15074,43,0,NULL,,”Slovenija v zdravljenju hemofilije v svetovnem vrhu “,slovenija-v-zdravljenju-hemofilije-v-svetovnem-vrhu,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1651682748,1651682748
890,15102,”Letošnji svetovni dan hemofilije posvečen želji po večji dostopnosti faktorjev strjevanja krvi po svetu “,”Danes obeležujemo svetovni dan hemofilije, redke dedne bolezni, pri kateri je moteno strjevanje krvi.”,”
Ljubljana, 17. aprila – Danes obeležujemo svetovni dan hemofilije, redke dedne bolezni, pri kateri je moteno strjevanje krvi. Slovenija pri zdravljenju hemofilije sodi v sam vrh razvitih držav, številni ljudje po svetu pa še vedno nimajo dostopa do faktorjev strjevanja krvi, opozarjajo v Zbornici zdravstvene in babiške nege Slovenije.
Kot je na sredini okrogli mizi Mejniki zdravljenja hemofilije skozi čas izpostavila zdravnica s Kliničnega oddelka za hematologijo Univerzitetnega kliničnega centra (UKC) Ljubljana Irena Preložnik Zupan, Slovenija spada med 20 odstotkov držav na svetu, kjer vse bolnike s težko obliko hemofilije zdravijo z redno profilakso, preventivnim zdravljenjem z dodajanjem faktorja strjevanja krvi. S tem preprečijo spontane krvavitve v sklepe in mišice, ki povzročajo bolečine in invalidnosti.
V preteklosti je hemofilija bolnikom predstavljala veliko breme, danes pa jim napredek v zdravljenju omogoča dokaj normalno življenje. A zdravljenje in dostop do faktorjev povsod po svetu nista samoumevna, saj bolezen predstavlja dokaj veliko finančno breme za zdravstveni sistem.
“Včasih, ko ni bilo ustreznega zdravljenja hemofilije, hemofiliki s težko obliko hemofilije niso dočakali odrasle dobe. V državah, kjer ustrezno zdravljenje ni na voljo, je še vedno tako, zato bi bilo treba v teh državah zdravljenje hemofilije implementirati v nacionalne protokole”, so pri Zbornici zdravstvene in babiške nege Slovenije – Zvezi strokovnih društev medicinskih sester, babic in zdravstvenih tehnikov Slovenije povzeli besede predsednika sekcije medicinskih sester in zdravstvenih tehnikov v hematologiji Boštjana Jovana.
Novi faktorji s podaljšanim delovanjem zagotavljajo višjo aktivnost potrebnega faktorja, manjše število njegovih aplikacij, manjšo porabo zdravila in izboljšano kakovost življenja bolnikov, saj so lahko bolj aktivni ob manjšem številu aplikacij faktorja, so še zapisali v sporočilu za javnost Zbornice – Zveze.
Nekateri bolniki so do novih načinov zdravljenja skeptični in si zdravila ne želijo zamenjati, a je pri tem po besedah Preložnik Zupanove ključno izobraževanje bolnikov. Pomembno je tudi ozaveščanje javnosti, saj se 30 odstotkov hemofilikov rodi zaradi nove spontane mutacije, ki je prej v družini ni bilo, kar pomeni, da se hemofilija lahko pojavi v vsaki od družin.
Za zdravljenje hemofilije se v zadnjih letih poleg nadomestnih zdravljenj pojavljajo zdravljenja z monokleonskimi protitelesi, razvija pa se tudi genska terapija, s katero bi po besedah zdravnice Barbare Faganel Kotnik z oddelka za otroško hematologijo in onkologijo UKC Ljubljana ne le obvladovali bolezni, ampak jo tudi trajno pozdravili.
“,”Jaka Verbic Miklic”,1650214200,1650214200,sl,15102,306,15101,43,0,NULL,,”Letošnji svetovni dan hemofilije posvečen želji po večji dostopnosti faktorjev strjevanja krvi po svetu “,letosnji-svetovni-dan-hemofilije-posvecen-zelji-po-vecji-dostopnosti-faktorjev-strjevanja-krvi-po-svetu,Post,,1,0,1655657470,1655657613
891,15104,”NIJZ: Dan brez alkohola je lahko prav vsak “,”Slovenija sodi med države, ki beležijo najvišjo porabo alkohola. Stroški države, povezani s pitjem alkohola, letno presegajo 200 milijonov evrov.”,”
Ljubljana, 25. aprila – NIJZ tudi po nedavno zaključeni akciji Slovenske karitas 40 dni brez alkohola prebivalce spodbuja k odgovornemu odnosu do pitja alkohola. Ljudi želi spodbuditi, da je dan brez alkohola lahko prav vsak. Slovenija sodi med države, ki beležijo najvišjo porabo alkohola. Stroški države, povezani s pitjem alkohola, letno presegajo 200 milijonov evrov.
Registrirana poraba je v letu 2020 znašala kar 9,8 litra čistega alkohola. To pomeni, da je vsak prebivalec, starejši od 15 let, v povprečju v tem letu spil 81 litrov piva in 42 litrov vina ter tri litre žgane pijače. Pri tem ne smemo zanemariti tudi težje ocenljive neregistrirane porabe, ki omenjeno številko poveča še za eno petino in izhaja predvsem iz domače proizvodnje alkoholnih pijač, so sporočili iz Nacionalnega inštituta za javno zdravje (NIJZ).
Podatki so po navedbi inštituta dodatno skrb vzbujajoči, ko pogledamo številke, ki govorijo o tem, da vsak dan zaradi vzrokov, povezanih izključno s pitjem alkohola, v Sloveniji umrejo tri osebe. V Sloveniji se kar 43 odstotkov oseb visoko tvegano opija in kar devet odstotkov povzročiteljev prometnih nesreč je v času nezgode vozilo pod vplivom alkohola.
S pitjem alkohola so povezani tudi mnogi stroški države, kot so zdravstveni stroški, stroški zaradi prometnih nezgod, nasilja v družini in kriminalnih dejanj. V letih 2012-2016 so letno v povprečju znašali kar 228 milijonov evrov, so izpostavili na NIJZ.
Še bolj poudarjena je problematika pitja alkohola v času epidemije covida-19. To obdobje namreč za marsikoga predstavlja izziv, breme, obdobje vprašanj in negotovosti, kar se pri nekaterih odraža tudi v povečanem pitju alkohola.
Raziskava NIJZ SI-PANDA, ki spremlja stanje v različnih obdobjih epidemije covida-19, razkriva, da je od 7,9 do 13,9 odstotka odraslih prebivalcev v Sloveniji v času epidemije pilo več alkoholnih pijač kot pred epidemijo. Porast je še najbolj očiten v starostni skupini od 18 do 29 let, kjer je približno petina posameznikov poročala o večji količini popitega alkohola v obdobju epidemije.
Stroka ob tem opozarja, da imajo že manjše količine popitega alkohola lahko negativen vpliv na naše zdravje in da varne meje pitja alkohola ni. S pitjem alkohola je namreč neposredno povezanih več kot 200 bolezenskih stanj in poškodb. Pitje alkohola pa ne vpliva samo na zdravje, ampak povečuje tudi tveganje za prometne nesreče, tvegana vedenja, nasilje, povečuje osebne stiske in uničujoče vpliva na bližnje medosebne odnose.
“Ljudje bi se morali pogosteje zavedati posledic, ki jih ima pitje alkohola na nas in druge ter da je ravno obdobje brez alkohola priložnost, da ugotovimo kakšne prednosti nam prinaša nepitje alkoholnih pijač. Zelo hitro lahko opazimo, da imamo več energije, da se počutimo boljše, čas pa lahko namenimo bolj zdravim izbiram, ki še dodatno izboljšajo naše počutje, hkrati pa občutimo ponos ob novih uspehih,” so navedli.
NIJZ je s projektom SOPA, ki ga je v 18 lokalnih okoljih izvajalo 300 strokovnjakov zdravstvenih domov in centrov za socialno delo, pilotno preizkusil pristop podpore. S pristopom so na poti zmanjšanja ali opuščanja pitja do sedaj skupno nagovorili skoraj 50.000 ljudi, obravnavali 4000 posameznikov, ki tvegano ali škodljivo pijejo, ter jih 943 uspešno podprli v smeri zmanjšanja ali opustitve pitja alkohola, so rezultate projekta SOPA opisali na NIJZ, kjer bodo projekt nadaljevali in ga širili.
“Močno verjamemo, da sta skrb za svoje zdravje in dobro počutje lahko pomembna motivacija in pot k večjemu zadovoljstvu vsakega izmed nas. Zato s simbolno gesto, kot je dan brez alkohola, spominjamo, naj bo takih dni čim več. Če piješ manj ali nič, je tebe več za vse,” so sklenili na NIJZ.
“,”Jaka Verbic Miklic”,1650905700,1650905700,sl,15104,306,15103,43,0,NULL,,”NIJZ: Dan brez alkohola je lahko prav vsak “,nijz-dan-brez-alkohola-je-lahko-prav-vsak,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1655657830,1655657830
892,15106,”Na svetovni dan varnosti in zdravja pri delu poziv k ureditvi prijave poklicnih bolezni”,”Zveza svobodnih sindikatov od države zahteva ureditev postopka za prijavo poklicnih bolezni.”,”
Ljubljana/Ženeva, 28. aprila – Svetovni dan varnosti in zdravja pri delu, 28. april, bo danes poudaril nujnost prizadevanj za boljšo varnost in zdravje pri delu ter velik pomen, ki ga ima pri tem sodelovanje med vodstvom podjetij in delavci. Zveza svobodnih sindikatov pa od države zahteva ureditev postopka za prijavo poklicnih bolezni.
Zveza svobodnih sindikatov Slovenije, ki je proti državi že lani vložila pritožbo na Mednarodno organizacijo dela (ILO) zaradi kršitve 11. člena konvencije o varstvu pri delu, ob svetovnem dnevu opominja, da inšpektorat za delo lani razen primerov azbestnih poklicnih bolezni ni zabeležil nobenega primera poklicne bolezni, ki ni azbestna.
Po drugi strani pa sta Svetovna zdravstvena organizacija in ILO v globalnem poročilu o bremenu bolezni in poškodb, povezanih z delom, za obdobje od leta 2000 do 2016 zapisali, da v Sloveniji zaradi nezgod pri delu in poklicnih bolezni letno skupno umre 500 ljudi, so navedli v zvezi.
ILO je že začela ugotavljati morebitne kršitve konvencije. Če bo vlada zavrnila sodelovanje v spravnem postopku, bo morala glede na poziv ILO do 4. junija pripraviti odgovor na prijavo zveze.
Svobodni sindikati so se za pritožbo odločili, ker Slovenija še ni sprejela ustreznega predpisa, po katerem bi bilo mogoče prijavljati veliko večino poklicnih bolezni. Njihovo preprečevanje je zato po opozorilu zveze neučinkovito in nesistematično.
Na inšpektorat za delo je bilo lani prijavljenih skoraj 11.200 nezgod pri delu. Med vsemi prijavljenimi je bilo skoraj 2000 nezgod, ki so bile povezane z epidemijo covida-19. Med prijavljenimi je bilo smrtnih nezgod 15, težjih pa 527, so navedli za STA.
Za boljše razmere in posledično manj nezgod pri delu ter okvar zdravja bi morali spremeniti odnos do samega področja varnega in zdravega dela, je poudaril glavni inšpektor Jadranko Grlić.
Samo s spremembo kulture bodo mogoči pozitivni trendi, se strinja predsednik Zbornice varnosti in zdravja pri delu Janez Balantič. “Varnost in zdravje pri delu mora veljati za temeljno vrednoto podjetja, vključeno v vsak vidik poslovanja podjetja,” je zapisal.
Po navedbah ILO skoraj tri milijone delavcev po svetu vsako leto izgubi življenje zaradi nesreče pri delu ali poklicne bolezni. Ugotavljajo koristi, ki jih v prizadevanjih za večjo varnost in zdravje pri delu prinaša sodelovanje med vodstvom in delavci. Na tak način je mogoče število nesreč pri delu zmanjšati za približno dve tretjini, število hospitalizacij pa za skoraj 60 odstotkov.
ILO je svetovni dan varnosti in zdravja pri delu razglasila v letu 2003 z namenom, da spodbudi prizadevanja za več kulture na tem področju. Mednarodna konferenca svobodnih sindikatov pa je leta 1996 uvedla 28. april tudi kot svetovni dan spomina na umrle in poškodovane delavce.
“,”Jaka Verbic Miklic”,1651165620,1651165620,sl,15106,306,15105,43,0,NULL,,”Na svetovni dan varnosti in zdravja pri delu poziv k ureditvi prijave poklicnih bolezni”,na-svetovni-dan-varnosti-in-zdravja-pri-delu-poziv-k-ureditvi-prijave-poklicnih-bolezni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1655658536,1655658544
893,15108,”Pri zdravljenju hujših oblik astme ključen multidisciplinarni pristop”,”Prvi torek v maju na pobudo Globalne iniciative za astmo obeležujemo svetovni dan boja proti astmi, ki letos poteka pod geslom Zapolnimo vrzeli pri vodenju astme.”,”
Ljubljana, 3. maja – Prvi torek v maju na pobudo Globalne iniciative za astmo obeležujemo svetovni dan boja proti astmi, ki letos poteka pod geslom Zapolnimo vrzeli pri vodenju astme. Po besedah specialistke pnevmologije Sabine Škrgat je pri zdravljenju bolnikov s hujšo obliko astme ključnega pomena sistemsko zdravljenje, ki temelji na multidisciplinarnem pristopu.
Astma sodi med najpogostejše kronične pljučne bolezni, za njo pa v Sloveniji trpi okoli 16 odstotkov ljudi, od tega pet do osem odstotkov za hudo obliko, je na današnji izjavi za medije opozorila Sabina Škrgat s kliničnega oddelka za pljučne bolezni v UKC Ljubljana.
Kot je pojasnila, obstajajo različni poteki astme. Slednja se lahko pri posamezniku razvije že v otroštvu, pri čemer gre pogosto za tipično alergično obliko astme, ki kasneje izzveni. V odrasli dobi pa se ponavadi razvije tipična nealergijska astma, ki pa ima že od začetka hujši potek.
“Ravno za najtežje oblike astme pa se je v zadnjih letih zgodil preboj v znanosti in pristopu do zdravljenja bolnikov z astmo,” je poudarila. Po njenih besedah se pri zdravljenju teh bolnikov ne uporabljajo zgolj inhalacijska protivnetna zdravila. Pomembno je namreč sistemsko zdravljenje, vključno z biološkimi zdravili, ki temelji na multidisciplinarnem pristopu oz. na sodelovanju zdravnikov različnih strok.
Simptomi astme so težko dihanje, kašelj, tiščanje v prsih in piskajoče dihanje, ki se lahko pri bolnikih pojavijo tudi večkrat na dan. “Z zdravljenjem želimo obvladovati simptome do te mere, da bolniki s to boleznijo živijo čimbolj normalno življenje,” je dejala specialistke pnevmologije in interne medicine.
Zbornica zdravstvene in babiške nege Slovenije – Zveza strokovnih društev medicinskih sester, babic in zdravstvenih tehnikov Slovenije pa je ob svetovnem dnevu boja proti astmi opozorila, da po svetu še vedno obstajajo številne vrzeli pri oskrbi bolnikov z astmo. Pojavljajo se predvsem pri enakopravnosti pri dostopu do diagnoze in zdravljenja oziroma zdravil, pri skrbi za različne socioekonomske, etnične in starostne skupine, v razlikah med bogatimi in revnejšimi skupnostmi in državami ter v komunikaciji o pravilni oskrbi ter izobraževanju za bolnike z astmo.
“Izziv, ki ga predstavlja letošnja tema svetovnega dne, je, da mednarodne organizacije v pulmologiji sodelujejo med seboj ter s pacienti in izvajalci zdravstvenih storitev. S tem sodelovanjem bi zaznali in zapolnili te vrzeli pri obravnavi bolnika z astmo ter pomagali izvajati in deliti inovativne rešitve tako lokalno kot svetovno,” je poudarila predsednica sekcije medicinskih sester in zdravstvenih tehnikov v pulmologiji pri Zbornici – Zvezi Mariana Paula Rezelj.
“,”Jaka Verbic Miklic”,1651599600,1651599600,sl,15108,306,15107,43,0,NULL,,”Pri zdravljenju hujših oblik astme ključen multidisciplinarni pristop”,pri-zdravljenju-hujsih-oblik-astme-kljucen-multidisciplinarni-pristop,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1655660533,1655660533
894,15110,”Ob svetovnem dnevu raka jajčnikov poudarek na pomenu zdravega življenjskega sloga in rednih pregledov “,,”
Ljubljana, 8. maja – Od današnjem svetovnem dnevu raka jajčnikov v Združenju Europa Donna Slovenija opozarjajo na pomen zgodnjega odkrivanja in učinkovitega zdravljenja raka jajčnikov, ki je med pogostejšimi raki rodil. Ob tem poudarjajo tudi pomen zdravega življenjskega sloga in rednih pregledov pri ginekologu.
V združenju Europa Donna ob svetovnem dnevu raka jajčnikov poudarjajo pomen zdravega življenjskega sloga z zdravo prehrano, redno telesno aktivnostjo in ohranjanjem primerne telesne mase ter pomen rednih pregledov pri ginekologu in ustreznih preventivnih ukrepov pri ženskah z dedno obremenjenostjo.
“Hkrati pa je dragoceno, da ženske, ki so se z boleznijo že srečale, delijo svoje izkušnje, saj je spoznanje, da niso same, neprecenljivo,” dodajajo. V združenju so zato leta 2018 ustanovili sekcijo za podporo bolnicam z raki rodil, kjer lahko ženske, ki se soočajo z diagnozo in zdravljenjem rakov, poiščejo pomoč.
Rak jajčnikov je po navedbah združenja med pogostejšimi raki rodil. Po podatkih Registra raka Slovenije je leta 2018 za rakom jajčnikov na novo zbolelo 142 žensk. Rak jajčnikov se najpogosteje pojavlja pri ženskah v menopavzi, 18 odstotkov bolnic pa je ob postavitvi diagnoze mlajših od 50 let.
Zaradi nespecifičnih in težko prepoznavnih začetnih simptomov in s tem povezanim poznim odkrivanjem ima rak jajčnikov najvišjo smrtnost med vsemi ginekološkimi raki. Bolezen pri 71 odstotkih bolnic odkrijejo v razsejanem stadiju, v petih letih po diagnozi umre več kot polovica bolnic.
Nespecifične simptome ženske pogosto pripisujejo slabemu počutju ali drugim obolenjem, zato jih v združenju pozivajo, naj bodo pozorne na nepojasnjene utrujenosti, nenadno in nepojasnjeno pridobivanje ali izgubo telesne mase, spremembe v prebavi, povečanje obsega trebuha, vztrajajočo bolečino v spodnjem delu trebuha, občutek hitre sitosti in spremembe v pogostosti uriniranja. Ob prepoznavi teh simptomov naj ženske ne odlašajo s pregledom pri ginekologu, še pozivajo v združenju.
“,”Jaka Verbic Miklic”,1652031840,1652031840,sl,15110,306,15109,43,0,NULL,,”Ob svetovnem dnevu raka jajčnikov poudarek na pomenu zdravega življenjskega sloga in rednih pregledov “,ob-svetovnem-dnevu-raka-jajcnikov-poudarek-na-pomenu-zdravega-zivljenjskega-sloga-in-rednih-pregledov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1655660702,1655660702
895,15112,”Z zgodnjo diagnozo, zdravljenjem in spremembo načina življenja lahko upočasnimo napredovanje srčnega popuščanja “,”Čeprav bolezen ni ozdravljiva, lahko njeno napredovanje upočasnimo z zgodnjo diagnozo, uvedbo najboljše možne terapije in spremembo načina življenja, poudarjajo strokovnjaki.”,”
Ljubljana, 9. maja – Srčno popuščanje, bolezen, pri kateri srce ne more prečrpati dovolj krvi, ne vpliva le na kakovost življenja, ampak lahko vodi do hudih zapletov, celo do odpovedi srca. Čeprav bolezen ni ozdravljiva, lahko njeno napredovanje upočasnimo z zgodnjo diagnozo, uvedbo najboljše možne terapije in spremembo načina življenja, poudarjajo strokovnjaki.
Kot je na današnji novinarski konferenci v organizaciji Društva za zdravje srca in ožilja Slovenije pojasnil predsednik društva in zdravnik Matija Cevc, je srčno popuščanje stanje, pri kateri srce ne more več prečrpati dovolj krvi za potrebe organov, kar vodi v zastajanje krvi v pljučih. To povzroča težko sapo oz. dušenje, sprva le med naporom, z napredovanjem bolezni pa tudi v mirovanju. Bolniki posledično pogosto spijo polsede, saj privzdignjeno vzglavje olajša dušenje.
Najpogostejša vzroka za nastanek bolezni sta visok krvni tlak in ishemična srčna bolezen, povzročiteljica pa je sicer lahko katerakoli srčna bolezen. Družinska zdravnica Alenka Simonič je pojasnila, da se v večini primerov simptomi pojavijo nenadno, starejši bolniki pa jih pogosto pripišejo staranju. Zato jih pogosto ne navedejo, zdravniki pa morajo po njih aktivno spraševati sami.
Po njenih izkušnjah je pot do ultrazvoka srca razmeroma enostavna in hitra, t. i. ambulante za srčno popuščanje pa zaradi dolgih čakalnih vrst niso zaživele v polnosti. Družinski zdravniki zato terapijo večinoma uvajajo sami, tudi s pomočjo referenčnih sester, ob napredovanju ali poslabšanju bolezni pa vključijo tudi kardiologa.
Kot opaža, se bolniki in njihovi svojci med procesom zdravljenja pogosto znajdejo v stiski zaradi omejitev, ki jim jih bolezen postavlja. Srčno popuščanje namreč vpliva na bolnikovo druženje, partnerske in družinske odnose, potovanja in zabavo, zaradi omejitev pa bolniki pogosto postanejo depresivni.
Cevc ob tem poudarja, da lahko z ustreznim življenjskim slogom preprečimo pojavnost srčnega popuščanja ali njegov pojav vsaj zamaknemo. Ob tem svetuje ustrezno prehrano in redno, zmerno telesno dejavnost. Prav tako priporoča obvladovanje stresa, skrb za zdravo in zadostno spanje, sproščanje in opustitev kajenja.
Srčno popuščanje je po njegovih besedah pogosto bolezensko stanje. Po predvidevanjih se v razvitih državah z omenjeno boleznijo sooča eden do dva odstotka ljudi oz. 10 odstotkov starejših od 70 let. Ocenjujejo, da se bo število bolnikov do leta 2040 podvojilo. V Sloveniji je po ocenah med 20.000 in 40.000 bolnikov s srčnim popuščanjem. Smrtnost bolnikov z napredovalo obliko srčnega popuščanja je visoka, saj le 50 odstotkov bolnikov preživi pet let.
Zdravnik Gregor Poglajen s kliničnega oddelka za srčno popuščanje in transplantacije srca Univerzitetnega kliničnega centra Ljubljana je predstavil bolnišnično zdravljenje bolnikov s srčnim popuščanjem. Med drugim je pojasnil, da pri zdravljenju bolnikov s srčnim popuščanjem uporabljajo štiri skupine zdravil, po potrebi pa uporabljajo tudi zdravila za odvajanje vode in vsadne defibrilatorje. “Vseskozi pa na tržišče prihajajo tudi nove učinkovine, ki omogočajo še učinkovitejšo in bolj individualizirano obravnavo teh bolnikov,” je dejal.
Specialistka za kardiologijo in vaskularno medicino Cirila Slemenik Pušnik od leta 2006 deluje v ambulanti za srčno popuščanje v Splošni bolnišnici Slovenj Gradec. Predstavila je delo ambulante in med drugim povedala, da najtežji bolniki s srčnim popuščanjem vključeni tudi v telemedicinsko zdravljenje, pri katerem merilci izmerjene parametre od bolnika pošiljajo v bolnišnico, kjer v primeru odstopanj prilagodijo terapijo.
Ob mesecu srčnega popuščanja bodo v Društvu za zdravje srca in ožilja Slovenije v posvetovalnici za srce na Dalmatinovi ulici v Ljubljani od danes do 10. junija v času uradnih ur (ob ponedeljki, torkih četrtkih in petkih od 9.00 do 12.00, ob sredah od 11.00 do 15.00) izvajali brezplačne meritve in svetovanje.
“,”Jaka Verbic Miklic”,1652120580,1652120580,sl,15112,306,15111,43,0,NULL,,”Z zgodnjo diagnozo, zdravljenjem in spremembo načina življenja lahko upočasnimo napredovanje srčnega popuščanja “,z-zgodnjo-diagnozo-zdravljenjem-in-spremembo-nacina-zivljenja-lahko-upocasnimo-napredovanje-srcnega-popuscanja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1655663105,1655663105
896,15114,”Javna objava prenosov vrednosti ZD in ZO 2021″,”Objava zajema podatke o prenosih vrednosti v preteklem koledarskem letu 2020.”,”
JAVNA OBJAVA PRENOSOV VREDNOSTI ZDRAVSTVENIM DELAVCEM, ZDRAVSTVENIM ORGANIZACIJAM IN DRUŠTVOM BOLNIKOV S STRANI FARMACEVTSKIH DRUŽB
Po enotnem Kodeksu ravnanja (v nadaljevanju Kodeks), ki je veljaven od 1.1.2021 in združuje prejšnje tri Kodekse (Kodeks Transparentnosti, Kodeks sodelovanja z zdravstvenimi delavci in Kodeks sodelovanja z društvi bolnikov), bodo članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ (v nadaljevanju FarmaForum) tudi v letošnjem letu javno objavile prenose vrednosti zdravstvenim delavcem, zdravstvenim organizacijam in društvom bolnikov.
Kot določa enotni Kodeks, bodo podatke objavile do vključno 30. junija 2022.
Objava zajema podatke o prenosih vrednosti v preteklem koledarskem letu in na spletnih straneh posameznih članic ponuja vpogled v prenose v obdobju od 1. januarja do 31. decembra 2021. Po določilih zveze EFPIA (evropska zveza farmacevtskih industrij in združenj) se podatki javno objavljajo periodično, vsako leto, najkasneje do konca meseca junija, in sicer za preteklo koledarsko leto.
O javni objavi prenosov vrednosti
Javna objava prenosov vrednosti vključuje podatke o vrednostih vseh sredstev, ki so jih prejeli posamezni zdravstveni delavci, zdravstvene organizacije in društva bolnikov s katerimi sodelujejo posamezne članice FarmaForuma ali FarmaForum – bodisi neposredno ali prek tretjih oseb, kot so agencije za organizacijo dogodkov. Javna objava vsebuje tudi informacije o vrsti dejavnosti ali tipu podpore:
Te prenose vsaka članica FarmaForuma objavi v slovenskem jeziku na svoji lokalni, regijski ali mednarodni spletni strani.
Individualne in skupinske objave
Vsi prenosi zdravstvenim organizacijam, kamor se po Kodeksu ravnanja uvrščajo javne zdravstvene institucije, zdravniška društva, združenja, zbornice in zasebna podjetja (d.o.o. in s.p.), so skladno z zakonodajo objavljeni individualno s polnim nazivom prejemnika.
Pri prenosih vrednosti posameznim zdravstvenim delavcem, fizičnim osebam, je objava v skladu z Zakonom o varstvu osebnih podatkov mogoča samo na podlagi predhodnega pisnega soglasja zdravstvenega delavca. V nasprotnem primeru se prenos objavi v skupinski obliki, pri čemer je v vsaki kategoriji navedeno število prejemnikov ter skupni znesek dodeljen tovrstnim prejemnikom.
Podatki o plačilih na področju raziskav in razvoja zaradi varstva konkurence ter inovacij, ki jih razvijajo posamezne družbe, skladno z zakonodajo, ne morejo biti objavljeni drugače kot v skupinski obliki.
Izjava o omejitvi odgovornosti
Podatki, objavljeni v tem poročilu, so izraz prizadevanj FarmaForuma za ravnanje skladno z zahtevami Kodeksa ravnanja in zveze EFPIA. Če se kljub našim prizadevanjem za zagotovitev natančnih objav zgodi, da poročilo vsebuje nepopolne ali netočne podatke, bomo to raziskali in morebitne napačne podatke ustrezno popravili.
PODATKI O PRENOSU VREDNOSTI ZDRAVSTVENIM DELAVCEM, ZDRAVSTVENIM ORGANIZACIJAM IN DRUŠTVOM BOLNIKOV S STRANI MEDNARODNEGA FORUMA ZNANSTVENORAZISKOVALNIH FARMACEVTSKIH DRUŽB, GIZ, ZA LETO 2021
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ, je v koledarskem letu 2021 sodeloval z različnimi organizacijami: sponzorsko je podprl aktivnosti Slovenskega zdravniškega društva, šestim organizacijam je poravnal stroške povezane z izvajanjem storitev in svetovanjem. Izplačana je bila ena donacija.
Skupna vrednost prenosov FarmaForuma zdravstvenim organizacijam je v letu 2021 znašala 86.988,80 EUR. V letu 2021 ni bil izveden noben prenos na zdravstvene delavce. Vrednost prenosov društvom bolnikov je znašala 6.900 EUR.
Metodologija
Javno objavljeni podatki zajemajo prenose vrednosti, ki so bili v finančnem sistemu FarmaForuma dejansko izvršeni v koledarskem letu 2021, to je od vključno 1. januarja 2021 do vključno 31. decembra 2021.
Prenosi zdravstvenim organizacijam in društvom bolnikov so navedeni kot neto zneski tovrstnih pogodb, ki ne vključujejo DDV. Prenosi vrednosti sredstev zdravstvenim delavcem se navajajo v bruto zneskih.
V letu 2021 ni bil izveden noben prenos vrednosti na zdravstvene delavce.
Vsi navedeni zneski predstavljajo skupne vrednosti za leto 2021.
Vse navedene transakcije so bile izvršene v koledarskem letu 2021, torej od vključno 1. januarja 2021 do vključno 31. decembra 2021.
Skladno s Kodeksom ravnanja je zdravstvena organizacija (ZO) opredeljena kot:
Zdravstvene delavce (ZD) Kodeks ravnanja opredeljuje kot:
Za namen tega Kodeksa, definicija ZD vključuje:
Skladno s Kodeksom ravnanja je društvo bolnikov (DB) opredeljeno kot:
Kodeks ravnanja je v celoti dostopen na: https://www.farmaforum.si/sl/o-forumu/kodeksi/forumov-kodeks-ravnanja
“,”Jaka Verbic Miklic”,1655828520,1655828520,sl,15114,306,15113,43,0,NULL,,”Javna objava prenosov vrednosti ZD in ZO 2021″,”Public disclosure of transfers in 2021″,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1655828740,1655831069
897,15114,”Public disclosure of transfers in 2021″,”Public notice on transfers of value from pharmaceutical companies to healthcare professionals and healthcare organizations”,”
PUBLIC NOTICE ON TRANSFERS OF VALUE FROM PHARMACEUTICAL COMPANIES TO HEALTHCARE PROFESSIONALS, HEALTHCARE ORGANIZATIONS AND PATIENT ORGANIZATIONS
According to the consolidated Code of Practice (hereinafter the Code), which is valid from 1.1.2021 and combines the previous three Codes (Code of Transparency, Code of Cooperation with Healthcare Professionals and Code of Cooperation with Patients’ Associations), members of the International Forum of Pharmaceutical Research Societies hereinafter referred to as the Forum), this year also announced the transfer of value to healthcare professionals, healthcare organizations and patient associations. As stipulated by the consolidated Code, the data will be published by 30 June 2022 inclusive.
The publication includes data on transfers of value in the previous calendar year and provides disclosure of transfer in the period from 1 January to 31 December 2021 on the websites of individual member company. According to the EFPIA provisions, the data are made public periodically, each year, by the end of June at the latest, for the previous calendar year.
About public disclosure of transfers of value
Public disclosure of transfers of value includes data on the value of all funds received by individual healthcare professional, healthcare organization or patient organization that collaborate with individual Forum members or the Forum itself, either directly or through third parties such as event organization agencies. Disclosure also includes information on the type of activity or support:
Each Forum member publishes these transfers in Slovenian at its local, regional, or international website.
Individual and group disclosures
All transfers to healthcare organizations, which under the Code include public healthcare institutions, physician associations and societies, chambers and private companies (d.o.o. and s.p.), are published individually, with the full name of the recipient.
Transfers of value to individual healthcare professionals who are natural persons are, pursuant to the Personal Data Protection Act, only possible based on advance written consent of the healthcare professional. If such consent is withheld, transfers are published in a group or aggregate form, with the number of recipients and total amount listed separately for each category of such recipients.
Data on payments in the field of research and development cannot be published otherwise than in a group or aggregated form due to legislative protection of competition and innovations being developed by separate companies.
Disclaimer
The data published in this report is an expression of our efforts towards observing the provisions of the EFPIA Code. Should it be found that the report contains incomplete or inaccurate data despite our best efforts towards assuring accurate publications, we will research the situation and appropriately correct false data.
DATA ON TRANSFERS OF VALUE TO HEALTHCARE PROFESSIONALS, HEALTHCARE ORGANISATIONS AND PATIENT ORGANIZATIONS FROM THE FORUM OF INTERNATIONAL RESEARCH AND DEVELOPMENT PHARMACEUTICAL COMPANIES, EIG, FOR 2021
In the calendar year 2021, the Forum of International Research and Development Pharmaceutical Companies, EIG, cooperated with various organizations: it sponsored the activities of the Slovenian Medical Association, six organizations received reimbursement related to the provision of services and consulting. Also, one donation was paid.
The total value of the Forum’s transfers to health organizations in 2021 amounted to EUR 86,988.80. In 2021, no transfer to healthcare professionals took place. The value of transfers to patients’ associations amounted to EUR 6,900.
Methodology
Publicly published data includes transfers of value that were actually executed in the financial system of the Forum in the calendar year 2021, from 1 January 2021 to 31 December 2021 inclusive.
Transfers to healthcare organizations and patient associations are reported as net amounts of such contracts, excluding VAT.
All these amounts represent the total values for 2021.
All these transactions were carried out in the calendar year 2021, from 1 January 2021 to 31 December 2021 inclusive.
The values of transfers of funds to healthcare organizations and patient associations are given in net amounts (excluding VAT).

According to the Code, a health care organization (HCO) is defined as:
According to the Code a Health Care Professionals (HCP) are defined as:
For the purpose of this Code, the definition of HCPs includes:
According to the Code Patient organizations (PO) are defined as:
Code of practice is available here: Code of Practice
“,”Jaka Verbic Miklic”,1655828520,1655828520,en,15114,306,15113,43,0,NULL,,”Javna objava prenosov vrednosti ZD in ZO 2021″,”Public disclosure of transfers in 2021″,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1655828740,1655831069
898,15116,”Ob mednarodnem dnevu medicinskih sester poudarek na nujnosti izboljšanja njihovih delovnih razmer “,”Ob tej priložnosti so različne organizacije opozorile na nujnost izboljšanja delovnih razmer medicinskih sester in nasploh zaposlenih v zdravstveni in babiški negi.”,”
Ljubljana, 12. maja – Danes obeležujemo mednarodni dan medicinskih sester. Ob tej priložnosti so različne organizacije opozorile na nujnost izboljšanja delovnih razmer medicinskih sester in nasploh zaposlenih v zdravstveni in babiški negi. Med drugim so izpostavile nujnost sprejema kadrovskih standardov in normativov ter nesorazmerja in anomalije v plačnih razredih.
Kljub decembra 2018 podpisanemu stavkovnemu sporazumu in novembra lani sklenjenemu dogovoru o nujnih ukrepih na področju zdravstva in socialnega varstva oblasti še vedno ne spoštujejo dogovorjenega in rokov za sprejem dokumentov, ki bi vsaj delno pripomogli k začetku nujnega urejanja razmer v zdravstveni negi, so tako pojasnili v Sindikatu delavcev v zdravstveni negi Slovenije (SDZNS).
Ob tem so dodali, da je minister za zdravje Janez Poklukar lani obljubil začetek pogovorov in tudi terminski načrt za sprejem kadrovskih standardov in normativov v zdravstveni negi, ti naj bi skladno z zagotovili ministra bili sprejeti do konca lanskega avgusta, a se to do danes še ni zgodilo.
Glede vprašanja dviga plačnih razredov zaposlenim so poudarili, da se je ta zgodil zgolj na sekundarnem nivoju in v socialnovarstvenih zavodih, medtem ko je bil primarni nivo v večini prezrt. Zaradi tega so se po njihovem mnenju pojavila nova nesorazmerja in anomalije, ki jih bodo naslovili na pogajanjih po oblikovanju nove vlade.
Predsednica Sindikata zdravstva in socialnega varstva Irena Ilešič Čujovič pa je izpostavila predvsem ključno vlogo sindikatov pri prizadevanjih za izboljšanje delovnih pogojev medicinskih sester in tudi ostalih zdravstvenih delavcev. “Zdravstvenega in socialnega varstva ni brez sodelovanja vseh zaposlenih. Največ lahko prispevamo prav sindikati, ki se intenzivno borimo za sprejem standardnih normativov in ustrezno vrednotenje dela, ki sta temelj vidnosti in dostojanstva tega poklica,” je povedala za STA.
Tudi v Zbornici zdravstvene in babiške nege Slovenije opozarjajo, da se morajo razmere nujno izboljšati. “Večkrat smo že poudarili in še večkrat bomo: nič o nas brez nas. Za tem trdno stojimo. Stroka zdravstvene in babiške nege je pomemben del zdravstvenega varstva in mora sodelovati na vseh ravneh načrtovanja in odločanja v zdravstvenem sistemu, ne le pri izvajanju aktivnosti. Zato zahtevamo, da se medicinske sestre in babice vključi v zdravstveno politiko ter v razvoj zdravstvenega sistema,” je izpostavila predsednica Monika Ažman.
Zbornica tako kot sindikat poudarja potrebo po sprejetju kadrovskih standardov in normativov, pričakujejo pa tudi sprejem odločitve o pripravi strategije razvoja zdravstvene in babiške nege za obdobje do leta 2030.
Po njihovem mnenju je prav tako nujen sprejem zakona o zdravstveni negi in babištvu. “Ta bo sistemsko in na zakonski ravni uredil področje in dal reguliranemu poklicu medicinske sestre in babice enakopraven položaj z drugimi reguliranimi poklici, kot so zdravnik, zobozdravnik in farmacevt, ki svoj zakon že imajo,” so zapisali.
Opozorili pa so še na nepriznavanje socialne in ženske politike. Ženske namreč predstavljajo kar 85 odstotkov vseh zaposlenih v zdravstveni in babiški negi. Zato v zbornici menijo, da bi bilo treba prilagoditi tudi politiko zaposlovanja in ponuditi bolj prilagodljive urnike dela.
Letošnji mednarodni dan medicinskih sester poteka pod geslom Glas medicinskih sester: vlaganje v zdravstveno nego in spoštovanje pravic medicinskih sester za zagotovitev svetovnega zdravja. 12. maja se je leta 1820 namreč rodila prva medicinska sestra na svetu, humanistka in ustanoviteljica modernega sestrinstva Florence Nightingale. Medicinske sestre ta dan obeležujejo in praznujejo že od leta 1965.
“,”Jaka Verbic Miklic”,1652377440,1652377440,sl,15116,306,15115,43,0,NULL,,”Ob mednarodnem dnevu medicinskih sester poudarek na nujnosti izboljšanja njihovih delovnih razmer “,ob-mednarodnem-dnevu-medicinskih-sester-poudarek-na-nujnosti-izboljsanja-njihovih-delovnih-razmer,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1655833544,1655833544
899,15118,”S kampanjo do manj kostno-mišičnih obolenj zaradi dela “,”Eden glavnih poudarkov kampanje EU za preprečevanje kostno-mišičnih obolenj Naredimo breme lažje za zdrava delovna mesta.”,”
Ljubljana, 15. maja – Kostno-mišična obolenja, ki so velik javnozdravstveni problem in najpogostejša zdravstvena težava, povezana z delom, je z ustreznim ravnanjem mogoče preprečiti ali vsaj omiliti. To je eden glavnih poudarkov kampanje EU za preprečevanje kostno-mišičnih obolenj Naredimo breme lažje za zdrava delovna mesta.
Neustrezna ergonomija delovnega procesa, denimo dvigovanja, prenašanja, potiskanja ali premikanja bremena, je pogost povod za nastanek kostno-mišičnih obolenj, izpostavlja republiški inšpektorat za delo. Ponavljajoči se gibi in delo v mrazu ali vročini prav tako predstavljajo tveganje za nastanek tovrstnih obolenj. Nenazadnje pomenijo velik strošek zaradi odsotnosti z dela in predčasnega upokojevanja.
Omenjena kampanja, ki poteka tako v Sloveniji kot ostalih članicah EU, želi spodbuditi ukrepe za varnost in zdravje pri delu in za obvladovanje tveganj na področju kostno-mišičnih obolenj. Cilj je vsem delavcem v EU zagotoviti enako raven varnosti in zdravja pri delu, podjetja pa naj bi imela enake konkurenčne pogoje.
Ciljne dejavnosti, v katerih se kampanja izvaja v vseh članicah, so zdravstveno in socialno varstvo, prevoz in kurirska dejavnost, proizvodnja hrane in pijač, frizerska in brivska dejavnost ter gradbeništvo.
V zdravstvenem in socialnem varstvu, kjer dela desetina zaposlenih v EU, je več kot tri četrtine delovne sile žensk. Bolečine v križu je v preteklih 12 mesecih imelo 47 odstotkov delavcev, odstotek manj pa jih je imelo bolečine v zgornjih okončinah, kaže raziskava Eurofounda EWCS iz leta 2015, v kateri so preučevali delovne pogoje v Evropi.
V industriji hrane in pijače bi bilo glede na študije mogoče preprečiti kar tri četrtine poškodb. Kostno-mišična obolenja bi lahko preprečevali zlasti z zagotavljanjem strokovne ocene tveganja. Ta je sicer običajno osredotočena na fizikalne dejavnike, vendar pa je treba upoštevati tudi organizacijske in psihosocialne dejavnike, navajajo organizatorji kampanje.
Med delavci v gradbeništvu jih je imelo po omenjeni raziskavi EWCS v preteklih 12 mesecih 54 odstotkov bolečine v zgornjih okončinah, 52 odstotkov bolečine v hrbtu, 41 odstotkov pa v spodnjih okončinah.
Inšpektorji v inšpekcijskih nadzorih ne le preverjajo izvajanje določil veljavne zakonodaje, ampak tudi svetujejo in osveščajo tako delodajalce kot delavce. Slovenski inšpektorat za delo, ki se je pridružil kampanji, izvaja aktivnosti v tem okviru na področjih prevoza, kurirske dejavnosti in proizvodnje hrane in pijač. Podatki za Slovenijo bodo znani v drugi polovici leta, za stanje v vseh državah članicah pa v začetku leta 2023.
“,”Jaka Verbic Miklic”,1652636820,1652636820,sl,15118,306,15117,43,0,NULL,,”S kampanjo do manj kostno-mišičnih obolenj zaradi dela “,s-kampanjo-do-manj-kostno-misicnih-obolenj-zaradi-dela,Post,,1,0,1655833689,1655833689
900,15120,”Ob svetovnem dnevu hipertenzije pozivi k rednem merjenju krvnega tlaka “,” V Združenju za arterijsko hipertenzijo ob tem pozivajo k rednemu merjenju krvnega tlaka, ker lahko le z rednimi meritvami pripomoremo k njegovemu hitrejšemu prepoznavanju in zdravljenju.”,”
Ljubljana, 17. maja – Danes obeležujemo svetovni dan hipertenzije. V Združenju za arterijsko hipertenzijo ob tem pozivajo k rednemu merjenju krvnega tlaka, ker lahko le z rednimi meritvami pripomoremo k njegovemu hitrejšemu prepoznavanju in zdravljenju. Zvišan krvni tlak velja za tihega ubijalca, saj ne boli, dolgoročno pa povzroči veliko škode, so sporočili.
Krvni tlak je sila, s katero kri pritiska na steno žile, po kateri teče. Opredeljujeta ga dve številki. Prva številka je vrednost najvišjega krvnega tlaka v žili ob utripu srca, druga številka pa je vrednost najnižjega krvnega tlaka v žili med dvema utripoma, ko srčna mišica počiva. Meja, ko govorimo o zvišanem krvnem tlaku, je 140/90 mm Hg (milimetrov živega srebra).
Visok krvni tlak odkrijejo z merjenjem. “Z merjenem lahko začnemo kadarkoli, že v otroštvu. Izmerili naj bi si ga vsaj enkrat na leto, če smo zdravi, in pogosteje, če so bile izmerjene vrednosti že kdaj prej višje,” so besede predsednice združenja Jane Brguljan Hitij navedli v sporočilu za javnost.
Primož Dolenc s kliničnega oddelka za hipertenzijo v Univerzitetnem kliničnem centru Ljubljana pa opozarja, da so običajno vrednosti tlaka, merjene doma, nižje. Priporoča, da se ob povprečju meritev krvnega tlaka doma, ki so višje od 135/85 mm Hg, posvetujete z osebnim zdravnikom.
Vzroka zvišanega krvnega tlaka večinoma ne poznamo, zato bolezni ne morejo dokončno pozdraviti. Zdravijo jo lahko s spremembo življenjskega sloga, kar pomeni zmanjšanje telesne teže, primerno telesno dejavnost, prenehanje kajenja, omejitev soli v prehrani in omejitev pitja alkoholnih pijač. Če ti ukrepi ne zadoščajo, zdravnik predpiše zdravila za znižanje krvnega tlaka.
Zvišan krvni tlak škodi srcu, možganom, žilam, ledvicam in očem. Zaradi poškodb na teh organih pa lahko pride do možganske kapi, odpovedi srca in ledvic ter do srčnega infarkta. Zvišan krvni tlak je tudi eden od pomembnih dejavnikov tveganja za nastanek bolezni srca in žilja, ki so pri nas glavni vzrok umiranja.
Slovenija se je tudi letos pridružila akciji Mesec meritev maj (MMM), v njenem okviru pa si bo krvni tlak možno izmeriti v nekaterih zdravstvenih ustanovah in lekarnah po Sloveniji, so še zapisali v Združenju za arterijsko hipertenzijo.
V Zbornici zdravstvene in babiške nege Slovenije – Zvezi strokovnih društev medicinskih sester, babic in zdravstvenih tehnikov Slovenije pa poudarjajo, da imajo pri diagnosticiranju visokega krvnega tlaka pomembno vlogo medicinske sestre.
“,”Jaka Verbic Miklic”,1652809740,1652809740,sl,15120,306,15119,43,0,NULL,,”Ob svetovnem dnevu hipertenzije pozivi k rednem merjenju krvnega tlaka “,ob-svetovnem-dnevu-hipertenzije-pozivi-k-rednem-merjenju-krvnega-tlaka,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1655833797,1655833797
901,15122,”V Sloveniji po ocenah okoli 100.000 bolnikov z imunsko pogojenimi vnetnimi boleznimi “,”Te za bolnike predstavljajo veliko breme in so neozdravljive, a so ob hitri diagnozi in zdravljenju obvladljive.”,”
Ljubljana, 18. maja – Okoli 100.000 bolnikov v Sloveniji ima imunsko pogojene vnetne bolezni. Te za bolnike predstavljajo veliko breme in so neozdravljive, a so ob hitri diagnozi in zdravljenju obvladljive. V Sloveniji so bolnikom na voljo vsi moderni načini zdravljenja, so novinarski konferenci poudarili zdravniki in predstavniki društev za pomoč bolnikom.
Na novinarski konferenci o imunsko pogojenih vnetnih boleznih so sodelovali dermatolog Tomaž Lunder, gastroenterologinja Nataša Smrekar, revmatologinja Sonja Praprotnik, predsednica Društva za kronično vnetno črevesno bolezen Mateja Saje, vodja gorenjske podružnice Društva psoriatikov Slovenije Simeon Setnikar in sekretarka Društva revmatikov Slovenije Petra Zajc.
Kot so uvodoma pojasnili, imunsko pogojene vnetne bolezni tvorijo skupino bolezni, vzrok katerih še ni znan. Mednje sodijo kronične vnetne črevesne bolezni (KVČB), luskavica in vnetna revmatska obolenja. Vse navedene bolezni zaznamuje nenadzorovano vnetje, ki poškoduje določen organ, vse so kronične, za bolnika predstavljajo težko breme, značilna pa so praviloma različno dolga obdobja zagonov in mirovanja.
Med imunsko pogojenimi vnetnimi bolezni je najbolj pogosta luskavica, ki se sprva kaže s pordelo, luščečo kožo, kasneje pa se na različnih dela telesa po telesu pojavijo odmrle kožne luske. Po besedah dermatologa Lundra se z njo soočajo od dva do trije odstotki prebivalstva, v Slovenji torej od 40.000 do 60.000 oseb.
Setnikar se je z boleznijo srečal pri 25 letih. Kot je pojasnil, se je zaradi bolezni začel izogibati skupinskim športom in se posvetil individualnim, saj ima bolezen zaradi vidnih posledic na koži tudi psihološke vplive na bolnika.
Lunder svetuje, naj posameznik v primeru kožnih težav obišče družinskega zdravnika, ki jih bo v primeru neuspešnega začetnega zdravljenja napotil k dermatologu. V zadnjih letih so sicer pri zdravljenju težjih oblik luskavice dosegli velik napredek. Bolniki, ki so pred tem potrebovali bolnišnično zdravljenje, lahko sedaj ob domači terapiji živijo normalno življenje.
Revmatične bolezni lahko ob odsotnosti zdravljenja povzročajo hude bolečine, otekle sklepe, okorelost, omejeno gibljivost in nepopravljive okvare, ki lahko vodijo v invalidnost in krajšo življenjsko dobo. Po besedah Zajčeve je zdravljenje tudi na tem področju močno napredovalo, slovenskim bolnikom pa so na voljo vse napredne oblike zdravljenja.
Revmatologinja Praprotnik je pojasnila, da v zadnjem času narašča pojavnost vnetnih revmatskih obolenj. Ob tem še ni znano, ali gre za posledico boljše diagnostike, zavedanja ljudi ali dejanske večje pojavnosti bolezni.
Med gastroenterološkimi bolezenskimi stanji pa sta najbolj pogosti Chronova bolezen in ulcerozni kolitis. Prva lahko prizadene katerikoli del prebavne cev, drugi pa je praviloma omejen na debelo črevo. Najpogostejši simptomi KVČB so dolgotrajne driske, bolečine v trebuhu, neješčost in hujšanje, pri otrocih pa zaostanek v rasti.
Sajetova je dodala, da bolezen zaznamujeta utrujenost in izčrpanost, bolniki pa morajo svoje poti zaradi pogostih obiskov stranišča načrtovati vnaprej. Po oceni gastroenterologinje Smrekar je v Sloveniji bolnikov s KVČB okoli 7000. “Imamo pa občutek, da je te bolezni vse več,” je dodala.
Vsi sodelujoči zdravniki so poudarili pomen zgodnjega odkrivanja in zdravljenja vseh naštetih imunsko pogojenih vnetnih boleznih, saj je zdravljenje v takih primerih običajno uspešno, kakovost življenja bolnika pa razmeroma dobra.
Izpostavili so tudi, da številne bolnike spremljajo duševen težave, med njimi depresija, anksioznost in bipolarna motnja. Po besedah Praprotnikove pri obravnavi revmatoloških zdravnikov razmišljajo, da bi v zdravljenje vključili tudi psihologe.
Predstavniki društev bolnikov pa so predstavili delo društev in programe, s katerimi pomagajo bolnikom. Med drugim pripravljajo delavnice, izobraževanja, nudijo telefonsko podporo v primeru stike in psihosocialno pomoč.
“,”Jaka Verbic Miklic”,1652896260,1652896260,sl,15122,306,15121,43,0,NULL,,”V Sloveniji po ocenah okoli 100.000 bolnikov z imunsko pogojenimi vnetnimi boleznimi “,v-sloveniji-po-ocenah-okoli-100-000-bolnikov-z-imunsko-pogojenimi-vnetnimi-boleznimi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1655833938,1655833938
902,15124,”V evropskem tednu o vlogi vsakega od nas za manj rakavih obolenj “,”Evropski teden je dogodek v okviru Zveze evropskih društev proti raku, ki si prizadeva za večjo ozaveščenost o preventivi in za dostopnost zdravljenja.”,”
Ljubljana/Bruselj, 25. maja – Tradicionalni evropski teden boja proti raku, ki bo potekal od danes do konca maja, se bo osredotočil na vlogo vsakega od nas pri hitrejšem uresničevanju načrta EU za boj proti raku. Evropski teden je dogodek v okviru Zveze evropskih društev proti raku, ki si prizadeva za večjo ozaveščenost o preventivi in za dostopnost zdravljenja.
V Sloveniji za rakom letno zboli približno 15.000 ljudi, rak je vodilni vzrok smrti pri moških, pri ženskah pa je na drugem mestu. Najpogostejši raki pri nas, denimo raki kože, debelega črevesa in danke ter pljuč, so povezani z nezdravim življenjskim slogom, čezmernim sončenjem, nepravilno prehrano in kajenjem.
V EU pa so leta 2020 raka odkrili pri 2,7 milijona ljudi, 1,3 milijona pa jih je zaradi raka umrlo, med njimi več kot 2000 mladih. Če ne bomo takoj odločno ukrepali, se bo število rakavih obolenj do leta 2035 povečalo za četrtino, svari Evropska komisija. To po njenih navedbah pomeni, da bi rak lahko postal glavni vzrok smrti v EU.
Z načrtom EU za boj proti raku naj bi izboljšali zgodnje odkrivanje raka s presejalnimi testi, predvideva pa tudi vzpostavitev platforme EU za večji dostop do zdravil.
V Državnem programu obvladovanja raka ugotavljajo, da je pred dobrimi 30 leti pet let po postavitvi diagnoze rak umrlo 70 odstotkov bolnikov, danes pa ta delež znaša 40 odstotkov. Po njihovih opozorilih je še zlasti pri rakih, kjer še ni na voljo najbolj učinkovitih načinov zdravljenja, zelo pomembno, da ljudje prej pridejo do zdravnika in čim prej začnejo zdravljenje. Gre denimo za raka trebušne slinavke in možganske tumorje.
Raziskava, ki je zajela starše iz več evropskih držav in jo je farmacevtska družba MSD predstavila pred evropskim tednom, je pokazala na nujno krepitev prizadevanj za večjo razširjenost cepljenja proti boleznim, ki jih je mogoče preprečiti. Takšno je tudi cepljenje proti okužbam s humanimi papilomavirusi (HPV), ki povzročajo raka materničnega vratu.
Po raziskavi je le nekaj manj kot dve tretjini staršev v Sloveniji seznanjenih s HPV, medtem ko je povprečje znašalo devet odstotnih točk več. Raziskava je pokazala tudi, da se samo slaba polovica anketiranih staršev zaveda, da HPV lahko povzroči raka tako pri ženskah kot tudi pri moških.
Po opozorilih s pogovora ob predstavitvi raziskave v torek bo treba vložiti še veliko dela pri preprečevanju širjenja HPV. Po njihovem mnenju se morajo države bolj potruditi, da bi starši prepoznali pomen cepljenja pri otrocih.
“,”Jaka Verbic Miklic”,1653501240,1653501240,sl,15124,306,15123,43,0,NULL,,”V evropskem tednu o vlogi vsakega od nas za manj rakavih obolenj “,v-evropskem-tednu-o-vlogi-vsakega-od-nas-za-manj-rakavih-obolenj,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1655834120,1655834120
903,15126,”Slovenska stroka poziva k vzpostavitvi registra bolnikov z multiplo sklerozo “,”Kot je na današnji novinarski konferenci izpostavila nevrologinja z ljubljanske nevrološke klinike Alenka Hrovat Ledinek, je za vzpostavitev registra treba imeti sogovornika na ravni države.”,”
Ljubljana, 30. maja – V Sloveniji nimamo registra bolnikov z multiplo sklerozo, čeprav stroka ocenjuje, da v Sloveniji živi od 3100 do 3500 ljudi s to boleznijo. Kot je na današnji novinarski konferenci izpostavila nevrologinja z ljubljanske nevrološke klinike Alenka Hrovat Ledinek, je za vzpostavitev registra treba imeti sogovornika na ravni države.
Po njenih podatkih število bolnikov z multiplo sklerozo narašča tudi v Sloveniji, v Evropi in svetu pa je ta bolezen v zadnjih treh letih porasla za 35 odstotkov.
Nevrologinja z mariborske nevrološke klinike Tanja Hojs Fabjan je dejala, da so pri njih uspeli pripraviti register bolnikov z multiplo sklerozo, prek katerega spremljajo zdravstveno stanje svojih bolnikov. Na ta način spremljajo učinkovitost zdravil in nezaželene učinke teh zdravil. Če se spremeni potek bolezni, je treba spremeniti tudi način zdravljenja, je pojasnila Hojs Fabjanova.
Prvi znaki, da je oseba zbolela za multiplo sklerozo, so zelo različni in nepredvidljivi. Nekateri bolniki se tako soočajo z motorično prizadetostjo, drugi pa navajajo mravljinčenje okončin, je pojasnila.
Multipla skleroza ima namreč več obrazov: odvisno od tipa in poteka bolezni je lahko zgolj tiha spremljevalka ali pa neznansko breme, ki ga bolnik ne more prenašati sam, zato potrebuje pomoč najbližjih, zdravstvenega sistema in podpornih ustanov, so še opozorili sodelujoči na današnji novinarski konferenci. To ilustrira tudi globalni slogan, ki zaznamuje današnji svetovni dan multiple skleroze #MSpovezujemo.
Popolnoma vsi bolniki z multiplo sklerozo pa nujno potrebujejo celostno obravnavo, ki po oceni nevrologov ni zagotovljena vsem slovenskim bolnikom, ampak samo tistim, ki se zdravijo v bolnišnici.
Multipla skleroza je namreč neozdravljiva avtoimunska bolezen in je drugi najpogostejši vzrok invalidnosti pri mladih. Običajno zbolevajo odrasle osebe, stare med 20 in 40 let. Pri multipli sklerozi gre za vnetno stanje, ki uniči mielin in tako upočasni ali povsem zavre prevajanje živčnih impulzov.
Predsednik Združenja multiple skleroze Slovenije Pavel Kranjc, ki je tudi sam zbolel za multiplo sklerozo, meni, da je treba čim prej poiskati ustrezno zdravniško pomoč in stopiti v stik z drugimi bolniki. Ob pomoči najbližjih je moč bolezen uravnavati, je prepričan. Zavzel se je za ustanovitev paliativnih ekip, ki bi bolnike z multiplo sklerozo obravnavale na domu. Tako bi lahko svojcem in lokalnim pomočnikom svetovali, kako ravnati s tovrstnimi bolniki.
Strokovna vodja osebne asistence pri združenju Maja Volarič je postregla s podatkom, da 210 njihovih članov ima osebnega asistenta, od tega 104 člani pa asistenco koristijo na sedežu združenja. Dejala je tudi, da število odobrenih ur, ki se tedensko giblje od 30 do 168 ur, za osebno asistenco ni vedno pravično razdeljeno. Po besedah Volaričeve je prav, da si bolnik pridobi osebno asistenco, ko ne more več skrbeti zase.
Strokovni vodja usmerjene integrirane oskrbe Doma Danice Vogrinec v Mariboru Drago Perger je dejal, da so v okviru pilotnega projekta, ta se je začel leta 2019, ponujali pomoč na domu starejšim od 65 let, ki niso bili nujno bolniki z multiplo sklerozo in so bili brez osebne asistence. Te bolnike so obravnavali v petih ekipah, na njihov dom so prihajali bolničarji in zdravstveni tehniki, skupaj s farmacevti pa so poskrbeli tudi za predpisano terapijo z zdravili.
Ob današnjem svetovnem dnevu mutiple skleroze ljubljanska podružnica združenja ob 15. uri pripravlja pohod na grad Fužine.
“,”Jaka Verbic Miklic”,1653933420,1653933420,sl,15126,306,15125,43,0,NULL,,”Slovenska stroka poziva k vzpostavitvi registra bolnikov z multiplo sklerozo “,slovenska-stroka-poziva-k-vzpostavitvi-registra-bolnikov-z-multiplo-sklerozo,Post,,1,0,1655834309,1655834309
904,15128,”Ob začetku kampanje o zgodnjem odkrivanju raka strokovnjakinje opozorile na odgovornost posameznika “,” “Odgovornost posameznika pri hitri reakciji je velika in lahko bistveno pripomore k zgodaj odkriti bolezni in pravočasnemu zdravljenju,” je dejala predsednica Združenja Onko Net Kristina Modic.”,”
Ljubljana, 1. junija – Ob začetku kampanje #BREZizgovorov o zgodnjem odkrivanju pogostih rakavih obolenj so strokovnjakinje opozorile, da smo za svoje zdravje odgovorni sami. “Odgovornost posameznika pri hitri reakciji je velika in lahko bistveno pripomore k zgodaj odkriti bolezni in pravočasnemu zdravljenju,” pa je dejala predsednica Združenja Onko Net Kristina Modic.
Modičeva je opozorila, da je rak vse večji javnozdravstveni problem. Med vzroki smrti je na prvem mestu pri moških in na drugem mestu pri ženskah. “A več kot tretjino primerov raka je mogoče preprečiti, drugo tretjino pa je ob zgodnjem odkritju mogoče pozdraviti,” je povedala. Opozorila je, da ima bolnik ob zgodaj odkritem raku več možnosti za uspešno in manj naporno zdravljenje, lažji potek bolezni za preživetje.
Podpredsednica Združenja zdravnikov družinske medicine Nena Kopčavar Guček je naštela nekaj najpogostejših znakov rakavih obolenj. To so kožna znamenja, ki se hitro spreminjajo, rastejo, so na izpostavljenih mestih, vsebujejo črn pigment, so asimetrična, nimajo ostrih robov, so privzdignjena ali večja od pol centimetra.
Zaskrbljujoči znaki so tudi različne zatrdline v dojkah, modih, pazduhah in bezgavkah na vratu ter v dimljah in na področju ščitnice. Med znaki je naštela tudi kašelj, ki se ne razvije v prehlad, nerazložljivo hujšanje, kri v blatu in urinu ter krvavi izcedki iz dojke ali vagine po rodni dobi ter nenavadno izgubo las in nenadne spremembe pri izločanju blata. Pomembna pa je tudi družinska zgodovina, torej prisotnost raka v družini.
Predstavnica Zveze slovenskih društev za boj proti raku Katja Jarm je predstavila 12 priporočil proti raku. Med drugim svetujejo, naj posamezniki ne kadijo, naj vzdržujejo normalno telesno težo, so vsak dan telesno dejavni in se prehranjujejo zdravo. Naj ne pijejo alkohola, se čim manj izpostavljajo sončnim žarkom, na delovnem mestu se naj zaščitijo pred rakotvornimi stvarmi in naj preverijo, če so doma izpostavljeni radonu. Cepite otroke proti hepatitisu B in virusu HPV ter se udeležujte presejalnih programov Svit, Zora in Dora, je še pozvala.
Slovenija je sicer po podatkih iz leta 2016 med državami z najvišjo stopnjo smrti zaradi raka. Predstojnica oddelka za onkologijo na mariborskem univerzitetnem kliničnem centru Maja Ravnik je ob tem dejala, da je to res, a da je boljši pokazatelj preživetje, ki pa se povečuje. Z njo se je strinjala strokovna direktorica Onkološkega inštituta Ljubljana Irena Oblak, ki je povedala, da se je preživetje v zadnjih 30 letih povečalo za 100 odstotkov. Tudi Oblakova je opozorila, da je vsak posameznik dolžen opazovati sebe in reagirati, če se pojavijo znaki.
Ambasador programa Svit Franci Strle pa je povabil vse, naj vabila za presejalni program Svit ne zavržejo, ampak že ob prvi pobudi oddajo vzorec. “Nič ne boli, rešuje pa življenja,” je dejal.
“,”Jaka Verbic Miklic”,1654106460,1654106460,sl,15128,306,15127,43,0,NULL,,”Ob začetku kampanje o zgodnjem odkrivanju raka strokovnjakinje opozorile na odgovornost posameznika “,ob-zacetku-kampanje-o-zgodnjem-odkrivanju-raka-strokovnjakinje-opozorile-na-odgovornost-posameznika,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1655834519,1655834519
905,15130,”Ob dnevu krvodajalstva opozorila o povečevanju potreb po darovanju krvi “,”Ob tem dnevu so na Rdečem Križu Slovenije opozorili, da se potrebe po krvi z vračanjem zdravstva v stare tire delovanja znova povečujejo, in predvsem mlade pozvali k njenemu darovanju.”,”
Ljubljana, 4. junija – V Sloveniji danes tradicionalno obeležujemo dan krvodajalstva kot spomin na ta dan leta 1945, ko so bile v Sloveniji odvzete in shranjene prve enote krvi. Ob tem dnevu so na Rdečem Križu Slovenije opozorili, da se potrebe po krvi z vračanjem zdravstva v stare tire delovanja znova povečujejo, in predvsem mlade pozvali k njenemu darovanju.
Po podatkih Zavoda RS za transfuzijsko medicino imamo v Sloveniji 62.000 krvodajalcev, od katerih jih 60 odstotkov kri daruje enkrat na leto, 28 odstotkov dvakrat, 10 odstotkov trikrat, dva odstotka pa štirikrat na leto. Da bi zadostili vsem potrebam, jih mora kri v povprečju darovati od 300 do 350 dnevno. 34 odstotkov darovalcev je žensk, 66 odstotkov pa moških. Letno opravijo 97.000 odvzemov krvi, od tega 45 odstotkov na terenskih akcijah.
Za pridobivanje in zagotavljanje zadostnega števila krvodajalcev je pri nas zadolžen Rdeči križ Slovenije, ki je tudi organizator krvodajalskih akcij na državni ravni. Za zbiranje, predelavo, testiranja ter oskrbo s krvjo in krvnimi pripravki pa je zadolžena transfuzijska služba. Slednjo sestavljajo zavod za transfuzijsko medicino s pripadajočimi centri za transfuzijsko dejavnost, Center za transfuzijsko medicino UKC Maribor in Transfuzijski center Splošne bolnišnice Celje.
Kot je v poslanici ob dnevu krvodajalstva v Sloveniji zapisala predsednica Rdečega Križa Slovenije Vesna Mikuž, je darovanje krvi plemenito in humanitarno dejanje, najvišja vrednota pomoči, ki ima v Sloveniji dolgo tradicijo. Pomembno se ji zdi, da se v krvodajalstvo vključi čim več mladih, “da lahko nadaljujemo nemoteno in vzorno preskrbo s krvjo, ki je ključnega pomena za delovanje zdravstvenega sistema v Sloveniji”.
Spomnila je, da se po epidemiji koronavirusa zdravstvo vrača v normalno delovanje, s čimer se povečuje število posegov, kjer je potrebna kri, zato se potrebe povečujejo. Predvsem mlade je pozvala, naj darujejo kri.
“,”Jaka Verbic Miklic”,1654367820,1654367820,sl,15130,306,15129,43,0,NULL,,”Ob dnevu krvodajalstva opozorila o povečevanju potreb po darovanju krvi “,ob-dnevu-krvodajalstva-opozorila-o-povecevanju-potreb-po-darovanju-krvi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1655836669,1655836669
906,15132,”Podelili nazive Moj zdravnik 2022″,”V Šentjakobskem gledališču v Ljubljani so slovenskim zdravnikom z 12 različnih področij medicine podelili laskave nazive Moj zdravnik in jim s tem izkazali priznanje za opravljeno delo.”,”
Ljubljana, 9. junija – V Šentjakobskem gledališču v Ljubljani so slovenskim zdravnikom z 12 različnih področij medicine podelili laskave nazive Moj zdravnik in jim s tem izkazali priznanje za opravljeno delo. Prireditve se je kot častni gost udeležil tudi minister za zdravje Danijel Bešič Loredan, lanski prejemnik naziva Moj ortoped.
Pri reviji Viva so na podlagi glasov svojih bralcev priznanja zdravnikom podelili že šestindvajsetič: “Glavno besedo pri podeljevanju imajo povsem navadni ljudje, največkrat bolniki, ki jih je življenje postavilo na preizkušnjo in so tako ali drugače morali priti v stik s katerim od zdravnikov.”
Akcija po njihovih besedah ljudem omogoči, da se na poseben način in javno zahvalijo najbolj srčnim zdravnikom in jim sporočijo, delajo dobro.
Glasovanje je potekalo v enajstih določenih kategorijah, za zdravnika, ki ga bralci in bolniki niso mogli uvrstiti v nobeno od njih, pa so lahko glasovali v kategoriji Moj specialist.
Bralci in bolniki so tako nagradili pediatra Jakoba Zapuška, dermatologinjo Tamaro Levičnik, diabetologa Milivoja Piletiča, ginekologa Aljošo Preskarja, hematologa Sama Zvera, kardiologinjo Julijo Tepeš, onkologa Domna Ribnikarja, specialistko javnega zdravja Urško Ivanuš, zobozdravnika Boštjana Novšaka, revmatologinjo Svjetlano Drljača, nevrologa Dejana Georgieva in družinsko zdravnico Natašo Podbregar.
Častni gost na podelitvi je bil minister za zdravje in prejemnik naziva Moj ortoped 2021 Danijel Bešič Loredan, ki je povedal, da je bil lani ob prejemu naziva počaščen. “Danes sem tukaj v nekoliko drugačni, težji vlogi. Izzivov je veliko, ampak se jih lotevam s strastjo zdravnika,” je poudaril.
Na ministrstvu za zdravje so ob tem na Twitterju zapisali, da je akcija pomembna, saj posameznikom prinaša prepoznavanje za odlično delovanje v zdravstvenem sistemu. Ob tem so čestitali vsem dobitnikom priznanj in jim zaželeli uspešno delo.
“,”Jaka Verbic Miklic”,1654799940,1654799940,sl,15132,306,15131,43,0,NULL,,”Podelili nazive Moj zdravnik 2022″,podelili-nazive-moj-zdravnik-2022,Post,,1,0,1655836816,1655836816
907,15134,”S pomočjo zveze organizacij pacientov naj bi bil glas bolnikov bolj slišan “,”Namen zveze bo zagovarjati glas bolnikov, je Lukič Zlobčeva dejala na novinarski konferenci po ustanovni skupščini.”,”
Ljubljana, 14. junija – Več kot 20 organizacij bolnikov meni, da bodo združene močnejše. Zato so danes ustanovile Zvezo organizacij pacientov Slovenije, za predsednico zveze pa izbrale predsednico združenja Spominčica Štefanijo Lukič Zlobec. Namen zveze bo zagovarjati glas bolnikov, je Lukič Zlobčeva dejala na novinarski konferenci po ustanovni skupščini.
“Naš namen je voditi dialog in skupaj z deležniki izboljševati razmere,” je pojasnila. Prepričana je, da bodo skupaj lažje spregovorili v imenu pacientov. Verjame v moč dialoga, ki po njenem mnenju edini lahko pripelje do rezultatov.
Zdaj so posamezna društva, ki delajo v korist pacientov, po njenih besedah razdrobljena, nimajo ne denarja ne prostorov za delo niti pravega sogovornika, na katerega bi se lahko obrnila s svojimi predlogi. V okviru zveze pa jim bo po njenem mnenju veliko lažje uresničevati naloge in cilje.
Zveza si bo prizadevala za večjo kakovost in boljšo dostopnost zdravstvenih storitev, za večjo varnost pacientov in uvedbo novega sistema za upravljanje kakovosti zdravstvenih storitev in varnosti pacientov. Po mnenju zveze je treba skrajšati čakalne vrste in povečati enakopravnost pacientov, ki bi morali biti bolj osveščeni in opolnomočeni glede svojih pravic in dolžnosti.
Zveza se bo nadalje zavzemala za uvedbo nekrivdne odškodninske odgovornosti za škodo pacientom, za ureditev zakonske podpore pri delovanju pacientov in za digitalno preobrazbo zdravstva.
Pri svojem delu želi sodelovati z vsemi osrednjimi deležniki v zdravstvu, tako denimo z ministrstvom za zdravje, Zavodom za zdravstveno zavarovanje Slovenije, Nacionalnim inštitutom za javno zdravje in Agencijo za zdravila in medicinske pripomočke. Napoveduje pa tudi, da se bo vključila v Evropski forum pacientov (EPF).
Zveza je na ustanovni skupščini sprejela sklep, da na ministrstvo pošlje pobudo za pripravo zakona o spodbujanju delovanja, opolnomočenja in vključevanja pacientov in njihovih združenj na področju zdravja. Zakon bi denimo določil, da se zveza financira tudi iz državnega proračuna in proračuna zdravstvenih zavarovalnic.
Zvezo je ustanovilo več kot 20 društev in združenj pacientov, med katerimi so poleg Spominčice denimo Zveza slovenskih društev za boj proti raku in Društvo za zdravje srca in ožilja Slovenije.
“,”Jaka Verbic Miklic”,1655232660,1655232660,sl,15134,306,15133,43,0,NULL,,”S pomočjo zveze organizacij pacientov naj bi bil glas bolnikov bolj slišan “,s-pomocjo-zveze-organizacij-pacientov-naj-bi-bil-glas-bolnikov-bolj-slisan,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1655837542,1655837542
908,15136,”Na konferenci Življenje z rakom po raku o novih presejalnih programih in pravici do pozabe “,” Na prvi okrogli mizi so debatirali o izzivih obstoječih in novih presejalnih programov, na drugi pa spregovorili o pravici do pozabe posameznikov, ki so raka preboleli, zdaj pa se zaradi diagnoze rak soočajo s težavami.”,”
Ljubljana, 21. junija – Na konferenci Življenje z rakom po raku sogovorniki in udeleženci razpravljajo o Evropskem načrtu boja proti raku v praksi. Na prvi okrogli mizi so debatirali o izzivih obstoječih in novih presejalnih programov, na drugi pa spregovorili o pravici do pozabe posameznikov, ki so raka preboleli, zdaj pa se zaradi diagnoze rak soočajo s težavami.
V Sloveniji potekajo trije presejalni programi Zora za zgodnje odkrivanje raka materničnega vratu, Dora za zgodnje odkrivanje raka dojk in Svit za zgodnje odkrivanje raka na debelem črevesju in danki. Prihajata pa dva nova presejalna programa, in sicer za zgodnje odkrivanje raka prostate in pljuč.
Generalna sekretarka Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb Barbara Stegel je ob začetku konference dejala, da smo v Sloveniji lahko ponosni na obstoječe presejalne programe, ki dosegajo dobro udeležbo in uspeh. “Ta uspeh pa lahko pretopimo tudi v številna pravočasna in uspešna zdravljenja in v zadovoljne posameznike, ki se po njih lahko vračajo v normalno življenje,” je povedala.
Oblikovanja presejalnih programov se bodo lotili na Zdravniški zbornici Slovenije, je obljubil podpredsednik zbornice Boštjan Kersnič. Dodal je, da bodo tako odkrili raka, še preden ima bolnik simptome. Predsednica Združenja Onko Net Kristina Modic je prav tako opozorila, da nekatere oblike raka odkrijejo šele v napredujočih stadijih, med njimi pa sta tudi rak pljuč in prostate. “Zato podpiramo vse strokovne napore, da bi se presajanje teh rakov čim prej zgodilo v praksi tudi pri nas,” je dejala ob začetku konference.
Bolniki, ki so raka preboleli, se pogosto soočajo z neenakostjo, težavami na trgu dela in pri dostopu do posojil ter zavarovanj, so opozorili govorci. Zato bi pravico do pozabe morali omogočiti tudi bolnikom z rakom.
Modičeva je dejala, da pravica do pozabe vsebuje kompleksna vprašanja kot je, kdaj bolniku, ki je prebolel raka, preneha status onkološkega bolnika. Kersnič pa je opozoril, da naj pravica do pozabe pomaga bolniku priti nazaj v normalno življenje, ne bi smela pa biti podlaga, da bi bolnik sam ali zdravstveni sistem pozabil na njegovo diagnozo.
Generalna direktorica direktorata za javno zdravje Vesna Kerstin Petrič pa je dejala, da Slovenija v evropskem prostoru pomeni eno gonilnih sil na področju odkrivanja in zdravljenja raka. Pomaga pa tudi, da imamo odlične zdravstvene delavce in bolnike, ki so povezani v številna društva.
“,”Jaka Verbic Miklic”,1655838360,1655838360,sl,15136,306,15135,43,0,NULL,,”Na konferenci Življenje z rakom po raku o novih presejalnih programih in pravici do pozabe “,na-konferenci-zivljenje-z-rakom-po-raku-o-novih-presejalnih-programih-in-pravici-do-pozabe,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1655838421,1655838421
909,15148,”2. konferenca Življenje z rakom po raku”,”Na konferenci so priznani domači gostje razpravljali o dveh zelo pomembnih in aktualnih temah.”,”
21.6. je potekala 2. konferenca Življenje z rakom po raku. Na konferenci so priznani domači gostje razpravljali o dveh zelo pomembnih in aktualnih temah. Prvi del konference naslovil aktualno vprašanje potrebe po širitvi presejalnih programov, pri čemer se omenjata predvsem presejalni program za zgodnje odkrivanje raka pljuč in raka prostate.
Uvodoma je svoj pogled na problematiko predstavil prof. dr. Harry J. de Koning, epidemiolog z univerze Erasmus v Rotterdamu, ki je kot član SAPEA, znanstvenega posvetovalnega telesa EU.
Sledila je panelna razprava na kateri so sodelovali:
Sonja Tomšič, dr. med., nacionalna koordinatorica Državnega programa obvladovanja raka za obdobje 2022 – 2026
dr. Urška Ivanuš, vodja državne komisije za presejalne programe
doc. dr. Martina Vrankar, spec. onkologije in radioterapije in vodja Konzilija za pljučni rak na Onkološkem inštitutu
Dr. Aleš Rozman, direktor Klinike Golnik
doc. dr. Tomaž Smrkolj, urolog z UKC Ljubljana
V drugem delu je beseda tekla o pravici do pozabe. Gre za koncept, ki pomeni, da ozdravljen pacient z rakom ne bi smel biti diskriminiran samo zato, ker je nekoč imel raka. Izhodišča za razpravo je podala dr. Francoise Munier, nekdanja direktorica Evropske organizacije za raziskave in zdravljenje raka (EORTC).
Sledila je panelna razprava z domačimi strokovnjaki v kateri so sodelovali:
doc. dr. Lorna Zadravec Zaletel iz Onkološkega inštituta
prof. dr. Metode Dodič Fikfak, predstojnice Kliničnega inštituta za medicino dela, prometa in športa
Izr. prof. dr. Jaka Cepec iz Ekonomske fakultete
Iva Dimic, poslanka DZ
Posnetek konference je na voljo tukaj: https://livestream.com/accounts/564247/events/7618799/videos/231736321/player
“,”Jaka Verbic Miklic”,1658654760,1658654760,sl,15148,306,15147,43,0,NULL,,”2. konferenca Življenje z rakom po raku”,2-konferenca-zivljenje-z-rakom-po-raku,Post,/sites/43/files/images/news/ali-resnicno-poznamo-potrebe-ljudi-z-redkimi-boleznimi.jpg,1,0,1658654814,1658654891
910,15150,”11. strateška konferenca Vrednost inovacij: Izidi zdravljenj v osrčju sistema”,Vabilo,”
V sredo, 23. novembra 2022 ob 11. uri, vabljeni na
11. strateško konferenco Vrednost inovacij: Izidi zdravljenj v osrčju sistema,
Letos bomo na konferenci obravnavali na vrednosti temelječo zdravstveno obravnavo (NaVTeZ, angleško value-based healthcare), ki v središče postavlja bolnika in njegovo zdravje. Cilj tega pristopa je organizirati zdravstveno obravnavo tako, da z njo dosežemo najboljše rezultate zdravljenja, ki so pomembni za bolnika. Doseganje visoke vrednosti za bolnike bi moral postati krovni cilj vseh zdravstvenih inovacij in izvajanja oskrbe.
Z glavnim govorcem, profesorjem Gregoryjem Katzem (vodja katedre za inovacije in vrednost v zdravstvu na Medicinski fakulteti Univerze v Parizu, ustanovni direktor Konzorcija VBHC in akademski direktor poročila EIT Health) in domačimi strokovnjaki bomo predstavili, kaj bolnikom prinaša na vrednosti temelječa zdravstvena obravnava in kako jo doseči. Predstavili bomo, kako imajo zdravstvo urejeno v tujini in kakšen je odnos izvajalec – plačnik.
Konferenca bo potekala v hibridni obliki – virtualno in v Ljubljani, v Cankarjevem domu, v Klubu CD. O vseh morebitnih spremembah ukrepov proti covidu-19 vas bomo pravočasno obvestili.
Celoten program konference si lahko ogledate TUKAJ.
Veselimo se vaše udeležbe in vas lepo pozdravljamo.
“,”Jaka Verbic Miklic”,1658655120,1658655120,sl,15150,306,15149,43,0,NULL,,”11. strateska konferenca”,11-strateska-konferenca,Post,”/sites/43/files/images/news/11. strateska/Naslovna_fotografija_strateske_konference.jpg”,1,0,1658655247,1669465627
911,15150,”11th Strategic Conference Value of Innovation: Outcomes of treatment at the heart of the system”,Invitation,”
On Wednesday, November 23rd, 2022 at 11 a.m., we are kindly inviting you to
11th Strategic Conference Value of Innovation: Outcomes of treatment at the heart of the system.
The main theme of the event will be value-based healthcare (VBHC), which puts the patient and his health at the center of healthcare. The goal of this approach is to organize medical treatment in such a way that it achieves the best treatment results that are important to the patient. Achieving high value for patients is the overarching goal of health innovation and care delivery.
With the help of our keynote speaker professor Gregory Katz (University of Paris School of Medicine, the Chair of Innovation and Value in Health, the founding director of the VBHC Consortium, and the academic director of the EIT Health report) and domestic experts, we will present what the high value of treatment represents for the patient and how to ensure more advanced and comprehensive treatment of patients. We will look at how health care is regulated abroad and what the provider-payer relationship is like.
The conference will be held in a hybrid form – virtually and live in Ljubljana in Cankarjev dom, Klub CD. We will inform you in due time about any possible changes regarding restrictive measures against COVID-19.
The entire conference program is available HERE.
We look forward to your participation and welcome you.
“,”Jaka Verbic Miklic”,1658655120,1658655120,en,15150,306,15149,43,0,NULL,,”11. strateska konferenca”,11-strateska-konferenca,Post,”/sites/43/files/images/news/11. strateska/Naslovna_fotografija_strateske_konference.jpg”,1,0,1658655247,1669465627
913,15166,”Raziskovalci Kemijskega inštituta prispevali k razvoju personaliziranih metod zdravljenja”,”Izboljšano orodje pomeni razvojni preskok na področju personaliziranih metod zdravljenja, med drugim tudi zdravljenja rakavih obolenj in genetskih bolezni.”,”
Ljubljana, 24. junija – Na Kemijskem inštitutu se lahko pohvalijo z izboljšavo orodja za modifikacijo genoma, t. i. sistema CRISPR/Cas, za katerega so leta 2020 podelili Nobelovo nagrado za kemijo. Izboljšano orodje pomeni razvojni preskok na področju personaliziranih metod zdravljenja, med drugim tudi zdravljenja rakavih obolenj in genetskih bolezni.
Sistem CRISPR/Cas predstavlja revolucionarno orodje, ki omogoča tarčno spremembo genoma. To se lahko s pridom izkorišča v raziskavah, izboljšani produkciji hrane, biogoriv, v zadnjem času pa tudi v zdravljenju različnih bolezni z genetskim ozadjem. Kljub velikemu potencialu pa je sistem mogoče še izboljšati, so sporočili s Kemijskega inštituta.
Prav to je uspelo raziskovalcem na odseku za sintezno biologijo in imunologijo pod vodstvom Romana Jerale. Po njegovih besedah dosežek dopolnjuje tehnološko platformo za napredno in personalizirano zdravljenje, ki ga razvijajo na inštitutu in ga želijo nadgraditi v center za tehnologijo genske in celične terapije.
Dvokomponentni sistem CRISPR/Cas sicer sestavlja encim Cas9 in majhna RNK, ki usmerja molekulske škarje na točno določeno tarčno zaporedje DNK, ki ga želijo spremeniti. V svetu trenutno poteka že več kot 60 kliničnih raziskav zdravljenje številnih bolezni z uporabo tega sistema, je opozoril glavni raziskovalec Duško Lainšček.
“Za nas je bil izziv, da izboljšano terapevtsko delovanje pokažemo še na živalskem modelu kronične mieloične levkemije, kar nam je tudi lepo uspelo. V tem primeru lahko z izboljšavo sistema natančno ciljamo genski zapis, ki je značilen za rakave celice in povzročimo njihov propad,” je dodal.
Kot so navedli na inštitutu, je izvirna ideja njihovih raziskovalcev v tem, “da so protein Cas9 preko obvitih vijačnic povezali z eksonukleazami, encimi, ki skrajšujejo verigo DNK od mesta cepitve, kar so poimenovali CCExo. Tvorba obvite vijačnice omogoči premik eksonukleaze k mestu DNA preloma, kar povzroči dodatno odstranitev nukleotidov z obeh koncev preloma”.
Slednje prepreči, da bi celici lastni mehanizmi prelom DNK popravili brez spremembe, kar izboljša delež izbitja gena na točno določenem mestu. Rezultate raziskave so objavili v ugledni reviji Nature Communications. Poleg Lainščka in Jerale so se pod članek podpisali še Vida Forstnerič, Veronika Mikolič, Špela Malenšek, Peter Pečan, Mojca Benčina, Matjaž Sever in Helena Podgornik.
“,”Jaka Verbic Miklic”,1656044160,1656044160,sl,15166,306,15165,43,0,NULL,,”Raziskovalci Kemijskega inštituta prispevali k razvoju personaliziranih metod zdravljenja”,raziskovalci-kemijskega-instituta-prispevali-k-razvoju-personaliziranih-metod-zdravljenja,Post,,1,0,1662351473,1662351533
914,15168,”Rutinsko cepljenje otrok se je po vsem svetu močno zmanjšalo “,”Leta 2021 zabeležen največji upad rutinskega cepljenja otrok v zadnjih približno 30 letih”,”
Ženeva/New York, 15. julija – Svetovna zdravstvena organizacija (WHO) in Sklad za otroke (Unicef) sta danes opozorila, da je bil leta 2021 zabeležen največji upad rutinskega cepljenja otrok v zadnjih približno 30 letih. 25 milijonov otrok tako ni dobilo življenjsko pomembnih cepiv, kar pomeni, da bi v bližnji prihodnosti lahko prišlo do novih izbruhov bolezni.
Odstotek otrok, ki so prejeli tri potrebne odmerke cepiva proti davici, tetanusu in oslovskemu kašlju (DTP), kar je pokazatelj pokritosti s cepljenjem znotraj držav in med njimi, se je med letoma 2019 in 2021 zmanjšal za pet odstotnih točk s 86 na 81 odstotkov, so sporočili iz WHO.
Posledično je 25 milijonov otrok samo leta 2021 zamudilo enega ali več odmerkov cepiv v okviru rutinskih storitev cepljenja. To je dva milijona več kot tistih, ki so izpustili odmerek leta 2020, in šest milijonov več kot leta 2019, kar kaže na naraščajoče število otrok, ki jih ogrožajo bolezni, ki jih je mogoče preprečiti.
18 milijonov od 25 milijonov otrok v letu 2021 ni prejelo niti enega odmerka cepiva proti DTP, od tega jih večina živi v državah z nizkimi in srednjimi dohodki, največ v Indiji, Nigeriji, Indoneziji, Etiopiji in na Filipinih. Med državami z največjim relativnim povečanjem števila otrok, ki med letoma 2019 in 2021 niso prejeli niti enega odmerka cepiva, pa sta Mjanmar in Mozambik.
Tudi pokritost s prvim odmerkom cepiva proti ošpicam je leta 2021 padla na 81 odstotkov, kar je najnižja raven po letu 2008. Podoben upad cepljenja so zabeležili še pri otroški paralizi in virusu HPV, ki deklice varuje pred rakom materničnega vratu pozneje v življenju.
Po podatkih WHO je Evropa v letu 2021 beležila 94-odstotno pokritost cepljenja proti DTP, kar pa predstavlja le enoodstotno zmanjšanje v primerjavi z letom 2019. Regija je tako preprečila nazadovanje, vendar pa še vedno ostajajo razlike v uspešnosti cepljenja med državami.
V 16 državah regije se je namreč stopnja cepljenosti proti DTP lani zmanjšala. Mnoge od teh držav so države s srednjimi dohodki in ker je 50 odstotkov teh držav bilo pod 90-odstotno pokritostjo cepljenja proti DTP, se je razkorak v enakosti cepljenja med državami v regiji povečal.
Zmanjšanje cepljenosti je na splošno posledica številnih dejavnikov, vključno z večjim številom otrok, ki živijo v konfliktnih in nestabilnih okoljih, kjer je dostop do cepljenja omejen, povečanim številom napačnih informacij in težavami, povezanimi s pandemijo covida-19, kot so prekinitve storitev in dobavne verige.
Države se sedaj soočajo s trojnim izzivom, in sicer nadaljnjim zagotavljanjem cepiv proti covidu-19, povečanjem obsega rednega cepljenja in zagotavljanjem, da necepljeni otroci nadoknadijo vse zamujene odmerke.
“To je rdeči alarm za zdravje otrok. Priča smo največjemu trajnemu upadu cepljenja otrok v eni generaciji, posledice pa se bodo merile v življenjih,” je dejala izvršna direktorica Unicefa Catherine Russell. Pri tem je opozorila, da covid-19 ne bi smel biti izgovor za trenutno stanje, in dodala, da se mora nadoknaditi manjkajoče milijone cepljenj, sicer bomo neizogibno priča novim izbruhom bolezni.
To zgodovinsko nazadovanje v stopnji cepljenosti se dogaja ob hitro naraščajoči stopnji hude akutne podhranjenosti. Podhranjen otrok ima že tako oslabljeno odpornost, zato lahko zaradi izpuščenih cepljenj običajne otroške bolezni zanj hitro postanejo smrtno nevarne.
“,”Jaka Verbic Miklic”,1657859160,1657859160,sl,15168,306,15167,43,0,NULL,,”Rutinsko cepljenje otrok se je po vsem svetu močno zmanjšalo “,rutinsko-cepljenje-otrok-se-je-po-vsem-svetu-mocno-zmanjsalo,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1662352020,1662352056
915,15170,”Ob svetovnem dnevu možganov pozivi k skrbi za njihovo zdravje “,”Človeški možgani so neke vrste človeški računalnik”,”
Ljubljana, 22. julija – Danes obeležujemo svetovni dan možganov. Ta je letos posvečen zdravju tega najpomembnejšega človeškega organa, ki je središče človeškega živčevja pa tudi živčevja vseh ostalih vretenčarjev in večine nevretenčarjev.
Človeški možgani so neke vrste človeški računalnik, ki v milisekundah sprejme informacije, jih obdela in ustvari odgovor. Zato je še posebej pomembna skrb za njihovo zdravje, ob svetovnem dnevu možganov opozarjajo v Lekarniški zbornici Slovenije (LZS).
Vzdrževanje delovanja možganov ali celo njegovo izboljšanje je moč doseči s treniranjem in učenjem, saj se možganska omrežja s tem prilagajajo in spreminjajo, na ta način pa se izboljša delovanje določenih možganskih funkcij.
“To je še posebej izrazito v zelo zgodnjem obdobju otroka – ko shodijo in se trudijo izgovoriti prve besede. V začetku življenja je dovolj že izpostavljenost, saj so se zmožni učiti tujih jezikov hitreje kot v odrasli dobi, kasneje pa za učenje na primer novega jezika, potrebujemo več napora. Ohranjanje dejavnih možganov v poznejšem življenjskem obdobju pa zahteva več truda, zato si moramo te izzive poiskati,” je poudarila predsednica LZS Darja Potočnik Benčič.
Za ohranjanje kondicije možganov moramo skrbeti tudi v zreli dobi. To lahko storimo s spodbujanjem miselnih procesov, deloma pa so lahko v pomoč tudi zdravila rastlinskega izvora.
“Postavljajmo jim nove izzive in vzdržujmo ali celo izboljšajmo njihovo delovanje. Sicer pa, ne glede na starost, za zdravje možganov poskrbimo s tem, da jim omogočimo pestro dejavnost. To med drugim vključuje sprehode, branje, učenje tujih jezikov, športne aktivnosti in kulturno udejstvovanje,” je še dodala Potočnik Benčič.
S prvimi koraki k ohranjanju in izboljševanju možganske funkcije lahko začnemo že danes, tako da v roke vzamemo dobro knjigo, se igramo miselne igre, ali pa se sprostimo ob reševanju ugank ter križank, še svetujejo v LZS.
“,”Jaka Verbic Miklic”,1658464140,1658464140,sl,15170,306,15169,43,0,NULL,,”Ob svetovnem dnevu možganov pozivi k skrbi za njihovo zdravje “,ob-svetovnem-dnevu-mozganov-pozivi-k-skrbi-za-njihovo-zdravje,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1662352265,1662352265
916,15172,”Pred svetovnim dnem tudi letos brezplačno testiranje na hepatitis C”,”Cilj akcije je odkrivanje nezaznavno okuženih – doslej se je v tovrstnih akcijah testiralo več kot 8200 posameznikov.”,”
Ljubljana, 25. julija – V UKC Ljubljana pred četrtkovim svetovnim dnem hepatitisa tudi letos organizirajo brezplačno testiranje na hepatitis C, ki bo na Poljanskem nasipu 58 v Ljubljani potekalo v sredo in četrtek od 14. do 18. ure. K testiranju, ki je brezplačno in anonimno, vabijo vse, še posebej pa posameznike, ki so kadarkoli imeli tveganje za okužbo.
Ob četrtkovem dnevu hepatitisa bodo na infekcijski kliniki UKC Ljubljana v sodelovanju z Inštitutom za mikrobiologijo in imunologijo, Slovenskim društvom bolnikov, obolelih za virusnim hepatitisom SLOVENIJA HEP in študenti medicine iz Projekta Virus pri Društvu študentov medicine Slovenije znova organizirali akcijo testiranja na okužbo z virusom hepatitisa C, je v izjavi za medije napovedala vodja ambulante za virusni hepatitis na infekcijski kliniki Univerzitetnega kliničnega centra (UKC) Ljubljana Mojca Matičič.
Testiranje bo potekalo v sredo in četrtek v stavbi na Poljanskem nasipu 58 v Ljubljani in bo brezplačno, anonimno, za testiranje posameznik ne potrebuje napotnice niti predhodnega naročanja. Ob oddaji vzorca bo na razpolago zdravnik, ki bo odgovarjal na vprašanja.
Cilj akcije je odkrivanje nezaznavno okuženih – doslej se je v tovrstnih akcijah testiralo več kot 8200 posameznikov. S tem so zdravniki rešili marsikatero življenje, saj okužba vrsto let poteka brez bolezenskih znakov. “Zadnji dve leti se je prvič zgodilo, da nismo med akcijo testiranja odkrili nobene osebe, okužene s hepatitisom C, kar posredno najverjetneje nakazuje na to, da se naše dobro delo obrestuje,” je poudarila.
K testiranju še posebej vabijo posameznike, ki so kadarkoli imeli tveganje za okužbo, in posamezniki s pomisleki, da bi morda lahko bili okuženi, saj opažajo nepojasnjeno utrujenost, težave s prebavili, bolečine v sklepih ali mišicah, motnje spanja in anksioznost ter depresijo.
Ob tem je Matičičeva spomnila, da anonimno brezplačno testiranje na okužbo z virusom hepatitisa B in C na navedenem naslovu sicer poteka vsak ponedeljek med 12.00 in 14.30.
Poudarila je pomen cepljenja proti hepatitisu B. Cepivo, ki je eno najbolj varnih in preučevanih v zgodovini medicine, zdravniki po njenih besedah priporočajo vsem, ki doslej še niso bili cepljeni – torej predvsem rojenim pred letom 1992, ko cepljenje proti hepatitisu B še ni bilo vključeno v nacionalni program cepljenja otrok.
Prav tako svetuje preventivno cepljenje proti hepatitisu A, ki ga v letošnjem letu bolj pogosto odkrivajo pri moških, ki imajo spolne odnose z moškimi. Gre za tip hepatitisa, ki za razliko od hepatitisa B in hepatitisa C ni kroničen, zaznamujejo pa ga enaki simptomi – splošno slabo počutje, kasneje pa bolečine v zgornjem delu trebuha, bruhanje, značilni simptom je tudi zlatenica.
Matičičeva je ob tem spomnila na pojav hudo potekajočega akutnega hepatitisa nejasnega vzroka pri otrocih, o katerem so bili strokovnjaki obveščeni v aprilu. Od 1. oktobra lani do danes je bilo po njenih besedah v svetu potrjenih več kot 1000 primerov bolezni pri mlajših od 16 let. V treh četrtinah primerov gre za otroke, mlajše od šest let. Dve tretjini primerov prihajata iz Evrope in Severne Amerike.
Zdravniki so doslej presadili 45 jeter, 22 otrok pa je zaradi bolezni umrlo. Kot je pojasnila, vzrok bolezni še vedno ni znan. Kot enega izmed možnih vzrokov strokovnjaki navajajo okužbo s koronavirusom. Po prebolelem covidu-19 se koronavirus namreč nahaja v črevesju, naknadna okužba s “črevesnimi” adenovirusi pa bi ga lahko spodbudila, da sproži izrazit imunski odziv v jetrih.
V Sloveniji primera hudo potekajočega akutnega hepatitisa še nismo imeli, je pa poudarila, da so slovenski strokovnjaki v pripravljenosti, s strokovnimi priporočili za ukrepanje pa so seznanjeni tako infektologi in pediatri, pa tudi širša strokovna javnost.
“,”Jaka Verbic Miklic”,1658723520,1658723520,sl,15172,306,15171,43,0,NULL,,”Pred svetovnim dnem tudi letos brezplačno testiranje na hepatitis C”,pred-svetovnim-dnem-tudi-letos-brezplacno-testiranje-na-hepatitis-c,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1662352403,1662352821
917,15174,”Slovenija primer dobre prakse odkrivanja in zdravljenja hepatitisa “,”Po ocenah je v Slovenji trenutno še dobrih 1000 neodkritih bolnikov s hepatitisom C.”,”
Ljubljana, 28. julija – Danes obeležujemo svetovni dan hepatitisa, ki letos poteka pod geslom Ne moremo čakati! Infektologinja Mojca Matičič ob tem poudarja, da WHO Slovenijo navaja kot primer dobre prakse odkrivanja in zdravljenja bolnikov, okuženih s hepatitisom C. Po ocenah je v Slovenji trenutno še dobrih 1000 neodkritih bolnikov s hepatitisom C.
Po svetu se vsako leto s hepatitisom B in C na novo okužijo trije milijoni ljudi, za posledicami bolezni umre 1,2 milijona ljudi. Okužbi s hepatitisom B in C sta krivi za 76 odstotkov primerov raka jeter na svetu, ki je šesti najpogostejši rak po številu primerov in tretji najpogostejši rak po smrtnosti.
Svetovni dan hepatitisa letos obeležujemo že šestnajstič. Svetovna zdravstvena organizacija (WHO) ga je določila na rojstni dan odkritelja virusa hepatitisa B nobelovega nagrajenca Barucha Blumberga. Letos dan poteka pod geslom Ne morem čakati!, je v izjavi za medije v ponedeljek povedala vodja ambulante za virusni hepatitis na infekcijski kliniki Univerzitetnega kliničnega centra (UKC) Ljubljana Mojca Matičič.
Geslo po njenih besedah predstavlja obupan klic množice okuženih v številnih državah, tudi evropskih, kjer še vedno vlada neenakost pri obravnavni bolnikov z virusnimi hepatitisi, predvsem hepatitisom C. Bolniki se pogosto soočajo z diskriminacijo in stigmatizacijo, pa tudi kriminalizacijo osebne rabe drog, ki se lahko razkrije ob diagnozi hepatitisa C.
V Sloveniji je stanje povsem drugačno: “Zdravniki aktivno iščemo okužene in jih takoj ustrezno zdravimo, s tem pa preprečimo posledice, kot sta rak na jetrih in ciroza jeter.”
V Sloveniji smo po njenih besedah z inovativnim pristopom prvi na svetu povsem izkoreninili okužbo s hepatitisom v določenih skupinah bolnikov, denimo pri hemofilikih, dializiranih bolnikih, bolnikih s presajenimi organi in bolnikih z virusom HIV.
V Evropi so za zdaj odkrili le desetino okužb s hepatitisom B in četrtino okužb s hepatitisom C, šele tretjino okužb s hepatitisom C pa so pozdravili. Medtem so slovenski strokovnjaki odkrili več kot 80 odstotkov okuženih in jih dve tretjini že pozdravili. S strokovnjaki Evropskega centra za nalezljive bolezni ocenjujejo, da je v Sloveniji trenutno še dobrih 1000 neodkritih bolnikov s hepatitisom C.
Letošnji svetovni dan hepatitisa zaznamuje več novosti. Med njimi spremenjena strategija WHO, saj ugotovitve WHO kažejo, da je pred šestimi leti sprejeto strategijo sposobnih udejanjiti le osem evropskih držav.
Želeno 95 odstotno precepljenost otrok proti hepatitisu B je doseglo le 11 držav, med njimi ni Slovenije, kjer je cepljenih slabih 80 odstotkov otrok. Se je pa delež zdravljenih med novo odkritimi bolniki po letu 2016 povečal za desetkrat.
Zato je WHO maja sprejela sklep o postavitvi nove strategije, ki do leta 2030 predvideva izkoreninjenje virusnih hepatitisov, virusa HIV in spolno prenosljivih okužb. Po strategiji, ki naj bi bila potrjena septembra, bi v rutinske presejalne programe uvrstili tudi presejalna testiranja na hepatitis B in C. Strategija predvideva tudi, da bi v evropski načrt boja proti raku vključili rutinsko cepljenje, testiranje in zdravljenje hepatitisa.
Vodja projekta Virus in študentka ljubljanske medicinske fakultete Eva Selan je pojasnila, da bodo ob svetovnem dnevu hepatitisa javnost o bolezni informirali prek objav na družbenih omrežjih in z ozaveščanjem mimoidočih na stojnicah.
V UKC Ljubljana pred četrtkovim svetovnim dnevom hepatitisa tudi letos organizirajo brezplačno testiranje na hepatitis C, ki je na Poljanskem nasipu 58 v Ljubljani potekalo v sredo in se nadaljuje danes od 14. do 18. ure. K testiranju, ki je brezplačno in anonimno, vabijo vse, še posebej pa posameznike, ki so kadarkoli imeli tveganje za okužbo.
“,”Jaka Verbic Miklic”,1658982840,1658982840,sl,15174,306,15173,43,0,NULL,,”Slovenija primer dobre prakse odkrivanja in zdravljenja hepatitisa “,slovenija-primer-dobre-prakse-odkrivanja-in-zdravljenja-hepatitisa,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1662352516,1662352516
918,15176,”V Sloveniji ob odpustu iz porodnišnic dojenih več kot 90 odstotkov otrok “,”Dojenje pomeni tudi zaščito okolja, predvsem vodnih virov ter zagotavlja okoljsko trajnost”,”
Celje, 2. avgusta – Tako kot drugod po svetu tudi v Sloveniji danes obeležujemo svetovni dan dojenja, letos s sloganom Zavzemajmo se za dojenje: Izobražujmo in podpirajmo. Delež dojenih otrok ob odpustu iz porodnišnic je v Sloveniji več kot 90-odstoten, tu so zajeti tako izključno kot tudi delno dojeni. Postopoma nato mamice začnejo dojenje opuščati.
Kot je za STA povedala predsednica Društva svetovalcev za laktacijo in dojenje Slovenije Cvetka Skale, ki je danes v Celju pripravilo srečanje nosečnic in doječih mater, žal v Sloveniji nimamo sistema za beleženje dojenih otrok po odhodu iz porodnišnic. To sicer beležijo nekateri zdravstveni domovi, ni pa enotnega sistema, kjer bi bili zajeti vsi otroci.
“Realno pa je veliko žensk, ki dojijo. Škoda le, da to nimamo prikazano. Seveda je pa izjemnega pomena podpora dojenju. Tako s strani strokovnjakov, kot tudi domačih in laikov. Podporo jim mora nuditi celoten sistem v državi. Posebej izobraženi strokovnjaki, zdravstveni delavci, delodajalci in širša skupnost. Vsi se moramo truditi, da dojenje postane nekaj samoumevnega,” je še dejala Skaletova.
Mlada mamica Kaja iz Velenja, ki je v pričakovanju drugega otroka, pa je za STA povedala, da bo tudi tega otroka dojila, saj bo tako dobil več hranilnih snovi kot, če bi bil hranjen z umetnim mlekom. Po njenih besedah je prvega otroka dojila 10 mesecev, imela je lepe izkušnje, čeprav je od začetka potrebovala mesec dni, da se je navadila na pravilno dojenje.
Dojenje je ključnega pomena tudi za doseganje ciljev trajnostnega razvoja do leta 2030. Cilji prizadevanj so izboljšati zdravje mater in otrok, zagotoviti zdrav in enak začetek življenja vsem otrokom, z dojenjem preprečevati podhranjenost otrok povsod po svetu, zagotoviti varno prehranjevanje dojenčkov in otrok v času krize, predvsem tudi v času pandemije covida-19, ter vplivati na pojav revščine, saj je dojenje brezplačno.
Kot navajajo v omenjenem društvu, dojenje pomeni tudi zaščito okolja, predvsem vodnih virov ter zagotavlja okoljsko trajnost.
Glavni cilj letošnjih prizadevanj za podporo dojenju pa je ustvarjanje in krepitev verige podpore dojenju. Predvsem z vidika, da morajo biti vsi, ki podpirajo starše pri dojenju in jim pomagajo, tudi sami dovolj izobraženi. Predvsem bi morali biti ključna podpora dojenju zdravstveni sistem v državi, delodajalci in skupnost, vsi ti pa morajo imeti pri tem tudi podporo vlade.
Navedeni cilji so povezani s prednostmi dojenja, kot so izključno dojenje in nadaljevanje dojenja ob mešani hrani, ki predstavlja optimalen način prehrane za otroka, dojenje ne obremenjuje družinskega proračuna in omogoča enak začetek življenja vsem, ne glede na spol, raso in narodno pripadnost, z dojenjem prejme otrok optimalna hranila in tudi zaščitne dejavnike, kar pozitivno vpliva na njegovo zdravje in tudi na preživetje, dojenje je pomembno povezano z boljšim zdravjem mater, ima tudi pozitivne učinke z vidika ekologije.
V celjskem mestnem parku pa bo v soboto potekal deveti festival Dojiva se.
“,”Jaka Verbic Miklic”,1659415320,1659415320,sl,15176,306,15175,43,0,NULL,,”V Sloveniji ob odpustu iz porodnišnic dojenih več kot 90 odstotkov otrok “,v-sloveniji-ob-odpustu-iz-porodnisnic-dojenih-vec-kot-90-odstotkov-otrok,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1662353004,1662353004
919,15180,”Česa nas je naučil COVID-19″,”Od samega začetka pandemije COVID-19 je bila raziskovalna farmacevtska industrija zavezana k sodelovanju med raziskovalno in zdravstveno skupnostjo in se je se pri spopadanju z izbruhom bolezni zanašala na svojo globalno vodilno znanost, ljudi in vire.”,”
Od samega začetka pandemije COVID-19 je bila raziskovalna farmacevtska industrija zavezana k sodelovanju med raziskovalno in zdravstveno skupnostjo in se je se pri spopadanju z izbruhom bolezni zanašala na svojo globalno vodilno znanost, ljudi in vire. Sadovi tega sodelovanja so vidni danes. Dve leti po tem, ko je Svetovna zdravstvena organizacija (WHO) razglasila COVID-19 za pandemijo, rezultati govorijo sami zase:
To je izjemen dosežek, saj v običajnih okoliščinah raziskovanje in razvoj cepiva v povprečju trajata od 10 do 15 let. Poleg tega imajo lahko zdravila ključno vlogo pri reševanju življenj, sproščanju zmogljivosti v enotah za intenzivno nego in zdravljenju bolnikov z dolgim COVIDom. Takšen odziv ne bi bil mogoč brez poglobljenega razumevanja informacijske RNA (mRNA), ki je rezultat desetletij znanstvenih raziskav na tem področju, in brez tesnega sodelovanja med institucijami EU, vladami, zdravstvenimi sistemi, regulatorji in raziskovalno farmacevtsko industrijo. V zvezi s tem je bilo med pandemijo vzpostavljenih več kot 370 projektov sodelovanja, od katerih večina vključuje prenos tehnologije.
Zagotavljanje pravičnega dostopa do inovativnih cepiv proti COVID-19 po vsem svetu je bilo velik izziv, naša panoga pa si je neprestano prizadevala za njegovo uresničitev. Danes glavni izziv ni pomanjkanje dobave cepiv, temveč zmožnosti zdravljenja v zdravstvenih sistemih in sprejemanje cepiva. Zato se neporabljene zaloge cepiv COVID-19 po vsem svetu hitro povečujejo. Število proizvedenih odmerkov (12,1 milijarde) vedno bolj presega število uporabljenih odmerkov (9,2 milijarde). Po podatkih COVAX se je distribucija cepiv razširila in presegla milijardo dobavljenih odmerkov. Dobave za države z nizkimi in srednjimi dohodki pa so presegle štiri milijarde odmerkov. Hkrati se stopnje cepljenja pri primarnem cepljenju z dvema odmerkoma po svetu močno razlikujejo. V EU segajo od 95 % na Portugalskem do 35 % v Bolgariji , v Afriki pa ostajajo zelo nizke, saj je polno cepljenih le 15 % odraslega afriškega prebivalstva.
Pandemija je razkrila tudi ranljivost sistemov cepljenja po vsem svetu, saj je bilo rutinsko cepljenje moteno, zaradi česar je na milijone otrok in odraslih ostalo necepljenih, povečalo pa se je tudi tveganje za morebitne izbruhe bolezni po zaprtjih družbe (lockdownih). Medtem ko so si vlade močno prizadevale za ponovno vzpostavitev programov cepljenja otrok, so bile hujše posledice zaznane pri mladostnikih (vključno s cepljenjem proti humanemu papiloma virusu za preprečevanje raka) in odraslih, kjer stopnje precepljenosti niso vedno znane.
Izkušnje s cepljenjem proti COVID-19 so pokazale tudi, da lahko digitalizacija omogoča dnevno spremljanje stopnje precepljenosti s cepivi, kar bi lahko bil precedens za vsa nadaljnja rutinska cepljenja. To bi bilo potrebno združiti s programi za nadomeščanje izpadov cepljenj in stalnimi prizadevanji za povečanje precepljenosti za varovanje javnega zdravja. V Evropi je glavna težava pri vseh cepivih z izjemo cepiv proti COVID-19 pomanjkanje vseevropskih podatkov in pravočasnega spremljanja stopnje precepljenosti v celotnem življenjskem obdobju.
Evropski zdravstveni podatkovni prostor bi moral vključevati tudi cepljenja, pri čemer bi moral imeti Evropski center za preprečevanje in obvladovanje bolezni (ECDC) osrednjo vlogo pri zbiranju in izmenjavi podatkov.
Raziskave in razvoj so svetu dale varna in učinkovita orodja proti COVID-19, vendar trenutne razmere poudarjajo potrebo po obravnavi vrste kratko- do srednjeročnih prednostnih nalog:
Obstaja tudi nekaj dolgoročnih priložnosti, ki jih velja izkoristiti za boljšo pripravljenost na prihodnje pandemije:
Zaščita intelektualne lastnine je imela osrednjo vlogo pri razvoju cepiv in zdravil proti COVID-19. Obstoječi okvir za varovanje intelektualne lastnine je omogočil hiter razvoj in povečanje obsega proizvodnje cepiv proti COVID-19 ter tako dokazal, da je del rešitve in ne ovira. Z zagonom največjega števila projektov sodelovanja v zgodovini (trenutno 377 za cepiva ) za namene hitre širitve globalne proizvodnje danes pomanjkanje cepiv po svetu ni več težava. Danes je namreč splošno sprejeto dejstvo, da težava ni več v proizvodnji odmerkov, temveč v zmogljivostih dobave teh odmerkov prebivalcem v državah z nižjimi srednjimi in nizkimi dohodki.
Pomanjkanje naložb in infrastrukture za podporo cepljenja odraslih ter splošno razširjeno oklevanje glede cepiv sta bila prav tako opredeljena kot ključni oviri za uporabo cepiva med pandemijo. Na drugi strani pa se je izkazalo, da povečanje števila cepilnih mest in izvajalcev cepljenja ter boljša digitalna komunikacija z javnostjo izboljšujejo dostopnost in izvajanje cepljenja.
Kljub takšnemu napredku pa se razprava, ki poteka v Svetovni trgovinski organizaciji (STO), nelogično osredotoča na vprašanja intelektualne lastnine in namenja premalo pozornosti dejanskim trgovinskim vprašanjem, ki bi lahko vplivala na oskrbo bolnikov, kot na primer odprava izvoznih omejitev in uvedba ukrepov za podporo čezmejni distribuciji kritičnega blaga. To bi bilo mogoče izvesti na primer s pobudo za trgovino in zdravje (TAHI) pri STO. Predlogi, kot sta tako imenovana “opustitev TRIPs” ali “besedilo četverice – “Quad Text” , lahko povzročijo zmanjšanje inovacij in škodujejo konkurenčnosti industrije, ko je to najbolj potrebno, ne da bi kakor koli prispevali k skupnemu cilju pravičnega dostopa do cepiv in zdravljenja.
V primeru pandemije lahko nacionalni neusklajeni ukrepi škodljivo vplivajo na oskrbo z zdravili v drugih državah. Med takšne ukrepe spadajo enostranske trgovinske omejitve, ki so se izkazale za bistvena ozka grla pri distribuciji, in nacionalne zahteve za obvezno kopičenje zalog, ki so preprečile prerazporeditev cepiv in zdravil tja, kjer bi jih bolniki najbolj potrebovali. Poleg tega nepreglednost dobavne verige na nižjih stopnjah proizvajalcem preprečuje, da bi dobavo usmerili tja, kjer je povpraševanje bolnikov. To je bistvena pomanjkljivost sistema, ki bi jo EU morala odpraviti z vzpostavitvijo integriranega sistema, ki bi povezoval oskrbo na začetku verige s povpraševanjem bolnikov. Za to pa bi bila potrebna usklajena opredelitev pomanjkanja in podatki o potrebah bolnikov v državah članicah s strani Evropskega centra za nadzor bolezni (ECDC). Za spremljanje načina dajanja zdravil na različne trge in njihove porabe na nacionalni ravni bi bilo treba uporabljati tudi podatkovne zbirke evropskega sistema za verifikacijo zdravil (EMVS) .
EU in nacionalne regulatorne agencije so se na pandemijo odzvale z izdajo smernic, v katerih so opisane regulatorne prožnosti za cepiva in zdravila za COVID-19. Številne tovrstne prožnosti bi lahko bile koristne tudi pri spopadanju s prihodnjimi pandemijami in tudi po kriznih razmerah , zlasti tam, kjer so se EU in države članice tesno uskladile, da bi zagotovile racionalizirano regulatorno okolje. Med takšnimi primeri so prožnosti in smernice, ki so spodbujale uporabo virtualnih in digitalnih metod za izvajanje rutinskih nalog, prožnosti na področju jezika in označevanja, ki bi jih bilo mogoče uporabiti za reševanje pomanjkanj in omejitev dobave po koncu pandemije, pa tudi prožnosti glede odstopanj za GSO in sprotnega pregledovanja. Poleg tega je pandemija pokazala tudi, da je treba upravne postopke revidirati, kadar so obstoječe regulatorne zahteve preveč obremenjujoče ali odvečne (prožnosti glede sprememb kakovosti, uvoznih testov in sprememb protokolov).
Usklajevanje javnih naročil na ravni EU je med pandemijo reševati izzive, ki so zelo značilni za zdravstveno krizo : usklajevanje med državami članicami za pravično in pregledno dodelitev sprva omejenih količin zalog ter potreba po preprečevanju težav, povezanih z nacionalnimi distribucijskimi kanali, ali tveganja neučinkovitega kopičenja zalog. Usklajevanje pa je hkrati tudi poudarilo pomembne izzive, ki jih je mogoče pričakovati pri pobudah za skupna naročila po krizi: različne sposobnosti držav članic za oceno razmer, razumevanje lokalne epidemiologije ter zmogljivosti in zmožnosti nacionalnih zdravstvenih sistemov za učinkovito uporabo zdravila ali izvajanje programov cepljenja ter različno dojemanje vrednosti zdravila in potrebe po hitrem ukrepanju v imenu bolnikov. Ti dejavniki lahko povzročijo velike zamude pri doseganju skupnega dogovora, kar povzroča zamude pri dostopu bolnikov do zdravil.
Skupno naročanje mora zato temeljiti na prostovoljnem sodelovanju in biti strukturirano tako, da se racionalizira dodeljevanje zdravil in preprečijo negativne posledice enostranskih nacionalnih pobud za kopičenje zalog med izrednimi razmerami na področju javnega zdravja. Zlasti pri cepivih so za reševanje vprašanj dostopa po pandemijah primernejši drugi ukrepi, kot na primer večja dodelitev sredstev za programe imunizacije. Programi imunizacije, zlasti izven pediatrije, so pokazali precejšnje pomanjkljivosti pri izvajanju in uspešnosti. Med drugim, na primer, proračun za primarno preventivo s cepljenjem proti izčrpavajočim in življenjsko nevarnim nalezljivim boleznim znaša manj kot 0,5 % proračunov za zdravstveno varstvo (manj kot 5 EUR na prebivalca) in je v večini držav EU v zadnjih petih letih ostal nespremenjen.
Medtem, ko se je EU med pandemijo na težave odzivala sproti, je ustanovitev organa HERA prvi korak k temu, da Evropa postane pripravljena na odzivanje na globalne zdravstvene grožnje . Partnersko povezovanje z razvijalci bo ključnega pomena za uspeh organa HERA v smislu zagotavljanja nemotenega usklajevanja, izmenjave informacij in združevanja znanja.
Ključnega pomena bo zagotovitev ustreznega financiranja HERA, zagotovitev robustnega in predvidljivega okvira za varovanje intelektualne lastnine, ki bo družbe spodbujal k razvoju in komercializaciji medicinskih protiukrepov na način, ki izpolnjuje cilje javnega zdravja. Jasnost glede lastništva in nadzora intelektualne lastnine podpira zadovoljevanje potreb javnega zdravja, saj pomaga pridobiti podporo industrije in zagotoviti njeno sodelovanje, hkrati pa pospešuje cilje komercializacije in distribucije. Poleg tega mora HERA prispevati tudi k pravičnemu dostopu do medicinskih protiukrepov za prednostne skupine prebivalstva po vsem svetu. Za doseganje tega cilja bo ključno sodelovanje z vladami in drugimi svetovnimi partnerji.
Varnost in učinkovitost seveda ostajata bistveni prioriteti pri vseh ukrepih ali medicinskih protiukrepih, razvitih za nujne primere, toda tveganje resnih neželenih dogodkov bo vedno obstajalo. Zlasti, kadar se nov izdelek ali intervencija hitro uvaja, in ko medicinske protiukrepe uporabljajo večje populacije bolnikov kot običajno. V takšnih okoliščinah je treba zagotoviti učinkovit dostop do ustreznega nadomestila za bolnike, ki so utrpeli resne neželene dogodke. Sistemi odškodnin brez krivde temeljijo na načelu, da so oškodovanci upravičeni do odškodnine, ne da bi jim bilo treba dokazati, da je nasprotna stranka kriva za škodo, in ne da bi jim bilo treba dokazati kakršno koli napako proizvoda, ki je škodo povzročil. HERA mora zagotoviti, da bodo bolniki, ki utrpijo poškodbe zaradi medicinskih protiukrepov, ki se razvijajo ali dobavijo preko HERE, lahko dobili odškodnino. Posamezniki lahko tako pridejo do takojšnje odškodnine brez izpostavljenosti stroškom, zamudam in negotovostim sodnega postopka. Vzpostavitev sistemov za odškodnino brez krivde v vseh državah članicah EU je nujna, dopolnjuje pa jo odškodninski sklad EU, ki bo podprl države članice pri teh prizadevanjih. Takšni ukrepi bi imeli bistveno vlogo pri zagotavljanju zaupanja javnosti v uporabljene zdravstvene protiukrepe in bi okrepili sposobnost EU za učinkovito odzivanje na nujne zdravstvene primere.
COVID-19 je pokazal, da je odprta in pravočasna izmenjava vzorcev patogenov in informacij o genetskem zaporedju bistvena za hiter odziv na pandemijo ter za zaščito pred morebitnimi nacionalnimi epidemijami. V primeru COVID-19 bi lahko zaradi enomesečne zamude pri dostopu do vzorcev virusa SARS-CoV-2 izgubilo življenje dodatnih 400.000 ljudi. Zamude niso le hipotetični scenarij: od leta 2014, ko je začel veljati Nagojski protokol o dostopu do genskih virov ter pošteni in pravični delitvi koristi, ki izhajajo iz njihove uporabe, se je dostop do patogenov slabšal. Do danes je k Nagojskem protokolu pristopilo 134 držav, mnoge med njimi pa so uvedle nacionalno zakonodajo na tem področju, ki lahko vpliva na izmenjavo patogenih materialov in povezanih genskih informacij. Aktualna ureditev zahteva dvostranska pogajanja o dostopu in pogodbah o delitvi koristi, ki so dolgotrajna in onemogočajo kakršnokoli možnost hitrega odzivanja na nujne primere v javnem zdravju. Potrebna je pravna varnost glede statusa patogenih materialov v okviru zakonodaje o dostopu in delitvi koristi, patogeni in z njimi povezane informacije pa morajo biti izvzeti iz dvostranskih obveznosti Nagojskega protokola in nacionalnih izvedbenih predpisov. Pri tem bi EU lahko prevzela vodilno vlogo pri iskanju učinkovitega in usklajenega mednarodnega pristopa, s katerim bi zagotovili hitro in predvidljivo izmenjavo patogenov in povezanih informacij.
Ena od redkih pozitivnih posledic COVID-19 je bilo pospešeno uvajanje digitalnega zdravstva. Bistveno je, da se ta zagon ne izgubi, toda njegovo vzdrževanje bo zahtevalo vlaganja v digitalno infrastrukturo in osredotočanje na upravljanje podatkov, da se zagotovi maksimalna interoperabilnost sistemov tako znotraj nacionalnih zdravstvenih sistemov kot med njimi. V prihodnje morajo države EU okrepiti naložbe v infrastrukturo ter uskladiti procese in standarde za povečanje učinkovitosti. Prav tako bo dobro delujoč Evropski zdravstveni podatkovni prostor ključnega pomena za zagotovitev inovacijam prijaznega ekosistema, ki bo izboljšal sposobnost EU za zagotavljanje oskrbe in povečal pripravljenost na prihodnje pandemije.
Poleg tega je treba pregledati in izboljšati finančne spodbude za podporo telemedicine in oskrbe na daljavo, da bi trajnostno podprli zagotavljanje e-oskrbe. Nenazadnje se je kljub nekaterim zelo potrebnim izboljšavam (kot na primer zmožnost vključevanja udeležencev kliničnih preskušanj COVID-19) uporaba digitalnega zelenega potrdila v številnih državah izkazala za koristno pri obvladovanju pandemije. V prihodnje bi lahko bilo digitalno zeleno potrdilo prvi korak k uvedbi e-cepilne kartice, ki bi zajemala vsa razpoložljiva cepiva in medsebojno povezljivega panevropskega sistema obstoječih ali na novo vzpostavljenih nacionalnih cepilnih informacijskih sistemov.
Številni zdravstveni sistemi so bili med pandemijo preobremenjeni, saj so delovali na ravni zmogljivosti ali celo nad njo, zato so se kratkoročno osredotočili le na reševanje neposrednih potreb v krizi. Izjemen pritisk bo zato verjetno imel posledice za splošno prebivalstvo, ki bodo ostale še dolgo po tem, ko bo pandemija izzvenela. Potrebna je nova vizija evropskih zdravstvenih sistemov , ki bo obravnavala sedanje in prihodnje potrebe, se odmaknila od reaktivnih in kratkoročnih pristopov in uvedla presoje in načrtovanje za dolgoročne zdravstvene rezultate. Takšen pristop bi, na primer moral vključevati:
[1] AirfinEuropeanity (2022)
[2] Ibid
“,”Jaka Verbic Miklic”,1662825660,1662825660,sl,15180,306,15179,43,0,NULL,,”Česa nas je naučil COVID-19″,cesa-nas-je-naucil-covid-19,Post,”/sites/43/files/images/news/Cesa nas je naucil kovid.jpg”,1,0,1662827316,1662827876
920,15182,”Začenja se svetovni teden dojenja “,”Zavzemajmo se za dojenje: izobražujmo in podpirajmo”,”
Ljubljana, 1. avgusta – Od danes do nedelje obeležujemo svetovni teden dojenja, katerega namen je usmeriti pozornost družbe k ohranjanju in spodbujanju dojenja. Teden bo letos minil v znamenju slogana Zavzemajmo se za dojenje: izobražujmo in podpirajmo. Na NIJZ ob tem poudarjajo, da je materino mleko pomembne vir hranil, zaščite pred boleznimi, varnosti in tolažbe.
Svetovna zdravstvena organizacija (WHO) po navedbah Nacionalnega inštituta za javno zdravje (NIJZ) priporoča začetek dojenja v prvi uri po porodu. Izključno dojenje naj traja do dopolnjenega šestega meseca otrokove starosti, nato pa naj starši postopoma uvajajo hranilno primerno in varno mešano hrano, ob čemer naj mati nadaljuje z dojenjem. Obdobje dojenja naj traja, dokler to ustreza materi in otroku, do dveh let ali več.
“Dojenje po enem letu ne ustreza vsakomur in s tem ni nič narobe. A če mama želi dojiti in če otrok dojenje potrebuje, je smiselno z njim nadaljevati, četudi otrok obiskuje vrtec in četudi se je mama vrnila na delovno mesto,” poudarja raziskovalka na NIJZ Zalka Drglin.
Predsednica nacionalnega odbora za spodbujanje dojenja pri Unicefu Slovenija, pediatrinja Andreja Tekauc Golob, poudarja, da dojenje ni nekaj samoumevnega. Ob tem je spomnila, da so v preteklosti matere o dojenju izvedele od svojim mater in babic, sedaj pa so pri dojenju dostikrat osamljene in se srečujejo s težavami.
V Sloveniji večina mater začne dojiti svojega novorojenčka. Več kot polovica dojenčkov se doji še po šestem mesecu starosti, kar sta razveseljiva podatka, poudarjajo pri NIJZ.
V povprečju matere v Sloveniji svoje otroke dojijo sedem mesecev, najdaljše zabeleženo obdobje pa je bilo 26 mesecev, kažejo podatki raziskave, izvedene v letih 2017 in 2018.
Unicef in Svetovna zdravstvena organizacija sta v skupni izjavi vlade držav pozvala, naj povečajo sredstva za zaščito, promocijo in podporo programov dojenja, še posebej za ranljivejše družine.
Vlade ob tem pozivata tudi, naj zdravstvene delavce zaščitita pred neetičnim vplivom oglaševanja proizvajalcev mlečnih nadomestkov.
V Sloveniji si prizadevamo za dobre prakse dojenja, varovanje pred promocijo mlečnih nadomestkov in za prehranjevanje otrok s sveže pripravljeno pestro mešano lokalno pridelano hrano, poudarjajo na NIJZ.
Ob tem so dodali, da našteto prinaša prednosti za zdravje otrok, družin in planeta. Zaradi kratkoročnih in dolgoročnih pozitivnih učinkov na zdravje otrok in mater in zaradi okoljskih prednosti v primerjavi z rabo mlečnih nadomestkov je dojenje koristno tudi za družbo.
“,”Jaka Verbic Miklic”,1659367440,1659367440,sl,15182,306,15181,43,0,NULL,,”Začenja se svetovni teden dojenja “,zacenja-se-svetovni-teden-dojenja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1663082731,1663082732
921,15184,”Diabetološko združenje svari pred zavajajočimi oglasi za zdravila “,”V združenju opozarjajo, da zdravnik diabetolog s tem imenom in priimkom v Sloveniji ne obstaja, kakor tudi ne inštitut za diabetologijo”,”
Ljubljana, 19. avgusta – Oglas o “čudežnem zdravilu” inspilar za sladkorno bolezen, ki naj bi ga prodajal predstojnik inštituta za diabetologijo Lojze Bizjak, je nevarno zavajanje, svarijo v Diabetološkem združenju Slovenije. V združenju opozarjajo, da zdravnik diabetolog s tem imenom in priimkom v Sloveniji ne obstaja, kakor tudi ne inštitut za diabetologijo.
Tudi vse druge trditve o načinu delovanja pripravka in njegovi domnevni učinkovitosti, navedene v promocijskem članku, niso resnične, so besede predsednice Diabetološkega združenja Slovenije Draženke Pongrac Barlovič povzeli na spletni strani Zdravniške zbornice Slovenije.
V združenju takšne oglase ostro obsojajo. “Hkrati imamo zaupanje, da znajo ljudje sami prepoznati, da se izza takšnih oglasov skrivajo lažne obljube ter da se v primeru dvomov posvetujejo z izbranim zdravnikom, medicinsko sestro, edukatorico ali diabetologom,” še opozarjajo.
Tudi v zdravniški zbornici opozarjajo na ponoven pojav lažnih zavajajočih oglasov za prodajo čudežnih zdravil, za katere je bila v tem primeru zlorabljena tudi spletna stran enega od medijev. Oglas je bil namreč objavljen na spletni strani, ki je posnemala podobo spletnega portala MMC.
V zdravniški zbornici so sum kršitve zakonodaje prijavili tržnemu inšpektoratu ter agenciji za zdravila in medicinske pripomočke.
“,”Jaka Verbic Miklic”,1660923000,1660923000,sl,15184,306,15183,43,0,NULL,,”Diabetološko združenje svari pred zavajajočimi oglasi za zdravila “,diabetolosko-zdruzenje-svari-pred-zavajajocimi-oglasi-za-zdravila,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1663083086,1663083086
922,15186,”Tobak in alkohol glavna vzroka za nastanek raka po vsem svetu”,”Skoraj polovica rakavih obolenj po vsem svetu je posledica znanega dejavnika tveganja, predvsem tobaka ali alkohola”,”
Pariz, 20. avgusta – Skoraj polovica rakavih obolenj po vsem svetu je posledica znanega dejavnika tveganja, predvsem tobaka ali alkohola, je pokazala obsežna globalna študija, ki je bila v petek objavljena v reviji Lancet. Študija kaže, da lahko spremembe vedenja pomagajo zmanjšati nevarnost bolezni, poroča francoska tiskovna agencija AFP.
Študija je bila izvedena v okviru obsežnega raziskovalnega programa, ki ga je financirala fundacija Billa Gatesa. Pokazala je, da je 44,4 odstotka smrti zaradi raka na svetu mogoče pripisati znanemu dejavniku tveganja. Več kot polovica smrti zaradi raka pri moških je posledica znanih dejavnikov tveganja, pri ženskah pa več kot tretjina.
Študija je analizirala vpliv 34 dejavnikov tveganja in potrdila že splošno znano dejstvo, da je tobak daleč največji dejavnik, ki prispeva k nastanku raka, saj je odgovoren za 33,9 odstotka primerov, sledi pa mu alkohol s 7,4 odstotka.
Ker so bili glavni dejavniki tveganja, ki so leta 2019 prispevali k svetovnemu bremenu raka, vedenjski, bi zmanjšanje izpostavljenosti tem spremenljivim dejavnikom tveganja zmanjšalo umrljivost zaradi raka po vsem svetu, ugotavlja študija.
“Kajenje ostaja vodilni dejavnik tveganja za nastanek raka po vsem svetu, k bremenu raka pa različno pomembno prispevajo tudi drugi dejavniki,” je dejal direktor Inštituta za merjenje in vrednotenje zdravja na Medicinski fakulteti Univerze v Washingtonu in eden od glavnih avtorjev študije Christopher Murray.
Dodal je, da breme raka ostaja pomemben javnozdravstveni izziv, ki se po vsem svetu povečuje.
Vendar pa približno polovice primerov raka ni mogoče pripisati znanemu dejavniku tveganja, kar pomeni, da morajo zgodnje diagnosticiranje in učinkovito zdravljenje spremljati prizadevanja za okrepitev preventive, še ugotavlja študija.
Študija o globalnem bremenu bolezni je obsežen regionalni in globalni raziskovalni program, v katerem sodeluje na tisoče raziskovalcev iz večine držav po vsem svetu.
“,”Jaka Verbic Miklic”,1661009460,1661009460,sl,15186,306,15185,43,0,NULL,,”Tobak in alkohol glavna vzroka za nastanek raka po vsem svetu”,tobak-in-alkohol-glavna-vzroka-za-nastanek-raka-po-vsem-svetu,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1663083171,1663083171
923,15188,”V Združenju Europa Donna pred rožnatim oktobrom s projektom osveščanja po Sloveniji “,”Europa Donna Slovenija letos obeležuje 25 let osveščanja o pomenu zdravega načina življenja in zgodnjega odkrivanja raka ter podpore bolnicam in njihovim svojcem”,”
Ljubljana, 29. avgusta – Združenje Europa Donna Slovenija letos obeležuje 25 let osveščanja o pomenu zdravega načina življenja in zgodnjega odkrivanja raka ter podpore bolnicam in njihovim svojcem. Septembra se za uvod v rožnati oktober, mednarodni mesec osveščanja o raku dojk, s projektom Kava z Europo Donno odpravljajo na teren. Obiskali bodo vse regije.
Združenje Europa Donna Slovenija v letošnjem letu praznuje 25 let svojega delovanja. Že 25 let povezujejo zdrave ženske, bolnice in njihove svojce, zdravnike, strokovne organizacije in podpornike. Z različnimi akcijami in dogodki osveščajo o raku dojk in rakih rodil ter opozarjajo na pomen zdravega načina življenja in zgodnjega odkrivanja bolezni ter si prizadevajo za celostno obravnavo bolnic z rakom dojk in raki rodil, učinkovito zdravljenje, ustrezno rehabilitacijo in psihosocialno podporo bolnicam in njihovim svojcem, so poudarili v sporočilu za javnost.
Zaradi zavedanja pomena osveščanja v lokalnem okolju se bodo septembra odpravili na teren. Obiskali bodo po dva kraja v vsaki regiji.
Kot so pojasnili, bodo na stojnicah mimoidoče osveščali o pomenu preventive in zgodnjega odkrivanja bolezni, predstavili dejavnosti združenja, delili promocijski material, pripravili zabavne nagradne naloge, ponudili kavo ter prikazali pravilen samopregled dojk na silikonskem modelu. Bolnicam in njihovim svojcem pa bodo na voljo za pogovor in morebitna vprašanja v zvezi z diagnozo in zdravljenjem.
V združenju bodo tako obiskali Mursko Soboto, Ljutomer, Maribor, Slovensko Bistrico, Slovenj Gradec, Ravne na Koroškem, Celje, Velenje, Trbovlje, Radeče, Postojno, Cerknico, Ilirsko Bistrico, Izola, Sežana, Krško, Sevnica, Bohinj, Jesenice, Domžale, Vrhniko, Novo mesto, Kočevje, Tolmin in Novo Gorico. Termini obiskov so dostopni na povezavi: sta.si/q7Ij9C.
“,”Jaka Verbic Miklic”,1661787360,1661787360,sl,15188,306,15187,43,0,NULL,,”V Združenju Europa Donna pred rožnatim oktobrom s projektom osveščanja po Sloveniji “,v-zdruzenju-europa-donna-pred-roznatim-oktobrom-s-projektom-osvescanja-po-sloveniji,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1663083453,1663083453
924,15190,”Ob mednarodnem dnevu ozaveščanja o predoziranjih zaradi drog opozorila o povečanem številu smrtnih primerov”,”V društvu Stigma opozarjajo, da se v svetu in v Sloveniji število smrti zaradi predoziranj z drogami povečuje”,”
Ljubljana, 31. avgusta – Ob današnjem mednarodnem dnevu ozaveščanja o predoziranjih zaradi drog v društvu Stigma opozarjajo, da se v svetu in v Sloveniji število smrti zaradi predoziranj z drogami povečuje. V društvu se zato med drugim zavzemajo za uvedbo zdravila nalokson, ki je poleg varnih sob za uporabo drog ključna aktivnost za preprečevanje smrtnih predoziranj.
Kot poudarjajo v Društvu za zmanjševanje škode zaradi drog Stigma, podatki Nacionalnega inštituta za javno zdravje že od leta 2014 nakazuje trend rasti števila umrlih. V letu 2019 so zabeležili že 74 smrti, kar Slovenijo po podatkih Evropskega centra za spremljanje drog in zasvojenosti z drogami (EMCDDA) uvršča v vrh po številu umrlih takoj za Škotsko, Irsko in skandinavskimi državami.
Še vedno je največ smrti povezanih z opiati, predvsem s heroinom in metadonom, se pa povečuje tudi število smrti zaradi kokaina. V društvu menijo, da bi podatek o številu smrti moral biti vreden odziva na lokalni in nacionalni ravni, ki bi skupaj v sodelovanju pripravili celostno strategijo boja proti predoziranjem. “Zaenkrat ustreznega odziva še ni. Tudi na nov Nacionalni program za področje drog in akcijski načrt, ki bi se odzval na stanje zadnjih let, čakamo že skoraj dve leti,” so opomnili.
Aktualni razpis ministrstva za zdravje prav tako ne omenja odziva na smrti kot prioriteto. Kot izpostavljajo, pa je še bolj zaskrbljujoč podatek, da so se za 30 odstotkov zmanjšala sredstva, ki jih bo ministrstvo namenilo področju obravnave problema uporabe nedovoljenih drog v naslednjih treh letih.
V društvu Stigma v okviru širitve dejavnosti programov v obdobju 2020-2022, ki jih sofinancira ministrstvo za zdravje, večji poudarek dajejo izobraževanju o varnejši uporabi drog kot tudi spodbujanju in motiviranju uporabnikov k manj tveganim načinom uporabe drog, kot so vdihavanje in kajenje drog na foliji, kjer smrtnega predoziranja skoraj ni. Obenem uporabnikom redno zagotavljajo sterilni pribor za varnejšo uporabo drog. V svoje programe pa so uspeli pridobiti tudi osebe, ki se prej niso vključevale. “Gre za skrito populacijo uporabnikov drog s pomanjkljivimi informacijami o možnih tveganjih, ki jih prinese uporaba drog,” so pojasnili. V programe društva je bilo v letu 2021 vključenih 715 različnih oseb.
Že vrsto let pa se zavzemajo za uvedbo zdravila nalokson, ki je po mnenju EMCDDA poleg varnih sob za uporabo drog najpomembnejša aktivnost za preprečevanje smrtnih predoziranj. Od marca 2021 je nazalni nalokson oz. nyxoid dostopen uporabnikom Centrov za preprečevanje in zdravljenje odvisnih od prepovedanih drog, a ukrep po mnenju društva ne doseže zadostnega števila uporabnikov. Tako vztrajajo, da je potrebna še večja dostopnost, predvsem za uporabnike, ki niso vključeni v centre po sistemu “Nalokson za domov”, saj po podatkih največ ljudi umre doma ali na javnih mestih.
V Sloveniji pa prav tako še vedno obstajajo tudi potrebe po varnih sobah. Kot povzema EMCDDA, je uspeh varnih sob v varnejši uporabi drog, v večji dostopnosti do drugih zdravstvenih in socialnih programov, ter v zmanjšanju javne uporabe drog. Izjemno pomembne ugotovitve so, da vzpostavitev varnih sob ne povzroči povečanja uporabe drog, niti ni zaznane povečane kriminalne aktivnosti, so še poudarili v društvu.
“,”Jaka Verbic Miklic”,1661960280,1661960280,sl,15190,306,15189,43,0,NULL,,”Ob mednarodnem dnevu ozaveščanja o predoziranjih zaradi drog opozorila o povečanem številu smrtnih primerov”,ob-mednarodnem-dnevu-ozavescanja-o-predoziranjih-zaradi-drog-opozorila-o-povecanem-stevilu-smrtnih-primerov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1663083575,1663083575
925,15192,”September je mesec ozaveščanja o raku pri otrocih “,”Vsako leto približno 80 otrok in mladostnikov zboli za rakavo boleznijo, približno 20 odstotkov jih ta boj izgubi”,”
Ljubljana, 1. septembra – Društvo Junaki 3. nadstropja si septembra prizadevajo ozaveščati o raku pri otrocih in jim s tem pomagati v boju za življenje. Vsako leto približno 80 otrok in mladostnikov zboli za rakavo boleznijo, približno 20 odstotkov jih ta boj izgubi. Društvo pa zbira tudi sredstva za nakup prenosne infuzijske črpalke, ki bo pomagala pri zdravljenju otrok.
V Sloveniji je rak še vedno tretji najpogostejši vzrok smrti pri osebah, mlajših od 15 let. S pomočjo medicine vsako leto sicer narašča odstotek otrok, ki v bitki z rakom zmagajo, se pa povečuje skupno število tistih, ki zbolijo. Najpogostejša med rakavimi obolenji otrok je levkemija, ki predstavlja 30 odstotkov vseh rakov pri otrocih, so sporočili iz društva Junaki 3. nadstropja.
Neprofitno društvo, ki združuje starše otrok z rakavimi obolenji, si bo v septembru prizadevalo zbrati sredstva za prenosno infuzijsko črpalko, ki bo pomagala pri zdravljenju na pediatrični kliniki. Tovrstno črpalko je možno namestiti v nahrbtnik ali infuzijsko stojalo, uporaba pa je možna tudi na domu, so sporočili.
Simbol raka pri otrocih je zlata pentlja, ki si jo lahko vsak posameznik pripne v znak solidarnosti in podpore. Pomoč junakom pa se lahko izkaže tudi z donacijo na spletni strani društva ali z sms-sporočilom JUNAKI5 na 1919, sporočajo iz društva.
Že danes bo društvo organiziralo Emin pohod od Škofje Loke do Pediatrične klinike v Ljubljani. Gre za tradicionalen pohod v spomin na Emo, ki je boj z rakom izgubila. Vikend pa bodo Junaki 3. nadstropja preživeli na Gorenjskem, kjer bodo med drugim plezali na ferati in obiskali Kekčevo deželo, družili se bodo tudi z vrhunskimi športniki.
“Naj bo september mesec, ko poskrbimo, da bodo junaki 3. nadstropja slišani, razumljeni in oskrbljeni ves čas, njihov boj z boleznimi pa zato lažji ter zmaga še bolj prepričljiva,” so še sporočili.
“,”Jaka Verbic Miklic”,1662046800,1662046800,sl,15192,306,15191,43,0,NULL,,”September je mesec ozaveščanja o raku pri otrocih “,september-je-mesec-ozavescanja-o-raku-pri-otrocih,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1663083659,1663083659
926,15194,”Unicef: Precepljenost otrok po svetu vztrajno upada “,”Precepljenost otrok s cepivom proti davici, tetanusu in oslovskem kašlju je padla na najnižjo raven po letu 2008, so danes sporočili iz Unicefa”,”
New York, 5. septembra – Precepljenost otrok s cepivom proti davici, tetanusu in oslovskem kašlju je padla na najnižjo raven po letu 2008, so danes sporočili iz Unicefa. Pri organizaciji opozarjajo, da je izjemno nazadovanje na tem področju povzročila pandemija covida-19, vse več otrok po svetu pa tako ogrožajo smrtonosne bolezni, ki bi jih bilo mogoče preprečiti.
Svet je upal, da si bodo od pandemije covida-19, ki je povzročila največje nazadovanje na področju cepljenja v zadnjih treh desetletjih, obremenjeni programi rutinskega cepljenja otrok vsaj v lanskem letu opomogli in da bodo cepiva prejeli tudi otroci, ki jih v letu 2020 niso, so v izjavi za javnost zapisali pri Unicefu.
Namesto tega je precepljenost s cepivom proti davici, tetanusu in oslovskem kašlju padla na najnižjo raven od leta 2008. 19 milijonov otrok v letu 2019 ni prejelo enega ali več odmerkov tega cepiva v okviru rutinskih storitev cepljenja. Leta 2020 je bilo takih otrok 23 milijonov, lani pa 25 milijonov, od česar jih 18 milijonov ni prejelo niti enega odmerka omenjenega cepiva.
Pri organizaciji ob tem opozarjajo, da večina necepljenih otrok živi v državah z nizkimi ali srednjimi dohodki, največ v Indiji, Nigeriji, Indoneziji, Etiopiji in na Filipinih.
Stopnja precepljenosti s prvim odmerkom cepiva proti ošpicam je lani padla na 81 odstotkov, kar je prav tako najnižja stopnja po letu 2008. S prvim odmerkom v letu 2021 ni bilo cepljenih 24,7 milijona otrok, kar je 5,3 milijone več kot v letu 2019, dodatnih 14,7 milijona otrok pa ni prejelo potrebnega drugega odmerka.
V primerjavi z letom 2019 lani 6,7 milijona otrok ni prejelo tretjega odmerka cepiva proti otroški paralizi, 3,5 milijona pa jih ni prejelo prvega odmerka cepiva proti HPV, piše v izjavi.
Poleg pandemije covida-19 so strmemu upadu precepljenosti otrok botrovali tudi drugi dejavniki, med drugim naraščanje števila otrok, ki živijo v konfliktnih in negotovih razmerah, kjer je dostop do cepljenja pogosto otežen. Pomembni dejavniki, povezani s pandemijo covida-19, so tudi naraščanje števila dezinformacij, motnje v storitvenih in dobavnih verigah, preusmeritev virov na prizadevanja za sanacijo kriznih razmer in zaščitni ukrepi, ki so omejili dostopnost do cepljenja.
Pri Unicefu opozarjajo, da bodo posledice vrzeli, ki je nastala na področju cepljenja, močno vplivale na življenja cele generacije otrok. To vrzel je po njihovi oceni mogoče zmanjšati le z večjim vlaganjem v programe cepljenja in z večjo predanostjo tem programom. Ponekod so se namreč po podatkih Unicefa upadanju precepljenosti uspešno izognili, na primer v Ugandi in Pakistanu.
“,”Jaka Verbic Miklic”,1662392520,1662392520,sl,15194,306,15193,43,0,NULL,,”Unicef: Precepljenost otrok po svetu vztrajno upada “,unicef-precepljenost-otrok-po-svetu-vztrajno-upada,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1663083793,1663083793
927,15196,”Poziv mladim, naj se v dobro svojih potomcev že pred nosečnostjo odpovedo pitju alkohola “,” V dobrobiti potomcev je to še zlasti pomembno med mladimi, saj bodo nekoč verjetno postali starši”,”
Ljubljana, 9. septembra – Ob dnevu fetalnega alkoholnega sindroma na NIJZ opozarjajo javnost na škodljivost alkohola pred zanositvijo in med nosečnostjo. V dobrobiti potomcev je to še zlasti pomembno med mladimi, saj bodo nekoč verjetno postali starši. Mladi vrstnikom sporočajo, naj se v dobro svojih potomcev že pred nosečnostjo odpovedo pitju alkohola, poudarjajo na NIJZ.
Dan fetalnega alkoholnega sindroma, ki ga obeležujemo danes, je mednarodni dan ozaveščanja o posledicah izpostavljenosti še nerojenega otroka alkoholu (Dan FASD). Odnos bodočih staršev do alkohola in nosečnosti je namreč odraz širšega družbenega odnosa do pitja alkohola, so zapisali na spletni strani Nacionalnega inštituta za javno zdravje (NIJZ).
Alkohol je dokazano teratogen, kar pomeni, da lahko pri zarodku oziroma plodu povzroči vrsto razvojnih motenj, tako v rasti kot v razvoju posameznih telesnih organov. Prizadeti so lahko različni organi in tkiva, odvisno od njihovega razvoja glede na čas v nosečnosti, v katerem pride do izpostavljenosti otroka alkoholu. Najbolj ranljivi pa so otrokovi možgani, ki se razvijajo skozi celotno nosečnost.
Posledice izpostavljenosti alkoholu so lahko spontani splavi, mrtvorojenost, moten psihološki razvoj in fizična rast po rojstvu. Izpostavljenost alkoholu pred rojstvom lahko pri otroku povzroči vrsto doživljenjskih stanj, znanih kot motnje fetalnega alkoholnega spektra.
Otroci imajo lahko različne motnje v telesnem, duševnem in kognitivnem razvoju, ki vodijo do težav v vedenju, razumevanju, sklepanju in presojanju, mišljenju, spominu ter učenju. Ker so te motnje prirojene, ostanejo za vse življenje.
Pomembno je zavedanje, da je najvarneje že pred zanositvijo prenehati piti pijače, ki vsebujejo alkohol. Ni “varnega” obdobja med nosečnostjo za pitje alkoholnih pijač. Otrokovi možgani se razvijajo skozi celotno nosečnost in alkohol lahko kadarkoli poškoduje različne dele možganov, še opozarjajo na NIJZ.
“,”Jaka Verbic Miklic”,1662738360,1662738360,sl,15196,306,15195,43,0,NULL,,”Poziv mladim, naj se v dobro svojih potomcev že pred nosečnostjo odpovedo pitju alkohola “,poziv-mladim-naj-se-v-dobro-svojih-potomcev-ze-pred-nosecnostjo-odpovedo-pitju-alkohola,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1663084026,1663084026
928,15198,”Cepljenje proti gripi tudi letos brezplačno “,”Cepivo proti gripi bo v Slovenjo predvidoma dostavljeno sredi septembra”,”
Ljubljana, 10. septembra – Cepljenje proti gripi bo tudi letos brezplačno za vse osebe z obveznim zdravstvenim zavarovanjem, ki se bodo želele cepiti. Cepivo proti gripi bo v Slovenjo predvidoma dostavljeno sredi septembra, tako da se bo cepljenje z oktobrom zagotovo lahko začelo, so STA sporočili z ministrstva za zdravje.
Na Nacionalnem inštitutu za javno zdravje (NIJZ) so za STA pojasnili, da je Slovenija za letošnjo jesensko-zimsko sezono respiratornih obolenj naročila 250.000 odmerkov cepiva proti gripi. To je manj kot lani, ko so naročili 360.000 odmerkov cepiva.
Nacionalna koordinatorica cepljenja Marta Grgič Vitek z NIJZ je na petkovi novinarski konferenci o spremenjenih cepivih proti covidu-19 dejala, da pričakuje, da bo cepljenje proti gripi tako kot lani tudi letos mogoče opraviti sočasno s cepljenjem proti covidu-19.
Na NIJZ cepljenje priporočajo vsem prebivalcem, ki želijo sebe in svoje bližnje zaščititi pred boleznijo. Je pa cepljenje še posebej priporočljivo za skupine z večjim tveganjem za težek potek bolezni, to so starejši od 65 let, kronični bolniki in njihovi družinski člani, osebe, ki imajo izrazito povečano telesno težo, majhnim otrokom in njihovim družinskim članom, nosečnicam in njihovim družinskim članom, zdravstvenim delavcem in sodelavcem ter zaposlenim v domovih starejših občanov, ki so pri svojem delu izpostavljeni nevarnosti okužbe ali pri delu lahko prenesejo okužbo na druge osebe, ter drugim delavcem v nujnih službah.
Bolezen pri mladih bolnikih brez kroničnih bolezni večinoma poteka kot nekajdnevno vročinsko stanje z znaki obolenja dihal ter bolečinami v mišicah in sklepih. Pri ogroženih skupinah prebivalstva pa lahko bolezen poteka s težjo klinično sliko s pogostimi zapleti, kot so virusne in bakterijske pljučnice, in tudi z višjo smrtnostjo. Pri teh skupinah cepljenje zmanjšuje tveganje za hospitalizacije in tudi smrt zaradi bolezni same ali njenih zapletov.
“,”Jaka Verbic Miklic”,1662824820,1662824820,sl,15198,306,15197,43,0,NULL,,”Cepljenje proti gripi tudi letos brezplačno “,cepljenje-proti-gripi-tudi-letos-brezplacno,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1663084110,1663084110
931,15219,”Koronarni klub Ljubljana ob 40-letnici delovanja poudaril pomen vseživljenjske rehabilitacije “,”Letno okoli 5000 ljudi doživi srčni infarkt.”,”
Ljubljana, 14. septembra – Letno okoli 5000 ljudi doživi srčni infarkt. Ti potrebujejo rehabilitacijo, ki pa ne sme biti kratkotrajna, ampak mora biti vseživljenjska, so danes poudarili na novinarski konferenci ob 40- letnici društva Koronarni klub Ljubljana.
Osnova dejavnost društva je vseživljenjska rehabilitacija srčno-žilnih bolnikov in preprečevanje bolezni srca in ožilja. Njegova predsednica Petra Simpson Grom pa je ob današnji predstavitvi dela izpostavila tudi, da si želijo izboljšati položaj bolnikov, hkrati pa sistemsko izboljšati tudi delovanje svoje organizacije.
Na današnjem dogodku so posebno pozornost namenili pomenu vseživljenjske rehabilitacije po akutnem koronarnem dogodku. “Rehabilitacija ni trenutek v življenju posameznika, ko se mora soočiti z boleznijo in ko se mora soočiti z zdravljenjem. Rehabilitacija ne pomeni 14-dnevno ali trimesečno zdravljenje v ambulantnem okolju, ampak je to vseživljenjski proces,” je izpostavil predstojnik kliničnega oddelka za srčno-žilne bolezni Univerzitetnega kliničnega centra (UKC) Ljubljana Borut Jug.
“Vključitev v program kardiovaskularne rehabilitacije, ki jo svojim članom nudi Koronarni klub Ljubljana, omogoča izboljšanje preživetja in življenjske kakovosti ter zmanjšuje tveganje za vnovični infarkt in smrt,” je še dodal.
Svojo izkušnjo s premagovanjem srčno-žilne bolezni je delil tudi član ljubljanskega društva Aleš Sterle, ki je poudaril, da sta mu pomoč in rehabilitacija, ki ju nudi klub pomagali, da se je ponovno postavil na noge.
Po podatkih predsednika Zveze koronarnih društev in klubov Slovenije Janeza Polesa je v Sloveniji 17 koronarnih klubov s 3800 člani. “To je veliko, po moji oceni pa bistveno premalo. V svetu namreč velja, da sta sodobna medicina in tehnologija sposobni rešiti akutni problem srca ali dogodek na srcu, ampak če potem temu ne sledita ambulantna in vseživljenjska rehabilitacija, je to nedokončana zgodba,” je povedal Poles. Opozoril pa je tudi na odgovornost zdravnikov, saj je bolnike treba na tovrstno rehabilitacijo napotiti.
“,”Jaka Verbic Miklic”,1663141800,1663141800,sl,15219,306,15218,43,0,NULL,,”Koronarni klub Ljubljana ob 40-letnici delovanja poudaril pomen vseživljenjske rehabilitacije “,koronarni-klub-ljubljana-ob-40-letnici-delovanja-poudaril-pomen-vsezivljenjske-rehabilitacije,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1665301841,1665301899
932,15221,”Ob svetovnem dnevu limfoma opozorila o pomenu celostne oskrbe bolnikov”,”Ob današnjem svetovnem dnevu limfoma v Slovenskem združenju bolnikov z limfomom in levkemijo opozarjajo na pomen celostne oskrbe bolnikov s krvnimi raki”,”
Ljubljana, 15. septembra – Ob današnjem svetovnem dnevu limfoma v Slovenskem združenju bolnikov z limfomom in levkemijo opozarjajo na pomen celostne oskrbe bolnikov s krvnimi raki. Ob peti obletnici programa Skupaj na poti do zdravja so njegovi predstavniki na današnji novinarski konferenci poleg samega zdravljenja izpostavili tudi ključen vpliv socializacije bolnikov.
Program celostne rehabilitacije Skupaj na poti do zdravja, ki poteka pod okriljem Slovenskega združenja bolnikov z limfomom in levkemijo, v septembru praznuje peto obletnico delovanja. Od sprva pilotnega projekta program zdaj postaja reden. Do danes ga je zaključilo že 200 bolnikov.
“Ne da se opisati hvaležnosti bolnikov ob koncu, ko zaključujejo ta program, ko pišejo, da smo jim pomagali se vrniti nazaj v življenje,” je dejala izvršna direktorica Slovenskega združenja bolnikov z limfomom in levkemijo Kristina Modic. S temi besedami je na novinarski konferenci STA kluba v sodelovanju z omenjenim združenjem izpostavila pomen rehabilitacije in celostne obravnave bolnikov.
Med pogosto zapostavljenimi vidiki pri obravnavi je prehranjevanje bolnikov. Zaradi bolezni, ki je zelo obremenjujoča za metabolizem, in zdravil, ki še dodatno prizadenejo posamezne organe, je prehranjevanje teh bolnikov zelo težavno. Tako jim, kot poudarja zdravnica s kliničnega oddelka za hematologijo UKC Ljubljana Irena Preložnik Zupan, ves čas pomagajo, da bolnik ostane v stanju, ki omogoča normalno ozdravitev.
S tem vsaj deloma ohranjajo tudi mišično maso, ki je ključnega pomena pri zelo pomembni fizični aktivnosti. S projektom so zato bolnikom omogočili sobna kolesa, s katerimi lahko ob nekajminutni dnevni vadbi ohranjajo mišično maso, prav tako pa rekreacija pozitivno vpliva na bolnikovo voljo, je dejala Preložnik Zupanova.
Poleg zdravljenja program bolnikom omogoča tudi socializacijo. “Marsikdo niti ne zna ubesediti, niti ne ve, da ima določene težave, ki jih je potem slišal od ostalih bolnikov, in je nato ugotovil, da so to tudi njegove težave. To delo v majhnih skupinah je tako pomembno za bolnike s podobnimi diagnozami, da so mnogi ob zaključku programa povedali, da njihovo življenje nikakor ne bi bilo takšno, kot so ga pridobili s tem programom,” je še poudarila.
Vodja projektov Slovenskega združenja bolnikov z limfomom in levkemijo Brina Žagar je prav tako izpostavila pomen podpore in pomoči med in po zdravljenju. V skupinskih rehabilitacijah namreč bolniki pogosto spoznajo ljudi s podobnimi izkušnjami in uvidijo, da niso sami.
Po zaključenem zdravljenju pa se morajo ti ljudje ponovno soočiti z zunanjim svetom, zato je pomembno, da ohranjajo skrb za zdravje tudi v tem obdobju, je dejal predsednik Združenja hematologov Slovenije Matevž Škerget. Opozoril je na pomen skrbi za duševno zdravje, prav tako pa na nujnost telesne aktivnosti in opore bližnjih.
Za vse, ki delujejo v programu, pa je najbolj izpolnjujoče, ko vidijo uspešne zgodbe posameznikov, ki ponovno zaživijo. “Kar zmoremo in znamo, vložimo v to, da človeku pomagamo. Ne da se opisati pri stiskah dobrega občutka, ko strokovnjaki in združenje človeka podpremo na različnih področjih, da se lahko vrne v svoje okolje,” je še dejala Modiceva.
Za uresničitev projekta so se povezali civilna družba, stroka in ministrstvo za zdravje, ki je program pet let tudi sofinanciralo. V tem obdobju so ga kot kakovostnega prepoznali tako doma kot tudi v tujini. Pogosto namreč kot primer dobre prakse gostujejo tudi v državah Zahodne Evrope. Kljub temu pa sogovorniki poudarjajo, da zgolj program ni dovolj. Po njihovem mnenju bi morali za njeno celostno reševanje težavo nujno naslavljati tudi na državni ravni.
Folikularni limfom je sicer ena od krvnih bolezni, o katerih ozaveščajo v septembru, sicer mesecu krvnih bolezni. Ker so krvni rak in ostale bolezni krvi zelo obremenjujoče za bolnike, je ključnega pomena njihovo pravočasno odkritje.
“,”Jaka Verbic Miklic”,1663228320,1663228320,sl,15221,306,15220,43,0,NULL,,”Ob svetovnem dnevu limfoma opozorila o pomenu celostne oskrbe bolnikov”,ob-svetovnem-dnevu-limfoma-opozorila-o-pomenu-celostne-oskrbe-bolnikov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1665302024,1665302024
933,15223,”Na drugi nacionalni konferenci poudarek na novi strategiji obvladovanja demence “,”Prvi nacionalni program za obvladovanje demence je bil napisan za obdobje 2016-2020, zato zdaj delovna skupina pri ministrstvu za zdravje pripravlja predlog drugega nacionalnega programa”,”
Ljubljana, 15. septembra – Nova strategija obvladovanja demence v Sloveniji 2020-2030 bo nadaljevala glavne cilje prve, to so zgodnja diagnoza bolezni, dostopnost do ustrezne obravnave in zdravljenja ter vzpostavitev usklajene podpore osebam z demenco, njihovim družinam in oskrbovalcem, je na današnji nacionalni konferenci povedala Nadja Čobal z ministrstva za zdravje.
Prvi nacionalni program za obvladovanje demence je bil napisan za obdobje 2016-2020, zato zdaj delovna skupina pri ministrstvu za zdravje pripravlja predlog drugega nacionalnega programa, to je strategije obvladovanja demence v Sloveniji za obdobje do 2030, je dejala Čobalova na drugi spletni konferenci. To je ob bližajočem se svetovnem dnevu Alzheimerjeve bolezni, 21. septembru, organiziral Nacionalni inštitut za javno zdravje (NIJZ), v sodelovanju z Znanstvenoraziskovalnim centrom SAZU ter Spominčico – Alzheimer Slovenija. Naslov konference z mednarodno udeležbo je Stanje in izzivi na področju Alzheimerjeve bolezni v Sloveniji v luči nove realnosti.
Drugi nacionalni program za obvladovanje demence v Sloveniji izhaja iz dobrih rešitev prve strategije, te pa bo lahko tudi nadgradil s pomočjo mednarodnih dokumentov in orodij, ki so bili razviti po letu 2016. V novi strategiji na področju demence v Sloveniji je po navedbah Čobalove navedenih devet ciljev, ki sledijo ciljem Svetovne zdravstvene organizacije. Med drugim vključujejo osveščanje, zgodnjo diagnostiko, podporo svojcem po diagnozi, organizacijo strokovne podpore in zmanjševanje stigme.
Kot je izpostavila, je eden od teh ciljev vzpostavitev registra demence. To je po njenem mnenju zelo pomembno, ker brez ustreznih podatkovnih baz ni možno kakovostno in učinkovito načrtovati in izvajati nobene strateške zdravstvene politike, torej tudi strategije za obvladovanje demence. Spomnila je tudi, da je eden od ciljev nove strategije tudi spodbujanje raziskav o demenci in vzpostavitev nacionalnega centra za demenco.
Kot pomemben sestavni del nove strategije, ki jo pripravlja interdisciplinarna delovna skupina, v katero je vključeno tudi društvo Spominčica, je akcijski načrt ukrepanja za obdobje najmanj dveh let. Po oceni predsednice društva Štefanije Lukič Zlobec je zelo pomembno, da strategijo spremlja akcijski načrt, ki bo vseboval tudi oceno potrebnih finančnih sredstev.
V nadaljevanju je Janja Romih z ministrstva za delo, družin, socialne zadeve in enake možnosti opozorila na nekatere izzive na področju Alzheimerjeve bolezni v Sloveniji v luči nove realnosti. Poudarila je, da je bilo ob prvi strategiji leta 2016 oseb z demenco približno 30.000, ob pripravi zadnje govorimo že o 34.000 osebah z demenco. V prihodnosti po njenih navedbah lahko pričakujemo bistveno povečanje števila teh oseb, kar vpliva tudi na socialno varstvo in na povečanje oseb z demenco pri uporabnikih socialno varstvenih storitev in programov.
Na ministrstvu po njenih besedah že kar nekaj časa opažajo veliko povečanje števila oseb z demenco v domovih za starejše. Danes je takšnih oseb med stanovalci domov že med 70 in 80 odstotkov. Pri tem je izpostavila velik pomen socialno varstvenih programov, kot je na primer Program starejši za starejše in tudi vse pomembnejšo vlogo centrov za socialno delo pri denimo določitvi skrbnika za določen primer.
Kot enega največjih izzivov je omenila socialno varstvene storitve za osebe z demenco, ki morajo biti njim prilagojene. Prepričana je, da je za uspešno obvladovanje demence ključno usklajevanje vseh izvajalcev oz. resorjev tako na nacionalni kot lokalni ravni. “Vsi moramo upoštevati, da osebe z demenco imajo pravico živeti življenje s toliko samoodločanja in neodvisnosti, kolikor ji dopuščajo telesne in duševne zmogljivosti, da imajo pravico dobiti nasvet in podporo za čim bolj samostojno življenje,” je še dodala Romihova.
“,”Jaka Verbic Miklic”,1663228440,1663228440,sl,15223,306,15222,43,0,NULL,,”Na drugi nacionalni konferenci poudarek na novi strategiji obvladovanja demence “,na-drugi-nacionalni-konferenci-poudarek-na-novi-strategiji-obvladovanja-demence,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1665302123,1665302124
934,15225,”Svetovni dan varnosti bolnikov v znamenju varne rabe zdravil “,”Svetovni dan varnosti bolnikov je letos posvečen ozaveščanju državnih institucij, strokovne javnosti in ljudi o pomembnosti varne uporabe zdravil in zdravljenja brez škode”,”
Ljubljana, 17. septembra – Danes obeležujemo svetovni dan varnosti bolnikov, ki je pod okriljem Svetovne zdravstvene organizacije (WHO) letos pod geslom Zdravila brez škode posvečen ozaveščanju ljudi o pravilni uporabi zdravil. Ta namreč pripomore k izboljšanju zdravja ljudi in večji kakovosti življenja, so poudarili v Lekarniški zbornici Slovenije.
Svetovni dan varnosti bolnikov je letos posvečen ozaveščanju državnih institucij, strokovne javnosti in ljudi o pomembnosti varne uporabe zdravil in zdravljenja brez škode, so sporočili iz Splošne bolnišnice (SB) Slovenj Gradec.
Cilji letošnjega dne so dvigniti zavedanje o velikem bremenu zaradi škode, povezane z zdravili, poročati o napakah pri ravnanju z zdravil ter izvajati ukrepe za izboljšanje varnosti zdravil. Prav tako želijo pri WHO pritegniti ključne predstavnike države in stroke in druge partnerje v prizadevanja za preprečevanje napak pri zdravljenju z zdravili in zmanjšanje škode, povezane z njihovo uporabo.
Kot pojasnjujejo v bolnišnici, so zdravila najpogosteje uporabljeni način zdravljenja. Škoda, ki se pojavlja zaradi napak pri zdravljenju z zdravili, pa predstavlja največji delež skupne škode za bolnike, kar 50-odstoten, ki pa jo je mogoče preprečiti.
Večina vzrokov za napake pri ravnanju z zdravili leži v neurejenih sistemih, zato je dolžnost vseh ključnih deležnikov, da z ustreznimi ukrepi storijo vse, da je zdravljenje z zdravili varno, so dodali.
Zaplete na področju ravnanja z zdravili lahko med vsemi zapleti v zdravstvu najpogosteje preprečimo oz. se jim izognemo, pa poudarjajo v Univerzitetnem kliničnem centru (UKC) Maribor.
Na pojav neželenih dogodkov lahko po njihovih navedbah vplivajo tako človeški faktor – denimo utrujenost, neustrezno znanje, delovna doba, lastno nezaupanje in strah. Vplivajo lahko tudi sistemski dejavniki, kot je neustrezna delovna shema, premalo zaposlenih, neustrezni pogoji hranjenja in priprave zdravil in drugi.
Ob tem so v UKC vsem organizacijskim enotam, kjer upravljajo z zdravili, predlagali izvesti pogovor o varnosti v timu različnih strokovnjakov. Zapise bodo analizirali in jih uporabili za načrtovanje izboljšav.
V lekarniški zbornici so ob dnevu opozorili na nevarnosti nakupa zdravil na spletu, kjer se pojavlja nešteto ponaredkov, njihova uporaba pa je običajno nepravilna ali celo nevarna.
Prav tako farmacevti vse pogosteje beležijo tudi povečano povpraševanje po “farmacevtskih izdelkih”, ki so oglaševani na spletu. V veliko primerih gre za zavajajoče oglaševanje, ki je predmet spletne prevare. Nekaterim izdelkom se namreč pripisuje lastnosti zdravil, medtem ko gre v resnici za prehranska dopolnila. Ali je izdelek zdravilo, ki ima dovoljenje za prodajo v Sloveniji, lahko kupci preverijo na spletni strani Javne agencije za zdravila in medicinsko-tehnične pripomočke.
Na prevaro nakazujejo tudi občutni popusti, ki so časovno omejeni, da še bolj pritegnejo potencialnega kupca. Nikakor naj kupcev ne prepričajo lažna pričevanja zadovoljnih kupcev in mnenja domnevnih znanstvenikov ter zdravnikov.
Ob svetovnem dnevu varnosti bolnikov bodo SB Slovenj Gradec osvetlili z oranžno barvo, ki je razpoznavni znak kampanje ob dnevu. Ob tem pripravljajo tudi številne akcije ozaveščanja bolnikov o pomenu varnega zdravljenja z zdravili.
“,”Jaka Verbic Miklic”,1663401360,1663401360,sl,15225,306,15224,43,0,NULL,,”Svetovni dan varnosti bolnikov v znamenju varne rabe zdravil “,svetovni-dan-varnosti-bolnikov-v-znamenju-varne-rabe-zdravil,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1665302257,1665302257
935,15227,”Bruselj predstavil priporočila za izboljšanje odkrivanja raka “,”Zaradi pandemije v EU ni bilo opravljenih okoli 100 milijonov testov v okviru presejalnih programov za odkrivanje raka”,”
Bruselj, 20. septembra – Evropska komisija je danes predstavila nov pristop EU za izboljšanje odkrivanja raka. Cilj danes objavljenih priporočil je, da bi bili do leta 2025 presejalni programi za raka dojk, debelega črevesa ter materničnega vratu na voljo 90 odstotkom ljudi, ki izpolnjujejo pogoje zanje. Za to bo na voljo okoli 100 milijonov evrov evropskih sredstev.
“Leta 2020 – v prvem letu pandemije covida-19 – je zaradi novega koronavirusa umrlo okoli 420.000 ljudi. V istem letu pa je približno trikrat toliko ljudi umrlo za rakom, 1,3 milijona ljudi. To niso samo številke, gre za osebne zgodbe, družine in prijatelje,” je ob predstavitvi priporočil povedala evropska komisarka za zdravje Stela Kiriakides.
Po njenih besedah zaradi pandemije v EU ni bilo opravljenih okoli 100 milijonov testov v okviru presejalnih programov za odkrivanje raka.
“S temi podatki želim sporočiti, da moramo ukrepati zdaj. Ker če ne bomo, bo rak do leta 2035 postal glavni vzrok smrti v EU. Treba je izvajati več presejalnih programov in bolje,” je poudarila komisarka.
Evropska komisija zato posodablja priporočila za izboljšanje presejalnih programov, ki se niso spremenila že skoraj 20 let. Glavni cilj je povečati vključenost ljudi v presejalne programe za raka dojk, debelega črevesa in danke ter materničnega vratu. Komisija želi doseči cilj iz evropskega načrta za boj proti raku, da bi bili tovrstni programi na voljo 90 odstotkom ljudi, ki izpolnjujejo pogoje za vključitev.
Bruselj priporoča, da se ciljno skupino za presejalne programe za raka dojk razširi s starostne skupine od 50 do 69 let na vse ženske, stare od 45 do 74 let.
Glede raka na materničnem vratu priporočila vključujejo testiranje na humani papiloma virus (HPV) za vse ženske, stare od 30 do 65, na vsakih pet let. Pri tem je treba upoštevati, ali so bile cepljene proti HPV.
Pri raku na debelem črevesu in danki pa komisija poziva k vzpostavitvi triažnega testiranja s fekalnim imunokemičnim testiranjem za ljudi od 50. do 74. leta starosti. Na podlagi tega pa bi se nato odločili za endoskopijo oziroma kolonoskopijo.
Komisija poleg tega priporoča, da se v smernice vključi tudi organizirano odkrivanje dodatnih treh vrst raka. Priporoča presejalno testiranje na raka pljuč za vse tiste, ki trenutno pogosto kadijo, in nekdanje kadilce, stare med 50 in 75 let.
Za raka prostate priporoča, da bi za moške do 70. leta starosti uvedli antigensko testiranje in na podlagi tega slikanje z magnetno resonanco. Na območjih z visoko stopnjo raka na želodcu in visoke smrtnosti zaradi tega pa bi uvedli presejalne preglede za bakterijo helicobacter pylori in spremljanje predrakavih želodčnih razjed.
Za izvajanje priporočil, ki jih bodo zdaj potrjevale države članice, je na voljo okoli 100 milijonov evrov evropskih sredstev. Komisija pa bo predlagala še dodatna sredstva.
“,”Jaka Verbic Miklic”,1663660740,1663660740,sl,15227,306,15226,43,0,NULL,,”Bruselj predstavil priporočila za izboljšanje odkrivanja raka “,bruselj-predstavil-priporocila-za-izboljsanje-odkrivanja-raka,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1665302449,1665302449
936,15229,”Ob svetovnem dnevu Alzheimerjeve bolezni poziv k sprejetju ustrezne strategije “,”Slovenija sodi med redke države v EU brez strategije in sistemske ureditve pri obvladovanju demence, ki sta nujni za zagotavljanje celovite obravnave bolnikov.”,”
Ljubljana/London, 21. septembra – Slovenija sodi med redke države v EU brez strategije in sistemske ureditve pri obvladovanju demence, ki sta nujni za zagotavljanje celovite obravnave bolnikov. Strategija je sicer pripravljena, a še vedno ni sprejeta, v združenju Spominčica – Alzheimer Slovenija opominjajo ob današnjem svetovnem dnevu Alzheimerjeve bolezni, 21. septembru.
Današnji svetovni dan, tako kot že ves september, ki je svetovni mesec Alzheimerjeve bolezni, poteka pod geslom Spoznaj demenco, spoznaj Alzheimerjevo bolezen. Pri tem se še posebej osredotoča na pomen podpore po diagnozi, tako za bolnike kot za svojce.
V Sloveniji po navedbah strokovnjakov z demenco živi povprečno 43.000 ljudi. Do leta 2050 bo v povprečju še 42.000 ljudi z demenco potrebovalo podporo po diagnozi, ki pa je v Sloveniji nezadostna, so opomnili ob svetovnem dnevu.
Po ugotovitvah združenja Spominčica ima le vsaka četrta oseba z demenco tudi postavljeno diagnozo. Kot zelo pomembno izpostavljajo, da gredo ljudje z demenco čim prej k zdravniku, da dobijo diagnozo in da se jim skupaj s svojci ponudi čim več podpore.
Alzheimerjeva bolezen je dolgotrajna, v možganih pa se lahko razvije že 20 let pred prvimi znaki demence. Študije medtem kažejo, da je na 40 odstotkov dejavnikov, ki lahko vodijo v razvoj demence, mogoče vplivati z načinom življenja.
Zelo pomembna je skrb za duševno zdravje. Med ključnimi dejavniki za razvoj demence je namreč depresija. Glede na to moramo po pozivu psihiatrov poskrbeti za dobro psihično počutje in se čim bolj izogibati stresu. Prav način spoprijemanja s stresom je ključen pri preventivi, pa naj gre za depresijo ali demenco.
Čeprav velika večina oseb z demenco živi doma, ti dobijo najmanj podpore. V Spominčici zato pozivajo k ureditvi njihovega položaja.
Spominčica ozavešča o demenci tudi prek mreže demenci prijaznih točk, ki jih je po vsej državi že več kot 300, do konca meseca pa bo ta številka presegla 400. Na teh točkah je osebje usposobljeno za prepoznavanje ljudi z demenco in pomoč tako bolnikom kot svojcem. Demenci prijazne točke so denimo vsi zdravstveni domovi v Ljubljani, nekatere poslovalnice Pošte Slovenije, danes pa se jim bodo pridružile tudi trgovine Lidl.
Svetovni dan Alzheimerjeve bolezni so začeli obeleževati na letni konferenci mednarodne zveze organizacij za Alzheimerjevo bolezen (Alzheimer’s Disease International – ADI) v Edinburghu na Škotskem 21. septembra 1994, na kateri so se spomnili 10. obletnice te zveze s sedežem v Londonu. Mesec september je osem let kasneje, leta 2012, po navedbah ADI postal svetovni mesec Alzheimerjeve bolezni, v katerem organizacije z obravnavanega področja ozaveščajo o bolezni in predstavljajo svoje programe.
V svetu z demenco živi 55 milijonov ljudi, do leta 2050 pa naj bi jih bilo že 139 milijonov.
“,”Jaka Verbic Miklic”,1663747260,1663747260,sl,15229,306,15228,43,0,NULL,,”Ob svetovnem dnevu Alzheimerjeve bolezni poziv k sprejetju ustrezne strategije “,ob-svetovnem-dnevu-alzheimerjeve-bolezni-poziv-k-sprejetju-ustrezne-strategije,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1665302539,1665302539
937,15231,”Ob letošnjem svetovnem dnevu družinske hiperholesterolemije posebna pozornost zdravju žensk “,”Na današnji novinarski konferenci Društva za zdravje srca in ožilja Slovenije so izpostavili zgodnje odkrivanje bolezni in ustrezno zdravljenje, kar lahko tudi rešuje življenja”,”
Ljubljana, 21. septembra – Ob letošnjem svetovnem dnevu ozaveščanja o družinski hiperholesterolemiji so strokovnjaki posebno pozornost namenili predvsem ženskam z omenjeno boleznijo. Na današnji novinarski konferenci Društva za zdravje srca in ožilja Slovenije so izpostavili zgodnje odkrivanje bolezni in ustrezno zdravljenje, kar lahko tudi rešuje življenja.
Kot je društvo pojasnilo v sporočilu za javnost, je družinska hiperholesterolemija pogosta dedna motnja presnove, za katero je značilna povišana vsebnost t. i. slabega holesterola v krvi ali LDL. Močno povečuje tveganje za prezgodnji pojav bolezni srca in ožilja, ima pa jo približno ena oseba na 250 prebivalcev.
Ob letošnjem dnevu družinske hiperholesterolemije želijo dodatno pozornost posvetiti ženskam z boleznijo, ki se lahko tekom življenja soočajo s različnimi dodatnimi izzivi. Kot je povedal Urh Grošelj s kliničnega oddelka za endokrinologijo, diabetes in presnovne bolezni na Pediatrični kliniki v Univerzitetnem kliničnem centru (UKC) Ljubljana, ženske redkeje dosegajo cilje zdravljenja skladno s smernicami in redkeje dobijo ustrezno terapijo in jih tako redkeje kot moške vrstnike ustrezno obravnavajo. Izpostavil je tudi povečanje holesterola med nosečnostjo in prekinitev zdravljenja zaradi nosečnosti.
“Pri ženski hiperholesterolemiji govorimo o najpogostejši prirojeni presnovni motnji, ki lahko hkrati ogroža življenje. Večina ljudi z motnjo v Sloveniji ne ve, da jo ima, s tem pa so izpostavljeni dodatnemu tveganju. Veliko odraslih oseb ima povišan holesterol, z izboljšanjem življenjskega sloga pa jih lahko veliko doseže cilje in pomembno zmanjša svoja tveganja. Pri osebah z družinsko hiperholesterolemijo pa gre za izrazite povišane vrednosti praktično od rojstva in te osebe so bistveno bolj ogrožene za kasnejše zaplete,” je še opozoril Grošelj.
Miran Šebeštjen s kliničnega oddelka za kardiologijo v UKC Ljubljana je pojasnil tudi pomen in vlogo holesterola lipoprotein, ki je prepoznan kot eden od dejavnikov tveganja za koronarno bolezen. “Pri 95 odstotkih oseb h koncentraciji lipoproteina oziroma k povišanim vrednostim pripomore genetika. Poveča pa tveganje bolnikov z družinsko hiperholesterolemijo poleg že povečanega nivoja LDL holesterola. Ni pa nujno, da imajo vsi bolniki z družinsko hiperholesterolemijo tudi povečano koncentracijo lipoproteina,” je povedal Šebeštjen.
Glede na nove evropske smernice svetujejo določitev vrednosti lipoproteina vsaj enkrat v življenju pri vsakem posamezniku, je izpostavil Šebeštjen. Po njegovih besedah sicer nimamo podatkov o vplivu spola tako na pojavnost družinske hiperholesterolemije, kot tudi povišane koncentracije lipoproteina, vendar se pri ženskah ponavadi odkrije približno 10 let kasneje kot pri moških, saj se klinično pomembna ateroskleroza pri ženskah prav tako pojavi približno 10 let kasneje kot pri moških.
“,”Jaka Verbic Miklic”,1663747380,1663747380,sl,15231,306,15230,43,0,NULL,,”Ob letošnjem svetovnem dnevu družinske hiperholesterolemije posebna pozornost zdravju žensk “,ob-letosnjem-svetovnem-dnevu-druzinske-hiperholesterolemije-posebna-pozornost-zdravju-zensk,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1665302655,1665302655
938,15233,”Svetovni dan srca pod geslom S srcem za vsako srce “,”Otroci so v času karanten in izolacij zaradi epidemije še več časa preživeli na spletu, kar je dokazano dejavnik tveganja za duševno zdravje”,”
Ljubljana, 29. septembra – Danes obeležujemo svetovni dan srca, ki letos poteka pod geslom S srcem za vsako srce. Ob tej priložnosti bo ljubljansko Tromostovje zvečer osvetljeno v rdeči barvi. V društvu za zdravje srca in ožilja poudarjajo pomen zgodnjega odkrivanja srčno žilnih bolezni in vse spodbujajo k razmisleku, kako bi lahko še bolje skrbeli za zdravje svojega srca.
Bolezni srca in ožilja so najpogostejši vzrok invalidnosti in umrljivosti. Zaradi njih življenje vsako leto izgubi 17 milijonov ljudi po svetu. Med srčno-žilne bolezni sodijo možganska kap, srčni infarkt, srčno popuščanje, angina pektoris, arterijska hipertenzija in druge.
V Društvu za zdravje srca in ožilja Slovenije ob tem poudarjajo pomen zgodnjega odkrivanja srčno-žilnih bolezni. Prav tako je pomembno odkrivanje sladkorne bolezni, saj predstavlja pomemben dejavnik tveganja za razvoj srčno-žilnih bolezni, so pojasnili v sporočilu za javnost.
Osebe s sladkorno boleznijo tipa dva imajo do štirikrat večje tveganje za smrt zaradi kapi ali srčnega napada kot osebe brez sladkorne bolezni. Pomemben dejavnik tveganja je tudi debelost, ki je vse bolj pogosta.
Pričakuje se, da bo v Sloveniji do leta 2025 okvirno 400.000 oseb živelo z debelostjo. “To je 400.000 Slovencev z višjim tveganjem za pojav sladkorne bolezni, srčno žilnih zapletov in nižjo pričakovano življenjsko dobo. Srčno žilna obolenja namreč predstavljajo glavni vzrok smrti oseb z debelostjo,” pojasnjujejo.
V Društvu za zdravje srca in ožilja Slovenije od vsega začetka sledijo dnevu srca z aktivnostmi po Slovenji – letos že triindvajsetič. Zvečer bo tako ljubljansko Tromostovje osvetljeno s simbolično barvo srca – rdečo. S tem želijo v društvu ljudi spodbuditi, da razmislijo, kako skrbijo za zdravje svojega srca in kako bi lahko zanj skrbeli še bolje.
V torek so ob tem pripravili novinarsko konferenco, na kateri so opozorili na zmanjšano športno aktivnost otrok v času epidemije covida-19, ki ima lahko dolgotrajne posledice za njihovo zdravje.
Vodja nacionalnega sistema športnega kartona Gregor Starc zato svetuje uvedbo ene ure športa v šolah na dan, ki bi vključevala redno, vsebinsko raznovrstno, dovolj intenzivno in dovolj časa trajajočo vadbo. Sam se zavzema, da bi ure športne vzgoje v čim večji meri potekale zunaj, v naravi.
Predsednik Društva za zdravje srca in ožilja Matija Cevc je ob tem spomnil, da so otroci v času karanten in izolacij zaradi epidemije še več časa preživeli na spletu, kar je dokazano dejavnik tveganja za duševno zdravje. Slabše duševno zdravje otrok se med drugim odraža v večji razdražljivosti, preobčutljivosti in občutku manjvrednosti.
“,”Jaka Verbic Miklic”,1664438760,1664438760,sl,15233,306,15232,43,0,NULL,,”Svetovni dan srca pod geslom S srcem za vsako srce “,svetovni-dan-srca-pod-geslom-s-srcem-za-vsako-srce,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1665302863,1665302863
939,15235,”Pred rožnatim oktobrom pozivi k samopregledovanju dojk v vseh obdobjih življenja”,”Strokovnjakinje so danes poudarile, da se je pomembno odzivati na preventivne presejalne programe in skrbeti za svoje zdravje, ob spremembah na in v telesu pa obiskati zdravnika”,”
Ljubljana, 29. septembra – Pred rožnatim oktobrom, mednarodnim mesecem ozaveščanja o raku dojk, v Združenju Europa Donna Slovenija pozivajo k samopregledovanju dojk v vseh obdobjih življenja. Strokovnjakinje so danes poudarile, da se je pomembno odzivati na preventivne presejalne programe in skrbeti za svoje zdravje, ob spremembah na in v telesu pa obiskati zdravnika.
Predsednica Združenja Europa Donna Slovenija Tanja Španić je na današnji novinarski konferenci dejala, da je rak dojk še vedno najpogostejši rak pri ženskah, zbolijo pa lahko tudi moški. Sodelovanje med stroko, odločevalci in civilno družbo pa lahko zmanjša umrljivost ter izboljša odstotek preživetja oziroma ozdravljivost raka, je poudarila.
Opozorila je, da rak v družbi še vedno predstavlja tabu in veliko stisko bolnikom in njihovim bližnjim. Družinska zdravnica Vesna Homar pa je spomnila, da je rak dojke pogost ne le med starejšimi, ampak tudi med ženskami srednjih let in mlajšimi ženskami. “Če ga odkrijemo dovolj zgodaj, je v veliki večini primerov ozdravljiv, zato je pomembno, da ga res aktivno iščemo in prepoznamo takrat, ko je izid zdravljenja lahko najbolj ugoden,” je dejala.
Večina rakov nastane naključno, spontano. “Pomembno sporočilo za ženske je, da bolezen ni kazen za pretekla dejanja,” je opozorila Homarjeva. Pri prepoznavanju raka dojke je ključno samopregledovanje. To je pomembno tudi po 50. letu starosti, ko so ženske že vključene v program Dora, saj lahko rak nastane tudi med dvema kontrolnima pregledoma.
Simptomi raka dojke so zatrdlina, boleč predel, sprememba velikosti ali oblike dojk, sprememba barve, izcedek iz dojk ali kakršnekoli spremembe v območju bradavice in pod pazduho. “Če ženska opazi spremembe, naj se obrne na izbranega zdravnika ali ginekologa, ta pa jo bo usmeril v regijsko ambulanto za bolezni dojk,” je danes pojasnila Vesna Homar.
Zdravljenje raka dojk se je v zadnjih 25 letih, odkar v Sloveniji deluje Združenje Europa Donna, zelo spremenilo. Pobudnica ustanovitve slovenske Europe Donne in nekdanja vodja oddelka za psihoonkologijo na onkološkem inštitutu Ljubljana Marija Vegelj Pirc se spominja, da je včasih bolezen zahtevala odstranitev cele dojke, bezgavk v pazduhi in velike prsne mišice, protez pa še ni bilo. “Bolezen je bila nekaj nezaslišanega, ženske pa so svojo diagnozo skrivale,” je povedala.
Zdravnica onkologinja Simona Borštnar pa je dejala, da bolniki danes bolezni ne skrivajo več. Obravnava raka dojke se je spremenila na vseh področjih. Izjemen uspeh je zgodnje odkrivanje zaradi presejalnega programa Dora, razvile so se tudi diagnostične metode odkrivanja raka. “Rak ni več ena bolezen, ampak je cela serija različnih podtipov, ki se različno zdravijo,” je pojasnila. Razvila se je tudi kirurgija, obsevalne tehnike in zdravila, v Sloveniji je danes na voljo vsaj 25 različnih hormonskih zdravil.
Za rakom dojke vsako leto zboli nekaj deset žensk, ki so mlajše od 40 let, in si želijo ustvariti družino. Od teh pa jih veliko potrebuje hormonsko zdravljenje, kar lahko materinstvo odloži za nekaj let. Trenutno poteka velika klinična raziskava, v katero je vključeno tudi deset Slovenk, ki preučuje, ali je možno z namenom zanositve ali poroda prekiniti s hormonsko terapijo. Prve rezultate pa pričakujejo decembra, je pojasnila Borštnarjeva. “Že nekaj let pa vemo, da je materinstvo varno in da ne poslabša prognoze bolnic,” je opomnila.
Sogovornice so ob tem pohvalile slovenski zdravstveni sistem. “S polno odgovornostjo trdim, da oskrba raka v Sloveniji ni niti za odtenek slabša kot v precej bogatejših državah,” je dejala Borštnarjeva. Naša država nudi tudi najnovejša zdravila in široko množico strokovnjakov. Španićeva pa bolnicam večkrat pove, da so lahko vesele, da če so že zbolele, da so zbolele tu. “Ker tudi države, ki so jih imamo za bolj razvite, nimajo takšne oskrbe kot je pri nas,” je zaključila.
Združenje Europa Donna Slovenija v letošnjem letu obeležuje 25 let delovanja. V rožnatem oktobru pripravljajo številne dogodke v več kot 40 krajih po Sloveniji. O raku dojk bodo ozaveščali na ljubljanskem maratonu, pridružujejo pa se tudi evropskemu dogodku Race for the cure. V združenju sodelujejo tudi z več podjetji, ki bodo ozaveščala med drugim s telefoni, kruhom, mehčalcem za oblačila, kavo in vodo v rožnati barvi. Po Ljubljani pa bo vozil roza avtobus.
“,”Jaka Verbic Miklic”,1664438880,1664438880,sl,15235,306,15234,43,0,NULL,,”Pred rožnatim oktobrom pozivi k samopregledovanju dojk v vseh obdobjih življenja”,pred-roznatim-oktobrom-pozivi-k-samopregledovanju-dojk-v-vseh-obdobjih-zivljenja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1665302959,1665302959
940,15237,”Z osredotočenjem na gensko mutacijo mogoče upočasniti širjenje raka dojk, ugotavlja študija “,”Po podatkih Svetovne zdravstvene organizacije so samo leta 2020 raka dojk ugotovili pri okoli 2,3 milijona žensk po svetu, 685.000 pa jih je zaradi te bolezni umrlo.”,”
Pariz, 30. septembra – Napredovanje določenih tipov raka dojk je mogoče upočasniti, če zdravniki ugotovijo določeno gensko mutacijo in hitro prilagodijo zdravljenje, ugotavlja študija, objavljena v znanstveni reviji Lancet Oncology, danes poroča francoska tiskovna agencija AFP.
Tumorske celice pri raku dojk se s časom spreminjajo in včasih povzročijo mutacije, odporne proti zdravilom, ki jih jemlje bolnica. V novi študiji so se znanstveniki osredotočili na mutacijo v krvi, imenovano bESR1mut. Mutacijo so ugotovili s pomočjo tekočinske biopsije, ki omogoča analizo vsebine tumorjev brez vzorca tkiva.
V študiji so s tekočinsko biopsijo vzeli vzorec krvi bolnic, pri katerih je rak dojke napredoval, da bi preverili prisotnost mutacije bESR1mut. Pri okoli četrtini od skupno več kot tisoč pacientk iz 83 francoskih bolnišnic so ugotovili povečanje mutacije bESR1mut v krvi.
Med njimi so jih naprej obravnavali 170 in jih razdelili v dve skupini. Ena skupina je nadaljevala dotedanje zdravljenje, druga pa ga je spremenila, med drugim z uporabo hormonskega zdravila fulvestrant, ki bi glede na prejšnje raziskave lahko vplivalo na mutacije, kot je bESR1mut.
Rak se je pri bolnicah, ki so dobile fulvestrant, v nekaj mesecih ustavil ali je napredoval počasneje kot pri kontrolni skupini, je pokazala študija. Po navedbah znanstvenikov je bil to prvi tovrsten poskus, ki je pokazal, da zgodnje ukrepanje glede mutacije bESR1mut daje dobre rezultate.
Ocenjujejo, da bi bila uporaba tekočinske biopsije za ugotovitev mutacije ter takojšnja sprememba zdravljenja lahko model za zdravljenje v prihodnje. V okviru študije so sicer poučevali le specifičen tip raka dojk, pri katerem je tumor dovzeten za estrogen.
Po podatkih Svetovne zdravstvene organizacije so samo leta 2020 raka dojk ugotovili pri okoli 2,3 milijona žensk po svetu, 685.000 pa jih je zaradi te bolezni umrlo. Konec leta 2020 je v svetu živelo 7,8 milijonov bolnic z rakom dojk, ki so ga diagnosticirali v zadnjih petih letih. Rak dojk je tako najbolj razširjena oblika raka na svetu.
“,”Jaka Verbic Miklic”,1664525340,1664525340,sl,15237,306,15236,43,0,NULL,,”Z osredotočenjem na gensko mutacijo mogoče upočasniti širjenje raka dojk, ugotavlja študija “,z-osredotocenjem-na-gensko-mutacijo-mogoce-upocasniti-sirjenje-raka-dojk-ugotavlja-studija,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1665303051,1665303051
941,15239,”V lanskem letu zvišanje registrirane porabe alkohola “,”V primerjavi z letom 2020 se je poraba zvišala za skoraj en liter”,”
Ljubljana, 3. oktobra – V lanskem letu je registrirana poraba alkohola znašala 10,62 litrov čistega alkohola na prebivalca, starega 15 let in več. To pomeni, da se je v primerjavi z letom 2020 poraba zvišala za skoraj en liter, je Nacionalni inštitut za javno zdravje (NIJZ) objavil na svoji spletni strani.
Največ alkohola se je lani po navedbah NIJZ popilo z vinom, in sicer 4,97 litrov čistega alkohola, sledilo je pivo (4,23 litra), najmanj alkohola pa se je popilo z žganimi pijačami (1,43 litra).
V primerjavi z letom 2020 se je v lanskem letu z vsemi vrstami alkoholnih pijač popilo več litrov čistega alkohola – z vinom 0,37 litra, s pivom 0,22 litra in z žganimi pijačami pa 0,23 litra čistega alkohola več kot leto pred tem.
Registrirana poraba alkohola je izračun porabe čistega alkohola v litrih na prebivalca starega 15 let in več. Pri izračunu se upoštevajo podatki o proizvodnji s kmetij, podatki o uvozu in izvozu alkohola, podatki o zalogah alkoholnih pijač in podatki o industrijski proizvodnji alkoholnih pijač – vina, piva in žganih pijač, pojasnjujejo na NIJZ.
“,”Jaka Verbic Miklic”,1664784720,1664784720,sl,15239,306,15238,43,0,NULL,,”V lanskem letu zvišanje registrirane porabe alkohola “,v-lanskem-letu-zvisanje-registrirane-porabe-alkohola,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1665303257,1665303257
942,15241,”Pred svetovnim dnevom o pomembnosti paliativne in hospic oskrbe”,”Bolnikom in njihovim bližnjim v času zdravljenja zdravstveno osebje celostno pomaga, svojcem pa tudi v procesu žalovanja.”,”
Ljubljana, 5. oktobra – Pred svetovnim dnevom paliativne in hospic oskrbe, ki bo v soboto, so strokovnjakinje opozorile, da je paliativna oskrba pomembna, dragocena in nepogrešljiva pri vseh bolnikih, ki se soočajo z neozdravljivo boleznijo. Bolnikom in njihovim bližnjim v času zdravljenja zdravstveno osebje celostno pomaga, svojcem pa tudi v procesu žalovanja.
Strokovna direktorica Onkološkega inštituta Ljubljana Irena Oblak je na današnji novinarski konferenci dejala, da gre za ohranjanje posameznikovega dostojanstva, “zato je potreba po sistemsko urejeni in dostopni paliativni oskrbi zelo velika”. Pomembno je tudi, da bolniki dobijo ustrezno paliativno oskrbo dovolj zgodaj in na vseh ravneh, saj tako ohranijo in celo zvišajo kakovost njihovega življenja.
Na onkološkem inštitutu povečanje potreb po paliativni oskrbi opažajo vsakodnevno. Izvajajo jo na vseh kliničnih oddelkih, za njen razvoj pa skrbijo z izobraževanji in raziskovanji.
V lanskem letu so uvedli mobilno paliativno enoto, s katero zdravstvena ekipa pride k bolniku na dom. “Bolniku zato ni treba iskati pomoči v zdravstvenih domovih, urgentnih centrih,” je pojasnila Oblakova. Mobilna paliativna ekipa vsak mesec obišče med 50 in 60 bolnikov. Potrebe so sicer veliko večje, a zaradi premalo zaposlenih te dejavnosti ne morejo širiti.
Paliativna oskrba ni namenjena le bolniku, ampak je podpora celi družini in celotnemu zdravstvenemu sistemu, “da okrog bolnika naredimo mrežo, ki mu omogoča kakovostno življenje vse do smrti in podporo svojcem v času žalovanja”, pa je povedala vodja oddelka za akutno paliativno oskrbo na Onkološkem inštitutu Ljubljana Maja Ebert Moltara.
Opozorila je, da paliativna oskrba ni samo pomoč v zadnjem obdobju bolnikovega življenja, v času umiranja, ampak je mnogo širša. “Nekatere bolnike lahko obravnavamo tudi celo leto ali več,” je dejala. V Sloveniji na leto umre okoli 23.000 bolnikov, velik del teh bolnikov pa bi potreboval paliativno oskrbo, je opozorila.
Na onkološkem inštitutu izvajajo tudi mobilno paliativno oskrbo, ki deluje 24 ur na dan in sedem dni v tednu. V avgustu so opravili skoraj 500 obravnav po telefonu, bolniki pa lahko pokličejo na telefonsko številko 030 662 139. Maja Ebert Moltara je dejala, da neodgovorjene klice vračajo, zato naj jih bolniki pokličejo.
Državni program paliativne oskrbe predvideva dvostopenjsko paliativno oskrbo, torej osnovno in specializirano, v vseh regijah, eno mobilno ekipo na 100.000 prebivalcev ter 150 do 200 postelj za specializirano paliativno oskrbo. Realnost pa je drugačna, v Sloveniji imamo šest mobilnih enot v petih regijah in 15 postelj za specializirano oskrbo.
Osnovno paliativno oskrbo izvajajo družinski zdravniki ter predvsem patronažne sestre, ki so velikokrat ključne osebe, ki pomagajo bolnikom, pa je povedala družinska zdravnica v Zdravstvenem domu Vrhnika Eva Gorup Cedilnik. V njihovem zdravstvenem domu taki oskrbi posvečajo veliko pozornosti. Poudarila je, da je zelo pomembna njihova urgentna služba in urgentni zdravniki, ki imajo vsi opravljeno specializirano izobraževanje iz paliativne oskrbe.
Svetovni dan paliativne in hospic oskrbe obeležujemo vsako drugo soboto v oktobru. Letos poteka pod geslom Celimo srca in družbo. Mednarodna zveza za paliativno in hospic oskrbo pa ob letošnjem dnevu poziva države, da v nacionalne strategije vključijo oskrbo ob izgubi in žalovanju.
“,”Jaka Verbic Miklic”,1664957700,1664957700,sl,15241,306,15240,43,0,NULL,,”Pred svetovnim dnevom o pomembnosti paliativne in hospic oskrbe”,pred-svetovnim-dnevom-o-pomembnosti-paliativne-in-hospic-oskrbe,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1665303384,1665303384
943,15243,”Osebe s shizofrenijo naj družba sprejme in ne stigmatizira “,”Približno en odstotek prebivalcev Slovenije shizofrenijo”,”
Ljubljana, 7. oktobra – Pred svetovnim dnevom duševnega zdravje, ki bo v ponedeljek, so strokovnjaki na novinarski konferenci opozorili, da so osebe s shizofrenijo v družbi še vedno stigmatizirane. Take osebe potrebujejo razumevanje in pripravljenost ljudi, da jim prisluhnejo, da se bodo počutili bolj sprejete, stigme ljudi o njih pa bodo manjše, svetujejo.
Specialist psihiatrije Borut Škodlar iz Psihiatrične klinike Ljubljana je na današnji novinarski konferenci dejal, da so psihotična stanja nekaj zelo pogostega in jih imamo občasno vsi ljudje. To je stanje, ko se zunanje okoliščine spremenijo in postanemo tesnobni. Nekaj drugega pa so psihotične motnje, takrat se psihotična stanja lahko zgodijo brez močnih zunanjih okoliščin.
Med psihotičnimi motnjami je najpogostejša shizofrenija. Pozitivni simptomi shizofrenije so halucinacije in blodnje, ki so neprijetne in moteče, “a niso največji problem”. Bolj pomembni so negativni simptomi, ki med drugim vključujejo brezvoljnost, neiniciativnost, zmanjšan čut in željo po druženju ter umikanje iz družbe. “Vse to zajema negativna simptomatika, ki veliko bolj določi, kakšen bo potek zdravljenja,” je povedal Škodlar.
Zdravljenje shizofrenije poteka z zdravili, psihoterapevtsko in z drugimi rehabilitacijami, kot so socialna, poklicna in zaposlitvena, pa je povedala specialistka psihiatrije Silva Demšar iz Psihiatrične klinike Ljubljana.
Pri shizofreniji gre za spremembe v možganih, z zdravili pa skušajo vplivati na ta del bolezni. Opozorila je, da je stigmatizirano tudi zdravljenje z zdravili, saj ljudje dvomijo, da zdravniki vedo, kaj zdravijo. Ampak se z zdravili izboljša bolnikova sposobnost razmišljanja, čustvovanja, lahko se odmakne od svoje bolezni in normalno živi med nami, je poudarila Demšarjeva.
Predsednik Ozare Slovenija Bogdan Dobnik je povedal, da bolezen zajame vso družino, osebe z shizofrenijo pa velikokrat ne želijo obiskati zdravnika. Najpogosteje zbolevajo fantje, stari med 15 in 20 let, in dekleta, stara med 25 in 30 let. Mladi ljudje se z boleznijo težko spopadejo, je ne sprejmejo in je zato ne zdravijo. “Potrebno je poiskati pomoč pravočasno, ne čakati, kar je velikokrat težko, ampak to je edina prava pot,” je opozoril.
Škodlar je še povedal, da ima približno en odstotek prebivalcev Slovenije shizofrenijo. Te osebe pa niso ljudje, ki se jih je treba bati in izogibati, “ampak so nam zelo podobni”.
“,”Jaka Verbic Miklic”,1665130620,1665130620,sl,15243,306,15242,43,0,NULL,,”Osebe s shizofrenijo naj družba sprejme in ne stigmatizira “,osebe-s-shizofrenijo-naj-druzba-sprejme-in-ne-stigmatizira,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1665303492,1665303492
944,15251,”Obeležujemo svetovni dan duševnega zdravja “,” Po ocenah Svetovne zdravstvene organizacije se bo vsak četrti med nami v življenju srečal z duševnimi težavami”,”
Ljubljana, 10. oktobra – Danes obeležujemo svetovni dan duševnega zdravja. Svetovna zdravstvena organizacija letos opozarja na naraščajoče družbene in ekonomske neenakosti, dolgotrajne konflikte, nasilje in izredne razmere na področju javnega zdravja. Te vplivajo na celotno svetovno prebivalstvo, ogrožajo napredek in blaginjo, so zapisali na NIJZ.
Na Nacionalnem inštitutu za javno zdravje (NIJZ) so navedli, da se bo po ocenah Svetovne zdravstvene organizacije vsak četrti med nami v življenju srečal z duševnimi težavami. Zato vsak 10. oktober obeležujemo svetovni dan duševnega zdravja, simbol dneva pa je zelena pentlja.
Opozarjajo, da vsak lahko nudi psihološko prvo pomoč osebi, ki doživlja panični napad, ima samomorilne misli, se znajde v depresiji ali ima težave s čezmernim pitjem alkohola. Bolj pomembno od uporabe “pravih besed” pa je, da pokažemo zanimanje za osebo s težavami. Svetujejo, da ji skušamo nuditi podporo, jo razumeti in ji prisluhniti. A to ne sme nadomeščati strokovne pomoči. Zato osebo s težavami opogumimo, da čim prej poišče pomoč.
“Pomembno je, da vsak od nas usvoji znanja, kako prepoznati, pristopiti in pomagati osebi v duševni stiski, dokler ji ni na voljo strokovna pomoč. Tudi nudenje psihološke prve pomoči namreč predstavlja pomembno podporo in lahko reši življenje,” so besede psihologinje Saške Roškar z NIJZ zapisali v sporočilu za javnost.
Duševno zdravje je treba spodbujati kot vrednoto, h kateri vsi stremimo in si zanjo prizadevamo. Stigma in diskriminacija še vedno predstavljata oviri pri socialni vključenosti in dostopu do ustrezne oskrbe. Svetovna zdravstvena organizacija zato poudarja, da ima vsak med nami pomembno vlogo pri ozaveščanju o tem, kateri preventivni ukrepi pri duševnem zdravju delujejo, so še zapisali na NIJZ.
Unicef Slovenija pa opozarja, da za preveč otrok in mladih stigma, nerazumevanje in nesprejemanje vseh vidikov duševnega zdravja še naprej predstavljajo velike izzive. “Pogovor o čustvih je prvi korak do pomoči otrokom, njihovim prijateljem, družinam in skupnostim, da prepoznavajo odtenke duševnega zdravja pri sebi in drugih,” so besede vodje kampanje Kako se počutiš Maje Planinc zapisali pri Unicefu.
Prepogosto se ljudje, ki se srečujejo s težavami v duševnem zdravju, ali njihove družine počutijo preveč osramočene, da o tem spregovorijo, kar preprečuje, da bi dobili podporo, ki jo potrebujejo, opozarjajo pri Unicefu. Ozaveščanje o duševnem zdravju, njegovo sprejemanje in razumevanje na vseh ravneh, vključno z vladnimi politikami, je ključno za odpravo škodljivih učinkov stigme in diskriminacije, menijo.
“,”Jaka Verbic Miklic”,1665393900,1665393900,sl,15251,306,15250,43,0,NULL,,”Obeležujemo svetovni dan duševnega zdravja “,obelezujemo-svetovni-dan-dusevnega-zdravja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1667035575,1667035575
945,15253,”Na konferenci za nujne korake pri gradnji inteligentnega zdravstva “,”Nove tehnologije in smernice razvoja v zdravstvu so realnost, vprašanje pa je, koliko znanja, denarja in energije bomo namenili zanje”,”
Ljubljana, 13. oktobra – Nove tehnologije in smernice razvoja v zdravstvu so realnost, vprašanje pa je, koliko znanja, denarja in energije bomo namenili zanje, je na hibridni konferenci eZdravje – Inteligentno zdravstvo prihodnosti dejal Igor Zorko iz Gospodarske zbornice Slovenije. Med drugim pa je bilo slišati tudi poziv državi, naj stori konkreten korak v tej smeri.
Cilj je, da odgovor na vprašanje glede znanja, denarja in energije najdemo čim hitreje, ker časa nimamo, je Zorko dejal kot podpredsednik gospodarske zbornice in predsednik Združenja za informatiko in telekomunikacije. Organizatorja konference sta bila namreč delovna skupina za eZdravje pri tem združenju in IKT horizontalna mreža.
“Vsi smo soodgovorni, da je v zdravstvu tako, kot je,” pa meni vršilka dolžnosti generalnega direktorja direktorata za digitalizacijo v zdravstvu na ministrstvu za zdravje Alenka Kolar. Kot je dodala, je v preteklosti do digitalnih rešitev prihajalo predvsem zaradi trenutnega navdiha posameznega direktorja ali osebja. Zavod za zdravstveno zavarovanje Slovenije je denimo dobro poskrbel za svojo informatiko, medtem ko je stanje v zdravstvenih domovih bolj kaotično, je spomnila. “Zdravstvo bo inteligentno, če bodo inteligentni vsi sodelujoči,” je dodala.
Po besedah Iztoka Štotla iz Zdravniške zbornice Slovenije pa v zbornici menijo, da digitalna preobrazba lahko nudi veliko možnosti tudi pri prizadevanjih za razbremenitve v delovnem procesu. Kot opaža, v Sloveniji v praksi informacijska tehnologija še ne olajša dela zdravnikov tako, kot bi lahko.
Na konferenci so se dotaknili tudi trendov v EU, še zlasti prihajajoče zakonodaje Evropskega zdravstvenega podatkovnega prostora, ki bo začela veljati leta 2025. Glavni znanstveni svetovalec za zdravstvene sisteme pri Evropski komisiji Andrzej Jan Rys je v video nagovoru kot nujno izpostavil harmoniziranje sistemov za izmenjavo podatkov v EU, s čimer bodo nenazadnje prihranjena finančna sredstva. Čas pandemije covida-19 je po njegovih besedah pokazal, kako pomembno je pri sprejemanju odločitev imeti kakovostne podatke.
Z njim se je strinjal evropski poslanec iz Romunije in namestnik predsednika v odboru Evropskega parlamenta za okolje, javno zdravje in potrošniško politiko Cristian-Silvu Busoi. V video prispevku je v povezavi z Evropskim zdravstvenim podatkovnim prostorom dejal, da odločevalci potrebujejo najboljše podatke, da bodo sprejemali najboljše rešitve. Države članice naj bi s prihajajočo zakonodajo dobile najboljši možni zakonodajni okvir, podatki pa bodo na voljo tudi za raziskovanje, je pojasnil.
Ray Pinto iz zveze Digitaleurope, ki povezuje podjetja v digitalni preobrazbi v Evropi in ima sedež v Bruslju, je prepričan, da je v EU na tem področju veliko potenciala, ki ga je treba spodbujati. Enako po njegovem opažanju velja za Slovenijo. Kot zelo pomembno pri tem pa je v video prispevku poudaril zaupanje uporabnikov, na katerem je treba graditi še naprej.
Inteligentno zdravstvo prihodnosti po besedah generalne direktorice Roche Slovenija Eve McLellan temelji na podatkih in je personalizirano. Zdravnik bo v prihodnosti natančno vedel denimo za zdravstveno stanje bolnikovih staršev in bo takoj pozoren na morebitna tveganja. Sicer pa morajo biti ureditve na področju zdravstva po njenem opozorilu progresivne, pri čemer morajo poudariti preventivo ter zgodnjo diagnozo in zdravljenje.
“,”Jaka Verbic Miklic”,1665653340,1665653340,sl,15253,306,15252,43,0,NULL,,”Na konferenci za nujne korake pri gradnji inteligentnega zdravstva “,na-konferenci-za-nujne-korake-pri-gradnji-inteligentnega-zdravstva,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1667035833,1667035833
946,15255,”Europa Donna pripravlja ozaveščevalno akcijo od dnevu zdravih dojk “,”Predstavnice združenja bodo med 9-o in 14-o uro skupaj s predsednico Tanjo Španić na stojnici na Prešernovem trgu v Ljubljani ozaveščale o raku dojk”,”
Ljubljana, 15. oktobra – Združenje Europa Donna Slovenija se tudi letos pridružuje dejavnostim ob dnevu zdravih dojk, s katerimi Evropska zveza Europa Donna opozarja na pomen življenjskega sloga za zdravje dojk. Predstavnice združenja bodo med 9. in 14. uro skupaj s predsednico Tanjo Španić na stojnici na Prešernovem trgu v Ljubljani ozaveščale o raku dojk.
Na ta način bodo simbolično zaključili projekt Kava po Sloveniji, s katero so obiskale 25 krajev in obeležile 25 let ozaveščanja o raku dojk, so sporočili iz združenja.
Za mimoidoče so pripravili zabavne naloge, ponudili bodo kavo in delili rožnate pentljice, simbol ozaveščanja o raku dojk, ter druge promocijske materiale, s katerimi želijo opozoriti na pomen skrbi za svoje zdravje.
Prikazali bodo tudi pravilen potek samopregleda dojk na silikonskem modelu, saj je za zgodnje odkrivanje raka dojk pomembno redno mesečno samopregledovanje dojk. Bolnicam in njihovim svojcem bodo na voljo za pogovor in morebitna vprašanja v zvezi z diagnozo in zdravljenjem.
Evropska zveza z dnevom zdravih dojk opozarja na pomen življenjskega sloga za preprečevanje obolevnosti in kot preventivo pred ponovitvijo bolezni. Zdrav življenjski slog z uravnoteženo prehrano, vzdrževanje primerne telesne teže in vsakodnevna telesna dejavnost so namreč ključni dejavniki, s katerimi lahko preprečimo, oziroma v prihodnost odložimo rakava obolenja in druge kronične nenalezljive bolezni.
Dan zdravih dojk bodo z različnimi dogodki obeležili tudi v Izoli, Vojni vasi, Krškem, Postojni in Tolminu, so zapisali v sporočilu za javnost.
“,”Jaka Verbic Miklic”,1665826260,1665826260,sl,15255,306,15254,43,0,NULL,,”Europa Donna pripravlja ozaveščevalno akcijo od dnevu zdravih dojk “,europa-donna-pripravlja-ozavescevalno-akcijo-od-dnevu-zdravih-dojk,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1667035958,1667036501
947,15257,”Ob svetovnem dnevu možganske kapi izpostavljen pomen preventivnega ravnanja “,”Možganska kap je ena najpogostejših srčno-žilnih bolezni, utrpi jo ena od štirih odraslih oseb po svetu, približno 30-odstotkov v aktivnem delovnem obdobju.”,”
Ljubljana, 29. oktobra – Danes obeležujemo svetovni dan možganske kapi, ene najpogostejših srčno-žilnih bolezni. Ker so njene posledice lahko za posameznika hude, zdravniki poudarjajo pomen preventive, med njimi zdravega življenjskega sloga in redne telesne aktivnosti, vse od otroštva.
Možganska kap je ena najpogostejših srčno-žilnih bolezni, utrpi jo ena od štirih odraslih oseb po svetu, približno 30-odstotkov v aktivnem delovnem obdobju. Možganska kap se lahko zgodi vsakomur, kadar koli in kjer koli. Je med vodilnimi vzroki smrti in invalidnosti po vsem svetu, vendar bi skoraj vse možganske kapi lahko preprečili. Preventiva je zato pomembna od otroštva, je na torkovi novinarski konferenci poudaril predsednik Društva za zdravje srca in ožilja Slovenije kardiolog Matija Cevc.
Med dejavniki tveganje za razvoj sladkorne bolezni, sekundarne dislipidemije in povišanega krvnega tlaka, ki so pomembni dejavniki za pojav možganske kapi, je naštel debelost in prekomerno prehranjenost. Dejavniki tveganja so še napredovanje ateroskleroze, depresija in pregorelost ter drugi psiho-socialni dejavniki.
V primeru možganske kapi je ključno bolezen prepoznati in ukrepati pravočasno, saj neukrepanje vodi v večje in hujše posledice, tudi invalidnost, opozarja Cevc. S hitrim in uspešnim zdravljenjem, denimo s topljenjem krvnih strdkov, je po njegovih besedah mogoče smrt preprečiti in bolezen celo pozdraviti.
Ob tem spominja na znake možganske kapi, združene v kratico grom – govor, roka, obraz, minuta. Oseba pri možganski kapi namreč govori nejasno in nerazumljivo, ima težave z dvigom rok, povešen ustni kot, beseda minuta pa zaznamuje pomen takojšnjega ukrepanja – klica na številko 112.
Nevrologinja Janja Pretnar Oblak je izpostavila, da je žilna nevrologija ena najhitreje razvijajočih se vej medicine. Intravensko trombolizo oz. topljenje strdkov zdravniki sicer izvajajo že 30 let, se pa od takrat spreminjajo meje mogočega. Tako je topljenje strdkov trenutno mogoče do devet ur po začetku simptomov, mehansko pa je strdek mogoče odstraniti do 24 ur od začetka simptomov.
Čeprav je možganska kap predvsem bolezen starejših s klasičnimi dejavniki tveganja, zdravniki po njenih besedah opažajo, da se pogosteje pojavlja tudi pri mlajših bolnikih. Pri njih je lahko povezana z rakom ali avtoimunskimi boleznimi.
Zdravnik Daniel Globokar z Univerzitetnega rehabilitacijskega inštituta (URI) Soča je spregovoril o rehabilitaciji po možganski kapi. Okrevanje je najbolj intenzivno v prvih mesecih po možganski kapi. Zgodnjo rehabilitacijo izvajajo v ljubljanskem in mariborskem kliničnem centru ter bolnišnicah, nadaljnja pa poteka v zdraviliščih, negovalnih bolnišnicah, pa tudi v URI Soča, kjer zaradi velikega števila čakajočih bolnikov sprejemajo le najbolj prizadete bolnike.
Bolnikom po možganski kapi pomoč nudijo tudi v Združenju bolnikov s cerebrovaskularno boleznijo Slovenije. Predsednik združenja Milan Čuček je pojasnil, da se bolniki po kapi udeležujejo obnovitvenih rehabilitacij v zdraviliščih, spodbuja se tudi udeležbo v programih za vzdrževanje telesne zmogljivosti. Redna telesna vadba poteka pod vodstvom strokovnjakov, organizirajo pa tudi druženja za bolnike, predavanja in druge aktivnosti.
“,”Jaka Verbic Miklic”,1667036400,1667036400,sl,15257,306,15256,43,0,NULL,,”Ob svetovnem dnevu možganske kapi izpostavljen pomen preventivnega ravnanja “,ob-svetovnem-dnevu-mozganske-kapi-izpostavljen-pomen-preventivnega-ravnanja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1667036461,1667036462
948,15259,”Uredba o izvajanju uredbe (EU) o kliničnem preizkušanju zdravil za uporabo v humani medicini”,” “,”
Na podlagi sedmega odstavka 21. člena Zakona o Vladi Republike Slovenije (Uradni list RS, št. 24/05 – uradno prečiščeno besedilo, 109/08, 38/10 – ZUKN, 8/12, 21/13, 47/13 – ZDU-1G, 65/14 in 55/17) Vlada Republike Slovenije izdaja
UREDBO
o izvajanju uredbe (EU) o kliničnem preskušanju zdravil za uporabo v humani medicini
1. člen
(vsebina)
S to uredbo se določajo pristojna organa, nacionalna kontaktna točka, nacionalni postopki v zvezi s kliničnimi preskušanji zdravil za uporabo v humani medicini (v nadaljnjem besedilu: klinično preskušanje) in sankcije za izvajanje Uredbe (EU) št. 536/2014 Evropskega parlamenta in Sveta z dne 16. aprila 2014 o kliničnem preskušanju zdravil za uporabo v humani medicini in razveljavitvi Direktive 2001/20/ES (UL L št. 158 z dne 27. 5. 2014, str. 1), zadnjič dopolnjene z Delegirano uredbo Komisije (EU) 2017/1569 z dne 23. maja 2017 o dopolnitvi Uredbe (EU) št. 536/2014 Evropskega parlamenta in Sveta z določitvijo načel in smernic dobre proizvodne prakse za zdravila za uporabo v humani medicini v preskušanju ter ureditvijo poteka pregledov (UL L št. 238 z dne 16. 9. 2017, str. 12), (v nadaljnjem besedilu: Uredba 536/2014/EU), Izvedbene uredbe Komisije (EU) 2017/556 z dne 24. marca 2017 o podrobnih ureditvah za postopke inšpekcijskih pregledov dobre klinične prakse v skladu z Uredbo (EU) št. 536/2014 Evropskega parlamenta in Sveta (UL L št. 80 z dne 25. 3. 2017, str. 7; v nadaljnjem besedilu: Uredba 2017/556/EU), Izvedbene uredbe Komisije (EU) 2022/20 z dne 7. januarja 2022 o pravilih za uporabo Uredbe (EU) št. 536/2014 Evropskega parlamenta in Sveta glede določitve pravil in postopkov za sodelovanje držav članic pri oceni varnosti kliničnih preskušanj (UL L št. 5 z dne 10. 1. 2022, str. 14; v nadaljnjem besedilu: Uredba 2022/20/EU) in te uredbe.
2. člen
(pristojna organa)
(1) Pristojni organ za izvajanje Uredbe 536/2014/EU, Uredbe 2017/556/EU, Uredbe 2022/20/EU in te uredbe je Javna agencija Republike Slovenije za zdravila in medicinske pripomočke (v nadaljnjem besedilu: JAZMP).
(2) Pristojni organ za izvajanje nalog odbora za etiko v skladu z Uredbo 536/2014/EU in to uredbo je Komisija Republike Slovenije za medicinsko etiko (v nadaljnjem besedilu: KME RS).
3. člen
(nacionalna kontaktna točka)
Nacionalna kontaktna točka iz 83. člena Uredbe 536/2014/EU je JAZMP.
5. člen
(raziskovalec)
(1) Na mestu kliničnega preskušanja mora biti določen en glavni raziskovalec.
(2) Glavni raziskovalec je zdravnik z licenco ali doktor dentalne medicine z licenco, ki je usposobljen za izvajanje kliničnih preskušanj v skladu z načeli dobre klinične prakse.
6. člen
(potrditev vloge – validacija)
Potrditev popolnosti vloge za odobritev kliničnega preskušanja in vloge za bistveno spremembo kliničnega preskušanja (v nadaljnjem besedilu: vloga) opravi JAZMP.
7. člen
(ocenjevanje vloge)
(1) JAZMP opravi znanstveni pregled kliničnega preskušanja in bistvene spremembe kliničnega preskušanja ter pripravi del I poročila o oceni iz 6., 11., 18. in 22. člena Uredbe 536/2014/EU.
(2) KME RS opravi etični pregled kliničnega preskušanja in bistvene spremembe kliničnega preskušanja ter pripravi del II poročila o oceni iz 7., 11., 20. in 22. člena Uredbe 536/2014/EU.
(3) Če ima KME RS pomisleke z vidika etičnosti izvajanja kliničnega preskušanja, zajetega v delu I poročila o oceni iz prvega odstavka tega člena, o tem v 30 dneh od datuma potrditve vloge obvesti JAZMP, ki pripravi poročilo o oceni iz prvega odstavka tega člena.
8. člen
(odločitev)
(1) JAZMP obvesti sponzorja o odločitvi glede odobritve, pogojne odobritve ali zavrnitve kliničnega preskušanja oziroma glede bistvene spremembe kliničnega preskušanja.
(2) Če KME RS v rokih, določenih v Uredbi 536/2014/EU in tej uredbi, ne predloži dela II poročila o oceni iz 7., 11., 20. in 22. člena Uredbe 536/2014/EU z ugotovitvijo in ne sporoči pomislekov iz tretjega odstavka prejšnjega člena, se šteje za odločitev glede vloge ugotovitev glede vidikov v delu I poročila o oceni iz 6., 11., 18. in 22. člena Uredbe 536/2014/EU, v primeru bistvene spremembe vidika dela II poročila o oceni iz 7., 11., 20. in 22. člena Uredbe 536/2014/EU pa, da je bistvena sprememba odobrena. JAZMP v teh primerih obvesti sponzorja o odločitvi brez mnenja KME RS.
9. člen
(nasprotje interesov)
(1) Pri osebah, ki potrjujejo popolnost in ocenjujejo dokumentacijo za klinično preskušanje v humani medicini, ne sme obstajati nasprotje interesov, neodvisne morajo biti od sponzorja, mesta kliničnega preskušanja, raziskovalcev, ki sodelujejo pri kliničnem preskušanju, in oseb, ki klinično preskušanje financirajo, ter so tudi sicer nepristranske.
(2) Osebe iz prejšnjega odstavka podpišejo izjavo o neodvisnosti in odsotnosti obstoja nasprotja interesov, v kateri izjavijo, da pri njih ni podano nasprotje interesov ali videz nasprotja interesov, da so neodvisne od sponzorja, mesta kliničnega preskušanja in raziskovalcev, ki sodelujejo pri kliničnem preskušanju, ter oseb, ki klinično preskušanje financirajo, in so tudi sicer nepristranske, ter da nimajo finančnih ali osebnih interesov, ki bi lahko vplivali na njihovo nepristranskost.
(3) Osebe iz prvega odstavka tega člena morajo, če bi pri njih prišlo do okoliščin, ki ne bi bile v skladu z izjavo iz prejšnjega odstavka, takoj prenehati delo ocenjevalca in v treh delovnih dneh od nastopa okoliščin nasprotja interesov ali seznanitve z njimi obvestiti JAZMP oziroma predsednika KME RS.
(4) Farmacevtski inšpektor za namene izpolnjevanja zahtev iz 5. člena Uredbe 2017/556/EU enkrat letno da izjavo iz drugega odstavka tega člena.
10. člen
(jezik)
(1) Dokumentacija vloge za odobritev kliničnega preskušanja in vloge za odobritev bistvene spremembe kliničnega preskušanja je v slovenskem ali angleškem jeziku.
(2) Ne glede na prejšnji odstavek so v slovenskem jeziku spremni dopis, povzetek protokola in dokumentacija, ki je namenjena udeležencem.
(3) Povzetek protokola iz prejšnjega odstavka vsebuje kratek opis:
(4) Vsebina povzetka rezultatov kliničnega preskušanja za nestrokovnjake je v slovenskem jeziku.
(5) Zdravila v preskušanju in pomožna zdravila so označena v slovenskem ali angleškem jeziku.
(6) Ne glede na prejšnji odstavek so v slovenskem jeziku označena zdravila v preskušanju in pomožna zdravila, ki jih prejme udeleženec za uporabo na domu.
11. člen
(poročanje o sumih na nepričakovane resne neželene učinke)
(1) Po predhodni pridobitvi soglasja JAZMP lahko nekomercialni sponzor v primeru pomanjkanja virov o sumu na nepričakovane resne neželene učinke, ki so se zgodili na ozemlju Republike Slovenije, izjemoma poroča JAZMP na obrazcu za poročanje o neželenem učinku zdravila, ki je objavljen na spletni strani JAZMP, namesto da bi informacijo o sumu vnesel v podatkovno zbirko iz prvega odstavka 40. člena Uredbe 536/2014/EU.
(2) Soglasje JAZMP iz prejšnjega odstavka nekomercialni sponzor pridobi pred začetkom izvajanja kliničnega preskušanja na podlagi ustrezne utemeljitve, ki jo da v spremnem dopisu.
12. člen
(ocena varnostnih poročil)
Informacije iz 42. in 43. člena Uredbe 536/2014/EU ocenjuje JAZMP. KME RS se na podlagi predhodne zahteve omogoči dostop do podatkov o oceni poročil o sumih na nepričakovane resne neželene učinke in letnih poročil o varnosti.
13. člen
(posebne zahteve za proizvodnjo in pripravo zdravil v preskušanju)
(1) Postopki iz petega odstavka 61. člena Uredbe 536/2014/EU se izvajajo in nadzirajo v skladu z zakonom, ki ureja lekarniško dejavnost, in z na njegovi podlagi izdanimi podzakonskimi predpisi.
(2) Dokumentacija iz 35. točke Priloge I Uredbe 536/2014/EU za:
(3) Pri izvajalcih postopkov iz petega odstavka 61. člena Uredbe 536/2014/EU nadzor nad kliničnim preskušanjem zdravila v skladu z Uredbo 2017/556/EU izvajajo farmacevtski inšpektorji JAZMP.
14. člen
(zavarovanje za škodo)
Pred začetkom izvajanja kliničnega preskušanja se zagotovi zavarovanje ali jamstvo za odgovornost sponzorja in odgovornost raziskovalca za morebitno škodo, ki jo utrpi udeleženec zaradi sodelovanja v kliničnem preskušanju, ki se izvaja na ozemlju Republike Slovenije.
15. člen
(pristojbine)
(1) Za stroške postopkov in dejavnosti JAZMP in KME RS, ki jih določata Uredba 536/2014/EU in ta uredba, plača sponzor pristojbino JAZMP. JAZMP najpozneje v 60 dneh po plačilu pristojbine sponzorja JAZMP nakaže sredstva za del pristojbine KME RS v skladu s tarifo JAZMP v proračun Republike Slovenije, na račun št. 01100-1000621284, sklic 18 27111-4029399-18009422 (za plačilo iz tujine na račun št. 01100-1000621284, SWIFT BSLJSI2X, IBAN SI56 01100-1000621284, delivery account 18 27111-4029399-18009422). Ministrstvo za zdravje tako prejeta sredstva nameni za plačilo stroškov delovanja KME RS.
(2) Vrsta pristojbine, višina in podrobnejši način plačila pristojbin so določeni v tarifi JAZMP.
16. člen
(nadzor)
(1) Inšpekcijski in prekrškovni nadzor nad izvajanjem Uredbe 536/2014/EU in te uredbe izvajajo farmacevtski inšpektorji JAZMP (v nadaljnjem besedilu: farmacevtski inšpektorji).
(2) Inšpekcijski in prekrškovni nadzor glede varstva osebnih podatkov iz točke (d) prvega odstavka 28. člena Uredbe 536/2014/EU izvaja Informacijski pooblaščenec v skladu s predpisi o varstvu osebnih podatkov.
(3) JAZMP na zahtevo inšpektorjev iz drugih držav članic Evropske unije omogoči dostop do mesta, prostorov in podatkov, povezanih s kliničnim preskušanjem.
(4) Na podlagi sodelovanja med državami članicami Evropske unije, zahteve pristojnega organa države članice Evropske unije, Evropske agencije za zdravila ali Evropske komisije, zaprosila pristojnega organa ali poslovnega subjekta iz Evropske unije ali tretje države farmacevtski inšpektorji v skladu z Uredbo 536/2014/EU in v skladu z Zbirko postopkov Evropske unije opravljajo strokovne naloge preverjanja izpolnjevanja dobre klinične prakse pri poslovnem subjektu v tujini.
17. člen
(prekrški sponzorja)
(1) Z globo od 800 do 180.000 eurov se za prekršek kaznuje pravna oseba, če kot sponzor:
(2) Z globo od 500 do 120.000 eurov se kaznuje samostojni podjetnik posameznik ali posameznik, ki samostojno opravlja dejavnost, če stori prekršek iz prejšnjega odstavka.
(3) Z globo od 300 do 10.000 eurov se kaznuje odgovorna oseba pravne osebe, odgovorna oseba samostojnega podjetnika posameznika ali odgovorna oseba posameznika, ki samostojno opravlja dejavnost, če stori prekršek iz prvega odstavka tega člena.
(4) Z globo od 150 do 5.000 eurov se kaznuje posameznik, če stori prekršek iz prvega odstavka tega člena.
18. člen
(prekrški raziskovalca)
Z globo od 1.500 do 5.000 eurov se kaznuje posameznik, če kot raziskovalec:
19. člen
(prekrški, vezani na pogoje za izvajanje kliničnega preskušanja)
(1) Z globo od 4.000 do 40.000 eurov se za prekršek kaznuje pravna oseba, ki ne zagotovi ustreznih pogojev za izvajanje kliničnega preskušanja v skladu z izjavo in opisom prostorov, opreme, človeških virov in strokovnega znanja iz 67. točke Priloge I Uredbe 536/2014/EU.
(2) Z globo od 3.000 do 30.000 eurov se kaznuje samostojni podjetnik posameznik ali posameznik, ki samostojno opravlja dejavnost, če stori prekršek iz prejšnjega odstavka.
(3) Z globo od 600 do 6.000 eurov se kaznuje odgovorna oseba pravne osebe, odgovorna oseba samostojnega podjetnika posameznika ali odgovorna oseba posameznika, ki samostojno opravlja dejavnost, če stori prekršek iz prvega odstavka tega člena.
20. člen
(pooblastilo za izrek globe v razponu)
Za prekrške iz te uredbe se lahko v hitrem postopku izreče globa tudi v znesku, ki je višji od najnižje predpisane globe, določene s to uredbo.
21. člen
(prehodno obdobje)
(1) Vloge za odobritev oziroma priglasitev kliničnega preskušanja zdravil in vloge za priglasitev pomembnih sprememb kliničnega preskušanja zdravil, vložene pred 31. januarjem 2022, se obravnavajo v skladu z Zakonom o zdravilih (Uradni list RS, št. 17/14 in 66/19) in Pravilnikom o kliničnih preskušanjih zdravil (Uradni list RS, št. 54/06 in 17/14 – ZZdr-2).
(2) Do 31. januarja 2023 se vloge za odobritev kliničnega preskušanja zdravil lahko vložijo in obravnavajo v skladu z Uredbo 536/2014/EU in to uredbo ali v skladu z Zakonom o zdravilih (Uradni list RS, št. 17/14 in 66/19) in Pravilnikom o kliničnih preskušanjih zdravil (Uradni list RS, št. 54/06 in 17/14 – ZZdr-2).
(3) Klinična preskušanja zdravil, odobrena v skladu z Zakonom o zdravilih (Uradni list RS, št. 17/14 in 66/19) in Pravilnikom o kliničnih preskušanjih zdravil (Uradni list RS, št. 54/06 in 17/14 – ZZdr-2), ki še potekajo, je treba do 31. januarja 2025 uskladiti z Uredbo 536/2014/EU in to uredbo.
22. člen
(pristojbine)
Svet JAZMP uskladi Tarifo Javne agencije Republike Slovenije za zdravila in medicinske pripomočke (Uradni list RS, št. 209/21) v 30 dneh od uveljavitve te uredbe.
23. člen
(začetek veljavnosti)
Ta uredba začne veljati petnajsti dan po objavi v Uradnem listu Republike Slovenije.
Št. 00704-359/2022
Ljubljana, dne 13. oktobra 2022
EVA 2019-2711-0032
Vlada Republike Slovenije
dr. Robert Golob
predsednik
“,”Jaka Verbic Miklic”,1667036880,1667036880,sl,15259,306,15258,43,0,NULL,,”Uredba o izvajanju uredbe (EU) o kliničnem preizkušanju zdravil za uporabo v humani medicini”,uredba-o-izvajanju-uredbe-(eu)-o-klinicnem-preizkusanju-zdravil-za-uporabo-v-humani-medicini,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,1,0,1667037009,1668863946
949,15259,”Regulation (EU) on clinical trials on medicinal products for human use”,”DECREE on the implementation of the Regulation (EU) on clinical trials on medicinal products for human use “,”
3202. Decree on the implementation of the Regulation (EU) on clinical trials on medicinal products for human use
Pursuant to Article 21(7) of the Government of the Republic of Slovenia Act (Official Gazette of the Republic of Slovenia, no. 24/05 – Official Consolidated Text, 109/08, 38/10 – ZUKN, 8/12, 21/13, 47/13 – ZDU-1G, 65/14 and 55/17), the Government of the Republic of Slovenia issues the following
DECREE
on the implementation of the Regulation (EU) on clinical trials on medicinal products for human use
I. GENERAL PROVISIONS
Article 1
(content)
This Decree establishes the competent authorities, the national contact point, the national procedures relating to clinical trials on medicinal products for human use (hereinafter: Clinical Trials) and sanctions for the implementation of Regulation (EU) no. 536/2014 of the European Parliament and of the Council of 16 April 2014 on clinical trials on medicinal products for human use and repealing Directive 2001/20/EC (OJ L no. 158 of 27 May 2014, p. 1), as last amended by Commission Delegated Regulation (EU) 2017/1569 of 23 May 2017 supplementing Regulation (EU) no. 536/2014 of the European Parliament and of the Council by laying down principles and guidelines of good manufacturing practice on clinical trials on medicinal products for human use and regulating the conduct of reviews (OJ L no. 238 of 16 September 2017, p. 12), (hereinafter: Regulation 536/2014/EU), Commission Implementing Regulation (EU) 2017/556 of 24 March 2017 laying down detailed arrangements for the procedures for good clinical practice inspections under Regulation (EU) 536/2014 of the European Parliament and of the Council (OJ L no. 80 of 25 March 2017, p. 7; hereinafter Regulation 2017/556/EU), Commission Implementing Regulation (EU) 2022/20 of 7 January 2022 laying down rules for the application of Regulation (EU) no. 536/2014 of the European Parliament and of the Council as regards the establishment of rules and procedures for the cooperation of Member States in the safety assessment of clinical trials (OJ L no. 5 of 10 January 2022, p. 14; hereinafter: Regulation 2022/20/EU), and the present Decree.
Article 2
(competent authorities)
(1) The competent authority for the implementation of Regulation 536/2014/EU, Regulation 2017/556/EU, Regulation 2022/20/EU, and this Decree shall be the Agency of the Republic of Slovenia for Medicinal Products and Medical Devices (hereinafter referred to as: JAZMP).
(2) The competent authority for the performance of the tasks of the ethics committee in accordance with Regulation 536/2014/EU and this Decree shall be the Medical Ethics Committee of the Republic of Slovenia (hereinafter referred to as: KME RS).
Article 3
(national contact point)
The national contact point referred to in Article 83 of Regulation (EU) 536/2014/EU shall be the JAZMP.
Article 5
(investigator)
(1) One principal investigator shall be designated at the clinical trial site.
(2) The principal investigator shall be a licensed medical doctor or a licensed doctor of dental medicine who is qualified to conduct clinical trials in accordance with the principles of good clinical practice.
II. AUTHORISATION PROCEDURE FOR A CLINICAL TRIAL
Article 6
(validation of the application – validation)
The validation of the completeness of an application for the approval of a clinical trial and of an application for a substantial modification of a clinical trial (hereinafter: application) shall be carried out by the JAZMP.
Article 7
(evaluation of the application)
(1) The JAZMP shall carry out a scientific review of the clinical trial and the substantial modification of the clinical trial and shall prepare part I of the assessment report as referred to in Articles 6, 11, 18 and 22 of Regulation 536/2014/EU.
(2) The KME RS shall carry out an ethical review of the clinical trial and the substantial modification of the clinical trial and shall prepare part II of the assessment report as referred to in Articles 7, 11, 20 and 22 of Regulation 536/2014/EU.
(3) If the KME RS has concerns regarding the ethicality of the conduct of the clinical trial covered by part I of the assessment report referred to in paragraph 1 of this Article, it shall, within 30 days of the date of validation of the relevant application, inform the JAZMP, which prepared the assessment report referred to in paragraph 1 of this Article.
Article 8
(decision)
(1) The JAZMP shall notify the sponsor of the decision on approval, conditional approval, or refusal of the clinical trial or on the substantial modification of the clinical trial.
(2) If the KME RS fails to submit part II of the assessment report referred to in Articles 7, 11, 20 and 22 of Regulation 536/2014/EU with the conclusion within the timelines laid down in Regulation 536/2014/EU and in this Decree and fails to communicate the concerns referred to in the third paragraph of the preceding Article, its decision regarding the application shall be construed as its findings regarding aspects of part I of the assessment report referred to in Articles 6, 11, 18 and 22 of Regulation 536/2014/EU and, in the case of a substantial modification of an aspect of part II of the assessment report referred to in Articles 7, 11, 20 and 22 of Regulation 536/2014/EU, the substantial modification shall be deemed approved. In such cases, the JAZMP shall notify the sponsor of the decision without the opinion of the KME RS.
III. CONFLICT OF INTEREST AND LANGUAGE OF THE APPLICATION
Article 9
(conflict of interest)
(1) Persons validating completeness and assessing the documentation for a human clinical trial shall have no conflict of interest and shall be independent of the sponsor, of the clinical trial site and the investigators involved in the clinical trial and of persons financing the clinical trial, as well as free of any other undue influence.
(2) The persons referred to in the preceding paragraph shall sign a declaration of independence and absence of conflict of interest stating that they have no conflict of interest or appearance of conflict of interest, that they are independent of the sponsor, the clinical trial site, the investigators involved in the clinical trial and the persons financing the clinical trial, and are otherwise impartial, and that they have no financial or personal interests which may affect their impartiality.
(3) The persons referred to in the first paragraph of this Article shall, if circumstances arise which would be inconsistent with the declaration referred to in the preceding paragraph, immediately cease to act as an evaluator and shall inform the JAZMP or the Chairman of the KME RS within three working days of such circumstances of conflict of interest arising or becoming known to them.
(4) A pharmaceutical inspector shall make the declaration referred to in paragraph 2 of this Article once a year for the purposes of compliance with the requirements laid down in Article 5 of Regulation 2017/556/EU.
Article 10
(language)
(1) The documentation of an application for approval of a clinical trial and an application for approval of a substantial modification of a clinical trial shall be in Slovenian or English language.
(2) Notwithstanding the preceding paragraph, the cover letter, the protocol summary, and the documentation intended for the participants shall be in Slovenian.
(3) The protocol summary referred to in the preceding paragraph shall contain a brief description of:
1. the purpose and scientific significance of the clinical trial, supported by references to the relevant literature, including Slovenian literature,
2. the planned methods, including statistical methods,
3. the intended duration of the clinical trial,
4. the intended number and age of participants in the clinical trial,
5. the procedures for inclusion of participants,
6. the criteria for inclusion and exclusion, including criteria for withdrawal of individual subjects from treatment or the clinical trial,
7. any potential randomisation,
8. ethical considerations related to the clinical trial, benefits, risks, and burdens for the participants.
(4) The content of the summary of the results of the clinical trial for laypersons shall be in the Slovenian language.
(5) Investigational and auxiliary medicinal products shall be labelled in Slovenian or English language.
(6) Notwithstanding the previous paragraph, investigational medicinal products and auxiliary medicinal products received by participants for home use shall be labelled in Slovenian language.
IV. REPORTING OF UNEXPECTED SERIOUS ADVERSE REACTIONS
Article 11
(reporting of suspected unexpected serious adverse reactions)
(1) After acquiring prior agreement of the JAZMP, a non-commercial sponsor may, due to a lack of resources, exceptionally notify the JAZMP on a suspected unexpected serious adverse reactions occurring in the territory of the Republic of Slovenia, using the form for reporting adverse reactions of medicinal products published on the JAZMP website instead of entering information on the suspected adverse reactions into the database referred to in Article 40(1) of Regulation 536/2014/EU.
(2) The agreement of the JAZMP referred to in the preceding paragraph shall be acquired by the non-commercial sponsor prior to the commencement of a clinical trial based on an appropriate justification stated in the cover letter.
Article 12
(assessment of safety reports)
Information referred to in Articles 42 and 43 of Regulation 536/2014/EU shall be assessed by the JAZMP. The KME RS shall be granted access to data on the assessment reports of suspected serious adverse reactions and annual safety reports upon prior request.
V. SPECIFIC REQUIREMENTS FOR INVESTIGATIONAL MEDICINAL PRODUCTS
Article 13
(specific requirements for the manufacturing and preparation of investigational medicinal products)
(1) The procedures referred to in Article 61(5) of Regulation 536/2014/EU shall be carried out and supervised in accordance with the law regulating the pharmacy activity and implementing regulations issued pursuant thereto.
(2) Documentation referred to in Item 35 of Annex I to Regulation 536/2014/EU for:
1. the re-labelling and re-packaging of investigational medicinal products in hospitals, clinics and clinical institutes shall comprise:
– a valid authorisation for undertaking pharmacy activities involving the supply of medicinal products for clinical trials; and
– a good clinical practice certificate for pharmacists involved in the conduct of the clinical trial.
2. the re-labelling and re-packaging of investigational medicinal products in health centres and outpatient clinics shall comprise:
– a valid agreement or other written agreement of cooperation with the pharmacy services provider;
– valid authorisation from the pharmacy services provider for carrying out pharmacy activities involving the supply of medicinal products for clinical trials; and
– a good clinical practice certificate for pharmacists involved in the conduct of the clinical trial.
3. the preparation of radiopharmaceuticals used as diagnostic investigational medicinal products, shall comprise:
– authorisation for carrying out radiopharmaceutical pharmacy activities; and
– a good clinical practice certificate for pharmacists involved in the conduct of the clinical trial.
4. the preparation of medicinal products referred to in Item (c) of the fifth paragraph of Article 61 of Regulation 536/2014/EU shall comprise:
– a valid authorisation for undertaking pharmacy activities involving the supply of medicinal products for clinical trials;
– a good clinical practice certificate for pharmacists involved in the conduct of the clinical trial; and
– evidence that an inspection as per the third paragraph of this Article has been carried out within the last three years, including an examination of the procedures for the preparation of medicinal products referred to in Item (c) of the fifth paragraph of Article 61 of Regulation 536/2014/EU. If the pharmacy services provider does not have such evidence, an inspection shall be carried out before the approval of the clinical trial. Costs of the inspection procedure shall be borne by the clinical trial applicant.
(3) In the case of operators of the procedures referred to in Article 61(5) of Regulation 536/2014/EU, supervision of clinical trials of medicinal products shall be carried out by the pharmaceutical inspectors of the JAZMP in accordance with Regulation 2017/556/EU.
VI. INSURANCE AGAINST DAMAGES
Article 14
(insurance against damages)
Before the commencement of a clinical trial, insurance or a guarantee shall be provided to cover the liability of the sponsor and the liability of the investigator for any potential damage suffered by a participant as a result of participation in a clinical trial conducted in the territory of the Republic of Slovenia.
VII. FEES
Article 15
(fees)
(1) For the costs of the procedures and activities of the JAZMP and the KME RS in accordance with Regulation 536/2014/EU and this Decree, the sponsor shall pay a fee to the JAZMP. JAZMP shall within 60 days of payment of the sponsor’s fee transfer the funds for the part of the fee of KME RS in accordance with the Tariff of the JAZMP to the budget of the Republic of Slovenia, to account no. 01100-1000621284, reference 18 27111-4029399-18009422 (payments from abroad to account no. 01100-1000621284, SWIFT BSLJSI2X, IBAN SI56 01100-1000621284, delivery account 18 27111-4029399-18009422). The Ministry of Health will earmark the funds so received for payment of the operating expenses of KME RS.
(2) The type of fee, the amount, and the detailed method of payment of the fees are laid down in the Tariff of the JAZMP.
VIII. SUPERVISION
Article 16
(supervision)
(1) Inspection and infringement supervision of the implementation of Regulation 536/2014/EU and this Decree shall be carried out by the pharmaceutical inspectors of the JAZMP (hereinafter: pharmaceutical inspectors).
(2) Inspection and infringement supervision regarding the protection of personal data referred to under Item (d) of Article 28(1) of Regulation 536/2014/EU shall be carried out by the Information Commissioner in accordance with regulations on the protection of personal data.
(3) At the request of inspectors from other Member States of the European Union the JAZMP shall enable access to the site, premises and data related to the clinical trial.
(4) On the basis of cooperation among Member States, a request from a competent authority of a Member State, the European Medicines Agency or the European Commission, a request from a competent authority or a commercial entity from the European Union or a third country, pharmaceutical inspectors shall, in accordance with Regulation 536/2014/EU and in accordance with the European Union’s Compendium of Procedures, carry out professional tasks of verifying compliance with good clinical practice at a commercial entity abroad.
IX. PENAL PROVISIONS
Article 17
(offences of the sponsor)
(1) A legal entity shall be liable to a fine of between 800 and 180,000 EUR if it, as a sponsor:
1. conducts a clinical trial without a decision on the approval of the clinical trial or conditional approval of the clinical trial as referred to in Article 8(1) or Article 14(3) of Regulation 536/2014/EU,
2. conducts a clinical trial that has been substantially modified without a decision to grant a substantial modification of a clinical trial or to grant a conditional approval of a substantial modification of a clinical trial as referred to in Article 19(1), Article 20(5), or Article 23(1) of Regulation 536/2014/EU,
3. conducts a clinical trial in breach of item (a) of Article 28(1) of Regulation 536/2014/EU,
4. fails to ensure that subjects or their legally appointed representatives give informed consent in accordance with Article 29(1) of Regulation 536/2014/EU, as provided by item (c) of Article 28(1) of Regulation 536/2014/EU,
5. fails to protect the rights of participants to physical and mental integrity and privacy, as provided for in item (d) of Article 28(1) of Regulation 536/2014/EU,
6. conducts a clinical trial in breach of items (e), (f) or (g) of Article 28(1) of Regulation 536/2014/EU,
7. fails to ensure that subjects are not improperly induced to participate in the clinical trial, including in financial terms, as provided for in item (h) of Article 28(1) of Regulation 536/2014/EU,
8. acts in breach of Article 28(3) of Regulation 536/2014/EU,
9. fails to ensure compliance with Article 31 of Regulation 536/2014/EU when enrolling incapacitated subjects in a clinical trial,
10. fails to ensure compliance with Article 32 of Regulation 536/2014/EU when enrolling minors in a clinical trial,
11. fails to ensure compliance with Article 33 of Regulation 536/2014/EU when enrolling pregnant or breastfeeding women in a clinical trial,
12. fails to ensure compliance with Article 35 of Regulation 536/2014/EU in emergency situations in clinical trials,
13. fails to notify the JAZMP of the start of a clinical trial, the first visit of the first participant or the completion of the recruitment of participants in the Republic of Slovenia in accordance with Article 36 of Regulation 536/2014/EU,
14. fails to notify the JAZMP of the end of a clinical trial in the Republic of Slovenia or the end of a clinical trial in all Member states concerned and all third countries in accordance with the first, second or third paragraph of Article 37 of Regulation 536/2014/EU,
15. fails to submit to the EU database a summary of the results of the clinical trial or a summary of the results of an interim data analysis in accordance with the fourth and eighth paragraphs of Article 37 of Regulation 536/2014/EU,
16. fails to notify the JAZMP of a temporary halt of a clinical trial in all Member states concerned or of a restart of a temporarily halted clinical trial in accordance with the fifth or sixth paragraph of Article 37 of Regulation 536/2014/EU,
17. fails to notify the JAZMP of the reasons for an early termination of a clinical trial for reasons that do not affect the benefit-risk balance, and of measures to be taken for participants in accordance with Article 37(7) of Regulation 536/2014/EU,
18. fails to notify the JAZMP of a temporary halt or early termination of a clinical trial due to a change in the benefit-risk balance in accordance with Article 38 of Regulation 536/2014/EU,
19. fails to keep a record of all adverse events reported by the investigator in accordance with Article 41(3) of Regulation 536/2014/EU,
20. fails to report suspected unexpected serious adverse reactions to the European Medicines Agency in accordance with Article 42 of Regulation 536/2014/EU,
21. fails to submit an annual safety report for each individual investigational medicinal product used in a clinical trial which it is sponsoring, in accordance with Article 43 of Regulation 536/2014/EU,
22. conducts a clinical trial in breach of Article 47 of Regulation 536/2014/EU,
23. fails to monitor a clinical trial in accordance with Article 48 of Regulation 536/2014/EU,
24. conducts a clinical trial in breach of Article 51 of Regulation 536/2014/EU,
25. fails to notify the JAZMP of a serious breach of Regulation 536/2014/EU or of the protocol in accordance with Article 52 of Regulation 536/2014/EU,
26. fails to notify the JAZMP of unexpected events in accordance with Article 53(1) of Regulation 536/2014/EU,
27. fails to submit to the JAZMP all reports on the inspection of the clinical trial by third country authorities in accordance with Article 53(2) of Regulation 536/2014/EU,
28. fails to take appropriate urgent safety measures to protect participants or fails to notify them to the JAZMP in accordance with the first and second paragraph of Article 54 of Regulation 536/2014/EU,
29. fails to review, update, or provide the investigator with the investigator brochure in accordance with Article 55 of Regulation 536/2014/EU,
30. fails to record, process, handle, or store clinical trial information in accordance with Article 56 of Regulation 536/2014/EU,
31. fails to prepare the clinical trial master file or enable JAZMP the access to it in accordance with Article 57 of Regulation 536/2014/EU,
32. fails to archive the clinical trial master file in accordance with Article 58 of Regulation 536/2014/EU,
33. conducts a clinical trial with investigational medicinal products that are not manufactured or imported in accordance with Articles 61, 62, 63 of Regulation 536/2014/EU or in accordance with Article 13 of this Decree,
34. fails to ensure that investigational medicinal products and auxiliary medicinal products are labelled in accordance with Articles 66 and 67 of Regulation 536/2014/EU and in accordance with Article 10 of this Decree,
35. fails to conclude a written agreement in accordance with Article 71 of Regulation 536/2014/EU for the delegation of tasks to an individual, company, institution, or organisation,
36. does not conduct a clinical trial with co-sponsors in accordance with Article 72 of Regulation 536/2014/EU,
37. conducts clinical trials with gene therapy that would result in genome alterations in the germline of the subject, contrary to Article 90(2) of Regulation 536/2014/EU,
38. does not have insurance or a guarantee in place for damages suffered by a clinical trial participant in accordance with Article 14 of this Decree,
39. requires participants to cover costs referred to in Article 92 of Regulation 536/2014/EU.
(2) A fine of 500 to 120,000 EUR shall be imposed on an individual sole trader or a self-employed individual who commits an offence referred to in the preceding paragraph.
(3) A fine of 300 to 10,000 EUR shall be imposed on the responsible person of a legal entity, the responsible person of a sole trader or the responsible person of a self-employed individual who commits the offence referred to in paragraph 1 of this Article.
(4) A fine of 150 to 5,000 EUR shall be imposed on an individual committing an offence referred to in paragraph 1 of this Article.
Article 18
(investigator offences)
A fine of 1,500 to 5,000 EUR shall be imposed on an individual if he/she as an investigator:
1. conducts a clinical trial without a decision on the approval of the clinical trial or conditional approval of the clinical trial as referred to in Article 8(1) or Article 14(3) of Regulation 536/2014/EU,
2. conducts a clinical trial that has been substantially modified without a decision to grant a substantial modification of a clinical trial or to grant a conditional approval of a substantial modification of a clinical trial as referred to in Article 19(1), Article 20(5), or Article 23(1) of Regulation 536/2014/EU,
3. conducts a clinical trial in breach of item (a) of Article 28(1) of Regulation 536/2014/EU,
4. fails to provide information to clinical trial participants or their legally appointed representatives in accordance with Article 29(2) through (6) of Regulation 536/2014/EU, as provided for in item (b) of the first paragraph of Article 28 of Regulation 536/2014/EU,
5. fails to obtain informed consent from participants or their legally appointed representatives in accordance with Article 29(1) of Regulation 536/2014/EU, as provided for in item (c) of the first paragraph of Article 28 of Regulation 536/2014/EU,
6. fails to protect the rights of participants to physical and mental integrity and privacy, as provided for in item (d) of Article 28(1) of Regulation 536/2014/EU,
7. conducts a clinical trial in breach of items (f) or (g) of Article 28(1) of Regulation 536/2014/EU,
8. improperly induces subjects to participate in a clinical trial (item (h) of Article 28(1) of Regulation 536/2014/EU),
9. acts in breach of Article 28(3) of Regulation 536/2014/EU,
10. acts in breach of Article 31 of Regulation 536/2014/EU when enrolling incapacitated subjects in clinical trial,
11. acts in breach of Article 32 of Regulation 536/2014/EU when enrolling minors in a clinical trial,
12. acts in breach of Article 33 of Regulation 536/2014/EU when enrolling pregnant or breastfeeding women in a clinical trial,
13. does not conduct a clinical trial in emergency situations in accordance with Article 35 of Regulation 536/2014/EU,
14. fails to record, document, or report adverse events or laboratory abnormalities to the sponsor in accordance with Article 41(1) of Regulation 536/2014/EU,
15. fails to record and document all adverse reactions or report all serious adverse reactions to the sponsor in accordance with the second and fourth paragraphs of Article 41 of Regulation 536/2014/EU,
16. conducts a clinical trial in breach of Article 47 of Regulation 536/2014/EU,
17. does not fulfil the conditions for an investigator in accordance with Article 49 of Regulation 536/2014/EU,
18. conducts a clinical trial in breach of Article 51 of Regulation 536/2014/EU,
19. fails to take appropriate urgent safety measures to protect participants in accordance with Article 54(1) of Regulation 536/2014/EU,
20. fails to record, process, handle, or store clinical trial information in accordance with Article 56 of Regulation 536/2014/EU,
21. fails to prepare the clinical trial master file or enable JAZMP the access to it in accordance with Article 57 of Regulation 536/2014/EU,
22. fails to archive the clinical trial master file in accordance with Article 58 of Regulation 536/2014/EU,
23. fails to act as principal investigator in accordance with Article 73 of Regulation 536/2014/EU,
24. conducts clinical trials with gene therapy that would result in genome alterations in the germline of the subject, contrary to Article 90(2) of Regulation 536/2014/EU,
25. requires participants to pay the costs of investigational medicinal products or procedures specifically required by the protocol in breach of Article 92 of Regulation 536/2014/EU,
26. does not have insurance or a guarantee in place for damages suffered by a clinical trial participant in accordance with Article 14 of this Decree.
Article 19
(offences related to the conditions for the conduct of a clinical trial)
(1) A fine of 4,000 to 40,000 EUR shall be imposed for an offence on a legal entity that fails to ensure appropriate conditions for the conduct of a clinical trial in accordance with the declaration and description of the premises, equipment, human resources, and expertise referred to in item 67 of Annex I to Regulation 536/2014/EU.
(2) A fine of 3,000 to 30,000 EUR shall be imposed on an individual sole trader or a self-employed individual who commits an offence referred to in the preceding paragraph.
(3) A fine of 600 to 6,000 EUR shall be imposed on the responsible person of a legal entity, the responsible person of a sole trader or the responsible person of a self-employed individual who commits the offence referred to in paragraph 1 of this Article.
Article 20
(authorisation to impose a fine within the specified limits)
A fine for offences referred to in this Decree may also be imposed in expedited procedure in an amount higher than the minimum fine prescribed by this Decree.
X. TRANSITIONAL AND FINAL PROVISIONS
Article 21
(transitional period)
(1) Applications for approval or notification of a clinical trial of medicinal products and applications for notification of substantial modifications to a clinical trial of medicinal products submitted before 31 January 2022 shall be processed in accordance with the Medicinal Products Act (Official Gazette of RS, no. 17/14 and 66/19) and the Rules on Clinical Testing of Medicinal Products (Official Gazette of RS, no. 54/06 and 17/14 – ZZdr-2).
(2) Until 31 January 2023, applications for approval of clinical trials of medicinal products may be submitted and processed in accordance with Regulation 536/2014/EU and this Decree or in accordance with the Medicinal Products Act (Official Gazette of RS, no. 17/14 and 66/19) and the Rules on Clinical Testing of Medicinal Products (Official Gazette of RS, no. 54/06 and 17/14 – ZZdr-2).
(3) Clinical trials of medicinal products approved in accordance with the Medicinal Products Act (Official Gazette of RS, no. 17/14 and 66/19) and the Rules on Clinical Testing of Medicinal Products (Official Gazette of RS, no. 54/06 and 17/14 – ZZdr-2), which are still ongoing, shall be harmonised with Regulation 536/2014/EU and this Decree by 31 January 2025.
Article 22
(fees)
The Council of the JAZMP shall harmonise the Tariff of the Agency of the Republic of Slovenia for Medicinal Products and Medical Devices (Official Gazette of RS, no. 209/21) within 30 days of the entry of this Decree into force.
Article 23
(Effective date)
This Decree shall enter into force on the fifteenth day following its publication in the Official Gazette of the Republic of Slovenia.
no. 00704-359/2022
Ljubljana, 13 October 2022
EVA 2019-2711-0032
Government of the Republic of Slovenia
Dr. Robert Golob
President
“,,1668863880,1668863880,en,15259,306,15258,43,0,NULL,,”Uredba o izvajanju uredbe (EU) o kliničnem preizkušanju zdravil za uporabo v humani medicini”,uredba-o-izvajanju-uredbe-(eu)-o-klinicnem-preizkusanju-zdravil-za-uporabo-v-humani-medicini,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,1,0,1667037009,1668863946
950,15266,”UKC Ljubljana z novo metodo vstavljanja srčne zaklopke “,”Pri tej metodi ni potrebna uporaba naprave za zunajtelesni krvni obtok”,”
Ljubljana, 2. novembra – V UKC Ljubljana izvajajo novo metodo vstavljanja srčne zaklopke, ki predstavlja nov mejnik pri zdravljenju srčnih bolnikov. Pri tej metodi namreč ni potrebna uporaba naprave za zunajtelesni krvni obtok, operacija pa poteka prek manjše rane na levi strani prsnega koša. Nedavno so uspešno opravili tudi prvi implantaciji te zaklopke.
Predstojnik kliničnega oddelka za kirurgijo srca in ožilja Univerzitetnega kliničnega centra (UKC) Ljubljana Nikola Lakič je na današnji predstavitvi nove metode povedal, da je nova zaklopka najbolj primerna za bolnike, ki so operacijo na srcu že imeli in potrebujejo novo.
Prav tako je primerna za tiste, za katere kirurško zdravljenje in zdravljenje z mitralno sponko ni primerno oziroma predstavlja preveliko tveganje. Kot je pojasnil, je namestitev te zaklopke manj tvegana, bolniku izboljša kakovost življenja in omogoči hitrejše okrevanje.
Vodja katetrskega laboratorija UKC Ljubljana Matjaž Bunc je razložil, da gre za klasično zasnovo zaklopke z elastičnim skeletom, ki ga je s posebno aplikacijsko tehniko mogoče zložiti v majhen volumen, znotraj zaklopke pa so lističi iz prašičjega perikarda. Zloženo zaklopko kirurgi po tulcu pripeljejo na mesto postavitve v levi atrij in jo namestijo tako, da zavzame svojo pozicijo znotraj mitralne zaklopke, zasidra pa se v srčno konico. Stara zaklopka torej ostane na mestu in funkcionira kot sidro za novo zaklopko, je še razložil.
Kardiokirurginja UKC Ljubljana Tadeja Kolar je dodala, da je ob razpiranju zaklopke v srcu pomembno, da jo s čepkom na vrvici, ki je nanjo pritrjena, pravilno prilagodimo. “Vrvica zaklopko zasidra v srce, s čepkom pa se nastavi ustrezna razdalja. Rano potem po plasteh zašijemo in medtem spremljamo delovanje zaklopke in srca,” je povedala in dodala, da bolniki po posegu v bolnišnici okrevajo od pet do deset dni, ta čas pa se bo z izkušnjami verjetno skrajšal.
Strokovnjaki so povedali, da so se na ta projekt pripravljali dve leti, pri zdravljenju pa trenutno uporabljajo edino komercialno razpoložljivo zaklopko podjetja Abbott. Ljubljanski UKC pa se je z implementacijo metode uvrstil med 98 centrov, ki jo po svetu že uporabljajo.
Lakič je razložil, da v UKC letno pričakujejo namestitev zaklopke desetim bolnikom. Stroški zdravljenja z zaklopko pa v celoti še niso pokriti iz zavarovanja, saj je metoda relativno nova. “Čaka nas še dolga in krvava pot. Mislim pa, da bomo uspeli, saj je napredek tisti, ki narekuje razvoj in s tem kvaliteto bolnikovega življenja,” je še dodal.
“,”Jaka Verbic Miklic”,1667395860,1667395860,sl,15266,306,15265,43,0,NULL,,”UKC Ljubljana z novo metodo vstavljanja srčne zaklopke “,ukc-ljubljana-z-novo-metodo-vstavljanja-srcne-zaklopke,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1668864776,1668864776
951,15268,”November v znamenju ozaveščanja o rakih pri moških “,”Rak prostate je ena najpogostejših vrst raka pri moških, za katerim zboli vsak četrti moški po 50. letu starosti.”,”
Ljubljana, 7. novembra – Rak prostate je ena najpogostejših vrst raka pri moških, za katerim zboli vsak četrti moški po 50. letu starosti. Vsako leto je diagnosticiranih približno 1600 moških s to boleznijo, umre pa jih približno 400. S kampanjo Dej se preglej! slovensko onkološko društvo za moške OnkoMan v novembru ozavešča o pomenu preventivnih pregledov prostate.
Kot so sporočili iz društva OnkoMan, je delež ozdravljivosti visok, če se bolezen ugotovi v zgodnji fazi, zato so redni preventivni pregledi izrednega pomena. Cilj kampanje Dej se preglej! je ozaveščati moške o pomenu preventivnih pregledov, da pravočasno ukrepajo in preprečijo, da bi postali del te statistike.
Kampanja izhaja iz karakteristik, ki stereotipno zaznamujejo moške. Veliko moških počne stvari, ki so morda sprva nerazumljive, nelogične ali nepotrebne. Eden takšnih primerov je postavljanje mlaja – posekajo drevo samo zato, da bi ga nato znova postavili. Če za rojstnodnevno slavje počnejo to, bi se lahko šli tudi pregledat, so zapisali v društvu.
“Moškim želimo sporočiti, da naj praznujejo življenje in naj ne tvegajo, zato jih pozivamo, dej se preglej,” pravi predsednik društva Matej Pečovnik. Po njegovih besedah želijo s sporočilom doseči čim več moških, zato bodo ta mesec po državi postavljali mlaje in tako ozaveščali o pomenu preventive.
“Moškim po vsej Sloveniji želimo sporočiti, da znajo in zmorejo početi veliko stvari, ena izmed teh pa bi morala biti tudi ta, da poskrbijo zase in za preventivne preglede prostate,” so njegove besede povzeli v sporočilu za javnost.
Kampanjo so podprli tudi številni znani Slovenci, med drugimi Cene Prevc, Žiga Pance, Aljaž Bedene, Benjamin Savšek, Matjaž Kek in Žan Papič, ki v videu moškim sporočajo “dej se preglej”. O znakih, na katere morajo biti moški pozorni, pa si lahko preberejo na spletni strani onkoman.si/dej-se-preglej. Tam z virtualnim “plezanjem” po mlaju lahko spoznajo ključne opozorilne znake za rak prostate ter poskrbijo, da bodo po dopolnjenem 50. letu slavili še čim večkrat.
Društvo OnkoMan je bilo ustanovljeno leta 2016 in je prvo društvo v Sloveniji, ki je prvenstveno namenjeno moškim in moškemu zdravju.
“,”Jaka Verbic Miklic”,1667828100,1667828700,sl,15268,306,15267,43,0,NULL,,”November v znamenju ozaveščanja o rakih pri moških “,november-v-znamenju-ozavescanja-o-rakih-pri-moskih,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1668864965,1668865555
952,15270,”Kakovost in varnost morata biti ključni usmeritvi slovenskega zdravstvenega sistema “,” Med drugim so kot ključen dejavnik pri obravnavi pacientov izpostavili digitalizacijo”,”
Ljubljana, 18. novembra – Izvozni produkt slovenskega zdravstvenega sistema bi morala biti usmeritev v kakovost in varnost, so bili na današnjem AmCham poslovnem zajtrku enotni strokovnjaki. Ob tem so poudarili pomen digitalizacije slovenskega zdravstva, opozorili na problem dolgih čakalnih vrst, pomanjkanja zdravstvenih kadrov in bega možganov v tujino.
Na poslovnem zajtrku, ki ga je organizirala Komisija za zdravstvo in kakovost bivanja, so strokovnjaki odprli različne problematike na področju slovenskega zdravstvenega sistema. Med drugim so kot ključen dejavnik pri kakovostni obravnavi pacientov izpostavili digitalizacijo. Direktor podjetja za programsko opremo Better Tomaž Gornik je ob tem poudaril, kako pomembna je ustrezna uporabo e-kartona, ki je pacientova zdravstvena kartoteka v elektronski obliki.
“Ne gre za to, da v državi nimamo infrastrukture za shranjevanje in prikaz podatkov, temveč za to, kako bomo zagotovili, da deležniki v zdravstvu polnijo ta sistem in ga tudi uporabljajo,” je dejal. Kot je pojasnil, primarno zdravstvo zelo malo podatkov pošilja v elektronski zdravstveni karton, veliko zapisov je še vedno na papirju in to bi se moralo spremeniti. Kot primer dobre prakse je sicer izpostavil obdobje v času epidemije covida-19, v katerem se je zbiranje zdravstvenih podatkov v elektronski obliki povečalo.
Poleg digitalizacije so se dotaknili tudi problema dolgih čakalnih vrst. Po besedah izvršne direktorice Slovenskega združenja bolnikov z limfomom in levkemijo ter državljanke Evrope 2021 Kristine Modic slednje predvsem za onkološke bolnike pomenijo pozno diagnozo, slabšo prognozo, dražje zdravljenje in težje okrevanje. “Problem čakalnih vrt je v Sloveniji velik problem in na tem področju je potrebno narediti več, saj gre za samo preživetje bolnikov,” je dejala.
Po mnenju člana strateškega sveta vlade za prenovo zdravstvenega sistema Dorjana Marušiča, smo v državi daleč od tega, da bi optimizirali dostopnost. “Če bi želeli to doseči, bi morali ob začetku simptomov bolnika pripraviti ustrezno pot gibanja, jo opremiti s spremljanjem in potem začeti meriti dostopnost tako, kot to počnejo v svetovnem prostoru, kjer spremljajo, kolikšen delež čakajočih pride do določenega posega, operacije v optimalnem času. V Sloveniji pa tega podatka nimamo,” je pojasnil. Obenem je opozoril, da se dostopnosti ne da rešiti samo z dodatnimi sredstvi.
Na temo čakalnih vrst je profesor na Ekonomski fakulteti Univerze v Ljubljani Marko Pahor komentiral, da bi morali zdravnike tudi razbremeniti administrativnih obveznosti, ki so po njegovem mnenju v dobi digitalizacije nesmiselne.
Temi razprave sta bili tudi pomanjkanje kadrov v zdravstvu ter izgubljanje primarne rasti zdravstva. Kljub visokim izdatkom za zdravstvo ima Slovenija relativno malo zdravnikov, na 1000 prebivalcev zgolj 3,3. Kot izpostavljajo na komisiji pa so razlogi za nezadovoljstvo zdravnikov izgorelost, preobremenjenost, birokracija, pomanjkanje možnosti za strokovni razvoj, omejena avtonomija, ter zaznavanje nepravičnega in neustreznega plačila.
Tako po mnenju Marušiča, kot specializanta infektologije Davida Zupančiča je velik problem tudi odhajanje ljudi iz javnega zdravstvenega sektorja v privatni sektor in v tujino, kjer vidijo boljše tako delovne kot finančne možnosti. Zupančič je ob tem opozoril na nekatere skromne plače v slovenskem zdravstvenem sistemu in da je predvsem najmlajše zdravnike potrebno spodbuditi z ustreznim plačilom. “Le tako je namreč možno na ta delovišča privabiti več ljudi, kar posledično vodi v lažje delovne pogoje,” je pojasnil.
“,”Jaka Verbic Miklic”,1668778980,1668778980,sl,15270,306,15269,43,0,NULL,,”Kakovost in varnost morata biti ključni usmeritvi slovenskega zdravstvenega sistema “,kakovost-in-varnost-morata-biti-kljucni-usmeritvi-slovenskega-zdravstvenega-sistema,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1668865517,1668865517
953,15272,”Kako bi lahko koncept »na vrednosti temelječe zdravstvene obravnave« izboljšal izide zdravljenja v Sloveniji?”,”Na vrednosti temelječa zdravstvena obravnava (NaVTeZ oziroma VBHC) v središče zdravstvene obravnave postavlja pacienta in njegovo zdravje ter želi zdravljenje organizirati tako, da z njim dosežemo najboljše rezultate zdravljenja za pacienta glede na vložena sredstva. “,”
Ljubljana, 23. november 2022 – Na vrednosti temelječa zdravstvena obravnava (NaVTeZ oz. VBHC) v središče zdravstvene obravnave postavlja pacienta in njegovo zdravje ter želi zdravljenje organizirati tako, da z njim dosežemo najboljše rezultate zdravljenja za pacienta glede na vložena sredstva. NaVTeZ prinaša celovito spremembo načina obravnave pacienta – pacienti so bistveno bolj vključeni v lastno obravnavo, zdravstveni timi so motivirani za čim boljše izide zdravljenja, z njim pa se izboljšuje kakovost zdravstvenega sistema za vse deležnike.
O tem so se tuji in domači strokovnjaki pogovarjali na že 11. strateški konferenci Vrednost inovacij, ki jo je organiziral Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb. Letos je konferenca potekala pod geslom Izidi zdravljenj v osrčju sistema. Koncept NaVTeZ oz. »Value-based healthcare« je predstavila Nicola Bedlington, partnerica v podjetju Millwater partners, in ena ključnih oseb, ki je pomagala zgraditi organizacijo Evropski forum bolnikov. Kot je pojasnila, koncept predlaga ureditev zdravstvenega sistema, ki je osredotočen na konkurenco in izboljšanje rezultatov za bolnike. NaVTeZ torej temelji na merjenju rezultatov, kjer »govorimo o zbiranju številnih podatkov, ki dajejo informacije o tem, kako učinkovito je bilo zdravljenje za bolnika (npr. klinični izvidi, počutje pacienta, bolečine itn.). Del podatkov poda zdravnik ali drugo zdravstveno osebje, del pa pacient. Pomembno vlogo pri tem igrata dobra in učinkovita digitalna ter tehnična podpora, saj zbiranje podatkov ne sme (dodatno) obremenjevati zdravstvenega osebja.« Kot je še dodala Bedlington, koncept NaVTeZ razume skupne zdravstvene potrebe bolnikov, oblikuje rešitve za izboljšanje zdravstvenih rezultatov, integrira učne ekipe ter meri zdravstvene rezultate, predvsem pa stroške. Po njenem prepričanju so prav denarni, oportunitetni, stroški celotnega procesa oskrbe na poti bolnika pomemben vidik na vrednosti temelječega zdravstva, ki ga ne smemo zanemarjati: »Preklop fokusa na zdravstvene rezultate in postopke oskrbe pomeni zmanjšano variacijo prakse, večjo kakovost zdravstvene oskrbe in izboljšano stroškovno učinkovitost.« Kot je še dodala, je premik k NaVTeZ pomemben, ker so zdravstveni sistemi po svetu že sedaj nevzdržni, prav tako pa se med državami vedno bolj povečujejo neenakosti v obravnavi. Prebivalstvo v Evropi se stara, zaradi česar se moramo po njenem nujno premakniti k zdravstvenim sistemom, ki lahko bolnikom nudijo pravično oskrbo, ki je trajnostna in dolgoročna ter vsem dostopna.
NaVTeZ sicer zelo dobro poznajo na Nizozemskem. Kot je povedal Pieter de Bey, generalni direktor nizozemskega bolnišničnega združenja Santeon, so se pred leti odločili, da bodo v sedmih bolnišnicah članicah združenja pričeli z uvajanjem koncepta NaVTeZ. Santeon je t. i. »učni sistem« 7 bolnišnic za akutno in kronično nego, ki na Nizozemskem velja za največjega ponudnika bolnišničnih storitev. Pri uvedbi koncepta NaVTeZ so si zastavili pet ambicij, in sicer da so pacienti v proces zdravljenja aktivno vključeni, da strokovnjaki tesno sodelujejo med seboj, da s skupnimi močmi delajo tudi na področju inovacij in raziskav, da je kakovost oskrbe transparentna ter da mora biti oskrba bolnikom vedno dostopna – tudi v finančnem smislu. V vseh sedmih bolnišnicah so skušali meriti vrednost zdravljenja na bolnika v širšem vidiku in ugotovili, da se med bolnišnicami dogajajo velike razlike. Zato so povsod uvedli standardizirane kartone, s katerimi merijo rezultate zdravljenja, stroške ter efektivnost procesa zdravljenja. »V zadnjih desetih letih smo se v skupini Santeon naučili, da moramo ustvariti skupno razumevanje vrednosti in jo meriti s pomočjo podatkovnih standardov. Pri nas verjamemo, da bo s ciklom nenehnega izboljševanja tudi finančna korist za bolnišnice največja. Začeti moramo z malimi koraki, postopno, nato pa rasti s pragmatičnostjo in grajenjem varnega učnega okolja,« je poudaril de Bey. Ob tem je Hans Winberg, generalni sekretar v stockholmski Fundaciji za vodilno zdravstveno varstvo, opozoril tudi na ovire, ki jih s seboj prinese NaVTeZ. Kot je povedal, je koncept NaVTeZ na ravni nacionalnega zdravstvenega sistema v osnovi model upravljanja. Kot tak izhaja iz tržne logike, kjer ima osrednji pomen merjenje rezultatov vezan na zunanje primerjave oz. izbiro: »NaVTeZ predstavlja perspektivo, ki poudarja “kaj je pomembno za pacienta,” hkrati pa ta stavek pristojni na operativni ravni in tisti na ravni politike razumejo vsak po svoje.«
Kako je pri nas?
Seveda je ob razmišljanju o NaVTeZ ključen napreden informacijski sistem oz. digitalizacija zdravstvenega sistema. Tu pri nas nazadujemo, so se strinjali govorci na okrogli mizi z naslovom Sprememba paradigme v zdravstvu: od prvih korakov do upravljanja življenjskega sloga, ki jo je moderiral prim. mag. Dorjan Marušič, svetovalec ministra za zdravje. Kot je v uvodnem nagovoru povedala državna sekretarka na Službi vlade RS za digitalno preobrazbo, dr. Aida Kamišalić Latifić, ima država sicer jasen cilj digitalne preobrazbe tako gospodarstva kot javnih storitev. »Tu smo si zadali cilj, da bodo do leta 2030 vse ključne javne storitve na voljo preko spleta ter da bodo vse državljanke in državljani imeli dostop do svojih e-kartotek.« Za uvedbo koncepta nujno potrebujemo dobro digitalno podlago ter NaVTeZ preusmeriti iz koncepta v dejansko uporabo. Kot je povedala red. prof. dr. Valentina Prevolnik Rupel, znanstvena svetnica na Inštitutu za ekonomska raziskovanja v Ljubljani, so pri pripravi usmeritev za uvedbo koncepta pri nas med relevantnimi deležniki opravili anketo o tem, koliko jim je sploh poznan NaVTeZ: »Ugotovili smo, da približno 40 odstotkov deležnikov koncept pozna. Paradoks, ki ga lahko omenim, pa je, da je od vseh vprašanih kar 81 odstotkov odgovorilo, da bi koncept v naš zdravstveni sistem prinesel nekaj dobrega, kljub temu, da ga niso nujno poznali.« Koncept zveni privlačno, a ob tem ne smemo pozabiti, da izhaja iz Združenih držav Amerike, kjer je zdravstvo bolj ekonomska disciplina, je poudaril doc. dr. Aleš Rozman, dr. med., spec. iz Univerzitetne klinike Golnik. Po njegovem golo preslikovanje koncepta na slovenska tla za nas ne bo prava metoda. S tem se je strinjala tudi izr. prof. dr. Petra Došenović Bonča, predstojnica Katedre za ekonomijo na Ekonomski fakulteti Univerze v Ljubljani, ki pravi, da moramo zelo paziti pri implementaciji koncepta: »Paziti je treba, da se manj pogovarjamo o zbiranju podatkov in več o tem, kako bomo te podatke uporabili. Frustracija zdravstvenih izvajalcev je, da ne dobijo povratne informacije in le s tem bodo v konceptu videli vrednost. Torej, kako dati vsakemu deležniku pravo informacijo, ki mu bo koristila.«
»Strinjam se, da imamo zelo veliko podatkov,« je povedala Anka Bolka, direktorica področja za analitiko in razvoj na Zavodu za zdravstveno zavarovanje Slovenije, ter dodala, da zavod od leta 2013 dalje vse podatke o plačanih storitvah za vsako osebo uporablja tudi za sekundarno rabo. »V tej smeri to ni novost, z nakupom storitev, ki so za pacienta najbolj koristne, se ukvarjamo že dlje časa. Vprašanje pa je, kolikšna je pristojnost zavoda v tem rigidnem sistemu, torej, če lahko podpremo takšne inovativne pristope, ker vsak tak pilotni preizkus traja dolgo. V tem vztrajati in financirati je zahtevno,« je še dodala Bolka.
Sogovorniki so se strinjali, da je pri nas potreben postopni pristop. NaVTeZ po njihovem namreč ni pristop za vse dejavnosti, kar pomeni da ne more biti univerzalen. Težava slovenskega zdravstva je namreč večplastna – z digitalizacijo zdravstva želimo izvajalcu olajšati delo, a mu ga trenutno le še otežujemo. Namreč, po mnenju sogovornikov, imamo premalo zdravstvenih delavcev tudi zato, ker morajo veliko časa presedeti za računalnikom in vnašati podatke. V prihodnosti bo moral biti zdravstveni tim drugačen, prav tako pa bomo morali, po mnenju sogovorcev, izvajalce zdravstvenih storitev razbremeniti planskega gospodarstva ter nameniti pomembno pozornost transparentnosti. V konceptu NaVTeZ je pomembno, da so izidi zdravljenj transparentni in dostopni uporabnikom zdravstvenih storitev. To omogoča primerjavo rezultatov, zdravo konkurenco med izvajalci, pacientom pa daje možnost izbire, kje bodo storitev, ki jo potrebujejo, opravili.
Link na posnetek: https://www.youtube.com/@farmaforum1498/featured
“,”Jaka Verbic Miklic”,1669465440,1669465440,sl,15272,306,15271,43,0,NULL,,”Kako bi lahko izboljšail izide zdravljenja v Sloveniji”,kako-bi-lahko-izboljsail-izide-zdravljenja-v-sloveniji,Post,”/sites/43/files/images/news/11. strateska/Naslovna_fotografija_strateske_konference.jpg”,1,0,1669465574,1690699922
954,15274,”Limfom ostaja težka bolezen, vendar je okrevanje mogoče “,”Osebe, ki pri sebi sumijo na pojav limfoma, opozorila, naj bodo pozorni na odklone pri počutju: nočno potenje, izgubo telesne teže in povečane bezgavke.”,”
Ljubljana, 22. novembra – Na izobraževalnem srečanju o razumevanje limfomov in levkemije L&L Info dan so zdravniki specialisti spregovorili o razumevanju limfomov, na katere simptome je treba biti pri sumu na bolezen pozoren in kako nato poteka zdravljenje. Gre za težko bolezen, vendar je okrevanje mogoče.
Na pogovoru v organizaciji Slovenskega združenja bolnikov z limfomom in levkemijo je specialistka internistične onkologije Jana Pahole uvodoma povedala, da so limfomi zelo raznolika skupina bolezni, skupaj jih je več kot 80. Najširše znan je Hodgkinov limfom, ki se pojavlja predvsem pri mlajših bolnikih in je ozdravljiv. Zanj je značilno, da je lahko potek ali zelo počasen ali zelo agresiven, zato je prava diagnoza ključna.
Pahole je osebe, ki pri sebi sumijo na pojav limfoma, opozorila, naj bodo pozorni na odklone pri počutju: nočno potenje, izgubo telesne teže in povečane bezgavke. Ljudje limfome najpogosteje opazijo na vratu, pod pazduhami in v dimljah, nahajajo pa se tudi v trebušni votlini in prsnem košu, kjer pa je že potrebna usmerjena diagnostika.
Sum na limfom sicer ni dovolj, da pacient pride do specialista, je dejala Pahole, za to je potrebna histološka diagnoza, ki pregleda celo bezgavko, to pa je precej dolgotrajen proces. “Težava je v tem, da včasih bolniki v sklopu terapije virusnih okužb dobivajo deksametazon in kortikosteroide, ki že napol ozdravijo limfom. Klinične slike so zato zabrisane, zato do diagnoze pride kasneje,” je pojasnila.
Vodja enote za ugotavljanje poznih posledic zdravljenja raka na Onkološkem inštitutu Lorna Zadravec Zaletel je povedala, da se uporaba obsevalnega zdravljenja na področju limfomov v zadnjih desetletjih krči, širi pa se uporaba kemoterapije. Pri sistemski bolezni se obsevanje uporablja na koncu, pri ostankih limfoma. Doze sevanja so nižje kot nekoč in bolj lokalizirane, je dodala.
Vodja transplantacijske dejavnosti na Kliničnem oddelku za hematologijo UKC Ljubljana Matjaž Sever pa je razložil, da v višjih stadijih bolezen zdravijo s transplantacijo kostnega mozga, ki se imenuje tudi visokodozna kemoterapija s podporo matičnih celic. Gre za resen poseg, po katerem morajo bolniki vsaj dva tedna preživeti v izolirani sobi, kjer niso izpostavljeni mikroorganizmom iz okolja. V tem času jim z infuzijami nadomeščajo vse funkcije kostnega mozga.
Sever je spregovoril tudi o najnovejšem zdravljenju s celicami CAR-T, ki jih bodo kmalu proizvajali v laboratoriju na Inštitutu za mikrobiologijo in imunologijo. Trenutno je laboratorij še v postopku pridobivanja dovoljenja. V njem limfocite spremenijo in vanje vgradijo genetski zapis, ko jih nato vrnejo v bolnika, pa limfociti uspešno izvajajo imunoterapijo na način, da iščejo tarčne maligne celice. Nabor pacientov, pri katerih uporabljajo to terapijo, je še zelo ozek, predvsem gre za tiste, ki niso dovolj pri moči, da bi jih zdravili s transplantacijo kostnega mozga.
“,”Jaka Verbic Miklic”,1668860880,1668860880,sl,15274,306,15273,43,0,NULL,,”Limfom ostaja težka bolezen, vendar je okrevanje mogoče “,limfom-ostaja-tezka-bolezen-vendar-je-okrevanje-mogoce,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1672662584,1672662646
955,15276,”Ljubljanski UKC z novo najsodobnejšo napravo za posege in preiskave žilja, možganov in hrbtenjače “,”Aparat omogoča odkrivanje in zdravljenje sprememb na ožilju vratu in glave ter drugje po telesu, pa tudi CT-vodeno izvajanje žilnih in nežilnih posegov. “,”
Ljubljana, 25. novembra – Na nevrološki kliniki UKC Ljubljana so danes prevzeli nov dvoravninski angiografski aparat. Gre za najsodobnejšo napravo za invazivne intervencijske posege in preiskave žilja, možganov in hrbtenjače. Z novim aparatom bodo bolnikom z akutno možgansko kapjo in tistim, ki jim ta grozi, še naprej omogočali najsodobnejše zdravljenje.
Aparat omogoča odkrivanje in zdravljenje sprememb na ožilju vratu in glave ter drugje po telesu, pa tudi CT-vodeno izvajanje žilnih in nežilnih posegov. Na njem bodo izvajali med drugim najzahtevnejše intervencijske posege, med drugim zožitev zapor in razširitev arterij.
Naprava ima dve rentgenski cevi in dva detektorja, ki lahko delujejo hkrati in omogočajo hkraten prikaz sprememb v dveh ravninah. Tako je možno zdravljenje najkompleksnejših sprememb na številnih, tudi drobnih žilah, ob najboljši možni ločljivosti. Zdravljenje takih sprememb je bilo do sedaj možno le v glavni stavbi UKC, kar je bilo neugodno za bolnike, hospitalizirane na nevrološki kliniki, posebno za take, ki so bili hudo prizadeti.
Montaža aparata je potekala v času epidemije covida-19, kar je bilo logistično zahtevno. Aparat se nahaja na nevrološki kliniki, na novi lokaciji v pritličju, saj je bil stari, iztrošen aparat umeščen v neustrezen prostor. To je v veliki meri omogočilo vodstvo nevrološke klinike, ki je z zmanjšanjem pisarniških prostorov zagotovilo ustrezen, sodoben prostor, so pojasnili na UKC Ljubljana.
Po besedah predstojnika kliničnega inštituta za radiologijo Dimitrija Kuhlja letno obravnavajo 800 bolnikov, ki jih bodo lahko zdravili in diagnosticirali na takem aparatu. Med drugim so med njimi tudi bolniki z akutno možgansko kapjo, enega so na novem aparatu zdravili že v četrtek popoldne. Kuhelj je s potekom zdravljenja zadovoljen, bolnik se z minimalnim defektom pogovarja in bo šel kmalu domov.
Nove pridobitve je vesel tudi predstojnik nevrološke klinike Simon Podnar. “Ves čas smo se zavedali, da kolegi delajo v nemogočih razmerah, da je prostor, ki so ga imeli za te intervencije, povsem neprimeren. Vsak teden smo se bali, da bi dokončno odpovedala njihova aparatura,” je dejal.
V. d. generalnega direktorja UKC Ljubljana Marko Jug je ob tem izpostavil, da nevrološka klinika vse dni v tednu zagotavlja konziliarno službo za celotno državo. “To je tisti prvi stik bolnikov s celotne države z vrhunskim specialistom 24 ur na dan,” je dejal. To omogoči takojšnjo obravnavo takega pacienta ter, ko je treba, tudi odlično rehabilitacijo z napravami, kot je danes prevzeti aparat.
Aparat v vrednosti 1,2 milijona evrov je sofinanciralo ministrstvo za zdravje. Projekt nabave se je sicer začel že v obdobju prejšnjega ministra za zdravje Janeza Poklukarja, sklenil pa se je v mandatu aktualnega, Danijela Bešiča Loredana. Kot je ta dejal danes, je s tem vzpostavljen model za nakupe drage medicinske opreme, ki ga želijo implementirati po celotni državi. Zelo veliko opreme po vseh bolnišnicah je namreč odslužene, je opozoril.
“,”Jaka Verbic Miklic”,1669379580,1669379580,sl,15276,306,15275,43,0,NULL,,”Ljubljanski UKC z novo najsodobnejšo napravo za posege in preiskave žilja, možganov in hrbtenjače “,ljubljanski-ukc-z-novo-najsodobnejso-napravo-za-posege-in-preiskave-zilja-mozganov-in-hrbtenjace,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1672662882,1672662882
956,15278,”Za zaustavitev svetovne pandemije aidsa najpomembnejše zgodnje odkrivanje”,”Za posledicami aidsa je lani umrlo 650 tisoč ljudi, na novo pa se je z virusom HIV okužilo 1,5 milijona oseb”,”
Ljubljana, 1. decembra – Svetovni dan boja proti aidsu, ki ga obeležujemo danes, poteka pod geslom Preizkusimo se: Doseganje enakosti za izkoreninjenje virusa HIV. Za zaustavitev svetovne pandemije je še vedno najpomembnejše testiranje na okužbo s HIV in s tem zgodnejše odkrivanje, ki vpliva na boljše izide zdravljenja ter omejuje prenos okužbe.
Po svetu je lani živelo 38,4 milijona ljudi, okuženih z virusom HIV, od teh se jih je 28,7 milijona zdravilo z antiretrovirusno terapijo. Za posledicami aidsa je lani umrlo 650.000 ljudi. Na novo pa se je z virusom HIV okužilo 1,5 milijona oseb, kažejo zadnji podatki programa Združenih narodov za boj proti HIV in aidsu (UNAIDS). Okoli šest milijonov ljudi ni poznalo svojega statusa.
Za zaustavitev svetovne pandemije je še vedno najpomembnejše testiranje na okužbo s HIV in s tem zgodnejše odkrivanje, ki vpliva na boljše izide zdravljenja ter omejujeta prenos okužbe. Ključna je tudi varna spolnost in pravilna uporaba kondoma. Okužba s HIV je zaenkrat še neozdravljiva, vendar je z zgodnjim odkrivanjem okužbe in sodobnim zdravljenjem možno dolgoročno preprečevati, da okužba napreduje v resna obolenja.
Na svetu pa še vedno obstajajo neenakosti pri dostopu do najosnovnejših storitvah, kot je dostop do testiranja, zdravljenja in kondomov. Mlade ženske v Afriki so še vedno nesorazmerno prizadete zaradi virusa HIV, medtem ko je pokritost z zanje namenjenimi programi še vedno premajhna, kažejo podatki UNAIDS, ki pod sloganom Equalize (Izenačiti!) letos poziva k ukrepanju in zmanjšanju razlik med med svetovnim jugom in severom.
Za odpravo neenakosti, ki ovirajo napredek, je ključna uvedba praktičnih ukrepov, ki bodo pomagali odpraviti aids, med drugim zagotovitev večje razpoložljivosti storitev za zdravljenje, testiranje in preprečevanje okužbe z virusom HIV, več finančnih sredstev, sprejem boljših zakonov in praks za odpravljanje stigmatizacije in izključenosti ljudi, ki živijo s HIV in boljša izmenjava tehnologije, ki bo omogočila enakopraven dostop do najboljših znanstvenih dognanj o virusu, je sporočila informacijska služba Združenih narodov na Dunaju.
Unicef medtem opozarja, da je v zadnjih treh letih zaradi pandemija covida-19 in drugih globalnih kriz napredek pri preprečevanju in zdravljenju okužb z virusom HIV pri otrocih, mladostnikih in nosečnicah skoraj v celoti obtičal na mrtvi točki. Kljub temu, da otroci in mladostniki predstavljajo le sedem odstotkov vseh ljudi, okuženih z virusom HIV, so leta 2021 predstavljali 17 odstotkov vseh smrti, povezanih z aidsom, in 21 odstotkov novih okužb s HIV. Skupno število otrok z virusom sicer upada, razlika med zdravljenimi otroki in zdravljenimi odraslimi pa še vedno narašča, opozarja Unicef.
Dolgoročni trendi kljub vsemu še naprej ostajajo pozitivni. Nove okužbe s HIV pri otrocih starih do 14 let so se med letoma 2010 in 2021 zmanjšale za 52 odstotkov, nove okužbe med mladostniki pa za 40 odstotkov. Podobno je tudi delež zagotovljenega doživljenjskega protiretrovirusnega zdravljenja nosečnic, okuženih s HIV, v enem samem desetletju zrasel s 46 odstotkov na 81 odstotkov, kažejo podatki Unicefa.
“,”Jaka Verbic Miklic”,1669898220,1669898220,sl,15278,306,15277,43,0,NULL,,”Za zaustavitev svetovne pandemije aidsa najpomembnejše zgodnje odkrivanje”,za-zaustavitev-svetovne-pandemije-aidsa-najpomembnejse-zgodnje-odkrivanje,Post,,1,0,1672663148,1672663148
957,15280,”V Franciji kondomi za mlade med 18. in 25. letom kmalu brezplačni “,”To je majhna revolucija za kontracepcijo”,”
Nantes, 9. decembra – V Franciji bodo kondomi v lekarnah za mlade med 18. in 25. letom starosti z novim letom brezplačni, je v četrtek napovedal francoski predsednik Emmanuel Macron. Poteza, s katero želi francoska vlada zmanjšati število neželenih nosečnosti, sledi predhodni uredbi o brezplačni kontracepciji za ženske, mlajše od 25 let, ki je v veljavo stopila letos.
“To je majhna revolucija za kontracepcijo,” je med zdravstveno razpravo z mladimi v predmestju Poitiersa Fontaine-le-Comte na zahodu Francije dejal Macron, poroča francoska tiskovna agencija AFP.
Pred tem je francoska vlada letos že začela ponujati brezplačno kontracepcijo ženskam, mlajšim od 25 let. S tem je razširila program, namenjen mlajšim od 18 let, da mlade ženske ne bi prenehale jemati kontracepcije zato, ker si je ne morejo privoščiti.
Stroški za nakup kondomov so v Franciji sicer že zdaj povrnjeni s strani nacionalnega zdravstvenega sistema, če jih predpiše zdravnik ali babica. Ukrep je namenjen boju proti širjenju aidsa in drugih spolno prenosljivih bolezni.
Glede spolne vzgoje v šolah pa je francoski predsednik dejal, da Francija v tem ni tako dobra. “Realnost se zelo, zelo razlikuje od teorije. To je področje, na katerem moramo veliko bolje izobraziti naše učitelje,” je opozoril.
“,”Jaka Verbic Miklic”,1670589660,1670589660,sl,15280,306,15279,43,0,NULL,,”V Franciji kondomi za mlade med 18. in 25. letom kmalu brezplačni “,v-franciji-kondomi-za-mlade-med-18-in-25-letom-kmalu-brezplacni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1672663369,1672663397
958,15282,”Civilna iniciativa opozorila na težave pri dostopu do družinskih zdravnikov”,”Opozarjajo, da Slovenija številnim ne zagotavlja več ustavne pravice do zdravstvenega varstva.”,”
Ljubljana, 15. decembra – Civilna iniciativa Glas ljudstva je danes predstavila začetek kampanje Ustavimo rušenje javnega zdravstva. Na novinarski konferenci pred ZD Polje so predstavili prvo zahtevo in peticijo za takojšnje razreševanje težav pri dostopu do družinskih zdravnikov. Opozarjajo, da Slovenija številnim ne zagotavlja več ustavne pravice do zdravstvenega varstva.
Kot so zapisali v peticijo, pod katero so do sedaj zbrali več kot 300.000 podpisov, verjamejo, da so družinski zdravniki zelo obremenjeni, vendar bi morali rešitev za to iskati v vsebinskih in organizacijskih spremembah, in ne v odklanjanju bolnikov.
S kampanjo tako med drugim želijo vse deležnike opozoriti in spodbuditi k aktivnemu iskanju rešitev za iskanje kakovostne zdravstvene oskrbe v okviru javnega sistema za vse, je dejala Katarina Rotar s Slovenske filantropije. Trenutno je brez izbranega osebnega zdravnika namreč 130.000 prebivalcev, situacija pa se je v zadnjem obdobju še poslabšala, predvsem v Ljubljani, kjer je Zdravstveni dom (ZD) Ljubljana zapustilo več družinskih zdravnikov.
Po oceni nekdanjega ministra za zdravje Dušana Kebra se obljube, ki so jih po volitvah dale koalicijske stranke na področju zdravstva, ne uresničujejo, med drugim odlašajo z napovedano ukinitvijo dopolnilnega zdravstvenega zavarovanja. Ob tem se nezavidljivo stanje za zaposlene v zdravstvenih domovih ne izboljšuje, zato bodo finančne injekcije za javno zdravje še hitreje odtekale v zasebno zdravstvo.
Kritična do trenutnega stanja je bila tudi Biserka Marolt Meden iz Srebrne niti. Ministrstvo za zdravje in vlado je pozvala k takojšnjim ukrepom in k temu, da prisluhnejo njihovim predlogom. “Želimo biti vključeni v reorganizacijo našega zdravstva in želimo, da to zdravstvo deluje,” je poudarila.
Sekretar skupnosti socialnih zavodov Denis Sahernik je ob tem opozoril, da je skupnost že poleti opozarjala, da so posamezni zdravstveni domovi zaradi kadrovskih težav zmanjšali prisotnost družinskih zdravnikov v domovih za starejše. Stanovalci tako niso imeli zagotovljene temeljne pravice zdravljenja iz osnovnega zdravstvenega zavarovanja, ki jim pripada po zakonu. “V zadnjem obdobju se je stanje marsikje tako zaostrilo, da lahko govorimo že o tem, da ogroža kakovostno zdravstveno obravnavo in tudi samo zdravje naših stanovalcev,” je opozoril.
Stanje iz zdravniške perspektive pa je pokomentiral Janez Jančar. Po njegovi oceni je napovedana stavka zdravniškega sindikata Fides kljub nedavnemu dogovoru o zvišanju plač predvsem mladim zdravnikom dejanje brez primere in izsiljevanje države, ki se ni ustrezno ostro odzvala. “Žal sklicevanje na zdravniško etiko med neredkimi mojimi poklicnimi kolegi vzbuja v najboljšem primeru le pomilovalno nasmihanje. Zdravniška stavka deluje kot cinično mahanje z rdečo cunjo pred očmi prizadete javnosti, ki tega zlepa ne bo pozabila,” je dejal.
V civilni iniciativi Glas ljudstva ob tem napovedujejo večmesečno kampanjo Ustavimo rušenje javnega zdravstva. Zagotovitev dostopa do družinskega zdravnika je le ena od njihovih zahtev, med drugim zahtevajo ukinitev dopolnilnega zdravstvenega zavarovanja in ustavitev “vseh procesov, kjer se javna sredstva stekajo v zasebne žepe,” je dejal Jaša Jenull iz iniciative.
Pred ZD Polje, kjer manjkajo vsi družinski zdravniki, se je v podporo kampanji danes zbralo nekaj več deset ljudi.
“,”Jaka Verbic Miklic”,1671108240,1671108240,sl,15282,306,15281,43,0,NULL,,”Civilna iniciativa opozorila na težave pri dostopu do družinskih zdravnikov”,civilna-iniciativa-opozorila-na-tezave-pri-dostopu-do-druzinskih-zdravnikov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1672663546,1672663546
959,15284,”Mineva leto dni od sprejetja državnega program boja proti raku “,”Program, ki ga izvaja Onkološki inštitut Ljubljana, največ pozornosti namenja kakovosti obravnave bolnikov z rakom, kjer do sedaj ni bilo na voljo dovolj podatkov.”,”
Ljubljana, 24. decembra – Te dni mineva leto dni od sprejetja državnega programa obvladovanja raka za obdobje 2022-2026. Program, ki ga izvaja Onkološki inštitut Ljubljana, največ pozornosti namenja kakovosti obravnave bolnikov z rakom, kjer do sedaj ni bilo na voljo dovolj podatkov. Koordinatorica projekta Sonja Tomšič pa že vidi napredek v zadnjih desetih letih.
Program ima enako kot prejšnja dva državna programa zastavljene tri ključne cilje in sicer, upočasniti povečevanje števila novih bolnikov z rakom, povečati preživetje slovenskih bolnikov z rakom in izboljšati kakovost življenja bolnikov z rakom. Na področju izboljšanja kakovosti življenja bodo ukrepe usmerjali predvsem v krepitev celostne rehabilitacije in paliativne oskrbe, so sporočili iz Onkološkega inštituta Ljubljana.
Tomšičeva je izpostavila, da so z vzpostavitvijo presejalnih programov ter s sprejetjem strateških dokumentov na tem področju v zadnjih desetih letih že zabeležili vrsto uspehov, saj so uspeli obrniti trend naraščanja števila novih primerov raka pri moških in ga upočasniti pri ženskah. Poleg tega so izboljšali tudi preživetje rakavih bolnikov ter vključili paliativno oskrbo v vse klinične zdravstvene specializacije.
V letu 2022 so tako že imenovali vse predvidene strukture za delovanje in uresničevanje ciljev programa do leta 2026 in sicer strokovni svet, nadzorni svet, strokovne skupine za raka dojk, pljučnega raka, raka prostate, malignih melanomov ter raka debelega črevesa in danke in skupino predstavnikov izvajalcev za področje onkologije.
Koordinatorica projekta je izrazila upanje, da bo s tem tako začrtana pot za uresničevanje ciljev programa, zdaj pa bodo lahko svoje napore usmerili v “primarno in sekundarno preventivo, diagnostiko, zdravljenje, celostno rehabilitacijo, onkološko paliativno oskrbo, izobraževanje, raziskovanje in spremljanje bremena raka”.
“,”Jaka Verbic Miklic”,1671886080,1671886080,sl,15284,306,15283,43,0,NULL,,”Mineva leto dni od sprejetja državnega program boja proti raku “,mineva-leto-dni-od-sprejetja-drzavnega-program-boja-proti-raku,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1672663749,1672663749
960,15286,”V veljavo stopa ukrep ambulant za osebe brez izbranega zdravnika “,”Ukrep ambulant za neopredeljene bolnike predvideva konec oktobra sprejet zakon o nujnih ukrepih za zajezitev širjenja in blaženje posledic covida-19 na področju zdravstva.”,”
Ljubljana, 1. januarja – Z današnjim dnem v veljavo stopa ukrep interventnega zakona v zdravstvu – ambulante za neopredeljene bolnike oziroma bolnike brez izbranega družinskega zdravnika. Zdravstveni delavci se bodo v predvidenih 94 ambulant vključevali prostovoljno, za delo pa bodo plačani po podjemnih pogodbah, ki bodo oproščene plačila davka.
Ukrep ambulant za neopredeljene bolnike predvideva konec oktobra sprejet zakon o nujnih ukrepih za zajezitev širjenja in blaženje posledic covida-19 na področju zdravstva. Veljal bo od 1. januarja 2023 do 31. decembra 2024. Vlada pa ga bo lahko še dvakrat podaljšala na podlagi strokovnega mnenja Nacionalnega inštituta za javno zdravje, vsakokrat za največ šest mesecev.
Z ministrstva za zdravje so izvajalcem minuli teden posredovali navodila glede organizacije ambulant za neopredeljene zavarovane osebe. V dopisu, ki ga je pridobila STA, so poudarili, da se bodo tovrstne ambulante organizirale pri javnih zdravstvenih zavodih, kjer zaradi pomanjkanja zdravnikov izbira družinskega zdravnika ni mogoča.
Ob tem so priložili seznam, s katerim je minister določil število ambulant za neopredeljene na posameznih javni zavod in največji obseg programa družinske medicine v posamezni ambulanti za neopredeljene, ki bo veljal do 31. marca 2023.
Javni zdravstveni zavodi bomo morali v treh dneh po organiziranju ambulante o tem obvestiti ministrstvo, poleg ministrstvu pa tudi Zavodu za zdravstveno zavarovanje Slovenije sporočiti kontaktne podatke in delovni čas ambulante, te podatke pa objaviti tudi na spletni strani.
Zaposleni se bodo v delo v ambulantah vključevali na podlagi podjemnih pogodb ali drugih pogodb civilnega prava, pri čemer bodo oproščeni plačila posebnega davka na izplačila na podlagi podjemnih pogodb, predvideva zakon. Sredstva za delovanje ambulant se bodo zagotavljala iz sredstev obveznega zdravstvenega zavarovanja.
Dejavnost ambulante za neopredeljene bo plačana po pavšalnem znesku. Zdravstveni zavodi bodo za uro dela zdravnikov prejeli 121 evrov, za tehnika zdravstvenega tehnika 54 evrov, za zdravstveno-administrativnega sodelavca pa 27 evrov. Koliko od tega denarja bo šlo zaposlenim, še ni znano.
V ambulante se bodo lahko poleg družinskih zdravnikov in drugih zdravstvenih delavcev v javnih zdravstvenih zavodih vključevali tudi zdravniki koncesionarji in zdravstveni delavci, zaposleni pri koncesionarjih. Zdravniki ter drugi zdravstveni delavci in sodelavci se bodo v ambulante po zakonu vključevali prostovoljno.
Ordinacijski čas tovrstnih ambulant določa pravilnik o organizaciji ambulant. Odvisen bo od obsega programa ambulante za neopredeljene, pri čemer je najkrajši ordinacijski čas najmanj dvakrat tedensko, skupaj štiri ure v tednu. Ambulanta za neopredeljene, ki bo delovala v obsegu enega tima programa splošne oziroma družinske medicine, pa ima ordinacijski čas osem ur dnevno. Javni zavod lahko delo ambulante za neopredeljene organizira tudi v soboto.
Glede na pravilnik bo zavarovana oseba prosto izbrala in se opredelila na ambulanto za neopredeljene tako, da bo podpisala listino o izbiri osebnega zdravnika, pri čemer se podatka o osebnem zdravniku na listini ne izpolni. Opredelitev na ambulanto za neopredeljene velja eno leto z možnostjo avtomatskega podaljšanja.
Ukrep je začasne narave in je namenjen večji dostopnosti do zdravstvene oskrbe na primarni ravni za osebe, ki so v danem trenutku brez izbranega osebnega zdravnika, pojasnjujejo na ministrstvu.
“,”Jaka Verbic Miklic”,1672577460,1672577460,sl,15286,306,15285,43,0,NULL,,”V veljavo stopa ukrep ambulant za osebe brez izbranega zdravnika “,v-veljavo-stopa-ukrep-ambulant-za-osebe-brez-izbranega-zdravnika,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1672663925,1672663925
961,15288,”Evropska skupnost za boj proti raku predstavlja vodnik najboljših praks za trajnostno, pravično in učinkovito oskrbo bolnikov”,”Novo poročilo, ki ga je pripravila Vintura po naročilu onkološke platforme združenja EFPIA, določa jasna navodila, kako lahko inovacije in najboljše prakse iz Evrope in drugod po svetu pomagajo pri preoblikovanju storitev zdravljenja raka in spreminjanju nege bolnikov. “,”
Pri pripravi je sodelovalo več kot 20 organizacij, ki se ukvarjajo z zdravljenjem raka, vključno z združenji zdravstvenih delavcev, združenji bolnikov, akademiki in farmacevtskimi družbami.
Poročilo z naslovom Inovacije za trajnostno zdravljenje raka predstavlja 30 pobud, ki naslavljajo aktualne izzive pri doseganju visokokakovostnega zdravljenja raka. S pomočjo inovativnih platform in postopkov, bolj premišljeno uporabo finančnih sredstev v zdravstvu in okoljsko trajnostnimi praksami predstavlja priložnosti in možnosti za izboljšanje učinkovitosti skozi celotno pot obravnave raka, od preventive do diagnostike, zdravljenja, paliativne oskrbe in preživetja.
Poročilo izpostavlja pet ključnih trendov na področju inovacij – in najboljših praks, ki so se izpopolnile v času pandemije – in jih je mogoče uporabiti za doseganje večje trajnosti oskrbe: umetna inteligenca in strojno učenje, digitalno zdravstvo in digitalna medicina, natančna medicina in testiranje biomarkerjev, terapije za kurativo in širjenje zmogljivosti ter zunajbolnišnična oskrba. 30 primerov iz prakse prikazuje potencial teh trendov pri preoblikovanju oskrbe raka v vseh fazah poti oskrbe. Med primeri so:
Preventiva in zgodnje odkrivanje:
Diagnostika:
Rehabilitacija in zdravljenje
Paliativna oskrba, rehabilitacija in preživetje
Sistemi zdravstvenega varstva
Čeprav so se rezultati zdravljenja raka v Evropi v zadnjih desetletjih bistveno izboljšali, se število diagnoz zaradi demografskih sprememb povečuje. To pa povečuje tudi pritisk na zdravstvene proračune in sredstva, vključno z zdravstvenimi delavci. Letne gospodarske posledice raka trenutno znašajo 100 milijard evrov. Ocenjuje se, da bo v Evropi do leta 2030 primanjkovalo 4,1 milijona zdravstvenih delavcev.
Z okoljskega vidika vsaka bolnišnična postelja za zdravljenje raka povzroči približno 1.200 kg odpadkov na leto, kar kaže, da so ukrepi nujni..
Poročilo nakazuje, da je EU na razpotju: lahko se še naprej bori proti staranju prebivalstva in naraščajočemu številu primerov raka z manj sredstvi, ali pa uporabi inovacije za strateško upravljanje in zmanjševanje razširjenosti raka z učinkovitejšim preprečevanjem in optimalno oskrbo za tiste, ki jo potrebujejo. Z uporabo najboljših praks v vseh fazah obravnave raka lahko zmanjšamo pritiske, trajnostno izboljšamo dostop do onkološke oskrbe in pomagamo doseči cilje evropskega načrta za boj proti raku.
Poročilo je objavljeno v času, ko se Evropska komisija pripravlja na objavo revizije farmacevtske zakonodaje. Čas objave poročila komisiji in državam članicam daje odlično priložnost, da s pomočjo, v poročilu predstavljenih ugotovitev, pomagajo uresničiti dvojni cilj: zagotoviti, da bo Evropa imela na voljo cenovno dostopna zdravila za svoje prebivalstvo, ter hkrati podpirati svojo industrijo, da bo v hudi svetovni konkurenci ostala vodilna v svetu na področju medicinskih inovacij. Poročilo pa bo prav tako v pomoč v času, ko se EU sooča s številnimi geopolitičnimi in finančnimi izzivi v aktualni dolgotrajni krizi.
Poročilo poziva oblikovalce politik, naj se pri sprejemanju ključnih odločitev glede prihodnje oskrbe raka posvetijo petim ključnim področjem:
To bo poenostavilo in povečalo učinkovitost izvajalcev zdravstvenega varstva pri uvajanju v tem poročilu opisanih praks, vladam pa olajšalo usklajevanje finančnih omejitev z zagotavljanjem dostopnega, učinkovitega in trajnostnega zdravstvenega varstva.
“,”Jaka Verbic Miklic”,1674640800,1674648000,sl,15288,306,15287,43,0,NULL,,”Evropska skupnost za boj proti raku predstavlja vodnik najboljših praks za trajnostno, pravično in učinkovito oskrbo bolnikov”,evropska-skupnost-za-boj-proti-raku-predstavlja-vodnik-najboljsih-praks-za-trajnostno-pravicno-in-ucinkovito-oskrbo-bolnikov,Post,”/sites/43/files/images/news/Povezani lahko/Povezani lahko bolje uresničujemo svoje interese.jpg”,1,0,1674986507,1674986614
962,15290,”V ZDA odobrili novo zdravilo za Alzheimerjevo bolezen “,”Novo zdravilo z imenom Leqembi, ki sta ga skupaj razvili ameriško podjetje Biogen in japonsko farmacevtsko podjetje Eisai, je FDA označila za pomemben korak v bitki za učinkovito zdravljenje Alzheimerjeve bolezni, za katero trpi okrog 6,5 milijona Američanov.”,”
Washington, 7. januarja – Ameriška Uprava za hrano in zdravila (FDA) je v petek odobrila novo zdravilo proti Alzheimerjevi bolezni, ki naj bi zavrlo upad kognitivnih sposobnosti pri ljudeh v zgodnjih fazah te bolezni. Gre za težko pričakovano zdravilo z učinkovino lecanemab, ki sledi odobritvi zdravila s podobnim delovanjem a vprašljivo učinkovitostjo izpred leta in pol.
Novo zdravilo z imenom Leqembi, ki sta ga skupaj razvili ameriško podjetje Biogen in japonsko farmacevtsko podjetje Eisai, je FDA označila za pomemben korak v bitki za učinkovito zdravljenje Alzheimerjeve bolezni, za katero trpi okrog 6,5 milijona Američanov.
Pri Alzheimerjevi bolezni, progresivni nevrodegenerativni bolezni centralnega živčnega sistema, se v možganih postopoma prekomerno kopičita dve beljakovini, amiloid beta in tau, zaradi česar možganske celice odmrejo, možgani pa se skrčijo. To povzroča izgubo spomina in vse večjo nezmožnost opravljanja vsakodnevnih opravil.
FDA se pri odobritvi naslanja na klinično testiranje, ki je pokazalo, da lahko zdravilo zavre kopičenje amiloidov. Predstavnik centra FDA za ocene zdravil in raziskave Billy Dunn je zdravilo označil kot najnovejše, ki deluje na sam proces bolezni, namesto da bi le zdravilo simptome.
FDA ob tem omenja tudi rezultate nedavno objavljene obširnejše klinične raziskave, ki so jo na 1800 sodelujočih izvajali 18 mesecev in je pokazala za 27 odstotkov zmanjšan upad kognitivnih sposobnosti pri tistih, ki so jih zdravili z lecanemabom.
A študija je razkrila tudi neželene učinke – del sodelujočih je denimo utrpel možganske krvavitve, najmanj ena oseba je med zdravljenjem umrla. FDA je zdravilu dodala opozorilo pred tveganjem krvavitev, poroča francoska tiskovna agencija AFP.
Gre za drugo zdravilo za Alzheimerjevo bolezen, ki ga je nedavno odobrila FDA. Ta je junija že prižgala zeleno luč za zdravilo Aduhelm, ki vsebuje učinkovino aducanumab. A njegova odobritev ni prinesla pričakovanega uspeha. Pojavili so se pomisleki glede učinkovitosti in njegovo rabo so na koncu omejili na bolnike z blagimi oblikami bolezni.
Nedavno poročilo ameriškega kongresa je poleg tega kritiziralo njegovo visoko ceno – 56.000 dolarjev na leto – in sistem zdravstvenega zavarovanja Medicare, namenjen starejšim ljudem, je naznanil, da ne bo kril njegovih stroškov, razen v primerih kliničnih testiranj.
“,”Jaka Verbic Miklic”,1673086080,1673086080,sl,15290,306,15289,43,0,NULL,,”V ZDA odobrili novo zdravilo za Alzheimerjevo bolezen “,v-zda-odobrili-novo-zdravilo-za-alzheimerjevo-bolezen,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1674987007,1674987007
963,15292,”V Zagrebu prvič na Hrvaškem opravili zahtevni presaditvi organov “,”Presaditve srca in jeter pri istem pacientu ter presaditve pljuč pri otrocih so izjemno redke, zdaj pa so jih prvič opravili tudi na Hrvaškem.”,”
Zagreb, 11. januarja – V zagrebškem kliničnem centru so prvič hkrati presadili srce in jetra pri odraslem bolniku in pljuča pri otroku. Presaditev srca in jeter pri 45-letniku je trajala 17 ur, poseg presaditve pljuč pri 11-letnem otroku pa deset, poročajo hrvaški mediji. Vsi organi so prišli prek Eurotransplanta iz Nemčije, oba posega pa sta bila uspešna.
Presaditve srca in jeter pri istem pacientu ter presaditve pljuč pri otrocih so izjemno redke, zdaj pa so jih prvič opravili tudi na Hrvaškem.
“Dejstvo, da nam je to uspelo, je dokaz kakovosti hrvaškega transplantacijskega programa skozi zgodovino,” je za hrvaški časnik Jutranji list povedal vodja oddelka za srčno kirurgijo na KBC Zagreb Hrvoje Gašparović. Pojasnil je, da je pri prvem posegu sodelovalo skupno 30 ljudi, med njimi dve kirurški ekipi za eksplantacijo in tri za transplantacijo.
Uspešna je bila tudi presaditev pljuč pri otroku. “Naša ekipa je doslej opravila 19 presaditev pljuč, a pri odraslih. Pri otrocih je vse bolj zapleteno, zato smo za vsak primer povabili torakalnega kirurga Joseja Matillo iz dunajske klinike AKH, kjer so se izobraževali tudi naši strokovnjaki, da ne bi šlo kaj narobe,” je pojasnil predstojnik klinike za bolezni pljuč KBC Zagreb Miroslav Samaržija in dodal, da se je vse odlično izteklo.
Moški je dobil srce in jetra istega donatorja, 11-letni otrok pa pljuča 14-letnega donatorja. Pred tem je več mesecev živel ob umetni podpori.
“,”Jaka Verbic Miklic”,1673431920,1673431920,sl,15292,306,15291,43,0,NULL,,”V Zagrebu prvič na Hrvaškem opravili zahtevni presaditvi organov “,v-zagrebu-prvic-na-hrvaskem-opravili-zahtevni-presaditvi-organov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1674987228,1674987228
964,15297,”Kako na zaščito populacije vpliva nižja precepljenost?”,”Okrogla miza STA”,”
19.4. 2023 je STA organiziral okroglo mizo z naslovom Kako na zaščito populacije vpliva nižja precepljenost?
O tem so na okrogli mizi spregovorili:
prof. dr. Danica Rotar Pavlič, predsednica Razširjenega strokovnega kolegija za družinsko
medicino
– prof. dr. Janez Tomažič, Klinika za infekcijske bolezni in vročinska stanja UKC Ljubljana
– dr. Marta Vitek Grgič, Vodja Centra za nalezljive bolezni, NIJZ
– dr. Mojca Rožič, Klinika za infekcijske bolezni in vročinska stanja UKC Ljubljana
Posnetek je na voljo tukaj: https://www.youtube.com/watch?v=IfNyL9-Qm3Q
“,”Jaka Verbic Miklic”,1682404020,1682404020,sl,15297,306,15296,43,0,NULL,,”Kako na zaščito populacije vpliva nižja precepljenost?”,kako-na-zascito-populacije-vpliva-nizja-precepljenost,Post,”/sites/43/files/images/news/Rare desises/Mic2.jpg”,1,0,1682404099,1682404208
965,15299,”Prijava na 12. strateško konferenco Vrednost inovacij”,”Zdravstvo, odporno na izzive prihodnosti”,”
V torek, 30. maja 2023 ob 11. uri, vabljeni na
12. strateško konferenco Vrednost inovacij: Zdravstvo, odporno na izzive prihodnosti.
Letos bomo razpravljali o tem, kako zagotoviti, da bo naš zdravstveni sistem odporen, prožen, odziven in sposoben prilagoditve prihodnjim potrebam. O tem bosta na konferenci z nami spregovorila Ricardo Baptista Leite, dr. med., ustanovitelj in predsednik ‘UNITE Parliamentarians Network for Global Health’, globalne platforme članov parlamentov, kongresov in senatov ter poslanec portugalskega nacionalnega parlamenta in Eric Sutherland, višji zdravstveni ekonomist, ki na OECD vodi področje digitalnega zdravja.
Na okrogli mizi, pod vodstvom izr. prof. dr. Petre Došenović Bonča, predstojnice Katedre za ekonomijo na Ekonomski fakulteti Univerze v Ljubljani, bomo z domačimi strokovnjaki iskali možnosti, kako slovensko zdravstvo pripraviti na izzive prihodnosti, vključno s tehnološkim napredkom in spreminjajočimi se demografskimi trendi.
Vabljeni!
“,”Jaka Verbic Miklic”,1683360300,1683360300,sl,15299,306,15298,43,0,NULL,,”12. strateško konferenco Vrednost inovacij: Zdravstvo, odporno na izzive prihodnosti”,12-stratesko-konferenco-vrednost-inovacij-zdravstvo-odporno-na-izzive-prihodnosti,Post,/sites/43/files/images/news/12.strateska/12.Voi.jpg,1,0,1683360426,1683360739
966,15299,”Application for 12th Strategic Conference Value of Innovation”,”Future-proof Healthcare”,”
On Tuesday, May 3oth, 2023 at 11 a.m., we are kindly inviting you to
12th Strategic Conference Value of Innovation: Future-proof Healthcare.
At this year’s conference we will look at directions towards resilient and responsive healthcare system adapted to future needs. We will host two keynote speakers, Ricardo Baptista Leite, MP, MD, founder and president of the ‘UNITE Parliamentarians Network for Global Health’, a global platform of members of parliaments, congresses and senates and member of the Portuguese National Parliament and Eric Sutherland, senior health economist who leads the field of digital health at the OECD.
The round table will be led by Petra Došenović Bonča, PhD, head of the Department of Economics at the Faculty of Economics of the University of Ljubljana. Together with local experts, they will look for ways to prepare Slovenian healthcare for future challenges , including technological progress and changing demographic trends.
You are kindly invited to join us!
“,”Jaka Verbic Miklic”,1683360300,1683360300,en,15299,306,15298,43,0,NULL,,”12. strateško konferenco Vrednost inovacij: Zdravstvo, odporno na izzive prihodnosti”,12-stratesko-konferenco-vrednost-inovacij-zdravstvo-odporno-na-izzive-prihodnosti,Post,/sites/43/files/images/news/12.strateska/12.Voi.jpg,1,0,1683360426,1683360739
967,15301,”V evropskem tednu preprečevanja raka materničnega vratu o pomembnosti cepljenja proti HPV “,”Rak materničnega vratu je med vsemi raki najbolje preprečljiv rak”,”
Ljubljana, 23. januarja – Ob začetku evropskega tedna preprečevanja raka materničnega vratu, ki bo potekal do nedelje, v programu Zora izpostavljajo pomen cepljenja proti humanim papilomavirusom (HPV). Cepljenje je namreč najučinkovitejši ukrep za preprečevanje raka materničnega vratu in drugih s HPV povzročenih rakov, so zapisali v sporočilu za javnost.
Rak materničnega vratu je med vsemi raki najbolje preprečljiv rak, a je še vedno četrti najpogostejši rak pri ženskah na svetu in eden od najpogostejših rakov pri mlajših ženskah, opozarjajo.
Svetovna zdravstvena organizacija (WHO) je leta 2020 lansirala globalno strategijo za odpravo raka materničnega vratu in postavila tri cilje, in sicer 70-odstotna udeležba žensk v presejalnih programih, ustrezno zdravljenih več kot 90 odstotkov odkritih predrakavih sprememb materničnega vratu in 90-odstotna precepljenost deklic proti HPV. Slovenija prva dva cilja že dosega, ne pa tudi cilja precepljenosti.
Spodbujanje cepljenja proti virusom, ki povzročajo raka, je ena izmed vodilnih pobud Evropskega načrta za boj proti raku. Pripravljajo tudi prva evropska priporočila za preprečevanje rakov, ki jih povzročajo okužbe, pri njihovem oblikovanju pa aktivno sodeluje tudi Slovenija. Med drugim s pomembno vlogo v evropskem projektu PERCH (Partnership to contrast HPV), so zapisali.
“Najučinkovitejši ukrep za preprečevanje raka materničnega vratu in drugih s HPV povzročenih rakov, je cepljenje proti HPV,” so besede Nadje Šinkovec Zorko z Nacionalnega inštituta za javno zdravje zapisali v sporočilu za javnost. Cepljenje proti HPV se izvaja pri mladostnicah in mladostnikih kot priporočeno cepljenje na sistematskem pregledu v šestem razredu osnovne šole.
V Sloveniji je preventivni program zgodnjega odkrivanja predrakavih sprememb materničnega vratu Zora v 20 letih dosegel izjemne rezultate, saj se je zbolevnost za rakom materničnega vratu več kot prepolovila. Leta 2021 je s tem rakom zbolelo 88 žensk, odkrili pa so 1.589 predrakavih sprememb visoke stopnje, kar so rezultati, ki omogočajo odpravo raka materničnega vratu, Slovenija pa bi lahko postala celo prva evropska država, ki bi ji uspelo raka materničnega vratu odpraviti.
Vodja Državnega programa Zora Urška Ivanuš poudarja, da je bilo v zadnjih petih letih v Sloveniji v okviru programa Zora pregledanih 85,6 odstotka vseh žensk v ciljni skupini 20 do 64 let, “kar nas glede pregledanosti uvršča v sam evropski vrh”.
Zaznali so nekoliko manjšo udeležbo na presejalnih programih v starostni skupini med 30 in 39 let, zaradi česar so v tej starostni skupini odkrili manj predrakavih sprememb visoke stopnje. “To nas skrbi, saj v tej starosti žensk običajno odkrijejo več kot tretjino vseh predrakavih sprememb visoke stopnje v Sloveniji,” je dejala Ivanuš.
“,”Jaka Verbic Miklic”,1674467220,1674467220,sl,15301,306,15300,43,0,NULL,,”V evropskem tednu preprečevanja raka materničnega vratu o pomembnosti cepljenja proti HPV “,v-evropskem-tednu-preprecevanja-raka-maternicnega-vratu-o-pomembnosti-cepljenja-proti-hpv,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683362964,1683362964
968,15303,”Poročilo IFRC: Svet ni pripravljen na naslednjo pandemijo “,”Po podatkih Svetovne zdravstvene organizacije (WHO) od začetka pandemije za covidom-19 umrlo najmanj 6,8 milijona ljudi.”,”
Ženeva, 30. januarja – Svet tudi tri leta po izbruhu covida-19 še vedno ni pripravljen na morebitne prihodnje pandemije, je danes v poročilu o svetovnih nesrečah opozorila Mednarodna federacija društev Rdečega križa in Rdečega polmeseca (IFRC). Izpostavila je pomen zaupanja javnosti v cepljenje ter države pozvala, naj okrepijo financiranje zdravstvenega sektorja.
IFRC je v svojem poročilu opozoril, da je po podatkih Svetovne zdravstvene organizacije (WHO) od začetka pandemije za covidom-19 umrlo najmanj 6,8 milijona ljudi. “Pandemija bi morala biti alarm za mednarodno skupnost, da se nemudoma pripravi na naslednjo zdravstveno krizo,” je dejal generalni sekretar IFRC Jagan Chapagain.
“Če izkušnja s covidom-19 ne bo pospešila naših priprav, kaj bo?” se v poročilu sprašuje IFRC in hkrati opozarja, da vlade tudi zdaj niso nič bolj pripravljene odzvati se na pandemije kot leta 2019.
Chapagain je prepričan, da bi priprave na prihodnje pandemije morale vključevati krepitev zaupanja javnosti v cepljenje in zdravstvene ukrepe. Svet pa mora odpraviti tudi neenakosti na področju zdravstva in socialno-ekonomske ranljivosti, piše v poročilu.
“Države se morajo pripraviti na več različnih nevarnosti, ne le na eno, saj družbe postanejo resnično odporne le z načrtovanjem za različne vrste nesreč, ki pa se lahko pojavijo hkrati,” je še dodal Chapagain.
Poleg pandemije je poročilo opozorilo tudi na porast nesreč povezanih s podnebnimi spremembami. “Ekstremni vremenski dogodki so vse pogostejši in intenzivnejši, naša sposobnost, da se nanje zgolj odzovemo, pa je omejena,” piše v poročilu.
Za leto 2020 je IFRC zabeležil 433 primerov nesreč s približno 15.400 smrtnimi žrtvami, za leto 2021 pa 529 primerov nesreč s 14.600 smrtnimi žrtvami. V obeh letih je bilo več kot 300 nesreč povezanih s podnebnimi spremembami.
V luči tega je IFRC države pozval, naj do leta 2025 okrepijo financiranje zdravstvenega sektorja za en odstotek BDP, medtem ko bi se svetovno financiranje zdravstva moralo okrepiti za vsaj 15 milijard dolarjev letno.
“,”Jaka Verbic Miklic”,1675072200,1675072200,sl,15303,306,15302,43,0,NULL,,”Poročilo IFRC: Svet ni pripravljen na naslednjo pandemijo “,porocilo-ifrc-svet-ni-pripravljen-na-naslednjo-pandemijo,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683363116,1683363116
969,15305,”Enakost oskrbe bolnikov z rakom v Sloveniji na visoki ravni, več naporov potrebnih pri preventivi “,”V Sloveniji se spopadamo s pomanjkanjem kadra in opreme, zadnje zlasti na področju slikovne diagnostike.”,”
Ljubljana, 2. februarja – Svetovni dan boja proti raku, ki ga bomo obeležili v soboto, letos opozarja na neenakosti pri obravnavi bolnikov z rakom. Ob tem sta Evropska komisija in OECD izdala poročilo o stanju neenakosti na področju raka, ki za Slovenijo ugotavlja, da je enakost oskrbe bolnikov z rakom sicer na visoki ravni, več naporov pa moramo namenjati preventivi.
Po podatkih slovenskega registra raka na Onkološkem inštitutu Ljubljana v Sloveniji vsako leto za rakom na novo zboli več kot 16.000 oseb, več kot 6500 pa jih umre. Kot so v skupni izjavi pred svetovnim dnevom boja proti raku zapisali pri Onkološkem inštitutu Ljubljana, Državnem programu za obvladovanje raka in ministrstvu za zdravje, je vpliv socio-ekonomskih neenakosti na pojavljanje in izid rakave bolezni v Sloveniji, kot tudi celotni Evropi, še vedno velik.
Poročilo Evropske komisije in Organizacije za gospodarsko sodelovanje in razvoj (OECD) o stanju neenakosti na področju raka v državah članicah je sicer pokazalo, da ima v Sloveniji vsak posameznik dostop do onkološkega zdravstvenega varstva in da je enakost oskrbe bolnikov z rakom na visoki ravni, saj ne glede na različno socio-ekonomsko razvitost regij ne beležimo večjih razlik med njimi.
Onkološki bolnik v Sloveniji ima najmanjše finančno breme iz lastnega žepa pri oskrbi raka med vsemi državami EU, so poudarili v izjavi. Po podatkih poročila, so izdatki za onkološko zdravstveno varstvo v državi v celoti kriti iz obveznega zdravstvenega zavarovanja in so zato dostopni več kot 99 odstotkom prebivalstva.
Po številu novih primerov rakov in umrljivosti je Slovenija v spodnji polovici med državami članicami. Pojavnost in umrljivost sta torej višji kot v povprečju EU. Preživetje bolnikov glede na EU pa se je v zadnjih desetih letih nadpovprečno povišalo, in sicer za več kot 10 odstotkov, kar gre pripisati tudi ciljem in ukrepom državnega programa obvladovanja raka, so dodali.
Po podatkih poročila je bilo izboljšanje podatkov o umrljivosti pri moških dvakrat večje kot pri ženskah. Med vsemi smrtmi zaradi raka je bilo 25 odstotkov smrti zaradi raka pri moških in 15 odstotkov pri ženskah preprečljivih. Pri tem se preprečljiva umrljivost nanaša na maligne tumorje ustnic, ustne votline in žrela, požiralnika, želodca, jeter, sapnika, bronhijev in pljuč, materničnega vratu in mehurja. Šest odstotkov pri moških in 13 odstotkov pri ženskah pa je bilo preprečljivih ob zdravstveni oskrbi, kar zajema maligne tumorje debelega črevesa in danke, dojk, materničnega vratu, materničnega telesa, mod in ščitnice.
Eden od pomembnejših ciljev državnega programa je zagotavljanje enakosti onkološke oskrbe in izboljševanje njene kakovosti. Slovenija je prav tako ena od redkih držav EU, ki ima uspešno vzpostavljene vse tri presejalne programe za raka, in sicer program za zgodnje odkrivanje raka materničnega vratu Zora, za zgodnje odkrivanje raka dojk Dora in zgodnje odkrivanje raka na debelem črevesju in danke Svit. Odzivnost v presejalnih programih za raka materničnega vratu in dojk sta blizu povprečij EU, pri raku debelega črevesa in danke pa je ta delež precej nad povprečjem EU, kažejo podatki poročila.
Najpogostejši raki v razvitem svetu in tudi pri nas (kože, pljuč, dojk, prostate ter debelega črevesa in danke) so leta 2019 predstavljali 60 odstotkov vseh ugotovljenih rakov. Po mnenju strokovnjakov so ti raki povezani z nezdravim življenjskim slogom, predvsem s kajenjem, čezmernim pitjem alkoholnih pijač, neustrezno prehrano, premalo gibanja in posledično prekomerno težo ter čezmernim sončenjem. Največje breme v državi predstavlja pljučni rak.
Poročilo tudi ugotavlja, da moramo v Sloveniji več naporov namenjati primarni preventivi. “Zavedamo se, da bi lahko s primarno preventivo v Sloveniji preprečili skoraj polovico vseh rakov. Zaradi tega smo na ministrstvu še okrepili izvajanje preventivnih aktivnosti, zlasti tistih, ki se morda v obdobju epidemije covida-19 niso v celoti izvajale. V letu 2022 smo zagotovili tudi sredstva za spodbujanje projektov primarne preventive, ki jih izvajajo različne nevladne organizacije,” je dejala koordinatorica državnega programa (2022-2026) z onkološkega inštituta Sonja Tomšič. Po njenih besedah je pomembno, da državljani poznamo 12 preventivnih korakov Evropskega kodeksa proti raku in jih po najboljših močeh udejanjamo.
V Sloveniji se spopadamo s pomanjkanjem kadra in opreme, zadnje zlasti na področju slikovne diagnostike. Onkološki inštitut Ljubljana je sicer z akcijskim načrtom že pristopil k nakupu dodatne naprave PET-CT (pozitronska emisijska tomografija), kjer je trenutno tudi največ pomanjkanja znotraj onkološkega zdravstvenega varstva, so še navedli v izjavi.
“,”Jaka Verbic Miklic”,1675331580,1675331580,sl,15305,306,15304,43,0,NULL,,”Enakost oskrbe bolnikov z rakom v Sloveniji na visoki ravni, več naporov potrebnih pri preventivi “,enakost-oskrbe-bolnikov-z-rakom-v-sloveniji-na-visoki-ravni-vec-naporov-potrebnih-pri-preventivi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683363258,1683363310
970,15307,”Kirurgi v UKC Ljubljana med prelomno operacijo čeljusti bolnici pomagali s 3D-tehnologijo natisnjenimi vsadki”,”To je bilo prvič narejeno pri nas”,”
Ljubljana, 6. februarja – Na Kliničnem oddelku za maksilofacialno in oralno kirurgijo UKC Ljubljana so decembra zdravniki prvič v Sloveniji in tudi širše v tem delu Evrope operirali bolnico s hudo skeletno čeljustno nepravilnostjo z uporabo posebej zanjo prilagojenih vsadkov in vodil, ki so jih natisnili s 3-D tehnologijo, so poročali v internem časopisu UKC Ljubljana.
Operacijo, ki so jo izvedli Mojca Knez, Žiga Kovačič in David Vozlič, so na daljavo načrtovali z belgijskim podjetjem Materialise, ki je vodilno v 3D načrtovanju in tiskanju na svetu, kritje stroškov načrtovanja in materiala pa je omogočilo slovensko podjetje Metalka media. Kirurgi so opravili tudi premik obeh čeljusti za popravo skeletne nepravilnosti.
V preteklosti so se operacije nesorazmerne čeljusti na začetku izvajale tako, da so razžagali spodnjo in zgornjo čeljust, ju z žicami privili v želeni položaj, potem pa je moral biti bolnik v takem položaju dva meseca, dokler se niso rane zacelile, je za portal MMC RTVS pojasnila Knez.
Ortognatska kirurgija je doživela velike premike s 3D in CAD/CAM tehnologijo. Individualni implantati pa so v maksilofacialni kirurgiji odgovor na izziv personalizirane medicine. Pomenijo še korak naprej, saj omogočajo natančnejše načrtovanje operacij, krajši operativni čas in boljše estetske rezultate, so decembra v internem časopisu pojasnili na UKC Ljubljana.
“Novejše tehnologije omogočajo boljši postopek, s 3D-tehnologijo vse delamo računalniško: sken spodnjega in zgornjega zobnega loka prenesemo v CT (računalniška tomografija op. STA) in se računalniško igramo. Zadnji trend je pa, da so bili še vsadki individualno natisnjeni za pacientko. Niso bile torej konfekcijske ploščice, ampak so, glede na premike, na naše želje, v Belgiji natisnili prav posebej zanjo prirejene ploščice. To je bilo prvič narejeno pri nas,” je Knezova pojasnila za MMC RTVS.
Ortognatska kirurgija omogoča bolnikom poleg ureditve griza, kar je bila paradigma pred desetimi leti, tudi ustrezne obrazne poteze in položaj aerodigestivnega trakta, torej organov zgornjega dela dihal in prebavil. S tem se bolniku omogočijo normalno prehranjevanje, govor in dihanje, rezultat pa pomembno vpliva tudi na samopodobo in samozavest, ki sta pomembni komponenti duševnega zdravja vsakega posameznika, so še pojasnili na UKC Ljubljana.
“,”Jaka Verbic Miklic”,1675677360,1675677360,sl,15307,306,15306,43,0,NULL,,”Kirurgi v UKC Ljubljana med prelomno operacijo čeljusti bolnici pomagali s 3D-tehnologijo natisnjenimi vsadki “,kirurgi-v-ukc-ljubljana-med-prelomno-operacijo-celjusti-bolnici-pomagali-s-3d-tehnologijo-natisnjenimi-vsadki,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683363504,1683363523
971,15309,”WHO: Kolera lani v Malaviju odnesla več kot 1200 življenj “,” “,”
Lilongwe, 10. februarja – Malavi se spopada z najhujšim izbruhom kolere v zgodovini te države, v katerem je lani umrlo več kot 1200 ljudi, je v četrtek opozorila Svetovna zdravstvena organizacija (WHO). Zaradi razširjenosti te bolezni po svetu se v Malaviju soočajo s pomanjkanjem cepiv, testov in zdravil.
V Malaviju so od začetka sedanjega izbruha marca lani zabeležili 37.000 okužb, prizadetih pa je bilo vseh 29 upravnih regij, so v izjavi zapisali pri WHO.
Kolera je v tej državi na jugovzhodu Afrike sicer endemična od leta 1998, a se je odtlej praviloma med prebivalstvom pojavljala le v deževnem obdobju med novembrom in majem.
Malavijska vlada je v začetku decembra razglasila izredne zdravstvene razmere zaradi geografske razširjenosti bolezni in umrljivosti okuženih, ki je presegala tri odstotke. Z rastjo števila okužb v začetku letošnjega leta se je malavijski zdravstveni sistem znašel pod dodatnim pritiskom.
Kolera je črevesna nalezljiva bolezen, ki jo povzročajo bakterije iz vrst vibrionov. Prenaša se s pitjem onesnažene vode oziroma pijač, uživanjem onesnažene hrane in preko onesnaženih rok.
Čeprav lahko kolera človeka ubije v nekaj urah, jo je mogoče zdraviti z oralno rehidracijo, v hujših primerih pa z antibiotiki. A večina ljudi po svetu nima pravočasnega dostopa do teh dveh, sicer preprostih načinov zdravljenja, opozarja WHO.
“,”Jaka Verbic Miklic”,1676023140,1676023140,sl,15309,306,15308,43,0,NULL,,”WHO: Kolera lani v Malaviju odnesla več kot 1200 življenj “,who-kolera-lani-v-malaviju-odnesla-vec-kot-1200-zivljenj,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683363643,1683363643
972,15311,”Nad stigmo zaradi epilepsije z osveščanjem”,” “,”
Ljubljana, 13. februarja – S širjenjem znanja o epilepsiji lahko odpravimo številne strahove in predsodke, ki povečujejo breme bolezni. Ta je še vedno po nepotrebnem stigmatizirana, so opozorili sogovorniki na današnjem spletnem pogovoru STAkluba. Pomemben korak pri premagovanju stigme je osveščanje, kar lahko pripomore k boljši vključenosti bolnikov v družbeno življenje.
Stigma je negativno stališče družbe do posameznika zaradi določene značilnosti ali bolezni, do katere ima družba odklonilen odnos, ter pogosto vodi bodisi do zapostavljanja, diskriminacije ali pa izključevanja takega posameznika. “Pri epilepsiji stigma običajno izhaja iz slabega poznavanja osnovnih dejstev o epilepsiji. Ljudje pogosto ne vedo, da je epilepsija bolezen, ki se da večinoma uspešno zdraviti in jo tudi znanstveno razumemo zelo dobro,” je pojasnil klinični psiholog na ljubljanski pediatrični kliniki David Gosar.
Epilepsija je sicer ena najpogostejših nevroloških motenj. Po ocenah ima v Sloveniji to bolezen približno en odstotek oseb. Epilepsija se lahko pokaže kadarkoli v življenju, a se približno pri polovici oseb prične v obdobju otroštva in mladostništva, je povedala otroška nevrologija, pediatrinja in predsednica Društva Liga proti epilepsiji Slovenije Natalija Krajnc.
Za bolezen so značilni kratkotrajni in nepričakovani napadi, ki se kažejo v različnih oblikah. “Nekateri so zelo subtilni, lahko jih zazna le tista oseba, ki sama doživlja napad. Napad se lahko kaže tudi v obliki kratkotrajne odsotnosti, kot kot bi za trenutek izgubili pozornost, lahko gre za kratkotrajne motnje občutkov, spremembah v vzorcu gibanja, kot so tresljaji in krči, ali pa z izgubi zavesti in tresljaji telesa, kar večina laikov še najbolj prepozna kot možno epilepsijo,” je dejala predsednica društva Liga Krajnc.
Epilepsijo je družbena zaznamovanost zaradi drugačnosti spremljala že vse od njenih samih začetkov, pri čemer smo po oceni nevrologinje z ljubljanske nevrološke klinike Veronike Rutar Gorišek naredili ogromen napredek pri prepoznavanju, zdravljenju in ugotavljanju razlogov, zakaj se epilepsija sploh pojavlja. Zaostajamo pa pri odpravi stigme, ugotavlja nevrologinja. To opaža tudi pri delu z bolniki v svoji ambulanti, ko z nelagodjem ali težavo sprejmejo diagnozo.
Pri tem po njenih besedah ne škodi malo humorja: “Povemo jim, da so v dobri družbi, saj je ima ogromno ljudi, tudi zgodovinskih, epilepsijo. Ta seznam je zelo dolg, od Julija Cezarja, Napoleona, Van Gogha, Michelangela in Čajkovskega, med njimi so tudi moderni glasbeniki, na primer Elton John.” Kot je poudarila nevrologinja, lahko ljudje z epilepsijo definitivno uresničijo svoje potenciale in niso zaradi bolezni nič manj nadarjeni ali inteligentni.
Se pa osebe z epilepsijo srečujejo tudi z nekaterimi omejitvami, ki jih ta bolezen prinese s seboj. “Te so namenjene temu, da zagotovijo neko varnost tako osebam z epilepsijo kot ostalim. Kar se tiče upravljanja motornih vozil, drugih strojev, dela na višini, plavanja, je povsem normalno, da moramo ljudi zaščititi, da pri tem ne pride do nekih poškodb oziroma nekih smrtnih izidov v najslabšem primeru. Včasih pa te omejitve pač postanejo preveč obremenjujoče in jih v zadostni meri ne nadomeščajo pravice, ki bi jih morale imeti osebe z epilepsijo,” je opozorila Rutar Gorišek.
O življenju z epilepsijo in o stigmi so spregovorile osebe s to boleznijo. Nekateri so se z njo srečali že v osnovnošolskem in srednješolskem izobraževanju, drugi prvič pri vstopu na trg dela. Kot je svojo izkušnjo iz prvega razgovora opisal Alen Jazbec, je takoj, ko je potencialnemu delodajalcu razkril svojo diagnozo, zaznal spremembo v obnašanju, službe nato ni dobil. Še težje trenutke pa je zaradi bolezni preživljal v obdobju odraščanja, ko so njegovi vrstniki lahko opravljali vozniški izpit, ki ga sam ni mogel.
Podobne težave tako z mobilnostjo kot diskriminacijo pri zaposlovanju so izpostavili tudi drugi sogovorniki z epilepsijo. Tudi Krajnčeva meni, da je na področju mobilnosti treba doseči boljšo situacijo. “Tukaj je trenutna zakonodaja kar zelo groba in rigidna,” je opozorila.
Spletni pogovor ob mednarodnem dnevu epilepsije, ki ga obeležujemo drugi ponedeljek v februarju, je pripravil STAklub v sodelovanju z Društvom Liga proti epilepsiji Slovenije. Dan letos poteka pod geslom Stopimo skupaj proti stigmi.
“,”Jaka Verbic Miklic”,1676283480,1676283480,sl,15311,306,15310,43,0,NULL,,”Nad stigmo zaradi epilepsije z osveščanjem”,nad-stigmo-zaradi-epilepsije-z-osvescanjem,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683364735,1683364735
973,15313,”Po svetu vsaki dve minuti umre nosečnica ali porodnica “,” “,”
Ženeva, 23. februarja – Po svetu med nosečnostjo ali porodom vsaki dve minuti umre ena ženska, kaže danes objavljeno poročilo agencij Združenih narodov. Dokument razkriva zaskrbljujoče nazadovanje na področju zdravja žensk v zadnjih letih, saj je v skoraj vseh regijah po svetu umrlo več ali pa enako število nosečnic in porodnic kot v obdobju med letoma 2000 in 2015.
Poročilo z naslovom Trendi v zvezi z umrljivostjo mater (Trends in maternal mortality), ki obravnava smrti mater na nacionalni, regionalni in globalni ravni od leta 2000 do leta 2020, ocenjuje, da je po svetu leta 2020 umrlo približno 287.000 nosečnic in porodnic. Ta številka je nekoliko nižja od 309.000 smrti v letu 2016, ko so stopili v veljavo cilji trajnostnega razvoja ZN. Poročilo sicer omenja bistven napredek na področju zmanjševanja števila smrti mater med letoma 2000 in 2015, ki pa je večinoma zastal in se v nekaterih primerih celo obrnil.
V dveh od osmih regij ZN – v Evropi in Severni Ameriki – se je stopnja umrljivosti mater med letoma 2016 in 2020 zvišala za 17 odstotkov, v Latinski Ameriki in na Karibih pa za 15. V ostalih regijah je ostala nespremenjena. Poročilo kljub temu poudarja, da je mogoče doseči napredek.
Število smrti nosečnic in porodnic je v veliki meri še naprej osredotočeno na najrevnejše dele sveta in države, ki jih pestijo konflikti. Leta 2020 so približno 70 odstotkov vseh smrti mater zabeležili v Podsaharski Afriki. V devetih državah, ki se spopadajo s hudimi humanitarnimi krizami, je umrlo 551 mater na na 100.000 živorojenih otrok, kar je dvakrat več od svetovnega povprečja 223 smrti mater na 100.000 živorojenih otrok.
“Nosečnost, ki bi morala biti za vse ženske pozitivna izkušnja, povezana z neizmernim upanjem, je tragično še vedno šokantno nevarna izkušnja za milijone žensk po vsem svetu, ki nimajo dostopa do visokokakovostne in spoštljive zdravstvene oskrbe,” je poudaril generalni direktor Svetovne zdravstvene organizacije (WHO) Tedros Adhanom Ghebreyesus. Dodal je, da novi statistični podatki razkrivajo, da je nujno zagotoviti vsem ženskam in dekletom dostop do nujno potrebnih zdravstvenih storitev pred in med porodom ter po njem.
Vodilni vzroki za smrti mater so hude krvavitve, visok krvni tlak, vnetja, povezana z nosečnostjo, zapleti, do katerih lahko pride pri nevarnih splavih, ter osnovna bolezenska stanja, ki jih lahko nosečnost še poslabša, kot sta aids in malarija. Vse te vzroke je v veliki meri mogoče preprečiti ali pozdraviti.
Poročilo še razkriva, da je treba na globalni ravni bistveno pospešiti napredek, da bi dosegli globalne cilje za zmanjševanje števila smrti mater, saj bo v nasprotnem primeru do leta 2030 ogroženo življenje dodatnega milijona nosečnic in porodnic.
“,”Jaka Verbic Miklic”,1677147600,1677147600,sl,15313,306,15312,43,0,NULL,,”Po svetu vsaki dve minuti umre nosečnica ali porodnica “,po-svetu-vsaki-dve-minuti-umre-nosecnica-ali-porodnica,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683364877,1683364877
974,15315,”Motnje dihanja v spanju vse pogosteje zaznana težava “,” “,”
Golnik, 27. februarja – Motnje dihanja v spanju so vse bolj pereč javno zdravstveni problem, saj ocene kažejo, da se z njimi sooča kar okoli 150.000 Slovencev. Na Kliniki Golnik, kjer se z diagnostiko in zdravljenjem motenj dihanja v spanju ukvarjajo že več kot 20 let, so zato minuli konec tedna pripravili 2. simpozij o spalni apneji.
Motnje dihanja v spanju so tretja najpogostejša kronična bolezen dihalnega sistema. Za obstruktivno spalno apnejo trpi približno 10 odstotkov odrasle populacije. Bolezen je bistveno pogostejša pri moških, in sicer jo ima približno 14 odstotkov odraslih moških in približno pet odstotkov odraslih žensk, večinoma po menopavzi.
Bolezen je tesno povezana tudi s prekomerno telesno težo, ki jo ima kar 70 odstotkov obolelih. “Ker smo v zadnjih letih priča trendom naraščanja debelosti je tudi bolnikov s to boleznijo vse več,” je pojasnila specialistka pnevmologije z Univerzitetne klinike za pljučne bolezni in alergijo Golnik Kristina Ziherl.
Če se prekinitve dihanja pojavljajo vsako noč v povprečju vsaj petnajstkrat v vsaki uri spanja, potem imajo lahko zaradi pomanjkanja kisika in ostalih reakcij organizma škodljive posledice za zdravje.
Nevarne postanejo, kadar tako poslabšajo kakovost spanja, da smo neprespani, imamo slabšo koncentracijo, slabši spomin ali težave s čustvovanjem. Lahko vodijo tudi v kronične zaplete, kot so na primer srčno-žilna obolenja in sladkorna bolezen. Vse več je dokazov, da motnje dihanja v spanju vodijo tudi v demenco in povečujejo tveganje za pojav raka.
Motnje dihanja v spanju so pogosto povezane s smrčanjem, vendar pa smrčanje samo po sebi ne vpliva pomembno na kakovost spanca. Se je pa treba v primeru smrčanja obrniti na osebnega zdravnika, če opazimo slabšo kakovost spanca, nemiren spanec in zbujanje, hlastajoč za zrakom. Še posebej pozorni morajo biti tisti, ki že imajo srčno-žilna obolenja, kot so srčno popuščanje ali motnje srčnega ritma.
Pri obstruktivni spalni apneji prihaja do ponavljajoče se zapore žrela med spanjem. Zato bolnike s hujšo motnjo dihanja v spanju zdravijo z aparatom, ki zrak iz prostora pod določenim tlakom vpihuje v dihalne poti in na ta način drži žrelo odprto. Kot je pojasnila Ziherl, gre za najbolj učinkovito terapijo in jo najpogosteje uporabljajo.
Se pa pri zdravljenju počasi uveljavlja tudi terapija s stimulatorji hipoglosnega živca, ki oživčuje jezik, saj k zapori žrela največ doprinese jezik, ki zdrsne proti zadnji steni žrela. “Seveda niso vsi bolniki primerni kandidati za tovrstno terapijo in zaenkrat te terapije v Sloveniji tudi še nimamo. Zelo verjetno pa jo bomo v prihodnosti bolnikom lahko omogočili,” je povedala Ziherl.
Z diagnostiko in zdravljenjem motenj dihanja v spanju se na Kliniki Golnik ukvarjajo že več kot dve desetletji in imajo največji spalni laboratorij v Sloveniji. V zadnjih letih tako bolniki kot zdravniki bolje prepoznavajo težave, ki so lahko posledica motenj dihanja med spanjem. Tako je napotitev na diagnostiko in zdravljenje iz leta v leto več.
Na simpoziju, ki je potekal v petek in soboto, so posebno pozornost namenili multidisciplinarni obravnavi debelosti kot pomembnemu dejavniku tveganja za razvoj motenj dihanja v spanju. Ta povezava ni enosmerna. Vse več je namreč dokazov, da lahko prekratek ali nekakovosten spanec pomeni tveganje za pridobivanje telesne teže, in sicer preko spremenjenega izločanja hormonov, ki vplivajo na občutek sitosti in apetit.
“,”Jaka Verbic Miklic”,1677493440,1677493440,sl,15315,306,15314,43,0,NULL,,”Motnje dihanja v spanju vse pogosteje zaznana težava “,motnje-dihanja-v-spanju-vse-pogosteje-zaznana-tezava,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683365128,1683365128
975,15317,”Preventivni pregledi in cepljenje ključni pri zmanjševanju tveganja za okužbo z virusom HPV “,” “,”
Ljubljana, 1. marca – Okužba s humanim papilomavirusom (HPV) je najpogostejša spolno prenosljiva okužba, s katero se večina spolno aktivnih ljudi okuži vsaj enkrat v življenju. V Zdravstvenem domu (ZD) Ljubljana poudarjajo, da so redni preventivni pregledi in cepljenje učinkovita metoda pri zmanjševanju tveganja za okužbo s HPV in pojavnost raka na materničnem vratu.
“Poznamo več kot 200 različic oz. genotipov virusa HPV, ki so lahko manj nevarni oz. nizkorizični ali bolj nevarni oz. visokorizični,” je povedala ginekologinja iz zdravstvenega varstva žensk ZD Ljubljana Tinkara Srnovršnik. Poudarila je, da okužba lahko nastopi ob tesnih stikih s kožo in pa sluznico okužene osebe, najpogosteje med spolnimi odnosi, in dodala, da okužba lahko poteka brez znakov in spontano izzveni v letu ali dveh, redkeje pa postane dolgotrajna.
Po raziskavah ZD Ljubljana o spolnem vedenju mladostnikov so prav mladi tisti, ki so relativno malo podučeni o tem, kako se virus prenaša in kakšne so lahko posledice okužbe, zato so prav oni tisti, ki so bolj dovzetni za okužbo. Po ocenah Nacionalnega inštituta za javno zdravje (NIJZ) je z vsaj enim visokorizičnim tipom HPV vsak trenutek okuženih vsaj 25 odstotkov mladih med 20. in 25. letom starosti.
Po navedbah ginekologinje Srnovršnik lahko pri ženskah visokorizična oblika HPV privede do predrakavih in rakavih sprememb tako materničnega vratu kot nožnice, pri obeh spolih pa do raka zunanjega spolovila, zadnjika in pa ustnega dela žrela.
V ZD Ljubljana poudarjajo, da zdravila za to okužbo ni, možno pa je zdravljenje zgodaj odkritih sprememb, kar dosežemo z rednimi presejalnimi pregledi, le te pa spodbujajo tudi preko preventivnega državnega presejalnega programa Zora. Dodali so, da je poleg rednih pregledov pri ginekologu pomembno tudi samopregledovanje.
“Letno v Sloveniji odkrijejo od 100 do 120 primerov raka na materničnem vratu, za posledicami raka pa umre od 40 do 50 žensk,” je še dodala Srnovršnik. Izpostavila je, da tveganje za okužbo lahko zmanjšamo tudi z upoštevanjem tako imenovanega ABC principa varne in zdrave spolnosti, ki zagovarja abstinenco oz. odlašanje prvega spolnega odnosa, zvestobo med partnerjema in pravilno uporabo kondoma pri spolnosti.
V ZD Ljubljana velik pomen pri zmanjševanju tveganja za okužbo s HPV pripisujejo tudi cepljenju. Pri deklicah prvo cepljenje proti HPV izvajajo po rednem programu cepljenja v šestem razredu osnovne šole. Od šolskega leta 2021/2022 pa so v programu rednega cepljenja do brezplačnega cepljenja proti HPV upravičeni tudi dečki.
Po podatkih NIJZ je bila precepljenost populacije v letih med 2009 in 2018 pod 50 odstotkov. Leta 2018/2019 pa je bila precepljenost višja, in sicer 59,3-odstotna. Šolska zdravnica Janja Schweiger Nemanič iz zdravstvenega varstva šolskih otrok in mladine ZD Ljubljana je navedla, da premajhna precepljenost v Sloveniji ne nudi zadostne kolektivne zaščite in predstavlja oviro na poti Slovenije k eliminaciji raka materničnega vratu in pa drugih s HPV povezanimi raki. Zato je po njenem mnenju tudi cepljenje dečkov ključnega pomena.
Schweiger Nemanič je še omenila, da je rak materničnega vratu na drugem mestu v svetovnem merilu pri ženskah med 15. in 44. letom in da je o dejavnikih tveganja in preventivi treba ozaveščati tudi starše.
“,”Jaka Verbic Miklic”,1677666600,1677666600,sl,15317,306,15316,43,0,NULL,,”Preventivni pregledi in cepljenje ključni pri zmanjševanju tveganja za okužbo z virusom HPV “,preventivni-pregledi-in-cepljenje-kljucni-pri-zmanjsevanju-tveganja-za-okuzbo-z-virusom-hpv,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683365473,1683365473
976,15319,”Ob svetovnem dnevu debelosti opozorila o porastu te bolezni “,” “,”
Ljubljana, 4. marca – Obeležujemo svetovni dan debelosti. Strokovnjaki ob tem opozarjajo, da je debelost kronična bolezen, ki je v porastu, in je tesno povezana z nevarnostjo srčno-žilnih bolezni, sladkorne bolezni in povišanega krvnega tlaka. Predsednik Društva za zdravje srca in ožilja Slovenije Matija Cevc meni, da je treba narediti vse, da bo debelosti čim manj.
Z dnevom želijo strokovnjaki vsak 4. marec doseči širši krog prebivalstva in ozaveščati o pomenu in škodljivost debelosti in nevarnostih, ki jih povzroča. “Debelost je postala vedno večji problem za zdravje prebivalstva ne samo pri nas, ampak po celem svetu,” je Cevc povedal za STA. Zaradi vseh bolezni, s katerimi je povezana, pa se zdravniki tega stanja bojijo, je dodal.
Pri preprečevanju debelosti je ključen zdrav življenjski slog, ki vključuje redno telesno dejavnost in zdravo prehrano, ki mora biti kalorično primerno uravnotežena, je povedal.
Letošnji svetovni dan debelosti je namenjen odpravi stigme oseb s čezmerno hranjenostjo in debelostjo, ki je odraz moralnega razlikovanja v družbi, pa so sporočili iz Splošne bolnišnice Jesenice. Stigmatizacija se najpogosteje začne z mediji, družinskimi člani in prijatelji. Tudi zdravstveni delavci kdaj podprejo kakšno stigmo in povzročajo sram pri bolnikih zaradi njihove telesne mase, so zapisali.
“Napačno oblikovana predstava o bolniku, na podlagi številke na tehtnici, lahko vodi v zdravstveno obravnavo, ki temelji na izpostavljanju bolnikovih napak, namesto da bi jih spodbujali in opolnomočili za izboljšave ter podprli njihovo odločitev iskanja zdravniške pomoči,” opozarjajo.
Svetovna zveza proti debelosti (World Obesity Federation) je pred dnevi objavila poročilo, v katerem navajajo, da bo do leta 2035 več kot polovica svetovnega prebivalstva opredeljena kot predebela ali s prekomerno telesno težo, če se preventiva, zdravljenje in podpora ne izboljšajo. Stroški debelosti pa bodo leta 2035 znašali več kot štiri bilijone dolarjev.
Stopnja debelosti med otroki narašča hitreje kot med odraslimi. Debelost otrok bi se lahko do leta 2035 več kot podvojila v primerjavi z letom 2020. Večjo razširjenost debelosti zaznavajo v državah z nizkim ali povprečnim življenjskim standardom, saj je devet od desetih držav z največjim pričakovanim porastom debelosti na svetu v Afriki in Aziji.
Svetovna zveza proti debelosti zato poziva k pripravi celovitih nacionalnih akcijskih načrtov, ki bi državam pomagali pri upoštevanju novih priporočil Svetovne zdravstvene organizacije za preprečevanje in obvladovanje debelosti.
“,”Jaka Verbic Miklic”,1677925980,1677925980,sl,15319,306,15318,43,0,NULL,,”Ob svetovnem dnevu debelosti opozorila o porastu te bolezni “,ob-svetovnem-dnevu-debelosti-opozorila-o-porastu-te-bolezni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683365642,1683365642
977,15321,”Strokovnjaki izpostavili pomen zgodnjega odkrivanja bolezni ledvic “,” “,”
Ljubljana, 7. marca – Delovanje ledvic in delovanje srčno-žilnega sistema sta tesno povezana, zato so bolezni ledvic tudi dejavnik tveganja za nastanek in poslabšanje bolezni srca in ožilja. Ob tem večina bolnikov s kronično ledvično boleznijo ne občuti težav z ledvicami, ki pa jih je ključno odkriti pravočasno, so strokovnjaki opozorili pred svetovnim dnevom ledvic.
Povezanost in odvisnost med srcem in ledvicami je zelo velika, pomanjkljivost sodobnega zdravstva pa je, da posameznika ne obravnava dovolj celovito, je na današnji novinarski konferenci Društva za zdravje srca in ožilja Slovenije povedal predsednik društva Matija Cevc. Medsebojnih vplivi se pogosto kažejo denimo v kardiorenalnem sindromu, ki ga ima od 40 do 50 odstotkov bolnikov s srčnim popuščanjem. Ta sindrom zajema spekter motenj, ki vključujejo srce in ledvice in pri katerih lahko akutna ali kronična disfunkcija enega organa povzroči akutno ali kronično disfunkcijo drugega organa, je še poudaril.
Populacijske raziskave so po njegovih navedbah pokazale, da imajo ljudje s kronično ledvično boleznijo zelo pogosto tudi klasične dejavnike tveganja za srčno-žilne bolezni, kot so kajenje, sladkorna bolezen, sedeč način življenja in podobno. Pri njih je poleg rednega jemanja predpisane terapije ključno obvladovanje teh dejavnikov tveganja tudi z zdravim življenjskim slogom, ki vključuje zlasti nekadilstvo, redno telesno dejavnost vsaj 30-60 minut dnevno in upoštevanje principov zdrave mediteranske prehrane, je dodal Cevc.
Predsednik Slovenskega nefrološkega društva Andrej Škoberne je povedal, da je kronična ledvična bolezen, ki poteka počasi in brez zdravljenja vztrajno napreduje, vedno pogostejša v populaciji. V veliki meri jo povzročajo sladkorna bolezen, povišan krvni tlak, debelost, kajenje in ostale dejavnosti, povezane z nezdravim življenjskim slogom.
Ker se glavni vzroki za kronično ledvično bolezen povečujejo, ni presenetljivo, da se v zadnjih desetletjih povečuje tudi njena pogostost. Z zdravim načinom življenja pa lahko bolezni ledvic preprečujemo, je dodal Škoberne. Eden od sloganov letošnjega svetovnega dneva ledvic, ki ga obeležujemo v četrtek, je zato Gremo vsi ven! Za zdrave ledvice, dušo in telo.
V zahodnem svetu ima približno 10 odstotkov odraslih kronično ledvično bolezen, kar bi v Sloveniji pomenilo približno 180.000 ljudi, je povedal Škoberne. Izpostavil je, da okoli 90 odstotkov teh ne ve, da jo ima. Zaradi tega priporočajo preverjanje stanja ledvic pri osebah, ki imajo dejavnike tveganja za kronično bolezen ledvic, in pri tistih, ki imajo težave, povezane z delovanjem ledvic.
“,”Jaka Verbic Miklic”,1678185780,1678185780,sl,15321,306,15320,43,0,NULL,,”Strokovnjaki izpostavili pomen zgodnjega odkrivanja bolezni ledvic “,strokovnjaki-izpostavili-pomen-zgodnjega-odkrivanja-bolezni-ledvic,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683366244,1683366244
978,15323,”Pomlad prinese tudi porast težav zaradi cvetnega prahu “,” “,”
Ljubljana, 11. marca – S pomladjo se pri marsikomu pojavijo težave in tudi alergijske reakcije, povezane s cvetnim prahom. V zadnjih tednih namreč cvetijo leske, jelše, cipresovke in druge alergene rastline. Strokovnjaki priporočajo, da so ljudje pozorni na ustrezno prezračevanje domov ter izogibanje dejavnostim na prostem v obdobju, ko je v zraku največ cvetnega prahu.
Najpogostejši simptomi senenega nahoda so voden izcedek iz nosu, močno kihanje v napadih, zamašen nos, oteženo dihanje in srbenje nosu. Nagnjenje k obolevanju je običajno podedovano, so navedli na spletni strani Nacionalnega laboratorija za zdravje, okolje in hrano (NLZOH).
Predlagajo upoštevanje ključnih preventivnih ukrepov za preprečevanje pretirani izpostavljenosti alergenu cvetnega prahu. Izpostavljenosti cvetnemu prahu se lahko v prvi vrsti izognemo s tem, da se v času, ko je v zraku največ cvetnega prahu, izogibamo športnim dejavnostim na prostem in daljšemu zadrževanju zunaj. Po navedbah NLZOH je priporočljivo, da v neposredni bližini stanovanjskih hiš ne zasajamo dreves z visokim alergenim potencialom, kot so na primer breza, cipresa, leska in jelša.
Opozarjajo, da prenos cvetnega prahu v stanovanjske prostore najpogosteje poteka z odpiranjem oken in vrat, lahko pa se zgodi tudi z vnosom preko oblačil in obutve. Obremenjenost bivalnih prostorov z alergeni cvetnega prahu po navedbah NLZOH lahko zmanjšamo tudi z rednim čiščenjem prahu in s postavitvijo prezračevalnih naprav z dobrimi filtri. Kratka pogosta prezračevanja prinesejo manj obremenitve v notranje prostore.
V primeru senenega nahoda se porast alergijskih obolenj pripisuje podnebnim spremembam, širjenju novih vrst rastlin in onesnaženju okolja. Podnebne spremembe vplivajo na časovni potek sezone cvetnega prahu in na razširjenost nekaterih alergenih rastlin. Kot so zapisali na NLZOH, se začetek sezone cvetnega prahu začne na prvi dan, ko se cvetni prah obravnavane rastline pojavi v zraku štiri dni zapored. Začetek sezone leske, glede na meritve merilnih postajah po Sloveniji, vsako leto nastopi konec januarja oziroma v začetku februarja.
Po raziskavah Agencije RS za okolje (Arso) se tako v Sloveniji kot v svetu občutljivost ljudi na alergene cvetnega prahu povečuje. Na to vpliva višanje povprečnih temperatur zraka. Višja povprečna temperatura zraka vpliva na to, da rastline dalj časa uspevajo, kar pa pomeni tudi daljšo prisotnosti alergenov v zraku, so povedali na Arsu. Opomnili so na trenutno rast rastlin, ki jih po fenološkem koledarju uvrščamo v obdobje predpomladi.
Za trenutno obdobje je najbolj značilno cvetenje leske, jelše, breze, gabra, hrasta ter bukve, v primorju pa se poleg celinskih vrst pojavlja še cvetni prah cipres. Na NLZOH so ugotovili, da glede na koledar 10-letnega merjenja cvetnega prahu v tem obdobju največ zdravstvenih težav povzroča prav cvetenje jelše in leske. Težave zaradi cvetenja trav pa se bodo občutneje povečale v maju.
“,”Jaka Verbic Miklic”,1678532940,1678532940,sl,15323,306,15322,43,0,NULL,,”Pomlad prinese tudi porast težav zaradi cvetnega prahu “,pomlad-prinese-tudi-porast-tezav-zaradi-cvetnega-prahu,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683367813,1683367814
979,15325,”Obeležujemo evropski dan žil “,” “,”
Ljubljana, 15. marca – Obeležujemo evropski dan žil, ki so eden največjih organov v človeškem telesu. Na ta dan tudi pri nas v Društvu za zdravje srca in ožilja Slovenije še bolj ozaveščajo prebivalstvo o skrbi za zdravje žil in preprečevanju žilnih bolezni. Letos so med drugim izpostavili, da je pomembno z gibanjem in zdravo prehrano za žile skrbeti že od otroštva.
Kardiolog Matija Cevc s kliničnega oddelka za žilne bolezni interne klinike Univerzitetnega kliničnega centra (UKC) Ljubljana je na novinarski konferenci Društva za zdravje srca in ožilja Slovenije v torek poudaril, da je po nekaterih podatkih samo v možganih za 167.000 kilometrov žil. V 75 letih življenja se pri 70 kg težkem človeku preko žil pretoči kar za okoli 221 milijonov litrov krvi, kar je skoraj ena četrtina Bohinjskega jezera.
Žile niso le cevi, preko katerih se pretaka kri, ampak imajo izredno velik pomen. Ne le, ker omogočajo vsaki celici telesa, da do njih pridejo za preživetje nujno potrebne snovi in kisik ter odnašajo odvečne in škodljive produkte presnove, ampak so tudi zelo aktivne pri uravnavanju pretoka, je pojasnil.
Na žile po njegovih besedah delujejo številni škodljivi dogodki in snovi. Okvarjajo jih številne bolezni, med njimi sladkorna bolezen, zvišan krvni tlak, kronična ledvična bolezen, kronične in lokalne vnetne bolezni.
Okvarjajo jih tudi nezdrave življenjske navade, kot je kajenje ali telesna nedejavnost. Nenazadnje nanje škodljivo deluje tudi stres in depresija. Zato je prav, da na žile z gibanjem in zdravo prehrano pazimo že od otroštva, je poudaril.
Kardiolog Vinko Boc, prav tako s kliničnega oddelka za žilne bolezni, je spregovoril o periferni arterijski bolezni. Pojasnil je, da je zdravljenje te bolezni sestavljeno iz obvladovanja dejavnikov tveganja za aterosklerozo, ki je glavni vzrok periferne arterijske bolezni, preprečevanja srčnega infarkta in možganske kapi ter izboljševanja arterijske prekrvavitve spodnjih udov. Pri slednjem je lahko zelo uspešen bolnik sam, če dovolj hodi, je pojasnil.
Kadar pa so bolečine v udu ob hoji prehude ali je prisotna kritično slaba prekrvavitev, ki ogroža preživetje uda, je potreben revaskularizacijski poseg, s katerim strokovnjaki obnovijo dotok krvi v ud.
Danes večino bolnikov, ki potrebujejo omenjeni poseg, zdravijo z znotrajžilnim posegom. Gre za minimalno invaziven poseg, pri katerem s posebnim pristopom vstopijo v arterijski sistem. Ob tem ni potrebna splošna anestezija, ki je pri starejših bolnikih lahko tvegana, bolnika pa lahko sprejmejo in odpustijo v istem dnevu. Na tem področju je, kot je pojasnil Boc, tehnologija v zadnjih letih močno napredovala.
Pediater Urh Grošelj s kliničnega oddelka za endokrinologijo, diabetes in presnovne bolezni pediatrične klinike UKC je pojasnil, da ima približno 400.000 odraslih in otrok v Sloveniji zaradi povišanih vrednosti lipoproteina vsaj za 90 odstotkov povišano tveganje za bolezni srca in ožilja in za bolezen srčnih zaklopk. Povišanja so, kot je pojasnil, v veliki največji meri dedno pogojena. Dejal je, da si lahko v bližnji prihodnosti obetamo pojav specifičnih in učinkovitih zdravil.
Ob mesecu lipidov bo do 14. aprila v posvetovalnici za srce na Dalmatinovi ulici v Ljubljani na voljo brezplačne meritve holesterola v krvi ter svetovanje glede rezultatov.
Evropski dan žil je vsako leto na tretjo sredo v mesecu marcu, letos 15. marca.
“,”Jaka Verbic Miklic”,1678883940,1678883940,sl,15325,306,15324,43,0,NULL,,”Obeležujemo evropski dan žil “,obelezujemo-evropski-dan-zil,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683459612,1683459612
980,15327,”Ob svetovnem dnevu spanja opozorila o vplivu spanja na zdravje “,” “,”
Ljubljana, 17. marca – Svetovni dan spanja, ki ga obeležujemo danes, tokrat poteka pod sloganom Spanje je ključno za zdravje. Spanje je namreč poleg zdrave prehrane in telesne dejavnosti steber človekovega zdravja, neurejeno spanje pa lahko predstavlja tveganje. Na NIJZ ob tem opozarjajo, da na vzroke pomanjkanja spanja lahko vplivamo sami.
Svetovni dan spanja poteka pod okriljem Svetovne zveze za spanje, namenjen pa je ozaveščanju javnosti o pomembnosti spanja in njegovega vpliva na zdravje. Kot opozarjajo na Nacionalnem inštitutu za javno zdravje (NIJZ), je spanje eden od ključnih gradnikov posameznikovega telesnega, duševnega in socialnega blagostanja. Vpliva na vsa področja človekovega delovanja in kakovost življenja v vseh starostnih obdobjih.
Raziskave pa kažejo, da Slovenci spimo premalo. Nacionalna raziskava o vplivu pandemije covida-19 na življenje, ki jo je izvedel NIJZ, denimo kaže, da je 42 odstotkov odraslih prebivalcev v času pandemije med delovnim tednom spalo manj kot sedem ur na noč in tako ne dosegajo priporočil o dolžini spanja. Tudi raziskava med slovenskimi mladostniki je pokazala, da le 54 odstotkov 11-letnikov in 26 odstotkov 13-letnikov med šolskim tednom spi skladno s priporočili, od devet do 11 ur.
Poleg dolžine spanja so sicer pomembni tudi kakovost, primerna časovna umeščenost in reden urnik spanja. O kakovostnem spanju govorimo, kadar zvečer potrebujemo čim krajši čas, da zaspimo, se preko noči čim manjkrat prebujamo, zjutraj pa se večinoma zbudimo sveži in spočiti ter čez dan normalno opravljamo vsakodnevne aktivnosti.
Spanje je po navedbah NIJZ ključni pokazatelj splošnega zdravja in dobrega počutja. Blagodejno vpliva na srce in ožilje, na celično obnovo in presnovo, uravnava količino inzulina in glukoze ter vpliva na raven razpoložljive energije in našo telesno pripravljenost. Spanje je pomembno tudi za normalno delovanje možganov, saj okrepi vrsto možganskih funkcij, so še zapisali na NIJZ. Dodajajo, da urejeno spanje tudi krepi imunski sistem, nenazadnje pa ima ugoden vpliv tudi na naše duševno zdravje in dobro počutje.
Na najpogostejše vzroke pomanjkanja spanja lahko v veliki meri vplivamo sami, so še poudarili. Če prepoznamo težave s spanjem, lahko strokovno pomoč poiščemo v lekarni ali pri osebnem zdravniku, ki nas lahko napoti tudi v nadaljnjo obravnavo k specialistu.
Izpostavili so tudi motnje dihanja v spanju, ki so pogosta motnja spanja in vedno bolj pereč javnozdravstveni problem, za katerim po ocenah trpi 150.000 prebivalcev Slovenije.
“,”Jaka Verbic Miklic”,1679056860,1679056860,sl,15327,306,15326,43,0,NULL,,”Ob svetovnem dnevu spanja opozorila o vplivu spanja na zdravje “,ob-svetovnem-dnevu-spanja-opozorila-o-vplivu-spanja-na-zdravje,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683459737,1683459737
981,15329,”NIJZ: Skoraj vsak četrti otrok v Evropi je debel ali ima prekomerno telesno težo “,” “,”
Ljubljana, 21. marca – Približno pet odstotkov otrok v EU je predebelih, 15 odstotkov pa jih ima prekomerno telesno težo, je sporočil Nacionalni inštitut za javno zdravje (NIJZ). V sklopu evropskega projekta Best-ReMap si v inštitutu zastavljajo cilj zmanjšati škodljivo trženje prehrane otrokom, izboljšanje javnih naročil zdrave prehrane in preoblikovanje živil.
S projektom skupnega ukrepanja želi NIJZ z ostalimi deležniki uvesti skupno orodje za spremljanje hranilne vrednost živil. Na ta način bi vse sodelujoče države opisale ponudbo živil in njihovo prehransko kakovost ter spodbudila preoblikovanje živil na podlagi izdelkov z oznako “najboljšega v razredu”.
V sodelovanju z deležniki v živilskopredelovalna industriji bi z zniževanjem vsebnosti sladkorja, soli in maščob v predelanih živilih radi zagotovili bolj zdrava živila. Glede vsebnosti sladkorja, soli in nasičenih maščob v predelanih živilih med cilji zastavljajo še pripravo nacionalne tarčne vrednosti in strateškega načrta za preoblikovanje sestave živil, so našteli.
“Trenutni kazalniki ciljev trajnostnega razvoja vključujejo le delna sklicevanja na prehranski sistem, zato bi spremljanju ciljev trajnostnega razvoja koristil dodatek niza kazalnikov, povezanih s celotnim prehranskim sistemom,” so v sporočilu navedli Moniko Robnik Levart iz inštituta.
Prehranski sistemi poleg zdravja vplivajo še na okoljski odtis in na socialno-ekonomske zunanje učinki evropske družbe, kot denimo na način neenakosti v dobavnih verigah, so pojasnili v sporočilu za javnost.
Po mnenju NIJZ bo izboljšanje ponudbe hrane imelo koristi za vse skupine prebivalstva, posebej pa za otroke in najbolj ranljive populacije, ki prepogosto uživajo predelana živila.
Po podatkih Evropske komisije je bilo namreč leta 2017 v Evropski uniji približno 15 odstotkov otrok in mladostnikov s prekomerno telesno težo. Približno pet odstotkov pa jih je bilo debelih. Debelost v otroštvu pogosto napoveduje debelost tudi v odrasli dobi, zato naraščajoča razširjenost otroške debelosti vključuje tudi vse večjo pojavnost debelosti v odrasli dobi z vsemi povezanimi boleznimi in zapleti, so opozorili na inštitutu.
Za preprečevanja tega so zagnali tudi pilotni pristop javnega naročanja živil v javnih institucijah, ki po besedah Barbare Lončarek iz Zbornice kmetijskih in živilskih podjetij olajša postopek javnega naročanja živil tako za javne zavode kot tudi za ponudnike živilskih izdelkov.
“Glavna prednost za ponudnike, ki so vpisani v katalog živil za javno naročanje, je trenutno avtomatsko izpolnjevanje predračuna s podatki o izdelkih iz aplikacije in posledično velik prihranek na času,” so na NIJZ povzeli besede Barbare Lončarek.
Projekt Best-ReMaP so začeli oktobra 2020, zdaj pa prehaja v zaključno fazo.
“,”Jaka Verbic Miklic”,1679402520,1679402520,sl,15329,306,15328,43,0,NULL,,”NIJZ: Skoraj vsak četrti otrok v Evropi je debel ali ima prekomerno telesno težo “,nijz-skoraj-vsak-cetrti-otrok-v-evropi-je-debel-ali-ima-prekomerno-telesno-tezo,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683459816,1683459817
982,15331,”Ob svetovnem dnevu tuberkuloze o novih tveganjih “,” “,”
Golnik, 24. marca – Danes obeležujemo svetovni dan tuberkuloze, katerega namen je povečati osveščenost in okrepiti prizadevanja za odpravo globalne epidemije tuberkuloze. Ta je ena najbolj smrtonosnih nalezljivih bolezni na svetu, za katero dnevno umre 4400 ljudi. Slovenija sicer velja za državo z nizko pojavnostjo, vendar nov begunski val prinaša nova tveganja.
Kot so sporočili z Univerzitetne klinike za pljučne bolezni in alergijo Golnik, ki vodi Register tuberkuloze RS, so svetovna prizadevanja za boj proti tuberkulozi od leta 2000 rešila približno 74 milijonov življenj. Vendar je pandemija covida-19 skupaj s konflikti v Evropi, Afriki in na Bližnjem vzhodu ter socialno-ekonomskimi neenakostmi obrnila dolgoletni napredek v boju za izkoreninjenje tuberkuloze.
Svetovna zdravstvena organizacija (WHO) je v svojem zadnjem poročilu o tuberkulozi v svetu poudarila, da sta se prvič v več kot desetletju povečala ocenjena pojavnost tuberkuloze in smrtnost zaradi nje. Za tuberkulozo vsak dan zboli 30.000 ljudi in umre 4400 ljudi.
Slogan letošnjega svetovnega dneva tuberkuloze je Da! Lahko odpravimo tuberkulozo!, s katerim želi WHO vzbuditi upanje in pospešiti ukrepanje ter multidisciplinarno sodelovanje v boju proti epidemiji tuberkuloze. WHO bo na letošnjem srečanju Združenih narodov o tuberkulozi skupaj s partnerji objavila poziv k ukrepanju in hitrejšemu uvajanju novih, krajših in oralnih režimov zdravljenja tuberkuloze.
Doslej uporabljeni režimi za zdravljenje odpornih oblik tuberkuloze so namreč vsebovali pet ali več antimikrobnih zdravil, ki jih je bolnik prejemal več mesecev, lahko tudi let, mnoga zdravila so bila v parenteralni obliki, kar je posledično zahtevalo hospitalno zdravljenje. Z uvedbo novih režimov se skrajša čas zdravljenja, zdravila v oralni pa obliki bolnik prejema v domačem okolju, zato ni potrebno dolgotrajno zdravljenje v bolnišnici.
Tuberkuloza je v svetovnem merilu še vedno bolezen, ki ima eno najvišjih stopenj umrljivosti med nalezljivimi boleznimi. V Sloveniji je stopnja umrljivosti šestodstotna, kar je primerljivo z ostalimi razvitimi evropskimi državami. Slovenija velja za državo z dobrim nadzorom nad epidemijo tuberkuloze in z nizko pojavnostjo. Leta 2021 je bilo v Sloveniji odkritih 80 novih primerov tuberkuloze.
Vendar zdajšnje dogajanje na vojnih območjih in nov begunski val prinašata tveganje za večje pojavljanje te bolezni tudi pri nas. V Ukrajini je tuberkuloza še vedno pogosta bolezen in predstavlja velik javnozdravstveni problem, je pojasnila vodja Registra tuberkuloze RS Petra Svetina.
O trenutnih izzivih pri obvladovanju tuberkuloze bodo Svetina in drugi strokovnjaki spregovorili na današnjem 6. mednarodnem simpoziju o tuberkulozi in 25. slovenskem posvetu o obravnavi in spremljanju bolnikov s tuberkulozo, ki ga pripravlja Klinika Golnik.
“,”Jaka Verbic Miklic”,1679661840,1679661840,sl,15331,306,15330,43,0,NULL,,”Ob svetovnem dnevu tuberkuloze o novih tveganjih “,ob-svetovnem-dnevu-tuberkuloze-o-novih-tveganjih,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683459922,1683459922
983,15333,”Strokovnjaki opozarjajo na previdnost pri uživanju prehranskih dopolnil “,” “,”
Ljubljana, 4. aprila – Prodaja prehranskih dopolnil je vse bolj razširjena, a strokovnjaki opozarjajo, da je ta trg nenadzorovan, veliko je zavajajočega oglaševanja in pogosto lahko uživanje teh snovi vodi celo k poslabšanju zdravja. Odločevalce pozivajo k sistemski ureditvi področja, javnost pa k previdnosti pri uporabi teh snovi. Niti športniki jih ne potrebujejo.
Predsednik Društva za zdravje srca in ožilja Slovenije Matija Cevc je na današnji spletni novinarski konferenci ob svetovnem dnevu zdravja opozoril, da je v lekarnah, trgovinah in na spletu vedno večja ponudba t. i. prehranskih dopolnil, a ker so ta obravnavana kot živilo, niso povržena takšnemu nadzoru kot zdravila, zato so številna dvomljivega izvora in učinka.
“Leta 2022 je bil trg prehranskih dopolnil po ocenah vreden 164 milijard ameriških dolarjev, do leta 2030 naj bi dosegel že 327 milijard. Jasno je, da tam, kjer se vrti toliko denarja, prihaja do manipulacij, še zlasti če ni nadzora in sankcij,” je povedal.
Številni pripravki obljubljajo čudežne učinke, a Cevc poudarja, da so zdravstvene trditve, ki niso podkrepljene z verodostojnimi raziskavami, po evropski zakonodaji prepovedane. “Nesprejemljivo je, da nihče ne ukrepa,” je dejal.
V društvu menijo, da bi morala država bistveno poostriti nadzor nad temi izdelki in zaščititi prebivalke in prebivalce pred zavajajočimi trditvami. Ljudem se namreč tako prodaja lažno upanje, kar lahko vpliva na njihovo nadaljnje zdravljenje. Z nakupom teh dodatkov se bolniki oddaljujejo od ustreznega zdravljenja ali primernega načina prehranjevanja, s čimer si delajo še dodatno škodo.
Vodja enote za klinično prehrano na Onkološkem inštitutu Nada Rotovnik Kozjek je pojasnila, da je uporaba prehranskih dopolnil v vsakodnevni prehrani brez specifične indikacije povsem nepotrebna. “Raziskave nedvomno kažejo, da je uravnotežena prehrana, ki je prilagojena potrebam posameznika, zadosten vir vseh hranilnih snovi, ki jih organizem potrebuje,” je dejala.
Trenutno najbolj prodajana prehranska dopolnila so proteinski dodatki, najbolj na udaru pa so starostniki s številnimi zdravstvenimi težavami ter preko spletnega oglaševanja in vplivnežev mlade generacije, tudi športniki.
Lovro Žiberna s Fakultete za farmacijo in Slovenske antidopinške organizacije (SLOADO) je povedal, da športniki v prvi vrsti potrebujejo urejeno prehrano z uravnoteženo kombinacijo hranil, ne pa prehranskih dopolnil. Opozoril je, da takšni pripravki pogosto ne vsebujejo snovi, ki se oglašujejo, številni so proizvedeni v dvomljivih okoliščinah in z neustreznimi sestavinami.
Uporaba teh dodatkov je sporna še posebej pri mladih športnikih, saj se s tem razvija nagnjenost k dopingu. Znanstvena literatura večinoma ni dokazala nobenega vpliva teh snovi na telesno zmogljivost, v resnici lahko celo ogrozijo zdravje, prihaja do kliničnih zapletov, tudi smrti. Takšni primeri so bili tudi v Sloveniji, je povedal Žiberna.
Aleš Blinc z oddelka za žilne bolezni UKC Ljubljana je opozoril, da se omenjene izdelke pogosto oglašuje z ukradenimi fotografijami priznanih zdravnikov, s čimer imajo takšna dejanja tudi elemente kaznivega dejanja, a jih je težko preganjati. “Drugega ni kot zdrava pamet,” je poudaril in opomnil, da zdravstvenih težav v nobenem primeru ni mogoče na hitro rešiti. “Če bi znali osteoporozo ozdraviti s tabletami, bi za to dobili Nobelovo nagrado, ne pa da to prodajajo neke obskurne spletne strani,” je dejal.
“,”Jaka Verbic Miklic”,1680608880,1680608880,sl,15333,306,15332,43,0,NULL,,”Strokovnjaki opozarjajo na previdnost pri uživanju prehranskih dopolnil “,strokovnjaki-opozarjajo-na-previdnost-pri-uzivanju-prehranskih-dopolnil,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683460148,1683460685
984,15335,”Umetna inteligenca presegla človeka pri ocenjevanju ultrazvoka srca “,” “,”
Los Angeles, 6. aprila – Umetna inteligenca (AI) je presegla človeške zmožnosti pri ocenjevanju ultrazvoka srca, ki je ena glavnih preiskav za ugotavljanje splošnega zdravja srca, je pokazala ena najnatančnejših raziskav na tem področju doslej, ki jo je v sredo objavila znanstvena revija Nature.
Glavni avtor študije in kardiolog na medicinskem centru Cedars-Sinai v Los Angelesu David Ouyang je za francosko tiskovno agencijo AFP povedal, da je glede razvoja na področju umetne inteligence “veliko navdušenja”, vendar je ključnega pomena, da modeli umetne inteligence dosežejo zelo natančne ocene.
Raziskave v preteklosti so sicer že pokazale potencialno sposobnost modelov AI za analizo medicinskih podatkov, avtorji nove študije pa trdijo, da “uspeh prvega tovrstnega kliničnega preizkusa na področju zdravja srca krepi verodostojnost trditev, da smo pripravljeni na naslednji korak”.
V okviru študije, objavljene v reviji Nature, so se srčni sonografisti pomerili z modelom umetne inteligence pri ocenjevanju ultrazvokov srca.
Srčni sonografist je zdravnik ali medicinski tehnik, ki je usposobljen za uporabo ultrazvoka za diagnostični pregled. Sonografisti pri bolnikih opravijo ultrazvok srca, znan tudi kot ehokardiogram, in običajno naredijo prvo oceno, preden posnetek izročijo kardiologu.
Sonografisti so tekmovali z modelom AI pri ocenjevanju sposobnosti črpanja krvi v telo med enim srčnim utripom. Ta preizkus je eden glavnih načinov merjenja delovanja srca. Z njegovo pomočjo lahko kardiolog ugotovi, ali so bolniki doživeli srčni infarkt in ali bi prenesli določene posege, kot je denimo vsaditev defibrilatorja.
“Umetna inteligenca je bila pri ocenah hitrejša in natančnejša, kardiologi pa niso opazili razlike,” je dejal Ouyang. Dodal je, da v ZDA in po vsem svetu opažajo “izjemno pomanjkanje” sonografistov, ki bi jim z modeli AI prihranili dragoceni čas.
Model umetne inteligence, imenovan EchoNet-Dynamic, za obdelavo velikih količin podatkov uporablja t.i. metodo globokega učenja. Raziskovalci trenutno vlagajo vlogo za odobritev metode pri ameriški Zvezni upravi za zdravila (FDA) in upajo, da bi temu kmalu lahko sledili tudi v Evropski uniji in drugod po svetu, je dodal Ouyang.
“,”Jaka Verbic Miklic”,1680782400,1680782400,sl,15335,306,15334,43,0,NULL,,”Umetna inteligenca presegla človeka pri ocenjevanju ultrazvoka srca “,umetna-inteligenca-presegla-cloveka-pri-ocenjevanju-ultrazvoka-srca,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683460878,1683460878
985,15337,”Svetovni dan zdravja s pozivi k reševanju težav zdravstvenega sistema”,” “,”
Ljubljana, 7. aprila – Ob današnjem svetovnem dnevu zdravja so se zvrstili številni pozivi k urejanju razmer v zdravstvenih sistemih. Tako v Sloveniji kot po svetu namreč primanjkuje zdravstvenega kadra. V več krajih po državi so potekale aktivnosti, ki so ozaveščale o zdravem načinu življenja, dan pa je sklenil pohod za javno zdravje civilne iniciative Glas ljudstva.
Generalna skupščina Svetovne zdravstvene organizacije (WHO), ki je bila ustanovljena leta 1948, je 7. april določila za svetovni dan zdravja. Vsako leto se v želji po večjem ozaveščanju javnosti na ta dan izpostavi določeno temo s področja zdravja. Letos je to Zdravje za vse, WHO pa ob tem začenja enoletno kampanjo, v kateri bodo moči združile države članice, partnerske organizacije in javnost.
Priložnost za razmislek in ideje, kaj lahko sami storimo za ohranjanje svojega zdravja, je bila danes na več dogodkih, ki so se zvrstili po državi. Društvo šola zdravja je tako zgodaj zjutraj v več krajih organiziralo brezplačno vadbo 1000 gibov. Po več zdravstvenih domovih so potekale različne zdravstvene meritve.
Minister za zdravje Danijel Bešič Loredan je v poslanici ob današnjem svetovnem dnevu zdravja pozval k tvorni razpravi o prihodnosti našega zdravstvenega sistema. “Samo skupaj namreč lahko najdemo rešitve, ki bodo zagotavljale njegovo zdržnost in omogočale razvoj, a bodo hkrati in predvsem dobre za ljudi,” je pozval v svoji poslanici.
Med izzivi za celotno družbo je Bešič Loredan izpostavil tudi duševne stiske in bolezni. Duševnemu zdravju v času po covidu-19 večina držav namenja bistveno več pozornosti, tudi Slovenija. Na ministrstvu so že pristopili k predlogom zakonodajnih sprememb.
Pri tem vidi več izzivov, med največjimi pomanjkanje zdravstvenih delavcev. Kot pravi, ne poznamo enostavnih rešitev. Ob zagotavljanju dodatnih zdravstvenih delavcev predvsem z vlaganji v izobraževanje bo nujen predvsem razmislek o drugačnih načinih dela, novih zdravstvenih profilih in večji vključenosti uporabnikov zdravstvenega sistema in civilne družbe, je prepričan minister.
Na pomanjkanje osebja v globalnem zdravstvenem sistemu je opozoril tudi generalni direktor WHO Tedros Adhanom Ghebreyesus. Do leta 2030 bo primanjkovalo okoli 10 milijonov zdravstvenih delavcev, je opozoril na četrtkovi novinarski konferenci v Ženevi.
Medtem ko svet okreva po pandemiji covida-19, je generalni direktor WHO vse države na svetu pozval k zaščiti ter vlaganjem v zdravje in zdravstvene delavce. Enostavno rečeno, ni zdravja brez zdravstvenih delavcev in negovalnega osebja, je poudaril.
Od začetka pandemije je po ocenah okoli polovica zdravstvenih delavcev trpela zaradi izgorelosti. Že pred tem so morali mnogi delati za prenizko plačilo in v nevarnih razmerah, je dejal Tedros.
Okrepiti in posodobiti moramo javni zdravstveni sistem in doseči soglasje, kako v javnem zdravstvenem sistemu zagotoviti pravočasno, kakovostno in dostopno oskrbo za vse, je v poslanici pozvala predsednica republike Nataša Pirc Musar.
Zavzela se je tudi za ukinitev dodatnega zdravstvenega zavarovanja. Spodbuja vlado, da v najkrajšem možnem času preuči predlog zakona o ukinitvi dodatnega zdravstvenega zavarovanja, kar naj se zgodi še pred napovedanim dvigom premij, ki bi predvsem najranljivejšim prebivalcem še poglobil socialno stisko.
Predsednica je napovedala, da bo z namenom spodbujanja dostopnega zdravstva za vse konec maja organizirala Predsedničin forum o izzivih v zdravstvu, kjer bodo skupaj z različnimi strokovnjaki iskali rešitve za učinkovit dostop do zdravstvenih storitev.
Zbornica zdravstvene in babiške nege Slovenije ob današnjem svetovnem dnevu zdravja izpostavlja, da je zelo pomembno področje celostne skrbi za zdravje tudi področje duševnega zdravja, ki se mora znebiti stigme in predsodkov ter postati dostopnejše slehernemu posamezniku v družbi. Ni zdravja brez duševnega zdravja, opozarja.
Študentske organizacije so ob današnjem svetovnem dnevu zdravja ponovno začele projekt Jem zdravo, študiram s polno paro! Z njim želijo mlade spodbujati k bolj zdravemu in trajnostnemu prehranjevanju, obenem pa naslavljajo prehransko draginjo.
Ob 18. uri pa je civilna iniciativa Glas ljudstva pripravila Pohod za javno zdravstvo, na katerem pozivajo k ureditvi razmer v zdravstvu. Za ureditev razmer so pripravili tri zakonske predloge, ki so jih predstavili na javni tribuni. Od premierja Roberta Goloba oz. koalicijskih poslancev pričakujejo, da predloge do 26. aprila vložijo v DZ.
“,”Jaka Verbic Miklic”,1680868920,1680868920,sl,15337,306,15336,43,0,NULL,,”Svetovni dan zdravja s pozivi k reševanju težav zdravstvenega sistema”,svetovni-dan-zdravja-s-pozivi-k-resevanju-tezav-zdravstvenega-sistema,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683460975,1683460975
986,15339,”Gana prva odobrila najbolj učinkovito cepivo proti malariji doslej “,” “,”
Akra, 13. aprila – Gana je kot prva država odobrila novo cepivo proti malariji, ki ga je razvila oxfordska univerza. Sodeč po dosedanjih raziskavah je to cepivo 77-odstotno učinkovito pri preprečevanju okužbe z malarijo, kar je bistveno več od predhodnih poskusov znanstvenikov na področju omejevanja širjenja te bolezni, ki vsako leto ubije okoli 620.000 ljudi.
Cepivo so zdravstvene oblasti v Gani odobrile za rabo pri otrocih v starosti med 5 in 36 mesecev, je sporočila univerza. To je namreč skupina prebivalstva, ki jo malarija najbolj ogroža.
Iz Oxforda so septembra lani sporočili obetavne podatke glede visoke stopnje imunosti tistih, ki so prejeli poživitveni odmerek cepiva, ob tem pa izrazili upanje, da bi novo cepivo lahko začeli množično proizvajati v roku nekaj let, poročajo tuje tiskovne agencije.
Indijski inštitut Serum, ki ima sklenjeno pogodbo o sodelovanju z oxfordsko univerzo, bo predvidoma v ganski prestolnici Akra proizvajal med 100 in 200 milijoni odmerkov letno. Posamezna doza naj bi stala nekaj ameriških dolarjev, navaja britanski BBC.
Britansko farmacevtsko podjetje BSK je lani dobilo odobritev Svetovne zdravstvene organizacije (WHO) za široko rabo cepiva, ki so ga razvili njeni strokovnjaki. Odmerek tega cepiva je prejelo več kot milijon otrok v Afriki, a se je cepivo na daljši rok izkazalo kot manj učinkovito.
WHO je konec lanskega leta podal oceno, da bi bilo treba sredstva za boj proti malariji več kot podvojiti, če svet želi doseči zastavljeni cilj, in sicer zmanjšanje števila primerov malarije in smrti za 90 odstotkov do leta 2030.
Malarijo povzročajo paraziti plazmodiji, ki jih s pikom na človeka prenašajo okuženi komarji. Med simptomi so visoka vročina, mrzlica in potenje, pa tudi bolečine v mišicah in sklepih, glavobol in prebavne težave, težave z dihanjem in kašelj.
“,”Jaka Verbic Miklic”,1681387740,1681387740,sl,15339,306,15338,43,0,NULL,,”Gana prva odobrila najbolj učinkovito cepivo proti malariji doslej “,gana-prva-odobrila-najbolj-ucinkovito-cepivo-proti-malariji-doslej,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683461384,1683461384
987,15341,”Ob svetovnem dnevu hemofilije poudarek na ključnih dosežkih v razvoju zdravljenja “,” “,”
Ljubljana, 17. aprila – Obeležujemo svetovni dan hemofilije. V Društvu hemofilikov Slovenije so ob tem kot nujno izpostavili ozaveščanje o stanju zdravljenja hemofilije in aktualni problematiki te redke prirojene bolezni. Javnost je treba seznaniti z vsemi pozitivnimi spremembami in dosežki v razvoju zdravljenja in celostne obravnave bolezni, so sporočili iz društva.
Društvu je v sodelovanju s strokovnjaki v zdravstvu in s pomočjo države uspelo tudi v mednarodnem okviru vzpostaviti uspešen sistem zdravljenja te nekdaj življenjsko ogrožujoče bolezni. Visoki strokovni in socialni standardi bolnikom hemofilikom ob najsodobnejših načinih zdravljenja in s podporo države omogočajo normalno dolgo in kakovostno življenje, so izpostavili v društvu.
Hemofilija je redka prirojena motnja strjevanja krvi, za katero je značilna zmanjšana količina beljakovine, potrebne za strjevanje krvi, so pojasnili. Krvavitve je zato pri ljudeh, ki se soočajo s to boleznijo, težje zaustaviti, zato je bistveno, da poskušajo preprečiti nastanek že najmanjših krvavitev. Za boleznijo večinoma zbolevajo moški, prenašajo pa jo ženske.
Zdravljenje s krvnimi pripravki je v zadnjih desetletjih znatno napredovalo, s čimer se je, po zaslugi predanih prostovoljnih krvodajalcev, življenje hemofilikov v Sloveniji znatno izboljšalo. Prav tako se pričakovana življenjska doba bolnikov približuje življenjski dobi splošne populacije, so še dodali.
Društvo hemofilikov Slovenije je član Svetovne zveze za hemofilijo in soustanovitelj Evropskega konzorcija za hemofilijo. Po njihovih besedah združuje in v sodelovanju z vsemi vrstami medicinskih strok skrbi za bolnike s hemofilijo in bolnike z drugimi motnjami strjevanja krvi.
O hemofiliji so se strokovnjaki pogovarjali tudi na četrtkovi okrogli mizi Misija hemofilija. Predsednik društva Krvni bratje Dominik Zver je skupaj s predsednikom društva hemofilikov Slovenije Janezom Dolinškom izpostavil, kako pomembno je vključevanje otrok in mladih bolnikov v društva, saj se tam lahko povežejo z ljudmi, ki se soočajo s podobnimi težavami hkrati pa se naučijo bolje živeti z boleznijo.
Po Zverovih besedah so si včasih hemofiliki bolečine lajšali z ledenimi obkladki in počivanjem, danes pa krvavitve preprečujejo. Preprečevanja krvavitev s profilaktičnim zdravljenjem se danes poslužuje večina odraslih bolnikov s težko obliko bolezni. Poudaril je tudi pomen rednega gibanja bolnikov s hemofilijo vsaj enkrat na teden pod nadzorom fizioterapevta ali drugega strokovnjaka.
“,”Jaka Verbic Miklic”,1681733400,1681733400,sl,15341,306,15340,43,0,NULL,,”Ob svetovnem dnevu hemofilije poudarek na ključnih dosežkih v razvoju zdravljenja “,ob-svetovnem-dnevu-hemofilije-poudarek-na-kljucnih-dosezkih-v-razvoju-zdravljenja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683461492,1683461492
988,15343,”Unicef: 67 milijonov otrok na svetu ni rutinsko cepljenih “,” “,”
New York, 20. aprila – Sklad ZN za otroke (Unicef) je danes objavil poročilo, ki razkriva zmanjšanje ravni rutinskega cepljenja otrok. 67 milijonov otrok na svetu ni rutinsko cepljenih za zaščito proti otroškim nalezljivim boleznim, ki jih je mogoče preprečiti. Med njimi je 48 milijonov takih, ki niso prejeli niti enega rutinskega cepiva, opozarjajo pri organizaciji.
Unicefovo poročilo z naslovom Položaj otrok v svetu 2023: Cepljenje za vsakega otroka razkriva, da je med letoma 2019 in 2021 67 milijonov otrok v celoti ali delno izpustilo cepljenje proti otroškim nalezljivim boleznim.
Razlogov za to je po navedbah Unicefa več – od motenj v izvajanju storitev zaradi preobremenjenih zdravstvenih sistemov in preusmerjanja virov v sanacijo kriznih razmer, pa do konfliktov, krhkih gospodarstev in zmanjšanja zaupanja staršev v cepiva. Slednje je tudi posledica negotovosti ob odzivu na pandemijo covida-19, vse večjega dostopa do zavajajočih informacij, upada zaupanja v strokovnjake in politične polarizacije.
Pri Unicefu opozarjajo, da otroci, rojeni tik pred ali med pandemijo covida-19, zdaj presegajo starost, ko se jih običajno cepi, kar pomeni, da bo treba hitro nadoknaditi zamujena cepljenja, če želimo preprečiti izbruhe smrtonosnih bolezni. Lani se je tako na primer število primerov okužb z ošpicami povečalo za več kot dvakrat v primerjavi z letom prej, število otrok, ki jih je ohromila otroška paraliza, pa se je leta 2022 v primerjavi z letom 2021 povečalo za 16 odstotkov.
“Dobro vemo, da bolezni ne poznajo meja. Rutinska cepljenja in močni zdravstveni sistemi so naš najboljši način za preprečevanje prihodnjih pandemij, nepotrebnih smrti in trpljenja,” je ob objavi poročila dejala izvršna direktorica Unicefa Catherine Russell.
48 milijonov otrok s t. i. ničelnim odmerkom na globalni ravni ni prejelo niti enega rutinskega cepiva. Konec leta 2021 je bilo takih otrok največ v Indiji in Nigeriji, povečanje njihovega števila pa je še posebej opazno v Mjanmaru in na Filipinih. Ti otroci navadno živijo v najrevnejših, najbolj oddaljenih in marginaliziranih skupnostih, vključno z območji konfliktov, še opozarjajo pri organizaciji.
“,”Jaka Verbic Miklic”,1681992720,1681992720,sl,15343,306,15342,43,0,NULL,,”Unicef: 67 milijonov otrok na svetu ni rutinsko cepljenih “,unicef-67-milijonov-otrok-na-svetu-ni-rutinsko-cepljenih,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683461578,1683461578
989,15345,”Teden cepljenja tudi z opozorilom zaradi upada precepljenosti “,” “,”
Ljubljana, 24. aprila – Začenja se svetovni in evropski teden cepljenja, s katerim želi Svetovna zdravstvena organizacija (WHO) opozoriti na globalni upad stopnje cepljenja in potrebo po tem, da se nadoknadijo morebitni izpuščeni odmerki cepiva, še posebej pri otrocih. Cilj tedna je zaščititi čim več ljudi pred boleznimi, ki jih je mogoče preprečiti s cepljenjem.
Cepljenje spada med največje uspehe v zgodovini medicine in hkrati tudi med največja upanja za medicino prihodnosti. Osnovna ideja cepljenja se je porodila iz opazovanja in spoznanja, da ljudje, ki so preboleli nekatere kužne bolezni, pozneje niso več zboleli za enako boleznijo, čeprav so bili v stiku z okuženimi osebami, so zapisali na spletni strani Nacionalnega inštituta za javno zdravje (NIJZ).
Že stoletja pred našim štetjem so Kitajci iz krast bolnikov s črnimi kozami izdelovali praške, cepiva, ki so jih vtirali v kožo zdravim ljudem, da bi jih zaščitili pred okužbo med epidemijami črnih koz. Danes delovanje takega ‘cepiva’ lahko pojasnimo s tem, da so se virusi med sušenjem krast na soncu inaktivirali. Ko so potem mrtve viruse vtrli v kožo, je imunski sistem cepljenega človeka izdelal protivirusna protitelesa, ki so pozneje ščitila organizem ob vdoru živih virusov črnih koz.
Cepljenja so prinesla ogromno zdravstveno korist tako posamezniku kot vsemu človeštvu. Zahvaljujoč cepljenju sedaj mnogih nalezljivih bolezni, zaradi katerih so ljudje nekoč hudo zbolevali, postali invalidi ali celo umirali, ne srečamo več
Cepljenje ima dokazane koristi za zdravje cepljenega posameznika. Pri nekaterih cepljenjih pa je namen tudi vzpostavitev kolektivne odpornosti proti določeni bolezni v celotni populaciji. Tako lahko preprečimo širjenje povzročiteljev med prebivalstvom ali bolezen celo izkoreninimo.
Pri tem je pomembno, da dosežemo zadostno precepljenost ciljne populacije. Kolektivna imunost omeji širjenje povzročiteljev in tako varuje pred okužbo tudi tiste, ki s cepljenjem še niso pridobili odpornosti ali se zaradi kontraindikacij in drugih razlogov ne morejo cepiti.
Proti mnogim nalezljivim boleznim zaenkrat še nimamo cepiv, potekajo pa raziskave novih metod za izdelavo cepiv. Po vsem svetu si znanstveniki prizadevajo, da bi še izboljšali doslej poznana cepiva v smislu učinkovitosti, varnosti in primernosti za množično uporabo, so še dodali na NIJZ.
O pomenu cepljenja so minuli teden na okrogli mizi STAkluba govorili tudi zdravstveni strokovnjaki in opozorili, da je epidemija covida-19 vplivala na ravni precepljenosti v družbi. Kot je pojasnila vodja centra za nalezljive bolezni pri NIJZ Marta Grgič Vitek, se je med epidemijo covida-19 skoraj pri vseh cepljenih precepljenost znižala tako pri obveznih kot priporočenih cepljenjih.
Podatki NIJZ kažejo, da se je precepljenost s šestvalentnim cepivom pri otroških boleznih v letu 2022 znižala na manj kot 90 odstotkov, kar je občuten padec, tudi precepljenost proti pnevmokoknim okužbam je upadla na 61 odstotkov.
Precepljenost proti gripi se je v sezoni 2021/22 v celotni populaciji znižala na osem odstotkov, medtem ko je bila v letu prej deset odstotkov. Enako je ta precepljenost pri starejših od 65 let padla z 28 na 25 odstotkov, kar je po njenem mnenju še zelo daleč od priporočil Svetovne zdravstvene organizacije.
“,”Jaka Verbic Miklic”,1682338380,1682338380,sl,15345,306,15344,43,0,NULL,,”Teden cepljenja tudi z opozorilom zaradi upada precepljenosti “,teden-cepljenja-tudi-z-opozorilom-zaradi-upada-precepljenosti,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683461668,1683461668
990,15347,”Zdravilo proizvajalca Eli Lilly za Alzheimerjevo bolezen kaže rezultate “,” “,”
New York, 4. maja – Ameriški proizvajalec zdravil Eli Lilly je v sredo sporočil, da je v obsežnem kliničnem preskušanju novo zdravilo za Alzheimerjevo bolezen za več kot tretjino upočasnilo upadanje kognitivnih sposobnosti bolnikov. Podjetje namerava do konca junija zaprositi za odobritev zdravila donanemab.
Eksperimentalno zdravilo deluje tako, da odstranjuje obloge v možganih, znane kot amiloid, ki so značilne za Alzheimerjevo bolezen. Vendar pa je med preizkusi prišlo do neželenih posledic. V preizkusih, ki so trajali 18 mesecev, je sodelovalo 1700 bolnikov.
“Za vsako zdravilo, za vsako bolezen obstajajo potencialna tveganja in potencialne koristi,” je dejal glavni znanstveni direktor podjetja Daniel Skovronsky, poroča CNN.
Vendar je opozoril, da se pri skoraj polovici udeležencev, ki so jemali zdravilo, v enem letu ni poslabšala ključna kognitivna sposobnost v primerjavi s skoraj 30 odstotki, ki so jemali placebo.
Alzheimerjeva bolezen prizadene več kot šest milijonov Američanov. V zgodnjih fazah bolezni je približno 1,7 do dva milijona ljudi, starejših od 65 let. Razvoj zdravil za Alzheimerjevo bolezen je bil večkrat neuspešen. Prvo zdravilo leqembi podjetij Eisai in Biogen je januarja dobilo pospešeno odobritev Uprave za hrano in zdravila (FDA).
Skovronsky je poudaril, da je nova skupina zdravil drugačna zaradi količine amiloida, ki ga lahko odstranijo, in tega, kako hitro ga lahko odstranijo.
Zdravilo bolniki prejemajo z infuzijo enkrat na mesec. Podjetje pravi, da donanemab tako učinkovito odstranjuje amiloid, da je 52 odstotkov bolnikov po enem letu lahko prenehalo jemati zdravilo, 72 odstotkov pa po letu in pol, poroča CNN.
“,”Jaka Verbic Miklic”,1683202500,1683202500,sl,15347,306,15346,43,0,NULL,,”Zdravilo proizvajalca Eli Lilly za Alzheimerjevo bolezen kaže rezultate “,zdravilo-proizvajalca-eli-lilly-za-alzheimerjevo-bolezen-kaze-rezultate,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1683461789,1683461852
991,15349,”Farmacevtska zakonodaja EU tvega, da bo oslabila evropsko znanstveno industrijo in evropske paciente oddaljila od vrhunskega zdravstvenega varstva”,”Odziv EFPIA na objavo farmacevtske zakonodaje EU”,”
Bruselj, 26. april 2023 Objava farmacevtske zakonodaje EU je pomemben mejnik, saj si tako EU, države članice in industrija prizadevajo za izboljšanje dostopa do zdravil in cepiv ter oživitev razvoja znanosti in inovacij v Evropi.
Nathalie Moll, generalna direktorica EFPIA, je povedala: »EFPIA s svojimi članskimi družbami in združenji že od vsega začetka podpira cilje farmacevtske strategije EU. Zagotavljanje hitrejšega in pravičnejšega dostopa do zdravil, preprečevanje in zmanjševanje pomanjkanja zdravil ter zagotavljanje vodilnega položaja Evrope na področju medicinskih inovacij so naši skupni cilji. Žal današnji predlogi spodkopavajo raziskave in razvoj v Evropi, hkrati pa ne naslavljajo dostopa do zdravil za bolnike.«
Hubertus von Baumbach, predsednik združenja EFPIA, je dejal: »Pozdravljamo ukrepe za prilagajanje evropskega regulativnega okvira na prihodnost in spodbuditev raziskav na področju novih načinov boja zoper protimikrobno odpornost. Revidirana zakonodaja naj bi povečala konkurenčnost Evrope, toda “neto” učinek v teh predlogih opisanih politik v sedanji obliki ogroža evropsko konkurenčnost, zmanjšuje privlačnost za naložbe v inovacije ter ovira evropsko znanost, raziskave in razvoj. Za dejansko uresničitev na bolnike osredotočenih ambicij EU na področju znanosti o življenju, je nujno opraviti celovito oceno učinkov revidirane farmacevtske zakonodaje na konkurenčnost.«
Nathalie Moll je nadaljevala: »V osnutku farmacevtske zakonodaje je opisan pristop s kaznovanjem inovacij, če zdravilo v dveh letih ni na voljo v vseh državah članicah. Ta je v osnovi zgrešen in za podjetja predstavlja nemogoč cilj. Znano je, da se velika večina zamud pri dostopu do novih zdravil pojavi po tem, ko podjetje odda vlogo za določitev cene in razvrstitev zdravila na listo ter čaka na odločitev, da bo novo zdravilo dostopno bolnikom. Za odpravo desetkratnih razlik v dostopu do novih zdravil v EU morajo vsi partnerji nemudoma sesti za skupno mizo in se lotiti reševanja dejanskih težav, ne pa sprejeti neuporabno zakonodajo na ravni EU, ki je obsojena na neuspeh.«
V prihodnjih mesecih bomo sodelovali s poslanci Evropskega parlamenta, Sveta in drugimi deležniki, da bi skupaj poskrbeli, da bo sveženj revidirane farmacevtske in patentne zakonodaje ustrezal potrebam bolnikov, zdravstvenim sistemom držav članic in evropskega sektorja znanosti o življenju.
Če sprememb ne bo, bo “zapuščina” te Komisije ta, da bo Evropa postala zgolj potrošnik medicinskih inovacij drugih regij, evropski bolniki pa bodo na najnovejše dosežke na področju zdravstva čakali dlje kot kdaj koli prej.
“,”Jaka Verbic Miklic”,1684258800,1684258800,sl,15349,306,15348,43,0,NULL,,”Farmacevtska zakonodaja EU tvega, da bo oslabila evropsko znanstveno industrijo in evropske paciente oddaljila od vrhunskega zdr”,farmacevtska-zakonodaja-eu-tvega-da-bo-oslabila-evropsko-znanstveno-industrijo-in-evropske-paciente-oddaljila-od-vrhunskega-zdra,Post,,1,0,1684258846,1684259226
992,15349,”EU pharma-legislation risks sabotaging Europe’s life science industry and putting European patients further away from the cutting-edge of healthcare.”,”EFPIA Response to the publication of the EU pharma legislation “,”
Brussels, 26 April 2023 Publication of the EU pharmaceutical legislation is an important milestone as the EU, Member States and industry strive to improve access to medicines and vaccines and reinvigorate science and innovation in Europe.
Nathalie Moll, Director General, EFPIA, said: “From its inception, EFPIA, its member Companies and Associations have supported the aims of the EU Pharmaceutical Strategy. Delivering faster, more equitable access to medicines, avoiding and mitigating shortages as well as ensuring that Europe can be a world leader in medical innovation are goals we share. Unfortunately, today’s proposals manage to undermine research and development in Europe while failing to address access to medicines for patients.”
Hubertus von Baumbach, President, EFPIA, said: “We welcome moves to future-proof Europe’s regulatory framework and stimulate research into new treatments to tackle AMR. Although the revised legislation was meant to improve Europe’s competitiveness, the ‘net’ impact of policies set out across these proposals, in their current form, puts European competitiveness at risk: overall, it weakens the attractiveness for investment in innovation and hampers European science, research and development. In order to truly realise a patient-focused EU life science ambition, it is vital that a comprehensive competitiveness check is conducted on the impact of the revised pharmaceutical legislation.”
Nathalie Moll continued. “The approach set out in the draft pharmaceutical legislation, penalising innovation if a medicine is not available in all Member States within two years is fundamentally flawed and represents an impossible target for companies. The vast majority of delays in access to new medicines are known to occur after a company has filed for pricing and reimbursement and is awaiting a decision so that the new treatment can be made available to patients. Fixing the tenfold variation in access to new medicines across the EU, requires all partners to urgently get round the table and address the real issues rather than unworkable EU-level legislation that is destined to fail.
Over the coming months, we are committed to working with Members of the European Parliament, Council and other stakeholders to ensure the revised pharmaceutical legislation and patent package meets the needs of patients, our healthcare systems, Member States and Europe’s life science sector.
If changes are not made “the legacy” of this Commission will be for Europe to be simply consumers of other region’s medical innovation, and European patients waiting longer than ever for the latest advances in care.”
“,”Jaka Verbic Mikklic”,1684258860,1684258860,en,15349,306,15348,43,0,NULL,,”Farmacevtska zakonodaja EU tvega, da bo oslabila evropsko znanstveno industrijo in evropske paciente oddaljila od vrhunskega zdr”,farmacevtska-zakonodaja-eu-tvega-da-bo-oslabila-evropsko-znanstveno-industrijo-in-evropske-paciente-oddaljila-od-vrhunskega-zdra,Post,,1,0,1684258846,1684259226
993,15351,”Strateška konferenca Vrednost inovacij: Zdravstvo, odporno na izzive prihodnosti”,”Kako prilagoditi zdravstveni sistem, da bo pripravljen na prihodnost”,”
Ljubljana, 30. maj 2023 – Kako zagotoviti, da bo naš zdravstveni sistem pripravljen na prihodnost, torej prožen, odziven in sposoben prilagoditve prihodnjim potrebam? Ker živimo v času globalnih zdravstvenih, ekonomskih in družbenih kriz, postaja koncept zdravstva, odpornega na krize, nujen. Zdravstvo moramo že sedaj prilagajati, to pa lahko naredimo na več različnih načinov. Nekaj od teh so tuji in domači govorci predstavili na 12. strateški konferenci Vrednost inovacij, ki je letos potekala pod geslom »Zdravstvo, odporno na izzive prihodnosti«.
Kot je v uvodnem nagovoru povedal član uprave Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ, Domen Groznik, lahko to dosežemo z integracijo najsodobnejših tehnologij in sodelovalnih modelov oskrbe. Kot pravi, bi na tak način stopili proti prihodnosti, v kateri bi zdravnikom pri njihovih odločitvah pomagale umetna inteligenca in genomske raziskave, s katerimi bi omogočili natančno diagnostiko in prilagajanje zdravljenja posamezniku. S tem se je strinjal tudi zdravstveni direktor na Copenhagen Institute for Future Studies Bogi Eliasen, in dodal, da se v zadnjem času raziskovalci osredotočajo predvsem na trajanje zdrave življenjske dobe in ne le celotne življenjske dobe posameznika, ter na zdravstveno oskrbo, ki se osredotoča na bolnike. Po njegovem na pomenu pridobiva preventiva: »Delo moramo usmeriti v povezovanje različnih vidikov zdravja in zdravstva med različnimi državami. Današnja razprava se osredotoča na izboljšanje zdravstva. Pomembno se je zavedati, da smo tu že naredili dolgo pot. Delati moramo prave stvari na pravi način. Ni enega samega odgovora, so pa izbire.« Poudaril je, da se znanje in izkušnje nanašajo na preteklost, odločitve pa na prihodnost. Razumeti moramo, da je vlaganje v zdravstvo investicija in ne strošek. »Pomembno je zagotoviti, da so ljudje čim dlje časa, čim bolj zdravi. Bolj zdrava populacija je ključna za vzdržno zdravstvo.«
Ricardo Baptista Leite, dr. med., glavni izvršni direktor The International Digital Health and Artificial Intelligence Research Collaborative v Ženevi, je na konferenci najprej predstavil portugalski zdravstveni sistem, ki se je uvrstil med 15 najboljših na svetu. Kot je dejal, so to dosegli tako, da so vlagali predvsem v kakovost usposabljanja. Srečujejo pa se, tako kot druge države, z demografskimi izzivi. Leta 2080 bo na Portugalskem manjši delež aktivne populacije kot bo znašal delež starejših od 65 let. »Imamo sistem pokojnin, v katerem aktivno prebivalstvo plačuje socialno varnost in jo starejša populacija potem prejema nazaj v obliki pokojnine. To ustvarja izziv nesorazmerja, ki se s časom in staranjem populacije povečuje. Pri vas v Sloveniji je nekoliko bolje, vendar se boste tudi vi v prihodnosti srečevali s podobnimi izzivi,« je dejal in dodal, da je zdravstvena oskrba temelj našega sistema, v katero moramo več vlagati. »Zmanjšati moramo breme bolezni. Zagotoviti moramo, da bolezni, ki jih je mogoče preprečiti preprečimo in bolezni, ki so ozdravljive, ozdravimo.« Po njegovem se mora zdravstvo prilagoditi in učiti uporabe novih orodij. Kot pravi se moramo osredotočiti na paciente in administrativno delo prepustiti digitalnim napravam. »Poskrbeti moramo za najboljši dostop do oskrbe. Preventiva in dobro počutje ljudi morata biti cilj vsega, kar počnemo.«
Eric Sutherland, vodja Digitalnega zdravsta pri OECD, je dejal, da potrebujemo sisteme, ki so stroškovno učinkoviti in trajnostni, nadgradljivi na različnih lokacijah in za različne ljudi, odzivni na spremembe in z nizkim tveganjem ter z boljšimi rezultati: »Namen inovacij je izboljšati in optimizirati rezultate zdravljenja. Integriran digitalni zdravstveni ekosistem prinaša boljše rezultate, saj je tak sistem stroškovno učinkovit, odziven in prilagodljiv. To dosežemo s predvidljivimi in prilagodljivimi procesi ter uporabo podatkov. Ključne ovire za inovacije tako niso tehnične, ampak izhajajo iz nezaupanja, odpora do sprememb in razdrobljenosti sistemov. Vse to lahko uspešno naslovimo s sodelovanjem, dobrim vodenjem in interoperabilnimi sistemi.« Po njegovem moramo biti osredotočeni na to kaj želimo izboljšati, kakšne podatke moramo zbrati in kako povezati sisteme, ki so ključni. Kot pravi Sutherland, lahko na tak način podatke pretvorimo v informacije, vpoglede in ustrezne ukrepe. In ko to počnemo znova in znova ter aktivno uporabljamo stvari, ki smo jih že naredili, lahko ustvarimo boljši zdravstveni ekosistem.
Na konferenci je potekala tudi okrogla miza z naslovom »Slovenija kot del prožne, vzdržne in na prihodnost pripravljene Evropske unije«, ki jo je moderirala izr. prof. dr. Petra Došenović Bonča, predstojnica Katedre za ekonomijo na Ekonomski fakulteti Univerze v Ljubljani. Tanja Španić, predsednica Združenja Europa Donna Slovenija in predsednica Evropske zveze za raka dojk – Europa Donna je dejala, da bolnik vse prepogosto postane samo diagnoza, šifra in da je potrebno obravnavati osebo v celoti, ne le diagnoze: »K temu se premikamo, imamo tudi primere dobrih praks v Sloveniji. Zagotovo se največ spreminja pri redkih boleznih. Nekje moramo začeti in iti korak za korakom, s tem kar trenutno imamo. Uporabniki smo vsi, danes jaz, jutri vi. Dokler ne zboliš ne veš, kaj zdravstveni sistem je in kaj ponuja.« Prim. mag. Dorijan Marušič, mednarodni svetovalec na področju zdravstva, je dejal da smo zdaj spoznali, da le ni tako velikega razkoraka med Slovenijo in mednarodnim prostorom: »Moramo začeti spreminjati besede, komunikacijo, investirati v zdravje, stimulirati državljane in državljanke ter se prilagoditi njihovemu načinu razmišljanja o zdravju. Slovenci smo najslabši v zadovoljstvu s svojim zdravjem, čeprav smo primerjalno in realno kar zdrava populacija. Pacient mora postati enakovreden partner v procesu zdravljenja, osredotočiti se moramo nanj in začeti meriti rezultate.« S tem se strinja tudi Metka Zaletel, predstojnica Zdravstveno podatkovnega centra Nacionalnega inštituta za javno zdravje (NIJZ), ki je omenila, da je Slovenija trenutno v fazi novega zakona o digitalizaciji, zato težko napove kakšna bo prihodnost. »Podatkov je v Sloveniji ogromno; trenutno še obstajajo – enako kot v drugih državah – informacijske luknje, ko nekaterim potrebam po podatkih še ne moremo zadostiti, vendar so te luknje relativno majhne in jih v večini primerov lahko nadomestimo z ocenami na podlagi modelov drugih držav. Dileme, s katerimi se soočamo vsakodnevno, in se navezujejo na kakovost podatkov, razpoložljivost podatkov in metodološko primerljivost podatkov, so večinoma rešljive, vendar le ob sodelovanju vseh deležnikov in uporabnikov podatkov. Evropski prostor zdravstvenih podatkov (EHDS) teh dilem ne bo razrešil, ampak bo pripomogel k večji uporabi in izkoriščenju raziskovalne moči slovenskih podatkov,« je še dejala. Mircha Poldrugovac, iz Centra za zdravstveno varstvo NIJZ je ob tem dodal, da velikokrat pričakujemo da bo skupnost poskrbela za nas, a moramo spodbujati vsakega izmed nas da prevzame tudi težo odgovornosti. Po njegovem je ključno, da se vsak od nas vpraša, kaj lahko naredimo kot posamezniki znotraj svojega okolja, da izboljšamo stanje. »Le tako bomo prepoznali, da sta medsebojno zaupanje in prevzem so-odgovornosti za celoten sistem nujna za uspešno in učinkovito uvajanje sprememb v zdravstvenem sistemu.« Simon Rekanović, dr. med. je še dejal, da je zdravstvo evolucija, proces sprememb, ki se dogajajo s pomočjo tehnologije, ki nam je na voljo. Po njegovem bi se morali manj ukvarjati s tem, da smo znotraj procesa digitalizacije oziroma inoviranja, ampak se dejansko vprašati kaj lahko naredimo – in to tudi narediti. Izr. prof. dr. Došenović Bonča je ob zaključku dejala: »Iskali smo odgovore na vprašanja, kaj potrebujemo, da bi pripravili naš zdravstveni sistem na izzive prihodnosti. Pokazali smo, da je finančna vzdržnost zgolj osnovni pogoj in da je ključno zagotavljanje ustreznega obsega visoko kompetentnih in zavzetih zaposlenih v zdravstvu ter v vseh podpornih in regulatornih organizacijah. Strategija zdravstva je po definiciji deležniška in kot taka zahteva partnerstvo, zaupanje in konstruktivno sodelovanje, saj brez tega ni mogoče zagotoviti fleksibilnega zdravstvenega sistema, ki se hitro odziva na potrebe bolnikov in zdravstvene izzive celotne družbe.«
“,”Jaka Verbic Miklic”,1685980500,1685980500,sl,15351,306,15350,43,0,NULL,,12.strateska,12-strateska,Post,”/sites/43/files/images/Fokus/Vrednost inovacij/12.strateska/12.strateska web.jpg”,1,0,1685980718,1686508831
994,15351,”12th Value of Innovation strategic conference: How to adapt the Healthcare system to be Future-proof”,”We must focus our work on connecting different aspects of health and healthcare between different countries”,”
Ljubljana, May 30th, 2023 – How to ensure that our healthcare system will be prepared for the future, i.e. flexible, responsive and able to adapt to future needs? As we live in a time of global health, economic and social crises, the concept of crisis-resilient healthcare is becoming imperative. We already have to adapt healthcare, and we can do this in several different ways. Some of these were presented by foreign and domestic speakers at the 12th Strategic conference Value of Innovation, which this year was held under the motto “Future-proof Healthcare”.
As Domen Groznik, member of the board of the Forum of International Research and Development Pharmaceutical Companies, EIG, said in his opening address, we can achieve this by integrating state-of-the-art technologies and collaborative models of care. As he says, in this way, we would be stepping towards a future in which artificial intelligence and genomic research would help doctors in their decisions, enabling accurate diagnostics and tailoring treatment to the individual. The director of Health at Copenhagen Institute for Future Studies, Bogi Eliasen, agreed with this, adding that recently researchers are focusing mainly on the duration of a healthy life span and not just the entire life span of an individual, and on health care that focuses on patients. According to him, prevention is gaining importance: “We must focus our work on connecting different aspects of health and healthcare between different countries. Today’s discussion focuses on improving healthcare. It is important to realize that we have already come a long way here. We must do the right things in the right way. There is no single answer, but there are choices.” He emphasized that knowledge and experience relate to the past, and decisions to the future. We must understand that investing in healthcare is an investment and not an expense. “It is important to ensure that people are as healthy as possible for as long as possible. A healthier population is key to sustainable healthcare.”
Ricardo Baptista Leite, MP MD, CEO of IDAIR, The International Digital Health and Artificial Intelligence Research Collaborative in Geneva, firstly showed the Portuguese health system, which ranked among the 15 best in the world. As he said, they achieved this by investing primarily in the quality of education. However, like other countries, they face demographic challenges. In 2080, the share of the active population in Portugal will be smaller than the share of people over 65 years of age. “We have a pension system in which the active population pays social security and the older population then receives it back in the form of a pension. This creates the challenge of a disparity that increases with time and the aging of the population. Things are a bit better here in Slovenia, but you too will face similar challenges in the future,” he said, adding that health care is the foundation of our system, in which we need to invest more. “We need to reduce the burden of disease. We must ensure that preventable diseases are prevented and curable diseases are cured.” According to him, healthcare must adapt and learn to use new tools. As he says, we need to focus on patients and leave administrative work to digital devices. “We need to ensure the best access to care. Prevention and people’s well-being must be the goal of everything we do.”
Eric Sutherland, Leader of Digital Health at the OECD, said that we need systems that are cost-effective and sustainable, scalable in different locations and for different people, responsive to changes and with low risk and better outcomes: “The purpose of innovation is to improve and optimize treatment results. An integrated digital health ecosystem brings better results, as such a system is cost-effective, responsive, and flexible. We achieve this through predictable and flexible processes and the use of data. The key barriers to innovation are thus not technical, but stem from mistrust, resistance to change and fragmentation of systems. All of this can be successfully addressed through cooperation, good management and interoperable systems.” According to him, we need to be focused on what we want to improve, what data we need to collect and how to connect the key systems. According to Sutherland, this way we can turn data into information, insights and relevant actions. And when we do that over and over and actively use the things we’ve already done, we can create a better health ecosystem.
The conference also featured a round table entitled “Slovenia as part of a flexible, sustainable and future-ready European Union”, moderated by assoc. prof. dr. Petra Došenović Bonča, Head of the Department of Economics at the Faculty of Economics of the University of Ljubljana. Tanja Španić, President of the Association Europa Donna Slovenia and President of the European Association for Breast Cancer – Europa Donna, said that patients to often become just a diagnosis, a code, and that it is necessary to treat the person as a whole, not just the diagnosis: “We are moving towards this, we have also examples of good practices in Slovenia. The changes are most seen in rare diseases. We have to start somewhere and go step by step with what we currently have. We are all users, today me, tomorrow you. Until you get sick, you don’t know what the health system is and what it offers.” Cf. MSc Dorijan Marušič, international healthcare adviser, said that we have now realized that there is not such a big gap between Slovenia and the international space: “We need to start changing words, communication, invest in health, stimulate citizens and adapt to their way of thinking about health. Slovenians are the worst in terms of satisfaction with their health, even though we are comparatively and realistically quite a healthy population. The patient must become an equal partner in the treatment process, we must focus on him and start measuring results.” Metka Zaletel, head of the Health Data Center of the National Institute of Public Health (NIJZ), agrees with this, as she mentioned that Slovenia is currently in the phase of the new digitization law, so it is difficult to predict what the future will be like. “There is a lot of data in Slovenia; currently there are still – as in other countries – information gaps when we cannot yet meet some data needs, but these gaps are relatively small and in most cases they can be replaced by estimates based on other countries’ models. The dilemmas we face on a daily basis, which are related to data quality, data availability and methodological comparability of data, are mostly solvable, but only with the cooperation of all stakeholders and data users. The European Health Data Area (EHDS) will not resolve these dilemmas, but will help to increase the use and utilization of the research power of Slovenian data,” she added. Mircha Poldrugovac, from the NIJZ Center for Health Care, added that we often expect the community to take care of us, but we must encourage each of us to also take on the weight of responsibility. According to him, the key is for each of us to ask ourselves what we can do as individuals within our community to improve the situation. “Only in this way we will recognize that mutual trust and co-responsibility for the entire system are necessary for the successful and efficient introduction of changes in the healthcare system.” Simon Rekanović, MP MD also said that healthcare is an evolution, a process of change that takes place with the help of the technology available to us. According to him, we should be less concerned with the fact that we are in the process of digitization or innovation, but actually ask ourselves what we can do – and do it. For conclusion, assoc. prof. dr. Došenović Bonča said: “We were looking for answers to the questions of what we need in order to prepare our health system for future challenges. We have shown that financial sustainability is only a basic condition and that the key is to ensure an adequate number of highly competent and committed employees in healthcare and in all supporting and regulatory organizations. The healthcare strategy is by definition stakeholder-based and as such requires partnership, trust and constructive cooperation, because without this it is not possible to ensure a flexible healthcare system that responds quickly to the needs of patients and the healthcare challenges of the entire society.”
“,,1685472000,1685472000,en,15351,306,15350,43,0,NULL,,12.strateska,12-strateska,Post,”/sites/43/files/images/Fokus/Vrednost inovacij/12.strateska/12.strateska web.jpg”,1,0,1685980718,1686508831
995,15359,”Strateška konferenca Vrednost inovacij: Zdravstvo, odporno na izzive prihodnosti”,”Kako prilagoditi zdravstveni sistem, da bo pripravljen na prihodnost”,”
Ljubljana, 30. maj 2023 – Kako zagotoviti, da bo naš zdravstveni sistem pripravljen na prihodnost, torej prožen, odziven in sposoben prilagoditve prihodnjim potrebam? Ker živimo v času globalnih zdravstvenih, ekonomskih in družbenih kriz, postaja koncept zdravstva, odpornega na krize, nujen. Zdravstvo moramo že sedaj prilagajati, to pa lahko naredimo na več različnih načinov. Nekaj od teh so tuji in domači govorci predstavili na 12. strateški konferenci Vrednost inovacij, ki je letos potekala pod geslom »Zdravstvo, odporno na izzive prihodnosti«.
Kot je v uvodnem nagovoru povedal član uprave Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ, Domen Groznik, lahko to dosežemo z integracijo najsodobnejših tehnologij in sodelovalnih modelov oskrbe. Kot pravi, bi na tak način stopili proti prihodnosti, v kateri bi zdravnikom pri njihovih odločitvah pomagale umetna inteligenca in genomske raziskave, s katerimi bi omogočili natančno diagnostiko in prilagajanje zdravljenja posamezniku. S tem se je strinjal tudi zdravstveni direktor na Copenhagen Institute for Future Studies Bogi Eliasen, in dodal, da se v zadnjem času raziskovalci osredotočajo predvsem na trajanje zdrave življenjske dobe in ne le celotne življenjske dobe posameznika, ter na zdravstveno oskrbo, ki se osredotoča na bolnike. Po njegovem na pomenu pridobiva preventiva: »Delo moramo usmeriti v povezovanje različnih vidikov zdravja in zdravstva med različnimi državami. Današnja razprava se osredotoča na izboljšanje zdravstva. Pomembno se je zavedati, da smo tu že naredili dolgo pot. Delati moramo prave stvari na pravi način. Ni enega samega odgovora, so pa izbire.« Poudaril je, da se znanje in izkušnje nanašajo na preteklost, odločitve pa na prihodnost. Razumeti moramo, da je vlaganje v zdravstvo investicija in ne strošek. »Pomembno je zagotoviti, da so ljudje čim dlje časa, čim bolj zdravi. Bolj zdrava populacija je ključna za vzdržno zdravstvo.«
Ricardo Baptista Leite, dr. med., glavni izvršni direktor The International Digital Health and Artificial Intelligence Research Collaborative v Ženevi, je na konferenci najprej predstavil portugalski zdravstveni sistem, ki se je uvrstil med 15 najboljših na svetu. Kot je dejal, so to dosegli tako, da so vlagali predvsem v kakovost usposabljanja. Srečujejo pa se, tako kot druge države, z demografskimi izzivi. Leta 2080 bo na Portugalskem manjši delež aktivne populacije kot bo znašal delež starejših od 65 let. »Imamo sistem pokojnin, v katerem aktivno prebivalstvo plačuje socialno varnost in jo starejša populacija potem prejema nazaj v obliki pokojnine. To ustvarja izziv nesorazmerja, ki se s časom in staranjem populacije povečuje. Pri vas v Sloveniji je nekoliko bolje, vendar se boste tudi vi v prihodnosti srečevali s podobnimi izzivi,« je dejal in dodal, da je zdravstvena oskrba temelj našega sistema, v katero moramo več vlagati. »Zmanjšati moramo breme bolezni. Zagotoviti moramo, da bolezni, ki jih je mogoče preprečiti preprečimo in bolezni, ki so ozdravljive, ozdravimo.« Po njegovem se mora zdravstvo prilagoditi in učiti uporabe novih orodij. Kot pravi se moramo osredotočiti na paciente in administrativno delo prepustiti digitalnim napravam. »Poskrbeti moramo za najboljši dostop do oskrbe. Preventiva in dobro počutje ljudi morata biti cilj vsega, kar počnemo.«
Eric Sutherland, vodja Digitalnega zdravsta pri OECD, je dejal, da potrebujemo sisteme, ki so stroškovno učinkoviti in trajnostni, nadgradljivi na različnih lokacijah in za različne ljudi, odzivni na spremembe in z nizkim tveganjem ter z boljšimi rezultati: »Namen inovacij je izboljšati in optimizirati rezultate zdravljenja. Integriran digitalni zdravstveni ekosistem prinaša boljše rezultate, saj je tak sistem stroškovno učinkovit, odziven in prilagodljiv. To dosežemo s predvidljivimi in prilagodljivimi procesi ter uporabo podatkov. Ključne ovire za inovacije tako niso tehnične, ampak izhajajo iz nezaupanja, odpora do sprememb in razdrobljenosti sistemov. Vse to lahko uspešno naslovimo s sodelovanjem, dobrim vodenjem in interoperabilnimi sistemi.« Po njegovem moramo biti osredotočeni na to kaj želimo izboljšati, kakšne podatke moramo zbrati in kako povezati sisteme, ki so ključni. Kot pravi Sutherland, lahko na tak način podatke pretvorimo v informacije, vpoglede in ustrezne ukrepe. In ko to počnemo znova in znova ter aktivno uporabljamo stvari, ki smo jih že naredili, lahko ustvarimo boljši zdravstveni ekosistem.
Na konferenci je potekala tudi okrogla miza z naslovom »Slovenija kot del prožne, vzdržne in na prihodnost pripravljene Evropske unije«, ki jo je moderirala izr. prof. dr. Petra Došenović Bonča, predstojnica Katedre za ekonomijo na Ekonomski fakulteti Univerze v Ljubljani. Tanja Španić, predsednica Združenja Europa Donna Slovenija in predsednica Evropske zveze za raka dojk – Europa Donna je dejala, da bolnik vse prepogosto postane samo diagnoza, šifra in da je potrebno obravnavati osebo v celoti, ne le diagnoze: »K temu se premikamo, imamo tudi primere dobrih praks v Sloveniji. Zagotovo se največ spreminja pri redkih boleznih. Nekje moramo začeti in iti korak za korakom, s tem kar trenutno imamo. Uporabniki smo vsi, danes jaz, jutri vi. Dokler ne zboliš ne veš, kaj zdravstveni sistem je in kaj ponuja.« Prim. mag. Dorijan Marušič, mednarodni svetovalec na področju zdravstva, je dejal da smo zdaj spoznali, da le ni tako velikega razkoraka med Slovenijo in mednarodnim prostorom: »Moramo začeti spreminjati besede, komunikacijo, investirati v zdravje, stimulirati državljane in državljanke ter se prilagoditi njihovemu načinu razmišljanja o zdravju. Slovenci smo najslabši v zadovoljstvu s svojim zdravjem, čeprav smo primerjalno in realno kar zdrava populacija. Pacient mora postati enakovreden partner v procesu zdravljenja, osredotočiti se moramo nanj in začeti meriti rezultate.« S tem se strinja tudi Metka Zaletel, predstojnica Zdravstveno podatkovnega centra Nacionalnega inštituta za javno zdravje (NIJZ), ki je omenila, da je Slovenija trenutno v fazi novega zakona o digitalizaciji, zato težko napove kakšna bo prihodnost. »Podatkov je v Sloveniji ogromno; trenutno še obstajajo – enako kot v drugih državah – informacijske luknje, ko nekaterim potrebam po podatkih še ne moremo zadostiti, vendar so te luknje relativno majhne in jih v večini primerov lahko nadomestimo z ocenami na podlagi modelov drugih držav. Dileme, s katerimi se soočamo vsakodnevno, in se navezujejo na kakovost podatkov, razpoložljivost podatkov in metodološko primerljivost podatkov, so večinoma rešljive, vendar le ob sodelovanju vseh deležnikov in uporabnikov podatkov. Evropski prostor zdravstvenih podatkov (EHDS) teh dilem ne bo razrešil, ampak bo pripomogel k večji uporabi in izkoriščenju raziskovalne moči slovenskih podatkov,« je še dejala. Mircha Poldrugovac, iz Centra za zdravstveno varstvo NIJZ je ob tem dodal, da velikokrat pričakujemo da bo skupnost poskrbela za nas, a moramo spodbujati vsakega izmed nas da prevzame tudi težo odgovornosti. Po njegovem je ključno, da se vsak od nas vpraša, kaj lahko naredimo kot posamezniki znotraj svojega okolja, da izboljšamo stanje. »Le tako bomo prepoznali, da sta medsebojno zaupanje in prevzem so-odgovornosti za celoten sistem nujna za uspešno in učinkovito uvajanje sprememb v zdravstvenem sistemu.« Simon Rekanović, dr. med. je še dejal, da je zdravstvo evolucija, proces sprememb, ki se dogajajo s pomočjo tehnologije, ki nam je na voljo. Po njegovem bi se morali manj ukvarjati s tem, da smo znotraj procesa digitalizacije oziroma inoviranja, ampak se dejansko vprašati kaj lahko naredimo – in to tudi narediti. Izr. prof. dr. Došenović Bonča je ob zaključku dejala: »Iskali smo odgovore na vprašanja, kaj potrebujemo, da bi pripravili naš zdravstveni sistem na izzive prihodnosti. Pokazali smo, da je finančna vzdržnost zgolj osnovni pogoj in da je ključno zagotavljanje ustreznega obsega visoko kompetentnih in zavzetih zaposlenih v zdravstvu ter v vseh podpornih in regulatornih organizacijah. Strategija zdravstva je po definiciji deležniška in kot taka zahteva partnerstvo, zaupanje in konstruktivno sodelovanje, saj brez tega ni mogoče zagotoviti fleksibilnega zdravstvenega sistema, ki se hitro odziva na potrebe bolnikov in zdravstvene izzive celotne družbe.«
“,”Jaka Verbic Miklic”,1686509040,1686509040,sl,15359,306,15355,43,0,NULL,,12.strateska,12-strateska,Post,”/sites/43/files/images/Fokus/Vrednost inovacij/12.strateska/12.strateska web.jpg”,1,0,1686509157,1686509353
996,15359,”12th Value of Innovation strategic conference: How to adapt the Healthcare system to be Future-proof”,”We must focus our work on connecting different aspects of health and healthcare between different countries”,”
Ljubljana, May 30th, 2023 – How to ensure that our healthcare system will be prepared for the future, i.e. flexible, responsive and able to adapt to future needs? As we live in a time of global health, economic and social crises, the concept of crisis-resilient healthcare is becoming imperative. We already have to adapt healthcare, and we can do this in several different ways. Some of these were presented by foreign and domestic speakers at the 12th Strategic conference Value of Innovation, which this year was held under the motto “Future-proof Healthcare”.
As Domen Groznik, member of the board of the Forum of International Research and Development Pharmaceutical Companies, EIG, said in his opening address, we can achieve this by integrating state-of-the-art technologies and collaborative models of care. As he says, in this way, we would be stepping towards a future in which artificial intelligence and genomic research would help doctors in their decisions, enabling accurate diagnostics and tailoring treatment to the individual. The director of Health at Copenhagen Institute for Future Studies, Bogi Eliasen, agreed with this, adding that recently researchers are focusing mainly on the duration of a healthy life span and not just the entire life span of an individual, and on health care that focuses on patients. According to him, prevention is gaining importance: “We must focus our work on connecting different aspects of health and healthcare between different countries. Today’s discussion focuses on improving healthcare. It is important to realize that we have already come a long way here. We must do the right things in the right way. There is no single answer, but there are choices.” He emphasized that knowledge and experience relate to the past, and decisions to the future. We must understand that investing in healthcare is an investment and not an expense. “It is important to ensure that people are as healthy as possible for as long as possible. A healthier population is key to sustainable healthcare.”
Ricardo Baptista Leite, MP MD, CEO of IDAIR, The International Digital Health and Artificial Intelligence Research Collaborative in Geneva, firstly showed the Portuguese health system, which ranked among the 15 best in the world. As he said, they achieved this by investing primarily in the quality of education. However, like other countries, they face demographic challenges. In 2080, the share of the active population in Portugal will be smaller than the share of people over 65 years of age. “We have a pension system in which the active population pays social security and the older population then receives it back in the form of a pension. This creates the challenge of a disparity that increases with time and the aging of the population. Things are a bit better here in Slovenia, but you too will face similar challenges in the future,” he said, adding that health care is the foundation of our system, in which we need to invest more. “We need to reduce the burden of disease. We must ensure that preventable diseases are prevented and curable diseases are cured.” According to him, healthcare must adapt and learn to use new tools. As he says, we need to focus on patients and leave administrative work to digital devices. “We need to ensure the best access to care. Prevention and people’s well-being must be the goal of everything we do.”
Eric Sutherland, Leader of Digital Health at the OECD, said that we need systems that are cost-effective and sustainable, scalable in different locations and for different people, responsive to changes and with low risk and better outcomes: “The purpose of innovation is to improve and optimize treatment results. An integrated digital health ecosystem brings better results, as such a system is cost-effective, responsive, and flexible. We achieve this through predictable and flexible processes and the use of data. The key barriers to innovation are thus not technical, but stem from mistrust, resistance to change and fragmentation of systems. All of this can be successfully addressed through cooperation, good management and interoperable systems.” According to him, we need to be focused on what we want to improve, what data we need to collect and how to connect the key systems. According to Sutherland, this way we can turn data into information, insights and relevant actions. And when we do that over and over and actively use the things we’ve already done, we can create a better health ecosystem.
The conference also featured a round table entitled “Slovenia as part of a flexible, sustainable and future-ready European Union”, moderated by assoc. prof. dr. Petra Došenović Bonča, Head of the Department of Economics at the Faculty of Economics of the University of Ljubljana. Tanja Španić, President of the Association Europa Donna Slovenia and President of the European Association for Breast Cancer – Europa Donna, said that patients to often become just a diagnosis, a code, and that it is necessary to treat the person as a whole, not just the diagnosis: “We are moving towards this, we have also examples of good practices in Slovenia. The changes are most seen in rare diseases. We have to start somewhere and go step by step with what we currently have. We are all users, today me, tomorrow you. Until you get sick, you don’t know what the health system is and what it offers.” Cf. MSc Dorijan Marušič, international healthcare adviser, said that we have now realized that there is not such a big gap between Slovenia and the international space: “We need to start changing words, communication, invest in health, stimulate citizens and adapt to their way of thinking about health. Slovenians are the worst in terms of satisfaction with their health, even though we are comparatively and realistically quite a healthy population. The patient must become an equal partner in the treatment process, we must focus on him and start measuring results.” Metka Zaletel, head of the Health Data Center of the National Institute of Public Health (NIJZ), agrees with this, as she mentioned that Slovenia is currently in the phase of the new digitization law, so it is difficult to predict what the future will be like. “There is a lot of data in Slovenia; currently there are still – as in other countries – information gaps when we cannot yet meet some data needs, but these gaps are relatively small and in most cases they can be replaced by estimates based on other countries’ models. The dilemmas we face on a daily basis, which are related to data quality, data availability and methodological comparability of data, are mostly solvable, but only with the cooperation of all stakeholders and data users. The European Health Data Area (EHDS) will not resolve these dilemmas, but will help to increase the use and utilization of the research power of Slovenian data,” she added. Mircha Poldrugovac, from the NIJZ Center for Health Care, added that we often expect the community to take care of us, but we must encourage each of us to also take on the weight of responsibility. According to him, the key is for each of us to ask ourselves what we can do as individuals within our community to improve the situation. “Only in this way we will recognize that mutual trust and co-responsibility for the entire system are necessary for the successful and efficient introduction of changes in the healthcare system.” Simon Rekanović, MP MD also said that healthcare is an evolution, a process of change that takes place with the help of the technology available to us. According to him, we should be less concerned with the fact that we are in the process of digitization or innovation, but actually ask ourselves what we can do – and do it. For conclusion, assoc. prof. dr. Došenović Bonča said: “We were looking for answers to the questions of what we need in order to prepare our health system for future challenges. We have shown that financial sustainability is only a basic condition and that the key is to ensure an adequate number of highly competent and committed employees in healthcare and in all supporting and regulatory organizations. The healthcare strategy is by definition stakeholder-based and as such requires partnership, trust and constructive cooperation, because without this it is not possible to ensure a flexible healthcare system that responds quickly to the needs of patients and the healthcare challenges of the entire society.”
“,”Jaka Miklic”,1686509280,1686509280,en,15359,306,15355,43,0,NULL,,12.strateska,12-strateska,Post,”/sites/43/files/images/Fokus/Vrednost inovacij/12.strateska/12.strateska web.jpg”,1,0,1686509157,1686509353
997,15361,”Javna objava prenosov vrednosti ZD, ZO in DB 2022″,”Objava zajema podatke o prenosih vrednosti v preteklem koledarskem letu 2022″,”
JAVNA OBJAVA PRENOSOV VREDNOSTI ZDRAVSTVENIM DELAVCEM, ZDRAVSTVENIM ORGANIZACIJAM IN DRUŠTVOM BOLNIKOV S STRANI FARMACEVTSKIH DRUŽB
Po enotnem Kodeksu ravnanja (v nadaljevanju Kodeks), ki je veljaven od 1.1.2021 in združuje prejšnje tri Kodekse (Kodeks Transparentnosti, Kodeks sodelovanja z zdravstvenimi delavci in Kodeks sodelovanja z društvi bolnikov), bodo članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ (v nadaljevanju FarmaForum) tudi v letošnjem letu javno objavile prenose vrednosti zdravstvenim delavcem, zdravstvenim organizacijam in društvom bolnikov.
Kot določa enotni Kodeks, bodo podatke objavile do vključno 30. junija 2023.
Objava zajema podatke o prenosih vrednosti v preteklem koledarskem letu in na spletnih straneh posameznih članic ponuja vpogled v prenose v obdobju od 1. januarja do 31. decembra 2022. Po določilih zveze EFPIA (evropska zveza farmacevtskih industrij in združenj) se podatki javno objavljajo periodično, vsako leto, najkasneje do konca meseca junija, in sicer za preteklo koledarsko leto.
O javni objavi prenosov vrednosti
Javna objava prenosov vrednosti vključuje podatke o vrednostih vseh sredstev, ki so jih prejeli posamezni zdravstveni delavci, zdravstvene organizacije in društva bolnikov s katerimi sodelujejo posamezne članice FarmaForuma ali FarmaForum – bodisi neposredno ali prek tretjih oseb, kot so agencije za organizacijo dogodkov. Javna objava vsebuje tudi informacije o vrsti dejavnosti ali tipu podpore:
za izobraževanje,
za kritje stroškov, povezanih z izobraževalnimi oziroma strokovnimi dogodki,
za storitve in svetovanje,
za raziskave in razvoj ter
donacije.
Te prenose vsaka članica FarmaForuma objavi v slovenskem jeziku na svoji lokalni, regijski ali mednarodni spletni strani.
Individualne in skupinske objave
Vsi prenosi zdravstvenim organizacijam, kamor se po Kodeksu ravnanja uvrščajo javne zdravstvene institucije, zdravniška društva, združenja, zbornice in zasebna podjetja (d.o.o. in s.p.), so skladno z zakonodajo objavljeni individualno s polnim nazivom prejemnika.
Pri prenosih vrednosti posameznim zdravstvenim delavcem, fizičnim osebam, je objava v skladu z Zakonom o varstvu osebnih podatkov mogoča samo na podlagi predhodnega pisnega soglasja zdravstvenega delavca. V nasprotnem primeru se prenos objavi v skupinski obliki, pri čemer je v vsaki kategoriji navedeno število prejemnikov ter skupni znesek dodeljen tovrstnim prejemnikom.
Podatki o plačilih na področju raziskav in razvoja zaradi varstva konkurence ter inovacij, ki jih razvijajo posamezne družbe, skladno z zakonodajo, ne morejo biti objavljeni drugače kot v skupinski obliki.
Izjava o omejitvi odgovornosti
Podatki, objavljeni v tem poročilu, so izraz prizadevanj FarmaForuma za ravnanje skladno z zahtevami Kodeksa ravnanja in zveze EFPIA. Če se kljub našim prizadevanjem za zagotovitev natančnih objav zgodi, da poročilo vsebuje nepopolne ali netočne podatke, bomo to raziskali in morebitne napačne podatke ustrezno popravili.
PODATKI O PRENOSU VREDNOSTI ZDRAVSTVENIM DELAVCEM, ZDRAVSTVENIM ORGANIZACIJAM IN DRUŠTVOM BOLNIKOV S STRANI MEDNARODNEGA FORUMA ZNANSTVENORAZISKOVALNIH FARMACEVTSKIH DRUŽB, GIZ, ZA LETO 2022
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ, je v koledarskem letu 2022 sodeloval z različnimi organizacijami: sponzorsko je podprl aktivnosti Slovenskega zdravniškega društva, dvanajstim organizacijam je poravnal stroške povezane z izvajanjem storitev in svetovanjem. Izplačana je bila ena donacija.
Skupna vrednost prenosov FarmaForuma zdravstvenim organizacijam je v letu 2022 znašala 84.289,50 EUR. V letu 2022 ni bil izveden noben prenos na zdravstvene delavce. Vrednost prenosov društvom bolnikov je znašala 16.290 EUR.
Metodologija
Javno objavljeni podatki zajemajo prenose vrednosti, ki so bili v finančnem sistemu FarmaForuma dejansko izvršeni v koledarskem letu 2022, to je od vključno 1. januarja 2022 do vključno 31. decembra 2022.
Prenosi zdravstvenim organizacijam in društvom bolnikov so navedeni kot neto zneski tovrstnih pogodb, ki ne vključujejo DDV. Prenosi vrednosti sredstev zdravstvenim delavcem se navajajo v bruto zneskih.
V letu 2022 ni bil izveden noben prenos vrednosti na zdravstvene delavce.
Vsi navedeni zneski predstavljajo skupne vrednosti za leto 2022.
Vse navedene transakcije so bile izvršene v koledarskem letu 2022, torej od vključno 1. januarja 2022 do vključno 31. decembra 2022.
Skladno s Kodeksom ravnanja je zdravstvena organizacija (ZO) opredeljena kot:
vsak samostojni podjetnik (s. p.) ali
pravna oseba,
(i) ki je zdravstveno, medicinsko ali znanstveno združenje oziroma organizacija (ne glede na pravno ali organizacijsko obliko), kot so bolnice, klinike, fundacije, univerze ali druge izobraževalne ustanove ali akademska združenja (razen društev bolnikov v okviru 21. člena tega Kodeksa) ali
(ii) preko katere eden ali več ZD izvaja storitve.
Zdravstvene delavce (ZD) Kodeks ravnanja opredeljuje kot:
vsaka fizična oseba, ki je članica zdravstvene, zobozdravstvene, farmacevtske ali negovalne stroke, in vse druge osebe, ki lahko pri opravljanju svojih poklicnih dejavnosti predpišejo, kupijo, dobavijo, priporočajo ali odmerijo zdravilo in katerih primarna praksa, naslov glavne poklicne dejavnosti ali sedež je v Evropi.
Za namen tega Kodeksa, definicija ZD vključuje:
(i) uradnika ali zaposlenega v vladni agenciji ali drugi organizaciji (ne glede na to ali je v zasebnem ali javnem sektorju), ki lahko predpiše, kupi, dobavi, priporoča ali odmeri zdravila in
(ii) zaposleno osebo pri članici EFPIA-e ali Forumu, katere primarni poklic je zdravstveni poklic, vendar pa izključuje
(x) ostale zaposlene pri članici EFPIA-e ali FarmaForumu ter
(y) prodajalce na debelo in distributerje zdravil.
Skladno s Kodeksom ravnanja je društvo bolnikov (DB) opredeljeno kot:
nepridobitna pravna oseba/subjekt (vključno s krovno organizacijo, ki ji pripada), ki jo v glavnem sestavljajo bolniki in/ali negovalci in ki zastopa in/ali podpira potrebe bolnikov in/ali negovalcev ter katere poslovni naslov, kraj ustanovitve ali primarni kraj delovanja je v Evropi.
Kodeks ravnanja je v celoti dostopen na: https://www.farmaforum.si/sl/o-forumu/kodeksi/forumov-kodeks-ravnanja
“,”Jaka Verbic Miklic”,1686992580,1686992580,sl,15361,306,15360,43,0,NULL,,”Javna objava prenosov vrednosti ZD in ZO 2022″,javna-objava-prenosov-vrednosti-zd-in-zo-2022,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1686992654,1687156201
998,15361,”Public disclosure of transfers in 2022″,”Public notice on transfers of value from pharmaceutical companies to healthcare professionals and healthcare organizations”,”
PUBLIC NOTICE ON TRANSFERS OF VALUE FROM PHARMACEUTICAL COMPANIES TO HEALTHCARE PROFESSIONALS, HEALTHCARE ORGANIZATIONS AND PATIENT ORGANIZATIONS
According to the consolidated Code of Practice (hereinafter the Code), which is valid from 1.1.2021 and combines the previous three Codes (Code of Transparency, Code of Cooperation with Healthcare Professionals and Code of Cooperation with Patients’ Associations), members of the International Forum of Pharmaceutical Research Societies hereinafter referred to as the FarmaForum), this year also announced the transfer of value to healthcare professionals, healthcare organizations and patient associations. As stipulated by the consolidated Code, the data will be published by 30 June 2023 inclusive.
The publication includes data on transfers of value in the previous calendar year and provides disclosure of transfer in the period from 1 January to 31 December 2022 on the websites of individual member company. According to the EFPIA (European Federation of Pharmaceutical Industries and Associations) provisions, the data are made public periodically, each year, by the end of June at the latest, for the previous calendar year.
About public disclosure of transfers of value
Public disclosure of transfers of value includes data on the value of all funds received by individual healthcare professional, healthcare organization or patient organization that collaborate with individual FarmaForum members or the FarmaForum itself, either directly or through third parties such as event organization agencies. Disclosure also includes information on the type of activity or support:
For education;
For coverage of expenses related to education or events;
For services and consultancy;
For research and development;
Donations.
Each FarmaForum member publishes these transfers in Slovenian at its local, regional, or international website.
Individual and group disclosures
All transfers to healthcare organizations, which under the Code include public healthcare institutions, physician associations and societies, chambers, and private companies (d.o.o. and s.p.), are published individually, with the full name of the recipient.
Transfers of value to individual healthcare professionals who are natural persons are, pursuant to the Personal Data Protection Act, only possible based on advance written consent of the healthcare professional. If such consent is withheld, transfers are published in a group or aggregate form, with the number of recipients and total amount listed separately for each category of such recipients.
Data on payments in the field of research and development cannot be published otherwise than in a group or aggregated form due to legislative protection of competition and innovations being developed by separate companies.
Disclaimer
The data published in this report is an expression of FarmaForum efforts towards observing the provisions of the EFPIA Code. Should it be found that the report contains incomplete or inaccurate data despite our best efforts towards assuring accurate publications, we will research the situation and appropriately correct false data.
DATA ON TRANSFERS OF VALUE TO HEALTHCARE PROFESSIONALS, HEALTHCARE ORGANISATIONS AND PATIENT ORGANIZATIONS FROM THE FORUM OF INTERNATIONAL RESEARCH AND DEVELOPMENT PHARMACEUTICAL COMPANIES, EIG, FOR 2022
In the calendar year 2022, the Forum of International Research and Development Pharmaceutical Companies, EIG, cooperated with various organizations: it sponsored the activities of the Slovenian Medical Association, twelve organizations received reimbursement related to the provision of services and consulting. Also, one donation was paid.
The total value of the FarmaForum’s transfers to health organizations in 2022 amounted to EUR 84,298.50. In 2022, no transfer to healthcare professionals took place. The value of transfers to patients’ associations amounted to EUR 16,290.
Methodology
Publicly published data includes transfers of value that were executed in the financial system of the FarmaForum in the calendar year 2022, from 1 January 2022 to 31 December 2022 inclusive.
Transfers to healthcare organizations and patient associations are reported as net amounts of such contracts, excluding VAT. Transfers to health care professionals are reported in gross amounts.
In 2022, no transfer of value to healthcare professionals took place.
All these amounts represent the total value for 2022.
All these transactions were carried out in the calendar year 2022, from 1 January 2022 to 31 December 2022 inclusive.
According to the Code, a health care organization (HCO) is defined as:
any sole entrepreneur or
legal person/entity
(i) that is a healthcare, medical or scientific association or organization (irrespective of the legal or organizational form) such as a hospital, clinic, foundation, university, or other teaching institution or learned society (except for POs within the scope of Article 21 of this Code) whose business address, place of incorporation or primary place of operation is in Europe or
(ii) through which one or more HCPs provide services
According to the Code a Health Care Professionals (HCP) are defined as:
any natural person that is a member of the medical, dental, pharmacy or nursing professions or any other person who, during his/her professional activities, may prescribe, purchase, supply, recommend or administer a Medicinal Product and whose primary practice, principal professional address or place of incorporation is in Europe.
For the purpose of this Code, the definition of HCPs includes:
(i) any official or employee of a government, agency or other organisation (whether in the public or private sector) that may prescribe, purchase, supply, recommend or administer Medicinal Products
(ii) any employee of a Member Company or FarmaForum whose primary occupation is that of a practising HCP, but excludes
(x) all other employees of a Member Company or FarmaForum and
(y) a wholesaler or distributor of Medicinal Products.
According to the Code Patient organizations (PO) are defined as:
not-for-profit legal person/entity (including the umbrella organisation to which it belongs), mainly composed of patients and/or caregivers, that represents and/or supports the needs of patients and/or caregivers and which business address, place of incorporation or primary place of operation is in Europe.
Code of practice is available here: Code of Practice
“,,1686993000,1686993000,en,15361,306,15360,43,0,NULL,,”Javna objava prenosov vrednosti ZD in ZO 2022″,javna-objava-prenosov-vrednosti-zd-in-zo-2022,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1686992654,1687156201
999,15272,”Could Value-based healthcare improve treatment outcomes in Slovenia?”,”This concept aims to organize the treatment outcomes in a way that it achieves the best possible treatment for the patient according to the resources invested”,”
Ljubljana, 23. november 2022 – In the center of value-based healthcare (VBHC) is the patient. This concept aims to organize the treatment outcomes in a way that it achieves the best possible treatment for the patient according to the resources invested. VBHC brings a comprehensive change in the way patients are treated. While it improves the quality of the healthcare system for all stakeholders, the patients are significantly more involved in their own treatment and medical teams are motivated for the best possible treatment outcomes.
Foreign and domestic experts discussed this at the 11th Strategic conference Value of Innovation, organized by the Forum of International Research & Development Pharmaceutical Companies, EIG. This year, the title of the conference was Treatment outcomes at the heart of the system. Nicola Bedlington, partner at Millwater Partners and one of the key people that helped build the European Patient Forum, explained, that the VBHC concept suggests regulating the healthcare system that is focused on competition and improving patient outcomes. VBHC is therefore based on results measurements, where “we are talking about the collection of many data that provide information on how effective the treatment was for the patient (e.g. clinical findings, patient well-being, pain, etc.). Part of the data is provided by the doctor or other medical staff and part by the patient. Good and efficient digital and technical support play an important role in this, as the collection of data must not (additionally) burden the medical staff.” Bedlington further explained that VBHC understands the common health needs of patients while it also designs solutions to improve health outcomes, integrates learning teams and measures health outcomes, and above all, costs. According to her, an important aspect of Value Based Healthcare is the monetary opportunity costs of the entire care process along the patient journey: “Switching the focus to health outcomes and care processes means reduced practice variation, greater quality of health care and improved cost-effectiveness.” As she added, the shift to VBHC is important because health systems around the world are already unsustainable while inequalities in treatment are increasing between countries. Europe’s population is aging, which means that we urgently need to move towards healthcare systems that can provide patients with equitable care that is sustainable, long-term, and accessible to all.
In the Netherlands, VBHC is already in use. As Pieter de Bey, general director of Santeon said, they decided years ago to start introducing the VBHC concept in the seven member hospitals at Santeon. Santeon is so called “learning system” of 7 hospitals for acute and chronic care, which is considered the largest provider of hospital services in the Netherlands. When introducing the VBHC they set five ambitions – patients must be actively involved in the treatment process, experts must work closely with each other, and they also have to work together in the field of innovation and research; the quality of care must be transparent and care must always be accessible to patients – also in financial terms. They tried to measure the value of treatment per patient in a broader perspective in all seven hospitals and found that there are big differences between hospitals. That’s why they introduced standardized cards with which they measure treatment outcomes, costs, and the effectiveness of the treatment process. “Over the past ten years, we have learned at Santeon that we need to create a common understanding of value and measure it using standardised data. We believe that with a cycle of continuous improvement, the financial benefit for hospitals will also be the greatest. We need to start with small steps, gradually, and then grow with pragmatism and building a safe learning environment,” emphasized de Bey.
Hans Winberg, Secretary General at the Leading Health Care Foundation in Stockholm pointed out the obstacles that VBHC brings. VBHC is originally and fundamentally a governance model on a national health system level. And as such it comes from the logic of market, where the central importance of measuring results is linked to external comparisons or choice: “VBHC represents a perspective that emphasizes ‘what is important for the patient,’ but at the same time, this phrase is understood differently by those in charge at the operational level and those at the policy level.”
How is it in Slovenia?
When thinking about VBHC, an advanced information system or digitization of the healthcare system is necessary. The speakers at the round table A Paradigm Shift in Healthcare: From First Steps to Lifestyle Management agreed that there is a regression in Slovenia on that matter. Aida Kamišalić Latifić, PhD, the State Secretary at the Office of the Government of the Republic of Slovenia for Digital Transformation said that Slovenia has a clear goal for digital transformation of both the economy and public services. “By 2030 all key public services will be available online and that all citizens will have access to their e-files.”
To introduce the VBHC in Slovenian healthcare, we urgently need a good digital basis. Valentina Prevolnik Rupel, PhD, Professor at Health Economist, Institute for Economic Research in Ljubljana said, that while they were preparing guidelines for the introduction of VBHC in Slovenia, they conducted a survey among relevant stakeholders on how familiar they are with the concept: “We found that approximately 40 percent of stakeholders know the concept. The paradox that I can mention however is that as many as 81 percent of all respondents answered that the concept would bring something good to our healthcare system, despite the fact that they were not necessarily familiar with it.” Assist. prof. Aleš Rozman, MD, PhD from University Clinic Golnik pointed out that we must not forget that VBHC comes from United States of America, where they have a different, more economic-driven healthcare system than Slovenia, where we have public healthcare. According to him, simply mapping the concept onto Slovenian would not be the right method. Petra Došenović Bonča, PhD, Associate Professor at School of Economic and Business agreed with him and added that Slovenia must be very careful when implementing the concept: “We need to be careful that we talk less about data collection and more about how we will use it. The frustration of healthcare providers is that they don’t get feedback and only then they will see the value of the concept. So, how to give each stakeholder the right information that will benefit them.”
“I agree that we have a lot of data,” said Anka Bolka, Director of Field for Development and Analysis at Health Insurance Institute of Slovenia, adding that the institute has been using all data on paid services for each person also for secondary use since 2013: “We have been dealing with the purchase of services that are most useful for the patient for a long time. The question, however, is what the authority of the institution in this rigid system is. And also, if we can even support such innovative approaches, because each such pilot test takes a long time. Persisting in this and financing it is challenging.”
The interlocutors agreed that we need a gradual approach. According to them, VBHC is not an approach for all areas, which means that it cannot be universal. The problem of Slovenian healthcare is multifaceted – Slovenian healthcare is gradually digitizing with the intent to make the provider’s job easier, but at the moment it is only making it more difficult.
In the future, the medical team will have to be different, and the healthcare will also have to relieve the providers of health services from the planned economy and pay significant attention to transparency. In the VBHC concept, it is important that the treatments results are transparent and accessible to users of health services. This allows comparison of results, healthy competition between providers, and gives patients the option of choosing where to get the service they need.
Link na posnetek: https://www.youtube.com/@farmaforum1498/featured
“,”Jaka Verbic Miklic”,1669465440,1669465440,en,15272,306,15271,43,0,NULL,,”Kako bi lahko izboljšail izide zdravljenja v Sloveniji”,kako-bi-lahko-izboljsail-izide-zdravljenja-v-sloveniji,Post,”/sites/43/files/images/news/11. strateska/Naslovna_fotografija_strateske_konference.jpg”,1,0,1669465574,1690699922
1000,15363,”Na konferenci Vrednost inovacij evropski in slovenski strokovnjaki z naborom priporočil za slovensko zdravstvo”,”VoI se je fokusirala na izzive prihodnosti”,”
12. strateška konferenca VoI se je fokusirala na izzive prihodnosti. Iskali smo odgovore na vprašanja, kaj potrebujemo, da jih bo naš zdravstveni sistem, na finančno vzdržen način, lahko naslavljal.
Bogi Eliasen, zdravstveni direktor na Copenhagen Institute for Future Studies je povedal, da bo na kratek rok težko zagotoviti hitro rast sredstev, zato je potrebno prerazporediti tista, ki so na voljo. »Že danes bi 30 % bremena bolezni lahko preprečili, bodisi s preventivo, primarno in predvsem sekundarno, bodisi z zgodnjo intervencijo in večjo odgovornostjo pacientov. Poleg politične odgovornosti moramo večji poudarek dati tudi osebni odgovornosti«, je dejal. To je poudarila tudi Tanja Španić, predsednica Združenja Europa Donna Slovenija in predsednica Evropske zveze za raka dojk – Europa Donna, ki svetuje: »V prvi vrsti smo sami odgovorni za svoje zdravje. Z zdravim življenjskim slogom ter odzivanjem na preventivne in presejalne programe lahko naredimo veliko, predvsem za kronične nenalezljive bolezni, z ustreznim cepljenjem pa tudi za nekatere nalezljive.«
Ricardo Baptista Leite, dr. med., glavni izvršni direktor The International Digital Health and Artificial Intelligence Research Collaborative v Ženevi, države spodbuja, da se čim prej preusmerijo iz sistemov, ki se ukvarjajo z zdravljenjem bolezni, k sistemu, ki dejansko spodbuja zdravje in dobro počutje. Osredotočiti se moramo na zdravstvene rezultate in na dobro počutje ter kakovost življenja, to je po njegovem osnova. Na tem moramo graditi in razvijati zdravstveni sistem. Kar 70 % koristi za zdravje izhaja iz zmanjšanja temeljnih okoljskih, socialnih in vedenjskih tveganj ter povečanja dostopa do visokokakovostne preventivne oskrbe. »Zagotovite, da bolezni, ki se jih lahko prepreči, preprečite in bolezni, ki jih lahko zdravimo, zdravite na najsodobnejše, oziroma najučinkovitejše načine. Pri zdravljenju se osredotočite na izide zdravljenja, ki so pomembni za paciente.« Kot je dejal prim. mag. Dorjan Marušič, mednarodni svetovalec: »Primarna raven mora (po)ostati temelj našega sistema s prvo prioriteto: usmeritev v rezultate za dvig kakovosti z osredotočenostjo na pacienta.« Temu je pritrdila tudi Tanja Španić, ko je dejala: »Opolnomočeni pacienti imajo boljše izide zdravljenja in bistveno bolje sodelujejo pri soodločanju o svojem zdravljenju.«
Pomemben izziv zdravstvenih sistemov je pomanjkanje in neustrezna razporeditev delovne sile. Danes dve tretjini zdravstvenih delavcev dela v bolnišnicah, ki bi morale biti zadnje mesto, kamor bolnik pride. Potrebna je prerazporeditev zdravstvenih delavcev v zgodnejše faze obravnave bolnikov. Predvsem pa je potrebna razbremenitev zdravstvenih delavcev, s pomočjo digitalizacije in digitalnih orodij. S tem lahko zdravstvene delavce razbremenimo rutinskih in administrativnih opravil. Glede uporabe digitalnih orodij je dr. Eric Sutherland, vodja Digitalnega zdravstva pri OECD opozoril, da se je treba upreti skušnjavi, da bi preprosto uporabili digitalna orodja, da samo dopolnimo način, kako delamo sedaj. Vzpostaviti moramo tehnično in regulatorno okolje, ki omogoča digitalne zdravstvene inovacije s sekundarno uporabo podatkov.
Glede podatkov je Metka Zaletel, predstojnica Zdravstveno podatkovnega centra NIJZ poudarila, da je podatkov v Sloveniji ogromno. Imamo sicer nekaj informacijskih lukenj, ki pa so relativno majhne in jih v večini primerov lahko nadomestimo z ocenami na podlagi modelov drugih držav. Izpostavila je pomen sodelovanja vseh deležnikov in uporabnikov podatkov. ”Le tako lahko dosežemo boljšo celostno obravnavo pacientov,” je prepričana Zaletelova. Prav tako je nujno zagotoviti ustrezno in kvalitetno povratno informacijo zdravstvenim delavcem. To jih motivira in spodbuja k izboljšavam in prispeva k njihovemu zadovoljstvu. Podatki, pretvorjeni v informacije, služijo tudi odločevalcem, da lahko bolje razvijajo politike zdravstvenega sistema, ki bo pripravljen na prihodnje potrebe.
Pomembno je tesnejše sodelovanje med vsemi deležniki, vključno z javnimi institucijami, podjetji in bolniki. To je na okrogli mizi izpostavil tudi Mircha Poldrugovac iz Centra za zdravstveno varstvo NIJZ, ko je dejal: »Ključno je, da se vsi deležniki tega zavedamo. Le tako bomo prepoznali, da sta medsebojno zaupanje in prevzem so-odgovornosti za celoten sistem nujna za uspešno in učinkovito uvajanje sprememb v zdravstvenem sistemu.«
Izr. prof. dr. Petra Došenović Bonča, predstojnica Katedre za ekonomijo na Ekonomski fakulteti Univerze v Ljubljani je srečanje sklenila z naslednjo mislijo: »Strategija zdravstva je po definiciji deležniška in kot takšna zahteva partnerstvo, zaupanje in konstruktivno sodelovanje, saj brez tega ni mogoče zagotoviti fleksibilnega zdravstvenega sistema, ki se hitro odziva na potrebe bolnikov in zdravstvene izzive celotne družbe.«
Na osnovi razprave FarmaForum izpostavlja še nekaj korakov, ki lahko pospešijo pot do skupnega cilja, ki je vzpostavitev vzdržnega, trajnostno naravnanega in na pacienta osredotočenega zdravstvenega sistema:
● Izobraževanje, usposabljanje in motiviranje zdravstvenih delavcev za digitalno transformacijo, ki jim bo postopoma omogočila več časa za pacienta in hitro pridobivanje relevantnih povratnih informacij, na osnovi podatkov, ki jih vnašajo v interoperabilen in robusten informacijski sistem;
● Pridobivanje in izobraževanje vodilnega kadra s sposobnostjo vodenja kompleksnih sistemov, kot je zdravstveni.
● Motiviranje vseh državljanov za deljenje in uporabo anonimiziranih zdravstvenih podatkov za boljše odločanje in napredek pri zdravljenju in v zdravstvu. Predlagamo kampanjo ozaveščanja o dobrobitih, ki jih sekundarna uporaba podatkov prinese posameznikom (vsem nam), zdravstvenemu sistemu in družbi kot celoti.
Posnetek celotne konference je na voljo tukaj: https://www.youtube.com/watch?v=3xj683U1f28
“,”Jaka Verbic Miklic”,1690701300,1690701300,sl,15363,306,15362,43,0,NULL,,”Na konferenci Vrednost inovacij evropski in slovenski strokovnjaki z naborom priporočil za slovensko zdravstvo”,na-konferenci-vrednost-inovacij-evropski-in-slovenski-strokovnjaki-z-naborom-priporocil-za-slovensko-zdravstvo,Post,/sites/43/files/images/news/12.strateska/12.Voi.jpg,1,0,1690701561,1690701630
1001,15365,”Opičje koze niso več grožnja svetovnemu zdravju “,”Do razglasitve konca nevarnosti je prišlo nekaj manj kot leto dni po tem, ko se je bolezen začela širiti, poroča francoska tiskovna agencija AFP.”,”
Ženeva, 11. maja – Svetovna zdravstvena organizacija (WHO) je danes sporočila, da opičje koze oziroma mpox, kot so v angleščini preimenovali to bolezen, niso več grožnja svetovnemu zdravju. Do razglasitve konca nevarnosti je prišlo nekaj manj kot leto dni po tem, ko se je bolezen začela širiti, poroča francoska tiskovna agencija AFP.
Generalni direktor WHO Tedros Adhanom Ghebreyesus je na spletni novinarski konferenci povedal, da je z veseljem sprejel nasvet odbora agencije Združenih narodov za izredne razmere, naj odpravi najvišjo stopnjo nevarnosti, potem ko se je število primerov po vsem svetu znatno zmanjšalo.
Izredne razmere in najvišjo stopnjo nevarnosti je WHO uvedla julija lani ter vladam držav po svetu izdala priporočila za omejevanje izbruha okužb. Odprava izrednih razmer tako nima neposrednih posledic, saj so se vlade že prej same odločale, katere priporočene ukrepe bodo sprejele.
Skupno je od začetka leta 2022 do 9. maja letos WHO zabeležila nekaj več kot 87.000 primerov okužbe z opičjimi kozami in 140 smrti v 111 državah. Strokovnjaki sicer menijo, da se je širjenje bolezni začelo že pred letom 2022 ter da je število okužb verjetno precej višje.
“,”Jaka Verbic Miklic”,1683817680,1683817680,sl,15365,306,15364,43,0,NULL,,”Opičje koze niso več grožnja svetovnemu zdravju “,opicje-koze-niso-vec-groznja-svetovnemu-zdravju,Post,,1,0,1692544162,1692544163
1002,15367,”WHO odsvetuje uporabo sladil za uravnavanje telesne teže “,”Rezultati pregleda tudi kažejo, da lahko dolgoročna uporaba sladil povzroči morebitne nezaželene učinke, kot so povečano tveganje za sladkorno bolezen tipa 2″,”
Ženeva, 15. maja – Svetovna zdravstvena organizacija (WHO) je danes izdala nove smernice, v katerih odsvetuje uporabo sladil brez sladkorja za nadzor telesne teže ali zmanjšanje tveganja za nenalezljive bolezni. WHO svetuje uživanje živil z naravno prisotnimi sladkorji ali nesladkanih živil in pijač, so zapisali v sporočilu za javnost.
Priporočilo temelji na ugotovitvah sistematičnega pregleda razpoložljivih dokazov, ki kažejo, da uporaba sladil ne prinaša dolgoročnih koristi pri zmanjševanju telesne teže pri odraslih ali otrocih.
Rezultati pregleda tudi kažejo, da lahko dolgoročna uporaba sladil povzroči morebitne nezaželene učinke, kot so povečano tveganje za sladkorno bolezen tipa 2, bolezni srca in ožilja ter umrljivost pri odraslih, je zapisala WHO.
“Ljudje morajo razmisliti o drugih načinih za zmanjšanje vnosa dodanih sladkorjev, kot je uživanje živil z naravno prisotnimi sladkorji, na primer sadja ali nesladkanih živil in pijač,” je dejala direktor WHO za prehrano in varnost hrane Francesco Branca.
Dodal je, da sladila v prehrani niso potrebna, saj nimajo prehranske vrednosti. Ljudje bi morali po njegovih besedah v celoti zmanjšati sladkor v prehrani, in sicer že v zgodnjem življenjskem obdobju, da bi izboljšali svoje zdravje.
Priporočilo velja za vse ljudi, razen za posameznike s sladkorno boleznijo, in vključuje vsa sintetična in naravno prisotna ali spremenjena sladila, ki niso uvrščena med sladkorje.
Smernice WHO o sladilih so del sklopa obstoječih in prihodnjih smernic o zdravi prehrani, katerih cilj je vzpostaviti vseživljenjske zdrave prehranjevalne navade, izboljšati kakovost prehrane in zmanjšati tveganje za nenalezljive bolezni po vsem svetu.
“,”Jaka Verbic Miklic”,1684163400,1684163400,sl,15367,306,15366,43,0,NULL,,”WHO odsvetuje uporabo sladil za uravnavanje telesne teže “,who-odsvetuje-uporabo-sladil-za-uravnavanje-telesne-teze,Post,,1,0,1692544280,1692544280
1003,15369,”WHO vzpostavila globalno mrežo za odkrivanje nevarnosti širjenja nalezljivih bolezni “,”Kot se je jasno pokazalo med pandemijo covida-19, je svet močnejši, če se skupaj bori proti skupnim zdravstvenim grožnjam”,”
Ženeva, 20. maja – Svetovna zdravstvena organizacija (WHO) je danes vzpostavila mednarodno mrežo, ki bo pomagala hitro odkrivati nevarnost nalezljivih bolezni, kot je covid-19, in izmenjevati informacije za preprečevanje njihovega širjenja.
Generalni direktor WHO Tedros Adhanom Ghebreyesus je pozdravil ambiciozne cilje nove mreže in dejal, da bi lahko imela “bistveno vlogo pri zdravstveni varnosti”. “Kot se je jasno pokazalo med pandemijo covida-19, je svet močnejši, če se skupaj bori proti skupnim zdravstvenim grožnjam,” je poudaril.
Mednarodna mreža za nadzor nad patogeni (IPSN) bo zagotovila platformo, ki bo povezovala države in regije ter izboljšala sisteme za zbiranje in analizo vzorcev, so sporočili z WHO.
Mreža bo omogočila hitro prepoznavanje in sledenje nalezljivih bolezni ter izmenjavo informacij in ukrepanje za preprečevanje katastrof, ko je bila pandemija covida-19. Temeljila bo na genomiki, ki vključuje sekvenciranje genoma virusov, bakterij in drugih patogenov, ki povzročajo bolezni. Na ta način bodo strokovnjaki skušali razumeti, kako nalezljivi in smrtonosni so ter kako se širijo.
Cilj omrežja je pomagati zagotoviti, da se nevarnosti nalezljivih bolezni hitro prepoznajo in spremljajo ter da se informacije izmenjujejo in pristojni nato ukrepajo, da se preprečijo katastrofe, kot je bila minula pandemija.
Zbrani podatki bodo vključeni v širši sistem nadzora za prepoznavanje nalezljivih bolezni, tako da bo mogoče ukrepati za preprečevanje njihovega širjenja ter razviti zdravljenje in cepiva.
Nova mreža, ki je bila vzpostavljena dan pred začetkom letne skupščine WHO v Ženevi, bo imela sekretariat v okviru središča WHO za obveščanje o pandemijah in epidemijah. Povezovala bo strokovnjake s področja genetike in analize podatkov z vsega sveta iz javnega, akademskega in zasebnega sektorja.
“Vsem je skupen cilj: odkriti in se odzvati na nevarnosti bolezni, preden postanejo epidemije in pandemije, ter optimizirati rutinsko spremljanje bolezni,” je še sporočila organizacija.
“,”Jaka Verbic Miklic”,1684595520,1684595520,sl,15369,306,15368,43,0,NULL,,”WHO vzpostavila globalno mrežo za odkrivanje nevarnosti širjenja nalezljivih bolezni “,who-vzpostavila-globalno-mrezo-za-odkrivanje-nevarnosti-sirjenja-nalezljivih-bolezni,Post,,1,0,1692544376,1692544376
1004,15371,”NIJZ: Podnebne spremembe vplivajo na duševno zdravje “,”V zvezi s podnebnimi spremembami se pojavlja tudi novejša beseda solastalgija, ki opisuje obliko čustvene ali bivanjske stiske”,”
Ljubljana, 23. maja – Svetovna zdravstvena organizacija in medvladni odbor za podnebne spremembe v zadnjem poročilu med vplivi podnebnih sprememb opozarjata na izzive na področju duševnega zdravja, sporoča Nacionalni inštitut za javno zdravje (NIJZ). Razvoj podnebnih sprememb lahko upočasnimo z blažilnimi ukrepi in s tem pozitivno vplivamo tudi na duševno zdravje.
Podnebne spremembe vplivajo na pojav duševnih težav in motenj preko nevarnosti, nesreč in globalnih okoljskih groženj ter družbenoekonomskih sprememb, povezanih s podnebnimi spremembami kot so tudi ekstremne vročine, poplave, nevihte, dvig morske gladine, požari v naravi in onesnaževanje oceanov, so zapisali na NIJZ.
Na ranljivost oseb s težavami z duševnim zdravjem vplivata dva dejavnika. Te osebe najprej težje poskrbijo zase, nekatera psihotropna zdravila, ki jih uživajo pa znižajo fiziološki odgovor telesa na povišano zunanjo temperaturo z delovanjem na termoregulacijske mehanizme in tako je prilagajanje telesa na povišane zunanje temperature omejeno.
Vplive dodatno okrepijo tudi dejavniki ranljivosti in neenakosti s področja zdravja, demografski dejavniki, geografski dejavniki, družbeno-ekonomski in družbeno-politični dejavniki. Pojavljajo ali krepijo pa se tudi različna stanja ali vplivi na duševno zdravje, kot so stres, anksioznost, depresija, samomorilno vedenje in napeti odnosi v družbi.
V zvezi s podnebnimi spremembami se pojavlja tudi novejša beseda solastalgija, ki opisuje obliko čustvene ali bivanjske stiske, ki jo povzroči sprememba okolja, ki ni več podobno domačemu, ki so ga prebivalci poznali. Nanaša se na preživeto izkušnjo, strah pred prihodnostjo in s tem strah pred podnebnimi spremembami, ki bodo vplivale na kvaliteto naših življenj.
Na NIJZ opozarjajo, da je mera v kolikšni se bodo podnebne spremembe nadaljevale odvisna od nas, spremembe lahko blažimo z ukrepi kot je zmanjševanje izpustov povzročiteljev podnebnih sprememb in prilagajanjem z ukrepi, kot je ustrezno obnašanje, zaščita pred nalezljivimi boleznimi, izolacija bivalnih prostorov in protipoplavna zaščita.
“,”Jaka Verbic Miklic”,1684854840,1684854840,sl,15371,306,15370,43,0,NULL,,”NIJZ: Podnebne spremembe vplivajo na duševno zdravje “,nijz-podnebne-spremembe-vplivajo-na-dusevno-zdravje,Post,,1,0,1692544514,1692544514
1005,15373,”Onkološkemu inštitutu mednarodna nagrada za komuniciranje programa Dora “,”Program je leta 2020 dosegel 75-odstotno udeležbo žensk, leta 2021 pa 77-odstotno”,”
Ljubljana, 7. junija – Onkološki inštitut Ljubljana je prejel mednarodno nagrado za komunikacijsko odličnost zlato pero. Nagrado so prejeli za upravljanje komuniciranja presejalnega programa za raka dojk Dora med epidemijo covida-19, so sporočili z inštituta.
Nagrado zlato pero podeljuje Mednarodno združenje poslovnih komunikatorjev IABC, onkološki inštitut pa jo je prejel v kategoriji upravljanje in komuniciranje kot odziv na epidemijo covida-19 in okrevanje po njej. Inštitut je v povezavi s projektom Dora dobil tudi posebno nagrado “Best of the Best”, ki jo prejme le nekaj najboljših primerov komuniciranja z vsega sveta, so še zapisali.
Kot so spomnili na onkološkem inštitutu, je dolgoročni cilj programa Dora za 30 odstotkov zmanjšati število smrti zaradi raka dojk v ciljni populaciji slovenskih žensk med 50. in 69. letom, ta pa je bil zaradi kriznih okoliščin in začasne zaustavitve presejanja v času izbruha epidemije ogrožen. “Komisijo združenja IABC je program navdušil, ker je s strateškim in dobro zastavljenim komuniciranjem ohranil zaupanje žensk na ravni pred epidemijo,” so sporočili z inštituta.
Program je leta 2020 dosegel 75-odstotno udeležbo žensk, leta 2021 pa 77-odstotno, kar presega minimalne zahteve za dosego ključnega dolgoročnega cilja programa, so še zapisali.
“Izjemno počaščeni smo, da so mednarodni strokovnjaki prepoznali naša prizadevanja, ko smo v kriznih okoliščinah, v času splošnega občutka negotovosti in strahu, uspeli slediti veljavnim epidemiološkim priporočilom, nenehno posodabljali zaščitne ukrepe in upravljali komuniciranje tako, da smo sodelavcem v programu Dora in ženskam zagotovili občutek varnosti,” so v sporočilu za javnost povzeli besede svetovalke za odnose z javnostmi programa Dora Vesne Škrbec.
“,”Jaka Verbic Miklic”,1686151020,1686151020,sl,15373,306,15372,43,0,NULL,,”Onkološkemu inštitutu mednarodna nagrada za komuniciranje programa Dora “,onkoloskemu-institutu-mednarodna-nagrada-za-komuniciranje-programa-dora,Post,,1,0,1692544718,1692544718
1006,15375,”ECDC opozarja na širjenje bolezni, ki jih prenašajo komarji “,”V letu 2022 je bilo v državah EU in EGP zabeleženih 1133 primerov okužb z virusom zahodnega Nila in 92 smrti.”,”
Stockholm, 22. junija – Porast temperatur, vse pogostejši vročinski valovi in poplave v Evropi ustvarjajo pogoje za geografsko širitev invazivnih vrst komarjev, ki prenašajo viruse, je danes opozoril Evropski center za preprečevanje in nadzor bolezni (ECDC). Bolezni, ki so bile nekdaj omejene na južnejše toplejše predele, se zdaj širijo proti severu in zahodu celine.
Vse daljša in toplejša poletja so privedla do širitve invazivnih vrst tigrastih komarjev Aedes albopictus in Aedes aegypti, ki so prenašalci virusov denge, rumene mrzlice, čikungunja, zika in virusa zahodnega Nila.
Vrsta Aedes albopictus je bila zgolj deset let nazaj uveljavljena v osmih državah članicah EU in Evropskega gospodarskega prostora (EGP) ter 114 regijah, danes pa je uveljavljena v 13 državah in 337 regijah. Aedes aegypti se je z lanskim letom uveljavila na Cipru, od koder bi se lahko širila naprej.
Uveljavljenost vrste ne pomeni zgolj prisotnosti, pač pa tudi, da le-ta na prizadetem območju uspešno prezimi in ohranja populacijo, na svoji spletni strani pojasnjuje ECDC.
“Če se bo to nadaljevalo, lahko pričakujemo več primerov in morda tudi smrtnih primerov bolezni, kot so denga, čikungunja in mrzlica zahodnega Nila. Prizadevanja se morajo osredotočiti na načine za nadzor populacij komarjev, izboljšanje nadzora in izvajanje osebnih zaščitnih ukrepov,” je dejala direktorica ECDC Andrea Ammon.
V letu 2022 je bilo v državah EU in EGP zabeleženih 1133 primerov okužb z virusom zahodnega Nila in 92 smrti. Daleč največ lokalnih okužb so zabeležili v Italiji, nekaj okužb pa je bilo zabeleženih tudi v preostalih treh slovenskih sosedah.
Minulo leto je še posebej izstopalo glede lokalnih primerov okužb z virusom denge. Leta 2022 so namreč našteli 71 takšnih primerov, kar je enako skupnemu številu lokalnih okužb med letoma 2010 in 2021.
ECDC poziva k trajnostnim načinom za omejevanje populacije komarjev z odstranjevanjem virov stoječe vode, uporabo okolju prijaznih insekticidov in ozaveščanjem skupnosti o nadzoru komarjev.
Za osebno zaščito ECDC svetuje uporabo mrež proti insektom, nošenje oblek, ki prekrivajo čim več kože, in uporabo sredstev proti komarjem. Kot so poudarili, je nujno potrebno tudi ozaveščanje splošne javnosti, zdravstvenih delavcev in turistov o boleznih, ki jih prenašajo komarji.
“,”Jaka Verbic Miklic”,1687447260,1687447260,sl,15375,306,15374,43,0,NULL,,”ECDC opozarja na širjenje bolezni, ki jih prenašajo komarji “,ecdc-opozarja-na-sirjenje-bolezni-ki-jih-prenasajo-komarji,Post,,1,0,1692544912,1692544912
1007,15377,”FDA odobrila prvo zdravilo za upočasnitev Alzheimerjeve bolezni “,”Zdravilo odstranjuje amiloidne obloge v možganih, ki so povezane z Alzheimerjevo boleznijo, in je odobreno le za ljudi z zgodnjimi oblikami Alzheimerjeve bolezni”,”
Washington, 7. julija – Ameriška Uprava za hrano in zdravila (FDA) je v četrtek dokončno odobrila prvo zdravilo, ki upočasnjuje Alzheimerjevo bolezen v zgodnji fazi, kar pomeni, da si ga bodo lahko privoščili tudi ameriški upokojenci z zveznim zdravstvenim zavarovanjem medicare. Zdravilo leqembi sicer le upočasni razvoj bolezni, vendar je ne ozdravi.
Zdravilo skupaj izdelujeta podjetji Eisai in Biogen, brez zavarovanja pa stane 26.500 dolarjev na leto. Odobreno je bilo že v začetku leta, vendar ga zavarovalnice še niso krile, sedaj pa je center za programa medicare in medicaid potrdil, da lahko pokriva njegovo uporabo.
Zdravilo odstranjuje amiloidne obloge v možganih, ki so povezane z Alzheimerjevo boleznijo, in je odobreno le za ljudi z zgodnjimi oblikami Alzheimerjeve bolezni – tiste z blago kognitivno motnjo ali blago demenco, pri katerih je bilo potrjeno, da imajo v možganih amiloidne obloge. Takih je približno šestina od skupaj šest milijonov bolnikov z Alzheimerjem v ZDA.
Zdravilo verjetno ne bo koristilo ljudem z naprednejšimi oblikami bolezni, ki se lahko soočijo tudi z večjimi varnostnimi tveganji. V 18-mesečnem kliničnem preizkušanju je bilo dokazano, da je zdravilo leqembi upad kognitivnih sposobnosti upočasnilo za 27 odstotkov uporabnikov.
Pri približno 13 odstotkih udeležencev v preizkušanju je prišlo do otekanja možganov ali krvavitve, ta tveganja pa so lahko pri nekaterih skupinah še večja zaradi njihove genetike, ali če jemljejo zdravila za redčenje krvi. Bolniki sicer zdravilo jemljejo enkrat na dva tedna v obliki infuzije.
“,”Jaka Verbic Miklic”,1688743380,1688743380,sl,15377,306,15376,43,0,NULL,,”FDA odobrila prvo zdravilo za upočasnitev Alzheimerjeve bolezni “,fda-odobrila-prvo-zdravilo-za-upocasnitev-alzheimerjeve-bolezni,Post,,1,0,1692545074,1692545075
1008,15379,”WHO aspartam označil kot možno rakotvorna snov, zmerna uporaba neškodljiva “,”Ob upoštevanju najvišjega dopustnega dnevnega vnosa pa ta ne bi smel predstavljati tveganj.”,”
Ženeva, 14. julija – Aspartam, eno najbolj razširjenih sladil na svetu, bi lahko pri ljudeh povzročal raka, ugotavlja poročilo, ki ga je danes objavila Svetovna zdravstvena organizacija (WHO). Do tega bi sicer lahko prišlo le pri uživanju sladila v prekomernih količinah. Ob upoštevanju najvišjega dopustnega dnevnega vnosa pa ta ne bi smel predstavljati tveganj.
Mednarodna agencija za raziskave raka (IARC), ki deluje v okviru WHO, je na podlagi študij aspartam uvrstila na seznam možnih rakotvornih snovi za ljudi, saj so študije ugotovile, da obstajajo omejeni dokazi, da snov lahko povzroči raka. Ob tem agencija poudarja potrebo po nadaljnjih raziskavah za izboljšanje razumevanja povezav med aspartamom in rakom.
“Po našem mnenju je to bolj poziv raziskovalni skupnosti, da poskuša bolje razjasniti in razumeti rakotvorno nevarnost, ki jo lahko ali pa tudi ne predstavlja uživanje aspartama,” je dejala predstavnica IARC Mary Schubauer-Berigan.
Skupni strokovni odbor za aditive za živila (JECFA), prav tako pod okriljem WHO, je medtem glede na poročilo sklenil, da študije niso zadostni razlog za spremembo trenutnega najvišjega dopustnega dnevnega vnosa aspartama.
Ta sicer znaša 40 miligramov na kilogram telesne teže. To pa pomeni, da bi morala odrasla oseba, ki tehta 70 kilogramov, zaužiti med 9 in 14 pločevink brezalkoholne pijače z visoko vsebnostjo aspartama, da bi presegla sprejemljiv dnevni vnos, navaja WHO.
“Rak je eden glavnih vzrokov smrti na svetu. Znanost se nenehno širi, da bi ocenila možne dejavnike, ki sprožajo ali pospešujejo nastanek raka,” je glede ugotovitev dejal direktor WHO za prehrano in varnost hrane Francesco Branca. Ljudem ne priporoča, da se v celoti odpovedo sladilom, svetuje pa jim zmernost.
Aspartam je eno najbolj razširjenih sladil na svetu, ki se od osemdesetih let prejšnjega stoletja pogosto uporablja v različnih živilih in pijačah, vključno z dietnimi pijačami, žvečilnimi gumiji in nekaterimi mlečnimi izdelki.
V Sloveniji je bila po podatkih, ki so jih sporočili iz Inštituta za nutricionistiko, pri zadnjem pregledu tržišča živil uporaba aspartama označena na več sto izdelkih, včasih tudi v kombinaciji z drugimi sladili.
Najpogosteje so aspartam našli kot sestavino žvečilnih gumijev; prisoten je bil v 71 odstotkih od 142 vzorčenih žvečilnih gumijev. Aspartam je bil mnogokrat dodan tudi v pijače, vključno z nektarji, izotoničnimi napitki, energijskimi pijačami in sirupi, pa tudi v sladice, deserte in jogurte. Posamezne izdelke z aspartamom so našli še med kavnimi pripravki, prigrizki, nadomestki obrokov in piškoti, je pojasnil Igor Pravst z inštituta.
Na Inštitutu za nutricionistiko sicer spremljajo sestavo živil v Sloveniji že vse od leta 2011. Vzorec raziskave je vključeval osvežilne brezalkoholne pijače, nektarje, sokove in energijske ter športne pijače.
“Če smo leta 2019 opažali bistvene spremembe v sestavi energijskih pijač, so se leta 2020 zgodili tudi bistveni premiki v sestavi osvežilnih brezalkoholnih pijač. Delež izdelkov s sladili se je v tej podskupini opazno povečal na 27 odstotkov. Najpogosteje uporabljena intenzivna sladila v pijačah v Sloveniji so bila so acesulfam K, sukraloza in aspartam,” so navedli besede Edvine Hafner z inštituta.
“,”Jaka Verbic Miklic”,1689348300,1689348300,sl,15379,306,15378,43,0,NULL,,”WHO aspartam označil kot možno rakotvorna snov, zmerna uporaba neškodljiva “,who-aspartam-oznacil-kot-mozno-rakotvorna-snov-zmerna-uporaba-neskodljiva,Post,,1,0,1692545204,1692545230
1009,15381,”Ema odobrila prvo cepivo za zaščito dojenčkov pred virusom RSV “,”Zaščito pridobi pasivno, prek matere, ki jo cepijo med nosečnostjo.”,”
Haag, 21. julija – Evropska agencija za zdravila (Ema) je danes odobrila prvo cepivo za zaščito dojenčkov pred okužbo z respiratornim sincicijskim virusom (RSV), ki povzroča bolezen spodnjih dihal. Cepivo Abrysvo, ki ga proizvaja podjetje Pfizer, ščiti dojenčka do šest mesecev po porodu. Zaščito pridobi pasivno, prek matere, ki jo cepijo med nosečnostjo.
“Abrysvo je prvo cepivo proti RSV, namenjeno za pasivno imunizacijo dojenčkov od rojstva do šestega meseca starosti po cepljenju matere med nosečnostjo,” je sporočila Ema in dodala, da je cepivo, ki ga proizvaja podjetje Pfizer, primerno tudi za aktivno imunizacijo odraslih, starih 60 let in več.
Zaščita dojenčkov traja do šest mesecev po rojstvu. Kot je še pojasnila Ema, je cepivo bivalentno, kar pomeni, da ščiti pred več kot enim sevom virusa. Maja so ga odobrili v ZDA.
Virus RSV je sicer pogost virus dihal, ki povzroča blage, prehladu podobne simptome. Večina ljudi okreva v enem do dveh tednih, pri ranljivih ljudeh, vključno s starejšimi, sladkornimi bolniki in tistimi z boleznimi pljuč ali srca, pa lahko povzroči resne težave.
Odobritev bo Ema sedaj posredovala Evropski komisiji, ki bo nato sprejela končno odločitev glede izdaje dovoljenja za promet s cepivom po vsej EU.
Odobritev cepiva Abrysvo sledi odobritvi cepiva Arexvy prejšnji mesec, ki je prvo cepivo za zaščito pred RSV, namenjeno starejšim od 60 let.
“,”Jaka Verbic Miklic”,1689953280,1689953280,sl,15381,306,15380,43,0,NULL,,”Ema odobrila prvo cepivo za zaščito dojenčkov pred virusom RSV “,ema-odobrila-prvo-cepivo-za-zascito-dojenckov-pred-virusom-rsv,Post,,1,0,1692545386,1692545386
1010,15383,”V Sloveniji najnižja pojavnost okužb s hepatitisom C med državami EU”,”Po ocenah je v Sloveniji trenutno okuženih le še 0,07 odstotka prebivalstva”,”
Ljubljana, 24. julija – Statistična projekcija, izvedena s pomočjo Evropskega centra za preprečevanje in obvladovanje bolezni, je pokazala, da imamo v Sloveniji najnižjo pojavnost okužb s hepatitisom C v EU. Po ocenah je v Sloveniji trenutno okuženih le še 0,07 odstotka prebivalstva, je pred petkovim svetovnim dnevom hepatitisa poudarila infektologinja Mojca Matičič.
Letošnji svetovni dan hepatitisa, ki ga bodo obeležili pod geslom Eno življenje, ena jetra, po besedah Mojce Matičič z infekcijske klinike Univerzitetnega kliničnega centra (UKC) Ljubljana zaznamuje kar nekaj izzivov, pa tudi novosti.
V Sloveniji želijo to izkoristiti za čim boljše informiranje in ozaveščanje splošne javnosti, saj preprečevanje okužb z virusoma hepatitisa B in C oziroma zgodnje odkrivanje in zdravljenje preprečujeta nastanek raka in odpoved delovanja jeter.
Ob dnevu tudi letos vabijo na akcijo anonimnega brezplačnega testiranju na okužbo z virusom hepatitisa C, ki bo v četrtek in petek med 13. in 18. uro potekalo na Poljanskem nasipu 58 v Ljubljani.
V Sloveniji glede na projekcije še dobrih 1000 bolnikov s hepatitisom C
Testiranje na okužbo s hepatitisom C je v Sloveniji že več kot 25 let enostavno dostopno, prav tako pa je medicinska oskrba okuženih na najvišji ravni, saj imajo bolniki dostop do takojšnje specialistične obravnave in zdravljenja z najsodobnejšimi zdravili, za kar se infektologinja Matičič zahvaljuje številnim deležnikom.
Strategija obvladovanja hepatitisa C iz leta 1997, ena prvih v svetu, je obrodila pomembne sadove, saj je Slovenija na poti k odpravi hepatitisa, Svetovna zdravstvena organizacija (WHO) pa Slovenijo opredeljuje kot primer dobre prakse, je dodala.
Z inovativnim aktivnim pristopom smo namreč prvi v svetu povsem odpravili okužbo v določenih skupinah bolnikov, kot so hemofiliki, dializirani bolniki, bolniki s presajenimi organi in okuženi z virusom HIV. Prav tako imamo v svetu priznano zelo dobro zastavljen model obvladovanja okužbe s hepatitisom C pri uporabnikih drog v programih nadomestnega zdravljenja.
Medtem ko je bila v Evropi zaenkrat odkrita le četrtina okuženih s hepatitisom C in od njih šele dve tretjini zdravljenih, je pri nas stanje zelo drugačno. S strategijo “testiraj in zdravi”, ki jo uporabljajo v zadnjih letih, smo po besedah infektologinje dosegli zavidljive rezultate.
Glede na omenjeno statistično projekcijo je treba v Sloveniji odkriti in pozdraviti še dobrih tisoč neprepoznanih bolnikov. Stroka si za to prizadeva prek informiranja in ozaveščanja, pa tudi prek enostavno dostopnega testiranja.
Za najranljivejše in najbolj izpostavljene skupine v sodelovanju z ministrstvom za zdravje na infekcijski kliniki UKC Ljubljana pripravljajo tudi mobilno enoto, ki bo na terenu omogočala celostno obravnavo okužbe s hepatitisom C.
Poziv k cepljenju proti hepatitisu A in B
V lanskem letu so v Sloveniji zabeležili največji izbruh akutnega hepatitisa A v tem tisočletju. Virus se je prenašal predvsem prek spolnih odnosov med moškimi, vnesen pa je bil z Madžarske. Med 55 primeri jih je več kot polovico potrebovala bolnišnično zdravljenje, dvema je grozila odpoved delovanja jeter. Zato zdravniki močno priporočajo preventivno cepljenje proti hepatitisu A, cepljenje je tudi po stiku z okuženim mogoče v obdobju 14 dni.
Matičič je izpostavila tudi cepljenje proti hepatitisu B, ki je učinkovito in eno najbolj preučevanih in varnih cepiv v zgodovini medicine. Priporočajo ga vsem, ki do sedaj še niso bili cepljeni, torej predvsem tistim, rojenim pred letom 1992, ko je bilo cepljenje proti hepatitisu B vključeno v nacionalni program cepljenja otrok.
V EU je sicer za zdaj le 11 držav doseglo želeni cilj WHO – 95 odstotno precepljenost otrok proti hepatitisu B. Slovenija se z nekaj manj kot 80 odstotno precepljenostjo v šolskem letu 2020/21 uvršča med najslabše precepljene generacije otrok v Evropi.
Pred kratkim uvedeno sočasno testiranje na hepatitis D ob testiranju na hepatitis B
V Sloveniji strokovnjaki pred 10 leti v raziskavi niso zaznali okužb s hepatitisom D. Zaradi porasta tovrstnih okužb v številnih državah EU in njihove dolgotrajne brezsimptomnosti so v zadnjem letu v Sloveniji vpeljali rutinsko testiranje na hepatitis D pri vseh, ki so okuženi s hepatitisom B. Tako so okužbo s hepatitisom D naključno odkrili pri dveh osebah, obeh že z zelo napredovalo boleznijo jeter in zanju tudi pridobili ustrezno zdravljenje z novimi zdravili, kar je prvi tovrstni primer pri nas.
Vse več okužb s hepatitisom E
Vse več pa v Sloveniji odkrivajo tudi bolnikov z akutnim hepatitisom E, ki je posledica uživanja termično slabo obdelanih ali neobdelanih mesnih izdelkov domačih svinj in divjačine. Bolezen poteka zelo neznačilno in lahko posnema najrazličnejše druge bolezenske sindrome. Bolj kot jetra okužba z virusom hepatitisa E lahko ogrozi druge organe oziroma sisteme, predvsem živčnega in ledvica in povzroči ohromelost, odpoved delovanja ledvic in še mnoge druge, tudi ogrožajoče zaplete.
Še posebej so ogrožene osebe z oslabelim imunskim odzivom, pri katerih lahko pride tudi do kroničnega hepatitisa E, zato takim osebam odsvetujejo uživanje suhomesnih izdelkov.
Obsežna raziskava je pokazala, da je med slovenskimi krvodajalci nad sedem odstotkov takih, ki so v preteklosti preboleli okužbo s hepatitisom E, pa tega sploh niso vedeli.
“,”Jaka Verbic Miklic”,1690212660,1690212660,sl,15383,306,15382,43,0,NULL,,”V Sloveniji najnižja pojavnost okužb s hepatitisom C med državami EU”,v-sloveniji-najnizja-pojavnost-okuzb-s-hepatitisom-c-med-drzavami-eu,Post,,1,0,1692545543,1692545544
1011,15385,”Zdravje ohranjamo že z nekaj tisoč koraki na dan “,”Analiza 226000 ljudi po vsem svetu je pokazala, da predčasno smrt iz kateregakoli razloga lahko preprečimo že z opravljenimi 4000 koraki na dan”,”
London, 10. avgusta – Dolgo je veljalo, da je 10.000 korakov na dan način za to, da ostanemo zdravi, vendar nova študija kaže, da koristi prinaša že manj kot 5000 korakov. Analiza 226.000 ljudi po vsem svetu je pokazala, da predčasno smrt iz kateregakoli razloga lahko preprečimo že z opravljenimi 4000 koraki na dan, poroča britanski BBC.
Za srce in krvne žile koristi prinaša že več kot 2300 opravljenih korakov, več kot jih naredimo, toliko več koristnega smo naredili za svoje zdravje, so ugotovili raziskovalci medicinske fakultete v Lodzu na Poljskem ter medicinske fakultete na univerzi Johns Hopkins v ZDA.
Ugotovili so, da vsakih tisoč korakov več nad 4000 koraki dnevno zmanjša tveganje za zgodnjo smrt za 15 odstotkov do 20.000 korakov.
Ugotovili so tudi, da hoja koristi vsem ljudem ne glede na starost in spol ter to, kje živijo. Največ koristi od hoje pa imajo mlajši od 60 let.
Profesor Maciej Banach z univerze v Lodzu je ob tem izpostavil, da je kljub zdravilom potrebno vedeti, da je pri zmanjševanju tveganj za srčno-žilne bolezni in prizadevanjih za podaljšanje življenja zelo učinkovita sprememba življenjskega sloga, prehrana in telesna aktivnost. Spremembo lahko prinese že sprehod do trgovine namesto vožnje z avtomobilom ter izstop iz avtobusa nekaj postaj prej.
Po podatkih Svetovne zdravstvene organizacije je nezadostna telesna dejavnost vsako leto vzrok za 3,2 milijona smrti. S tem je četrti najpogostejši vzrok smrti na svetu.
“,”Jaka Verbic Miklic”,1691681640,1691681640,sl,15385,306,15384,43,0,NULL,,”Zdravje ohranjamo že z nekaj tisoč koraki na dan “,zdravje-ohranjamo-ze-z-nekaj-tisoc-koraki-na-dan,Post,,1,0,1692545706,1692545751
1012,15387,”Medijski zajtrk na temo Varstva intelektualne lastnine”,”Medijski zajtrk je bil namenjen razumevanju zakonov o intelektualni lastnini in podajanju informacij za pravilno in učinkovito poročanje “,”
Forum je v sredo, 11. oktobra 2023, organiziral medijski zajtrk za izbrane novinarje na temo zaščite intelektualne lastnine. Medijski zajtrk je bil namenjen razumevanju zakonov o intelektualni lastnini in podajanju informacij za pravilno in učinkovito poročanje o vprašanjih, povezanih z intelektualno lastnino. Na zajtrku smo obravnavali ključne koncepte, kot so avtorske pravice, blagovne znamke, patenti in poštena uporaba, ter praktične nasvete za pokrivanje zgodb, povezanih z IL.
Namen izobraževalnega srečanja je bil podati relevantne informacije o pomenu intelektualne lastnine, predstaviti praktične nasvete o izzivih povezanih z intelektualno lastnino ter spodbuditi razpravo in izmenjavo izkušenj.
“,”Jaka Verbic Miklic”,1697368440,1697368440,sl,15387,306,15386,43,0,NULL,,”Medijski zajtrk na temo Varstva intelektualne lastnine”,medijski-zajtrk-na-temo-varstva-intelektualne-lastnine,Post,”/sites/43/files/images/news/Rare desises/Mic2.jpg”,1,0,1697368532,1700060408
1013,15387,”Media breakfast on the topic of Intellectual Property Protection”,”The media breakfast was aimed at understanding intellectual property laws and providing information for correct and effective reporting on issues related to intellectual property”,”
On Wednesday, October 11, 2023, Forum organized a media breakfast for selected journalists on the topic of intellectual property protection. The media breakfast was aimed at understanding intellectual property laws and providing information for correct and effective reporting on issues related to intellectual property. At the breakfast, we covered key concepts such as copyright, trademarks, patents and fair use, as well as practical tips for covering IL-related stories.
The purpose of the educational meeting was to provide relevant information on the importance of intellectual property, to present practical advice on challenges related to intellectual property, and to stimulate discussion and exchange of experiences.
“,”Jaka Verbic Miklic”,1697368440,1697368440,en,15387,306,15386,43,0,NULL,,”Medijski zajtrk na temo Varstva intelektualne lastnine”,medijski-zajtrk-na-temo-varstva-intelektualne-lastnine,Post,”/sites/43/files/images/news/Rare desises/Mic2.jpg”,1,0,1697368532,1700060408
1014,15389,”Zima je pred vrati”,”Še vedno lahko poskrbimo za zaščito in zdravje”,”
14.11. 2023 je STA organiziral okroglo mizo z naslovom »Zima je pred vrati: Še vedno lahko poskrbimo za zaščito in zdravje«
O tem so na okrogli mizi spregovorili:
– Nadja Šinkovec Zorko, dr. med., spec. javnega zdravja, Nacionalni inštitut za javno zdravje,
– Tatjana Mrvič, dr. med., spec. infektologije in pediatrije, Klinika za infekcijske bolezni in vročinska stanja, UKC Ljubljana,
– doc. dr. Vesna Homar, dr. med, spec. družinske in urgentne medicine, Zdravstveni dom Vrhnika
– Denis Baš, dr. med., spec. pediatrije, predsednik sekcije za primarno pediatrijo
Posnetek pogovora je na voljo tu: https://video.sta.si/video/4530#17594
“,”Jaka Verbic Miklic”,1699981320,1699981320,sl,15389,306,15388,43,0,NULL,,”Zima je pred vrati”,zima-je-pred-vrati,Post,”/sites/43/files/images/news/Rare desises/Mic2.jpg”,1,0,1701191051,1701191051
1015,15391,”Mesec krvnih bolezni v znamenju osveščanja o pravočasnem odkrivanju bolezni”,”Urška Rugelj je izpostavila, da imamo v Sloveniji veliko prednost pri zdravljenju krvnih bolezni, saj lahko bolniki zdravila, ki so odobrena na Evropski agenciji za zdravila, prejmejo v slabega pol leta od odobritve.”,”
Ljubljana, 31. avgusta – S prvim septembrom se bo začel mesec krvnih bolezni, ki bo potekal v znamenju osveščanja o pravočasnem odkrivanju, prepoznavanju in zdravljenju krvnih bolezni. Strokovnjaki opozarjajo, da so simptomi teh bolezni, kot sta huda utrujenost in nepojasnjena povišana telesna temperatura, zelo splošni in zato pogosto spregledani.
Krvne bolezni močno obremenjujejo bolnike, njihove bližnje in celotno družbo, saj ima kar 82 odstotkov bolnikov s krvnim rakom simptome, ki jih onesposabljajo v vsakodnevnem življenju. Leta 2019 je krvni rak v Evropi povzročil 154.000 smrti, skupni stroški vseh bolezni krvi in krvnih rakov v Evropi pa so ocenjeni na 23 milijard evrov letno, je v sporočilu za javnost zapisalo Društvo bolnikov s krvnimi boleznimi Slovenije in Slovensko združenje bolnikov z limfomom in levkemijo.
Urška Rugelj iz Onkološkega inštituta Ljubljana je na današnji novinarski konferenci društev bolnikov dejala, da je med simptomi krvnih bolezni tudi nočno potenje, povečane bezgavke običajno pa je indikator krvne bolezni tudi nenadna izguba telesne teže.
Ravno zaradi splošnih in pogosto spregledanih simptomov krvnih bolezni je pravočasno odkrivanje in prepoznavanje bolezni še toliko pomembneje. Pri krvnih rakih in krvnih boleznih je po besedah strokovnjakov zelo pomembna preiskava krvne slike, ki zdravnikom pomaga pri postavljanju diagnoz.
Poleg humanitarke Anite Ogulin je svojo izkušnjo z diagnozo krvne bolezni delil tudi glasbenik in libretist Drago Ivanuša. Ivanuša je na novinarski konferenci dejal, da gre veliko večino zaslug za učinkovito spopadanje z boleznijo pripisati slovenskemu zdravstvenemu sistemu.
Tudi predstojnik Kliničnega oddelka za hematologijo Interne klinike UKC Ljubljana Samo Zver ocenjuje, da je za bolnike s krvnimi boleznimi v Sloveniji dobro poskrbljeno. “Če je nekdo zares bolan, pride do nas zelo hitro,” je dejal.
Rugelj je izpostavila, da imamo v Sloveniji veliko prednost pri zdravljenju krvnih bolezni, saj lahko bolniki zdravila, ki so odobrena na Evropski agenciji za zdravila, prejmejo v slabega pol leta od odobritve. Poudarila je tudi pomembnost obveznega zdravstvenega zavarovanja pri pridobivanju zdravil, a obenem dejala da so zdravniki večkrat preobremenjeni z birokratskimi postopki v zvezi z zdravili.
Izvršna direktorica Slovenskega združenja bolnikov z limfomom in levkemijo Kristina Modic je pred začetkom meseca krvnih bolezni opozorila na pomanjkanje hematologov. “V zadnjih letih se srečujemo s težavami in sicer tudi kadrovskimi, s pomanjkanjem hematologov izven Ljubljane, tako smo zaznali dosti težav v splošni bolnišnici Novo mesto, Izola in pa na Jesenicah,” je povedala. Omenila je, da so se primorani mnogi bolniki zaradi pomanjkanja hematologov redno voziti na preglede, kar predstavlja nezanemarljivo finančno breme, poleg tega pa je za bolnike tovrstna pot lahko izjemno fizično naporna.
V združenju bolnikov z limfomom in levkemijo sicer omogočajo tudi nekatere podporne programe za bolnike. Med drugim je Modic izpostavila portal posvetuj.se, kjer bolnikom in svojcem s krvnimi bolezni in rakom nudijo brezplačno podporo izkušenih psihologov in kliničnih dietetikov.
V mesecu krvnih bolezni se bodo sicer zvrstili tudi številni dogodki kot je dobrodelno kolesarjenje, ki jih organizirata Društvo bolnikov s krvnimi boleznimi Slovenije in Slovensko združenje bolnikov z limfomom in levkemijo in bodo usmerjeni k osveščanju o pomembnosti pravočasnega odkrivanja krvnih bolezni.
“,”Jaka Verbic Miklic”,1693496280,1693496280,sl,15391,306,15390,43,0,NULL,,”Mesec krvnih bolezni v znamenju osveščanja o pravočasnem odkrivanju bolezni”,mesec-krvnih-bolezni-v-znamenju-osvescanja-o-pravocasnem-odkrivanju-bolezni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1701967147,1701967320
1016,15393,”September mesec ozaveščanja o otroškem raku”,”Mesec september je namenjen ozaveščanju o redki nenalezljivi bolezni, raku pri otrocih, za katerim v Sloveniji letno zboli približno 80 otrok. “,”
Ljubljana, 1. septembra – Mesec september je namenjen ozaveščanju o redki nenalezljivi bolezni, raku pri otrocih, za katerim v Sloveniji letno zboli približno 80 otrok. Kljub temu, da z zgodnjo diagnozo in optimalnim zdravljenjem pri nas ozdravi skoraj 80 odstotkov otrok, ima zdravljenje lahko tudi dolgoročne posledice, so pojasnili v Društvu Junaki 3. nadstropja.
September, ki bo v znamenju zlate pentlje kot simbola boja proti otroškemu raku, predstavlja priložnost za širjenje zavesti o prisotnosti zahrbtne bolezni, s katero se soočajo otroci v 3. nadstropju ljubljanske pediatrične klinike na hemato-onkološkem oddelku. Kot so zapisali v Društvu Junaki 3. nadstropja, vsak teden raka na novo odkrijejo pri enem do dveh slovenskih otrok. Bitko z boleznijo izgubi vsak peti oboleli otrok.
Tako pri nas kot tudi v tujini obstaja več načinov zdravljenja otroškega raka. Večina stranskih učinkov se pojavi med ali kmalu po zdravljenju in hitro izzveni, so dodali. Kljub temu lahko nekatere težave ostanejo ali pa se pojavijo šele mesece ali leta po zdravljenju. Prizadet lahko ostane en ali več delov telesa oz. organov, med drugim so lahko to možgani, oči, mišice, kosti in srce. Zdravljenje pa lahko vpliva tudi na rast, razvoj in plodnost, so pojasnili na društvu.
“Vsak starš se z diagnozo, zdravljenjem in tudi z izidom zdravljenja sooča drugače, po svoje. Na splošno pa bi lahko rekli, da je na začetku za vse diagnoza raka pri otroku velik šok. Sprašuješ se, kaj si naredil narobe, zakaj je zbolel ravno tvoj otrok ipd.,” so za STA pojasnili v društvu. Večina staršev se relativno hitro pobere, ker niti nima izbire. Otrok namreč ob sebi v teh težkih trenutkih potrebuje močnega in pozitivno naravnanega starša, so dodali.
Večina staršev se tako oklene upanja na ozdravitev in vsaj pred otrokom funkcionira kar se da normalno. “Seveda pa se, ko so sami s svojimi mislimi, soočajo s strahovi, občutkom nemoči, bolečino ob pogledu na izčrpanega otroka. Na koncu pa je seveda vse odvisno od izida zdravljenja,” so izkušnje povzeli v društvu.
Starši, katerih otroci se pozdravijo, se morajo soočiti z morebitnimi posledicami. Pri večini pa je zelo prisoten tudi velik strah pred ponovitvijo. Kadar zdravljenje ni uspešno, pa se morajo starši žal soočiti s tistim najhujšim, z izgubo otroka. Na vseh korakih imajo starši na voljo strokovno pomoč kliničnih psihologov na oddelku, so še dodali.
V društvu bodo tudi v letošnjem septembru zbirali sredstva, ki jih bodo porabili za nakup nujno potrebnega spektrofotometra. V septembru pripravljajo tudi več aktivnosti, med drugim Junaški vikend na Bledu in v Bohinju za 50 družin otrok z rakom ter kulturni dan s koncertom Junakov. Kot uvod v aktivnosti meseca ozaveščanja o otroškem raku, zlatega septembra, pa danes društvo organizira 36 kilometrov dolg Emin pohod od Škofje Loke do pediatrične klinike, ki tradicionalno poteka v spomin na deklico Emo, ki je boj z rakom izgubila 1. septembra.
“,”Jaka Verbic Miklic”,1693582920,1693582920,sl,15393,306,15392,43,0,NULL,,”September mesec ozaveščanja o otroškem raku”,september-mesec-ozavescanja-o-otroskem-raku,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1701967444,1701967444
1017,15395,”Ob svetovnem dnevu fizioterapije izpostavili pomenu fizioterapevtov pri zdravljenju artritisa”,”Fizioterapevti lahko pacientom pomagajo pri obvladovanju simptomov artritisa ter povrnitvi kakovosti življenja, so ob dnevu poudarili strokovnjaki.”,”
Ljubljana, 8. septembra – Svetovni dan fizioterapije, ki ga vsako leto obeležujejo 8. septembra, letos osvetljuje artritis in pomen fizioterapevtov pri njegovem zdravljenju in obravnavi. Fizioterapevti lahko pacientom pomagajo pri obvladovanju simptomov artritisa ter povrnitvi kakovosti življenja, so ob dnevu poudarili strokovnjaki.
Artritis – akutno ali kronično vnetje sklepov – lahko prizadene ljudi vseh starosti, ne glede na njihovo telesno pripravljenost, tudi otroke, najstnike in športnike, je predsednik Združenja fizioterapevtov Slovenije Tine Kovačič v četrtek povedal na novinarski konferenci, ki so jo v združenju organizirali skupaj z Univerzitetnim rehabilitacijskim inštitutom (URI) Soča.
V povprečju je na letni ravni v Sloveniji diagnosticiranih okrog 12.600 primerov različnih vrst artritisa. Po podatkih Nacionalnega inštituta za javno zdravje (NIJZ) je bilo od leta 2015 do 2021 na primarni ravni zdravstva skupaj diagnosticiranih 65.000 primerov artritisa, na sekundarni ravni pa 23.000 primerov – skupaj torej 88.000 primerov.
Pri artritisu ne gre le za eno bolezensko stanje, pač pa obstajajo različne vrste. Najpogostejše vrste artritisa so revmatoidni artritis, protin (putika), spondilitis in juvenilni idiopatski artritis, ki prizadene enega na 1000 otrok.
Artritis prizadene ljudi na različne načine. Vsako stanje ima specifične simptome, ki se spreminjajo dnevno ali na daljša obdobja. Vsem oblikam artritisa je skupna bolečina v sklepih, okorelost, vnetje in otekline, topla in pordela koža na prizadetem sklepu, šibkost ter izguba mišične mase. Artritis lahko negativno vpliva na življenje posameznika, saj zmanjša mobilnost in oteži izvajanje vsakodnevnih dejavnosti ter je pogosto povezan z depresijo ali tesnobo.
Simptomi, ki se pojavljajo ob artritisu, pa so obvladljivi, je poudarila predsednica sekcije fizioterapevtov za krepitev zdravja pri združenju fizioterapevtov Andrea Backović Juričan z NIJZ.
Fizioterapevt je po njenih besedah prava oseba, ki lahko pacientom pomaga in jih nauči različnih strategij za obvladovanje artritisa, sestavi pa lahko tudi prilagojen program telesne vadbe. Za osebe z artritisom je namreč nujen aktivni življenjski slog in redno gibanje, je poudarila.
Paciente z različnimi oblikami artritisa obravnavajo tudi fizioterapevti URI Soča v sodelovanju z zdravniki in drugimi zdravstvenimi delavci. Fizioterapevti izvajajo kinezioterapijo, bolnikom svetujejo in pomagajo pri obvladovanju simptomov, razvijejo tudi načrt individualno prilagojene vadbe, da pacient ohranja zdrav življenjski slog, je pojasnil podpredsednik združenja fizioterapevtov in vodja fizioterapije na URI Soča Janez Špoljar.
Ob svetovnem dnevu fizioterapije združenje fizioterapevtov tudi letos organizira številne brezplačne aktivnosti. Letos bodo od 4. septembra do 2. oktobra v 40 krajih po Sloveniji organizirali več kot 80 različnih dogodkov. Med njimi je Backović Juričan naštela individualna svetovanja, prikaze skupinskih vadb, predavanja, delavnice, pohode ter testiranja.
V javni zdravstveni mreži je dostop do fizioterapevtskih storitev pri težavah z artritisom sicer mogoč z delovnim nalogom za fizioterapijo, ki ga lahko izdajo družinski zdravniki, ali z napotitvijo na fizioterapevtsko obravnavo s strani drugih zdravnikov specialistov.
Za pomoč pri spremembi gibalnih navad in pripravo individualiziranega programa telesne vadbe lahko pacienti obiščejo tudi fizioterapevte, zaposlene v centrih za krepitev zdravja ali zdravstveno-vzgojnih centrih, ki delujejo znotraj zdravstvenih domov po Sloveniji. Za individualno posvete pri njih pacienti ne potrebuje napotitve zdravnika, na voljo pa so tudi številne skupinske delavnice.
“,”Jaka Verbic Miklic”,1694187960,1694187960,sl,15395,306,15394,43,0,NULL,,”Ob svetovnem dnevu fizioterapije izpostavili pomenu fizioterapevtov pri zdravljenju artritisa”,ob-svetovnem-dnevu-fizioterapije-izpostavili-pomenu-fizioterapevtov-pri-zdravljenju-artritisa,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1701967644,1701967725
1018,15397,”Obeležujemo svetovni dan ozaveščanja o limfomu”,”Najpogostejši simptomi so povečane bezgavke na vratu, pod pazduho ali v dimljah, izrazito nočno potenje, pogoste okužbe, povišana telesna temperatura zvečer, izguba telesne teže in utrujenost”,”
Ljubljana, 15. septembra – Danes obeležujemo svetovni dan ozaveščanja o najpogostejši obliki krvnega raka, limfomu. V Slovenskem združenju bolnikov z limfomom in levkemijo L&L želijo letos še posebej ozaveščati o pomenu zgodnjega odkrivanja limfoma, saj je zdravljenje pravočasno odkrite bolezni manj zahtevno in bolj uspešno, višje je tudi preživetje.
Najpogostejši simptomi so povečane bezgavke na vratu, pod pazduho ali v dimljah, izrazito nočno potenje, pogoste okužbe, povišana telesna temperatura zvečer, izguba telesne teže in utrujenost, je za STA pojasnila izvršna direktorica združenja Kristina Modic.
Med možne simptome spadajo tudi kašelj, zasoplost ter dolgotrajno srbenje po celem telesu, pri nekaterih oblikah pa tudi povečana vranica, napetost v trebuhu ter kožni izpuščaji.
Gre za raka limfatičnega sistema in predstavlja najpogostejšo obliko krvnega raka, pogosto pa se pojavlja tudi pri mladih. Gre za dobro ozdravljiv oziroma zazdravljiv rak, je pojasnila Modic in dodala, da tudi če gre za višji stadij bolezni, še ne pomeni, da zdravljenje ne bo uspešno.
Bolezen ima zelo splošne simptome, zato jih ljudje zelo hitro zamenjajo za manj nevarne težave, prav tako tudi zdravniki, je še opozorila Modic.
Obstaja več kot 80 podtipov limfomov, ki se jih v grobem deli na Hodgkinov in ne-Hodgkinov limfom, vsi pa imajo različne metode diagnosticiranja in zdravljenja. Zaradi tega je zelo pomembno, da strokovnjak za limfom pravilno diagnosticira podtip.
Svetovni dan ozaveščanja o limfomu je bil prvič obeležen leta 2004, nastal pa je na pobudo koalicije Lymphoma Coalition.
“,”Jaka Verbic Miklic”,1694793000,1694793000,sl,15397,306,15396,43,0,NULL,,”Obeležujemo svetovni dan ozaveščanja o limfomu”,obelezujemo-svetovni-dan-ozavescanja-o-limfomu,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1701967890,1701968385
1019,15399,”Ob svetovnem dnevu Alzheimerjeve bolezni poudarek na zmanjševanju stigm”,”Na ministrstvu so ob svetovnem dnevu v sporočilu za javnost spomnili, da je vlada 6. julija sprejela Strategijo obvladovanja demence v Sloveniji do leta 2030″,”
Ljubljana, 21. septembra – Današnji svetovni dan Alzheimerjeve bolezni, tako kot že ves september, ki je svetovni mesec te bolezni, poteka pod geslom Nikoli prezgodaj, nikoli prepozno. Poudarek je predvsem na preventivi, zmanjševanju in preprečevanju dejavnikov tveganja za nastop demence, ob svetovnem dnevu poudarja Nacionalni inštitut za javno zdravje (NIJZ).
Demenca je med največjimi zdravstvenimi, socialnimi in finančnimi izzivi sodobne družbe in predstavlja velik javnozdravstveni problem. Poznamo več vrst demence, daleč najpogostejša demenca je pri Alzheimerjevi bolezni. S podaljševanjem življenjske dobe se veča pojavnost Alzheimerjeve demence, ki je kronična napredujoča možganska bolezen, opozarja NIJZ.
Po podatkih ministrstva za zdravje ima demenco več kot 40.000 prebivalcev Slovenije. Bolezen presega zdravstveno področje, saj imajo osebe z demenco največ težav pri opravljanju vsakdanjih nalog, pri katerih so praviloma bolj ali manj odvisne od pomoči drugih.
Ta bolezen je v svojem nastajanju zahrbtna. Razvija se počasi, enakomerno, več let, zaradi česar okolica večinoma ne prepozna tega bolezenskega stanja, dokler bolezen že močno ne napreduje. Najbolj izstopajo težave s spominom. Demenca je povezana s slabšanjem zdravstvenega stanja, z upadom kakovosti življenja tako obolelega kot svojcev, s številnimi preprekami, socialno izključenostjo, prikrajšanostjo, nerazumevanjem, nepoznavanjem, strahom, stigmo.
“Izredno pomembno je, da se osebe, ki opažajo pri sebi ali pri svojcih težave s spominom in mišljenjem, obrnejo na zdravnika. Ta bo ocenil kognitivne sposobnosti in presodil, ali gre za demenco. Zgodnje odkrivanje in zdravljenje demence ima prednosti, saj gre za tekmo s časom, nezdravljenje pa vodi v hitrejše napredovanje demence,” je poudarila svetnica z NIJZ Mercedes Lovrečič. Predsednica združenja Spominčica – Alzheimer Slovenija Štefanija Zlobec Lukič medtem opozarja, da se demence še vedno drži prevelika stigma.
Razvoj demence je povezan z različnimi dejavniki, kot so starost, spol, genetika, ki jih ni mogoče spremeniti. Obstajajo pa tudi takšni, na katere posameznik lahko vpliva in tako zmanjša tveganje za demenco, opozarjajo strokovnjaki. Številni dejavniki tveganja za demenco se prekrivajo z nenalezljivimi boleznimi, kot so bolezni srca, sladkorna bolezen in rakava obolenja. Na omenjene bolezni lahko vsak posameznik vpliva s svojimi življenjskim slogom.
V svetu se podaljšuje življenjska doba, kar je vzrok za čedalje večje število starejših, še posebej starejših od 65 let, s starostjo pa narašča pojavnost demence. Tudi za Slovenijo velja podobno. V Sloveniji je bila leta 2021 petina prebivalcev starih 65 let ali več, dobrih pet odstotkov pa je bilo starejših od 80 let. Za leto 2030 podatki kažejo, da bo prebivalcev, starih 65 let in več že četrtina, skoraj sedem odstotkov v starosti nad 80 let.
Daljšanje pričakovane življenjske dobe tako ni vedno povezano z več leti zdravega življenja, je opozorila Lovrečič. Demenca prizadene dobra dva odstotka prebivalcev, starih od 65 do 69 let, in kar 42 odstotka prebivalcev v starosti 90 let in več, tako s podaljševanjem življenjske dobe narašča delež prebivalcev z demenco, še posebej po 80. letu starosti, kažejo podatki NIJZ.
Na ministrstvu so ob svetovnem dnevu v sporočilu za javnost spomnili, da je vlada 6. julija sprejela Strategijo obvladovanja demence v Sloveniji do leta 2030. Strategija opredeljuje deset ciljev, med njimi spodbujanje preventivnih programov za zmanjševanje dejavnikov tveganja, vzpostavitev nacionalnega centra za demenco in zmanjšanje stigme.
“,”Jaka Verbic Miklic”,1695311820,1695311820,sl,15399,306,15398,43,0,NULL,,”Ob svetovnem dnevu Alzheimerjeve bolezni poudarek na zmanjševanju stigm”,ob-svetovnem-dnevu-alzheimerjeve-bolezni-poudarek-na-zmanjsevanju-stigm,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1701968294,1701968294
1020,15401,”Ministrstvo sprejelo program cepljenja za letošnje leto”,”Sprejeti program cepljenja med drugim prinaša spremembe na področju cepljenja proti humanim papilomavirusom (HPV). Cepljenje je po novem zagotovljeno dvema dodatnima generacijama dečkov, in sicer v 1. in 3. letniku srednje šole.”,”
Ljubljana, 24. septembra – Ministrstvo za zdravje je nedavno sprejelo pravilnik o določitvi programa cepljenja in zaščite z zdravili za leto 2023. V programu so upoštevali večino predlogov NIJZ, med drugim so dodatnima generacijama zagotovili cepljenje proti HPV, ob tem pa so cepljenje proti davici, tetanusu in oslovskemu kašlju premaknili iz 3. v 2. razred osnovne šole.
Sprejeti program cepljenja med drugim prinaša spremembe na področju cepljenja proti humanim papilomavirusom (HPV). Cepljenje je po novem zagotovljeno dvema dodatnima generacijama dečkov, in sicer v 1. in 3. letniku srednje šole.
Zagovornik načela enakosti je sicer Nacionalnemu inštitutu za javno zdravje (NIJZ) in ministrstvu za zdravje priporočili, da omogočita cepljenje proti HPV vsem mladostnikom in mladostnicam do 26. leta. Sekciji za primarno pediatrijo in za šolsko, študentsko in adolescentno medicino, ki se strinjata z vključitvijo dodatne generacije v 1. in 3. letniku, pa sta ocenili, da bi bilo treba omogočiti cepljenje tudi vsem ostalim fantom, tako kot velja za dekleta, za kar bi bilo treba zagotoviti dodatna finančna sredstva in cepivo.
Ministrstvo je v programu upoštevalo tudi predloge NIJZ, da se cepljenje proti davici, tetanusu in oslovskemu kašlju premakne iz 3. v 2. razred osnovne šole, da se obvezno cepljenje dijakov v srednji šoli, ki je do sedaj potekalo s cepivom proti tetanusu, zamenja s cepivom proti davici, tetanusu in oslovskemu kašlju ter da se cepljenje s tretjim odmerkom proti hepatitisu B iz 1. razreda premakne v 2. razred osnovne šole.
V skladu s sklepom posvetovalne skupine za cepljenje, ki deluje pri NIJZ, je inštitut predlagal tudi, da se določenim skupinam z največjim tveganjem za invazivne pnevmokokne okužbe, ki jim v skladu z nacionalnimi priporočili pripada cepljenje proti pnevmokoknim okužbam s konjugiranim in polisaharidnim cepivom v breme obveznega zdravstvenega zavarovanja, omogoči cepljenje z 20-valentnim konjugiranim cepivom iz sredstev obveznega zdravstvenega zavarovanja. Tudi ta predlog so na ministrstvu upoštevali.
Vključili so tudi predlog NIJZ, da se zagotovi cepljenje proti pasovcu z rekombinantnim cepivom proti pasovcu (Shingrix) za najbolj ranljive, imunsko oslabljene bolnike.
NIJZ je predlagal še, da se cepljenje proti covidu-19 poleg četrtega poglavja vključi tudi v druge programe oz. poglavja programa cepljenja. “Namen predloga je zgolj to, da se cepljenje proti covidu-19 vključi v program cepljenja tako kot vsa ostala cepljenja (na primer cepljenje proti gripi), ki jih financira ZZZS ali državni proračun,” so pojasnili na inštitutu.
A je ministrstvo cepljenje proti covidu-19 ohranilo le v četrtem poglavju. “Cepljenje proti covidu-19 je navedeno med priporočljivimi cepljenji v četrti skupini programa pri ciljni skupini ‘ostali prebivalci’, izvaja pa se v skladu z nacionalnimi priporočili in ni za nikogar obvezno,” so pojasnili.
Program cepljenja za letos je bil v Uradnem listu objavljen 11. avgusta.
“,”Jaka Verbic Miklic”,1695571260,1695571260,sl,15401,306,15400,43,0,NULL,,”Ministrstvo sprejelo program cepljenja za letošnje leto”,ministrstvo-sprejelo-program-cepljenja-za-letosnje-leto,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1701968529,1701968535
1021,15403,”Nova zdravila upanje za bolnike z Alzheimerjevo boleznijo”,”Učinkovitost zdravil lecanemaba in donanemaba pri odstranjevanju amiloidne beljakovine ter njuna klinična korist za bolnike sta bili nedvomno dokazani, a bo tovrstno zdravljenje na voljo le v zgodnji fazi Alzheimerjeve bolezni.”,”
Ljubljana, 26. septembra – Po dolgih letih čakanja imajo evropski bolniki z Alzheimerjevo boleznijo upanje, saj se obetajo nova zdravila proti tej bolezni. Trenutno pri Emi teče postopek presoje za registracijo zdravila lecanemab, je poudarila specialistka nevrologije Milica Kramberger z nevrološke klinike Univerzitetnega kliničnega centra Ljubljana.
Nova zdravila temeljijo na monoklonskih protitelesih, ki odstranjujejo amiloidno beljakovino. Ta zdravila igrajo ključno vlogo pri obvladovanju Alzheimerjeve bolezni. Ob tem zdravila tudi pozitivno vplivajo na kognitivne funkcije in vsakodnevno delovanje oseb z zgodnjo obliko Alzheimerjeve bolezni, je na novinarski konferenci povedala Kramberger.
Po uspešni registraciji lecanemaba v ZDA julija letos teče postopek presoje za registracijo tega zdravila za uporabo v Evropi pri Evropski agenciji za zdravila (Ema). Pričakovanja so visoka tako med strokovnjaki kot tudi med bolniki in njihovimi svojci.
Učinkovitost zdravil lecanemaba in donanemaba pri odstranjevanju amiloidne beljakovine ter njuna klinična korist za bolnike sta bili nedvomno dokazani, a bo tovrstno zdravljenje na voljo le v zgodnji fazi Alzheimerjeve bolezni. V tem zgodnjem obdobju imajo bolniki blage težave s spominom, orientacijo, govorom in drugimi kognitivnimi funkcijami, vendar so še vedno samostojni ali potrebujejo zgolj minimalno pomoč druge osebe pri vsakodnevnih aktivnostih.
Osebe s hujšo obliko Alzheimerjeve demence in tisti, ki trpijo za drugimi vrstami demence, ne bodo imeli koristi od teh novih oblik zdravljenja, zato je zelo pomembno zgodnje odkrivanje bolezni.
Raziskave kažejo, da skrb za dejavnike tveganja koristi našim kognitivnim sposobnostim tudi v kasnejših življenjskih obdobjih, je poudarila vodja enote za gerontopsihiatrijo na Univerzitetni psihiatrični kliniki Ljubljana Polona Rus Prelog.
Vse več študij pa se zaradi še vedno nezadostnega zdravljenja osnovne bolezni usmerja tudi k terciarni preventivi, torej tisti, ki zmanjšuje možnosti za napredovanje bolezni, ko se bolezenski znaki že pojavijo. V terciarni preventivi je za lajšanje spremljajočih simptomov in boljše življenje ljudi z demenco na voljo cela vrsta možnosti in pristopov, je pojasnila.
Razvitih je veliko dobrih programov – od kognitivnih treningov, ki krepijo spomin, pa do takšnih, ki spremljajo in skrbijo za prilagoditve okolja, komunikacije, prostora, zato je pomembno, da je čim več strokovnjakov v Sloveniji izobraženih glede simptomov demence, možnosti obravnave in zdravljenja in pomoči na različnih nivojih, kar naslavlja tudi strategija za obvladovanje demence do leta 2030.
Predsednica združenja Spominčica – Alzheimer Slovenija Štefanija Lukič Zlobec je predstavila aktivnosti v septembru, ki je svetovni mesec Alzheimerjeve bolezni. Glavni cilj je osveščanje o prepoznavanju prvih znakov in komuniciranju s posamezniki, ki imajo demenco. Prav tako so nadgradili mrežo demenci prijaznih točk, ki jih je že 450, je povedala.
Predsednica Zdravniške zbornice Slovenije Bojana Beović se je združenju Spominčica zahvalila za ogromno delo, ki ga opravlja na področju demence. Ob tem je spomnila, da se v Sloveniji zdravniki ne morejo specializirati za področje geriatrije. Ker si želijo organiziranih izobraževanj za zdravnike, čakajo na pravilnik – zakonske osnove so bile sprejete -, ki bo omogočil pridobivanje posebnega znanja s tega področja, enako velja za področje paliativne medicine.
“,”Jaka Verbic Miklic”,1695744180,1695744180,sl,15403,306,15402,43,0,NULL,,”Nova zdravila upanje za bolnike z Alzheimerjevo boleznijo”,nova-zdravila-upanje-za-bolnike-z-alzheimerjevo-boleznijo,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1701968691,1701968691
1022,15405,”Ob rožnatem oktobru strokovnjaki pozivajo k samopregledovanju dojk”,”Po podatkih Registra raka RS je v obdobju 2016-2020 v Sloveniji povprečno letno za rakom dojk zbolelo 1481 žensk, umrlo pa 439.”,”
Ljubljana, 1. oktobra – Rožnati oktober je mednarodni mesec ozaveščanja o raku dojk, ki je najpogostejša oblika raka pri ženskah. Strokovnjaki ob tem pozivajo k samopregledovanju dojk v vseh obdobjih življenja. Potrebno pa se je odzivati tudi na preventivne presejalne programe in skrbeti za svoje zdravje, ob spremembah na telesu pa obiskati zdravnika, opozarjajo.
Onkološki inštitut Ljubljana se v rožnatem oktobru pridružuje pobudam ozaveščanja o tej bolezni ter izpostavlja pomen pravočasnega odkrivanja in učinkovitega zdravljenja raka dojk, so zapisali v sporočilu za javnost.
“Tudi letošnje leto je živahno pri pridobivanju novih spoznanj pri zdravljenju raka dojk. Veseli smo, da z uvajanjem novih zdravil zadovoljivo hitro sledimo njihovi registraciji. Veliko smo naredili na področju celostne rehabilitacije, kjer pa nas čaka še naporna pot, da bomo dobre izkušnje iz pilotne raziskave o onkološki rehabilitaciji OREH razširili na vse bolnice z rakom dojk v Sloveniji,” so povzeli besede onkologinje Simona Borštnar.
Sicer so na Onkološkem inštitutu po njenih navedbah pričeli tudi s kliničnim registrom raka dojk, ki jim bo z bogato zbirko podatkov za podrobnejše analize primerov te bolezni pomagal ne le natančno spremljati diagnostiko in zdravljenje, ampak bo tudi podlaga za spremljanje kakovosti celostne obravnave bolnikov z rakom dojk po Sloveniji.
Po podatkih Registra raka RS je v obdobju 2016-2020 v Sloveniji povprečno letno za rakom dojk zbolelo 1481 žensk, umrlo pa 439. V letu 2020 je za rakom dojk zbolelo 1459 oseb, od tega 1448 žensk in 11 moških, umrlo pa 472 žensk in trije moški. To predstavlja 8 odstotkov manj odkritih rakov dojk pri ženskah (131) glede na pričakovano število novih primerov raka, pripravljeno na podlagi ocene registra raka za leto 2020, ki je bila, da bo za rakom dojk v letu 2020 zbolelo 1579 žensk.
Ob koncu 2020 je imelo približno 20.000 oseb postavljeno diagnozo raka dojk. Najpogosteje za to boleznijo zbolevajo ženske od 50. do 65. leta. Rak dojk sicer spada med bolezni z dobrim preživetjem. Možnost za ozdravitev je velika, če je ta odkrit pravočasno, ko je še v zgodnji fazi razvoja. In prav državni presejalni program raka dojk Dora je namenjen zgodnjemu odkrivanju te bolezni.
“Samopregledovanje je pomembno ne glede na starost. Vsaka ženska bi morala že v mladosti začeti s samopregledovanjem in tako spoznati svoje dojke. Tako lahko zgodaj zatipamo zatrdline in opazimo spremembe, na katere morda sicer ne bi bile pozorne,” so še navedli.
“,”Jaka Verbic Miklic”,1696176360,1696176360,sl,15405,306,15404,43,0,NULL,,”Ob rožnatem oktobru strokovnjaki pozivajo k samopregledovanju dojk”,ob-roznatem-oktobru-strokovnjaki-pozivajo-k-samopregledovanju-dojk,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1701968820,1701968837
1023,15407,”Nobelova nagrada za medicino za razvoj mRNK cepiv”,”Predvsem je pomembno, da bomo dobili cepiva proti boleznim, za katere jih doslej še nismo imeli, in predvsem tudi to, da bodo hitreje dostopna”,”
Stockholm, 2. oktobra – Letošnja Nobelova nagrada za medicino gre v roke madžarski znanstvenici Katalin Kariko in ameriškemu znanstveniku Drewu Weissmanu za njun prispevek pri razvoju mRNK cepiv, je danes sporočil švedski inštitut Karolinska. Kot je izpostavila žirija, so njune raziskave omogočile razvoj učinkovitih cepiv proti covidu-19.
Letošnja Nobelova nagrajenca, madžarska znanstvenica Katalin Kariko in ameriški raziskovalec Drew Weissman, je švedski inštitut Karolinska nagradil za delo na področju kemijskih modifikacij nukleotidov.
Vodja odseka za sintezno biologijo in imunologijo na Kemijskem inštitutu je za STA pojasnil, da sta nagrajenca odkrila, da lahko z uporabo določenih modifikacij nukleotidov, ki sestavljajo mRNK, bistveno zmanjšajo vnetni odziv ob vnosu v celico, kar je omogočilo razvoj in napredek cepiv. Jerala njuna odkritja označuje kot pomemben kamenček v mozaiku razvoja te tehnologije.
Cepiva mRNK za razliko od vektorskih cepiv ne vsebujejo oslabljenih virusov, pač pa nosijo delček genskega zapisa virusa, ki vsebuje zapis za specifičen antigen. Telesne celice nato s pomočjo tega genskega zapisa proizvedejo antigen, ki v telesu izzove imunski odziv, na svoji spletni strani navaja Nacionalni inštitut za javno zdravje (NIJZ). Prednost tega pristopa je relativna enostavnost obsežne proizvodnje cepiva.
Kot je pojasnil Jerala, je bil ključni znanstveni članek, na podlagi katerega sta bila izbrana, objavljen že leta 2005. Pomen mRNK tehnologij za javno zdravje pa je najbolj prišel do izraza med pandemijo covida-19, ko so znanstveniki uspešno razvili več različic cepiv, ki v veliki meri varujejo pred hujšim potekom bolezni ob okužbi z virusom sars-cov-2.
Med pandemijo se je izkazalo, da je s pomočjo mRNK tehnologije možno hitro pripraviti in prilagajati cepiva. Kot izpostavlja Jerala, pa ima ta tehnologija potencial tudi na področju bojev proti morebitnim novim virusom, po drugi strani pa preizkušajo rabo mRNK cepiv pri rakavih bolnikih.
“Predvsem je pomembno, da bomo dobili cepiva proti boleznim, za katere jih doslej še nismo imeli, in predvsem tudi to, da bodo hitreje dostopna,” je še dodal.
Kariko in Weissman so mediji v preteklih letih že navajali med favoriti za Nobelovo nagrado za medicino, a ju je ta čast doletela šele letos. Po besedah Jerale to še zdaleč ni nenavadno, saj so številni nobelovci bili za svoje delo nagrajeni tudi desetletje ali več po njihovih odkritjih.
Jerala pomen izbire žirije vidi v tem, da gre za primer koristne uporabe znanosti. To razume tudi kot spodbudo za nadaljnje raziskave, “zato da se pripravimo tudi na eventualne druge pandemije, ki bodo lahko mogoče povzročile še hujše posledice, kot je bila ta s covidom-19,” je povedal slovenski strokovnjak.
Kot je poudaril, je inštitut seveda omejen pri tem, koliko nagrajencev lahko izbere, ti pa predstavljajo le del zgodbe. Razvoj mRNK cepiv namreč poteka že več desetletij.
“,”Jaka Verbic Miklic”,1696262880,1696262880,sl,15407,306,15406,43,0,NULL,,”Nobelova nagrada za medicino za razvoj mRNK cepiv”,nobelova-nagrada-za-medicino-za-razvoj-mrnk-cepiv,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1701968986,1701968987
1024,15409,”Posvet o zdravstveni pismenosti”,”Zdravstvena pismenost uporabnikom zdravstvenih storitev omogoča lažje pridobivanje, razumevanje in vrednotenje zdravstvenih informacij ter posledično sprejemanje informiranih odločitev o lastnem zdravju”,”
Ljubljana, 16. november 2023 Zveza organizacij pacientov Slovenije (ZOPS) je tretji letošnji izobraževalni posvet za zagovornike bolnikov in uporabnike zdravstvenih in socialno varstvenih storitev posvetila zdravstveni pismenosti. Sodelujoči so se strinjali, da sta ustrezna zdravstvena in digitalna pismenost bolnikov ključni za sodobno zdravstveno obravnavo in dobro obvladovanje bolezni, saj brez kompetenc, opolnomočenosti in računalniških veščin bolniki in ostali uporabniki zdravstvenih storitev vse težje vstopajo v zdravstveni sistem. Pri informiranju, edukaciji in podpori bolnikom v digitalni transformaciji zdravstva so organizacije zagovornikov bolnikov posledično morda pomembnejše kot kadarkoli doslej. Čeprav razcvet informacijsko – komunikacijskih tehnologij in elektronskih virov za zdravstveni sistem pomeni velik napredek v razpoložljivosti, izmenjavi in uporabi zdravstvenih podatkov, interaktivni komunikaciji z zdravstvenimi strokovnjaki in razvoju e-zdravja, brez primerne digitalne zdravstvene pismenosti bolniki ne morejo dostopati in varno uporabljati zdravstvenih informacij v spletnem okolju.
Zdravstvena pismenost uporabnikom zdravstvenih storitev omogoča lažje pridobivanje, razumevanje in vrednotenje zdravstvenih informacij ter posledično sprejemanje informiranih odločitev o lastnem zdravju. Zagotavlja tudi učinkovitejše komuniciranje z zdravstvenimi delavci, sodelovanje v načrtovanju zdravljenja in okrevanja ter lažjo pot skozi zdravstveni sistem. Višja raven zdravstvene pismenosti je tako povezana z bolj zdravim življenjskim slogom, boljšo udeležbo na preventivnih pregledih in v presejalnih programih, obvladovanjem že pridobljene kronične bolezni in posledično tudi z izboljšanjem zdravstvenega stanja ter kakovosti življenja. Zato je zdravstvena pismenost predpogoj za učinkovito primarno in sekundarno preventivo. Dobra populacijska in organizacijska zdravstvena pismenost prispevata tudi k sodobnim rešitvam v zdravstveni oskrbi, odpornejšemu zdravstvenem sistemu in prebojem v znanosti. Po drugi strani pa je nizka stopnja zdravstvene pismenosti povezana z slabšim znanjem o zdravju in lastni kronični bolezni ter težavami z obvladovanjem le te, neustrezno uporabo zdravstvenih storitev, težavami z udejanjanjem priporočenih vedenj, interpretacijo vrednosti meritev in jemanjem terapije. Botruje tudi slabšemu zdravstvenemu stanju in možnosti preživetja ter višjim stroškom zdravstvenega varstva.
Po uvodnih nagovorih generalnega sekretarja ZOPS Gregorja Cuzaka in mag. Barbare Stegel, generalne sekretarke Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, pokrovitelja izobraževalnega srečanja, se je posvet nadaljeval s predavanji treh strokovnjakinj, ki se pri svojem raziskovalnem delu posvečajo zdravstveni pismenosti in zdravstvenim podatkom. Sanja Vrbovšek, raziskovalka integrirane preventive kroničnih bolezni za odraslo populacijo in zdravstvene pismenosti z Nacionalnega inštituta za javno zdravje, je na posvetu izpostavila, da je za izboljšanje zdravstvene pismenosti, zmanjševanje neenakosti in bolj zdrave skupnosti ključno povezovanje različnih sektorjev, strokovnjakov, organizacij in bolnikov: »O zdravstveni pismenosti se veliko govori, konec koncev je tudi ena ključnih tem evropskih politik na področju zdravstva. Po drugi strani pa se občasno sliši, da je to samo staro vino v novi steklenici, da naj bi bila to zdravstvena vzgoja, zdravstveno informiranje. Pa vendar je zdravstvena pismenost bistveno več. Gre za znanje in kompetence uporabnikov zdravstvenih storitev ter za njihovo motivacijo.« Da so dejanske kompetence in motivacija bolnikov, da razumejo, si zapomnijo in uporabijo zdravstvene informacije, pogosto spregledane tudi s strani zdravstvenih delavcev s pristopom »pacientu sem povedala, naj jemlje zdravilo«, je napaka. Kajti, da bi lahko bolnik navodila upošteval, jih mora najprej razumeti. Kako zdravstveno pismen je na koncu dneva pacient, tako ni odvisno le od njegove pripravljenosti za učenje in sodelovanje, temveč tudi od tega, kako mu zdravstveni delavci podajo informacije in ali so mu na razpolago za dodatna pojasnila. Zdravstvena pismenost posega na polje obvladovanja bolezni, izide zdravljenja in ne nazadnje tudi na stroške zdravstvenega varstva. Nacionalna raziskava zdravstvene pismenosti v Sloveniji ZaPIS iz leta 2019 je pokazala, da kar 70% vprašanih odraslih oseb s kronično boleznijo ne ve, kako se orientirati v zdravstvenem sistemu. Za izboljšanje zdravstvene pismenosti je potrebna integrirana zdravstvena oskrba na strokovni, kadrovski in organizacijski ravni.
Aktualna digitalizacija zdravstva od vseh deležnikov v zdravstvu terja ustrezno digitalno zdravstveno pismenost, za katero so poleg zdravstvenih kompetenc potrebne tudi digitalne veščine. Za digitalno zdravstvo pa so ključni zdravstveni podatki in uporaba novih tehnologij, je v svoji predstavitvi poudarila dr. Tanja Zdolšek Draksler, raziskovalka podatkovne znanosti in uporabe umetne inteligence na področju redkih bolezni z Inštituta Jožef Stefan. Dr. Zdolšek Draksler je sicer tudi mama deklice z redko nevrorazvojno boleznijo sindromom Kleefstra, kar jo je motiviralo k aktivnemu vključevanju in sodelovanju s skupnostmi redkih bolezni na evropski in globalni ravni ter k ustanovitvi ustanove IDefine Europe, ki jo tudi vodi. Danes je v svetu namreč identificiranih že okoli 7.000 različnih redkih bolezni in 80% redkih bolezni je genetskih. Zato dr. Zdolšek Draksler opozarja, da starši otrok z redkimi boleznimi ne morejo delovati le lokalno ali nacionalno, temveč je za raziskovanje in zagovorništvo bolnikov z redkimi bolezni nujno povezovanje in tvorjenje globalne skupnosti: »Ker nas je tako malo, da ne bomo nič spremenili. V Sloveniji je nekje 5 otrok s sindomom Kleefstra, zato je potreben mednarodni, globalni pristop. Digitalno zdravstvo nam daje neko upanje, da bomo na podlagi teh novih tehnologij in dostopa do podatkov lahko boljše razumeli redke bolezni in jih obvladovali.« Pojasnila je, da so digitalne tehnologije še posebej dragocene za globlje razumevanje in obvladovanja redkih bolezni, saj so digitalne tehnološke rešitve izboljšale možnosti za na bolnika osredotočene pristope. Umetna inteligenca in strojno učenje tako omogočata lažjo diagnostiko nekaterih redkih bolezni. Z novimi biomarkerji lahko umetna inteligenca in strojno učenje prispevata tudi k natančnejši napovedi bolezni, izboru najustreznejših terapevtskih pristopov za bolnike in odkrivanju zdravil. Trenutno se že uporabljata tudi v predkliničnih raziskavah, kliničnih preizkušanjih ter v analitiki registrov bolnikov in digitalnih zdravstvenih kartotek. K razvoju digitalnih rešitev za raziskovanje redkih bolezni v svetu pomembno prispevajo močne skupnosti bolnikov, posebne fundacije za raziskovanje in financiranje raziskav redkih bolezni ter rastoči biotehnološki trg, osnova za tovrstne digitalne rešitve pa je dostop do zbirk zdravstvenih podatkov. Za njihovo uporabo sta potrebna izboljšanje digitalne zdravstvene pismenosti in aktivna globalna skupnost zagovornikov bolnikov z redkimi boleznimi, je še poudarila raziskovalka dr. Zdolšek Draksler.
Tretje predavanje je bilo posvečeno vizualizaciji podatkov. Dr. Alenka Guček, raziskovalka z Oddelka za umetno inteligenco na Inštitutu Jožef Stefan in predavateljica predmeta Vizualizacija podatkov na Univerzi v Uppsali, je izpostavila, da je vizualizacija podatkov pomemben del zdravstvene pismenosti, saj bolnikom omogoča lažje razumevanje kompleksnih zdravstvenih informacij, strokovnjakom pa zagotavlja boljšo analizo in interpretacijo podatkov ter boljše upravljanje zdravstvenih sistemov.
Sledilo je delo po skupinah. Sodelujoči so poudarili, da sta ustrezna zdravstvena in digitalna pismenost bolnikov ključni za sodobno zdravstveno obravnavo in dobro obvladovanje bolezni, saj brez kompetenc, opolnomočenosti in računalniških veščin bolniki in ostali uporabniki zdravstvenih storitev vse težje vstopajo v zdravstveni sistem. Zato je ob pospešeni digitalizaciji nujno, da ostanejo uporabnikom v zdravstvenem sistemu na voljo tudi klasične poti komunikacije in obravnave. Pri informiranju, edukaciji in podpori bolnikom v digitalni transformaciji zdravstva so organizacije zagovornikov bolnikov posledično morda pomembnejše kot kadarkoli doslej. Čeprav razcvet informacijsko – komunikacijskih tehnologij in elektronskih virov za zdravstveni sistem pomeni velik napredek v razpoložljivosti, izmenjavi in uporabi zdravstvenih podatkov, interaktivni komunikaciji z zdravstvenimi strokovnjaki in razvoju e-zdravja, ostaja namreč dejstvo, da brez ustreznih zdravstvenih in računalniških kompetenc ali tki. digitalne zdravstvene pismenosti bolniki ne morejo dostopati in varno uporabljati zdravstvenih informacij v spletnem okolju.
“,”Jaka Verbic Miklic”,1700154720,1700154720,sl,15409,306,15408,43,0,NULL,,”Posvet o zdravstveni pismenosti”,posvet-o-zdravstveni-pismenosti,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,1,0,1701969351,1701969351
1025,15411,”Zaznamujemo svetovni dan duševnega zdravja”,”Nova raziskava Eurobarometer o duševnem zdravju je pokazala, da se je v Sloveniji v zadnjih 12 mesecih s čustveno ali psihosocialno stisko, kot je občutek depresije ali anksioznosti, soočilo 41 odstotkov vprašanih, ob tem je brez strokovne pomoči ostalo 61 odstotkov vprašanih.”,”
Ljubljana, 10. oktobra – Danes zaznamujemo svetovni dan duševnega zdravja, ki letos poteka s sloganom Duševno zdravje je univerzalna človekova pravica. Dan poudarja pomen sodelovanja in povezovanja vseh v prizadevanjih za preprečevanje, prepoznavanje in zdravljenje duševnih težav in motenj ter krepitev dobrega duševnega zdravja vseh prebivalcev, so zapisali na NIJZ.
Svetovni dan duševnega zdravja vsako leto zaznamujemo 10. oktobra in je namenjen ozaveščanju o pomenu duševnega zdravja za dobrobit posameznika in družbe, so zapisali na ministrstvu za zdravje. Menijo, da je letošnji dan priložnost, da izboljšamo znanje, okrepimo opolnomočenost in spodbudimo ukrepe. Spomnili so, da je vlada letošnje leto razglasila za slovensko leto duševnega zdravja.
Univerzalna človekova pravica na področju duševnega zdravja vključuje razpoložljivo, dostopno, sprejemljivo in kakovostno oskrbo, zato krepijo organizacijske oblike na primarni ravni zdravstvenega varstva ter razvijajo mrežo centrov za duševno zdravje odraslih in centrov za duševno zdravje otrok in mladostnikov.
V letu 2024 pa na ministrstvu načrtujejo vpeljavo sistema vrstniške pomoči na področju duševnega zdravja in začetek projekta z naslovom Razvoj programov duševnega zdravja za otroke, mladostnike in mlajše odrasle v okviru načrta za okrevanje in odpornost. Dodali so, da pripravljajo zakon o duševnem zdravju ter zakon, ki bo uredil področje psihoterapije.
Da brez duševnega zdravja ni zdravja, poudarjajo tudi v Zbornici zdravstvene in babiške nege Slovenije – Zvezi strokovnih društev medicinskih sester, babic in zdravstvenih tehnikov Slovenije (Zbornica – Zveza). Letošnji slogan izpostavlja, da ima vsak posameznik pravico, da se dobro počuti, živi kakovostno in je zdrav, so zapisali.
Dodali so, da imajo medicinske sestre pomembno vlogo pri skrbi za duševno zdravje. Predsednik sekcije medicinskih sester in zdravstvenih tehnikov v psihiatriji pri Zbornici – Zvezi Aljoša Lapanja je spomnil, da je dolžnost medicinskih sester in zdravstvenih tehnikov, da osebam s težavami v duševnem zdravju znajo in zmorejo brez predsodkov, humano, empatično in strokovno izvajati vse aktivnosti zdravstvene nege.
Iz Varstveno delovnega centra Tončke Hočevar pa so sporočili, da je duševno zdravje sestavni del celostnega zdravja in blaginje vsakega posameznika. “Duševno zdravje je ključno za splošno kakovost življenja naših uporabnikov. V centru jim nudimo celostno, holistično in individualno obravnavo,” so zapisali v sporočilu za javnost.
Nova raziskava Eurobarometer o duševnem zdravju je pokazala, da se je v Sloveniji v zadnjih 12 mesecih s čustveno ali psihosocialno stisko, kot je občutek depresije ali anksioznosti, soočilo 41 odstotkov vprašanih. Ob tem je brez strokovne pomoči ostalo 61 odstotkov vprašanih.
Ob svetovnem dnevu duševnega zdravja v Sloveniji potekajo številni dogodki. V Slovenskem združenju za duševno zdravje Šent ob 30-letnici pripravljajo prireditev, kjer bo imela nagovor predsednica republike Nataša Pirc Musar. Dogodke med drugim pripravljajo tudi Slovenska nacionalna zveza za duševno zdravje v športu, Zveza prijateljev mladine Ljubljana Moste-Polje, Kinodvor in novomeška enota Nacionalnega inštituta za javno zdravje (NIJZ).
“,”Jaka Verbic Miklic”,1696927560,1696927560,sl,15411,306,15410,43,0,NULL,,”Zaznamujemo svetovni dan duševnega zdravja”,zaznamujemo-svetovni-dan-dusevnega-zdravja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1702201635,1702201635
1026,15414,”Obveščanje o neželenih učinkih ključno za uspešno zdravljenje”,”V mednarodni kampanji #MedSafetyWeek po njihovih navedbah letos sodeluje več kot 80 držav, ki se skupaj trudijo za varnejšo uporabo zdravil po vsem svetu.”,”
Ljubljana, 6. novembra – Danes se začenja mednarodna medijska kampanja za ozaveščanje o pomembnosti poročanja o neželenih učinkih zdravil #MedSafetyWeek, ki bo s temo Kdo lahko poroča potekala do petka. V Lekarniški zbornici Slovenije ob tem pozivajo k pozornosti na potencialne neželene učinke zdravil, saj gre za ključen dejavnik pri učinkovitosti zdravljenja.
Uporaba zdravil dokazano preprečuje in zdravi številne bolezni, vendar ima vsako zdravilo poleg svojega koristnega, pričakovanega in želenega učinka tudi neželene. Neželeni učinek zdravila je vsaka škodljiva in nenamerna reakcija, ki lahko nastane pri odmerkih, ki se običajno uporabljajo v zdravljenju, so ob mednarodnem tednu pojasnili na lekarniški zbornici.
Vse zdravstvene delavce in paciente zato pozivajo, naj ob pojavu neželenih učinkov poročajo Nacionalnemu centru za farmakovigilanco pri Javni agenciji Republike Slovenije za zdravila in medicinske pripomočke (JAZMP). Na ta način je možna posodobitev varnostnega profila zdravila, so poudarili.
“Čeprav se je nekaterim neželenim učinkom zdravil težko popolnoma izogniti, pa lahko z upoštevanjem pravilne uporabe zdravil številne med njimi preprečimo ali vsaj omilimo,” poudarja nacionalni koordinator projekta farmacevtske skrbi Vprašaj o svojem zdravilu pri zbornici Bojan Madjar. Kot primer navaja navodilo, da določeno zdravilo vzamemo s hrano, s čimer vplivamo na izraženost neželenih učinkov v prebavilih. Drugi primer je jemanje zdravila ob določenem delu dneva, na primer zdravila z učinkom uspavanja vzamemo zvečer.
O pojavu domnevnega neželenega učinka lahko bolnik poroča sam, priporočljivo pa se je prej o tem posvetovati z zdravstvenim delavcem, na primer s farmacevtom ali zdravnikom. V Lekarniški zbornici posameznikom svetujejo, da imajo ob poročilu o neželenem učinku s sabo kartico zdravstvenega zavarovanja ali novo biometrično osebno izkaznico, ki farmacevtu omogoča dostop do podatkov o pacientovih zdravilih. Če ima pacient v okviru brezšivne skrbi osebno kartico zdravil, je ta dokument lahko v pomoč tudi v takem primeru.
S poročanjem o domnevnem neželenem učinku prispevamo pomembne podatke za zaznavanje tako imenovanih varnostnih signalov in oceno razmerja med koristjo in tveganjem zdravil. V prihodnje bo zaradi tega zdravljenje z zdravili varnejše za vse paciente, še svetujejo na zbornici.
Z letošnjo temo Kdo lahko poroča želijo sodelujoče države poudariti ključno vlogo, ki jo ima vsak, tako bolniki, zdravniki, medicinske sestre ali farmacevti, da poročajo o neželenem učinku in s tem prispevajo k varnejši uporabi zdravil, so poudarili na JAZMP.
V mednarodni kampanji #MedSafetyWeek po njihovih navedbah letos sodeluje več kot 80 držav, ki se skupaj trudijo za varnejšo uporabo zdravil po vsem svetu. Vsak nacionalni pristojni organ na področju zdravil vodi sistem za zaznavanje in analizo neželenih učinkov zdravil. Namen tovrstnega spremljanja varnosti je pridobivanje več informacij o že znanih kot tudi o novih oziroma nepričakovanih neželenih učinkih zdravil. Stalno zbiranje in spremljanje informacij v poročilih pomaga pri prepoznavanju morebitnih tveganj, povezanih z zdravili, in pri sprejemanju ukrepov za njihovo zmanjševanje.
Ob tem so na JAZMP pripravili zgibanko za splošno javnost o pomembnosti poročanja o neželenih učinkih, ki je dostopna na povezavi https://www.jazmp.si/humana-zdravila/farmakovigilanca/porocanje-o-nezelenih-ucinkih-zdravil/#MedSafetyWeek2023.
“,”Jaka Verbic Miklic”,1699264320,1699264320,sl,15414,306,15413,43,0,NULL,,”Obveščanje o neželenih učinkih ključno za uspešno zdravljenje”,obvescanje-o-nezelenih-ucinkih-kljucno-za-uspesno-zdravljenje,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1702201979,1702202018
1027,15416,”Pred vrati sezona nalezljivih bolezni, nujna skrb za zaščito in zdravje”,”Slovenija je žal ena od evropskih držav z najmanjšo precepljenostjo proti gripi in smo še zelo daleč od cilja Svetovne zdravstvene organizacije, da bi se v vsaki sezoni gripe cepilo vsaj 75 odstotkov starejših od 65 let”,”
Ljubljana, 14. novembra – S hladnejšimi meseci je pred vrati sezona nalezljivih bolezni, zato strokovnjaki ponovno opozarjajo na pomen cepljenja in drugih zaščitnih ukrepov. Sezona gripe se sicer še ni uradno začela, a bolniške postelje se polnijo. “Tveganja cepljenja so zelo majhna, koristi pa zelo velike,” je na okrogli mizi STAkluba poudaril pediater Denis Baš.
Začetek sezone gripe se po besedah Nadje Šinkovec Zorko z Nacionalnega inštituta za javno zdravje (Nijz) pričakuje v naslednjih tednih, običajno se začne proti koncu leta in doseže vrh v januarju ali februarju. Smo pa v Sloveniji že potrdili posamezne primere gripe, podobno velja za druge nalezljive bolezni, kot so pnevmokokne okužbe in respiratorni sincicijski virus (RSV).
“Slovenija je žal ena od evropskih držav z najmanjšo precepljenostjo proti gripi in smo še zelo daleč od cilja Svetovne zdravstvene organizacije, da bi se v vsaki sezoni gripe cepilo vsaj 75 odstotkov starejših od 65 let,” je povedala na današnji okrogli mizi, ki jo je v Ljubljani gostil STAklub.
V lanski sezoni se je proti gripi cepilo okoli šest odstotkov Slovencev, pri starejših od 65 let je bil delež precepljenosti 19 odstotkov.
Specialistka infektologije in pediatrije Tatjana Mrvič s klinike za infekcijske bolezni in vročinska stanja UKC Ljubljana je pojasnila, da lahko pride do resnejših zapletov zaradi gripe ne le pri bolj ogroženih skupinah, ampak tudi pri sicer povsem zdravih ljudeh. “Tudi ti lahko pristanejo zaradi težje oblike bolezni v intenzivni enoti,” je dejala.
Potrdila je, da se število respiratornih virusnih okužb v zadnjih tednih povečuje, ne samo na infekcijski kliniki ampak tudi v urgentni ambulanti interne klinike. “Dotok pacientov je kar velik, tako da že počasi zmanjkuje postelj, pa se sezona še ni začela. Trenutno opažamo, da je potrjenih nekaj več okužb z RSV pri dojenčkih oziroma majhnih otrocih, tako da bo to nekakšen prvi val, v roku enega meseca verjetno sledi sezona gripe,” je dejala.
Podobno opažajo v ambulantah družinske medicine. Specialistka družinske in urgentne medicine Vesna Homar iz Zdravstvenega doma Vrhnika je povedala, da priporočajo cepljenje proti gripi in drugim nalezljivim boleznim celotni populaciji, ne le najbolj ogroženim skupinam. “Ljudje se morajo zavedati, da je to zelo pomembno ne le zanj osebno, ampak tudi za ljudi okoli njega,” je poudarila.
Visok delež precepljenosti je pomemben še posebej med starejšimi, na primer v domovih za starejše, kjer je v teh dneh treba delovati še posebej previdno. Prehlajeni sorodniki naj ne hodijo na obiske, obiskovalci naj bodo cepljeni, pa tudi sicer naj ljudje upoštevajo zaščitne ukrepe, kot so dosledno umivanje rok, pogosto prezračevanje prostorov in prednostno zadrževanje na svežem zraku.
Specialist pediatrije in predsednik sekcije za primarno pediatrijo Denis Baš je med drugim izpostavil spletno stran cepljenje.info, kjer lahko ljudje najdejo vse potrebne in verodostojne informacije. Opaža namreč, da ljudje še vedno premalo vedo o nevarnosti posameznih nalezljivih bolezni in pomenu ustrezne zaščite pred njimi. Ključno se mu zdi, da se v javnosti znova vzpostavi zaupanje do cepljenja, ki se je med epidemijo covida-19 skrhalo. “Dajmo izkoristiti, kar država plača, in se cepiti, da lahko živimo čim bolj polno življenje,” je dejal.
“Cepljenje je še vedno najbolj učinkovit in varen način za zaščito pred nalezljivimi boleznimi,” je poudarila tudi Nadja Šinkovec Zorko. To po njenih besedah velja tako za obvezna kot priporočljiva cepljenja, pa tudi za bolezni, ki jih trenutno v Sloveniji ni več, a obstajajo drugod po svetu in se lahko s potovanji ponovno prenesejo k nam. “V Sloveniji imamo dobra, učinkovita in varna cepiva, zato res ni razlogov za oklevanje za cepljenje,” je dodala.
“,”Jaka Verbic Miklic”,1699956000,1699956000,sl,15416,306,15415,43,0,NULL,,”Pred vrati sezona nalezljivih bolezni, nujna skrb za zaščito in zdravje”,pred-vrati-sezona-nalezljivih-bolezni-nujna-skrb-za-zascito-in-zdravje,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1702202509,1702202509
1028,15418,”NIJZ: Najboljša preventiva pred okužbo oslovskega kašlja je cepljenje”,”Precepljenost otrok se je namreč v zadnjih dveh letih precej znižala.”,”
Ljubljana, 1. decembra – V novembru so v Sloveniji zabeležili rahel porast števila primerov oslovskega kašlja v primerjavi s prejšnjimi meseci, vendar številke po navedbah Nacionalnega inštituta za javno zdravje (NIJZ) še niso visoke. Pomembno je, da so prebivalci in zdravstveni delavci pozorni na znake oslovskega kašlja, najboljša preventiva pred okužbo pa je cepljenje.
Ob izrazitem povečanju števila primerov oslovskega kašlja na Hrvaškem na NIJZ opozarjajo, da je na oslovski kašelj potrebno posumiti pri vsaki osebi, ki kašlja 14 dni ali več in kašelj poteka bodisi v obliki napadov ali ga spremlja riganje ob vdihu ali bruhanje po kašlju.
Oslovski kašelj je zelo nalezljiva bakterijska okužba dihal, ki povzroča hude napade kašlja. Bolezen najbolj prizadene dojenčke do šestega meseca starosti. Pri otrocih so značilni napadi suhega, dražečega kašlja, ki včasih spominja na oslovsko riganje in med katerim bolnik težko vdihne ter hlasta za zrakom, pordi ali pomodri.
Pri dojenčkih, mlajših od treh mesecev, lahko bolezen poteka neznačilno; opazimo lahko le dihalne premore brez kašlja. Pri cepljenih otrocih in odraslih je kašelj lahko blag, neznačilen in ga zato pogosto ne prepoznamo. Na oslovski kašelj moramo pomisliti pri vsaki osebi z dolgotrajnim kašljem, ki je edini ali prevladujoč simptom bolezni, opozarjajo na NIJZ.
Cepljenje proti oslovskemu kašlju je priporočljivo za otroke, odrasle, nosečnice, vse zdravstvene delavce, posebej pa za tiste, ki so zaposleni na specializiranih oddelkih, kot so neonatalni, infektološki, pediatrični, kjer se zdravijo najbolj ogrožene skupine, vključno z novorojenčki, nedonošenčki in dojenčki.
“Zdravstveni delavci naj bodo pozorni na znake oslovskega kašlja pri svojih pacientih, tako pri otrocih kot pri odraslih. V primeru suma na oslovski kašelj je potrebna laboratorijska potrditev in prijava epidemiološki službi,” so navedli. Potrditi je potrebno vsak sporadičen primer, v primeru izbruha pa vsaj en primer oslovskega kašlja. Najbolj primerna metoda za potrditev akutne okužbe je potrditev bakterijske nukleinske kisline s testom PCR, na osnovi brisa nosno-žrelnega prostora. Preiskava je najbolj optimalna v prvih treh tednih po začetku znakov bolezni.
Pomembno je preveriti cepilni status pri ciljnih skupinah in zagotoviti čim boljšo precepljenost, so dodali. Precepljenost otrok se je namreč v zadnjih dveh letih precej znižala.
Več informacij o bolezni je na voljo na spletni strani NIJZ.
“,”Jaka Verbic Miklic”,1701425280,1701425280,sl,15418,306,15417,43,0,NULL,,”NIJZ: Najboljša preventiva pred okužbo oslovskega kašlja je cepljenje”,nijz-najboljsa-preventiva-pred-okuzbo-oslovskega-kaslja-je-cepljenje,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1702202962,1702202962
1029,15420,”Število cepljenih proti gripi v letošnji sezoni že presega 100.000″,”Cepljenje proti gripi je še posebej priporočljivo za starejše od 65 let, otroke od šest do 23 mesecev in nosečnice, ker se zapleti bolezni v teh skupinah pojavljajo pogosteje kot pri preostali populaciji.”,”
Ljubljana, 6. decembra – Od začetka sezonskega cepljenja proti gripi 1. oktobra do danes se je v pri nas cepilo 100.090 ljudi. Za primerjavo, v lanski sezoni se je proti gripi cepilo 129.148 ljudi. Cepiva je trenutno na voljo v zadostnih količinah, so sporočili z Nacionalnega inštituta za javno zdravje (NIJZ). Največ cepljenih je starejših od 65 let.
Največ, približno tretjina vseh cepljenj je bilo doslej izvedenih v ljubljanski zdravstveni regiji (33.008), sledita mariborska (16.949) in celjska regija (14.779).
Dve tretjini vseh cepljenih je starejših od 65 let (69.700), kar je po mnenju NIJZ pomemben podatek. Cepljenje proti gripi je še posebej priporočljivo za starejše od 65 let, otroke od šest do 23 mesecev in nosečnice, ker se zapleti bolezni v teh skupinah pojavljajo pogosteje kot pri preostali populaciji.
Priporočljivo je tudi za kronične bolnike, ne glede na starost. Sem sodijo kronične bolezni obtočil, dihal, sečil, jeter, metabolne bolezni, nekatere živčno-mišične in vezivne bolezni, maligna obolenja, nekatere bolezni krvi in krvotvornih organov ter bolezni, ki oslabijo imunski odziv, pa tudi otroci, ki so dlje časa zdravljeni z salicilati.
Cepljenje proti gripi se izvaja v jesenskih in zimskih mesecih s cepivom z ustrezno antigensko sestavo glede na priporočila Svetovne zdravstvene organizacije. Za letošnjo sezono gripe je bilo naročenih in prejetih 185.000 odmerkov cepiva proti gripi. Do danes je bilo izdanih 144.500 odmerkov cepiv, na zalogi pa je še 40.500 odmerkov, so navedli.
V tednu od 20. do 26. novembra je bilo obiskov in posvetov v ambulantah osnovnega zdravstvenega varstva zaradi gripi podobnih bolezni nekoliko več kot v preteklem tednu. Incidenci akutnih okužb dihal in gripi podobnih bolezni sta primerni za sezono in podobni kot v istem obdobju lani. Skupna incidenca akutnih okužb dihal je presegla prag 1635 na 100.000 in se ocenjuje kot srednje visoka. Skupna incidenca gripi podobnih bolezni po navedbah NIJZ še ni presegla praga.
Priliv vzorcev bolnikov z gripi podobnimi boleznimi in akutno okužbo dihal v laboratorije je bil v omenjenem tednu nekoliko višji kot pretekli teden. V tem tednu so v 18 vzorcih določili influenco tipa A, kar predstavlja 1,7 odstotka vseh testiranih vzorcev. Delež pozitivnih na gripo med vzorci iz mreže primarnega zdravstva je bil višji kot med vzorci iz bolnišnic, so navedli na NIJZ.
“,”Jaka Verbic Miklic”,1701857580,1701857580,sl,15420,306,15419,43,0,NULL,,”Število cepljenih proti gripi v letošnji sezoni že presega 100.000″,stevilo-cepljenih-proti-gripi-v-letosnji-sezoni-ze-presega-100-000,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1702203324,1702203324
1030,15422,”4. konferenca Življenje z rakom”,”Zakaj je za bolnike z rakom ključno urediti integracijo v poklicno življenje in kako bi bilo mogoče ta pomemben del celostne rehabilitacije izvajati na sistemski ravni, da bo dostopno prav vsem bolnikom?”,”
6.2. 2024 je potekala 4. konferenca Življenje z rakom – Bolnikova pot skozi zdravstveni sistem in reintegracija v poklicno življenje, v kateri so soorganizatorji Slovensko združenje organizacij bolnikov z rakom ONKO NET, Zdravniška zbornica Slovenije in Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb v Sloveniji iskali odgovore na izzive, s katerimi se srečujejo bolniki z rakom v Sloveniji. Kakšna je njihova pot skozi zdravstveni sistem? Zakaj je za bolnike z rakom ključno urediti integracijo v poklicno življenje in kako bi bilo mogoče ta pomemben del celostne rehabilitacije izvajati na sistemski ravni, da bo dostopno prav vsem bolnikom?
Odgovore na te pomembne izzive današnje družbe je s podatki raziskav, izkušnjami, primeri dobrih praks in konkretnimi predlogi v osmih predavanjih in okrogli mizi iskalo 16 predstavnikov društev bolnikov, strokovnjakov, ki so vpeti v zdravljenje in rehabilitacijo bolnikov z rakom, predstavnikov javnih zavodov, ki skrbijo za obravnavo bolnikov, ter odločevalcev.
V uvodnem nagovoru je mag. Barbara Stegel, generalna sekretarka Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb v Sloveniji, poudarila, da je namen konference »motivirati ter držati prostor za dialog in nadaljnje izboljšave. Veseli smo dobrih praks, ker pomenijo temelj in dajejo upanje za boljše ravnanje in načrtovanje za naprej ter krepijo zavedanje, da imamo v našem sistemu že veliko dobrega, kar je mogoče uporabiti tudi na drugih primerih.« Na kakovost spoprijemanja z boleznijo in življenja z njo bistveno vplivajo poti skozi zdravstveni sistem, je poudarila, ključno pa je to, da so speljane tako, da so čim bolj dostopne in da jim bolniki lahko sledijo.
Tokratna konferenca se je posvetila precej neurejenemu področju za bolnike z rakom, njihovi reintegraciji v poklicno življenje. Kristina Modic, predsednica organizacije ONKO NET in izvršna direktorica Slovenskega združenja bolnikov z limfomom in levkemijo, L & L, je izpostavila: »Onkološki bolniki se srečujejo z najrazličnejšimi težavami in stiskami, ki močno vplivajo na kakovost njihovega življenja in življenja svojcev. Dolgotrajni bolniški staleži so breme za družbo, a trenutni sistem ne zagotavlja dovolj kapacitet, da bi se v poklicno rehabilitacijo lahko vključili vsi, ki jo potrebujejo. Zato smo se na tem dogodku povezali, da bi našli kratkoročne in dolgotrajne rešitve.«
Bolnikova pot skozi zdravstveni sistem
Zakaj je pot bolnika ključnega pomena za celostno in celovito obravnavo bolnika, še posebno bolnika z rakom, je predstavil doc. dr. Tit Albreht, dr. med., spec. socialne medicine in mag. javnega zdravja, raziskovalec z Nacionalnega inštituta za javno zdravje (NIJZ). »Pot bolnika skuša orisati pot, ki jo prehodi bolnik v vseh postopkih, od diagnoze, zdravljenja, do življenja z boleznijo ali soočanja s posledicami zdravljenja. Predstavlja orodje za celostno vrednotenje in obravnavanje bolnikovih potreb in je najboljše orodje za udejanjanje zdravstvenega sistema, ki je osredotočen na bolnika.« Poti bolnika skozi zdravstveni sistem ponazarjajo celotno sestavo aktivnosti in potreb bolnika, s čimer je mogoče kakovostno podpreti načrtovanje vseh storitev, vključno z viri za izvajanje.
Dr. Tanja Španić, predsednica Združenja Europa Donna Slovenija, ki je izpostavila, da poleg celostne obravnave bolnikov, ki naj bi bila osrediščena na bolnika, ostaja ključna »multidisciplinarna obravnava bolnikov. Bolniki pa so večinoma zadovoljni takrat, ko lahko aktivno soodločajo o svojem zdravju.« Pri tem ni pomembna le njihova zdravstvena pismenost, temveč tudi viri pomoči, ki so jim na voljo na poti obravnave – da se lahko pogovorijo o postopkih zdravljenja, dobijo psihoonkološko podporo in pomoč pri vračanju nazaj na delo po zaključku bolniškega staleža. Ker področje ni sistemsko urejeno, se društva bolnik trudijo to vsaj delno nadomestiti s svojimi programi. .
Potrebe bolnikov na poti onkološke oskrbe je predstavila tudi Ivka Glas, predsednica Združenja EuropaColon Slovenija. Poudarila je, da je poleg zagotavljanja celostne obravnave bolnikov ključno skrajšati pot do diagnoze pri bolnikih z raki prebavil, centralizirati diagnostiko in zdravljenje, poskrbeti, da so vse te storitve na voljo v javnem sistemu , in omogočiti obravnavo vseh bolnikov na multidisciplinarnem konziliju: »Bolniki si želijo čim hitrejši začetek zdravljenja, več jasne in razumljive komunikacije z zdravnikom, pot do diagnoze ostaja predolga.«
Osebno izkušnjo na poti zdravljenja raka materničnega vratu (RMV) je delila tudi Barbara Drmota, kostumografinja in umetnica. Njena pot do diagnoze je bila dolga, v postopkih obravnave pa je pogrešala več jasne in bolniku razumljive komunikacije ter dostop do svoje onkologinje. »Izjemno mi je pomagala psihoonkološka obravnava na Onkološkem inštitutu, pokazala mi je pot, kako sprostiti svoje najgloblje skrbi, ne da bi obremenjevala najbližje,« je izpostavila ter vse bolnike pozvala, naj ne obupajo, zdravnike pa, naj v odnosu z bolniki poskušajo poleg svoje znanstvene plati pokazati tudi ali predvsem človeško plat.
Da je zdravstvena pismenost Slovencev, še posebej bolnikov s kroničnimi boleznimi, velik izziv, so pokazali rezultati raziskave Nacionalne raziskave zdravstvene pismenosti v Sloveniji (ZaPiS), ki jih je predstavila vodja raziskave Sanja Vrbovšek z NIJZ. V raziskavi so ugotovili, da ima kar 48 % Slovencev omejeno zdravstveno pismenost, še večji delež, 61 %, pa ima omejeno navigacijsko zdravstveno pismenost. »Kronični bolniki imajo še nižjo stopnjo zdravstvene pismenosti, še več imajo težav s presojo in uporabo zdravstvenih informacij, nižja pa je tudi stopnja njihove navigacijske zdravstvene pismenosti, torej, kako so se zmožni orientirati v zdravstvenem sistemu.« Izpostavila je tudi, da so ugotovili nizko stopnjo digitalne zdravstvene pismenosti in slabo presojo kredibilnosti virov zdravstvenih informacij na spletu.
Dr. Simona Borštnar, dr. med., spec. internistične onkologije z Onkološkega inštituta Ljubljana, je predstavila kompleksno pot bolnic z rakom dojk, ki je za vsakega bolnika glede na njegove potrebe malce drugačna. V obravnavi bolnikov je nujno potrebno timsko delo in sodelovanje različnih strok. Trenutno se po koncu zdravljenja bolnike spremlja na terciarni ravni, kar pa bo v prihodnje glede na naraščanje števila uspešno zdravljenih bolnikov vse večje breme. »Čaka nas še sprememba sledenja bolnikov. To mora biti strokovno, ne zahteva pa nujno obiska v bolnišnici, želimo si, da bi lahko spremljanje bolnic iz specializiranih onkoloških centrov preusmerili na primarno raven.«
Reintegracija bolnikov v poklicno in družbeno življenje
Darja Molan, koordinatorica projektov in programov v Združenju EuropaDonna Slovenija ter pobudnica projekta Nazaj v življenje, je predstavila prizadevanja Združenja za individualno obravnavo vseh bolnic v postopku vračanja na delo. Ta proces naj se začne že v času bolniškega staleža, tako jim bo povzročil manj stresa. Poudarila je, da imamo sedaj tako primere slabih in dobrih izkušenj z delodajalci, kar je nedopustno: »Kakšen je sistem, ki dovoljuje takšno ohlapnost? Kakovost življenja po raku ne bi smela biti odvisna od sreče ali od tega, kako se boš znašel v sistemu.« Prav tako je treba omogočiti ustrezno podporo tudi mladim bolnikom, ki še niso stopili na trg dela in zato niso upravičeni do pravic poklicne rehabilitacije ali pokojninske oziroma invalidske obravnave.
Zgodnja poklicna rehabilitacija je v praksi žal dostopna le peščici onkoloških bolnikov, a predstavlja temeljno pravico oseb z zmanjšano delovno sposobnostjo. Na to je opozorila Tina Rozman, dr. med., spec. medicine dela, prometa in športa z Univerzitetnega rehabilitacijskega inštituta Republike Slovenije – Soča. »Trenutno ureditev je potrebno korenito spremeniti. Na primarni in sekundarni ravni storitev ni priznana in se izvaja le posamično v dogovoru z delodajalcem kot plačnikom. V tujini so do pomoči pri vračanju na delo upravičeni vsi delavci. Programi so osredotočeni na preventivo in zgodnje intervencije. Upam, da bodo odločevalci to področje čim prej sistemsko uredili. Poti, ki jih lahko izberemo, je več, upam, da se bomo odločili za pravo.«
Kakšno breme predstavljajo bolniški staleži v Sloveniji, je predstavila mag. Ana Vodičar z Zavoda za zdravstveno zavarovanje Slovenije. To se iz različnih razlogov povečuje. Samo v letu 2022 je bilo za 17, 1 milijon izgubljenih delovnih dni, v zadnjih letih pa je opaziti trend naraščanja dolgotrajnih bolniških staležev. Stopnja absentizma v Sloveniji je bila 6,1 %, povprečje v Evropski uniji pa je 3–6 %. »Pri ukrepih za obvladovanje zdravstvenega absentizma z vidika družbe je tako potrebno zagotoviti zniževanje njegovega celokupnega bremena in ne zgolj prenosa med deležniki ali prenosa v druge oblike izgub produktivnosti.«
Vse bolj uspešno zdravljenje raka omogoča boljše preživetje in daljše življenje onkoloških bolnikov. »Celostna, individualizirana rehabilitacija močno pripomore k višji kakovosti življenja, saj zmanjša težave, omili neželene učinke zdravljenja, skrajša bolniško odsotnost, poveča delovno zmožnost in zmanjša invalidnost,« pa je povedal prof. dr. Nikola Bešić, dr. med., spec. kirurgije z Onkološkega inštituta Ljubljana in vodja Programa OREH (O = onkološka, REH = rehabilitacija) za bolnice z rakom dojk Onkološkega inštituta (OI) Ljubljana s partnerji, ki je potekala med letoma 2019 in 2022. Program OREH se na OI Ljubljana nadaljuje ter bo v celostno onkološko rehabilitacijo pilotno vključil bolnike z rakom debelega črevesa in danke.
Na poti do sistemskih rešitev, ki bodo prijazne bolniku
O tem, kakšne bi bile možne kratkoročne in dolgoročne rešitve, pa so v sklepnem delu konference razpravljali na okrogli mizi. Predsednica združenja ONKO NET Kristina Modic je izpostavila, da glede na to, da imajo bolniki največ težav z razumevanjem zdravstvenega sistema in svojih pravic, je treba narediti sistem bolniku bolj prijazen. »Izrednega pomena je, da bi obstajala nekakšna info točka, kamor bi se lahko v bolniki z vsemi vprašanji obrnili v času bolniškega staleža in na enem mestu dobili kakovostne in razumljive informacije, tudi za izračun nadomestila za skrajšan delovni čas. Tako se bo bolnik lažje odločal o vračanju na delo in bo proces veliko lažji.«
Prim. prof. dr. Danica Rotar Pavlič, dr. med., spec. družinske medicine z Združenja zdravnikov družinske medicine se je strinjala, da je treba proces vračanja nazaj na delo poenostaviti. »Družinski zdravniki imamo na tem področju veliko izkušenj, znamo oceniti, kateri bolniki se bodo lažje in kateri težje vračali nazaj na delo. Največ težav imajo bolniki v srednjem življenjskem obdobju, kjer se iz različnih razlogov odločajo, da podaljšujejo bolniške staleže. Zato si družinski zdravniki želimo, da bi se projekt OREH v drugih oblikah razširili tudi na druge rake.« Pozdravlja tudi predlog, da bi že na začetku zdravljenja z bolnikom naredili načrt, kako bi potekal proces vračanja na delo. Pomoč pri tem bi lahko prevzel poseben koordinator oz. informator.
Kakšna je možnost, da bi v programe društev bolnikov s prehransko, psihoonkološko in fizikalno podporo, ki jih finančno podpira tudi Ministrstvo za zdravje, sistemsko vključili tudi poklicno rehabilitacijo, je odgovorila Mojca Gobec, višja sekretarka z Ministrstva za zdravje. »Na Direktoratu za javno zdravje si tri desetletja prizadevamo za primarno preventivo in podpiramo nevladne organizacije, predvsem društva bolnikov, ki s svojimi programi zapolnjujejo vrzeli v zdravstvenem sistemu. Želeli bi si, da bi se ti programi čim bolj implementirali v sistem. Program OREH bo financiran še za raka debelega črevesa in danke, prav tako bo sistemsko financiran koordinator oskrbe na Onkološkem inštitutu Ljubljana in za onkološke bolnike v UKC Maribor. Sedaj je čas, da povežemo vse rešitve v eno mrežo in jih še bolj optimiziramo. Državni program obvladovanja raka vidim kot platformo, kjer se to lahko razvije. Da bi to lahko dosegli, bodo potrebne spremembe zakonodaje in političnavolja..«
Kristina Modic kot izvršna direktorica Združenja L&L je pritrdila, da je treba celostno rehabilitacijo, ki jo nudijo bolnikom s krvnimi raki, urediti sistemsko in dostopno za vse, saj se v programe večinoma vključujejo proaktivni bolniki, ki sami iščejo pomoč. »Celostna rehabilitacija mora biti dostopna za vse. Program OREH se širi na raka debelega črevesa in danke, treba ga je razširiti še na druge vrste raka.« Temu je pritrdil tudi doc. dr. Tit Albreht, ki je poudaril, da je treba rehabilitacijo bolnikom ponuditi v takšni obliki, da je dostopna vsem. »Ne sme biti odvisna od iznajdljivosti, razgledanosti, zdravstvene pismenosti ali socialnih mrež. Sistem celostne rehabilitacije in vračanja na delo mora imeti tako nizek prag, da bo podpiral prav vse in nihče ne bo prikrajšan.«
Mag. Ana Vodičar je na vprašanje, kako bi lahko našli ravnovesje med vzdržnostjo zdravstvene blagajne in upoštevanjem pravic ter potreb bolnikov, odgovorila, da bi bilo treba slediti cilju, da bi »vsi bolniki, ki potrebujejo nadomestilo zaradi zmanjšanje zmožnosti za delo, dobili tako visoko nadomestilo, ki ne bo ogrožalo njihovega preživetja in preživetja njihove družine.« Da bi to lahko uresničili, pa je »treba spremeniti zgodnje intervencije, da nam ne bo treba omejevati pravic do bolniških staležev.«
Mag. Dean Premik, podpredsednik Odbora za zdravstvo Državnega zbora RS, je dodal, da si že več let prizadeva za spremembe na tem področju. »Sistem bi bilo treba urediti tako, da bi ta že v začetku bolniškega staleža pripravljal ljudi na povratek na delo, kar se zdi pri onkoloških bolnikih precej oddaljeno, saj se čaka na končano medicinsko rehabilitacijo.« Ob tem pa je dodatno opozoril, da »je za uspešno sistemsko ureditev potrebno povezovanje organov, ki ocenjujejo trajno in začasno nezmožnost za delo z vključitvijo specialistov medicine dela, prometa in športa.« Ti so namreč iz tega procesa trenutno izključeni. V pripravi je tudi sprememba pokojninske in invalidske zakonodaje, ki bi izpostavljene izzive sistemsko urejala v okviru socialnih pravic.
Okroglo mizo so razpravljavci zaključili z mislijo, naj bodo vsa prizadevanja vseh, ki so vpeti v snovanje novih elementov socialnega sistema, pomemben korak naprej k reševanju stisk, s katerimi se soočajo bolniki. Podlag za nadaljnje reševanje problematike in nemotene ter celostne obravnave bolnikov v zdravstvenem sistemu je dovolj.
“,”Jaka Verbic Miklic”,1707205260,1707205260,sl,15422,306,15421,43,0,NULL,,”4. konferenca Življenje z rakom”,4-konferenca-zivljenje-z-rakom,Post,”/sites/43/files/images/news/Zivljenje z rakom/4 konferenca/Konferenca Zivljenje z rakom.jpg”,1,0,1707982977,1707983749
1031,15424,”Odziv EFPIA na plenarno glasovanje Evropskega parlamenta”,”Kljub izboljšavam je pred farmacevtsko zakonodajo še dolga pot do ponovne vzpostavitve konkurenčnosti Evrope.”,”
10. april 2024 – Danes so poslanci Evropskega parlamenta sprejeli stališče o farmacevtski zakonodaji EU.
V svojem komentarju o glasovanju je Nathalie Moll, generalna direktorica EFPIA, dejala:
»To je pomemben trenutek za raziskovalno farmacevtsko industrijo. Današnje glasovanje določa, kako Evropa vidi prihodnost raziskav in inovacij na področju zdravstva in znanosti o življenju ter nege bolnikov v regiji.
Zagotavljanje hitrejšega in pravičnejšega dostopa bolnikov do novih zdravil – in načinov, na katere lahko Evropa zmanjša zaostanek v naložbah za drugimi deli sveta – je bilo v preteklih mesecih predmet številnih pomembnih razprav.
Verjamemo, da je Parlament izglasoval nekatere spremembe, ki so izboljšale prvotne predloge Evropske komisije za razvoj na prihodnost odpornega regulatornega okvira. To je poteza, ki jo industrija pozdravlja.
Poslanci Evropskega parlamenta so sprejeli tudi pragmatičen in zdravorazumski ukrep, s katerim smo se izognili stanju, v katerem bi bila dveletna regulatorna zaščita podatkov (RDP) podjetja odvisna od tega, ali bo novo zdravilo na voljo v vseh 27 državah članicah EU v dveh letih od pridobitve dovoljenja za promet. Prepoznali so, da posamezno podjetje ne more vplivati na večino dejavnikov, ki določajo, ali bo določeno zdravilo na voljo bolnikom ali ne. Namesto čakanja na zakonodajo, ki ni namenjena reševanju dostopa do zdravil v državah članicah, smo prepričani, da lahko z dogovorom med bolniki, plačniki, ponudniki in nacionalnimi oblikovalci politik poiščemo izvedljive rešitve za izboljšanje dostopa do zdravil že danes.
Kljub nekaterim izboljšavam prvotnih predlogov Evropske komisije pa na plenarnem zasedanju sprejeto stališče skrajšuje regulatorno zaščito podatkov za šest mesecev. Težko je razumeti, kako bi lahko bilo zmanjšanje spodbud za raziskave, razvoj in proizvodnjo novih zdravil in cepiv v najboljšem interesu Evrope ali evropskih bolnikov, zlasti v času, ko se Evropa zaveda, da mora povečati konkurenčnost, če želi za globalne naložbe tekmovati z ambicioznimi državami, kot sta ZDA in Kitajska.
Ustvarjalci politik morajo sedaj uskladiti naslednjo različico farmacevtske zakonodaje s ponavljajočimi se pozivi evropskih voditeljev k povečanju evropske konkurenčnosti in oblikovanju odporne in prilagodljive industrijske prihodnosti. Predstavniki panoge, ki v trgovinsko bilanco EU prispeva več kot katera koli druga, menimo, da bi moralo biti zdravstvo in znanosti o življenju temeljni kamen takšne prihodnosti.
To pa bo mogoče doseči le z izvajanjem doslednih in komplementarnih politik v okviru revizije farmacevtske zakonodaje, ki bodo okrepile in ne oslabile raziskovalno farmacevtsko industrijo v vseh državah članicah.«
===========================================================================
Nadaljnji komentarji EFPIA o posameznih vidikih glasovanja na plenarnem zasedanju
O regulatornem okviru
»Ohranitev predlogov Komisije za uvedbo tako imenovanega »regulatornega peskovnika« (angleško regulatory sandbox) je pomemben korak v smeri oblikovanja na prihodnost odpornega regulatornega okvira. Učinek določb o »regulatornem peskovniku« na zagotavljanje prihodnjih prebojnih inovacij za bolnike v EU bi lahko povečali, če bi omogočili njegovo uporabo v več zakonodajnih okvirih, ne le na področju farmacevtske zakonodaje.
Administrativno breme se bo zmanjšalo s predlogom o izključno elektronskih informacijah za bolnike za zdravila, ki jih dajejo neposredno zdravstveni delavci. Vendar pa zamujamo priložnost, ker Evropski komisiji ne dajemo pristojnosti za določanje kdaj je pravi čas, da se vsa navodila dajo na voljo izključno v elektronski obliki. Kljub temu pa EFPIA meni, da morajo biti po potrebi na voljo tudi papirnato navodilo za tiste bolnike, ki ga potrebujejo.
O protimikrobni odpornosti (AMR) in ohranitvi predlogov o TEV
»Vključitev spodbud za protimikrobno odpornost, kot je na primer prenosljivi kupon za ekskluzivnost (angleško tranferable eclusivity voucher, TEV), v besedilo Evropskega parlamenta predstavlja pomemben korak pri spopadanju z izzivom protimikrobne odpornosti. Pomembno je, da se takšni ukrepi v postopku zakonodajnih pogajanj dodatno izpopolnijo, da se zagotovi njihova učinkovitost.
Revizija farmacevtske zakonodaje Evropi prinaša edinstveno priložnost, da prevzame vodilni položaj v svetovnem boju proti protimikrobni odpornosti. Veselimo se nadaljnjih pogovorov z vsemi partnerji, v okviru katerih bomo identificirali politične rešitve za doseganje tega cilja.«
O zdravilih sirotah
»Stabilne in zanesljive sheme spodbud ostajajo bistvene. Če želimo zadovoljiti potrebe bolnikov z redkimi boleznimi, pa bo potrebno spodbude okrepiti, saj je ekonomska upravičenost za naložbe v redke bolezni minimalna.
Preprost in predvidljiv sistem spodbud za zdravila sirote z okrepljenim izhodiščem tržne ekskluzivnosti in možnosti za prilagajanje shem, ki upoštevajo specifične izzive v zvezi z določeno vrsto razvoja in ne uporabljajo stopnjevanja nezadovoljenih potreb bolnikov, bi bil za evropske bolnike z redkimi boleznimi boljša izbira. Upamo, da bodo države članice upoštevale te ključne sestavine in omogočile izboljšan ekosistem za raziskave in razvoj rešitev za bolnike z redkimi boleznimi.
Čudovito je videti tudi vključitev zamisli o evropskem okviru za redke bolezni, ki bi omogočil boljše usklajevanje politik in programov.«
O definiciji neizpolnjenih zdravstvenih potreb
»Veseli nas, da bodo v skladu s predlogi Evropskega parlamenta vsi zainteresirani deležniki povabljeni k aktivnemu sodelovanju pri definiranju neizpolnjenih medicinskih potreb z različnih perspektiv. Če želimo oblikovati na bolnike osredotočeno definicijo, bo potrebno prepoznati vrednost inovacij ter spodbujati napredek pri preprečevanju, zdravljenju in negi.«
O pediatriji
»Na področju pediatrije moramo graditi na obstoječi zakonodaji in oblikovati ekosistem, ki bo spodbujal učinkovite raziskave zdravil za otroke, zlasti na področjih neizpolnjenih zdravstvenih potreb. Uvedba načrtov za pediatrične raziskave na podlagi mehanizma delovanja je korak v pravo smer, vendar zaenkrat še ne daje primernega okvira, ki bi zagotovil, da razširjene raziskovalne obveznosti dejansko pripeljejo do znanstveno in klinično pomembnih ter izvedljivih raziskav in razvoja, ki bo koristil pediatričnim bolnikom in ne bo pretirano obremenjeval farmacevtskih inovacij. Poleg tega mora takšen ekosistem omogočiti tudi, da bodo pediatrična zdravila na voljo tam, kjer obstajajo dejanske potrebe in povpraševanje bolnikov po vsej EU.«
O cepivih
»Pozdravljamo sprejeto definicijo cepiv, saj je usklajena s smernicami agencije EMA za presojo cepiv in omogoča prihodnje inovacije na področju imunizacije. Cepiva so edinstvena zdravila z zapletenimi proizvodnimi postopki, dolgimi časi izdelave ter zelo specifičnimi regulatornimi zahtevami in potmi vstopa na trg. V večini držav EU morajo biti na primer rutinska cepiva vključena v nacionalne programe imunizacije, da so upravičena do postopka določanja cen in razvrstitve. Obžalujemo, da posebnosti cepiv niso v celoti upoštevane v sprejetih besedilih, zlasti kar zadeva obveznost oddaje vloge za postopek določanja cen in razvrščanja, saj bi to lahko povzročilo neoptimalen in neenak dostop do cepljenja ter s tem neustrezno zaščito evropskega prebivalstva.«
O pomanjkanju zdravil
»V besedilu, ki ga je potrdil Parlament, so številni pozitivni elementi, vključno s proaktivnim posvetovanjem z vsemi deležniki o seznamu nujno potrebnih zdravil, možnostjo, da Evropska agencija za zdravila presoja o ukrepih držav članic za reševanje pomanjkanja in njihov vpliv na druge države, ter načrti Komisije za sodelovanje z Evropskim centrom za preprečevanje in obvladovanje bolezni (ECDC) pri oblikovanju zanesljivih napovedi morebitnih groženj in pomanjkanj.
Vendar pa ima EFPIA v zvezi z nekaterimi predlogi še vedno pomisleke. Še vedno ni načrtov za uporabo preprosto dostopnih podatkov iz repozitorija direktive o ponarejenih zdravilih za potrebe spremljanje pomanjkanja, kar je po našem mnenju zamujena priložnost. Podaljšanje aktualnega dvomesečnega roka za obveščanje o začasnih motnjah v dobavni verigi na šest mesecev bo verjetno povzročilo nepotrebna obvestila, ki bi lahko zmanjšala vidnost dejanskih pomanjkanj. Načrti za preprečevanje pomanjkanja bi morali biti rezervirani za nujno potrebna zdravila.
Tudi nova zahteva po vključitvi informacij o označevanju na vsakem posameznem odmerku v pretisnih omotih bi povzročila znatne motnje v proizvodnih procesih.«
O proizvodnji
»Veseli nas, da je Evropski parlament sprejel matične datoteke za platformne tehnologije, kar bo omogočilo hitrejše odobritve inovativnih zdravil.
Po drugi strani pa predlog za uveljavljanje okoljske varnosti in varnosti pri delu z inšpekcijskimi pregledi dobrih proizvodnih praks pomeni tveganje za zamude pri odobritvi zdravil v EU in tretjih državah ter ukinitev obstoječih sporazumov o vzajemnem priznavanju takšnih inšpekcijskih pregledov z državami, ki niso članice EU. Zahteva, da inšpektorji za dobro proizvodno prakso uveljavljajo okoljsko varnost in varnost pri delu, ko to že izvajajo specializirani inšpektorji za okolje in delavske predpise je potrata virov. To bo tudi težko uveljavljati zunaj EU/EGP.«
O okoljskih predlogih
»Farmacevtska industrija se zaveda pomena ocen tveganja za okolje pri ocenjevanju potencialnega vpliva zdravil za ljudi in njihove proizvodnje na okolje. Za proaktivno obravnavo in obvladovanje okoljskih tveganj, ki jih prinaša uporaba zdravil za uporabo v humani medicini pri bolnikih, predlagamo uvedbo razširjene ocene tveganja za okolje. Vendar pa nas skrbijo nekatere določbe, ki jih je sprejel Evropski parlament, saj krepijo možnost preklica ali zavrnitve dovoljenja za promet na podlagi okoljskih pomislekov, pri čemer naj bi ocena tveganja za okolje zajemala celoten življenjski cikel zdravila, vključno s proizvodnjo, ter odpirajo možnosti za uporabo inšpektorjev kakovosti Evropske agencije za zdravila (EMA) za uveljavljanje okoljskih standardov v proizvodnji izven EU.«
“,”Jaka Verbic Miklic”,1712823900,1712823900,sl,15424,306,15423,43,0,NULL,,”Odziv EFPIA na plenarno glasovanje Evropskega parlamenta”,odziv-efpia-na-plenarno-glasovanje-evropskega-parlamenta,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1712824012,1716441670
1032,15426,”Moč podatkov pri obvladovanju sladkorne bolezni”,”Povprečni letni izdatek za sladkorno bolezen je v obdobju 2019-2022 znašal 174 milijonov evrov”,”
Ljubljana 04.04.2024 – Več kot polovica neposrednih letnih izdatkov, ki jih Zavod za zdravstveno zavarovanje Slovenije (ZZZS) nameni za sladkorno bolezen, gre za obvladovanje posledic zapletov sladkorne bolezni, na primer hospitalizacije zaradi srčno-žilnih zapletov, zapletov na ledvicah, diabetične noge in drugih.
Skupina raziskovalcev pod vodstvom prof. dr. Petre Došenović Bonča z Ekonomske fakultete v Lju-bljani – v timu raziskovalcev je sodelovala tudi diabetologinja in strokovna sodelavka ZZZS Karmen Janša – je za obdobje med avgustom 2019 in 2022 po sedmih skupinah bolezni zbrala podatke iz baze ZZZS, jih razvrstila in jih analizirala. Dobili smo prve celovite in poglobljene podatke o tem, koli-ko sredstev iz obveznega zdravstvenega zavarovanja z doplačili gre v povprečju na leto za zdravljenje sladkorne bolezni. Članek, z rezultati raziskave, je bil objavljen tudi v ugledni mednarodni reviji za zdravstveno ekonomiko, rezultate pa sta Došenović Bonča in Janša predstavili na tiskovni konferenci.
Sladkorna bolezen je presnovna bolezen, za katero je značilno nihanje sladkorja v krvi ali glikemija, ki sčasoma, če ni ustrezno nadzorovana, okvari tudi druge organe in organske sisteme. Je zelo pogo-sta, saj jo ima po zadnjih podatkih mednarodne zveze za diabetes (IDF) že 10 odstotkov svetovnega prebivalstva med 20. in 79. letom. Prav zato kot taka, predvsem pa njeni zapleti, predstavlja veliko ekonomsko breme za posameznike, zdravstvene sisteme in družbe.
Večjih presenečenj ni bilo, ker smo določene rezultate oziroma stroške spremljali že pred raziskavo. Prvo oceno sva s prof. dr. Petro Došenović Bonča naredili že pred leti, ko sva dobili podatke v okviru neke evropske raziskave. Vendar takrat še nismo dostopali do podatkov, kakršne imamo danes,« je uvo-doma povedala dr. Janša. »Ker imamo dostop do podatkov preko ZZZS, sva se odločili, da oceno do-polnimo. Pričakovala sem, da bodo kasni zapleti zajemali večji odstotek od 53, sem pa vesela, da ne.«
Podrobnosti o članku je podala tudi prof. dr. Došenović Bonča in pojasnila, da so poleg neposrednih izdatkov dodali še starostno spolne profile izdatkov. Povprečna letna stopnja rasti neposrednih izdatkov za sladkorno bolezen in njene zaplete je v opazovanem obdobju znašala 12,5 odstotkov. »Izdatke smo razdelili po spolu in starosti, da smo jih lahko uporabili za napovedovanje prihodnosti. Če gledamo demografske spremembe in upoštevamo projekcije, te kažejo, da bo 7,5 odstotkov prirasta stroškov v Sloveniji prispevala sladkorna bolezen, če ne spremenimo načina obravnave in njenega prepreče-vanja,« je jasna Došenović Bonča. »ZZZS ima zelo dobro razvito podatkovno skladišče in želeli smo uporabiti podatke. Takšne študije so zelo pomembne za nove odločitve, denimo če je primerno uvesti neko novo zdravilo ali tehnologije. Tako lahko lažje in bolje načrtujemo zdravstveno košarico in nas-lavljamo potrebe družbe. Želela bi si, da takšno spremljanje postane redno in da se vzpostavi tudi za druge bolezni, saj lahko te podatke ustrezno izkoristimo za namene odločanja.«
Zapleti neusmiljeno povečujejo izdatke
Povprečni letni izdatek na osebo s sladkorno boleznijo, ki nima zapletov, znaša 520 evrov, za osebo, ki ima zaplet, nekajkrat več. V opazovanem obdobju je bilo denimo izračunano, da za zaplet slad-korne bolezni na ledvicah porabimo letno 4.385 evrov povprečno na bolnika. Zapletov pa je še več. Dr. Karmen Janša je pojasnila, da so raziskovalci skupni neposredni izdatek izračunali tako, da so poleg neposrednih izdatkov za obravnavo same sladkorne bolezni prišteli še izdatke za obravnavo po skupinah znanih zapletov sladkorne bolezni: zapleti na srcu, ledvicah, očeh, nogah, živcih ter tudi akutne zaplete sladkorne bolezni (kjer so pogoste hospitalizacije zaradi posebnih akutnih stanj, kot je hipoglikemija). V razrezu po izdatkih je tako jasno vidno, da je več kot polovico neposrednih izdatkov za sladkorno bolezen povezanih z zapleti.
Na drage zaplete kaže tudi podatek o izdatkih za hospitalizacije, ki znaša kar 33 % vseh neposrednih stroškov za sladkorno bolezen. »Sladkorna bolezen ni le povišana glukoza v krvi, to je kronična meta-bolična bolezen, ki ima številne kasne zaplete, ne le akutne.« pojasnjuje dr. Janša. Pozne zaplete deli-mo na mikrovaskularne in makrovaskularne, zato je treba pri bolniku spremljati tudi krvni tlak, povišane maščobe v krvi itn. »Zato je ena od najbolj kompleksnih obravnav prav obravnava osebe s sladkorno boleznijo,« meni diabetologinja.
»Za mene kot diabetologa je ključno sporočilo, da so znatna sredstva porabljena za zdravljenje kro-ničnih zapletov sladkorne bolezni in zato bi bilo smiselno čim več tega denarja preusmeriti v prepre-čevanje teh zapletov, tako da bi se denar porabljal za še zdrave ljudi in ohranjal njihovo zdravje,« je o pomenu preprečevanja zapletov spregovoril prof. dr. Tadej Battelino, pediater endokrinolog in predstojnik Oddelka za endokrinologijo, diabetes in presnovne bolezni Pediatrične klinike Ljubljana.
»Ti podatki bodo ključni, da bomo tudi v Sloveniji lahko končno stopili na pot preprečevanja, zgodnje dostopnosti tehnologij in sodobnih zdravil za zdravljenje sladkorne bolezni.«
Malo manj kot četrtino neposrednih izdatkov (24 %) gre za zdravila za sladkorno bolezen, kjer je Slo-venija v dostopnosti med državami EU ena najboljših. Dostopne so vse najnaprednejše terapije. »Pred desetimi leti je bil ta delež za skoraj polovico nižji in upam, da ne bo tako zelo naraščal še naprej,« je pokomentiral izdatke za zdravila prim.dr. Jurij Furst, vodja oddelka za zdravila na ZZZS. Izpostavil je problem, da osebe s sladkorno boleznijo jemljejo tri ali štiri zdravila na dan. »Bolje bi bilo predpisati manj zdravil, a ukinjanje zdravil je umetnost, veliko lažje jih je dodajati.«
Zato je Došenović Bonča tudi poudarila, da so v opazovanem obdobju stroški za obravnavo rasli in si-cer za približno 12 odstotkov letno, kar je povezano z naraščanjem števila pacientov, kar seveda vpliva na večjo porabo zdravil. »Podatki so pomembni, a vsi se zavedamo pomena zdravega življenjskega sloga, torej smo izobraženi, dosegati spremembe v načinu življenja pa je nekaj povsem drugega kot edukacija,« še pristavlja profesorica z Ekonomske fakultete v Ljubljani.
Več pozornosti na človeške vire in bolnika
Kot je dejala diabetologinja in predstojnica Oddelka za endokrinologijo in sladkorno bolezen v UKC Maribor Urška Kšela, moderna zdravila in druga orodja za obvladovanje bolezni, do katerih imamo odličen dostop, niso dovolj, potrebujemo strategijo, kako uskladiti time, ki delajo z osebami s sladkor-no boleznijo in zagotoviti bolj enakomerno dostopnost po Sloveniji.
»Za celostno obravnavo oseb s sladkorno boleznijo je odgovoren razširjen zdravstveni tim, ki je na različnih ravneh zdravstvenega sistema definiran in organiziran različno. V tem pogledu pa Slovenija na žalost sodi na dno lestvice razvitih držav,« meni dr. Kšela. »Zaradi pomanjkanja zdravnikov in zdravstvenih delavcev na vseh ravneh zdravstvenega sistema, tako na primarni, sekundarni in terciarni ravni, so osebe s sladkorno boleznijo zato obravnavane manj kakovostno. Zdravstveni timi so regijsko izrazito neenakomerno razporejeni in na nacionalnem nivoju nimamo strategije, da bi te težave naslo-vili in jih začeli konstruktivno reševati.«
S tem se strinja tudi družinska zdravnica dr. Katarina Skubec Moćić iz ZD Celje. »Pomembno je, da vsi deležniki v zdravstvu in vladi govorimo isti jezik. V timu družinske medicine so naloge preventive in zdravljenja dobro definirane in razdeljene. Vsem nam je cilj opolnomočen bolnik.«
Da bi bili bolniki bolj opolnomočeni, se trudi Zveza društev diabetikov Slovenije, katere podpredse-dnik je Samo Fakin. »Ključni problem je motivacija osebe s sladkorno boleznijo. Diabetiki tip 1 so zelo motivirani, da se naučijo pravilnega prehranjevanja, ker kazen pride takoj. Diabetike tipa 2, zlasti starejše od 75 let, je težje spraviti k vsakodnevni fizični aktivnosti in da se začnejo zdravo prehranjeva-ti,« je o problematiki še dodal Samo Fakin, podpredsednik Zveze društev diabetikov Slovenije.
Rezultati kažejo, kje smo. Kam bi radi šli?
Samo v treh opazovanih letih je povprečna letna stopnja rasti izdatkov za sladkorno bolezen dosegla 12,5 %. Po uradnih podatkih samo 15 % oseb s sladkorno boleznijo svojo bolezen uspe obvladovati z nefarmakološkimi ukrepi in zdravim življenjskim slogom. Starajoče se prebivalstvo, številni dejavniki tveganja ter sedeča družba z nezdravimi prehranjevalnimi navadami bodo glavni pogon za rast izdat-kov v prihodnjih letih. “Glede na velik obseg izdatkov, ki so potrebni za zdravljenje zapletov sladkorne bolezni, bi z intenzivnejšim izvajanjem ukrepov za preprečevanje in optimalno obvladovanje te bolez-ni lahko znatno zmanjšali njen vpliv na zdravstveni sistem,” so o praktični vrednosti take raziskave za odločevalce v zdravstvu zapisali raziskovalci.
Rezultati so za slovenski prostor zelo pomembni, ker na podlagí številk in dokazov lahko mnogo trdneje ocenjujemo stanje in načrtujemo za naprej, meni tudi Mojca Gobec z Ministrstva za zdravje.
»Zavedamo se, kako kompleksna je bolezen z njenimi zapleti. Imamo smernice, ki so bile že večkrat posodobljene, pripravljali so jih različni strokovnjaki, ne le zdravniki, zato je v njih zajeto vse, od zgodnjega prepoznavanja, do zdravljenja in preprečevanja zapletov. Kot sestavni del zdravljenja mora vedno biti tudi edukacija. Ni pa dovolj, zelo pomembna je tudi motivacija bolnika,« je prepričana Gobčeva.
Raziskovalci so odločevalcem v zaključku predlagali nekaj usmeritev, s katerimi bi lahko zmanjšali breme sladkorne bolezni. Na številne dejavnike tveganja, ki pomembno prispevajo k razvoju sladkor-ne bolezni lahko vplivamo, zato je po njihovem treba okrepiti primarno preventivo in programe za spodbujanje zdravega načina življenja. Z izboljšanjem odkrivanja in zdravljenja sladkorne bolezni v zgodnji obliki, z optimalnim obvladovanjem in nadzorom lahko upočasnimo napredovanje in pojav dragih zapletov.
»Na Zvezi društev diabetikov Slovenije se veselimo takšnih raziskav, kajti to potrjuje naše prepričanje, da preventiva zelo pomembna v samem zdravljenju sladkorne bolezni, pa tudi drugih nenalezljivih kroničnih bolezni. Tu je pomembno tudi opolnomočenje bolnika, ki mora sodelovati pri samem zdra-vljenju sladkorne bolezni in se ne zanašati na samo zdravstveno osebje,« meni Robert Gratton, predsednik Zveze društev diabetikov Slovenije:
Za zaključek je Došenovič Bonča še dodala, da lahko »bolnik s svojim ravnanjem in samoobvladova-njem razbremeni zdravstveni sistem.«

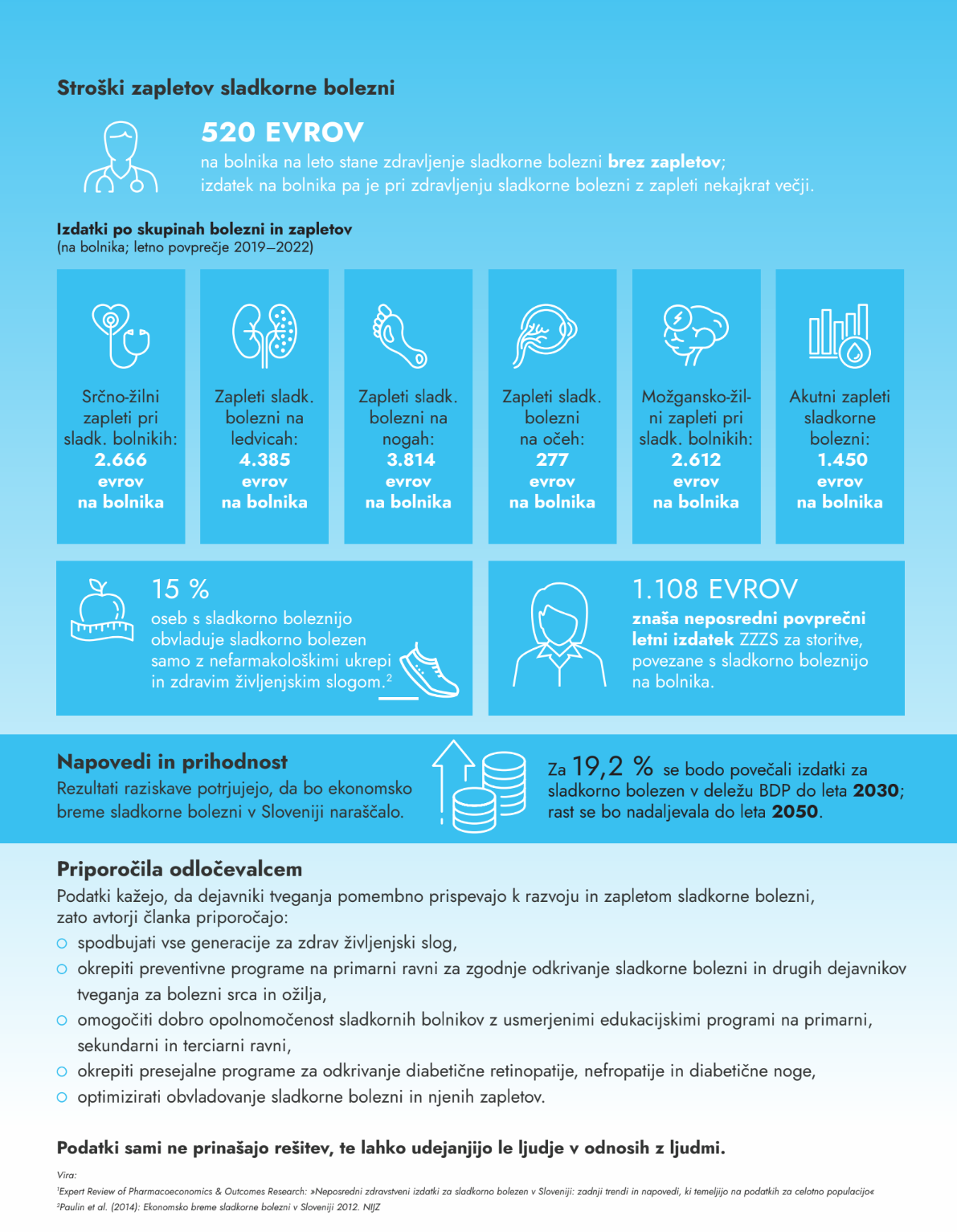
“,”Jaka Verbic Miklic”,1713088800,1713088800,sl,15426,306,15425,43,0,NULL,,”Moč podatkov pri obvladovanju sladkorne bolezni”,moc-podatkov-pri-obvladovanju-sladkorne-bolezni,Post,”/sites/43/files/images/news/Moc podatkov/MOČ PODATKOV_1.jpg”,1,0,1713089003,1713702212
1033,15428,”V Šentu za spoštovanje človekovih pravic ljudi s težavami v duševnem zdravju”,”Prezirljivo izražanje o ljudeh z invalidnostjo je po njihovih navedbah prepovedano tudi z mednarodnimi dokumenti.”,”
Ljubljana, 19. decembra – Površne in poenostavljene razlage duševnih težav so nesprejemljive, posledice diskriminatornega govora, ki ga uporabljajo v psihiatriji, psihologiji in pravosodju, pa so velike, opozarjajo v društvu Šent v izjavi ob nedavni 75. obletnici sprejetja splošne deklaracije človekovih pravic.
Prezirljivo izražanje o ljudeh z invalidnostjo je po njihovih navedbah prepovedano tudi z mednarodnimi dokumenti.
Ljudi z diagnozo s področja duševnega zdravja v institucionalnih okoljih obravnavajo pokroviteljsko, opaža predsednica Slovenskega združenja za duševno zdravje Šent Vesna Švab. Kot značilen primer je omenila govorjenje o psihiatričnih bolnikih na konferencah, kjer se strokovnjaki šalijo na njihov račun, pripovedujejo anekdote iz svoje prakse in jih označujejo z žaljivimi izrazi.
Enega od osnovnih problemov vidi v pomanjkanju znanja nekaterih strokovnjakov, ki na psihično motnjo gledajo zgolj z medicinskega vidika.
Švab tudi od medijev pričakuje, da bodo pri poročanju o primerih, ki zadevajo ljudi s težavami v duševnem zdravju, spoštovali človekove pravice.
Svetovna zdravstvena organizacija je po njenih besedah v letih 2021 in 2022 v več dokumentih opozorila, da je temeljni problem na področju pomoči ljudem z duševnimi težavami nerazumevanje konteksta, v katerem živijo. Ti ljudje so po opozorilu Svetovne zdravstvene organizacije z vidika spoštovanja človekovih pravic zelo ogroženi, je poudarila.
“,”Jaka Verbic Miklic”,1702983060,1702983060,sl,15428,306,15427,43,0,NULL,,”V Šentu za spoštovanje človekovih pravic ljudi s težavami v duševnem zdravju”,v-sentu-za-spostovanje-clovekovih-pravic-ljudi-s-tezavami-v-dusevnem-zdravju,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713693184,1713693190
1034,15430,”WHO poziva države k boljši pripravljenosti na prihodnje pandemije”,””Svet še ni pripravljen na morebitno novo pandemijo” Antonio Guterres”,”
Ženeva, 27. decembra – Potem ko so se letos po treh letih končali kriza, trpljenje in izgube zaradi covida-19, se mora svet ustrezno pripraviti na prihodnje pandemije, je v torek v video poslanici ob koncu leta opozoril generalni direktor Svetovne zdravstvene organizacije (WHO) Tedros Adhanom Ghebreyesus. Države je pozval k sklenitvi ustreznega sporazuma v letu 2024.
Da svet še ni pripravljen na morebitno novo pandemijo in da je na tem področju treba storiti več, pa je v torek opozoril generalni sekretar Združenih narodov Antonio Guterres.
“Odreči se moramo moralni in zdravstveni katastrofi bogatih držav, ki kopičijo in nadzorujejo zaloge zdravil in medicinske opreme za pandemijo, in vsem zagotoviti dostop do diagnostike, zdravljenja in cepiv,” je dejal pred današnjim svetovnim dnevom pripravljenosti na epidemije.
Tedros pa je izpostavil, da čeprav je letošnje leto s koncem pandemije covida-19 pomenilo prelomnico v boju proti velikim zdravstvenim izzivom, je prineslo tudi veliko trpljenja, ki bi se mu lahko izognili. Države je pozval k sklenitvi sporazuma, s katerim bi odpravili vrzeli v pripravljenosti na morebitne prihodnje pandemije, poroča francoska tiskovna agencija AFP.
V okviru WHO se namreč države pogajajo o prvem svetovnem sporazumu o pandemijah, katerega namen je boljša priprava na bodoče pandemije. Sporazum naj bi sprejeli v letu 2024 med skupščino WHO, ki bo potekala od 27. maja do 1. junija. Nemška tiskovna agencija dpa izpostavlja, da bi v veljavo stopil ob ratifikaciji v določnem številu držav, veljal pa bi samo v državah, ki bi ga ratificirale.
Predlog sporazuma, ki med drugim ureja, kako hitro je treba deliti informacije o novih povzročiteljih bolezni, kdo in kje proizvaja cepiva in zdravila ter kako se distribuirajo, je sicer pri več vprašanjih sporen. Bogate države so kritične, ker bi morale objaviti podrobnosti o financiranju raziskav, farmacevtska podjetja pa bi morala biti transparentna glede cen zdravil. Predvideva tudi, da bi se proizvajalci v primeru nove pandemije odpovedali pravicam do intelektualne lastnine zdravil, del proizvodnje pa predali v distribucijo WHO.
Po desetih mesecih je WHO sicer maja letos tako kot za covid-19 tudi za opičje koze razglasil, da ne predstavljajo več grožnje globalnemu javnemu zdravju. Organizacija je letos tudi odobrila nova cepiva za malarijo, mrzlico denga in meningitis, je še dejal Tedros. Spomnil je še, da so bili Azerbajdžan, Belize in Tadžikistan razglašeni za države brez malarije ter da so na nedavni letni konferenci ZN o podnebju COP28 izpostavili vpliv podnebnih sprememb na zdravje. Pozval je še k okrepitvi humanitarnih prizadevanj za območje Gaze.
“,”Jaka Verbic Miklic”,1703674440,1703674440,sl,15430,306,15429,43,0,NULL,,”WHO poziva države k boljši pripravljenosti na prihodnje pandemije”,who-poziva-drzave-k-boljsi-pripravljenosti-na-prihodnje-pandemije,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713693325,1713693608
1035,15432,”Od danes se ljubljanski študenti lahko naročijo na cepljenje proti virusu HPV”,”HPV je najpogostejša spolno prenosljiva okužba”,”
Ljubljana, 4. januarja – Zdravstveni dom za študente ljubljanske univerze poziva mlade k cepljenju proti humanim papilomavirusom (HPV). Gre za najpogostejšo spolno prenosljivo okužbo, zato bodo v želji po boljši zaščiti mladih za študente pripravili že 16. cepilni dan, ki bo 17. januarja. Obvezno je predhodno naročanje, in sicer od danes do 16. januarja.
Kot so sporočili iz zdravstvenega doma, je okužba z virusom HPV najpogostejša spolno prenosljiva okužba, s katero se večina spolno aktivnih ljudi okuži vsaj enkrat v življenju. Najpogostejša je pri mladostnikih in mladih odraslih, starih od 15 do 25 let.
Okužba je največkrat prehodna in mine brez večjih posledic, v nekaterih primerih pa je dolgotrajna in lahko povzroči nastanek genitalnih bradavic, predrakavih in rakavih sprememb materničnega vratu, zunanjega spolovila in zadnjika ter ustno-žrelnega prostora pri obeh spolih.
Na brezplačno cepljenje zato v zdravstvenem domu vabijo študentke zamudnice, torej rojene 1998 in mlajše, ki še niso bile cepljene, ter samoplačniško vse ostale študentke in študente, ki se želijo zaščititi pred okužbo s HPV.
Cepljenje bo 17. januarja, od 7. do 19. ure, potekalo v Zdravstvenem domu za študente Univerze v Ljubljani na Aškerčevi 4 v Ljubljani. Študenti se morajo za cepljenje obvezno predhodno naročiti, in sicer do 16. januarja preko aplikacije doZdravnika. Pred prvo uporabo se morajo registrirati s številko zdravstvenega zavarovanja. Lahko pa se na cepljenje naročijo tudi s poskeniranjem QR kode.
Cepilni dan je namenjen vsem, ki se še nikoli niso cepili in bi se proti okužbi z virusom HPV radi cepili prvič, pa tudi tistim, ki so že prejeli katerega izmed odmerkov ter želijo opraviti cepljenje z drugim oziroma tretjim odmerkom. Za dosego dolgoročne zaščite proti virusu HPV je namreč treba izvršiti celotno predpisano shemo cepljenja.
Učinkovita zaščita pred boleznimi zaradi okužbe s HPV je cepljenje tako deklic kot dečkov, najbolje pred začetkom spolne aktivnosti. Za dekleta v 6. razredu osnovne šole je cepljenje proti HPV priporočeno in brezplačno v okviru nacionalnega programa cepljenja. Tista dekleta, ki so cepljenje v 6. razredu zamudila in so rojena 1998 ali pozneje, se lahko brezplačno cepijo pri svojem izbranem zdravniku.
Cepljenje proti HPV je priporočljivo tudi za fante in moške ter starejša dekleta in ženske, vendar pa je zanje samoplačniško. Cepljenje se zlasti priporoča ženskam, ki so že imele predrakave spremembe ali raka zaradi okužbe s HPV, so še zapisali v zdravstvenem domu.
“,”Jaka Verbic Miklic”,1704365760,1704365760,sl,15432,306,15431,43,0,NULL,,”Od danes se ljubljanski študenti lahko naročijo na cepljenje proti virusu HPV”,od-danes-se-ljubljanski-studenti-lahko-narocijo-na-cepljenje-proti-virusu-hpv,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713693458,1713693515
1036,15434,”Raziskava: Liter vode v plastenki vsebuje do 240.000 nanoplastičnih delcev”,” Voda v plastenkah vsebuje od deset do stokrat več mikroskopsko majhnih plastičnih delcev, kot smo mislili doslej”,”
Washington, 9. januarja – Voda v plastenkah vsebuje od deset do stokrat več mikroskopsko majhnih plastičnih delcev, kot smo mislili doslej, je pokazala raziskava, ki je bila v ponedeljek objavljena v ameriški znanstveni reviji PNAS. Z nedavno izumljeno tehniko so znanstveniki v enem litru vode v plastenki v povprečju našteli okrog 240.000 delcev nanoplastike.
Rezultati študije, objavljene v reviji ameriške Nacionalne akademije znanosti (NAS), so pokazali, da en liter vode v plastenki povprečno vsebuje med 110.000 in 370.000 delcev plastike. Od tega je bilo okrog 90 odstotkov delcev nanoplastike, ostalo pa mikroplastike, poroča francoska tiskovna agencija AFP.
Gre za mikroskopsko majhne plastične delce, ki odpadejo in se ločijo od večjih kosov plastike, danes pa jih lahko najdemo povsod, od oceanov do polarnih ledenikov in gorskih vrhov. Mikroplastika in nanoplastika se pretakata po vseh ekosistemih in se pogosto znajdeta tudi v pitni vodi ali hrani.
Mikroplastični delci so definirani kot delci plastike, manjši od petih milimetrov, nanoplastični delci pa so manjši od enega mikrometra ali ene milijardinke metra. So tako majhni, da lahko preidejo skozi človekov prebavni sistem in pljuča, vstopijo neposredno v krvni obtok in od tam v organe, vključno z možgani in srcem.
V okviru študije so znanstveniki testirali vodo v plastenkah, ki jo tržijo tri vodilne blagovne znamke, vendar so se odločili, da jih ne bodo imenovali, je povedal Beizhan Yan, profesor geokemije na univerzi Columbia in eden od soavtorjev raziskave. “Menimo, da vse vrste vode v plastenkah vsebujejo nanoplastiko, zato bi se lahko izpostavljanje le treh priljubljenih blagovnih znamk zdelo nepošteno,” je še dejal Yan.
Avtorji študije ob tem poudarjajo, da so dosedanje raziskave o vplivu nanoplastičnih delcev na ekosisteme in zdravje ljudi omejene. Nekatere so jih sicer že povezale z negativnimi učinki, kot so reproduktivne težave in želodčne motnje. Načrtujejo, da bodo v prihodnosti na enak način testirali tudi vzorce vode iz pipe.
“,”Jaka Verbic Miklic”,1704798060,1704798060,sl,15434,306,15433,43,0,NULL,,”Raziskava: Liter vode v plastenki vsebuje do 240.000 nanoplastičnih delcev”,raziskava-liter-vode-v-plastenki-vsebuje-do-240-000-nanoplasticnih-delcev,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713693804,1713693805
1037,15436,”Zelenortski otoki postali tretja afriška država brez malarije”,” V državi že najmanj tri leta niso imeli prenosa te tropske bolezni”,”
Praia, 12. januarja – Zelenortski otoki so postali tretja afriška država brez malarije, je danes sporočila Svetovna zdravstvena organizacija (WHO). V državi že najmanj tri leta niso imeli prenosa te tropske bolezni, za katero na kontinentu še vedno umirajo številni ljudje, poroča francoska tiskovna agencija AFP.
“Pozdravljam neomajno predanost vlade Zelenortskih otokov in prebivalcev na poti k odpravi malarije. Potrdilo WHO, da je država brez malarije, je dokaz moči strateškega načrtovanja javnega zdravstva, sodelovanja in trajnih prizadevanj za zaščito in krepitev zdravja ljudi,” je dejal generalni direktor WHO Tedros Adhanom Ghebreyesus.
WHO je prav tako poudaril prednosti, ki jih odprava malarije prinaša Zelenortskim otokom. Te med drugim vključujejo krepitev gospodarstva, zlasti turizma, ki predstavlja približno 25 odstotkov bruto domačega proizvoda.
Malarijo povzročajo paraziti plazmodiji, ki jih s pikom na človeka prenašajo okuženi komarji. Med simptomi so visoka vročina, mrzlica in potenje, pa tudi bolečine v mišicah in sklepih, glavobol in prebavne težave, težave z dihanjem in kašelj.
Po ocenah WHO je leta 2022 zaradi malarije po svetu umrlo okoli 608.000 ljudi, okužilo pa se jih je približno 250 milijonov. Bolezen je še posebej prisotna v Afriki, brez nje pa je po svetu trenutno okoli 43 držav. V Afriki sta poleg Zelenortskih otokov brez malarije tudi Alžirija in Mavricij.
“,”Jaka Verbic Miklic”,1705057440,1705057440,sl,15436,306,15435,43,0,NULL,,”Zelenortski otoki postali tretja afriška država brez malarije”,zelenortski-otoki-postali-tretja-afriska-drzava-brez-malarije,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713693950,1713693950
1038,15438,”NIJZ: Gripa in okužbe dihal v porastu”,”Cepljenje proti gripi je zato za vse, ki se želijo zaščititi, še vedno smiselno”,”
Ljubljana, 15. januarja – Gripa in akutne okužbe dihal so med prebivalstvom v porastu, pojavljajo se v vseh zdravstvenih regijah. Cepljenje proti gripi je zato za vse, ki se želijo zaščititi, še vedno smiselno, so objavili na spletni strani Nacionalnega inštituta za javno zdravje (NIJZ). V letošnji sezoni se je sicer proti gripi cepilo 115.722 prebivalcev Slovenije.
Na NIJZ poudarjajo, da je najučinkovitejša zaščita pred gripo vsakoletno cepljenje. To ščiti tako pred boleznijo kot tudi pred morebitnimi zapleti, ki gripo spremljajo. Pri nekaterih skupinah (starejši, kronični bolniki, imunsko oslabljeni) je lahko uspešnost cepljenja manjša, zato je pomembno, da se proti gripi cepijo tudi njihovi družinski člani, saj tako zmanjšajo možnost, da posameznik pride v stik z virusom. Še posebej pa je cepljenje priporočljivo za skupine z večjim tveganjem za težek potek bolezni.
Cepljenje proti gripi še posebej priporočajo starejšim od 65 let, kroničnim bolnikom in njihovim družinskim članom, osebam, ki imajo izrazito povečano telesno težo, majhnim otrokom (od 6 do 23 mesecev starosti) in njihovim družinskim članom ter nosečnicam in njihovim družinskim članom.
Cepljenje svetujejo tudi zdravstvenim delavcem in sodelavcem ter zaposlenim v domovih starejših občanov, ki so pri svojem delu izpostavljeni nevarnosti okužbe ali pa lahko okužbo prenesejo na druge osebe in drugim delavcem v nujnih službah, ki so pomembni za delovanje različnih dejavnosti.
Skupno število obiskov in posvetov v ambulantah osnovnega zdravstva zaradi akutnih okužb dihal in gripi podobne bolezni je bilo v prvem tednu januarja nizko zaradi praznikov in šolskih počitnic. Akutnih okužb dihal je bilo več kot v preteklem tednu v starostnih skupinah nad 15 let, gripi podobne bolezni pa je bilo več predvsem v starostnih skupinah od 4 do 14 let.
Med vzorci, ki jih testirajo v laboratorijih, narašča delež pozitivnih na gripo. Virus influence, ki povzroča gripo, so namreč potrdili v 15,5 odstotka vseh testiranih vzorcev. V vzorcih, ki so jih odvzeli v ambulantah primarnega zdravstva, je bila tretjina pozitivnih na gripo, med vzorci iz bolnišnic je bilo pozitivnih 15 odstotkov.
V letošnji sezoni se je s cepivom proti gripi zaščitilo 2712 oseb, starih do 18 let, 33.608 oseb, starih od 18 do 64 let in 79.256 starejših od 65 let. Trenutno krožeči sevi se zaenkrat dobro ujemajo s sevi zajetimi v cepivu.
Gripa pri mladih brez kroničnih bolezni večinoma poteka kot nekajdnevno vročinsko stanje z znaki obolenja dihal ter bolečinami v mišicah in sklepih. Pri ogroženih skupinah prebivalstva pa lahko bolezen poteka s težjo klinično sliko s pogostimi zapleti, kot so virusne in bakterijske pljučnice in tudi z višjo smrtnostjo. Pri kroničnih bolnikih pride lahko tudi do poslabšanja osnovne bolezni.
Naraščajo tudi okužbe z respiratornim sincicijskim virusom (RSV). Medtem ko so v zadnjem tednu lanskega leta okužbo z RSV potrdili v šestih odstotkih analiziranih vzorcev, se je ta delež v prvem tednu letošnjega leta povečal na 11 odstotkov.
RSV je sicer najpogostejši povzročitelj akutnega brohiolitisa majhnih otrok, pri večjih otrocih in odraslih pa povzroča blažja prehladna obolenja. Začetek kroženja RSV zaznamo le, če kužnine dihal testiramo na RSV, saj klinična slika okužbe z RSV nima značilnega poteka.
Delež vzorcev, pozitivnih na koronavirus, pa je v prvem tednu leta 2024 padel, a je še vedno visok. Pozitivnih je 16 odstotkov testiranih vzorcev, delež pozitivnih je višji pri vzorcih odvzetih v bolnišnicah, so zapisali na NIJZ.
“,”Jaka Verbic Miklic”,1705317060,1705317060,sl,15438,306,15437,43,0,NULL,,”NIJZ: Gripa in okužbe dihal v porastu”,nijz-gripa-in-okuzbe-dihal-v-porastu,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713694364,1713694364
1039,15440,”V Sloveniji dosegli največjo pregledanost žensk za raka materničnega vratu v 20 letih”,”Zbolevnost se je v vseh teh letih več kot prepolovila, Slovenija pa je prepoznana kot ena izmed držav, ki lahko med prvimi v Evropi doseže odpravo raka materničnega vratu.”,”
Ljubljana, 21. januarja – V Sloveniji smo dosegli največjo pregledanost žensk za raka materničnega vratu od vzpostavitve programa Zora pred 20 leti, so sporočili z Onkološkega inštituta Ljubljana. Zbolevnost se je v vseh teh letih več kot prepolovila, Slovenija pa je prepoznana kot ena izmed držav, ki lahko med prvimi v Evropi doseže odpravo raka materničnega vratu.
Slovenija na poti k odpravi raka materničnega vratu
Organizirano populacijsko odkrivanje in zdravljenje predrakavih in zgodnjih rakavih sprememb materničnega vratu v programu Zora je v dvajsetih letih rešilo že mnogo življenj slovenskih žensk. Slovenija že dosega dva od treh ciljev, ki so nujni za odpravo raka materničnega vratu, in sicer več kot 70-odstotno udeležbo žensk v programu Zora in učinkovito zdravljenje predrakavih in rakavih sprememb materničnega vratu pri več kot 90 odstotkih žensk. Doseči moramo še tretji cilj, to je 90-odstotno precepljenost deklic proti HPV.
Nekoč drugi najpogostejši rak pri ženskah danes v Sloveniji zaradi učinkovitega odkrivanja in zdravljenja predrakavih sprememb v programu Zora postaja redek rak. V zadnjih letih v Sloveniji letno odkrijejo in zdravijo okrog 1500 predrakavih sprememb visoke stopnje, za rakom materničnega vratu zboli le še med 100 in 120 žensk, 40 jih zaradi tega raka umre.
“Zaradi odličnega dela vseh, ki sodelujejo v programu Zora, in zaradi zaupanja žensk, ki se odzivajo na preglede, smo dosegli odlične rezultate in smo na poti odprave tega raka,” je poudarila generalna direktorica direktorata za javno zdravje na ministrstvu za zdravje Vesna Marinko. Po njenih besedah ministrstvo podpira vse aktivnosti za dosego tega cilja.
Pri udeleženkah programa Zora v povprečju odkrijejo raka materničnega vratu devet let prej kot pri ženskah, ki se preventivnih ginekoloških pregledov z odvzemom brisa materničnega vratu pri izbranem osebnem ginekologu ne udeležujejo. Zadnja triletna pregledanost v ciljni skupini od 20 do 64 let je 74,4 odstotka, kar je največja pregledanost do sedaj. Prvič od vzpostavitve programa Zora je pregledanost presegla 70 odstotkov v vseh slovenskih regijah in tudi v starostni skupini 50 do 54 let, so navedli na onkološkem inštitutu.
Največja pregledanost je pri mlajših ženskah, najmanjša pri starejših
Pregledanost je eden od glavnih kazalnikov, s katerim se ocenjuje uspešnost programa Zora, in cilj, da vsaj 70 odstotkov žensk v opazovanem triletnem obdobju opravi presejalni pregled pri svojem ginekologu, Zora dosega že od vzpostavitve. Rezultati pregledanosti se razlikujejo v posameznih starostnih skupinah, teritorialnih enotah in časovnih obdobjih. Najnovejši podatki kažejo, da se preventivnih pregledov najbolj redno udeležujejo mlade ženske, stare od 20 do 24 let, triletna pregledanost pri njih je 81,6-odstotna.
Najslabše se na preventivne preglede odzivajo ženske, stare med 55 in 64 let. V zadnjih letih se rak materničnega vratu najpogosteje pojavlja pri ženskah po 50. letu starosti, ki se presejalnih pregledov v okviru programa Zora ne udeležujejo redno. Zato vodja programa Zora Urška Ivanuš poziva ženske, da tudi po koncu rodne dobe hodijo na redne presejalne preglede vsaka tri leta. “Če so presejalni izvidi do 64. leta starosti negativni, potem je verjetnost, da boste zboleli za rakom materničnega vratu, zelo majhna in lahko s pregledi prenehate. Do takrat pa nikar ne odnehajte, saj je rak, odkrit v začetnem stadiju, zelo dobro ozdravljiv, kakovost življenja po zdravljenju pa pomembno boljša. S pravočasnim odkrivanjem in zdravljenjem predrakavih sprememb pa do raka niti ne pride, zato s preventivnim pregledom pri ginekologu nikar ne odlašajte,” svetuje.
Svetovna zdravstvena organizacija prepoznala program Zora kot primer dobre prakse
Zora je decembra prejela mednarodno priznanje, ko je bila kot vzorčni primer predstavljena na konferenci o zdravstvenih sistemih pod okriljem Svetovne zdravstvene organizacije za evropsko regijo. Presejalni program Zora je bil izbran kot primer dobre prakse pri preoblikovanju zdravstvenih sistemov, ki se uspešno spopadajo z izzivi 21. stoletja.
Svetovna zdravstvena organizacija je o slovenski izkušnji posnela tudi kratek dokumentarni film. Ta izpostavlja dobro prakso, kako umestiti tako organiziran populacijski presejalni program v obstoječ zdravstven sistem na način, da mu ženske zaupajo ter da je kakovost vseh storitev v presejanju, diagnostiki, zdravljenju in spremljanju po zdravljenju predrakavih in rakavih sprememb nadzorovana in dobra, so še navedli na onkološkem inštitutu.
“,”Jaka Verbic Miklic”,1705836000,1705836000,sl,15440,306,15439,43,0,NULL,,”V Sloveniji dosegli največjo pregledanost žensk za raka materničnega vratu v 20 letih”,v-sloveniji-dosegli-najvecjo-pregledanost-zensk-za-raka-maternicnega-vratu-v-20-letih,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713694929,1713694929
1040,15442,”Kamerun kot prvi na svetu začel množično cepljenje proti malariji”,”Leta 2021 so v Afriki zabeležili 95 odstotkov vseh primerov malarije na svetu in približno 96 odstotkov z njo povezanih smrti.”,”
Yaounde, 23. januarja – V Kamerunu so v ponedeljek kot prvi na svetu začeli program cepljenja proti malariji, ki naj bi rešil na tisoče otroških življenj. Svetovna zdravstvena organizacija (WHO) je kampanjo označila za zgodovinski korak. Po podatkih WHO zaradi malarije letno umre več kot 600.000 ljudi, večina v Afriki, poroča britanski BBC.
Več kot 80 odstotkov smrti zaradi malarije v Afriki predstavljajo otroci, mlajši od pet let. Po Kamerunu bodo podobne kampanje cepljenja s cepivom RTS,S, ki je prvo cepivo proti tej bolezni, ki ga je priporočila WHO, izvedli tudi v drugih afriških državah.
Pred tem so poskusne programe cepljenja izvedli v Keniji, Gani in Malaviju, kjer so nato po podatkih Sklada Združenih narodov za otroke (Unicef) zabeležili 13-odstotno zmanjšanje števila smrtnih primerov.
Kamerunske oblasti cepivo dojenčkom do šestega meseca starosti ponujajo brezplačno. Skupno potrebujejo štiri odmerke, ki jih bodo prejeli sočasno z drugimi rutinskimi cepivi za otroke.
Učinkovitost cepiva sicer ni stoodstotna, vendar pa za zdravnike pomeni pomembno dodatno sredstvo v boju proti malariji – poleg mrež proti komarjem in tablet. “Imamo možnost, da znatno zmanjšamo število primerov in smrti zaradi malarije ter pospešimo izkoreninjenje bolezni,” je pojasnil kamerunski zdravnik Shalom Ndoula, poroča francoska tiskovna agencija AFP.
Leta 2021 so v Afriki zabeležili 95 odstotkov vseh primerov malarije na svetu in približno 96 odstotkov z njo povezanih smrti. Z obsežnimi programi cepljenja proti bolezni, znani tudi pod imenom močvirska mrzlica, bodo Kamerunu med drugim sledile Burkina Faso, Liberija, Niger in Sierra Leone.
Zelenortski otoki so medtem sredi meseca postali tretja afriška država brez malarije. Pred tem sta bili državi brez malarije na celini le Mavricij in Alžirija.
“,”Jaka Verbic Miklic”,1706011500,1706011500,sl,15442,306,15441,43,0,NULL,,”Kamerun kot prvi na svetu začel množično cepljenje proti malariji”,kamerun-kot-prvi-na-svetu-zacel-mnozicno-cepljenje-proti-malariji,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713697624,1713697624
1041,15444,”Delež obolenj z lymsko boreliozo in klopnim meningoencefalitisom z leti postopoma upada”,”Obe obolenji, ki sta najpogostejši v poletnih mesecih, se prenašata z ugrizom okuženega klopa. “,”
Ljubljana, 31. januarja – Število primerov obolenj z lymsko boreliozo in klopnim meningoencefalitisom se po višku okužb leta 2020 po podatkih NIJZ postopoma zmanjšuje. Obe obolenji, ki sta najpogostejši v poletnih mesecih, se prenašata z ugrizom okuženega klopa. Lani so zabeležili 2509 prijav obolenja z lymsko boreliozo in 62 prijav obolenja s klopnim meningoencefalitisom.
Za lymsko boreliozo, obolenjem, ki jo povzročajo bakterije iz rodu Borrelia, razširjene v evropskem in severnoameriškem prostoru ter v nekaterih državah Azije, je lani zbolelo 1365 žensk in 1144 moških, so zapisali na NIJZ. Najvišja stopnja obolevnosti je bila v goriški statistični regiji, sledili sta ji gorenjska in primorsko-notranjska statistična regija. Največ zabeleženih primerov lymske borelioze je bilo v občinah Ljubljana, Kranj in Radovljica. Okužilo se je največ otrok starih med enim in četrtim letom starosti. Letos pa so do začetka tega tedna prejeli 36 prijav obolenja z lymsko boreliozo.
Boreliozo največkrat povezujemo z značilnimi spremembami na koži. Nastane neboleča rdečina, ki se počasi širi po koži, na sredi bledi in dobi obliko kolobarja. Kožna sprememba je lahko ena sama ali pa jih je več na različnih delih telesa. Bakterije se v primeru lymske borelioze na človeka prenesejo z ugrizom okuženega klopa rodu Ixodes.
Klopni meningoencefalitis pa je virusna bolezen osrednjega živčevja, ki se prenaša z ugrizom okuženega klopa ali neprekuhavanjem mleka. Kot so pojasnili na NIJZ, je v Evropi znanih veliko naravnih žarišč te bolezni, posebej v osrednji in vzhodni Evropi, Skandinaviji in baltskih državah. Slovenija spada med države z najvišjo obolevnostjo za klopnim meningoencefalitisom. Bolezen lahko pusti trajne posledice, kot so glavobol, zmanjšana delovna sposobnost, zmanjšana sposobnost koncentracije, pa tudi ohromelost ali celo smrt.
Lani so na NIJZ prejeli 62 prijav obolenja s klopnim meningoencefalitisom. Zbolelo je 30 žensk in 32 moških. Najvišja stopnja obolevnosti je bila v primorsko-notranjski statistični regiji, sledili sta ji gorenjska in koroška statistična regija. Okužilo se je največ ljudi starih med 55 in 64 letom.
En izmed načinov kako se zaščititi pred to boleznijo je cepljenje. Tega na NIJZ priporočajo vsem prebivalcem Slovenije od enega leta starosti naprej. Tveganje za okužbo pa lahko zmanjšamo tudi na druge načine, med drugim z uporabo repelentov, ki odganjajo klope in nošenjem svetlih oblačil, ki pokrivajo čim večji del telesa. Priporočljivo je, da ob vrnitvi iz narave opravimo temeljit pregled telesa, če pa opazimo, da je klop že prisesan, ga poskušamo čimprej odstraniti.
“,”Jaka Verbic Miklic”,1706702940,1706702940,sl,15444,306,15443,43,0,NULL,,”Delež obolenj z lymsko boreliozo in klopnim meningoencefalitisom z leti postopoma upada”,delez-obolenj-z-lymsko-boreliozo-in-klopnim-meningoencefalitisom-z-leti-postopoma-upada,Post,,1,0,1713697845,1713697846
1042,15446,”V EU bodo od prihodnjega leta prepovedane črne zobne zalivke”,”Zobozdravniki jih bodo izjemoma lahko uporabljali tudi po tem datumu, če bo to potrebno zaradi posebnih zdravstvenih potreb pacienta”,”
Strasbourg, 8. februarja – V Evropski uniji bosta od začetka prihodnjega leta prepovedana uporaba in izvoz amalgamskih oziroma črnih zobnih zalivk, predvideva danes doseženi politični dogovor evropskih poslancev in držav članic o predlogu revizije uredbe o živem srebru. Spremembe zakonodaje prinašajo tudi prepoved žarnic z živim srebrom.
Pogajalci Evropskega parlamenta in Sveta EU so se strinjali o postopni uvedbi prepovedi amalgamskih zalivk do 1. januarja 2025. Zobozdravniki jih bodo izjemoma lahko uporabljali tudi po tem datumu, če bo to potrebno zaradi posebnih zdravstvenih potreb pacienta, so pojasnili v parlamentu.
Članice, ki še ne krijejo stroškov alternativnih zalivk, lahko postopno uvedbo prepovedi preložijo do 30. junija 2026, s čimer se želijo izogniti negativnim posledicam za posameznike z nizkimi prihodki.
Od začetka prihodnjega leta bo prepovedan tudi izvoz črnih zalivk, njihova proizvodnja in uvoz pa od 1. julija 2026.
Kot so poudarili v parlamentu, se v EU kljub drugim možnostim še vedno vsako leto za zobne amalgame porabi okoli 40 ton živega srebra. Trenutna pravila namreč prepovedujejo zgolj uporabo tovrstnih zalivk za zdravljenje zob otrok do 15. leta starosti, nosečnic in doječih mater.
Sprememba uredbe o živem srebru prinaša tudi prepoved proizvodnje, izvoza in uvoza še šestih žarnic, ki vsebujejo to kemikalijo. Prepovedi bodo začele veljati konec leta 2025 oziroma 30. junija 2026, so navedli na Evropski komisiji.
S prenovljeno uredbo, ki jo bosta morala zdaj Svet EU in Evropski parlament še uradno potrditi, bodo tako v EU prepovedali še zadnjo namerno uporabo živega srebra – strupene kemikalije, ki ogroža zdravje ljudi in okolje.
“Ni razloga, da bi še naprej uporabljali živo srebro v našem vsakdanjem življenju, saj je tveganje za zdravje jasno dokumentirano. Imamo učinkovite alternative v zobozdravstvu in svetilih,” je ob tem povedal evropski komisar za okolje Virginijus Sinkevičius.
Z revizijo uredbe bo EU po njegovih besedah postala prvo gospodarstvo, ki ne bo uporabljalo živega srebra.
“,”Jaka Verbic Miklic”,1707394380,1707394380,sl,15446,306,15445,43,0,NULL,,”V EU bodo od prihodnjega leta prepovedane črne zobne zalivke”,v-eu-bodo-od-prihodnjega-leta-prepovedane-crne-zobne-zalivke,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713698092,1713698092
1043,15448,”Belgijski deček kot prvi ozdravljen redkega možganskega tumorja”,”Po besedah raziskovalke Marie-Anne Debily bodo Lucasove genske razlike, zaradi katerih je bil njegov organizem dovzetnejši za zdravljenje, poskušali umetno reproducirati.”,”
Pariz, 14. februarja – Belgijski deček Lucas je prvi otrok na svetu, ki so ga ozdravili glioma možganskega debla, je v torek poročala francoska tiskovna agencija AFP. Omenjeni tumor s polnim imenom difuzni intrinzični pontinski gliom (DIPG) letno prizadene približno 300 otrok v ZDA in do 100 v Franciji. Večina jih ne preživi niti prvega leta po diagnozi.
Lucasu so tumor DIPG diagnosticirali pred sedmimi leti, ko je bil star šest let. Njegova družina se je nato v Franciji pridružila programu BIOMEDE, v okviru katerega raziskujejo morebitna nova zdravila za DIPG. Lucas se je od samega začetka dobro odzival na zdravilo everolimus, ki so mu ga naključno dodelili.
Danes o njegovem tumorju ni več sledu, s čimer je Lucas po besedah zdravnika Jacquesa Grilla, vodje programa za možganske tumorje v centru Gustave Roussy v Parizu, premagal vse možnosti, ki so mu jih pripisali. “V seriji slikanj z magnetno resonanco sem opazoval, kako je tumor popolnoma izginil,” je dejal Grill in dodal, da na svetu ne pozna podobnega primera.
Kljub temu so obeti za otroke s tumorjem DIPG še vedno klavrni, saj jih večina ne preživi niti enega leta po diagnozi, dve leti pozneje pa jih je živih le še okoli deset odstotkov. Zakaj si je Lucas popolnoma opomogel, in kako bi lahko njegov primer doprinesel nadaljnjim raziskavam na tem področju, še ni povsem znano.
Sicer se je tudi sedem drugih otrok v raziskavi uspešno odzvalo na dodeljena zdravila, vendar je le Lucasov tumor popolnoma izginil. Razlog za to, da so se nekateri otroci odzvali na zdravila, drugi pa ne, naj bi tičal v bioloških posebnostih posameznih tumorjev.
“Lucasov tumor je imel izjemno redko mutacijo, zaradi katere so bile njegove celice po našem mnenju veliko bolj občutljive na zdravilo,” je pojasnil Grill.
Po besedah raziskovalke Marie-Anne Debily bodo Lucasove genske razlike, zaradi katerih je bil njegov organizem dovzetnejši za zdravljenje, poskušali umetno reproducirati. Če bo to uspelo, bo naslednji korak iskanje zdravila, ki bo imelo enak učinek na tumorske celice kot te razlike. A pot do tja je še zelo dolga, je dodala.
Mednarodni dan boja proti otroškemu raku obeležujemo 15. februarja vsako leto. Svetovno kampanjo ozaveščanja o tej bolezni v otroštvu in mladosti je leta 2002 ustanovila mednarodna organizacija International Childhood Cancer Day, ki se zavzema za napredno zdravljenje in oskrbo ter spodbuja k večjemu razumevanju težav, s katerimi se srečujejo družine otrok in mladostnikov med zdravljenjem in po njem.
Za različnimi oblikami raka sicer v Sloveniji letno zboli približno 80 otrok in mladostnikov, je razvidno s spletne strani Junaki 3. nadstropja.
“,”Jaka Verbic Miklic”,1707912960,1707912960,sl,15448,306,15447,43,0,NULL,,”Belgijski deček kot prvi ozdravljen redkega možganskega tumorja”,belgijski-decek-kot-prvi-ozdravljen-redkega-mozganskega-tumorja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713698261,1713698262
1044,15450,”Za bolnike z redkimi boleznimi poleg ustrezne obravnave pomembno tudi deljenje izkušnje s sobolniki”,”Redke bolezni (poznamo jih okoli 8000) so bolezni, ki prizadenejo največ pet oseb na 10.000 prebivalcev”,”
Ljubljana, 26. februarja – V Sloveniji je več kot 120.000 bolnikov z redkimi boleznimi. Pred svetovnim dnevom redkih bolezni, ki ga obeležujemo 29. februarja, je predsednik Združenja za redke bolezni Slovenije Jože Faganel poudaril, da je za bolnika, ki je soočen z diagnozo redke bolezni poleg ustrezne obravnave pomembno tudi to, da se poveže z ljudmi s podobno izkušnjo.
Faganel je po navedbah ministrstva za zdravje dejal, da bi bilo treba odpraviti stigmo, ki se prilepi na marsikatero redko bolezen ter učiti bolnike živeti odgovorno s tovrstno boleznijo. “Prav tako pa zdravstvene delavce opozarjati, naj vendar ob nenavadnih težavah trpeče temeljiteje poslušajo in nato pogledajo na ‘strokovni internet’,” je dodal. Opozoril je, da bi bilo treba deliti dobre prakse in o redkih boleznih bolj ozaveščati tako bolnike, stroko kot tudi širšo javnost. Uporabne informacije bolnikom med drugim nudi tudi Nacionalna kontaktna točka za redke bolezni, do katere lahko dostopamo na spletu.
Po Faganelovih besedah Slovenija sodi med države z dobro razvitim javnim zdravstvenim sistemom, kjer je tudi obravnava bolnikov z redkimi boleznimi bolje razvita. “Na ravni države se je na področju redkih bolezni v zadnjih desetletjih pri nas ogromno naredilo. Velik del teh bolezni se danes odlično obravnava,” je izpostavil. Ministrstvo je leta 2021 pripravilo nov načrt dela na področju redkih bolezni za obdobje od leta 2021 do 2030 in s tem zagotovilo dodatna sredstva za področje redkih bolezni, in sicer v skupni vrednosti več kot štiri milijone evrov, so zapisali na ministrstvu.
Za register redkih nemalignih bolezni skrbi ljubljanska pediatrična klinika
V Sloveniji imamo dobro razvit sistem presejalnega testiranja vseh novorojencev za redke bolezni, je poudaril Faganel. Ministrstvo za zdravje je leta 2022 v okviru načrta za delo na področju redkih bolezni do leta 2030 zagotovilo 1.926.868,24 evra letno za uvedbo dodatnega programa presejanja novorojencev, s katerim bodo predvidoma začeli na dan redkih bolezni. Poleg že obstoječega presejanja bodo pri novorojenčkih zdaj odkrivali še nekaj drugih bolezni. Med drugim pa so v register redkih nemalignih bolezni, za katerega skrbi Pediatrična klinika Univerzitetnega kliničnega centra (UKC) Ljubljana, že začeli vnašati prve bolnike z redkimi boleznimi. Namenjen je učinkovitejšemu spremljanju in izboljšanju zdravstvene oskrbe bolnikov.
Za ljudi, ki kasneje v življenju zbolijo za redko boleznijo pa obravnave potekajo počasneje. “Združenje za redke bolezni se zelo trudi najti sistem pomoči za tiste, ki zbolijo za kakšno čudno boleznijo, že na primarni ravni, zato da bi jih sploh kdo resno obravnaval,” je navedel Faganel. Za potrebe celostne obravnave bolnikov je ministrstvo zagotovilo sredstva za delovanje tako slovenskega vozlišča za evropske referenčne mreže, centra za nediagnosticirane redke bolezni in registra redkih nemalignih bolezni, kot tudi štirih specializiranih multidisciplinarnih timov za obravnavo redkih bolezni. Na novo je bila ustanovljena tudi informacijska točka za redke bolezni na pediatrični kliniki, so pojasnili na ministrstvu.
Če bolezen zdravimo še pred izbruhom, je lahko ozdravljiva oziroma ji lahko preprečimo razvoj
Redke bolezni so bolezni, ki prizadenejo največ pet oseb na 10.000 prebivalcev. Poznamo jih okoli 8000. Gre za raznoliko skupino bolezenskih stanj, ki imajo pogosto skupne značilnosti kroničnega, napredujočega, degenerativnega in včasih življenjsko ogrožajočega poteka. Kar osemdeset odstotkov redkih bolezni je prirojenih.
Če so te bolezni odkrite in jih začnemo zdraviti, še preden se pojavijo znaki, je velika verjetnost, da bo otrok lahko kakovostno živel. “Vsako presejanje je ekonomsko bistveno cenejše, kot če otrok zboli, postane invalid, je umsko zaostal …,” je po navedbah ministrstva dejal predstojnik kliničnega oddelka za endokrinologijo, diabetes in presnovne bolezni UKC Ljubljana Tadej Battelino.
Stroške neonatalnega presajanja novorojenčkov bo v celoti kril Zavod za zdravstveno zavarovanje Slovenije (ZZZS). Sicer pa doktrino zdravljenja redkih bolezni v Sloveniji določajo posamezne klinike in razširjeni strokovni kolegiji (medicinskih strok), in ne ZZZS. So pa na zavodu v letu 2022 krili najdražje zdravljenje z zdravilom otroku s spinalno mišično atrofijo, in sicer v znesku 2.129.804,52 evra, zdravljenje otroka, hemofilika z zdravili na recept in bolnišničnimi zdravili v skupnem znesku 809.226,81 evra ter zdravljenje z zdravili na recept otroka zaradi Duchennove mišične distrofije v znesku 649.310,98 evra, so za STA zapisali na ZZZS.
Na mednarodni ravni so sicer potrebna prizadevanja za spremembe zlasti na področju zdravil za redke bolezni, kjer se velik del razvoja teh zdravil financira iz javnih sredstev (npr. preko mehanizmov Evropske komisije), vendar pa se to ne odraža v razumnih cenah zdravil, so zapisali na ZZZS. “Povečati bi morali tudi neodvisno raziskovanje, obenem pa spodbujati nadaljnji razvoj zdravil v neprofitnem sektorju vse do registracije novih zdravil. Le tako bomo lahko dosegli, da bomo zdravila plačevali po realnih cenah, in ne po nerazumno visokih cenah,” so poudarili.
Na pomoč otrokom z redkimi boleznimi priskočijo humanitarne organizacije
Društvo Viljem Julijan je le eno izmed humanitarnih organizacij, ki skozi številne projekte nudi finančno in drugo pomoč ter podporo otrokom z redkimi boleznimi in njihovim družinam. Sredstva za zdravljenje otrok zbirajo z različnimi zbiralnimi akcijami. Kot so zapisali na spletni strani, so z dobrodelnim skladom Viljem Julijan do sedaj pomagali že 144 otrokom z redkimi boleznimi z donacijami v višini 1.300.782 evrov.
Združenje za redke bolezni v torek organizira dogodek, ki je namenjen širši javnosti. Na njem bodo sodelovali gostje z dolgoletnimi izkušnjami na področju zagotavljanja kakovostne obravnave ljudi z redkimi boleznimi v Sloveniji. Dva dneva kasneje, na dan redkih bolezni pa za javnost odprt dogodek pripravlja tudi ministrstvo za zdravje.
“,”Jaka Verbic Miklic”,1708950120,1708950120,sl,15450,306,15449,43,0,NULL,,”Za bolnike z redkimi boleznimi poleg ustrezne obravnave pomembno tudi deljenje izkušnje s sobolniki”,za-bolnike-z-redkimi-boleznimi-poleg-ustrezne-obravnave-pomembno-tudi-deljenje-izkusnje-s-sobolniki,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713698635,1713698635
1045,15452,”Na nacionalni konferenci ob dnevu redkih bolezni tudi o uvedbi razširitve programa presejanja novorojencev”,”Današnja konferenca je po eni strani priložnost za izmenjavo najnovejših dognanj in strokovnega znanja, po drugi strani pa tudi priložnost za povezovanje strokovnjakov, pacientov, njihovih svojcev in organizacij”,”
Brdo pri Kranju, 29. februarja – Ministrstvo za zdravje in Združenje za redke bolezni Slovenija sta danes na Brdu pri Kranju pripravila 10. nacionalno konferenco ob dnevu redkih bolezni. Med drugim so spregovorili o razširitvi programa presejalnega testiranja novorojencev z 18 na 41 vrojenih bolezni, so sporočili z ministrstva.
Ministrstvo je pred kratkim sprejelo spremembe pravilnika za izvajanje preventivnega zdravstvenega varstva na primarni ravni, ki bo v uradnem listu objavljen predvidoma v petek. Po novem bodo opravili presejalno testiranje tudi za spinalno mišično atrofijo, težke prirojene okvare imunosti, cistično fibrozo in kongenitalno adrenalno hiperplazijo in druge.
To bo omogočilo še učinkovitejše zgodnje odkrivanje redkih bolezni in na ta način zagotovilo še bolj razvit sistem presejanja novorojencev, so v sporočilu za javnost zapisali na ministrstvu. Presejalno testiranje za vrojene bolezni se opravi iz vzorca posušene krvi novorojenca, ki jo odvzamejo 48 do 72 ur po porodu in je ključnega pomena pri zgodnjem odkrivanju redkih bolezni, kar lahko bistveno vpliva na kakovost življenja novorojenca in njegove celotne družine, poudarjajo.
Na današnji konferenci so med drugim predstavili tudi primer obravnave družine z redko boleznijo in personalizirano pot oskrbe ter registracijo testiranih družin in njihovo vključevanje v register Evropske referenčne mreže za redke bolezni. Državna koordinatorica razvoja paliativne oskrbe z ministrstva za zdravje Mateja Lopuh je spregovorila o možnosti vključevanja paliativnega pristopa v obravnavo bolnika z redko boleznijo.
Na konferenci so poleg strokovnjakov sodelovali tudi bolniki in društva za redke bolezni. “Današnja konferenca je po eni strani priložnost za izmenjavo najnovejših dognanj in strokovnega znanja, po drugi strani pa tudi priložnost za povezovanje strokovnjakov, pacientov, njihovih svojcev in organizacij, ki delujejo na tem področju,” je v uvodnem nagovoru poudarila ministrica za zdravje Valentina Prevolnik Rupel.
Ministrstvo je po njenih navedbah v letu 2021 pripravilo nov načrt dela na področju redkih bolezni za obdobje do leta 2030. Program je potrdil Zdravstveni svet, zaradi česar so lahko na ministrstvu za področje zagotovili dodatna sredstva v skupni vrednosti več kot štiri milijone evrov, so še sporočili.
“,”Jaka Verbic Miklic”,1709209500,1709209500,sl,15452,306,15451,43,0,NULL,,”Na nacionalni konferenci ob dnevu redkih bolezni tudi o uvedbi razširitve programa presejanja novorojencev”,na-nacionalni-konferenci-ob-dnevu-redkih-bolezni-tudi-o-uvedbi-razsiritve-programa-presejanja-novorojencev,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713698802,1713698802
1046,15454,”Ob svetovnem dnevu sluha pozivi k skrbnemu ravnanju s sluhom”,”Ko ga enkrat izgubimo, si ga največkrat ne moremo več povrniti.”,”
Ljubljana, 3. marca – Zveza društev gluhih in naglušnih Slovenije bo današnji svetovni dan sluha obeležila pod sloganom Skrbite in pazite na svoj sluh. Z njim želijo opozoriti na okvare sluha tistih, ki so izpostavljeni hrupu, pa tudi preglasnim zvokom. Po ocenah šumenje v ušesih ali tinitus prizadene približno 300.000 Slovencev.
“Sluh je eno izmed neprecenljivih čutil, ki nam omogoča tudi polno sporazumevanje. Ko ga enkrat izgubimo, si ga največkrat ne moremo več povrniti. Zato moramo z njim ravnati skrbno. Žal smo vse prevečkrat izpostavljeni hrupu, ki nam lahko trajno poškoduje sluh. Pomembno je, da so ljudje ozaveščeni, kaj je izguba sluha, kako jo je mogoče preprečiti in kako ukrepati ob njenem nastanku. Kajti če izgube sluha ne obravnavamo, lahko to močno vpliva na naše življenje,” so ob dnevu zapisali v zvezi društev gluhih.
Prav zato je pomembno, da se ljudje zavedajo in ustrezno ukrepajo, če zaznajo izgubo sluha, saj bodo tako imeli boljši nadzor nad svojim zdravjem, kakovost življenja pa se bo približala ravni pred izgubo sluha.
Zavod za zdravstveno zavarovanje Slovenije na leto izda okoli 19.000 naročilnic za slušne aparate, vzrok za to pa ni le staranje prebivalstva, ampak izpostavljenost hrupu, saj je po opozorilih zveze naglušnost najpogostejša poklicna bolezen, česar se ne zavedamo dovolj.
Naš sluh lahko prizadene tudi tinitus, ki se izraža s šumenjem, piskanjem ali brenčanjem ter je lahko stalno prisoten v naših ušesih, kar lahko močno zmanjša kakovost našega življenja. Na nevarnosti preglasnega poslušanja glasbe so opozarjali na glasbenem festivalu Ment, so še navedli v zvezi.
Svetovna zdravstvena organizacija je leta 2007 razglasila 3. marec za mednarodni dan skrbi za sluh in ga z leti preimenovala v svetovni dan sluha.
“,”Jaka Verbic Miklic”,1709468820,1709468820,sl,15454,306,15453,43,0,NULL,,”Ob svetovnem dnevu sluha pozivi k skrbnemu ravnanju s sluhom”,ob-svetovnem-dnevu-sluha-pozivi-k-skrbnemu-ravnanju-s-sluhom,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713698932,1713698932
1047,15456,”Kar 90 odstotkov primerov kožnega melanoma lahko po navedbah stroke preprečimo”,”Strokovnjaki pozivajo, da postane redno samopregledovanje kožnih znamenj in obisk osebnega zdravnika ob sumljivih spremembah del vsakdanjih zdravih navad vseh.”,”
Ljubljana, 4. marca – Letošnji teden boja proti raku poteka pod geslom Obdrži sonce na varni strani in v ospredje postavlja kožni melanom, ki velja za najbolj nevarno obliko kožnega raka. Zaradi njega letno umre 125 Slovencev, čeprav 90 odstotkov primerov lahko preprečimo. Za zgodnje odkritje je ključno poznavanje in redno opazovanje kože, opozarjajo strokovnjaki.
Čeprav je kožni melanom v veliki meri preprečljiv, ostaja na šestem mestu po pogostosti med vsemi raki in za njim letno zboli okoli 610 Slovencev, je na današnji novinarski konferenci ob začetku 41. tedna boja proti raku opozorila predsednica Zveze slovenskih društev za boj proti raku specialistka javnega zdravja Urška Ivanuš.
Breme kožnega melanoma je še vedno preveliko, glede na to, da ga je mogoče zelo dobro preprečiti, je poudarila Ivanuš. Pojasnila je, da po podatkih Mednarodne agencije za raziskovanje raka Slovenija sodi med države, kjer je delež kožnega melanoma, ki je povezan z UV sevanjem, okrog 90-odstoten. Slovenija se tako umešča na 6. mesto med 40 evropskimi državami glede na delež kožnega raka, ki ga lahko pripišemo UV sevanju.
Petletno preživetje bolnikov s kožnim melanomom je po podatkih Registra raka okrog 90-odstotno, predvsem na račun tega, da v Sloveniji kar v 75 odstotkih odkrivamo kožne melanome v omejenem stadiju, ko je preživetje 100-odstotno, je dejala specialistka dermatovenerologije Katarina Šmuc Berger. Če kožni melanom odkrijemo v razširjenem stadiju, je 5-letno preživetje 61-odstotno, v razsejanem stadiju pa le še 31-odstotno.
Kožni melanom je v veliki meri povezan z okvarami kože, ki jih povzroči izpostavljenost UV žarkom, je pojasnila Šmuc Berger. Tveganje za nastanek melanoma se poveča v primeru številnih sončnih opeklin, opeklin v otroški dobi in opeklin z mehurji. “Zelo veliko tveganje pomeni tako imenovano brutalno sončenje, se pravi občasno intenzivno izpostavljanje UV žarkom recimo takrat, ko gredo ljudje na morje,” je izpostavila na današnji novinarski konferenci.
Med ljudmi so že dobro znani kriteriji ABCDE kot koristen opomnik za prepoznavanje morebitnih znakov melanoma: asimetrija znamenja, nepravilni robovi, neenakomerna ali spremenjena barva, premer več kot šest milimetrov in spremembe v znamenju, kot so rast, srbenje, krvavitev ali pojav novih. Ob tem se v zadnjih letih uveljavlja tudi znak grde račke, s katerim opisujemo spremembo na koži, ki se po svojih lastnostih močno razlikuje od vseh ostalih, poudarja Šmuc Berger.
Pravočasno odkrita sprememba na koži, za katero se izkaže, da je kožni melanom, je preprosto odstranljiva in s tem tudi v 90 odstotkih preprosto ozdravljiva z relativno hitrim kirurškim posegom, ki ne prinaša pomembnejših ali pa nevarnejših zapletov in posledic, je poudarila kirurginja na onkološkem inštitutu Barbara Perić.
“Običajno je potreben samo izrez kože, kjer se je nahajal tumor, velikokrat tudi diagnostičen poseg na bezgavkah in s tem v bistvu pridobimo tudi vse informacije, na podlagi katerih se odločamo potem o prognozi in nadaljnjem zdravljenju te bolezni,” je pojasnila.
Strokovnjaki pozivajo, da postane redno samopregledovanje kožnih znamenj in obisk osebnega zdravnika ob sumljivih spremembah del vsakdanjih zdravih navad vseh. Šmuc Berger prebivalce opozarja, naj se poleti med 10. in 16. uro umaknejo v globoko senco, uporabljajo zaščitna oblačila, pokrivala, sončna očala in kreme z visokim zaščitnim faktorjem in ne obiskujejo solarijev.
“,”Jaka Verbic Miklic”,1709555460,1709555460,sl,15456,306,15455,43,0,NULL,,”Kar 90 odstotkov primerov kožnega melanoma lahko po navedbah stroke preprečimo”,kar-90-odstotkov-primerov-koznega-melanoma-lahko-po-navedbah-stroke-preprecimo,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713699188,1713699189
1048,15458,”Začenjajo se akcije cepljenja proti klopnemu meningoencefalitisu”,””Klopni meningoencefalitis se na človeka ponavadi prenese zelo hitro po vbodu klopa, že v nekaj minutah,” je opozorila Šinkovec Zorko.”,”
Ljubljana, 10. marca – V različnih zdravstvenih domovih po državi se začenjajo akcije cepljenja proti klopnemu meningoencefalitisu (KME). Na NIJZ poudarjajo, da cepljenje predstavlja najučinkovitejšo zaščito proti tej bolezni. Priporočljivo ga je opraviti v zimskih mesecih, da dosežemo zaščito pred začetkom sezone aktivnosti klopov v toplejših mesecih.
Cepljenje proti KME je priporočljivo za vse osebe, starejše od enega leta, ki živijo ali predvidevajo aktivnosti na območju, kjer se pojavlja KME. Od leta 2019 je v Sloveniji v program cepljenja uvedeno cepljenje odraslih in otrok proti KME, in sicer za otroke po dopolnjenem enem letu starosti ter odrasle, ki v tekočem letu dopolnijo 49 let starosti. Cepljenje za to skupino se opravi s tremi odmerki cepiva, ki se plačajo iz sredstev obveznega zdravstvenega zavarovanja. Cepljenje pripada tudi zamudnikom, med te sodijo otroci, rojeni leta 2016 ali kasneje ter odrasli, ki so dopolnili 49 let v letu 2019 ali kasneje in še niso prejeli treh odmerkov v breme zavarovanja, so zapisali na Nacionalnem inštitutu za javno zdravje (NIJZ).
V Sloveniji na voljo učinkovito in varno cepivo
V Sloveniji je cepivo, ki je na voljo, zelo učinkovito in varno, je za STA dejala Nadja Šinkovec Zorko z NIJZ. Poudarila je, da je cepljenje smiselno in priporočljivo še posebej za tiste, ki se radi gibljejo v naravi. “Kljub temu se moramo zavedati, da lahko klopa, ki nas lahko okuži, dobimo tudi na domačem vrtu,” je dejala. Ker je bolezen virusna, specifičnega zdravljenja zanjo ni. “Lajšamo lahko le simptome in nudimo podporno terapijo prizadetim organskim sistemom. Zato je preventiva pri tej bolezni še toliko bolj pomembna,” je poudarila.
V zdravstvenih domovih po državi akcije cepljenja proti KME organizirajo tekom tega in naslednjega meseca. Večina se jih odloči, da bodo cepiva v času trajanja akcije na voljo po znižani ceni. V Zdravstvenem domu (ZD) Maribor bodo cepljenje organizirali predvidoma sredi aprila v okviru že trinajste akcije Zdravo v naravo, s katero želijo povišati odstotek precepljenosti. Kot so navedli za STA, se za cepljenje v njihovem zdravstvenem domu namreč odloča manjši delež pacientov, in sicer le okrog 5-odstotni. “Kar nekaj let se giblje številka cepljenih med 3000 do 3500 občank in občanov, tako je bilo lani cepljenih 3196 oseb, leto prej pa 3483,” so navedli. Za primerjavo se je v ZD Ljubljana lani aprila in maja proti KME cepilo 3129 oseb.
V ZD Kranj bodo cepljenje začeli v sredo, v ZD Celje pa v soboto. S klopi, ki so sicer najbolj aktivni v obdobju od aprila do novembra, se lahko srečamo tudi v mestu, parkih in na otroških igriščih, zato je preventiva tudi v mestih ključnega pomena.
KME se prenaša z vbodom okuženega klopa, poleg cepljenja so pomembni tudi drugi zaščitni ukrepi
KME je resna virusna bolezen osrednjega živčevja, ki se prenaša z vbodom okuženega klopa, pa tudi z vnosom nepasteriziranega mleka ali mlečnih izdelkov narejenih iz mleka kužne živine. Prvi znaki bolezni se lahko pojavijo sedem do 14 dni po okužbi. Prvo obdobje bolezni se kaže kot kratka neznačilna vročinska bolezen z mišičnimi bolečinami, utrujenostjo in glavobolom. Sledi obdobje brez simptomov, ki traja okrog osem dni. Drugo obdobje bolezni se izraža z znaki prizadetosti osrednjega živčevja, kar lahko pušča dolgotrajne posledice (glavobol, utrujenost, motnje zbranosti, motnje spomina), včasih tudi trajne ohromitve (pet odstotkov) ali celo smrt (en odstotek), so navedli na NIJZ.
Kot so zapisali na NIJZ, se je pojavnost KME sicer zlasti po letu 2014 začela manjšati. V 9-letnem obdobju od 2014 do 2022 so zabeležili povprečno okoli 110 prijav KME letno. V letu 2022 so prejeli 124 prijav obolenja, lani pa 62. Delež cepljenih oseb je nizek. Tveganju okužbe so izpostavljeni ljudje vseh starostnih skupin, najpogosteje pa obolevajo osebe, stare med 55 in 64 let. Pri starejših bolezen v povprečju tudi težje poteka in pogosteje pušča trajne posledice.
Poleg cepljenja so pomembni tudi drugi zaščitni ukrepi, so poudarili na NIJZ. Če je mogoče, se izogibamo endemičnim območjem, sicer pa je pomembna zaščita pred vbodom klopa. Na sprehodih in izletih v naravo se zaščitimo s svetlimi oblačili, ki pokrijejo čim več kože (dolge hlače, dolgi rokavi, stisnjeni na zapestjih in gležnjih) in zaprtimi čevlji. Na izpostavljeno kožo nanesemo repelent, ki z vonjem odganja klope, na oblačila pa permetrin. Po vrnitvi s sprehoda natančno pregledamo vso kožo, predvsem mehke predele, tudi lasišče in morebitne prisesane klope čim prej odstranimo.
“Klopni meningoencefalitis se na človeka ponavadi prenese zelo hitro po vbodu klopa, že v nekaj minutah,” je opozorila Šinkovec Zorko. Z odstranitvijo klopa v prvih 24 urah zelo zmanjšamo tudi tveganje za pojav lymske borelioze, ki je prav tako bolezen, ki se na človeka prenese z vbodom okuženega klopa.
“,”Jaka Verbic Miklic”,1710074040,1710074040,sl,15458,306,15457,43,0,NULL,,”Začenjajo se akcije cepljenja proti klopnemu meningoencefalitisu”,zacenjajo-se-akcije-cepljenja-proti-klopnemu-meningoencefalitisu,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713699380,1713699381
1049,15460,”Letos že 381 prijav primerov oslovskega kašlja”,”Kljub obveznemu cepljenju otrok proti oslovskemu kašlju se ta bolezen v Sloveniji še vedno pojavlja, tudi v obliki izbruhov.”,”
Ljubljana, 13. marca – Na Nacionalnem inštitutu za javno zdravje (NIJZ) so do 13. marca prejeli 381 prijav primerov oslovskega kašlja. Lani v celem letu pa je bilo skupaj prijavljenih 125 primerov. Kot ob tem opozarjajo na NIJZ, je najučinkovitejši način preprečevanja oslovskega kašlja vzdrževanje visokega deleža cepljenih v skupnosti.
Cepljenje namreč zmanjšuje tveganje za okužbo z bakterijo Bordetella pertussis in zmanjšuje resnost bolezni pri cepljenih posameznikih. A kot izpostavljajo na NIJZ, zaščita po cepljenju, kot tudi po preboleli bolezni, s časom upada.
Na NIJZ opozarjajo, da je izjemnega pomena, da otroci prejmejo vsa cepljenja v skladu s programom cepljenja, priporočljivo pa je tudi cepljenje proti oslovskemu kašlju (s kombiniranim cepivom proti davici, tetanusu in oslovskemu kašlju) enkrat v odrasli dobi.
Cepljenje s kombiniranim cepivom proti davici, tetanusu in oslovskemu kašlju je priporočljivo tudi za nosečnice čim prej po 24. tednu nosečnosti, ki jim cepljenje krije obvezno zdravstveno zavarovanje, medtem ko je cepljenje pri odraslih zaenkrat samoplačniško.
Po podatkih elektronskega registra cepljenih oseb se je v Sloveniji proti oslovskemu kašlju v letu 2023 cepilo več kot tisoč nosečnic.
Cepljenje proti oslovskemu kašlju se je v Sloveniji začelo leta 1959 in je vključeno v obvezni program cepljenja. Predšolski otroci dobijo tri odmerke cepiva v prvih dveh letih življenja, nato v 2. razredu osnovne šole in ob sistematskem pregledu v srednji šoli sledita poživitvena odmerka.
Kljub obveznemu cepljenju otrok proti oslovskemu kašlju se ta bolezen v Sloveniji še vedno pojavlja, tudi v obliki izbruhov. V Sloveniji je pojavnost oslovskega kašlja glede na prijavljene primere največja pri dojenčkih in mladostnikih. Ker je klinična slika pri odraslih običajno neznačilna, bolezen večkrat ni prepoznana kot oslovski kašelj in tudi ni prijavljena, so še pojasnili na NIJZ.
“,”Jaka Verbic Miklic”,1710333420,1710333420,sl,15460,306,15459,43,0,NULL,,”Letos že 381 prijav primerov oslovskega kašlja”,letos-ze-381-prijav-primerov-oslovskega-kaslja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713699566,1713699567
1050,15462,”Svetovni dan letos o vplivu ustnega zdravja na sistemske bolezni”,”Še posebej dobro morajo za ustno zdravje skrbeti kronični bolniki, saj lahko slabo ustno zdravje privede do dodatnega poslabšanja njihove kronične bolezni, so poudarili pri zbornici.”,”
Ljubljana, 20. marca – Današnji svetovni dan ustnega zdravja je letos namenjen ozaveščanju o vplivu ustnega zdravja na sistemske bolezni. Ustno zdravje je namreč neločljivo povezano s splošnim zdravjem. Bolezni zob in ustne votline pomembno vplivajo na kakovost življenja, posameznikovo vsakodnevno delovanje in psihosocialno stanje, poudarjajo na zdravniški zbornici.
Povezanost ustnega in splošnega zdravja se kaže v obeh smereh. Nekatere sistemske bolezni se s svojimi simptomi in znaki najprej izrazijo v ustni votlini. Velja tudi obratno, saj zdravje ustne votline vpliva tudi na nekatera druga bolezenska stanja, so na spletni strani zapisali pri Zdravniški zbornici Slovenije.
Za ustno zdravje moramo skrbeti ves čas. Še posebej dobro morajo za ustno zdravje skrbeti kronični bolniki, saj lahko slabo ustno zdravje privede do dodatnega poslabšanja njihove kronične bolezni, so poudarili pri zbornici.
Neurejena sladkorna bolezen se tako v ustni votlini lahko kaže kot občutek suhih in pekočih ust, v izgubi okusa, ustnem zadahu, glivičnih okužbah, slabem celjenju ran, krvavitvi iz dlesni, majavosti zob in parodontalni bolezni, ki lahko vodi v izgubo zob. Slabo ustno zdravje pa lahko poslabša sladkorno bolezen in oteži nadzorovanje sladkorja.
Manjše število zob pri starejših je povezano tudi s povečanim tveganjem za kognitivni upad in pojav demence. Bolniki zaradi narave bolezni izgubijo potrebo, motivacijo in spretnost umivanja zob kot enega od osnovnih higienskih opravil. Posledično je treba redno umivanje zob uvesti med vsakodnevna rutinska opravila že na začetku bolezni, pojasnjujejo pri zdravniški zbornici.
Nižja mineralna kostna gostota in osteoporozi zlom pomenita več izgubljenih zob. Vsem bolnikom z osteoporozo, ki bodo pričeli zdravljenje z antiresorptivnimi zdravili, pred zdravljenjem svetujejo obisk in posvet pri zobozdravniku, da se morebitni posegi med zdravljenjem ustrezno načrtujejo in prilagodijo.
Kronični bolniki morajo zobozdravnika obiskati pogosteje kot zdravi ljudje. V primerih kronične bolezni je potrebna kontrola vsakih šest do osem mesecev. Nujna je redna in učinkovita ustna higiena, ki mora biti prilagojena kronični bolezni. Za zdravo ustno votlino in urejeno kronično bolezen je izjemnega pomena sodelovanje pacienta, zdravnika in zobozdravnika, je na novinarski konferenci v torek poudaril vodja delovne skupine ustno zdravje pri odboru za zobozdravstvo zdravniške zbornice Matej Praprotnik.
Praprotnik je sicer na vprašanje, ali se ustno zdravje Slovencev skozi leta izboljšuje, odgovoril, da si zobozdravniki želijo verjeti, da je temu tako. Izboljšuje se namreč osveščanje v javnosti. Je pa ob tem opozoril, da živimo v družbi, v kateri je vedno težje držati rutino, zato vse manj časa posvečamo osebni higieni.
Največ težav z vzdrževanjem rutine je po njegovih besedah denimo ob prehodu iz otroštva v adolescenco, ko za ustno higieno niso več odgovorni starši, pač pa otroci sami. Preden zopet vzpostavijo rutino, se lahko zgodi kar nekaj težav in kar nekaj škode na ustnem zdravju, je pojasnil.
“,”Jaka Verbic Miklic”,1710938400,1710938400,sl,15462,306,15461,43,0,NULL,,”Svetovni dan letos o vplivu ustnega zdravja na sistemske bolezni”,svetovni-dan-letos-o-vplivu-ustnega-zdravja-na-sistemske-bolezni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713699758,1713699759
1051,15464,”Raziskovalci s Klinike Golnik ugotovili povezavo med anafilaksijo in genetsko boleznijo”,”Anafilaksija je življenje ogrožajoča sistemska preobčutljivostna reakcija, ki se razvije v nekaj minutah po prvem stiku z alergenom.”,”
Golnik, 26. marca – Raziskovalna skupina na Univerzitetni kliniki za pljučne bolezni in alergijo Golnik je na podlagi večletne raziskave ugotovila, da imajo pacienti z najtežjimi alergijskimi reakcijami pogosto v osnovi genetsko bolezen. To odkritje pomembno vpliva na klinično prakso in obravnavo najbolj ogroženih pacientov, so sporočili s Klinike Golnik.
Ugotovitve izhajajo iz večletne raziskave, v katero sta bili vključeni 1502 osebi iz Slovenije, Avstrije, Hrvaške in Poljske. Pri raziskavi so poleg Klinike Golnik kot vodilne partnerice sodelovali še Medicinska fakulteta v Gradcu, Univerzitetni klinični center Zagreb, Medicinska fakulteta v poljskem Krakovu in Nacionalni inštitut za zdravje v ZDA.
Cilj raziskave je bil z raziskovanjem genetskega ozadja anafilaksije oziroma življenjsko ogrožajočih alergijskih reakcij odkriti bolnike, ki so nagnjeni k najtežjim alergijskim reakcijam, in tako preprečiti smrtni izid. Ugotovitve raziskave so bile sredi marca objavljene v strokovnem članku v ugledni alergeološki reviji Allergy: European Journal of Allergy and Clinical Immunology.
Doslej je veljalo prepričanje, da je alergijska reakcija nepredvidljiva in da ne moremo napovedati, kako težko reakcijo bo pacient imel. Raziskava pa bistveno spreminja naš pogled na mehanizme anafilaksije, so izpostavili na Kliniki Golnik in pojasnili, da so raziskovalci odkrili, da imajo pacienti z najtežjimi alergijskimi reakcijami lahko genetsko bolezen.
Raziskava je pokazala, da je možno pri pacientu, ki je že doživel težko anafilaktično reakcijo, preveriti genetske dejavnike, ali ima večje tveganje za naslednji težji potek alergije. Na tej podlagi lahko paciente z odkrito genetsko motnjo odslej zdravijo na drugačen in intenzivnejši način, jih nadzorujejo in zdravijo doživljenjsko.
Vodja Alergološke enote na Kliniki Golnik in soavtor raziskave Peter Kopač je pojasnil, da je njihova raziskava potrdila, da ima do 30 odstotkov pacientov, ki so alergični na strup ose ali čebele in jih zato zdravijo z imunoterapijo, v osnovi genetsko motnjo, in sicer bolezen mastocitov.
“To je zelo velika skupina, na katero smo sedaj posebej pozorni. Ti pacienti so bolj ogroženi za naslednje reakcije in vemo, da je tudi zdravljenje manj uspešno. Zato jih sedaj zdravimo drugače, potrebujejo doživljenjsko imunoterapijo in kljub temu morajo še vedno s seboj nositi avtoinjektor z adrenalinom,” je izpostavil Kopač.
Vodja Laboratorija za klinično imunologijo in molekularno genetiko na Kliniki Golnik ter glavni raziskovalec projekta Peter Korošec je povedal, da je v raziskavi sodelovalo veliko število pacientov iz štirih držav. “Ne glede na to, da so bili pacienti obravnavani v različnih državah, so bili rezultati zelo primerljivi, kar kaže na veliko težo naših ugotovitev,” je poudaril.
Kot je dodal, je zelo pomembno, da je bil ves visokotehnološki del genetske analize izveden v Sloveniji, kar kaže na izjemen nivo slovenskega medicinskega raziskovalnega dela na področju genetike in imunologije.
Na Kliniki Golnik vsako leto obravnavajo približno 200 pacientov z najtežjimi oblikami alergije, ki so smrtno nevarne. Ocenjujejo, da letno v Sloveniji zaradi anafilaksije umrejo dve ali tri osebe, pri čemer gre v večini primerov za alergije na pike žuželk, zdravila ali hrano.
Anafilaksija je življenje ogrožajoča sistemska preobčutljivostna reakcija, ki se razvije v nekaj minutah po prvem stiku z alergenom. Pri anafilaksiji so prizadeta dihala in srčno-žilni sistem, pojavijo se spremembe na koži in sluznicah. Prvi znaki anafilaksije so srbež kože, pogosto dlani, podplatov ali za ušesi, pojav koprivnice, pordevanje kože, kihanje ali otekanje obraza. Pojavijo se zelo hitro in lahko hitro napredujejo z občutkom cmoka v grlu, težko sapo, znižanim krvnim tlakom, vrtoglavico in kolapsom. Lahko so prisotni tudi krči v trebuhu, bruhanje in driska.
“,”Jaka Verbic Miklic”,1711457040,1711457040,sl,15464,306,15463,43,0,NULL,,”Raziskovalci s Klinike Golnik ugotovili povezavo med anafilaksijo in genetsko boleznijo”,raziskovalci-s-klinike-golnik-ugotovili-povezavo-med-anafilaksijo-in-genetsko-boleznijo,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713699966,1713699966
1052,15466,”Pred svetovnim dnevom zdravja danes ponekod brezplačne meritve”,”Poudarili bodo pomen zdravega življenjskega sloga in pozvali k udeležbi v presejalnih programih.”,”
Ljubljana/Velenje, 5. aprila – Pred svetovnim dnevom zdravja, ki ga vsako leto zaznamujemo 7. aprila, bodo danes v Ljubljani in Velenju potekale številne brezplačne meritve in svetovanja. Obiskovalci bodo med drugim lahko opravili meritve krvnega tlaka, analizo telesne sestave in nasičenosti s kisikom. Strokovnjaki pa bodo na stojnicah podajali zdravstvene nasvete.
V Ljubljani bo dogodek potekal na Pogačarjevem trgu med 10. in 13. uro. Predstavili bodo brezplačne delavnice za zdravo življenje, ki se jih lahko prebivalci udeležijo skozi vse leto, pomagali z nasveti o ustnem zdravju, zdravi prehrani, preprečevanju bolezni, samopregledovanju dojk in psihosocialni podpori, so sporočili iz Zdravstvenega doma Ljubljana.
Poudarili bodo pomen zdravega življenjskega sloga in pozvali k udeležbi v presejalnih programih. Obiskovalci pa bodo lahko opravili meritve krvnega tlaka s svetovanjem, analizo telesne sestave z nasveti dietetika, meritve z dinamometrom in nasveti fizioterapevta.
Dogodek pripravlja ZD Ljubljana skupaj z Mestno občino Ljubljana, Lekarno Ljubljana, Nacionalnim inštitutom za javno zdravje, Zvezo društev za boj proti raku in Združenjem za boj proti raku dojk Europa Donna.
V Velenju pa bodo svetovni dan zdravja obeležili danes dopoldne na Cankarjevi ulici. Na stojnicah se bodo med 8. in 12. uro predstavila društva s področja zdravja in preventive, so sporočili z Mestne občine Velenje.
Center za krepitev zdravja ZD Velenje bo predstavil preventivne presejalne programe Dora, Zora in Svit. Na voljo bodo brezplačne meritve s področja zdravja in preventive – meritve krvnega tlaka, nasičenosti s kisikom in testiranje za funkcijsko manjzmožnost. Svetovale bodo diplomirane medicinske sestre s specialnimi znanji, ki delujejo v referenčni ambulanti ZD Velenje.
Predstavila se bodo Medobčinsko društvo gluhih in naglušnih, Društvo za boj proti raku, Hospic, Območno združenje Rdečega križa, Društvo Invalid Konovo, velenjska podružnica društva Šola zdravja, Društvo Sončnica, Društvo bolnikov z osteoporozo, Društvo diabetikov, Združenje multiple skleroze SAŠA regije, Šaleški koronarni klub in Prvi posredovalci.
V Novem mestu pa bodo ob svetovnem dnevu danes obeležili tudi 130-letnico Splošne bolnišnice (SB) Novo mesto. Ob tem bodo odprli fotografsko razstavo v restavraciji bolnišnice z naslovom SB NM skozi čas in nove informacijske panele ob poti do glavnega vhoda, so sporočili iz bolnišnice.
“,”Jaka Verbic Miklic”,1712317680,1712317680,sl,15466,306,15465,43,0,NULL,,”Pred svetovnim dnevom zdravja danes ponekod brezplačne meritve”,pred-svetovnim-dnevom-zdravja-danes-ponekod-brezplacne-meritve,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713700185,1713700185
1053,15468,”WHO opozarja na naraščanje smrti zaradi hepatitisa B in C”,”Leta 2019 je za posledicami virusnega hepatitisa umrlo 1,1 milijona ljudi, leta 2022 pa 1,3 milijona”,”
Ženeva, 9. aprila – Svetovna zdravstvena organizacija (WHO) v danes objavljenem letnem poročilu opozarja na naraščanje smrti zaradi hepatitisa B in C, zaradi katerih dnevno umre 3500 ljudi. Leta 2019 je za posledicami virusnega hepatitisa umrlo 1,1 milijona ljudi, leta 2022 pa 1,3 milijona, tako da je to druga najbolj smrtonosna nalezljiva bolezen za tuberkulozo.
Kar 83 odstotkov smrtnih primerov je bila posledica okužbe z virusom hepatitisa B, 17 odstotkov pa z virusom hepatitisa C, navaja WHO v globalnem poročilu o hepatitisu, ki ga je objavil na svoji spletni strani.
Obstaja pet različnih vrst hepatitisa, ki jih povzročajo različni virusi od A do E. Hepatitis B in C, ki sta med glavnimi vzroki za cirozo jeter in raka na jetrih, in na katera se poročilo WHO v glavnem nanaša, pa sta še posebej nevarna. Prenašata se preko krvi in spolnih odnosov.
WHO v poročilu poudarja, da je kljub boljšim orodjem za diagnosticiranje in zdravljenje ter vse nižjih cen zdravil zastala raven testiranja in zdravljenja. WHO pa ob sprejemu hitrih ukrepov pričakuje, da bo mogoče doseči cilj odprave hepatitisa do leta 2030.
Poročilo kaže, da število smrtnih primerih narašča, čeprav je WHO v istem obdobju v 187 državah zabeležil rahlo zmanjšanje števila okužb s hepatitisom, in sicer z 2,5 milijona v letu 2019 na 2,2 milijona leta 2022. Med njimi je 1,2 milijona novih okužb s hepatitisom B in skoraj milijon novih okužb s hepatitisom C. WHO izpostavlja, da so cepljenje in drugi preventivni ukrepi učinkoviti, a se kljub temu s hepatitisom dnevno okuži okoli 6000 ljudi.
Posodobljene ocene WHO še kažejo, da je leta 2022 s hepatitisom B živelo 254 milijonov ljudi, 50 milijonov pa s hepatitisom C. Polovica bremena kroničnih okužb s hepatitisom B in C je med ljudmi, starimi od 30 do 54 let, 12 odstotkov pa med mlajšimi od 18 let. Moški predstavljajo 58 odstotkov vseh primerov.
Do konca leta 2022 je bilo diagnosticiranih samo 13 odstotkov ljudi s kroničnim hepatitisom B, samo trije odstotki pa so imeli dostop do zdravljenja. Med kroničnimi bolniki s hepatitisom C so jih diagnosticirali okoli tretjino, petino obolelih pa so zdravili.
Hepatitis B in C prizadeneta predvsem prebivalce Afrike in Azije. Po podatkih WHO so dve tretjini novih okužb na svetu zabeležili v Etiopiji, Bangladešu, na Kitajskem, v Indiji, Indoneziji, Nigeriji, Pakistanu, Filipinih, Rusiji in Vietnamu.
“,”Jaka Verbic Miklic”,1712664480,1712664480,sl,15468,306,15467,43,0,NULL,,”WHO opozarja na naraščanje smrti zaradi hepatitisa B in C”,who-opozarja-na-narascanje-smrti-zaradi-hepatitisa-b-in-c,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713701365,1713701365
1054,15470,”WHO: Nigerija prva z novim cepivom proti meningitisu”,”To cepivo nudi zdravstvenim delavcem novo orodje tako za ustavitev izbruha kot začetek izkoreninjena te bolezni v Nigeriji”,”
Ženeva, 13. aprila – Najbolj naseljena afriška država Nigerija je po navedbah Svetovne zdravstvene organizacije (WHO) prva država na svetu, ki je uvedla “revolucionarno” novo cepivo proti meningitisu. Obetajo si, da bodo s tem rešili številna življenja, danes poroča francoska tiskovna agencija AFP.
“Meningitis je star in smrtonosen sovražnik, vendar ima to novo cepivo potencial, da spremeni potek bolezni, prepreči prihodnje izbruhe in reši mnoga življenja,” je sporočil generalni sekretar WHO Tedros Adhanom Ghebreyesus. “S cepivom v Nigeriji smo korak bližje našemu cilju, da do leta 2030 izkoreninimo meningitis,” je dodal.
Cepivo Men5CV naj bi nudilo zaščito pred petimi glavnimi tipi meningokokne bakterije (A, C, W, Y in X). Po navedbah WHO nudi širšo zaščito od cepiva, ki je trenutno v uporabi v večini Afrike in ščiti samo pred različico A.
Število primerov meningitisa je lani v Afriki poskočilo za 50 odstotkov. Eno od žarišč je Nigerija, ki ima 220 milijonov prebivalcev. V zadnjem valu okužb od 1. oktobra lani do 11. marca letos je zaradi te bolezni v tej državi umrlo 153 ljudi. Najhuje je na severu države.
“To cepivo nudi zdravstvenim delavcem novo orodje tako za ustavitev izbruha kot začetek izkoreninjena te bolezni v Nigeriji,” je povedal Muhammad Ali Pate z nigerijskega ministrstva za zdravje.
Bolezen povzroči vnetje membran ali ovojnic, ki ščitijo možgane in hrbtenjačo. Najresnejša je bakterijska okužba, ki se lahko konča tudi s smrtjo.
“,”Jaka Verbic Miklic”,1713010260,1713010260,sl,15470,306,15469,43,0,NULL,,”WHO: Nigerija prva z novim cepivom proti meningitisu”,who-nigerija-prva-z-novim-cepivom-proti-meningitisu,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1713701571,1713701572
1055,15472,”Vabilo na 13-to strateško konferenco Vrednost inovacij”,”Prepoznavanje potencialov v zdravstvenem sistemu za spodbujanje inovacij.”,”
vljudno vabljeni na
13. strateško konferenco Vrednost inovacij:
Prepoznavanje potencialov v zdravstvenem sistemu za spodbujanje inovacij.
Potekala bo v torek, 21. maja 2024, od 11. do 15. ure.
V uvodnem delu konference nas bo nagovorila dr. Valentina Prevolnik Rupel, ministrica za zdravje.
Kot glavna govorca se nam bosta letos pridružila Bogi Eliasen, zdravstveni direktor na kopenhagenskem inštitutu za študije prihodnosti in vizionar na področju globalnega zdravstvenega futurizma in inovacij in Marc Schreiner, direktor berlinskega združenja bolnišnic in član izvršnega odbora Nemškega bolnišničnega združenja (DKG).
Bogdan Tušar iz Društva ekonomistov v zdravstvu bo predstavil pomen ekonomike v zdravstvu za izboljšanje organizacije zdravstvenega varstva, Karmen Janša, dr. med. bo predstavila rezultate analize ekonomskega bremena sladkorne bolezni.
Na okrogli mizi bodo pod moderatorstvom prim. mag. Dorjana Marušiča, dr. med. sodelovali uveljavljeni domači strokovnjaki, ki bodo razpravljali o metodologijah za optimalno upravljanje z zdravstvenimi viri z namenom, da bo zdravstveni sistem osredotočen na bolnika. Delili bodo tudi vizijo prihodnosti organizacije zdravstvenega varstva, ki v središče postavlja bolnika. Z nami bodo: prof. dr. Urh Grošelj, dr. med. iz pediatrične klinike Ljubljana, Iztok Štotl, dr. med. iz UKC Ljubljana, Tanja Španić, predsednica združenja Europa Donna Slovenija in predsednica evropske zveze Europa Donna ter Janez Poklukar, dr. med., zdravnik in nekdanji direktor UKC Ljubljana, SB Jesenice in nekdanji minister za zdravje ter predstavnica Združenja zdravstvenih zavodov Slovenije.
Konferenca bo potekala v živo, v Klubu Cankarjevega doma v Ljubljani, in virtualno preko našega YouTube kanala.
Več o konferenci si lahko preberete na spletni strani. FarmaForum letošnjo konferenco organizira v sodelovanju z Društvom ekonomistov v zdravstvu.
Veselimo se vaše udeležbe in vas lepo pozdravljamo.
“,”Jaka Verbic Miklic”,1715242380,1715242380,sl,15472,306,15471,43,0,NULL,,”13. strateška konferenca”,13-strateska-konferenca,Post,”/sites/43/files/images/news/13. strateška konferenca/13 Strateska Konferenca.png”,1,0,1715242519,1715242921
1056,15474,”Slovenija je na področju inovacij prodorna, njihova implementacija v celotnem zdravstvenem sistemu pa je pomanjkljiva “,”Nahajamo se na kritični točki, kjer izzivi evropskega zdravstva ogrožajo socio-ekonomsko stabilnost naše družbe”,”
Ljubljana, 21. maj 2024 – Nahajamo se na kritični točki, kjer izzivi evropskega zdravstva ogrožajo socio-ekonomsko stabilnost naše družbe. To ni le zdravstvena kriza, ampak družbena nujnost, ki zahteva sistemske in strateške odzive za preprečevanje negativnih posledic tako za paciente kot za širše socio-ekonomske sisteme. O tem in še marsičem smo govorili na letošnji 13. konferenci Vrednost inovacij, ki je potekala pod naslovom »Prepoznavanje potencialov v zdravstvenem sistemu za spodbujanje inovacij«. Letos je Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb konferenco organiziral v sodelovanju z Društvom ekonomistov v zdravstvu.
Bogi Eliasen, zdravstveni direktor na Copenhagen Institute for Future Studies je ob začetku konference povedal, da je ob pregledu zdravstvenega sistema v Sloveniji razvidno, da se, tako kot drugje v Evropi, sooča z izzivi uvajanja sprememb: »Vendar je sistem dokaj zrel pri prepoznavanju potreb po premiku proti preventivi in primarnemu zdravstvenemu varstvu in bi lahko, če bi to postala prioriteta, postal vodilni na tem področju, saj je to sprememba, ki jo potrebuje vsaka država. Slovenija se tu sooča s prednostmi in izzivi majhne države. Prednost je sposobnost hitrega povezovanja relevantnih deležnikov. Izziv pa je, da nekatere spremembe zahtevajo zadosten obseg. Pri tem je pomembno biti povezan z evropsko in globalno mrežo.« Ob tem je še dodal, da je Slovenija na področju zdravstva vodilna v svoji mikro geografski regiji, tako v krogu držav adriatika, kot v krogu srednjevzhodno evropskih držav. To je lahko tako odgovornost kot tudi priložnost za napredek.
Marc Schreiner, LL.M., direktor berlinskega združenja bolnišnic, je ob tem poudaril ključno potrebo po nenehnih inovacijah v zdravstvenem varstvu, saj po njegovem stagnacija pomeni nazadovanje. Kot je povedal, je v Nemčiji Zvezni skupni odbor za financiranje inovativnih zdravstvenih projektov, od leta 2016 dodelil 200 milijonov evrov projektom, ki izboljšujejo medicinske napovedi in upravljanje pacientov v prenatrpanih reševalnih centrih. Schreiner je tudi izpostavil pomembno naložbo v višini 4,3 milijarde evrov od leta 2020 do 2025 za digitalizacijo bolnišnic, s poudarkom na integraciji naprednih digitalnih tehnologij, za boljšo zdravstveno oskrbo. Poudaril je nujnost reforme bolnišnic za reševanje finančnih težav, pomanjkanja osebja in velikega birokratskega bremena za zdravstvene delavce.
»V Društvu ekonomistov v zdravstvu, ki je osrednje združenje strokovnjakov na področju zdravstvene ekonomike, poslovanja, organizacije zdravstvenih zavodov in ima pomembno vlogo pri vsebinah, kot je zdravstvena ekonomika, si želimo, da to področje postane prepoznavno tudi v prihodnosti,« je povedal Bogdan Tušar. »Zato veliko energije vlagamo v to, da opozarjamo in ponujamo rešitve za zdravstveni sistem, za zdravstvo, za zdravstvene zavode. Kot smo ugotavljali tudi na današnji konferenci, se že vsaj 15 let vrtimo okrog enih in istih problemov. Torej težave ostajajo, rešitve pa tukaj so. Društvo si zato želi, da bi bilo vključeno v procese sprememb in da bi lahko to, kar prepoznavamo kot pomembno, tudi nekoč ugledalo luč sveta oziroma se realiziralo.«
Karmen Janša, dr. med., iz Zavoda za zdravstveno zavarovanje Slovenije je v svojem predavanju predstavila študijo, ki je bila objavljena januarja letos, in sicer na temo neposrednih zdravstvenih izdatkov za sladkorno bolezen v Sloveniji. »Skupaj s sodelavci Petro Došenović Bonča, Jožetom Sambtom in Daliborjem Gavrićem, smo analizirali podatke ZZZS za obdobje od leta 2019 do 2022. Povprečni letni izdatki za sladkorno bolezen so znašali 174 milijonov evrov, oziroma 1.108 evrov na bolnika, s povprečno letno rastjo 12,5 odstotka. Več kot polovico izdatkov so povzročili zapleti sladkorne bolezni, predvsem srčni zapleti, dializa zaradi odpovedi ledvic in oskrba diabetičnega stopala.«
O tem in vsem ostalem so na okrogli mizi razpravljali prof. dr. Urh Grošelj, dr. med. iz Pediatrične klinike Ljubljana, Iztok Štotl iz UKC Ljubljana, Tanja Španić, predsednica Europa Donna Slovenije, Tatjana Jevševar, mag. ekon. in posl. ved., direktorica Združenja zdravstvenih zavodov Slovenije ter Janez Poklukar, zdravnik in nekdanji direktor UKC Ljubljana, Splošne bolnišnice Jesenice in nekdanji minister za zdravje. Okroglo mizo je povezoval Dorjan Marušič, mednarodni svetovalec. Tatjana Jevševar je na okrogli mizi izpostavila dva ključna izziva, ki ovirata razvoj inovacij v javnih zdravstvenih zavodih: »Prvi izziv je pomanjkanje strokovnih znanj na področju upravljanja in vodenja, kar zavira učinkovito implementacijo inovativnih pristopov. Drugi izziv pa je pomanjkanje finančnih virov za uvajanje novih tehnologij, opreme in izboljšanje procesov, kar omejuje sposobnost zdravstvenih zavodov za sledenje sodobnim trendom. Združenje predlaga povečanje finančnih virov za inovacije in poenotenje pogojev za uvajanje novih zdravstvenih storitev, da bi zagotovili visoko kakovostno zdravstveno oskrbo v Sloveniji.« Prav inovacije so bile osrednja tematika okrogle mize. Janez Poklukar je poudaril, da je pri uvajanju inovacij ključno dobro pripravljena strategija: »Izdelan mora biti strateški koncept, kot imamo v Sloveniji na primer ta trenutek strategijo digitalizacije. Potem morajo temu projektu slediti vsi izvedbeni projekti in zaposleni morajo biti v prvi vrsti dobro seznanjeni s tem, kakšni so cilji. Cilji tistih, ki pišejo strategijo in kakšen je namen teh sprememb. Ko zaposleni verjamejo v to strategijo in ko grejo za vodstvom, najsi gre za vodstvo bolnišnice ali vodstvo ministrstva, pri implementaciji načeloma ni problema. Seveda pa ne smemo izpustiti oziroma pozabiti na uporabnika. Našega bolnika je moramo prav tako usposobiti oziroma izobraziti, da bo vedel, zakaj delamo te spremembe. In če seštejemo vse to, verjamem, da lahko na tak način uspešno izpeljemo spremembe.« Urh Grošelj je dodal, da »se v zdravstvenem sistemu velikokrat pričakuje predvsem, da opraviš serijo nekih rutinskih storitev, skoraj nihče pa od zdravstva ne pričakuje inovacij. V okoljih, ki niso tako naklonjena inovacijam, se inovatorje celo gleda malce postrani. Menim, da smo dolžni priznati, da tista vodstva zdravstvenih zavodov, ki so neposredno naklonjena inovacijam, opravljajo zelo pomembno delo. Če so pogoji ustrezni, mislim da prinesejo tudi inovacije in obratno.« Iztok Štotl je poudaril, da je merilo uspešnosti digitalizacije v zdravstvu, tako za bolnike kot medicinsko stroko, predvsem učinkovitost v praksi. Ključna strateška pomanjkljivost slovenskega zdravstvenega podatkovnega prostora je, da na nacionalni ravni nismo ustvarili kapacitet za usklajevanje vsakodnevne rabe kliničnih podatkov. Tanja Španić pa je predstavila vidik bolnikov: »Inovacije imamo, voljo imamo, zdaj pa mislim, da jih moramo samo čim prej začeti uporabljati. Mogoče nas bo v to prisilila malo tudi zakonodaja, saj je nova regulativa pred vrati, sploh v onkologiji. Mogoče je to lahko izhodišče, kjer bodo tudi zdravstveni sistemi opazili prednost inovacij. Predvsem to, da nam bodo olajšale procese, ne otežile in da bo bolnik bolj v ospredju. Včasih pa so nekatere inovacije tudi posledice predlogov s strani pacientov, tako da se tukaj spet vračam k pozivu, da sodelujemo in pogledamo, kje lahko čim večkrat doprinesemo tudi mi svoj pogled.«
Dorjan Marušič je konferenco zaključil z mislijo, da je Slovenija med državami, ki uvajajo inovacije, prodorna. »Težava je predvsem vgraditev inovacij v celoten zdravstveni sistem. Zato so danes naši sogovorniki na okrogli mizi izpostavljali dosežke in predlagali tudi določene spremembe – od reorganizacije samih institucij, reorganizacije regulatorja, pa do tega, da bi moralo biti okolje bolj naklonjeno inovacijam, da bi jih tudi pacienti z odprtimi rokami sprejeli, z željo da bo njihovo zdravje čim boljše in bo trajalo čim dlje.«
Konferenco si lahko ogledate na spodnji povezavi:
https://www.youtube.com/watch?v=BzntNq1vbb4
ali pa obiščete spletno stran konference na
https://www.vrednostinovacij.
“,”Jaka Verbic Miklic”,1716441300,1716441300,sl,15474,306,15473,43,0,NULL,,”Slovenija je na področju inovacij prodorna, njihova implementacija v celotnem zdravstvenem sistemu pa je pomanjkljiva “,slovenija-je-na-podrocju-inovacij-prodorna-njihova-implementacija-v-celotnem-zdravstvenem-sistemu-pa-je-pomanjkljiva,Post,”/sites/43/files/images/news/13. strateška konferenca/13 Strateska Konferenca.png”,1,0,1716441410,1716479056
1057,15474,”Slovenia is strong on innovation, but implementation across the health system is lacking”,”We are standing at a critical point where the challenges of European healthcare threaten the socio-economic stability of our societies”,”
Ljubljana, 21 May, 2024 – We are standing at a critical point where the challenges of European healthcare threaten the socio-economic stability of our societies. This is not just a health crisis, but a societal crisis that requires systemic and strategic responses to prevent negative consequences for patients as well as wider socio-economic systems. This and much more was discussed at this year’s 13th “Value of Innovation Conference” that was organized under the title “Unlocking Potentials in Healthcare to Foster Innovation”. This year, the Forum of International Research and Development Pharmaceutical Companies organized the conference in collaboration with the Association of Economists in Healthcare.
Bogi Eliasen, Medical Director at the Copenhagen Institute for Future Studies, opened the conference by saying that a review of the health system in Slovenia shows that, as elsewhere in Europe, it is faced with challenges in implementing change: “However, the system is quite mature in recognizing the need to move towards prevention and primary healthcare and could, if this were to become a priority, become a leader in this field, as this is a change that every country needs to make. Here Slovenia is facing the advantages and challenges of a small country. Its advantage is its ability to bring together relevant stakeholders quickly, but the challenge is that some changes require a certain scale. Ties to the European and global network are very important.” He added that Slovenia is a leader in the healthcare field in its micro-geographic region, both among the Adriatic countries and among Central Eastern European countries. This can be both a responsibility and an opportunity for advancement.
Marc Schreiner, LL.M., Director of the Berlin Hospital Association, stressed the crucial need for continuous innovation in healthcare because stagnation means decline. In Germany, he said, the Federal Joint Committee for the Financing of Innovative Health Projects has allocated €200 million since 2016 to projects that improve medical prognosis and patient management in overcrowded emergency centres. Schreiner also highlighted a significant investment of €4.3 billion from 2020 to 2025 for the digitization of hospitals, with emphasis on the integration of advanced digital technologies for better healthcare. He stressed the urgency of hospital reform to resolve financial difficulties, staff shortages, and the massive bureaucratic burden on health professionals.
“In the Association of Economists in Healthcare, which is the central association of experts in the field of health economics, operation, organisation of health institutions and plays an important role in topics such as health economics, we want this field to become visible in the future,” said Bogdan Tušar. “That is why we are investing a lot of energy in highlighting and offering solutions for the health system, for healthcare, for healthcare institutions. As we also noted at today’s conference, we have been circling the same problems for at least 15 years. So, the problems remain, but the solutions are there. That is why the Association wants to be involved in the processes of change so that what we see as important can one day see the light of day or be realized.”
Karmen Janša, M.D., from the Health Insurance Institute of Slovenia, presented a study published in January this year on direct health expenditure on diabetes in Slovenia. “Together with my colleagues Petra Došenović Bonča, Jože Sambt, and Dalibor Gavrić, we analysed data from the Health Insurance Institute for the period from 2019 to 2022. The average annual expenditure on diabetes amounted to EUR 174 million, or EUR 1,108 per patient, with an average annual growth rate of 12.5 percent. Over half of the expenditure was due to complications of diabetes, mainly cardiac complications, dialysis due to kidney failure, and diabetic foot care.”
This and more was discussed at the round table by Prof. Dr. Urh Grošelj, M.D., from the Ljubljana Paediatric Clinic, Iztok Štotl from Ljubljana’s University Medical Centre, Tanja Španić from Europa Donna Slovenia, Tatjana Jevševar, director of the Association of Health Care Institutions of Slovenia, and Janez Poklukar, physician at Jesenice General Hospital and former Director of Ljubljana University Medical Centre, and former Minister of Health. The panel was moderated by Dorjan Marušič, International Consultant. Tatjana Jevševar highlighted two key challenges that hinder the development of innovation in public healthcare institutions: “The first challenge is the lack of expertise in the fields of management and leadership which hinders the effective implementation of innovative approaches. The second challenge is the lack of financial resources to introduce new technologies, equipment, and process improvements, which limits the ability of healthcare institutions to keep up with modern trends. The Association proposes an increase in financial resources for innovation and a harmonization of conditions for the introduction of new health services to ensure high-quality health care in Slovenia.” Innovation was the main theme of the round table. Janez Poklukar stressed that a well-developed strategy is essential in introducing innovation: “A strategic concept has to be developed, like the digitization strategy we have in Slovenia at the moment. The project then has to be followed by all the implementation projects and the employees have to first and foremost be well informed about the objectives of those who write the strategy and the purpose of the changes. When employees trust the strategy and follow the leadership, be it the leadership of the hospital, the ministry, there is no problem in implementation. Of course, we must not leave out or forget the user. Our patients also need to be educated or trained so that they know why we are implementing the changes. And if we add it all up, I believe we can successfully implement changes.” Urh Grošelj added that “in the healthcare system, you are often expected to provide a series of routine services, but almost no one expects healthcare to innovate. In environments that do not have a strong innovation culture, innovators are even looked down upon. I think we should recognize that those health service managers who openly support innovation are doing a very important job. If the conditions are right, I think they do bring innovation and vice versa.” Iztok Štotl stressed that the true measure of success of digitization in healthcare, for both patients and the medical profession, is primarily its effectiveness in practice. The key strategic shortcoming of the Slovenian health data space is that we have not created the capacity at the national level to coordinate the daily use of clinical data.
Tanja Španić presented the patient perspective: “We have the innovations, we have the will, and now I think we just need to start using them as soon as possible. Perhaps the legislation will force us into it somewhat with the new regulation on the way, especially in oncology. Perhaps this can be a starting point where health systems begin to notice the benefit of innovation. Especially the fact that it will make processes easier, not harder and that it will put the patient at the forefront. Sometimes certain innovations can arise out of suggestions from patients, so I wish to reiterate my call to work together and see where we can contribute our own perspective as often as possible.”
Dorjan Marušič concluded the conference by noting that Slovenia is a pioneer among countries that introduce innovation. “The main issue is the integration of innovation into the entire healthcare system. That is why today our panelists highlighted achievements and proposed certain changes – from reorganizing the institutions themselves to reorganizing the regulator and making the environment more favorable to innovation so that patients also embrace it with open arms with the wish for their health to be as good as it can be and last as long as it can.”
You can view the conference at this link:
https://www.youtube.com/watch?
or visit the website of the conference
https://www.vrednostinovacij.si/en
“,”Jaka Verbic Miklic”,1716441300,1716441300,en,15474,306,15473,43,0,NULL,,”Slovenija je na področju inovacij prodorna, njihova implementacija v celotnem zdravstvenem sistemu pa je pomanjkljiva “,slovenija-je-na-podrocju-inovacij-prodorna-njihova-implementacija-v-celotnem-zdravstvenem-sistemu-pa-je-pomanjkljiva,Post,”/sites/43/files/images/news/13. strateška konferenca/13 Strateska Konferenca.png”,1,0,1716441410,1716479056
1058,15476,”Slovenija je na področju inovacij prodorna, njihova implementacija v celotnem zdravstvenem sistemu pa je pomanjkljiva “,”Nahajamo se na kritični točki, kjer izzivi evropskega zdravstva ogrožajo socio-ekonomsko stabilnost naše družbe”,”
Ljubljana, 21. maj 2024 – Nahajamo se na kritični točki, kjer izzivi evropskega zdravstva ogrožajo socio-ekonomsko stabilnost naše družbe. To ni le zdravstvena kriza, ampak družbena nujnost, ki zahteva sistemske in strateške odzive za preprečevanje negativnih posledic tako za paciente kot za širše socio-ekonomske sisteme. O tem in še marsičem smo govorili na letošnji 13. konferenci Vrednost inovacij, ki je potekala pod naslovom »Prepoznavanje potencialov v zdravstvenem sistemu za spodbujanje inovacij«. Letos je Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb konferenco organiziral v sodelovanju z Društvom ekonomistov v zdravstvu.
Bogi Eliasen, zdravstveni direktor na Copenhagen Institute for Future Studies je ob začetku konference povedal, da je ob pregledu zdravstvenega sistema v Sloveniji razvidno, da se, tako kot drugje v Evropi, sooča z izzivi uvajanja sprememb: »Vendar je sistem dokaj zrel pri prepoznavanju potreb po premiku proti preventivi in primarnemu zdravstvenemu varstvu in bi lahko, če bi to postala prioriteta, postal vodilni na tem področju, saj je to sprememba, ki jo potrebuje vsaka država. Slovenija se tu sooča s prednostmi in izzivi majhne države. Prednost je sposobnost hitrega povezovanja relevantnih deležnikov. Izziv pa je, da nekatere spremembe zahtevajo zadosten obseg. Pri tem je pomembno biti povezan z evropsko in globalno mrežo.« Ob tem je še dodal, da je Slovenija na področju zdravstva vodilna v svoji mikro geografski regiji, tako v krogu držav adriatika, kot v krogu srednjevzhodno evropskih držav. To je lahko tako odgovornost kot tudi priložnost za napredek.
Marc Schreiner, LL.M., direktor berlinskega združenja bolnišnic, je ob tem poudaril ključno potrebo po nenehnih inovacijah v zdravstvenem varstvu, saj po njegovem stagnacija pomeni nazadovanje. Kot je povedal, je v Nemčiji Zvezni skupni odbor za financiranje inovativnih zdravstvenih projektov, od leta 2016 dodelil 200 milijonov evrov projektom, ki izboljšujejo medicinske napovedi in upravljanje pacientov v prenatrpanih reševalnih centrih. Schreiner je tudi izpostavil pomembno naložbo v višini 4,3 milijarde evrov od leta 2020 do 2025 za digitalizacijo bolnišnic, s poudarkom na integraciji naprednih digitalnih tehnologij, za boljšo zdravstveno oskrbo. Poudaril je nujnost reforme bolnišnic za reševanje finančnih težav, pomanjkanja osebja in velikega birokratskega bremena za zdravstvene delavce.
»V Društvu ekonomistov v zdravstvu, ki je osrednje združenje strokovnjakov na področju zdravstvene ekonomike, poslovanja, organizacije zdravstvenih zavodov in ima pomembno vlogo pri vsebinah, kot je zdravstvena ekonomika, si želimo, da to področje postane prepoznavno tudi v prihodnosti,« je povedal Bogdan Tušar. »Zato veliko energije vlagamo v to, da opozarjamo in ponujamo rešitve za zdravstveni sistem, za zdravstvo, za zdravstvene zavode. Kot smo ugotavljali tudi na današnji konferenci, se že vsaj 15 let vrtimo okrog enih in istih problemov. Torej težave ostajajo, rešitve pa tukaj so. Društvo si zato želi, da bi bilo vključeno v procese sprememb in da bi lahko to, kar prepoznavamo kot pomembno, tudi nekoč ugledalo luč sveta oziroma se realiziralo.«
Karmen Janša, dr. med., iz Zavoda za zdravstveno zavarovanje Slovenije je v svojem predavanju predstavila študijo, ki je bila objavljena januarja letos, in sicer na temo neposrednih zdravstvenih izdatkov za sladkorno bolezen v Sloveniji. »Skupaj s sodelavci Petro Došenović Bonča, Jožetom Sambtom in Daliborjem Gavrićem, smo analizirali podatke ZZZS za obdobje od leta 2019 do 2022. Povprečni letni izdatki za sladkorno bolezen so znašali 174 milijonov evrov, oziroma 1.108 evrov na bolnika, s povprečno letno rastjo 12,5 odstotka. Več kot polovico izdatkov so povzročili zapleti sladkorne bolezni, predvsem srčni zapleti, dializa zaradi odpovedi ledvic in oskrba diabetičnega stopala.«
O tem in vsem ostalem so na okrogli mizi razpravljali prof. dr. Urh Grošelj, dr. med. iz Pediatrične klinike Ljubljana, Iztok Štotl iz UKC Ljubljana, Tanja Španić, predsednica Europa Donna Slovenije, Tatjana Jevševar, mag. ekon. in posl. ved., direktorica Združenja zdravstvenih zavodov Slovenije ter Janez Poklukar, zdravnik in nekdanji direktor UKC Ljubljana, Splošne bolnišnice Jesenice in nekdanji minister za zdravje. Okroglo mizo je povezoval Dorjan Marušič, mednarodni svetovalec. Tatjana Jevševar je na okrogli mizi izpostavila dva ključna izziva, ki ovirata razvoj inovacij v javnih zdravstvenih zavodih: »Prvi izziv je pomanjkanje strokovnih znanj na področju upravljanja in vodenja, kar zavira učinkovito implementacijo inovativnih pristopov. Drugi izziv pa je pomanjkanje finančnih virov za uvajanje novih tehnologij, opreme in izboljšanje procesov, kar omejuje sposobnost zdravstvenih zavodov za sledenje sodobnim trendom. Združenje predlaga povečanje finančnih virov za inovacije in poenotenje pogojev za uvajanje novih zdravstvenih storitev, da bi zagotovili visoko kakovostno zdravstveno oskrbo v Sloveniji.« Prav inovacije so bile osrednja tematika okrogle mize. Janez Poklukar je poudaril, da je pri uvajanju inovacij ključno dobro pripravljena strategija: »Izdelan mora biti strateški koncept, kot imamo v Sloveniji na primer ta trenutek strategijo digitalizacije. Potem morajo temu projektu slediti vsi izvedbeni projekti in zaposleni morajo biti v prvi vrsti dobro seznanjeni s tem, kakšni so cilji. Cilji tistih, ki pišejo strategijo in kakšen je namen teh sprememb. Ko zaposleni verjamejo v to strategijo in ko grejo za vodstvom, najsi gre za vodstvo bolnišnice ali vodstvo ministrstva, pri implementaciji načeloma ni problema. Seveda pa ne smemo izpustiti oziroma pozabiti na uporabnika. Našega bolnika je moramo prav tako usposobiti oziroma izobraziti, da bo vedel, zakaj delamo te spremembe. In če seštejemo vse to, verjamem, da lahko na tak način uspešno izpeljemo spremembe.« Urh Grošelj je dodal, da »se v zdravstvenem sistemu velikokrat pričakuje predvsem, da opraviš serijo nekih rutinskih storitev, skoraj nihče pa od zdravstva ne pričakuje inovacij. V okoljih, ki niso tako naklonjena inovacijam, se inovatorje celo gleda malce postrani. Menim, da smo dolžni priznati, da tista vodstva zdravstvenih zavodov, ki so neposredno naklonjena inovacijam, opravljajo zelo pomembno delo. Če so pogoji ustrezni, mislim da prinesejo tudi inovacije in obratno.« Iztok Štotl je poudaril, da je merilo uspešnosti digitalizacije v zdravstvu, tako za bolnike kot medicinsko stroko, predvsem učinkovitost v praksi. Ključna strateška pomanjkljivost slovenskega zdravstvenega podatkovnega prostora je, da na nacionalni ravni nismo ustvarili kapacitet za usklajevanje vsakodnevne rabe kliničnih podatkov. Tanja Španić pa je predstavila vidik bolnikov: »Inovacije imamo, voljo imamo, zdaj pa mislim, da jih moramo samo čim prej začeti uporabljati. Mogoče nas bo v to prisilila malo tudi zakonodaja, saj je nova regulativa pred vrati, sploh v onkologiji. Mogoče je to lahko izhodišče, kjer bodo tudi zdravstveni sistemi opazili prednost inovacij. Predvsem to, da nam bodo olajšale procese, ne otežile in da bo bolnik bolj v ospredju. Včasih pa so nekatere inovacije tudi posledice predlogov s strani pacientov, tako da se tukaj spet vračam k pozivu, da sodelujemo in pogledamo, kje lahko čim večkrat doprinesemo tudi mi svoj pogled.«
Dorjan Marušič je konferenco zaključil z mislijo, da je Slovenija med državami, ki uvajajo inovacije, prodorna. »Težava je predvsem vgraditev inovacij v celoten zdravstveni sistem. Zato so danes naši sogovorniki na okrogli mizi izpostavljali dosežke in predlagali tudi določene spremembe – od reorganizacije samih institucij, reorganizacije regulatorja, pa do tega, da bi moralo biti okolje bolj naklonjeno inovacijam, da bi jih tudi pacienti z odprtimi rokami sprejeli, z željo da bo njihovo zdravje čim boljše in bo trajalo čim dlje.«
Konferenco si lahko ogledate na spodnji povezavi:
https://www.youtube.com/watch?v=BzntNq1vbb4
ali pa obiščete spletno stran konference na
https://www.vrednostinovacij.
“,”Jaka Verbic Miklic”,1716479820,1716479820,sl,15476,306,15475,43,0,NULL,,”Slovenija je na področju inovacij prodorna”,slovenija-je-na-podrocju-inovacij-prodorna,Post,”/sites/43/files/images/news/13. strateška konferenca/13 Strateska Konferenca.png”,1,0,1716479954,1716479954
1059,15476,”Slovenia is strong on innovation, but implementation across the health system is lacking”,”We are standing at a critical point where the challenges of European healthcare threaten the socio-economic stability of our societies”,”
Ljubljana, 21 May, 2024 – We are standing at a critical point where the challenges of European healthcare threaten the socio-economic stability of our societies. This is not just a health crisis, but a societal crisis that requires systemic and strategic responses to prevent negative consequences for patients as well as wider socio-economic systems. This and much more was discussed at this year’s 13th “Value of Innovation Conference” that was organized under the title “Unlocking Potentials in Healthcare to Foster Innovation”. This year, the Forum of International Research and Development Pharmaceutical Companies organized the conference in collaboration with the Association of Economists in Healthcare.
Bogi Eliasen, Medical Director at the Copenhagen Institute for Future Studies, opened the conference by saying that a review of the health system in Slovenia shows that, as elsewhere in Europe, it is faced with challenges in implementing change: “However, the system is quite mature in recognizing the need to move towards prevention and primary healthcare and could, if this were to become a priority, become a leader in this field, as this is a change that every country needs to make. Here Slovenia is facing the advantages and challenges of a small country. Its advantage is its ability to bring together relevant stakeholders quickly, but the challenge is that some changes require a certain scale. Ties to the European and global network are very important.” He added that Slovenia is a leader in the healthcare field in its micro-geographic region, both among the Adriatic countries and among Central Eastern European countries. This can be both a responsibility and an opportunity for advancement.
Marc Schreiner, LL.M., Director of the Berlin Hospital Association, stressed the crucial need for continuous innovation in healthcare because stagnation means decline. In Germany, he said, the Federal Joint Committee for the Financing of Innovative Health Projects has allocated €200 million since 2016 to projects that improve medical prognosis and patient management in overcrowded emergency centres. Schreiner also highlighted a significant investment of €4.3 billion from 2020 to 2025 for the digitization of hospitals, with emphasis on the integration of advanced digital technologies for better healthcare. He stressed the urgency of hospital reform to resolve financial difficulties, staff shortages, and the massive bureaucratic burden on health professionals.
“In the Association of Economists in Healthcare, which is the central association of experts in the field of health economics, operation, organisation of health institutions and plays an important role in topics such as health economics, we want this field to become visible in the future,” said Bogdan Tušar. “That is why we are investing a lot of energy in highlighting and offering solutions for the health system, for healthcare, for healthcare institutions. As we also noted at today’s conference, we have been circling the same problems for at least 15 years. So, the problems remain, but the solutions are there. That is why the Association wants to be involved in the processes of change so that what we see as important can one day see the light of day or be realized.”
Karmen Janša, M.D., from the Health Insurance Institute of Slovenia, presented a study published in January this year on direct health expenditure on diabetes in Slovenia. “Together with my colleagues Petra Došenović Bonča, Jože Sambt, and Dalibor Gavrić, we analysed data from the Health Insurance Institute for the period from 2019 to 2022. The average annual expenditure on diabetes amounted to EUR 174 million, or EUR 1,108 per patient, with an average annual growth rate of 12.5 percent. Over half of the expenditure was due to complications of diabetes, mainly cardiac complications, dialysis due to kidney failure, and diabetic foot care.”
This and more was discussed at the round table by Prof. Dr. Urh Grošelj, M.D., from the Ljubljana Paediatric Clinic, Iztok Štotl from Ljubljana’s University Medical Centre, Tanja Španić from Europa Donna Slovenia, Tatjana Jevševar, director of the Association of Health Care Institutions of Slovenia, and Janez Poklukar, physician at Jesenice General Hospital and former Director of Ljubljana University Medical Centre, and former Minister of Health. The panel was moderated by Dorjan Marušič, International Consultant. Tatjana Jevševar highlighted two key challenges that hinder the development of innovation in public healthcare institutions: “The first challenge is the lack of expertise in the fields of management and leadership which hinders the effective implementation of innovative approaches. The second challenge is the lack of financial resources to introduce new technologies, equipment, and process improvements, which limits the ability of healthcare institutions to keep up with modern trends. The Association proposes an increase in financial resources for innovation and a harmonization of conditions for the introduction of new health services to ensure high-quality health care in Slovenia.” Innovation was the main theme of the round table. Janez Poklukar stressed that a well-developed strategy is essential in introducing innovation: “A strategic concept has to be developed, like the digitization strategy we have in Slovenia at the moment. The project then has to be followed by all the implementation projects and the employees have to first and foremost be well informed about the objectives of those who write the strategy and the purpose of the changes. When employees trust the strategy and follow the leadership, be it the leadership of the hospital, the ministry, there is no problem in implementation. Of course, we must not leave out or forget the user. Our patients also need to be educated or trained so that they know why we are implementing the changes. And if we add it all up, I believe we can successfully implement changes.” Urh Grošelj added that “in the healthcare system, you are often expected to provide a series of routine services, but almost no one expects healthcare to innovate. In environments that do not have a strong innovation culture, innovators are even looked down upon. I think we should recognize that those health service managers who openly support innovation are doing a very important job. If the conditions are right, I think they do bring innovation and vice versa.” Iztok Štotl stressed that the true measure of success of digitization in healthcare, for both patients and the medical profession, is primarily its effectiveness in practice. The key strategic shortcoming of the Slovenian health data space is that we have not created the capacity at the national level to coordinate the daily use of clinical data.
Tanja Španić presented the patient perspective: “We have the innovations, we have the will, and now I think we just need to start using them as soon as possible. Perhaps the legislation will force us into it somewhat with the new regulation on the way, especially in oncology. Perhaps this can be a starting point where health systems begin to notice the benefit of innovation. Especially the fact that it will make processes easier, not harder and that it will put the patient at the forefront. Sometimes certain innovations can arise out of suggestions from patients, so I wish to reiterate my call to work together and see where we can contribute our own perspective as often as possible.”
Dorjan Marušič concluded the conference by noting that Slovenia is a pioneer among countries that introduce innovation. “The main issue is the integration of innovation into the entire healthcare system. That is why today our panelists highlighted achievements and proposed certain changes – from reorganizing the institutions themselves to reorganizing the regulator and making the environment more favorable to innovation so that patients also embrace it with open arms with the wish for their health to be as good as it can be and last as long as it can.”
You can view the conference at this link:
https://www.youtube.com/watch?
or visit the website of the conference
https://www.vrednostinovacij.si/en
“,”Jaka Verbic Miklic”,1716479820,1716479820,en,15476,306,15475,43,0,NULL,,”Slovenija je na področju inovacij prodorna”,slovenija-je-na-podrocju-inovacij-prodorna,Post,”/sites/43/files/images/news/13. strateška konferenca/13 Strateska Konferenca.png”,1,0,1716479954,1716479954
1060,15478,”Javna objava prenosov vrednosti ZD, ZO in DB 2023″,”Objava zajema podatke o prenosih vrednosti v preteklem koledarskem letu 2023″,”
JAVNA OBJAVA PRENOSOV VREDNOSTI ZDRAVSTVENIM DELAVCEM, ZDRAVSTVENIM ORGANIZACIJAM IN DRUŠTVOM BOLNIKOV S STRANI FARMACEVTSKIH DRUŽB
Skladno s Kodeksom ravnanja bodo članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ (v nadaljevanju FarmaForum) tudi v letošnjem letu javno objavile prenose vrednosti zdravstvenim delavcem, zdravstvenim organizacijam in društvom bolnikov.
Kot določa enotni Kodeks, bodo podatke objavile do vključno 30. junija 2024.
Objava zajema podatke o prenosih vrednosti v preteklem koledarskem letu in na spletnih straneh posameznih članic ponuja vpogled v prenose v obdobju od 1. januarja do 31. decembra 2023. Po določilih zveze EFPIA (evropska zveza farmacevtskih industrij in združenj) se podatki javno objavljajo periodično, vsako leto, najkasneje do konca meseca junija, in sicer za preteklo koledarsko leto.
Javna objava prenosov vrednosti vključuje podatke o vrednostih vseh sredstev, ki so jih prejeli posamezni zdravstveni delavci, zdravstvene organizacije in društva bolnikov s katerimi sodelujejo posamezne članice FarmaForuma ali FarmaForum – bodisi neposredno ali prek tretjih oseb, kot so agencije za organizacijo dogodkov. Javna objava vsebuje tudi informacije o vrsti dejavnosti ali tipu podpore:
za izobraževanje,
za kritje stroškov, povezanih z izobraževalnimi oziroma strokovnimi dogodki,
za storitve in svetovanje,
za raziskave in razvoj ter
donacije.
Te prenose vsaka članica FarmaForuma objavi v slovenskem jeziku na svoji lokalni, regijski ali mednarodni spletni strani.
Vsi prenosi zdravstvenim organizacijam, kamor se po Kodeksu ravnanja uvrščajo javne zdravstvene institucije, zdravniška društva, združenja, zbornice in zasebna podjetja (d.o.o. in s.p.), so skladno z zakonodajo objavljeni individualno s polnim nazivom prejemnika.
Pri prenosih vrednosti posameznim zdravstvenim delavcem, fizičnim osebam, je objava v skladu z Zakonom o varstvu osebnih podatkov mogoča samo na podlagi predhodnega pisnega soglasja zdravstvenega delavca. V nasprotnem primeru se prenos objavi v skupinski obliki, pri čemer je v vsaki kategoriji navedeno število prejemnikov ter skupni znesek dodeljen tovrstnim prejemnikom.
Podatki o plačilih na področju raziskav in razvoja zaradi varstva konkurence ter inovacij, ki jih razvijajo posamezne družbe, skladno z zakonodajo, ne morejo biti objavljeni drugače kot v skupinski obliki.
Podatki, objavljeni v tem poročilu, so izraz prizadevanj FarmaForuma za ravnanje skladno z zahtevami Kodeksa ravnanja in zveze EFPIA. Če se kljub našim prizadevanjem za zagotovitev natančnih objav zgodi, da poročilo vsebuje nepopolne ali netočne podatke, bomo to raziskali in morebitne napačne podatke ustrezno popravili.
PODATKI O PRENOSU VREDNOSTI ZDRAVSTVENIM DELAVCEM, ZDRAVSTVENIM ORGANIZACIJAM IN DRUŠTVOM BOLNIKOV S STRANI MEDNARODNEGA FORUMA ZNANSTVENORAZISKOVALNIH FARMACEVTSKIH DRUŽB, GIZ, ZA LETO 2023
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ, je v koledarskem letu 2023 sodeloval z različnimi organizacijami: sponzorsko je podprl aktivnosti Slovenskega zdravniškega društva in Univerzitetnega kliničnega centra Ljubljana, enajstim organizacijam je poravnal stroške povezane z izvajanjem storitev in svetovanjem. Izplačana je bila ena donacija.
Skupna vrednost prenosov FarmaForuma zdravstvenim delavcem in zdravstvenim organizacijam je v letu 2023 znašala 97.519,10 EUR. V letu 2023 sta bila izvedena dva prenosa na zdravstvene delavce. Vrednost prenosov društvom bolnikov je znašala 7.500 EUR
Javno objavljeni podatki zajemajo prenose vrednosti, ki so bili v finančnem sistemu FarmaForuma dejansko izvršeni v koledarskem letu 2023, to je od vključno 1. januarja 2023 do vključno 31. decembra 2023.
Prenosi zdravstvenim organizacijam, zdravstvenim delavcem in društvom bolnikov so navedeni kot neto zneski tovrstnih pogodb, ki ne vključujejo DDV.
V letu 2023 sta bila izvedena dva prenos vrednosti na zdravstvene delavce v skupni vrednosti 3.800,00 EUR.
Vsi navedeni zneski predstavljajo skupne vrednosti za leto 2023.
Vse navedene transakcije so bile izvršene v koledarskem letu 2023, torej od vključno 1. januarja 2023 do vključno 31. decembra 2023.
Skladno s Kodeksom ravnanja je zdravstvena organizacija (ZO) opredeljena kot:
vsak samostojni podjetnik (s. p.) ali
pravna oseba,
Zdravstvene delavce (ZD) Kodeks ravnanja opredeljuje kot:
vsaka fizična oseba, ki je članica zdravstvene, zobozdravstvene, farmacevtske ali negovalne stroke, in vse druge osebe, ki lahko pri opravljanju svojih poklicnih dejavnosti predpišejo, kupijo, dobavijo, priporočajo ali odmerijo zdravilo in katerih primarna praksa, naslov glavne poklicne dejavnosti ali sedež je v Evropi.
Za namen tega Kodeksa, definicija ZD vključuje:
Skladno s Kodeksom ravnanja je društvo bolnikov (DB) opredeljeno kot:
nepridobitna pravna oseba/subjekt (vključno s krovno organizacijo, ki ji pripada), ki jo v glavnem sestavljajo bolniki in/ali negovalci in ki zastopa in/ali podpira potrebe bolnikov in/ali negovalcev ter katere poslovni naslov, kraj ustanovitve ali primarni kraj delovanja je v Evropi.
Kodeks ravnanja je v celoti dostopen na: https://www.farmaforum.si/sl/o-forumu/kodeksi/forumov-kodeks-ravnanja
“,”Jaka Verbic Miklic”,1717345440,1717345440,sl,15478,306,15477,43,0,NULL,,”Javna objava prenosov vrednosti ZD, ZO in DB 2023″,javna-objava-prenosov-vrednosti-zd-zo-in-db-2023,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1717345497,1719161324
1061,15478,”Public disclosure of transfers in 2023″,”Public notice on transfers of value from pharmaceutical companies to healthcare professionals and healthcare organizations”,”
PUBLIC NOTICE ON TRANSFERS OF VALUE FROM PHARMACEUTICAL COMPANIES TO HEALTHCARE PROFESSIONALS, HEALTHCARE ORGANIZATIONS AND PATIENT ORGANIZATIONS
In accordance with the Code of Conduct the members of the International Forum of Scientific Research Pharmaceutical Companies, GIZ (hereinafter FarmaForum) will also publicly announce value transfers to healthcare professionals, healthcare organizations and patient associations this year. As stipulated by the Uniform Code, they will publish the data up to and including June 30, 2024.
The publication provides data on transfers of value for the past calendar year. On the websites of individual members, you can find detailed information covering the period from January 1 to December 31, 2023. In compliance with EFPIA (European Federation of Pharmaceutical Industries and Associations) regulations, this data is published annually by the end of June for the past calendar year.
Public disclosure of transfers of value includes data on the value of all funds received by individual healthcare professionals, healthcare organizations, or patient organizations that collaborate with individual FarmaForum members or the FarmaForum itself, either directly or through third parties such as event organization agencies. Disclosure also includes information on the type of activity or support:
Each FarmaForum member publishes these transfers in Slovenian on its local, regional, or international website.
All transfers to healthcare organizations, which under the Code include public healthcare institutions, physician associations and societies, chambers, and private companies (d.o.o. and s.p.), are published individually, with the full name of the recipient.
Transfers of value to individual healthcare professionals who are natural persons are, under the Personal Data Protection Act, only possible based on advance written consent of the healthcare professional. If such consent is withheld, transfers are published in a group or aggregate form, with the number of recipients and total amount listed separately for each category of such recipients.
Data on payments in the field of research and development cannot be published otherwise than in a group or aggregated form due to legislative protection of competition and innovations being developed by separate companies.
The data in this report reflects FarmaForum’s commitment to adhering to the EFPIA Code. If any inaccuracies or omissions are discovered despite our rigorous efforts to ensure accuracy, we will investigate the issue and promptly correct any errors.
DATA ON TRANSFERS OF VALUE TO HEALTHCARE PROFESSIONALS, HEALTHCARE ORGANISATIONS, AND PATIENT ORGANIZATIONS FROM THE FORUM OF INTERNATIONAL RESEARCH AND DEVELOPMENT PHARMACEUTICAL COMPANIES, EIG, FOR 2022
In the calendar year 2023, the Forum of International Research and Development Pharmaceutical Companies, EIG, cooperated with various organizations: it sponsored the activities of the Slovenian Medical Association and University Clinical Center Ljubljana, eleven organizations received reimbursement related to the provision of services and consulting. Also, one donation was paid.
FarmaForum’s transfers to health organizations in 2023 amounted to EUR 94,719. In 2023, two transfers to healthcare professionals took place for EUR 3,800. The value of transfers to patients’ associations amounted to EUR 7.500.
Publicly published data includes transfers of value executed in the financial system of the FarmaForum in the calendar year 2023, from 1 January 2023 to 31 December 2023 inclusive.
Transfers to healthcare organizations, healthcare professionals and patient associations are reported as net amounts of such contracts, excluding VAT.
In 2023, two transfers of value to healthcare professionals took place.
All these amounts represent the total value for 2023.
All these transactions were carried out in the calendar year 2023, from 1 January 2023 to 31 December 2023.
According to the Code, a health care organization (HCO) is defined as:
According to the Code, Health Care Professionals (HCP) are defined as:
For this Code, the definition of HCPs includes:
According to the Code Patient organizations (PO) are defined as:
Code of practice is available here: Code of Practice
“,”Jaka Verbic Miklic”,1717346040,1717346040,en,15478,306,15477,43,0,NULL,,”Javna objava prenosov vrednosti ZD, ZO in DB 2023″,javna-objava-prenosov-vrednosti-zd-zo-in-db-2023,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1717345497,1719161324
1062,15480,”Smernice 13-e strateške konference Vrednost Inovacij”,”Organizacijske strukture moramo prilagoditi za podporo inovacijam in vzpostavitev visokih standardov kakovosti.”,”
Ministrica za zdravje dr. Valentina Prevolnik Rupel je na 13. strateški konferenci Vrednost inovacij poudarila zavezanost inovacijam in potrebo po prilagoditvi organizacijskih struktur za podporo inovacijam. Izpostavila je, da mora biti cilj vseh deležnikov zagotavljanje večje učinkovitosti in kakovosti zdravstvenega sistema. Zdravstvene organizacije morajo sprejeti inovativne pristope, kot je na vrednosti temelječa zdravstvena obravnava (NaVTeZ), za merjenje in izboljšanje rezultatov, pomembnih za paciente. Na podlagi analize podatkov lahko izboljšamo učinkovitost zdravljenja in povečamo kakovost zdravstvene oskrbe.
Trenutno se v zdravstvenem sistemu soočamo s približno 30 odstotki nepotrebnih izdatkov, kar kaže na neučinkovito rabo virov. To vključuje podvajanje storitev, administrativne napake, prekomerno zdravljenje in druge nepotrebne postopke. Potrebujemo sistematičen pristop k prepoznavanju in odpravi nepotrebnih izdatkov, kar bo zahtevalo izboljšano upravljanje virov, uvedbo boljših praks in uporabo inovativnih tehnologij za optimizacijo procesov.
Preventiva, zgodnje odkrivanje in zgodnja obravnava bolezni so ključni za zmanjšanje bremena bolezni in izboljšanje zdravstvenih rezultatov. Potrebujemo večji poudarek na preventivnih programih, kot so presejalni programi in promocija zdravega načina življenja. Zgodnje odkrivanje bolezni lahko vodi k hitrejšemu in uspešnejšemu zdravljenju, kar prispeva k zmanjšanju izdatkov in boljšim zdravstvenim izidom. V slovenskem zdravstvenem sistemu se soočamo z visoko stopnjo neudeležbe pacientov na specialističnih pregledih – kar 20 odstotkov pacientov izostane na dogovorjenem terminu za pregled. To moramo spremeniti z izboljšanjem sistema naročanja in s spodbujanjem odgovornosti državljanov / pacientov. Ti ukrepi bodo pripomogli k večji učinkovitosti sistema in boljšemu izkoristku virov.
Bogi Eliasen, zdravstveni direktor na Copenhagen Institute for Future Studies, je na 13. strateški konferenci »Vrednost inovacij« predstavil nordijski model zdravstvenega sistema, ki temelji na podatkovno podprtih odločitvah in učinkovitem upravljanju virov. FarmaForum predlaga, da se ta model uvede kot pilotni projekt v Sloveniji, saj verjamemo, da lahko prinese pomembne izboljšave v našem zdravstvenem sistemu. Pilotni projekt bi lahko omogočil prilagoditev modela slovenskemu okolju in potencialno razširitev na celoten zdravstveni sistem.
“,”Jaka Verbic Miklic”,1716320700,1716320700,sl,15480,306,15479,43,0,NULL,,”Smernice 13-e strateške konference Vrednost Inovacij”,smernice-13-e-strateske-konference-vrednost-inovacij,Post,”/sites/43/files/images/news/13. strateška konferenca/13 Strateska Konferenca.png”,1,0,1717962596,1717962634
1063,15480,”Guidelines from the 13th Strategic Conference on the Value of Innovation”,”Organizational structures must be adjusted to support innovation and establish high-quality standards.”,”
At the 13th Strategic Conference “Value of Innovation”, Minister of Health Dr. Valentina Prevolnik Rupel underscored the commitment to innovations and the necessity of adapting organizational structures to foster innovations. She stressed that the overarching aim for all stakeholders must be to enhance the efficiency and quality of the healthcare system. Healthcare organizations should embrace innovative approaches, such as value-based healthcare (VBHC), to measure and improve outcomes that matter to patients. Data analysis can be leveraged to boost treatment efficiency and elevate the quality of healthcare.
Currently, our healthcare system faces approximately 30% unnecessary expenditures, indicating inefficient resource utilization. This encompasses service duplication, administrative errors, over-treatment, and other redundant procedures. A systematic approach is needed to identify and eliminate these unnecessary expenditures, which will involve better resource management, the adoption of best practices, and the deployment of innovative technologies to optimize processes.
Prevention, early detection, and early treatment of diseases are pivotal for reducing the disease burden and enhancing health outcomes. Greater emphasis should be placed on preventive programs, such as screening initiatives and the promotion of healthy lifestyles. Early detection can lead to faster and more effective treatments, resulting in lower costs and improved health outcomes. The Slovenian healthcare system faces a high rate of patient no-shows for specialist appointments—around 20% of patients miss their scheduled appointments. Addressing this issue requires improving the appointment system and encouraging greater patient responsibility. These measures will enhance system efficiency and optimize resource utilization.
Bogi Eliasen, Health Director at the Copenhagen Institute for Future Studies, presented the Nordic healthcare model at the conference. This model relies on data-driven decision-making and efficient resource management. FarmaForum suggests implementing this model as a pilot project in Slovenia, believing it could bring substantial improvements to our healthcare system. The pilot project could facilitate the adaptation of the model to the Slovenian context and potentially expand it across the entire healthcare system.
“,”Jaka Verbic Miklic”,1717962300,1717962300,en,15480,306,15479,43,0,NULL,,”Smernice 13-e strateške konference Vrednost Inovacij”,smernice-13-e-strateske-konference-vrednost-inovacij,Post,”/sites/43/files/images/news/13. strateška konferenca/13 Strateska Konferenca.png”,1,0,1717962596,1717962634
1064,15482,”Cepljenje kot temelj javnega zdravja: Zgodbe in spoznanja”,”Okroglaa miza”,”
Ljubljana, 6. junij 2024 – Na Medicinski fakulteti je v organizaciji STA potekala okrogla miza z naslovom »Cepljenje kot temelj javnega zdravja: Zgodbe in spoznanja«.
Na njej so trije priznani domači strokovnjaki spregovorili o zgodovini in prihodnosti cepljenja, o njegovem uspehu in pomenu za posameznike in družbo kot celoto.
S Sanjo Gornjec so svoje poglede, izkušnje in znanje delili:
Posnetek je na voljo tu: https://video.sta.si/video/
“,”Jaka Verbic Miklic”,1717703520,1717703520,sl,15482,306,15481,43,0,NULL,,”Cepljenje kot temelj javnega zdravja: Zgodbe in spoznanja”,cepljenje-kot-temelj-javnega-zdravja-zgodbe-in-spoznanja,Post,/sites/43/files/images/slideshow/fidprc_005.jpg,1,0,1717962834,1717962935
1065,15484,”Strokovnjaki pred tednom cepljenja poudarili pomen vzdrževanja zdravja tudi s cepljenjem “,”Letos s tednom posebej obeležujejo 50-to obletnico, odkar je Svetovna zdravstvena organizacija (WHO) sprejela razširjeni program cepljenja.”,”
Ljubljana, 19. aprila – Strokovnjaki so pred svetovnim in evropskim tednom cepljenja, ki se začne v sredo, na novinarski konferenci Nacionalnega inštituta za javno zdravje (NIJZ) poudarili pomen vzdrževanja zdravja tudi s cepljenjem. Letos s tednom posebej obeležujejo 50. obletnico, odkar je Svetovna zdravstvena organizacija (WHO) sprejela razširjeni program cepljenja.
Vodja predstavništva WHO v Sloveniji Melita Vujnović je dejala, da so države leta 1974 ugotovile, da je dostop do cepiv za vse otroke na svetu zelo slab. “Bolezni so povzročale smrti majhnih otrok, medtem ko je znanost že odkrila učinkovit način za njihovo preprečevanje,” je spomnila. Zato je WHO sprejela razširjeni program cepljenja, in sicer proti tuberkulozi, davici, tetanusu, oslovskem kašlju, otroški paralizi in ošpicam, je še pojasnila.
Nacionalni programi cepljenja in prizadevanja, da bi bila cepiva na voljo vsem otrokom, so po njenih besedah v zadnjih 50 letih skupno rešili 250 milijonov življenj. “Od takrat je znanost zelo napredovala, danes je na voljo 13 splošno priporočenih cepiv skozi celotno življenjsko obdobje ter 17 dodatnih cepiv, ki so priporočena odvisno od okoliščin,” je naštela. Izpostavila je cepivo proti HPV, ki preprečuje razvoj raka materničnega vratu in cepivo proti pnevmokoknim okužbam.
Predstojnica Centra za nalezljive bolezni NIJZ Marta Grgič Vitek pa je dodala, da ima slovenski nacionalni program cepljenja še daljšo tradicijo kot razširjeni program cepljenja, saj so bila ta cepljenja v Sloveniji predpisana že v 60. letih.
“Zaradi sistematičnega cepljenja skozi več desetletij so se pri nas nalezljive bolezni nekatere čisto nehale pojavljati, recimo otroška paraliza, davica, rdečke, mumps in okužbe s hemofilusom influence. Nekatere pa se pojavljajo zelo redko, recimo tetanus, ki se pojavlja pri starejših necepljenih osebah, in posamični primeri ošpic,” je povedala.
Precepljenost proti ošpicam je ves čas zelo visoka, cepivo pa je zelo učinkovito, je poudarila. Letos so sicer zabeležili devet primerov ošpic, med epidemijo covida-19 pa nobene. Pogosteje pa se pojavlja oslovski kašelj, kar Grgič Vitek pripisuje veliki nalezljivosti bolezni, kratkotrajni imunosti po cepljenju in temu, da je cepivo nekoliko manj učinkovito.
“V Sloveniji bomo letos očitno zabeležili največje število prijav oslovskega kašlja v zadnjih desetletjih, ker smo že do zdaj imeli prijavljenih več kot 900 primerov,” je povedala. Razlog je tudi v ukrepih za omejevanje širjenja covida-19, zaradi katerih je v času epidemije prišlo do izrazitega zmanjšanja okužb dihal, tudi oslovskega kašlja, zato pa se je povečalo število dovzetnih oseb.
Na NIJZ sicer za letošnji program cepljenja predlagajo razširitev cepljenj, ki se krijejo iz obveznega zdravstvenega zavarovanja.
Infektologinja Mateja Logar z infekcijske klinike UKC Ljubljana je poudarila, da je cepljenje ukrep, ki pomembno vpliva na celoten javnozdravstveni sistem in je pomembno znižal umrljivost po celem svetu.
Opozorila je, da se premalo govori o cepljenju pri odraslih. “V Sloveniji še vedno velja, da je cepljenje nekaj, kar se dogaja predvsem pri otrocih, ko pa smo enkrat odrasli, pa cepljenje ni več za nas. To je pravzaprav zmotno,” je poudarila. Druga zmota pa je, da ljudje na vprašanje, zakaj se ne odločijo za cepljenje, odgovorijo, da so zdravi. “Seveda, cepimo se zato, da ostanemo zdravi. Ko enkrat zbolimo, je za cepljenje že prepozno,” je še dejala.
Poudarila je, da naj k cepljenju proti gripi, pnevmokoknim okužbam, klopnemu meningoencefalitisu, RSV in drugim pristopijo tudi odrasli. Za odrasle pa je pomembno tudi, da prejmejo poživitvene odmerke cepiva proti tetanusu in oslovskemu kašlju.
Pediater Denis Baš iz Zdravstvenega doma Kamnik je ponovil, da imamo v Sloveniji dober program cepljenja, na žalost pa se vsi, ki jim je cepivo na voljo, ne cepijo. Poudaril je, da cepivo ščiti le tiste, ki so cepljeni, za določene bolezni pa je pomembna kolektivna zaščita. Pomembno je tudi, da se nosečnice cepijo proti oslovskemu kašlju, saj je novorojenček le tako zaščiten, a se za to odloči zelo malo nosečnic. “Zavedati se moramo, da z odločitvijo, da se ne cepiš, pride tudi odgovornost,” je prepričan.
“,”Jaka Verbic Miklic”,1713538860,1713538860,sl,15484,306,15483,43,0,NULL,,”Strokovnjaki pred tednom cepljenja poudarili pomen vzdrževanja zdravja tudi s cepljenjem “,strokovnjaki-pred-tednom-cepljenja-poudarili-pomen-vzdrzevanja-zdravja-tudi-s-cepljenjem,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1718031762,1718031980
1066,15486,”Pediatri zaskrbljeni zaradi ponovnega pojava ošpic in oslovskega kašlja “,”V Sloveniji so začele spet pojavljati ošpice in v večji meri spet tudi oslovski kašelj”,”
Ljubljana, 24. aprila – Slovenski pediatri in šolski zdravniki so ob začetku svetovnega tedna cepljenja izrazili zaskrbljenost, ker so se zaradi upada deleža cepljenih otrok in mladostnikov tudi v Sloveniji začele spet pojavljati ošpice in v večji meri spet tudi oslovski kašelj. To je po njihovih navedbah znova resno ogrozilo zdravje in življenje necepljenih oseb.
“Prav tako pa nas žalosti, da je v nekaterih delih Slovenije deklicam in dečkom v šestih razredih še v veliki meri odtegnjena možnost brezplačnega cepljenja proti HPV in s tem zaščita pred raki,” so zapisali v poslanici ob začetku svetovnega tedna cepljenja.
Po njihovih navedbah danes več pomembnih dogajanj v družbi predstavlja svetovno grožnjo cepljenju kot najbolj varnemu in najbolj učinkovitemu javnozdravstvenemu ukrepu za zaščito zdravja in življenja otrok in mladostnikov. Na eni strani so to krizne razmere, ki jih povzročajo vojne, naravne katastrofe in klimatske grožnje s posledičnimi tokovi migracij, na drugi strani pa v razvitih državah vznikajo proticepilska gibanja, ki prav tako predstavljajo eno najpomembnejših groženj zdravju človeštva, so opozorili.
Poslanico so spisali, da bi se staršem in mladim zahvalili za zaupanje, ki jo izkazujejo prediatrom in šolskim zdravnikom. “To zaupanje nam predstavlja dodatno obvezo za neprestano poglabljanje našega znanja in veščin na področju zdravljenja in preprečevanja bolezni otrok in mladostnikov. Pri tem se še posebej močno zavedamo pomena cepljenja,” so še zapisali.
Z evropskim in svetovnim tednom cepljenja, ki potekata v teh dneh, obeležujemo tudi 50 let od vzpostavitve razširjenega programa cepljenja, ki je omogočil cepljenje proti šestim otroškim boleznim – tuberkulozi, davici, tetanusu, oslovskemu kašlju, otroški paralizi in ošpicam, so sporočili z Nacionalnega inštituta za javno zdravje. Evropski teden cepljenja se je začel v nedeljo in bo potekal do sobote, svetovni teden cepljenja pa se je začel danes in bo potekal do konca aprila.
“,”Jaka Verbic Miklic”,1713970980,1713970980,sl,15486,306,15485,43,0,NULL,,”Pediatri zaskrbljeni zaradi ponovnega pojava ošpic in oslovskega kašlja “,pediatri-zaskrbljeni-zaradi-ponovnega-pojava-ospic-in-oslovskega-kaslja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1718031950,1718032026
1067,15488,”V Veliki Britaniji preizkušajo prvo personalizirano cepivo proti kožnemu raku “,”Cepivo, ki vzbuja upanje pri zdravljenju raka, je izdelano za vsako osebo po meri v samo nekaj tednih.”,”
London, 26. aprila – V Veliki Britaniji na bolnikih kot prvi na svetu testirajo prvo personalizirano cepivo mRNA za zdravljenje melanoma, ki bi lahko ustavilo tudi raka na pljučih, mehurju in ledvicah. Cepivo je izdelano po meri bolnika in je zasnovano tako, da pomaga njegovemu imunskemu sistemu prepoznati in odstraniti rakaste celice, poročajo danes britanski mediji.
Cepivo, ki vzbuja upanje pri zdravljenju raka, je izdelano za vsako osebo po meri v samo nekaj tednih. Deluje tako, da spodbuja telo, naj poišče in uniči rakave celice ter s tem prepreči ponovitev bolezni.
Cepivo mRNA uporablja isto tehnologijo kot cepiva proti covidu-19. Po besedah nacionalne koordinatorke za testiranje Heather Shaw lahko cepivo ozdravi ljudi s kožnim rakom, preizkušajo pa ga tudi pri drugih oblikah raka.
Kot je dejala, je to “ena najbolj vznemirljivih stvari, kar smo jih videli v res dolgem času”. Novo cepivo je individualizirana neoantigenska terapija (INT), ki je zasnovano tako, da sproži delovanje imunskega sistema za boj proti določeni vrsti raka. Končni cilj je ozdraviti bolnika raka, je dejala Shaw.
Po zaključeni drugi fazi preizkušanja cepiva, ki je pokazala, da cepivo znatno zmanjša tveganje za ponovitev raka pri bolnikih z melanomom, so raziskovalci začeli zadnjo fazo. Po poročanju britanskih medijev jo vodi University College London Hospitals NHS Foundation Trust (UCLH).
Druga faza preskušanja cepiva je pokazala, da je bilo pri ljudeh z melanomi z visokim tveganjem, ki so poleg imunoterapije Keytruda prejeli tudi cepivo, za skoraj polovico (49 odstotkov) manj verjetnosti, da bodo umrli ali se bo rak po treh letih ponovil kot pri tistih, ki so prejeli samo Keytrudo.
Raziskovalci želijo v tretjo fazo preizkušanja cepiva vključiti širši krog bolnikov, pri čemer upajo, da bodo lahko cepivo testirali na približno 1100 ljudeh, poroča britanska tiskovna agencija PA.
“,”Jaka Verbic Miklic”,1714144080,1714144080,sl,15488,306,15487,43,0,NULL,,”V Veliki Britaniji preizkušajo prvo personalizirano cepivo proti kožnemu raku “,v-veliki-britaniji-preizkusajo-prvo-personalizirano-cepivo-proti-koznemu-raku,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1718032148,1718032148
1068,15490,”Letos potrjenih več kot 1000 primerov oslovskega kašlja”,”Po podatkih Evropskega centra za preprečevanje in obvladovanje bolezni je bilo med januarjem in marcem letos v državah EU zabeleženih več kot 32.000 primerov oslovskega kašlja”,”
Ljubljana, 10. maja – Letos so v Sloveniji po podatkih NIJZ potrdili 1164 primerov oslovskega kašlja. Tudi v nekaterih drugih evropskih državah beležijo večje izbruhe te bolezni, po podatkih Evropskega centra za preprečevanje in obvladovanje bolezni je bilo med januarjem in marcem letos v državah EU zabeleženih več kot 32.000 primerov oslovskega kašlja.
Za obvladovanje oslovskega kašlja, predvsem pa zaščito ranljivih skupin, je ključno vzdrževanje visoke precepljenosti otrok in mladostnikov, zelo priporočljivo in brezplačno pa je cepljenje tudi za nosečnice, saj s tem zaščitijo svojega otroka v prvih mesecih življenja.
Oslovski kašelj je bolezen dihal, ki jo povzroča bakterija bordetella pertussis. Osebe, ki zbolijo za oslovskim kašljem, lahko imajo epizode kašlja, ki trajajo od štiri do osem tednov. Bolezen najbolj ogroža dojenčke in majhne otroke.
Medtem ko je bilo v zadnjih 10 letih v Sloveniji le enkrat več kot 200 potrjenih primerov oslovskega kašlja v enem letu, pa je v letošnjem letu potrjenih že 1164 primerov oslovskega kašlja, so sporočili z Nacionalnega inštituta za javno zdravje (NIJZ).
Cepljenje proti oslovskemu kašlju je brezplačno za dojenčke, otroke oz. mladostnike v osnovni in srednji šoli – za njih je tudi obvezno. Poleg tega se v Sloveniji že kar nekaj let priporoča cepljenje nosečnic proti oslovskemu kašlju čim prej po 24. tednu nosečnosti.
V zadnjih dveh letih se je v Sloveniji cepilo okoli 1000 nosečnic proti oslovskemu kašlju. To je razmeroma majhen delež glede na to, da je na leto nosečih med 16.000 do 17.000 žensk v Sloveniji. V letošnjem letu pa se je proti oslovskemu kašlju v Sloveniji cepilo že skoraj 1000 nosečnic, tretjina v cepilnih ambulantah NIJZ, so še zapisali na spletni strani.
“Sama nosečnost kot fiziološko stanje bodoče mame sicer ne predstavlja povečanega tveganja za težek potek oslovskega kašlja. Res je, da nosečnica zboli za enako obliko oslovskega kašlja kot nenoseča ženska podobne starosti, lahko pa intenzivni kašelj pri nosečnosti sproži prezgodnji porod,” je pojasnila epidemiologinja Alenka Trop Skaza z NIJZ.
Oslovski kašelj se prenaša s človeka na človeka s kužnimi kapljicami pri kašljanju, kihanju, tudi posredno prek okuženih predmetov. V začetku bolezni so simptomi podobni navadnemu prehladu – pojavi se izcedek iz nosu in oči, rahlo povišana telesna temperatura, občasno tudi blag kašelj.
Nato se začne kašelj postopoma stopnjevati in pojavijo se značilni napadi kašlja, katerim sledi nenaden globok vdih, ki ga spremlja značilen zvok, podoben riganju. Bolnik lahko pomodri, ker zaradi kašlja ne dobi dovolj kisika. Napadom, ki so najpogostejši ponoči, lahko sledita bruhanje in utrujenost.
Oslovski kašelj je po navedbah NIJZ še vedno lahko vzrok smrti pri dojenčkih, mlajših od 6 mesecev. Najpogostejša od zapletov je bakterijska pljučnica, ki ima tudi najvišjo smrtnost. Od ostalih zapletov so možni še vročinski krči, prenehanje dihanja, izguba apetita, vnetje srednjega ušesa, dehidracija in nevrološke posledice (možganske krvavitve) zaradi zmanjšanega dotoka kisika v možgane.
Bolezen zdravijo z antibiotikom, ki zmanjša intenzivnost bolezni, hkrati pa zmanjša možnost prenosa bakterije na druge. Pri zdravljenju je pomembno tudi zadostno uživanje tekočine za preprečitev dehidracije.
“,”Jaka Verbic Miklic”,1715353860,1715353860,sl,15490,306,15489,43,0,NULL,,”Letos potrjenih več kot 1000 primerov oslovskega kašlja”,letos-potrjenih-vec-kot-1000-primerov-oslovskega-kaslja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1718032360,1718032360
1069,15492,”Začenja se zasedanje Svetovne zdravstvene skupščine “,”Letošnje zasedanje, ki bo trajalo do sobote, bo potekalo pod geslom Vsi za zdravje, zdravje za vse.”,”
Ženeva, 27. maja – V švicarski Ženevi se bo danes začelo 77. zasedanje Svetovne zdravstvene skupščine (WHA), najvišjega organa Svetovne zdravstvene organizacije (WHO). Letošnje zasedanje, ki bo trajalo do sobote, bo potekalo pod geslom Vsi za zdravje, zdravje za vse. Predvideno je bilo glasovanje o novem sporazumu o preprečevanju pandemij, a pogajanj niso končali.
WHA je osrednji organ odločanje v okviru WHO, ki jo tvori 194 držav članic. Delegati iz vseh držav članic se vsako leto sestanejo na zasedanju WHA, na katerem se dogovorijo o prednostnih nalogah in ciljih organizacije na področju javnega zdravja v prihodnjem letu. Srečanje predstavlja tudi priložnost za poročanje o opravljenem delu in za pogovor o strategijah za odpravo pomanjkljivosti.
Načrtovano je bilo, da naj bi skupščina med drugim glasovala o novem sporazumu glede preprečevanja pandemij in spremembah mednarodnega zdravstvenega pravilnika. Kot so minuli teden pojasnili na ministrstvu za zdravje v Ljubljani, dokumenta, ki so ju začeli pripravljati spričo težav po izbruhih preteklih pandemij, vključno s pandemijo covida-19, ne bosta posegla v suverenost držav članic.
Vendar se je med pogajanji zataknilo, saj pogajalci do petka niso uspeli doseči končnega dogovora. Izziv so predstavljali številni predlogi držav članic, do septembra 2022 so namreč podale predloge za več kot tristo dopolnil. Pogajanja so potekala za vsak dokument posebej.
Kljub temu nameravajo pogajalci članicam predstaviti vse ugotovitve in podrobnosti pogajanj. Nato bodo na potezi članice, ki se bodo morale odločiti, kako naprej.
Pred uradnim odprtjem zasedanja bo v prostorih WHO v Ženevi potekal slavnostni dogodek, ki ga bo odprl generalni direktor WHO Tedros Adhanom Ghebreyesus. Na njem bodo države članice organizacije podale izjave o zavezanosti WHO, zmagovalcem filmskega festivala Zdravje za vse, ki poteka pod okriljem WHO, pa bodo podelili nagrade.
“,”Jaka Verbic Miklic”,1716823020,1716823020,sl,15492,306,15491,43,0,NULL,,”Začenja se zasedanje Svetovne zdravstvene skupščine “,zacenja-se-zasedanje-svetovne-zdravstvene-skupscine,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1718032709,1718032709
1070,15494,”WHO in Unicef opozarjata na naraščanje primerov ošpic v Evropi “,”To je tudi 60-krat več kot leta 2022, ko so poročali o 941 primerih ošpic”,”
Koebenhavn/Ženeva/Ljubljana, 28. maja – Število primerov ošpic v Evropi narašča že drugo leto zapored in bi lahko že kmalu preseglo skupno število lani zabeleženih primerov, sta danes opozorila Svetovna zdravstvena organizacija (WHO) in Unicef. Države sta pozvala k hitremu ukrepanju in okrepitvi cepljenja.
V prvih treh mesecih letošnjega leta so v 45. od 53 držav evropske regije WHO, ki vključuje tudi srednjo Azijo, zabeležili že 56.634 primerov ošpic in štiri smrtne primere. To je samo 5000 primerov manj kot lani, ko so v celotnem letu iz 41 držav poročali o 61.070 primerih ošpic in 13 smrtnih primerih. To je tudi 60-krat več kot leta 2022, ko so poročali o 941 primerih ošpic, poroča francoska tiskovna agencija AFP.
WHO in Sklad Združenih narodov za otroke (Unicef) sta v skupnem sporočilu za javnost opozorila, da imajo ošpice uničujoč učinek na zdravje otrok, pri čemer so hudim zapletom najbolj izpostavljeni majhni otroci. Zaradi visoke stopnje hospitalizacije in dolgotrajne oslabitve imunskega sistema so tudi bolj izpostavljeni drugim nalezljivim boleznim.
Izpostavili so, da je bila lani hospitalizirana več kot polovica oseb, ki je zbolela za ošpicami. Skoraj polovica obolelih so bili otroci, mlajši od pet let, saj mnoge med pandemijo covida-19 niso redno cepili proti ošpicam in drugim boleznim, medtem ko se je precepljenost v letih 2021 in 2022 le počasi krepila.
Regionalni direktor WHO za Evropo Hans Kluge je poudaril, da bi že en sam primer ošpic moral pomeniti nujen poziv k ukrepanju, saj ne bi smel nihče trpeti zaradi posledic te uničujoče bolezni, ki jo je mogoče zlahka preprečiti.
Vse države je pozval k takojšnjemu ukrepanju. Tudi tiste, v katerih je splošna precepljenost visoka, je pozval k cepljenju ranljivih skupin, k zapolnitvi vrzeli, da bi preprečili širjenje bolezni v skupnostih.
Regina De Dominicis, direktorica Unicefovega regionalnega urada za Evropo in Srednjo Azijo, je prav tako vlade pozvala k nujnim ukrepom tako za krepitev zdravstvenih sistemov kot k izvajanju učinkovitih ukrepov javnega zdravstva, da bi vsem otrokom zagotovili zaščito, so sporočili iz Slovenske fundacije za Unicef.
Po minuli teden objavljenih podatkih Nacionalnega inštituta za javno zdravje so v Sloveniji letos potrdili enajst primerov ošpic.
Ošpice se prenašajo s kihanjem ali kašljanjem. Bolnik je kužen že okoli štiri dni pred pojavom izpuščaja in še štiri dni zatem. Bolezen se najhitreje prenaša v okoljih, kot so vrtci, šole, pa tudi na množičnih prireditvah.
“,”Jaka Verbic Miklic”,1716909540,1716909540,sl,15494,306,15493,43,0,NULL,,”WHO in Unicef opozarjata na naraščanje primerov ošpic v Evropi “,who-in-unicef-opozarjata-na-narascanje-primerov-ospic-v-evropi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1718032879,1718032879
1071,15496,”Slovenski raziskovalci razvili vnašanje cepiv v telo preko lične sluznice “,”Film se preprosto prilepi na lično sluznico, ki je lahko dostopna in dobro prekrvljena, so zapisali na inštitutu.”,”
Ljubljana, 30. maja – Raziskovalci Kemijskega inštituta so skupaj s sodelavci z ljubljanske fakultete za farmacijo, UKC Ljubljana, Klinike Golnik in sodelavci iz Nemčije razvili in testirali vnašanje cepiv v telo s pomočjo t. i. mukoadhezivnih filmov. Film se preprosto prilepi na lično sluznico, ki je lahko dostopna in dobro prekrvljena, so zapisali na inštitutu.
Lična sluznica ima po njihovem pojasnilu zaradi svoje dostopnosti in obilja imunskih celic, ki so ključne za sprožitev prirojenega in pridobljenega imunskega odziva, velik potencial za cepljenje. Film je sestavljen iz mukoadhezivne plasti iz sestavin, varnih za prehrano, in zaščitne plasti, ki omogoča usmerjeno sproščanje in počasno raztapljanje ter nabrekanje filma.
Zaščitna plast iz neprepustne celuloze omogoča, da se omenjena mukoadhezivna plast počasi raztaplja in nabreka. Cepivo prehaja skozi sluznično površino proti celicam imunskega sistema, kjer sproži imunski odziv. Takšen način ima pomembne prednosti, ki sta denimo večja stabilnost cepiva in učinkovit vnos v tkivo, ki predstavlja prvi kontakt s patogeni. Vnašanje cepiv v telo preko sluznice je mogoče s pomočjo tablet, pršil ali obližev.
Po navedbah raziskovalcev je mogoče na opisani način vnašati v telo tudi sodobna cepiva na osnovi mRNA v lipidnih nanodelcih, ki so se najbolje izkazala v boju proti covidu-19. Cepiva mRNA/LNP so več dni ostala stabilna in ohranila aktivnost. Platforma je prav tako primerna pri drugih vrstah cepiv vključno s plazmidno DNA in vektorskimi cepivi.
Avtorji so v članku v reviji Journal of Controlled Release, pri čemer sta kot prva avtorja navedena doktorska študenta Hana Esih in Klemen Mezgec, dokazali, da takšen način vnašanja cepiva na miših izzove močan lokalni in sistemski imunski odziv. Ključnega pomena je večje izločanje sekretornih protiteles IgA. Ta imajo pomembno vlogo pri nevtralizaciji patogenov na površini dihal, kjer vstopajo v telo.
Cepiva, ki so v telo vnesena na predstavljeni način, bi bila lahko posebej primerna za poživitvene odmerke, saj so manj invazivna in morda lahko prepričajo tiste, ki oklevajo pri odločitvi za cepljenje zaradi nelagodja zaradi uporabe injekcije, izhaja iz članka.
Po pričakovanju avtorjev bi ta način cepljenja lahko omogočil učinkovito zaščito pred boleznimi dihal, kot je covid-19. Pri njih je namreč zaželeno, da se doseže močnejša sluznična imunost. Na tak način bi lahko po njihovi oceni preprečili okužbo že v zgodnjih fazah in zmanjšali možnost za širjenje bolezni. A še preden bi se predstavljeni način lahko uveljavil, bo treba izsledke preveriti na modelih, ki so bolj podobni človeku, predvsem pa v kliničnih raziskavah.
“,”Jaka Verbic Miklic”,1717082520,1717082520,sl,15496,306,15495,43,0,NULL,,”Slovenski raziskovalci razvili vnašanje cepiv v telo preko lične sluznice “,slovenski-raziskovalci-razvili-vnasanje-cepiv-v-telo-preko-licne-sluznice,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1718032992,1718032992
1072,15498,”Zdravniki o cepljenju kot temelju javnega zdravja “,”Poudarili so, da zaradi cepljenja številne bolezni ne krožijo več, danes pa vlada večji strah pred neželenimi učinki kot pred boleznimi, ki jih cepljenje preprečuje.”,”
Ljubljana, 6. junija – Zdravniki Alojz Ihan, Marko Pokorn in David Zupančič so na okrogli mizi STAkluba razpravljali o cepljenju kot temelju javnega zdravja. Poudarili so, da zaradi cepljenja številne bolezni ne krožijo več, danes pa vlada večji strah pred neželenimi učinki kot pred boleznimi, ki jih cepljenje preprečuje.
Kar nekaj bolezni zaradi cepljenja ne kroži več, je poudaril specialist infektologije in pediatrije Marko Pokorn, sicer strokovni direktor ljubljanske pediatrične klinike. Med njimi je izpostavil otroško paralizo, ki je v Sloveniji ni že nekaj desetletij. Tudi zadnji primer davice so zabeležili leta 1967.
Pokorn je kot mladi zdravnik konec prejšnjega tisočletja še doživel primere bolezni, ki jo povzroča hemofilus influence tipa b. Gre za bakterijo, ki predvsem pri otrocih, mlajših od petih let, povzroča hude okužbe. Od leta 2000, ko se je začelo cepljenje proti tej bolezni, primerov okužb s to bakterijo v otroški populaciji praktično ni več, je poudaril.
Strinjal se je s trditvijo, da je cepljenje postalo žrtev lastnega uspeha. Danes v slovenski družbi najbrž vlada večji strah pred neželenimi učinki cepljenja kot pred boleznimi, ki jih s cepljenjem preprečujemo, je ocenil. “Če bi povsem opustili cepljenje, pa bi se marsikatera od teh bolezni seveda zelo hitro vrnila,” je opozoril.
Če se nekdo ne odloči za cepljenje, nato pa zboli, je to šola zanj, če pa se odloči, da ne cepi otroka, ki nato zboli, pa “šolnino za šolo plača otrok”, je ponazoril. Glede na ankete in analize starši po njegovih besedah glede cepljenja sicer še vedno najbolj zaupajo pediatrom.
Številni informacije iščejo tudi na družbenih omrežjih, je povedal specialist infektologije David Zupančič z ljubljanske infekcijske klinike. Problem družbenih omrežij pa je, da nimajo urednikov. Če se na njih ne oglašajo tudi strokovnjaki, prevladujejo mnenja nasprotnikov in dvomljivcev, je opozoril.
Kot problem je izpostavil, da se precej malo govori o prednostnih cepljenja, veliko pa o razlogih, zakaj se ne cepiti. Ljudje zdravnikom več ne zaupajo brezkompromisno, zato morajo ti ljudem jasno razložiti, zakaj je cepljenje pomembno, je poudaril.
Specialist klinične mikrobiologije in imunologije Alojz Ihan, ki vodi laboratorij za celično imunologijo in oddelek za imunologijo na inštitutu za mikrobiologijo in imunologijo, je pojasnil, da je v postopku kliničnih študij trenutno ogromno novih cepiv.
Med njimi so tudi cepiva proti alergijam, avtoimunosti in tumorjem. Veliko je interesa tudi za razvoj cepiv proti nevarnim kroničnim okužbam, denimo virusu Epstein – Barr (EBV). Ta namreč povzroča limfome, kot kaže, pa ima tudi zelo pomembno vlogo pri nastanku multiple skleroze, je pojasnil. Veliko projektov se ukvarja tudi z razvojem cepiva proti citomegalovirusu (CMV).
Povedal je, da je cepljenje odvisno tudi od biološkega odnosa človeka z določenim patogenom. Proti nekaterim patogenom tako po njegovih besedah ne bo mogoče cepiti. Gre zlasti za patogene, ki povzročajo nekatere kronične okužbe, ki se neprestano ponavljajo.
So pa strokovnjaki nekoč tudi za humane papilomaviruse (HPV) menili, da proti njim cepiva ne bo mogoče razviti. “Ko so skupaj stopili fiziologi, imunologi in infektologi, pa se je na nek način pokazalo, da je tako cepivo vseeno možno. Samo s to razliko, da ga je treba dati v tisti zgodnji fazi, ko še ni prve okužbe,” je pojasnil. Ko virus pride globlje v sluznico, do celic, ki se neprestano razmnožujejo, ga namreč cepljenje ne more odstraniti, je dodal.
“,”Jaka Verbic Miklic”,1717687440,1717687440,sl,15498,306,15497,43,0,NULL,,”Zdravniki o cepljenju kot temelju javnega zdravja “,zdravniki-o-cepljenju-kot-temelju-javnega-zdravja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1718033159,1718033160
1073,15500,”WHO svari pred ponarejenimi zdravili za diabetes “,”WHO je opozorilo izdala po tem, ko je od oktobra lani odkrila ponarejena zdravila v Veliki Britaniji, ZDA in Braziliji.”,”
Ženeva, 21. junija – Svetovna zdravstvena organizacija (WHO) je v četrtek opozorila, da so od leta 2022 po vsem svetu v obtoku ponarejena zdravila za sladkorno bolezen. Gre za zdravilo Ozempic, ki vsebuje učinkovino semaglutid in je v EU odobreno za zdravljenje sladkorne bolezni tipa 2, pogosto pa se uporablja tudi za zniževanje telesne teže.
WHO je opozorilo izdala po tem, ko je od oktobra lani odkrila ponarejena zdravila v Veliki Britaniji, ZDA in Braziliji.
Kot je sporočila organizacija s sedežem v Ženevi, je ponarejena različica videti enako kot pravo zdravilo. Vendar pa ponarejena zdravila morda ne vsebujejo prave količine aktivnih sestavin in lahko zato privedejo do nenadzorovanega sladkorja pri diabetikih, opozarja WHO. Dodaja, da ponarejena zdravila lahko vsebujejo tudi druge aktivne sestavine, ki pomenijo tveganje za zdravje.
Organizacija je zato zdravnike, farmacevte, nadzorne organe in javnost pozvala k pazljivosti.
Ljudem svetuje, naj zdravilo kupujejo le na recept v lekarnah in ne prek spleta. Ob tem priporoča uporabnikom, naj preverijo, ali je na inzulinskih peresih pravilno prikazana lestvica za odmerjanje, ali je etiketa videti pravilno in ali so na embalaži morda pravopisne napake.
“,”Jaka Verbic Miklic”,1718969040,1718969040,sl,15500,306,15499,43,0,NULL,,”WHO svari pred ponarejenimi zdravili za diabetes “,who-svari-pred-ponarejenimi-zdravili-za-diabetes,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1726399580,1726399580
1074,15502,”Na NIJZ prejeli novo prijavo ošpic v Sloveniji “,”Pred ošpicami niso zaščiteni, če niso bili cepljeni z dvema odmerkoma cepiva ali če ošpic niso preboleli.”,”
Ljubljana, 3. julija – Na Nacionalnem inštitutu za javno zdravje (NIJZ) so prejeli novo prijavo okužbe z ošpicami. Gre za osebo, ki se je v nedeljo, 30. junija, med 14. in 21. uro nahajala v čakalnici v urgentnem bloku UKC Ljubljana. Vse, ki so bili v nedeljo popoldan v urgentnem bloku, opozarjajo, da obstaja možnost za okužbo, če pred ošpicami niso zaščiteni.
Pred ošpicami niso zaščiteni, če niso bili cepljeni z dvema odmerkoma cepiva ali če ošpic niso preboleli. “Če bi se vam v naslednjih dneh, najkasneje do tri tedne po stiku z bolnikom, pojavil izpuščaj, vročina, vnetje očesnih veznic, izcedek iz nosu ali kašelj, morate o tem takoj obvestiti izbranega zdravnika,” pozivajo na NIJZ.
Svetujejo še, da naj zdravnika najprej pokličejo po telefonu, da ne bi morebitni okužbi izpostavljali drugih ljudi, ter naj zdravniku povejo, da so bili v stiku z bolnikom z ošpicami, so objavili na spletni strani inštituta.
Letos so sicer na NIJZ prejeli 16 prijav ošpic, lani pa so v celem letu zabeležili en primer.
Ošpice so akutna, zelo nalezljiva virusna bolezen, za katero je značilna vročina, kašelj, nahod, vnetje veznic ter izpuščaj. Značilen izpuščaj se pojavi od tretjega do sedmega dneva bolezni najprej na obrazu, nato tudi drugod po telesu. Obolela oseba ima izpuščaj med štirimi in sedmimi dnevi. Povprečen interval od izpostavljenosti do pojava izpuščaja znaša 14 dni, redko tudi dlje, in sicer od 19 do 21 dni.
Ošpice se prenašajo po zraku, s kužnimi kapljicami, z neposrednim stikom z izločki dihal okužene osebe, redkeje pa s posrednim prenosom prek sveže kontaminiranih predmetov.
Ošpice so ena najbolj kužnih nalezljivih bolezni, okužene osebe so kužne od štiri dni pred do štiri dni po pojavu izpuščaja. Tisti, ki so ošpice preboleli ali pa so prejeli dva odmerka cepiva proti ošpicam kadarkoli v preteklosti, so proti okužbi in bolezni zaščiteni.
Ošpice so posebej nevarne za majhne otroke do enega leta starosti, ki še niso bili cepljeni, necepljene nosečnice in za osebe s hudo motnjo imunosti, na primer bolnike, ki trenutno prejemajo kemoterapijo, kortikosteroide v visokih odmerkih ali imajo prirojene motnje imunosti.
“,”Jaka Verbic Miklic”,1720006080,1720006080,sl,15502,306,15501,43,0,NULL,,”Na NIJZ prejeli novo prijavo ošpic v Sloveniji “,na-nijz-prejeli-novo-prijavo-ospic-v-sloveniji,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1726399788,1726399788
1075,15504,”Ministrstvo na predlog NIJZ širi nabor cepljenj v breme zdravstvenega zavarovanja “,”Obvezno zdravstveno zavarovanje bo tako po novem krilo tudi cepljenje proti klopnemu meningoencefalitisu (KME) za odrasle, ki v tekočem letu dopolnijo 47 in 48 let.”,”
Ljubljana, 6. julija – Ministrstvo za zdravje je v petkovem uradnem listu objavilo program cepljenja in zaščite z zdravili za leto 2024. Ta na predlog NIJZ širi nabor cepljenj, ki se bodo izvajala v breme obveznega zdravstvenega zavarovanja. Po novem bo tako kot za ženske tudi za moške do dopolnjenega 26. leta omogočeno cepljenje proti HPV.
Lanskoletni program cepljenja je brezplačno cepljenje proti proti humanim papilomavirusom (HPV) zagotovil dvema dodatnima generacijama dečkov, in sicer v 1. in 3. letniku srednje šole, so spomladi za STA pojasnili na Nacionalnem inštitutu za javno zdravje (NIJZ), kjer so podali omenjen predlog razširitve financiranja cepljenja proti HPV.
NIJZ je predlagal tudi nekatere druge novosti, na ministrstvu za zdravje pa so predlog inštituta v celoti upoštevali.
Obvezno zdravstveno zavarovanje bo tako po novem krilo tudi cepljenje proti klopnemu meningoencefalitisu (KME) za odrasle, ki v tekočem letu dopolnijo 47 in 48 let. Do sedaj so bili do brezplačnega cepljenja upravičeni odrasli, ki v tekočem letu dopolnijo 49 let in zamudniki.
Za nosečnice pa bo obvezno zdravstveno zavarovanje poleg cepljenja proti oslovskemu kašlju po novem krilo tudi cepljenje proti okužbam z respiratornim sincicijskim virusom (RSV). Krilo bo tudi cepljenje otrok proti noricam, in sicer od 1. januarja 2025. Vsa druga našteta cepljenja pa bo obvezno zdravstveno krilo od današnjega dne.
Na NIJZ, kjer so podali predloge, so za STA pojasnili, da so prejeli več predlogov in pobud različnih strokovnih združenj za širitve programa cepljenja. Poleg tega je dovoljenje za promet prejelo novo cepivo proti okužbi z RSV.
Predloge za širitve programa je obravnavala njihova posvetovalna skupina za cepljenje, predlog širitve z univerzalnim programom cepljenja otrok proti noricam pa je potrdil tudi zdravstveni svet na svoji seji lanskega decembra.
Ob sprejetem letošnjem programu cepljenja inštitut tako vse osebe, ki jim v skladu s programom pripadajo določena cepljenja in so torej zanje priporočena, pozivajo, da to možnost izkoristijo in se cepijo, v kolikor se še niso. To ne velja samo za novosti, temveč za vsa cepljenja, ki so za posamezne skupine prebivalcev priporočena, so poudarili.
Vsem staršem tako priporočajo, da svoje otroke zaščitijo tako z obveznimi kot tudi priporočenimi rednimi cepljenji, ki se izvajajo v okviru sistematskih pregledov otrok. Mladostnikom in mladim odraslim do 26. leta starosti, ki še niso cepljeni proti HPV, priporočajo cepljenje proti HPV. Gre namreč za najboljšo zaščito pred različnimi raki in drugimi boleznimi, ki jih povzročajo okužbe s HPV. To cepljenje je najbolj učinkovito, če se opravi še pred začetkom spolne aktivnosti, so pojasnili.
Vsem odraslim na inštitutu priporočajo vsakoletno cepljenje proti gripi v jesenskem času pred začetkom sezone gripe, poživitveno cepljenje proti davici in tetanusu na 10 let, enkrat v odrasli dobi pa tudi poživitveno cepljenje proti oslovskemu kašlju.
Nosečnicam priporočajo cepljenje proti oslovskemu kašlju, gripi in po novem tudi proti RSV, saj našteta cepljenja predstavljajo najboljšo zaščito tako za novorojenčka, kot tudi nosečnico, so poudarili.
Starejšim osebam in kroničnim bolnikom ob cepljenju proti gripi priporočajo tudi cepljenje proti pnevmokoknim okužbam, pred sezono okužb dihal pa tudi proti covidu-19.
Cepljenje proti KME priporočajo vsem starejšim od enega leta, ki bivajo ali predvidevajo aktivnosti na endemskem območju. Je pa to cepljenje za prebivalce, ki niso vključeni v program cepljenja, samoplačniško, so še pojasnili na NIJZ.
“,”Jaka Verbic Miklic”,1720265400,1720265400,sl,15504,306,15503,43,0,NULL,,”Ministrstvo na predlog NIJZ širi nabor cepljenj v breme zdravstvenega zavarovanja “,ministrstvo-na-predlog-nijz-siri-nabor-cepljenj-v-breme-zdravstvenega-zavarovanja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1726399919,1726399919
1076,15506,”Milijoni otrok po svetu še naprej brez zaščite cepiv “,”Jasno oviro pri razdeljevanju cepiv predstavljajo oboroženi konflikti po svetu, saj večina otrok brez imunizacije živi v 31 državah, ki jih zaznamujejo nestabilnost, nasilje in ranljivost.”,”
Ženeva, 15. julija – Ravni precepljenosti otrok po svetu so še vedno pod stopnjo iz časa pred pandemijo covida-19, niti enega odmerka cepiv proti davici, tetanusu in oslovskem kašlju pa ni prejelo 14,5 milijona otrok, sta danes opozorila Unicef in Svetovna zdravstvena organizacija. Lani je bilo proti tem ključnim boleznim polno cepljenih le 84 odstotkov vseh otrok.
Globalna stopnja precepljenosti med otroki je lani ostala nespremenjena v odnosu na leto 2022 in tako vztraja nekoliko pod ravnjo iz leta 2019, v novem poročilu svarita organizaciji Združenih narodov.
Cepljenje proti davici, tetanusu in oslovskem kašlju sklad ZN za otroke Unicef in Svetovna zdravstvena organizacija (WHO) opredeljujeta kot glavni kazalnik precepljenosti najmlajših.
V predstavljenih številkah izstopa porast števila otrok, ki niso prejeli niti enega odmerka cepiv proti tem trem boleznim – z 12,8 milijona leta 2019 na 14,5 milijona v letu 2023.
Ravno pandemija in takratni omejevalni ukrepi proti širjenju bolezni so marsikje poskrbeli za zamude in motnje pri cepljenju, opozarja poročilo, ki pa kot razlog za slabšo precepljenost navaja tudi skepticizem, ki se je razširil v času pandemije.
Ena od strokovnjakinj WHO Katherine O’Brien je pojasnila, da razmah takšnega skepticizma neposredno vodi k smrti otrok. Razne dezinformacije in laži glede cepiv, ki so se širile prek spleta v bogatejših državah, pa so prek diaspore dosegle tudi revnejše države po svetu, kjer se po navedbah Unicefovega strokovnjaka Ephrema Lemanga že sicer soočajo s pomanjkanjem zaupanja v zdravstvo, poroča nemška tiskovna agencija dpa.
Še eno jasno oviro pri razdeljevanju cepiv predstavljajo oboroženi konflikti po svetu, saj večina otrok brez imunizacije živi v 31 državah, ki jih zaznamujejo nestabilnost, nasilje in ranljivost.
Organizaciji sta ob tem opozorili še na pojave ošpic v 103 državah v zadnjih petih letih. Da bi te izbruhi ustavili, je treba doseči 95-odstotno precepljenost, a ta trenutno znaša 83 odstotkov za prvi in 74 odstotkov za drugi odmerek cepiva.
Poročilo sicer beleži tudi določene pozitivne premike, predvsem na področjih cepljenja proti okužbam s humanimi papilomavirusi (HPV), meningitisu, pnevmokoknim okužbam, rotavirozam in otroški paralizi.
“,”Jaka Verbic Miklic”,1721043180,1721043180,sl,15506,306,15505,43,0,NULL,,”Milijoni otrok po svetu še naprej brez zaščite cepiv “,milijoni-otrok-po-svetu-se-naprej-brez-zascite-cepiv,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1726400066,1726400066
1077,15508,”Zaradi covida-19 po svetu še vedno umre 1700 ljudi na teden “,””WHO priporoča, da se ljudje v najbolj ogroženih skupinah cepijo s cepivom proti covidu-19 v 12 mesecih po zadnjem odmerku”,”
Ženeva, 12. julija – Zaradi covida-19 po svetu še vedno umre 1700 ljudi na teden, je v četrtek sporočila Svetovna zdravstvena organizacija (WHO). Njen generalni direktor Tedros Adhanom Ghebreyesus je ogrožene skupine prebivalstva pozval k cepljenju, saj se obseg tega zmanjšuje.
Kot je na novinarski konferenci povedal Tedros, se je precepljenost med drugim zmanjšala v vrstah zdravstvenih delavcev in med starejšimi od 60 let, ki predstavljajo dve najbolj ogroženi skupini. “WHO priporoča, da se ljudje v najbolj ogroženih skupinah cepijo s cepivom proti covidu-19 v 12 mesecih po zadnjem odmerku,” je dejal.
Po podatkih WHO je od prvih zabeleženih primerov covida-19 konec leta 2019 v kitajskem Wuhanu zaradi te bolezni po svetu umrlo dobrih sedem milijonov ljudi. Neuradno naj bi bilo sicer število precej večje.
Države članice WHO so na zadnjem zasedanju Svetovne zdravstvene skupščine (WHA) v začetku junija za največ eno leto podaljšale pogajanja o sporazumu o obvladovanju prihodnjih pandemij. Spričo pandemije covida-19 so poskušale doseči zaveze za boj proti prihodnjim pandemijam, a jim to do roka 24. maja ni uspelo.
Države namreč še vedno nimajo enotnih stališč glede dostopa do patogenov in izdelkov za boj proti pandemijam, kot so cepiva. Med nerešenimi temami so tudi trajnostno financiranje, nadzor nad patogeni, dobavne verige ter pravična porazdelitev testov, zdravljenja in cepiv, pa tudi sredstev za njihovo proizvodnjo.
“,”Jaka Verbic Miklic”,1720784940,1720784940,sl,15508,306,15507,43,0,NULL,,”Zaradi covida-19 po svetu še vedno umre 1700 ljudi na teden “,zaradi-covida-19-po-svetu-se-vedno-umre-1700-ljudi-na-teden,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1726401030,1726401030
1078,15510,”WHO opozarja na grožnjo otroške paralize v Gazi “,”Do nedelje nameravajo pripraviti tudi priporočila za morebitno kampanjo cepljenja v Gazi, pri kateri bi med drugim pomagala WHO.”,”
Gaza/Jeruzalem, 23. julija – Svetovna zdravstvena organizacija (WHO) je vse bolj zaskrbljena zaradi grožnje, ki jo predstavlja otroška paraliza za prebivalstvo Gaze. Izbruh te nevarne bolezni je spričo izraelske ofenzive namreč vse bolj verjeten, čeprav zaenkrat še niso potrdili nobene okužbe z virusom otroške paralize, poročajo tuje tiskovne agencije.
“Zelo me skrbi, da bi v Gazi lahko prišlo do izbruha bolezni,” je v Jeruzalemu dejal predstavnik Svetovne zdravstvene organizacije Ayadil Saparbekov.
Virus otroške paralize so nedavno odkrili v vzorcih odplak z vojnega območja. Do zdaj pa ga niso potrdili pri nobenem bolniku, je še povedal strokovnjak WHO, odgovoren za zdravstvene krize na palestinskih ozemljih.
Kot je pojasnil, je zaradi velikih težav z oskrbo s svežo vodo, odvajanjem odpadne vode in močno oslabljenega zdravstvenega sistema tveganje za širjenje bolezni zelo veliko. Več sto ljudi si v zasilnih namestitvah deli po eno stranišče, vsaka oseba pa ima na voljo manj kot dva litra vode na dan, je pojasnil.
Predstavnik WHO tako ni zaskrbljen le zaradi otroške bolezni, ampak tudi drugih nalezljivih bolezni, ki lahko vodijo v smrt.
Najverjetneje so ostanki virusa prišli v odplake od cepljenega človeka, ki je imel virus v sebi. Pozitivni vzorci tako še ne pomenijo, da se je v Gazi že nekdo okužil z virusom otroške paralize. Bodo pa v prihodnjih dneh opravili natančnejšo analizo vzorcev.
Do nedelje nameravajo pripraviti tudi priporočila za morebitno kampanjo cepljenja v Gazi, pri kateri bi med drugim pomagala WHO.
Izraelska vojska je medtem po lastnih navedbah že začela cepiti vojake proti otroški paralizi. Vojska in druge organizacije pa naj bi se pripravljale tudi na dostavo cepiva v Gazo.
“,”Jaka Verbic Miklic”,1721735520,1721735520,sl,15510,306,15509,43,0,NULL,,”WHO opozarja na grožnjo otroške paralize v Gazi “,who-opozarja-na-groznjo-otroske-paralize-v-gazi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1726401199,1726401199
1079,15512,”Svetovni dan hepatitisa s sloganom Ukrepajte. Testirajte se. Zdravite se. Cepite se “,”S projektom zagotavljajo brezplačno in anonimno testiranje na HIV, hepatitis B in C ter ostale spolno prenosljive okužbe.”,”
Ljubljana, 28. julija – Danes obeležujemo svetovni dan hepatitisa, letos pod sloganom Ukrepajte. Testirajte se. Zdravite se. Cepite se. Nevladne organizacije ob dnevu, ki ga obeležujemo 18. leto zapored, izpostavljajo projekt Expand, namenjen izboljšanju zdravstvene oskrbe in olajšanju dostopa do testiranja za nekatere najbolj ranljive skupine v družbi.
Projekt Expand, ki ga izvajajo Društvo za zmanjševanje škode zaradi drog Stigma, Legebitra, Slovenska Filantropija – Združenje za promocijo prostovoljstva ter Univerza v Ljubljani – Inštitut za mikrobiologijo in imunologijo, se osredotoča na osebe, ki se ukvarjajo s spolnim delom, migrante in uporabnike drog. Cilj projekta je implementacija sistema testiranja v skupnosti za te tri skupine z namenom izboljšanja zdravja posameznikov iz teh skupin ter preprečevanje širjenja okužb v širši družbi.
Kot so partnerji v projektu pred svetovnim dnevom hepatitisa zapisali v sporočilu za javnost, s projektom zagotavljajo brezplačno in anonimno testiranje na HIV, hepatitis B in C ter ostale spolno prenosljive okužbe. Projekt izstopa zaradi svojega celostnega pristopa k reševanju zdravstvenih izzivov, s katerimi se soočajo te skupine, in zaradi njegovega poudarka na dostojanstvu, spoštovanju in vključenosti uporabnikov v sistem zdravstvene pomoči, poudarjajo nevladne organizacije.
V Društvu Legebitra so v okviru projekta letos testiranje omogočili 26 osebam, ki se ukvarjajo s spolnim delom. Pri tem niso odkrili nobenih primerov hepatitisa B ali C, odkrili pa so okužbo s klamidijo in mikoplazmo. Slovenska filantropija, ki se osredotoča na testiranje migrantov, je letos testirala 89 oseb. Odkrili so eno okužbo s hepatitisom B in štiri okužbe s hepatitisom C. Odkrili so tudi dve okužbi s HIV in eno okužbo s povzročiteljem sifilisa.
Društvo Stigma je testiralo 130 uporabnikov drog. Odkrili so 28 okužb s hepatitisom C, eno okužbo s hepatitisom B, dve okužbi s povzročiteljem sifilisa ter dve okužbi z mikoplazmo in trihomono.
Naročanje na zaupno in brezplačno testiranje ni potrebno, oseba prav tako ne potrebuje osebne izkaznice ali kartice zdravstvenega zavarovanja. Testiranje se začne z izpolnitvijo kratkega vprašalnika, v katerem pri osebi preverijo, s kakšnimi tveganji se srečuje, glede na tveganja pa se določi, na kaj se oseba testira. Osebam, ki imajo tvegane spolne odnose ali se ukvarjajo s spolnim delom, svetujejo tudi test na druge okužbe, kot sta sifilis in gonoreja, so sporočili iz društva Stigma.
“Z zgodnjim odkrivanjem okužb in bolezni projekt prispeva k boljšim zdravstvenim izidom za posameznike in preprečuje širjenje okužb v širši skupnosti. S svojim pristopom, ki temelji na spoštovanju in vključenosti, projekt ne le izboljšuje zdravstvene izide, temveč tudi krepi vezi v skupnosti ter spodbuja večje razumevanje in podporo za marginalizirane skupine,” so zapisali.
Po svetu živi več kot 500 milijonov ljudi z diagnosticirano eno od oblik hepatitisa. Za to boleznijo letno umre približno 1,4 milijona ljudi. Poznamo sicer pet glavnih povzročiteljev virusnega hepatitisa, to so virusi hepatitisa A, B, C, D in E. Gre za bolezni jeter, ki lahko povzročijo akutno ali kronično bolezen tega organa.
“,”Jaka Verbic Miklic”,1722168240,1722168240,sl,15512,306,15511,43,0,NULL,,”Svetovni dan hepatitisa s sloganom Ukrepajte. Testirajte se. Zdravite se. Cepite se “,svetovni-dan-hepatitisa-s-sloganom-ukrepajte-testirajte-se-zdravite-se-cepite-se,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1726401950,1726401950
1080,15514,”Afriški center za javno zdravje zaradi opičjih koz razglasil izredne razmere “,”Izbruh opičjih koz je prizadel več afriških držav, zlasti Demokratično republiko Kongo.”,”
Nairobi, 13. avgusta – Afriški center za nadzor bolezni (Africa CDC) je danes zaradi širjenja opičjih koz (mpox) na afriški celini razglasil izredne razmere na področju javnega zdravja. Pozval je k ukrepanju za zaustavitev širjenja te bolezni, poroča francoska tiskovna agencija AFP.
Po podatkih, ki jih je prejšnji teden objavil zdravstveni nadzorni organ Afriške unije, so od januarja 2022 v 16 afriških državah zabeležili skupno 38.465 primerov bolezni s 1456 smrtnimi primeri. Letos so v primerjavi z enakim obdobjem lani zabeležili 160-odstotno povečanje primerov.
Izbruh opičjih koz je prizadel več afriških držav, zlasti Demokratično republiko Kongo.
“S težkim srcem, a z neomajno zavezanostjo našim ljudem, našim afriškim državljanom, razglašamo izredne razmere na področju javnega zdravja na celini,” je dejal generalni direktor afriške agencije za javno zdravje s sedežem v Adis Abebi v Etiopiji Jean Kaseya.
“Ta razglasitev ni zgolj formalnost, ampak jasen poziv k ukrepanju. To je priznanje, da si ne moremo več privoščiti, da bi bili neodzivni,” je dodal.
Bolezen so pri ljudeh prvič odkrili leta 1970 v Demokratični republiki Kongo, od takrat pa je bilo širjenje okužb med ljudmi omejeno predvsem na nekatere zahodno in srednjeafriške države. Maja 2022 so se primeri okužb opičjih koz, ki povzroča vročino, bolečine v mišicah in izpuščaje na koži, začeli hitro širiti po vsem svetu, predvsem med moškimi, ki imajo spolne odnose z moškimi.
Svetovna zdravstvena organizacija (WHO) je sicer leta 2022 sporočila, da so opičje koze v angleščini preimenovali v mpox, da bi se izognili stigmatizaciji, ki izhaja iz prvotnega imena. Ime opičje koze izvira iz leta 1958, ko so virus identificirali pri opicah, ki so jih na Danskem uporabljali za raziskave. Virus je sicer prisoten pri številnih živalih, najpogosteje pa pri glodavcih.
“,”Jaka Verbic Miklic”,1723550820,1723550820,sl,15514,306,15513,43,0,NULL,,”Afriški center za javno zdravje zaradi opičjih koz razglasil izredne razmere “,afriski-center-za-javno-zdravje-zaradi-opicjih-koz-razglasil-izredne-razmere,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1726402099,1726402099
1081,15516,”WHO svari pred paniko: Mpox ni novi covid “,”Pri WHO poudarjajo, da izbruh mpoxa ni še en covid-19, saj je o virusu opičjih koz in načinih za njegov nadzor že veliko znanega.”,”
Ženeva/Bruselj, 20. avgusta – Svetovna zdravstvena organizacija (WHO) je ob prvem potrjenem primeru okužbe z novo različico opičjih koz oziroma mpoxom v Evropi posvarila pred paniko. Regionalni direktor WHO za Evropo Hans Kluge je danes dejal, da izbruh mpoxa ni novi covid. Tudi odbor EU za zdravstveno varnost meni, da za zdaj ni zdravstvene krize zaradi mpoxa v Evropi.
“Mpox ni novi covid,” je regionalni direktor za Evropo Kluge dejal v Ženevi, kjer je sedež WHO. “Vemo, kako nadzorovati mpox,” je poudaril po poročanju tujih tiskovnih agencij.
Kot je dejal Kluge, virus v evropski regiji kroži v različici, imenovani clade 2, od prejšnjega izbruha leta 2022. Po njegovih besedah je v Evropi vsak mesec zabeleženih približno sto primerov te različice virusa opičjih koz.
Izbruh pred dvema letoma je bil obvladan zahvaljujoč močnemu nadzoru, cepljenjem in neposrednemu sodelovanju najbolj prizadetih skupin, je še pojasnil Kluge.
WHO je julija 2022 razglasila javnozdravstveno krizo globalnih razsežnosti zaradi mednarodnega izbruha manj hude oblike clade 2b, ki je večinoma prizadel istospolno usmerjene in biseksualne moške. Izredne razmere so veljale do maja lani.
Prejšnjo sredo je organizacija razglasila mednarodno javnozdravstveno krizo, kar je najvišja stopnja opozorila, zaradi porasta primerov nove, morda nevarnejše različice clade 1b v Demokratični republiki Kongo in njenega širjenja v bližnje države.
Dan kasneje je Švedska sporočila, da so v državi potrdili prvi primer okužbe z novo različico opičjih koz oziroma mpox zunaj Afrike.
Zdaj obstaja priložnost, da smo pozorni na novo uvožene primere različice clade 1b iz Afrike in za učinkovit boj proti clade 2, je na današnji novinarski konferenci opozoril Kluge. Kot je dodal, je tveganje za splošno populacijo majhno.
Da širjenja opičjih koz za zdaj ne bi smeli obravnavati kot “izredne razmere za javno zdravje v Evropi”, se je strinjal tudi odbor EU za zdravstveno varnost, ki je zasedal v ponedeljek, pri čemer je ocenil, da “tveganje ostaja nizko”.
Kot je danes povedal pristojni govorec Evropske komisije Stefan De Keersmaecker, se je odbor za zdravstveno varnost dogovoril o tesno usklajenem pristopu glede virusa opičjih koz. “Od covida smo se naučili, da moramo biti pripravljeni”, je spomnil.
De Keersmaecker je še dejal, da je evropski organ za pripravljenost in odzivanje na izredne zdravstvene razmere (Hera) sklenil pogodbo za skupni nakup dveh milijonov odmerkov cepiva mpox in zdravil za 100.000 doz.
“,”Jaka Verbic Miklic”,1724155740,1724155740,sl,15516,306,15515,43,0,NULL,,”WHO svari pred paniko: Mpox ni novi covid “,who-svari-pred-paniko-mpox-ni-novi-covid,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1726402226,1726402226
1082,15518,”V Sloveniji potrdili prve tri primere okužbe z virusom Zahodnega Nila letos”,”Kot so pojasnili na NIJZ, po piku okuženega komarja večina ljudi ne zboli, saj v približno 80 odstotkih okužba poteka brez simptomov.”,”
Ljubljana, 2. septembra – V Sloveniji so potrdili prve tri primere okužbe z virusom Zahodnega Nila letos, so sporočili z Nacionalnega inštituta za javno zdravje (NIJZ). Kot so navedli, so vse tri primere okužbe potrdili v severovzhodnem delu Slovenije, v Pomurski in Podravski regiji. To so prvi primeri po petih sezonah, ko okužb z virusom v Sloveniji niso zaznali.
Obvestilo Inštituta za mikrobiologijo in imunologijo Medicinske fakultete v Ljubljani, da so potrdili okužbo z virusom Zahodnega Nila pri treh osebah iz severovzhodnega dela Slovenije, je NIJZ prejel 30. avgusta.
Virus so odkrili leta 1937 na severozahodu Ugande. Okužbe z njim so v preteklosti že bile tudi v Sloveniji. Tako je bila v letu 2013 in letu 2017 zabeležena po ena prijava, v letu 2018 pa pet.
So pa letos, že zgodaj v sezoni, o primerih okužb poročali iz nekaterih držav EU, tudi sosednjih. Letos so tako o pojavu virusa Zahodnega Nila poročale Italija, Avstrija, Madžarska, Hrvaška, Španija, Francija, Bolgarija, Nemčija, Romunija. Prav tako so bili primeri okužb z virusom v Srbiji, Albaniji in na Kosovem.
Medtem ko so na Hrvaškem in v Avstriji regije s potrjenimi primeri precej oddaljene od slovenske meje, so v Italiji potrdili primere v Furlaniji-Julijski krajini, ki je blizu Slovenije, so navedli na NIJZ.
Virus Zahodnega Nila prenašajo komarji. Najpogosteje se zato pojavlja v toplejših mesecih, ko so komarji najbolj aktivni. Zelo redko se virus prenese med ljudmi preko transfuzije, tkiv ali darovanih organov.
Kot so pojasnili na NIJZ, po piku okuženega komarja večina ljudi ne zboli, saj v približno 80 odstotkih okužba poteka brez simptomov. Manjši del okuženih razvije kratkotrajno vročinsko bolezen, ki jo spremljajo simptomi, kot so slabo počutje, glavobol, vročina, izpuščaji, bolečine v mišicah in sklepih (vročica Zahodnega Nila). Bolezen se običajno pojavi od tri do 14 dni po okužbi.
Večje tveganje za hujši potek bolezni imajo osebe, starejše od 50 let, ter tiste z oslabljenim imunskim sistemom. Za okužbo pa so dovzetne vse osebe, ki z virusom še niso bile okužene. Po okužbi je imunost najverjetneje dolgotrajna.
Blage oblike bolezni ne potrebujejo zdravljena, pri hudih pa je običajno potrebno zdravljenje v bolnišnici. Učinkovitih protivirusnih zdravil ni. Zdravljenje je simptomatsko, kar pomeni, da se lajšajo simptomi bolezni, ter podporno – podpirajo se prizadeti organski sistemi.
Prav tako ni cepiva, ki bi preprečilo okužbo z virusom pri ljudeh. Najbolj učinkovit ukrep za zmanjšanje tveganja okužbe na območju, kjer kroži virus Zahodnega Nila, so zato ukrepi za preprečevanje pikov komarjev.
“,”Jaka Verbic Miklic”,1725279120,1725279120,sl,15518,306,15517,43,0,NULL,,”V Sloveniji potrdili prve tri primere okužbe z virusom Zahodnega Nila letos”,v-sloveniji-potrdili-prve-tri-primere-okuzbe-z-virusom-zahodnega-nila-letos,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1726402461,1726402461
1083,15520,”Prvi dan kampanje proti otroški paralizi v Gazi cepljenih 87.000 otrok “,”Otroška paraliza, primer katere so po 25 letih nedavno odkrili v Gazi, je nalezljiva virusna bolezen, ki prizadene živčni sistem in povzroča ohromitve, lahko tudi smrt.”,”
Gaza, 2. septembra – V Gazi je bilo v nedeljo, prvi dan kampanje cepljenja proti otroški paralizi, cepljenih okoli 87.000 otrok, je sporočila agencije Združenih narodov za palestinske begunce (UNRWA). Do torka bo po napovedih cepljenih skupno 156.000 otrok, mlajših od deset let. Drugi odmerek bodo otroci potrebovali čez štiri tedne.
Svetovna zdravstvena organizacija (WHO) je prejšnji teden sporočila, da se je Izrael strinjal s serijo tridnevnih humanitarnih premorov v različnih delih Gaze, da bi pristojni proti otroški paralizi lahko cepili približno 640.000 tamkajšnjih otrok, mlajših od deset let.
Uradno se je kampanja začela v nedeljo z obsežnejšim cepljenjem, ko so tudi začeli veljati kratkotrajni premori. So pa neuradno s kampanjo v osrednjem delu enklave začeli že v soboto. V nedeljo je bilo nato cepljenih okoli 87.000 otrok, je na družbenem omrežju X sporočila UNRWA.
Tiskovna predstavnica organizacije Louise Wateridge je medtem poudarila, da se spopadi v enklavi niso popolnoma ustavili.
Do torka bo po napovedih cepljenih približno 156.000 otrok, mlajših od deset let. Drugi odmerek bodo otroci potrebovali čez štiri tedne, poroča nemška tiskovna agencija dpa.
Otroška paraliza, primer katere so po 25 letih nedavno odkrili v Gazi, je nalezljiva virusna bolezen, ki prizadene živčni sistem in povzroča ohromitve, lahko tudi smrt. Okužba se prenaša fekalno-oralno prek umazanih rok. Za otroško paralizo so dovzetni vsi, ki je niso preboleli ali proti njej niso cepljeni.
“,”Jaka Verbic Miklic”,1725279420,1725279420,sl,15520,306,15519,43,0,NULL,,”Prvi dan kampanje proti otroški paralizi v Gazi cepljenih 87.000 otrok “,prvi-dan-kampanje-proti-otroski-paralizi-v-gazi-cepljenih-87-000-otrok,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1726402684,1726402684
1084,15522,”Število smrti zaradi kolere lani naraslo za 70 odstotkov “,”Lani je kolera terjala 4.000 življenj, kljub temu, da je enostavno ozdravljiva, je po poročanju francoske tiskovne agencije AFP na novinarski konferenci v sredo povedal generalni direktor WHO Tedros Adhanom Ghebreyesus.”,”
Ženeva, 5. septembra – Število primerov in smrti zaradi kolere se je lani močno povečalo, je v sredo opozorila Svetovna zdravstvena organizacija (WHO). Število smrti je poskočilo za 71 odstotkov, število potrjenih primerov pa za 13 odstotkov v primerjavi z letom 2022. Agencija ZN je ob tem pozvala k nujnim ukrepom za zajezitev te bolezni, ki jo je možno preprečiti.
“K večjemu številu izbruhov kolere so prispevali konflikti, podnebne spremembe, voda, ki ni varna, higienske razmere, revščina in razseljevanje,” je še dodal.
Geografska porazdelitev izbruhov se je lani znatno spremenila. Na Bližnjem vzhodu in v Aziji se je število primerov zmanjšalo za 32 odstotkov, medtem ko so v Afriki zabeležili velik porast, in sicer za kar 125 odstotkov.
Letos je bilo doslej zabeleženih več kot 342.000 primerov in 2.400 smrti, 22 držav pa poroča o aktivnih izbruhih, je dejal Tedros. Med prizadete države spada tudi od vojne razdejani Sudan, kjer so epidemijo kolere razglasili po obilnem deževju.
Številke verjetno ne odražajo dejanskega obsega bolezni, je dejal Philippe Barboza, strokovnjak za kolero pri WHO. Modelne raziskave namreč kažejo, da je vsako leto dejansko število primerov kolere okoli dva milijona primerov. Zaradi bolezni tako letno verjetno umre okoli 100.000 ljudi.
Barboza je izpostavil, da bi preprečevanje teh smrti stalo le nekaj centov na osebo, zaradi česar so te “popolnoma moralno nesprejemljive”.
Tedros je zato znova pozval k povečanju proizvodnje cepiv. Povedal je, da je bilo lani proizvedenih približno 36 milijonov odmerkov, kar predstavlja le polovico količine, ki so jo prizadete države zahtevale v letu 2022.
Trenutno cepivo proti koleri proizvaja le južnokorejsko farmacevtsko podjetje EuBiologics, Tedros pa poziva, naj se vključijo še drugi proizvajalci.
“Čeprav je cepljenje pomembno orodje, pa ostajajo varna pitna voda, sanitarne razmere in higiena edine dolgoročne in trajnostne rešitve za preprečevanje izbruhov kolere,” je dodal.
Kolera je nalezljiva bakterijska bolezen, ki povzroča hudo drisko, bruhanje in krče v mišicah. Ponavadi je posledica uživanja hrane ali pijače, v kateri je prisotna bakterija.
“,”Jaka Verbic Miklic”,1725539100,1725539100,sl,15522,306,15521,43,0,NULL,,”Število smrti zaradi kolere lani naraslo za 70 odstotkov “,stevilo-smrti-zaradi-kolere-lani-naraslo-za-70-odstotkov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1726403207,1726403207
1085,15524,”60 tisoč manj mest v kliničnih preskušanjih za Evropejce, kljub globalnemu porastu raziskovalnih projektov”,”Kljub temu, da se je število globalnih kliničnih preskušanj v zadnjem desetletju povečalo za 38 %, se je delež držav članic Evropskega gospodarskega prostora (EGP) v svetovnih preskušanjih v istem obdobju prepolovil. “,”
Novo poročilo, ki ga je za EFPIA in Vaccines Europe pripravilo podjetje IQVIA kaže, da se je delež komercialnih preskušanj v EGP – tistih, ki jih sponzorira farmacevtska industrija – zmanjšal z 22 % v letu 2013, na 18 % v letu 2018 in na 12 % v letu 2023.
To za države EGP pomeni 60.000 manj pacientov, ki imajo dostop do preskušanj, in 20.000 manj mest v preskušanjih, ki potekajo samo v EGP. To pomeni, da ljudje, ki živijo v Evropi, nimajo priložnosti za dostop do najnovejših zdravil. Podatki kažejo na pomembna odstopanja na ravni držav znotraj EGP; vendar se je število preskušanj zmanjšalo v vseh državah, razen v treh, kar nakazuje na sistemski problem znotraj regije.
V velikem geografskem preobratu je Kitajska od leta 2018 podvojila število komercialnih preskušanj in zdaj predstavlja 18 % delež globalnih komercialnih kliničnih preskušanj.
Klinična preskušanja pacientom omogočajo najzgodnejši dostop do novih zdravil, tudi 5 do 10 let pred njihovim lansiranjem. IQVIA ocenjuje, da zdravstveni sistemi EGP vsako leto iz naslova kliničnih študij dobijo med 1 in 1,5 milijarde EUR zaradi plačil za preskušanja in prihrankov pri stroških zdravil. Zmanjšanje števila preskušanj v EGP ima zato bistveno večji vpliv kot le na oskrbo bolnikov.
Raziskava nakazuje, da zmanjšano privlačnost Evrope za klinične raziskave lahko pripišemo manj ugodnemu regulativnemu in finančnemu okolju. EGP, na primer, je počasnejši pri vzpostavitvi in dostopu do preskušanj na vseh preučevanih terapevtskih področjih (onkologija, nalezljive in redke bolezni) v primerjavi z ZDA. Potreba po izvajanju več državnih kliničnih preskušanj je za Evropo tudi izziv, medtem ko imata ZDA in Kitajska korist že zaradi večje populacije pacientov.
Glavne ugotovitve poročila::
Onkološka preskušanja: V vseh fazah preskušanj onkoloških zdravil v EGP je prišlo do relativnega ali absolutnega upada. Trenutno je regija padla pod raven iz leta 2018. Nasprotno so v ZDA, opazili povečanje v letu 2021 in stabilnost od takrat dalje. Padec v EGP lahko povzročajo različni dejavniki, kot je Uredba o in vitro diagnostiki (IVDR), ki povzroča operativne izzive za več državna preskušanja v onkologiji in preskušanja, odvisna od in vitro testiranja. Pobude, kot sta EU Cancer Mission in Evropski načrt za boj proti raku, lahko pomagajo pri izzivih na tem področju.
Preskušanja na področju imunizacije: Podatki kažejo, da so se globalna in EGP preskušanja cepiv zmanjšala po vrhuncu, doseženem med Covidom. Medtem, ko se komercialna preskušanja globalno povečujejo, se je njihovo število v EGP močno zmanjšalo, kar je povzročilo padec svetovnega deleža s 17 % v letu 2018 na 8 % v letu 2023, predvsem zaradi upada preskušanj faze 3 in 4. Geografsko gledano je EGP izgubil preskušanja cepiv proti Aziji in Oceaniji, pri čemer znotraj EGP obstajajo pomembne razlike.
Preskušanja redkih bolezni: Kljub globalni rasti so preskušanja redkih bolezni v EGP padla za 4 %. Poročilo navaja pomanjkanje financiranja tveganega kapitala za evropska mala in srednja podjetja kot eden od dejavnikov.
Pediatrična preskušanja: V skladu z globalnim trendom se je število komercialnih pediatričnih preskušanj v EGP zmanjšalo za 4 %; le Kitajska je povečala število objav pediatričnih preskušanj po pandemiji.
Celične in genske terapije (CaGT): Evropski delež preskušanj celičnih in genskih terapij globalno je postopoma upadal s 25 % v letu 2013 na 10 % v letu 2023. V tem obdobju je Kitajska doživela dramatično povečanje CaGT preskušanj in postala vodilna regija s 42 % deležem (iz 10 %), kar je posledica ugodnega regulativnega okolja, finančnih tokov in strateškega poudarka na naprednih tehnologijah.
Preskušanja faze ena: V primerjavi z globalnim trendom povečevanja preskušanj faze ena v zadnjih 10 letih – z 32 % na 41 % – je EGP opazil postopno zmanjšanje z 19 % na 14 %. Preskušanja faze ena so pomembna, saj postavljajo temelje za nadaljnji klinični razvoj, vlaganja in financiranje v regiji, čigar škodljiv vpliv bo verjetno opazen v prihodnjih letih.
EFPIA in Vaccines Europe pozivata države članice in Evropsko komisijo, da ustavijo in obrnejo te trende, nadgradijo nedavni poročili »Letta« in »Draghi« ter takoj ocenijo vpliv Uredbe o kliničnih preskušanjih (CTR). Številni dejavniki so pomembni za izboljšanje ekosistema kliničnih preskušanj, od zmanjšanja regulativne kompleksnosti do poenostavitve in uskladitve procesov sklepanja pogodb. Za nadgradnjo zmogljivosti Evrope za klinična preskušanja in izboljšanje ekosistema, EFPIA in Vaccines Europe predlagata naslednja priporočila:
Nathalie Moll, generalna direktorica EFPIA, je dejala: “Evropska klinična preskušanja ovira počasen in razdrobljen raziskovalni ekosistem, trenutne pobude pa so s sedanjim tempom nezadostne, da bi ustavile in obrnile desetletje upada. Če želi Evropa biti konkurenčna, mora delovati kot enotna regija, ne pa kot posamezne države članice, in mora biti podprta s politikami, ki privabljajo globalne raziskovalne naložbe. Samo tako bodo Evropejci imeli enake priložnosti za dostop do medicinskih prebojev kot bolniki v drugih delih sveta.”
“,”Jaka Verbic Miklic”,1729577400,1729577400,sl,15524,306,15523,43,0,NULL,,”60.000 manj mest v kliničnih preskušanjih za Evropejce, kljub globalnemu porastu raziskovalnih projektov”,60-000-manj-mest-v-klinicnih-preskusanjih-za-evropejce-kljub-globalnemu-porastu-raziskovalnih-projektov,Post,/sites/43/files/images/VoI_2018a.jpg,1,0,1730790804,1754758849
1086,15524,” 60,000 fewer clinical trial places for Europeans, despite global surge in research projects. “,”Despite global clinical trials increasing by 38% over the past decade, the European Economic Area’s (EEA) global share of trials has halved over the same period.”,”
A new report by IQVIA for EFPIA and Vaccines Europe, shows that the EEA’s share of commercial trials – those sponsored by a pharmaceutical company – has reduced from 22% in 2013, to 18% in 2018 to 12% in 2023.
This translates to 60,000 fewer patients accessing a trial involving a country within the EEA and 20,000 fewer places available in EEA-only trials, meaning people living in Europe are missing out on the opportunity to access the latest medicines. The data shows significant country-level variation within the EEA; however, the number of trials has decreased in all but three countries, suggesting a systemic problem in the region.
In a major geographical shift, China has doubled its number of commercial trials since 2018, and now accounts for an 18% share of global commercial clinical trials.
Clinical trials provide patients with the earliest access to new medicines, up to 5-10 years before launch; IQVIA data estimates that EEA health systems benefit from between 1-1.5bn Euros from trial payments and drug cost savings every year; a reduction in EEA trials will therefore be felt beyond patient care.
The research suggests that Europe’s diminishing attractiveness for clinical research can be attributed to less favourable regulatory and funding environments. The EEA, for example, is slower for set up and access to trials across all therapy areas studied (oncology, infectious and rare diseases) when compared with the US. The need to conduct multi-country trials is also challenging for Europe, while the US and China in particular benefit from larger patient populations. The report’s main findings include:
Oncology trials: There has been a relative or absolute decline in all phases of oncology trials in the EEA, which are now below 2018 levels. This contrasts to the US, who saw an increase in 2021, with levels maintained since. The fall in the EEA may be driven by factors including the In-vitro Diagnostic Regulation (IVDR), which poses operational challenges for multi-country trials in oncology and trials which are dependent on in-vitro testing. Initiatives like the EU Cancer Mission and Europe’s Beating Cancer Plan can help provide better focus in this area.
Immunisation trials: Data shows that global and EEA vaccine trials have fallen back from a Covid peak. While commercial trials are growing in numbers globally, the EEA has seen a sharp decline in numbers resulting in a drop in global share from 17% in 2018 to 8% in 2023, largely down to a decrease in Phase 3 and 4 trials. Geographically, the EEA has lost immunisation trials to Asia and Oceania, and significant variation exists within the EEA.
Rare disease trials: Despite global growth, rare disease trials in the EEA fell 4%. The report cites a lack of venture capital (VC) funding for European SMEs as a contributing factor.
Paediatric trials: Following a global trend, the number of commercial paediatric trials fell 4% in the EEA; only China has increased paediatric trial publications since the pandemic.
Cell and gene therapies (CaGT): Europe’s global share of cell and gene therapy trials has steadily decreased from 25% in 2013 to 10% in 2023. During this period, China saw a dramatic rise in CaGT trials to become the leading region with 42% share (rising from 10%), due to a favourable regulatory environment, funding streams, and strategic focus on advanced technologies.
Phase one trials: Compared to a global trend of increased phase one trials over the past 10 years – 32% to 41% – the EEA has seen a gradual decline from 19% to 14%. Phase one trials are significant as they establish a basis for further clinical development, investment and funding into a region, the detrimental impact of which is likely to be seen over the coming years.
EFPIA and Vaccines Europe are seeking action from Member States and the European Commission, to stop and reverse these trends, build on the recent Letta and Draghi reports and carry out an immediate assessment of the impact of the Clinical Trial Regulation (CTR). A range of factors are seen to enhance the clinical trial ecosystem, from minimising regulatory complexity, and simplifying and harmonising contracting processes. To build on Europe’s clinical trial capabilities, enhance the ecosystem, EFPIA and Vaccines Europe propose the following recommendations.
Nathalie Moll, Director General, EFPIA, said: “European clinical trials are hampered by a slow and fragmented research ecosystem, and current initiatives, at the current pace, are insufficient to stop and reverse a decade of decline. For Europe to be competitive it needs to function as a unified region, not as individual Member States and be supported by policies to attract global research investment. Only then will Europeans have the same opportunities to access medical breakthroughs as patients in other parts of the world”
“,,1729577640,1729577640,en,15524,306,15523,43,0,NULL,,”60.000 manj mest v kliničnih preskušanjih za Evropejce, kljub globalnemu porastu raziskovalnih projektov”,60-000-manj-mest-v-klinicnih-preskusanjih-za-evropejce-kljub-globalnemu-porastu-raziskovalnih-projektov,Post,/sites/43/files/images/VoI_2018a.jpg,1,0,1730790804,1754758849
1087,15526,”Pomemben vpliv farmacevtske industrije na gospodarski razvoj Evrope”,”Nova raziskava, ki jo je danes objavila Evropska zveza farmacevtskih industrij in združenj EFPIA”,”
Nova raziskava, ki jo je danes objavila Evropska zveza farmacevtskih industrij in združenj EFPIA, vsebuje poglobljeno analizo gospodarskega odtisa farmacevtske industrije v Evropi, in primerjavo Evrope z drugimi regijami sveta. Poročilo kaže na “močno in rastočo” industrijo, ki je leta 2022 prispevala skupno 311 milijard evrov k bruto dodani vrednosti EU-27.
Farmacevtska industrija je v Sloveniji leta 2022 prispevala 2,9 milijarde evrov k bruto dodani vrednosti in je podprla 25.600 delovnih mest v celotnem gospodarstvu.
Raziskava kaže, da so izdatki za raziskave in razvoj v farmacevtski industriji v območju EU med letoma 2010 in 2022 rasli v povprečju za 4,4 odstotke na leto in se povzpeli iz 27,8 milijarde evrov na 46,2 milijarde evrov.
Hkrati pa podatki opozarjajo tudi na razlike v rasti izdatkov za raziskave in razvoj med EU in drugimi deli sveta, saj Evropa ne uspe dohiteti rasti, ki jo v tem sektorju beležijo v Aziji in ZDA. V istem obdobju je rast izdatkov za raziskave in razvoj v ZDA znašala 5,5 odstotkov, na Kitajskem pa 20,7-odstotka.
V zadnjih letih je vse večja razlika v naložbah v raziskave in razvoj med Evropo, ZDA in Kitajsko povezana z relativnim zmanjšanjem števila evropskih novih molekul (NME) – zdravil z aktivno učinkovino, ki so prvič uvedena na trg – in so ključnega pomena za razcvet področja raziskav in razvoja. EU je leta 2023 po številu odkritih NME zaostala za Kitajsko.
Podatki iz poročila, ki ga je pripravilo podjetje PwC kažejo, da je leta 2022 farmacevtska industrija prispevala 311 milijard evrov k bruto dodani vrednosti EU, kar predstavlja 2 odstotka njene bruto dodane vrednosti. Farmacevtska industrija je v EU ustvarila 2,3 milijona delovnih mest – kar predstavlja 2,1-odstotno letno rast med letoma 2016 in 2022.
Zaradi nenehno visokih ravni raziskav in inovacij – in bruto dodane vrednosti 197.000 evrov na delavca – je farmacevtska industrija v Evropi trikrat bolj produktivna kot evropsko gospodarstvo v celoti. Produktivnost na delavca v farmacevtskem sektorju je v vsaki preučevani državi EU višja kot v gospodarstvu kot celoti. To velja tudi za Slovenijo, kjer je bruto dodana vrednost na zaposlenega v farmacevtski industriji znašala v povprečju 200.500 evrov in je bila kar 335,9-odstotka višja od povprečne produktivnosti vseh industrij med letoma 2016 in 2022.
Podatki na sliki kažejo gospodarski vpliv in število zaposlenih za vsako državo članico.
Generalna direktorica EFPIA, Nathalie Moll, je ob publikaciji poročila povedala: “Gospodarsko gledano, farmacevtski sektor bistveno prispeva k razvoju Evrope. Še naprej ostaja ključnega pomena za evropsko zdravje in gospodarsko varnost, kljub čedalje večjemu številu omejitev.
Zaradi počasne rasti investicij v raziskave in razvoj ter obsega in hitrosti upadanja svetovnega deleža naložb v raziskave in razvoj v Evropi, je za preobrat na tem področju na voljo le malo časa. Krepitev evropske konkurenčnosti za ponovno vzpostavitev rasti zahteva usklajeno in skupno ukrepanje. Izvedba usklajene strategije na področju znanosti o življenju v Evropi bi bila dober začetek za zagotovitev prihodnosti tega sektorja.“
Celotno poročilo je na voljo TUKAJ.
Za podrobnejše informacije o posameznih državah članicah si oglejte priložene drsnice TUKAJ.
“,”Jaka Verbic Miklic”,1731561360,1731561360,sl,15526,306,15525,43,0,NULL,,”Pomemben vpliv farmacevtske industrije na gospodarski razvoj Evrope”,pomemben-vpliv-farmacevtske-industrije-na-gospodarski-razvoj-evrope,Post,/sites/43/files/images/slideshow/fidprc_004.jpg,1,0,1731565489,1731566517
1088,15526,”Despite a decade of gradual growth, R&D spending in Europe outpaced by the US”,”New research published today by EFPIA provides in-depth analysis of the economic footprint”,”
Despite a decade of gradual growth, R&D spending in Europe outpaced by the US – with increasing competition from China, new data shows.
New research published today by EFPIA provides in-depth analysis of the economic footprint of the pharmaceutical industry in Europe, across Member States and compares Europe to other regions of the world.
It shows a ‘strong and growing’ industry which contributed a total of €311bn[1] to the EU-27 economy in 2022.
The pharmaceutical industry in Slovenia contributed 2.9 billion euros to gross added value in 2022 and supported 25,600 jobs across the entire economy.
The research shows that EU pharmaceutical R&D spending grew on average 4.4% per year between 2010 and 2022, from €27.8 billion to €46.2 billion.
However, the data also provides further warning of the divergence in R&D spending between the EU and the other parts of the world, as Europe fails to keep pace with the growth seen in the sector in Asia and the US.
Over the same period, R&D spending growth in the US was 5.5%, and in China 20.7%.
In recent years, this growing gap in R&D investment between Europe, the US and China has correlated with a relative decline in the number of European new molecule entities (NME) – drugs with an active ingredient marketed for the first time – vital to R&D activity. The EU fell behind China for numbers of NME discovered in 2023.
The report by PwC builds on research published in 2019. New figures show:
This also applies to Slovenia, where the gross added value per employee in the pharmaceutical industry averaged 200,500 euros and was 335.9 percent higher than the average productivity of all industries between 2016 and 2022.
The data shows the economic footprint and employment figures for every Member State.
EFPIA Director General, Nathalie Moll, said: “Economically, the sector is delivering for the EU. It continues to be central to Europe’s health and economic security, despite a growing number of constraints.
Despite R&D spending growing slowly, the scale and pace of the downward trends in Europe’s global share of R&D investment shows that there is only a finite time to turn things around.
Boosting European competitiveness to kickstart growth requires concerted, collective action; urgent implementation of a coherent life sciences strategy for Europe would be a good start to futureproofing the sector.”
The full report can be accessed here.
For more detailed information about individual Member States, see the accompanying slides here.
“,,1731562320,1731562320,en,15526,306,15525,43,0,NULL,,”Pomemben vpliv farmacevtske industrije na gospodarski razvoj Evrope”,pomemben-vpliv-farmacevtske-industrije-na-gospodarski-razvoj-evrope,Post,/sites/43/files/images/slideshow/fidprc_004.jpg,1,0,1731565489,1731566517
1089,15528,”Inovacije za boljšo prihodnost”,”Naložbe v nova cepiva in terapije za obvladovanje zdravstvenih groženj, kot je AMR, prinašajo upanje”,”
Ljubljana, Bruselj, 10. december 2024 – Evropska zveza farmacevtskih industrij in združenj, EFPIA, je objavila pregled inovacij za neizpolnjene potrebe za leto 2024. Poročilo poudarja pomemben napredek na področju farmacevtskih inovacij, vključno s preboji na področju redkih bolezni, celičnih in genskih terapij, nevroloških zdravljenj in tehnologije mRNA. S tem je postalo jasno, da mora Evropa posodobiti regulativne okvire, zato da bo zagotovila pravočasen dostop bolnikov do zdravljenja in ohranila konkurenčnost.
Poročilo tako razkriva izjemne spremembe pri boleznih, ki vplivajo na našo družbo. Starajoče se prebivalstvo, podnebne spremembe, življenjski slog in odpornost na antimikrobna sredstva so namreč le nekateri od dejavnikov, ki oblikujejo prihodnost zdravstva.
Poročilo kaže, da inovacije na področju preprečevanja in zdravljenja obetajo občutno zmanjšanje bremena bolezni, kar odpira vrata novim možnostim za paciente in obljublja pomembne izboljšave v zdravstveni oskrbi.
Bolezni, ki nujno potrebujejo rešitve
Bolezni, kot so rak, srčno-žilne bolezni, demenca in kronična obstruktivna pljučna bolezen (KOPB), so v porastu. Približno 20 do 30 milijonov Evropejcev trpi za redkimi boleznimi, medtem ko so duševne motnje, kot je na primer depresija, še vedno izjemno kompleksne in globoko vplivajo na kakovost življenja. In pacienti, ki živijo s takšnimi boleznimi, nujno potrebujejo nova zdravljenja.
Podatki kažejo, da je Evropska agencija za zdravila do novembra 2024 izdala 97 novih dovoljenj za promet, od tega 56 za nove aktivne snovi – kar je povečanje v primerjavi z letom 2023, ko je bilo izdanih 77 dovoljenj in 39 novih aktivnih snovi.
Inovacije, ki spreminjajo potek bolezni pri raku
Onkologija ostaja največje področje kliničnih raziskav in tudi prioriteta, saj predstavlja skoraj tretjino vseh preskušanj, to je 29 odstotkov. Zlasti genske in celične terapije (CaGT) trenutno kažejo velik potencial pri zdravljenju raka. Klinična preskušanja, začeta leta 2023 za onkološke indikacije, se osredotočajo na napredovalne in metastatske rake, kot so rak pljuč in dojke ter raki z nizko stopnjo preživetja, kot je na primer rak trebušne slinavke in debelega črevesa.
Prav tako se je med letoma 2018 in 2023 povečal delež kliničnih preskušanj na področjih terapij za srčno-žilne bolezni, infekcijske bolezni in reproduktivno zdravje
Ključne inovacije za prihodnost pacientov
Poročilo EFPIA izpostavlja ključne inovacije, ki obljubljajo preobrat v zdravstveni oskrbi in prinašajo upanje pacientom z najtežjimi boleznimi. Ena od osrednjih tem je boj proti odpornosti na antimikrobna sredstva (AMR). Od leta 2021 je bilo začetih 52 kliničnih preskušanj za razvoj cepiv proti Streptococcus pneumoniae, ki bi lahko zmanjšala okužbe, uporabo antibiotikov ter podaljšala življenjsko dobo novih antibiotikov. Kljub nujnosti novih antimikrobnih pripravkov za zdravljenje »super odpornih« bakterij, ki ogrožajo učinkovitost medicinskih postopkov, pa žal ostaja razvoj na tem področju šibek. Trenutno so v razvoju le štirje inovativni antimikrobni pripravki, kar opozarja na potrebo po dodatnih spodbudah za oživitev tega ključnega segmenta.
Na področju kroničnih virusnih okužb so v razvoju tri profilaktična cepiva proti virusu Epstein-Barr (EBV), povezanih z multiplo sklerozo in določenimi vrstami raka. Prva odobritev teh cepiv je pričakovana v naslednjih tridesetih letih, kar bi lahko znatno zmanjšalo pojavnost teh bolezni in s tem tudi družbene stroške.
Medtem pa mRNA tehnologija, ki se je med pandemijo izkazala za revolucionarno, odpira nova obzorja pri zdravljenju raka. Ta tehnologija usmerja imunski sistem, da prepozna in uniči rakave celice. Od leta 2022 je bilo začetih 37 kliničnih preskušanj na tem področju, pri čemer večina še vedno poteka v začetni fazi. Prva odobritev mRNA terapij za raka je pričakovana v prihodnjem desetletju, kar bo pacientom omogočilo personalizirane in učinkovitejše možnosti zdravljenja.
Velika depresivna motnja, ki prizadene približno 32 milijonov Evropejcev, ostaja eno od ključnih področij raziskav. Od leta 2019 je bilo v Evropi začetih 248 kliničnih preskušanj, osredotočenih na izboljšanje nevroplastičnosti možganov, kar bi lahko pomembno vplivalo na zdravljenje te pogosto izčrpavajoče bolezni.
Genske terapije prinašajo revolucijo v zdravljenju redkih bolezni, ki povzročajo invalidnost. Od leta 2022 je bilo začetih 175 kliničnih preskušanj, osredotočenih predvsem na nevrološke in nevromuskularne motnje. Med njimi je Duchennova mišična distrofija, za katero se pričakuje, da bodo genske terapije pridobile odobritev v naslednjih petih letih, s čimer bi se izboljšala kakovost življenja bolnikov in upočasnilo napredovanje bolezni.
Nathalie Moll, generalna direktorica EFPIA, je ob predstavitvi poročila povedala, da je “pregled inovacij pomemben opomnik, da številni ljudje še vedno živijo z izčrpavajočimi in življenjsko omejujočimi boleznimi, za katere nova zdravila predstavljajo življenjsko pomembno priložnost. Razveseljivo je videti znanstvene napredke in raznolikost inovacij, ki jih farmacevtska podjetja razvijajo za spopadanje s temi zdravstvenimi izzivi. Naložbe v nova cepiva in terapije za obvladovanje zdravstvenih groženj, kot je AMR, prinašajo upanje; vendar lahko dosežemo še več, če bodo evropski oblikovalci politik sodelovali z nami in spodbujali več raziskav in razvoja na tem ključnem področju neizpolnjenih potreb. Politična nestabilnost in vedno večje breme bolezni zahtevata večjo podporo za zdravstveno varnost v Evropi ter inovacije za paciente. To je mogoče doseči le z usklajenimi politikami in sodelovanjem vseh deležnikov.”
“,”Jaka Verbic Miklic”,1733842800,1733842800,sl,15528,306,15527,43,0,NULL,,”Inovacije za boljšo prihodnost”,inovacije-za-boljso-prihodnost,Post,”/sites/43/files/images/news/Cesa nas je naucil kovid.jpg”,1,0,1733899231,1733899537
1090,15528,”Patients and society set to benefit from innovation”,”It is exciting to see the advances in science, and the diversity in innovation coming from pharmaceutical companies to address these health challenges”,”
EFPIA has today published its 2024 Pipeline Review – Innovation for unmet need. The report highlights a range of factors contributing to a major shift in the types of diseases impacting society. These include an aging population, climate change, lifestyle choices and antimicrobial resistance (AMR).
It shows that across the pipeline innovative advances in prevention and treatment are emerging that promise to alleviate a significant part of this disease burden, addressing the needs of patients and significantly improving patient care.
Conditions like cancer, cardiovascular disease, dementia and COPD are on the rise. The report estimates that around 20-30 million Europeans are suffering from a rare disease, while mental health conditions, including depression remain profound and multi-faceted. Patients living with these conditions need new treatments.
Data shows that to date [November 2024], the European Medicines Agency issued 97 new market authorisations, 56 of which are new active substances – a rise from 2023, which saw 77 market authorisations, and 39 new active substances.
Oncology remains the largest area for clinical research, accounting for almost a third of trials (29%). Cell and Gene Therapies (CaGT) also hold a significant share of overall trials, indicating strong investment in novel approaches to targeting cancer.
Trials initiated in 2023 for oncology indications continue to focus primarily on advanced or metastatic cancers, with high incidence cancers such as metastatic non-small cell lung cancer (NSCLC) & breast cancer particular focal points of clinical activity. Cancers with low survival rates such as pancreas and colorectal cancer are also an active area in clinical activity.
Cardiovascular, infectious disease and reproductive health therapy areas have also grown their respective share of the clinical trial pipeline between 2018 and 2023.
The report highlights several areas of innovation set to transform care for patients, they include:
Fighting Antimicrobial Resistance (AMR):
The report highlights the rise of AMR vaccines, with vaccines against Streptococcus pneumoniae a focal point, with 52 trials initiated since 2021. New vaccines can help prevent infections, reduce antibiotic usage and prolong the lifespan of novel antibiotics.
Novel antimicrobials are also needed to treat superbugs that are resistant to existing treatments, ensuring medical treatments and surgeries remain effective, and to fight the growing threat of AMR. However, the pipeline for new antimicrobials is fragile. Companies are increasingly facing financial struggles and experts are leaving the field. With only four antimicrobials in development that could be considered as innovative, a suite of strong incentives to reignite innovation and restore the pipeline are needed urgently.
Chronic viral infections have demonstrated a causal role in the onset of severe non-communicable diseases in patients, for example, Epstein-Barr virus (EBV) which is implicated in the development of multiple sclerosis and some cancers. There are currently three prophylactic vaccines in early-stage development for EBV, with the first approvals expected in the 2030’s. This would bring major benefits for people through reduced incidence of multiple sclerosis and EBV-associated cancers, as well as significantly reducing healthcare and societal costs. NCDs are responsible for 41m deaths globally each year.
mRNA vaccines – which came into focus during the pandemic – offer transformational personalised therapy for patients with cancer, by training the body’s immune system to destroy cancerous cells. 37 oncology trials have been initiated since 2022, 86% of which are in Phase 1. In colorectal cancer, there are three mRNA vaccines in phase 1 /2 trials, with the first approval expected in early 2030’s. They are set to offer patients a completely new treatment option, promising improved survival rates as well as minimising surgical procedures and associated complications.
Major Depressive Disorder (MDD) is a common mental health disorder, severely impacting quality of life and estimated to affect around 32million people in Europe. Several novel treatments for MDD are currently in development, many or which focus on improving neuroplasticity (aiding the brain to grow and heal). Clinical trial activity in MDD is high, with 248 trials initiated since 2019 in Europe.
Gene therapies are new treatments that replace defective or missing genes with the aim of curing life-long, debilitating diseases. The report shows that 175 clinical trials involving AAV-based gene therapies have been initiated since 2022, with neurology and neuromuscular indications a focus.
Several gene therapies for Duchenne Muscular Dystrophy (DMD) are aiming for approval in the next 5 years, holding the promise not only to alleviate symptoms but also to slow or stabilize disease progression for those living with the condition. DMD is a rare genetic disorder and the most severe form of muscular dystrophy, leading to progressive muscle degeneration and premature death.
The full EFPIA pipeline review can be found here.
Speaking about the report, Nathalie Moll, Director General, EFPIA, said:
“The Pipeline review is an important reminder that many people continue to live with debilitating and life limiting disease, for whom new medicines could provide an essential lifeline. It is exciting to see the advances in science, and the diversity in innovation coming from pharmaceutical companies to address these health challenges.
The investment we are seeing into new vaccines and treatments to tackle the health threats posed by AMR also brings hope; however, there is much more that we can achieve if EU policy makers work with us to incentivise more research and development in this vital area of unmet need.
Political instability and an ever-evolving disease burden means that now, more than ever, we must support Europe’s health security and its ability to innovate for patients. This can only be achieved through policies delivered through a coherent European life science strategy and a collaborative approach among all stakeholders.”
“,”Jaka Verbic Miklic”,1733842800,1733842800,en,15528,306,15527,43,0,NULL,,”Inovacije za boljšo prihodnost”,inovacije-za-boljso-prihodnost,Post,”/sites/43/files/images/news/Cesa nas je naucil kovid.jpg”,1,0,1733899231,1733899537
1091,15530,”Izzivi bolnikov z rakom in sledenje poznih posledic zdravljenja”,Vabilo,”
Vljudno vabljeni na 5. strateško konferenco Življenje z rakom, ki bo letos potekala pod geslom IZZIVI BOLNIKOV Z RAKOM IN SLEDENJE POZNIH POSLEDIC ZDRAVLJENJA.
Program konference je na voljo tukaj.
Konferenca bo potekala v torek, 4. februarja 2025, ob 14. ur preko platforme Zoom.
Kotizacije ni!
Podeljene bodo kreditne točke Zdravniške zbornice Slovenije.
“,”Jaka Verbic Miklic”,1737297060,1737297060,sl,15530,306,15529,43,0,NULL,,”5. konferenca”,5-konferenca,Post,”/sites/43/files/images/news/Zivljenje z rakom/5 konferenca/5. konferenca.png”,1,0,1737298015,1737298015
1092,15532,”Ob svetovnem dnevu sepse poziv k pozornosti zlasti bolnikom z oslabljeno imunostjo”,”Po besedah Jereba so znaki in posledice te infekcijske bolezni dokaj nespecifični.”,”
Ljubljana, 12. septembra – Pred svetovnem dnevu sepse, ki ga obeležujemo 13. septembra, je predstojnik klinike za infekcijske bolezni in vročinska stanja Matjaž Jereb opomnil na znake bolezni, ki je lahko v najtežjih oblikah tudi smrtna. Med njimi so povišana temperatura, utrujenost in manj urina. Opozoril je še na neurejenost zdravstvenega sistema, ki vpliva na zdravljenje.
Po besedah Jereba so znaki in posledice te infekcijske bolezni dokaj nespecifični. Med znaki septične okužbe je naštel mrzlico, povišano telesno temperaturo, zmedenost, zmanjšano količino urina in utrujenost. Med posledice okužbe pa spadajo stalna utrujenost, kognitivne motnje, depresija in nespečnost. “Pri hujših oblikah prihaja tudi do amputacij prstov in nog, kar omejuje življenje in aktivnosti posameznika ter pušča trajne posledice,” je dejal v današnji izjavi za medije.
Na pozornost opozarja predvsem posameznike, ki imajo oslabljeno imunost. To so zlasti kronični bolniki, na primer bolniki s sladkorno boleznijo, pa bolniki brez vranice, tisti na glukokortikoidni terapiji ali imunosupresivnih zdravilih in tisti, ki so imeli presaditev katerega od organov ali matičnih krvotvornih celic. Ob sepsi namreč prihaja tudi do prizadetosti in odpovedi organskih sistemov, zato se lahko funkcija obolelih organov kronično poslabša.
Po besedah Jereba so najbolj ogroženi novorojenčki z nizko porodno težo in posamezniki po 65. letu starosti.
Po njegovih navedbah lahko bakterijske okužbe, kot je sepsa, preprečimo tudi s cepljenjem proti pnevmokoku, ki je relativno pogost povzročitelj okužb. “Za starostno skupino nad 65 let starosti je cepljenje brezplačno,” je izpostavil.
Bolnike z najtežjo obliko sepse morajo zdraviti na oddelkih za intenzivno zdravljenje. To je namreč kompleksno. “Pomembno je, da bolnik kar se da hitro prejme antibiotik in podporno terapijo, s katero rešimo življenje in obvladujemo bolezen,” je še dejal infektolog.
Kot je izpostavil Jereb, je lani po informacijah klinike za infekcijske bolezni in vročinska stanja umrlo nekaj več kot 30 odstotkov bolnikov s sepso.
Ob tem pa je ocenil, da je treba izboljšati dostopnost do zdravnikov. Spomnil je na težave tako v primarnem zdravstvu kot v bolnišnicah, zlasti s kadrom, na težave z negovalnim kadrom in na krčenje števila bolnišničnih postelj. “Vse to nenazadnje vpliva tudi na oskrbo bolnikov in potencialno na prognozo bolnikov s sepso”.
Po njegovem mnenju najtežji bolniki sicer dobijo zdravnika, ustrezno posteljo in oskrbo, vendar “neurejenost našega zdravstvenega sistema vpliva na uspehe tudi našega zdravljenja in želimo si, da se stvari na sistemski ravni postavijo na svoje mesto”.
Ob dnevu sepse je še poudaril, da je sepsa bolezen, s katero smo se soočali, se soočamo in se bomo soočali tudi v bodoče.
“,”Jaka Verbic Miklic”,1726145580,1726145580,sl,15532,306,15531,43,0,NULL,,”Ob svetovnem dnevu sepse poziv k pozornosti zlasti bolnikom z oslabljeno imunostjo”,ob-svetovnem-dnevu-sepse-poziv-k-pozornosti-zlasti-bolnikom-z-oslabljeno-imunostjo,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1737899768,1737899843
1093,15534,”Ob svetovnem dnevu Alzheimerjeve bolezni izpostavili porast obolenj z demenco”,”Število oseb z demenco v Sloveniji vztrajno narašča”,”
Ljubljana, 16. septembra – Število oseb z demenco v Sloveniji vztrajno narašča, je na novinarski konferenci ob svetovnem dnevu Alzheimerjeve bolezni povedala sodelavka Nacionalnega inštituta za javno zdravje (NIJZ) Mercedes Lovrečič. S povečanim številom oseb z demenco je povezan tudi vse višji strošek zdravljenja in oskrbe.
Porast obolenj z demenco je povezan zlasti s hitrim staranjem družbe. “Demenca ni naravni pojav starosti, temveč bolezen možganov,” je poudarila Lovrenčič. S starostjo se tveganje za razvoj demence zgolj poveča. Pri starejših od 65 let je stopnja tveganja pet odstotokov, pri starejših od 85 let pa kar 30 odstotkov.
Po prvotni oceni NIJZ naj bi zdravljenje in oskrba oseb z demenco povzročala skupne stroške v višini nekaj sto milijonov evrov letno. Ti stroški se porazdelijo med zdravstvene ustanove, socialne storitve ter oskrbovalce oseb z demenco. Največji del stroškov nosijo oskrbovalci, v večini primerov so to družinski člani. “Domači skrbi za bližnje z demenco v povprečju namenijo vsaj pet ur dnevno. Zanje ni prostih dni, nimajo prostih sobot in nedelj,” je izpostavila Lovrenčič.
Učinkovitih zdravil za demenco še ni, nekatera zdravila zgolj pomagajo lajšati simptome bolezni, je na novinarski konferenci izpostavila upokojena nevrologinja Vida Drame Orožim. “Vzroki za obolenje so raznoliki, mednje spadajo genetski dejavniki, raznolike okužbe in obolenja srčno-žilnega sistema,” je še dodala. Zato priporoča, da se posebno pozornost posveča zdravemu prehranjevanju, ustreznim spalnim navadam in rednemu gibanju.
Svetovni dan Alzheimerjeve bolezni zaznamujemo 21. septembra. Alzheimerjeva bolezen je najpogostejši vzrok demence, ki prizadene človekove možgane, to pa vpliva na posameznikove motnje spomina, spremembe v razpoloženju in vedenju, težave z mišljenjem ali govorom.
“,”Jaka Verbic Miklic”,1726491600,1726491600,sl,15534,306,15533,43,0,NULL,,”Ob svetovnem dnevu Alzheimerjeve”,ob-svetovnem-dnevu-alzheimerjeve,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1737900439,1737900439
1094,15536,”V presejalnem programu za preprečevanje raka na želodcu 14 odstotkov pozitivnih testov”,”V okviru presejalnega pilotnega programa za preprečevanje raka na želodcu so v ZD Ljubljana približno 1600 pacientov že testirali na okužbo s Helicobacter pylori.”,”
Ljubljana, 24. septembra – V okviru presejalnega pilotnega programa za preprečevanje raka na želodcu so v ZD Ljubljana približno 1600 pacientov že testirali na okužbo s Helicobacter pylori. Med njimi beležijo 14-odstotni delež pozitivnih rezultatov. V ZD Ljubljana in NIJZ ob tem vabijo vse, ki so prejeli vabilo za testiranje, da se nanj odzovejo.
Nacionalni inštitut za javno zdravje (NIJZ) je v sodelovanju z Zdravstvenim domom (ZD) Ljubljana januarja začel pilotni projekt presejanja in zdravljenja okužbe z bakterijo Helicobacter pylori za preprečevanje raka želodca. Ta poteka v okviru evropskega projekta Togas, katerega cilj je prispevati k izboljšanju in krepitvi zdravja v EU z zmanjšanjem bremena, ki ga povzroča rak želodca.
Kot je na današnji novinarski pojasnila Tatjana Kofol Bric z NIJZ, v ZD Ljubljana raziskava poteka na naključnem vzorcu 6200 pacientov v starosti 30 do 34 let, opredeljenih v ambulantah družinske medicine. Na pisno vabilo se je od marca letos odzvalo 2206 oseb, kar je 35,6-odstotna odzivnost. Želijo pa doseči 50-odstotno odzivnost, zato vabijo vse, ki so prejeli vabilo, da se nanj odzovejo, so njene besede povzeli v sporočilu ZD Ljubljana.
Od prijavljenih je okrog 1600 ljudi že opravilo odvzem krvi za testiranje na okužbo s Helicobacter pylori. Več kot 1300 jih je že prejelo informacijo, da niso okuženi s to bakterijo, na testiranju krvi pa beležijo 14-odstotni delež pozitivnih rezultatov. Pri 200 pacientih so že opravili dihalni test, s katerim potrdijo akutno okužbo. Ta je bila potrjena pri 88 odstotkih teh pacientov.
Tiste s pozitivnim dihalnim testom zdravijo s terapijo dveh antibiotikov, zaviralca protonske črpalke in bizmuta, je pojasnila družinska zdravnica iz ZD Ljubljana Špela Tevžič. Doslej je zdravljenje opravilo 130 pacientov. Po besedah Tevžič jih je 74 že opravilo kontrolni dihalni test, ki je pokazal, da je shema zdravljenja zelo učinkovita, kar 98-odstotna.
Zdravljenje sicer občutno zmanjša tveganje za razvoj raka želodca, saj v skoraj 90 odstotkih prepreči njegov nastanek. Z zdravljenjem okužbe zmanjšajo možnost za nastanek razjede na želodcu in dvanajstniku, gastritisa, dispepsije in raka na želodcu.
Predsednica združenja EuropaColon Ivka Glas pa je poudarila pomen pravočasnega odkritja okužbe pri preprečevanju raka želodca. Kot je poudarila, mnogi prepozno obiščejo svojega zdravnika, posebej zato ker simptomi niso izraziti. Kar 80 odstotkov vseh okuženih je namreč brez simptomov. V omenjenem združenju pričakujejo, da bo to testiranje bistveno pripomoglo k hitrejšemu odkrivanju in zdravljenju bolezni, so še sporočili iz ZD Ljubljana.
“,”Jaka Verbic Miklic”,1727183520,1727183520,sl,15536,306,15535,43,0,NULL,,”V presejalnem programu za preprečevanje raka na želodcu 14 odstotkov pozitivnih testov”,v-presejalnem-programu-za-preprecevanje-raka-na-zelodcu-14-odstotkov-pozitivnih-testov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1737900858,1737900858
1095,15538,”Ob dnevu slovenskih lekarn o zdravljenju s tarčnimi zdravili”,”V sporočilu za javnost so zapisali, da gre za nov in sodoben pristop k zdravljenju bolezni”,”
Ljubljana, 26. septembra – Slovensko farmacevtsko društvo in Lekarniška zbornica Slovenije danes organizirata 20. dan slovenskih lekarn. Letos posebej izpostavljajo zdravljenje s tarčnimi zdravili, ki omogočajo bolj natančno in selektivno zdravljenje tudi najtežjih bolezni. V sporočilu za javnost so zapisali, da gre za nov in sodoben pristop k zdravljenju bolezni.
“Pri zdravljenju s tarčnimi zdravili govorimo o personalizirani medicini oziroma načinu zdravljenja, ki je najbolj primerno za določenega bolnika. Glavni prednosti zdravljenja s tarčnimi zdravili sta natančnost in selektivnost, pomembno prednost pa predstavlja tudi prilagajanje odmerkov zdravil glede na aktivnost bolezni,” so povzeli besede predsednice lekarniške zbornice Darje Potočnik Benčič.
Tarčna zdravila so tako pogost način zdravljenja raka, vnetnih bolezni, kot so revmatoidni artritis, kronična vnetna črevesna bolezen, astma in luskavica, hiperholesterolemije, osteoporoze, multiple skleroze in migrene. Običajno jih predpišejo bolnikom z resnimi bolezenskimi stanji in kadar s standardnim zdravljenjem ne dosežejo zazdravitve bolezni ali izboljšanja zdravstvenega stanja.
V Sloveniji veljajo natančno izdelana merila, kdaj je zdravljenje s tarčnimi zdravili primerno. “Ob predpisu in izdaji tarčnih zdravil bolniki prejmejo natančne napotke zdravnika in farmacevta o ravnanju z njimi, odmerjanju, načinu aplikacije in ukrepih ob pojavu neželenih učinkov,” je povedala predsednica sekcije farmacevtov javnih lekarn pri Slovenskem farmacevtskem društvu Maša Koritnik Zadravec.
Dodala je, da se bolniki lahko v lekarni tudi pogovorijo s farmacevtom o pravilnem jemanju zdravil. Pomembno pa je, da bolniki zdravila redno uporabljajo ter pravočasno obiščejo zdravnika za nov predpis recepta in pravočasno naročijo zdravila v lekarni.
V društvu in zbornici opozarjajo, da se uspešnost zdravljenja razlikuje od posameznika do posameznika, saj niso vsa tarčna zdravila primerna za vse. Učinkovitost je odvisna od stopnje napredovanja bolezni, fiziološkega stanja bolnika in njegove genske zasnove.
Ob dnevu slovenskih lekarn je društvo izdalo knjižico z naslovom O pravilni in varni uporabi zdravil: Tarčna zdravila, v kateri so zbrane preverjene informacije o zdravljenju s tarčnimi zdravili. Knjižice bodo obiskovalci prejeli v lekarni.
“,”Jaka Verbic Miklic”,1727356740,1727356740,sl,15538,306,15537,43,0,NULL,,”Ob dnevu slovenskih lekarn o zdravljenju s tarčnimi zdravili”,ob-dnevu-slovenskih-lekarn-o-zdravljenju-s-tarcnimi-zdravili,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1737901273,1737901273
1096,15540,”V rožnati oktober s kampanjo Pretipaj še svoje”,”Po podatkih registra raka je v obdobju 2017-2021 v Sloveniji povprečno letno za rakom dojk zbolelo 1504 žensk, umrlo pa 446″,”
Ljubljana, 30. septembra – Združenje Europa Donna Slovenija v rožnati oktober vstopa s kampanjo Pretipaj še svoje, ki poudarja pomen preventive in zgodnjega odkrivanja raka dojk. Ta je namreč, če je odkrit dovolj zgodaj, dobro ozdravljiv, so povedali na novinarski konferenci. Ob tem so izpostavili pomen rednega mesečnega samopregledovanja in presejalnih programov.
Kljub temu je z zgodnjim odkrivanjem in napredki v zdravljenju ozdravljivost raka dojk izjemno visoka. “Zato je pomembno, da ženska pozna svoje dojke in ve, kaj je zanje običajno. Tako lažje opazi morebitne spremembe med rednim samopregledovanjem dojk,” je pojasnila vodja programa Dora Barbara Mihevc Ponikvar in spomnila na uspešen državni presejalni program za raka dojk Dora. V program so vključene ženske med 50. in 69. letom starosti, ki jih vsaki dve leti povabijo na mamografijo.
“V programu se trudimo biti ženskam prijazni in jim nudimo zdravstvene storitve na najvišji stopnji kakovosti. Letos v prvi polovici leta beležimo že 79-odstotno udeležbo žensk, kar je največ doslej. Ravno v teh dneh bomo opravili že milijonto mamografijo od začetka delovanja programa leta 2008. Ob tej priložnosti se ženskam zahvaljujemo za zaupanje,” je še dodala Mihevc Ponikvar.
Kot je izpostavila, je mamografija še vedno strokovno dokazano najbolj zanesljiva metoda za zgodnje odkrivanje raka dojk in najbolj primerna za organizirano presejanje. S tem so v programu Dora od začetka delovanja leta 2008 odkrili raka dojk pri okoli 6000 ženskah, večinoma na začetni stopnji, ko je bolezen omejena na dojko.
“Odkrivanje raka dojk na začetni stopnji bolezni praviloma pomeni večjo možnost ozdravitve bolnice. Obenem zgodaj odkriti rak dojk omogoča manj obsežno kirurško zdravljenje, pri čemer pa bolnici zagotovimo enako dobre možnosti za ozdravitev,” je poudaril kirurg Janez Žgajnar z Onkološkega inštituta Ljubljana.
Pri kirurškem zdravljenju bolnic, pri katerih je bil rak dojk odkrit v presejalnem programu, je večji delež ohranitev dojk in manj odstranitev vseh pazdušnih bezgavk kot pri bolnicah izven programa Dora, je pojasnil in dodal, da je z manj obsežnim zdravljenjem kakovost življenja bolnic večja.
Predsednica Združenja Europa Donna Slovenija Tanja Španić je predstavila lokalne dogodke združenja in sodelovanja s podjetji v rožnatem oktobru, s katerimi širijo ključna sporočila osveščanja o raku dojk. V združenju po njenih besedah začenjajo še en rožnati oktober, ko želijo ponovno izpostaviti pomen zdravega načina življenja in zgodnjega odkrivanja raka dojk.
“Pomembno je, da ženske ne le slišijo naša sporočila, temveč jih tudi vključijo v svoje vsakdanje življenje, saj je zgodnja diagnoza raka dojk povezana z večjimi možnostmi za uspešno zdravljenje. Zavedanje pomena preventivnih ukrepov in pravočasno ukrepanje lahko rešita življenje,” je še dodala.
“,”Jaka Verbic Miklic”,1727702520,1727702520,sl,15540,306,15539,43,0,NULL,,”V rožnati oktober s kampanjo Pretipaj še svoje”,v-roznati-oktober-s-kampanjo-pretipaj-se-svoje,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1737901469,1737901469
1097,15542,”Strokovnjaki priporočajo cepljenje proti gripi”,”Cepljenje priporočajo vsem starejšim od šest mesecev.”,”
Ljubljana, 4. oktobra – Strokovnjaki pred sezono gripe opozarjajo, da gre za zelo nalezljivo bolezen, ki se zelo lahko širi med ljudmi. Poudarjajo, da je zdaj idealen čas za cepljenje proti gripi, ki je najučinkovitejši ukrep za zaščito pred boleznijo, predvsem pa učinkovito ščiti pred težkimi poteki in zapleti gripe. Cepljenje priporočajo vsem starejšim od šest mesecev.
Cepljenje proti gripi je brezplačno, posebej pomembno pa je, da se cepijo starejši, kronični bolniki, majhni otroci, nosečnice in osebe z izrazito povečano telesno težo. Cepljenje priporočajo tudi vsem z večjim tveganjem za okužbo na delovnem mestu, predvsem zdravstvenim delavcem, in tistim, ki so pri delu v stikih z drugimi ljudmi, kot so zaposleni v vzgoji in izobraževanju.
Cepljenje ob zmanjšanem tveganju za težji potek bolezni in zaplete zmanjšuje tudi tveganje za hospitalizacijo in smrt zaradi gripe.
“Pomembno je, da se cepimo vsako leto, ker se virusi gripe spreminjajo in je vsako leto cepivo pripravljeno na način, da vsebuje oziroma pokrije tiste viruse, za katere svetovna zdravstvena organizacija predvidi, da bodo krožili v naslednji sezoni,” je spomnila Grgič Vitek.
Opozorila je, da je precepljenost proti gripi v Sloveniji žal zelo nizka, v najboljših sezonah okoli deset odstotkov. “Še bolj zaskrbljujoče je, da je nizka precepljenost tudi med starejšimi,” je povedala. Svetovna zdravstvena organizacija za starejše od 65 let priporoča precepljenost okrog 75 odstotkov, v Sloveniji pa se je lani cepilo le 17 odstotkov starejših od 65 let.
Vodja službe za preprečevanje in obvladovanje bolnišničnih okužb v Univerzitetnem kliničnem centru (UKC) Ljubljana Tatjana Mrvič je dodala, da gripa “ni navadna viroza”, ampak jo lahko spremljajo številni zapleti. Pri majhnih otrocih so to običajno dehidracija, vročinski krči, vnetje srednjega ušesa in pljučnica. Pri starostnikih, sploh kroničnih bolnikih, lahko pride do zapletov na dihalih, kot je pljučnica, ali bakterijskih okužb. V sezoni gripe je v UKC Ljubljana povprečno hospitaliziranih med 500 in 600 bolnikov.
Družinski zdravnik iz Zdravstvenega doma Ljubljana Leon Kranjec je poudaril, da naj se ob starejših in kroničnih bolnikih cepijo tudi njihovi svojci in oskrbovalci. “S tem zmanjšamo možnost, da do okužbe pride s prenašanjem virusa domov,” je dejal. Dodal je, da so svojci velikokrat edini oskrbovalci starejših in če zbolijo, ni nikogar, ki bi jih negoval.
Cepivo so že razdelili v cepilne centre, cepiti pa se je med drugim mogoče v ambulantah družinskih zdravnikov, v cepilnih centrih in na območnih enotah NIJZ.
Hkrati s cepljenjem proti gripi na NIJZ priporočajo tudi cepljenje proti pnevmokoknim okužbam, ki je brezplačno za kronične bolnike in starejše od 65 let, opravi pa se enkrat. Svetujejo tudi cepljenje proti covidu-19.
Sezona gripe se sicer še ni pričela, prav tako ne sezona okužb z respiratornim sincicijskim virusom (RSV). Trenutno so povzročitelji akutnih okužb dihal predvsem sars-cov-2, rinovirusi, enterovirusi in virusi parainfluence, je povedala Grgič Vitek.
“,”Jaka Verbic Miklic”,1728048420,1728048420,sl,15542,306,15541,43,0,NULL,,”Strokovnjaki priporočajo cepljenje proti gripi”,strokovnjaki-priporocajo-cepljenje-proti-gripi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1737901739,1737901927
1098,15544,”Rdeči križ ob svetovnem dnevu oživljanja opozarja na pomen izobraževanja o prvi pomoči”,”Hkrati izpostavljajo pomen poznavanja temeljnih postopkov oživljanja z uporabo avtomatskega eksternega defibrilatorja (AED).”,”
Ljubljana, 16. oktobra – Ob današnjem svetovnem dnevu oživljanja je med drugim v ospredju vprašanje dostopa do izobraževanja s področja prve pomoči, so v sporočilu za javnost zapisali na Rdečem Križu Slovenije (RKS). Hkrati izpostavljajo pomen poznavanja temeljnih postopkov oživljanja z uporabo avtomatskega eksternega defibrilatorja (AED).
RKS je tekom meseca prve pomoči, ki se je sklenil z današnjim svetovnim dnem oživljanja, opozarjal na pomen dostopnosti znanja in veščin prve pomoči ne glede na starost. Med izvajanjem več delavnic so opazili, “da si ljudje vseh generacij želijo poznati vsaj osnove temeljnih postopkov oživljanja”.
Po podatkih Zdravstvenega doma Ljubljana več kot 1500 oseb na leto doživi srčni zastoj, od tega se 60 odstotkov srčnih zastojev zgodi doma. Pri reševanju oseb, ki doživijo srčni zastoj, lahko največ prispevajo očividci, ki znajo pravilno ukrepati v prvih petih minutah, so opozorili v zavodu. “V prvih kritičnih minutah so očividci pogosto edini prisotni, zato je njihovo hitro in pravilno ukrepanje ključno za preživetje osebe, ki je doživela srčni zastoj,” so poudarili.
V okviru svetovnega dneva oživljanja bo po Sloveniji potekalo več dogodkov. V Splošni bolnišnici Jesenice bodo med 9. in 12. uro s študenti Fakultete za zdravstvo Angele Boškin pokazali temeljne postopke oživljanja.
Praktični prikaz oživljanja odraslega in otroka bodo v organizaciji Sekcije reševalcev v zdravstvu opravili tudi v preddverju dvorane državnega sveta. Poleg tega bodo demonstrirali uporabo defibrilatorja AED.
V ljubljanskem zdravstvenem domu pa bodo z Zavodom Varna pot ob 12.30. uri prikazali temeljne postopke oživljanja in prvo pomoč ob simulaciji prometne nesreče.
“,”Jaka Verbic Miklic”,1729085640,1729085640,sl,15544,306,15543,43,0,NULL,,”Rdeči križ ob svetovnem dnevu oživljanja opozarja na pomen izobraževanja o prvi pomoči”,rdeci-kriz-ob-svetovnem-dnevu-ozivljanja-opozarja-na-pomen-izobrazevanja-o-prvi-pomoci,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1737902165,1737902992
1099,15546,”V programu Dora opravili milijon mamografij”,”Doslej so s presejalno mamografijo od začetka delovanja Dore raka dojk odkrili pri okoli 6000 ženskah”,”
Ljubljana/Ptuj, 18. oktobra – Tik pred začetkom meseca ozaveščanja o raku dojk rožnati oktober so konec septembra v okviru državnega presejalnega programa za raka dojk Dora opravili milijonto mamografijo. Doslej so s presejalno mamografijo od začetka delovanja Dore raka dojk odkrili pri okoli 6000 ženskah, so sporočili z Onkološkega inštituta Ljubljana.
Milijonto mamografijo so opravili v Splošni bolnišnici (SB) Ptuj. Ženske, ki rentgensko slikanje dojk opravijo v tamkajšnjem presejalnem centru programa Dora in jim radiologi na mamografskih slikah odkrijejo sumljive spremembe, napotijo na dodatno obravnavo v presejalno-diagnostični center programa Dora v Univerzitetni klinični center Maribor.
Odziv vabljenih žensk v ptujski center je zelo dober. V zadnjih letih se je namreč presejalne mamografije udeležilo 79 odstotkov vseh povabljenih žensk, v letošnjem letu pa celo 85 odstotkov, kar je ena izmed najvišjih udeležb v Sloveniji. Od začetka delovanja programa Dora v SB Ptuj leta 2015 so opravili že več kot 45.000 mamografij in pri več kot 200 ženskah odkrili raka dojk. Večina odkritih rakov je bilo majhnih in omejenih na dojke, so pojasnili na inštitutu.
“Veseli smo, da smo ravno v našem centru zabeležili milijonto mamografijo, in da nas je gospa, pri kateri smo opravili milijonto mamografijo, še enkrat obiskala ob današnji obeležitvi pomembnega mejnika, ki smo ga uspeli doseči v 16 letih delovanja programa Dora v Sloveniji,” je po navedbah inštituta povedala vodja presejalnega centra programa Dora v SB Ptuj Barbara Brlek.
Program Dora po Sloveniji deluje na 19 lokacijah. Vanj so vključene vse ženske med 50. in 69. letom starosti, ki jih vsaki dve leti povabijo na presejalno mamografijo. Dolgoročni cilj programa je zmanjšanje umrljivost žensk zaradi raka dojk med 50. in 69. letom za od 25 do 30 odstotkov.
Po rezultatih dela se program Dora uvršča v sam vrh evropskih držav in kot evropski primer dobre prakse presejanja sodeluje kot učni center za države, kjer presejalne programe šele vzpostavljajo, so izpostavili na onkološkem inštitutu. V zadnjih letih se ga na ravni države udeležuje že več kot 77 odstotkov vseh povabljenih žensk.
S presejalno mamografijo, ki je še vedno strokovno dokazano najbolj zanesljiva metoda za zgodnje odkrivanje raka dojk in najbolj primerna za organizirano presejanje, so v programu od začetka delovanja leta 2008 odkrili raka dojk že pri okoli 6000 ženskah, večinoma v začetni stopnji, ko je zdravljenje praviloma manj obsežno in zelo uspešno.
“,”Jaka Verbic Miklic”,1729259220,1729259220,sl,15546,306,15545,43,0,NULL,,”V programu Dora opravili milijon mamografij”,v-programu-dora-opravili-milijon-mamografij,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1737902979,1737902979
1100,15548,”V Sloveniji za rakom vsako leto zboli več kot 8000 moških”,”Vemo, da so moški še vedno manj pozorni na lastno zdravje, zato je takšna akcija, kot je Movember”,”
Ljubljana, 6. novembra – Po podatkih Registra raka Republike Slovenije, ki deluje na Onkološkem inštitutu, v Sloveniji za rakom vsako leto zboli več kot 8000 moških. Najpogostejša raka pri moških sta nemelanomski kožni rak in rak prostate. Med bolj pogostimi sta tudi pljučni rak ter rak debelega črevesa in danke, pri mlajših moških pa rak mod, so navedli na inštitutu.
“Vemo, da so moški še vedno manj pozorni na lastno zdravje, zato je takšna akcija, kot je Movember, ko cel mesec poudarjamo pomembnost in spodbujamo k odgovornosti do skrbi za zdravje, izjemnega pomena,” so na inštitutu in v državnem programu obvladovanja raka v današnji izjavi za javnost povzeli besede vodje multidisciplinarnega tima za raka prostate na Onkološkem inštitutu Ljubljana in vodje strokovne skupine za raka prostate pri Državnem programu obvladovanja raka (DPOR) Janke Čarman.
Podatki kažejo, da bo med rojenimi leta 2021 do svojega 75. leta starosti za rakom predvidoma zbolel vsak drugi moški. Zato je nujno, da vsakdo pozna dejavnike tveganja za nastanek, prepozna morebitne simptome, se na njih hitro odziva in se redno udeležuje presejalnega programa Svit, poudarjajo v izjavi.
“Preventiva in zgodnje odkrivanje bolezni namreč pomenita boljši izid zdravljenja, večjo verjetnost preživetja in boljšo kakovost življenja, ne samo v času zdravljenja, temveč tudi kasneje v življenju,” izpostavlja Čarman.
V letu 2021 je v Sloveniji za rakom prostate zbolelo 1617 moških, umrlo pa 487. Za rakom mod je v letu 2021 zbolelo 122 moških, umrlo sedem, za pljučnim rakom pa je v tem letu zbolelo 945 moških, umrlo pa 723.
Strokovnjaki Onkološkega inštituta Ljubljana in Državnega programa obvladovanja raka moškim svetujejo odločitev za zdrav življenjski slog, redno samopregledovanje mod in redno udeležbo v presejalnem programu Svit.
“,”Jaka Verbic Miklic”,1730904840,1730904840,sl,15548,306,15547,43,0,NULL,,”V Sloveniji za rakom vsako leto zboli več kot 8000 moških”,v-sloveniji-za-rakom-vsako-leto-zboli-vec-kot-8000-moskih,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1737903338,1737903338
1101,15550,”Dopis organizatorjem strokovnih dogodkov – marec 2024″,” “,”
Zdravniška društva in drugi organizatorji dogodkov
Ljubljana, 27.3.2024
Zadeva: Pojasnila Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb glede organizacije ali podpore strokovnih dogodkov in srečanj
Spoštovani,
Sodelovanje med farmacevtsko industrijo in zdravstveno skupnostjo je izjemno pomembno za zagotavljanje kakovostne zdravstvene oskrbe ter nujni pogoj za razvoj inovativnih zdravil in metod zdravljenja v dobro bolnikov. Raziskovanje, razvoj in uvajanje novih, inovativnih zdravil v klinično prakso namreč niso mogoči brez sodelovanja z zdravstvenimi delavci, zdravstvenimi organizacijami in drugimi deležniki. Zavedamo se pomembnosti prenosa znanja med zdravstvenimi delavci, pa tudi izzivov pri organiziranju strokovnih dogodkov. V ta namen družbe članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb nudijo podporo pri organizaciji strokovnih dogodkov in pri njih tudi sodelujejo.
Farmacevtska industrija velja za eno najbolj reguliranih panog, poleg tega pa že vrsto let potekajo tudi aktivnosti na področju samoregulacije. Za najvišje etične standarde se zavzema tudi Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb (v nadaljevanju: »FarmaForum«), ki s Kodeksom ravnanja vse članice zavezuje k etičnemu in transparentnemu poslovanju. Družbe članice FarmaForuma so dolžne spoštovati določila Kodeksa ravnanja. Zato so dolžne pred odobritvijo podpore strokovnega srečanja oceniti ali sta tako vsebina dogodka kot tudi lokacija dogodka skladna z določili Kodeksa ravnanja.
Namen tega dopisa je podrobneje pojasniti, kaj se po Kodeksu šteje za razumno gostoljubnost in kakšne so v praksi omejitve naših članic pri podpori dogodkov.
Kodeks ravnanja prepoveduje organizacijo ter finančno ali drugačno podporo pri organizaciji promocijskih, znanstvenih ali strokovnih srečanj, kongresov, konferenc, simpozijev in drugih sorodnih dogodkov (v nadaljevanju: dogodek), ki vsebujejo gostoljubnost za udeležence, ki presega razumno raven in/ali glavni namen dogodka.
Uvodoma izpostavljamo, da na dogodkih, ki jih podpirajo naše članice, ni dovoljeno zagotavljati nobenega samostojnega razvedrila ter drugih interesnih ali družabnih dejavnosti. Ob povedanem želimo pojasniti, da se za namen Kodeksa pod pojmoma “samostojno razvedrilo” ali “druga interesna ali družabna dejavnost” šteje vsaka zabavna, umetniška, kulturna ali plačljiva športna dejavnost, ki je posebej omenjena v programu dogodka in se organizira pred, med ali po izvedbi strokovnega programa in ni namenjena podpori strokovnim vsebinam. Gornja pojma na primer vključujeta organizirane večurne zabave pred začetkom ali po zaključku dogodka, ki presegajo pozdravno srečanje udeležencev brez posebnih razkošnih pogostitev ali razvedrila, koncerte, gledališke predstave, ogled športnih prireditev ali športna dejavnost, za katero se običajno plačuje znesek za udeležbo – na primer smučanje, golf in podobno.
Nadalje želimo izpostaviti, da se bo, tudi če v programu ni posebej omenjeno, za samostojno razvedrilno dejavnost štel vsak nastop, ki se sicer samostojno trži kot plačljiva zabavna, umetniška ali kulturna prireditev. Kot praktičen primer lahko navedemo nastop pianista ali komika, ki svoje nastope (bodisi posamično ali v skupini) sicer tudi komercialno trži na način, da je obiskovalcem za ogled potrebno plačati vstopnino. Za samostojno razvedrilo se tako na primer ne bo štela glasbena spremljava ob večerji, ki jo izvaja manj znan glasbenik, tudi če njegov nastop organizator dogodka ali ponudnik večerje honorira, pod pogojem da tak glasbenik za svoje nastope običajno ne prodaja vstopnic.
Na splošno je potrebno upoštevati tudi vodilo, da je članicam dovoljeno finančno ali drugače podpreti le dogodke, pri katerih izkazano gostoljubje ne presega ravni, za katero se predvideva, da bi bili zanjo v podobnih okoliščinah zdravstveni delavci pripravljeni plačati tudi sami. Tako je sprejemljivo, če se na dogodku ponudi razumna prehrana za udeležence ali osvežitev s kavo in osvežilnimi napitki, pod pogojem, da je takšna pogostitev sekundarna glavnemu namenu srečanja in se ne nudi osebam, ki niso udeleženci dogodka – na primer spremljevalcem udeležencev.
V zadnjem času je opaziti, da se organizatorji strokovnih dogodkov odločajo za izvedbo dogodkov na lokacijah, ki niso skladne z določili Kodeksa ravnanja. Zato v nadaljevanju povzemamo določila Kodeksa ravnanja.
ČLEN 10 – DOGODKI IN GOSTOLJUBNOST
10.01. Vsi dogodki, ki jih organizira ali sponzorira članica, morajo biti organizirani na “primernem kraju” in “primerni lokaciji”, ki ustreza glavnemu namenu dogodka, stroški pa se krijejo le, če je to primerno in v skladu z zakonsko omejenimi zneski ter določbami tega Kodeksa.
“Primeren” kraj v smislu te točke je kraj, ki je večini udeležencev najlažje dostopen in ima dostopne kapacitete za izvedbo dogodka.
“Primerna” lokacija v smislu te točke pomeni katero koli lokacija, ki se običajno uporablja za organizacijo podobnih dogodkov, z izjemo “razvedrilnih” ali “razkošnih” lokacij.
“Razvedrilna” lokacija v smislu te točke pomeni lokacijo, ki je znana zlasti po zagotavljanju posebnih vrst zabave (kar ni tipična kongresna dejavnost), kot sta na primer igralnica in igrišče za golf.
“Razkošna” lokacija v okviru te točke pomeni hotel s kategorizacijo 5* ali podoben objekt luksuzne kategorije, pri čemer se šteje, da je kategorizacija kongresnih kapacitet na posamezni lokaciji enaka kategorizaciji hotela ali objekta, v ali neposredno ob katerem se nahajajo.
Dodatno pojasnilo glede kategorizacije »razkošna«:
Vljudno vas vabimo na internetno stran FarmaForuma, kjer je na voljo Kodeks ravnanja, ki opredeljuje tako določila kot tudi etična načela, ki so jih družbe članice dolžne upoštevati in spoštovati. Kodeks ravnanja je dosegljiv tule: https://www.farmaforum.si/sl/o-forumu/kodeksi/forumov-kodeks-ravnanja
V upanju, da smo dovolj nazorno pojasnili omejitve, ki skladno s Kodeksom ravnanja zavezujejo naše članice, vas lepo pozdravljamo in vam želimo veliko uspeha pri organizaciji prihodnjih dogodkov, na katerih bodo naše članice v skladu z zgornjimi načeli še naprej pripravljene sodelovati in jih podpirati.
S prijaznimi pozdravi
mag. Barbara Stegel Jurij Stariha
generalna sekretarka predsednik uprave
“,”Jaka Verbic Miklic”,1738166220,1738166220,sl,15550,306,15549,43,0,NULL,,”Dopis organizatorjem strokovnih dogodkov – marec 2024″,dopis-organizatorjem-strokovnih-dogodkov-marec-2024,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,1,1,1738166350,1738254846
1103,15554,”Informacija in opozorilo Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb o ravnanju v primeru spremembe statusa lokacije dogodkov in konkreten primer”,” “,”
Zdravniška društva in drugi organizatorji dogodkov
Ljubljana, 30. 1. 2025
Zadeva: Informacija in opozorilo Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb o ravnanju v primeru spremembe statusa lokacije dogodkov in konkreten primer
Spoštovani,
Kot smo vas že obvestili (glejte dopis z dne 27. 3. 2024 – TUKAJ ), je sodelovanje med farmacevtsko industrijo in zdravstveno skupnostjo izjemnega pomena za zagotavljanje kakovostne zdravstvene oskrbe in njen razvoj v dobro bolnikov.
V Mednarodnem forumu znanstvenoraziskovalnih farmacevtskih družb (v nadaljevanju: »FarmaForum«) se tega še posebej zavedamo. Zato tako mi kot tudi naše članice aktivno podpiramo in organiziramo strokovna srečanja, namenjena prenosu znanja o zdravilih in strokovnih vsebinah.
Hkrati smo predani zagotavljanju najvišjih etičnih standardov, saj je etičnost sodelovanja med medicinsko stroko in farmacevtsko industrijo ključnega pomena za ohranjanje zaupanja javnosti v zdravstveni sistem. Naše članice se zavezujemo k spoštovanju Kodeksa ravnanja, ki zagotavlja transparentno in etično poslovanje. Vabimo vas, da si določbe Kodeksa ogledate ali jih osvežite na naslednji povezavi: https://www.farmaforum.si/sl/o-forumu/kodeksi/forumov-kodeks-ravnanja
Pomembnost skladnosti s Kodeksom ravnanja:
Naše članice so zavezane, skladno s Kodeksom ravnanja, ocenjevati ustreznost vsebine in lokacije strokovnih dogodkov pred odobritvijo njihovega sodelovanja. Pri tem opozarjamo, da lahko spremembe v statusu lokacije vplivajo na njeno ustreznost. Na primer, hotel, ki je bil prej kategoriziran kot 4*, lahko pridobi kategorizacijo 5*, ali pa se v okviru objekta odpre igralnica ali igrišče za golf. V takih primerih lokacija ne ustreza več določilom Kodeksa, zato naše članice na njej ne bodo več smele podpreti organizacije strokovnih dogodkov.
Sprememba statusa hotela Four Points by Sheraton – hotel MONS:
Zaradi odprtja igralnice v sklopu hotela Four Points by Sheraton (hotel MONS) ob zahodni ljubljanski obvoznici, ki je pričela obratovati septembra 2024, ta lokacija od 20. junija 2025 ne velja več za primerno za organizacijo strokovnih dogodkov. Dogodkov, ki bi potekali na tej lokaciji po tem datumu naše članice ne bodo smele niti organizirati niti podpreti.
Zavedamo se, da lahko tovrstne spremembe za organizatorje dogodkov predstavljajo dodaten izziv, vendar verjamemo, da boste našli ustrezne alternative, ki bodo skladne z etičnimi smernicami FarmaForuma.
V primeru, da ste v dvomih glede tovrstnih vprašanj, nas vedno lahko kontaktirate na elektronski naslov office@farmaforum.si in se z nami posvetujete.
Lepo vas pozdravljamo in vam želimo veliko uspeha pri organizaciji prihodnjih strokovnih dogodkov.
Naše članice bodo z veseljem sodelovale in jih podpirale, če bodo izpolnjevali zgoraj navedene pogoje.
S spoštovanjem,
mag. Barbara Stegel
in
Tjaša Burnik
generalna sekretarka predsednica uprave
“,”Jaka Verbic Miklic”,1738254420,1738254420,sl,15554,306,15553,43,0,NULL,,”Informacija in opozorilo Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb o ravnanju v primeru spremembe statusa “,informacija-in-opozorilo-mednarodnega-foruma-znanstvenoraziskovalnih-farmacevtskih-druzb-o-ravnanju-v-primeru-spremembe-statusa-,Post,”/sites/43/files/images/O nas/Predpisi/Predpisi.jpg”,1,0,1738254457,1749395734
1104,15556,”SPOROČILO ZA MEDIJE: Izzivi bolnikov z rakom in sledenje poznih posledic zdravljenja”,”Pri nas živi preko 130 tisoč oseb, ki so jim kadarkoli v življenju postavili diagnozo rak, vsako leto se tem osebam pridruži še 17 tisoč novo zbolelih bolnikov. “,”
SPOROČILO ZA MEDIJE
5. strateška konferenca Življenje z rakom – Izzivi bolnikov z rakom in sledenje poznih posledic zdravljenja
NA POTI K SISTEMSKI UREDITVI SPREMLJANJA POZNIH POSLEDIC ONKOLOŠKEGA ZDRAVLJENJA

Ljubljana – 5. februar 2025 – Včeraj je potekala 5. strateška konferenca Življenje z rakom – Izzivi bolnikov z rakom in sledenje poznih posledic zdravljenja, ki so jo soorganizirali Slovensko združenje organizacij bolnikov z rakom ONKO NET, Zdravniška zbornica Slovenije in Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb v Sloveniji. Ob svetovnem dnevu boja proti raku so organizatorji in udeleženci opozorili na številne izzive, s katerimi se soočajo bolniki z rakom v Sloveniji – tako v času zdravljenja kot tudi po njem. Pri nas živi preko 130.000 oseb, ki so jim kadarkoli v življenju postavili diagnozo rak, vsako leto se tem osebam pridruži še 17.000 novo zbolelih bolnikov.
Napredek v zdravljenju raka pomeni, da vse več bolnikov preživi, vendar zdravljenje pogosto prinaša dolgoročne posledice, ki zahtevajo sistematično spremljanje in obravnavo. Na konferenci so strokovnjaki, zagovorniki bolnikov, predstavniki plačnika in odločevalci razpravljali o tem, kako vzpostaviti celostno in trajnostno rešitev za spremljanje poznih posledic onkološkega zdravljenja. V uvodnem nagovoru je mag. Barbara Stegel, generalna sekretarka Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb v Sloveniji, poudarila, da je namen teh strateških konferenc slišati bolnike in obravnavati tiste teme, ki jih izpostavljajo sami. Pri tem se ji zdi najpomembnejše sodelovanje med organizacijami bolnikov in medicinsko stroko. »Nekatere izzive bolnikov smo v preteklosti že uspešno naslovili, ponosni smo, da je pravica do pozabe zagledala luč v zakonski obliki in da se delajo premiki na področju presajanja raka pljuč in prostate. Proučevali smo implementacijo načrta za reintegracijo v delovno okolje in celostno rehabilitacijo, danes nadaljujemo s temo, ki gre onkraj zdravljenja onkoloških obolenj, s spremljanjem in načrtnim odpravljanjem poznih posledic zdravljenja raka.«
Kristina Modic, predsednica Združenja slovenskih organizacij bolnikov z rakom ONKO NET in izvršna direktorica Slovenskega združenja bolnikov z limfomom in levkemijo, L & L, je opozorila, da se zdravljenje ne konča z zadnjo terapijo: »Uspešna zdravljenja so le del oskrbe bolnika. Pozne posledice zdravljenja lahko vplivajo na zdravje in kakovost življenja še vrsto let po zdravljenju. Prav zato je ključna celostna in dolgoročna obravnava bolnikov, da bi preprečili nove zaplete in dolgoročne zdravstvene težave.«. Čeprav se lahko Slovenija primerja z najbolj razvitimi državami Evrope, se na tem področju še vedno soočamo s številnimi izzivi, tako organizacijskimi, kadrovskimi, pa tudi finančnimi.«
Predsednica Zdravniške zbornice Slovenije (ZZS) prof. dr. Bojana Beović, dr. med., spec. infektologije, je izpostavila, da jo kot zdravnico in človeka veseli, da se beseda rak iz smrtne obsodbe spreminja v kronično bolezen. »To pa pomeni drugačno obravnavo bolnikov, ta se razširi, zato je zelo pomembno, da se te razširitve zaveda tudi družba.« Rak postaja bolezen, s katero živimo, tako kot živimo z drugimi kroničnimi boleznimi, je poudarila predsednica ZZS.
Sledenje poznim posledicam zdravljenja raka v praksi: Kje smo in kam gremo?
Ena izmed pionirk sledenja poznih posledic zdravljenja raka v Sloveniji, doc. dr. Lorna Zadravec Zaletel, dr. med., spec. onkologije in radioterapije, ki na Onkološkem inštitutu Ljubljana vodi enoto za ugotavljanje poznih posledic raka, je v svojem predavanju predstavila, kako je to področje pri nas sistemsko, z dokazi podprto in na podlagi strokovnih priporočil urejeno za vse, ki so se zdravili za rakom v otroštvu, adolescenci in mladi odrasli dobi, kjer imamo pri nas tudi dorečena priporočila sledenja. »Ti bolniki so za nastanek poznih posledic ogroženi v večji meri kot tisti, ki so zdravljeni v višji starosti. Tveganje za nastanek poznih posledic narašča z leti po končanem zdravljenju. S poznimi posledicami zdravljenja se sooči kar tri četrtine ljudi, ki so raka preboleli v otroštvu, kar je veliko.« Glede na podatke raziskav se pri treh četrtinah preživelih pojavi ena ali več somatskih posledic in ti so do šestkrat bolj ogroženi za nastanek novega raka v primerjavi z njihovimi vrstniki, med drugim pa je pri njih pomembno preprečevati tudi okvare kardiovaskularnega sistema, pomembne pa so tudi psihološke posledice diagnoze.
Vesna Homar, dr. med., spec. družinske medicine iz Združenja za družinsko medicino pri Zdravniškem društvu Slovenija je poudarila, da tudi odrasli, ki so imeli postavljeno diagnozo raka in so zaključili zdravljenje, potrebujejo posebno obravnavo zaradi možnosti ponovitve bolezni ter spremljanja dolgoročnih učinkov zdravljenja. Stroka si prizadeva, da bi spremljanje bolnikov iz rok onkologov po ustreznem času prenesli na primarno raven. »Kako si bomo to breme razdelili? Število ljudi, ki potrebujejo spremljanje narašča, kakovost spremljanja pa želimo ohraniti na visokem nivoju,« je poudarila družinska zdravnica in dodala, da bi bilo zato treba »za vsakega bolnika izdelati personalizirana navodila, ki bi jih prejel družinski zdravnik. Moramo vedeti, katerega raka so imeli bolniki, kakšno zdravljenje so prejeli in kako moramo glede na vse to spremljati vsakega bolnika posebej. Navodila morajo biti jasna in digitalno podprta.« Ob tem je pomembna aktivna vloga osveščenega bolnika in vključevanje socialne mreže, da bo spremljanje ustrezno.
Brina Žagar iz Slovenskega združenja bolnikov z limfomom in levkemijo, L & L, in Maja Sedej iz Združenja EuropaColon Slovenija sta delili dragocene osebne izkušnje spremljanja posledic zdravljenja. Maja Sedej je zdravljenje raka zaključila nedolgo nazaj, o poznih posledicah onkološkega zdravljenja pa se je prvič poučila v združenju EuropaColon. Izpostavila je, da je ključno, da se bolniki odzovejo na vsak poziv na kontrolni pregled. »Nujno je, da me po zaključku zdravljenja nekdo spremlja in opazuje moje telo. Odzvala se bom vsem povabilom na kontrolne preglede, nekateri so težji, drugi malce lažji, a to je treba narediti. Gre za tvoje življenje, za tvojo kvaliteto življenja po težki bolezni.« Brina Žagar je poudarila, da je njena izkušnja sledenja po končanem zdravljenju dobra, saj se vodi v enoti za sledenje poznih posledic zdravljenja na Onkološkem inštitutu, za prenekatere člane njihovega društva pa ni tako, saj so »če nimajo izbranega osebnega zdravnika, prepuščeni svoji iznajdljivosti.« Poudarila je, da je zato še toliko bolj pomembna ozaveščenost in angažiranost bolnika, vsem pa svetovala, naj poiščejo psihološko pomoč, če so zaradi strahu pred negativnimi posledicami zdravljenja v stiski.
Stiske bolnikov onkraj onkološkega zdravljenja
Najpogostejši rak mladih moških je rak mod, ki ob pravočasni diagnozi sodi med visoko ozdravljive bolezni. Ta diagnoza pa prinaša številne, tudi najbolj intimne izzive, ki presegajo naporno onkološko zdravljenje. Sebastjan Jeršinovič, dr. med., spec. urologije, FEBU, iz Centra sodobne urologije Ljubljana, je za pravočasno učinkovito zdravljenje raka mod izpostavil redno samo-pregledovanja mod enkrat na mesec. »Ob odkriti zatrdlini ni časa za raziskovanje po spletu, temveč je nujen obisk urologa.« Poudaril pa je, da ta diagnoza močno vpliva na samopodobo bolnikov, tudi zaradi vpliva na spolnost. »Stopnja erektilne disfunkcije pri bolnikih s tumorjem mod je relativno visoka, o tem se malo govori, pomembno pa je, da bolniki spregovorijo, saj jim lahko pomagamo.« Dodaja, da je v Slovenji psihosocialna pomoč v organizacijah bolnikov dobro razvita, podpora v društvih s pozitivnimi zgodbami bolnikom jim lahko olajša spoprijemanje z diagnozo in drugih izzivih na poti zdravljenja in po njem.
Zdravljenje z aktivnim spremljanjem
Nekatere vrste raka, kot je rak prostate, danes obravnavajo po metodi aktivnega spremljanja. Za katere bolnike je takšen način zdravljenja ustrezen, je razložil asist. Miha Pukl, dr. med., spec. urologije, FEBU, z Onkološkega inštituta Ljubljana. Gre za metodo, pri kateri se izognemo ali odložimo nepotrebno radikalno zdravljenje. »Številne raziskave lokalno omejenega raka prostate so pokazale, da je pri tem raku, če gre za nizko ali srednje rizično obliko, ne glede na pristop k zdravljenju na začetku (takojšnja operacija, obsevanje ali aktivno opazovanje), dolgoročno preživetje bolnikov enako.« Zato je pomembno, da so bolniki seznanjeni, da je to varna metoda pri izbranih bolnikih. Bolnike ob tem redno spremljajo pri specialistu, in če ti ugotovijo, da je, glede na histološke spremembe bolezen napredovala, nato presodijo, kako nadaljevati zdravljenje.
Kako takšno zdravljenje doživlja bolnik, je zaupal Dušan Lenček, ki je povedal, da se je po premisleku in pogovoru z zdravnikom strinjal z aktivnim opazovanjem. »Veliko strahov izvira iz našega neznanja, nekateri bi se morda raje odločili drugače. Ko mi je zdravnik razložil, da je ta metoda varna in da pomaga ohraniti kvaliteto življenja, sem se tudi sam odločil za to.« Drugim v podobni situaciji svetuje, naj tudi sami zaupajo zdravnikovemu mnenju, nato pa redno hodijo na kontrolne preglede, da ne spregledajo morebitnega napredovanja bolezni.
Potrebe mladih odraslih z izkušnjo raka so različne in drugačne
Na svetu med 15. in 39. letom starosti za rakom zboli okrog 1,2 milijona oseb, v Sloveniji okoli 500. Domen Lampret iz Slovenskega onkološkega društva za moške OnkoMan je povedal, da je diagnozo raka mod dobil pri 25. letih. K zdravniku pa se kljub težavam, bolečinam v križu, kolku, stegnih in kolenih, ki niso pojenjale, ni odpravil takoj, rdečo luč je prižgalo šele dejstvo, da je v kratkem obdobju shujšal 20 kg. »Življenje se mi je takrat ustavilo, razmišljal sem samo o tem, da preživim.« Darja Molan iz Slovenskega združenja za boj proti raku dojk Europa Donna, ki je za rakom dojk zbolela na porodniškem dopustu pri 30. letih, je poudarila, da »zboleti mlad močno vpliva na življenje, velik izziv pa predstavlja življenje po diagnozi. Ko je bilo konec zdravljenja, nisem vedela, kako naprej, ‘ožigosana’ z diagnozo sem imela težave pri iskanju zaposlitve, saj nisem poznala spodbud pri zaposlovanju, o katerih sedaj v združenju učim druge.« Poudarila je, da imajo mladi različne potrebe, nekateri so ob diagnozi v izobraževalnem postopku, drugi že zaposleni in z ustvarjeno družino. Pozdravlja lansko leto sprejeti zakon o pravici do pozabe, še vedno pa si želi, da bi imeli vsi bolniki enake možnosti pri pridobivanju invalidnosti ter poklicne rehabilitacije. »Želim si, da bi zaživel izvedenski organ, ki bi vsem bolnikom določil delazmožnost in da bi bil lahko vsak bolnik, tudi če še ni zaposlen, upravičen do invalidnine. To je še eno od področij, ki jih moramo urediti.« Domen Lampret, ki je bil ob diagnozi zaposlen, je še dodal, da si je tudi sam želel, da bi se njegova poklicna rehabilitacija začela že prej.
Okroga miza: Za sistemsko ureditev sledenja poznih posledic zdravljenja
Na okrogli mizi so razpravljavci iskali možne poti do sistemske ureditve sledenja poznih posledic zdravljenja pri odraslih onkoloških bolnikih. Doc. dr. Lorna Zadravec Zaletel, dr. med., je izpostavila, da je v načrtu priprava smernic za sledenje tudi odraslih oseb, vsak bolnik pa bo po končanem zdravljenju dobil navodila za spremljanje, ki bi se izvajalo v ambulantah družinske medicine. »Bolniki si želijo biti obravnavani čim bližje domu, zato je smiselno, da se jih obravnava v referenčnih ambulantah.«
S tem se je strinjala tudi dr. Simona Borštnar, dr. med., spec. internistične onkologije in interne medicine z Onkološkega inštituta (OI) Ljubljana, je izpostavila izziv pri sledenju bolnic z rakom dojk: »Vsako leto imamo več kot 7.000 bolnic v procesu zdravljenja in več kot 13.000 tistih, ki so zdravljenje uspešno zaključile. Zato moramo to področje nujno reorganizirati.« Asist. Mateja Kokalj Kokot, dr. med., spec. družinske medicine iz Združenja zdravnikov družinske medicine je povedala, da družinski zdravniki bolnike po zaključenem zdravljenju spremljajo tudi zaradi drugih kroničnih ali akutnih obolenj in pozdravlja predlog, da v prihodnje sledijo tudi dolgoročnim posledicam onkološkega zdravljenja, če bodo prejeli jasna navodila. »Izziv bo okrepitev timov družinskih ambulant, saj trenutno vsaki ambulanti pripada ‘polovica diplomirane sestre’. Ko bodo lahko zaposlena za polni delovni čas, bomo pozne posledice zdravljenja raka lahko spremljali tudi pri odraslih osebah z izkušnjo raka.«
Mag. Ana Vodičar iz Zavoda za zdravstveno zavarovanje Slovenije, je predstavila ekonomske vidike spremljanja dolgoročnih posledic zdravljenja, pri čemer je opozorila, da se več kot polovica stroškov bremena raka nanaša na posredne stroške, povezane z bolniškimi odsotnostmi, zgodnjim upokojevanjem in zmanjšano delovno sposobnostjo. …«
Vesna Marinko, generalna direktorica Direktorata za javno zdravje na Ministrstvu za zdravje je izpostavila, da je ena izmed prioritet državnega obvladovanja raka zviševanje kakovosti obravnave in izboljšanje življenja bolnikov z rakom. »Rak ostaja pomembno družbeno breme, ki je povezano tudi s staranjem prebivalstva, še več moramo delati na preprečevanju, zgodnjem odkrivanju ter celostni obravnavi bolnikov. Naš skupni cilj mora biti, da je spremljanje poznih posledic zdravljenja strokovno utemeljeno in finančno vzdržno.«
Okroglo mizo je sklenil doc. dr. Tit Albreht, dr. med., spec. socialne medicine in mag. javnega zdravja, raziskovalec z Nacionalnega inštituta za javno zdravje v prepričanju, da je bilo v preteklosti s prizadevanji vseh vključenih narejenega veliko za reševanje stisk bolnikov z rakom. »Nismo daleč od rešitve, jasno je, da moramo sistem urediti tako, da bo prijazen bolnikom. Za mlade imamo sistem sledenja poznih posledic zdravljenja dobro urejen, spremljanje pa moramo na podlagi smernic zagotoviti tudi za odrasle bolnike, tako da bodo vsi obravnavani enakopravno, ne glede na lokacijo raka in ne glede na to, kje živijo. Upam, da bomo z našimi pozivi prispevali k ureditvi tega področja in uspešnemu reševanju teh pomembnih vprašanj.«
Posnetek konference si lahko ogledate na povezavi: https://video.sta.si/prenos/konferenca-zivljenje-z-rakom
Več informacij: Maja Južnič Sotlar (051 687 117) in Tili Kojič (040 555 835)
“,”Jaka Verbic Miklic”,1738911300,1738911300,sl,15556,306,15555,43,0,NULL,,”Izzivi bolnikov z rakom in sledenje poznih posledic zdravljenja”,izzivi-bolnikov-z-rakom-in-sledenje-poznih-posledic-zdravljenja,Post,”/sites/43/files/images/news/Zivljenje z rakom/5 konferenca/5. konferenca.png”,1,0,1738911642,1738914013
1105,15558,”Kampanja Ostani v tekmi v sodelovanju s športniki spodbuja moške k pregledu prostate”,”Zdravnica Janka Čarman je predstavila tudi projekt Peter, ki pripravlja temelje za uvedbo nacionalnega presejalnega programa za raka prostate.”,”
Ljubljana, 11. novembra – Društvo Onkoman je danes na novinarski konferenci v Ljubljani predstavilo kampanjo Ostani v tekmi, kjer slovenski športniki spodbujajo moške nad 50 let k preventivnim pregledom za raka prostate. Zdravnica Janka Čarman je predstavila tudi projekt Peter, ki pripravlja temelje za uvedbo nacionalnega presejalnega programa za raka prostate.
Kampanja Ostani v tekmi je nastala v sodelovanju društva Onkoman, prvega društva v Sloveniji, ki je prvenstveno namenjeno moškim in agencije Futura DDB, v kateri so povezali slovenske športnike in moške nad 50 let nagovorili, da opravijo preventivni pregled. “Vsak moški ima priljubljen šport in klub, za katerega navija. Da lahko navijamo, moramo biti zdravi, zato so športniki ambasadorji letos pomagali povečati ozaveščenost o tej pomembni temi,” je predsednik društva Onkoman Matej Pečovnik pojasnil izbiro športa kot povezovalnega elementa kampanje.
Kreativna direktorica na Futuri DDB Tina Križaj je dodala, da je ideja kampanje spodbuditi moške k preventivnim pregledom brez zastraševanja, saj lahko le zdravi navijači ostanejo aktivni na tribunah in v življenju. “Če hočejo biti super navijači, zakaj ne bi tega sporočila predali moškim športniki, ki so tudi njihovi idoli, nekdo, ki ga občudujejo,” je izpostavila.
V kampanji kot ambasadorji sodelujejo štirje športniki, eden izmed njih je tudi nekdanji nogometaš Sašo Udovič, ki je poudaril pomen takšnih projektov. “Bistvo je v tem, da ostanemo v tekmi čim dlje in čim bolj kakovostno,” je dejal Udovič.
Z njim se strinja tudi član društva Onkoman in preživeli raka na prostati Martin Lisec, ki je opozoril na pomen preventive in rednih zdravstvenih pregledov. “V nekem trenutku se bodo stvari tako zakomplicirale, da boš moral iti k zdravniku, preventiva je pa ravno to, da tudi na ta način skrbim za svoje zdravje,” je dejal.
Zdravnica in vodja strokovne skupine za raka prostate pri državnem programu za obvladovanje raka Janka Čarman je predstavila dvoletni projekt Peter, katerega namen je priprava temeljev za uvedbo nacionalnega presejalnega programa za raka prostate. V prihodnjem letu bo potekala pilotna raziskava, ki bo zajela omejeno skupino moških, kar bo omogočilo preizkus učinkovitosti programa in prilagoditve za kasnejšo širšo uvedbo.
“To torej še ne bo presejalni program na nacionalnem nivoju, ampak na eni omejeni skupini moških, kjer bomo poskušali ugotoviti še različne stvari, da bomo potem na kar se da učinkovit način to implementirali kasneje. Seveda se bomo ves čas prilagajali, upoštevali smernice in vse novosti, ki bodo na tem področju,” je pojasnila Čarman.
Čarman je predstavila še najnovejše smernice na področju zdravljenja raka prostate. Izpostavila je, da pri nizkorizičnih oblikah raka prostate smernice priporočajo aktivno sledenje, kar pomeni, da zdravljenje ni takoj potrebno in moški lahko ohranijo kakovostno življenje brez stranskih učinkov terapij. Pri bolj agresivnih oblikah raka pa uporabljajo kombinacijo lokalnega in sistemskega zdravljenja, da čim bolj povečajo možnosti preživetja.
“,”Jaka Verbic Miklic”,1731326940,1731326940,sl,15558,306,15557,43,0,NULL,,”Kampanja Ostani v tekmi v sodelovanju s športniki spodbuja moške k pregledu prostate”,kampanja-ostani-v-tekmi-v-sodelovanju-s-sportniki-spodbuja-moske-k-pregledu-prostate,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740571785,1740571842
1106,15560,”Oseb s sladkorno boleznijo v letu 2023 skoraj 4000 več kot leto prej”,”Z zdravili se je zaradi sladkorne bolezni lani zdravilo več kot 126 tisoč oseb, med njimi več moških kot žensk”,”
Ljubljana, 13. novembra – V Sloveniji je po ocenah Nacionalnega inštituta za javno zdravje (NIJZ) v letu 2023 živelo 149.160 oseb z znano sladkorno boleznijo, kar je 3920 več kot v letu 2022 in 7318 več kot v letu 2021. Z zdravili se je zaradi sladkorne bolezni lani zdravilo 126.786 oseb, med njimi več moških kot žensk, so navedli pred svetovnim dnevom sladkorne bolezni.
NIJZ je danes objavil novo publikacijo Obvladovanje sladkorne bolezni v letu 2023.
NIJZ na letni ravni spremlja število oseb, ki prejemajo zdravila za zniževanje glukoze. Zanje domnevajo, da jih jemljejo zaradi sladkorne bolezni, razen v primerih, ko prejemajo zdravila iz skupin, ki se uporabljajo tudi za druge bolezni. Za oceno števila vseh oseb s sladkorno boleznijo na podlagi števila oseb, ki prejemajo zdravila, pa predpostavljajo, da se 15 odstotkov oseb zdravi nefarmakološko. Razlikovanje med tipi sladkorne bolezni ni možno, so zapisali na NIJZ.
Največ moških se zdravi v svojih šestdesetih, žensk pa v sedemdesetih letih
Ocenjujejo, da se je v letu 2023 v Sloveniji zaradi sladkorne bolezni zdravilo 3332 oseb oziroma 2,6 odstotka več kot v letu 2022 in 34.328 oseb oziroma 37,1 odstotka več kot v letu 2010. Med prejemniki je 69.143 (54,5 odstotka) moških in 57.643 (45,5 odstotka) žensk.
Največ moških je zdravila prejemalo v starosti med 60 in 69 let, in sicer 22.558. Največ žensk pa je zdravila prejemalo v starosti med 70 in 79 let, in sicer 17.586.
Med prebivalci Slovenije, starimi med 20 in 79 let, je 6,1 odstotka takšnih, ki so leta 2022 prejeli zdravila za zniževanje glukoze, razlikuje pa se delež med posameznimi regijami. Največ oseb z vsaj eno izdajo zdravila je v Zasavski regiji, 7,6 odstotka, najmanj pa v Goriški regiji, 5,1 odstotka.
Na novo se je začelo zdraviti 12.242 oseb
Z zdravili za zniževanje glukoze se je v letu 2023 začelo zdraviti 12.242, kar je povezano tudi s povečevanjem števila preventivnih pregledov v timu družinske medicine, kjer se odkriva tudi sladkorna bolezen tipa 2, so zapisali na NIJZ. Teh pregledov je bilo leta 2023 61.306 oziroma 16.658 več kot leto prej.
Na novo je začelo lani zdravila za zdravljenje sladkorne bolezni prejemati 6355 moških in 5887 žensk, skupaj torej 12.242 oseb, kar je 415 več kot v letu 2022.
Po podatkih NIJZ je bilo lani 3740 porodnic s sladkorno boleznijo v nosečnosti, kar je 120 več kot v letu 2022, 193 manj kot v letu 2021 in 1832 več kot v letu 2013.
V letu 2023 je bilo na 1000 porodnic takih s sladkorno boleznijo 224,8, leto prej 209,8, v letu 2013 pa 93. Število samo po sebi in število, izraženo glede na 1000 porodnic, sta do leta 2021 strmo naraščali, opažajo na NIJZ.
Raste tudi število pregledanih za diabetično retinopatijo
V letu 2023 so v centrih za diabetično retinopatijo pregledali 29.323 oseb s sladkorno boleznijo, 3291 več kot v letu prej.
“Trend rasti je ugoden, še vedno pa je preveč tistih oseb s sladkorno boleznijo, ki niso zajete v sistematično pregledovanje. Za tiste osebe, ki bi glede na stanje očesnega ozadja, potrebovale dodatno zdravljenje, je namreč čakalna doba do začetka terapije bistveno daljša kot pri tistih, ki so vključeni v preglede v centre za diabetično retinopatijo,” opozarjajo na NIJZ.
Lani zaradi sladkorne bolezni umrlo 317 oseb
Zaradi sladkorne bolezni kot osnovnega vzroka smrti je lani umrlo 317 oseb, v letu 2022 304, v letu 2021 pa 476 oseb. Standardizirana stopnja umrljivosti v Sloveniji zaradi sladkorne bolezni kot osnovnega vzroka smrti je 13,6, še navajajo v publikaciji NIJZ.
“,”Jaka Verbic Miklic”,1731499860,1731499860,sl,15560,306,15559,43,0,NULL,,”Oseb s sladkorno boleznijo v letu 2023 skoraj 4000 več kot leto prej”,oseb-s-sladkorno-boleznijo-v-letu-2023-skoraj-4000-vec-kot-leto-prej,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740572008,1740572008
1107,15562,”Začel se je evropski teden testiranja”,”Testiraj, zdravi, prepreči”,”
Ljubljana, 18. novembra – Začel se je evropski teden testiranja na okužbo s HIV, na spolno prenosljive okužbe ter na okužbe z virusoma hepatitisa B in C. Geslo letošnjega tedna je Testiraj, zdravi, prepreči. Namen tedna je ozaveščanje prebivalstva in zdravstvenega osebja o prednostih testiranja in zgodnjega zdravljenja omenjenih okužb, so sporočili z NIJZ.
“,”Jaka Verbic Miklic”,1731932040,1731932040,sl,15562,306,15561,43,0,NULL,,”Začel se je evropski teden testiranja”,zacel-se-je-evropski-teden-testiranja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740572158,1740572158
1108,15564,”V zadnjem letu porast primerov atipične pljučnice”,”Če simptomi vztrajajo več kot teden dni, mora bolnik obiskati svojega zdravnika, je za STA pojasnila vodja službe za preprečevanje bolnišničnih okužb v Univerzitetnem kliničnem centru (UKC) Ljubljana Tatjana Mrvič.”,”
Ljubljana, 22. novembra – Na ljubljanski infekcijski kliniki so v zadnjem letu zdravili večje število bolnikov, ki so zdravljenje potrebovali zaradi okužbe z bakterijo Mycoplasma pneumoniae. Ta povzroča sindrom atipične pljučnice. Trenutno pa zdravijo tudi druge bolnike, ki zdravljenje potrebujejo zaradi zimskih respiratornih obolenj.
Za bolezen je značilen kašelj, nekateri bolniki poročajo o občutku težkega dihanja. Bolnik se lahko zelo slabo počuti, možna je tudi visoka vročina. Če simptomi vztrajajo več kot teden dni, mora bolnik obiskati svojega zdravnika, je za STA pojasnila vodja službe za preprečevanje bolnišničnih okužb v Univerzitetnem kliničnem centru (UKC) Ljubljana Tatjana Mrvič.
Na infekcijski kliniki UKC Ljubljana so v zadnjem letu zdravili 353 bolnikov z dokazano okužbo z omenjeno bakterijo. To je skoraj petkrat več kot v enakem obdobju pred pandemijo, torej v obdobju 2018/2019, ko je bila v Sloveniji zadnja velika epidemija okužb z Mycoplasmo pneumoniae. V primerjavi z enakim obdobjem v letih 2017/2018 pa je tokrat okužb kar desetkrat več, je minuli teden poročal časnik Dnevnik.
Po besedah Tatjane Mrvič večinoma zbolevajo šolarji. “Imamo tudi kar nekaj manjših otrok, se pravi tistih, ki hodijo v vrtec. Tudi kar nekaj odraslih je že bilo obravnavanih, predvsem na infekcijski kliniki, ker so potrebovali hospitalizacijo zaradi potrebe po dodatnem kisiku in pa seveda uvedbo antibiotika,” je pojasnila.
Sicer pa se začenja vsakoletna zimska sezona respiratornih obolenj. V prejšnjem tednu je bilo število obiskov zaradi akutnih okužb dihal v ambulantah na primarni ravni, ki so zajete v mrežo za spremljanje, nekaj višje kot pretekli teden in primerno sezoni, kažejo podatki Nacionalnega inštituta za javno zdravje. Akutne okužbe dihal so večinoma povzročali rinovirusi in koronavirus.
Na ljubljanski infekcijski kliniki zdravijo bolnike z različnimi virusnimi okužbami, med njimi so prvi primeri obolelih z gripo. Zaradi respiratornega sincicijskega virusa so že zdravili prvega otroka v tej sezoni.
“Gremo v skladu s predvidevanji zimske sezone. Verjetno se bo začel povečevati delež gripe do decembra recimo, tako da vrh pričakujemo okrog novega leta, mogoče januarja,” je pojasnila Mrvič.
Beležijo tudi posamezne primere covida-19, pa tudi okužb z virusi, ki krožijo celo leto. Med njimi je naštela rinoviruse, enteroviruse, adenoviruse in viruse parainfluence.
Tokratni zimski val respiratornih obolenj bo za UKC Ljubljana še poseben izziv. Od leta 2017 do leta 2023 se je število postelj v UKC Ljubljana zmanjšalo za 10 odstotkov. Ključni problem je pomanjkanje medicinskih sester. Trenutno je število razpoložljivih postelj še nekoliko manjše, saj je infekcijska klinika zaradi gradnje prizidka od poletja razseljena na več lokacij, ob tem pa še vedno poteka prenova glavne stavbe.
Že sedaj tako v ljubljanskem UKC beležijo vse večji priliv bolnikov na internistično prvo pomoč in urgentno ambulanto infekcijske klinike. Rešitve iščejo iz dneva v dan, a Mrvič opozarja, da se prava epidemija respiratornih obolenj sploh še ni začela.
“,”Jaka Verbic Miklic”,1732277820,1732277820,sl,15564,306,15563,43,0,NULL,,”V zadnjem letu porast primerov atipične pljučnice”,v-zadnjem-letu-porast-primerov-atipicne-pljucnice,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740572347,1740572347
1109,15566,”V ospredju letošnjega svetovnega dneva boja proti aidsu pravica do zdravja za vse”,”Moje zdravje, moja izbira, moja pravica”,”
Ljubljana, 26. novembra – Svetovni dan boja proti aidsu, ki je vsako leto 1. decembra, bo v Sloveniji letos potekal pod geslom Moje zdravje, moja izbira, moja pravica, s čimer želijo poudariti pravico do zdravja za vse, pomen zagotavljanja človekovih pravic in enakopravnega dostopa do kakovostnih zdravstvenih storitev, brez stigmatizacije in diskriminacije.
“,”Jaka Verbic Miklic”,1732623600,1732623600,sl,15566,306,15565,43,0,NULL,,”V ospredju letošnjega svetovnega dneva boja proti aidsu pravica do zdravja za vse”,v-ospredju-letosnjega-svetovnega-dneva-boja-proti-aidsu-pravica-do-zdravja-za-vse,Post,,1,0,1740572488,1740572488
1110,15568,”Ob svetovnem dnevu boja proti aidsu pozivi k odpravi neenakosti”,”Za posledicami aidsa je lani umrlo približno 630 tisoč ljudi, na novo pa se je okužilo 1,3 milijona oseb”,”
Ljubljana, 1. decembra – Svetovni dan boja proti aidsu, ki ga obeležujemo danes, poteka pod geslom Moje zdravje, moja izbira, moja pravica in v ospredje postavlja pravico do zdravja za vse. Svetovna zdravstvena organizacija na ta dan poziva svetovne voditelje, naj se z odpravljanjem neenakosti, ki ovirajo napredek pri odpravljanju aidsa, zavzemajo za pravico do zdravja.
Po svetu je lani živelo okoli 39,9 milijona ljudi, okuženih z virusom HIV, od teh se jih je po ocenah 30,7 milijona zdravilo z antiretrovirusno terapijo. Za posledicami aidsa je lani umrlo približno 630.000 ljudi, na novo pa se je okužilo 1,3 milijona oseb, kažejo zadnji podatki programa Združenih narodov za boj proti HIV in aidsu (Unaids). Okoli 5,4 milijona ljudi ni poznalo svojega statusa.
Velik napredek pri odzivanju na HIV je neposredno povezan z napredkom na področju varstva človekovih pravic, spodbudil pa je tudi širši napredek pri uresničevanju pravice do zdravja in krepitvi zdravstvenih sistemov, so pred svetovnim dnevom poudarili v Unaids. Toda vrzeli pri uresničevanju človekovih pravic za vse škodujejo javnemu zdravju in preprečujejo, da bi svet odpravil aids.
Diskriminatorni zakoni, politike in prakse kaznujejo ter stigmatizirajo ranljive ljudi, zlasti ženske, dekleta in manjšine. Preprečujejo jim dostop do preverjenih preventivnih ukrepov, testiranja, zdravljenja in oskrbe, je pred svetovnim dnevom opozoril generalni sekretar ZN Antonio Guterres.
Opozoril je, da se na svetu vsakih 25 sekund nekdo okuži z virusom HIV. Več kot devet milijonov ljudi, ki živijo s HIV, nima dostopa do življenjsko pomembnega zdravljenja. “Aids bomo premagali, če bodo zaščitene pravice vseh in povsod,” je zapisal Guterres.
Slovenija se sicer uvršča med države, ki ohranjajo nizko stopnjo epidemije. Letos so do 20. novembra po podatkih Nacionalnega inštituta za javno zdravje (NIJZ) zabeležili 36 novih diagnoz okužbe s HIV. Do vključno 20. novembra je bilo prijavljenih še 12 primerov okužbe s HIV pri osebah, ki so letos nadaljevale zdravljenje v Sloveniji in so diagnozo prejele že pred letom 2024 v tujini. Letos so zabeležili 16 poznih diagnoz okužbe s HIV, je na torkovem nacionalnem posvetu pojasnila Irena Klavs z NIJZ.
Svetovni dan boja aidsu, ki ga simbolizira rdeča pentlja, je Svetovna zdravstvena organizacija razglasila leta 1988. Epidemija aidsa je globalno zahtevala okoli 42,3 milijona življenj, več kot 88,4 milijona osebam pa so potrdili okužbo z virusom HIV.
“,”Jaka Verbic Miklic”,1733055780,1733055780,sl,15568,306,15567,43,0,NULL,,”Ob svetovnem dnevu boja proti aidsu pozivi k odpravi neenakosti”,ob-svetovnem-dnevu-boja-proti-aidsu-pozivi-k-odpravi-neenakosti,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740572695,1740572695
1111,15570,”Presejalni program Svit praznuje 15-letnico delovanja”,”Vodja programa Dominika Novak Mlakar poudarja, da so v tem času odkrili več kot 4100 rakov debelega črevesa in danke”,”
Ljubljana, 12. decembra – Državni program presejanja in zgodnjega odkrivanja predrakavih sprememb in raka debelega črevesa in danke Svit praznuje 15-letnico delovanja. Vodja programa Dominika Novak Mlakar poudarja, da so v tem času odkrili več kot 4100 rakov debelega črevesa in danke, večino v zgodnjem stadiju, ko bolniki ne potrebujejo dodatnega onkološkega zdravljenja.
Novak Mlakar je ob robu današnjega strokovnega srečanja programa Svit za STA dejala, da so v 15 letih dosegli zelo dobre rezultate, ob odkritih rakih pa so odkrili tudi več kot 31.700 predrakavih sprememb, ki so jih odstranili med kolonoskopijo in s tem preprečili nastanek raka.
“Program Svit je pomembno doprinesel k znižanju pojavnosti raka debelega črevesa in danke. Pred uvedbo organiziranega populacijskega presejanja je bil to rak, ki je bil najpogosteje odkrit pri obeh spolih, skupaj s sistematičnim izvajanjem presejanja pa je zdrsnil po pogostosti na četrto mesto med novoodkritimi raki,” je poudarila.
Odzivnost na vabila je 65-odstotna, a si želijo boljše, vsaj 70-odstotne. Novak Mlakar opozarja, da se slabše odzivajo moški, in sicer za dobrih 11 odstotnih točk. “Zato moramo iskati načine, pristope, kako jih motivirati, oziroma vstopati v okolje, kjer je več moške populacije,” meni.
V programu nagovarjajo ženske in moške v starosti med 50 in 74 let, vabilo pa na vsaki dve leti dobijo po pošti. Vodja programa ob prejemu vabila ljudem svetuje, naj o programu premislijo, če potrebujejo dodatne informacije, pa naj se obrnejo na klicni center programa Svit, osebnega zdravnika, referenčno medicinsko sestro, zdravstvene delavce v centru za krepitev zdravja ali na nevladne organizacije, ki delujejo na področju spodbujanja preventive.
“Na vabilo se je sigurno dobro odzvati, ker sodelovanje v programu zmanjšuje tveganje, da bi bil rak debelega črevesa ali danke oziroma predrakava sprememba odkrita prepozno,” je povedala Novak Mlakar.
Dodala je, da tako kot ženske redno hodijo na pregled h ginekologu ter na mamografijo v programu Dora, je prav, da se odzovejo tudi na vabilo v program Svit. “Poseben izziv pa so gospodje. Tako kot vsako leto peljejo svoj avto na servis, je pomembno poskrbeti tudi zase. Naše zdravje je tisto, ki nam bo omogočilo, da bomo dolgo in zdravo živeli. Naj ne bodo strah, sram oziroma teme, kot so prebava, odvajanje ali blato, razlog, da o tem ne bomo govorili ali da se za sodelovanje ne bomo odločili,” je prepričana.
V prihodnosti si tako želijo izboljšati odzivnost, vključiti čim več moških, dostopati do ljudi v populaciji, ki imajo drugačne potrebe, in biti vključujoči. Pripravljajo tudi strokovne smernice, skrbijo za kakovost in mrežo, kjer opravljajo dodatne preiskave, kolonoskopije. Želijo si tudi digitalizacije programa, in sicer možnosti elektronske prijave v program.
Z Nacionalnega inštituta za javno zdravje pa so sporočili, da je Svit eden najuspešnejših javnozdravstvenih programov v Sloveniji, ki je prispeval k reševanju številnih življenj, povečal ozaveščenost o raku ter spodbudil prebivalce k preventivni skrbi za svoje zdravje. Izvajati so ga začeli leta 2009.
Cilj programa je med navidezno zdravimi osebami med 50. in 74. letom starosti s pomočjo preprostega testa ugotoviti prikrite sledi krvavitev v blatu. Osebe s pozitivnim izvidom presejalnega testa napotijo na kolonoskopski pregled, na katerem ugotovijo vzrok krvavitve. Če med kolonoskopijo najdejo spremembe na steni debelega črevesa in danke, morda tudi rakave spremembe, te v večini primerov odstranijo že med preiskavo, s čimer preprečijo nastanek ali napredovanje raka.
“,”Jaka Verbic Miklic”,1734006360,1734006360,sl,15570,306,15569,43,0,NULL,,”Presejalni program Svit praznuje 15-letnico delovanja”,presejalni-program-svit-praznuje-15-letnico-delovanja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740572872,1740572873
1112,15572,”S prihodnjim letom redno cepljenje otrok proti noricam”,”Čeprav norice pri večini potekajo blago, se bolezen pri dveh odstotkih zaplete. “,”
Ljubljana, 23. decembra – Od 1. januarja 2025 bodo v Sloveniji začeli izvajati redno cepljenje otrok proti noricam. Do brezplačnega cepljenja proti noricam bodo upravičeni otroci, rojeni od februarja 2024. Čeprav norice pri večini potekajo blago, se bolezen pri dveh odstotkih zaplete. Najboljši način preprečevanja noric je cepljenje, so sporočili z NIJZ.
Norice so najpogostejša nalezljiva izpuščajna bolezen, ki jo povzroča virus varičele zostra iz družine herpes virusov. Večina ljudi preboli norice že v otroštvu. Pri otrocih potekajo blago z značilnim mehurčkastim izpuščajem na koži, pa tudi sluznicah in spolovilu, praviloma jih spremlja tudi povišana telesna temperatura, so pojasnili na Nacionalnem inštitutu za javno zdravje (NIJZ).
Dva odstotka otrok pa lahko potrebujeta bolnišnično zdravljenje. Bolezen pa lahko pri njih pusti dolgotrajne posledice. Poleg tega virus, ki povzroča norice, pri okoli 15 odstotkih oseb, ki so norice prebolele, pozneje v življenju povzroči težave v obliki herpesa zostra ali pasovca.
Večje tveganje za težji potek bolezni in zaplete imajo novorojenčki, odrasli, nosečnice in bolniki z okrnjeno imunostjo. Bolezen je zelo kužna, 90 odstotkov ljudi, ki še niso preboleli noric, bo ob stiku z bolnikom zbolelo, navaja NIJZ. Virus se prenaša s kužnimi kapljicami, po zraku, lahko pa tudi z neposrednim stikom, denimo z okuženimi rokami obolelega na zdravo osebo.
Bolniki so kužni dva dneva pred pojavom izpuščaja in vse dokler se vsi mehurčki ne posušijo, kar je običajno pet dni po pojavu izpuščaja. Od okužbe do pojava bolezni mine od 10 do 21 dni, najpogosteje od 14 do 16 dni, so še pojasnili na inštitutu.
Ministrstvo za zdravje je julija v uradnem listu objavilo program cepljenja in zaščite z zdravili za leto 2024. Ta je na predlog NIJZ razširil nabor cepljenj v breme obveznega zdravstvenega zavarovanja. Zdravstveno zavarovanje bo od 1. januarja tako krilo tudi cepljenje otrok proti noricam.
“,”Jaka Verbic Miklic”,1734957000,1734957000,sl,15572,306,15571,43,0,NULL,,”S prihodnjim letom redno cepljenje otrok proti noricam”,s-prihodnjim-letom-redno-cepljenje-otrok-proti-noricam,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740573116,1740573116
1113,15574,”WHO: “Bolezen X” v DR Kongo ni novo obolenje”,”V okrožju Panzi v provinci Kwango na jugozahodu DR Kongo je od konca oktobra zbolelo več sto ljudi.”,”
Ženeva, 28. decembra – Mednarodni zdravstveni strokovnjaki menijo, da val obolenj na odročnem jugozahodnem delu Demokratične republike Kongo z delovnim imenom bolezen X ni nova bolezen, temveč je posledica znanih patogenov, je v petek sporočila Svetovna zdravstvena organizacija (WHO).
Kot so pojasnili v WHO, so v 430 laboratorijskih vzorcih, odvzetih bolnikom v regiji, našli viruse malarije, gripe, rinoviruse, koronaviruse in druge znane viruse, poroča nemška tiskovna agencija dpa.
V okrožju Panzi v provinci Kwango na jugozahodu DR Kongo je od konca oktobra zbolelo več sto ljudi. Bolniki so imeli simptome, podobne gripi, vključno z vročino, prehladom, glavoboli, bolečinami v okončinah in težavami z dihanjem.
Svetovna zdravstvena organizacija je poročala o 48 smrtnih primerih, lokalne oblasti pa so sporočile, da je umrlo več kot 130 ljudi. Med prizadetimi je bilo zlasti veliko otrok, mlajših od pet let.
Ekipa WHO je po preiskavi ugotovila, da kombinacija običajnih in sezonskih virusnih okužb dihal ter malarije skupaj z akutno podhranjenostjo vodi v povečanje števila hudih okužb in smrti, ki nesorazmerno prizadenejo otroke, mlajše od pet let.
V regiji naj bi bilo podhranjenih okoli 40 odstotkov ljudi, med otroki naj bi bil ta delež kar 60-odstoten. Pri ljudeh, ki ne jedo dovolj in jim zato primanjkuje hranilnih snovi, je veliko večje tveganje, da resno zbolijo zaradi različnih patogenov, opozarjajo v WHO.
“,”Jaka Verbic Miklic”,1735389120,1735389120,sl,15574,306,15573,43,0,NULL,,”WHO: “Bolezen X” v DR Kongo ni novo obolenje”,who-bolezen-x-v-dr-kongo-ni-novo-obolenje,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740573290,1740573291
1114,15576,”Slovenci zaužijejo dvakrat več od priporočanega vnosa soli”,”V raziskavi je sodelovalo 518 odraslih prebivalcev, starih od 25 do 64 let, s stalnim prebivališčem v Sloveniji, vzorce so zbirali leta 2022.”,”
Ljubljana, 14. januarja – Prekomeren vnos soli je eden od ključnih prehranskih dejavnikov, ki prispevajo k razvoju visokega krvnega tlaka. Odrasli prebivalci Slovenije v povprečju dnevno zaužijejo približno deset gramov soli, kar je dvakrat več od priporočenega vnosa Svetovne zdravstvene organizacije, ki znaša največ pet gramov soli dnevno, kaže raziskava NIJZ.
Nacionalni program o prehrani in telesni dejavnosti za zdravje 2015-2025 med ključnimi cilji navaja zmanjšanje vnosa soli med prebivalci za 15 odstotkov. Z namenom ugotavljanja stanja so na Nacionalnem inštitutu za javno zdravje (NIJZ) v sodelovanju z raziskovalnimi partnerji izvedli raziskavo spremljanja izločenega natrija, kalija in joda v 24-urnem urinu pri odraslih prebivalcih Slovenije, imenovano Manjsoli.si.
V raziskavi je sodelovalo 518 odraslih prebivalcev, starih od 25 do 64 let, s stalnim prebivališčem v Sloveniji, vzorce so zbirali leta 2022.
Glede na izsledke raziskave je povprečen vnos soli pri moških ocenjen na 11,7 grama soli na dan, med ženskami pa je vnos nižji, in sicer 8,7 grama na dan. Manj kot pet gramov soli na dan dosega le 12 odstotkov odraslih prebivalcev Slovenije, in sicer 16 odstotkov žensk in osem odstotkov moških, so na spletni strani NIJZ povzeli pojasnila koordinatorke projekta Manjsoli.si Urške Blaznik. Rezultati so sicer pokazali, da prebivalci zaužijejo manj soli, kot so pokazale prejšnje raziskave.
V sodelovanju z Inštitutom za nutricionistiko so na NIJZ izvedli tudi do sedaj najobsežnejšo analizo vsebnosti soli v postreženih kruhih in pekovskih izdelkih v Sloveniji, saj so ti prepoznani kot eni izmed ključnih virov soli v prehrani. Raziskava je zajela izdelke večjih proizvajalcev in manjših pekarn v enajstih statističnih regijah. Vzorec, ki so ga zbrali leta 2022, je obsegal 178 vzorcev kruha in pekovskih izdelkov, od tega so jih 117 pridobili pri večjih trgovcih in 61 v manjših pekarnah.
Ugotovili so, da se je vsebnost soli v belih kruhih večjih proizvajalcev od leta 2012 znižala za 12 odstotkov, medtem ko je v celotni kategoriji kruhov zaznati le sedemodstotno znižanje. Najnižjo povprečno vsebnost soli so ugotovili v črnem pšeničnem ter v rženem kruhu, ki v primerjavi z belim kruhom vsebujeta tudi precej več koristnih prehranskih vlaknin.
Čeprav so rezultati raziskav spodbudni, bosta za nadaljnje zmanjševanje vnosa soli v populaciji potrebna nadaljevanje in okrepitev različnih aktivnosti in ukrepov, ocenjujejo na NIJZ.
Poudarjajo, da lahko za nižji vnos soli marsikaj stori tudi sam potrošnik, in sicer z izogibanjem dosoljevanja in izborom živil, ki vsebujejo manj soli. Ta podatek je naveden na označbi, viden pa je tudi v brezplačni mobilni aplikaciji VešKajJeš.
Čeprav je zmanjševanje vnosa soli pomembno, na NIJZ poudarjajo, da sol v Sloveniji predstavlja tudi ključni vir joda v prehrani. Z jodiranjem soli se namreč preprečuje resno pomanjkanje joda in s tem povezane zdravstvene težave. Zato vsem priporočajo, da pri nakupu vedno izberejo jodirano sol.
“,”Jaka Verbic Miklic”,1736858340,1736858340,sl,15576,306,15575,43,0,NULL,,”Slovenci zaužijejo dvakrat več od priporočanega vnosa soli”,slovenci-zauzijejo-dvakrat-vec-od-priporocanega-vnosa-soli,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740573674,1740573674
1115,15578,”NIJZ še vedno priporoča cepljenje proti gripi”,”Za gripo vsako leto zboli med 100 in 200 tisoč prebivalcev Slovenije.”,”
Ljubljana, 15. januarja – Nacionalni inštitut za javno zdravje (NIJZ) kljub temu, da je sezona gripe že v teku, še vedno priporoča cepljenje proti tej bolezni. Vrh sezone pričakujejo čez nekaj tednov, cepljenje pa svetujejo vsem prebivalcem, ki so starejši od šestih mesecev. Opozarjajo, da za gripo vsako leto zboli med 100.000 in 200.000 prebivalcev Slovenije.
Gripa je Evropi in Sloveniji v porastu od božično-novoletnih praznikov. Prevladuje kroženje virusov influence tipa A, primeri gripe pa se pojavljajo po vsej državi, so zapisali v sporočilu za javnost.
Nacionalna koordinatorica za cepljenje Marta Grgič Vitek z NIJZ poudarja, da je “kljub porastu gripe cepljenje proti gripi še vedno smiselno, saj vrh obolevanja pričakujemo v naslednjih tednih – proti koncu januarja oziroma v začetku februarja”. Vsem prebivalcem, ki se v tej sezoni še niso cepili, svetuje, naj to storijo čim prej, saj po cepljenju traja še nekaj časa, da se v telesu vzpostavi zaščita.
Na NIJZ izpostavljajo, da je cepljenje najboljša zaščita proti gripi, predvsem pred težkim potekom, ki lahko zahteva tudi bolnišnično zdravljenje. Cepljenje proti gripi je brezplačno za vse osebe z urejenim obveznim zdravstvenim zavarovanjem, opraviti pa ga je treba vsako leto.
Gripa pri mladih brez kroničnih bolezni večinoma poteka z nekajdnevno vročino, znaki obolenja dihal ter bolečinami v mišicah in sklepih, pri ranljivih skupinah prebivalstva pa lahko poteka težje, s pogostimi zapleti (kot so virusne in bakterijske pljučnice) in tudi z višjo smrtnostjo. Pri kroničnih bolnikih lahko pride tudi do poslabšanja osnovne bolezni.
Cepljenje zlasti priporočajo skupinam, ki imajo večje tveganje za težji potek bolezni. To so osebe, stare več kot 65 let, kronični bolniki, osebe z izrazito povečano telesno težo, majhni otroci (od 6 do 23 mesecev starosti) in nosečnice.
Precepljenost proti gripi je sicer v Sloveniji nizka. Doslej se je v sezoni 2024/2025 proti gripi cepilo več kot 117.000 prebivalcev Slovenije, kar je 5,5 odstotka prebivalstva. Najvišji delež cepljenih je med starejšimi od 80 let, in sicer skoraj 20 odstotkov. “Žal je to daleč od priporočila Svetovne zdravstvene organizacije, da se proti gripi cepi vsaj 75 odstotkov starejših odraslih,” so še zapisali na NIJZ.
“,”Jaka Verbic Miklic”,1736945700,1736945700,sl,15578,306,15577,43,0,NULL,,”NIJZ še vedno priporoča cepljenje proti gripi”,nijz-se-vedno-priporoca-cepljenje-proti-gripi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740574618,1740574618
1116,15580,”Otrok naj se v šolo ali vrtec vrne, ko ne kaže znakov bolezni”,”Pravočasna vrnitev otroka v šolo je pomembna tako za njegovo zdravje in počutje kot za druge”,”
Ljubljana, 18. januarja – V sezoni nalezljivih bolezni je Nacionalni inštitut za javno zdravje (NIJZ) pripravil smernice za vračanje otrok v vrtec ali šolo po preboleli bolezni. Pravočasna vrnitev otroka v šolo je pomembna tako za njegovo zdravje in počutje kot za druge. Starši pa morajo otroka obdržati doma, dokler ne preboli bolezni, so sporočili iz inštituta.
Na inštitutu poudarjajo, da ima po zakonu o nalezljivih boleznih vsakdo pravico in dolžnost varovati svoje zdravje in zdravje drugih pred nalezljivimi boleznimi. Pomembno je, da so otroci, ki obiskujejo vrtce ali šole pravočasno cepljeni proti boleznim v skladu s programom cepljenja in zaščite z zdravili. Prav v vrtcih in šolah se zaradi tesnih stikov med otroki nalezljive bolezni namreč zelo hitro širijo.
Okužbe otroci pogosto prenašajo iz domačega okolja v vrtce ali šole in obratno. Vrtci in šole so tako dolžni zagotoviti ustrezne higienske pogoje, ki zmanjšujejo tveganje za prenos bolezni, za preprečitev širjenja pa so odgovorni tudi starši, so zapisali na spletni strani NIJZ.
V primeru, da otrok zboli v vrtcu ali šoli, mu morajo vzgojitelji ali učitelji omejiti stik z drugimi otroki do prihoda staršev. Pri tem pa mora osebje upoštevati ukrepe za preprečevanje širjenja nalezljivih bolezni glede na znake, ki jih kaže otrok. Predvsem pa morajo starši znake bolezni prepoznati že doma in bolne otroke obdržati doma, dokler se ne pozdravijo in prenehajo biti kužni, opozarjajo.
Pri tem je pomembno, da prepoznajo znake nalezljivih bolezni. Blažji kašelj in nahod v primeru, da se otrok dobro počuti, tako nista razlog, da bi otrok ostajal doma. V primeru, da otrok močneje kašlja, ima drisko, vročino in izpuščaje, pa ga morajo starši obdržati doma, saj so to znaki nalezljivih bolezni, svetujejo.
Pri okužbi s koronavirusom ali gripo se otrok v kolektiv lahko vrne po ozdravitvi oziroma glede na mnenje izbranega zdravnika, pri oslovskem kašlju po petih dneh od začetka antibiotičnega zdravljenja ali po 21 dneh od nastopa bolezni, v kolikor ni bilo zdravljenja z antibiotiki. O vrnitvi po okužbi z davico odloči otrokov zdravnik, ki se posvetuje z območnim epidemiologom, v primeru tuberkuloze pa o vrnitvi odloča pulmolog, piše v smernicah NIJZ.
V primeru, da ima otrok črevesno nalezljivo bolezen, kot je rotavirus, torej driska ali bruha, se lahko v šolo ali vrtec vključi po dveh dnevih od zadnjega bruhanja ali driske. V kolikor ima otrok ošpice, se lahko vrne po štirih dneh po pojavu izpuščaja, če ima rdečke pa po šestih. V primeru garij, se lahko v kolektiv vrne takoj po uspešnem zdravljenju. Pri ostalih kožno nalezljivih bolezni kot so mehkužke, bradavice in mikrosporija ni omejitev za vrnitev, je pa pri mikrosporiji potrebno, da starši pokrijejo kožne spremembe, sporočajo iz inštituta.
Smernice za ravnanje v primeru ostalih nalezljivih bolezni so dostopne na spletni strani inštituta, pri pripravi pa so izhajali iz različnih strokovnih virov, vključno s podobnimi priporočili tujih javnozdravstvenih nacionalnih ustanov.
“,”Jaka Verbic Miklic”,1737205080,1737205080,sl,15580,306,15579,43,0,NULL,,”Otrok naj se v šolo ali vrtec vrne, ko ne kaže znakov bolezni”,otrok-naj-se-v-solo-ali-vrtec-vrne-ko-ne-kaze-znakov-bolezni,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740574766,1740574766
1117,15582,”Kemijski inštitut razvil nov terapevtski pristop za boj proti raku”,”Uporabili so ga že v predkliničnih raziskavah na miših z melanomom, v katerih je bil učinkovit v štiridesetih odstotkih primerov”,”
Ljubljana, 22. januarja – Terapevtski pristop, ki so ga razvili raziskovalci in raziskovalke Kemijskega inštituta, z vnosom proteinov povzroča celično smrt rakavih celic in krepi imunski sistem. Uporabili so ga že v predkliničnih raziskavah na miših z melanomom, v katerih je bil učinkovit v štiridesetih odstotkih primerov, so danes sporočili z inštituta.
Raziskovalci in raziskovalke so se pri razvijanju pristopa navdihovali pri inflamosomih, ki so sestavni del prirojenega imunskega sistema. Inflamosomi so proteinski stroji, ki celice človeškega telesa uporabljajo kot orodje v boju proti škodljivim mikroorganizmom. V okuženih celicah inflamosomi zaznajo prisotnost mikroorganizma, nato pa sprožijo posebno obliko celične smrti, pri kateri z izločanjem vnetnih molekul citokinov in izlitjem vsebine celice sprožijo vnetje, ki na mesto okužbe privlači imunske celice, so navedli v sporočilu za javnost.
V tumorske celice miši z melanomom so raziskovalci vnesli zapis za protein gasdermin D, ki naluknja celično membrano in sproži celično smrt ter vnetje. Obenem pa so v rakave celice vnesli zapis za citokine, ki v kombinaciji z izlito celično vsebino odmrlih celic delujejo kot alarm za imunske celice. Te vstopijo v tumor in se spopadejo z rakavimi celicami. S pristopom, ki spodbuja protitumorsko delovanje imunskih celic so raziskovalci ozdravili štirideset odstotkov miši z melanomom, ki velja za izredno agresivno obliko raka, so sporočili z inštituta.
Raziskovalci so obenem ugotovili, da določeni tipi citokina, kot je interlevkin 12, ojačajo protitumorsko delovanje imunskih celic, medtem ko ga drugi, kot je interferon gama, zavirajo. Za uspešno zdravljenje je torej potrebna posebna previdnost pri izbiri citokina. Proteine so v tumorske celice vnesli s pomočjo elektroporacije, ki je priročna predvsem za lažje dostopne tumorje, kot so različne vrste kožnega raka ali raka dojk. V prihodnosti, pa raziskovalci nameravajo raziskati drugačne načine dostave proteinov, ki bi lahko omogočili tudi zdravljenje manj dostopnih tumorjev, so navedli na inštitutu.
Raziskavo so izvedli Sara Orehek, Taja Železnik Ramuta, Duško Lainšček, Špela Malenšek, Martin Šala, Mojca Benčina, Roman Jerala in Iva Hafner Bratkovič, rezultate raziskave pa so objavili v ugledni znanstveni reviji Nature Communications, so navedli v sporočilu za javnost.
“,”Jaka Verbic Miklic”,1737550860,1737550860,sl,15582,306,15581,43,0,NULL,,”Kemijski inštitut razvil nov terapevtski pristop za boj proti raku”,kemijski-institut-razvil-nov-terapevtski-pristop-za-boj-proti-raku,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740574929,1740574929
1118,15584,”Cepljena dekleta za skoraj polovico manj zbolevajo za predrakavimi spremembami materničnega vratu”,”Brezplačno cepljenje proti HPV za dekleta v Sloveniji izvajajo od leta 2009, za dečke pa od leta 2021.”,”
Ljubljana, 26. januarja – Generacije slovenskih deklet, ki so cepljene proti HPV, za skoraj polovico manj zbolevajo za predrakavimi spremembami materničnega vratu visoke stopnje kot generacije, ki te možnosti še niso imele, je pokazala kohortna raziskava programa Zora. Brezplačno cepljenje proti HPV za dekleta v Sloveniji izvajajo od leta 2009, za dečke pa od leta 2021.
Članek s prvimi ugotovitvami programa Zora glede učinka cepljenja proti HPV v Sloveniji so nedavno objavili v ugledni strokovni reviji The Lancet Regional Health – Europe, so zapisali na spletni strani programa.
V raziskavi so ugotavljali pogostost predrakavih sprememb visoke stopnje (CIN2+) pri cepljenih in necepljenih dekletih v petih letih po tem, ko so se prvič udeležile presejalnega pregleda.
Ugotovili so, da je pojavnost predrakavih sprememb pri generaciji deklet, ki so rojene med letoma 1998 in 2001 ter so imele priložnost cepljenja proti HPV v 6. razredu osnovne šole, 42 odstotkov manjša kot pri generaciji deklet, rojenih med letoma 1994 in 1997. Slednje priložnosti cepljenja proti HPV namreč niso imele, saj to še ni bilo v nacionalnem programu cepljenja, ko so obiskovale 6. razred osnovne šole.
V programu Zora so ocenili, da raziskava potrjuje učinkovitost cepljenja proti HPV in poziva k še večjemu prizadevanju za povečanje precepljenosti deklic in dečkov proti HPV na poti k preprečevanju raka materničnega vratu. Rezultati pa so pokazali učinkovitost cepljenja, kljub temu da je trenutna precepljenost v Sloveniji okoli 50-odstotna.
Dodali so, da si je podobno kot Svetovna zdravstvena organizacija, tudi Evropska unija v okviru načrta za boj proti raku zadala cilj, da bo do leta 2030 dosegla 90-odstotno precepljenost.
Raziskavo so izvedli v sodelovanju s strokovnjaki iz univerzitetnega kliničnega centra Erasmus MC z Nizozemske v okviru projekta EU-TOPIA-EAST. Projekt financira program Evropske unije Obzorje 2020 z namenom optimizacije presejalnih programov za raka materničnega vratu v Evropi, še posebej v vzhodnoevropskih državah.
V Zvezi slovenskih društev za boj proti raku pa so poudarili, da je okužba s HPV glavni vzrok za nastanek raka materničnega vratu, zato lahko skoraj vse primere tega raka preprečimo s cepljenjem in organiziranimi preventivnimi programi za odkrivanje predrakavih in zgodnjih rakavih sprememb na materničnem vratu, so zapisali v sporočilu za javnost.
Spomnili so, da v Sloveniji od leta 2003 zelo uspešno deluje državni presejalni program Zora, cepljenje proti HPV pa se v Sloveniji izvaja v 6. razredu osnovne šole. Brezplačno cepljenje proti HPV je od lani na voljo vsem do dopolnjenega 26. leta starosti.
Ta teden sicer obeležujemo 19. evropski teden preprečevanja raka materničnega vratu.
“,”Jaka Verbic Miklic”,1737896580,1737896580,sl,15584,306,15583,43,0,NULL,,”Cepljena dekleta za skoraj polovico manj zbolevajo za predrakavimi spremembami materničnega vratu”,cepljena-dekleta-za-skoraj-polovico-manj-zbolevajo-za-predrakavimi-spremembami-maternicnega-vratu,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740575049,1740575050
1119,15586,”V letošnji sezoni gripe doslej cepljenih več kot 122 tisoč ljudi”,”Pri ranljivih skupinah prebivalstva lahko poteka težje, s pogostimi zapleti, kot so virusne in bakterijske pljučnice”,”
Ljubljana, 28. januarja – Sezona gripe je v teku, pojavlja se po vsej državi. Proti gripi se je še vedno smiselno cepiti, so poudarili na spletni strani NIJZ. V letošnji sezoni se je proti tej bolezni doslej cepilo več kot 122.000 prebivalcev Slovenije. To je več kot v vsej lanski sezoni, ko se je proti gripi cepilo 118.118 oziroma 5,6 odstotka prebivalcev.
V letošnji sezoni se je proti gripi doslej cepilo 5,7 odstotka prebivalcev Slovenije. Čeprav se je letos doslej cepilo več ljudi kot v vsej lanski sezoni, precepljenost proti gripi v Sloveniji ostaja nizka, so pojasnili na Nacionalnem inštitutu za javno zdravje (NIJZ).
V tej sezoni je najvišji delež cepljenih proti gripi med starejšimi od 80 let. V tej starostni skupini se je cepilo skoraj 20 odstotkov ljudi. Blizu 20 odstotkov precepljenih je tudi v starostni skupini 70-79 let. Žal pa je to daleč od priporočila Svetovne zdravstvene organizacije, da se proti gripi cepi vsaj 75 odstotkov starejših odraslih, so navedli na NIJZ.
Na glede na to, da je gripa v porastu in da se pojavlja po vseh državi, je cepljenje proti tej bolezni, zaradi katere vsako leto zboli med 100.000 in 200.000 prebivalcev Slovenije, še vedno smiselno.
Kot so poudarili na inštitutu, je cepljenje namreč najboljša zaščita proti gripi, predvsem pred težkim potekom, ki lahko zahteva tudi bolnišnično zdravljenje. Priporočljivo pa je čimprejšnje cepljenje, saj se v telesu zaščita vzpostavi šele čez nekaj časa.
Cepljenje je brezplačno za vse osebe z urejenim obveznim zdravstvenim zavarovanjem. Opraviti ga je treba vsako leto.
Na NIJZ cepljenje proti gripi priporočajo vsem prebivalcem, ki so starejši od šestih mesecev. Še zlasti pa ga priporočajo tistim skupinam, ki imajo večje tveganje za težek potek bolezni. To so osebe, stare 65 let in več, kronični bolniki, osebe z izrazito povečano telesno težo, otroci, stari od šest do 23 mesecev ter nosečnice.
Ne glede na to, da gripa pri mladih brez kroničnih bolezni večinoma poteka z nekajdnevno vročino, z znaki obolenja dihal ter bolečinami v mišicah in sklepih, pa pri ranljivih skupinah prebivalstva lahko poteka težje, s pogostimi zapleti,kot so virusne in bakterijske pljučnice, in tudi z višjo smrtnostjo. Pri kroničnih bolnikih lahko pride do poslabšanja osnovne bolezni, so še zapisali na NIJZ.
“,”Jaka Verbic Miklic”,1738069680,1738069680,sl,15586,306,15585,43,0,NULL,,”V letošnji sezoni gripe doslej cepljenih več kot 122 tisoč ljudi”,v-letosnji-sezoni-gripe-doslej-cepljenih-vec-kot-122-tisoc-ljudi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740575444,1740575444
1120,15588,”Svetovni dan boja proti raku v ospredje postavlja prilagojeno obravnavo raka”,”V zadnjih letih je Slovenija po njihovih navedbah dosegla velik napredek na področju raka, kar potrjuje tudi poročilo Evropske komisije in Organizacije za ekonomsko sodelovanje in razvoj (OECD) o (ne)enakosti obravnave raka.”,”
Ljubljana, 4. februarja – Zaznamujemo svetovni dan boja proti raku. Letos se začenja nova triletna mednarodna kampanja z sloganom Združeni v edinstvenosti, ki v ospredje postavlja posamezniku prilagojeno obravnavo raka. Slovenije je sicer glede na poročilo OECD v zadnjih letih dosegla velik napredek pri obravnavi raka, priložnosti pa so med drugim v okrepljeni preventivi.
V Sloveniji se tako kot drugod po svetu soočamo z velikim javnozdravstvenim bremenom raka, a uspešno krepimo presejalne programe za raka, dostop do najnovejših načinov zdravljenja in celostno obravnavo bolnikov z rakom, so v skupni izjavi za javnost zapisali pri Državnem programu obvladovanja raka in Onkološkem inštitutu Ljubljana.
V zadnjih letih je Slovenija po njihovih navedbah dosegla velik napredek na področju raka, kar potrjuje tudi poročilo Evropske komisije in Organizacije za ekonomsko sodelovanje in razvoj (OECD) o (ne)enakosti obravnave raka. Hkrati poročilo izpostavlja priložnost za nadaljnje izboljšave z močnejšim poudarkom na primarni preventivi. Po ocenah bi lahko med letoma 2023 in 2050 s tem v Sloveniji preprečili več tisoč primerov raka.
Z izpolnitvijo ciljev za zmanjšanje uporabe tobaka bi lahko preprečili 6714 primerov raka, 2403 primere bi lahko preprečili z zmanjšanjem onesnaženosti zraka, 1059 primerov z uresničitvijo ciljev za zmanjšanje debelosti, 529 primerov raka pa bi lahko preprečili z zmanjšanjem škodljivega pitja alkohola.
Poročilo Evropske komisije in OECD prepoznava več ključnih prednosti onkološke oskrbe v Sloveniji. V Sloveniji je onkološko zdravstveno varstvo izjemno visoko dostopno, krije pa ga obvezno zdravstveno zavarovanje, kar zagotavlja enakopravno obravnavo bolnikov, so navedli pri državnem programu in inštitutu.
Visoki standardi kakovosti obravnave bolnikov z rakom so po njihovih navedbah vzpostavljeni z večdisciplinarno celostno obravnavo, ki je v Sloveniji že uveljavljen standard in ga dodatno podpirajo cilji državnega programa obvladovanja raka za obdobje od leta 2022 do leta 2026. Sistematično spremljanje kakovosti onkoloških obravnav, ki ga izvajata slovenski register raka in strokovne skupine v okviru državnega programa, omogoča izboljšave na podlagi podatkov.
Omenjeno evropsko poročilo pomemben napredek za Slovenijo prepoznava tudi v razvoju celostne rehabilitacije in specializirane paliativne oskrbe v zadnjih letih, pri čimer je za nadaljnji razvoj ključno zlasti zagotavljanje dodatnih strokovnjakov s teh dveh področij.
Slovenija ostaja med vodilnimi državami EU na področju vseh treh, s strokovnimi dokazi podprtih organiziranih presejalnih programov za raka materničnega vratu (Zora), raka dojk (Dora) ter raka debelega črevesa in danke (Svit). Vsi trije programi, ki imajo eno izmed najvišjih stopenj udeležbe v državah EU, se izvajajo v skladu z evropskimi smernicami kakovosti in jih v celoti krije obvezno zdravstveno zavarovanje.
“,”Jaka Verbic Miklic”,1740575640,1740575640,sl,15588,306,15587,43,0,NULL,,”Svetovni dan boja proti raku v ospredje postavlja prilagojeno obravnavo raka”,svetovni-dan-boja-proti-raku-v-ospredje-postavlja-prilagojeno-obravnavo-raka,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740575800,1740575801
1121,15590,”Na matineji redkih boleznih izpostavili pomen podpore in vlogo žensk”,” “,”
Ljubljana, 11. februarja – Na matineji Združenja za redke bolezni pred svetovnim dnevom redkih bolezni, ki ga obeležujemo zadnji dan v mesecu, so sogovorniki izpostavili pomen Centra za redke bolezni, ki nudi celostno obravnavo in podporo bolnikom ter družinam. Pogovor se je dotaknil tudi žensk in redkih boleznih, kjer so spodbudili iskanje podpore pri različnih združenjih.
Več, kot si lahko predstavljaš, je letošnji globalni slogan dneva, zato so matineji, ki je potekala v hotelu Slon, dali naslov Več podpore, kot si lahko predstavljaš.
Podatki kažejo, da naj bi bilo v Sloveniji okoli 130.000 bolnikov z redkimi boleznimi, je predstavil predsednik Združenja za redke bolezni Slovenije Jože Faganel.
Na dogodku so izpostavili pomen Centra za redke bolezni, ki ga vodi specialistka klinične genetike Sara Bertok. “Gre za skupino strokovnjakov, visoko specializiranih zdravnikov, medicinskih sester, kliničnih psihologov, socialne delavke in drugih strokovnih delavcev,” je pojasnila Bertok. Ti delujejo na področju diagnostike, celostnega vodenja, predvsem pa poskušajo zagotoviti čim boljšo podporo otrokom, mladostnikom in njihovim družinam. Njihov cilj je, da nudijo celostno obravnavo in podporo. “Naj se zdravniki in strokovnjaki vrtijo okoli bolnika in družine, ne družina okoli njih,” je še poudarila.
Socialna delavka Klara Škvarč Kirn je ob tem izpostavila, da je pomembno družinam dati občutek, da niso sami, ter da vedo, kam poklicati ob začetku postavljene diagnoze. Poudarila je tudi pomen pomoči lokalnih organizacij.
Vloga žensk je bila ena izmed tem na današnjem dogodku, kjer je Faganel izpostavil vlogo mame. Pomembno se mu zdi, da se mama ne čuti krivo, da otroka obravnava kot normalnega in da od otroka kljub bolezni še vedno pričakuje veliko.
Predsednici Združenja za miastenijo gravis in kongenitalni miastenični sindrom Saša Ciber in Združenja bolnikov s hereditarnim angioedemom Teja Iskra Cigljar pa sta spregovorili o bolezni in njunih izkušnjah z nosečnostjo.
Ciber je ustanovila združenje, saj v času nosečnosti ni prejela dovolj podpore, je pojasnila. Ustanavljanje društev za posamezne redke bolezni se ji zdi izredno pomembno.
Obe sta mladim bolnicam svetovali, da naj se pred načrtovanjem nosečnosti posvetujejo s svojim izbranim zdravnikom, ginekologom ter si poiščejo podporo tudi v združenjih, kjer lahko najdejo različne informacije in izkušnje drugih z isto boleznijo.
Faganel je še povedal, da bo letošnja nacionalna konferenca za redke bolezni potekala v sredo, 26. februarja.
“,”Jaka Verbic Miklic”,1739279880,1739279880,sl,15590,306,15589,43,0,NULL,,”Na matineji redkih boleznih izpostavili pomen podpore in vlogo žensk”,na-matineji-redkih-boleznih-izpostavili-pomen-podpore-in-vlogo-zensk,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740576103,1740576104
1122,15592,”V Teksasu potrdili 48 primerov ošpic”,” “,”
Austin, 15. februarja – V ameriškem Teksasu so do petka potrdili 48 primerov ošpic, poroča francoska tiskovna agencija AFP. Večino primerov so potrdili pri otrocih, ki niso bili cepljeni, 13 jih je moralo v bolnišnice.
“,”Jaka Verbic Miklic”,1739625720,1739625720,sl,15592,306,15591,43,0,NULL,,”V Teksasu potrdili 48 primerov ošpic”,v-teksasu-potrdili-48-primerov-ospic,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1740576218,1740576218
1123,15594,”Poročilo s posveta o pomenu PROMov in PREMov ter vlogi bolnikov”,”PROMi in PREMi so v tujini že več desetletij priznani kazalniki kakovosti za oblikovanje na vrednosti temelječe zdravstvene obravnave skozi oči pacientov.”,”
Ljubljana, 12. marec 2025: Na posvetu o pomenu PROMov in PREMov ter vlogi bolnikov, ki je za predstavnike organizacij pacientov potekal na Zdravniški zbornici Slovenije, so strokovnjaki predstavili uporabo kazalnikov kakovosti za na vrednosti temelječo zdravstveno obravnavo (NaVTeZ) koronarnih in onkoloških bolnikov v praksi. Udeleženci so se seznanili z izkušnjami delovne skupine Ministrstva za zdravje za postopno uvedbo NaVTeZ ter spoznali vlogo bolnikov pri njeni izvedbi. Posvet, ki sta ga v partnerstvu pripravila Zveza organizacij pacientov Slovenije in Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ, je sklenila polemična razprava o pomenu in izzivih uvedbe kazalnikov za vrednotenje kakovosti v zdravstvu skozi perspektivo bolnikov.
PROMi (patient-reported outcome measures) in PREMi (patient-reported experience measures) so v tujini že več desetletij priznani kazalniki kakovosti za oblikovanje na vrednosti temelječe zdravstvene obravnave skozi oči pacientov. Na eni strani gre za vrednotenje zdravstvene obravnave s pomočjo standardiziranega poročanja bolnikov o izidih zdravljenja (PROMi), na drugi pa za poročane izkušnje bolnikov z zdravstvenimi storitvami (PREMi). Pristop v središče postavlja paciente, odločevalcem in izvajalcem zdravstvenih storitev pa poleg razumevanja kliničnih izidov obravnave zagotavlja tudi dejanski vpogled v oceno bolnikov o dejanskih rezultatih zdravljenja in vrednosti zdravstvene obravnave za njihovo kakovost življenja.
Vrednotenje zdravstvene obravnave skozi perspektivo bolnikov tako v središče postavlja njihove potrebe in želje, prispeva h kakovostnejšemu zdravstvenemu varstvu in spodbuja k inovacijam v zdravstvu. Bolnikom na vrednosti temelječa zdravstvena obravnava omogoča primerjavo kakovosti posameznih medicinskih intervencij in zdravstvenih zavodov; izvajalcem zdravstvenih storitev načrtovanje izboljšav in učinkovitejše obvladovanje stranskih učinkov zdravljenja, plačnikom zdravstvenih storitev pa plačilo po izidih obravnave.
Predstojnik Kliničnega oddelka za žilne bolezni UKC Ljubljana prof. dr. Borut Jug, dr. med., spec. kardiologije in vaskularne medicine, je predstavil različne standardizirane vprašalnike PROMe, ki jih na oddelku uporabljajo za oceno izidov zdravljenja in posameznih medicinskih intervencij s strani koronarnih bolnikov: »Z vidika bolnikove perspektive so vsaj toliko kot naši izvidi pomembni počutje, simptomi, skrb, ali sem zmožen skrbeti zase in vsakodnevne aktivnosti, ali sem mobilen in pa moje duševno zdravje.» Za oceno bolnikovih izkušenj oziroma zadovoljstva s posamezno zdravstveno obravnavo (PREMi) pa so jim v pomoč podatki, ki so pridobljeni s pomočjo splošnejših vprašalnikov NIJZ. Spremljanje različnih kazalnikov kakovosti, tudi PROMov in PREMov, jim omogoča primerjavo kakovosti posameznih dejavnosti in centrov za obvladovanje kardiovaskularnega tveganja ter sekundarne preventive in rehabilitacije.
Na Onkološkem inštitutu Ljubljana si s celostno obravnavo bolnikov prizadevajo za boljše izide zdravljenja in počutje bolnikov, učinkovitejše obvladovanje simptomov, večjo kakovost življenja in izboljšanje onkološke oskrbe, ki mora biti prilagojena bolnikovim individualnim potrebam in željam. V ta namen s pomočjo standardiziranega vprašalnika o kakovosti življenja Evropske organizacije za razvoj in klinične raziskave analizirajo odgovore na 30 vprašanj, s katerimi poskušajo ugotoviti, kaj o izidih zdravljenja poročajo bolniki. Zanima jih predvsem dinamika simptomov in težav, s katerimi se skozi čas spoprijemajo, da se lahko nanje pravočasno odzovejo in stremijo k izboljšanju kakovosti onkološke obravnave. Bolnikom vprašalnike pošiljajo po pošti, prek aplikacije, pred kratkim so vprašalnike pričeli pošiljati tudi prek SMS. Bolnik vprašalnike prejme periodično – po prvi obravnavi, štirih, osmih, 12 in po 24 mesecih, standardizirani zapisi pa se prenašajo v Centralni register podatkov o pacientu (CRPP) in v standardizirano obliko za bolnika. Velik izziv ostaja slab odziv bolnikov na vprašalnike o izidih obravnave, čeprav jim v praksi prav izpolnjevanje teh vprašalnikov omogoča sprotno strokovno obravnavo težav, s katerimi se bolniki lahko soočajo. Koordinator celostne obravnave na podlagi natančnega točkovnega sistema in dodatnih presejalnih vprašalnikov namreč prepozna ogrožene bolnike: »Opravi telefonski klic, se z njimi pogovori o težavah, ki so izpostavljene v samem vprašalniku in na podlagi tega ukrepa. Ali gre za zdravstveno svetovanja oz. nadaljnjo obravnavo pri strokovnjaku,» je pojasnila koordinatorica kliničnih raziskav na Onkološkem inštitutu Ljubljana Aleksandra Grbič.
Kako pomembni so PROMi in PREMi v luči doseganja najboljših rezultatov za bolnike ob optimalni uporabi razpoložljivih virov ter kako se kazalniki za NaVTeZ po posameznih diagnozah postopno uvajajo v onkologiji, kardiologiji, oftalmologiji in ortopediji, je predstavila Nina Remškar iz delovne skupine za uvajanje NaVTeZ Ministrstva za zdravje. Na primeru obravnave raka prostate v Nemčiji, na Švedskem in konkretno v ugledni nemški kliniki za raka prostate Martini – Klinik je slikovito ponazorila pomen in dejansko vrednost PROMov. V omenjenem primeru so primerjali izide obravnave bolnikov po operaciji raka prostate skozi perspektivo bolnikov: »Lahko ugotovimo, da je pet let po operaciji raka prostate živelo med 94 in 95 % pacientov. Če bi primerjali zgolj stopnjo preživetja, bi lahko ugotovili, da je kakovost operacije oz. obravnave na klinikah v Nemčiji in na Švedskem povsod enaka. Ko so primerjali še inkontinenco, o kateri so poročali pacienti, so ugotovili, da je na splošno v Nemčiji in na Švedskem približno polovica pacientov eno leto po operaciji raka prostate inkontinentna, medtem ko je bilo v Martini – Klinik takih 6,5 % pacientov.» Pomembna razlika v prid zdravstvene obravnave v Martini – Klinik se je pokazala tudi glede erektilne disfunkcije leto dni po operaciji raka prostate. Takšni podatki bolnikom zagotavljajo možnost za izbiro klinike z najboljšimi rezultati s perspektive pacientov, hkrati pa izvajalcem zdravstvenih storitev omogočajo analizo in priložnosti za izboljšavo kakovosti svoje zdravstvene obravnave.
Mag. Gregor Cuzak, generalni sekretar Zveze organizacij pacientov Slovenije, ki je odigral ključno vlogo pri pripravi in izdaji prve publikacije na temo NaVTeZ pri nas z naslovom “Usmeritve za uvedbo na vrednosti temelječe zdravstvene obravnave v Sloveniji”, je opozoril na nenadomestljivo vlogo pacientov pri vrednotenju kakovosti zdravstvene oskrbe, pri čemer, kot je izpostavil: »Merilo ne sme biti cilj, cilj je dobrobit pacienta. Ko postavimo merilo za cilj, je težava, da ko merilo dosežemo, smo vse ostalo zanemarili in na ta način ostanejo stvari, ki jih ne bomo dobro izmerili.«
Zato je kazalnike in orodja za oblikovanje na vrednosti temelječe zdravstvene obravnave vredno poznati, prav tako pa tudi vlogo bolnikov oz. pacientskih organizacij pri njenem oblikovanju ter jih zlagoma implementirati v slovenski zdravstveni sistem. Čeprav ostaja na tej poti veliko izzivov, so se udeleženci razprave, s katero so sklenili posvet, strinjali, da brez aktivnega sodelovanja pacientov pri oceni kakovosti zdravstvene obravnave, njene resnične vrednosti ni mogoče ovrednotiti in je zato tudi ne usmerjeno izboljševati.
“,”Jaka Verbic Miklic”,1741760940,1741760940,sl,15594,306,15593,43,0,NULL,,”Poročilo s posveta o pomenu PROMov in PREMov”,porocilo-s-posveta-o-pomenu-promov-in-premov,Post,”/sites/43/files/images/news/PROMov in PREMov/Posvet.png”,1,0,1742365936,1742366060
1124,15596,”Vabilo na 14-to konferenco Vrednost inovacij”,”Zdravje kot gibalo družbeno-ekonomskega razvoja.”,”
Spoštovani,
Vljudno vabljeni na 14. strateško konferenco Vrednost inovacij:
Zdravje kot gibalo družbeno-ekonomskega razvoja.
Potekala bo v torek, 27. maja 2025, od 11. do 15. ure, v Klubu Cankarjevega doma.
Na letošnji konferenci bomo v ospredje postavili pomen medsektorskega sodelovanja za oblikovanje trajnostnega zdravstvenega sistema, z jasnim ciljem prispevati k večji blaginji celotne družbe.
Uvodni del konference bo zaznamovalo predavanje dr. Aleksandra Zadela, kliničnega psihologa in direktorja Inštituta za osebni razvoj C.A.R., ki bo spregovoril o izzivih sodelovanja med ključnimi akterji v zdravstvenem ekosistemu ter vplivu družbeno-kulturnih dejavnikov na razvoj družbe in njenih pod-sistemov, vključno z zdravstvom.
Sledilo bo predavanje izr. prof. dr. Petre Došenović Bonča z Ekonomske fakultete Univerze v Ljubljani, ki bo osvetlila pomen sodelovanja gospodarstva in zdravstva kot temelja za dolgoročno uspešne in trajnostne rešitve.
Uvodni sklop bo zaključil izr. prof. dr. Branko Gabrovec, generalni direktor Nacionalnega inštituta za javno zdravje, s predavanjem o pomembnosti usklajenih politik in skupnega delovanja vseh deležnikov pri krepitvi javnega zdravja in spodbujanju trajnostnega razvoja celotne družbe.
Sledila bo okrogla miza pod moderatorstvom prof. dr. Dejana Verčiča, na kateri bodo sodelovali ugledni predstavniki zdravstva in gospodarstva:
Sogovorniki bodo razpravljali o pomenu sodelovanja in oblikovanja skupnih politik za krepitev zdravja, ki prispevajo k večji produktivnosti, boljšim gospodarskim rezultatom ter višji družbeni blaginji.
Veselimo se vaše prisotnosti ter skupnega razmisleka o oblikovanju prihodnosti slovenskega zdravstvenega sistema.
Več o konferenci si lahko preberete TUKAJ.
Strateški partner FarmaForuma je letos Gospodarska zbornica Slovenije.
“,”Jaka Verbic Miklic”,1743441900,1743441900,sl,15596,306,15595,43,0,NULL,,”Vabilo na 14-to konferenco Vrednost inovacij”,vabilo-na-14-to-konferenco-vrednost-inovacij,Post,”/sites/43/files/images/news/14. strateska konferenca/Naslovna 1.jpg”,1,0,1743442051,1743443504
1125,15596,”Invitation to 14th Strategic Conference Value of Innovations”,”Health as a Driver of Socio-Economic Development”,”
Dear guest,
You are kindly invited to the 14th Strategic Conference Value of Innovations:
Health as a Driver of Socio-Economic Development.
The conference will take place on
Tuesday, May 27, 2025, from 11:00 AM to 3:00 PM at Klub Cankarjev dom.
This year’s conference will highlight the importance of cross-sector collaboration in shaping a sustainable healthcare system, with a clear goal of contributing to the overall well-being of society.
The opening part of the conference will feature a lecture by Aleksander Zadel, PhD, clinical psychologist and director of the Institute for Personal Development C.A.R., who will speak about the challenges of cooperation among key actors in the healthcare ecosystem and the influence of socio-cultural factors on the development of society and its subsystems, including healthcare.
This will be followed by a lecture by Assoc. Prof. Petra Došenović Bonča, PhD, from the School of Economics and Business, University of Ljubljana, who will highlight the importance of cooperation between the economy and healthcare as a foundation for long-term successful and sustainable solutions.
The opening block will conclude with a lecture by Assoc. Prof. Branko Gabrovec, PhD, Director General of the National Institute of Public Health, on the importance of coordinated policies and joint action by all stakeholders in strengthening public health and promoting sustainable development of society as a whole.
This will be followed by a panel discussion, moderated by Prof. Dejan Verčič, PhD, featuring distinguished representatives from the healthcare and economy sectors:
The panelists will discuss the importance of cooperation and the development of joint policies to strengthen health, which contribute to increased productivity, better economic outcomes, and greater social well-being.
We look forward to welcoming you and shaping the future of Slovenia’s healthcare system together.
To learn more about the conference, click HERE.
This year’s strategic partner of FarmaForum is the Chamber of Commerce and Industry of Slovenia.
“,”Jaka Verbic Miklic”,1743441900,1743441900,en,15596,306,15595,43,0,NULL,,”Vabilo na 14-to konferenco Vrednost inovacij”,vabilo-na-14-to-konferenco-vrednost-inovacij,Post,”/sites/43/files/images/news/14. strateska konferenca/Naslovna 1.jpg”,1,0,1743442051,1743443504
1126,15598,”Ob svetovnem dnevu redkih bolezni pozivi za boljšo dostopnost zdravil”,”Državo pozivajo, da čim prej zagotovi mehanizem, ki bo lahko stanje na tem področju popravil.”,”
Ljubljana, 28. februarja – Otroci z redkimi boleznimi in njihovi starši se vse bolj pogosto soočajo s problematiko dostopnosti do najnovejših genskih zdravil, so ob današnjem svetovnem dnevu redkih bolezni na ljubljanskem Trgu republike izpostavili v Društvu Viljem Julijan. Državo pozivajo, da čim prej zagotovi mehanizem, ki bo lahko stanje na tem področju popravil.
Vsako leto 28. februarja, ob prestopnih letih pa 29. februarja, zaznamujemo svetovni dan redkih bolezni. V Društvu Viljem Julijan so se z namenom ozaveščanja o redkih boleznih danes z otroki z redkimi boleznimi in njihovimi družinami sprehodili po ljubljanskih ulicah in med drugim opozorili na pomanjkljivo dostopnost in financiranje genskih zdravil.
“Znašli smo se v situaciji, ko imamo na eni strani gensko zdravilo, ki pomaga, na drugi strani pa imamo otroke, kot so Matic, Karolina in Miloš, ki do teh zdravil ne morejo. Starši in državljani ne moremo v neskončnost na naših plečih zbirati donacij, da bodo ti otroci prišli do zdravil, zato srčno apeliramo na našo državo, da čim prej zagotovi mehanizem, ki bo lahko stanje na tem področju popravil,” je danes dejal ustanovitelj društva Gregor Bezenšek.
V Društvu Viljem Julijan so na državo naslovili tudi poziv, da za otroke z redkimi boleznimi uredi paliativno oskrbo in jim zagotovi pomoč tretje osebe na domu. Bezenšek je opozoril, da je oskrba teh otrok pogosto zelo zahtevna, zato so starši, še posebej samohranilci, večkrat izčrpani in potrebujejo pomoč. Želijo si tudi, da bi država otrokom zagotovila več terapij, saj trenutno zanje še vedno zbirajo zamaške in prirejajo dobrodelne koncerte.
Bezenšek je zbranim zagotovil, da jim bodo v društvu še naprej pomagali, a del te odgovornosti mora nase prevzeti tudi država. Otroci z redkimi boleznimi so del družbe in si zaslužijo najboljšo možno oskrbo na vseh ravneh, je bil jasen predsednik društva Nejc Jelen. Napovedal je, da se bodo v društvu še naprej borili za prav za vsakega otroka posebej in glasno opozarjali na sistemske pomanjkljivosti.
Redke bolezni so v Evropi opredeljene kot bolezni, ki prizadenejo največ pet oseb na 10.000 prebivalcev. Čeprav je posamična redka bolezen lahko zelo redka, pa je različnih vrst redkih bolezni zelo veliko, po ocenah vsaj 8000, in skupaj prizadenejo med štiri do sedem odstotkov prebivalstva. Kar 75 odstotkov redkih bolezni prizadene otroke, za 95 odstotkov pa ni zdravila ali zdravljenja, opozarjajo v društvu.
“,”Jaka Verbic Miklic”,1740725520,1740725520,sl,15598,306,15597,43,0,NULL,,”Ob svetovnem dnevu redkih bolezni pozivi za boljšo dostopnost zdravil”,ob-svetovnem-dnevu-redkih-bolezni-pozivi-za-boljso-dostopnost-zdravil,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1744955630,1744955630
1127,15600,”Ob dnevu ozaveščanja o HPV cepilni dan za mlade”,”Mladostnikom in mladim odraslim do dopolnjenega 26-ega leta starosti cepljenje proti HPV krije obvezno zdravstveno zavarovanje.”,”
Ljubljana, 4. marca – Nacionalni inštitut za javno zdravje (NIJZ) ob letošnjem mednarodnem dnevu ozaveščanja o humanih papilomavirusih (HPV) skupaj s petimi zdravstvenimi domovi v univerzitetnih mestih po državi danes organizira skupno akcijo cepljenja študentov in mladih. Akcija poteka pod geslom Šeraj ljubezen, ne bolezen, so sporočili z NIJZ.
Cepljenje za študente in mlade do 26. leta starosti danes poteka v zdravstvenih domovih Maribor, Koper, Novo mesto in Nova Gorica. V Ljubljani je cepljenje v Zdravstvenem domu (ZD) za študente. Za zagotovitev termina je bila potrebna predhodna prijava.
Z NIJZ so danes sporočili, da se je na cepljenje proti HPV v okviru akcije skupaj prijavilo več kot 360 študentov. Ker so bili v ljubljanskem ZD za študente vsi današnji termini zasedeni, so odprli dodaten termin, in sicer 12. marca. Tudi takrat so vsi termini že zasedeni. Vsi, ki bi se še želeli cepiti proti HPV, lahko to storijo še 13. marca.
Na inštitutu so ob mednarodnem dnevu poudarili, da so okužbe s HPV ene najpogostejših spolno prenosljivih okužb v svetu in tudi v Sloveniji. S HPV se namreč vsaj enkrat v življenju okuži med 80 in 90 odstotkov ljudi, večina že kmalu po začetku spolne aktivnosti.
Pogostost okužb je tako najvišja pri mladostnikih in mlajših odraslih, starih med 15 in 25 let. Pri 90 odstotkih okužba izzveni sama, pri 10 odstotkih pa napreduje v dolgotrajno okužbo, ki lahko vodi v nastanek šest vrst rakov tako pri ženskah kot pri moških. Okužbe s HPV tako na leto povzročijo raka pri okoli 200 prebivalcih Slovenije.
Najboljši način preprečevanja okužb s HPV je cepljenje, so poudarili na NIJZ. V Sloveniji se od leta 2009 v skladu z nacionalnim programom cepljenja proti HPV cepi šestošolke, od leta 2021 tudi šestošolce. Cepljenje proti HPV je namreč najbolj učinkovito, če je opravljeno v obdobju zgodnjega mladostništva, še pred začetkom spolne aktivnosti.
Hkrati pa cepljenje proti HPV priporočajo vsem mladostnikom in mladim odraslim do 26. leta. Mladostnikom in mladim odraslim do dopolnjenega 26. leta starosti cepljenje proti HPV krije obvezno zdravstveno zavarovanje.
“,”Jaka Verbic Miklic”,1741071300,1741071300,sl,15600,306,15599,43,0,NULL,,”Ob dnevu ozaveščanja o HPV cepilni dan za mlade”,ob-dnevu-ozavescanja-o-hpv-cepilni-dan-za-mlade,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1744955851,1744962214
1128,15602,”Delovanje ledvic in srčno-žilnega sistema tesno povezano “,”Obiskovalci bodo lahko pri jih opravili različne meritve.”,”
Ljubljana, 11. marca – Delovanje ledvic in srčno-žilnega sistema je tesno povezano, so pred svetovnim dnevom ledvic, ki ga obeležujemo vsako leto drugi četrtek v marcu, javnosti na novinarski konferenci skupaj sporočili predstavniki Društva za zdravje srca in ožilja Slovenije, Zveze društev ledvičnih bolnikov Slovenije in Slovenskega nefrološkega društva.
Omenjena društva skupaj spodbujajo javnost k skrbi za zdravje ledvic in srca in k zgodnjemu odkrivanju kronične ledvične bolezni (KLB) ter s tem preprečevanju številnih zapletov, ki jih ledvične bolezni povzročajo, med drugim srčno-žilne bolezni in prezgodnjo smrt.
Kot je povedal predsednik Društva za zdravje srca in ožilja Slovenije Matija Cevc, KLB pomeni postopno napredujoče in nepovratno slabšanje ledvičnega delovanja, ki ga lahko povzročajo različne ledvične bolezni.
“Bolezen je tesno povezana z nezdravim življenjskim slogom. Ocenjuje se, da ima kronično bolezen vsak deseti odrasel prebivalec, kar pomeni, da je na svetu več kot 500 milijonov odraslih oseb, ki imajo kronično ledvično bolezen, v Sloveniji pa naj bi jih bilo okoli 180.000,” je dodal.
Ker okvara ledvic praviloma ne boli, se neredko zgodi, da bolezni ne prepoznamo, zato moramo biti nanjo pozorni zlasti pri osebah s srčnim popuščanjem, sladkornih bolnikih, osebah z zvišanim krvnim tlakom, ledvičnimi kamni, povečanjem prostate, pogostimi vnetji sečil, pa tudi pri kadilcih in debelih.
Tudi predsednica Slovenskega nefrološkega društva Andreja Marn Pernat je opozorila na dejstvo, da so srčno-žilne bolezni dejavnik tveganja za razvoj kronične ledvične bolezni. Dobra polovica bolnikov s srčnim popuščanjem zboli za kronično ledvično boleznijo, po drugi strani pa se s slabšanjem ledvičnega delovanja za dva do štirikrat poveča pojavnost srčnega popuščanja.
Pri bolnikih s sladkorno boleznijo je najpogostejši zaplet kardiorenalna bolezen, ki se razvije pri dobri tretjini bolnikov. Delno je temu tako, ker imajo srčne in ledvična bolezen enake vzroke za nastanek, pa tudi zato, ker sta srce in ledvica medsebojno tesno povezana in obolevnost enega poslabša tudi delovanje drugega organa, je dodala.
Ker KLB dolgo časa poteka tiho in brez simptomov, večina ljudi ne ve, da so ledvični bolniki, zato jih moramo iskati aktivno s pomočjo presejalnih programov za kronične bolezni, ki se v Sloveniji večinoma izvajajo v sklopu družinskih ambulant, v tako imenovanih referenčnih ambulantah.
Danes je sicer na voljo več zdravil, s katerimi lahko uspešno zdravimo KLB in zaviramo napredovanje ledvične bolezni, zato je po njenem postalo še bolj pomembno, da te bolnike odkrijemo čim prej, saj je zgodnje zdravljenje bistveno bolj uspešno od poznega.
Svetovni dan ledvic je letos namenjen prav osveščanju laične javnosti o pomenu zgodnjega odkrivanja in pravočasnega zdravljenja ledvičnih bolezni. V Sloveniji bomo letos pričeli s ciljanim iskanjem ledvičnih bolezni, zato v društvih ljudi pozivajo, da se odzovejo na vabilo na pregled v referenčno ambulanto in preverijo zdravje svojih ledvic.
Zveza društev ledvičnih bolnikov Slovenije zastopa potrebe bolnikov s KLB in ima 1400 članov. Po besedah predsednice Dragice Mlinšek podporo nudijo bolnikom in njihovim svojcem, da bi čim lažje premagovali težave bolezni in zdravljenja ter da bi še naprej živeli čim bolj dejavno življenje.
Društvo za zdravje srca in ožilja Slovenije od danes ves mesec vabi v posvetovalnico za srce na Dalmatinovi ulici, kjer bodo osveščali o tem, kako so povezane bolezni srca in ledvic. Obiskovalci bodo lahko pri jih opravili različne meritve.
“,”Jaka Verbic Miklic”,1741682640,1741682640,sl,15602,306,15601,43,0,NULL,,”Delovanje ledvic in srčno-žilnega sistema tesno povezano “,delovanje-ledvic-in-srcno-zilnega-sistema-tesno-povezano,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1744962382,1744962382
1129,15604,”Najboljša zaščita proti klopnemu meningoencefalitisu je cepljenje “,”Virus KME se na človeka najpogosteje prenese z vbodom okuženega klopa, zelo redko pa se lahko prenaša tudi z zaužitjem nepasteriziranega mleka ali mlečnih izdelkov narejenih iz mleka kužne živine”,”
Ljubljana, 17. marca – Slovenija še vedno sodi med države z najvišjo pojavnostjo klopnega meningoencefalitisa (KME) v Evropi, so na današnji novinarski konferenci NIJZ opozorili strokovnjaki. V zadnjem desetletju je v Sloveniji za KME zbolelo povprečno 100 ljudi letno. Zbrani so poudarili, da cepljenje predstavlja najučinkovitejšo zaščito proti tej bolezni.
Virus KME se na človeka najpogosteje prenese z vbodom okuženega klopa, zelo redko pa se lahko prenaša tudi z zaužitjem nepasteriziranega mleka ali mlečnih izdelkov narejenih iz mleka kužne živine, je danes pojasnil infektolog in nekdanji predstojnik infekcijske klinike Univerzitetnega kliničnega centra Ljubljana Franc Strle.
KME se najpogosteje pojavlja na Gorenjskem, Koroškem, na Notranjskem in v ljubljanski regiji, je dodala nacionalna koordinatorica programa cepljenja z Nacionalnega inštituta za javno zdravje (NIJZ) Marta Grgič Vitek. Najvišjo obolevnost zaznavajo v starostni skupini od 55 do 64 let. Pri starejših se pogosteje pojavi težek potek bolezni, ki lahko pušča tudi trajne posledice, pri mlajših pa je potek praviloma blažji, vendar ne vedno, je pojasnila.
Na NIJZ cepljenje zato priporočajo vsem, ki so starejši od enega leta ter se gibljejo ali živijo na območju, kjer se bolezen pojavlja. Priporočajo jim, da cepljenje s prvima dvema odmerkoma opravijo v zimskih mesecih z enomesečnim presledkom. Tretji odmerek sledi čez pet do 12 mesecev, prvi poživitveni odmerek sledi po treh letih, naslednji pa na pet let. Zaradi slabšega imunskega odziva so pri starejših osebah priporočljivi poživitveni odmerki na tri leta, je izpostavila Grgič Vitek.
Vsaj z enim odmerkom je cepljenih okoli 22 odstotkov prebivalcev, okoli osem odstotkov odraslih pa se redno cepi, je podatke predstavila Grgič Vitek. Trenutno je cepljenje brezplačno za odrasle, ki so rojeni med letom 1970 in 1980, ter vse otroke, rojene leta 2016 in kasneje, vendar precepljenost v teh generacijah ni bistveno višja.
Na infekcijski kliniki v Ljubljani zdravijo približno 70 odstotkov vseh bolnikov, ki zbolijo za KME, je dejal Strle. Bolezen se prične po inkubaciji, ki najpogosteje traja okoli 10 dni po vbodu klopa. V prvi fazi nastopijo vročina, glavobol, utrujenost in slabo počutje, ki traja nekaj dni. Sledi obdobje brez simptomov, ki traja nekaj dni do tri tedne.
Nato nastopi drugo obdobje bolezni. Bolniki imajo višjo vročino, hujši glavobol ter pogosto bruhajo. Več kot polovico odraslih dobi znake prizadetosti možganovine, pet do 10 odstotkov bolnikov pa znake ohromitve, je pojasnil Strle.
Približno dve tretjini odraslih po bolezni povsem okrevajo, ostali pa imajo trajne posledice, ki jim bistveno poslabšajo kakovost življenja. Ohromitve se medtem razmeroma slabo popravljajo, je dejal. “Klopni meningoencefalitis je resna bolezen in dobro bi bilo, če bi uporabljali cepivo in s tem bolezen preprečili,” je zatrdil.
V Univerzitetnem rehabilitacijskem inštitutu (URI) Soča na leto zdravijo od enega do dva bolnika z najhujšim potekom bolezni, je pojasnil predstojnik oddelka za rehabilitacijo po možganski kapi Klemen Grabljevec z URI Soča. Običajno so težko prizadeti in odvisni od nege. “Bolnika začnemo na novo praktično učiti požiranja, sedenja, oblačenja, uporabe različnih pripomočkov. Nekako mu poskušamo vračati dostojanstvo s tem, da ga učimo, da skrbi sam zase, kar je seveda zelo težko,” je orisal.
“,”Jaka Verbic Miklic”,1742201220,1742201220,sl,15604,306,15603,43,0,NULL,,”Najboljša zaščita proti klopnemu meningoencefalitisu je cepljenje “,najboljsa-zascita-proti-klopnemu-meningoencefalitisu-je-cepljenje,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1744962489,1744962489
1130,15606,”Okrogla miza STAkluba”,”Kako izboljšati dostopnost do cepljenja?”,”
Ljubljana, 16. april 2025 – V Ljubljani je v organizaciji STA potekala okrogla miza z naslovom »Kako izboljšati dostopnost do cepljenja?
Čeprav imamo v Sloveniji na voljo varna in učinkovita cepiva, se odrasli pogosto ne odločijo za
cepljenje ali odločitev odlagajo. Razlogov je več: od pomanjkanja informacij do organizacijskih
ovir, od dostopnosti storitev do osebnega odnosa do cepljenja.
O možnostih za boljšo dostopnost ter o pomenu cepljenja so na okrogli mizi spregovorili
domači strokovnjaki:
Posnetek je na voljo tu: https://video.sta.si/video/7857#43426
“,”Jaka Verbic Miklic”,1744797120,1744797120,sl,15606,306,15605,43,0,NULL,,”Okrogla miza STAkluba”,okrogla-miza-stakluba,Post,”/sites/43/files/images/news/Cepljenje Novica.jpg”,1,0,1744970071,1744970071
1131,15609,”Javna objava prenosov vrednosti ZD, ZO in DB 2024″,”Javna objava prenosov vrednosti ZD, ZO in DB 2024″,”
JAVNA OBJAVA PRENOSOV VREDNOSTI ZDRAVSTVENIM DELAVCEM, ZDRAVSTVENIM ORGANIZACIJAM IN DRUŠTVOM BOLNIKOV S STRANI FARMACEVTSKIH DRUŽB
Skladno s Kodeksom ravnanja bodo članice Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb, GIZ (v nadaljevanju FarmaForum) tudi v letošnjem letu javno objavile prenose vrednosti zdravstvenim delavcem, zdravstvenim organizacijam in društvom bolnikov.
Kot določa enotni Kodeks, bodo podatke objavile do vključno 30. junija 2025.
Objava zajema podatke o prenosih vrednosti v preteklem koledarskem letu in na spletnih straneh posameznih članic ponuja vpogled v prenose v obdobju od 1. januarja do 31. decembra 2024. Po določilih zveze EFPIA (evropska zveza farmacevtskih industrij in združenj) se podatki javno objavljajo periodično, vsako leto, najkasneje do konca meseca junija, in sicer za preteklo koledarsko leto.
O javni objavi prenosov vrednosti
Javna objava prenosov vrednosti vključuje podatke o vrednostih vseh sredstev, ki so jih prejeli posamezni zdravstveni delavci, zdravstvene organizacije in društva bolnikov s katerimi sodelujejo posamezne članice FarmaForuma ali FarmaForum – bodisi neposredno ali prek tretjih oseb, kot so agencije za organizacijo dogodkov. Javna objava vsebuje tudi informacije o vrsti dejavnosti ali tipu podpore:
Te prenose vsaka članica FarmaForuma objavi v slovenskem jeziku na svoji lokalni, regijski ali mednarodni spletni strani.
Individualne in skupinske objave
Vsi prenosi zdravstvenim organizacijam, kamor se po Kodeksu ravnanja uvrščajo javne zdravstvene institucije, zdravniška društva, združenja, zbornice in zasebna podjetja (d.o.o. in s.p.), so skladno z zakonodajo objavljeni individualno s polnim nazivom prejemnika.
Pri prenosih vrednosti posameznim zdravstvenim delavcem, fizičnim osebam, je objava v skladu z Zakonom o varstvu osebnih podatkov mogoča samo na podlagi predhodnega pisnega soglasja zdravstvenega delavca. V nasprotnem primeru se prenos objavi v skupinski obliki, pri čemer je v vsaki kategoriji navedeno število prejemnikov ter skupni znesek dodeljen tovrstnim prejemnikom.
Podatki o plačilih na področju raziskav in razvoja zaradi varstva konkurence ter inovacij, ki jih razvijajo posamezne družbe, skladno z zakonodajo, ne morejo biti objavljeni drugače kot v skupinski obliki.
Izjava o omejitvi odgovornosti
Podatki, objavljeni v tem poročilu, so izraz prizadevanj FarmaForuma za ravnanje skladno z zahtevami Kodeksa ravnanja in zveze EFPIA. Če se kljub našim prizadevanjem za zagotovitev natančnih objav zgodi, da poročilo vsebuje nepopolne ali netočne podatke, bomo to raziskali in morebitne napačne podatke ustrezno popravili.
PODATKI O PRENOSU VREDNOSTI ZDRAVSTVENIM DELAVCEM, ZDRAVSTVENIM ORGANIZACIJAM IN DRUŠTVOM BOLNIKOV S STRANI MEDNARODNEGA FORUMA ZNANSTVENORAZISKOVALNIH FARMACEVTSKIH DRUŽB, GIZ, ZA LETO 2024
Mednarodni forum znanstvenoraziskovalnih farmacevtskih družb, GIZ, je v koledarskem letu 2024 sodeloval z različnimi organizacijami: z donacijami je podprl aktivnosti Slovenskega zdravniškega društva, Univerzitetnega kliničnega centra Ljubljana in Medicinsko fakulteto v skupni vrednosti 33.000 EUR. Sedmim organizacijam je poravnal stroške povezane z izvajanjem storitev in svetovanjem.
Skupna vrednost prenosov FarmaForuma zdravstvenim organizacijam je v letu 2024 znašala 111.681,89 EUR. V letu 2024 je bil izveden en prenos vrednosti na zdravstvene delavce v bruto vrednosti 1.257 EUR. Vrednost prenosov društvom bolnikov je znašala 21.100 EUR.
Metodologija
Javno objavljeni podatki zajemajo prenose vrednosti, ki so bili v finančnem sistemu FarmaForuma dejansko izvršeni v koledarskem letu 2024, to je od vključno 1. januarja 2024 do vključno 31. decembra 2024.
Prenosi zdravstvenim organizacijam in društvom bolnikov so navedeni kot neto zneski tovrstnih pogodb, ki ne vključujejo DDV. Prenosi vrednosti sredstev zdravstvenim delavcem se navajajo v bruto zneskih.
Vsi navedeni zneski predstavljajo skupne vrednosti za leto 2024.
Vse navedene transakcije so bile izvršene v koledarskem letu 2024, torej od vključno 1. januarja 2024 do vključno 31. decembra 2024.
Skladno s Kodeksom ravnanja je zdravstvena organizacija (ZO) opredeljena kot:
Zdravstvene delavce (ZD) Kodeks ravnanja opredeljuje kot:
Za namen tega Kodeksa, definicija ZD vključuje:
Skladno s Kodeksom ravnanja je društvo bolnikov (DB) opredeljeno kot:
Kodeks ravnanja je v celoti dostopen na: https://www.farmaforum.si/sl/o-forumu/kodeksi/forumov-kodeks-ravnanja
“,”Jaka Verbic Miklic”,1748791140,1748791140,sl,15609,306,15607,43,0,NULL,,”Javna objava prenosov vrednosti ZD, ZO in DB 2024″,javna-objava-prenosov-vrednosti-zd-zo-in-db-2024,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1748794775,1748796957
1132,15609,”Public disclosure of transfers of value to HCPs, HCOs and POs in 2024″,”Public disclosure of transfers of value to HCPs, HCOs and POs in 2024″,”
PUBLIC NOTICE ON TRANSFERS OF VALUE FROM PHARMACEUTICAL COMPANIES TO HEALTHCARE PROFESSIONALS, HEALTHCARE ORGANIZATIONS AND PATIENT ORGANIZATIONS
In accordance with the Code of Conduct the members of the International Forum of Scientific Research Pharmaceutical Companies, GIZ (hereinafter FarmaForum) will also publicly announce value transfers to healthcare professionals, healthcare organizations and patient associations this year. As stipulated by the Code, they will publish the data up to and including June 30, 2025.
The publication provides data on transfers of value for the past calendar year. On the websites of individual members, you can find detailed information covering the period from January 1 to December 31, 2024. In compliance with EFPIA (European Federation of Pharmaceutical Industries and Associations) regulations, this data is published annually by the end of June for the past calendar year.
About public disclosure of transfers of value
Public disclosure of transfers of value includes data on the value of all funds received by individual healthcare professionals, healthcare organizations, or patient organizations that collaborate with individual FarmaForum members or the FarmaForum itself, either directly or through third parties such as event organization agencies. Disclosure also includes information on the type of activity or support:
Each FarmaForum member publishes these transfers in Slovenian on its local, regional, or international website.
Individual and group disclosures
All transfers to healthcare organizations, which under the Code include public healthcare institutions, physician associations and societies, chambers, and private companies (d.o.o. and s.p.), are published individually, with the full name of the recipient.
Transfers of value to individual healthcare professionals who are natural persons are, under the Personal Data Protection Act, only possible based on advance written consent of the healthcare professional. If such consent is withheld, transfers are published in a group or aggregate form, with the number of recipients and total amount listed separately for each category of such recipients.
Data on payments in the field of research and development cannot be published otherwise than in a group or aggregated form due to legislative protection of competition and innovations being developed by separate companies.
Disclaimer
The data in this report reflects FarmaForum’s commitment to adhering to the EFPIA Code. If any inaccuracies or omissions are discovered despite our rigorous efforts to ensure accuracy, we will investigate the issue and promptly correct any errors.
DATA ON TRANSFERS OF VALUE TO HEALTHCARE PROFESSIONALS, HEALTHCARE ORGANISATIONS, AND PATIENT ORGANIZATIONS FROM THE FORUM OF INTERNATIONAL RESEARCH AND DEVELOPMENT PHARMACEUTICAL COMPANIES, EIG, FOR 2022
The International Forum of Research-Based Pharmaceutical Companies, GIZ, collaborated with various organizations in the calendar year 2024: through donations, it supported the activities of the Slovenian Medical Association, the University Medical Centre Ljubljana, and the Faculty of Medicine in Ljubljana. It covered costs related to service provision and consulting for seven organizations.
The total value of transfers from FarmaForum to healthcare professionals and healthcare organizations in 2024 amounted to EUR 111,681.89. In 2024, one transfer was made to healthcare professionals, and three donations were given to healthcare organizations, amounting to EUR 33,000. The total value of transfers to patient associations was EUR 21,100.
Methodology
The publicly disclosed data covers value transfers that were executed in FarmaForum’s financial system during the 2024 calendar year, i.e., from January 1, 2024, to December 31, 2024, inclusive.
Transfers to healthcare organizations and patient associations are presented as net amounts based on such contracts, excluding VAT. Transfers of value to healthcare professionals are reported as gross amounts.
In 2024, one value transfer to healthcare professionals was executed in the total amount of EUR 1,257.
All stated amounts represent total values for the year 2024.
According to the Code, a health care organization (HCO) is defined as:
According to the Code, Health Care Professionals (HCP) are defined as:
For this Code, the definition of HCPs includes:
According to the Code Patient organizations (PO) are defined as:
Code of practice is available here: Code of Practice
“,”Jaka Verbic Miklic”,1748791140,1748791140,en,15609,306,15607,43,0,NULL,,”Javna objava prenosov vrednosti ZD, ZO in DB 2024″,javna-objava-prenosov-vrednosti-zd-zo-in-db-2024,Post,”/sites/43/files/images/O nas/Kodeksi/shutterstock_574912636.jpg”,1,0,1748794775,1748796957
1133,15611,”Zdravje kot strateška naložba za družbeno-ekonomski razvoj Slovenije”,”Sistemsko razumevanje in načrtno naslavljanje vpliva zdravja na gospodarstvo ter družbeno blaginjo bo ključno za zagotavljanje odpornosti, konkurenčnosti in višje kakovosti življenja v Sloveniji”,”
Ljubljana, 27. maj 2025 – Zdravje je strateška naložba v prihodnost družbe, ki omogoča dolgoročen napredek in gospodarsko rast. Sistemsko razumevanje in načrtno naslavljanje vpliva zdravja na gospodarstvo ter družbeno blaginjo bo ključno za zagotavljanje odpornosti, konkurenčnosti in višje kakovosti življenja v Sloveniji. O tem smo se pogovarjali na letošnji 14. strateški konferenci Vrednost inovacij, ki je potekala pod naslovom »Zdravje kot gibalo družbeno-ekonomskega razvoja«. Letošnji strateški partner Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb je bila Gospodarska zbornica Slovenije, dogodka pa se je udeležilo več kot 130 gostov iz vrst zdravstva, gospodarstva in odločevalcev.
Konferenco je z uvodnim nagovorom otvorila predsednica uprave Mednarodnega foruma znanstvenoraziskovalnih farmacevtskih družb Tjaša Burnik, ki je poudarila, da je zdravje ključno razumeti kot naložbo, ki se obrestuje na dolgi rok . »Zdravstvo in gospodarstvo se ne le stikata, ampak sta tudi neločljivo povezana. Zato je ključno, da ima zdravo prebivalstvo, ker to pomeni manj bolniških odsotnosti, manj invalidnosti, hitrejše okrevanje in daljšo delovno dobo. Zdravstveni sistem pa s sodelovanjem gospodarstva pridobi vire, znanje, inovacije in rešitve, ki pomagajo optimizirati procese« je zaključila.
V uvodnem video nagovoru je ministrica za zdravje dr. Valentina Prevolnik Rupel poudarila, da zdravje ni zgolj osebna vrednota ali družbena odgovornost, temveč tudi temelj produktivnosti, inovacij, odpornosti gospodarstva in splošne blaginje. »Zdravje ni strošek, temveč je naložba, ki prinaša večjo gospodarsko stabilnost in dolgoročno blaginjo,« je dejala. Opozorila je na izzive, kot so starajoče prebivalstvo, porast kroničnih bolezni, pomanjkanje kadrov in naraščajoč absentizem, za katere trdi, da jih je mogoče nasloviti le z ukrepi, ki temeljijo na podatkih, dokazih in dolgoročnih ciljih. »Naš skupen cilj je zdrava, produktivna in vključujoča družba,« je še dejala.
Nagovor je podal tudi Mitja Gorenšček, glavni izvršni direktor Gospodarske zbornice Slovenije (GZS) za socialni dialog. Izpostavil je, da je za gospodarstvo pomembno, da ima zdrave, prisotne in motivirane zaposlene, za kar je ključen dobro organiziran, odziven in visoko strokoven zdravstveni sistem. »Gospodarstvo ne sme biti zgolj pasivni uporabnik zdravstvenih storitev, postati mora aktivni sogovornik pri razvoju čim bolj optimalnih rešitev. Sodelovanje v zdravstvu ni dobrodelnost, ampak strateška naložba v dolgoročno vzdržnost sistema,« je poudaril ter dodal, da vlaganje v zdravstveni sistem ni le javno finančna obveznost, temveč predstavlja priložnost razvoj domače industrije, raziskav in digitalizacije.
Uvodni glavni govorec letošnje konference dr. Aleksander Zadel, klinični psiholog in direktor inštituta za osebni razvoj C.A.R., je izpostavil razkorak med vrednoto zdravja in vsakdanjim vedenjem Slovencev: »Slovenci zdravje postavljamo visoko na lestvici vrednot, a naše vsakdanje vedenje pogosto tega ne kaže. Natančno vemo, kaj bi bilo prav, a ravnamo drugače. Predavanje raziskuje psihološki mehanizem te razpetosti skozi teorijo izbire, pri čemer pokaže, kako odločitve posameznika odsevajo v družbeni realnosti in kako z družbenimi podsistemi skupaj oblikujemo kulturo pasivne odgovornosti do zdravja.«
Izr. prof. Petre Došenović Bonča, iz Ekonomske fakultete Univerze v Ljubljani je prikazala neposredne in posredne učinke uspešnega zdravstvenega sistema na ekonomsko blaginjo družbe: »Učinkovito in uspešno zdravstvo neposredno in posredno izrazito vpliva na ekonomsko blaginjo naše družbe. Zahteva sicer občutne investicije, ki pa se preko boljših zdravstvenih izidov in s tem boljšim počutjem posameznikov več kot povrnejo z višjo produktivnostjo, krepitvijo intelektualnega kapitala in družbeno kohezijo, kar zdravstvo umešča med ključna gonila vzdržnega dolgoročnega razvoja.«
Na izzive javnega zdravja in potrebo po dolgoročnem načrtovanju je opozoril tudi izr. prof. dr. Branko Gabrovec, generalni direktor NIJZ: »Slovenija se sooča s starajočo se populacijo, kjer lahko življenjski slog pomembno pripomore k povečanju zdravih let življenja, kakovostni starosti in manjši obremenitvi zdravstvenega sistema. Slabše kazalnike imamo tudi pri otrocih kjer je življenjski slog enako pomemben. Ključne spremenljivke zdravega načina življenja in zdravstvene pismenosti potrebujejo strateško, dolgoročno načrtovanje. Tukaj leži prihodnost javnega zdravja.«
Glavne teme in problematike konference so govorci naslovili tudi na okrogli mizi z naslovom »Zdravje in gospodarstvo – skupna pot do družbene blaginje?«, kjer so sodelovali Barbara Gnilšak, direktorica pravne službe na GZS, mag. Vlasta Mežek, generalna direktorica Direktorata za dostopnost in ekonomiko na Ministrstvu za zdravje, izr. prof. dr. Branko Gabrovec ter izr. prof. dr. Petra Došenovič Bonča. Okroglo mizo je povezoval prof. dr. Dejan Verčič, profesor na Fakulteti za družbene vede in partner v agenciji Herman & partnerji. Barbara Gnilšak je na okrogli mizi poudarila, da je gospodarstvo pripravljeno podpreti rešitve, ki bodo prispevale k zmanjšanju bolniških odsotnosti in podaljšanju delovne aktivnosti zaposlenih: »Delodajalci smo naklonjeni vsem rešitvam, ki znižujejo bolniško odsotnost zaposlenih z dela, spodbujajo podaljševanje njihove delovne aktivnosti v pozno starost in skrbijo za uravnotežen življenjski slog med delom in prostim časom. Prepričana sem, da lahko dobre prakse na tem področju iz bolj razvitih držav implementiramo tudi v Sloveniji.« Na okrogli mizi je pomemben vidik naslovila tudi mag. Vlasta Mežek, ki je opozorila na potrebo po bolj sistematičnem razumevanju vpliva zdravja na gospodarstvo in pomen strateških vlaganj v inovacije, digitalizacijo ter dostopnost zdravstvenih storitev: »Zdravje ni le temeljna človekova pravica, temveč tudi ključni dejavnik trajnostnega razvoja, gospodarske stabilnosti in socialne kohezije. Vrednost inovacij v zdravstvu presega meje medicine – oblikuje bolj vključujočo, odpornejšo in uspešnejšo družbo. Naša naloga je, da s strateškimi vlaganji v zdravstvene inovacije, digitalizacijo in dostopnost oskrbe lahko zagotovimo, da bo zdravje dejansko postalo motor družbeno-ekonomskega napredka. Trenutno merimo vpliv zdravja na gospodarstvo predvsem posredno – preko indikatorjev, kot so absentizem, invalidnost, prezgodnja umrljivost in podobno. Konference, kot je današnja, vidim kot priložnost, da se pogovarjamo tudi o vzpostavitvi bolj sistematičnih metod, da bi bolje razumeli in kvantificirali multiplikativne učinke vlaganj v zdravje na BDP in produktivnost. Ključno je, da uvedemo v sistem ocene ekonomskega bremena bolezni, ki upošteva neposredne stroške zdravljenja in širše posledice za delovno sposobnost, dolgotrajno oskrbo in družbeno funkcionalnost. Današnja konferenca je torej dragocena priložnost, da skupaj začrtamo pot k bolj pravičnemu, učinkovitemu in inovativnemu zdravstvenemu sistemu.«
Sklepe konference je povzel prof. dr. Dejan Verčič, ki je kot enega osrednjih izzivov izpostavil potrebo po prehodu od sedanjega, silosno zasnovanega financiranja zdravstva k celovitim analizam ekonomskega bremena bolezni in dolgoročnim projekcijam potreb. Tak pristop bi omogočil učinkovitejšo razporeditev virov ter razvoj odpornega, stabilno financiranega in digitalno podprtega zdravstvenega sistema, v katerem bo zdravstvo prepoznano kot strateška infrastruktura.
Vsi govorci so se strinjali, da brez tesnega sodelovanja med zdravstvom, gospodarstvom in državnimi institucijami ni mogoče vzpostaviti trajnostnega zdravstvenega modela. Skupaj podpirajo ukrepe, ki prispevajo k zmanjševanju bolniških odsotnosti, podaljševanju delovne aktivnosti ter spodbujanju zdravega in uravnoteženega življenjskega sloga.
Mag. Barbara Stegel, generalna sekretarka FarmaForuma pa je v zaključnem nagovoru predstavila predlog za vzpostavitev sistematičnega spremljanja input-output analiz za pet terapevtskih področij z največjo porabo zdravstvenega proračuna. Digitalizacija, skladna z Evropskim zdravstvenim podatkovnim prostorom (EHDS), bi zajela tudi analizo socio-ekonomskih učinkov zdravstva in zdravja, kar odpira nove možnosti za razvoj podatkovno podprtih in bolj učinkovitih zdravstvenih politik.
Z omenjenimi sklepi in predlogi smo postavili trdne temelje za nadaljnje strateško usmerjeno sodelovanje. Zdravje kot strateška naložba ostaja ključno gonilo družbeno-ekonomskega razvoja, odpornosti in blaginje Slovenije. Napredek bomo pregledali in sodelovanje nadgradili na naslednji konferenci.
“,”Jaka Verbic Miklic”,1748495040,1748495040,sl,15611,306,15610,43,0,NULL,,”Zdravje kot strateška naložba za družbeno-ekonomski razvoj Slovenije”,zdravje-kot-strateska-nalozba-za-druzbeno-ekonomski-razvoj-slovenije,Post,”/sites/43/files/images/news/14. strateska konferenca/iz konference/14-VI-001.jpg”,1,0,1750050467,1750050526
1134,15613,”Znanstveniki dosegli preboj v preprečevanju širjenja malarije”,”Malarijo povzročajo paraziti, ki jih s pikom na človeka prenašajo okužene samice komarjev”,”
Boston, 22. maja – Ameriški znanstveniki so našli zdravili, s katerima lahko pri komarjih odpravijo okužbo s parazitom, ki povzroča malarijo. Trenutno se proti komarjem, ki prenašajo malarijo, borijo predvsem z insekticidi, novo odkritje pa bi lahko pomenilo ugodno in učinkovito alternativo, poroča britanski BBC.
Malarijo povzročajo paraziti, ki jih s pikom na človeka prenašajo okužene samice komarjev. Vsako leto za boleznijo umre skoraj 600.000 ljudi, med njimi večinoma otroci.
Ekipa znanstvenikov univerze v Harvardu je odkrila zdravilo, ki lahko pri komarjih učinkovito uniči te parazite, če zdravilo absorbirajo preko nog. Tako bi lahko bile dolgotrajna rešitev mreže proti komarjem, ki bi bile prepojene z zdravilom.
“Pred tem nismo poskušali neposredno uničiti parazitov v komarju, saj smo preprosto ubijali komarje,” je dejala raziskovalka Alexandra Probst s Harvarda. Prepričana je, da ta pristop ni več primeren.
V svoji raziskavi, ki so jo objavili v znanstveni reviji Nature, so podrobneje preučili DNK malarije, da bi našli šibke točke. Obenem pa so naredili seznam morebitnih zdravil in uspeli najti dve učinkoviti, ki sta v celoti ubili parazite v komarjih.
Zdravili so testirali tako, da so ju nanesli na mreže proti komarjem. Pri tem pa so ugotovili, da tudi če komar preživi stik z mrežo, absorbirano zdravilo ubije parazite, tako da se malarija ne more več širiti.
“Mislim, da je to res vznemirljiv pristop, saj gre za popolnoma nov način, kako se lotiti komarjev samih,” je ocenila Probst.
Tak način zdravljenja pa tudi zmanjša verjetnost, da bo parazit postal odporen na zdravila, saj je v vsakem komarju po manj kot pet parazitov, medtem ko se jih lahko v človeku po okužbi najde tudi po več milijard, je še pojasnila.
Zdravilo ostane na mreži aktivno približno eno leto, zato je to po oceni znanstvenikov tudi ugodna in dolgotrajna alternativa insekticidom.
Medtem ko so učinkovitost v laboratoriju že dokazali, pa bodo v kratkem učinkovitost preverili tudi v resničnem svetu in sicer v Etiopiji. Do zaključka študije bo verjetno minilo še nekaj let.
“,”Jaka Verbic Miklic”,1747902360,1747902360,sl,15613,306,15612,43,0,NULL,,”Znanstveniki dosegli preboj v preprečevanju širjenja malarije”,znanstveniki-dosegli-preboj-v-preprecevanju-sirjenja-malarije,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1753000086,1753000252
1135,15616,”NIJZ razširil programe cepljenja proti noricam in klopnem meningoencefalitisu”,”Omogočili tudi odraslim, ki so se rodili med letom 1970 in 1980.”,”
Ljubljana, 18. aprila – Cepljenje je najboljša naložba v javno zdravstvo, so sogovorniki poudarili na novinarski konferenci Nacionalnega inštituta za javno zdravje (NIJZ) pred začetkom svetovnega in evropskega tedna cepljenja. Ob pozitivnem trendu precepljenosti proti gripi in HPV inštitut letos širi programe cepljenja proti noricam in klopnem meningoencefalitisu.
Po podatkih Svetovne zdravstvene organizacije so cepiva v zadnjih petdesetih letih rešila vsaj 154 milijonov življenj, je izpostavila generalna direktorica direktorata za javno zdravje na ministrstvu za zdravje Vesna Marinko. Poudarila je, da so cepljenja temelj individualne in kolektivne zaščite ter da so v Sloveniji varna, učinkovita in številna brezplačna cepiva tako za otroke kot odrasle.
“V javnosti je cepljenje še vedno poznano kot zaščita pred otroškimi nalezljivimi boleznimi, a se tudi odrasli s cepljenjem lahko učinkovito zaščitijo proti okužbam,” je dodala.
Ob tem je izpostavila pomen cepljenja v nosečnosti, ki zaščiti tudi novorojenčka. Meni, da se je treba cepiti tudi za zaščito tistih, ki se ne morejo. “Cepimo se, ko smo zdravi, da bi ostali zdravi,” je poudarila.
V Sloveniji zaradi cepljenja ni primerov otroške paralize, davice, rdečk, mumpsa in okužbe s Hib, je ocenila nacionalna koordinatorica cepljenja Marta Grgič Vitek. So pa lani zabeležili največjo pojavnost oslovskega kašlja v zadnjih 60 letih. Razloge vidi v novem, manj učinkovitem cepivu, kratki imunosti po cepljenju ter v ukrepih, sprejetimi med covidom.
Letošnje novosti v nacionalnem programu cepljenja po njenih besedah prinašajo razširitev programov cepljenja otrok proti noricam in cepljenja proti klopnem meningoencefalitisu, ki ga bodo omogočili tudi odraslim, ki so se rodili med letom 1970 in 1980, je pojasnila.
Pozitiven obrat vidi v precepljenosti proti gripi. Čeprav ima Slovenija med državami EU najnižjo precepljenost proti gripi, se je letos cepilo 6000 ljudi več kot lani. Znatno se povečuje tudi cepljenje nosečnic proti oslovskemu kašlju in gripi, kar nudi zaščito tudi novorojenčkom.
V sodelovanju z zdravstvenimi domovi in študenti medicine je NIJZ marca organiziral akcijo cepljenja proti HPV Širi ljubezen, ne bolezen. Po podatkih NIJZ se je v času akcije, ki je potekala marca, cepilo kar 135.000 več oseb kot lani v istem obdobju, je izpostavila Grgič Vitek.
Sanja Vuzem iz Svetovne zdravstvene organizacije v Sloveniji pa je opozorila, da kljub visoki precepljenosti v evropski regiji še vedno opažajo vrzeli v pokritosti s cepljenjem. Tako je bilo v letu 2023 v evropski regiji zaznanih več kot 78.000 primerov oslovskega kašlja, največ po letu 1994, je izpostavila.
Kot je dejala, želijo v Evropi do leta 2030 omogočiti pravičen dostop do cepiv za vse, cepljenje skozi vse življenje in več sodelovanje med pristojnimi, je pojasnila. Po njenih besedah je nujno, da cepljenje ostane prednostna javnozdravstvena naloga.
“,”Jaka Verbic Miklic”,1744965120,1744965120,sl,15616,306,15615,43,0,NULL,,”NIJZ razširil programe cepljenja proti noricam in klopnem meningoencefalitisu”,nijz-razsiril-programe-cepljenja-proti-noricam-in-klopnem-meningoencefalitisu,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1753000459,1753000459
1136,15618,”Obeležujemo svetovni dan tuberkuloze”,”Bolezen najpogosteje prizadene pljuča, pri tretjini bolnikov pa so prizadeti tudi drugi organi.”,”
Ljubljana, 24. marca – Obeležujemo svetovni dan tuberkuloze, ki je še vedno najpogostejša nalezljiva bolezen na svetu. V Svetovni zdravstveni organizaciji poudarjajo, da je treba omogočiti zgodnjo prepoznavo in diagnostiko bolezni, preventivno zdravljenje in visokokakovostno oskrbo bolnikov s to boleznijo, zlasti s tuberkulozo, odporno na zdravila.
Letošnji slogan svetovnega dneva tuberkuloze je Da! Lahko odpravimo tuberkulozo: Zaveži se, investiraj, reši. Na Univerzitetni kliniki za pljučne bolezni in alergijo Golnik so pojasnili, da ključna sporočila slogana pomenijo intenzivno ukrepanje za pospešitev prizadevanj za odpravo tuberkuloze, k čemur so se svetovni voditelji zavezali že leta 2023 na srečanju Združenih narodov.
Slogan opozarja, da je potrebno hitrejše izvajanje smernic in okrepitev nacionalnih strategij, ustrezno financiranje inovacij in raziskav na področju diagnostike, zdravljenja in preprečevanja ter zapolnitev vrzeli pri preprečevanju, zdravljenju in oskrbi tuberkuloznih bolnikov, so zapisali v sporočilu za javnost.
V Sloveniji je bolezen redka in se praviloma pojavlja med občutljivimi skupinami prebivalstva, kot so starejši od 65 let, priseljeni iz držav z višjo pojavnostjo bolezni in nezaposleni. Posebno skrb na kliniki dajejo tudi osebam z okrnjeno imunostjo.
V Register tuberkuloze RS, ki ga vodi Klinika Golnik, je bilo leta 2023 prijavljenih 88 oseb s tuberkulozo, od tega 57 moških in 31 žensk. Med tuberkuloznimi bolniki je bilo 50 odstotkov rojenih zunaj Slovenije. Preliminarni podatki za leto 2024 kažejo, da je bilo zabeleženih 48 primerov, od tega je bila polovica bolnikov rojenih zunaj Slovenije.
“V letu 2024 smo pridobili še zadnje zdravilo iz niza novih zdravil za zdravljenje odpornih oblik tuberkuloze, tako da smo v krogu držav, ki so začele zdravljenje teh večkratnih rezistentnih oblik tuberkuloze z novimi, krajšimi in bolniku bolj prijaznimi režimi zdravljenja,” so povzeli besede vodje registra tuberkuloze na Kliniki Golnik Petre Svetina.
Spomnili so, da so lani imeli prvi primer bolnika s tuberkulozo v zaporu. “Poleg uspešnega zdravljenja te osebe smo izvedli vse ukrepe za preprečevanje širjenja okužbe. Ustanovljena je bila delovna skupina, ki pripravlja posodobitve priporočil za obravnavo in preprečevanje tuberkuloze v zaporih,” so še zapisali.
Tuberkuloza je huda nalezljiva bolezen, ki jo povzročajo bacili tuberkuloze. Ljudje se s tuberkulozo okužijo z vdihavanjem zračnih kapljic, ki vsebujejo bacile tuberkuloze in jih v okolje izločajo kužni bolniki, na primer pri kašljanju, kihanju, glasnem govorjenju ali petju.
Bolezen najpogosteje prizadene pljuča, pri tretjini bolnikov pa so prizadeti tudi drugi organi. Simptomi pljučne tuberkuloze so več tednov trajajoč kašelj, bolečina v prsih in izkašljevanje izmečka, v katerem so lahko sledovi krvi ali sama kri. Sistemski znaki tuberkuloze so povišana telesna temperatura, nočno znojenje, splošna utrudljivost, izguba apetita in hujšanje.
“,”Jaka Verbic Miklic”,1742809020,1742809020,sl,15618,306,15617,43,0,NULL,,”Obeležujemo svetovni dan tuberkuloze”,obelezujemo-svetovni-dan-tuberkuloze,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1753000693,1753000738
1137,15620,”Ob svetovnem dnevu bolnišničnih lekarn o pomenu strokovnega farmacevtskega osebja”,”Bolnišnične lekarne so srce vsake bolnišnice, saj zagotavljajo varno in učinkovito farmakoterapijo ter prispevajo k racionalni rabi zdravil.”,”
Ljubljana, 27. marca – Danes je svetovni dnevu bolnišničnih lekarn, ki majo ključno vlogo pri zagotavljanju varne in učinkovite oskrbe bolnikov v bolnišnicah. V Lekarniški zbornici Slovenije so ob dnevu poudarili pomen strokovnega farmacevtskega osebja, ki skrbi za pravočasen in enakopraven dostop do ustreznih in varnih zdravil ter medicinskih pripomočkov.
Farmacevtski strokovnjaki v bolnišnicah igrajo vse pomembnejšo vlogo pri celostni obravnavi bolnikov, so ob dnevu zapisali v zbornici. S svojo prisotnostjo na bolnišničnih oddelkih izboljšujejo oskrbo bolnikov z zdravili, sodelujejo pri obvladovanju polifarmakoterapije, prispevajo k boljšemu sodelovanju bolnikov pri zdravljenju ter pomagajo zniževati stroške zdravljenja. So nepogrešljivi pri optimizaciji terapije, kar pomembno vpliva na boljše zdravstvene izide bolnikov, so dodali.
“Bolnišnične lekarne so srce vsake bolnišnice, saj zagotavljajo varno in učinkovito farmakoterapijo ter prispevajo k racionalni rabi zdravil. Naša vloga presega zgolj izdajo zdravil – aktivno sodelujemo v zdravstvenih timih, spremljamo terapije in pomagamo zagotavljati optimalne izide zdravljenja. Prav zato si bolnišnični farmacevti, farmacevtski tehniki in drugo osebje zaslužijo priznanje za svoje delo,” je poudarila predsednica sekcije bolnišničnih lekarn pri zbornici Alenka Kovačič.
Predanost in strokovnost bolnišničnih farmacevtov, farmacevtskih tehnikov, administrativnega osebju in drugih sodelavcev sta po oceni zbornice ključni za zagotavljanje varnosti in kakovosti zdravljenja z zdravili.
Poudarili so tudi nujnost, da odločevalci, vodstva zdravstvenih ustanov in nacionalni organi prepoznajo pomen dobro organiziranih in ustrezno financiranih bolnišničnih lekarn. Le s primerno podporo in razvojem farmacevtskih storitev v bolnišničnem okolju bomo lahko še naprej zagotavljali najboljše rezultate zdravljenja z zdravili ter celovito skrb za bolnike, so še dodali.
V Sloveniji je po podatkih zbornice 354 lekarn na primarni ravni zdravstvene dejavnosti in 27 bolnišničnih lekarn.
“,”Jaka Verbic Miklic”,1743069660,1743069660,sl,15620,306,15619,43,0,NULL,,”Ob svetovnem dnevu bolnišničnih lekarn o pomenu strokovnega farmacevtskega osebja”,ob-svetovnem-dnevu-bolnisnicnih-lekarn-o-pomenu-strokovnega-farmacevtskega-osebja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1753002136,1753002266
1138,15622,”Svetovni dan zdravja letos namenjen zdravju mater in novorojenčkov”,”Zdravi začetki, svetla prihodnost”,”
Ljubljana, 7. aprila – Danes zaznamujemo svetovni dan zdravja, ki je letos namenjen zdravju mater in novorojenčkov. Kot so poudarili na Nacionalnem inštitutu za javno zdravje (NIJZ), je zdravje novorojenčkov in njihovih mater eden najpomembnejših kazalnikov splošnega zdravstvenega stanja in blaginje prebivalstva.
Na zdrav začetek življenja namreč vplivajo številni dejavniki, med katerimi so varna nosečnost in porod, telesno in duševno zdravje, dobro počutje žensk pred in med porodom ter po njem in nenalezljive bolezni. Stopnja umrljivosti dojenčkov v Sloveniji je med najnižjimi v Evropi, stopnja maternalne umrljivosti pri nas pa je primerljiva z razvitimi državami, so sporočili z NIJZ.
Ob svetovnem dnevu zdravja se začenja tudi celoletna kampanja z naslovom Zdravi začetki, svetla prihodnost, s katero Svetovna zdravstvena organizacija (WHO) poziva vlade in zdravstvene ustanove, naj povečajo prizadevanja za odpravo smrti mater in novorojenčkov.
Evropska regija WHO, v katero spada tudi Slovenija, ima sicer najmanjšo stopnjo umrljivosti mater na svetu, in sicer na 100.000 porodov umre 11 mater. WHO za splošno zmanjšanje umrljivosti mater predlaga tri ukrepe. Prvi je univerzalna zdravstvena pokritost, vključno z dostopom do celovitih zdravstvenih storitev za matere. Drugi je vlaganje v izobraževanje in kampanje za ozaveščanje, tretji pa širitev nujne porodniške oskrbe.
NIJZ skupaj s predstavništvom WHO osrednji dogodek v Sloveniji pripravlja v Centru Rog, kjer bo zbrane nagovorila tudi ministrica za zdravje Valentina Prevolnik Rupel, na njem pa bodo predstavili najbolj sveže podatke s področja zdravja mater in novorojenčkov. Na okrogli mizi se bodo posvetili duševnemu zdravju žensk v obporodnem obdobju.
Svetovni dan zdravja, ki ga vsako leto zaznamujemo 7. aprila, je WHO razglasila leta 1950 z namenom ozaveščanja o pomenu zdravja na svetovni ravni. Tudi v Sloveniji na ta dan potekajo številni dogodki.
“,”Jaka Verbic Miklic”,1744016640,1744016640,sl,15622,306,15621,43,0,NULL,,”Svetovni dan zdravja letos namenjen zdravju mater in novorojenčkov”,svetovni-dan-zdravja-letos-namenjen-zdravju-mater-in-novorojenckov,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1753002342,1753002458
1139,15623,”V Severni Makedoniji prva primera okužbe z virusom mpox”,”Simptomi so zvišana telesna temperatura, glavobol, bolečine v mišicah, otekle bezgavke, mrzlica in izčrpanost.”,”
Skopje, 23. maja – V Severni Makedoniji so zabeležili dva potrjena primera okužbe z virusom mpox, je danes sporočil Inštitut za javno zdravje v Skopju. Kot so pojasnili, sta okužena moška, nobeden od njiju pa naj ne bi bil na potovanju. To je sicer prvič, da so v državi zabeležili primer okužbe z mpox, poroča francoska tiskovna agencija AFP.
Okužena sta moška iz Skopja, rojena leta 1985 oziroma 1981, je na novinarski konferenci povedala direktorica Inštituta za javno zdravje Marija Andonovska. Dodala je, da ne gre za povezana primera.
Bolnika glede na njune izjave nista potovala v tujino, poroča AFP. Po podatkih inštituta sta bila primera okužbe z mpox potrjena po treh različnih laboratorijskih testih.
Državni sekretar za zdravje Jovica Andovski je državljane posvaril pred paniko in spomnil, da ta bolezen ni nova ter da obstaja protokol za njeno zdravljenje.
Virus mpox povzroča istoimensko nalezljivo bolezen, znano tudi kot opičje koze. Klinični potek bolezni je običajno blag. Simptomi so zvišana telesna temperatura, glavobol, bolečine v mišicah, otekle bezgavke, mrzlica in izčrpanost. Običajno se razvije tudi izpuščaj.
Virus so pri ljudeh prvič odkrili leta 1970 v Demokratični republiki Kongo. Odtlej je bilo širjenje okužb med ljudmi omejeno zlasti na nekatere države v srednji in zahodni Afriki, maja 2022 pa so se primeri začeli širiti po vsem svetu.
Svetovna zdravstvena organizacija (WHO) je zaradi te epidemije lani razglasila najvišjo stopnjo pripravljenosti.
“,”Jaka Verbic Miklic”,1747991940,1747991940,sl,15623,306,15614,43,0,NULL,,”V Severni Makedoniji prva primera okužbe z virusom mpox”,v-severni-makedoniji-prva-primera-okuzbe-z-virusom-mpox,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1753002572,1753003335
1140,15625,”Ob svetovnem dnevu pljučne hipertenzije opozorila o pomenu diagnoze”,”Vsak vdih šteje”,”
Ljubljana, 5. maja – Svetovni dan pljučne hipertenzije, ki ga vsako leto zaznamujemo 5. maja, je namenjen ozaveščanju o tej resni in pogosto napačno diagnosticirani bolezni. Letos je kampanja ob dnevu namenjena opozarjanju na izzive, s katerimi se soočajo bolniki pri prejemu diagnoze, ki je ključna za njeno zdravljenje, so zapisali v Združenju za pljučno hipertenzijo.
Za pljučno hipertenzijo je značilen povišan krvni tlak v pljučnem ožilju, zaradi česar mora srce črpati proti vedno večjemu pritisku in je vedno bolj obremenjeno. Bolezen lahko prizadene ljudi vseh starosti, hkrati pa izredno hitro napreduje.
Bolezen je v redkih primerih lahko tudi dedna. Najpogostejša oblika bolezni se pojavlja pri tistih bolnikih, pri katerih se v globokih venah nog tvorijo krvni strdki. Ti strdki se odtrgajo in potujejo po ožilju do pljučnega žilja, kjer se zagozdijo. Tako se lumen pljučnih žil začne postopoma ožiti.
Simptomi, vključno z zadihanostjo, utrujenostjo in bolečino v prsih, so pogosto nespecifični in jih bolniki zlahka zamenjajo za manj resna stanja. Zato mnogi mesece ali celo leta ne prejmejo ustrezne diagnoze, kar podaljša čas brez ustreznega zdravljenja, podaljšuje negotovost in vodi v napredovanje bolezni, so opozorili v Združenju za pljučno hipertenzijo.
Drugi simptomi bolezni vključujejo zmanjšano telesno zmogljivost, ponavljajoča se omedlevica pri obremenitvi in med kašljanjem, izkašljevanje krvavega izpljunka ali krvi, ki izvira iz dihal, omotica in modrikaste ustnice, so zapisali v Društvu za pljučno hipertenzijo Slovenije.
Društvo ob dnevu vabi na dogodek Vsak vdih šteje, ki bo danes med 13. in 18. uro na Slovenskem trgu v Kranju in je namenjen širši ter strokovni javnosti. Obiskovalci bodo lahko med drugim spoznali značilne simptome pljučne hipertenzije in govorili z zdravnikom specialistom, bolniki ter člani društva.
Osrednja aktivnost bo prilagojen šestminutni test hoje, preko katerega bodo obiskovalci lahko izkusili, kako je dihati s pljuči bolnika s pljučno hipertenzijo. Dihanje bolnika je namreč skoraj enako dihanju zdravega človeka z nosno ščipalko in dvema slamicama v ustih, kar oteži dovod kisika v pljuča. Posledično se posameznik hitreje zadiha in zmore manj fizičnega napora, so pojasnili v društvu.
“,”Jaka Verbic Miklic”,1746436560,1746436560,sl,15625,306,15624,43,0,NULL,,”Ob svetovnem dnevu pljučne hipertenzije opozorila o pomenu diagnoze”,ob-svetovnem-dnevu-pljucne-hipertenzije-opozorila-o-pomenu-diagnoze,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1753003061,1753003061
1141,15627,”Evropski dan osveščanja o možganski kapi”,”Znake možganske kapi lahko prepoznamo s pomočjo kratice GROM.”,”
Ljubljana, 13. maja – Možganska kap je po celem svetu najpogostejša nevrološka bolezen. Samo v Sloveniji jo letno doživi več kot 4000 ljudi. Smrtnost je visoka, velika pa je tudi invalidnost, zato je pomen osveščanja in prepoznavanja znakov možganske kapi izjemnega pomena, so ob današnjem evropskem dnevu osveščanja o možganski kapi izpostavili v društvu za zdravje srca.
Možganska kap je nenadna motnja v delovanju možganov, ko zaradi različnih dogodkov pride do nezadostne oskrbe možganovine s krvjo. V Sloveniji letno utrpi možgansko kap okrog 4000 oseb, zaradi te bolezni pa jih umre skoraj 2000, od tega okoli 800 moških in 1200 žensk, je na nedavni novinarski konferenci povedal predsednik Društva za zdravje srca in ožilja Slovenije Matija Cevc.
Možganska kap je tesno povezana z dejavniki tveganja, med katerimi so visok krvni tlak, visok indeks telesne mase, kajenje, slaba prehrana in nizka telesna aktivnost. Sočasna izpostavljenost več dejavnikom tveganja bistveno poveča ogroženost za kap, zato je po njegovem mnenju tako pomembno, da se trudimo čim bolj zmanjšati število, izraženost in izpostavljenost dejavnikom tveganja. Pri tem je ključno tudi prepoznavanje možganske kapi, saj lahko pravočasno prepoznavanje in hitro ukrepanje izrazito zmanjša posledice.
Znake možganske kapi lahko prepoznamo s pomočjo kratice GROM. Črka G predstavlja govor (ali oseba lahko govori jasno in razumljivo), črka R roko (ali lahko oseba dvigne roko in jo tam zadrži), črka O obraz (ali se oseba lahko nasmehne, ali ima povešen ustni kot), črka M pa minuto oz. čas. Če pri nekomu opazimo kateregakoli od teh znakov, moramo namreč ukrepati takoj s klicem na 112.
Ob tem dnevu v društvu pripravljajo osrednjo prireditev na Prešernovem trgu. Od 10. do 13. ure bodo tam stojnice z različnimi zdravstveno-informativnimi gradivi in predstavitvami, medicinska ekipa pa bo svetovala in izvajala nekatere osnovne meritve.
Združenje bolnikov s cerebrovaskularno boleznijo Slovenije pa bo danes v Novo Gorico odpeljalo 320 bolnikov po možganski kapi iz vse Slovenije. Z množično udeležbo želijo pokazati, da je možganska kap ozdravljiva in življenje z njo vredno življenja.
Evropski dan osveščanja o možganski kapi je vsako leto na drugi torek v maju.
“,”Jaka Verbic Miklic”,1747127940,1747127940,sl,15627,306,15626,43,0,NULL,,”Evropski dan osveščanja o možganski kapi”,evropski-dan-osvescanja-o-mozganski-kapi,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1753003241,1753003241
1142,15629,”Zgodnje odkritje raka sečnega mehurja poveča možnost preživetja”,”Sogovorniki so se strinjali, da zgodnje odkritje in pravočasno diagnosticiranje bolezni, sodobne možnosti zdravljenja in predvsem multidisciplinarna obravnava izredno povečajo možnosti, da bo bolnik z rakom sečnega mehurja živel dlje in bolje.”,”
Ljubljana, 17. junija – Rak sečnega mehurja spada med sedem najpogostejših rakov pri moških, pri ženskah je na 12. mestu. V letu 2021 so odkrili 392 novih bolnikov s tem rakom, lani 288, v letu 2021 je bilo 229 smrti zaradi te bolezni, so povedali na novinarski konferenci društva uroloških bolnikov. Zgodnje odkrivanje izredno poveča možnosti za preživetje, so izpostavili.
Kot so izpostavili na konferenci ob mesecu ozaveščanja o raku sečnega mehurja, skrbi tudi dejstvo, da se ta vrsta raka zelo pogosto ponovi, in sicer v 50 do 90 odstotkih. A če raka mehurja odkrijejo zgodaj, je zelo ozdravljiv, stopnja preživetja je v tem primeru lahko do 90-odstotna. Največji dejavniki tveganja tega pa sta kajenje in dolgotrajna izpostavljenost v kemični, lesni, usnjarski in gumarski industriji.
Najbolj ključna za ugoden razplet bolezni je po mnenju Simona Hawline s kliničnega oddelka za urologijo Univerzitetnega kliničnega centra (UKC) Ljubljana hitra postavitev diagnoze. “Najpogostejši zgodnji simptom raka na mehurju je krvav urin. To in dlje časa pekoče uriniranje je alarm za diagnostiko in takojšen pregled pri osebnem zdravniku,” je poudaril. Neboleča krvavitev se sicer pojavi pri 85 odstotkih bolnikov.
Ko pride bolnik k specialistu v UKC, po njegovih navedbah opravijo cistoskopijo oz. pregled sečnega mehurja s cistoskopom in biopsijo tumorja ter postavijo dokončno diagnozo. Po potrebi opravijo še ultra zvok, CT in/ali MR trebuha. Žal, pa je čakalna doba na dokončno postavitev diagnoze pri nas tri mesece, pri nekaterih posegih na prostati pa kar pet let, je poudaril. K zmanjšanju čakalnih dob bi po njegovem mnenju prispevalo več operacijskih dvoran, rabili bi vsaj dve, je dejal.
Boštjan Šeruga z Onkološkega inštituta Ljubljana je izpostavil, da imamo v Sloveniji na voljo najsodobnejše terapije sistemskega zdravljenja. Včasih je bila kemoterapija, zdaj imamo na voljo še imunoterapijo, napredna zdravila, prihaja t. i. kombinacija imunoterapije in naprednih zdravil ter tarčna zdravila, je naštel. “Preživetje v 80. ali 90. letih nekoga, ki je imel razsejan rak sečnega mehurja, je bilo osem mesecev, s temi najnaprednejšimi načini zdravljenja pa je zdaj tudi do tri leta,” je pojasnil. Nekatere vrste tega raka lahko celo ozdravijo, je dodal.
Podpredsednik Društva uroloških bolnikov Slovenije Franc Hočevar je med drugim opozoril na pomanjkanje urologov in slabo organizacijo na tem področju. “Uroloških rakov je več kot 2500, uspešnost zdravljenja je primerljiva z evropskimi parametri, a bila bi še boljša, če bi imeli urološko službo bolj organizirano, urologov je premalo,” je poudaril. Da bi pospešili diagnostiko, bi morali zaposliti od 120 do 130 urologov, je ocenil in izpostavil pomen zgodnjega odkrivanja bolezni.
Sogovorniki so se strinjali, da zgodnje odkritje in pravočasno diagnosticiranje bolezni, sodobne možnosti zdravljenja in predvsem multidisciplinarna obravnava izredno povečajo možnosti, da bo bolnik z rakom sečnega mehurja živel dlje in bolje.
Na konferenci je Majda Popovič predstavila svojo zgodbo bolnika, ki se je soočil z diagnozo rak sečnega mehurja.
“,”Jaka Verbic Miklic”,1750152420,1750152420,sl,15629,306,15628,43,0,NULL,,”Zgodnje odkritje raka sečnega mehurja poveča možnost preživetja”,zgodnje-odkritje-raka-secnega-mehurja-poveca-moznost-prezivetja,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1753003723,1753003723
1143,15631,”Ob mednarodnem dnevu boja proti drogam pozivi k prekinitvi širjenja zasvojenosti”,”Pri tem sodelujejo zdravniki, psihologi, medicinske sestre, socialni delavci in drugi strokovnjaki. Smernice temeljijo na znanstveno podprtih praksah, ki omogočajo ljudem s težavami zaradi uporabe drog varno, dostojno in celostno pomoč, so ob dnevu poudarili v Zbornici – Zvezi.”,”
Ljubljana, 26. junija – Ob današnjem mednarodnem dnevu boja proti zlorabi in nezakonitemu trgovanju z drogami se vrstijo pozivi k enakopravnemu dostopu do pomoči ne glede na okoliščine, v katerih se je posameznik znašel. Letos dan namreč poteka pod geslom Pretrgajmo verigo: preventiva, zdravljenje in okrevanje za vse.
Krepitev preventivnih programov ter dostopnost do storitev zdravljenja in okrevanja sta nujni, saj se po ugotovitvah Evropskega centra za spremljanje drog in zasvojenosti z drogami trg z nezakonitimi drogami zelo hitro spreminja. Opazen je porast novih sintetičnih substanc, ki od držav zahtevajo hitro ukrepanje, spremljanje razmer ter pripravo in uvedbo ukrepov, temelječih na raziskavah, navajajo.
V Zbornici zdravstvene in babiške nege Slovenije – Zveze strokovnih društev medicinskih sester, babic in zdravstvenih tehnikov Slovenije pozivajo, da se temu prilagodijo tudi nove politike. Verjamejo, da je le tako mogoče učinkovito zaščititi prebivalstvo in preprečiti širjenje teh nevarnih substanc. Hkrati pa ugotovitve prinašajo nekaj optimizma, saj se je po podatkih uporaba drog med mladimi zmanjšala. Pri tem opozarjajo, da ostaja delo na področju preprečevanja, zdravljenja in zmanjšanja škode bolj pomembno kot kdaj koli prej.
Ob letošnjem mednarodnem dnevu poudarjajo pomen sočutja, enakosti in vključujočega pristopa do vseh, ki potrebujejo pomoč. “Na poti okrevanja ne bi smel nihče ostati sam,” so v sporočilu za javnost navedli besede predsednice sekcije medicinskih sester in zdravstvenih tehnikov v psihiatriji pri Zbornici – Zvezi Simone Podgrajšek.
V Sloveniji smernice za zdravljenje odvisnosti od prepovedanih drog priporočajo celosten pristop. Ta vključuje zdravljenje v specializiranih centrih in bolnišnicah, substitucijsko zdravljenje z zdravili, kot je metadon, psihosocialno podporo, kot so individualne, skupinske in družinske terapije, ter ukrepe zmanjševanja škode, med katere sodita svetovanje in testiranje glede na potrebe posameznika.
Pri tem sodelujejo zdravniki, psihologi, medicinske sestre, socialni delavci in drugi strokovnjaki. Smernice temeljijo na znanstveno podprtih praksah, ki omogočajo ljudem s težavami zaradi uporabe drog varno, dostojno in celostno pomoč, so ob dnevu poudarili v Zbornici – Zvezi.
“,”Jaka Verbic Miklic”,1750930200,1750930200,sl,15631,306,15630,43,0,NULL,,”Ob mednarodnem dnevu boja proti drogam pozivi k prekinitvi širjenja zasvojenosti”,ob-mednarodnem-dnevu-boja-proti-drogam-pozivi-k-prekinitvi-sirjenja-zasvojenosti,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1753003885,1753003885
1144,15633,”Farmacevti pred potovanjem svetujejo pripravo potovalne lekarne”,”Obenem naj dopustniki pred odhodom na potovanje poskrbijo za osnovno in dodatno zdravstveno zavarovanje.”,”
Ljubljana, 27. junija – V Lekarniški zbornici Slovenije pred poletnim dopustom svetujejo pripravo potovalne lekarne. Na številnih turističnih destinacijah, zlasti bolj oddaljenih, dostop do zdravnika ali lekarne ni hiter ali enostaven, zato potovalna lekarna, ki vključuje osnovno opremo in zdravila, zagotavlja dobrodošlo prvo pomoč, so sporočili iz lekarniške zbornice.
O zdravilih, ki jih je smotrno vzeti na potovanje, se lahko dopustniki pred odhodom na potovanje posvetujejo s farmacevti. “V lekarnah pogosto svetujemo, kaj uporabiti pri zastrupitvah s hrano, alergijskih reakcijah ali vročini pri otroku,” je navedla predsednica zbornice Darja Potočnik Benčič.
Tistim, ki se odpravljajo na dopust tako svetujejo, da s seboj vzamejo osnovno opremo, kot so sterilne obveze, gaze, povoji, obliži, elastični povoji, razkužilo, škarje in termometer ter zdravila.
Med zdravili izpostavljajo predvsem pripravke proti prehladu, sredstva za zniževanje telesne temperature in lajšanje bolečin, zdravila za vnetje sečil ali spolovil. Ob tem priporočajo uporabo žvečljivih ali topnih tablet, ki omogočajo uporabo brez vode, za otroke pa priporočajo zdravila v obliki sirupov ali svečk. “Zdravila naj turisti zaščitijo pred sončno svetlobo in visokimi temperaturami, saj lahko te zmanjšujejo njihovo učinkovitost,” je opozorila Potočnik Benčič.
Ena od pogostejših težav na potovanjih so prebavne težave, kot so driska, zaprtje, zgaga, potovalna slabost, alergije in zastrupitve s hrano. Farmacevti zato priporočajo, da turisti v potovalno lekarno vključijo medicinsko oglje, tablete proti slabosti, rehidracijski prašek, probiotike in odvajalo. Ob potovanjih v bolj tvegana okolja pa priporočajo tudi tablete za filtracijo vode.
Obenem naj dopustniki pred odhodom na potovanje poskrbijo za osnovno in dodatno zdravstveno zavarovanje. Prav tako naj pridobijo potrdila o cepljenjih in ustrezna dovoljenja za prenos določenih zdravil, če jih zahteva država, v katero odhajajo. V potovalno lekarno pa spadajo tudi izdelki za zaščito pred soncem in oskrbo morebitnih opeklin, pri čemer priporočajo, da za otroke izberejo izdelke z visoko zaščito.
“,”Jaka Verbic Miklic”,1751016720,1751016720,sl,15633,306,15632,43,0,NULL,,”Farmacevti pred potovanjem svetujejo pripravo potovalne lekarne”,farmacevti-pred-potovanjem-svetujejo-pripravo-potovalne-lekarne,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1753004023,1753004023
1145,15635,”Nov logistični center NIJZ za preskrbo s cepivi predvidoma odprt junija 2026″,”V preteklem mesecu so podpisali pogodbo za pričetek del, ki so se že začela.”,”
Ljubljana, 30. junija – Ministrica za zdravje Valentina Prevolnik Rupel si je danes ogledala lokacijo objekta novega logističnega centra NIJZ za preskrbo s cepivi. Nov logistični center bo služil nemotenemu in varnemu skladiščenju ter distribuciji cepiv, omogočal pa bo tudi oskrbo s cepivi v času izrednih razmer. Center bo predvidoma uradno odprt junija 2026.
Cepljenje je eden najpomembnejših javnozdravstvenih ukrepov, saj preprečuje mnoge nezaželene zdravstvene izide in nepotrebne smrti, je po ogledu prostorov v izjavi za medije pojasnil generalni direktor Nacionalnega inštituta za javno zdravje (NIJZ) Branko Gabrovec. “Zato se še posebej veselimo vzpostavitve novega, prenovljenega logističnega centra, ki bo služil za distribucijo cepiv po vseh cepilnih centrih po držav,” je zatrdil.
NIJZ cepilnim centrom po državi vsako leto dostavi od 600.000 do 700.000 odmerkov cepiv, med pandemijo covida-19 pa je ta številka presegla 3,5 milijona, je dodal. Nov logistični center bo po njegovih zagotovilih omogočal dobro oskrbo s cepivi tudi v izrednih razmerah.
Prebivalci in prebivalke Slovenije si po besedah Prevolnik Rupel zaslužijo stabilno in varno okolje za pripravo in skladiščenje cepiv, ki bo zagotavljalo dobro oskrbo tako v normalnih časih kot tudi v izrednih razmerah. Pri tem je izrazila upanje, da bo prenova objekta potekala po načrtih in bo končana v enem letu.
Kot so pojasnili na NIJZ, je bil objekt novega logističnega centra kupljen januarja 2023 s sredstvi evropskega sklada za regionalni razvoj v višini 1,55 milijona evrov. Vrednost investicije za prenovo in prilagoditev objekta je okoli 2,8 milijona evrov, je danes pojasnil v. d. direktorja urada za nadzor, kakovost in investicije v zdravstvu Ivan Osrečki. Gradbeno dovoljenje za objekt so po njegovih besedah pridobili marca letos. V preteklem mesecu so podpisali pogodbo za pričetek del, ki so se že začela.
Center naj bi bil uradno odprt junija 2026, cepiva pa bodo na lokacijo prispela že prej, saj sta predhodno predvidena dva meseca testiranja hladilnih pogojev, je dodal. Po njegovih besedah je bil pogoj za izbiro lokacije dovolj veliko mesto za shranjevanje nujno potrebnih cepiv in dodatnih zalog za pokrivanje potreb državljanov Slovenije.
Nov logistični center bo po pojasnilih NIJZ vseboval tri hladilne komore za shranjevanje cepiv na temperaturi od dve stopinji Celzija do osem stopinj Celzija, eno zamrzovalno komoro za shranjevanje cepiv na temperaturi od -25 do -15 stopinj Celzija in šest zamrzovalnikov za shranjevanje cepiv na temperaturi od -90 do -60 stopinj Celzija. Prav tako bo v stavbi prostor za shranjevanje zdravil na sobni temperaturi in prostor za skladiščenje dodatnega materiala, kot je cepilni pribor.
Do zdaj so na NIJZ cepiva shranjevali v lastnih prostorih na Trubarjevi cesti 2 in v najetih kapacitetah pri zunanjem izvajalcu Salusu. Stroški najema dodatnih skladiščno-distribucijskih kapacitet so lani po pojasnilih NIJZ znašali 150.000 evrov brez DDV.
Ministrica Prevolnik Rupel se je pred ogledom lokacije novega logističnega centra udeležila delovnega sestanka s širšim vodstvom NIJZ o ključnih dosežkih in izzivih inštituta. Kot je za medije pojasnil Gabrovec, so govorili o več aktualnih izzivih, predvsem o čakalnih dobah, dostopnosti do zdravstvene oskrbe in preventivnih dejavnostih.
Prevolnik Rupel je dodala, da je besedah tekla tudi o izboljšanju oziroma optimizaciji delovanja centrov za krepitev zdravja, dotaknili pa so se tudi kalkulatorja za zmanjšanje ogljičnega odtisa v zdravstvu, ki ga vzpostavljajo.
“,”Jaka Verbic Miklic”,1751276160,1751276160,sl,15635,306,15634,43,0,NULL,,”Nov logistični center NIJZ za preskrbo s cepivi predvidoma odprt junija 2026″,nov-logisticni-center-nijz-za-preskrbo-s-cepivi-predvidoma-odprt-junija-2026,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1753004283,1753004283
1146,15637,”Odobrili prvo zdravilo proti malariji za dojenčke”,”Malarija je ena najbolj smrtonosnih bolezni na svetu, zlasti med otroki.”,”
Zürich, 8. julija – Švicarski farmacevtski koncern Novartis je danes sporočil, da so mu švicarske oblasti za uporabo odobrile zdravilo Coartem Baby, prvo zdravilo proti malariji za novorojenčke in dojenčke. Osem afriških držav, ki so sodelovale pri njegovem preizkušanju, naj bi bile med prvimi, ki bi ga lahko prejele že v nekaj tednih, poroča britanski BBC.
Zdravila proti malariji za otroke sicer že obstajajo, vendar pri njihovi uporabi pri dojenčkih, lažjih od 4,5 kilograma, obstaja tveganje prevelikega odmerka, saj se njihova jetra še razvijajo, tako da drugače predelujejo zdravila.
Iz Novarisa so v sporočilu za javnost pojasnili, da je odmerek, namenjen dojenčkom, težkim od dveh do pet kilogramov, odobril švicarski zdravstveni nadzorni organ Swissmedic.
Zdravilo je izjemnega pomena, saj malarija zahteva največ življenj prav med otroki, ki so mlajši od petih let. Po zadnjih dostopnih podatkih Svetovne zdravstvene organizacije (WHO) je leta 2023 zaradi malarije umrlo okoli 597.000 ljudi. Skoraj vsi so umrli na afriški celini, predvsem v podsaharski Afriki, približno tri četrtine umrlih pa so predstavljali prav otroci, mlajši od pet let, navaja BBC.
Novo zdravilo, ki je v nekaterih državah znano kot Riamet Baby, bodo verjetno v nekaj tednih že začeli uporabljati v regijah in državah z najvišjo stopnjo malarije.
Iz Novartisa so še sporočili, da načrtujejo, da bodo zdravilo na območjih, kjer je bolezen endemična, uvajali na neprofitni osnovi. Razvili so ga v sodelovanju z neprofitno organizacijo za razvoj zdravil proti malariji MMV s sedežem v Švici, ki so jo podprle britanska, švicarska in nizozemska vlada ter Svetovna banka in Rockefellerjeva fundacija.
Direktor organizacije MMV Martin Fitchet je odobritev zdravila izpostavil kot še en pomemben korak k odpravi velikega krvnega davka, ki ga zahteva malarija. “Malarija je ena najbolj smrtonosnih bolezni na svetu, zlasti med otroki. Toda s pravimi sredstvi in osredotočenostjo jo je mogoče odpraviti,” je poudaril.
“,”Jaka Verbic Miklic”,1751967660,1751967660,sl,15637,306,15636,43,0,NULL,,”Odobrili prvo zdravilo proti malariji za dojenčke”,odobrili-prvo-zdravilo-proti-malariji-za-dojencke,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1753004572,1753004572
1147,15639,”V UKC Ljubljana uspešno izvedli prvo endoskopsko odstranitev raka nosnega dela žrela”,”Priprave so trajale več tednov, poseg pa je trajal približno šest ur. “,”
Ljubljana, 11. julija – Klinika za otorinolaringologijo in cervikofacialno kirurgijo Univerzitetnega kliničnega centra (UKC) Ljubljana je uspešno izvedla prvo in izjemno zahtevno endoskopsko kirurško odstranitev raka nosnega dela žrela z rekonstrukcijo. Gre za odstranitev raka brez reza na obrazu, saj do nosnega dela žrela dostopajo skozi nosni in obnosne votline.
Poseg so prvič v Sloveniji izvedli junija, pacient pa zdaj okreva v domači oskrbi. Gre za pomemben dosežek v širši regiji, so poudarili na današnji novinarski konferenci.
Pri endoskopski nazofaringektomiji kirurg do nosnega dela žrela dostopi skozi nosni votlini in obnosne votline. Uporablja endoskopsko tehniko s posebnimi inštrumenti in tehnikami, ki omogočajo zelo natančen prikaz struktur.
Poseg je opravil specialist otorinolaringolog Domen Vozel, ki je specializiran za rinokirurgijo in kirurgijo lobanjske baze, za poseg pa se je usposabljal v ZDA. Pojasnil je, da so raka odstranili 46-letnem pacientu, ki se mu je po zaključenem zdravljenju z obsevanjem in kemoterapijo rak ponovil.
Rak nazofarinksa oziroma nosnega dela žrela je rak, ki se pojavi za nosom in je umeščen v sredino dna lobanje. “Razrast tega raka povzroča zelo hude težave, torej okvaro različnih živcev, ki omogočajo gibanje oči, obraza, senzoriko obraza in tako naprej. Pomembno je, da se ga zdravi in prepozna na učinkovit način, torej zgodaj in varno,” je povedal Vozel.
To bolezen sicer večinoma uspešno zdravijo z obsevanjem in kemoterapijo, kirurški poseg pa opravijo pri bolnikih, pri katerih je prišlo do nezadostnega učinka tega zdravljenja ali do ponovitve bolezni.
Pred posegom so pacientu razložili možna tveganja, saj gre za zahteven poseg, pri katerem lahko pride do možganske kapi ali smrti, ker operirajo v neposredni bližini velikih vratnih arterij. Vozel je dodal, da je operacija zahtevna tudi, ker se izvaja v predhodno obsevanem tkivu, kar pomeni da gre za brazgotinjenje, zato je treba poseg izvesti še bolj natančno.
Priprave so trajale več tednov, poseg pa je trajal približno šest ur. V prvi fazi posega so pripravili vse potrebno v nosu in skozi nosnici prišli do nosnega dela žrela, v drugi fazi pa so rak izrezali. Sledila je faza rekonstrukcije, v kateri so območje izreza prekrili z zdravim tkivom iz sluznice nosu.
“Operacija je potekala gladko, brez zapletov, prav tako tudi pooperativno obdobje. Gospod je bil peti dan po operaciji odpuščen iz klinike ORL brez težav. Normalno se je hranil, ni imel težav z dihanjem in z odpiranjem ust. Z izidom operacije smo bili zelo zadovoljni,” je povedal Vozel.
“,”Jaka Verbic Miklic”,1752227040,1752227040,sl,15639,306,15638,43,0,NULL,,”V UKC Ljubljana uspešno izvedli prvo endoskopsko odstranitev raka nosnega dela žrela”,v-ukc-ljubljana-uspesno-izvedli-prvo-endoskopsko-odstranitev-raka-nosnega-dela-zrela,Post,/sites/43/files/images/STA/sta2.jpg,1,0,1753004738,1753004738
V organizaciji revije Medicina danes je potekal webinar na temo »Pogledi na oblikovanje novega nacionalnega načrta za obravnavo redkih bolezni
V organizaciji revije Medicina danes je v četrtek, 18. junija 2020 potekal webinar na temo »Pogledi na oblikovanje novega nacionalnega načrta za obravnavo redkih bolezni, ki smo jo podprli tudi v Mednarodnem forumu znanstvenoraziskovalnih farmacevtskih družb. Medicina danes se s povezovanjem strokovnjakov in slovenskih zdravnikov zavzema za pozitiven premik zdravstvenega sistema na nacionalni ravni in za oblikovanje nacionalnega načrta za obravnavo redkih bolezni. Po ocenah naj bi v Sloveniji z redkimi boleznimi živelo okoli 120.000 bolnikov, pri tem naj bi svetovno gledano 80% redkih bolezni imelo genetski izvor in 75% bolnikov z redkimi boleznimi naj bi bili otroci.
Sogovorniki na webinarju so bili: prof. dr. Borut Peterlin iz Inštituta za genetiko UKC Ljubljana, doc. dr. Blaž Koritnik iz Nevrološke klinike UKC Ljubljana, dr. Urh Grošelj iz Pediatrične klinike UKC Ljubljana in dr. Tina Bregant, državna sekretarka na Ministrstvu za zdravje.
“To je quote Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod tempor incididunt ut labore et dolore magna aliqua.”
Pogovor s strokovnjaki je tekel v smeri iskanja dobrih praks, ki so se uresničile s starim nacionalnim načrtom redkih bolezni in iskanja novih izzivov, ki bodo del oblikovanja novega načrta. V letošnjem letu se namreč izteka rok 9-letnega nacionalnega načrta za redke bolezni. Na področju obravnave redkih bolezni je bilo veliko doseženega: vpeljali smo nove modele socialne oskrbe pacienta, vzpostavljena in financirana je bila informacijska točka za redke bolezni, izboljšali smo položaj dostopa informacij in diagnostike redkih bolezni ter dosegli obeležitev dneva redkih bolezni.